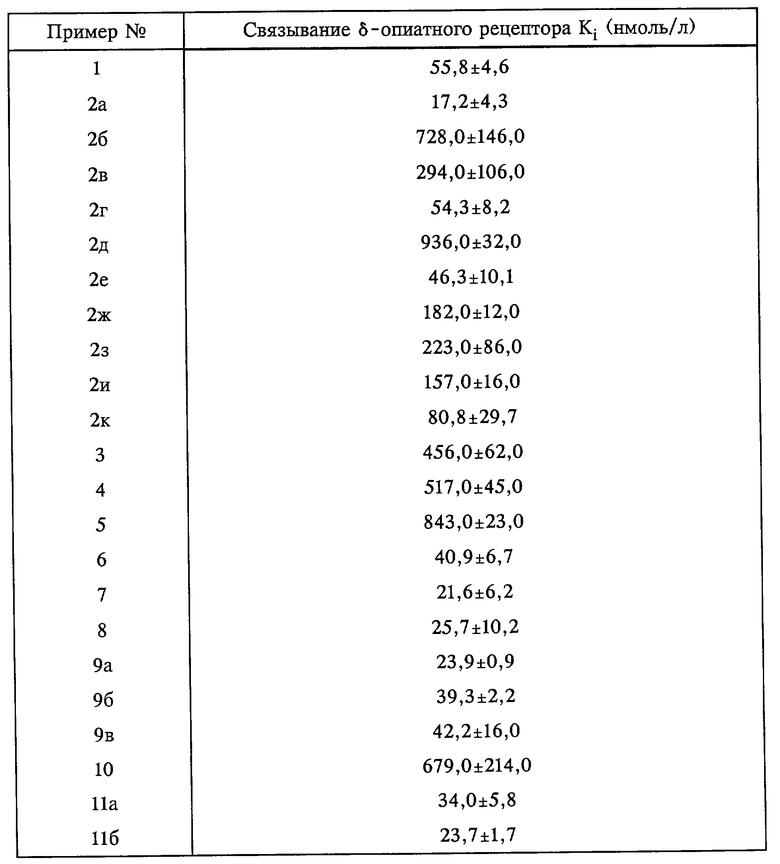
Изобретение относится к замещенным аминосоединениям общей формулы I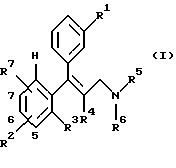
или к их фармацевтически применимым солям, к способу их получения и к их применению в качестве лекарственных средств.
Классические опиоиды (синтетические наркотические препараты, по действию сходные с опиатами, но не являющиеся их производными), такие как морфин, высокоэффективны при терапии сильных и очень сильных болей. Однако их применение ограничено по причине вызываемых ими побочных эффектов, как, например, депрессия дыхания, рвота, седативный эффект и запоры, а также развитие привыкания. Кроме того, они малоэффективны при невропатических или инциденцидентных болях, от которых в первую очередь страдают раковые больные.
Опиоиды проявляют свое анальгетическое действие благодаря связыванию с присутствующими на мембране рецепторами, относящимися к семейству так называемых связанных с G-протеином рецепторов. Биохимические и фармакологические свойства подтипов этих рецепторов позволяют надеяться, что специфические опиоиды этих подтипов обладают другим механизмом действия, в том числе вызывающим побочные эффекты, по сравнению, например, с морфином. Если морфин связывается селективно с так называемыми μ-рецепторами, то эндогенные энкефалины характеризуются как δ-селективные пептиды. Дальнейшие фармакологические исследования дают основание предположить, что существует целый ряд подтипов этих опиоидных рецепторов (μ1, μ2, κ1, κ2, κ3, δ1 и δ2).
Сведения о физиологическом значении δ-рецепторно-селективных субстанций были существенно расширены благодаря открытию непептидного антагониста налтриндол. На сегодняшний день очевидно, что δ-агонисты обладают собственным антиноцицептивным потенциалом. Наряду с данными, полученными при проведении многочисленных экспериментов на животных, имеются также результаты исследований, проводившихся с пептидным агонистом DADL на пациентах, больных раком, у которых морфин более не проявлял анальгетического действия. При интратекальном введении DADL обеспечивал продолжительный анальгетический эффект.
Ярко выраженное отличие δ-агонистов от μ-агонистов проявляется в их взаимодействии с "эндогенным опиоидным антагонистом" холецистокинином (ССК). Наряду с этим различием в диапазоне действия δ-агонисты могут, как полагают, отличаться от μ-агонистов также и механизмом действия, вызывающим побочные эффекты, что проявляется, в частности, в снижении депрессии дыхания.
Исходя из вышеизложенного, в основу изобретения была положена задача получить обладающие анальгетическим действием субстанции, биологическая эффективность которых частично либо преимущественно опосредуется через δ-опиатные рецепторы.
Было установлено, что указанным требованиям отвечают аминосоединения общей формулы I.
Предметом изобретения в соответствии с этим являются замещенные аминосоединения общей формулы I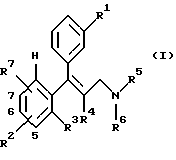
где R1 означает Н, ОН, О-С1-6алкил, О-С3-7циклоалкил, (причем R1 не является Н, если R2 и R7 представляют собой Н или в положении 7 ОСН3-группа замещена);
R2 означает Н (если R1 не является Н), ОН, С1-6алкил, O-арил, С2-6алкениленарил, О-С3-7циклоалкил, Cl, F, С1-6алкокси, арил, гетероциклил, С1-6алкилгетероциклил, С1-6алкиларил, 5,6- либо 6,7-бензо, незамещенный, одно- либо двузамещенный Cl, F, СF3, С1-6алкилом, О-С1-6алкилом, ОН (причем, если R1 и R2 или R7 являются Н, R2 или R7 не могут представлять собой СF3-группу и R2 или R7 в положении 7 не могут представлять собой ОСН3-группу, или R2 и R7 оба вместе представляют собой -О-(СH2)(1-2)-O- (в положении 5,6 или 6,7);
R3 означает Н;
R4 означает С1-6алкил или
R3 и R4 оба вместе представляют собой -(CH2)(1-4)-;
R5 означает С1-6алкил, С3-7циклоалкил;
R6 означает С1-6алкил, С1-6алкиларил, С1-6алкилгетероциклил, -СН2-(CH= C(R8)2, -СН2-(С3-7)циклоалкил, С3-7циклоалкил;
R7 означает Н (если R1 не является Н), ОН, С1-6алкил, О-арил, С2-6алкениленарил, O-С3-7циклоалкил, С1-6алкокси, Cl, F, арил, гетероциклил, С1-6алкилгетероциклил, С1-6алкиларил, 5,6- либо 6,7-бензо, незамещенный, одно- либо двузамещенный Cl, F, CF3, С1-6алкилом, O-С1-6алкилом, ОН (причем, если R1 и R2 или R7 являются Н, R2 или R7 не могут представлять собой СF3-группу и R2 или R7 в положении 7 не могут представлять собой ОСН3-группу) и
R8 означает Н или CH3,
или фармацевтически применимые соли этих соединений.
К предпочтительным замещенным аминосоединениям общей формулы I относятся те из них, в которых
R2, R6 и R7 означают С1-6алкиларил или С1-6алкилгетероциклил, a R1, R3-R5 и R8 имеют указанное выше значение согласно общей формуле I или
R2, R7 означают арил или гетероциклил, а R1, R3-R6 и R8 имеют указанное выше значение согласно общей формуле I или
R1 означает ОН или -О-C1-6алкил, R5 и R6 означают С1-6алкил, a R2-R4 и R7 имеют указанное выше значение.
Особенно предпочтительны соединения, в которых R1 означает ОН, R5 и R6 означают метил, a R2-R4 и R7 имеют значения согласно общей формуле I.
Понятие "С1-6алкил" в контексте настоящего изобретения означает прямоцепочечные либо разветвленные углеводороды с 1-6 атомами углерода. В качестве примеров таковых можно назвать метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, неопентил и н-гексил.
Понятие "С1-6алкокси" в рамках настоящего изобретения означает прямоцепочечные либо разветвленные углеводороды с 1-6 атомами углерода, как указано выше, связанные через атом кислорода.
Понятие "арил" в рамках настоящего изобретения означает фенилы, незамещенные либо одно- или многократно замещенные ОН, F, Cl, CF3, С1-6алкилом, С1-6алкоксигруппой, С1-7циклоалкоксигруппой, С3-7циклоалкилом, С2-6алкиленом, гетероциклилом или фенилом. Гетероциклильные или фенильные остатки могут быть необязательно присоединены реакцией конденсации. Указанное понятие может необязательно включать также нафтил.
Под понятием "гетероциклил" в рамках настоящего изобретения имеются в виду 5- или 6-членные насыщенные либо ненасыщенные, необязательно снабженные сконденсированной арильной системой гетероциклические соединения, содержащие 1 или 2 гетероатома из группы, включающей азот, кислород и/или серу.
В качестве примеров насыщенных гетероциклилов можно привести 1,4-диоксан, тетрагидрофуран и 1,4-тиоксан.
Из группы ненасыщенных гетероциклилов можно назвать, например, фуран, тиофен, пиридин, пиримидин, тиазол, оксазол, изоксазол, пиридазин, пиразин, хинолин, изохинолин, фталазин и хиназолин.
Понятия "С1-6алкиларил", соответственно "С1-6алкилгетероциклил" в рамках настоящего изобретения означают, что "арилы", соответственно "гетероциклилы" в приведенной выше расшифровке их значений связаны через С1-6алкильную группу.
Под понятием "силанильное соединение" в рамках настоящего изобретения имеются в виду триалкил- или триарилсилилы, диалкиларилсилилы или диарилалкилсилилы, которые используют в качестве защитной группы для гидроксильной функции. Примерами таковых могут служить триэтилсилил, трипропилсилил, диметилфенилсилил, ди-трет-бутилфенилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил или пропилдифенилсилил.
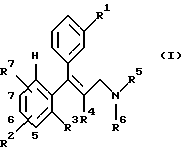
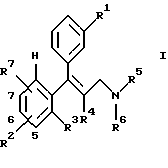
Предметом изобретения является также способ получения замещенных аминосоединений общей формулы I, отличающийся тем, что третичный спирт общей формулы II
где R1-R7 имеют те же значения, что и в формуле I,
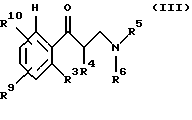
подвергают взаимодействию с полуконцентрированными или концентрированными органическими либо неорганическими кислотами, прежде всего с муравьиной кислотой или соляной кислотой в диапазоне температур от 0 до 100oС, причем третичные спирты общей формулы II получают за счет того, что сначала β-аминокетоны общей формулы III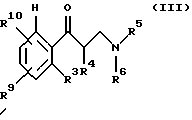
где R3-R6 имеют те же значения, что и в формуле I, R9 идентичен R2, a R10 идентичен R7, за исключением тех случаев, когда гидроксильная функция представлена в защищенной форме, например в виде бензилокси- или силанилоксигруппы,
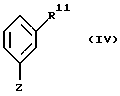
подвергают взаимодействию с металлорганическим соединением формулы IV
в которой Z означает MgCl, MgBr, MgI или Li, a R11 имеет те же значения, что и R1, за исключением тех случаев, когда гидроксильная функция представлена в защищенной форме в виде бензилокси- или силанилоксигруппы, такой, например, как трет-бутилдифенилсилилокси,
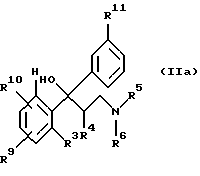
с получением соединения формулы IIа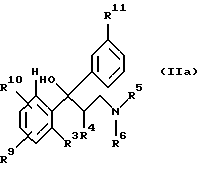
которое затем переводят в соединение формулы II.
Реакцию с соединениями формул III и IV проводят в простом алифатическом эфире, например в диэтиловом эфире и/или тетрагидрофуране, в интервале температур от -70 до 60oС. Соединения формулы IV, в которых Z представляет собой атом лития, получают при этом из соединений формулы IV, в которых Z означает Вr или I, за счет обмена галогена и лития, осуществляемого, например, в растворе н-бутиллития/н-гексане.
Для осуществления реакции с соединением формулы IIа с получением соединения формулы II в зависимости от значений R9, R10, соответственно R11 существует целый ряд методов.
Так, если R9, R10 и/или R11 представляют собой бензилоксигруппу, то целесообразно применять метод восстановительного дебензилирования с помощью каталитически активированного водорода, причем катализатором служит платина или палладий, абсорбированные на носителе, таком как активированный уголь. Реакцию проводят в растворителе, таком как уксусная кислота, или в С1-4алкиловом спирте при давлении в пределах от 1 до 100 бар и в диапазоне температур от 20 до 100oС, причем соединение IIа применяют предпочтительно в виде одной из его солей.
Если R9, R10 и/или R11 представляют собой силильную группу, то отщепление защитной группы осуществляют благодаря тому, что соответствующее соединение формулы IIа при 20oС подвергают в инертном растворителе, как, например, тетрагидрофуран, диоксан или диэтиловый эфир, взаимодейcтвию с фторидом тетра-н-бутиламмония или обрабатывают метанольным раствором хлористого водорода.
Если же R9, R10 и/или R11 в соединении формулы IIа представляют собой метоксильный радикал, то взаимодействием с гидридом диизобутилалюминия в ароматическом углеводороде, таком, например, как толуол или ксилол, при температурах в диапазоне от 60 до 130oС можно получить соединение формулы II, в котором R1 представляет собой гидроксильную группу. Возможно также непосредственное получение аналогичного соединения формулы I, осуществляемое путем нагрева с обратным холодильником соединения IIа с раствором бромистого водорода в ледяном уксусе либо концентрированной бромистоводородной кислоты.
Также из соединений формулы I, в которых R1, R2 и/или R7 представляют собой метоксильную группу, можно получить по описанной выше методике взаимодействием с гидридом диизобутилалюминия соединения формулы I, где R1, R2 и/или R7 представляют собой ОН.
Соединения формулы I с помощью физиологически приемлемых кислот, таких как соляная кислота, бромистоводородная кислота, серная кислота, метансульфоновая кислота, муравьиная кислота, уксусная кислота, щавелевая кислота, янтарная кислота, винная кислота, миндальная кислота, фумаровая кислота, молочная кислота, лимонная кислота, глутаминовая кислота и/или аспарагиновая кислота, могут быть переведены по известной методике в их соли. Предпочтительно проводить процесс солеобразования в растворителе, в таком как диэтиловый эфир, диизопропиловый эфир, алкиловый эфир уксусной кислоты, ацетон и/или 2-бутанон. Для получения гидрохлоридов особенно пригоден триметилхлорсилан в водосодержащем растворе.
Предметом изобретения, кроме того, является применение предлагаемых замещенных аминосоединений общей формулы I в качестве лекарственных средств. Обладающие анальгетическим действием композиции наряду с по крайней мере одним соединением формулы I по изобретению содержат в своем составе вспомогательные вещества, например наполнители, растворители, разбавители, красители и связующие. Выбор этих вспомогательных веществ, равно как и их применяемые количества, зависят от того, предназначено ли лекарственное средство для орального, внутривенного, внутрибрюшинного, интрадермального, внутримышечного, щечного или локального введения. Для орального введения пригодны композиции в виде таблеток, жевательных таблеток, драже, капсул, гранул, капель, микстур или сиропов; для парентерального, местного и ингаляционного введения пригодны растворы, суспензии, легко реконструируемые сухие композиции, а также аэрозоли. Предлагаемые соединения в депо в растворенном виде, нанесенные на пленку-основу или введенные в пластырь, необязательно с добавками средств, способствующих проницаемости через кожу, - таковы примеры форм, пригодных для трансдермального введения. Из применяемых для орального или чрескожного введения композиций соединения согласно изобретению могут высвобождаться постепенно, с определенным замедлением. Назначаемые пациенту дозы активных веществ варьируют в зависимости от веса пациента, от метода введения, показания и степени тяжести заболевания.
Способ согласно изобретению подробнее поясняется на нижеследующих примерах.
В качестве неподвижной фазы для колоночной хроматографии применяли силикагель 60 (0,040-0,063 мм) фирмы Е.Merck, Дармштадт.
Исследования посредством тонкослойной хроматографии проводили с помощью готовых ТСХВР-пластин, силикагель 60 F 254, фирма Е.Merck, Дармштадт.
Соотношение компонентов в элюентах для всех хроматографических исследований указаны во всех случаях в отношении объем/объем.
Пример 1
3-(2-Диметиламинометил-3,4-дигидронафт-1-ил)фенол, гидрохлорид
Стадия 1
(RS)-2-Диметиламинометил-3,4-дигидро-2Н-нафталин-1-он
Раствор из 21 мл 3,4-дигидро-2Н-нафталин-1-она в 200 мл ледяного уксуса последовательно смешивали с 8,2 г диметиламина, гидрохлорида, и 3,0 г параформальдегида. Смесь нагревали в течение 2 ч до 100oС, после чего под вакуумом выпаривали растворитель и остаток растворяли в 200 мл воды. Затем трижды экстрагировали соответственно порциями по 100 мл диэтилового эфира. Водную фазу при интенсивном перемешивании за счет добавок порциями карбоната калия устанавливали на рН 10. Затем трижды экстрагировали соответственно порциями по 150 мл этилового эфира уксусной кислоты. Экстракты промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. После отфильтровывания и упаривания фильтрата под вакуумом получили 15,4 г (75,6% от теории) (RS)-2-диметиламинометил-3,4-дигидро-2Н-нафталин-1-она в виде масла желтоватого цвета.
Стадия 2
(lRS, 2RS)-2-Димeтилaминoмeтил-l-(3-мeтoкcифeнил)-1,2,3,4-тетрагидронафт-1-ол
Раствор из 7,5 г 1-бром-3-метоксибензола в 15 мл сухого тетрагидрофурана при -50oС при перемешивании и в атмосфере защитного газа N2 смешивали по каплям с 25 мл 1,6-молярного раствора н-бутиллития в н-гексане. Перемешивание продолжали еще в течение 30 мин при -30oС, после чего при -50oС добавляли по каплям раствор из 6,1 г продукта из стадии 1 в 120 мл сухого тетрагидрофурана. Смесь перемешивали сначала в течение 3 ч при -50oС, а затем в течение 12 ч при -20oС. После добавления 100 мл соляной кислоты (10%) дважды экстрагировали соответственно порциями по 100 мл этилового эфира уксусной кислоты. Солянокислую фазу за счет добавки карбоната калия устанавливали на рН порядка 10 и трижды экстрагировали соответственно порциями по 50 мл дихлорметана. Экстракты сушили над сульфатом натрия, растворитель выпаривали под вакуумом и остаток очищали посредством колоночной хроматографии этиловым эфиром уксусной кислоты/метанолом = 3/1 в качестве элюента. Таким путем получили 5,3 г (56,5% от теории) (1RS,2RS)-2-диметиламинометил-1-(3-метоксифенил)-1,2,3,4-тетрагидронафт-1-ола в виде вязкого масла.
Стадия 3
3-(2-Диметиламинометил-3,4-дигидронафт-1-ил)фенол, гидрохлорид
5,2 г продукта из стадии 2 нагревали с обратным холодильником в течение 6 ч со 160 мл раствора бромистого водорода в ледяном уксусе (33% НВr). Затем упаривали под вакуумом и остаток растворяли в 150 мл воды. Далее подщелачивали карбонатом натрия и трижды экстрагировали соответственно порциями по 50 мл дихлорметана. После промывки экстрактов насыщенным раствором хлорида натрия и сушки над сульфатом натрия упаривали и остаток очищали посредством колоночной хроматографии этиловым эфиром уксусной кислоты/метанолом (5/1) в качестве элюента. Полученное таким путем основание соединения, указанного в заголовке, перевели с помощью триметилхлорсилана/воды в 2-бутаноне в гидрохлорид.
Выход 2,3 г (43,8% от теории), т. пл. 197-199oС.
Пример 2
Используя индан-1-он, 3,4-дигидро-2Н-фенантрен-1-он, 6,7,8,9-тетрагидробензоциклогептен-5-он, 7,8,9,10-тетрагидро-6Н-бензоциклооктен-5-он, 5-фенил-3,4-дигидро-2Н-нафталин-1-он, 6-фенил-3,4-дигидро-2Н-нафталин-1-он, 6-(3-хлорфенил)-3,4-дигидро-2Н-нафталин-1-он, 8,9,10,11-тетрагидроциклогепта[α] нафталин-1-он, 3,4-дигидро-2Н-антрацен-1-он или 6-(4-хлорфенил)-3,4-дигидро-2Н-нафталин-1-он вместо 3,4-дигидро-2Н-нафталин-1-она, а также необязательно других аминов на стадии 1, по методике, аналогично описанной в примере 1, получили следующие соединения:
2а: 3-(6-диметиламинометил-8,9-дигидро-7Н-бензоциклогептен-5-ил)фенол, гидрохлорид, т. пл. 218-220oС,
2б: 3-(6-диэтиламинометил-8,9-дигидро-7Н-бензоциклогептен-5-ил)фенол, гидрохлорид, т. пл. 208-211oС,
2в: 3-(6-ди-н-пропиламинометил-8,9-дигидро-7Н-бензоциклогептен-5-ил)фенол, гидрохлорид, т. пл. 199-201oС,
2г: 3-{6-[(метилфенетиламино)метил]-8,9-дигидро-7Н-бензоциклогептен-5-ил}фенол, гидрохлорид, т. пл. разложение от 117oС,
2д: 3-{6-[(бензилметиламинометил]-8,9-дигидро-7Н-бензоциклогептен-5-ил} фенол, гидрохлорид, т. пл. разложение от 80oС,
2е: 3-(6-диметиламинометил-7,8,9,10-тетрагидробензоциклооктен-5-ил)фенол, гидрохлорид, т. пл. 251-253,5oС,
2ж: 3-{ 6-[(циклопропилметилметиламино)метил]-8,9-дигидро-7Н-бензоциклогептен-5-ил}фенол, гидрохлорид, т. пл. 200-202oС,
2з: 3-(6-{ [метил-(2-пиридин-2-илэтил)амино]метил}-8,9-дигидро-7Н-бензоциклогептен-5-ил)фенол, дигидрохлорид, т. пл. 100-105oС,
2и: 3-(2-диметиламинометил-3Н-инден-1-ил)фенол, гидрохлорид, т. пл. 210-212oС,
2к: 3-(2-диметиламинометил-3,4-дигидрофенантрен-1-ил)фенол, гидрохлорид, т. пл. 253-254oС,
2л: 3-(2-диметиламинометил)-5-фенил-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 250-263,5oС,
2м: 3-(2-диметиламинометил-6-фенил)-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 242-243oС,
2н: 3-[6-(3-хлорфенил)-2-диметиламинометил-3,4-дигидронафт-1-ил] фенол, гидрохлорид, т. пл. разложение от 152oС,
2о: 3-(8-диметиламинометил-10,11-дигидро-9Н-циклогепта[α] нафт-7-ил)фенол, гидрохлорид, т. пл. 264-267oС,
2п: 3-(2-диметиламинометил-3,4-дигидроантрацен-1-ил)фенол, гидрохлорид, т. пл. 220-222oС,
2р: 3-[6-(4-хлорфенил)-2-диметиламинометил-3,4-дигидронафт-1-ил] фенол, гидрохлорид, т. пл. 245-247oС,
2с: 2-{ 6-[(фуран-3-илметиламино)метил] -8,9-дигидро-7Н-бензоциклогептен-5-ил}фенол, гидрохлорид.
Пример 3
(6-Метокси-1-фенил-3,4-дигидронафт-2-илметил)диметиламин, гидрохлорид
Стадия 1
Раствор из 50 г 6-метокси-3,4-дигидро-2Н-нафталин-1-она в 500 мл ацетонитрила смешивали с 26,6 г хлорида N,N-диметилметилениммония и двумя каплями ацетилхлорида и смесь перемешивали в течение 30 ч при 20oС. Затем кристаллический продукт выделяли, промывали ацетоном и сушили под вакуумом при 40oС. Таким путем получили 70,9 г (92,5% от теории) гидрохлорида соединения, указанного в заголовке (т. пл. 180-182oС), из которого с помощью разбавленного натрового щелока выделяли основание, которое экстрагировали дихлорметаном. После сушки экстрактов над сульфатом натрия и выпаривания растворителя под вакуумом получили 56,3 г (RS)-2-диметиламинометил-6-метокси-3,4-дигидро-2Н-нафталин-1-она в виде масла желтоватого цвета.
Стадия 2
(1RS, 2RS)-2-Диметиламинометил-6-метокси-1-фенил-1,2,3,4-тетрагидронафт-1-ол
Раствор из 20,5 г продукта из стадии 1 в 300 мл сухого диэтилового эфира при -60oС при перемешивании и подаче сухого азота смешивали по каплям с 50 мл 2-молярного раствора фениллития в циклогексане/диэтиловом эфире (70/30). Перемешивание продолжали еще в течение 2 ч при -60oС, после чего разлагали 150 мл насыщенного раствора хлорида аммония. Органическую фазу отделяли, а водную фазу еще дважды экстрагировали этиловым эфиром уксусной кислоты. Объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Оставшееся после выпаривания под вакуумом растворителя масло очищали посредством колоночной хроматографии диизопропиловым эфиром в качестве элюента. В результате получили 21,3 г (78,0% от теории) (1RS, 2RS)-2-диметиламинометил-6-метокси-1-фенил-1,2,3,4-тетрагидронафт-1-ола в виде масла.
Стадия 3
(6-Метокси-1-фенил-3,4-дигидронафт-2-илметил)диметиламин, гидрохлорид
Раствор из 6,3 г продукта из стадии 2 в 100 мл соляной кислоты (10%) перемешивали в течение 12 ч при 20oС. Затем подщелачивали 1 н. натровым щелоком и трижды экстрагировали дихлорметаном. Экстракты промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Полученный после выпаривания под вакуумом растворителя сырой продукт очищали посредством колоночной хроматографии этиловым эфиром уксусной кислоты/метанолом (3/1) в качестве элюента. Затем основание с помощью хлортриметилсилана/воды в 2-бутаноне переводили в гидрохлорид. Выход 5,4 г, 81% от теории; т. пл. 189-191oС.
Пример 4
(5-Метокси-1-фенил-3,4-дитидронафт-2-илметил)диметиламин, гидрохлорид
Применяя 5-метокси-3,4-дигидро-2Н-нафталин-1-он в качестве исходного соединения, по стадийному механизму и методике, описанным в примере 3, получили указанное в заголовке соединение в виде белых кристаллов, т. пл. 205-206oС.
Пример 5
5а: 6-Диметиламинометил-5-фенил-7,8-дигидронафт-2-ол, гидрохлорид
3,5 г продукта из примера 3 аналогично тому, как это описано в примере 1, стадия 3, подвергали взаимодействию со 100 мл раствора бромистого водорода в ледяном уксусе (33% НВr). После соответствующей переработки, очистки посредством колоночной хроматографии и взаимодействия с триметилхлорсиланом/водой получили 2,4 г (63,7% от теории) соединения, указанного в заголовке, в виде белых кристаллов, т. пл. 189-191oС.
5б: 6-Диметиламинометил-5-фенил-7,8-дигидронафт-1-ол, гидрохлорид.
По методике, описанной в примере 5а, из продукта из примера 4 аналогичным путем получили указанное в заголовке соединение, т. пл. 245-247oС.
Пример 6
6-Диметиламинометил-5-(3-гидроксифенил)-7,8-дигидронафт-2-ол, гидрохлорид
Стадия 1
(1RS, 2RS)-2-Диметиламинометил-6-метокси-1-(3-метоксифенил)-1,2,3,4-тетрагидронафт-1-ол
Из 7,3 г магниевой стружки и 56,1 г 1-бром-3-метоксибензола в 200 мл сухого тетрагидрофурана при легком кипении получили соответствующий реагент Гриньяра, к которому затем при 5-10oС по каплям добавляли раствор из 46,7 г (RS)-2-диметиламинометил-6-метокси-3,4-дигидро-2Н-нафталин-1-она (продукт из примера 3, стадия 1) в 100 мл сухого тетрагидрофурана. Перемешивание продолжали в течение 16 ч при 22oС и после охлаждения до приблизительно 10oС разлагали 100 мл насыщенного раствора хлорида аммония. Затем реакционную смесь разбавляли 100 мл воды и 200 мл диэтилового эфира, фазы разделяли и водную фазу еще дважды экстрагировали соответственно порциями по 100 мл диэтилового эфира. Объединенные органические фазы сушили над сульфатом натрия и под вакуумом удаляли летучие компоненты. Маслянистый остаток очищали посредством колоночной хроматографии этиловым эфиром уксусной кислоты в качестве элюента с получением в результате 43,9 г (64,3% от теории) (1RS, 2RS)-2-диметиламинометил-6-метокси-1-(3-метоксифенил)-1,2,3,4-тетрагидронафт-1-ола.
Стадия 2
6-Диметиламинометил-5-(3-гидроксифенил)-7,8-дигидронафт-2-ол, гидрохлорид
34,2 г продукта из стадии 1 перемешивали с 350 мл раствора бромистого водорода в ледяном уксусе (33% НВr) в течение 20 ч при температуре 100-110oС. Затем упаривали под вакуумом и остаток растворяли в 500 мл воды. После переработки, аналогичной описанной в примере 1, стадия 2, проводили очистку посредством колоночной хроматографии этиловым эфиром уксусной кислоты/метанолом (3/1) в качестве элюента. Полученное таким путем основание соединения, указанного в заголовке, с помощью триметилхлорсилана/воды в 2-бутаноне переводили в гидрохлорид.
Выход 12,2 г (41,2% от теории), т. пл. 210-212oС.
Пример 7
Изомерные по отношению к продукту в примере 6 соединения 7а и 7б получили, применяя соответствующие исходные субстанции, по методике, описанной в примере 6:
7а: 6-диметиламинометил-5-(3-гидроксифенил)-7,8-дигидронафт-1-ол, гидрохлорид, т. пл. 260-262oС,
7б: 7-диметиламинометил-8-(3-гидроксифенил)-5,6-дигидронафт-2-ол, гидрохлорид, т. пл. 239-242oС.
Заменив (RS)-2-диметиламинометил-6-метокси-3,4-дигидро-2Н-нафталин-1-он в примере 6, стадия 1, на (RS)-6-диметиламинометил-2-метокси-6,7,8,9-тетрагидробензоциклогептен-5-он (7в), соответственно на (RS)-2-диметиламинометил-6-(3-метоксифенил)-3,4-дигидро-2Н-нафталин-1-он (7 г) и осуществив дальнейшую реакцию по методике, описанной в примере 6, получили:
7в: 6-диметиламинометил-5-(3-гидроксифенил)-8,9-дигидро-7Н-бензоциклогептен-2-ол, гидрохлорид, т. пл. разложение от 110oС,
7г: 3-[2-диметиламинометил-6-(3-гидроксифенил)-3,4-дигидронафт-1-ил]фенол, гидрохлорид.
Пример 8
3-(2-Диметиламинометил-7-фенокси-3,4-дигидронафт-1-ил)фенол, гидрохлорид
Стадия 1
7-Фенокси-3,4-дигидро-2Н-нафталин-1-он
Суспензию из 60,8 г карбоната калия в 300 мл сухого пиридина смешивали с 35,7 г 7-гидрокси-3,4-дигидро-2Н-нафталин-1-она и смесь нагревали до 40oС. После этого при перемешивании добавляли сначала 19,9 г оксида меди (II), а затем по каплям 39,6 г бромбензола. Реакционную смесь нагревали в течение 4 дней с обратным холодильником. После практически полного выпаривания под вакуумом пиридина остаток тщательно перемешивали с 200 мл этилового эфира уксусной кислоты и фильтровали через силикагель. Затем фильтрат промывали насыщенными растворами хлорида аммония и хлорида натрия, сушили над сульфатом натрия и упаривали под вакуумом. Остаток очищали посредством колоночной хроматографии н-гексаном/этиловым эфиром уксусной кислоты в качестве элюента с получением в результате 41,2 г (78,6% от теории) 7-фенокси-3,4-дигидро-2Н-нафталин-1-она.
Стадия 2
2-Диметиламинометил-7-фенокси-3,4-дигидро-2Н-нафталин-1-он
Аналогично примеру 3, стадия 1, 40,5 г продукта из стадии 1 в 500 мл ацетонитрила подвергали взаимодействию с 16,0 г хлорида N,N-диметилметилениммония. После соответствующей переработки получили 45,8 г (91,3% от теории) 2-диметиламинометил-7-фенокси-3,4-дигидро-2Н-нафталин-1-она в виде масла.
Стадия 3
(1RS, 2RS)-1-[3-(трет-бутилдифенилсиланилокси)фенил] -2-диметиламинометил-7-фенокси-1,2,3,4-тетрагидронафт-1-ол
Раствор из 41,2 г (3-бромфенокси)-трет-бутилдифенилсилана в 300 мл сухого тетрагидрофурана при -40oС при перемешивании и подаче сухого азота смешивали по каплям с 62,5 мл 1,6М раствора н-бутиллития в н-гексане. Перемешивание продолжали еще в течение 30 мин, после чего по каплям добавляли раствор из 25,1 г продукта из стадии 2 в 75 мл сухого тетрагидрофурана. Реакционной смеси дали в течение 12 ч нагреться до 20oС и затем разлагали добавлением 100 мл насыщенного раствора хлорида аммония. После разбавления соответственно порциями по 200 мл воды и этилового эфира уксусной кислоты органическую фазу отделяли, а водную фазу дважды экстрагировали порциями по 100 мл этилового эфира уксусной кислоты. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и упаривали под вакуумом. Остаток очищали посредством колоночной хроматографии этиловым эфиром уксусной кислоты в качестве элюента и получили таким путем 32,9 г (61,6% от теории) (1RS,2RS)-1-[3-(трет-бутилдифенилсиланилокси)фенил]-2-диметиламинометил-7-фенокси-1,2,3,4-тетрагидронафт-1-ола в виде практически бесцветного вязкого масла.
Стадия 4
(1RS, 2RS)-2-Диметиламинометил-1-(3-гидроксифенил)-7-фенокси-1,2,3,4-тетрагидронафт-1-ол
Раствор из 31,4 г продукта из стадии 3 в 360 мл сухого тетрагидрофурана при температуре в интервале от 5 до +10oС при перемешивании смешивали по каплям с 57,5 мл 1-молярного раствора фторида тетра-н-бутиламмония в тетрагидрофуране. После завершения добавления перемешивали в течение 3 ч при 20oС, смешивали со 150 мл насыщенного раствора хлорида натрия и трижды экстрагировали соответственно порциями по 150 мл этилового эфира уксусной кислоты. Экстракты сушили над сульфатом натрия и упаривали под вакуумом. Остаток очищали посредством колоночной хроматографии этиловым эфиром уксусной кислоты/метанолом (5/1) в качестве элюента и таким путем получили 17,3 г (88,7% от теории) (1RS,2RS)-2-диметиламинометил-1-(3-гидроксифенил)-7-фенокси-1,2,3,4-тетрагидронафт-1-ола в виде вязкого масла, слегка окрашенного в желтый цвет.
Стадия 5
3-(2-Диметиламинометил-7-фенокси-3,4-дигидронафт-1-ил)фенол, гидрохлорид
15,6 г продукта из стадии 4 аналогично тому, как это описано в примере 3, стадия 3, подвергали взаимодействию со 150 мл 6 н. соляной кислоты. После аналогичной обработки и перевода в гидрохлорид получили 12,1 г (73,8% от теории) 3-(2-диметиламинометил-7-фенокси-3,4-дигидронафт-1-ил)фенола, гидрохлорида, в виде белых кристаллов, т. пл. 210-212oС.
Пример 9
Заменив 7-фенокси-3,4-дигидро-2Н-нафталин-1-он из примера 8, стадия 2, на соответствующие производные 5-метокси (9а), 7-фенила (9б), 7-фенетила (9г), 5-фенокси (9д), 6-фенокси (9е) и 7-н-бутила (9в), соответственно на 2-фенокси-6,7,8,9-тетрагидробензоциклогептен-5-он (9ж), по стадийному механизму и методике, описанным в примере 8, из указанных соединений получили:
9а: 3-(2-диметиламинометил-5-метокси-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 245-247oС,
9б: 3-(2-диметиламинометил-7-фенил-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 232-233oС,
9в: 3-(7-н-бутил-2-диметиламинометил-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 202-205oС,
9г: 3-(2-диметиламинометил-7-фенетил-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 233-237oС,
9д: 3-(2-диметиламинометил-5-фенокси-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 197-198oС,
9е: 3-(2-диметиламинометил-6-фенокси-3,4-дигидронафт-1-ил)фенол, гидрохлорид, т. пл. 224,5-226oС,
9ж: 3-(6-диметиламинометил-2-фенокси-8,9-дигидро-7Н-бензоциклогептен-5-ил)фенол, гидрохлорид, т. пл. 245-247oС.
Пример 10
3-{ 6-[Аллилметиламинометил]-8,9-дигидро-7Н-бензоциклогептен-5-ил}фенол, гидрохлорид
Стадия 1
6-[(аллилметиламинометил]-6,7,8,9-тетрагидробензоциклогептен-5-он
5,2 г 6,7,8,9-тетрагидробензоциклогептен-5-она, 0,96 г параформальдегида и 10,0 г аллилметиламина, гидрохлорида в 60 мл ледяного уксуса подвергали взаимодействию аналогично тому, как это описано в примере 1, стадия 1. После аналогичной обработки получили 6,7 г (84,8% от теории) 6-[(аллилметиламинометил] -6,7,8,9-тетрагидробензоциклогептен-5-она в виде масла желтоватого цвета.
Конечная стадия
3-{ 6-[аллилметиламинометил]-8,9-дигидро-7Н-бензоциклогептен-5-ил}фенол, гидрохлорид
Продукт из стадии 1 по методике, описанной в примере 8, стадии 3-5, подвергали дальнейшей переработке. В результате получили 3-{6-[аллилметиламинометил]-8,9-дигидро-7Н-бензоциклогептен-5-ил}фенол, гидрохлорид в виде белых кристаллов, т. пл. 156-159oС (разложение).
Пример 11
а) 3-[3-диметиламино-1-(3-гидроксифенил)-2-метилпропенил]фенол, гидрохлорид
Стадия 1
(2RS)-3-диметиламино-1,1-бис(3-метоксифенил)-2-метилпропан-1-ол, гидрохлорид
27,0 г магниевой стружки перемешивали в 150 мл сухого тетрагидрофурана. Затем по каплям добавляли 207,6 г 1-бром-3-метоксибензола, растворенных в 400 мл сухого тетрагидрофурана, причем добавление осуществляли таким образом, что реакционная смесь при этом слегка кипела. После добавления нагрев продолжали еще в течение одного часа с обратным холодильником, затем охлаждали до 5-10oС и при этой температуре добавляли по каплям 166,0 г (RS)-3-диметиламино-1-(3-метоксифенил)-2-метилпропан-1-она, растворенных в 400 мл тетрагидрофурана. Реакционную смесь выдерживали в течение ночи, после чего повторно охлаждали до 5-10oС. Добавлением 300 мл 20%-ного раствора хлорида аммония раствор Гриньяра разлагали. Затем реакционную смесь разбавляли 400 мл простого эфира, фазы разделяли и водную фазу экстрагировали дважды соответственно порциями по 250 мл эфира. Объединенные органические фазы сушила над сульфатом натрия и растворитель удаляли. Остаток (342 г) растворяли в 4000 мл 2-бутанона и смешивали с 81,5 г триметилхлорсилана и 13,5 мл воды. В течение ночи при 4-5oС в виде кристаллов выпало 165,0 г (60% от теории) 3,3-бис(2-гидроксифенил-2-метилпроп-2-енил)диметиламина, гидрохлорида, т. пл. 158-160oС.
Стадия 2
3-[3-Диметиламино-1-(3-гидроксифенил)-2-метилпропенил]фенол, гидрохлорид
58 г (2RS)-3-диметиламино-1,1-бис(3-метоксифенил)-2-метилпропан-1-ола, гидрохлорида из стадии 1 растворяли в 2000 мл концентрированной бромистоводородной кислоты (47%-ной) и в течение 7 ч нагревали с обратным холодильником. После охлаждения до комнатной температуры реакционную смесь смешивали с 800 мл воды, 2000 мл дихлорметана и 80 г гидрокарбоната натрия. После отделения дихлорметановой фазы водную фазу дважды экстрагировали 1000 мл этилового эфира уксусной кислоты. Объединенные органические фазы сушили над сульфатом натрия и растворитель удаляли. Остаток (42 г), растворенный в смеси, состоящей из 100 мл этилового эфира уксусной кислоты и 100 мл тетрагидрофурана, очищали посредством колоночной хроматографии. После элюирования этиловым эфиром уксусной кислоты/метанолом (4/1) получили 22 г основания, которое растворяли в 500 мл 2-бутанона и смешивали с 8,5 г триметилхлорсилана и 16 мл воды. Выпавший в виде кристаллов гидрохлорид (14,6 г) отфильтровывали через вакуум-фильтр и для очистки суспедировали в 1000 мл 2-бутанона. Суспензию перемешивали в течение 5 ч с использованием обратного холодильника. После охлаждения до комнатной температуры получили 13,5 г гидрохлорида (26,4% от теории), т. пл. 222-224oС.
б) Z-3-(1-Бифенил-4-ил-3-диметиламино-2-метилпропенил)фенол, гидрохлорид
По описанной в примере 11a методике и применяя (RS)-1-бифенил-4-ил-3-диметиламино-2-метилпропан-1-он, аналогичным путем получили соединение, указанное в заголовке, т. пл. 192-194oС.
Применяя соответствующие замещенные диметиламиноалкан-1-оны на стадии 1 по аналогичному стадийному механизму получили следующие соединения:
11в: Е-3-[1-(3,4-дихлорфенил)-3-диметиламино-2-метилпропенил] фенол, гидрохлорид, т. пл. 176-178oС,
11г: Z-3-[1-(4-хлорфенил)-3-диметиламино-2-метилпропенил]фенол, гидрохлорид, т. пл. 144-146oС,
11д: Z-3-[3-диметиламино-2-метил-1-(4-феноксифенил)пропенил]фенол, гидрохлорид, т. пл. 190-192oС,
11е: Z-3-(3-диметиламино-2-метил-1-п-толилпропенил)фенол, гидрохлорид, т. пл. 200-201oС,
11ж: Z-3-(2-диметиламинометил-1-фенилбут-1-енил)фенол, гидрохлорид, т. пл. 188-190oС,
11з: Z-3-[1-(4'-хлорбифенил-4-ил)-3-диметиламино-2-метилпропенил]фенол, гидрохлорид, т. пл. 156-158oС,
11и: Z-3-[3-диметиламино-2-метил-1-(4-стирилфенил)пропенил] фенол, гидрохлорид, т. пл. 236-237oС,
11к: Z-3-[3-диметиламино-2-метил-1-(4-фенетилфенил)пропенил]фенол, гидрохлорид, т. пл. 183-185oС,
11л: Z-3-[3-диметиламино-1-(4-гидроксифенил)-2-метилпропенил]фенол, гидрохлорид,
11м: Z-3-(1-бензо[1,3]диоксол-5-ил-3-диметиламино-2-метилпропенил)фенол, гидрохлорид, т. пл. 121-124oС.
Описанные ниже исследования по связыванию δ-опиатного рецептора подтверждают, что предлагаемые согласно изобретению соединения формулы I обладают исключительно высокой эффективностью в качестве анальгетиков.
Исследования по связыванию δ-опиатного рецептора
Исследования по выявлению сродства предлагаемых согласно изобретению соединений формулы I с δ-опиатным рецептором проводили на гомогенатах мембран головного мозга мужских особей крыс линии Wistar (гомогенат головного мозга без мозжечка, моста и продолговатого мозга).
С этой целью соответственно свежепрепарированный мозг крыс при охлаждении льдом гомогенизировали в 50 ммолях/л трис-HCl (рН 7,4) и в течение 10 мин центрифугировали при 5000 g и 4oС. После декантирования и отбрасывания надосадочной жидкости повторного растворения и гомогенизации мембранного осадка в 50 ммолях/л трис-НСl (рН 7,4) гомогенат в течение 20 мин центрифугировали при 20000 g и 4oС. Эту стадию промывки повторяли еще раз. Затем надосадочную жидкость декантировали, а мембранный осадок гомогенизировали в холодном 50 ммолей/л трис-HCl, 20% глицерине (мас./об.), 0,01% бацитрацине (мас. /об. ) (рН 7,4) и в аликвотных количествах замораживали до начала тестирования. Для исследования по связыванию рецептора аликвоты оттаивали и разбавляли соответствующим буфером в соотношении 1:10. В качестве буфера в этих исследованиях применяли 50 ммолей/л трис-HCl, 5 ммолей/л MgCl2 (рН 7,4), дополненные 0,1% (мас./об.) бычьим сывороточным альбумином, а в качестве радиоактивного лиганда использовали 1 нмоль/л (3H)-2-D-Ala-дeльтopфин II. Долю неспецифического связывания определяли в присутствии 10 мкмолей/л налоксона.
В других смесях соединения по изобретению добавляли в последовательно изменяющейся концентрации и определяли вытеснение радиоактивного лиганда из его специфически связанного состояния. Соответствующие смеси, которые исследовали в трех параллельных опытах, инкубировали в течение 90 мин при 37oС, после чего для выявления связанного с гомогенатом мембран радиоактивного лиганда последний собирали посредством фильтрации через фильтр из стекловолокна (GF/B). Радиоактивность дисков стекловолоконного фильтра измеряли после добавления сцинциллятора в счетчике бета-излучения.
Сродство соединений по изобретению к δ-опиатным рецепторам рассчитывали в качестве IC50 согласно закону действующих масс с помощью нелинейной регрессии. На основе IC50-значений по уравнению Ченга-Пруссоффа рассчитывали значения Кi. Эти Кi-значения указаны в качестве средних значений ± стандартные отклонения в проведенных независимо друг от друга опытах в количестве ≥3.
Представленные в таблице данные показывают, что предлагаемые согласно изобретению аминосоединения обладают анальгетической эффективностью, причем эта биологическая эффективность частично либо преимущественно опосредуется через δ-опиатные рецепторы и тем самым может быть подтверждена.
В качестве эффективных и селективных δ-опиоидных агонистов и антагонистов соединения общей формулы I согласно изобретению могут применяться в качестве средств при патологических состояниях, для лечения которых обычно используют агонисты и антагонисты δ-опиоидного рецептора. Предпочтительно соединения общей формулы I могут применяться в качестве анальгетиков.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ГЕТЕРОЦИКЛИЧЕСКИХ БЕНЗОЦИКЛОАЛКЕНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1998 |
|
RU2197484C2 |
| ДИМЕТИЛ(3-АРИЛБУТ-3-ЕНИЛ)АМИНОСОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2167146C2 |
| ПРОИЗВОДНЫЕ АКРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1999 |
|
RU2225399C2 |
| 1-ФЕНИЛ-2-ДИМЕТИЛАМИНОМЕТИЛЦИКЛОГЕКСАН-1-ОЛОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1996 |
|
RU2167148C2 |
| 6-ДИМЕТИЛАМИНОМЕТИЛ-1-ФЕНИЛЦИКЛОГЕКСАНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИ ДЕЙСТВУЮЩИХ ВЕЩЕСТВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1996 |
|
RU2178409C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЛИ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2002 |
|
RU2309942C2 |
| ЗАМЕЩЕННЫЕ ЦИКЛОГЕПТЕНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1999 |
|
RU2233268C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ С-ЦИКЛОГЕКСИЛМЕТИЛАМИНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО И ПРИМЕНЕНИЕ | 2001 |
|
RU2295515C2 |
| КОМБИНАЦИЯ ОПРЕДЕЛЕННЫХ ОПИОИДОВ С МУСКАРИНОВЫМИ АНТАГОНИСТАМИ ДЛЯ ТЕРАПИИ НЕДЕРЖАНИЯ МОЧИ | 2002 |
|
RU2305562C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАН-1,4-ДИАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2002 |
|
RU2321579C2 |
Изобретение относится к новым замещенным аминосоединениям формулы I, их фармацевтически приемлемым солям и способу их получения. Указанные соединения проявляют анальгетическую активность и могут быть использованы для получения лекарственного средства, представляющего собой анальгетик. В соединениях формулы I R1 означает Н, ОН, О-С1-6алкил, причем R1 не является Н, если R2 и R7 представляют собой Н или в положении 7 OCH3-группа замещена; R2 означает Н (если R1 не является Н), ОН, С1-6алкил, О-арил, С2-6алкениленарил, Cl, F, С1-6алкокси, арил, С1-6алкиларил, 5,6- либо 6,7-бензо, незамещенный, одно- либо двузамещенный Cl, F, СF3, С1-6алкилом, О-С1-6алкилом, ОН (причем, если R1 и R2 или R7 являются Н, R2 или R7 не могут представлять собой СF3-группу и R2 или R7 в положении 7 не могут представлять собой ОСН3-группу), или R2 и R7 оба вместе представляют собой -О-(СН2)(1-2)-О- (в положении 5,6 или 6,7); R3 означает Н; R4 означает С1-6алкил или R3 и R4 оба вместе представляют собой -(CH2)(1-4)-; R5 означает C1-6алкил, C3-7циклоалкил; R6 означает С1-6алкил, С1-6алкиларил, -СН2-СН= С(R8)2, -СH2-(С3-7)циклоалкил, С3-7циклоалкил; С1-6алкилгетероциклил; R7 означает Н (если R1 не является Н), ОН, С1-6алкил, О-арил, С2-6-алкениленарил, С1-6алкокси, Cl, F, арил, С1-6алкиларил, 5,6- либо 6,7-бензо, незамещенный, одно- либо двузамещенный Cl, F, CF3, С1-6алкилом, О-С1-6алкилом, ОН (причем, если R1 и R2 или R7 являются Н, R2 или R7 не могут представлять собой СF3-группу и R2 или R7 в положении 7 не могут представлять собой OCH3-группу), и R8 означает Н или CH3, при том, что "гетероциклил" обозначает 5- или 6-членную ненасыщенную либо насыщенную, необязательно конденсированную с арилом гетероциклическую систему, содержащую 1 или 2 гетероатома из группы, включающей азот, кислород и/или серу. Способ получения аминосоединениям формулы I заключается в том, что третичный спирт формулы II, где R1-R7 имеют значения, указанные в формуле I, подвергают взаимодействию с неорганическими или органическими кислотами в диапазоне температур от 0 до 100oС, третичный спирт общей формулы II получают взаимодействием β-аминокетона формулы III, где R3-R6 имеют вышеуказанные значения, а R9 идентично R2, а R10 идентично R7, за исключением случаев, когда гидроксигруппа защищена и представляет бензилокси или силанилоксигруппы, с металлорганическим соединением формулы IV, в которой Z означает MgCl, MgBr, MgI или Li, a R11 представляет водород, O-C1-6алкил или защищенную гидроксильную группу, как указано выше, с получением соединения формулы IIа, которое затем переводят в соединение II. 2 с. и 6 з.п.ф-лы, 1 табл.

где R1 означает Н, ОН, О-С1-6алкил, причем R1 не является Н, если R2 и R7 представляют собой Н или в положении 7 ОСН3-группа замещена;
R2 означает Н (если R1 не является Н), ОН, С1-6алкил, O-арил, С2-6алкениленарил, Cl, F, С1-6алкокси, арил, C1-6алкиларил, 5,6- либо 6,7-бензо, незамещенный, одно- либо двузамещенный Cl, F, СF3, С1-6алкилом, O-С1-6алкилом, ОН (причем, если R1 и R2 или R7 являются Н, R2 или R7 не могут представлять собой СF3-группу и R2 или R7 в положении 7 не могут представлять собой ОСН3-группу), или R2 и R7 оба вместе представляют собой -О-(СН2)(1-2)-О- (в положении 5,6 или 6,7);
R3 означает Н;
R4 означает С1-6алкил, или R3 и R4 оба вместе представляют собой -(СН2)(1-4)-;
R5 означает С1-6алкил, С3-7циклоалкил;
R6 означает С1-6алкил, С1-6алкиларил, -CH2-CH= С(R8)2, -СН2-(С3-7)циклоалкил, С3-7циклоалкил, С1-6алкилгетероциклил;
R7 означает Н (если R1 не является Н), ОН, С1-6алклл, O-арил, С2-6алкениленарил, С1-6алкокси, Cl, F, арил, С1-6алкиларил, 5,6- либо 6,7-бензо, незамещенный, одно- либо двузамещенный Cl, F, СF3, С1-6алкилом, О-С1-6алкилом, ОН (причем, если R1 и R2 или R7 являются Н, R2 или R7 не могут представлять собой CF3-группу и R2 или R7 в положении 7 не могут представлять собой ОСН3-группу); и
R8 означает Н или СН3, при том, что "гетероциклил" обозначает 5- или 6-членную ненасыщенную либо насыщенную, необязательно конденсированную с арилом гетероциклическую систему, содержащую 1 или 2 гетероатома из группы, включающей азот, кислород и/или серу,
или фармацевтически применимые соли этих соединений.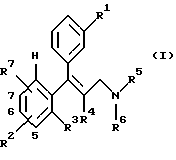
где R1-R7 имеют значение, указанное в п. 1,
отличающийся тем, что третичный спирт общей формулы II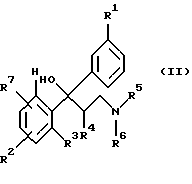
где R1-R7 имеют то же значение, что и в формуле I,
подвергают взаимодействию с органическими либо неорганическими кислотами в диапазоне температур от 0 до 100oС, причем третичный спирт общей формулы II получают за счет того, что сначала β-аминокетоны общей формулы III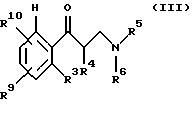
где R3-R6 имеют то же значение, что и в формуле I, R9 идентичен R2, a R10 идентичен R7, за исключением тех случаев, когда гидроксильная функция представлена в защищенной форме в виде бензилокси- или силанилоксигруппы,
подвергают взаимодействию с металлорганическим соединением формулы IV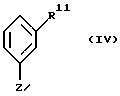
в которой Z означает MgCl, MgBr, MgI или Li, a R11 представляет собой водород, О-С1-6алкил или защищенную гидроксильную функцию, представленную в виде бензилокси- или силанилоксигруппы,
с получением соединения формулы IIа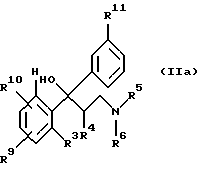
которое затем переводят в соединение формулы II.
| DE 3405333 A, 22.05.1985 | |||
| US 3452094 А, 24.06.1969 | |||
| Экономайзер | 0 |
|
SU94A1 |
| DE 3541118 А, 30.10.1990 | |||
| Оснастка для изготовления криволинейных судовых обшивок | 1980 |
|
SU872371A2 |
| АРАЛКИЛАМИНОВЫЕ ПРОИЗВОДНЫЕ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2021256C1 |
Авторы
Даты
2003-01-27—Публикация
1998-03-12—Подача