Предметом настоящего изобретения является 2,2-дихлоралканкарбоновые кислоты, способ их получения и содержащие эти соединения лекарственные средства.
Изобретение относится к 2,2-дихлоралканкарбоновым кислотам общей формулы (I):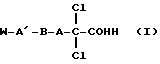
в которой А означает алкиленовую цепь с 5-20 атомами углерода;
А' означает валентную связь, виниленовую или ацетиленовую группу или алкиленовую цепь с 1-10 атомами углерода;
В означает валентную связь, метиленовую группу, серу, кислород или группу NR1,
причем R1 может означать водород, бензил, фенил или алкильный остаток с 1-4 атомами углерода;
карбонильную, сульфонамидную, сульфоксидную или сульфоновую группу. Е- или Z -виниленовую или ацетиленовую группу, CR2R3 - группу, причем
R2 может означать водород, алкильный остаток с 1-4 атомами углерода или фенил;
R3 может означать алкильный остаток с 1-4 атомами углерода, бензил, фенил, гидроксил или группу NR4R5, где
Р4 может означать водород, бензил, фенил или алкильный остаток с 1-4 атомами углерода и
R5 может означать водород или алкильный остаток с 1-4 атомами углерода;
группу У-Z-У, причем
Y может означать серу или кислород,
Z может означать алкильную цепь (СН2)n, где n=1-5;
W означает атом галогена, цианогруппу или роданогруппу, аминокарбонил; метильный, изопропильный или трет.-бутильный остаток;
циклоалкильный остаток с 3-8 атомами углерода, который может быть незамещен или замещен фенилом или алкилом с 1-4 атомами углерода;
циклогексенильный или циклопентенильный остаток; фенильное кольцо, которое может быть замещено одним или любой комбинацией из следующих заместителей: алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, алкилтиогруппа с 1-4 атомами углерода, алкилсульфинил с 1-4 атомами углерода, алкилсульфонил с 1-4 атомами углерода, трифторметил, нитрогруппа, аминогруппа, гидроксил, цианогруппа, меркаптогруппа, сульфонаминогруппа, ацетиламиногруппа, карбоксил, феноксигруппа, бензилоксигруппа, фенил, бензоил, карбоксиалкил с 1-4 атомами углерода в алкильной части, метилендиоксигруппа, этилендиоксигруппа, фтор, хлор, бром, иод, карбоксиметоксигруппа, карбоксиэтоксигруппа, ацетоксигруппа, ацетил, пропионил, группа NR6R7,
где R6 означает водород, алкил с 1-4 атомами углерода, бензил,
a R7 означает водород, алкил с 1-4 атомами углерода, бензил, фенил или бензоил, причем соответствующие ароматические кольца могут быть незамещены или одно- или многократно замещены галогеном, гидроксилом или алкоксилом с 1-4 атомами углерода; далее,
α- или β-нафтильное кольцо, которое может быть замещено метилом, гидроксилом, метоксигруппой, карбоксилом, метоксикарбонилом, этоксикарбонилом, цианогруппой, ацетилом, хлором или бромом;
или тетрагидронафтильный остаток;
а также к их физиологически приемлемым солям или эфирам и веществам, которые in vivo гидролизуют или метаболизируют до соединений общей формулы (I). В случае если путем замещения алкиленовой цепи в положении 1 описанными остатками образуются хиральные соединения, то как вещества с конфигурацией R, так и вещества с конфигурацией S составляют предмет изобретения. Под алкильными заместителями с 1-4 атомами углерода понимают линейные или разветвленные алкильные остатки.
Соединения формулы (I) обладают ценными фармакологическими свойствами. Они вызывают нормализацию повышенного уровня глюкозы без сопутствующей опасности гипогликемии и поэтому исключительно пригодны для лечения сахарного диабета.
Прежние принципы действия оральных антидиабетических средств, как и вообще применяемых сульфонилмочевин, основываются на повышенном высвобождении инсулина из β-клеток поджелудочной железы, причем механизм приводит от длительного до полного прекращения собственного продуцирования инсулина больным диабетом. В центре внимания современной патобиохимии старческого диабета поэтому находится необходимость лечения периферической резистентности к инсулину.
Соединения формулы (I) повышают эффективность использования глюкозы, например, в мышце, за счет повышения чувствительности к инсулину они подавляют гиперинсулинемию и, таким образом, точно соответствуют требуемой концепции лечения.
Больные диабетом при общем нарушении адаптации зачастую страдают общим состоянием обмена веществ, характеризующимся гиперлипидемией, повышенным уровнем холестерина, гипертонией, болезненным ожирением и гиперинсулинемией, т. е. картиной болезни, которую называют метаболическим синдромом или синдромом Х и которая приводит к поздним осложнениям. Наряду с подавлением гиперинсулинизма соединения общей формулы (I) дополнительно вызывают снижение уровня триглицеридов, холестерина и фибриногена, вследствие чего они исключительно пригодны для лечения метаболического синдрома.
Соединения общей формулы (I), в которых W означает атом хлора и А-В-А' означает алкиленовую цепь -(СН2)п-, уже описаны без указания фармакологического действия. Так, в журнале ДАН СССР, 127, 1027 (1959), указывается получение этилового эфира 2,2,8-трихлороктановой кислоты (п=6). В журнале Известия АН СССР (1215 (1960)) описывается синтез 2,2,8-трихлороктановой кислоты (п= 6), 2,2,6-трихлоргексановой кислоты (п=4) и 2,2,6-трихлоргептановой кислоты (п=5).
Далее, известны соединения общей формулы (I), в которых W означает метильную группу и А-В-А' означает алкиленовую цепь -(CH2)п - и которые являются основными или побочными продуктами при реакциях хлорирования, однако для которых до сих пор не описано применение в качестве лекарственных средств из следующих источников: Ind. Eng. Chem. Res., 114, 2425 (1992): 2,2-дихлордекановая кислота, 2,2-дихлорок-тановая кислота и 2,2-дихлортетрадекановая кислота; Bull. Soc. Chem. Belg., 97, 525 (1988); 2,2-дихлордекановая кислота, 2,2-дихлороктановая кислота, 2,2-дихлороктадекановая кислота, 2,2-дихлордодекановая кислота, 2,2-дихлоргексадекановая кислота и 2,2-дихлортетрадекановая кислота;
европейский патент 167202: 2,2-дихлороктановая кислота и 2,2-дихлорнонановая кислота;
Wear, 3, 200 (1960): 2,2-дихлороктадекановая кислота;
европейский патент 87835: 2,2-дихлороктадекановая кислота;
Известия высших учебных заведений по химии и химической технологии, 18, 674 (1975): 2,2-дихлороктадекановая кислота и 2,2-дихлорнонановая кислота;
Ger.Offen: 2264234: 2,2-дихлортетрадекановая кислота;
патент США 3573332: 2,2-дихлордодекановая кислота;
Can.Chem., 36, 440 (1958): 2,2-дихлордодекановая кислота.
Предпочтительными соединениями общей формулы (I) являются соединения, в которых
А означает алкиленовую цепь с 8-14, предпочтительно 10-12 атомами углерода;
А' означает валентную связь, винилен или ацетилен;
В означает валентную связь, метиленовую группу, кислород, серу, сульфоксид или сульфонил; и
W означает циклоалкил с 3-8 атомами углерода или, возможно, замещенный фенильный остаток, в особенности 4-хлорфенил, 4-метилтиофенил, 4-алкилфенил с 1-4 атомами углерода в алкильной части, 4-метилсульфонилфенил.
Алкиленовая цепь А, соответственно А' предпочтительно является линейной, однако также может быть разветвленной.
Под галогеном нужно понимать фтор, хлор, бром или иод. Циклоалкильные остатки с 3-8 атомами углерода означают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
Примерами физиологических приемлемых солей соединений формулы (I) являются соли щелочных металлов, щелочноземельных металлов, аммония и алкиламмония, как соль натрия, калия, магния, кальция или тетраметиламмония.
Примерами сложных эфиров являются сложные эфиры алифатических спиртов, как алканолов с 1-6 атомами углерода, в особенности метиловый, этиловый, пропиловый, бутиловый и изопропиловый сложные эфиры.
Производные карбоновой кислоты общей формулы (I) можно вводить в жидкой или твердой форме, орально и парентерально. В качестве среды для инъекции предпочтительно используют воду, которая содержит обычные в случае растворов для инъекций стабилизаторы, агенты растворения и/или буферы. Такого рода добавками являются, например, тартратные или боратные буферы, этанол, диметилсульфоксид, комплексообразователи (как этилендиаминтетрауксусная кислота), высокомолекулярные полимеры (как жидкий полиэтиленоксид) для регулирования вязкости или полиэтиленовые производные сорбитангидридов. Твердыми носителями являются, например, крахмал, лактоза, маннит, метилцеллюлоза, тальк, высокодисперсная кремневая кислота, более высокомлекулярные полимеры (как полиэтиленгликоли). Пригодные для орального применения композиции могут содержать при желании вкусовые и подслащивающие вещества.
Вводимая доза зависит от возраста, состояния здоровья и массы реципиента, масштаба заболевания, рода осуществляемых одновременно других лечений и желательного действия. Обычно суточная доза активного соединения составляет от 0,1 до 50 мг/кг массы тела. Обычно эффективны 0,5-40 и предпочтительно 1,0-20 мг/кг/день путем одноразового или многоразового введений в день для достижения желаемых результатов.
Предметом настоящей заявки являются также новые соединения формулы (I), в которой
А означает алкиленовую цепь с 5-20 атомами углерода;
А' означает валентную связь, виниленовую или ацетиленовую группу или алкиленовую цепь с 1-10 атомами углерода;
В означает валентную связь, серу, метилен, кислород или группу NR1 причем R1 может означать водород, бензил, фенил или алкильный остаток с 1-4 атомами углерода; карбонильную, сульфонамидную, сульфоксидную или сульфоновую группу. Е- или Z-виниленовую или ацетиленовую группу, CR2R3-группу, причем
R2 может означать водород, алкильный остаток с 1-4 атомами углерода или фенил;
R3 может означать алкильный остаток с 1-4 атомами углерода, бензил, фенил, гидроксил или группу NR4R5, где
R4 может означать водород, бензил, фенил или алкильный остаток с 1-4 атомами углерода и
R5 может означать водород или алкильный остаток с 1-4 атомами углерода;
группу Y-Z-Y, причем Y может означать серу или кислород;
Z может означать алкильную цепь (СН2)п, где "п"=1-5; и
W означает бром, цианогруппу или роданогруппу, аминокарбонил; метильный, изопропильный или трет. -бутильный остаток; циклоалкильный остаток с 3-8 атомами углерода, который может быть незамещен или замещен фенилом или алкилом с 1-4 атомами углерода; циклогексенильный или циклопентенильный остаток; фенильное кольцо, которое может быть замещено одним или любой комбинацией из следующих заместителей: алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода, алкилтиогруппа с 1-4 атомами углерода, алкилсульфинил с 1-4 атомами углерода, алкилсульфонил с 1-4 атомами углерода, трифторметил, нитрогруппа, аминогруппа, гидроксил, цианогруппа, меркаптогруппа, сульфонамингруппа, ацетиламиногруппа, карбоксил, феноксигруппа, бензилоксигруппа, фенил, бензоил, карбоксиалкил с 1-4 атомами углерода в алкильной части, метилендиоксигруппа, этилендиоксигруппа, фтор, хлор, бром, иод, карбоксиметоксигруппа, карбоксиэтоксигруппа, ацетоксигруппа, ацетил, пропионил, группа NR6R7, где
R6 означает водород, алкил с 1-4 атомами углерода, бензил, а
R7 означает водород, алкил с 1-4 атомами углерода, бензил, фенил или бензоил,
причем соответствующие ароматические кольца могут быть незамещены или одно- или многократно замещены галогеном, гидроксилом или алкоксилом с 1-4 атомами углерода; далее,
α- или β-нафтильное кольцо, которое может быть замещено метилом, гидроксилом, метоксигруппой, карбоксилом, метоксикарбонилом, этоксикарбонилом, цианогруппой, ацетилом, хлором или бромом; или тетрагидронафтильный остаток;
а также их физиологически приемлемые соли или сложные эфиры и вещества, которые in vivo гидролизуются или метаболизируются до соединений общей формулы (I).
Соединения общей формулы (I), в которой А, А', В и W имеют вышеуказанные значения, получают тем, что галоидное соединение общей формулы (II):
X-A-B-A'-W (II)
вводят во взаимодействие с дихлоруксусной кислотой или эфирами дихлоруксусной кислоты в присутствии сильных оснований. Реакцию обычно проводят в растворителях, как диэтиловый эфир, тетрагидрофуран, диметоксиэтан, диэтиленгликольдиметиловый простой эфир или трет.-бутилдиметиловый простой эфир, при температурах в диапазоне от -80oС до -20oС. Предпочтительным основанием является диизопропиламид лития (ЛДА). Очистку продуктов обычно осуществляют путем флэш-хроматографии на силикагеле и/или путем перекристаллизации натриевых солей из спиртов, как метанол, этанол или изопропанол.
Соединения формулы (II) известны из литературы, или их можно получать известными способами. Так, например, синтез галоидных соединений осуществляют путем реакции Виттига ароматического или алифатического альдегида W-СНО с фосфониевой солью α,ω-дигалоидного соединения, при необходимости с последующим каталитическим гидрированием образовавшейся двойной связи. Альтернативно, получаемое из арил-или алкилбромида соединение W-Вr с помощью магния можно переводить в соединение Гриньяра и вводить в реакцию сочетания с α,ω-дигалоидными соединениями при катализе с помощью купрата по Шлоссеру (Angew. Chem., 86, 50 (1974)).
Галоидные соединения общей формулы (II), в которых W означает арильный, алкильный или циклоалкильный остаток, получают тем, что соответствующее бромсодержащее соединение W-Вr с помощью магния переводят в соединение Гриньяра и вводят в реакцию сочетания с α,ω-дигалоидным соединением при купратном катализе по Шлоссеру (Angew. Chem, 86, 50 (1974)).
Соединения формулы (II), в которых А' или В соответствует ацетиленовой группе, синтезируют путем взаимодействия ацетиленового соединения W-C≡-H, соответственно W-A-C≡C- Н с α,ω-дибромалканами в жидком аммиаке в присутствии амида натрия или в диоксане в присутствии бутиллития. Путем гидрирования тройной связи известными способами, например, в присутствии катализатора по Линдлару, получают вещества формулы (II), в которых В, соответственно А' означает виниленовую группу.
Если речь идет о соединениях формулы (II), в которых В означает атом серы, то их получают путем взаимодействия тиолов W-SH, соответственно W-A'-SН с описываемыми в настоящем изобретении эфирами ω-бром-2,2-дихлоркарбоновых кислот. Для проведения этой реакции пригодны диполярные апротонные растворители, предпочтительно диметилформамид, в присутствии неорганических оснований, как гидрид натрия или карбонат калия. Полученные простые тиоэфиры известным образом путем окисления с помощью 3-хлор-надбензойной кислоты, соответственно пероксида водорода можно переводить в сульфоксиды, соответственно сульфоны.
Соединения общей формулы (II), в которых В означает кислород или азот, получают путем взаимодействия спиртов, фенолов W-А'-ОН, соответственно аминов W-A'-NHR1 с α,ω-дибромалканами, причем реакцию обычно проводят в диметилформамиде или диметилсульфоксиде в присутствии оснований, как гидрид натрия, гидроксид калия, триэтиламин, карбонат калия или пиридин, при температурах от 20 до 120oС.
В соответствии с настоящим изобретением кроме указанных в примерах соединений принимают во внимание следующие соединения формулы (I), которые также могут находиться в виде солей или сложных эфиров:
1. 2,2-дихлор-14-(3,5-ди-трет. -бутил-4-гидрокси-фенил)тетрадекановая кислота;
2. 2,2-дихлор-14-(3,5-диметил-4-гидрокси-фенил)тетрадекановая кислота;
3. 2,2-дихлор-14-(3-трифторметил-фенил)тетрадекановая кислота;
4. 2,2-дихлор-14-(2-метокси-фенил)тетрадекановая кислота;
5. 2,2-дихлор-14-(2-хлор-фенил)тетрадекановая кислота;
6. 14-(4-карбокси-фенил)-2,2-дихлор-тетрадекановая кислота;
7. 12-(4-карбоксиметокси-фенил)-2,2-дихлордодекановая кислота;
8. 2,2-дихлор-14-циклогекс-2-енил-тетрадекановая кислота;
9. 2,2-дихлор-14-циклопентил-тетрадекановая кислота;
10. цис-14-(4-трет.-бутил-циклогексил)-2,2-дихлортетрадекановая кислота
11. 2,2-дихлор-12-(5,6,7,8-тетрагидро-нафт-1-ил)додекановая кислота;
12. 2,2-дихлор-14-(4-цианофенил)тетрадекановая кислота;
13. 12-бифен-4-ил-2,2-дихлордодекановая кислота;
14. 10-(4-бензилоксифенил)-2,2-дихлордекановая кислота;
15. 2,2-дихлор-12-(4-метилфенилсульфониламино)додекановая кислота;
16. 2,2-дихлор-12-(4-феноксифенил)додекановая кислота;
17. 14-(4-ацетиламино-фенил)-2,2-дихлортетрадекановая кислота;
18. 10-(4-бензил-фенил)-2,2-дихлордекановая кислота;
19. 2,2-дихлор-17,17-диметилоктадекановая кислота;
20. 2,2-дихлор-14-(4-метилфенил)-14-оксо-тетрадекановая кислота;
21. 2,2-дихлор-14-(4-фтор-фенил)тетрадекановая кислота;
22. 2,2-дихлор-12-(4-метилсульфонилфенил)додекановая кислота;
23. 12-(4-трет.-бутилфенил)-2,2-дихлордодекановая кислота;
24. 12-(4-трет.-бутилфенокси)-2,2-дихлордодекановая кислота;
25. 2,2-дихлор-15-фенил-пентадекановая кислота;
26. 2,2-дихлор-16-фенил-гексадекановая кислота;
27. 2,2-дихлор-13-фенил-тридекановая кислота;
28. 2,2-дихлор-14-циклогексил-тетрадекановая кислота;
29. 2,2-дихлор-14-(4-метокси-фенил)-14-оксо-тетрадекановая кислота.
Примеры осуществления
Пример 1: 12-Бром-2,2-дихлор-додекановая кислота (I)
К раствору диизопропиламида лития, приготовленному в атмосфере азота из 11,2 г (110 моль) диизопропиламина и 66,0 мл (105 ммоль) бутиллития (1,6 М раствор в гексане) при 0oС в 150 мл тетрагидрофурана, при температуре -70oС в течение 30 минут прикапывают раствор 6,41 г (49,7 ммоль) дихлоруксусной кислоты в 20 мл тетрагидрофурана. Перемешивают еще в течение 30 минут при -70oС и прозрачный желтого цвета раствор смешивают с 15,0 г (50,0 ммоль) 1,10-дибромдекана, растворенными в 30 мл тетрагидрофурана и в течение 6 часов выдерживают при температуре от -50 до -35oС. Первоначально образовавшийся осадок при этом снова растворяется. Для обработки полученный раствор смешивают с 200 мл 3н. соляной кислоты и экстрагируют с помощью 200 мл этилацетата. Органическую фазу дополнительно промывают с помощью 3н. соляной кислоты и насыщенного раствора хлорида натрия и водную фазу экстрагируют еще раз с помощью 200 мл этилацетата. Объединенные органические фазы сушат над сульфатом натрия и растворитель отгоняют. Флэш-хроматография остатка на силикагеле (растворитель: петролейный эфир с этилацетатом в соотношении 4:1; 1% ледяной уксусной кислоты) дает 8,3 г (48%) соединения 1. Т.пл. 49-51oС (изогексан)
Пример 2: 14-Бром-2,2-дихлор-тетрадекановая кислота (2)
Получают аналогично примеру 1 из 50,0 г (152 ммоль) 1,12-дибромдодекана и 39,3 г (305 ммоль) дихлоруксусной кислоты. Выход: 11,9 г (21%). Т.пл. 59-60oС.
Пример 3: Этиловый эфир 14-бром-2,2-дихлор-тетрадекановой кислоты
К раствору 3,30 г (8,77 ммоль) соединения 2 в 40 мл дихлорметана добавляют 1 каплю диметилформамида и 1,34 г (10,5 ммоль) оксалилхлорида. Спустя 30 минут избыточный оксалилхлорид удаляют в токе азота. Затем прикапывают смесь из 0,97 г (21,1 ммоль) этанола и 2,13 г (21,1 ммоль) триэтиламина при 0oС. Оставляют нагреваться до комнатной температуры и перемешивают дополнительно в течение 30 минут. После разложения с помощью 60 мл воды экстрагируют метиленхлоридом, промывают с помощью 0,5н. соляной кислоты и воды, сушат над сульфатом натрия и растворитель удаляют. Получают 3,38 г (95%) бесцветного масла.
Пример 4: 16-Бром-2,2-дихлор-гексадекановая кислота (4)
Получают аналогично примеру 1 из 2,0 г (5,6 ммоль) 1,14-дибромтетрадекана и 2,3 г (22,5 ммоль) дихлоруксусной кислоты. Выход: 0,58 г (23%). Т.пл. 61-63oС.
Пример 5: 7-Бром-2,2-дихлор-гептановая кислота (5)
При перемешивании и в атмосфере азота 24,3 г (33,6 мл, 0,240 моль) диизопропиламина растворяют в 100 мл тетрагидрофурана и при температуре -50oС прикапывают 100 мл (0,240 моль) 2,40 М раствора бутиллития в гексане. Выдерживают в течение 10 минут при температуре -10oС, затем при -75oС прикапывают раствор 15,5 г (0,120 моль) дихлоруксусной кислоты в 20 мл тетрагидрофурана, перемешивают в течение 25 минут при -75oС и после этого добавляют 93,5 г (55,0 мл; 0,41 моль) 1,5-дибромпентана в 50 мл тетрагидрофурана так, чтобы температура повысилась до -40oС. После выдерживания в течение 2,5 часов при -40oС гидролизуют с помощью 10 мл 6н. соляной кислоты и выпавший осадок растворяют в 20 мл воды. Органическую фазу промывают дважды небольшим количеством воды, сушат над сульфатом магния и растворитель удаляют в вакууме. Флэш-хроматография остатка на силикагеле (растворитель: этилацетат/гептан в соотношении 1:10) дает 19,5 г (59%) 7-бром-2,2-дихлоргептановой кислоты (5) в виде бесцветного масла.
Пример 6: Этиловый эфир 7-бром-2,2-дихлор-гептановой кислоты (6)
19,5 г Соединения 5 растворяют в 300 мл этанола, насыщают при 0oС газообразным хлористым водородом и перемешивают еще 5 часов при 0oС. После удаления основного количества этанола в вакууме остаток обрабатывают эфиром, полученный экстракт промывают водой, сушат над сульфатом магния и растворитель удаляют. Получают 21,2 г (98%) этилового эфира 7-бром-2,2-дихлор-гептановой кислоты (6) в виде бесцветного масла.
Пример 7: 8-Бром-2,2-дихлор-октановая кислота (7)
Получают аналогично примеру 5 из 12,7 г (52,0 ммоль) 1,6-дибромгексана и 2,2 г (17,0 ммоль) дихлоруксусной кислоты. Выход: 7,64 г (50%); бесцветное масло.
Пример 8: 2,2-Дихлор-12-циано-додекановая кислота (8)
К суспензии 393 мг (9,82 ммоль) гидрида натрия (60%-ный в вазелиновом масле) в 30 мл диметилсульфоксида непрерывно прикапывают раствор 3,42 г (9,82 ммоль) соединения 1 в 5 мл диметилсульфоксида. По окончании выделения водорода добавляют 1,47 г (30,0 ммоль) цианида натрия (высушен при 120oС в высоком вакууме) и нагревают в течение 45 минут при 50-60oС. После охлаждения смешивают с 200 мл этилацетата и подкисляют с помощью раствора 10 г хлорида железа-(III) в 3н. соляной кислоте. Промывают дважды насыщенным раствором хлорида натрия и экстрагируют водную фазу этилацетатом. Объединенные органические фазы сушат над сульфатом натрия. После удаления растворителя и флэш-хроматографии на силикагеле (растворитель: петролейный эфир с этилацетатом в соотношении 4: 1, 1% ледяной уксусной кислоты) получают 2,61 г (90%) соединения 8 в виде светло-желтого масла.
Пример 9: 2,2-Дихлор-12-фенокси-додекановая кислота (9)
1-Бром-10-фенокси-декан (61)
К раствору метанолята натрия, полученному из 1,20 г (30,0 ммоль) гидрида натрия (60%-ный в вазелиновом масле) и 30 мл этанола, добавляют 2,90 г (30,8 ммоль) фенола и 9,00 г (30,0 ммоль) 1,10-дибромдекана. Вначале прозрачный раствор слабо-желтого цвета кипятят с обратным холодильником. Уже спустя 30 минут начинает образовываться осадок. Спустя 6 часов реакционную смесь охлаждают, добавляют 300 мл этилацетата и трижды промывают по 200 мл насыщенным раствором хлорида натрия. После высушивания над сульфатом натрия и концентрирования в ротационном испарителе остаток растворяют в этаноле и выдерживают в течение 24-х часов в холодильнике. Осадившийся продукт отсасывают и дополнительно промывают небольшим количеством этанола. Получают 6,00 г (64%) соединения 61. Т.пл. 62-64oС.
К раствору енолята, полученному аналогично примеру 1 из 7,60 г (75,0 ммоль) диизопропиламина, 46 мл (74 ммоль) бутиллития (1,6 М раствор в гексане) и 4,81 г (37,2 ммоль) дихлоруксусной кислоты в 80 мл тетрагидрофурана, при температуре -78oС добавляют раствор 5,84 г (18,6 ммоль) соединения 61 и оставляют медленно оттаивать в охлаждающей бане. После достижения температуры -30oС охлаждают еще раз до -50oС и затем доводят до -20oС. После добавления 50 мл 3н. соляной кислоты и 200 мл этилацетата промывают дважды по 150 мл 3н. соляной кислоты и дважды с помощью насыщенного раствора хлорида натрия. После высушивания над сульфатом натрия и удаления растворителя в ротационном испарителе осуществляют очистку путем флэш-хроматографии на силикагеле (растворитель: петролейный эфир с изопропанолом в соотношении 96: 4; 0,5% ледяной уксусной кислоты). Получают 4,25 г (63%) слабо-желтого застывающего в воскообразную массу масла.
Пример 10: 2,2-Дихлор-12-(4-метил-фенокси)додекановая кислота (10)
1-Бром-10-(4-метил-фенокси)декан (62)
К раствору фенолята, полученному из 6,5 г (60 ммоль) гидрида натрия (60%-ный в вазелиновом масле) в 60 мл этанола, добавляют 18 г (60 ммоль) 1,10-дибромдекана и кипятят с обратным холодильником в течение 6 часов. Выделяется бесцветный осадок. После добавления 200 мл 3н. соляной кислоты и 200 мл этилацетата полученную смесь промывают дважды насыщенным раствором хлорида натрия, сушат над сульфатом натрия и растворитель выпаривают в вакууме. Из сырого продукта после добавления толуола осаждают дифениловый эфир. Фильтрат перегоняют и фракцию 150-160oС (1,3 мбар) перекристаллизуют из этилацетата. Выход: 9,75 г соединения 62.
Полученный по аналогии с примером 9 из 5,15 г (40 ммоль) дихлоруксусной кислоты и 9,5 г (29 ммоль) соединения 62 сырой продукт с помощью флэш-хроматографии (силикагель; растворитель: этилацетат: петролейный эфир в соотношении 9: 1; 1% ледяной уксусной кислоты) освобождают от полярных примесей. Полученное масло обрабатывают петролейным эфиром и натриевую соль осаждают с помощью насыщенного раствора гидрокарбоната натрия. После отфильтровывания и перекристаллизации из этилацетата с помощью 3н. соляной кислоты снова высвобождают кислоту, экстрагируют этилацетатом, сушат над сульфатом натрия и растворитель выпаривают. Перекристаллизация свободной кислоты из петролейного эфира дает 2,4 г (22%) соединения 10. Т.пл. 67-68oС.
Пример 11: 2,2-Дихлор-12-(4-хлор-фенокси)додекановая кислота (11)
1-Бром-10-(4-хлор-фенокси)декан (63)
Аналогично получению соединения 62 из 7,7 г (60 ммоль) 4-хлорфенола и 18 г (60 ммоль) 1,10-дибромдекана получают 13,6 г (65%) соединения 63.
Соответственно примеру 9 13,3 г (38,0 ммоль) соединения 63 вводят во взаимодействие с дихлоруксусной кислотой. Получают 5,9 г (50%) соединения 11. Т.пл. 63-64oС.
Пример 12: 2,2-Дихлор-12-(4-метокси-фенокси)додекановая кислота (12)
1-Бром-10-(4-метокси-фенокси)декан (64)
Аналогично получению соединения 62 путем введения во взаимодействие 7,5 г (60 ммоль) монометилового простого эфира гидрохинона с 18 г (60 ммоль) 1,10-дибромдекана получают 8,8 г (43%) соединения 64. Т.пл. 64-66oС.
Раствор енолята, полученный из 80,0 ммоль диизопропиламида лития и 5,15 г (40,0 ммоль) дихлоруксусной кислоты в 50 мл тетрагидрофурана, в течение 1 часа при температуре 0-10oС прикапывают к раствору 7,0 г (20 ммоль) соединения 64 в 20 мл тетрагидрофурана. После перемешивания в течение 1 часа гидролизуют с помощью 3н. соляной кислоты, смешивают с 200 мл этилацетата, промывают дважды с помощью 3н. соляной кислоты и один раз с помощью насыщенного раствора хлорида натрия и органическую фазу концентрируют в вакууме. Маслянистый остаток обрабатывают петролейным эфиром и смешивают с таким количеством насыщенного раствора гидрокарбоната натрия, пока не будет наблюдаться выделение диоксида углерода. Спустя 30 минут выпавший осадок отсасывают и перекристаллизуют из этилацетата. Бесцветную соль растворяют в этилацетате, смешивают с 3н. соляной кислотой и органическую фазу промывают насыщенным раствором хлорида натрия. Полученное после высушивания над сульфатом натрия и выпаривания масло кристаллизуют из петролейного эфира. Получают 1,6 г (20%) соединения 12 в виде бесцветных пластинок. Т.пл. 68-69oС.
Пример 13; 2,2-Дихлор-12-фенил-додец-11-еновая кислота (13)
9-Бромнонилтрифенилфосфонийбромид (65)
103 г (0,36 моль) 1,9-Дибромнонана перемешивают при 120oС и в течение 8 часов добавляют 11,8 г (0,045 моль) трифенилфосфина в 120 мл толуола. После выдерживания в течение 10 часов при 120oС оставляют охлаждаться, декантируют надосадочный раствор и вязкий остаток перемешивают дважды с изогексаном при 60oС. После высушивания в ротационном испарителе в токе азота получают 22,4 г (91%) соединения 65 в виде почти бесцветной смолы.
10-Бром-1-фенил-1-децен (66)
2,13 г (3,8 ммоль) Соединения 65 растворяют в 200 мл тетрагидрофурана и в атмосфере азота охлаждают до -78oС. Прикапывают 1,53 мл (3,6 ммоль) бутиллития (2,45н. раствор в гексане), причем возникает типичная оранжево-красная окраска илида. Перемешивают еще 30 минут при температуре -78oС и смешивают на один раз с 0,40 мл (4,0 ммоль) свежеперегнанного бензальдегида, после чего раствор обесцвечивается. В течение 30 минут оставляют температуру повышаться до 0oС и затем смешивают с 5 мл насыщенного раствора хлорида аммония. После добавления нескольких капель 2н. соляной кислоты органическую фазу отделяют, водную фазу экстрагируют один раз эфиром и объединенные органические фазы промывают дважды водой. После высушивания над сульфатом магния и удаления растворителя осуществляют очистку с помощью флэш-хроматографии на силикагеле (растворитель: гептан). Получают 0,86 г (73%) соединения 66 в виде бесцветного масла.
Аналогично методике примера 9 4,52 г (15,3 ммоль) соединения 66 вводят во взаимодействие с 4,34 г (33,7 ммоль) дихлоруксусной кислоты. Реакционную смесь при -40oС гидролизуют с помощью 6н. соляной кислоты и выпавший осадок растворяют путем добавления нескольких миллилитров воды. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и растворитель выпаривают в вакууме. После флэш-хроматографии на силикагеле (растворитель: гептан-->гептан/этилацетат в соотношении 10:1) получают 2,32 г (454%) соединения 13. Т.пл. 50-52oС.
Пример 14: 2,2-Дихлор-12-фенил-додекановая кислота (14)
1,09 г (3,18 ммоль) Соединения 13 растворяют в 300 мл тетрагидрофурана и после добавления 200 мг 10%-ного палладия на сульфате бария гидрируют при температуре -40oС в течение 40 минут при избыточном давлении водорода 42 мбар. Катализатор отсасывают и после выпаривания остающегося раствора получают 0,95 г (90%) соединения 14 в виде бесцветного масла. 100 мг (0,29 ммоль) Соединения 14 растворяют в 1 мл этанола, охлаждают на бане со льдом и смешивают с раствором 12 мг (0,29 ммоль) гидроксида натрия в 1 мл этанола. Путем добавления эфира осаждают натриевую соль и оставляют стоять в течение 12 часов в холодильнике. Осадок отсасывают, промывают холодным эфиром и высушивают в вакууме. Получают 100 мг (94%) натриевой соли соединения 14. Т. пл. 157-159oС.
Пример 15: 2,2-Дихлор-12-циклогексил-додекановая кислота (15)
1-Бром-10-циклогексил-декан (67)
К раствору 18,0 г (60,0 ммоль) 1,10-дибромдекана в 20 мл тетрагидрофурана добавляют 10 мл (1 ммоль) оранжево-красного раствора Li2CuCl4, полученного из 1,344 г (10,0 ммоль) хлорида меди-(II) и 0,848 г (20,0 ммоль) безводного хлорида лития в 100 мл тетрагидрофурана. Затем в течение 1 часа и при 0oС прикапывают раствор Гриньяра, полученный из 2,10 г магния и 11,7 г (72,0 ммоль) циклогексилбромида. Выдерживают для повышения температуры (оттаивать), причем реакционная смесь окрашивается в темный цвет и выпадает осадок. После перемешивания в течение 20 часов добавляют 50 мл насыщенного раствора хлорида аммония и 100 мл этилацетата, фазы разделяют, органическую фазу промывают дважды с помощью насыщенного раствора хлорида натрия, сушат над сульфатом натрия, растворитель удаляют в ротационном испарителе и остаток фракционируют путем вакуумной перегонки. Получают 9,62 г (53%) соединения 67. Т.кип. 103-105oС при давлении 0,7 мбар; в виде бесцветной жидкости.
Аналогично методике примера 9 из 9,10 г (30,0 ммоль) соединения 67 и 4,64 г (36,0 ммоль) дихлоруксусной кислоты после флэш-хроматографии (растворитель: петролейный эфир/этилацетат в соотношении 7:3, с 1% ледяной уксусной кислоты), получают 6,5 г бесцветного масла. Кристаллизация при низкой температуре из толуола дает 4,88 г (46%) соединения 15 с т.пл. 67-68oС.
Пример 16: 2,2-Дихлор-14-фенил-тетрадекановая кислота (16)
1-Бром-12-фенил-додекан (68)
Аналогично методике получения соединения 67 (пример 15), из 19,7 г (60,0 ммоль) 1,12 -дибромдодекана, 11,31 г (72,0 ммоль) бромбензола, 2,10 г магния и 10 мл (1 ммоль) Li2CuCl4 (0,1 M раствор в тетрагидрофуране) получают 12,2 г (61%) соединения 68 в виде бесцветной жидкости с т.кип. 130-140oС /0,7 мбар. К раствору енолята, полученному, как описано в примере 1, из 7,27 г (72,0 ммоль) диизопропиламина, 29 мл (72,0 ммоль) бутиллития (2,5 М раствор в гексане) и 4,64 г (30,0 ммоль) дихлоруксусной кислоты в тетрагидрофуране, при температуре -78oС добавляют раствор 9,94 г (30,0 ммоль) соединения 68 и оставляют медленно оттаивать на охлаждающей бане. После достижения температуры -30oС еще раз охлаждают до -50oС и выдерживают до повышения температуры -20oС. После добавления 50 мл 3н. соляной кислоты и 200 мл этилацетата промывают дважды по 150 мл 3н. соляной кислоты и дважды насыщенным раствором хлорида натрия. После высушивания над сульфатом натрия и удаления растворителя в ротационном испарителе остаток очищают путем флэш-фильтрации через силикагель (растворитель: петролейный эфир/этилацетат в соотношении 7:3 с 1% ледяной уксусной кислоты). Полученный раствор смешивают с насыщенным раствором гидрокарбоната натрия, выпавшую в осадок натриевую соль отсасывают, промывают петролейным эфиром и дважды перекристаллизуют из этилацетата. Получают 6,72 г (56%) бесцветной натриевой соли соединения 16 с т.пл. 171oС (разложение).
Пример 17: 2.2-Дихлор-10-фенил-декановая кислота (17)
1-Бром-8-фенил-октан (69)
Аналогично методике получения соединения 67 (пример 15) из 16,3 г (60,0 ммоль) 1,8-дибромоктана, 11,31 г (72,0 ммоль) бромбензола, 2,10 г магния и 10 мл (1 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране) получают 12,2 г (61%) соединения 69 в виде бесцветной жидкости с т.кип. 110-120oС /0,7 мбар.
К раствору енолята, полученного, как описано в примере 1, из 7,27 г (72,0 ммоль) диизопропиламина, 29 мл (72,0 ммоль) бутиллития (2,5 М раствор в гексане) и 4,64 г (30,0 ммоль) дихлоруксусной кислоты в тетрагидрофуране, при температуре -78oС добавляют раствор 9,94 г (30,0 ммоль) соединения 69 и оставляют на охлаждающей бане медленно оттаивать. После достижения температуры -30oС еще раз охлаждают до -50oС и оставляют температуру повышаться до -20oС. После добавления 50 мл 3н. соляной кислоты и 200 мл этилацетата промывают дважды по 150 мл 3н. соляной кислотой и дважды насыщенным раствором хлорида натрия. После высушивания над сульфатом натрия и удаления растворителя в ротационном испарителе осуществляют очистку остатка путем флэш-фильтрации через силикагель (растворитель: петролейный эфир/этилацетат в соотношении 7: 3 с 1% ледяной уксусной кислоты). Полученный раствор смешивают с насыщенным раствором гидрокарбоната натрия, выпавшую в осадок натриевую соль отсасывают, промывают петролейным эфиром и перекристаллизуют дважды из этилацетата. Получают 3,5 г (35%) бесцветной натриевой соли соединения 17 с т.пл. 154-156oС.
Пример 18: 2,2-Дихлор-7-(4-хлорфенил)гептановая кислота (18)
5-(4-Хлорфенил)пентилбромид (70)
Аналогично методике получения соединения 67 (пример 15) из 13,8 г (60,0 ммоль) 1,5-дихлорпентана, 13,8 г (72,0 ммоль) 4-бром-1-хлор-бензола, 1,95 г (80 ммоль) магния и 10 мл (1 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране) получают 15,7 г (53%) соединения 70 в виде бесцветной жидкости с т. кип. 115-117oС /0,05 мбар.
Аналогично примеру получения соединения 17 из 5,00 г (19,1 ммоль) и 9,81 г (76,4 ммоль) дихлоруксусной кислоты после флэш-хроматографии (смесь петролейного эфира с этилацетатом в соотношении 10:1), получают 4,7 г (79%) соединения 18 в виде бесцветного масла. Аналогично методике примера 17, получают натриевую соль соединения 18 в количестве 4,7 г (74%) с т.пл. 158-162oС.
Пример 19: 2,2-Дихлор-12-(4-метилфенил)додекановая кислота (19)
1-Бром-10-(4-метилфенил)декан (71)
Аналогично методике получения соединения 67 (пример 15), из 18,0 г (60,0 ммоль) 1,10-дибромдекана, 12,3 г (72,0 ммоль) 4-бромтолуола, 2,10 г (86,0 ммоль) магния и 10 мл (1 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране) получают 11,0 г (57%) соединения 71 в виде бесцветной жидкости с т.кип. 105-120oС/0,7 мбар.
К раствору енолята, полученному, как описано в примере 1, из 7,27 г (72,0 ммоль) диизопропиламина, 29 мл (72,0 ммоль) бутиллития (2,5 М раствор в гексане) и 4,64 г (30,0 ммоль) дихлоруксусной кислоты в тетрагидрофуране при температуре -78oС добавляют раствор 9,94 г (30,0 ммоль) соединения 71 и медленно оттаивают на охлаждающей бане. После достижения температуры -30oС еще раз охлаждают до -50oС и выдерживают до повышения температуру -20oС. После добавления 3н. соляной кислоты и 200 мл этилацетата промывают дважды по 150 мл 3н. соляной кислоты и дважды насыщенным раствором хлорида натрия. После высушивания над сульфатом натрия и удаления растворителя в ротационном испарителе остаток очищают путем флэш-фильтрации через силикагель (растворитель: петролейный эфир/этилацетат в соотношении 7:3 с 1% ледяной уксусной кислоты). Полученный раствор смешивают с насыщенным раствором гидрокарбоната натрия, выпавшую в осадок натриевую соль отсасывают, промывают петролейным эфиром и перекристаллизуют из этилацетата. Получают 5,87 г (52%) бесцветной натриевой соли. Путем суспендирования соли в этилацетате и подкисления с помощью 3н. соляной кислоты высвобождают кислоту 19. После высушивания органической фазы над сульфатом натрия, выпаривания растворителя в вакууме и кристаллизации из петролейного эфира получают 4,5 г (40%) соединения 19 с т.пл. 58-59oС.
Пример 20: 2,2-Дихлор-12-(4-метоксифенил)додекановая кислота (20)
1-Бром-10-(4-метоксифенил) декан (72)
Аналогично методике получения соединения 67 из 60,0 г (0,200 ммоль) 1,10-дибромдекана, 28,0 г (0,15 моль) 4-броманизола, 4,8 г (0,20 моль) магния и 20 мл (1 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране) получают 11,4 г (23%) соединения 72 в виде бесцветной жидкости с т.кип. 178-190oС /0,7 бар. Таким же способом, как описано в примере 19, из 11,4 г (34,8 ммоль) соединения 72 и 5,15 г (40,0 ммоль) дихлоруксусной кислоты получают в целом 2,6 г (20%) бесцветного соединения 20 с т.пл. 48-49oС.
Пример 21: 2,2-Дихлор-12-(4-хлорфенил)додекановая кислота (21)
1-Бром-10-(4-хлорфенил)декан (73)
К раствору 40,0 г (130 ммоль) 1,10-дибромдекана в 110 мл тетрагидрофурана добавляют 20 мл (2,0 ммоль) Li2CuCl4 - раствора (0,1 М раствор в тетрагидрофуране) и при комнатной температуре в течение 4-х часов прикапывают 100 мл 1 М раствора 4-хлорфенилмагнийбромида (Aldrich) в диэтиловом эфире. Дополнительно перемешивают в течение 18 часов, гидролизуют с помощью 100 мл 3н. соляной кислоты, разбавляют с помощью 300 мл этилацетата, промывают по 300 мл 3н. соляной кислоты, насыщенного раствора хлорида аммония и раствора хлорида натрия, органическую фазу сушат над сульфатом натрия и концентрируют в ротационном испарителе. Остаток фракционируют в вакууме. Получают 8,0 г (24%) соединения 73 с т.кип. 170-175oС /0,8 мбар.
Аналогично методике примера 19, из 8,0 г (24,0 ммоль) соединения 73 и 6,45 г (50,0 ммоль) дихлоруксусной кислоты получают соединение 21 слабо-желтого цвета, которое после кристаллизации из петролейного эфира при -30oС становится бесцветным. Температура плавления ниже комнатной. Для получения натриевой соли кислоту растворяют в 100 мл этилацетата и смешивают полученный раствор с насыщенным раствором гидрокарбоната натрия, органическую фазу промывают дважды насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Добавляют такое количество петролейного эфира, чтобы появилось легкое помутнение, и оставляют стоять в течение ночи при комнатной температуре. Получают 2,4 г (30%) натриевой соли соединения 21. Бесцветные пластинки.
Пример 22: 2,2-Дихлор-7-(5-фенилпентокси)гептановая кислота (22)
1-Бром-5-(5-фенилпентокси)пентан (74)
К суспензии 610 мг (15,0 ммоль) гидрида натрия (60%-ная в вазелиновом масле) в 5 мл тетрагидрофурана прикапывают 2,40 г (14,6 ммоль) 5-фенил-пентан-1-ола. По окончании выделения водорода добавляют 9,6 мл (33 ммоль) 1,5-дибромпентана и нагревают в течение 6 часов при 80oС. После флэш-фильтрации реакционной смеси через силикагель (растворитель: петролейный эфир) получают 8,3 г бесцветной жидкости, из которой путем флэш-хроматографии (петролейный эфир) выделяют 3,50 г (76%) соединения 74 в виде бесцветной жидкости.
Аналогично методике примера 15 3,03 г (9,67 ммоль) соединения 64 вводят во взаимодействие с 1,93 г (15,0 ммоль) дихлоруксусной кислоты. После флэш-хроматографии (петролейный эфир/этилацетат в соотношении 9:1 с 1% ледяной уксусной кислоты) получают 2,5 г соединения 22, из которых после кристаллизации из толуола при -30oС получают 1,6 г чистого соединения 22 с т.пл. 82-84oС.
Пример 23: 2,2-Дихлор-14-фенил-тетраден-13-иновая кислота (23)
1-Бром-12-фенил-додец-11-ин (75)
К охлажденному до -78oС раствору 8,20 г (80,0 ммоль) фенилацетилена в 70 мл тетрагидрофурана прикапывают 37,2 мл (84,0 ммоль) бутиллития (2,35 М раствор в гексане) и затем смешивают с 50,42 г (168 ммоль) 1,10-дибромдекана. Оставляют нагреваться до комнатной температуры и в течение 12 часов кипятят с обратным холодильником. После добавления 80 мл полунасыщенного раствора хлорида аммония экстрагируют изогексаном, экстракт сушат над сульфатом магния и концентрируют. Остаток фракционируют путем перегонки в трубке с шаровым расширением. Получают 13,4 г (52%) соединения 75 с т.кип. 95oС /0,05 мбар.
Аналогично методике примера 17 6,70 г (20,9 ммоль) соединения 75 вводят во взаимодействие с 10,8 г (83,4 ммоль) дихлоруксусной кислоты. Получают 2,3 г (30%) соединения 23, которое превращают в натриевую соль соединения 23. Получают 1,2 г; т.пл. 155-157oС.
Пример 24: 2,2-Дихлор-14-фенилсульфенил-тетрадекановая кислота (24)
Этиловый эфир 2,2-дихлор-14-фенилсульфенил-тетрадекановой кислоты (76)
К раствору 10/1 г (25,0 ммоль) соединения 3 в 200 мл диметилформамида добавляют 3,46 г (25,0 ммоль) карбоната калия и 2,75 г (25,0 ммоль) тиофенола. Перемешивают в течение 12 часов при комнатной температуре, смешивают с 300 мл воды, экстрагируют (диэтиловым) эфиром, экстракт промывают водой, сушат над сульфатом натрия и растворитель удаляют в ротационном испарителе. После флэш-хроматографии остатка (силикагель: гептан/толуол в соотношении 5: 1) получают 6,62 г (61%) соединения 76 в виде бесцветного масла.
1,5 г (3,5 ммоль) Соединения 76 растворяют в 3,8 мл этанола и смешивают с 3,8 мл 1н. раствора гидроксида калия. Образующийся спустя непродолжительное время осадок растворяют с помощью 20 мл смеси этанола с водой в соотношении 1:1. Спустя 5 часов добавляют 1 мл 1н. раствора гидроксида калия и перемешивают еще следующие 6 часов. После подкисления с помощью 2н. соляной кислоты экстрагируют эфиром, сушат экстракт над сульфатом магния и растворитель удаляют. Получают 1,18 г (92%) соединения 24 в виде бесцветных кристаллов с т.пл. 74oС.
Пример 25: 2,2-Дихлор-14-фенилсульфинил-тетрадекановая кислота (25)
Этиловый эфир 2,2-дихлор-14-фенилсульфинил-тетрадекановой кислоты (77)
К раствору 1,80 г (4,15 ммоль) соединения 76 в 30 мл метиленхлорида при температуре от 0 до -5oС добавляют раствор 0,72 г (4,15 ммоль; 0,96 г 75%-ной кислоты) м-хлорпербензойной кислоты в 15 мл метиленхлорида. В течение двух часов доводят температуру до комнатной и органическую фазу промывают раствором гидрокарбоната натрия и водой. После высушивания над сульфатом магния и удаления растворителя остаток очищают путем флэш-хроматографии (гептан/этил-ацетат в соотношении 2:1). Получают 1,24 г (66%) соединения 77 в виде бесцветного масла.
0,46 г (1,02 ммоль) Соединения 77 вместе с 2,0 мл этанола и 2,0 мл 1н. раствора гидроксида калия перемешивают в течение 2-х часов при комнатной температуре и затем подкисляют с помощью 2н. соляной кислоты. Экстрагируют эфиром, промывают водой, сушат над сульфатом натрия и после выпаривания растворителя получают 0,41 г (95%) соединения 25 в виде бесцветного масла, которое кристаллизуется после выдерживания в холодильнике. Т.пл. 68oС.
Пример 26: 2,2-Дихлор-14-фенилсульфонил-тетрадекановая кислота (26)
Этиловый эфир 2,2-дихлор-14-фенилсульфонил-тетрадекановой кислоты (78)
К раствору 1,50 г (3,46 ммоль) соединения 76 в 15 мл ледяной уксусной кислоты добавляют 4,5 мл 30%-ного пероксида водорода, перемешивают 48 часов и выливают в воду со льдом. После экстракции эфиром, высушивания над сульфатом натрия и удаления растворителя получают 1,23 г (77%) соединения 78 в виде бесцветного масла.
1,22 г (2,62 ммоль) Соединения 78 смешивают с 5,2 мл этанола и 5,2 мл 1н. раствора гидроксида калия и перемешивают в течение трех часов. Охлаждают до 0oС и подкисляют с помощью 2н. соляной кислоты. Выпавший осадок отсасывают, промывают водой и изогексаном и высушивают в вакууме. Получают 1,12 г (97%) соединения 26 в виде бесцветных кристаллов. Т.пл. 69-71oС.
Пример 27: 2,2-Дихлор-7-/5-(4-хлорфенил)пентилсульфенил/гептановая кислота (27)
5-(4-Хлорфенил)-1-пентантиол (79)
К раствору 10,6 г (0,139 моль) тиомочевины в 40 мл этанола добавляют 24,2 г (92,6 ммоль) 5-(4-хлорфенил)пентилбромида (60) в 60 мл этанола. Кипятят с обратным холодильником в течение 5 часов, оставляют охлаждаться, смешивают с 50 мл концентрированного раствора аммиака и снова в течение 3-х часов кипятят с обратным холодильником. После охлаждения подкисляют с помощью примерно 30 мл концентрированной соляной кислоты до установления значения рН, равного 1, и экстрагируют дважды по 150 мл эфира. Полученный эфирный раствор промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и растворитель удаляют в ротационном испарителе. Получают 19,0 г (95%) соединения 79. Смесь из 5,00 г (16,8 ммоль) соединения 79, 2,25 (16,3 ммоль) карбоната калия, 3,50 г (16,3 ммоль) соединения 6 и 50 мл диметилформамида перемешивают в течение 12 часов при комнатной температуре. Смешивают с водой и экстрагируют эфиром. Эфирную фазу промывают водой, сушат над сульфатом натрия и выпаривают. Получают 7,1 г бесцветного масла, которое после флэш-хроматографии (толуол/гептан в соотношении 1:2) дает 5,06 г (71%) сложного этилового эфира соединения 27.
Смесь из 1,50 г (3,41 ммоль) полученного сложного эфира, 6,82 мл (6,82 ммоль) 1н. раствора гидроксида калия и 7 мл этанола перемешивают в течение 3-х часов при комнатной температуре. После подкисления с помощью 2н. соляной кислоты и экстракции эфиром эфирную фазу промывают водой и сушат над сульфатом натрия. После удаления растворителя получают 1,21 г (86%) соединения 27 в виде бесцветного масла. Из 1,13 г соединения 27 и 110 мг гидроксида натрия получают натриевую соль, и промывают эфиром. Получают 0,75 г (64%) соли с т. пл. 155-157oС.
Пример 28: 2,2-Дихлор-14-(4-изопропилфенокси)тетрадекановая кислота (28)
1-Бром-12-(4-изопропилфенокси)додекан (80)
Аналогично методике получения соединения 62 (пример 10), из 8,85 г (65,0 ммоль) 4-изопропилфенола, 1,60 г (65 ммоль) гидрида натрия и 23,0 г (70,0 ммоль) 1,12 дибромдодекана после флэш-хроматографии (этилацетат/гептан в соотношении 1: 10), получают 10,0 г (41%) соединения 80 с т.пл. 51-52oС (диэтиловый эфир).
Как описано в примере 9, 4,00 г (10,0 ммоль) соединения 80 вводят во взаимодействие с 5,16 г (40,0 ммоль) дихлоруксусной кислоты. Получают 0,9 г (21%) соединения 28 с т.пл. 47-49oС. Полученная из соединения 28 и гидроксида натрия в этаноле натриевая соль плавится при 109oС (разложение).
Пример 29: 2,2-Дихлор-12-(2,6-диизопропилфенокси)додекановая кислота (29)
1-Бром-10-(2,6-диизопропилфенокси)декан (81)
Согласно методике получения соединения 62 (пример 10), из 11,6 г (65,0 ммоль) 2,6-диизопропилфенола, 1,60 г (65,0 ммоль) гидрида натрия и 21,0 г (70,0 ммоль) 1,10-дибромдекана после флэш-хроматографии (этилацетат/гептан в соотношении 1: 10), получают 13,95 г (54%) соединения 81 в виде светло-желтого масла.
Как описано в примере 9, 7,95 г (20,0 ммоль) соединения 81 вводят во взаимодействие с 10,3 г (80,0 ммоль) дихлоруксусной кислоты, флэш-хроматография (этилацетат/гептан в соотношении 1:10) дает 4,7 г (53%) соединения 29 в виде светлого масла.
Пример 30: 2,2-Дихлор-14-/4-(хлорфенилкарбониламино)фенилсульфенил/тетрадекановая кислота (30)
Этиловый эфир 2,2-дихлор-14-/4-(4-хлорфенилкарбониламино)фенилсульфенил/тетрадекановой кислоты (82)
К раствору 700 мг (2,83 ммоль) 4-(4-хлорбензоиламино)тиофенола в 10 мл диметилформамида добавляют 390 мг (2,83 ммоль) карбоната калия и 1,14 г (2,83 ммоль) соединения 3 и перемешивают в течение 50 часов при комнатной температуре. При охлаждении смешивают с 20 мл воды, осадок отсасывают, промывают его изогексаном и сушат в вакууме. Полученный сырой продукт в количестве 1,3 г (78%) очищают путем флэш-хроматографии (толуол). Получают 0,82 г (50%) соединения 82 с (пл. 130-131oС (метиленхлорид/изогексан).
0,68 г (1,16 ммоль) Соединения 82, 2,3 мл 1н. раствора гидроксида калия и 8 мл этанола перемешивают в течение 2-х часов при комнатной температуре. Подкисляют при охлаждении с помощью 2н. соляной кислоты, разбавляют водой, экстрагируют эфиром, эфирную фазу промывают водой, сушат над сульфатом натрия и растворитель удаляют. Получают 0,61 г (98%) соединения 30. Растворяют его в 1 мл этанола и при охлаждении смешивают с 44 мг гидроксида натрия в 0,5 мл этанола. После осаждения за счет добавления эфира, отсасывания и промывки эфиром получают 0,46 г (61%) натриевой соли соединения 30 с т.пл. 167-168oС.
Пример 31: 2,2-Дихлор-12-(2-нафтил)додекановая кислота (31)
1-Бром-10-(2-нафтил) декан (83)
Согласно методике получения соединения 67 (пример 15), из 16,5 г (55,0 ммоль) 1,10-дибромдекана, 13,3 г (64,2 ммоль) 2-бромнафталина, 1,7 г (70 ммоль) магния и 10 мл (1 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране), после флэш-хро-матографии (этялацетат/гептан в соотношении 1:10), получают 3,7 г (20%) соединения 83 в виде бледно-желтого масла.
Как описано в примере 9, из 3,5 г (10,0 ммоль) соединения 83 и 5,16 г (40,0 ммоль) дихлоруксусной кислоты получают 3,1 г (79%) соединения 31. Т. пл. 66-67oС (диэтиловый эфир).
Пример 32: 2,2-Дихлор-12-(4-метилсульфенилфенил)додекановая кислота (32)
1-Бром-10-(4-метилсульфенилфенил)декан (84)
Согласно методике получения соединения 67 (пример 15) из 16,5 г (55,0 ммоль) 1,10-дибромдекана, 13,1 г (64,2 ммоль) 4-бромтиоанизола, 1,7 г (70,0 ммоль) магния и 10 мл (1,0 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране), после флэш-хроматографии (градиентное элюирование: гептан
-->гептан/этилацетат в соотношении 10:1), получают 11,2 г (59%) соединения 84 в виде воскообразной массы.
Как описано в примере 9, из 6,9 г (20,0 ммоль) соединения 84 и 10,32 г (80,0 ммоль) дихлоруксусной кислоты после флэш-хроматографии (гептан/этилацетат в соотношении 10:1-->гептан/этилацетат в соотношении 3: 1), получают 1,1 г (14%) соединения 32 в виде бесцветного масла. Полученная аналогично примеру 30 натриевая соль соединения 32 разлагается начиная со 143oС.
Пример 33: 2,2-Дихлор-7-/4-(4-хлорфенилкарбониламино)фенилсульфенил/гептановая кислота (33)
Этиловый эфир 2,2-дихлор-7-/4-(4-хлорфенилкарбониламино)фенилсульфенил/гептановой кислоты (85)
Согласно методике получения соединения 82 (пример 30), из 940 мг (3,79 ммоль) 4-(4-хлорбензоиламино)тиофенола, 10 мл диметилформамида, 520 мг (3,79 ммоль) карбоната калия и 1,60 г (3,79 ммоль) соединения 6 после флэш-хроматографии (толуол) получают 1,14 г (63%) соединения 85 с т.пл. 136-137oС (этилацетат/изогексан).
Путем омыления (пример 30) 0,41 г (0,96 ммоль) соединения 85 получают 0,25 г (57%) соединения 33 с т.пл. 140-142oС.
Пример 34: 2,2-Дихлор-8-/5-(4-хлорфенил)пентилсульфенил/октановая кислота (34)
Аналогично методике примера 27 3,50 г (16,3 ммоль) соединения 79 вводят во взаимодействие с 5,2 г (16,3 ммоль) сложного этилового эфира соединения 7. После флэш-хроматографии (гептан/толуол в соотношении 2:1) получают 5,2 г (70%) этилового эфира 2,2-дихлор-8/5-(4-хлорфенил)пентилсульфенил/ октановой кислоты (86) в виде бесцветного масла, 2,5 г (5,5 ммоль) Соединения 86, 11 мл (11 ммоль) 1н. раствора гидроксида калия и 11 мл этанола перемешивают в течение двух часов при комнатной температуре. При охлаждении на бане со льдом реакционную смесь подкисляют с помощью 2н. соляной кислоты до рН=2, отгоняют этанол, экстрагируют эфиром, эфирную фазу промывают водой, сушат над сульфатом натрия и после удаления растворителя получают 2,24 г (96%) соединения 34 в виде бесцветного масла. Из 1,41 г (3,29 ммоль) соединения 34 в 3 мл этанола и 0,13 г (3,3 ммоль) гидроксида натрия в 5 мл этанола после перемешивания, смешения с эфиром, отсасывания и высушивания получают 1,14 г (78%) натриевой соли соединения 34 с т.пл. 154oС.
Пример 35: 12-Карбамоил-2,2-дихлор-додекановая кислота (35)
200 мг (0,70 ммоль) Соединения 8 вносят в 10 мл 80%-ной серной кислоты и выдерживают в течение 6 часов при комнатной температуре. Полученный раствор выливают в 150 мл воды со льдом, отсасывают окрашенный в бежевый цвет осадок и дополнительно промывают его петролейным эфиром. Получают 180 мг (85%) соединения 35 с т.пл. 93-94oС.
Пример 36: 2,2-Дихлор-12-(4-метилсульфинилфенил)додекановая кислота (36)
391 мг (1,00 ммоль) Соединения 32 растворяют в 10 мл метиленхлорида и при температуре от -5oС до 0oС смешивают с раствором 173 мг (1,00 ммоль) м-хлорпербензойной кислоты в 10 мл метиленхлорида. Оставляют температуру повышаться до комнатной, перемешивают еще дополнительно 2 часа и разбавляют смесь водой со льдом. Экстрагируют метиленхлоридом, сушат над сульфатом натрия, обрабатывают активным углем и выпаривают. Полученные 0,5 г сырого продукта очищают путем флэш-хроматографии (толуол/диоксан/ледяная уксусная кислота в соотношении 15:12:1) и получают 0,20 г (50%) соединения 36 с т.пл. 74-76oС.
Пример 37: 2,2-Дихлор-7-/5-(4-хлорфенил)пентилсульфинил/гептановая кислота (37)
Этиловый эфир 2,2-дихлор-7-/5-(4-хлорфенил)пентилсульфинил/гептановой кислоты (87)
1,60 г (3,64 ммоль) Этилового эфира 2,2-дихлор-7-/5-(4-хлорфенил)пентилсульфенил/гептановой кислоты (пример 27) растворяют в 30 мл метиленхлорида и при температуре -5oС прикапывают раствор 0,63 г (3,64 ммоль) м-хлорпербензойной кислоты в 15 мл метиленхлорида. Перемешивают 2 часа при 0oС, отсасывают выпавшую в осадок 3-хлорбензойную кислоту, фильтрат промывают дважды раствором гидрокарбоната натрия, дважды водой, сушат над сульфатом магния, концентрируют в вакууме и остаток очищают путем флэш-хроматографии (гептан/этилацетат в соотношении 2:1). Получают 1,2 г (73%) соединения 87 в виде бесцветного масла.
1,00 г (2,20 ммоль) Соединения 87 смешивают с 4,4 мл (4,4 ммоль) 1н. раствора гидроксида калия и 4,4 мл этанола. Перемешивают 4 часа при комнатной температуре, подкисляют при охлаждении до рН=2. При этом кислота осаждается в виде бесцветного мелкокристаллического осадка, который после перемешивания в течение 10 минут отсасывают и промывают смесью 10:1 изогексана с эфиром и высушивают в вакууме. Получают 0,86 г (92%) соединения 37 с т.пл. 84-85oС.
Пример 38: 2,2-Дихлор-14-(4-хлорфенил)тетрадец-8-иновая кислота (38)
4,5 г (12,4 ммоль) 7-(4-Хлорфенил)-гепт-1-ина (88) растворяют в смеси 100 мл диоксана и 40 мл толуола, охлаждают до -10oС, смешивают с 5,1 мл (12,5 ммоль) бутиллития (2,46 М раствор в гексане) и затем с 9,7 г (25 ммоль) 1,5-дибромпентана. Нагревают в течение 14 часов при 80oС, затем в течение 9 часов при 100oС и оставляют охлаждаться. Смешивают с 3н. соляной кислотой и экстрагируют изогексаном. Органическую фазу промывают водой, сушат над сульфатом магния, концентрируют и остаток перегоняют в трубке с шаровым расширением. Получают 3,95 г 1-бром-12-(4-хлорфенил)додец-6-ина (89) с т.кип. 120oС /0,2 мбар.
Согласно примеру 9 3,90 г (11,1 ммоль) 1-бром-12(4-хлорфенил)-додец-6-ина (89) вводят во взаимодействие с 11,4 г (89 ммоль) дихлоруксусной кислоты. Получают 2,00 г (45%) соединения 38 в виде бесцветного масла.
Пример 39: 2,2-Дихлор-14-(4-трет.-бутилфенил)тетрадекановая кислота (39)
1-Бром-12-(4-трет.-бутилфенил)додекан (90)
Согласно методике получения соединения 67 (пример 15), из 18,0 г (55 ммоль) 1,12 дибромдодекана, 13,7 г (64,2 ммоль) 4-трет.-бутилбромбензола, 1,7 г (70 ммоль) магния и 10 мл (1 ммоль) Li2CuCl4 (0,1 M раствор в тетрагидрофуране), после флэш-хроматографии (этилацетат/гептан в соотношении 1: 10), получают 4,3 г (21%) соединения 90 в виде бесцветного масла, (т.кип. 126-128oС/0,2 мбар).
Как описано в примере 9, из 3,9 г (10,2 ммоль) соединения 90 и 3,87 г (30 ммоль) дихлоруксусной кислоты получают 1,5 г (35%) соединения 39. Т.пл. 47-48oС.
Аналогично методике примера 30 получают натриевую соль.
Разложение выше 174oС.
Пример 40: 2,2-Дихлор-12-(4-трет.-бутилфенил)додекановая кислота (40)
1-Бром-10-(4-трет.-бутилфенил)декан (91)
Согласно методике получения соединения 67 (пример 15) из 16,5 г (55 ммоль) 1,10-дибромдодекана, 13,7 г (64,2 ммоль) 4-трет.-бутилбромбензола, 1,7 г (70 ммоль) магния и 10 мл (1 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране), после флэш-хроматографии (этилацетат/гептан в соотношении 1:10), получают 4,6 г (24%) соединения 91 в виде бесцветного масла (т.кип. 134oС/ 0,2 мбар).
Как описано в примере 9, из 4,6 г (13,0 ммоль) соединения 91 и 6,7 г (52,0 ммоль) дихлоруксусной кислоты получают 1,1 г (22%) соединения 40. Т. пл. 46-48oС. Аналогично методике примера 30 получают натриевую соль. Разложение выше 176oС.
Пример 41: 2,2-Дихлор-12-(4-трет.-бутилфенокси)додекановая кислота (41)
1-Бром-10-(4-трет.-бутилфенокси)декан (92)
Согласно методике получения соединения 62 из 9,75 г (65,0 ммоль) 4-трет. -бутилфенола, 1,60 г (65 ммоль) гидрида натрия и 21,0 г (70,0 ммоль) 1,10-дибромдекана после перегонки при 170-175oС/0,06 мбар получают 16,1 г (67%) соединения 92 в виде желтого масла.
Как описано в примере 9, 6,8 г (20 ммоль) соединения 92 вводят во взаимодействие с 10,3 г (80 ммоль) дихлоруксусной кислоты. Получают 2,8 г (35%) соединения 41 с т.пл. 56-57oС. Полученная из соединения 41 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 178oС (разложение).
Пример 42: 2,2-Дихлор-15-фенил-пентадекановая кислота (42)
1-Бром-13-фенил-тридекан (93)
Согласно методике получения соединения 67 (пример 15), из 7,48 г (27,5 ммоль) дибромсктана, 7,27 г (32,1 ммоль) 1-бром-5- фенил-пентана, 0,85 г (35 ммоль) магния и 5 мл (0,5 ммоль) Li2CuCl4 (0,1 М раствор в тетрагидрофуране) после перегонки в высоком вакууме получают 4,9 г (51%) соединения 93 в виде бесцветного масла с т.кип. 158-159oС/ 0,15 мбар.
Как описано в примере 9, из 1,7 г (5 ммоль) соединения 93 и 2,58 г (20 ммоль) дихлоруксусной кислоты получают 1,3 г (67%) соединения 42 с т.пл. 52-53oС.
Из 0,8 г (2,1 ммоль) соединения 42 с помощью 84 мг (2,1 ммоль) порошкообразного гидроксида натрия получают натриевую соль в количестве 0,7 г с т. пл. 170oС (разложение).
Пример 43: 2,2-Дихлор-13-фенил-тридекановая кислота (43)
1-Бром-11-фенил-ундекан (94)
Согласно методике получения соединения 67 (пример 15) из 12,65 г (55 ммоль) дибромпентана, 15,5 г (64,2 ммоль) 1-бром-6-фенилгексана, 1,7 г (70 ммоль) магния и 10 мл (1 ммоль) раствора купрата после перегонки в высоком вакууме получают 7,5 г (44%) соединения 94 в виде бесцветного масла с т.кип. 150-152oС/0,4 мбар.
Как описано в примере 9, из 6,23 г (20 ммоль) соединения 94 и 10,3 г (80 ммоль) дихлоруксусной кислоты получают 5,1 г (71%) соединения 43 с т.пл. 46-47oС.
Полученная из соединения 43 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 165oС (разложение).
Пример 44: 2,2-Дихлор-16-фенил-гексадекановая кислота (44)
1-Бром-14-фенил-тетрадекан (95)
Согласно методике получения соединения 67 (пример 15), из 14,96 г (55 ммоль) дибромоктана, 15,5 г (64,2 ммоль) 1-бром-6-фенилгексана, 1,7 г (70 ммоль) магния и 10 мл раствора купрата после перегонки, получают 8,7 г (45%) соединения 95 в виде бесцветного масла с т.кип. 168oС/0,15 мбар.
Как описано в примере 9, из 7,1 г (20 ммоль) соединения 95 и 10,3 г (80 ммоль) дихлоруксусной кислоты получают 1,55 г (20%) соединения 44 с т.пл. 58-59oС. Полученная из соединения 44 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 166oС (разложение).
Пример 45: 2,2-Дихлор-14-циклогексил-тетрадекановая кислота (45)
1-Бром-12-циклогексил-додекан (96)
Согласно методике получения соединения 67 (пример 15), из 15,86 г (65 ммоль) дибромгексана, 19,8 г (80 ммоль) 1-бром-6-циклогексилгексана, 2,42 г (0,1 ммоль) магния и 10 мл раствора купрата после флэш-хроматографии на силикагеле (растворитель: гептан; гептан/этилацетат в соотношении 10:1), получают 10,6 г (49%) соединения 96 в виде бесцветного масла.
Аналогично примеру 5 из 7,5 г (22,63 ммоль) соединения 96 и 8,75 г (67,89 ммоль) дихлоруксусной кислоты получают 1,65 г (20%) соединения 45 с т. пл. 68-69oС. Полученная из соединения 45 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 146-148oС.
Пример 46: 2,2-Дихлор-13-циклогексил-тридекановая кислота (46)
1-Бром-11-циклогексилундекан (97)
Согласно методике получения соединения 67 (пример 15), из 17,6 г (75 ммоль) 1,6-дибромгексана, 11,66 г (50 ммоль) 1-бром-5-циклогексилпентана, 1,46 г (60 ммоль) магния и 10 мл раствора купрата после перегонки получают 6,81 г (43%) соединения 97 в виде бесцветного масла с т.кип. 106-110oС /0,006 мбар.
Аналогично примеру 5 из 3,0 г (9,45 ммоль) соединения 97 и 3,66 г (28,36 ммоль) дихлоруксусной кислоты получают 2,16 г (62%) соединения 46 с т.пл. 50-51oС. Полученная из соединения 46 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 166-168oС (разложение).
Пример 47: 2,2-Дихлор-15-циклогексил-пентадекановая кислота (47)
1-Бром-13-циклогексил-тридекан (98)
Согласно методике получения соединения 67 (пример 15), из 20,4 г (75 ммоль) 1,8-дибромоктана, 11,66 г (50 ммоль) 1-бром-5-циклогексилпентана, 1,46 г (60 ммоль) магния и 10 мл раствора купрата и после перегонки получают 8,14 г (47%) соединения 98 в виде бесцветного масла с т.кип. 121-125oС/0,005 мбар.
Аналогично примеру 5 из 4,2 г (12,24 ммоль) соединения 98 и 4,74 г (36,72 ммоль) дихлоруксусной кислоты получают 1,0 г (21%) соединения 47 с т. пл. 53-56oС. Полученная из соединения 47 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 162-164oС.
Пример 48: 2,2-Дихлор-16-циклогексил-гексадекановая кислота (48)
1-Бром-14-циклогексил-тетрадекан (99)
Согласно методике получения соединения 67 (пример 15), из 10,87 г (38 ммоль) 1,9-дибромнонана, 5,6 г (24 ммоль) 1-бром-5-циклогексилпентана, 0,73 г (30 ммоль) магния и 5 мл раствора купрата и после перегонки получают 4,5 г (53%) соединения 99.
Аналогично примеру 5, из 4,4 г (12,24 ммоль) соединения 99 и 4,74 г (36,72 ммоль) дихлоруксусной кислоты получают 3,53 г (73%) соединения 48 с т. пл. 72-73oС. Полученная из соединения 48 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 156-158oС.
Пример 49: 2,2-Дихлор-17-циклогексил-гептадекановая кислота (49)
1-Бром-15-циклогексил-пентадекан (100)
Согласно методике получения соединения 67 (пример 15), из 22,51 г (75 ммоль) 1,10-дибромдекана, 11,7 г (40 ммоль) 1-бром-5-циклогексилпентана, 1,21 г (50 ммоль) магния и 5 мл раствора купрата и после перегонки получают 24,1 г (86%) соединения 100.
Аналогично примеру 5 из 6,5 г (17,4 ммоль) соединения 100 и 6,73 г (52,21 ммоль) дихлоруксусной кислоты получают 1,84 г (25%) соединения 49 с т. пл. 65-66oС. Полученная из соединения 49 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 152-155oС (разложение).
Пример 50: 2,2-Дихлор-14-(4-хлорфенил)тетрадекановая кислота (50)
1-Бром-6-(4-хлорфенил)гексан (101)
Согласно методике получения соединения 67 (пример 15) из 50 мл (330 ммоль) 1,6-дибромгексана, 30 г (160 ммоль) 4-хлорбромбензола, 3,8 г (160 ммоль) магния и 20 мл раствора купрата и после перегонки с использованием колонки Вигро получают 20,5 г (47%) соединения 101 с т.кип. 158-162oС /3,5 мбар.
1-Бром-12-(4-хлорфенил)додекан (102)
Согласно методике получения соединения 67 (пример 15) из 25 мл (140 ммоль) 1,6-дибромгексана, 20 г (72 ммоль) соединения 91, 1,8 г (72 ммоль) магния и 20 мл раствора купрата и после флэш-хроматографии на силикагеле получают 18,5 г (71%) соединения 102.
Аналогично примеру 5 из 10,8 г (30 ммоль) соединения 102 и 6,45 г (50 ммоль) дихлоруксусной кислоты получают 8,6 г (70%) соединения 50. Полученная из соединения 50 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 163-164oС.
Пример 51: 2,2-Дихлор-12-(4-метилсульфонил-фенил)додекановая кислота (51)
4,0 г (10,2 ммоль) Соединения 32 и 3,2 мл 30%-ного пероксида водорода в 10 мл ледяной уксусной кислоты нагревают в течение 1 часа при 90oС и выливают в воду со льдом. После экстракции эфиром, высушивания над сульфатом натрия и удаления растворителя получают 3,8 г (84%) соединения 51 с т.пл, 167-168oС.
Пример 52: 2,2-Дихлор-гексадекановая кислота (52)
Аналогично примеру 5 из 5,55 г (20 ммоль) 1-тетрадецилбромида (Aldrich) и 7,74 г (60 ммоль) дихлоруксусной кислоты получают 2,45 г (38%) соединения 52 с т.пл. 34-37oС. Полученная из соединения 52 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 165-168oС.
Пример 53: 2,2-Дихлор-эйкозановая кислота (53)
Аналогично примеру 5 из 11,1 г (33,34 ммоль) 1-октадецилбромида (Aldrich) и 12,89 г (0,1 ммоль) дихлоруксусной кислоты получают 10,4 г (82%) соединения 53 с т.пл. 49-51oС. Полученная из соединения 53 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 147-149oС.
Пример 54: 2,2-Дихлор-12-(4-хлорфенил-сульфенил)додекановая кислота (54)
Этиловый эфир 12-бром-2,2-дихлор-додекановой кислоты (103)
Аналогично примеру 3 10,0 г (28,7 ммоль) соединения 1 вводят во взаимодействие с 4,19 г (33 ммоль) оксалилхлорида, 3,04 г (66 ммоль этанола и 6,67 г (66 ммоль) триэтиламина с получением 9,9 г (92%) соединения 103 в виде бесцветного масла.
Этиловый эфир 2,2-дихлор-12-(4-хлорфенилсульфенил)додекановой кислоты (104)
Аналогично примеру 30 (получение соединения 82) из 1,85 г (12,76 ммоль) 4-хлортиофенола, 100 мл диметилформамида, 1,76 г (12,76 ммоль) карбоната калия и 4,8 г (12,76 ммоль) соединения 103 получают 5,24 г (94%) соединения 104 в виде светло-желтого масла.
Путем омыления (пример 30) 1,65 г (3,73 ммоль) соединения 104 получают 1,29 г (84%) соединения 54 с т.пл. 74-78oС. Полученная из соединения 54 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 154-157oС.
Пример 55: 2,2-Дихлор-12-(4-хлорфенилсульфинил)додекановая кислота (55)
Этиловый эфир 2,2-дихлор-12-(4-хлорфенилсульфинил)додекановой кислоты (105)
К раствору 1,5 г (3,41 ммоль) соединения 104 в 30 мл метиленхлорида аналогично примеру 25 (получение соединения 77) прикапывают раствор 0,59 г (3,41 ммоль) м-хлорпербензойной кислоты в 15 мл метиленхлорида. После флэш-хроматографии на силикагеле получают 1,24 г (80%) соединения 105. 1,24 г (2,72 ммоль) Соединения 105 смешивают с 5,5 мл 1н. раствора гидроксида калия и в течение 5 часов выдерживают при комнатной температуре. Охлаждают до 0oС и подкисляют с помощью 2н. соляной кислоты. Выпавший осадок отсасывают, промывают водой и изогексаном и высушивают в вакууме. Получают 0,65 г (56%) соединения 55. Полученная из соединения 55 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 91-94oС.
Пример 56: 2,2-Дихлор-12-(4-хлорфенил-сульфинил)додекановая кислота (56)
Этиловый эфир 2,2-дихлор-12-(4-хлорфенилсульфинил)додекановой кислоты (106)
Согласно методике получения соединения 78 (пример 26) 2,0 г (4,55 ммоль) соединения 104 окисляют с помощью 6 мл 30%-ного пероксида водорода в 20 мл ледяной уксусной кислоты с получением соединения 106 в количестве 2,08 г (99%) в виде бесцветного масла.
Путем омыления (пример 26) 2 г (4,24 ммоль) соединения 106 с помощью 8,5 мл (8,48 ммоль) 1н. раствора гидроксида калия получают 1,8 г (96%) соединения 56 с т.пл. 84oС.
Полученная из соединения 56 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 144-147oС.
Пример 57: Метиловый эфир 2,2-дихлор-14-фенил-тетрадекановой кислоты (57)
Аналогично методике получения соединения 103 (пример 54) из 1,98 г (5 ммоль) соединения 16, 1,27 г (10 ммоль) оксалилхлорида и 20 мл абсолютного метанола получают 1,1 г (57%) соединения 57.
Пример 58: 2,2-Дихлор-13-(циклогексилокси)тридекановая кислота (58)
1-Бром-11-(циклогексилокси)ундекан (107)
Аналогично получению соединения 74 (пример 22) из 1,22 г (30 ммоль) гидрида натрия (60%-ный в вазелиновом масле) и 2,92 г (29,2 ммоль) циклогексанола, а также 18,85 г (60 ммоль) 1,11-дибромундекана (Aldrich) получают 5,6 г (58%) соединения 107 в виде бледно-желтого масла.
Как описано в примере 9, из 5,41 г (16,23 ммоль) соединения 107 и 6,28 г (48,96 ммоль) дихлоруксусной кислоты и после флэш-хроматографии на силикагеле получают 1,25 г (21%) соединения 58 в виде бесцветного масла.
Полученная из соединения 58 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 75-78oС.
Пример 59: 2,2-Дихлор-14-(4-хлорфенил-сульфониламино) тетрадекановая кислота (59)
11-Циано-ундеканол-(1) (108)
К раствору 25,1 г (0,1 моль) 11-бромундеканола (1) в 50 мл диметилсульфоксида при 100oС в течение часа прикапывают раствор 7,89 г (0,12 моль) цианида калия в 20 мл воды. После перемешивания в течение 6 часов при кипячении с обратным холодильником реакционную смесь охлаждают, разбавляют 100 мл воды и экстрагируют эфиром. Эфирную фазу после промывки высушивают над сульфатом магния и концентрируют. После флэш-хроматографии на силикагеле (гептан/этилацетат в соотношении 5:1) получают 11,1 г (53%) бесцветных кристаллов с т.пл. 34-35oС.
12-Амино-додеканол-(1)-(109)
В аппаратуре для гидрирования при высоком давлении 11,0 г (52 ммоль) соединения 108 в 150 мл метанола в присутствии 5,0 г никеля Ренея в качестве катализатора и при добавке 50 мл жидкого аммиака гидрируют в течение 8 часов при температуре 80oС и давлении 120 бар. После отфильтровывания, концентрирования и высушивания в высоком вакууме получают 10,3 г (98%) светло-желтого масла (109).
12-(4-Хлорфенил-сульфониламино)додеканол-(1) (110)
10 г (46,4 ммоль) Соединения 109 растворяют в 200 мл пиридина и при 30oС добавляют 9,8 г (46,4 ммоль) хлорангидрида п-хлорбензолсульфокислоты. Перемешивают в течение ночи при комнатной температуре, путем отгонки удаляют основное количество пиридина и остаток распределяют между водой и эфиром. После выпаривания органической фазы получают 5,9 г (34%) соединения 110 с т. пл. 90-92oС.
1-Бром-12-(4-хлорфенил-сульфониламино)додекан (111)
5,62 г (15 ммоль) Соединения 110 вместе с 15 мл трибромида фосфора нагревают в течение 2 часов при 40oС, охлаждают, выливают в воду со льдом и экстрагируют эфиром. После высушивания над сульфатом магния и концентрирования получают 5,16 г (78%) соединения 111 с т.пл. 70-73oС.
Аналогично примеру 9 из 1,3 г (3 ммоль) соединения 101 и 2,3 г (18 ммоль) дихлоруксусной кислоты и после флэш-хроматографии на силикагеле получают 0,6 г (46%) соединения 59 в виде бесцветного кристаллизата с т.пл. 70oС.
Полученная из соединения 59 и порошкообразного гидроксида натрия в этаноле натриевая соль плавится при 150-152oС.
Пример 60: Фармакологический тест
Гепатоциты крыс в культуре пригодны для исследований клеточного обмена веществ. Эти первичные культуры обладают тем преимуществом, что различные вещества можно исследовать в сравнительном плане в непролиферирующей, следовательно, первичной, определяемой метаболическими процессами системе.
Гепатоциты крыс выделяют путем рециркулирующей перфузии коллагеназы и культивируют в пробирках со скошенным дном. Стимулированное инсулином внедрение 14С-ацетата в триглицериды (ТГ) исследуют в присутствии и в отсутствие тест-веществ.
Указанные в таблице 2,2-дихлоралканкарбоновые кислоты приводят к отчетливому повышению стимулированного инсулином внедрения 14С-ацетата в триглицериды. Это указывает на то, что предлагаемые в изобретении соединения действуют антидиабетически. Этот эффект выражается прежде всего в сильном снижении ТГ в новом синтезе.

Изобретение относится к области медицины. Описываются лекарственные средства для лечения сахарного диабета, которые в качестве активного вещества содержат соединение формулы (I),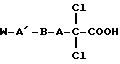
в которой А, В, А' и W имеют указанное в формуле изобретения значение, новые соединения формулы (I), а также способ их получения. Заявленные соединения вызывают нормализацию уровня глюкозы без опасности возникновения гипогликемии. 3 c. и 3 з.п. ф-лы, 1 табл.
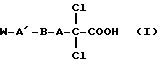
в которой А означает алкиленовую цепь с 5-20 атомами углерода;
А' означает валентную связь, виниленовую или ацетиленовую группу или алкиленовую цепь с 1-10 атомами углерода;
В означает валентную связь, метиленовую группу, серу, кислород или группу NR1, причем R1 может означать водород, бензил, фенил или алкильный остаток с 1-4 атомами углерода; карбонильную, сульфонамидную, сульфоксидную или сульфоновую группу, Е- или Z-виниленовую или ацетиленовую группу, CR2R3-группу, причем R2 может означать водород, алкильный остаток с 1-4 атомами углерода или фенил; R3 может означать алкильный остаток с 1-4 атомами углерода, бензил, фенил, гидроксил или группу NR4R5, где R4 может означать водород, бензил, фенил или алкильный остаток с 1-4 атомами углерода и R5 может означать водород или алкильный остаток с 1-4 атомами углерода; группу У-Z-Y, причем Y может означать серу или кислород, Z может означать алкильную цепь (СН2)n, где n=1-5;
W означает атом брома, цианогруппу или роданогруппу, аминокарбонил; циклоалкильный остаток с 3-8 атомами углерода, который может быть незамещен или замещен фенилом или алкилом с 1-4 атомами углерода; циклогексенильный или циклопентенильный остаток; фенильное кольцо, которое может быть замещено одним или любой комбинацией из следующих заместителей: алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, алкилтиогруппа с 1-4 атомами углерода, алкилсульфинил с 1-4 атомами углерода, алкилсульфонил с 1-4 атомами углерода, трифторметил, нитрогруппа, аминогруппа, гидроксил, цианогруппа, меркаптогруппа, сульфонаминогруппа, ацетиламиногруппа, карбоксил, феноксигруппа, бензилоксигруппа, фенил, бензоил, карбоксиалкил с 1-4 атомами углерода в алкильной части, метилендиоксигруппа, этилендиоксигруппа, фтор, хлор, бром, йод, карбоксиметоксигруппа, карбоксиэтоксигруппа, ацетоксигруппа, ацетил, пропионил, группа NR6R7, где R6 означает водород, алкил с 1-4 атомами углерода, бензил, R7 означает водород, алкил с 1-4 атомами углерода, бензил, фенил или бензоил, причем соответствующие ароматические кольца могут быть незамещены или одно- или многократно замещены галогеном, гидроксилом или алкоксилом с 1-4 атомами углерода; далее, α или β-нафтильное кольцо, которое может быть замещено метилом, гидроксилом, метоксигруппой, карбоксилом, метоксикарбонилом, этоксикарбонилом, цианогруппой, ацетилом, хлором или бромом; или тетрагидронафтильный остаток;
а также его физиологические приемлемые соли, сложные эфиры и оптически активные формы.
Х-А-В-А'-W (II)
в которой А, В, А' и W имеют указанное значение и Х означает галоген,
подвергают взаимодействию с дихлоруксусной кислотой или эфиром дихлоруксусной кислоты в присутствии сильных оснований и затем в желательном случае полученные соединения формулы (I) путем окисления, гидрирования или омыления переводят в другие соединения формулы (I), а также при необходимости свободную кислоту превращают в сложные эфиры или соли.
| ВРЕМЕННАЯ КРЕПБ | 0 |
|
SU302481A1 |
| Стробоскопическое устройство для измерения частоты колебаний вибратора или скорости вращения | 1946 |
|
SU81930A1 |
| BONT М | |||
| и др | |||
| Bull | |||
| Chem | |||
| Soc | |||
| J | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СAS, Реферат | |||
| De BUYCR L | |||
| et | |||
| al | |||
| Bull | |||
| Soc | |||
| Chim | |||
| Belg | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| Телескоп | 1920 |
|
SU525A1 |
| ГЕНЕС В.С., Этиология, патогенез и подходы к патогенетической терапии инсулинзависимого сахарного диабета | |||
| Обзор | |||
| Физиология и экспериментальная терапия, 1999, № 3, с | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
Авторы
Даты
2003-02-10—Публикация
1995-11-09—Подача