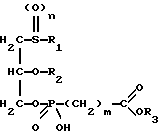
Изобретение относится к новым липидным производным фосфонокарбоновых кислот и их сложным эфирам общей формулы I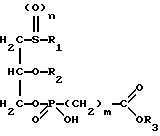
в которой R1 обозначает линейную или разветвленную, насыщенную или ненасыщенную алкильную цепь с 9-13 атомами углерода
R2 обозначает линейную или разветвленную, насыщенную или ненасыщенную алкильную цепь с 8-12 атомами углерода;
R3 обозначает Н, линейную или разветвленную алкильную цепь с 1-6 атомами углерода, в частности метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, неопентил, тексил или фенил, холин, этаноламин, карнитин, C5-C7-циклоалкил, бензил или одну из следующих групп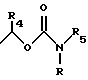

где R4 обозначает алкил, бензил или фенил R5 и R6 обозначают алкил и n = 1, 2 или 3;
n равно 0,1 или 2;
m равно 0, соответственно 1-3,
к их таутомерам, их физиологически приемлемым солям неорганических и органических оснований, а также к способу их получения и к содержащим эти соединения лекарственным средствам.
Так как соединения общей формулы I содержат асимметричные атомы углерода, то все оптически активные формы и рацемические смеси этих соединений являются предметом настоящего изобретения.
Под соединениями формулы I ниже подразумеваются также соли, таутомеры, сложные эфиры, оптически активные формы и рацемические смеси.
Терапия злокачественных неоплазий (карциномы, саркомы, гематологические неоплазии), воспалительных заболеваний или аутоиммунных заболеваний, а также заболеваний, вызываемых вирусами или ретровирусами, таких как, например СПИД, ARC (родственный СПИДу комплекс), инфекции цитомегалии и герпеса или гепатита, наряду с недостаточной эффективностью применяемых терапевтических активных веществ, часто связана также с их крайне нежелательными побочными действиями. Этот эффект объясняется слишком малой селективностью in vivo, соответственно ограниченным терапевтическим спектром применяемых активных веществ. Оптимальные фармакологические свойства фармакологически активных веществ, проявляемые ими in vitro, часто rte могут быть перенесены на условия in vivo.
Поэтому в течение многих лет пытаются путем модификации химической структуры фармакологически активных веществ создать новые вещества, обладающие улучшенным терапевтическим спектром действия. Кроме того, часто получают новые лекарственные формы фармацевтических препаратов с той целью, чтобы целенаправленно транспортировать активные вещества в то место, в котором они должны осуществлять свое терапевтическое действие. При этом, в частности, необходимо предотвратить нежелательное взаимодействие со здоровыми клетками. Одна возможность улучшения терапевтического спектра состоит в том, что путем незначительной модификации фармакологически активного вещества, например путем получения соли присоединения кислоты или основания, или путем получения фармакологически приемлемых сложных эфиров [например, эфиров жирных кислот; J.Pharm.Sci. 79, 531 (1990)] физические свойства активного вещества изменяют таким образом, чтобы была улучшена растворимость или переносимость активного вещества. Эти незначительно химически модифицированные соединения часто обозначаются также как "пролекарства", так как они при контакте с жидкостями организма или в печени (метаболизм первого прохода) почти непосредственно могут быть превращены в терапевтически активные агенты. Такие "пролекарства" соединений общей формулы I также включает настоящее изобретение.
Для улучшения катаболической стабильности осуществляют химическое связывание нуклеозидов, например, ara-C и arа-A, с фосфолипидами. Соответствующие производные проявляют меньшую токсичность и более высокую стабильность in vivo в сравнении с немодифицированными нуклеозидами. Однако это не оказывало практически никакого влияния на абсорбцию и проницаемость клетки [J. Med. Chem. , 32, 367 (1989), Cancer Res., 37, 1640 (1977) и 41, 2707 (1981)] . Другие фосфолипидные производные нуклеозидов описаны, например, в следующих литературных источниках:
В J. Biol. Chem., 265, 6112 (1990) описано получение и применение липонуклеотидов в качестве антивирусных лекарственных средств. Однако в этом случае были исследованы и синтезированы лишь связанные с известными нуклеозидами, например AZT и ddC, димиристоилфосфатидильные и дипальмитоилфосфатидильные остатки с их структурой сложных эфиров жирных кислот.
В J.Med. Chem., 33, 1380 (1990) описаны нуклеозидные конъюгаты тиоэфирлипидов с цитидиндифосфатом, которые обладают противоопухолевым действием и могут найти применение в онкологии.
В Chem. Pharm. Bull., 36, 209 (1988) описаны 5'-(3-SN-фосфатидил)-нуклеозиды с противолейкемической активностью, а также их ферментативный синтез из соответствующих нуклеозидов и фосфохолинов в присутствии фосфолипазы D с трансферазной активностью.
Описан также, в частности, в Tetrahedron Lett., 28, 199 (1987) и Chem. Pharm. Bull., 36, 5020 (1988) ферментативный синтез липонуклеотидов.
В W094/13324 описаны орально применяемые активные вещества с 1-O-алкил-, 1-O-ацил, 1-S-ацил- и 1-S-алкил-sn-глицеро-3-фосфатами в качестве носителей липида.
В заявке ЕР 418814, а также в J.Med. Chem., 34, 1912 (1991) описаны изопреноидфосфинилформиаты в качестве ингибиторов сквален-синтетазы.
В Biochem. Biophys. Res. Coinmun, 171, 458 (1990) описан липидный конъюгат противоретровирусного фоскарнета с пальмитилфосфоноформиатом, а в J. Med. Chem. , 20, 660 (1977) показана анти-ВИЧ-активность (гексилокси)-гидроксифосфинилуксусной кислоты.
В принципе большую помощь оказало бы нахождение эффективных путей транспортировки терапевтических концентраций лекарственных средств в соответствующие органы мишени или клетки-мишени, в случае СПИДа, например, в клетки иммунной системы и лимфатической системы, считающиеся главным резервуаром вирусной репликации.
Фосфономуравьиная кислота (PFA=phosphonoformic acid) и фосфоноуксусная кислота (PAA= phosphonoacetic acid) показывают высокую антивирусную активность против вируса простого герпеса (HSV) 1 и 2, гриппа, вируса гепатита В (HBV), вируса ветряной оспы (VZV), вируса Эпштейна-Барра (EBV), а также ретровирусных инфекций.
Фосфономуравьиная и фосфоноуксусная кислоты и их производные представляют собой в некоторых случаях эффективную альтернативу, соответственно дополнение для нуклеозидов, так как они тормозят широкий спектр ДНК и РНК-полимераз, а также RT ретровирусов с достаточной селективностью.
Сами фосфономуравьиная и фосфоноуксусная кислоты благодаря их сходству с пирофосфатом проявляют токсичность из-за их накопления в костях.
Соединения согласно настоящему изобретению также обладают ценными фармакологическими свойствами. В частности, они пригодны для терапии и профилактики инфекций, вызываемых ДНК-вирусами, например, такими, как вирус простого герпеса, вирус цитомегалии, паповавирусы, вирус ветряной оспы, вирусы гепатита или вирус Эпштейна-Барра, вирус гриппа или РНК-вирусами, такими как вирусы Тогга, или, в частности, ретровирусами, такими как онковирусы HTLV-1 и II (вирус человеческого Т-клеточного лейкоза), а также лентивирусами Visna и вирус человеческого иммунодефицита ВИЧ-1 и 2.
Особенно пригодны соединения формулы I для лечения клинических проявлений ретровирусной ВИЧ-инфекции у человека, такой как длительная генерализованная лимфоденопатия (PGL), далеко зашедшая стадия родственного СПИДу комплекса (ARC) и полная клиническая картина СПИДа, а также ассоциированные вирусные инфекции цитомегалии (CMV) и простого герпеса (HSV).
В J. Infect. Dis., 172, 225 (1995) описано антивирусное/антиретровирусное действие фоскарнета (тринатриевая соль фосфономуравьиной кислоты/ фосфономуравьиная кислота) против ВИЧ у пациентов с CMV-ретинитом.
Антивирусный эффект в мышином вирусе цитомегалии (CMV) описан в Antiviral Res., 26, 1 (1995).
Далее, в JAMA 273, 1457 (1995) описано лечение CMV-ретинита с использованием фосфономуравьиной кислоты.
Конъюгаты фосфономуравьиной и фосфоноуксусной кислот с 2',3'-дидезокси-3'-тиацитидином, ингибирующие ВИЧ-1-репликацию, описаны в J. Med.Chem., 37, 2216 (1994), а в J. Pharm.Sci., 83, 1269 (1994) описаны сложные ацилоксиалкильные эфиры фоскарнета.
Особый интерес представляют заявка США 5194654, соответственно PCT WO 94/13682. В них описаны липидные производные фосфонокарбоновых кислот и их применение в липосомах с образованием особенно стабильного липосомального комплекса. Наряду с исключительно широкой формулой изобретения в качестве объекта заявки описаны 1-O-алкил-sn-глицеро-3-фосфонокарбоновые кислоты, которые особенно хорошо встраиваются в двойной липидный слой липисом. Заявленные алкильные остатки могут включать от 2 до 24 атомов углерода, однако дополнительно они не замещены.
В качестве примера описано и подтверждено данными об антивирусном действии лишь соединение 1-O-октадецил-sn-глицеро-3- фосфоноформиат (батил-фосфоноформиат). В проведенных исследованиях и при получении это соединение оказалось нестойким. В противоположность названным патентным заявкам это соединение применялось в качестве чистого вещества в растворе/суспензии, но не в липосомах.
Предлагаемые согласно настоящему изобретению соединения общей формулы I в тех же условиях устойчивы и обладают как in vitro, так и in vivo (модель в мышином вирусе цитомегалии) очевидными преимуществами. В частности, сложные эфиры карбоновых кислот при оральном введении стабильнее и обладают лучшей биодоступностью в сравнении с соответствующими свободными карбоновыми кислотами.
Неожиданным образом была установлена очень тесная взаимосвязь между эффектом и структурой в смысле длины цепи применяемых насыщенных алкильных остатков. Только применение двух алкильных остатков с длиной цепи в пределах 10-13 атомов углерода давало оптимальный эффект.
Соединения, являющиеся предметом настоящей заявки, представляют поэтому интересное усовершенствование WO 94/13682 и US 5194654, которое нельзя было ожидать, причем они хотя и охватываются этими заявками, однако не являются объектом заявки, не названы даже явно, соответственно ни упомянуты поименно, и их применение также не вытекает с очевидностью из указанных публикаций.
Соединения формулы I являются новыми. Наряду с более высокой устойчивостью (в субстанции в растворе) заявляемых соединений они проявляют еще лучшее действие в сравнении с известными липидными производными.
Неожиданным образом было установлено, что фармацевтически активные вещества формулы I обладают в сравнении с фармакологически активными свободными, соответственно немодифицированными веществами, более широким терапевтическим спектром. Кроме того, они улучшают их время пребывания в организме, биодоступность и часто известную в качестве критически важного фактора проходимость через мембрану (например, гематоэнцефалический барьер, клеточную мембрану и т. д.). Соединения формулы I служат таким образом в качестве системы-носителя для фармакологически активных веществ. Конъюгаты формулы I могут быть обозначены с точки зрения их функции как внутриклеточная система депонирования лекарства, система целеуказания лекарства и система доставки лекарства. Они приводят к тому, что фармакологически активное вещество после орального приема высвобождается внутри клетки, причем это высвобождение предпочтительно происходит не во всех клетках, органах или тканях организма, но лишь прицельно а таких клетках, которые содержат определенный фермент. Однако особенно поразительно то, что расщепление происходит уже не во время транспорта субстрата в жидкостях организма, таких как кровь, сыворотка или лимфатическая жидкость, или в печени, но лишь на соответствующих клетках-мишенях. Таким образом предотвращается нежелательное выделение фосфонокарбоновой кислоты почкой или расщепление конъюгата в печени, благодаря чему значительно большая часть активного вещества транспортируется на или в соответствующие клетки-мишени. Такого рода клетками, как уже упомянуто выше, являются, в частности, физиологически или патофизиологически активированные клетки, которые могут применяться в качестве целевого объекта для доставки фармакологически активных веществ, например лейкоциты крови, лимфоциты, макрофаги и другие клеточные популяции иммунологически лимфатической системы. При этом речь, в частности, идет об активированных клетках (например, макрофагах, гранулоцитах, лимфоцитах, лейкоцитах, тромбоцитах, моноцитах и т. д. ), которые играют патофизиологическую или симптоматичеcкую роль в конкретном патологическом процессе. Кроме того, имеются в виду также клетки, инфицированные вирусами, бактериями, грибками или другими микроорганизмами.
Неожиданно было также установлено, что терапевтический спектр фармакологически активной фосфонокарбоновой кислоты и ее сложных эфиров значительно улучшается, если вещество связывается с очень специальной липидообразной молекулой-носителем. Полученный таким образом конъюгат служит новым активным веществом для получения лекарственных форм фармацевтического препарата. Общим итогом такого связывания является усиление действия фармацевтически активной фосфонокарбоновой кислоты in vivo, так как образовавшаяся система депонирования, доставки и транспорта лекарства вызывает локализацию фармакологически активного вещества в клетках-мишенях и тем самым улучшает эффективность и переносимость фармакологически активного вещества. Это означает, что, с одной стороны, назначаемая дозировка фармакологически активной фосфонокарбоновой кислоты может быть снижена, а с другой стороны, при одном и том же эффективном количестве достигается усиление фармакологического действия.
Фармакологически активная фосфонокарбоновая кислота высвобождается из конъюгата в результате ферментативного гидролиза конъюгата.
Конъюгаты формулы I имеют явные преимущества в сравнении с неконъюгированной фармацевтически активной фосфонокарбоновой кислотой, соответственно с ее сложными эфирами. Специфический, ковалентно связанный с фармацевтически активным веществом носитель улучшает биодоступность плохо ресорбируемых фармацевтически активных веществ, переносимость потенциально токсичных активных молекул, время пребывания быстро выводимых или метаболизируемых лекарственных средств и проникновение через мембрану соединений с плохой мембранной проходимостью (например, гематоэнцефалический порог, клетки и т.д.)
Ферментативное расщепление липидного компонента in vivo происходит, как правило, не в сыворотке, а лишь внутри клетки. Кроме того, компонент носителя улучшает своей лецитинообразной структурой, которая существенна для обсуждаемого эффекта, проникновение через мембрану фармацевтически активного вещества и способствует эффекту депонирования. Кроме того, желудочно-кишечная переносимость липидных конъюгатов многократно лучше в сравнении с чистой фармацевтически активной фосфонокарбоновой кислотой. И при ресорбции липидный конъюгат лучше проникает через мембранные структуры и тем самым лучше преодолевает резорбционные барьеры. То же самое относится к проникновению, например, через гематоэнцефалический барьер.
Далее, благодаря лучшему связыванию конъюгата с плазменными и тканевыми белками улучшается распределение in vivo. В результате нормальной биотрансформации конъюгат первично окисляется из тиоэфира (n=0) в сульфоксид (n= 1), что, однако, в силу равноценного действия сульфоксида в сравнении с тиоэфиром не является недостатком. Медленное высвобождение фармацевтически активной фосфонокарбоновой кислоты из конъюгата обеспечивает низкий, однако постоянный в течение длительного периода времени активный уровень вещества, и тем самым улучшает его действие и/или устраняет побочные токсические эффекты. Высвободившееся фармацевтически активное вещество в форме монофосфата в силу своей большой гидрофильности уже больше не покидает клетку.
Периоды полураспада фармацевтически активного вещества как в организме в целом, так и в клетке и в органах благодаря конъюгации значительно увеличиваются в результате более продолжительного времени пребывания конъюгата в организме. Так как отсутствует расщепляющая активность в сыворотке и в различных органах, то почти не наблюдается или наблюдается лишь очень незначительная токсичность для костного мозга и органов. В особенности преимуществом является то, что конъюгаты формулы I специфически накапливаются в различных органах-мишенях, тканях или клетках.
Соединения формулы I могут применяться в качестве активных веществ для получения лекарственных средств, применяемых для лечения всех тех заболеваний, при которых требуются или полезны высокие уровни фармацевтически активных веществ в клетках, органах или тканях. Существенной предпосылкой для этой системы, обозначаемой как система депонирования, доставки и целеуказания лекарства, является то, что интересные в смысле планируемой терапии клетки имеют фермент расщепления, так что на первой стадии активное вещество связывается и затем транспонируется через клеточную мембрану внутрь клетки, причем расщепление активного вещества в физиологически активную фосфонокарбоновую кислоту происходит либо в основном одновременно с транспортом через клеточную мембрану, либо позже отчасти внутри клетки. Внутриклеточное расщепление происходит, в частности, в тех случаях, когда фермент расщепления локализован также и внутри клетки.
Подходящими клетками-мишенями являются, в частности, клетки иммунологически лимфатической системы (например, лейкоциты крови, моноциты, макрофаги, лимфоциты) или инфицированные клетки.
Неожиданно было также установлено, что соединения общей формулы I ингибируют размножение ДНК-, соответственно РНК-вирусов на стадии вирус-специфической ДНК-, соответственно РНК-транскрипции. Эти вещества могут оказывать через ингибирование фермента обратной транскриптазы влияние на размножение ретровирусов (см. Proc. Natl. Acad.Sci USA 83, 1911, 1986 или Nature 325, 773, 1987). Особый терапевтический интерес представляет ингибирующее действие на ВИЧ-вирус, вызывающий заболевание человека иммунодефицитом (СПИДом). Для лечения СПИДа в настоящее время допущен 3'-азидо-3'- дезокситимидин (DE-A-3608606). Однако токсичные побочные действия 3'-азидо-3'-дезокситимидина на костный мозг у приблизительно 50% пациентов требует переливания крови. Соединения общей формулы I не имеют этих недостатков. Их противовирусное действие не сопряжено с цитотоксичностью в фармакологически релевантных дозах.
Соединения согласно настоящему изобретению и их фармацевтические препараты могут применяться также в комбинации с другими лекарственными средствами для лечения и профилактики вышеназванных инфекций. Примеры этих других лекарств включают средства, которые могут быть использованы для лечения и профилактики ВИЧ-инфекций или заболеваний, сопровождающих эту болезнь, такие как 3'-азидо-3'- дезокситимидин, 2',3'-дидезоксинуклеозиды, такие как 2',3'- дидезоксицитидин, 2', 3'-дидезоксиаденозин и 2',3'- дидезоксиинозин, ациклические нуклеозиды (например, Acyclovir), ненуклеозидные RT-ингибиторы, ингибиторы протеазы, такие как, например, инвиразы, интерфероны, такие как, например, интерферон α,β,γ, цитокины и интерлейкины (например, интерлейкин 16), хемокины, такие как, например, MIP1 α , MIP1 β , CCl, ингибиторы почечных выделений, такие как, например, пробеницид, ингибиторы транспорта нуклеозидов, такие как, например, дипиридамол, а также иммуномодуляторы, такие как, например, интерлейкин II или стимулирующие факторы, такие как, например, факторы, стимулирующие колонию гранулоцитов-макрофагов (GM-CSF), факторы, стимулирующие колонию гранулоцитов (G-CSF, нейтропоэтин), тромбопоэтин и тромбопоэтино-подобные факторы. Соединения согласно настоящему изобретению и другое лекарственное средство могут применяться каждое отдельно, возможно одновременно, соответственно в одной единственной лекарственной форме или в двух различных лекарственных формах, или в разное время, так что достигается синергический эффект.
В качестве возможных солей соединений общей формулы I могут рассматриваться прежде всего соли щелочных и щелочноземельных металлов и аммония с карбоксильной и фосфонатной группами. В качестве солей щелочных металлов предпочтительны соли лития, натрия и калия. В качестве солей щелочноземельных металлов могут рассматриваться, в частности, соли магния и кальция. Под солями аммония согласно изобретению подразумеваются соли, содержащие ион аммония, который может быть замещен вплоть до четырехкратно алкильными остатками с 1-4 атомами углерода и/или аралкильными остатками, предпочтительно бензильными остатками. Заместители могут быть при этом одинаковыми или разными.
Под сложными эфирами карбоновых кислот липидных производных фосфонокарбоновых кислот подразумеваются фармакологически приемлемые сложные эфиры, предпочтительно сложные эфиры, образованные с бензилом, холином, этаноламином, карнитином, C5-C7-циклоалкилом или с линейным, или разветвленным алкильным остатком, содержащим 1-6 C-атомов углерода, в частности метилом, этилом, пропилом, бутилом, пентилом, гексилом, изопропилом, изо-бутилом, трет-бутилом, неопентилом или тексилом. Совершенно особенно предпочтительны метил, этил, пропил, бутил, трет-бутил и бензил.
Сложные эфиры липидофосфонокарбоновых кислот in vitro имеют такую же эффективность, что и соответствующие карбоновые кислоты. In vivo они, напротив, проявляют явные преимущества, в частности, при оральном введении. Сложные эфиры карбоновых кислот соединений формулы I подвержены меньшему разложению в кислой среде в результате декарбоксилирования и, следовательно, обеспечивают связанную с этим лучшую биодоступность. В соответствии с этим назначаемая доза может быть еще уменьшена в сравнении со свободной карбоновой кислотой. Кроме того, улучшается проходимость через мембрану, например, при преодолении гематоэнцефалического барьера и при прохождении через клеточную мембрану в клетку-мишень. Так как сложный эфир карбоновой кислоты должен быть расщеплен эстеразами лишь in vivo, то период полураспада в сыворотке удлиняется.
В общей формуле I остаток R1 предпочтительно обозначает линейную C10-C12-алкильную группу,
R1, в частности, представляет собой децильную, ундецильную, додецильную или тридецильную группу,
n предпочтительно обозначает одно из чисел 0 или 1,
R2 предпочтительно обозначает линейную C9-C122-алкильную группу,
R2, в частности, представляет собой децильную, ундецильную или додецильную группу.
Предпочтительными сопряженными фосфонокарбоновыми кислотами, соответственно их сложными эфирами в предлагаемых конъюгатах общей формулы I являются следующие кислоты и их сложные эфиры:
- фосфономуравьиная кислота
- фосфоноуксусная кислота
- фосфонопропионовая кислота.
Особенно предпочтительные липидные компоненты включают n=0 и комбинацию: R1децил/R2= додецил, R1=ундецил/R2=ундецил или R1=додецил/R2=децил и, кроме того, еще R1=ундецил/R2=децил, R1=тридецил/R2=децил, R1=додецил/R2=ундецил.
Соединения общей формулы I могут быть получены тем, что:
1) соединение общей формулы II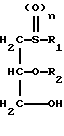
в которой R1, R2 и n имеют указанные значения, подвергают взаимодействию с соединением общей формулы III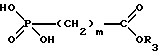
в которой m имеет вышеуказанное значение и R представляет собой один из вышеуказанных сложных эфиров, в присутствии в случае необходимости замещенного хлорангидрида арилсульфоновой кислоты в органическом основании, соответственно в присутствии основания в инертном органическом растворителе, и необязательно затем переводят сложный эфир карбоновой кислоты щелочным омылением в производное формулы I, соответственно в его физиологически приемлемую соль, или
2) получают смешанный ангидрид из соединения формулы III и хлорангидрида алкил- или арилсульфоновой кислоты и вводят его в реакцию со спиртом формулы II в присутствии основания в инертном органическом растворителе, соответственно непосредственно в основании, и в случае необходимости затем подвергают сложный эфир карбоновой кислоты щелочному омылению, или
3) подвергают фосфонокарбоновую кислоту формулы III, в которой R обозначает водород, со спиртом формулы II в присутствии основания и в случае необходимости замещенного хлорангидрида арилсульфоновой кислоты и при желании переводят в физиологически приемлемую соль, или
4) смешанный ангидрид из соединения формулы III, в которой R обозначает водород, и хлорангидрида алкил- или арилсульфоновой кислоты вводят в реакцию со спиртом формулы II в присутствии основания, соответственно в инертном органическом растворителе, и в случае необходимости конъюгат переводят в физиологически приемлемую соль, или
5) дихлорангидриды фосфоновой кислоты общей формулы IV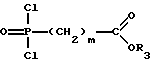
которые могут быть получены согласно Бонгле и сотр. (Synthetic Commun., 17, 1071 (1987)), исходя из бис-триметилсилилового эфира фосфоновой кислоты, путем последующего взаимодействия с оксалилхлоридом, подвергают взаимодействию со спиртом общей формулы II в присутствии основания в молярном соотношении 1:1, или
6) соединение формулы III переводят с помощью оксалилхлорида, как описано в Tetrahedron Letters 33, 7473 (1992), в соответствующий дихлорангидрид фосфоновой кислоты формулы IV, который затем подвергают взаимодействию со спиртом формулы II в присутствии основания в молярном соотношении 1:1. Получаемый в качестве промежуточного продукта монохлорангидрид фосфоновой кислоты омыляют до полуэфира и переводят в сложный эфир карбоновой кислоты путем щелочного омыления в производное формулы I, соответственно в его физиологически приемлемую соль.
Свободные кислоты липидных производных фосфонокарбоновых кислот могут быть при необходимости переведены в соответствующие сложные эфиры.
Получение соединений общей формулы II описано в примерах в EP 0545966.
Содержащие соединения формулы I лекарственные средства для лечения, например, вирусных инфекций могут применяться в жидкой или твердой форме энтерально или парентерально. При этом приемлемы обычные формы применения, например таблетки, капсулы, драже, сиропы, растворы или суспензии. В качестве инъекционной среды предпочтительно используют воду, содержащую обычные в инъекционных растворах добавки, такие как стабилизаторы, агенты растворения и буферные смеси. Такого рода добавками, например, являются тартратный и цитратный буфер, этанол, комплексообразователи, такие как этилендиаминтетрауксусная кислота и ее нетоксичные соли, высокомолекулярные полимеры, такие как жидкий полиэтиленоксид для регулирования вязкости.
Жидкие носители для инъекционных растворов должны быть стерильны и предпочтительно их разливают в ампулы. Твердыми носителями являются, например, крахмал, лактоза, маннит, метилцеллюлоза, тальк, высокодисперсные кремниевые кислоты, более высокомолекулярные жирные кислоты, такие как стеариновая кислота, желатин, агар-агар, фосфат кальция, стеарат магния, животные и растительные жиры, твердые высокомолекулярные полимеры, такие как полиэтиленгликоли и т.д. Препараты, пригодные для орального применения, при необходимости могут содержать вкусовые добавки и подсластители.
Соединения формулы I принципиально могут вводиться пациенту орально, интратрахеально, ректально, в нос, вагинально, подъязычно, внутривенно, внутриартериально, внутримышечно, внутрикожно или подкожно. Дозировка может зависеть от различных факторов, таких как способ применения, вид заболевания, возраст или индивидуальное состояние пациента. Соединения согласно изобретению обычно применяют в количестве от 0,1 до 1000 мг, предпочтительно от 2 до 800 мг, особенно предпочтительно от 30 мг до 250 мг в день и на кг веса тела. Дневная доза предпочтительно распределяется на 2-5 приемов, причем при каждом приеме принимают по 1-2 таблетки с содержанием активного вещества от 0,5 до 3000 мг. Таблетки могут быть также ретардированы, благодаря чему количество приемов лекарства в день уменьшается до 1-3. Содержание активного вещества в ретардированных таблетках может составлять от 20 до 5000 мг. Активное вещество может вводиться также путем продолжительного вливания, причем, как правило, достаточны количества от 5 до 10000 мг в день.
Помимо соединений, названных в примерах и получающихся в результате комбинации всех указанных в формуле изобретения значений заместителей, в объеме настоящего изобретения могут рассматриваться следующие соединения формулы I:
1. (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиная кислота
2. (3-додецилсульфинил-2-децилокси)пропокси- фосфинилгидроксимуравьиная кислота
3. (3-додецилсульфонил-2-децилокси)пропокси- фосфинилгидроксимуравьиная кислота
4. (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиная кислота
5. (3-децилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиная кислота
6. (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиная кислота
7. (3-ундецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксимуравьиная кислота
8. (3-ундецилсульфинил-2-ундецилокси)пропокси- фосфинилгидроксимуравьиная кислота
9. (3-ундецилсульфонил-2-ундецилокси)пропокси- фосфинилгидроксимуравьиная кислота
10. (3-додецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксимуравьиная кислота
11. (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксимуравьиная кислота
12. (3-ундецилмеркапто-2-додецилокси)пропокси- фосфинилгидроксимуравьиная кислота
13. (3-додецилмеркапто-2-додецилокси)пропокси- фосфинилгидроксимуравьиная кислота
14. (3-додецилмеркапто-2-нонилокси)пропокси- фосфинилгидроксимуравьиная кислота
15. (3-ундецилмеркапто-2-нонилокси)пропокси- фосфинилгидроксимуравьиная кислота
16. (3-додецилмеркапто-2-октилокси)пропокси- фосфинилгидроксимуравьиная кислота
17. (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксипропионовая кислота
18. (3-додецилсульфинил-2-децилокси)пропокси- фосфинилгидроксипропионовая кислота
19. (3-додецилсульфонил-2-децилокси)пропокси- фосфинилгидроксипропионовая кислота
20. (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксипропионовая кислота
21. (3-децилмеркапто-2-децилокси)пропокси- фосфинилгидроксипропионовая кислота
22. (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксипропионовая кислота
23. (3-ундецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксипропионовая кислота
24. (3-ундецилсульфинил-2-ундецилокси)пропокси- фосфинилгидроксипропионовая кислота
25. (3-ундецилсульфонил-2-ундецилокси)пропокси- фосфинилгидроксипропионовая кислота
26. (3-додецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксипропионовая кислота
27. (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксипропионовая кислота
28. (3-ундецилмеркапто-2-додецилокси)пропокси- фосфинилгидроксипропионовая кислота
29. (3-додецилмеркапто-2-додецилокси)пропокси- фосфинилгидроксипропионовая кислота
30. (3-додецилмеркапто-2-нонилокси)пропокси- фосфинилгидроксипропионовая кислота
31. (3-ундецилмеркапто-2-нонилокси)пропокси- фосфинилгидроксипропионовая кислота
32. (3-додецилмеркапто-2-октилокси)пропокси- фосфинилгидроксипропионовая кислота
33. (3-лодецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусная кислота
34. (3-додецилсульфинил-2-децилокси)пропокси- фосфинилгидроксиуксусная кислота
35. (3-додецилсульфонил-2-децилокси)пропокси- фосфинилгидроксиуксусная кислота
36. (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусная кислота
37. (3-децилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусная кислота
38. (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусная кислота
39. (3-ундецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксиуксусная кислота
40. (3-ундецилсульфинил-2-ундецилокси)пропокси- фосфинилгидроксиуксусная кислота
41. (3-ундецилсульфонил-2-ундецилокси)пропокси- фосфинилгидроксиуксусная кислота
42. (3-додецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксиуксусная кислота
43. (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксиуксусная кислота
44. (3-ундецилмеркапто-2-додецилокси)пропокси- фосфинилгидроксиуксусная кислота
45. (3-додецилмеркапто-2-додецилокси)пропокси- фосфинилгидроксиуксусная кислота
46. (3-додецилмеркапто-2-нонилокси)пропокси- фосфинилгидроксиуксусная кислота
47. (3-ундецилмеркапто-2-нонилокси)пропокси- фосфинилгидроксиуксусная кислота
48. (3-додецилмеркапто-2-октилокси)пропокси- фосфинилгидроксиуксусная кислота
49. метиловый эфир (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
50. метиловый эфир (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
51. метиловый эфир (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
52. метиловый эфир (3-ундецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксимуравьиной кислоты
53. метиловый эфир (3-додецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксимуравьиной кислоты
54. метиловый эфир (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксимуравьиной кислоты
55. метиловый эфир (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
56. метиловый эфир (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
57. метиловый эфир (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
58. метиловый эфир (3-ундецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксиуксусной кислоты
59. метиловый эфир (3-додецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксиуксусной кислоты
60. метиловый эфир (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксиуксусной кислоты
61. этиловый эфир (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
62. этиловый эфир (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
63. этиловый эфир (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
64. этиловый эфир (3-ундецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксимуравьиной кислоты
65. этиловый эфир (3-додецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксимуравьиной кислоты
66. этиловый эфир (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксимуравьиной кислоты
67. этиловый эфир (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
68. этиловый эфир (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
69. этиловый эфир (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
70. этиловый эфир (3-ундецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксиуксусной кислоты
71. этиловый эфир (3-додецилмеркапто-2-ундецилокси)пропокси- фосфинилгидроксиуксусной кислоты
72. этиловый эфир (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксиуксусной кислоты
73. изопропиловый эфир (3-додецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
74. изопропиловый эфир (3-ундецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
75. изопропиловый эфир (3-тридецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
76. изопропиловый эфир (3-ундецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
77. изопропиловый эфир (3-додецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
78. изопропиловый эфир (3-децилмеркапто-2-додецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
79. изопропиловый эфир (3-додецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксиуксусной кислоты
80. изопропиловый эфир (3-ундецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксиуксусной кислоты
81. изопропиловый эфир (3-тридецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксиуксусной кислоты
82. изопропиловый эфир (3-ундецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
83. изопропиловый эфир (3-додецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
84. изопропиловый эфир (3-децилмеркапто-2-додецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
85. неопентиловый эфир (3-додецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
86. неопентиловый эфир (3-ундецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
87. неопентиловый эфир (3-тридецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
88. неопентиловый эфир (3-ундецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
89. неопентиловый эфир (3-додецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
90. неопентиловый эфир (3-децилмеркапто-2-додецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
91. неопентиловый эфир (3-додецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксиуксусной кислоты
92. неопентиловый эфир (3-ундецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксиуксусной кислоты
93. неопентиловый эфир (3-тридецилмеркапто-2-децилокси)- пропокси-фосфинилгидроксиуксусной кислоты
94. неопентиловый эфир (3-унлецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
95. неопентиловый эфир (3-додецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
96. неопентиловый эфир (3-децилмеркапто-2-додецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
97. бензиловый эфир (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
98. бензиловый эфир (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
99. бензиловый эфир (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты
100. бензиловый эфир (3-ундецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
101. бензиловый эфир (3-додецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксимуравьиной кислоты
102. бензиловый эфир (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксимуравьиной кислоты
103. бензиловый эфир (3-додецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
104. бензиловый эфир (3-ундецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
105. бензиловый эфир (3-тридецилмеркапто-2-децилокси)пропокси- фосфинилгидроксиуксусной кислоты
106. бензиловый эфир (3-ундецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
107. бензиловый эфир (3-додецилмеркапто-2-ундецилокси)- пропокси-фосфинилгидроксиуксусной кислоты
108. бензиловый эфир (3-децилмеркапто-2-додецилокси)пропокси- фосфинилгидроксиуксусной кислоты
Пример 1
Динатриевая соль R,S-(3-додецидмеркапто-2-децилокси)пропокси- фосфинилгидроксимуравьиной кислоты (DMDOP-PFA) и сложный метиловый эфир (DMDOP-PFA-OMe)
18,2 мл сложного триметилового эфира фосфономуравьиной кислоты растворяют в 140 мл дихлорметана и смешивают при перемешивании с 72,5 мл бромтриметилсилана. Смесь перемешивают в течение 2 ч при комнатной температуре, упаривают, остаток дважды растворяют в метаноле и раствор каждый раз снова упаривают. Остаток растворяют в 30 мл абсолютного пиридина и смешивают с раствором 48,7 R,S-(3- додецидмеркапто-2-децилокси)-пропан-1-ола. Смесь упаривают досуха, остаток при перемешивании смешивают с 47,1 г 2,4,6-три- изопропилбензолсульфохлорида и 150 мл абсолютного пиридина. Вначале густая суспензия приблизительно через 30 мин становится жиже, и ее перемешивают в течение 25 ч при комнатной температуре.
Осадок отсасывают и промывают небольшим количеством пиридина. Фильтрат смешивают со 150 мл воды при перемешивании, смесь в течение 30 мин перемешивают при комнатной температуре, упаривают и смешивают с эфиром. Вновь выпавший осадок отфильтровывают и эфирный фильтрат встряхивают с 0,5 н. HCl. Эфирную фазу хорошо промывают водой, сушат и упаривают.
Остаток (84,2 г) очищают с помощью хроматографии на силикагеле в системе растворителей дихлорметан/метанол/ледяная уксусная кислота (9:0,5:0,5). Содержащие продукт фракции упаривают. Получают 45,4 г соответствующего сложного эфира R,S-(3-додецидмеркапто-2- децилокси) пропокси-фосфинилгидроксимуравьиной кислоты (DMDOP- PFA-OMe).
Тонкослойная хроматография на силикагеле:
Rf= 0,3 (эфир уксусной кислоты/ацетон/ледяная уксусная кислота/вода (10: 4:0,5:0,5);
Rf = 0,69 (дихлорметан/метанол 8:2)/
Для омыления сложного метилового эфира карбоновой кислоты 5 г полученного выше продукта растворяют в 70 мл тетрагидрофурана и смешивают с 6,7 мл 2 н. NaOH. Перемешивают в течение 4 ч и оставляют на ночь. Реакционную смесь с помощью буфера 2 - этилгексановой кислоты доводят до pH 8 и упаривают. Остаток перемешивают с ацетоном и выпавший в осадок продукт отсасывают. Получают 4.1 г кислоты с Tпл. 242-246oC (разложение).
Тонкослойная хроматография на силикагеле:
Rf=0,31 (изопропанол/бутилацетат/вода/конц.аммиак 10:6:3:1);
13C-ЯМР в D2O:COOH (d, 175 м.д., Jp-c-231,4 Гц)
Пример 2
Динатриевая соль R, S-(3-додецилмеркапто-2-децилокси) пропокси-фосфинилгидроксиуксусной кислоты (DMDOP-PAA) и сложный метиловый эфир (DMDOP-PAA-OMe)
Аналогично примеру 1, исходя из сложного метилового эфира фосфоноуксусной кислоты в виде воскообразного продукта и (3-додецил-меркапто-2-децилокси)-пропан-1-ола, получают указанное в заголовке соединение с Tпл=358-360oC (разложение).
DMDOP-PAA:
Тонкослойная хроматография на силикагеле:
Rf = 0,53 (н-бутанол/ледяная уксусная кислота/вода 2:1:1);
Rf = 0,07 (дихлорметан/ледяная уксусная кислота/вода 9:0,5:0,5)
DMDOP-PAA-OMe:
Тонкослойная хроматография на силикагеле:
Rf = 0,6 (н-бутанол/ледяная уксусная кислота/вода 2:1:1)
Rf = 0,1 (дихлорметан/ледяная уксусная кислота/вода 9:0,5:0,5)
Пример 3
Определение токсичности для костного мозга in vitro (CFU-GM-Assay=пpoбa на гранулоцитарно-макрофагальную колониеобразующую единицу)
Проводили пробы на ГМ-КОЕ, как описано у Seidel и Kreja (Seidel Н. und J. Kreja, L. , Blut 47, 139-145, 1983). Клетки костного мозга (1•105 клеток/мл) мышей Balb/c культивировали в среде Iscove, которая содержит 0,8% метилцеллюлозы, 20% лошадиной сыворотки, 10-4 М α- тиоглицерина и оптимальный объем (12,5 или 25 ммл) мышиной сыворотки, активированной эндотоксином, которую получали у мышей Balb/c через 4 ч после внутривенной инъекции 50 мкг эндотоксина на одно животное (Salmonella abortus equi; Sigma, Дайзенгофен, Германия). После 6-дневной инкубации в течение следующих 24 ч колонии окрашивали 2 (п-иодфенил)-3-(п-нитрофенил)-5-фенил-тетразолийхлорид-гидратом (INT, Sigma) и затем считали с помощью автоматического процессора изображений (Artek 982 В, Biosys GmbH, Карбен, Германия).
В табл. 1 показаны IC50-концентрации из нескольких проведенных концентрационно зависимых экспериментов с фосфономуравьиной кислотой, DMDOP-PFA, фосфоноуксусной кислотой, DMDOP-PAA, сложным этиловым эфиром (3-октадецил-окси-2-гидрокси) - пропокси-фосфинилгидроксимуравьиной кислоты (OOHP-PFAE) и (3- октадецилокси-2-гидрокси)-пропоксифосфинилмуравьиной кислотой (OOHP-PFA) в сравнении с цитостатиком цисплатином (Cis-DDP) и доксорубицином. Как следует из табл. 1, DMDOP-PFA и DMDOP-PAA вплоть до наивысшей концентрации 100 мкг/мл не проявляют никакой токсичности для стволовых клеток костного мозга гранулоцитарно/моноцитарного ряда. Хотя это относится также и к фосфонмуравьиной кислоте, фосфоноуксусная кислота, а также конъюгаты OOHP-PFAE и OOHP-PFA токсичнее, чем DMDOP-PFA и DMDOP- PAA.
Пример 4
Определение оральной биодоступности в модели мышиного вируса цитомегалии (MCMV)
Иммунокомпроментированным самкам мыши Бальб/е вводили внутрибрюшинно дозу 8•105 бляшкообразующих единиц (PFU). Выживаемость животных возрастала в ряду нелеченые<леченые фоскарнетом<DMDOP-PFA<DMDOP-PFA-OMe.
ФАРМАКОЛОГИЧЕСКИЕ ДАННЫЕ
Приложение 1
1. Определение активности в зависимости от структуры: Sn3 -варианты
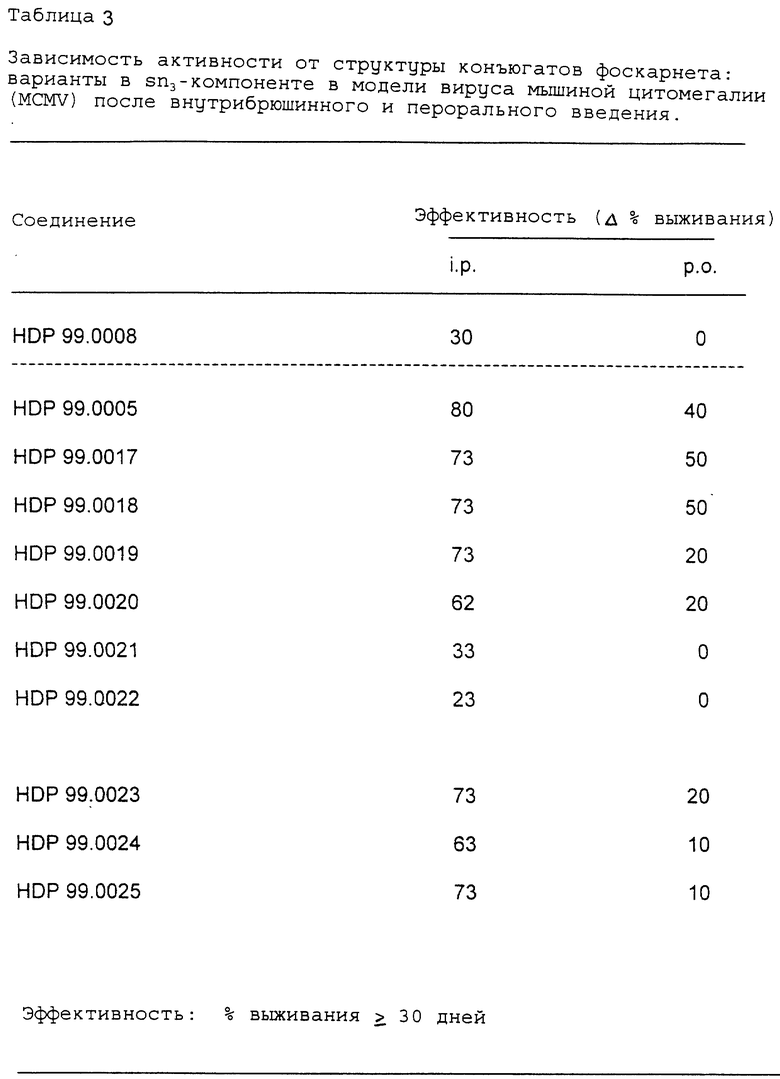
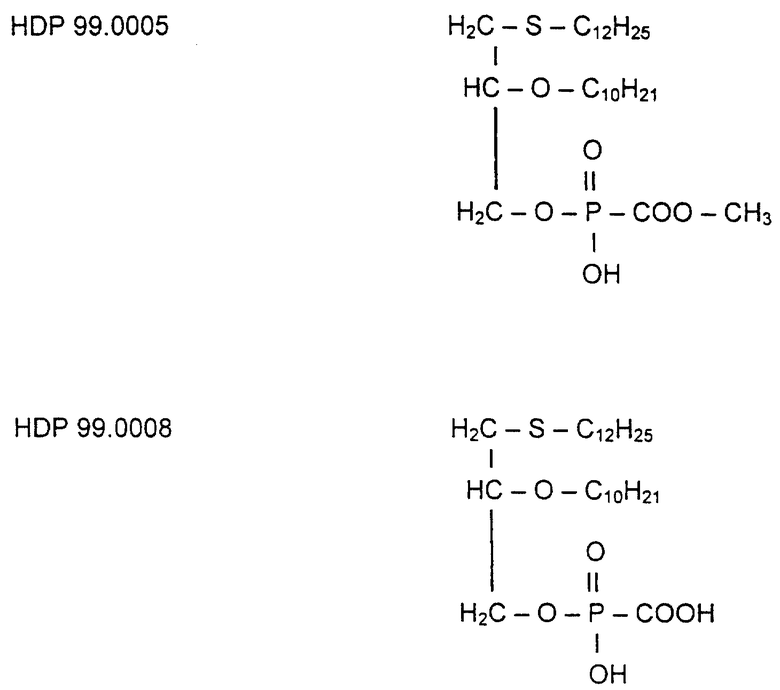
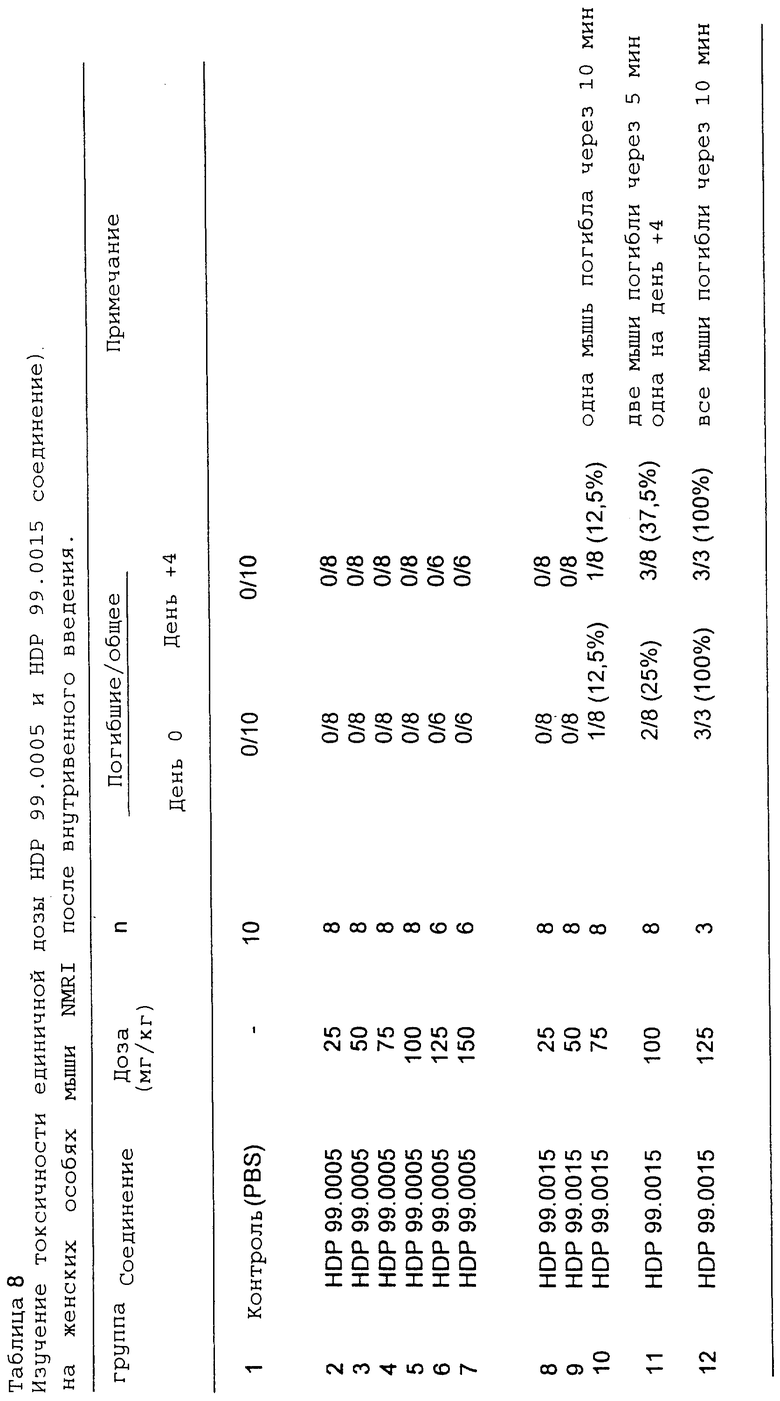
Фоскарнет-конъюгаты, т.е. эфиропроизводные в Sn3 -компоненте (исключение: HDP 99.0008, см. табл. 2), были протестированы in vivo на их антивирусную активность на животной модели вируса мышиной цитомегалии (MCMV).
1.1 Методы
Модель MCMV описана в приложении A.
1.2 Результаты
Данные, представленные в табл. 3, иллюстрируют эффективность соединений, тестированных на модели MCMV. Результаты демонстрируют процентное содержание выживших животных (в течение 30 дней и более) в этой системе острой вирусной инфекции. Все значения выражены% выживших крыс по сравнению с контрольной группой с симулированной обработкой.
Данные, представленные в табл. 3 показывают
- неожиданно тестируемые эфиропроизводные оказались очень активны in vivo на животной модели вируса мышиной цитомегалии после внутрибрюшинного введения,
- неожиданно обнаружена четкая зависимость между структурой соединения и его активностью. Антивирусная активность тестированных соединений в большой степени зависит от длины алкильной цепи фоскарнета,
- неожиданно большинство из этих эфиропроизводных также активны после перорального введения,
- неожиданно оральная биодоступность также зависит от длины алкильной цепи фоскарнета,
- неожиданно в противоположность HDP 99.0005 производные кислот HDP 99.0008 проявляют только умеренную активность после внутрибрюшинного введения и являются полностью неактивными после перорального введения.
Приложение A
Тестирование конъюгатов эфиролипидов и фоскарнета на модели in vivo вируса мышиной цитомегалии (MCMV)
Различные конъюгаты эфиролипидов и фоскарнета были исследованы in vivo на модели вируса мышиной цитомегалии. В этой системе степень выживания после инфекции вирусом мышиной цитомегалии определяли через 30 и более дней после инфекции по сравнению с контролем, обработанным плацебо.
Животные были инфицированы (за исключением контрольных животных) внутрибрюшинно 2•105 дозами PFU на животное в день 0. Все животные за исключением контрольных были иммунодепрессированы в день - 1 с помощью перорального введения 100 мг циклофосфамида на кг веса. Все тестируемые соединения были введены один раз в день внутрибрюшинно или перорально в количестве 30 мг•кг-1•день-1 (от 0 дня +1 ч после инфекции) через день +8. Количество выживших животных определяли через 30 и более дней.
Приложение 2
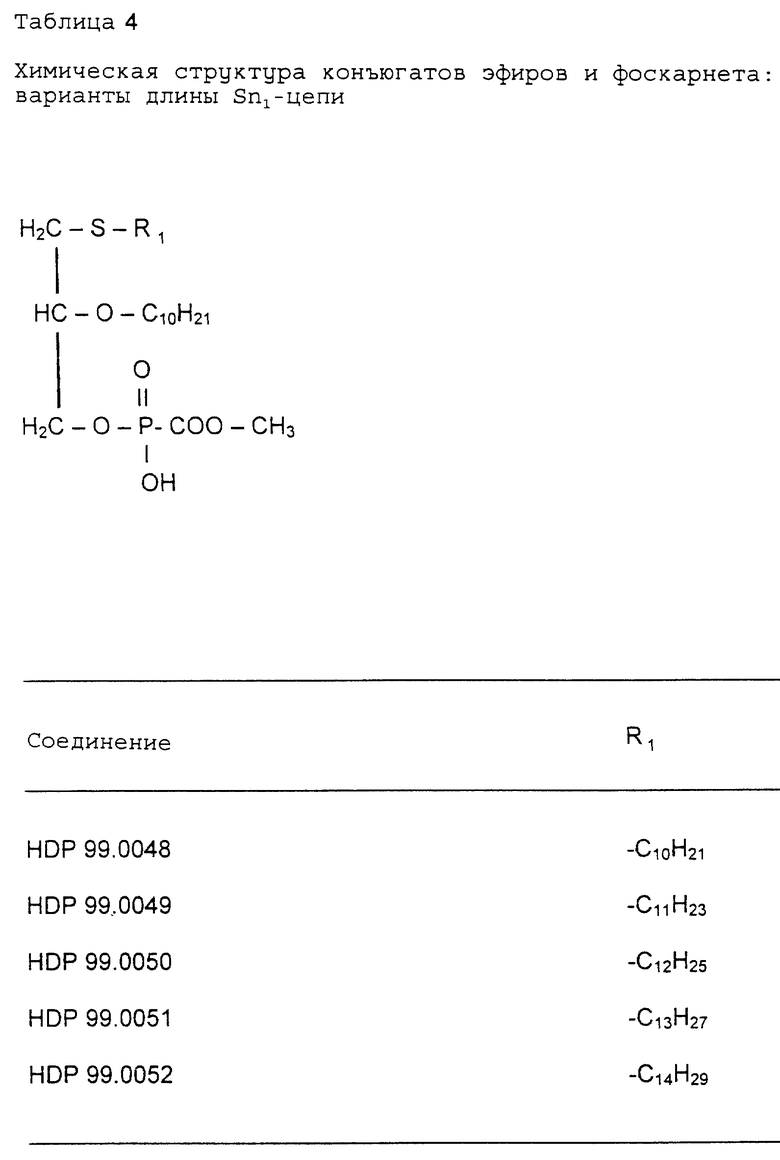
2.1 Взаимосвязь структура - активность: варианты длины Sn1-цепи конъюгаты эфиров и фоскарнета, т.е. производные с различной длиной Sn1 - цепи (табл. 4), были протестированы на антивирусную активность на животной модели MCMV in vivo.
2.1.1 Методы
Модель MCMV описана в приложении A.
2.1.2 Результаты
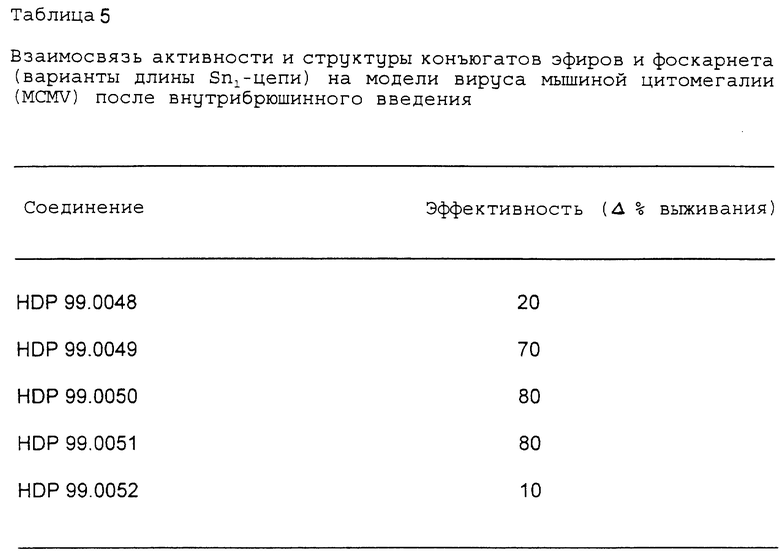
Данные, представленные в табл. 5, иллюстрируют эффективность соединений, протестированных на модели MCMV. Результаты представляют процентное содержание выживших животных (в течение 30 дней и более) в этой системе острой вирусной инфекции. Все значения выражены% выживших крыс по сравнению с контрольной группой с симулированной обработкой. Данные, представленные в таблице 5, указывают на наличие четкой взаимосвязи структуры и активности, зависящей от длины Sn1-алкильной части цепи.
Приложение 3
Антивирусная активность конъюгатов фоскарнета на животной модели вируса мышиной цитомегалии (MCMV) после внутрибрюшинного введения: сравнение с различными соединениями
3.1 Методы
Соединения тестировались на животной модели MCMV, описанной в приложении A.
3.2 Результаты
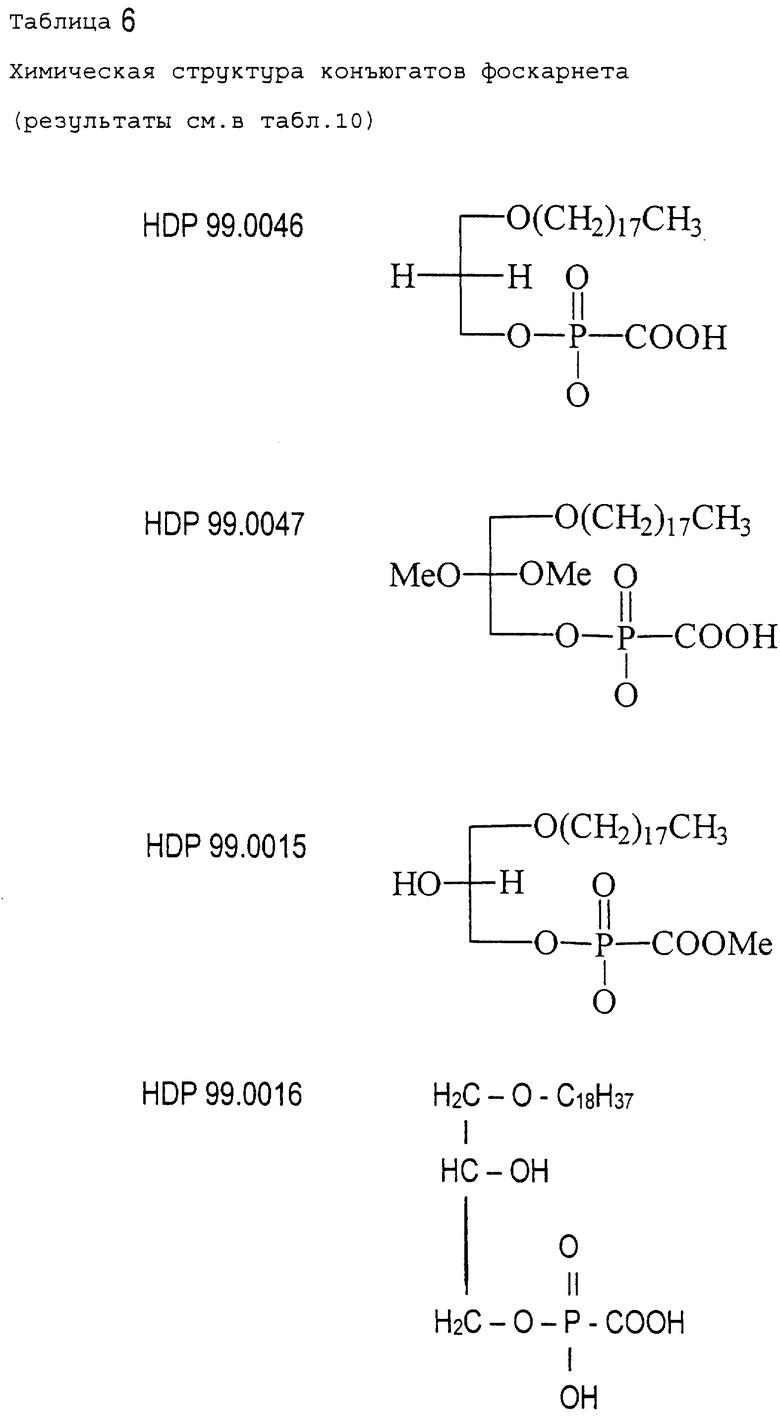
В табл. 6 показана химическая структура соединений, тестированных в этих сериях экспериментов.
Табл. 7 иллюстрирует эффективность различных соединений (HDP 99.0046, HDP 99.0047, HDP 99.0015, HDP 99.0016) в сравнении с HDP 99.0005, HDP 99.0008 и HDP 99.0040.
Показано:
- все соединения, тестированные in vivo на антивирусную активность, не являются активными и/или высокотоксичными,
- напротив соединения HDP 99.0005, HDP 99.0008 и HDP 99.0040 являются необычайно активными в животной модели MCMV. В частности, сравнение результатов для HDP 99.0016 соединения и соединения HDP 99.0040 показало, что тиоэфирное производное HDP 99.0040 является необычайно активным в противоположность O-алкильному аналогу.
Приложение 4
4. Определение токсичности соединения HDP 99.0005 по сравнению с Hostetler соединением HDP 99.0015 при внутривенном введении женской особи мыши NMRI: погибшие/общее количество животных в группе.
4.1 Метод
Женские особи мыши NMRI в возрасте 6-8 недель обрабатывали внутривенно одной дозой в день 0. Параметры крови определяли на анализаторе крови на день +1 и +4. Животные погибли на день +4.
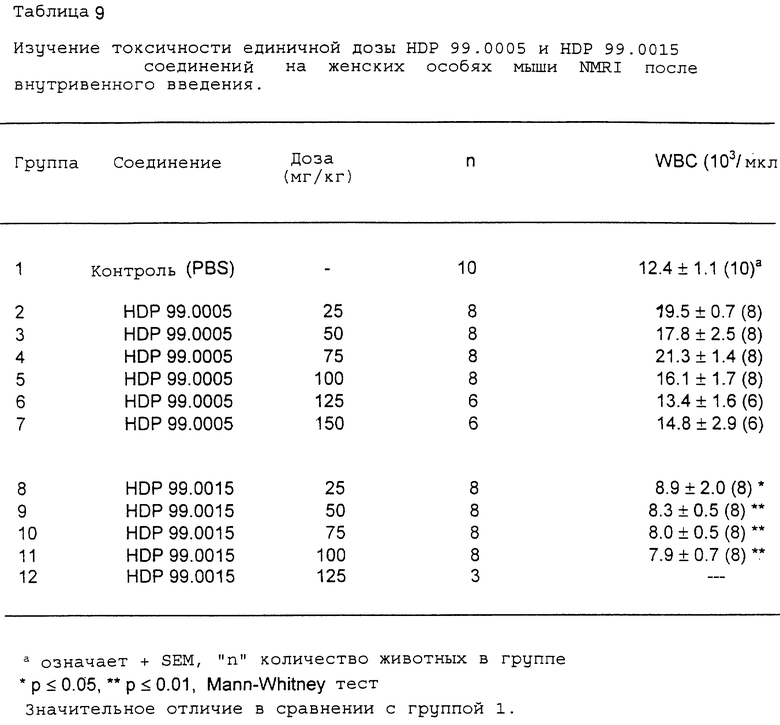
4.2 Результаты
В табл. 8 показана толерантность в зависимости от дозы соединений HDP 99.0005 и HDP 99.0015 после внутривенного введения на женских особях мыши NMRI. В противоположность соединению HDP 99.0005 соединение HDP 99.0015 было высокотоксичным для животных. Наблюдается четкий токсический эффект в зависимости от дозы соединения HDP 99.0015 со 100%-ным смертельным исходом уже через 10 мин после внутривенного введения 100 мг/кг этого соединения. В противоположность этому соединение HDP 99.0005 хорошо переносилось всеми животными в наивысшей тестируемой дозе, т.е. 150 мг/кг.
Такая токсичность в зависимости от дозы HDP 99.0015 наблюдалась уже при минимальном уровне тестируемой дозы, т.е. при 25 мг/кг, на количестве белых кровяных клеток через один день после введения, данные приведены в табл. 9.

Изобретение относится к новым фосфонолипидам карбоновых кислот формулы I и их солям, где R1 обозначает линейный алкил С9-С13, R2 обозначает линейный алкил С8-С12, R3 обозначает водород, линейный алкил С1-С6 или бензил, n = 0-2, m 0-3, которые обладают антивирусной активностью и могут найти применение в медицине. Описано также антивирусное средство, содержащее в качестве активного вещества соединение формулы I. 2 с. и 5 з.п.ф-лы, 9 табл.
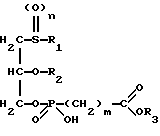
где R1 обозначает линейный алкил C9 - C13;
R2 обозначает линейный алкил C8 - C12;
R3 обозначает водород, линейный алкил C1 - C6, в частности, метил, этил, пропил, бутил, пентил, гексил или бензил;
n = 0, 1 или 2;
m = 0 - 3,
их физиологически приемлемые соли неорганических и органических оснований.
Приоритет по признаку R3 - атом водорода от 15.12.1995.
Приоритет по признаку R3 - алкил или бензил от 22.10.1996.
| Экономайзер | 0 |
|
SU94A1 |
| 1972 |
|
SU416401A1 | |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГВКСИТАМИДОФОСФОНАТОВ | 0 |
|
SU248678A1 |
Авторы
Даты
2001-05-10—Публикация
1996-12-16—Подача