Изобретение относится к эпотилонам С, D, Е и F, их получению и к применению для получения терапевтических средств и средств для защиты растений.
Эпотилоны С и D
Один из объектов настоящего изобретения относится к эпотилонам С и D, которые получают
а) культивированием известным образом микроорганизма Sorangium cellulosum DSM 6773 в присутствии адсорбирующей смолы,
б) отделением адсорбирующей смолы от культуры и промывкой водно-метанольной смесью,
в) элюированием промытой адсорбирующей смолы метанолом и концентрированием элюата до получения сырого экстракта,
г) экстрагированием полученного концентрата этилацетатом, концентрированием экстракта и разделением его метанолом и гексаном,
д) концентрированием метанольной фазы до рафината и фракционированием полученного концентрата на колонке сефадекс,
е) получением фракции, содержащей продукты обмена веществ используемого микроорганизма,
ж) хроматографированием полученной фракции на C18-обращенной фазе с помощью смеси метанол/вода в следующей временной последовательности:
- после первой фракции эпотилоном А и
- второй фракции с эпотилоном В
- третьей фракции с одним первым последующим эпотилоном и
- четвертой фракции с одним вторым последующим эпотилоном и
з1) выделением эпотилона первой последующей фракции и/или
з2) выделением эпотилона второй последующей фракции.
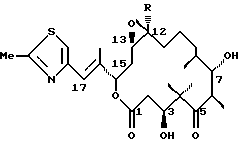
Далее, изобретение относится к эпотилону С суммарной формулы C26H39NО5S, отличающемуся 1H- и 13С-ЯМР-спектрами согласно таблице 1.
Далее, изобретение относится к эпотилону С формулы
эпотилон С, где R=Н.
Далее, изобретение относится к эпотилону [D] суммарной формулы C27H41NО5S, отличающемуся 1H- и 13С-ЯМР-спектрами согласно таблице 1.
Далее, изобретение относится к эпотилону D формулы
эпотилон D, где R=СН3.
Эпотилоны С и D можно использовать для получения соединений нижеуказанной формулы 1, при этом, что касается их дериватизации, то можно сослаться на методы дериватизации, описанные в заявке WO-A-97/19086.
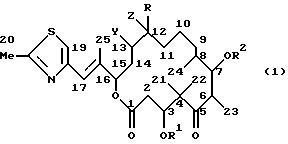
где R обозначает Н, C1-4-алкил;
R1, R2 обозначают H, C1-6-алкил, C1-6-ацилбензоил, C1-4-триалкилсилил, незамещенный или замещенный C1-6-алкоксигруппой, С6-алкилом, оксигруппой или галогеном бензил или фенил, причем два из остатков R1-R5 могут вместе образовать и группу -(СН2)n-, где n=1-6, и содержащиеся в остатках алкильные и ацильные группы представляют собой линейные или разветвленные остатки;
Y и Z одинаковы или различны и означают водород, галоген, такой как F, C1, Вr или J, псевдогалоген, такой как -NCO, -NCS или -N3, ОН, О-(C1-6)-ацил, О-(C1-6)-алкил, О-бензоил, Y и Z могут представлять собой и атом кислорода эпоксида, причем эпотилоны А и В не обсуждаются, или образовать одну из С-С-связей в двойной связи С=С.
Например, 12,13-двойную связь можно избирательно
- гидрировать, например, каталитическим путем или с помощью диимина, в результате чего получают соединение формулы 1, где Y=Z=H,
- эпоксидировать, например, диметилдиоксираном или надкислотой, в результате чего получают соединение формулы 1, где Y и Z = -О- или
- превратить в дигалогениды, дипсевдогалогениды или диазиды, в результате чего получают соединение формулы 1, где Y и Z обозначают галоген, псевдогалоген или N3.
Эпотилоны Е и F
Следующий объект изобретения относится к биотрансформанту эпотилона А, получаемому
а) культивированием микроорганизма Sorangium cellulosum DSM 6773 в присутствии адсорбирующей смолы известным образом, отделением культуры от адсорбирующей смолы и, в случает необходимости, добавлением ко всему количеству или к части отделенной культуры метанольного раствора эпотилона А,
б) инкубированием культуры с добавленным эпотилоном А с последующим добавлением адсорбирующей смолы,
в) отделением адсорбирующей смолы от культуры, элюированием метанолом и концентрированием элюата до получения сырого экстракта,
г) разделением сырого экстракта этилацетатом и водой, отделением этилацетатной фазы с последующим ее концентрированием до получения масла,
д) хроматографией масла на обращенной фазе при следующих условиях:
материал колонки: Нуклеосил 100 С-18, 7 мкм
размеры колонки 250 х 16 мм
растворитель: метанол/вода = 60:40
скорость протекания растворителя 10 мл/мин
с последующим отделением содержащих биотрансформант фракций, детектируемых гашением флуоресценции при 254 нм, при значении Rt 20 мин, и выделением биотрансформанта.
Далее, изобретение относится к подобному биотрансформанту эпотилона А, который получают тем, что на стадии (а) отделяют культуру в возрасте 3-4 или более суток.
Далее, изобретение относится к подобному биотрансформанту эпотилона А, который получают тем, что на стадии (б) инкубируют в течение 1-2 или более суток.
Далее, изобретение относится к соединению суммарной формулы С26Н39NO7S, отличающемуся следующим 1H-ЯМР-спектром (300 МГц, CDC13): δ 2.38 (2-Ha), 2.51 (2-Нb), 4.17 (3-Н), 3.19 (6-Н), 3.74 (7-Н), 1.30-1.70 (8-Н, 9-Н2, 10-H2, 11-H2), 2.89 (12-Н), 3.00 (13-Н), 1.88 (14-На), 2.07 (14-Нb), 5.40 (15-Н), 6.57 (17-Н), 7.08 (19-Н), 4.85 (21-H2), 1.05 (22-Н3), 1.32 (23-Н3), 1.17 (24-Н3), 0.97 (25-Н3), 2.04 (27-Н3).
Далее изобретение относится к соединению (эпотилон Е) формулы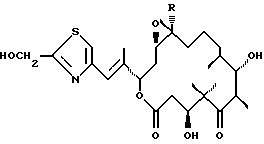
эпотилон Е, где R=Н.
Другой объект изобретения относится к биотрансформанту эпотилона В, получаемому
а) культивированием микроорганизма Sorangium cellulosum DSM 6773 в присутствии адсорбирующей смолы известным образом, отделением культуры от адсорбирующей смолы и, в случае необходимости, добавлением ко всему количеству или к части отделенной культуры метанольного раствора эпотилона В,
б) инкубированием культуры с добавленным эпотилоном B с последующим добавлением адсорбирующей смолы,
в) отделением адсорбирующей смолы от культуры элюированием метанолом и концентрированием элюата до получения сырого экстракта,
г) разделением сырого экстракта этилацетатом и водой, отделением этилацетатной фазы с последующим ее концентрированием до получения масла,
д) хроматографией масла на обращенной фазе при следующих условиях:
материал колонки: Нуклеосил 100 С-18, 7 мкм
размеры колонки 250 х 4 мм
растворитель: метанол/вода = 60:40
скорость протекания растворителя 10 мл/мин
с последующим отделением содержащих биотрансформант фракций, детектируемых гашением флуоресценции при 254 нм, при значении Rt 24,5 мин, и выделением биотрансформанта.
Далее, изобретение относится к подобному биотрансформанту эпотилона В, который получают тем, что на стадии (а) отделяют культуру в возрасте 3-4 или более суток.
Далее, изобретение относится к подобному биотрансформанту эпотилона В, который получают тем, что на стадии (б) инкубируют в течение 1-2 или более суток.
Далее, изобретение относится к соединению суммарной формулы C27H41NО7S, отличающемуся следующим 1H-ЯМР-спектром (300 МГц, СDС13): δ 2.37 (2-На), 2.52 (2-Нb), 4.20 (3-Н), 3.27 (6-Н), 3.74 (7-Н), 1.30-1.70 (8-Н, 9-Н2, 10-Н2, 11-H2), 2.78 (13-Н), 1.91 (14-Н), 2.06 (14-Нb), 5.42 (15-Н), 6.58 (17-Н), 7.10 (19-Н), 4.89 (21-H2), 1.05 (22-Н3), 1.26 (23-Н3), 1.14 (24-Н3), 0.98 (25-Н3), 1.35 (26-Н3), 2.06 (27-Н3).
Далее, изобретение относится к соединению (эпотилон F) формулы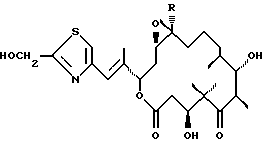
эпотилон F, где R=СН3.
Получение предлагаемых эпотилонов и средства, их содержащие
Предлагаемые эпотилоны получают вышеуказанными путями.
Далее, изобретение относится к средствам, используемым для защиты растений в сельском хозяйстве, в лесном хозяйстве и/или в садоводстве и состоящим из одного или нескольких указанных выше эпотилонов С, D, Е и F или одного или нескольких указанных выше эпотилонов наряду с одним или несколькими обычными носителями и/или разбавителями.
Наконец, изобретение относится к терапевтическим средствам, состоящим из одного или нескольких указанных выше соединений наряду с одним или несколькими обычными носителями и/или разбавителями. В частности, эти средства могут иметь цитостатическую активность и/или вызывать иммуносупрессию и/или их можно использовать для лечения злокачественных опухолей, причем предпочтительно их применяют в качестве цитостатиков.
Изобретение иллюстрируется нижеприведенными примерами выполнения.
Пример 1. Эпотилоны С и D.
А. Штамм-продуцент и условия культивирования, соответствующие эпотилону, основной патент DE-B-4138042.
Б. Получение эпотилонов с помощью штамма DSM 6773.
В соответствии с основным патентом выращивают 75 л культуры и используют ее для прививки продукционного ферментатора 700 л производственной среды, содержащей 0,8% крахмала, 0,2% глюкозы, 0,2% соевой муки, 0,2% дрожжевого экстракта, 0,1% CaCl2•2H20, 0,1% MgSO4•7H2O, 8 мг/л Fe-ЭДТА (рН 7.4) и, если необходимо, 15 л адсорбирующей смолы Amberlite XAD-16. Процесс ферментации проводят в течение 7-10 суток при 30oС с аэрацией 0,1 нл/м3. Регулированием числа оборотов значение рO2 поддерживают на уровне 30%.
В. Выделение эпотилонов.
Адсорбирующую смолу отделяют от культуры с помощью технического фильтра (нутча) 0,7 м2 с размером отверстий 100 меш, после чего ее освобождают от полярных примесей промывкой 3 объемами смеси воды и метанола (2:1). Элюированием метанолом (4 объема) получают сырой экстракт, который в вакууме выпаривают до появления водной фазы. Последнюю трижды экстрагируют одинаковым объемом этилацетата. В результате выпаривания органической фазы получают 240 г сырого экстракта, который разделяют метанолом и гептаном для отделения липофильных примесей. Потом выпариванием метанольной фазы в вакууме получают 180 г рафината, который тремя порциями фракционируют на колонке сефадекс LH-20 (колонка 20 х 100 см, 20 мл/мин метанола). Получаемые эпотилоны содержатся в элюированной фракции (время удерживания Rt 240-300 мин) в количестве 72 г. Для разделения эпотилонов хроматографируют тремя порциями на Lichrosorb RP-18 (размер частиц 15 мкм, размер колонки 10 х 40 см, растворитель - метанол/вода 65:35, 180 мл/мин). После эпотилонов А и В элюируют эпотилон С (Rt=90-95 мин) и эпотилон D (Rt=100-110 мин), выход каждого после выпаривания в вакууме составляет 0,3 г в виде бесцветного масла.
Г. Физические свойства.
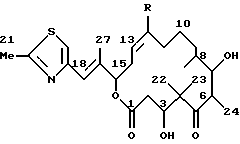
эпотилон С, где R=Н,
эпотилон D, где R=СН3.
Эпотилон С
С26Н39NО5S [477].
ESI-MC (положительные ионы): 478.5 для [М+Н]+.
1H- и 13С-ЯМР-спектры указаны в таблице с данными ЯМР-спектроскопии.
TCX:Rf = 0,82.
Алюминиевая фольга для тонкослойной хроматографии типа 60 F 254 фирмы Мерк, растворитель - дихлорметан/метанол = 9:1.
Детекция: гашение флуоресценции при 254 нм. Обрызгивают реактивом на основе ванилина и серной кислоты, при нагреве до 120oС - окрашивание в сине-серый цвет.
ВЭЖХ: Rt = 11,5 мин.
Колонка: Нуклеосил 100 С-18, размер частиц 7 мкм, размер колонки 125 х 4 мм.
Растворитель: метанол/вода = 65:35.
Скорость протекания растворителя 1 мл/мин.
Детекция: светодиодная система.
Эпотилон D
C27H41NО5S [491].
ESI-MC (положительные ионы): 492,5 для [М+Н]+.
1Н- и 13С-ЯМР-спектры указаны в таблице с данными ЯМР-спектроскопии.
TCX:Rf = 0,82.
Алюминиевая фольга для тонкослойной хроматографии типа 60 F 254 фирмы Мерк, растворитель - дихлорметан/метанол = 9:1.
Детекция: гашение флуоресценции при 254 нм. Обрызгивают реактивом на основе ванилина и серной кислоты, при нагреве до 120oС - окрашивание в сине-серый цвет.
ВЭЖХ: Rt = 15,3 мин.
Колонка: Нуклеосил 100 С-18, размер частиц 7 мкм, размер колонки 125 х 4 мм.
Растворитель: метанол/вода = 65:35.
Скорость протекания растворителя 1 мл/мин.
Детекция: светодиодная система.
Пример 2. Эпотилон А и 12,13-бисэпи-эпотилон А из эпотилона С.
50 мг эпотилона А растворяют в 1,5 мл ацетона, после чего добавляют 1,5 мл 0,07-молярного раствора диметилдиоксирана в ацетоне. После отстаивания в течение 6 часов при комнатной температуре выпаривают раствор в вакууме и отделяют эпотилоны друг от друга препаративной ВЭЖХ на силикагеле (растворитель - трет-бутилметиловый эфир/петролейный эфир/метанол, 33:66:1).
Выход 25 мг эпотилона A, Rt = 3,5 мин (аналит. ВЭЖХ, размер частиц 7 мкм, размер колонки 4 х 250 мм, растворитель - как указано выше, скорость протекания растворителя 1,5 мл/мин) и
20 мг 12, 13-бисэпи-эпотилона А, Rt=3,7 мин, ESI-MC (положительные ионы): m/z = 494 [M+H]+.
1H-ЯМР-спектроскопия в метаноле [D4], выбранные сигналы: δ 4.32 (3-Н), 3.79 (7-Н), 3.06 (12-Н), 3.16 (13-Н), 5.54 (15-Н), 6.69 (17-Н), 1.20 (22-Н), 1.45 (23-Н).
12,13-бисэпи-эпотилон А, где R=Н.
Пример 3. Эпотилоны Е и F - новые продукты биотрансформации эпотилонов А и В соответственно.
Штамм-продуцент
В июле 1985 г. на фирме "Гезельшафт фюр Биотехнологише Форшунг" удалось выделить из пробы почвы, взятой на берегу р. Замбези, штамм-продуцент Sorangium cellulosum So ce 90. 28 октября 1991 г. он был депонирован за номером DSM 6773 в Германской коллекции микроорганизмов.
Штамм-продуцент и условия его культивирования описаны авторами G. Hofle, N. Bedorf, К. Gerth, H. Reichenbach в "Erothilone, deren Herstellungsverfahren sowie sie enthaltende Mittel", DE 4138042 Al, вылож. 27 мая 1993.
Образование эпотилонов Е и F в результате ферментации
Типичный процесс ферментации проводят следующим образом. В биореактор объемом 100 л загружают 60 л среды (0,8% крахмала, 0,2% глюкозы, 0,2% соевой муки, 0,2% дрожжевого экстракта, 0,1% CaCl2•2H2O, 0,1% MgSО4•7H2O, 8 мг/л Fe-ЭДТА; рН 7,4). Затем еще добавляют 2% адсорбирующей смолы (XAD-16, ф-ы Rohm & Haas). Среду стерилизуют в автоклаве (2 часа, 120oС). Засевают 10 л предварительной культуры, выращенной в той же среде (с добавлением 50 мМ буфера HEPES, рН 7,4) в встряхиваемой колбе (160 об/мин, 30oС). Ферментируют при 32oС при скорости вращения мешалки 500 об/мин и аэрации 0,2 нл/м3 в час, причем значение рН поддерживают на уровне 7,4 добавлением раствора едкого кали. Процесс ферментации проводят в течение 7-10 суток. Образующиеся в течение фермантации эпотилоны непрерывно связываются с адсорбирующей смолой. После отделения культуральной жидкости, например, отсевом с помощью технического фильтра смолу промывают водой (3 объемами) и элюируют метанолом (4 объемами). Элюат концентрируют досуха и растворяют в 700 мл метанола.
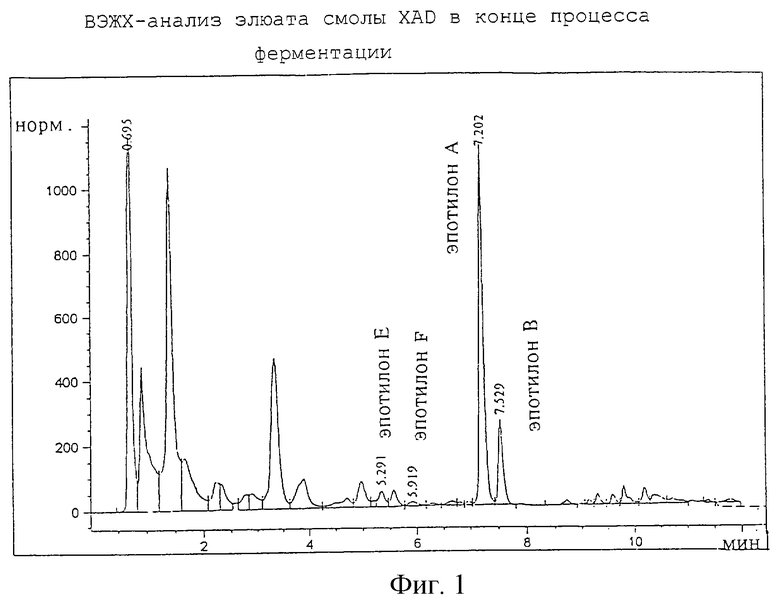
ВЭЖХ-анализ элюата XAD
По сравнению с исходным объемом реактора (70 л) элюат сконцентрирован в соотношении 100: 1. Анализ элюата проводят посредством установки ВЭЖХ 1090 фирмы Hewlett Packard. Для разделения содержащихся в элюате веществ используют колонку типа Microbore (125/2 нуклеосил 120-5 C18) фирмы Machery-Nagel (г. Дюрен). Элюируют смесью воды и ацетонитрила с градиентом, начиная с соотношения 75: 25 и заканчивая через 5,5 мин соотношением 50:50. Последнее соотношение поддерживают до седьмой минуты с последующим повышением соотношения вплоть до десятой минуты до 100% ацетонитрила.
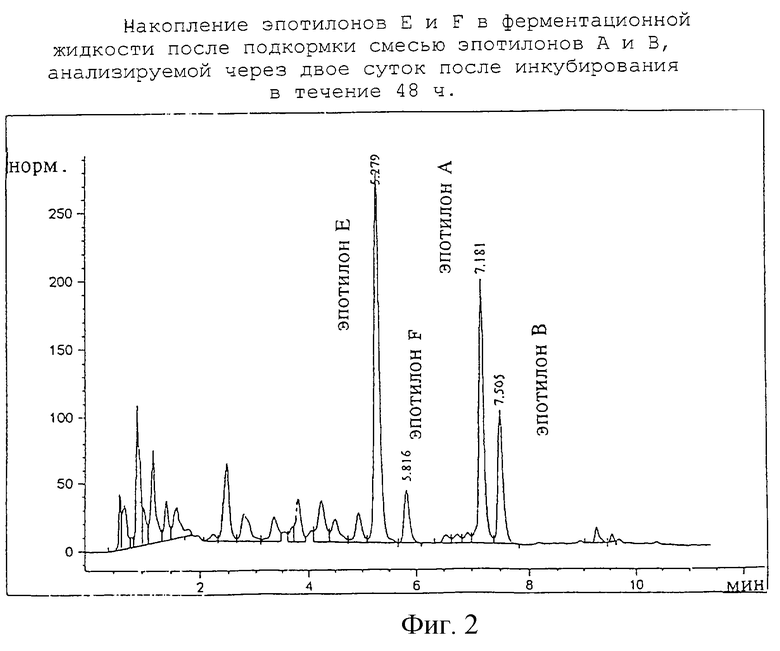
Спектры измеряют при длине волны 250 нм и при ширине полосы 4 нм. Спектры светодиодной системы измеряют в диапазоне длин волн 200 - 400 нм. Элюат смолы XAD содержит два новых вещества при значениях Rt 5,29, Rt 5,91 соответственно, адсорбционные спектры которых идентичны спектрам эпотилонов А и В соответственно (см. фиг.1), причем эпотилон Е соответствует эпотилону А, а эпотилон F - эпотилону В. Эти вещества образуются в данных условиях ферментации всего лишь в микроколичествах.
Биотрансформация эпотилонов А и В до эпотилонов Е и F
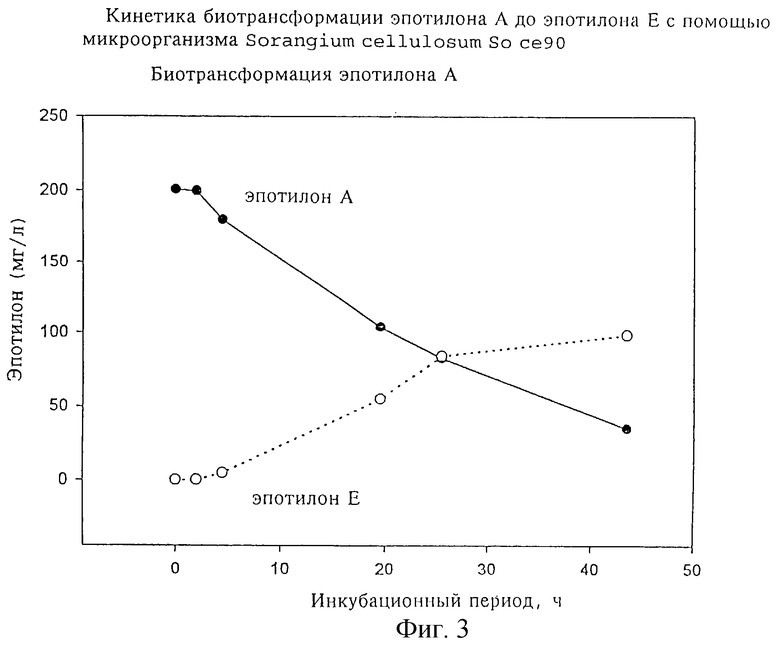
Для целенаправленной биотрансформации эпотилонов А и В используют 4-суточную фиксированную на адсорбирующей смоле культуру (500 мл) микроорганизма So се 90. Оставляя XAD на месте, переводят 250 мл этой культуры в стерильную однолитровую колбу Эрленмейера. Затем добавляют метанольный раствор смеси 36 мг эпотилона А и 14 мг эпотилона В, после чего инкубируют колбу в качалке в течение двух суток при 30oС и со скоростью вращения 200 об/мин. Образование эпотилонов Е и F определяют анализом непосредственно 10 мкл центрифугированной надкультуральной жидкости (см. фиг.2). Превращение эпотилонов происходит только в присутствии клеток и зависит от плотности клеток и времени. Кинетика процесса превращения для эпотилона А изображена на фиг. 3.
Выделение эпотилонов Е и F
Для выделения эпотилонов Е и F собирают исходные смеси из трех колб, использованных в вышеописанном процессе биотрансформации, и встряхивают их в течение одного часа вместе с 20 мл смолы XAD-16. Затем последнюю отсеивают и элюируют 200 мл метанола. Потом элюат выпаривают в вакууме с получением 1,7 г сырого экстракта, который разделяют 30 мл этилацетата и 100 мл воды. Из этилацетатной фазы путем выпаривания в вакууме получают 330 мг маслянистого остатка, который 5 потоками хроматографируют на колонке типа RP-18 размером 250 х 20 мм (растворитель - смесь метанола и воды в соотношении 58:42, детекция при 254 нм).
Выход эпотилона Е 50 мг, эпотилона F 10 мг.
Биологическое действие эпотилона Е
Определяют концентрацию эпотилона Е, уменьшающую рост клеточной культуры на 50% (IС50), и сравнивают ее с соответствующей концентрацией эпотилона А (см. таблицу 2).
Эпотилон Е
C26H39NО7S [509].
ESI-MC (положительные ионы): 510.3 для [М+Н]+.
TCX: Rf = 0,58.
Алюминиевая фольга для тонкослойной хроматографии типа 60 F 254 фирмы Мерк, растворитель - дихлорметан/метанол = 9:1.
Детекция: гашение флуоресценции при 254 нм. Обрызгивают реактивом на основе ванилина и серной кислоты, при нагреве до 120oС - окрашивание в сине-серый цвет.
ВЭЖХ: Rt = 5,0 мин.
Колонка: Нуклеосил 100 С-18, размер частиц 7 мкм, размер колонки 250 х 4 мм.
Растворитель: метанол/вода = 60:40.
Скорость протекания растворителя 1,2 мл/мин.
Детекция: светодиодная система.
Результаты 1H-ЯМР-спектроскопии (300 МГц, СDС13): δ 2.38 (2-На), 2.51 (2-Нb), 4.17 (3-Н), 3.19 (6-Н), 3.74 (7-Н), 1.30-1.70 (8-Н, 9-H2, 10-H2, 11-Н2), 2.89 (12-Н), 3.00 (13-Н), 1.88 (14-На), 2.07 (14-Нb), 5.40 (15-Н), 6.57 (17-Н), 7.08 (19-Н), 4.85 (21-Н2), 1.05 (22-Н3), 1.32 (23-Н3), 1.17 (24-Н3), 0.97 (25-Н3), 2.04 (27-Н3).
Эпотилон F
C21H41NO7S [523].
ESI-MC (положительные ионы): 524.5 для [М+Н]+.
TCX: Rf = 0,58.
Алюминиевая фольга для тонкослойной хроматографии типа 60 F 254 фирмы Мерк, растворитель - дихлорметан/метанол = 9:1.
Детекция: гашение флуоресценции при 254 нм. Обрызгивают реактивом на основе ванилина и серной кислоты, при нагреве до 120oС - окрашивание в сине-серый цвет.
ВЭЖХ: Rt = 5,4 мин.
Колонка: Нуклеосил 100 С-18, размер частиц 7 мкм, размер колонки 250 х 4 мм.
Растворитель: метанол/вода = 60:40.
Скорость протекания растворителя 1,2 мл/мин.
Детекция: светодиодная система.
Результаты 1H-ЯМР-спектроскопии (300 МГц, СDС13): δ 2.37 (2-На), 2.52 (2-Нb), 4.20 (3-Н), 3.27 (6-Н), 3.74 (7-Н), 1.30-1.70 (8-Н, 9-Н2, 10-Н2, 11-H2), 2.78 (13-Н), 1.91 (14-Н), 2.06 (14-Нb), 5.42 (15-Н), 6.58 (17-Н), 7.10 (19-Н), 4.89 (21-H2), 1.05 (22-Н3), 1.26 (23-Н3), 1.14 (24-Н3), 0.98 (25-Н3), 1.35 (26-Н3), 2.06 (27-Н3).
Пример 4. Получение эпотилонов Е и F биотрансформацией с помощью микроорганизма Sorangium cellulosum So ce 90.
1) Проведение процесса биотрансформации.
Для проведения процесса биотрансформации используют культуру микроорганизма Sorangium cellulosum So ce 90, которую 4 суток встряхивали в присутствии 2% адсорбирующей смолы XAD 16 фирмы Rohm und Haas, г. Франкфурт-на-Майне, при 30oС и 160 об/мин. В состав культуральной среды входили следующие компоненты, г/л дистиллированной воды: крахмал картофельный (фирмы Maizena) 8, глюкоза (фирмы Maizena) 8, мука соевая обезжиренная 2, дрожжевой экстракт (фирмы Маrсоr) 2, Fe(III)-натриевая соль этилендиаминтетрауксусной кислоты 0,008, MgSO4•7H2О 1, CaCl2•2H2О 1, HEPES 11,5. До обработки среды в автоклаве раствором едкого кали устанавливается значение рН 7,4. Смолу XAD отсевают от культуры, просеивая ее через сито из высококачественной стали (диаметр отверстий 200 мкм). Бактерии осаждают центрифугированием при 10000 об/мин в течение 10 мин, а полученный шарообразный осадок повторно ресуспендируют в 1/5 надкультуральной жидкости. В концентрированную суспензию бактерий добавляют соответственно эпотилон А и эпотилон В в виде метанольного раствора с концентрацией 0,5 г/л. Культуру продолжают культивировать, как указано выше. Для анализа степени биотрансформации в нужное время отбирают пробу в 1 мл, добавляют 0,1 мл смолы XAD и встряхивают пробу 30 мин при 30oС. Элюирование смолы XAD производится с помощью метанола. Элюат выпаривают досуха, а затем растворяют в 0,2 мл метанола. Полученная проба подвергается ВЭЖХ.
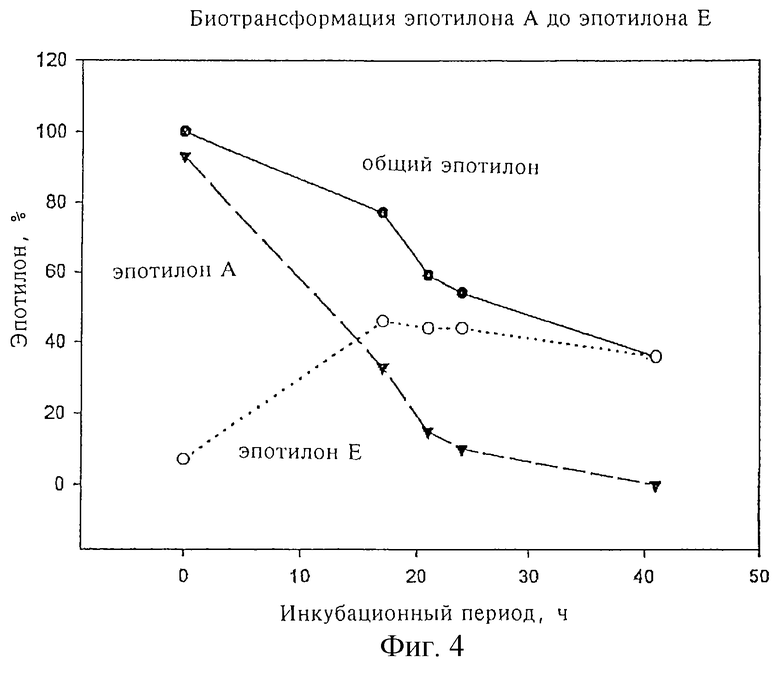
Фиг. 4 отражает кинетику биотрансформации эпотилона А до эпотилона Е; фиг.5 - кинетику биотрансформации эпотилона В до эпотилона F.
2) Получение эпотилона Е биотрансформацией 1 г эпотилона А.
Штамм Sorangium cellulosum So се 90 в течение 4 суток выращивают в 8,5 л вышеуказанной среды (однако без добавки смолы XAD) в 10-литровом биореакторе при 30oС со скоростью вращения мешалки 150 об/мин и при аэрации 0,1 об./об. в мин.
Затем культуру методом тангенциальной фильтрации концентрируют до 3 л. Для этого используют 0,6 м2 мембраны с размером пор 0,3 мкм.
Сконцентрированную культуру переводят в 4-литровый биореактор, после чего добавляют метанольный раствор 1 г эпотилона А в 10 мл метанола. Затем продолжают культивировать культуру в течение 21,5 ч, причем температура составляет 32oС, скорость вращения мешалки 455 об/мин и аэрацию проводят со скоростью 6 л/мин. Во время сбора клеток добавляют 100 мл смолы XAD и продолжают инкубировать в течение 1 ч. Потом смолу отсевом отделяют от клеток и элюируют достаточным количеством метанола. Наконец сконцентрированный элюат анализируют методом ВЭЖХ.
Баланс биотрансформации.
Исходное количество эпотилона А 100 мг = 100%
Количество эпотилона А, обнаруженное через 21,5 ч 53,7 мг = 5,4%
Количество эпотилона Е, образовавшееся через 21,5 ч 661,4 мг = 66,1%
Количество полностью разложившегося эпотилона А 28,5%
Пример 5.
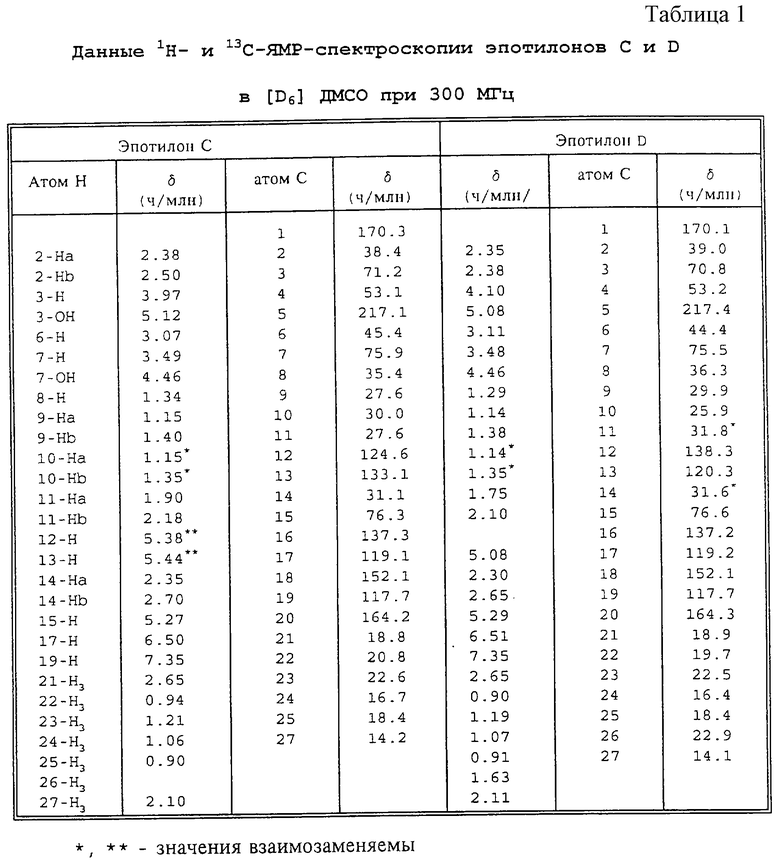
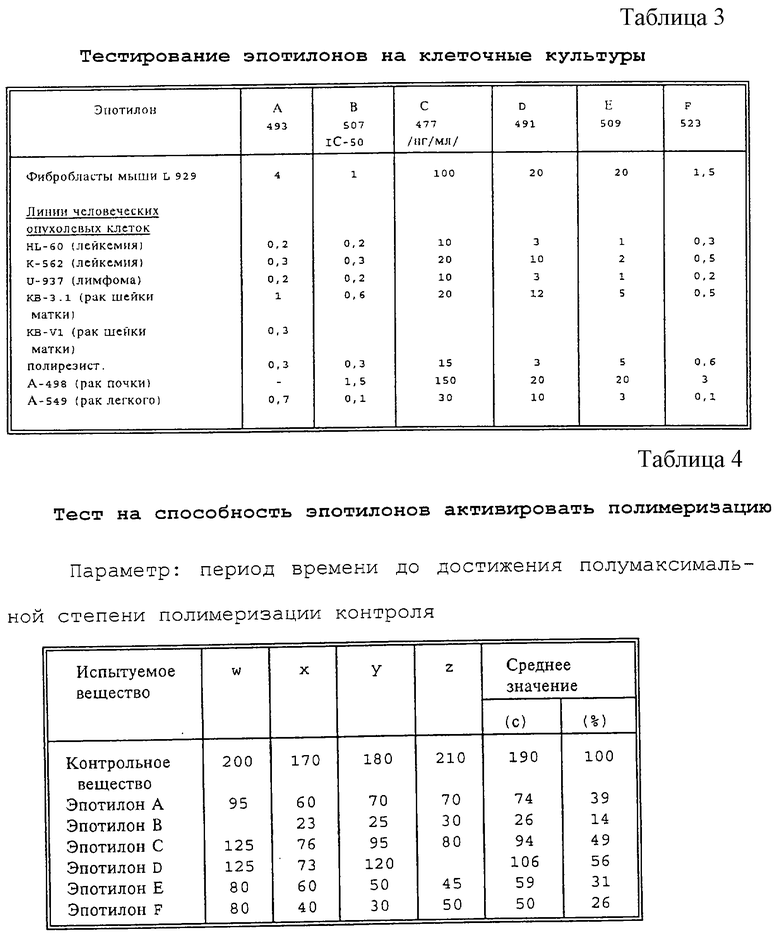
Предлагаемые согласно изобретению эпотилоны испытывали на клеточных культурах (см.таблицу 3), а также активацию полимеризации (см. таблицу 4).
Параметр: период времени до достижения полумаксимальной степени полимеризации контроля
Условия стандартного теста: 0,9 мг тубулина/мл, концентрация пробы 1 мкМ.
Тест на способность эпотилонов активировать процесс полимеризации проводили in vitro с использованием очищенного тубулина из головного мозга свиньи. Результаты теста анализируют методом фотометрии. Такие активирующие полимеризацию вещества, как эпотилон, сокращают время, необходимое для достижения полумаксимальной степени полимеризации, т.е. чем меньше период времени, тем эффективнее данное соединение. Символы w, х, у, z означают четыре независимых опыта, а относительная эффективность соединений указана в последней колонке. Она выражена в процентах относительно действия контрольного вещества. И здесь наименьшее значение свидетельствует о наивысшей эффективности. Приведенные в таблице 3 результаты довольно точно соответствуют результатам, полученным с клеточными культурами.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЕ В БОКОВОЙ ЦЕПИ ЭПОТИЛОНЫ | 1998 |
|
RU2201932C2 |
| С-21 МОДИФИЦИРОВАННЫЕ ЭПОТИЛОНЫ | 2000 |
|
RU2253652C2 |
| СПОСОБ ОБНАРУЖЕНИЯ МУТАЦИЙ ДЕЗОКСИРИБОНУКЛЕИНОВЫХ КИСЛОТ С ПОМОЩЬЮ РЕСТРИКТАЗ И НАБОР ДЛЯ ПРОВЕДЕНИЯ СПОСОБА | 1997 |
|
RU2193069C2 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ПОЛУЧЕНИЯ ЭПОТИЛОНОВ, КРИСТАЛЛИЧЕСКАЯ ФОРМА ЭПОТИЛОНА B И ЕЕ ИСПОЛЬЗОВАНИЕ | 1999 |
|
RU2268306C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ И ОЧИСТКИ ЭПОТИЛОНА B И РЕНТГЕНОСТРУКТУРНЫЕ КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ ЭПОТИЛОНА В | 2003 |
|
RU2368661C2 |
| ГИБРИДНЫЙ БЕЛОК ДЛЯ ИНГИБИРОВАНИЯ ДЕГРАНУЛЯЦИИ МАСТОЦИТОВ И ЕГО ПРИМЕНЕНИЕ | 1999 |
|
RU2214420C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ЭПОТИЛОНОВ ИЗ РЕАКЦИОННОЙ СМЕСИ И ДЕСОРБЦИИ ИЗ СИНТЕТИЧЕСКОЙ СМОЛЫ (ВАРИАНТЫ), ПРИМЕНЕНИЕ СЛАБОПОЛЯРНОГО ИЛИ АПОЛЯРНОГО РАСТВОРИТЕЛЯ ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБОВ | 2001 |
|
RU2285007C2 |
| ИНДУЦИРУЕМЫЙ ТЕПЛОМ ПРОМОТОР И ЕГО ИСПОЛЬЗОВАНИЕ | 2000 |
|
RU2230786C2 |
| Способ получения низших @ - @ -аминокислот | 1980 |
|
SU1069622A3 |
| Способ выделения выращенных клеток микроорганизмов из питательного бульона | 1990 |
|
SU1836420A3 |


Изобретение относится к новым эпотилонам формулы 1, где R=СН3, Н. Также эти соединения используют для защиты растений в сельском и лесном хозяйстве и/или садоводстве, а также в качестве терапевтического средства, в качестве цитостатического средства. 5 с. и 12 з.п. ф-лы, 5 ил., 4 табл.


где R=Н, СН3.
где R=Н, СН3.
8. Эпотилон по п.6, представляющий собой эпотилон F при R=СН3
9. Эпотилон по п.7 суммарной формулы C26H39NO7S, отличающийся следующим 1H-ЯМР-спектром (300 МГц, CDCl3): δ=2.38 (2-Ha), 2.51 (2-Нb), 4.17 (3-Н), 3.19 (6-Н), 3.74 (7-Н), 1.30-1.70 (8-H, 9-Н2, 10-Н2, 11-Н2), 2.89 (12-Н), 3.00 (13-Н), 1.88 (14-Нa), 2.07 (14-Нb), 5.40 (15-Н), 6.57 (17-Н), 7.08 (19-Н), 4.85 (21-Н2), 1.05 (22-Н3), 1.32 (23-Н3), 1.17 (24-Н3), 0.97 (25-Н3), 2.04 (27-Н3).
Приоритет по пунктам:
18.11.1996 по пп.1-5, 17;
25.02.1997 по пп.6-10;
18.11.1997 по пп.11-17.
| WO 9310121 А, 27.05.1993 | |||
| WO 9719086 A1, 29.05.1997 | |||
| ПРОИЗВОДНЫЕ ТИАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ БОРЬБЫ С ГРИБКАМИ | 1990 |
|
RU2049782C1 |
Авторы
Даты
2003-02-10—Публикация
1997-11-18—Подача