Изобретение относится к способу обнаружения мутаций дезоксирибонуклеиновых кислот (ДНК), причем одна ДНК амплифицируется с помощью полимеразной цепной реакции (ПЦР), а получаемые в результате ампликоны разрезаются одним или более рестрикционными ферментами (рестриктазами) и подвергаются обнаружению, способ отличается тем, что используют две меченые затравки, причем метка первых затравок служит для связывания ампликонов с одним или более носителями, а метка вторых затравок - для обнаружения. Далее изобретение относится к набору для проведения вышеназванного способа, отличающемуся тем, что он включает две меченые затравки.
В процессе выявления человеческого генома показано значение дефектных генов в возникновении множества заболеваний. Так, например, при многих видах рака, при таких заболеваниях, как муковисцидоз, болезнь Альцгеймера, а также при развитии тромбозов наблюдаются изменения генетической информации, которые в определенных случаях вызывают возникновение названных заболеваний. Поэтому в медицинской диагностике все большее значение приобретает обнаружение подобных мутаций.
В настоящее время мутации часто обнаруживают с помощью так называемого рестрикционного анализа. При этом пользуются рестриктазами, способными распознавать двухцепочечную ДНК по определенным ее последовательностям и расщеплять ее в соответствующем сайте. В настоящее время идентифицировано около 500 различных рестриктаз более чем со 100 характерными для них сайтами расщепления. Эту высокую специфичность используют для обнаружения дефектов, ибо в пределы такого сайта расщепления фермента часто входит мутация, вызывающая болезненное изменение организма. Вследствие мутации сайт настолько изменяется, что исследуемая цепь не поддается расщеплению. В других случаях сайт, поддающийся расщеплению данным ферментом, появляется лишь в результате мутации, которая ранее не имела места.
Для проведения стандартного анализа исследуемая геномная ДНК подвергается ПЦР, с помощью которой удается скопировать нужный участок ДНК, в пределах которого находится мутация. В этих целях используют так называемые праймеры - участки ДНК - (затравки), определяющие начало и конец амплифицированного участка ДНК. Далее, для проведения анализа нужны еще свободные нуклеотиды - фрагменты ДНК и полимераза - фермент, катализирующий образование исследуемых и копируемых сегментов ДНК. Далее, для проведения ПЦР используют еще прибор, термостат, обеспечивающий нужный температурный режим ПЦР.
После копирования исследуемого сегмента его расщепляют с помощью соответствующей рестриктазы. Последняя при определенных условиях после мутации расщепляет специфическую последовательность ДНК или же расщепления ДНК не происходит. В зависимости от концентрации фермента этот процесс может продолжаться несколько часов.
До сих пор для анализа продукта не используют метод электрофореза в агарозном геле. Для этого в буферном растворе путем нагревания растворяют полимерагарозу и после охлаждения гелеобразный полисахарид выливают в прибор для проведения электрофореза. После полного охлаждения геля на него наносят пробы и при приложении разности потенциалов фрагменты ДНК начинают перемещаться в агарозном геле, причем степень перемещения зависит от их размера.
Фрагменты ДНК можно визуализировать, например, добавив флуоресцирующие интеркалаты, т.е. вещества, которые внедряются во фрагменты ДНК и становятся видимыми под действием УФ-излучения. Мутацию удается диагностицировать в том случае, когда в геле наблюдается специфическое изменение поведения относительно рестриктированного образца.
Для обнаружения мутации служат наряду с копированием интересующего фрагмента ДНК, сложные гель-электрофоретические методы, связанные с приготовлением соответствующих гелей, нанесением проб и периодами ожидания между отдельными операциями гель-электрофореза.
Указанные способы требуют больших затрат времени, они сложны и, следовательно, дорогостоящи.
Задачей изобретения является разработка способа и соответствующего набора для его осуществления, с помощью которых удается обнаружить вышеописанные мутации просто и с высокой степенью воспроизводимости и прохождения проб, избегая недостатков гель-электрофореза.
Задача решается способом обнаружения мутаций дезоксирибонуклеиновых кислот (ДНК), причем одна ДНК амплифицируется с помощью ПЦР, а получаемые в результате ампликоны разрезаются одной или более рестриктазами и подвергаются обнаружению, т.е. анализируются, отличающимся тем, что используют две меченые затравки, причем метка первых затравок служит для связывания ампликонов (скопированных фрагментов ДНК) с одним или более носителями, а метка вторых затравок - для обнаружения (анализа).
ПЦР, используемую при осуществлении настоящего способа, проводят обычным образом, причем в качестве затравок используют затравки вышеописанного типа.
Согласно изобретению в качестве носителей предпочтительно используют такие, которые в условиях ПЦР также позволяют провести связывание первых затравок. При этом особо предпочтительными оказались носители, имеющие активированную поверхность, такие как обработанная соответствующим образом поверхность реакционного сосуда или микротитрационный планшет.
Согласно предлагаемому способу первые затравки частично или полностью фиксируются на носителях либо до, либо во время, либо после ПЦР, в то время как вторые затравки предпочтительно присутствуют в реакционном растворе в свободном, т. е. не зафиксированном на носителях виде и в случае необходимости в избыточном количестве. Затравки могут добавляться в реакционный раствор либо одновременно, либо последовательно.
Вторые затравки предпочтительно должны иметь метки, легко обнаруживаемые обычными методами.
Согласно изобретению до, во время или после связывания сегментов ДНК (ампликонов, полученных в результате ПЦР) к носителям можно добавить одну или несколько рестриктаз, причем предпочтительно их добавление после процесса связывания. Согласно изобретению рестриктазы можно инкубировать с ампликонами.
В качестве рестриктазы могут быть использованы все известные рестриктазы, при этом какой энзим или какие энзимы будут применяться в конкретном случае, зависит, конечно, от расщепляемой последовательности.
После фиксации ампликонов на подходящих носителях с помощью первых затравок и до и/или после расщепления предпочтительно, однако, после расщепления ампликона с помощью одной или более вышеуказанных рестриктаз ампликоны промываются пригодным промывным средством, например, при необходимости, деионизированной или дистиллированной водой, содержащей в случае необходимости добавки, например буферы. При осуществляемом после расщепления промывании удаляются расщепленные, но не зафиксированные сегменты ДНК.
Согласно изобретению методы обнаружения выбирают так, чтобы имелась возможность обнаружить метку вторых затравок. При этом процесс обнаружения в соответствии с типом меток вторых затравок может осуществляться прямым или косвенным путем.
На практике биохимического анализа известно множество методов обнаружения.
1. Сопряжение с веществами, непосредственно обнаруживаемыми спектроскопией.
2. Использование ферментативных меток, которые превращают свой субстрат в фотохимически обнаруживаемые вещества. Преимущество последнего метода состоит в усилении связанного с этим измерительного сигнала.
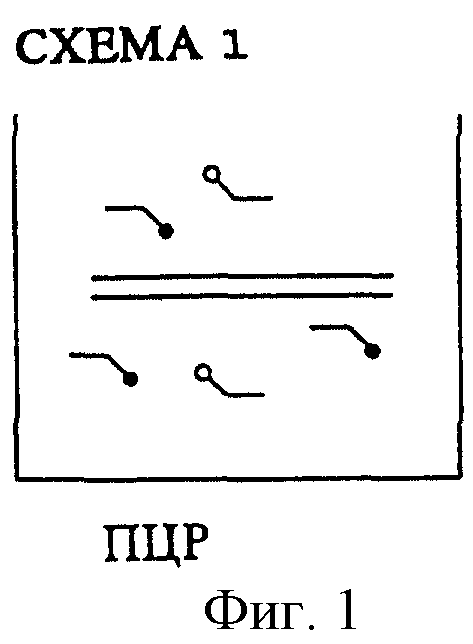
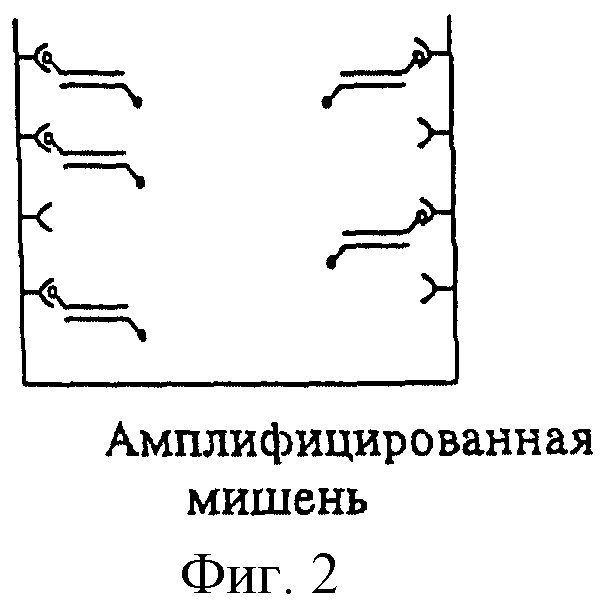
Согласно первой форме осуществления изобретения (см. схему 1) сначала амплифицируется ДНК, и получаемые в результате ампликоны связываются с подходящим носителем, при этом метка на первой затравке служит фактором связывания. В случае необходимости первые затравки могут включать также несколько таких меток.
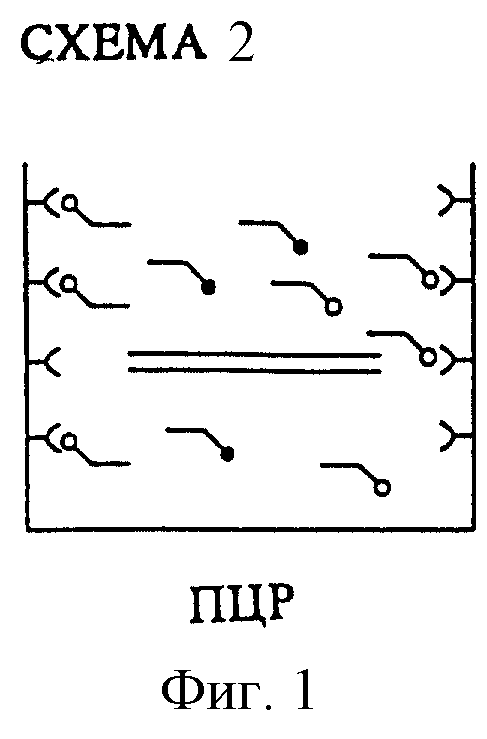
Согласно второй форме выполнения изобретения (см. схему 2) первые затравки сначала связывают с соответствующим носителем, например с поверхностью сосуда, в котором протекает ПЦР. При этом выбираемый метод сопряжения должен удовлетворять граничным условиям ПЦР, например термостойкости. Реакция затем протекает в стандартных условиях, при этом вторая затравка не связана с носителем и относительно к первой затравке предпочтительно находится в избытке.
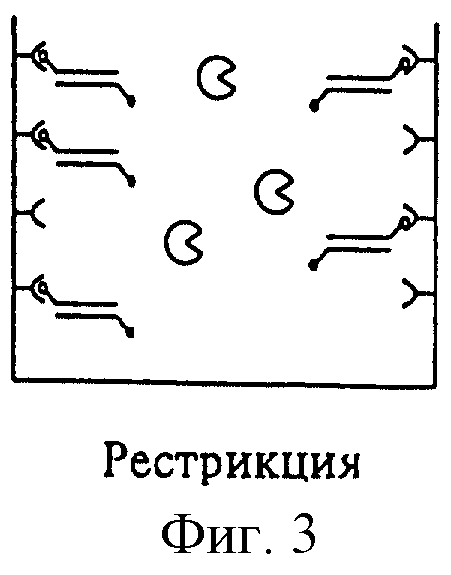
Во время ПЦР в растворе образуется нужный сегмент ДНК, причем процессы гибридизации и амплификации, иницируемые уже связанной затравкой, происходят и на поверхности носителя. По окончании ПЦР получают желаемые продукты, которые непосредственно связаны с носителем. Затем удаляют промыванием излишки необходимых для проведения ПЦР исходных веществ (например, свободные нуклеотиды) и несвязанные продукты реакции. Потом расщепляют сегмент соответствующей рестриктазой, осуществляют в случае необходимости еще одну стадию промывки и, наконец, осуществляют вышеописанное обнаружение.
Согласно схеме 1 можно метить, например, биотином. На стадии 3 согласно этой схеме сопряжение с носителем осуществляется, например, с помощью микротитрационного планшета через связывающий биотин белок, например стрептавидин или авидин, который адсорбируется на поверхности носителя или ковалентно связывается, например, на поверхности лунок микротитрационного планшета. Микротитрационные планшеты, покрытые слоем стрептавидина, имеются в продаже (ф-ма Берингер, г. Мангейм).
Согласно схеме 2 для затравки 1 можно предусмотреть ковалентное сопряжение с носителем, например микротитрационным планшетом. В этих целях можно использовать, например, фосфорилированные затравки, которые в рамках карбодиимидной реакции могут реагировать с активированными соответствующим образом носителями. Примером подходящих функциональных групп носителя, например микротитрационного планшета, могут служить аминогруппы. Подобного рода миркотитрационные планшеты тоже доступны в торговле.
В случае схем 1 и 2 можно использовать одни и те же метки для затравок 2. Подходящими примерами являются флуоресцеин и его производные, родамин и его производные, Су5 (флуоресцирующий краситель), Су3 (флуоресцирующий краситель) или соединения, подвергающиеся косвенному обнаружению.
- Флуоресцирующие красители: в случае этих затравок возможно непосредственное последующее обнаружение с помощью подходящего флуориметра.
- Дигоксин: возможно косвенное обнаружение после добавления меченого ферментом антитела.
- Биотин: возможно косвенное обнаружение после добавления конъюгата авидина и фермента, например, после добавления авидина или стрептавидина.
Факт связывания соответствующего белка распознавания (антитела, авидина или стрептавидина) как в других анализах с микротитрационными планшетами можно обнаружить, добавив подходящие ферментные субстраты, в частности ферменты пероксидазы или щелочной фосфатазы (причем в результате реакции с ферментом получают окрашенные продукты), или же непосредственно, если процесс сопряжения осуществляется не на микротитрационных планшетах, а на подходящих детекторах. При этом подходящими детекторами могут служить, например, известные из техники биосенсоров планарные волноводы, на которых можно провести реакции сопряжения с помощью затравки 1, описанной выше для микротитрационных планшетов.
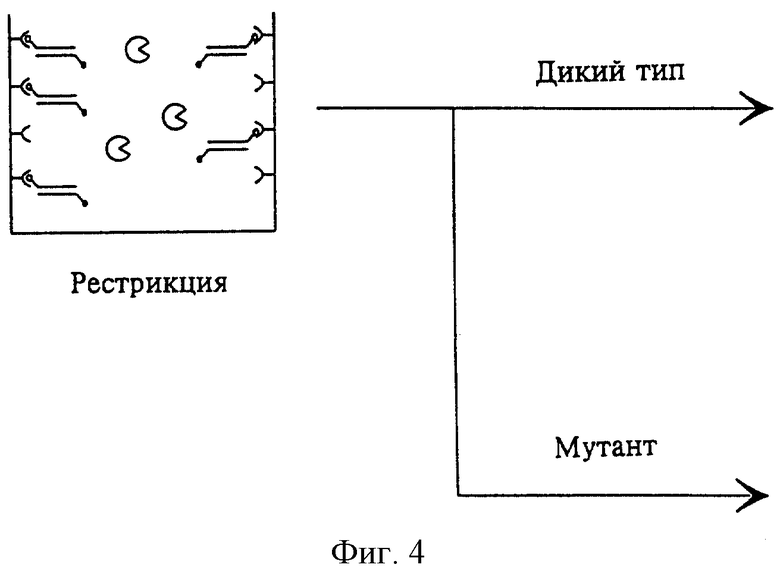
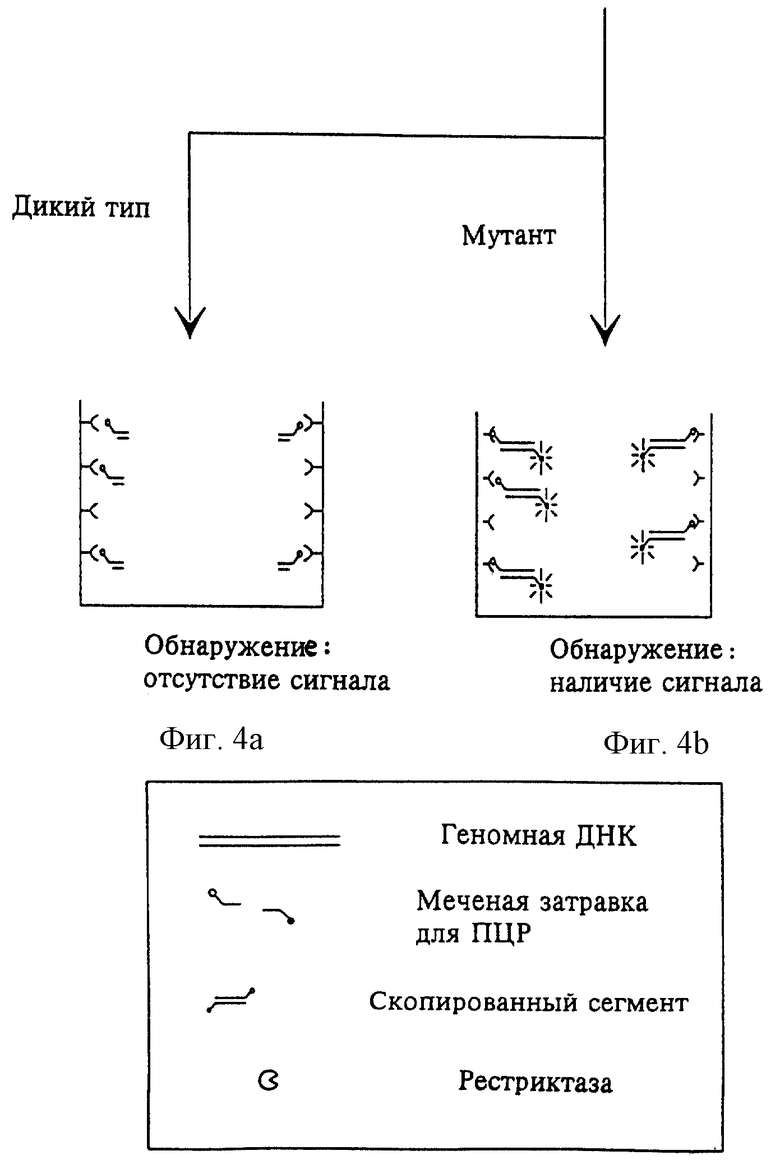
Согласно изобретению исследуемая ДНК, представляющая собой дикий тип или мутант, может иметь рестрикционный сайт.
а) Наличие рестрикционного сайта в неповрежденной ДНК дикого типа:
В случае возникновения мутации в интересующем участке ДНК удаляют рестрикционный сайт ДНК в соответствии с выбранным примером. При этом для предупреждения специфического распознавания и расщепления сегмента ферментом достаточно точечной мутации. В последующей стадии промывания до проведения собственно обнаружения можно удалить рестриктазу, исходные продукты для ПЦР и в случае необходимости продукты ПЦР, содержащие обнаруживаемую метку.
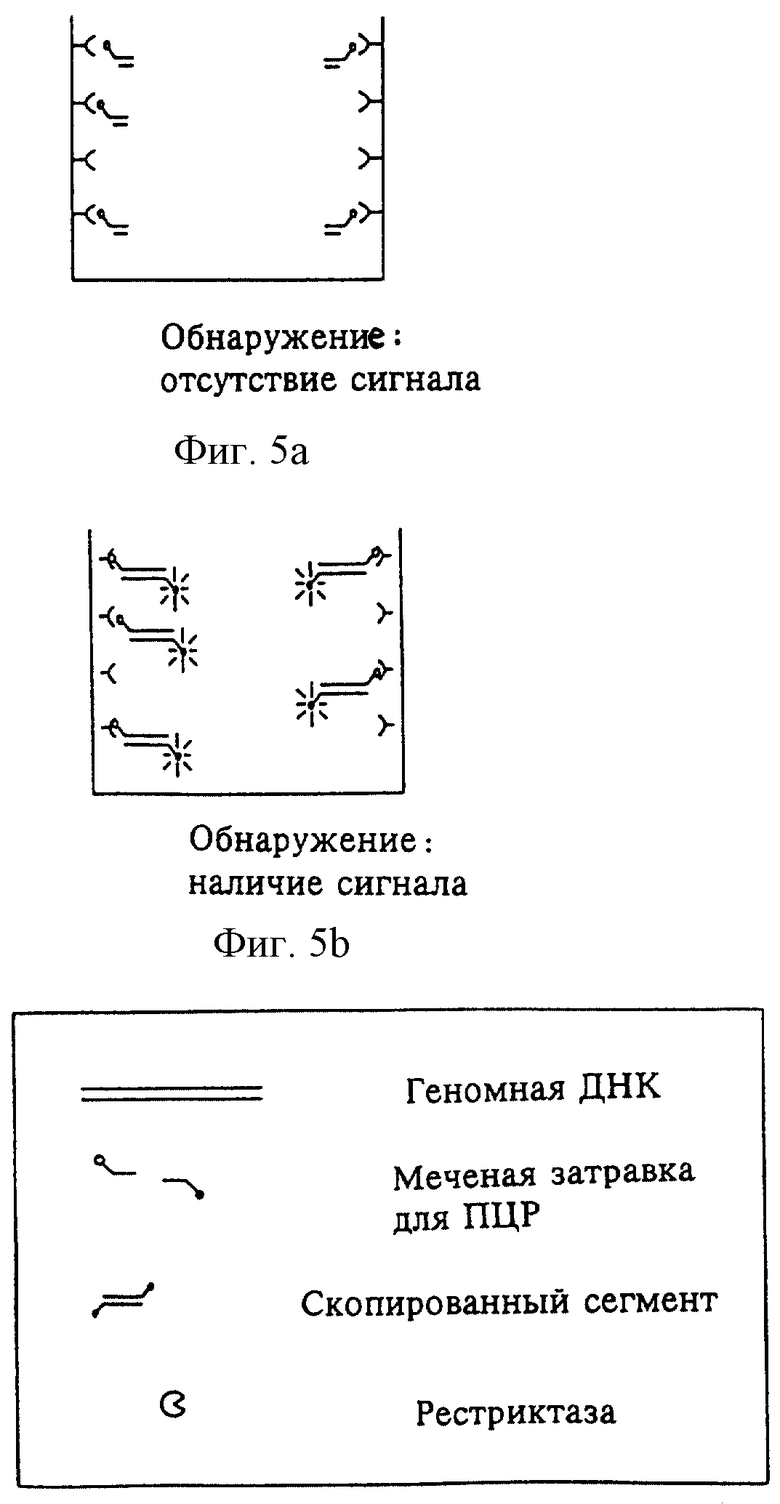
На стадии обнаружения анализируют наличие или отсутствие метки. В случае мутации ДНК имеет место обнаруживаемая метка, и в зависимости от выбранного типа метки наблюдается соответствующая реакция. В случае метки ферментом, например, наблюдается катализированная цветная реакция. В случае отсутствия мутации фермент способен к специфическому расщеплению и метка удаляется, так что определяемый сигнал отсутствует.
б) Наличие рестрикционного сайта в мутированной ДНК:
В случае возникновения мутации в интересующем участке ДНК создают рестрикционный сайт ДНК в соответствии с выбранным примером. При этом для специфического распознавания и расщепления сегмента ферментом достаточно точечной мутации. В последующей стадии промывания до проведения собственно обнаружения можно удалить рестриктазу, исходные продукты для ПЦР и в случае необходимости выделенные продукты ПЦР, содержащие обнаруживаемую метку.
На стадии обнаружения анализируют наличие или отсутствие метки. В случае мутации ДНК обнаруживаемая метка отсутствует, и реакции не происходит. В случае отсутствия мутации фермент не способен к специфическому расщеплению, и метка не удаляется, и, следовательно, получают определяемый сигнал.
Изобретение ниже подробно поясняется чертежами, иллюстрирующими вышеописанный случай а) :
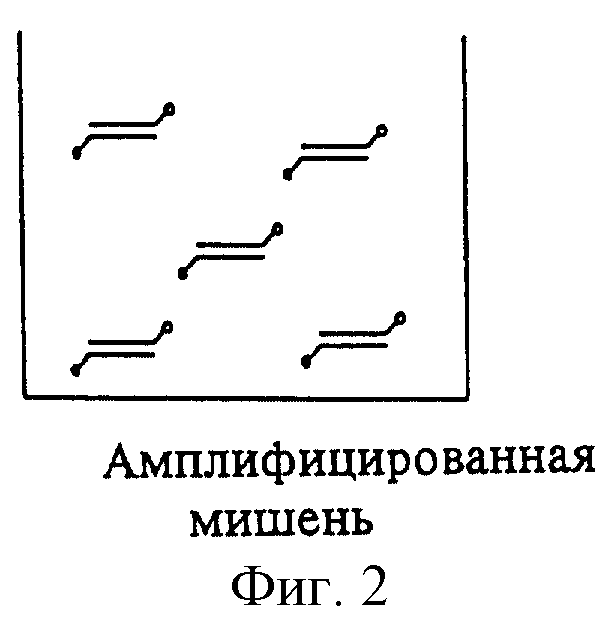
Схема 1 иллюстрирует первую последовательность стадий предлагаемого способа обнаружения. На фиг.1 изображена амплификация мишени с помощью меченых затравок. ПЦР проводят в пригодных для этого сосудах. На фиг.2 изображены маркированные метками продукты ПЦР. Один конец продуктов ПЦР имеет метку, служащую для последующего связывания с поверхностью носителя, а метка на другом их конце служит для обнаружения. Искомая последовательность, содержащая возможную мутацию, находится внутри пределов амплифицированных сегментов.
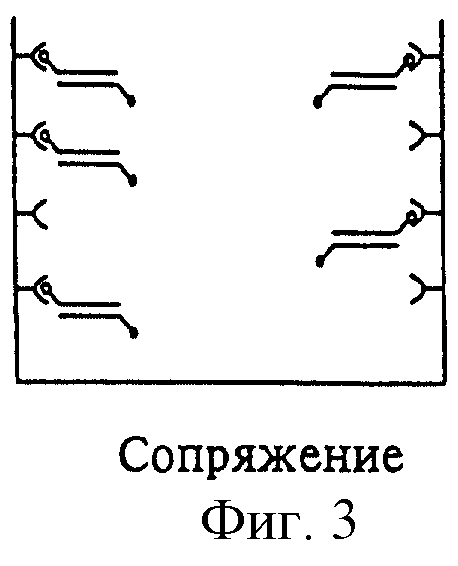
На фиг.3 изображен процесс связывания сегментов благодаря первой метке; на фиг. 4 изображен процесс воздействия рестриктазой, для того чтобы установить, удален или нет рестрикционный сайт вследствие мутации. В случае наличия мутации, как изображено на фиг.5, рестрикционный сайт отсутствует и обнаруживаемые метки не удаляются. Наоборот, в случае отсутствия мутации фермент способен к расщеплению. Простой промывкой можно отделить сегмент, вследствие чего связанная часть сегмента не дает сигнала.
Схема 2 иллюстрирует вторую последовательность стадий предлагаемого способа обнаружения. На фиг.1 показано, что часть первой затравки, служащей для связывания с поверхностью носителя, имеется в связанном виде уже до начала ПЦР. Вторая затравка, которую можно обнаружить, имеется в избытке в растворе. На фиг.2 изображено, что по окончании ПЦР ампликон, содержащий исследуемую последовательность, зафиксирован на поверхности носителя. На фиг. 3 изображено добавление рестриктазы, которая, как выше описано, способна к расщеплению последовательности дикого типа, но не мутированной последовательности. На фиг. 4 изображен результат произведенного обнаружения. После (не изображенной) стадии промывки обнаруживаемая метка в случае мутации еще имеется на зафиксированном сегменте. Однако в случае дикого типа не получают сигнала, так как в связи с присутствием рестрикционного сайта рестриктаза может расщепить несущий метку сегмент, который после отделения удаляется промывкой.
Изобретение относится также к набору для проведения предлагаемого способа, отличающемуся тем, что он включает две меченые затравки и, кроме того, предпочтительно содержит дополнительные свободные нуклеотиды и одну полимеразу.
При этом первая затравка служит для связывания продуктов ПЦР с одним или более носителями, а вторая - для обнаружения мутаций, причем используемый носитель предпочтительно имеет активированную поверхность.
По сравнению с уровнем техники предлагаемые способ и набор имеют следующие преимущества.
- Описанные формы выполнения изобретения позволяют сэкономить время. Преимуществами обладает особенно вторая форма выполнения изобретения, так как и ПЦР, и анализ ее продуктов осуществляют в одном сосуде. Благодаря этому отпадает необходимость в переносе проб пипеткой из одного сосуда в другой, что упрощает обращение с ними и исключает возникновения ошибок, связанных с подобными операциями.
- В зависимости от типа обнаруживаемой метки мутацию обнаруживают сразу после расщепления ДНК рестриктазой, а не по окончании гель-электрофореза.
- В клинической практике тестирование часто связано с большим количеством проб. Поэтому процесс обработки проб по известному способу обнаружения мутаций, основанному на гель-электрофорезе, очень трудоемок. Так как предлагаемый способ можно осуществить полностью на микротитрационных планшетах, он обладает преимуществом одновременной обработки, например, 96 (или 384) проб.
- В случае гель-электрофореза приходится работать с токсичными соединениями внедрения (интеркалатами) ДНК. Используя предлагаемый способ, можно полностью отказаться от применения этих соединений.
Пример 1.
Мутация в человеческом факторе V считается ответственной за повышение опасности возникновения тромбоза, поскольку она ингибирует распад гликопротеина фактора V серинпротеазой АБС (активированный белок С). Человеческий фактор V представляет собой гликопротеин с молекулярной массой 330 кДа, который вступает в специфическое взаимодействие с АБС и, как правило, расщепляется ею в определенном сайте последовательности - в случае человеческого белка за Аrg 506 (аргинином - 506-ой аминокислотой белка). При исследовании последовательности соответствующего гена было найдено, что, когда в сайте 1, 691 нуклеотидной последовательности G (гуанин) заменен А (аденином), существует повышенный риск возникновения тромбоза. Эта мутация приводит к тому, что в белке Аrg 506 (продукт нуклеотидной последовательности CGA) заменен глютамином (Gln) (продукт нуклеотидной последовательности САА) и, следовательно, уже не происходит вышеописанного расщепления протеазой. Для обнаружения этой мутации используют затравки, с помощью которых в рамках ПЦР удается скопировать участок гена, включающий соответствующую нуклеотидную последовательность. В результате получают, например, фрагменты длиной 267 пар оснований. Тогда в случае наличия гуанина в сайте 1, 691 обработкой рестриктазой MnlI получают три фрагмента длиной 67, 37 и 163 пар оснований соответственно, поскольку фермент благодаря своей специфичности по последовательностям способен к расщеплению фрагмента гена по двум сайтам (после 67 и далее после 37 пар оснований). В случае наличия мутации до аденина отпадает второй сайт расщепления. В результате наблюдаются только два продукта расщепления длиной 67 и 200 пар оснований соответственно, так как вследствие мутации последовательность настолько изменяется, что используемый фермент уже не может действовать. Обнаружение отдельных фрагментов гена осуществляют методом гель-электрофореза. Эта информация в основном известна из публикации R. М. Bertina и др., Mutation in blood coagulation factor V associated with resistance to activated protein C, Nature, 369, 1994, 64-67.
Изобретение относится к генной инженерии, а именно к способу обнаружения мутаций ДНК с помощью рестриктаз. Интересующий сегмент ДНК в мутированном геноме копируется полимеразной цепной реакцией (ПЦР). Применяют меченые затравки. Метка первой служит для связывания сегмента ДНК с поверхностью носителя, а метка второй - для обнаружения мутации. Выбранная рестриктаза инкубируется с ампликоном, получаемым в результате ПЦР. Мутированный сегмент не расщепляется, если сайт расщепления выпадает вследствие мутации. После связывания сегмента с поверхностью носителя проводят обнаружение, при этом метка второй затравки в случае дикого типа ДНК удаляется. В случае мутанта ее можно обнаружить. При этом можно пользоваться множеством меток, которые позволяют непосредственно или косвенно обнаружить мутацию. Изобретение предлагает быстродействующий способ для обнаружения определенных мутаций в геноме со снижением трудоемкости. 2 с. и 10 з.п. ф-лы, 9 ил.
| WO 9525538 А, 28.09.1995 | |||
| СОРТОВОЙ ПРОКАТ, КРУГЛЫЙ, ИЗ МИКРОЛЕГИРОВАННОЙ ВЫСОКОПЛАСТИЧНОЙ СТАЛИ ДЛЯ ХОЛОДНОЙ ОБЪЕМНОЙ ШТАМПОВКИ ВЫСОКОПРОЧНЫХ КРЕПЕЖНЫХ ДЕТАЛЕЙ | 2003 |
|
RU2249627C1 |
| ТОКООГРАНИЧИВАЮЩЕЕ УСТРОЙСТВО | 2002 |
|
RU2230388C2 |
| ИЗОЛИРУЮЩИЙ СОСТАВ ДЛЯ КАБЕЛЕЙ СВЯЗИ | 1999 |
|
RU2220467C2 |
| Цифровой вычислительный синтезатор частотно-модулированных сигналов | 2019 |
|
RU2718461C1 |
| Г.Маниатис и др | |||
| Методы генетической инженерии | |||
| Молекулярное клонирование | |||
| Колосниковая решетка с чередующимися неподвижными и движущимися возвратно-поступательно колосниками | 1917 |
|
SU1984A1 |
Авторы
Даты
2002-11-20—Публикация
1997-09-10—Подача