Настоящее изобретение относится к устойчивым липосомным порошковым векторам активных веществ, в частности активных веществ, восприимчивых к дигестивному и/или плазматическому разложению, таких, как протеины, а также к их применению в качестве лекарственных средств.
В целях защиты подобных хрупких активных веществ предлагались многие виды векторов, в числе которых следует упомянуть липосомы, считавшиеся отборным вектором.
Начальные исследования действенности орального приема липосом убедительными не были (DESHMUCK D.S. и др. Life Sciences, 1981 г., 28, стр.239-242). Полученные результаты свидетельствовали о том, что липосомы состава: диэфирфосфатидилхолин (нерасщепляемый аналог фосфатидилхолина) / холестерин в пропорции 7: 1 обеспечили желудочно-кишечную защиту инкапсулированного пептида, но не обеспечили его прохождения через кишечный барьер.
Можно назвать несколько причин, объясняющих такую непроходимость, это - слишком большой и не калиброванный размер липосом, слабая устойчивость структуры или утечка инкапсулированного соединения во внелипосомную среду.
Недавно группе Роберта Гринвуда (Robert Greenwood) (Drug Dev. And Ind. Pharm. , 1993 г., 19, 11, стр. 1303-1315) из Кэмбеллского университета в США удалось показать, как интубация транспортирующих инсулин липосом в двенадцатиперстную кишку сопровождается эффектом гипогликемии, превосходящим эффект от интубации в двенадцатиперстную кишку свободного раствора инсулина.
Были проведены многочисленные опыты с целью получения липосом с хорошей способностью к транспортировке активных веществ, в частности, что касается воздействия на процент улавливания активного вещества, устойчивости липосом и биоэффективности активного вещества. Для сведения можно назвать, например:
- S. B. Kulkarni и др. (ж. "Microencapsulation", 1995г., 12, 3, стр. 229-246), которые выявили факторы, влияющие на микроинкапсуляцию лекарственных средств в липосомы, это - размер липосомы, ее тип, заряд на ее поверхности, хрупкость бислоя, введение инкапсулирующих добавок. Из этой оценки следует, что мультиламеллярные везикулы (MLV (multilamellar vesicles)), содержащие несколько бислоев и имеющие диаметр от 100 нм до 20 мкм оптимальны для инкапсуляции гидрофобных лекарственных средств, взаимодействующих с бислоями, в то время как крупные униламеллярные везикулы (LUV (large unilamellar vesicles) ), содержащие только один бислой и имеющие размер от 100 до 1000 нм, рассматриваются как наиболее подходящие для инкапсуляции гидрофильных лекарственных средств;
- I. De Miguel и др. (Biochimica et Biophysica Acta, 1995 г., 1237, стр. 48-49), которые предложили наночастицы, состоящие из внутреннего ядра, образованного структурированными полисахаридами с привитыми на их наружной части жирными кислотами и покрытыми фосфолипидным слоем;
- P. S. Uster и др. (FEBS Letters, 1996 г., 386, стр. 243-246), предложивших ввести модифицированные полиэтиленгликолем фосфолипиды в предварительно сформированные липосомы с целью повышения биологической эффективности.
Были проведены серии экспериментов по оральному введению пептидов, в которых либо использовали разные методы инкапсуляции липосом, либо модифицировали липидное активное начало прививкой липофильной функции. В любом случае цель заключалась в преобразовании активного липидного вещества в "предлекарство"; такое предлекарство обладает свойством сохранять устойчивость при прохождении через желудочно-кишечный тракт, т. е. устойчивость к рН желудка, к физиологическим детергентам (соли желчных кислот), протеазам (кишечные экзо- и эндопептидазы) и к их метаболизации кишечной флорой. Так, например, образование мостиков в положении 2 1,3-диглицерида из пентапептида позволило наделить указанными свойствами лекарственное сырье после такой модификации.
Однако такие разные липосомы известного уровня техники не позволяют обеспечить одновременно хорошую устойчивость, продуктивность инкапсуляции соответствующего активного вещества и существенное повышение биологической эффективности per os упомянутого активного вещества без необходимости его модифицирования, который бы сохранял при этом совокупность своих функций и свойств. Под биологической эффективностью понимается часть дозы, проникающая в систему кровообращения в фармакологически активной форме, а также скорость такого проникновения.
J. C. Hauton описал липосомы с желатинированным внутренним ядром (липогелосомы®) в виде суспензии в водной среде, содержащей желатинирующие вещества. В частности, им был разработан способ получения таких липосом (европейский патент 0393049), отличающихся от традиционных тем, что инкапсулированная водная фаза имеет вид полутвердого геля, а не жидкости, чем и предупреждается слияние липосом при соударениях. Такие липогелосомы® получают исключительно на основе природных материалов, чем сводится до минимума риск непереносимости. В частности, согласно европейскому патенту 0393049 такие липогелосомы® состоят из межфазной поверхности в виде бислоя в случае с униламеллярными липогелосомами® или из множества межфазных поверхностей в виде бислоев, расположенных концентрически друг над другом, в случае с мультиламеллярными липогелосомами®, а также из желатинированной инкапсулированной внутренней полярной водной фазы, в которой полимеризующаяся или неполимеризующаяся желатинированная субстанция выбирается из полисахаридов, полипептидов или полиакриламидов; так, например, неполимеризующаяся желатинирующаяся субстанция выбирается из желатина, агарозы или каррагенанов, а полимеризующаяся желатинирующаяся субстанция выбирается из полиакриламидных гелей. Такие липогелосомы® обладают значительно более высокой устойчивостью по сравнению с липосомами из известного уровня техники, в частности, благодаря неслиянию частиц при соударении.
Однако их недостатком является то, что они находятся в дисперсной форме в жидкой фазе, непригодной для приготовления твердых композиций, для хранения и легко осуществимого приема внутрь.
Поэтому заявитель поставил своей целью создание нового вектора, позволяющего одновременно эффективно обеспечить достаточную продуктивность инкапсуляции и значительно более высокую биоэффективность per os упомянутого активного вещества по сравнению с липосомами известного уровня техники при достижении высокой стойкости как при хранении, так и in vivo. Такие векторы приспособлены для орального приема; кроме того, водный раствор может вводиться и другими путями, например чрезкожно, через легкие, через нос, через гениталии, внутривенно, подкожно или окулярно, в зависимости от выбранного эксципиента.
Указанные векторы отличаются тем, что они состоят из:
- порошковой композиции, которая содержит преимущественно униламеллярные липосомы с внешней липидной фазой, образованной липидами 4-го класса (фосфолипидами), при необходимости ассоциированными с веществами 2-го класса (тригилицеридами с длинными цепочками, сложными эфирами холестерина), веществами 3-го класса (холестерином, неионизированными жирными кислотами с длинной цепочкой) и/или веществами 5-го класса (солями желчных кислот, производными фусидовой кислоты), и с внутренним водным ядром, образующим водный термообратимый гель, выполняющим весь внутренний объем до внешней липидной фазы, при этом внутреннее водное ядро состоит в основном из смеси (М) по меньшей мере двух разных желатинирующих неполимеризующихся веществ G1 и G2, температура фазового перехода "гель-золь" которых выше или равна 37oС, причем G1 представляет собой желатинирующее вещество, выбираемое из желатинов и каррагенанов, таких, как каппа-каррагенаны, a G2 выбирается из каррагенанов со свойствами, отличными от присущих каррагенанам для G1, таких, как йота-каррагенаны, и целлюлоз, таких, как гидроксипропилметилцеллюлоза, при этом липосомы имеют диаметр от 20 нм до 1 мкм, предпочтительно от 20 нм до 500 нм, и которая имеет вид частиц со средним диаметром от 10 мкм до 1000 мкм, образованных одной или несколькими названными липосомами, окруженных оболочкой, выбираемой из группы, содержащей обезвоженный термообратимый водный гель, идентичный водному гелю упомянутого внутреннего ядра, декстрины или их смесь, с таким расчетом, чтобы она содержала в среднем от 1016 до 1018 липосом/г порошка, и
- по меньшей мере одного активного вещества, содержащегося в зависимости от обстоятельств либо в желатинированном внутреннем ядре, либо во внешней липидной фазе указанной композиции.
Такие векторы неожиданно позволили устранить недостатки, связанные с традиционными липосомами. Действительно они позволяют:
- повысить устойчивость липосом благодаря неслиянию частиц во время соударений,
- повысить биоэффективность активного вещества (защита внутри желудочно-кишечного тракта и проходимость через кишечный барьер); в частности, у крысы время прохождения векторов согласно изобретению (липогелосом) через кишечный барьер с момента орального приема может составлять от 2 до 4 часов, а именно 1 час на освобождение желудка и 1-3 часа для прохода через просвет кишечника в систему кровообращения; таким образом, активное вещество, способность которого к проникновению в клетку незначительна или отсутствует, может быть эффективно введено в дифференцированную кишечную эпителиальную клетку в том случае, когда оно инкапсулировано в вектор (липогелосома) согласно изобретению, не модифицируя активность или состав активного вещества;
- уменьшить токсичность инкапсулированных активных веществ и
- сократить утечки инкапсулированных продуктов благодаря более слабой молекулярной подвижности внутри желатинированной инкапсулированной водной фазы.
При выборе желатинирующих веществ неожиданно выявилась возможность получения липосом (SUV = small unilamellar vesicles (малые униламеллярные везикулы)), пригодных для использования в сухом виде (порошок) и обладающих особо привлекательными свойствами в качестве вектора активных веществ; в самом деле поразительно, что биоэффективность per os таких активных веществ, преимущественно активных веществ, восприимчивых к дигестивному разложению, плохо абсорбируемых или очень токсичных, существенно повышается в том случае, когда они инкапсулированы или ассоциированы с вектором согласно настоящему изобретению.
Кроме того, подобные векторы в порошковой форме сохраняют полную целостность содержащихся в них липосом, которые остаются стабильными во времени как в порошковом виде, так и в виде суспензии благодаря поддержанию целостности конститутивных липидов (отсутствие продуктов разложения) и свойств желатинирующих веществ, в частности смеси G1 и G2 (вязкость, крепость геля, прочность на разрыв, молекулярная масса).
Заинтересованность в применении липогелосом® в таком контексте обусловлена использованием стабилизированной формы липосом (JC Hauton и др., Eur. J. Surg. , 1994 г., прил. 574, стр. 117-119) для орального приема активных веществ. Способ получения липогелосом® позволяет достигнуть средней степени инкапсуляции желатинированных гидрофильных фаз около 10%. Этот процент зависит, в частности, от молекулярного веса активного вещества и рассчитывается по соотношению между количеством инкапсулированного активного вещества и количеством используемого активного вещества. Так, например, отмечено по меньшей мере 5% инкапсуляции для молекулы в 500 Да и по меньшей мере 50% инкапсуляции для молекулы по меньшей мере в 20 кДа. Что же касается, например, пептидов, то наблюдалось от 10 до 50% инкапсуляции, в то время как обычно процент инкапсуляции активных веществ составляет от 5 до 80% в зависимости от обстоятельств.
Желатинирующие вещества G1 и G2 различаются между собой, в частности, вязкостью, молекулярной массой и температурой перехода "гель-золь" (т. е. температурой плавления). Для желатинирующих веществ G1 указанная температура равна или менее 45oС, для желатинирующих веществ G2 эта температура равна или более 45oС.
Смесь М, состоящая по меньшей мере из двух желатинирующих веществ G1 и G2, таких, как описанные выше, обладает текстурометрическими свойствами (крепость геля и прочность на разрыв), которые особо привлекательны с точки зрения стойкости полученных липосом и биоэффективности инкапсулированного активного вещества. Таким образом предпочтительно, смесь М по меньшей мере двух желатинирующих веществ G1 и G2 обладает при 5oС релаксацией от 70 до 100%, предпочтительно от 81 до 89%, и прочностью на разрыв от 1000 до 1600 г, предпочтительно от 1109 до 1503 г.
Согласно другому предпочтительному варианту получения указанной композиции упомянутое внутреннее водное ядро липосомы содержит дополнительно по меньшей мере один стабилизатор олигосахаридной природы и/или по меньшей мере одно вещество для регулирования осмолярности среды и/или по меньшей мере одно поверхностно-активное вещество, такое, как соль желчной кислоты и/или неионное ПАВ.
Предпочтительно указанные векторы содержат в % (в отношении массы):
25-75% липидов 4-го клсса, 5-45% желатинирующих веществ, 0-70% стабилизатора олигосахаридной природы, 0-15% вещества для регулирования осмолярности среды, 0-20% поверхностно-активных веществ и 0-15% декстринов, предпочтительно 8-12%; эта рецептура не включает в себя активные вещества.
Согласно другому предпочтительному варианту получения указанной порошковой композиции согласно изобретению указанное водное внутреннее ядро содержит в себе от 70 до 95% желатинирующего вещества G1 и от 5 до 30% желатинирующего вещества G2.
Согласно еще одному предпочтительному варианту получения указанной порошковой композиции согласно изобретению стабилизатор олигосахаридной природы представляет собой сахарозу, трегалозу или любое другое защитное вещество.
Целью настоящего изобретения является также способ получения порошковых векторов согласно изобретению, в которых наружняя оболочка частиц содержит фракцию термообратимого водного геля, отличающийся тем, что он включает следующие стадии:
(1) получение дисперсии липосом с желатинированным внутренним ядром (липогелосомы®) в водной фазе путем: (а) приготовления раствора по меньшей мере одного соответствующего желатинирующего вещества, в частности смеси М из желатинирующих веществ G1 и G2, растворением указанных желатинирующих веществ при медленном перемешивании при температуре, превышающей температуру фазового перехода "гель-золь" указанных желатинирующих веществ, в водном растворе при рН, подходящем для инкапсулируемого активного вещества, (b) введения активного вещества в полученный на стадии (а) раствор, (с) введения липидов в полученный на стадии (b) раствор при медленном перемешивании смеси в течение менее 5 часов, предпочтительно в вакууме, и образования эмульсии, (d) получения упомянутой дисперсии липосом с желатинированным внутренним ядром (липогелосомы®) в водной фазе, содержащей указанные желатинирующие вещества, при быстром перемешивании полученной на стадии (с) эмульсии, предпочтительно в вакууме,
(2) получение порошкового продукта соответствующей сушкой приготовленной дисперсии.
Согласно предпочтительному варианту осуществления указанного способа сушка проводится распылением, коацервацией в тонком слое или грануляцией.
Целью настоящего изобретения является, кроме того, способ получения порошковых векторов согласно изобретению, в которых наружная оболочка частиц содержит фракцию термообратимого водного геля и/или декстрина, отличающийся тем, что он включает следующие стадии:
(1) получение дисперсии липосом с желатинированным внутренним ядром (липогелосомы®) в водной фазе путем: (а) приготовления раствора по меньшей мере одного соответствующего желатинирующего вещества, в частности смеси М желатинирующих веществ G1 и G2, растворением указанных желатинирующих веществ при медленном перемешивании при температуре, превышающей температуру фазового перехода "гель-золь" указанных желатинирующих веществ, в водном растворе при рН, подходящем для инкапсулируемого активного вещества, (b) введения активного вещества в полученный на стадии (а) раствор, (с) введения липидов в полученный на стадии (b) раствор при медленном перемешивании смеси в течение менее 5 часов, предпочтительно в вакууме, и образования эмульсии, (d) получения упомянутой дисперсии липосом с желатинированным внутренним ядром (липогелосомы®) во внешней водной фазе, содержащей указанные желатинирующие вещества, при быстром перемешивании полученной на стадии (с) эмульсии, предпочтительно в вакууме,
(2) удаление по меньшей мере части водной жидкой фазы, содержащей упомянутые желатинирующие вещества и диспергированные липосомы,
(3) добавление по меньшей мере одного соответствующего декстрина и
(4) получение порошкового продукта сушкой путем распыления полученного на стадии (3) продукта.
Согласно варианту осуществления указанного способа стадия (2) удаления по меньшей мере части водной жидкой фазы, содержащей указанные желатинирующие вещества проводится разбавлением и/или фильтрацией.
В соответствии со способами получения согласно изобретению полученный на стадии (а) водный раствор дополнительно содержит вещество для регулирования осмолярности среды (например, 0,9% NaCl) и/или стабилизатор олигосахаридной природы, и/или поверхностно-активное вещество, предпочтительны вещества 5-го класса (соли желчных кислот).
В качестве варианта активное вещество добавляется в наружную водную фазу до момента его введения в смесь, полученную на стадии (а).
Например, кальцитонин вводится при рН 5, AZT при рН 7,5 и доксорубицин при рН 3.
Неожиданно было обнаружено, что такие способы позволяют получать вектор в порошковой форме на основе стойких липосом с желатинированным внутренним ядром (липогелосомы®) всего лишь на одной стадии, включающей фазу выдержки (вызревания) ингредиентов в водной фазе при низкой скорости, фазу диспергирования (формирование липогелосом®) при большой скорости, что они включают стадию, на которой получают стойкую дисперсию липогелосом® в жидкой фазе с однородной морфологией, пригодную для использования на стадии сушки: подобная дисперсия из липосом с желатинированным внутренним ядром имеет следующую морфологию:
- везикулярная структура диаметром от 20 до 500 нм, предпочтительно от 20 до 80 нм,
- при наблюдениях под микроскопом при негативной окраске, замораживании-скалывании, криотрансмиссионной микроскопии и ядерной микроскопии отмечены везикулы или скопления везикул характерного для фосфолипидных бислоев вида: негативная окраска позволяет наблюдать более или менее выраженное присутствие смеси М желатинирующих веществ, покрывающей наружный фосфолипидный слой,
- полидисперсность липосом с желатинированной внутренней фазой составляет от 10 до 55%, предпочтительно от 10 до 30%.
Такой способ имеет то преимущество, что он воспроизводим и приспособлен к широкому применению в промышленном масштабе.
Кроме того, он обладает преимуществом, заключающемся в более легком осуществлении по сравнению со способами известного уровня техники, в которых необходим этап ультразвуковой обработки, экструзии или удаления детергентов, как это описано в патенте 0393049.
Согласно предпочтительному варианту осуществления указанных способов стадия (с) проводится предпочтительно при скорости среза менее 200 с-1; как правило, скорость среза определяется следующим соотношением:
скорость перемешивающего модуля/зазор между внутренней стенкой реактора и дистальным концом перемешивающей лопасти (называется также "кольцевым зазором").
Целью настоящего изобретения является, кроме того, фармацевтическая композиция, отличающаяся тем что она содержит порошковый липосомный вектор активного вещества, такой, как описан выше, и по меньшей мере один фармацевтически совместимый носитель.
Согласно предпочтительному варианту получения указанной композиции последняя имеет твердую форму (капсула, таблетка, водорастворимый порошок).
Согласно еще одному варианту получения указанной композиции последняя содержит дополнительно активатор кАМФ.
Наряду с приведенными выше положениями изобретение касается и других положений, которые раскрыты в приводимом ниже описании со ссылкой на примеры осуществления способа, как предмета настоящего изобретения, и на приложенные чертежи, на которых:
- фиг. 1 показывает изменения кальцемии в зависимости от времени (-D- = свободный кальцитонин; -▪- = вектор "липогелосомы®-кальцитонин" согласно изобретению);
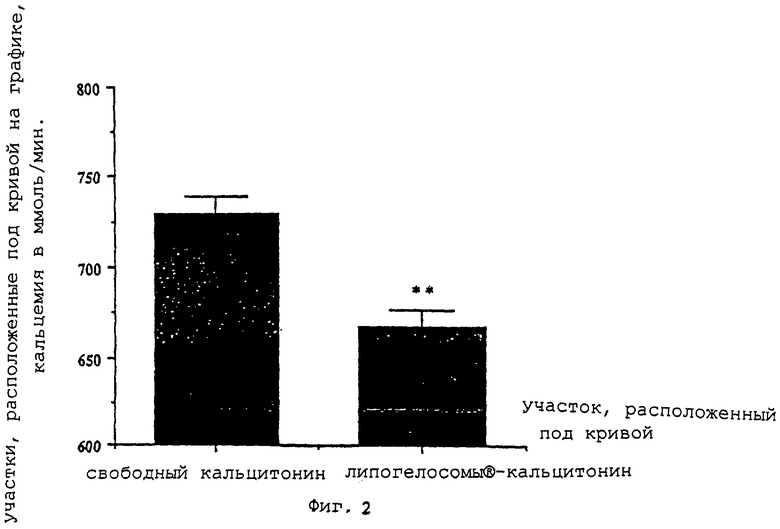
- фиг. 2 показывает разницу между участками под кривой на графике (AUC) при кальцемии, полученной с помощью свободного кальцитонина, и при кальцемии после орального приема векторов липогелосомы®-кальцитонин согласно изобретению;
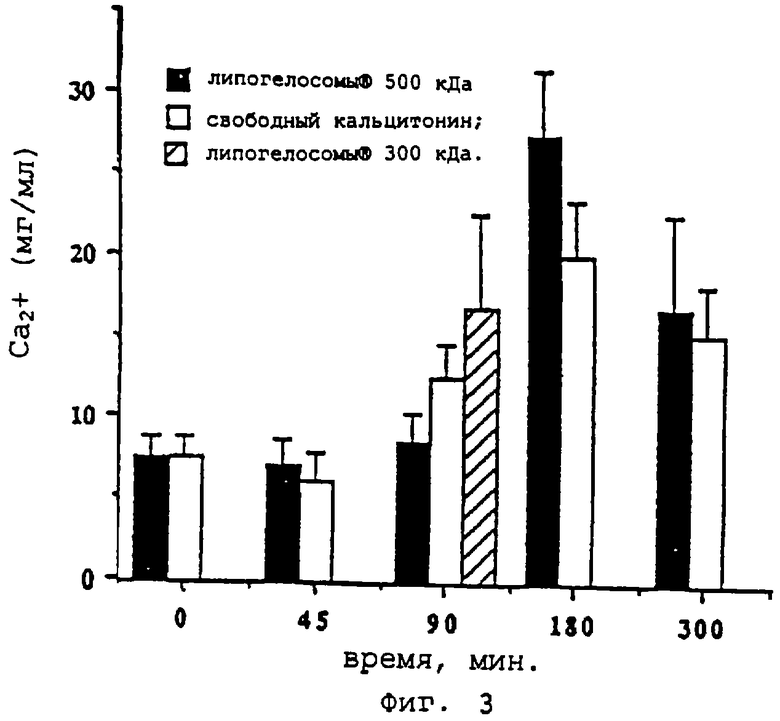
- фиг.3 показывает изменения кальцеурии в зависимости от времени (-□- = вектор "липогелосомы®-кальцитонин" 500 кДа, -□- = свободный кальцитонин, -▪- = вектор "липогелосомы®-кальцитонин" 300 кДа);
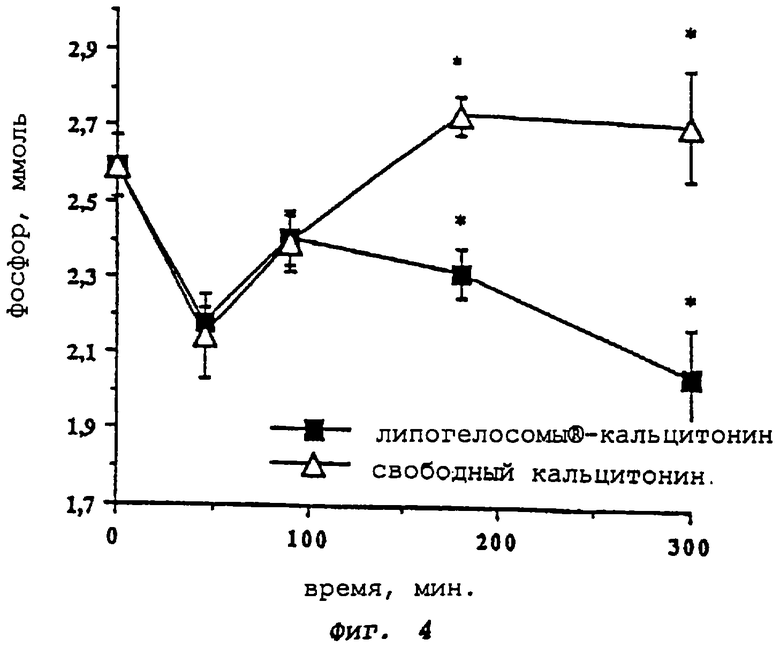
- фиг. 4 показывает оценку фосфатемии в зависимости от времени (-D- = свободный кальцитонин; -▪- = вектор "липогелосомы®-кальцитонин" согласно изобретению);
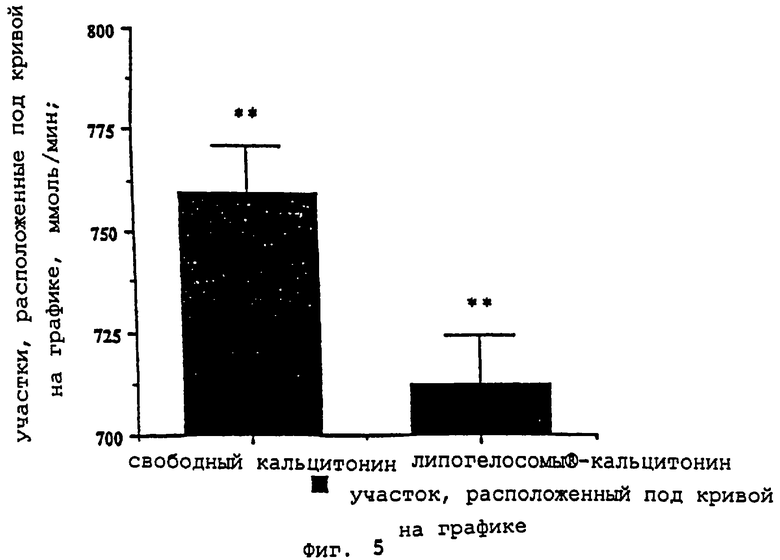
- фиг. 5 показывает разницу между участками под кривой на графике (AUC) при фосфатемии, полученной с помощью свободного кальцитонина, и при фосфатемии после орального приема векторов "липогелосомы®-кальцитонин" согласно изобретению;
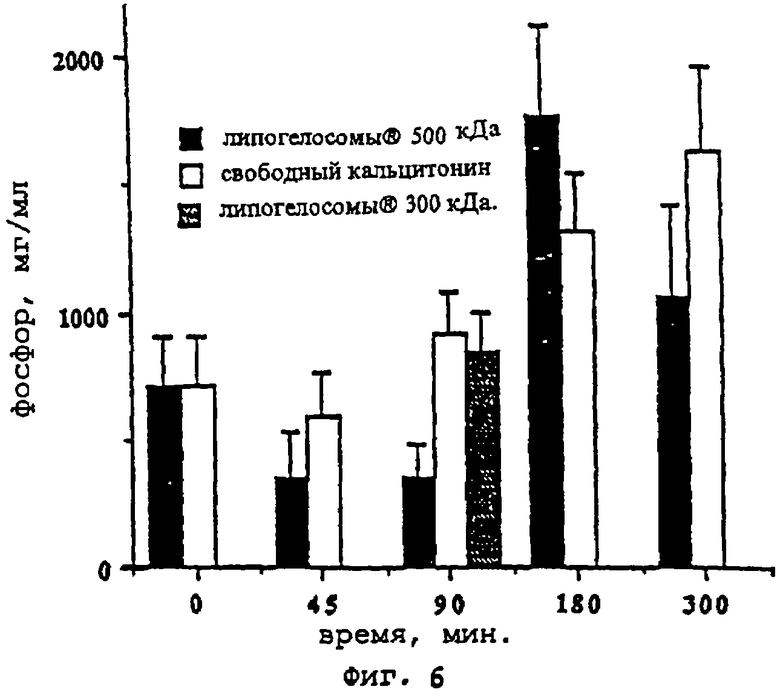
- фиг.6 показывает изменения фосфатурии в зависимости от времени (-▪- = вектор "липогелосомы®-кальцитонин" (конструкция вектор-активное вещество) с молекулярным весом по меньшей мере более 500 кДа, что эквивалентно липогелосомам®, инкапсулирующим кальцитонин, диаметром, превышающим по меньшей мере 40 нм), -□- = свободный кальцитонин, -□- = вектор "липогелосомы®-кальцитонин" (конструкция (вектор-активное вещество) с молекулярным весом по меньшей мере более 300 кДа, что эквивалентно липогелосомам®, инкапсулирующим кальцитонин, диаметром по меньшей мере более 20 нм);
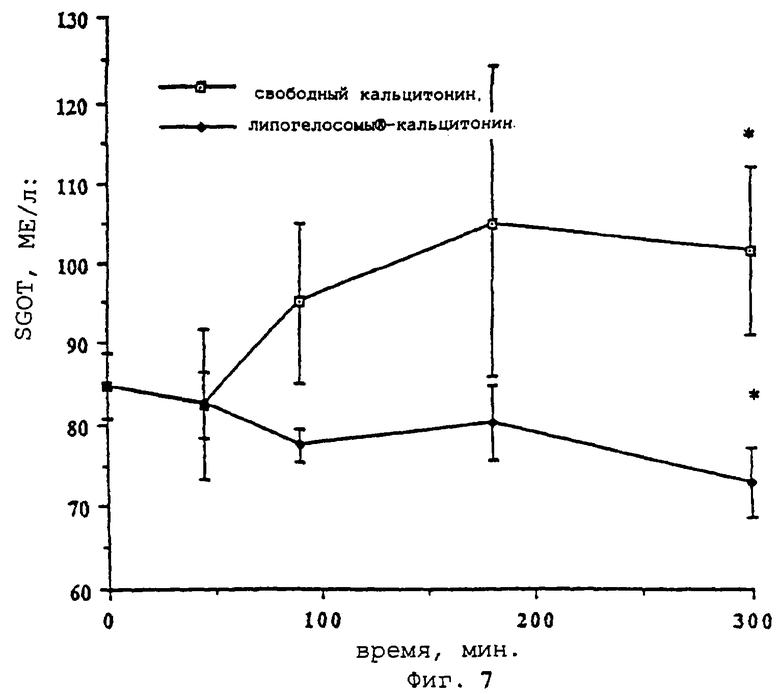
- фиг.7 показывает изменения SGOT (МЕ/л) в зависимости от времени (-□- = свободный кальцитонин,  вектор "липогелосомы®-кальцитонин" согласно изобретению);
вектор "липогелосомы®-кальцитонин" согласно изобретению);
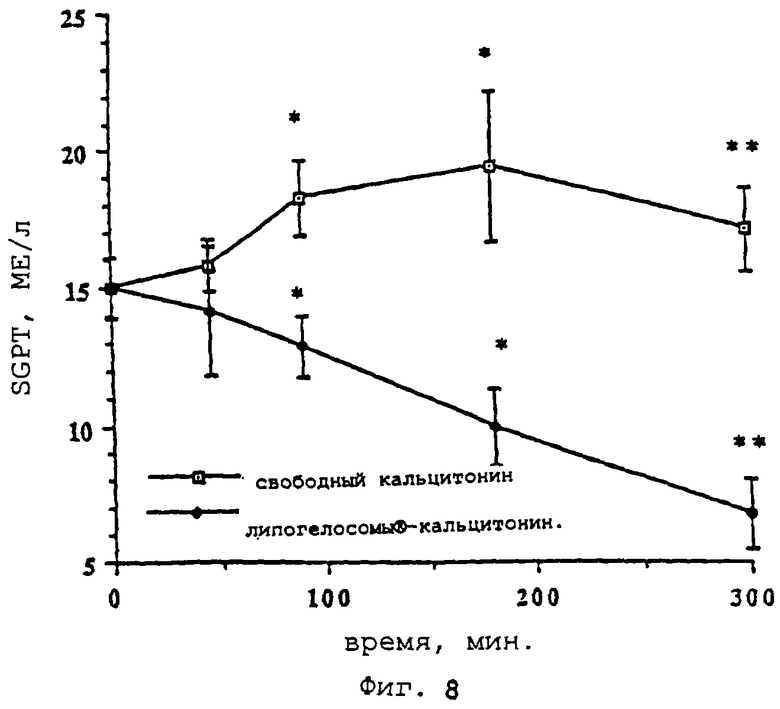
- фиг.8 показывает изменения SGPT (МЕ/л) в зависимости от времени (-□- = свободный кальцитонин,  вектор "липогелосомы®-кальцитонин" согласно изобретению);
вектор "липогелосомы®-кальцитонин" согласно изобретению);
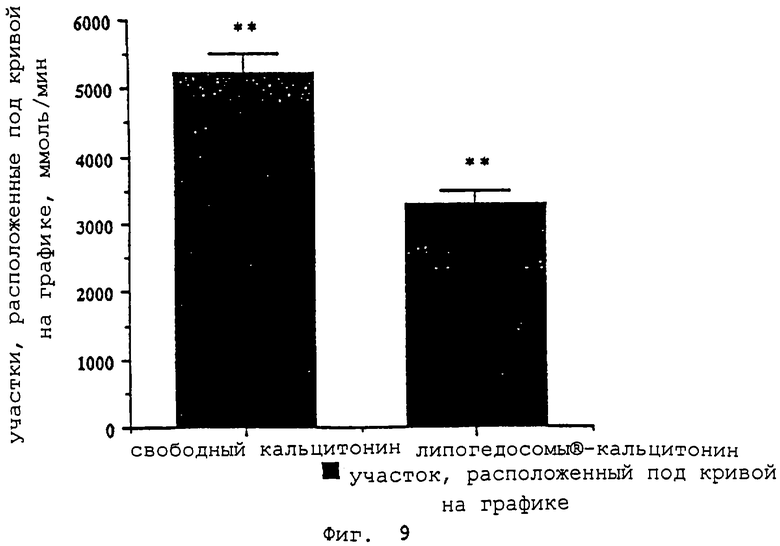
- фиг.9 показывает различия между участками под кривой на графике (AUC) при значениях SGPT для групп, получавших свободный кальцитонин, и групп, получавших вектор "липогелосомы®-кальцитонин" согласно изобретению.
Само собой разумеется, что примеры приводятся единственно для иллюстрации предмета изобретения и что они ни в коем случае его не ограничивают.
ПРИМЕР 1: текстурометрические замеры смеси желатинирующих веществ G1 и G2.
а) Аппаратура и методы
Замеры производились с помощью аппарата TA-XT2i фирмы Rheo. Исследовали свойства гелей, состоящих из смеси желатина, каррагенанов йота и каппа, при испытаниях на разрыв и релаксацию.
Концентрация проб: 7,5 об. % смеси желатины и каррагенанов йота и каппа (80:17,5:2,5) в среде из 5 мМ Na2HPO4 и 0,9 или 2% NaCl.
Приготовление раствора желатинирующих веществ
Хлорид натрия растворяют в мешалке, оборудованной турбиной и планетарной передачей и содержащей очищенную воду (в течение 15 минут при 10 оборотах в минуту), доводят температуру внутри мешалки до 75oС (перемешивание при 10 об/мин в течение 45 минут), вводят в мешалку при температуре 75oС желатинирующие вещества (желатину, каррагенаны йота и каппа), запускают турбину мешалки со скоростью 1500 об/мин; длительность этапа растворения составляет около 30 минут; растворение прекращают, как только раствор становится прозрачным и не содержит взвешенных частиц.
Приготовление проб
Для проведения испытания на релаксацию 45 мл горячего геля выливают в чашку Петри с плоским дном и наружным диаметром 92±2 мм. Для проведения испытания на разрыв 30 мл горячего геля заливают в кристаллизатор с плоским дном и наружным диаметром 50±2 мм. Гель получают охлаждением до температуры 37oС или менее. Продолжительность вызревания гелей, соответствующая их максимальной гидратации, составляет 2,5 суток при температуре исследования и выдержки.
Условия эксперимента
Для испытания на релаксацию к гелю прилагают усилие сжатия в течение определенного времени. В качестве подвижного тела применяли алюминиевый цилиндр диаметром 25 мм с начальной скоростью 1,0 мм/с, последующей скоростью 0,5 мм/с и завершающей скоростью 10,0 мм/с. Смещение подвижного тела составляет 1,0 мм за 30 секунд.
Для проведения испытания на разрыв используют в качестве подвижного тела эбонитовый цилиндр диаметром 10 мм с начальной, последующей и конечной скоростями 1,0 мм/с. Смещение тела составляет 12 мм.
б) Результаты исследования при температуре 5oС и содержании 0, 9% NaCl
Релаксация (%):
минимальная величина 81±2,2
максимальная величина 89±0,8
Разрывное усилие (г):
минимальная величина 1109±25
максимальная величина 1503±35
в) Результаты, полученные в зависимости от температуры и разных содержаний NaCl
Условия эксперимента идентичны условиям, описанным в п. а), за исключением смещения подвижного тела, использованного при испытании на релаксацию (смещение составляет 20% от общей толщины геля).
Релаксация (%):
при 5oС
0,9% NaCl - 89±0,8
2% NaCl - 90±0,2
при 25oС
0,9% NaCl - 32±3,9
2% NaCl - 38±4,4
при 37oС
0,9% NaCl - 36±3,7
2% NaCl - 40±4,9
Разрывное усилие (г):
при 5oС
0,9% NaCl - 1413±66
2% NaCl - 1114±143
при 25oС
0,9% NaCl - 211±2,7
2% NaCl - 173±1,5
при 37oС
0,9% NaCl - 25,7±2,4
2% NaCl - 45,7±3,9
ПРИМЕР 2: способ получения порошкового вектора, содержащего кальцитонин согласно изобретению.
1) Приготовление дисперсии липосом с желатинирующим внутренним ядром (липогелосомы®)
Ингредиенты, кг (%):
Соевые лецитины - 11,915 (7,943)
Желатин В 150 - 7,149 (4,766)
Йота-каррагенаны - 1,565 (1,043)
Каппа-каррагенаны - 0,222 (0,148)
Сахароза - 8,936 (5,957)
Хлорид натрия - 1,073 (0,715)
Очищенная вода - 119,15 (79,43)
ОБЩЕЕ КОЛИЧЕСТВО МАТЕРИАЛА - 150,01 (100)
а) Получение дисперсии липосом
Смесь, кг:
Желатин В 150 - 7,149
йота-Каррагенаны - 1,565
каппа-Каррагенаны - 0,222
Сахароза - 8,936
NaCl - 1,073
Na+-xeнодеoксихолат - 1,131
Очищенная вода (количество, достаточное для 150 кг) - 118,00
предварительно перемешивают в мешалке со скоростью 10 об/мин в условиях вакуума, при этом ее планетарная передача вращается со скоростью 1500 об/мин в течение 1,5 ч.
б) Введение кальцитонина
Последовательными добавками концентрированной уксусной кислоты (6 н.) снижают рН смеси до получения устойчивого рН 4,5. Затем добавляют 4,075 г кальцитонина лосося (Bachem California) с удельной активностью 7017 МЕ/мг.
в) Введение фосфолипидов в раствор, полученный на стадии а)
Соевые лецитины (11,915 кг) добавляют на стадии предварительного перемешивания в мешалку, вращающуюся со скоростью
10 об/мин, планетарная передача которой вращается со скоростью 1500 об/мин, в течение 5 часов в условиях вакуума (-> приготовление эмульсии).
Конечную дисперсию получают при повышенных скоростях вращения планетарной передачи (25 об/мин) и турбины (2500 об/мин) в течение времени, достаточного для достижения полидисперсности менее 40%.
Получают дисперсию липогелосом® в водной фазе.
При наблюдениях под микроскопом при негативнной окраске, замораживании-скалывании, криотрансмиссионной микроскопии и ядерной микроскопиии отмечены везикулы или скопления везикул с характерным для фосфолипидных бислоев видом; негативная окраска позволила наблюдать более или менее выраженное присутствие наружного желатинирующего вещества в зависимости от выбранного способа получения и/или разделения.
г) Тангенциальная фильтрация
Один объем дисперсии липогелосом®, полученной на предыдущих стадиях, разбавляют в 20 объемах 0,9%-ного NaCl в горячем состоянии при перемешивании. В разбавитель (0,9%-ный NaCl) добавляют 8,25•10-4% хенодеоксихолата с учетом содержания этого ПАВ в предварительно полученной дисперсии. Не инкапсулированную фазу удаляют непрерывной тангенциальной ультрафильтрацией в горячем виде. Ультрафильтрацию проводят на мембране с выборочной пористостью от 300 до 500 кДа, в зависимости от выбранного класса крупности липогелосом®. Пролученный продукт представляет собой суспензию липогелосом® с инкапсулированным кальцитонином лосося в количестве не менее 17%, в которой диаметр липосом составляет от 20 до 500 нм после ультрафильтрации суспензии через мембрану 300 кДа и от 40 до 500 нм после ультрафильтрации через мембрану 500 кДа.
2) Сушка дисперсии
Полученную дисперсию липогелосом® в жидкой фазе переводят в вакуумную сушилку (50-100 мбар) и выдерживают в течение около 4 часов. Получают довольно однородный порошок очень светлого соломенного цвета, содержащий зерна диаметром от 0,1 мкм до 1 мм.
При наблюдении в электронный микроскоп было отмечено сжимание липидных везикул вследствие обезвоживания. Кроме того, было замечено, что, если в жидком состоянии липогелосомы® часто скапливаются внутри однородной желатинированной оболочки вокруг многочисленных отдельных пузырьковых структур, на этапе сушки такая желатиновая оболочка преобразуется в сухие волокна желатинирующего вещества на поверхности скоплений, а также на поверхности отдельных пузырьковых структур.
В качестве варианта сушки последняя проводится следующим образом: дисперсию липогелосом® в водной фазе непосредственно подают в сушилку с вращающимися цилиндрами (температура цилиндров 120-150oС, скорость вращения 3-6 об/мин). Затем полученную "стружку" измельчают и калибруют на соответствующей решетке. Таким образом получают порошок из липогелосом®, свойства которого описаны выше.
Сушка может быть оптимизирована за счет добавки наполнителя, например мальтодестрина или β-циклодекстринов.
ПРИМЕР 3: сравнение действия свободного кальцитонина и кальцитонина, инкапсулированного в векторы, полученные в примере 2, при пероральном введении на крысе.
Действие препарата, полученного в примере 2, на кальциемию, кальциурию, фосфатемию и фосфатурию сравнивали с действием кальцитонина в свободной форме при пероральном введении. Также сравнили фармакокинетику, полученную для обеих форм вводимого кальцитонина.
Также были проанализированы и другие параметры: трансаминазы (SGOT и SGPT) и гликемия.
Важно отметить, что действие кальцитонина у крысы или человека с нормальным содержанием кальция в крови трудно выявить и что реакция на этот гормон проявляется значительно более отчетливо при лечении больных пациентов (с гиперкальциемией).
Протокол эксперимента
Приготовление "липогелосом®-кальцитонина"
См. пример 2.
Животные и фармакологическое лечение
Животные
Было сформировано 10 групп крыс Wistar Ico (IOPS AF/Han, IFFA CREDO) пo 10 штук в каждой, т. е. всего 100 крыс в возрасте 6 недель и весом от 160 до 180 г.
Вес животных определяют в начале эксперимента с тем, чтобы на уровне этого параметра гарантировать однородное распределение крыс по группам.
6 подопытных групп предварительно содержат в течение 7 суток на базовой стерильной диете типа "АO4" (ф. UAR (завод рационального питания) (поставщик диетических продуктов)).
Крыс прекращают кормить и вводят глюкозу ad libilum за 24 часа до введения экспериментальных доз.
Перед введением экспериментальных доз проверяют вес животных.
Экспериментальная схема
Группы А, В, С, D, Е, F, G, H, I, J были сформированы следующим образом:
- группа А: 10 контрольных крыс, от которых были взяты плазма и моча в момент времени 0;
- группа В: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии "липогелосомы®-кальцитонин" -500 кДа (приблизительная концентрация кальцитонина 54 МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 45 минут;
- группа С: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии липогелосомы®-Са/500 кДа (приблизительная концентрация кальцитонина 54МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 90 минут;
- группа D: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии "липогелосомы®-кальцитонин" -500 кДа (приблизительная концентрация кальцитонина 54 МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 180 минут;
- группа Е: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии "липогелосомы®-кальцитонин" 500 кДа (приблизительная концентрация кальцитонина 54 МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 300 минут;
- группа F: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии из свободного кальцитонина (концентрация 54 МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 45 минут;
- группа G: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии из свободного кальцитонина (концентрация 54 МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 90 минут;
- группа Н: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии из свободного кальцитонина (концентрация 54 МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 180 минут;
- группа 1: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии из свободного кальцитонина (концентрация 54 МЕ/крыса или 330 МЕ/кг); забор плазмы и мочи проводят через 300 минут;
- группа J: 10 интубированных крыс, каждой крысе было введено 1,8 мл суспензии "липогелосомы®-кальцитонин"-300 кДа (приблизительная концентрация кальцитонина 36 МЕ/крыса или 228 МЕ/кг); забор плазмы и мочи проводят через 90 минут.
Анестезия производилась с применением Rompun® (2%-ный Ксилацин; 10 мг/кг)/Imalgene® (10%-ный Кетамин; 60 мг/кг) внутрибрюшной инъекцией в последовательности, приведенной в схеме эксперимента.
Взятие проб
Забор крови из брюшной аорты с помощью катетера при анестезии производился: в группе А в момент времени 0, в группах В и F через 45 мин, в группах С, G и J - через 90 мин, в группах D и Н - через 180 мин, в группах Е и I - через 300 мин. В мочевой пузырь вводилась канюла и собиралась моча одновременно с взятием крови.
Общую плазму получают после разделения проб крови на центрифуге со скоростью вращения 3000 об/мин в течение 15 минут в пробирках 3,8% ЭДТА (не белковый антикоагулянт).
Анализы
Для каждой пробы плазмы кальциемию, фосфатемию и трансаминазы определяют колориметрией.
Статистическая обработка данных
Результаты замеров выражают в средних значениях ± SEM для десяти крыс каждой группы. Данные сравнивают с помощью статистических тестов, соответствующих данному типу протокола (исследование параметров фармакокинетики). Выбранным статистическим тестом был тест ANOVA или анализ, вариантности, величины расхождений определяли тестом Фишера и тестом Шеффа, являющимся более дискриминантным.
Применили два способа выражения результатов: графическое представление средних значений для 10 величин, относящихся к рассматриваемому параметру, и сопоставительный анализ AUC (areas under the curve (участки под кривой на графике)). Такой способ выражения позволил уточнить расхождения между полученными амплитудами ответных реакций.
Полученные результаты представлены в соответствии с техникой фармакокинетики: изменение значения параметра рассматривается с учетом времени. В данном случае речь не идет об исследовании эффекта дозы.
Результаты
Фармакокинетическое действие свободного кальцитонина или кальцитонина, инкапсулированного в виде "липогелосомы®-кальцитонин" на содержание кальция в крови
На фиг.1 показаны изменения содержания кальция в крови в зависимости от времени. Дозы, применявшиеся для определения содержания кальция, приготовлены колометрическим методом, приведенным в фармакопее. Основные показатели кальциемии (в момент 0) очень хорошо коррелируют с предыдущими данными. Каждая точка соответствует среднему значению для 10 показателей, т. е. 9 отдельным группам по 10 крыс. Средние значения выражены посредством ± SEM. Для не объединенных в пары величин результаты сопоставляют путем анализа вариантности (ANOVA). Значительные расхождения отмечены символом **. Такой символ указывает на значимость очень дикриминантного теста Шеффа.
После орального введения свободного кальцитонина было отмечено временное понижение кальциемии. Это объясняется тем, что при введении большого количества пептида типа кальцитонина его небольшой процент (1%) преодолел барьер кишечника, не претерпев изменения. В данном случае было введено 330 ME, что соответствует прохождению через лимфу в количестве 3,3 ME (прохождение из просвета кишечника к плазме по лимфатическим каналам). Однако действие кальцитонина через путь IV начинается с 0,9 ME. Следовательно, такое действие свободного кальцитонина является нормальным. Гипокальциемия после орального введения кальцитонина снижается и достигает нормальной величины через 90 минут.
В отношении липогелосом®-кальцитонина такой эффект отмечался через 45 минут, однако эффект гипокальцемии возрос в два раза через 180 минут. Это обстоятельство указывает на то, что препарат "липогелосомы®" с эквивалентным содержанием кальцитонина обладает более выраженным фармакологическим действием по сравнению со свободным кальцитонином. Такой двухфазный эффект можно отнести к активности кальцитонина, связанного с внешним слоем липогелосом® (первое воздействие), второй эффект можно было бы объяснить присутствием кальцитонина внутри липогелосом®. Следовательно, отмечается эффект запаздывания, сопровождающийся двойным увеличением активности активного вещества.
На фиг. 2 показана разница между участками под кривой на графике (AUC) при кальциемии после приема свободного кальцитонина и при кальциемии после перорального введения липогелосом®-кальцитонина. Наблюдающаяся разница весьма значительна в тесте Шеффа. AUC соответствует сумме всех величин, полученных в ходе эксперимента; сначала эти величины интегрировали, затем сравнивали. AUC соответствует участку под кривой изменений кальцемии в зависимости от времени. Чем меньше AUC, тем выше эффект гипокальциемии (так как кривая приближается к оси абсцисс).
Фармакокинетика действия свободного кальцитонина и кальцитонина, инкапсулированного в форме "липогелосомы®-кальцитонин", на кальциурию
Ограничения, приведенные по поводу результатов, касающихся плазмы и полученных атомной абсорбцией, подтвердились анализом показателей мочи крыс, получавших свободный и инкапсулированный кальцитонин. В самом деле, фиг.3 подтверждает показатели фиг. 1, так как гипокальциемия постоянно сопровождается повышением кальциурии.
Фармакокинетика действия свободного кальцитонина и кальцитонина, инкапсулированного в форме "липогелосомы®-кальцитонин", на фосфатемию (фиг.4)
Липогелосомы®-кальцитонин и свободный кальцитонин вызывают гипофосфатемию (колориметрическая дозировка), которая сохраняется только в группах, получающих липогелосомы®-кальцитонин. Показательные результаты получены в тесте Фишера. Приведенное на фиг.5 сравнение соответствующих участков под кривой графика (AUC) очень четко подтверждает данные фармакокинетики.
Разница между двумя участками под кривой значительна в тесте Шеффа.
Фармакокинетика действия свободного кальцитонина и кальцитонина, инкапсулированного в форме "липогелосомы®-кальцитонин", на фосфатурию (фиг.6)
Количественные анализы проб мочи проводились методом атомной абсорбции, как и при определении кальциурии (см. выше).
Эти результаты менее показательны, чем результаты кальциурии. И, следовательно, сложно делать выводы. Тем не менее представляется, что через 180 минут действие липогелосом®-кальцитонина превосходило эффект не инкапсулированного лекарства.
Токсикологический аспект исследования
Благодаря взятиям проб стало возможным количественное определение трансаминаз во время введения обеих форм активных веществ. Анализ показателей SGOT с учетом времени показал, что инкапсулированная форма кальцитонина (фиг. 7) проявляет тенденцию к гипотоксичности по сравнению с его свободной формой. Такая разница очень контрастно проявляется в тесте Фишера через 300 минут. Тем не менее сравнение участков под кривой графика (AUC) не выявило значительных расхождений в изменении показателей SGOT в зависимости от времени.
Такая тенденция умеренного повышения трансаминаз ("гипотоксичность") подтверждается анализом значений SGPT в зависимости от времени (фиг.8).
Эти данные указывают на сильно выраженную гипотоксичность инкапсулированной формы кальцитонина по сравнению с его свободной формой. На фигуре 9 приведена разница между участками под кривой для SGPT в группах, которые получали свободный кальцитонин, и в группах, которые получали инкапсулированный кальцитонин.
В тесте Шеффа разница между обоими участками значительна. Такой эффект может использоваться, в частности, при введении высокотоксичных активных веществ с целью снижения их гепатотоксического действия.
Выводы
- Инкапсуляция кальцитонина в виде липогелосом® способствует прохождению через барьер кишечника.
- Сравнение с эффектом от орального введения свидетельствует о реальном потенциале формы липогелосомы®, тем более, что теперь стало возможным стабилизировать эту структуру в виде порошка.
- Двухфазный эффект гипокальциемии, вызываемый липогелосомами®-кальцитонином, может быть объяснен распределением кальцитонина по поверхности и внутри липогелосом®.
- Данный эксперимент позволил определить гипотоксичность формы "липогелосомы®-кальцитонин" по сравнению со свободной формой, которая представляется более токсичной.
- Данные, доказывающие превосходство формы "липогелосомы®-кальцитонин" над свободным кальцитонином, были получены методом количественного анализа, рекомендованного фармакопеей.
- Были уточнены оба пика гипокальциемии, вызванной оральным введением обеих форм активного вещества, их время 45 и 180 минут после введения.
- Эффект "запаздывания" липогелосом®-кальцитонина возможно вызван последовательным высвобождением в кишечнике микросфер маточной матрицы: концентраты липогелосом®-кальцитонина постепенно проходят через барьер кишечника.
ПРИМЕР 4: повышение биоэффективности инкапсулированных активных веществ в форме липогелосом® и производных; сравнение липосом и липогелосом®.
1. Сравнение резистентности или устойчивости классических форм: липогелосома® и липосома
Липогелосомы® позволяют получать галеновые формы (порошок), которые невозможны при классических липосомных формах; только липогелосомы® обладают резистентностью к воздействию физиологических условий: рН, температура, моторика кишечника, ферменты, то, что придает им способность к пероральному или пульмональному введению, в то время как при введении липосом такими путями происходит их разрушение.
а) Резистентность к рН и солям желчных кислот кишечника
Проводят серии инкубации липогелосом® и липосом в течение 1 часа при 37oС в присутствии соли желчной кислоты (тауродеоксихолата) с детергентными и, следовательно, разрушающими свойствами по отношению к липидным пузырькам. Результаты свидетельствуют о том, что при содержании 0,25 мМ соли желчной кислоты липогелосомы® оказываются в три раза устойчивее липосом. Резистентность структур анализировали с помощью лазерной гранулометрии (изменение подсчитанного количества частиц, показанное изменением лазерной дифракции в кГц).
Сравнение структуры (наблюдавшейся при лазерной гранулометирии) липогелосом® и липосом через 1 час после инкубации при разных значениях рН показывает, что липогелосомы® сохраняют устойчивость при рН 2,5-9, в то время как липосомы в большинстве своем остаются целостными только при рН 6,3.
Липогелосомы® обладают большей резистентностью, чем липосомы, к рН и концентрации гетерогенных веществ в желудке; это дает основание для вывода, что в желудке липосомы разлагаются, в то время как липогелосомы® сохраняют устойчивость более длительное время.
б) Резистентностъ к температуре и перемешиванию в среде сыворотки
Серии инкубаций липогелосом® и липосом проводят в течение 24 часов при 37oС и перемешивании. Липидные фазы липогелосом® и липосом строго идентичного состава были мечены изотопом (14С) одинаковым способом. Продукты разложения структур обоих типов, липосомы и липогелосомы®, анализируют в зависимости от времени. С учетом полученных результатов представляется, что липидные компоненты липосом высвобождаются легче, чем те же компоненты липогелосом®.
Эти результаты показывают, что форма липогелосом® устойчивее формы липосом.
в) Сравнение размера утечки инкапсулированных активных веществ, содержащихся в липогелосомах® и липосомах
Активное вещество с малым размером частиц (500 Да) инкапсулируют в липогелосомы® и липосомы в одинаковом количестве. Затем оба препарата помещают в среду сыворотки при температуре 37oС, перемешивают и замеряют количество высвободившегося инкапсулированного активного вещества. Количество высвободившегося активного вещества из липосом превышает на 60% количество активного вещества, высвободившегося из липогелосом® (1,6 единицы активного вещества для
липосомы и 1,01 единицы активного вещества для липогелосомы®).
Благодаря такой существенно более высокой стойкости липогелосом® становится возможным получение твердых галеновых форм и, следовательно, пероральное введение, что исключено для липосом традиционного состава.
2. Сравнение биоэффективности липогелосом® и классических липосомных форм на модели клетки
Анализируют различия клеточной интернализации маркера и активного вещества в том случае, когда эти молекулы инкапсулированы и имели форму липогелосом® и липосом.
а) Сравнение клеточной интернализации липосом и липогелосом®
Липосомы и липогелосомы® метят радиоактивными и флюоресцирующими зондами после инкубации в среде в присутствии человеческих макрофагов (штамм ТНР1) в культуре при 37oС, в конце инкубации анализируют сопоставленную интернализацию обоих типов структур (липосомы и липогелосомы®), при этом время инкубации одинаково в обоих случаях. Анализ интернализации проводится разными аналитическими способами.
А. Флюоресцентная микроскопия
На снимках видна интернализация липосом и липогелосом®, в случае с липосомами распределение сигнала было однородным, в то время как распределение сигнала липогелосом® оказалось локализованным во внутриклеточных точечных структурах.
Этот результат свидетельствует о том, что липогелосомы® разлагаются внутри клетки медленнее, чем структуры липосом (в которых сигнал рассеивается в клетке быстрее).
Следовательно, имеет место эффект медленного рассеивания активных веществ, инкапсулированных в липогелосомы®, в то время как в липосомах этот эффект отсутствует.
Б. Мечение радиоактивным изотопом
Подсчет меченных радиоактивным изотопом внутриклеточных липогелосом® и липосом показал, что интернализация липогелосом® в 2,5 раза превышает интернализацию липосом в тех же экспериментальных условиях.
Интернализация охватывает большее количество липогелосом®, чем липосом, этот факт показывает, что клеточная биоэффективность липогелосом® превышает биоэффективность липосом и обусловлена разницей между обоими липосомными структурами: присутствие специального термообратимого геля во внутренней фазе липогелосом®, заполняющего весь объем до поверхности частицы, придает липогелосомам® свойство предпочтительного поглощения клеткой.
В. Проточная цитометрия
Такие эксперименты основаны на сравниваемом клеточном эндоцитозе липогелосом® и липосом, меченных флюоресцентным зондом. После инкубации клетки собирают, пропускают их через проточный цитометр, которым производится количественное определение флюоресцирующего сигнала в каждой клетке. Полученные спектры показывают, что клетки, проходившие инкубацию вместе с липогелосомами®, испускают флюоресцентный сигнал в 2,5 раза больше, чем клетки, прошедшие инкубацию с липосомами.
Интернализация липогелосом® превышает в 2,5 раза интернализацию липосом, этот факт говорит о том, что клеточная биоэффективность липогелосом® превосходит биоэффективность липосом.
б) Сопоставляемая клеточная фармакология липогелосом® - активное вещество/свободное активное вещество
A. AZT и ЗТС, воздействие на макрофаги в культуре
В ходе этих экспериментов липогелосомы®, инкапсулирующие AZT или ЗТС, подвергают инкубации вместе с макрофаговыми клетками человека. Анализировали показатели цитотоксичности свободных и инкапсулированных в липогелосомы® продуктов. Полученные результаты свидетельствуют о том, что инкапсулированные активные вещества обладают эффективностью, превышающей в 150 раз эффективность свободных AZT и ЗСТ, при предельной цитоксичности по отношению к макрофагам в культуре.
Эти эксперименты показывают что при равных количествах инкапсулированное активное вещество обладает эффективностью по отношению к макрофагам, превышающей в 150 раз эффективность свободного активного вещества, вероятно вследствие лучшей клеточной интернализации.
В. Доксорубицин и PEG 4000, воздействие на гепатоциты и дифференцированные эпителиальные клетки кишечника в культуре
Сравнивают клеточную интернализацию двух молекул: доксорубицин и PEG 4000, в свободной или инкапсулированной в виде липогелосомы® форме.
При одних и тех же показателях времени и концентрации инкапсулированная молекула характеризуется увеличением своего проникновения в клетку или фармакологической активностью по отношению к клеткам печени или кишечника от 1,5 до 3 раз.
Эти эксперименты показывают, что биоэффективность молекул, инкапсулированных в виде липогелосом®, возрастает по сравнению с их свободными формами на эпителиальных клетках кишечника или на паренхиматозных клетках печени.
в) Объяснение модифицированной биоэффективности молекул, инкапсулированных в виде липогелосом®
Обычно липосомы претерпевают интернализацию на клеточном уровне вследствие процесса мембранного слияния, так называемой пассивной диффузии, т. е. без использования вторичных мРНК, ответственных за экспрессию мембранного рецептора.
Однако липогелосомы® отличаются от липосом наличием специального термообратимого геля в своей внутренней фазе, заполняющего весь объем до поверхности частицы, а также наличием гелевой пленки на своей внешней поверхности. Такой гель имеет протеосахаридное происхождение (смесь из желатина и каррагеназы).
Различия в клеточной интернализации и, следовательно, биоэффективности между липосомами и липогелосомами® согласно изобретению заключаются преимущественно в наличии и составе такого геля.
На полупористом фильтре (диффузионная чашка) культивируют дифференцированные и недиференцированные клетки кишечника (штаммы: НТ29, HT29gal, T84). Липогелосомы® инкубируют вместе с этими клетками в присутствии или в отсутствие cpt-кАМФ. В присутствии cpt-кАМФ интернализация липогелосом® возрастает в два раза.
Этот эксперимент свидетельствует о том, что интернализация липогелосом® представляет собой явление, зависящее от cpt-кАМФ. В частности, кривая интернализации липогелосом® в зависимости от дозы показывает, что феномен интернализации липогелосом® способен к насыщению. Эти оба существенных фактора говорят о том, что интернализация липогелосом® происходит при посредстве рецептора. Однако такой способ интернализации отличается от процессов эндоцитоза из-за слияния традиционных липосом, не зависящих от рецептора. Следовательно, оптимальная биоэффективность лекарств, инкапсулированных в липогелосомы®, объясняется участием рецептора к липогелосомам®.
г) Биоэффективность форм "липогелосомы®" in vivo (на крысе)
См.пример 3.
д) Биоэффективность форм "липогелосомы®" на модели "диффузионная камера"
Эпителиальные клетки кишечника культивировали до слияния на полупористом фильтре, обеспечивающим получение системы с двумя отделениями, в которой "плазматическая" среда отделена от среды "просвет кишечника". Липогелосомы® расположили со стороны "просвета кишечника", затем по окончании периода инкубации анализировали "плазматическую" среду.
Лазерной гранулометрией в этом отделении были обнаружены структуры с характеристиками, совпадающими с характеристиками липогелосом®, помещенных в начале эксперимента в отделение "просвет кишечника". После добавки некоторого количества хенодеоксихолата в состав липогелосом® увеличилось количество частиц в "плазматическом" отделении.
Эти эксперименты показывают, что некоторое количество липогелосом® проходит через эпителий кишечника, вероятно, благодаря процессу параклеточного переноса или трансцитоза. Такой перенос усиливается в том случае, когда состав липогелосом® модифицируют добавкой хенодеоксихолата.
Следовательно, можно оптимизировать трансэпителиальный перенос в кишечнике молекул, инкапсулированных в липогелосомы® (например, при пероральном приеме); форма липогелосом® позволяет повысить биоэффективность инкапсулированных молекул в кишечнике, такое свойство усиливается в том случае, когда в состав липогелосом® введен хенодеоксихолат.
Как следует из вышеизложенного, изобретение ни в коем случае не ограничивается этими вариантами своего выполнения, осуществления и применения, как это было подробно описано выше; напротив, оно включает в себя все варианты, которые могут возникнуть в воображении специалиста в данной области и не выходят за рамки настоящего изобретения и его объема.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОРОШКООБРАЗНЫЕ КОМПОЗИЦИИ УНИЛАМЕЛЛЯРНЫХ ЛИПОСОМ | 1998 |
|
RU2214231C2 |
| МИКРОСФЕРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2154465C2 |
| Способ получения полисахаридсодержащих полимерных матриц | 2017 |
|
RU2657608C1 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2005 |
|
RU2574926C2 |
| НОВЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2395493C2 |
| Способ лечения онкологических заболеваний с помощью инъекций лекарственного препарата | 2018 |
|
RU2706427C1 |
| Способ лечения онкологических заболеваний с помощью инъекций лекарственного препарата | 2018 |
|
RU2706356C1 |
| Способ лечения онкологических заболеваний с помощью инъекций лекарственного препарата | 2019 |
|
RU2712212C1 |
| ЗАМЕДЛЕННОЕ ВЫСВОБОЖДЕНИЕ ПРОТИВОИНФЕКЦИОННЫХ АГЕНТОВ | 2006 |
|
RU2438655C2 |
Изобретение относится к медицине и касается липосомных векторов активных веществ, которые состоят из порошковой композиции, содержащей главным образом униламеллярные липосомы с внешней липидной фазой, образованной липидами 4-го класса (фосфолипидами), при необходимости ассоциированными с веществами 2-го класса, веществами 3-го класса и/или с веществами 5-го класса (солями желчных кислот, производными фусидовой кислоты), и с внутренним водным ядром, образованным смесью М по меньшей мере двух разных желатинирующих неполимеризующихся веществ G1 и G2, температура фазового перехода "гель-золь" которых выше или равна 37oС, причем G1 представляет собой желатинирующеее вещество, выбираемое из желатинов и каррагенанов, с температурой плавления ниже или равной 45oС, а G2 выбирается из каррагенанов со свойствами, отличными от каррагенанов для G1, и целлюлоз, причем желатинирующее вещество G2 имеет температуру плавления выше или равную 45oС, при этом липосомы имеют диаметр от 20 нм до 1 мкм, предпочтительно от 20 до 500 нм; указанная композиция имеет вид частиц со средним диаметром 10 - 1000 мкм и состоит из одной или нескольких указанных липосом, окруженных оболочкой, выбираемой из группы, содержащей обезвоженный термообратимый водный гель, идентичный водному гелю внутреннего ядра, из декстринов или их смеси, с таким расчетом, чтобы в ней содержалось в среднем 1016-1018 липосом/г порошка и по меньшей мере одно активное вещество, введенное либо в желатинированное внутреннее ядро, либо в наружную липидную фазу. Изобретение позволяет получать порошкообразные композиции, обладающие искомыми свойствами, в частности улучшенной биодоступностью при пероральном вводе. 5 с. и 14 з.п.ф-лы, 9 ил.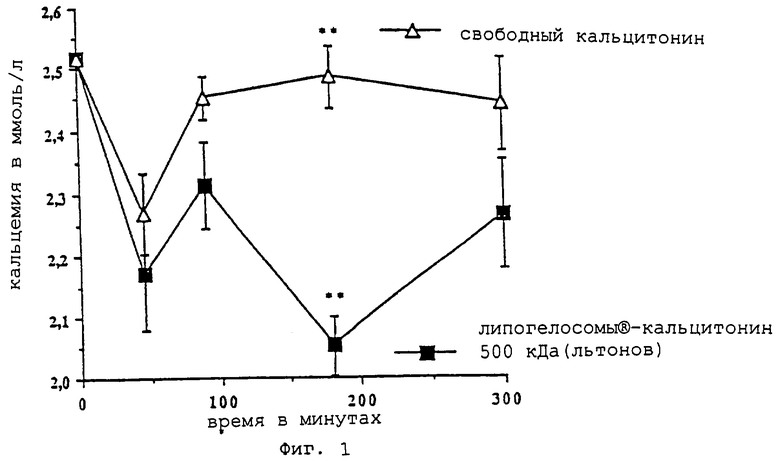
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| US 5464629, 07.11.1995 | |||
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2003-05-10—Публикация
1998-06-11—Подача