Изобретение относится к способу получения (-)-транс-1-бензил-3-гидроксиметил-4-(4-фторфенил)пиперидина, представляющего собой ценное промежуточное соединение для получения пароксетина (пароксетин=(-)-транс-4-(4-фторфенил)-3-{ [3,4-(метилендиокси)фенокси] метил}пиперидин) и к способу получения пароксетина.
Из патента США 4,007,196 известны соединения, обладающие антидепрессивным действием. Одно из соединений, описанных в данном патенте, известно под названием "пароксетин" и имеет структуру согласно формуле А: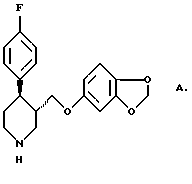
Было установлено, что данное соединение является особенно полезным при лечении депрессии, и описано несколько способов его получения.
В международной заявке, опубликованной под WO 96/36636 (которая включается в данное описание в качестве ссылки), описан один из этих способов. Стадия С согласно основному пункту формулы изобретения данной заявки описывает восстановление соединения формулы В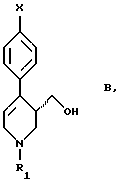
с получением соединения формулы С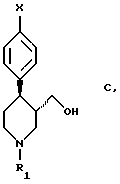
в которой Х означает галоген, предпочтительно фтор, и R1 означает алкил с 2-5 атомами углерода, фенилалкил с 1 - 5 атомами углерода в алкильной части или замещенный фенилалкил с 1 - 5 атомами углерода в алкильной части. Восстановление осуществляют с использованием гидрида металла, согласно п. 4 формулы изобретения предпочтительно представляющего собой LiAIH4 или NaAIH4. Единственный пример, приведенный в этой заявке, относится к соединению формулы В, в которой Х означает фтор, а R1 - этил, и которое восстановили с использованием смеси гидрида натрия и алюмогидрида лития.
Было установлено, что при осуществлении реакции согласно условиям, описанным в заявке WO 96/36636, когда Х означает фтор, а R1 - бензил, наблюдается неприемлемая степень дефторирования. Отделение этой примеси от желаемого продукта на данной стадии является сложным и приводит к присутствию дефторированного аналога пароксетина в получаемом продукте. И там является сложным отделять дефторированный аналог пароксетина от пароксетина. В результате требуются длительные процессы отделения, которые приводят к потери материала и повышению стоимости процесса.
Задачей данного изобретения является разработка способа получения 1-замещенного 3-гидроксиметил-4-(4-фторфенил)пиперидина, имеющего меньше побочных продуктов.
Поставленная задача решается в способе получения соединения формулы (I)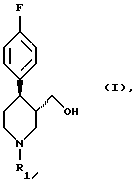
в которой R1 означает аминозащитную группу, путем восстановления соединения формулы (II)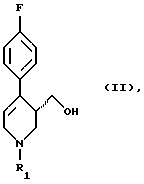
в которой R1 имеет вышеуказанное значение, гидридом металла в среде разбавителя за счет того, что процесс ведут в присутствии неорганической соли, выбранной из группы, включающей соль лития, натрия, магния, кальция, цинка, лантана или железа или их смесь, причем используют соединение формулы (II), у которого аминозащитная группа выбрана из группы, включающей а) аллил, б) бензгидрил, в) метоксиметил, г) бензилоксиметил, д) тетрагидропиранил, е) незамещенный или замещенный бензил, ж) ди(п-метоксифенил)метил, з) трифенилметил, и) (п-метоксифенил)дифенилметил, к) дифенил-4-пиридилметил, л) 2,4,6-триметилбензолсульфонил, м) толуолсульфонил, н) бензилсульфонил, о) алкил с 1 - 6 атомами углерода, п) трифторалкил с 1 - 4 атомами углерода, р) алкинил и с) п-метоксибензил или незамещенный или замещенный аммоний, а в качестве гидрида металла - соединение, выбранное из группы, включающей гидрид натрия, калия, магния или кальция, боргидрид натрия, калия или лития, алюмогидрид лития или натрия, гидрид алюминия, бис-(2-метоксиэтокси)алюмогидрид натрия, моно(С1-4-алкокси)алюмогидрид лития, ди(С1-4-алкокси)алюмогидрид лития, диэтилалюмогдирид натрия или их смесь.
Целесообразно аминозащитная группа является инертной в отношении восстановления гидридом металла. Предпочтительно аминозащитная группа представляет собой бензил, незамещенный или замещенный на фенильном кольце одной или несколькими из следующих групп: алкил с 1 - 4 атомами углерода, алкоксигруппа с 1 - 4 атомами углерода, галоген, нитрогруппа. Более предпочтительно R1 означает бензил.
Предпочтительно гидрид металла представляет собой алюмогидрид лития или натрия, а наиболее предпочтительно алюмогидрид лития.
Гидрид металла обычно используют в количестве от 0,5 до 5 мольных эквивалентов в пересчете на количество соединения формулы (II). Предпочтительно количество гидрида металла составляет от 0,75 до 1,25 мольных эквивалентов, а еще более предпочтительно от 0,90 до 1,10 мольных эквивалентов.
Предпочтительно неорганическая соль представляет собой галоидную соль лития, натрия, кальция, цинка, магния, лантана или железа, или их смесь. Еще более предпочтительно неорганическая соль выбрана из группы, включающей хлорид лития, натрия, кальция, цинка, железа (II), железа (III), лантана или магния, фторид магния, бромид магния или йодид магния или их смеси. Наиболее предпочтительно неорганическая соль представляет собой хлорид, бромид или йодид магния. Особенно предпочтительной солью является хлорид магния.
Подробности механизма предлагаемого способа не были изучены. Специалисты данной области будут согласны с тем, что активный восстановительный агент может образоваться в результате реакции первоначально используемого гидрида металла с неорганической солью. Например, в случае алюмогидрида лития и хлорида магния активными соединением может быть, по меньшей мере, одно соединение из группы, включающей гидрид магния, алюмогидрид хлор-магния, алюмогидрид магния или алюмогидрид литий-магния или комплекс хлорида магния и алюмогидрида лития. Предлагаемый способ включает все возможности.
Обычно неорганическую соль используют в количестве от 0,25 до 5 мольных эквивалентов в пересчете на количество соединения формулы (II). Предпочтительно количество неорганической соли составляет от 0,5 до 1,5 мольных эквивалентов, а еще более предпочтительно от 0,75 до 1,25 мольных эквивалентов.
Пригодным разбавителем является органическая жидкость, инертная в отношении используемого гидрида металла, предпочтительно являющаяся также растворителем соединения формулы (II). Предпочтительно разбавитель представляет собой простой эфир, или углеводород, или их смесь. Более предпочтительно разбавитель выбран из группы, включающей тетрагидрофуран, толуол, диоксан, диэтиловый эфир, простой диизопропиловый эфир, простой т-бутилметиловый эфир, диметиловый эфир диметиленгликоля, этиленгликолевый диметиловый эфир и их смеси. Наиболее предпочтительным разбавителем является тетрагидрофуран.
Обычно разбавитель используют в количестве от 1 до 100 вес. ч. в пересчете на количество соединения формулы (II). Предпочтительно количество разбавителя составляет от 2 до 50 вес.ч. в пересчете на количество соединения формулы (II), а еще более предпочтительно от 3 до 10 вес.ч.
Целесообразно предлагаемый способ осуществляют при температуре от -70oС до температуры кипения используемого разбавителя. Предпочтительной является температура в пределах от 0oС до 150oС, более предпочтительной в пределах от 0oС до 100oС, а наиболее предпочтительной в пределах от 50oС до 70oС.
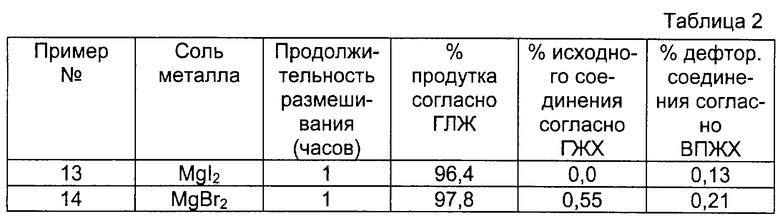
Количество образуемого дефторированного соединения обычно находится в пределах от 0,001 до 1%. Данная величина относится к результату, получаемому с помощью высокопроизводительной жидкостной хроматографии при условиях, приведенных ниже в примерах. Предпочтительно количество образуемого дефторированного содениения составляет от 0,001 до 0,5%, более предпочтительно от 0,001 до 0,2%.
Преимущество предлагаемого способа заключается в том, что с его помощью можно получать предшественник пароксетина в чистом виде. Пароксетин можно получать в чистом виде из соединений формулы (I) путем а) превращения гидроксигруппы в отщепляемую группу, например, гало- или тозилоксигруппу, б) взаимодействия с сезамолом (= 3,4-метилендиоксифенол) или его солью, в) удаления защитной группы R1 и в случае необходимости, г) образования соли, например гидрохлорида в безводной форме или гемигидрата.
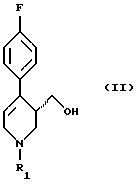
Следовательно дальнейшим объектом данного изобретения является способ получения пароксетина или его соли путем восстановления соединения формулы (II)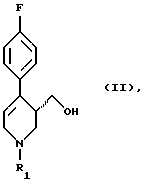
в которой R1 означает аминозащитную группу, гидридом металла в среде разбавителя и перевода гидроксильной группы получаемого соединения формулы (I)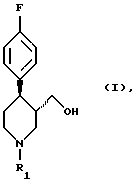
в которой R1 имеет вышеуказанное значение, в удаляемую группу с последующим взаимодействием с 3,4-метилендиоксифенолом или его солью, удалением аминозащитной группы R1 и выделением целевого продукта в свободном виде или в виде соли за счет того, что восстановление соединения формулы (II) гидридом металла ведут в присутствии неорганической соли, выбранной из группы, включающей соль лития, натрия, магния, кальция, цинка, лантана или железа или их смесь, причем используют соединение формулы (II), у которого аминозащитная группа выбрана из группы, включающей а) аллил, б) бензгидрил, в) метоксиметил, г) бензилоксиметил, д) тетрагидропиранил, е) незамещенный или замещенный бензил, ж) ди(п-метоксифенил)метил, з) трифенилметил, и) (п-метоксифенил)дифенилметил, к) дифенил-4-пиридилметил, л) 2,4,6-триметилбензолсульфонил, м) толуолсульфонил, н) бензилсульфонил, о) алкил с 1 - 6 атомами углерода, п) трифторалкил с 1 - 4 атомами углерода, р) алкинил и с) п-метоксибензил или незамещенный или замещенный аммоний, а в качестве гидрида металла - соединение выбранное из группы, включающей гидрид натрия, калия, магния или кальция, боргидрид натрия, калия или лития, алюмогидрид лития или натрия, гидрид алюминия, бис-(2-метоксиэтокси)алюмогидрид натрия, моно(С1-4-алкокси)алюмогидрид лития, ди(С1-4-алкокси)алюмогидрид лития, диэтилалюмогдирид натрия или их смесь.
Предпочтительно в качестве неорганической соли используют галоидную соль. Более предпочтительно в качестве неорганической соли используют хлорид, бромид или йодид магния.
Предпочтительным разбавителем являются простой эфир, углеводород или их смесь.
Изобретение поясняется с помощью нижеследующих примеров. Продукты, получаемые согласно данным примерам, характеризованы с помощью одного из следующих методов: газо жидкостной хроматографии, высокопроизводительной жидкостной хроматографии, элементарного анализа, спектроскопии ядерного магнитного резонанса, инфракрасной спектроскопии.
Дефторированное содеинение представляет собой (-)-транс-1-бензил-3-гидроксиметил-4-фенилпиперидин.
ПРИМЕРЫ
Пример 1. (-)-Транс-1-бензил-3-гидроксиметил-4-(4-фторфенил)пиперидин
2,0 мл 1 М. раствора алюмогидрида лития в тетрагидрофуране в атмосфере азота осторожно добавляют к 0,19 г в общем безводного (1,5 % воды) хлорида магния. Полученную смесь размешивают и нагревают до температуры 50oС, после чего в течение примерно 2 минут каплями добавляют раствор 0,60 г (+)-1 -бензил-3-гидроксиметил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина (получение см. заявку WO 96/36636) в 1,7 мл тетрагидрофурана. Реакционную смесь размешивают и кипятят с обратным холодильником в течение 4,2 часов. Затем охлаждают до комнатной температуры и размешивают в ледяной/водной бане, одновременно добавляя сперва 0,1 мл воды, а затем 0,1 мл 5 М. раствора гидроокиси натрия и 0,1 мл воды. Суспензию разбавляют путем добавления 5 мл тетрагидрофурана, и смесь фильтруют. Остаток трижды промывают, каждый раз используя 5 мл тетрагидрофурана, и объединенные фильтраты и промывные растворы упаривают при пониженном давлении, в результате чего получают 0,49 г желтого масла, которое исследуют путем газожидкостной хроматографии, хиральной высокопроизводительной жидкостной хроматографии и 1H-ЯМР.
Условия газожидкостной хроматографии:
Колонка: DB1 1,5 мкм, 15 м х 0,53 мм
Поток газообразного носителя (В): 4,5 мл/мин, первоначальная температура:
40oС в течение 1 минуты. Повышение температуры: 5oС в минуту до 300oС в течение 7 минут.
Условия высокопроизводительной жидкостной хроматографии:
Колонка: длина 15 см, внутренний диаметр 4,6 мм, наполненная частицами силикагеля, поверхность которых модифицирована химически связанными октилсилиловыми группами; размер частиц: 5 мкм, температура в колонке: 35oС Длина волн: 214 нм.
Подвижная фаза: 15 об. % от ацетонитрила, 0,1 об.% от ортофосфорной кислоты и 0,1 вес.% в пересчете на объем бутансульфоната натрия в воде.
Согласно внутренней нормализации полученный продукт имеет чистоту 98,7% и содержит 0,3% дефторированного соединения согласно исследованию с помощью высокопроизводительной жидкостной хроматографии.
Пример 2. (-)-Транс-1-бензил-3-гидроксиметил-4-(4-фторфенил)пиперидин
16,7 мл 1 М. раствора алюмогидрида лития в тетрагидрофуране в атмосфере азота осторожно добавляют к 1,58 г в общем безводного (1,5% воды) хлорида магния. Полученную смесь размешивают и нагревают до температуры 50oС, после чего в течение примерно 5 минут каплями добавляют раствор 5,0 г (+)-1-бензил-3-гидроксиметил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина в 14,2 мл тетрагидрофурана. Реакционную смесь размешивают и кипятят с обратным холодильником в течение 6 часов. Затем охлаждают до комнатной температуры и размешивают в ледяной/водной бане, одновременно добавляя сперва 0,8 мл воды, а затем 0,8 мл 5 М. раствора гидроокиси натрия и 0,8 мл воды. Суспензию разбавляют путем добавления 5 мл тетрагидрофурана, и смесь фильтруют. Остаток трижды промывают, каждый раз используя 10 мл тетрагидрофурана, и объединенные фильтраты и промывные растворы упаривают при пониженном давлении, в результате чего получают 3,3 г желтого масла, которое исследуют путем газожидкостной хроматографии, хиральной высокопроизводительной жидкостной хроматографии и 1H-ЯМР при вышеуказанных условиях. Получаемый продукт имеет чистоту 97,0% и согласно внутренней нормализации содержит 0,2% дефторированного соединения согласно данным высокопроизводительной жидкостной хроматографии.
Примеры 3-8
Примеры 3-8 осуществляют аналогично примеру 1 при условиях, указанных в таблице 1. В таблице 1 использованы следующие сокращения:
М. экв. (II) означает мольные эквиваленты в пересчете на количество соединения формулы (II), ГЖХ - газожидкостная хроматография, ВПЖХ - высокопроизводительная жидкостная хроматография, % (-F) - % дефторированного содениения, ТГФ - тетрагидрофуран.
Указанные в этих колонках величины относятся к процентам согласно внутренней нормализации.
Пример 9. (-)-Транс-1-бензил-3-гидроксиметил-4-(4-фторфенил)пиперидин
2,0 мл 1 М. раствора алюмогидрида натрия в тетрагидрофуране в атмосфере азота осторожно добавляют к 0,19 г в общем безводного (1,5 % воды) хлорида магния. Полученную смесь размешивают и нагревают до температуры 50oС, после чего в течение примерно 2 минут каплями добавляют раствор 0,60 г (+)-1-бензил-3-гидроксиметил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина в 1,7 мл тетрагидрофурана. Реакционную смесь размешивают и кипятят с обратным холодильником в течение 4 часов. Затем охлаждают до комнатной температуры и размешивают в ледяной/водной бане, одновременно добавляя сперва 0,1 мл воды, а затем 0,1 мл 5 М. раствора гидроокиси натрия и 0,1 мл воды. Суспензию разбавляют путем добавления 5 мл тетрагидрофурана, и смесь фильтруют. Остаток трижды промывают, каждый раз используя 5 мл тетрагидрофурана, и объединенные фильтраты и промывные растворы упаривают при пониженном давлении, в результате чего получают 0,49 г желтого масла, которое исследуют путем газожидкостной хроматографии, хиральной высокопроизводительной жидкостной хроматографии и 1H-ЯМР при вышеуказанных условиях. Согласно данным газожидкостной хроматографии в получаемом продукте имеется еще исходное соединение в количестве 13,2 %. Согласно данным высокопроизводительной жидкостной хроматографии количество дефторированного соединения составляет менее чем 0,1%.
Пример 10. (-)-Транс-1-бензил-3-гидроксиметил-4-(4-фторфенил)пиперидин
2,0 мл 1 М. раствора алюмогидрида лития в тетрагидрофуране и 0,69 мл толуола в атмосфере азота одновременно осторожно добавляют к 0,53 г в общем безводного (1,5% воды) хлорида магния. Полученную смесь размешивают и нагревают до температуры 50oС, после чего в течение примерно 5 минут каплями добавляют раствор 2,60 г (+)-1-бензил-3-гидроксиметил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина (получаемого по способу согласно заявке WO 96/36636) в 3,6 мл тетрагидрофурана и 0,4 мл толуола. Реакционную смесь размешивают и кипятят с обратным холодильником в течение 3,5 часов. Затем охлаждают до комнатной температуры и размешивают в ледяной/водной бане, одновременно добавляя 4,1 мл 5 М. раствора гидроокиси натрия. Суспензию разбавляют путем добавления 10 мл тетрагидрофурана, и смесь фильтруют. Остаток промывают с использованием 10 мл тетрагидрофурана, и объединенные фильтраты и промывные растворы упаривают при пониженном давлении, в результате чего получают 1,83 г желтого масла, которое исследуют путем газожидкостной хроматографии, хиральной высокопроизводительной жидкостной хроматографии и 1H-ЯМР. Получаемый целевой продукт содержит дефторированное соединение в количестве 0,24 %.
Пример 11. (-)-Транс-1-бензил-3-гидроксиметил-4-(4-фторфенил)пиперидин
3,76 мл 1 М. раствора алюмогидрида лития в тетрагидрофуране в атмосфере азота осторожно добавляют к 0,55 г в общем безводного бромида магния. Полученную смесь размешивают и нагревают до температуры 50oС, после чего в течение примерно 5 минут каплями добавляют раствор 1,12 г (+)-1-бензил-3-гидроксиметил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина в 2,2 мл тетрагидрофурана. Реакционную смесь размешивают и кипятят с обратным холодильником в течение 4,2 часов. Затем охлаждают до комнатной температуры и размешивают в ледяной/водной бане, одновременно добавляя 2 мл 0,5 М. раствора гидроокиси натрия и 0,1 мл воды. Суспензию разбавляют путем добавления 7 мл тетрагидрофурана, и смесь фильтруют. Остаток промывают с использованием 7 мл тетрагидрофурана, и объединенные фильтраты и промывныые растворы упаривают при пониженном давлении, в результате чего получают 0,99 г желтого масла, которое исследуют путем газожидкостной хроматографии, хиральной высокопроизводительной жидкостной хроматографии и 1H-ЯМР. Получаемый целевой продукт содержит 0,18% дефторированного соединения.
Пример 12. (-)-Транс-1-бензил-3-гидроксиметил-4-(4-фторфенил)пиперидин
7,24 мл 1 М. раствора алюмогидрида лития в тетрагидрофуране в атмосфере азота при размешивании осторожно добавляют к 0,698 г в общем безводного хлорида магния в 32 мл тетрагидрофурана, не давая температуре повышаться до 20oС. Полученную смесь размешивают и нагревают до температуры 50oС, после чего в течение примерно 30 минут каплями добавляют раствор 2,15 г (+)-1 -бензил-3-гидроксиметил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина (полученного по методу согласно заявке WO 96/36636) в 3,92 мл тетрагидрофурана и 2,32 мл толуола. Реакционную смесь размешивают и кипятят с обратным холодильником в течение 4 часов. Затем охлаждают в ледяной/водной бане до температуры 0 - 5oС, одновременно добавляя 2,48 мл 5 вес.%-ного раствора гидроокиси натрия. Суспензию фильтруют, остаток промывают с использованием 8 мл тетрагидрофурана, и объединенные фильтраты и промывные растворы упаривают при пониженном давлении, в результате чего получают желтое масло, которое исследуют путем газожидкостной хроматографии, хиральной высокопроизводительной жидкостной хроматографии и 1H-ЯМР. Получаемый целевой продукт содержит 0,24% дефторированного соединения.
Примеры 13 и 14
Данные примеры осуществляют аналогично примеру 12, но с заменой хлорида магния одним мольным эквивалентом соли металла, указанной в таблице 2.
Пример 15
Осуществляют пример 12 с той разницей, что вместо тетрагидрофурана в качестве растворителя используют толуол и что смесь при размешивании нагревают при температуре 110oС в течение 2 часов. В результате получают продукт с чистотой 93,7% (согласно данным газожидкостной хроматографии), согласно данным высокопроизводительной жидкостной хроматографии содержащий 1,07% дефторированного соединения.
Остальные 1-замещенные 3-гидроксиметил-4-(4-фторфенил)пиперидины общей формулы (I), где R1 означает аминозащитную группу, выбранную из группы, включающей аллил, бензгидрил, метоксиметил, бензилоксиметил, тетрагидропиранил, незамещенный или замещенный бензил, ди(п-метоксифенил)метил, трифенилметил, (п-метоксифенил)дифенилметил, дифенил-4-пиридилметил, 2,4,6-триметилбензолсульфонил, толуолсульфонил, бензилсульфонил, алкил с 1 - 6 атомами углерода, трифторалкил с 1 - 4 атомами углерода, алкинил и п-метоксибензил или незамещенный или замещенный аммоний получают аналогичным образом, причем используют соединение формулы (II), где R1 имеет вышеуказанное значение, гидрид металла, выбранный из группы, включающей гидрид натрия, калия, магния или кальция, боргидрид натрия, калия или лития, алюмогидрид лития или натрия, гидрид алюминия, бис-(2-метоксиэтокси)алюмогидрид натрия, моно(С1-4-алкокси)алюмогидрид лития, ди(С1-4-алкокси)алюмогидрид лития, диэтилалюмогдирид натрия или их смесь и неорганическую соль, выбранную из группы, включающей соль лития, натрия, магния, кальция, цинка, лантана или железа или их смесь.
(-)Транс-4-(4-фторфенил)-3-{ [3,4-метилендиокси)фенокси]метил} пиперидин или его соли получают аналогично описанному выше методу при использовании соединения формулы (II), где R1 означает аминозащитную группу, выбранную из группы, включающей аллил, бензгидрил, метоксиметил, бензилоксиметил, тетрагидропиранил, незамещенный или замещенный бензил, ди(п-метоксифе-нил)метил, трифенилметил, (п-метоксифенил)дифенилметил, дифенил-4-пиридилметил, 2,4,6-триметилбензолсульфонил, толуолсульфонил, бензилсульфонил, алкил с 1 - 6 атомами углерода, трифторалкил с 1 - 4 атомами углерода, алкинил и п-метоксибензил или незамещенный или замещенный аммоний, гидрида металла, выбранного из группы, включающей гидрид натрия, калия, магния или кальция, боргидрид натрия, калия или лития, алюмогидрид лития или натрия, гидрид алюминия, бис-(2-метоксиэтокси)алюмогидрид натрия, моно(С1-4-алкокси)алюмогидрид лития, ди(С1-4-алкокси)алюмогидрид лития, диэтилалюмогдирид натрия или их смесь и неорганической соли, выбранной из группы, включающей соль лития, натрия, магния, кальция, цинка, лантана или железа или их смесь.
Сравнительные примеры
При сравнительных примерах, проведенных без неорганической соли, количество образуемого дефторированного соединения находится в пределах от 2 до 4% и оказалось, что удаление данного дефторированного соединения является очень сложным.
Данное изобретение относится к способу получения 1-замещенного 3-гидроксиметил-4-(4-фторфенил)пиперидина формулы I путем восстановления соединения указанной в формуле изобретения формулы (II) гидридом металлов в среде разбавителя, предпочтительно простого эфира, в присутствии неорганической предпочтительно галоидной соли и к способу получения (-)транс-4-(4-фторфенил)-3-{ [3,4-метилендиокси)фенокси] метил} пиперидина, (пароксетина). Описываемый способ имеет малое количество побочных продуктов. 2 с. и 8 з.п.ф-лы, 2 табл.
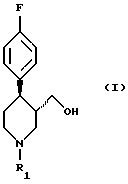
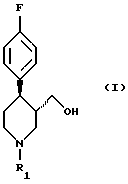
в которой R1 означает аминозащитную группу,
путем восстановления соединения формулы (II)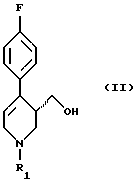
в которой R1 имеет вышеуказанное значение,
гидридом металла в среде разбавителя, отличающийся тем, что процесс ведут в присутствии неорганической соли, выбранной из группы, включающей соль лития, натрия, магния, кальция, цинка, лантана или железа или их смесь, причем используют соединение формулы (II), у которого аминозащитная группа выбрана из группы, включающей а) аллил, б) бензгидрил, в) метоксиметил, г) бензилоксиметил, д) тетрагидропиранил, e) незамещенный или замещенный бензил, ж) ди(п-метоксифенил)метил, з) трифенилметил, и) (п-метоксифенил)дифенилметил, к) дифенил-4-пиридилметил, л) 2,4,6-триметилбензолсульфонил, м) толуолсульфонил, н) бензилсульфонил, о) алкил с 1 - 6 атомами углерода, п) трифторалкил с 1-4 атомами углерода, р) алкинил и с) п-метоксибензил или незамещенный или замещенный аммоний, а в качестве гидрида металла - соединение, выбранное из группы, включающей гидрид натрия, калия, магния или кальция, боргидрид натрия, калия или лития, алюмогидрид лития или натрия, гидрид алюминия, бис-(2-метоксиэтокси)алюмогидрид натрия, моно(С1-4-алкокси)алюмогидрид лития, ди(С1-4-алкокси)алюмогидрид лития, диэтилалюмогдирид натрия или их смесь.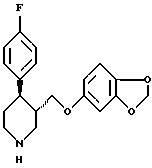
или его соли путем восстановления соединения формулы (II)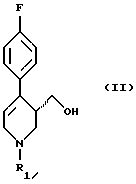
в которой R1 означает аминозащитную группу,
гидридом металла в среде разбавителя и перевода гидроксильной группы получаемого соединения формулы (I)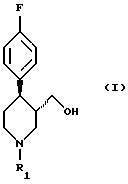
в которой R1 имеет вышеуказанное значение,
в удаляемую группу с последующим взаимодействием с 3,4-метилендиоксифенолом или его солью, удалением аминозащитной группы R1 и выделением целевого продукта в свободном виде или в виде соли, отличающийся тем, что восстановление соединения формулы (II) гидридом металла ведут в присутствии неорганической соли, выбранной из группы, включающей соль лития, натрия, магния, кальция, цинка, лантана или железа или их смесь, причем используют соединение формулы (II), у которого аминозащитная группа выбрана из группы, включающей а) аллил, б) бензгидрил, в) метоксиметил, г) бензилоксиметил, д) тетрагидропиранил, е) незамещенный или замещенный бензил, ж) ди(п-метоксифенил)метил, з) трифенилметил, и) (п-метоксифенил)дифенилметил, к) дифенил-4-пиридилметил, л) 2,4,6-триметилбензолсульфонил, м) толуолсульфонил, н) бензилсульфонил, о) алкил с 1 - 6 атомами углерода, п) трифторалкил с 1 - 4 атомами углерода, р) алкинил и с) п-метоксибензил или незамещенный или замещенный аммоний, а в качестве гидрида металла - соединение, выбранное из группы, включающей гидрид натрия, калия, магния или кальция, боргидрид натрия, калия или лития, алюмогидрид лития или натрия, гидрид алюминия, бис-(2-метоксиэтокси)алюмогидрид натрия, моно(С1-4-алкокси)алюмогидрид лития, ди(С1-4-алкокси)алюмогидрид лития, диэтилалюмогидрид натрия или их смесь.
| WO 9636636, 21.11.1996 | |||
| US 3849542, 19.11.1974 | |||
| US 4007196, 08.02.1977. |
Авторы
Даты
2003-05-27—Публикация
1998-05-13—Подача