Настоящее изобретение относится к затравочным кристаллам для получения пептидов или протеинов, таких как цинк-инсулиновые продукты.
Семейство цинк-инсулиновых продуктов "Lente" представляет собой цинк-инсулиновые суспензии такого типа, который был первоначально разработан в 1950-х годах с целью получения инсулиновых препаратов, которые могли бы обеспечить потребность диабетиков в инсулине одной инъекцией в день (смотри, например, Jens Brange, Galenic of Insulin, 1987). Различные инсулиновые продукты Lente, имеющие разный профиль действия, выпускаются в виде различных сочетаний аморфных и/или кристаллических инсулиновых частиц компанией Novo Nordisk A/S, Дания. Они включают в себя SEMILENTE, суспензию аморфных инсулиновых частиц, ULTRALENTE, суспензию кристаллических инсулиновых частиц, и LENTE, представляющую собой смесь из 30% аморфных и 70% кристаллических частиц инсулина.
В течение нескольких десятилетий затравочные кристаллы для получения цинк-инсулиновых продуктов Lente готовили тем самым основным способом лиофильной сушки, который был разработан и запатентован в начале 1950-х годов. Этот способ, который описан в GB 766994, включает в себя добавление полученного лиофильной сушкой аморфного инсулина, обычно бычьего инсулина, к инсулин-содержащей кристаллизационной среде для того, чтобы вызвать образование суспензии микрокристаллов инсулина размером около 2-7 мкм. Данную суспензию, которая в конечном счете используется для получения целевого кристаллического цинк-инсулинового продукта, заливают в небольшие сосуды (например, 10 мл), замороженные в смеси спирт/двуокись углерода, и хранят замороженной при температуре -18oС или ниже.
Данный способ, хотя еще и применяется, имеет целый ряд недостатков.
1. Он основывается на использовании бычьего инсулина, поскольку до настоящего времени не было возможно получать приемлемые микрокристаллы инсулина человека. В результате использования бычьего инсулина в качестве зародышевых центров для образования микрокристаллов конечный продукт содержит небольшое количество бычьего инсулина, что является нежелательным.
2. Способ лиофильной сушки применения лиофилизатора и последующей транспортировки и хранения при температуре не выше -18oС. Это дорого и требует больших помещений.
3. Способ получения крайне трудно осуществлять достаточно асептическим образом.
Поэтому было бы предпочтительно иметь возможность получать затравочные кристаллы инсулина, используя способ, который не имел бы недостатков известных способов. Неожиданно было обнаружено, что можно, применяя относительно простой и недорогой способ, получить затравочные кристаллы инсулина, не содержащие бычий инсулин, которые можно хранить при комнатной температуре и которые дают инсулиновые препараты, имеющие благоприятные свойства в виде, например, размера кристаллических частиц и однородности. Кроме того, было также высказано предположение, что данный способ будет применим для получения затравочных кристаллов для других пептидов и протеинов, в частности, для пептидов или протеинов, используемых в качестве лекарств.
Цель настоящего изобретения - обеспечить новый способ получения затравочных кристаллов пептида или протеина. Более конкретно, предметом изобретения является способ получения затравочных кристаллов инсулина, который не требует применения бычьего инсулина, который делает возможным хранение и транспортировку без необходимости дорогой лиофильной сушки и хранения при температурах ниже нуля и который можно осуществить в закрытой системе, так, чтобы легче использовать асептические способы производства.
Другой целью изобретения является способ получения затравочных кристаллов инсулина для получения цинк-инсулиновых суспензий, имеющих узкое распределение размеров частиц.
Таким образом, в наиболее широком аспекте настоящее изобретение относится к способу получения затравочных микрокристаллов для производства пептида или протеина, включающему в себя получение суспензии пептида или протеина без затравки и гомогенизацию указанной суспензии под давлением, чтобы получить микрокристаллы пептида или протеина, пригодные для использования в качестве затравочных микрокристаллов.
В предпочтительном варианте осуществления изобретение относится к способу получения затравочных микрокристаллов для производства инсулина человека, в котором указанные микрокристаллы были бы свободны от нечеловеческого панкреатического инсулина, включающему в себя получение суспензии инсулина человека без затравки, где указанная суспензия была бы свободна от нечеловеческого панкреатического инсулина, и гомогенизацию указанной инсулиновой суспензии под давлением, чтобы получить микрокристаллы инсулина человека, пригодные для использования в качестве затравочных микрокристаллов для получения цинк-инсулиновых продуктов.
Другой аспект изобретения относится к способу получения пептидного или протеинового продукта, включающему в себя получение суспензии пептида или протеина без затравки и затравки указанной суспензии микрокристаллами, полученными по вышеуказанному способу.
В предпочтительном осуществлении этого аспекта изобретения получаемым пептидным или протеиновым продуктом является цинк-инсулиновый продукт, и суспензией без затравки является суспензия инсулина человека.
Дополнительный аспект изобретения относится к микрокристаллам инсулина человека, пригодным для использования в качестве затравочных микрокристаллов при получении цинк-инсулиновых продуктов, где указанные микрокристаллы были бы свободны от нечеловеческого панкреатического инсулина.
Еще один аспект изобретения относится к человеческому цинк-инсулиновому продукту, свободному от нечеловеческого панкреатического инсулина.
Как указано выше, способ согласно изобретению направлен на получение затравочных микрокристаллов для производства пептидов и протеинов вообще и, в частности, пептидов и протеинов, которые используются в качестве лекарств. Более конкретно, способ относится к затравочным микрокристаллам для получения терапевтических пептидов или протеинов, таких как инсулин, GPL-1, глюкагон, и гормонов роста, таких как гормон роста человека, а также аналогов и производных таких пептидов и протеинов. Пептидом или протеином является, в частности, инсулин человека или его аналог или производное, как описано ниже. По отношению к пептидам и протеинам, отличным от инсулина, термины "аналог" и "производное" следует понимать аналогично определениям, данным ниже по отношению к инсулину.
В настоящем тексте термин "инсулин человека" использован для того, чтобы обозначить встречающийся в природе инсулин человека, а также аналоги инсулина и производные инсулина. Термин "аналог инсулина" использован для обозначения пептида с инсулиновой активностью, полученного из природного инсулина путем замещения одного или нескольких аминокислотных остатков, удаления одного или нескольких аминокислотных остатков, и/или добавления одного или нескольких аминокислотных остатков. Инсулин или аналог инсулина может необязательно быть в форме "производного инсулина", где термин "производное" относится к пептиду, в котором один или несколько аминокислотных остатков исходного инсулина модифицированы химически, например, алкилированием, ацилированием, образованием сложного эфира или образованием амида. "Ацилированный инсулин" (или аналог инсулина) представляет собой инсулин (или аналог инсулина), который имеет ацильную группу в ε-аминогруппе одного или нескольких аминокислотных остатков, часто в остатке лизина.
Термин "нечеловеческий панкреатический инсулин", как он использован здесь, относится к встречающемуся в природе инсулину из нечеловеческих источников, например, к бычьему или свиному инсулину.
Основной принцип представленного предпочтительного варианта осуществления изобретения схематично показан на фиг.1. Установка на фиг.1 включает в себя приемную емкость 1, из которой инсулиновую суспензию с помощью насоса 2 передают в гомогенизатор 3. Гомогенизатор 3 включает в себя клапан с очень малым отверстием, через которое инсулиновую суспензию прокачивают под высоким давлением, например, около 100000 кПа (1000 бар) или выше. На выходе из клапана инсулиновая суспензия претерпевает резкое падение давления, что приводит к разлому кристаллов инсулина, т.е. к эффекту гомогенизации. Поскольку суспензию инсулина предпочтительно подвергают многократным циклам гомогенизации, с тем чтобы получить достаточно однородную суспензию микрокристаллов, имеющих желаемые размеры и распределение размеров, и поскольку используемое в гомогенизаторе 3 высокое давление приводит к повышению температуры суспензии, установка предпочтительно включает в себя также теплообменник 4 на выходе из гомогенизатора 3 для того, чтобы понизить температуру суспензии. Из теплообменника 4 суспензию инсулина, если требуется, возвращают в приемную емкость 1 для дополнительных циклов гомогенизации.
Температура суспензии возрастает согласно следующему уравнению:
ΔТ=Р/(с•δ),
где ΔT - рост температуры, oС;
Р - давление суспензии, Н•м2;
δ - плотность суспензии, г/м3;
с - теплоемкость, Дж•г-1•oС-1.
Давление и температуру контролируют в ходе процесса, и вышеприведенное уравнение может быть использовано при проектировании установки и регулировании процесса.
В способе согласно изобретению гомогенизацию обычно проводят при давлении по меньшей мере около 50000 кПа (500 бар), более предпочтительно по меньшей мере около 100000 кПа (1000 бар). В некоторых случаях давление может быть, например, по меньшей мере около 120000 кПа (1200 бар), например, примерно до 150000 кПа (1500 бар) и более, несмотря на то, что такие высокие давления примерно выше 100000 кПа (1000 бар) обычно не считают необходимыми.
В предпочтительном осуществлении гомогенизацию суспензии проводят, используя многократные циклы гомогенизации, т.е. по меньшей мере 2 цикла, поскольку было найдено, что многократные циклы обеспечивают улучшенные результаты, т. е. оптимизацию размера затравочных кристаллов и однородность. Так, предполагалось, что обычно будет благоприятно использовать более чем 2 цикла, так 3, 4, 5, 6, 7, 8, 9 или 10 циклов или даже более, например, в некоторых случаях до 15 или 20 циклов или, может быть, даже больше 20 циклов. Наиболее благоприятное число циклов гомогенизации должно быть определено квалифицированным специалистом в каждом конкретном случае исходя из таких факторов, как природа инсулиновой суспензии, характеристика используемой установки гомогенизации и желаемые размеры частиц микрокристаллов инсулина и распределение размеров.
Поскольку, как указано выше, использованное в гомогенизаторе высокое давление приводит к повышению температуры суспензии, применение многократных циклов гомогенизации предпочтительно сопровождается использованием теплообменника для снижения температуры суспензии, так, чтобы поддерживать суспензию при подходящей температуре в ходе процесса гомогенизации. Поскольку теплообменники известны из практики, специалист легко сможет подобрать характеристики теплообменника для данного процесса и установки. Предпочтительно температуру рециркулируемой суспензии инсулина поддерживают в интервале примерно 10-40oС, например, примерно 20-35oС.
Хотя размер частиц получаемых микрокристаллов инсулина должен варьироваться в зависимости от намечаемого применения, подходящие микрокристаллы часто должны иметь средний размер частицы, определяем по наиболее длинной диагонали кристалла, в интервале примерно 0,5-4 мкм, например, примерно 1-3 мкм.
Результатом процесса гомогенизации являются микрокристаллы инсулина человека, пригодные для использования в качестве затравочных микрокристаллов при получении цинк-инсулиновых продуктов, важной отличительной чертой каковых микрокристаллов является отсутствие нечеловеческого панкреатического инсулина. При получении цинк-инсулиновых продуктов затравочные микрокристаллы согласно изобретению должны использоваться обычным образом, т.е. суспензию инсулина человека без затравки засеивают суспензией микрокристаллов, полученной вышеописанным способом, и позволяют кристаллизации протекать таким образом, который сам по себе хорошо известен из практики. Как обычно в практике, точное количество микрокристаллов, добавляемых к заданной суспензии инсулина без затравки, может быть определено эмпирически.
Изобретение будет далее разъяснено на следующих неограничительных примерах.
Примеры
Материалы и методы
При использовании базового процесса гомогенизации и описанной выше установки, т. е. рециркуляционного гомогенизатора, оборудованного теплообменником, провели ряд экспериментов для проверки влияния числа циклов гомогенизации, а также давления и времени гомогенизации.
Использовали гомогенизатор высокого давления Rannie, модель LAB 10,51 VH (series 1.89239), оборудованный керамическим вентилем типа SEO 719685. Производительность гомогенизатора составляла 80 л/ч при давлении 100000 кПа (1000 бар). Центробежный насос обеспечивал давление на выходе 450-500 кПа (4,5-5 бар). В теплообменнике для этих опытов использовали охлаждающую воду с температурой около 20oС. Однако, поскольку производительность теплообменника была недостаточной по отношению к данному конкретному гомогенизатору, температура суспензии инсулина была несколько выше при максимальной нагрузке гомогенизатора, т. е. около 28-29oС, но немного ниже при меньшей производительности гомогенизатора (около 65 л/ч), т.е. примерно 24-25oС. Приемная емкость включала 100 л емкость под давлением и небольшой конический сосуд объемом около 3 л.
Суспензия инсулина, использованная для получения микрокристаллов, представляла собой сбор загрузок (2•20 л) суспензии без затравки ULTRALENTE НМ (gе), 100 ед/мл от Novo Nordisk A/S.
Пример 1
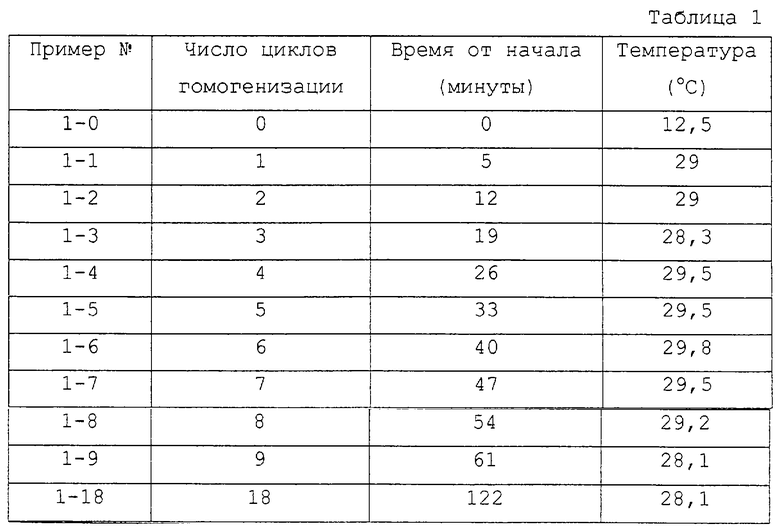
Порцию 100 л сборной загрузки инсулиновой суспензии ULTRALENTE гомогенизировали под давлением 100000 кПа (1000 бар), суспензия рециркулировалась для многократных циклов гомогенизации, как описано выше, с получением постепенного увеличения степени гомогенизации. Использовали расход потока 80 л/ч. Всего было проведено 18 циклов гомогенизации, и пробы отбирали от первых 10 циклов и после последнего цикла. Температуру инсулиновой суспензии измеряли на выходном трубопроводе между гомогенизатором и теплообменником. Времена и измеренные температуры для разных циклов показаны в табл. 1.
Ряд проб анализировали под микроскопом и сделали следующие наблюдения:
Пример 1-0: большей частью целые и остроконечные ромбоэдрические кристаллы, имеющие размер примерно 3-80 мкм; немного сломанных кристаллов и фрагментов кристаллов.
Пример 1-1: все еще много целых ромбоэдрических кристаллов, имеющих размеры примерно 20-40 мкм; также много мелких обломков кристаллов с размером 3 мкм или менее.
Пример 1-2: все еще некоторое количество целых ромбоэдрических кристаллов с размером примерно до 20 мкм, а также немного более крупных кристаллических агломератов с размером примерно до 40 мкм; еще больше мелких осколков кристаллов в 3 мкм или менее.
Пример 1-18: мелкие микрокристаллы примерно в 1 мкм или менее; небольшое количество осколков кристаллов с размером до 10 мкм; отсутствие целых ромбоэдрических кристаллов.
Пример 2
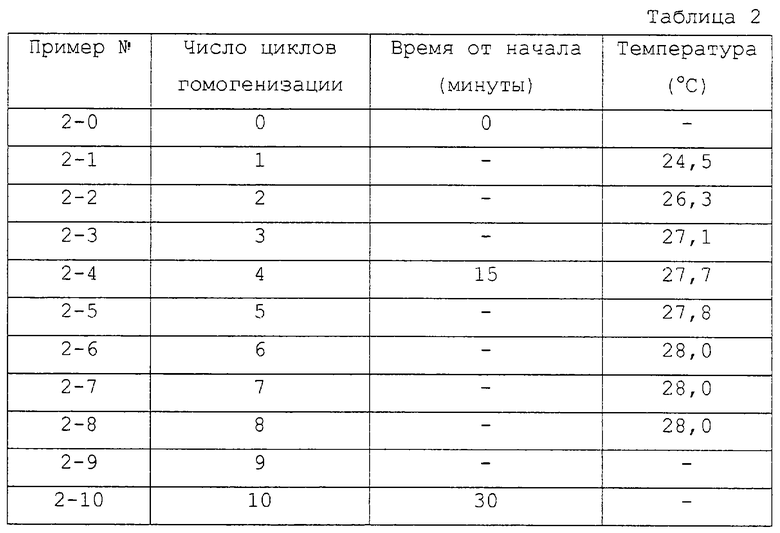
Порцию 5 л сборной загрузки инсулиновой суспензии ULTRALENTE гомогенизировали под давлением 100000 кПа (1000 бар), причем суспензия рециркулировалась для многократных циклов гомогенизации, как описано выше, используя расход потока 65 л/ч. Всего было проведено 10 циклов гомогенизации, и пробы отбирали от каждого цикла. В этом случае вместо того, чтобы направлять суспензию после теплообменника непосредственно в приемную емкость, ее собирали после каждого цикла. От каждой порции отбирали пробу, а остаток порции возвращали в приемную емкость для следующего цикла гомогенизации. Времена и измеренные температуры были следующими (см. табл.2).
Пример 3
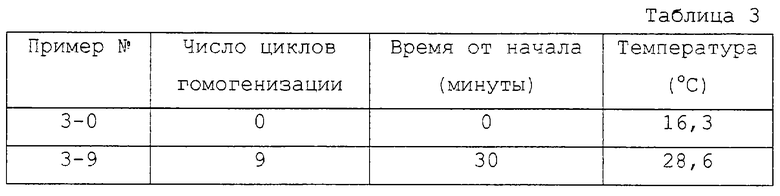
Для исследования влияния давления гомогенизации были проведены опыты при 140000-150000 кПа (1400-1500 бар) с общим числом циклов гомогенизации 9. Из-за увеличенного давления и сопровождающего это повышения температуры суспензии расход потока был дополнительно снижен до 54 л/ч, для того, чтобы теплообменник мог обеспечить достаточное снижение температуры. Величина загрузки в этом случае была 3 л. Температуру суспензии поддерживали на уровне примерно 26-29oС (см. табл.3).
Пример 4
Использовали ту же методику, что и в примере 3, за тем исключением, что инсулиновая суспензия ULTRALENTE в этом случае при кристаллизации образовывала расходящиеся кристаллы ("розы"). Количество загрузки составляло 2 л, и поэтому время гомогенизации было, соответственно, понижено в целом до 21 мин (см. табл.4).
Пример 5
Эксперименты по затравке избранными загрузками микрокристаллов
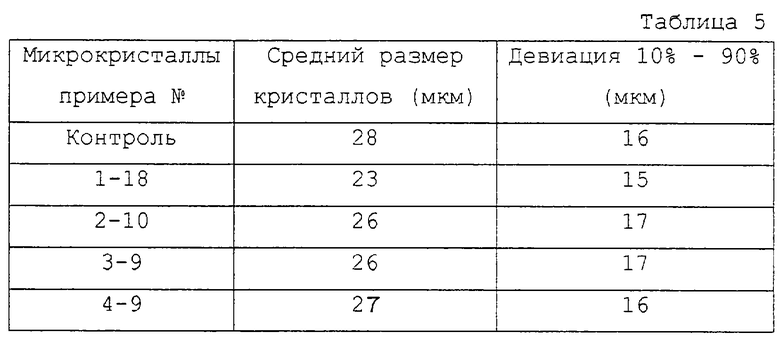
Эксперименты по затравке проводили для испытания избранных загрузок микрокристаллов инсулина человека, полученных, как описано выше. В качестве контроля испытывали также затравочную загрузку стандартных микрокристаллов бычьего инсулина. Эти эксперименты проводили, используя 1 л загрузки ULTRALENTE (40 ед/мл). Кристаллизацию проводили, используя пропеллерную мешалку в течение периода времени 20 ч. Результаты показаны в табл. 5.
Из результатов табл. 5 можно видеть, что микрокристаллы инсулина человека, полученные по изобретению, дают размер кристаллов инсулина и их девиацию, которые сравнимы с полученными при использовании стандартных микрокристаллов бычьего инсулина, и что пять затравочных загрузок дали в большой степени идентичные результаты.
Пять загрузок инсулина, полученных, как описано выше, дополнительно анализировали по ряду других параметров, включая рН, крепость инсулина, компонент А+М+В, процентное содержание аморфного инсулина, содержание метил-парагидроксибензоата, содержание димера и полимера, кислотность и содержание нейтральных дезамидоинов и содержание цинка. Было найдено, что партии инсулина, полученные с использованием микрокристаллов согласно изобретению, в целом были сравнимы с инсулином, полученным с использованием стандартных микрокристаллов бычьего инсулина.
Поскольку известно, что время кристаллизации и тип мешалки могут оказать влияние на внешний вид образовавшихся ромбоэдров, единичную партию, полученную согласно изобретению (пример 3-9), использовали для опытов по затравке, в которых варьировали время кристаллизации и тип мешалки. Что касается перемешивания, то не наблюдалось существенных отличий между кристаллами, полученными при использовании пропеллерной мешалки и при перемешивании с использованием качательных движений. Что касается времени кристаллизации, то было найдено, что достаточно 4 ч, т.е. было найдено, что время кристаллизации 20 ч не является необходимым. Существовала тенденция получения лучших результатов при использовании пропеллерной мешалки и времени кристаллизации 4 ч, что приводило к меньшему количеству отклоняющихся кристаллов.
Заключение
Можно сделать вывод, что чистые микрокристаллы инсулина человека могут быть получены путем гомогенизации под высоким давлением незатравленного препарата ULTRALENTE НМ (gе). Данный способ приводит к образованию микрокристаллов в виде мелких обломков кристаллов с размером частиц примерно 1-2 мкм и некоторому количеству более крупных обломков с размером частиц примерно до 10 мкм.
Изменение давления от 100000 кПа (1000 бар) до примерно 150000 кПа (1500 бар) не оказывает сколько-нибудь заметного влияния на микрокристаллы. С другой стороны, число циклов гомогенизации оказывает влияние, по меньшей мере в том, что увеличенное число циклов дает более однородную суспензию микрокристаллов с большей долей микрокристаллов, имеющих размер около 1-2 мкм, и с меньшей долей более крупных обломков кристаллов и целых ромбоэдрических кристаллов. Однако число циклов гомогенизации, необходимое для достижения заданной степени гомогенизации, связано также с временем гомогенизации на цикл.
Повышение температуры суспензии, обнаруженное в этих опытах как результат процесса гомогенизации, не оказывает влияния на микрокристаллы с точки зрения химического разложения. Регулирование температуры может быть оптимизировано путем необходимых изменений, например, в конструкции и производительности теплообменника.
Вариации размера частиц микрокристаллов, полученных в данных опытах, и, следовательно, вариации в размере частиц цинк-инсулинового продукта, полученного с использованием микрокристаллов, могут быть, если это желательно или необходимо, понижены посредством, например, седиментации или центрифугирования.
Показано, что затравочная способность микрокристаллов, полученных согласно изобретению, является приемлемой, поскольку указанные микрокристаллы дают цинк-инсулиновые продукты с ромбоэдрическими кристаллами, имеющими требуемый размер кристаллов.

Изобретение относится к способу получения затравочных микрокристаллов для производства пептида или протеина, отличающемуся тем, что он включает в себя получение суспензии пептида или протеина без затравки и по меньшей мере двухкратную гомогенизацию указанной суспензии под давлением 50000-150000 кПа для получения микрокристаллов пептида или протеина, имеющих размер 0,5-4 мкм, пригодных для использования в качестве затравочных микрокристаллов в процессе производства указанного пептида или протеина. Способ гомогенизации под давлением может быть применен для получения затравочных микрокристаллов таких пептидов, как инсулин, GLP-1, глюкагон и гормоны роста. Изобретение также относится к микрокристаллам инсулина человека, полученным описанным способом, а также к способу получения пептидного или протеинового продукта с использованием микрокристаллов по изобретению. 3 с. и 9 з.п. ф-лы, 1 ил., 5 табл.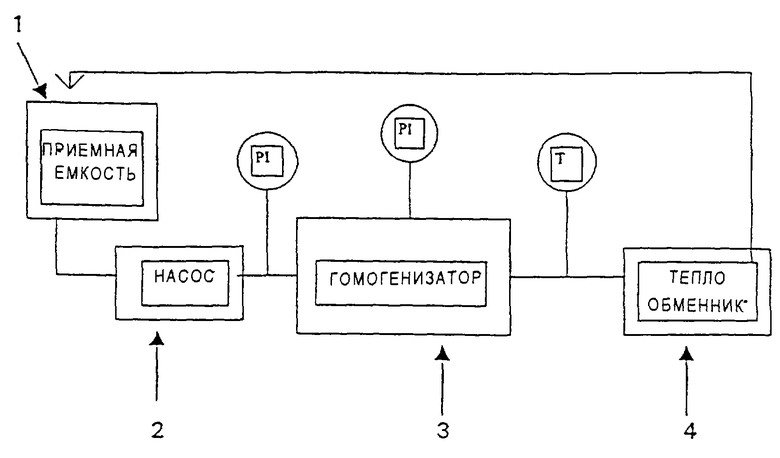
| WO 9000176 А1, 11.01.1990 | |||
| RU 95110107 А1, 10.05.1997 | |||
| Устройство для контроля и управления ленточным загрузочным механизмом | 1977 |
|
SU766994A1 |
| Шланговое соединение | 0 |
|
SU88A1 |
Авторы
Даты
2003-05-27—Публикация
1999-06-30—Подача