ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к неводным фармацевтическим композициям и к их применению в способах лечения диабета и гипергликемии.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Обычно полипептиды обладают низкой растворимостью в большинстве неводных растворителей за исключением некоторых апротонных растворителей типа диметилсульфоксида (DMSO), диметилацетамида и диметилформамида. Однако токсичность этих апротонных растворителей делает их непригодными в какой-либо значительной степени для использования в фармацевтических композициях.
Известно (Klibanov и др. (J.Т.Chin, S.L.Wheeler, and A.M.Klibanov. Communication to the editor: On protein solubility in organic solvents. BIOTECHNOL. BIOENG. 44(1):140-145, 1994)), что в протонных, очень гидрофильных и полярных растворителях растворяется более чем 10 мг/мл лизоцима (лиофилизированного из водного раствора рН 6,0). Растворимость в индивидуальном растворителе (1,5-пентадиоле) значительно увеличивалась, если лизоцим перед растворением в пентадиоле подвергали сублимационной сушке из водных растворов, величины рН которых были смещены в область ниже изоэлектрической точки лизоцима. Никакой строгой корреляции между характеристиками растворителя и растворимостью лизоцима установить не смогли.
В WO 00/42993 описаны композиции для доставки макромолекул, причем макромолекулы растворены или диспергированы в низкотоксичном органическом растворителе, который может быть переведен в аэрозольное состояние для доставки в легкое пациента посредством ингаляции.
Многие органические полярные протонные растворители имеют тенденцию дестабилизировать полипептиды вследствие частичного разворачивания полипептидов, что зачастую усиливает процессы агрегации и химического расщепления, в значительной степени обусловленные более высокой конформационной подвижностью. Некоторые органические полярные протонные растворители типа этанола могли бы действовать даже в качестве денатурирующего агента для полипептидов. Кроме того, органические полярные протонные растворители зачастую содержат небольшие количества очень реакционно-способных примесей, таких как альдегиды и кетоны, которые нарушают стабильность полипептида. Поэтому приготовить неводный раствор полипептида с надлежащей стабильностью на протяжении срока годности - трудная задача.
Поскольку неводные растворы полипептидов могут далее быть преобразованы в раствор для дозирующих ингаляторов под давлением (pMDI), где полярное неводное вещество действует как сорастворитель для того, чтобы солюбилизировать полипептид в гидрофторалкане, их можно успешно использовать для легочного введения.
Кроме того, неводные растворы полипептидов могут быть преобразованы в микроэмульсии для перорального введения путем добавления детергентов и неполярных гидрофобных растворителей, таких как масла. Микроэмульсия могла бы защищать полипептид против протеолитического расщепления и усиливать системное всасывание полипептида из желудочно-кишечного тракта. Кроме того, ожидается, что гидролиз полипептидов сведется к минимуму в неводных композициях вследствие снижения активности воды.
Зачастую к неводным фармацевтическим композициям терапевтических пептидов необходимо применить обработку и добавление различных эксципиентов, чтобы улучшить их растворимость и их стабильность.
Срок годности жидких парентеральных композиций пептидов должен составлять по меньшей мере год, предпочтительно больше. Период использования (in-use period), когда продукт может подвергаться ежедневной транспортировке и встряхиванию при температуре окружающей среды, предпочтительно должен составлять несколько недель.
Таким образом, существует необходимость в неводных фармацевтических композициях терапевтических пептидов с улучшенной стабильностью.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1 - зависимость между растворимостью инсулина аспарта в пропиленгликоле при температуре окружающей среды от рН инсулина аспарта, повторно растворенного в воде (заданное значение рН (target рН)).
Фиг.2 - растворимость инсулина аспарта (заданное значение рН: 7,5) в различных полуполярных протонных растворителях при температуре окружающей среды.
Фиг.3 - проницаемость человеческого инсулина в присутствии или в отсутствие 10% (об./об.) пропиленгликоля (PG) через мешочки из свежеиссеченного кишечника крысы (проксимальная тонкая кишка) через 2 часа инкубации в физиологической культуральной среде (рН 7,4) при 37°С.
Фиг.4 - анализ с использованием MALDI (ионизации посредством лазерной десорбции из матрицы) показывает наличие прошедших (через мешочек) нерасщепленного инсулина аспарта (пик ~5828) и продукта его деградации (пик ~5218) для каждого из двух буферных контрольных образцов (S3 и S6) и для двух пропиленгликольсодержащих образцов (SPG5 и SPG6). Можно видеть, что в присутствии пропиленгликоля (PG) через слизистую оболочку кишечника проникает большее количество нерасщепленного инсулина.
Фиг.5 - снижение уровня глюкозы в крови (ммоль/л) после перорального введения человеческого A14GluB25HisдезB30 инсулина (8 мМ) с пропиленгликолем или без него. SPRD-крысам (Sprague-Dawley) введен объем дозировки 1,2 мл/кг путем использования кормления через желудочный зонд.
Фиг.6 - FUV CD (круговой дихроизм в дальней УФ-области) 0,2 мМ инсулина аспарта, рН 7,4 (сплошная линия), 0,2 мМ инсулина аспарта в 100%-ном пропиленгликоле (PG) (линия из точек), 0,2 мМ инсулина аспарта в 2%-ном PG после разведения из 100%-ого пропиленгликоля (PG) (пунктирная линия).
Фиг.7 - NUV CD (круговой дихроизм в ближней УФ-области) 0,2 мМ инсулина аспарта, рН 7,4 (сплошная линия), 0,2 мМ инсулина аспарта в 100%-ном пропиленгликоле (PG) (линия из точек), 0,2 мМ инсулина аспарта в 2%-ном пропиленгликоле (PG) после разведения из 100%-ого пропиленгликоля (PG) (пунктирная линия).
Фиг.8 - чистота инсулина аспарта (IA), солюбилизированного или в пропиленгликоле, или в 0,1 М ТРИС-буфере, рН 7,5, после инкубации при 25 и 40°С в течение до 4 недель включительно. Заданное значение рН для порошка инсулина аспарта составляло 7,5. Чистоту определяли, используя обращенно-фазовую хроматографию.
Фиг.9 - образование высокомолекулярного белка (HMWP) инсулина аспарта (IA), солюбилизированного или в пропиленгликоле, или в 0,1 М ТРИС-буфере, рН 7,5, после инкубации при 25 и 40°С в течение до 4 недель включительно. Заданное значение рН для порошка инсулина аспарта составляло 7,5. Количество HMWP определяли, используя стерическую эксклюзионную хроматографию.
Фиг.10 - образование позитивно окрашенных тиофлавином Т фибрилл инсулина аспарта (IA), солюбилизированного или в пропиленгликоле, или в 0,1 М ТРИС-буфере, рН 7,5, после инкубации при 40°С в течение до 4 недель включительно. Заданное значение рН для порошка инсулина аспарта составляло 7,5.
Фиг.11 - диаграмма, описывающая процесс формирования фибрилл.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из аспектов изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от рI полипептида в водном растворе.
В одном из аспектов изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от рI полипептида в водном растворе, и где указанное заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения открыли, что полипептиды, такие как инсулиновые пептиды в твердом состоянии (дегидратированные), могут быть солюбилизированы до очень высокой степени в неводном полуполярном протонном растворителе посредством оптимизации рН указанных полипептидов в водном растворе перед дегидратированием, что дает возможность получения стабильных при хранении фармацевтических композиций. Такие фармацевтические композиции, например для перорального, легочного и назального применения, демонстрируют высокую химическую и/или физическую стабильность. Кроме того, композиции по изобретению, такие как пероральные фармацевтические композиции, в которых используют пропиленгликоль в качестве полуполярного протонного органического растворителя, могут показывать значительно улучшенную биодоступность.
В одном из аспектов изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе.
В другом аспекте изобретения предложена фармацевтическая неводная композиция, содержащая дегидратированный полипептид и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе, при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) (GLP обозначает глюкагоноподобный пептид) или его аналогом либо производным, или эксендином или его аналогом либо производным.
В следующем аспекте изобретения предложена фармацевтическая неводная композиция, содержащая
a) дегидратированный терапевтически активный полипептид, и
b) по меньшей мере один полуполярный протонный органический растворитель,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе, и указанное заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0.
В еще одном следующем аспекте изобретения предложена фармацевтическая неводная композиция, содержащая
a) дегидратированный терапевтически активный полипептид, и
b) по меньшей мере один полуполярный протонный органический растворитель,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе и указанное заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0 при условии, что полипептид не является инсулинотропным пептидом, GLP-1 (7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
В другом аспекте изобретения предложена фармацевтическая неводная композиция, содержащая смесь
a) дегидратированного терапевтически активного полипептида, содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе. В предпочтительном воплощении заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0.
В еще одном другом аспекте изобретения предложена фармацевтическая неводная композиция, содержащая смесь
a) дегидратированного терапевтически активного полипептида, содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе. В предпочтительном воплощении заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0 при условии, что полипептид не является инсулинотропным пептидом, GLP-1 (7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
Термин "неводный", использованный в данном описании, относится к композиции, содержащей менее 10% (мас./мас.) воды. В более предпочтительном воплощении композиция по изобретению содержит менее 8% (мас./мас.) воды, в более предпочтительном воплощении менее 5% (мас./мас.) воды, в более предпочтительном воплощении менее 3% (мас./мас.) воды и в еще более предпочтительном воплощении менее 2% (мас./мас.) воды.
Термин "дегидратированный", использованный в данном описании в связи с полипептидом, относится к полипептиду, который высушен из водного раствора. Термин "заданное значение рН", использованный в данном описании, относится к значению рН водного раствора, которое будет установлено, когда дегидратированный полипептид будет повторно гидратирован в чистой воде до концентрации приблизительно 40 мг/мл или больше. Заданное значение рН обычно будет идентично значению рН водного раствора полипептида, из которого данный полипептид был получен в результате сушки. Однако значение рН раствора полипептида не будет идентично заданному значению рН, если раствор полипептида содержит летучие кислоты или основания. Обнаружено, что "предыстория" рН полипептида будет являться определяющим фактором того, какое количество полипептида может быть солюбилизировано в полуполярном протонном органическом растворителе.
Согласно данному изобретению полипептид дегидратирован при заданном значении рН, которое по меньшей мере на 1 единицу рН отличается от рI полипептида в водном растворе. Таким образом, в одном из аспектов изобретения заданное значение рН более чем на 1 единицу рН превышает изоэлектрическую точку полипептида. В другом аспекте изобретения заданное значение рН более чем на 1 единицу рН лежит ниже изоэлектрической точки полипептида. В предпочтительном аспекте заданное значение рН лежит более чем на 1,5 единицы рН выше или ниже рI полипептида. В еще более предпочтительном аспекте заданное значение рН лежит на 2,0 единицы рН выше или ниже рI полипептида. В следующем аспекте заданное значение рН лежит на 2,5 единицы рН выше или ниже рI полипептида. В еще одном следующем аспекте заданное значение рН лежит выше рI полипептида.
Под "летучим основанием" понимают основание, которое до некоторой степени будет выпариваться при нагревании и/или при пониженном давлении, например, основания, которые имеют давление паров выше 65 Па при комнатной температуре, или водную азеотропную смесь, включающую основание с давлением паров выше 65 Па при комнатной температуре. Примерами летучих оснований являются гидроксиды аммония, гидроксиды тетраалкиламмония, вторичные амины, третичные амины, ариламины, алифатические амины или бикарбонат аммония или их комбинация. Например, летучее основание может представлять собой бикарбонат, карбонат, аммиак, гидразин или такое органическое основание, как низшие алифатические амины, например триметиламин, триэтиламин, диэтаноламины, триэтаноламин и их соли. Другим летучим основанием может быть гидроксид аммония, этиламин или метиламин или их комбинация.
Под "летучей кислотой" понимают кислоту, которая до некоторой степени будет выпариваться при нагревании и/или при пониженном давлении, например, кислоты, которые имеют давление паров выше 65 Па при комнатной температуре, или водную азеотропную смесь, включающую кислоту с давлением паров выше 65 Па при комнатной температуре. Примерами летучих кислот являются угольная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота и масляная кислота.
Термин "нелетучее основание", упомянутый в данном описании, означает основание, которое не выпаривается или только частично выпаривается при нагревании, например, основания с давлением паров ниже 65 Па при комнатной температуре. Нелетучее основание может быть выбрано из группы, состоящей из солей щелочных металлов, гидроксидов щелочных металлов, солей щелочноземельных металлов, гидроксидов щелочноземельных металлов и аминокислот или их комбинации. Примерами нелетучих оснований являются гидроксид натрия, гидроксид калия, гидроксид кальция и оксид кальция.
Термин "нелетучая кислота", упомянутый в данном описании, означает кислоту, которая не выпаривается или только частично выпаривается при нагревании, например кислоты с давлением паров ниже 65 Па при комнатной температуре. Примерами нелетучих кислот являются соляная кислота, фосфорная кислота и серная кислота.
Термин "рI полипептида", использованный в данном описании, относится к изоэлектрической точке полипептида.
Термин "изоэлектрическая точка", использованный в данном описании, означает величину рН, при которой общий отрицательный заряд макромолекулы, такой как пептид, равен нулю. В пептидах может быть несколько заряженных групп, и в изоэлектрической точке сумма всех этих зарядов равна нулю. При рН выше изоэлектрической точки общий заряд пептида будет отрицательным, тогда как при величинах рН ниже изоэлектрической точки общий заряд пептида будет положительным.
рI белка может быть определена экспериментально с использованием электрофоретических методик, таких как электрофокусирование.
Градиент рН устанавливают в антиконвекционной среде, такой как полиакриламидный гель. Когда белок вводят в данную систему, он будет двигаться под влиянием электрического поля, приложенного к гелю. Положительно заряженные белки будут мигрировать к катоду. В конечном счете, мигрирующий белок достигает точки в градиенте рН, где его общий электрический заряд равен нулю, и о нем говорят, что он будет фокусироваться. Это и есть изоэлектрическая точка (рI) белка. Белок фиксируют в геле и окрашивают. рI белка далее может быть определена путем сравнения положения белка в геле с положениями маркерных молекул с известными величинами pI.
Общий заряд белка при заданном значении рН может быть оценен теоретически специалистом в данной области техники с использованием общепринятых методов. По существу, общий заряд белка эквивалентен сумме парциальных зарядов заряженных аминокислот в белке: аспарагиновой аминокислоты (β-карбоксильная группа), глутаминовой аминокислоты (δ-карбоксильная группа), цистеина (тиоловая группа), тирозина (фенольная группа), гистидина (боковые цепи имидазола), лизина (ε-аминогруппа) и аргинина (гуанидиновая группировка). Кроме этого следует принимать во внимание заряд концевых групп белка (α-NH2 и α-СООН). Парциальный заряд способных к ионизации групп может быть рассчитан на основании характеристических величин рКа.
Сушка, т.е. дегидратирование полипептида, может быть осуществлена любым традиционным методом сушки, как, например, посредством распылительной, сублимационной, вакуумной, открытой и контактной сушки. В одном из аспектов изобретения раствор полипептида сушат распылительной сушкой с получением содержания воды ниже примерно 10%. Содержание воды может составлять ниже примерно 8%, ниже примерно 6%, ниже примерно 5%, ниже примерно 4%, ниже примерно 3%, ниже примерно 2% или ниже примерно 1%, что рассчитано/измерено в тесте на потери при сушке (гравиметрически), как указано в экспериментальной части.
В одном из аспектов изобретения полипептид сушат распылительной сушкой. В следующем аспекте изобретения полипептид сушат сублимационной сушкой.
В одном из аспектов изобретения растворимость, полученная в результате предварительной обработки полипептида путем дегидратирования при выбранном заданном значении рН в органическом растворителе, составляет по меньшей мере 20 мг/мл. В следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 30 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 40 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 50 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 60 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 70 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 80 мг/мл. В еще одном следующем аспекте растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 100 мг/мл.
Термин "полуполярный протонный органический растворитель", использованный в данном описании, относится к гидрофильному, смешивающемуся с водой углеродсодержащему растворителю, который содержит связь O-Н или N-H, или его смесям. Полярность отражена в диэлектрической постоянной или дипольном моменте растворителя. Полярность растворителя определяет, какой тип соединений он способен растворять и с какими другими растворителями или жидкими соединениями он может смешиваться. Обычно полярные растворители наилучшим образом растворяют полярные соединения, а неполярные растворители наилучшим образом растворяют неполярные соединения: "подобное растворяется в подобном". Сильно полярные соединения типа неорганических солей (например, хлорид натрия) растворяются только в очень полярных растворителях.
Полуполярные растворители определены в данном описании как растворители с диэлектрической постоянной в диапазоне 20-50, тогда как полярные и неполярные растворители определяются как растворители с диэлектрической постоянной выше 50 и ниже 20 соответственно. Примеры полуполярных протонных растворителей приведены в Таблице вместе с водой в качестве вещества сравнения.
В настоящем контексте 1,2-пропандиол и пропиленгликоль используются взаимозаменяемо. В настоящем контексте пропантриол и глицерин используются взаимозаменяемо. В настоящем контексте этандиол и этиленгликоль используются взаимозаменяемо.
В одном из аспектов изобретения растворитель выбран из группы, состоящей из полиолов. Термин "полиол", использованный в данном описании, относится к химическим соединениям, содержащим множественные гидроксильные группы.
В следующем аспекте изобретения растворитель выбран из группы, состоящей из диолов и триолов. Термин "диол", использованный в данном описании, относится к химическим соединениям, содержащим две гидроксильные группы. Термин "триол", использованный в данном описании, относится к химическим соединениям, содержащим три гидроксильные группы.
В следующем аспекте изобретения растворитель выбран из группы, состоящей из глицерина (пропантриола), этандиола (этиленгликоля), 1,3-пропандиола, метанола, 1,4-бутандиола, 1,3-бутандиола, пропиленгликоля (1,2-пропандиола), этанола и изопропанола или их смесей. В следующем аспекте изобретения растворитель выбран из группы, состоящей из пропиленгликоля и глицерина. В предпочтительном аспекте изобретения растворителем является глицерин. Этот растворитель является биологически совместимым даже при высоких дозах и обладает высокой способностью к растворению инсулиновых пептидных соединений. В другом предпочтительном аспекте изобретения растворитель выбран из группы, состоящей из пропиленгликоля и этиленгликоля. Эти растворители имеют низкую вязкость, являются биологически совместимыми в умеренных дозах и обладают очень высокой способностью к растворению инсулиновых пептидов.
В предпочтительном случае растворители должны иметь высокую степень чистоты с низким содержанием, например, альдегидов, кетонов и других восстанавливающих примесей, чтобы свести к минимуму химическое повреждение солюбилизированного полипептида, обусловленное, например, реакцией Майара (Maillard reaction). К композициям, содержащим полуполярный протонный органический растворитель(и), такой как полиолы, можно добавить акцепторные молекулы типа глицилглицина и этилендиамина для уменьшения повреждений полипептида, тогда как для снижения скорости образования дополнительных восстанавливающих примесей можно добавить антиоксиданты.
В одном из аспектов изобретения органический растворитель присутствует в фармацевтической композиции в количестве по меньшей мере 20% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 30% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 40% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 50% мас./мас. В следующем аспекте изобретения органический растворитель присутствует в количестве по меньшей мере 80% мас./мас.
Обнаружено, что для увеличения стабильности во время хранения фармацевтической композиции заданное значение рН предпочтительно следует подвести до попадания в диапазон от примерно 6,0 до примерно 9,0. В одном из аспектов изобретения заданное значение рН составляет от примерно 6,0 до примерно 9,0, как например, от примерно 6,2 до примерно 8,4, от примерно 6,4 до примерно 8,7, от примерно 6,5 до примерно 8,5, от примерно 7,0 до примерно 8,5 или от примерно 7,2 до примерно 8,3. В одном аспекте заданное значение рН составляет выше примерно 7,4, выше примерно 7,6, выше примерно 7,8, выше примерно 8,0, выше примерно 8,2, выше примерно 8,4 или выше примерно 8,6. Считается, что повышенная стабильность во время хранения обуславливается меньшей тенденцией полипептидов к образованию фибрилл после дегидратирования, как описано выше.
Термин "стабильная во время хранения фармацевтическая композиция", использованный в данном описании, означает фармацевтическую композицию, которая стабильна в течение по меньшей мере периода времени, соответствующего требованиям контролирующих органов применительно к терапевтическим белкам. Предпочтительно, стабильная во время хранения фармацевтическая композиция стабильна в течение по меньшей мере одного года при 5°С. Стабильность во время хранения включает химическую стабильность, а также физическую стабильность. Химическая нестабильность включает расщепление ковалентных связей, например, гидролиз, рацемизацию, окисление или перекрестное сшивание. Химическую стабильность композиций оценивают посредством обращенно-фазовой (RP-HPLC) и стерической эксклюзионной (SE-HPLC) высокоэффективной жидкостной хроматографии. В одном из аспектов изобретения содержание образовавшихся из пептида примесей в течение срока годности составляет менее 10% от общего содержания пептида. В следующем аспекте изобретения содержание образовавшихся из пептида примесей в течение срока годности составляет менее 5%. RP-HPLC-анализ обычно проводят в смесях вода-ацетонитрил или вода-этанол. В одном воплощении растворитель на стадии RP-HPLC будет содержать соль, такую как Na2SO4, (NH4)2SO4, NaCl, KCl и такие буферные системы, как фосфат, цитрат и малеиновая кислота. Необходимая концентрация соли в растворителе может составлять от примерно 0,1 М до примерно 1 М, предпочтительно от 0,2 М до 0,5 М, наиболее предпочтительно от 0,3 до 0,4 М. Увеличение концентрации соли требует увеличения концентрации органического растворителя, чтобы достичь элюирования с колонки за подходящий промежуток времени.
Физическая нестабильность вовлекает конформационные изменения, касающиеся нативной структуры, включая потерю структуры более высокого порядка, агрегацию, образование фибрилл, выпадение в осадок или адсорбцию на поверхностях. Например, известно, что инсулиновые пептиды и соединения амилина имеют склонность к нестабильности, обусловленной образованием фибрилл. Физическую стабильность композиций можно оценивать традиционными методами, например посредством визуальной проверки, нефелометрии и анализа с использованием тиофлавина Т, после хранения композиции при разных температурах в течение различных периодов времени.
Конформационную стабильность можно оценить с применением методов кругового дихроизма и ЯМР (ядерного магнитного резонанса), как описано, например в Hudson and Andersen, Peptide Science, vol.76 (4), pp.298-308 (2004).
Термин "терапевтически активный полипептид" или "терапевтические полипептиды", использованный в данном описании, относится к полипептиду, способному излечивать, ослаблять или частично подавлять клинические проявления определенного заболевания и его осложнений.
В следующем аспекте изобретения термин "терапевтически активный полипептид" или "терапевтические полипептиды", использованный в данном описании, означает полипептид, который разрабатывается для терапевтического применения или который разработан для терапевтического применения.
Количество, достаточное для достижения этой цели, определяют как "терапевтически эффективное количество".
Эффективные количества для каждого назначения будут зависеть от тяжести заболевания или повреждения, а также массы и общего состояния здоровья субъекта. Очевидно, что определение соответствующей дозировки может быть достигнуто в результате рутинного экспериментирования, путем построения матрицы величин и тестирования различных точек в этой матрице, все это доступно обычным специалистам с подготовкой врача и ветеринара.
Термины "полипептид" и "пептид" используются в данном описании взаимозаменяемо для обозначения соединения, состоящего по меньшей мере из пяти структурных составляющих - аминокислот, соединенных пептидными связями. Структурные составляющие - аминокислоты - могут быть из группы аминокислот, кодируемых генетическим кодом, и они могут представлять собой природные аминокислоты, не кодируемые генетическим кодом, а также синтетические аминокислоты. Природными аминокислотами, которые не кодируются генетическим кодом, являются, например гидроксипролин, γ-карбоксиглутаминовая аминокислота, орнитин, фосфосерин, D-аланин и D-глутаминовая кислота. Синтетические аминокислоты включают аминокислоты, получаемые химическим синтезом, т.е. D-изомеры аминокислот, кодируемых генетическим кодом, такие как D-аланин и D-лейцин, Aib (α-аминоизомасляная кислота), Abu (α-аминомасляная кислота), Tle (тpeт-бутилглицин), β-аланин, 3-аминометилбензойная кислота, антраниловая кислота.
Получение полипептидов и пептидов хорошо известно в данной области техники. Полипептиды или пептиды могут быть получены, например, классическим пептидным синтезом, например твердофазным пептидным синтезом с использованием химии t-Boc (трет-бутилоксикарбонил) или Fmoc (9-флуоренилметилоксикарбонил), или с применением других хорошо устоявшихся методик, см., например Greene и Wuts, "Protective Groups in Organic Synthesis", John Wiley & Sons, 1999. Полипептиды или пептиды также могут быть получены способом, который включает в себя культивирование клеток хозяина, содержащих последовательность ДНК, кодирующую данный (поли)пептид, и способных экспрессировать данный (поли)пептид в подходящую питательную среду в условиях, позволяющих осуществлять экспрессию пептида. Для (поли)пептидов, содержащих остатки неприродных аминокислот, рекомбинантная клетка должна быть модифицирована таким образом, чтобы неприродные аминокислоты оказались включенными в данный (поли)пептид, например, посредством получения мутантных форм тРНК.
Термин "фармацевтическая композиция", использованный в данном описании, означает продукт, содержащий терапевтически активный полипептид вместе с фармацевтическими эксципиентами, такими как поверхностно-активное вещество, буфер, консервант и модификатор тоничности, при этом указанная фармацевтическая композиция полезна для лечения, предупреждения или уменьшения тяжести заболевания или расстройства путем введения указанной фармацевтической композиции субъекту. Таким образом, фармацевтическая композиция также известна в данной области техники в качестве фармацевтического препарата. Следует понимать, что значение рН фармацевтической композиции, которая должна быть подвергнута повторному разведению, равно величине рН, которое получается после измерения в повторно разведенной композиции, полученной в результате повторного разведения в предписанной для повторного разведения жидкости при комнатной температуре.
Термин "фармацевтически приемлемый", использованный в данном описании, означает удовлетворение требованиям обычных фармацевтических применений, т.е. не вызывание никаких серьезных неблагоприятных событий у пациентов и т.д.
Термин "буфер", использованный в данном описании, относится к химическому соединению в фармацевтической композиции, которое снижает тенденцию к изменению рН композиции в течение времени, что в противном случае может происходить в результате химических реакций. Буферы включают химические соединения, такие как фосфат натрия, трис, глицин и цитрат натрия.
Термин "консервант", использованный в данном описании, относится к химическому соединению, которое добавляют к фармацевтической композиции для предупреждения или замедления микробиологической активности (роста и метаболизма). Примерами фармацевтически приемлемых консервантов являются фенол, мета-крезол и смесь фенола и мета-крезола.
Термин "стабилизатор", использованный в данном описании, относится к химическим соединениям, добавленным к пептидсодержащим фармацевтическим композициям для того, чтобы стабилизировать пептид, т.е. увеличить срок годности и/или время использования таких композиций. Примерами стабилизаторов, используемых в фармацевтических композициях, являются L-глицин, L-гистидин, аргинин, глицилглицин, этилендиамин, цитрат, EDTA (этилендиаминтетрауксусная кислота), полиэтиленгликоль, карбоксиметилцеллюлоза и поверхностно-активные вещества и антиоксиданты, подобные альфа-токоферолу и L-аскорбиновой кислоте.
Термин "поверхностно-активное вещество", использованный в данном описании, относится к любому веществу, в частности, детергенту, который может адсорбироваться на поверхностях и границах раздела фаз, типа жидкость-воздух, жидкость-жидкость, жидкость-контейнер или жидкость-любое твердое вещество. Поверхностно-активное вещество может быть выбрано из детергента, такого как этоксилированное касторовое масло, полигликозилированные глицериды, ацетилированные моноглицериды, сложные эфиры жирных кислот и сорбитана, полисорбат, как например, полисорбат-20, полоксамеры, как например, полоксамер 188 и полоксамер 407, сложные эфиры жирных кислот и полиоксиэтиленсорбитана, производные полиоксиэтилена, как например, алкилированные и алкоксилированные производные (твины, например Твин-20 или Твин-80), моноглицериды или их этоксилированные производные, диглицериды или их полиоксиэтиленовые производные, глицерин, холевая кислота или ее производные, лецитины, спирты и фосфолипиды, глицерофосфолипиды (лецитины, кефалины, фосфатидилсерин), глицерогликолипиды (галактопиранозид), сфингофосфолипиды (сфингомиелин) и сфингогликолипиды (церамиды, ганглиозиды), DSS (докузат натрия, регистрационный номер по CAS (Chemical abstract service) [577-11-7]), докузат кальция (регистрационный номер по CAS [128-49-4]), докузат калия (регистрационный номер по CAS [7491-09-0]), SDS (додецилсульфат натрия) или лаурилсульфат натрия, дипальмитоил-фосфатидиловая кислота, каприлат натрия, конъюгаты желчных кислот и их солей и глицина или таурина, урсодезоксихолевая кислота, холат натрия, дезоксихолат натрия, таурохолат натрия, гликохолат натрия, N-гексадецил-N,N-диметил-3-аммонио-1-пропансульфонат, анионные (алкил-арил-сульфонаты) моновалентные поверхностно-активные вещества, пальмитоил-лизофосфатидил-L-серин, лизофосфолипиды (например, сложные 1-ацил-sn-глицеро-3-фосфатные эфиры этаноламина, холина, серина или треонина), алкил -, алкоксил - (сложный алкиловый эфир), алкокси - (простой алкиловый эфир) - производные лизофосфатидил- и фосфатидилхолинов, например, лауроил- и миристоил-производные лизофосфатидилхолина, дипальмитоилфосфатидилхолина и модифицированных структур с полярной головной группой, которая представляет собой, холины, этаноламины, фосфатидиловую кислоту, серины, треонины, глицерин, инозит и положительно заряженные DODAC (диолеилдиметиламмония хлорид), DOTMA (диолеоилоксопропил-триметиламмония хлорид), DCP, BISHOP, лизофосфатидилсерин и лизофосфатидилтреонин, цвиттерионные поверхностно-активные вещества (например, N-алкил-N,N-диметиламмонио-1-пропансульфонаты, 3-холамидо-1-пропилдиметил-аммонио-1-пропан-сульфонат, додецилфосфохолин, миристоил-лизофосфатидилхолин, лизолецитин куриного яйца), катионные поверхностно-активные вещества (четвертичные аммониевые основания) (например, цетил-триметиламмония бромид, цетилпиридиния хлорид), неионные поверхностно-активные вещества (например, алкилглюкозиды типа додецил-β-D-глюкопиранозида, додецил-β-D-мальтозида, тетрадецил-β-D-глюкопиранозида, децил-β-D-мальтозида, додецил-β-D-мальтозида, тетрадецил-β-D-мальтозида, гексадецил-β-D-мальтозида, децил-β-D-мальтотриозида, додецил-β-D-мальтотриозида, тетрадецил-β-D-мальтотриозида, гексадецил-β-D-мальтотриозида, н-додецил-сахарозы, н-децил-сахарозы), этоксилаты жирных спиртов (например, простые полиоксиэтилен-алкиловые эфиры типа октаэтиленгликоль-монотридецилового эфира, октаэтиленгликоль-монододецилового эфира, октаэтиленгликоль-монотетрадецилового эфира), блоксополимеры, такие как блоксополимеры полиэтиленоксида и полипропиленоксида (плюроники/тетроники, Тритон Х-100), поверхностно-активные этоксилированные сорбитан-алканоаты (например, Твин-40, Твин-80, Брий-35 (Brij-35)), производные фузидовой кислоты (например, тауро-дигидрофузидат натрия и т.д.), длинноцепочечные жирные кислоты и их (С6-С12) - соли (например, олеиновая кислота и каприловая кислота), ацилкарнитины и производные, Nα-ацилированные производные лизина, аргинина или гистидина либо ацилированные по боковой цепи производные лизина или аргинина, Nα-ацилированные производные дипептидов, содержащих любую комбинацию лизина, аргинина или гистидина и нейтральной или кислой аминокислоты, Nα-ацилированное производное трипептида, содержащего любую комбинацию нейтральной аминокислоты и двух заряженных аминокислот, или поверхностно-активное вещество может быть выбрано из группы производных имидазолина или их смеси.
Термин "лечение заболевания", использованный в данном описании, обозначает терапию и излечение пациента с выявленным заболеванием, состоянием или расстройством. Задача лечения заключается в оказании противодействия этому заболеванию, состоянию или расстройству. Лечение включает введение активных соединений для устранения или влияния на заболевание, состояние или расстройство, а также для ослабления симптомов или осложнений, ассоциированных с данным заболеванием, состоянием или расстройством, и для предупреждения этого заболевания, состояния или расстройства.
Термин "предупреждение заболевания", использованный в данном описании, определяют как терапию и излечение индивидуального риска развития заболевания перед появлением клинической картины начала заболевания. Задача предупреждения заключается в оказании противодействия развитию заболевания, состояния или расстройства и включает введение активных соединений для предупреждения или замедления начала проявления симптомов или осложнений и для предупреждения или замедления развития сопутствующих заболеваний, состояний или расстройств.
Термин "аналог", использованный в данном описании относительно пептида, относится к модифицированному пептиду, в котором один или более чем один аминокислотный остаток заменен в пептиде на другие аминокислотные остатки, и/или в котором один или более чем один аминокислотный остаток удален из пептида, и/или в котором один или более чем один аминокислотный остаток добавлен к пептиду. Такое добавление или удаление аминокислотных остатков может иметь место на N-конце пептида и/или на С-конце пептида. В одном воплощении аналог содержит менее 6 модификаций (замен, делеций, вставок) по сравнению с нативным пептидом. В другом воплощении аналог содержит менее 5 модификаций (замен, делеций, вставок) по сравнению с нативным пептидом. В другом воплощении аналог содержит менее 4 модификаций (замен, делеций, вставок) по сравнению с нативным пептидом. В другом воплощении аналог содержит менее 3 модификаций (замен, делеций, вставок) по сравнению с нативным пептидом. В другом воплощении аналог содержит менее 2 модификаций (замен, делеций, вставок) по сравнению с нативным пептидом. В другом воплощении аналог содержит только единственную модификацию (замену, делецию, вставку) по сравнению с нативным пептидом. Добавленные и/или замененные аминокислотные остатки могут быть, или кодируемыми аминокислотными остатками, или другими существующими в природе остатками, или чисто синтетическими аминокислотными остатками.
Термин "производное", использованный в данном описании в отношении исходного пептида, относится к химически модифицированному исходному белку или его аналогу, в котором имеется по меньшей мере один заместитель, отсутствующий в исходном белке или его аналоге, т.е. к исходному белку, который ковалентно модифицирован. Типичными заместителями, используемыми для модификаций, являются амиды, углеводы, алкильные группы, ацильные группы, сложные эфиры, ПЭГ (для ПЭГилирования) и тому подобное.
Термин " соединение GLP-1", использованный в данном описании, означает GLP-1 (7-37) (SEQ ID NO 1), его инсулинотропный аналог и его инсулинотропные производные.
Термин "инсулинотропный", использованный в данном описании и относящийся к пептиду или соединению, означает способность стимулировать секрецию инсулина в ответ на повышенный уровень глюкозы в плазме крови. Инсулинотропные пептиды и соединения являются агонистами рецептора GLP-1. Инсулинотропные свойства соединения могут быть определены с использованием известных в данной области техники анализов in vitro или in vivo.
Термин "соединение эксендин-4", использованный в данном описании, предназначен для обозначения эксендина-4 (1-39) (SEQ ID NO 2), его инсулинотропных фрагментов, его инсулинотропных аналогов и его инсулинотропных производных.
Под термином "инсулиновый пептид", использованным в данном описании, понимается инсулин человека, инсулин свиньи или бычий инсулин с дисульфидными связями между CysA7 и CysB7 и между CysA20 и CysB19 и внутренней дисульфидной связью между СузА6 и CysAH либо аналог инсулина или его производное.
Термин "инсулиновый аналог", использованный в данном описании, обозначает полипептид, имеющий молекулярную структуру, которая формально может происходить из структуры существующего в природе инсулина, например из инсулина человека, в результате удаления и/или замены по меньшей мере одного аминокислотного остатка, имеющегося в природном инсулине, и/или добавления по меньшей мере одного аминокислотного остатка.
В одном аспекте инсулиновый аналог по изобретению содержит менее 8 модификаций (замен, делеций, вставок) по сравнению с исходным инсулином. В одном аспекте инсулиновый аналог содержит менее 7 модификаций (замен, делеций, вставок) по сравнению с исходным инсулином. В одном аспекте инсулиновый аналог содержит менее 6 модификаций (замен, делеций, вставок) по сравнению с исходным инсулином. В другом аспекте инсулиновый аналог содержит менее 5 модификаций (замен, делеций, вставок) по сравнению с исходным инсулином. В другом аспекте инсулиновый аналог содержит менее 4 модификаций (замен, делеций, вставок) по сравнению с исходным инсулином. В другом аспекте инсулиновый аналог содержит менее 3 модификаций (замен, делеций, вставок) по сравнению с исходным инсулином. В другом аспекте инсулиновый аналог содержит менее 2 модификаций (замен, делеций, вставок) по сравнению с исходным инсулином.
Инсулиновые аналоги могут быть такими, например, чтобы достигалось быстрое начало действия, чтобы их действие было продолжительным и/или чтобы они были стабильны к действию протеаз.
В одном аспекте инсулиновые аналоги являются такими, что достигается быстрое начало действия, т.е. начало действия инсулинового аналога находится в пределах 4 часов, альтернативно 3 часов, 2 часов, 1 часа или ½ часа после введения. В другом аспекте инсулиновые аналоги являются такими, что достигается продолжительное действие, т.е. действие инсулинового аналога продолжается более 4 часов, альтернативно 6 часов, 8 часов, 12 часов, 18 часов или 24 часов после введения.
Инсулиновые аналоги могут быть такими, что положение 28 В-цепи может быть модифицировано с заменой существующего в природе остатка Pro на один из остатков Asp, Lys, Leu, Val, Ala или lie. В другом аспекте Lys в положении В29 инсулина заменен на Pro или Glu. В одном из аспектов инсулиновый аналог по изобретению будет таковым, в котором аминокислотный остаток в положении В28 инсулина представляет собой Pro, Asp, Lys, Leu, Val или Ala, а аминокислотный остаток в положении В29 представляет собой Lys или Pro и возможно аминокислотный остаток в положении В30 удален. Кроме этого, Asn в положении А21 может быть заменен на Ala, Gln, Glu, Gly, His, lie, Leu, Met, Ser, Thr, Trp, Туr или Val, в частности на Gly, Ala, Ser или Thr и предпочтительно на Gly. Кроме того, Asn в положении В3 может быть заменен на Lys, Thr, Ser, Gln, Glu или Asp. Другими примерами инсулиновых аналогов являются дез(В30) человеческий инсулин; аналоги дез(В30) человеческого инсулина; инсулиновые аналоги, где PheB1 делетирован; инсулиновые аналоги с удлиненной по N-концу А-цепью и/или В-цепью и инсулиновые аналоги с удлиненной по С-концу А-цепью и/или В-цепью. Так, в положение В1 могут быть добавлены один или два Аrg. В другом аспекте инсулиновый аналог по изобретению представляет собой человеческий дез(В28-В30) инсулин, человеческий дез(В27) инсулин или человеческий дез(В30) инсулин. В еще одном другом аспекте инсулиновый аналог по изобретению представляет собой инсулиновый аналог, в котором аминокислотным остатком в положении ВЗ является Lys, а аминокислотным остатком в положении В29 является Glu или Asp.
В другом аспекте инсулиновый аналог по изобретению представляет собой человеческий дез(В28-В30) инсулин, человеческий дез(В27) инсулин или человеческий дез(В30) инсулин. В еще одном другом аспекте инсулиновый аналог по изобретению представляет собой инсулиновый аналог, в котором аминокислотный остатком в положении В3 является Lys, а аминокислотным остатком в положении В29 является Glu или Asp.
Инсулиновые аналоги согласно данному изобретению могут быть стабильными к протеолизу инсулиновыми аналогами, т.е. защищенными от расщепления протеазами. Неограничивающий пример стабильных к протеолизу инсулиновых аналогов описан, например в WO 2008/034881 (Novo Nordisk).
В одном аспекте инсулиновый аналог по изобретению представляет собой стабильный к протеолизу инсулиновый аналог.
Под термином "стабильный к протеолизу инсулиновый аналог", используемым в данном описании, понимают инсулиновый аналог, содержащий одну или более мутаций, т.е. одну или более замен, добавок, вставок и/или делеций по сравнению с человеческим инсулином, и который подвержен более медленному расщеплению под действием одной или более чем одной протеазы по сравнению с человеческим инсулином. В одном из аспектов изобретения инсулиновый аналог по изобретению стабилизирован в отношении расщепления под действием одного или более чем одного фермента, выбранного из группы, состоящей из: пепсина (такого как, например, изоформы - пепсин А, пепсин В, пепсин С и/или пепсин F), химотрипсина (такого как, например, изоформы - химотрипсин А, химотрипсин В и/или химотрипсин С), трипсина, фермента, разрушающего инсулин (IDE), эластазы (такой как, например, изоформы панкреатической эластазы I и/или II), карбоксипептидазы (например, изоформы - карбоксипептидаза А, карбоксипептидаза А2 и/или карбоксипептидаза В), аминопептидазы, катепсина D и других ферментов, присутствующих в кишечных экстрактах крысы, свиньи или человека.
В одном из аспектов изобретения стабильный к протеолизу инсулиновый аналог представляет собой инсулиновый аналог, в котором аминокислотой в положении А14 является Glu или His, аминокислотой в положении В25 является His, и который возможно еще содержит одну или более дополнительных мутаций;
инсулиновый аналог, в котором
- аминокислотой в положении А8 является His, и/или аминокислотой в положении А12 является Glu или Asp, и/или аминокислотой в положении А13 является His, Asn, Glu или Asp, и/или аминокислотой в положении А14 является Asn, Gln, Glu, Arg, Asp, Gly или His, и/или аминокислотой в положении А15 является Glu или Asp; и
- аминокислотой в положении В1 является Glu, и/или аминокислотой в положении В16 является Glu или His, и/или аминокислотой в положении В25 является His, и/или аминокислотой в положении В26 является His, Gly, Asp или Thr, и/или аминокислотой в положении В27 является His, Glu, Lys, Gly или Аrg, и/или аминокислотой в положении В28 является His, Gly или Asp; и который возможно еще содержит одну или более дополнительных мутаций; или инсулиновый аналог, в котором аминокислота в положении А14 выбрана из группы, состоящей из Lys, Glu, Arg, Asp, Pro и His; и В-цепь данного инсулинового аналога содержит по меньшей мере две мутации по сравнению с исходным инсулином, причем две или более мутаций представлены в форме делеций аминокислот в положениях В27, В28, В29 и В30 или в форме комбинации делеций аминокислоты в положении В30 и замены аминокислоты, выбранной из замен аминокислот в положении: В25 на His, B26 на Gly или Glu, B27 на Gly или Lys и В28 на Asp, His, Gly, Lys или Glu.
В еще одном следующем аспекте инсулин по изобретению выбран из группы, состоящей из: человеческого инсулина; человеческого дезВ30 инсулина; человеческого AspB28 инсулина; человеческого АsрВ28, дезВ30 инсулина; человеческого LysB3, GluB29 инсулина; человеческого LysB28, ProB29 инсулина; человеческого GluA14, HisB25 инсулина; человеческого HisA14, HisB25 инсулина; человеческого СluА14, НisВ25, дезВ30 инсулина;
человеческого HisA14, HisB25, дезВ30 инсулина;
человеческого СluА14, НisВ25, дезВ27, дезВ28, дезВ29, дезВ30 инсулина;
человеческого СluА14, НisВ25, СluВ27, дезВ30 инсулина;
человеческого CluА14, НisВ16, НisВ25, дезВ30 инсулина;
человеческого HisA14, HisB16, HisB25, дезB30 инсулина;
человеческого HisA8, GluA14, HisB25, GluB27 дeзB30 инсулина;
человеческого HisA8, GluA14, GluB1, СluВ16, НisВ25, СliВ27, дезВ30 инсулина; и
человеческого HisA8, GluA14, GluB16, HisB25 дeзB30 инсулина.
Под терминами "дезВ30 инсулин", "человеческий дезВ30 инсулин" понимают инсулин или его аналог без аминокислотного остатка В30.
Под "исходным инсулином" понимают существующий в природе инсулин, такой как человеческий инсулин или инсулин свиньи. Альтернативно, исходным инсулином может быть аналог инсулина.
В одном аспекте настоящего изобретения терапевтически активный полипептид представляет собой инсулиновый пептид.
В одном из аспектов изобретения инсулиновый пептид представляет собой человеческий инсулин, аналог человеческого инсулина, производное человеческого инсулина или производное аналога человеческого инсулина.
В одном из аспектов изобретения инсулиновый пептид представляет собой человеческий инсулин.
В одном из аспектов изобретения инсулиновый пептид представляет собой производное инсулина. В следующем аспекте изобретения инсулин выбран из группы, состоящей из человеческого B29-Nε-миpиcтoил-дeз(B30) инсулина, человеческого B29-Nε-пaльмитoил-дeз(B30) инсулина, человеческого B29-Nε-миристоил инсулина, человеческого B29-Nε-пaльмитoил инсулина, человеческого B28-Nε-миpиcтoил LysB28ProB29 инсулина, человеческого B28-Nε-пaльмитoил LysB28ProB29 инсулина, человеческого В30-Nε-миристоил-ТhrB29LysB30 инсулина, человеческого В30-Nε-пальмитоил-ТhrB29LysB30 инсулина, человеческого В29-Nε-(N-пальмитоил-γ-глутамил)-дез(В30) инсулина, человеческого B29-Nε-(N-литoxoлил-γ-глутамил)-дез(В30) инсулина, человеческого B29-Nε-(ω-кapбoкcигeптaдeкaнoил)-дез(В30) инсулина и человеческого B29-Nε-(ω-кapбoкcигeптaдeкaнoил) инсулина.
В другом аспекте изобретения производное инсулина представляет собой человеческого B29-Nε-миpиcтoил-дeз(B30) инсулин.
В следующем аспекте изобретения инсулиновый пептид представляет собой кислотостабилизированный инсулин.
Кислотостабилизированный инсулин может быть выбран из аналогов человеческого инсулина, содержащих одну из замен следующих аминокислотных остатков:
A21G;
A21G, B28K, B29P;
A21G, B28D;
A21G, В28Е;
A21G, В3К, В29Е;
А21G, дезВ27;
A21G, В9Е;
A21G, B9D;
A21G, B10E.
В следующем аспекте изобретения инсулиновый пептид представляет собой инсулиновый аналог. Инсулиновый аналог может быть выбран из группы, состоящей из аналогов, в которых аминокислотой в положении В28 является Asp, Lys, Leu, Val или Ala, а в положении В29 - Lys или Pro; и человеческого дез(В28-В30)-, дез(В27)- или дез(В30) инсулина.
В другом аспекте изобретения инсулиновый аналог представляет собой аналог человеческого инсулина, в котором аминокислотой в положении В28 является Asp или Lys, а в положении В29 - Lys или Pro.
В другом аспекте изобретения инсулиновый аналог представляет собой человеческий дез(В30) инсулин.
В другом аспекте изобретения инсулиновый аналог представляет собой аналог человеческого инсулина, в котором аминокислотой в положении В28 является Asp.
В другом аспекте изобретения инсулиновый аналог проставляет собой аналог человеческого инсулина, в котором аминокислотой в положении В3 является Lys, а в положении В29 - Glu или Asp.
В другом аспекте изобретения инсулиновые аналоги и производные выбраны среди таковых, описанных в ЕР 0792290 (Novo Nordisk A/S), EP 0214826 и ЕР 0705275 (Novo Nordisk A/S), US 5504188 (Eli Lilly), EP 0368187 (Aventis), патентах США 5750497 и 6011007, ЕР 375437 и ЕР 383472, и где такие инсулины могут включать, но этим не ограничиваются, инсулин глулизин (также известный как Apidra®; отличается от человеческого инсулина тем, что аминокислота аспарагин в положении В3 заменена на лизин, а лизин в положении В29 заменен на глутаминовую кислоту), человеческий LysB28ProB29 инсулин (Humalog®) и человеческий AspB28 инсулин (инсулин аспарт (Novolog®)).
В одном из аспектов изобретения указанный аналог человеческого инсулина представляет собой человеческий АspB28-инсулин. В другом аспекте изобретения указанный аналог человеческого инсулина представляет собой человеческий LysB28РroB29-инсулин. В другом аспекте изобретения указанный аналог человеческого инсулина представляет собой человеческий LysB3, GluB29-инсулин (инсулин глулизин). В другом аспекте изобретения указанный аналог человеческого инсулина представляет собой человеческий дез(В30) инсулин.
Кроме того, данным изобретением охватываются производные предшественников или промежуточных соединений. Примером такого производного является одноцепочечный инсулин, который содержит В- и А-цепь человеческого инсулина или его аналогов либо производных, соединенных соединяющим пептидом.
Производное инсулина по изобретению представляет собой существующий в природе инсулин или инсулиновый аналог, который химически модифицирован, например, посредством введения боковой цепи в одно или более чем одно положение остова инсулина, или посредством окисления или восстановления групп аминокислотных остатков в инсулине, или посредством превращения свободной карбоксильной группы в группу сложного эфира или в амидную группу. Другие производные получают ацилированием свободной аминогруппы или гидроксильной группы, как например, в положении В29 человеческого инсулина или человеческого дезВ30 инсулина. Неограничивающий пример ацилированных полипептидов можно, например, найти в WO 95/07931, которая тем самым включена посредством ссылки.
В одном из аспектов изобретения терапевтически активный полипептид имеет молекулярную массу менее 100 кДа, менее 50 кДа или менее 10 кДа.
В одном из аспектов изобретения терапевтически активный полипептид имеет молекулярную массу менее 100 кДа, менее 50 кДа или менее 10 кДа при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
В другом аспекте изобретения терапевтически активный полипептид содержит менее 100 аминокислот, или менее 90 аминокислот, или менее 60 аминокислот. В другом аспекте изобретения терапевтически активный полипептид содержит по меньшей мере 10 аминокислот, по меньшей мере 15 аминокислот или по меньшей мере 20 аминокислот. В следующем аспекте изобретения терапевтически активный полипептид содержит 10-100 аминокислот, в следующем аспекте 15-90 аминокислот, в следующем аспекте 20-80 аминокислот, в следующем аспекте 20-70 аминокислот, в следующем аспекте 25-70 аминокислот, в еще одном следующем аспекте 25-65 аминокислот, в еще одном следующем аспекте 25-60 аминокислот или 25-55 аминокислот. В еще одном следующем аспекте терапевтически активный полипептид содержит 30-70 аминокислот, 30-65 аминокислот, 30-60 аминокислот или 30-55 аминокислот.
В другом аспекте изобретения терапевтически активный полипептид содержит менее 100 аминокислот, или менее 90 аминокислот, или менее 60 аминокислот. В другом аспекте изобретения терапевтически активный полипептид содержит по меньшей мере 10 аминокислот, по меньшей мере 15 аминокислот или по меньшей мере 20 аминокислот. В следующем аспекте изобретения терапевтически активный полипептид содержит 10-100 аминокислот, в следующем аспекте 15-90 аминокислот, в следующем аспекте 20-80 аминокислот, в следующем аспекте 20-70 аминокислот, в следующем аспекте 25-70 аминокислот, в еще одном следующем аспекте 25-65 аминокислот, в еще одном следующем аспекте 25-60 аминокислот или 25-55 аминокислот. В еще одном следующем аспекте терапевтически активный полипептид содержит 30-70 аминокислот, 30-65 аминокислот, 30-60 аминокислот или 30-55 аминокислот при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
В одном из аспектов изобретения терапевтически активный полипептид является растворимым в воде полипептидом. В другом аспекте терапевтически активный полипептид растворим в воде в концентрации по меньшей мере 100 мкг полипептида на один мл раствора при 25°С. Еще в одном другом аспекте терапевтически активный полипептид растворим в воде при значениях рН, отличающихся по меньшей мере на 2 единицы рН от изоэлектрической точки полипептида в водном растворе. Таким образом, в одном из аспектов изобретения полипептид растворим в воде при значениях рН, более чем на 2 единицы рН превышающих изоэлектрическую точку полипептида. В другом аспекте изобретения полипептид растворим в воде при значениях рН, лежащих более чем на 2 единицы рН ниже изоэлектрической точки полипептида. В следующем аспекте полипептид растворим в воде при значениях рН, лежащих более чем на 2,5 единицы рН выше или ниже pI полипептида. В еще одном следующем аспекте полипептид растворим в воде при значениях рН, лежащих на 3,0 единицы рН выше или ниже pI полипептида. В следующем аспекте полипептид растворим в воде при значениях рН, лежащих на 3,5 единицы рН выше или ниже pI полипептида.
В одном из аспектов изобретения терапевтически активный полипептид является растворимым в воде полипептидом по любому из приведенных выше аспектов при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
Под термином "растворимый в воде" понимают, что полипептид растворяется в большой концентрации, такой как 100 мкг полипептида на один мл раствора, в водном или буферном растворе при 25°С. Методы определения, является ли содержащийся в растворе полипептид растворенным, известны в данной области техники.
В одном воплощении раствор можно подвергнуть центрифугированию в течение 20 минут при 30000 g и затем определить концентрацию полипептида в супернатанте, используя RP-HPLC. Если эта концентрация равна, в пределах ошибки эксперимента, концентрации полипептида, изначально использованной для приготовления композиции, то полипептид полностью растворим в композиции по изобретению.
В другом воплощении растворимость полипептида в композиции по изобретению может быть определена просто посредством визуальной проверки контейнера, в котором данная композиция содержится. Полипептид считается растворимым, если раствор на взгляд прозрачен и не содержит никаких частичек вещества ни в суспендированном состоянии, ни в виде осадка на стенках/дне контейнера.
Специалистам известно, например, что циклоспорины не растворяются в воде.
В одном из аспектов изобретения, терапевтически активный полипептид выбран из группы, состоящей из одноцепочечного инсулина (такого как, например, описанный в WO 2005/054291), миметиков инсулина (таких как, например, описанные в WO 2006/018450), полипептида, который связывается с МС4-рецептором, гормона роста человека или его аналога, фактора VII или его аналога, паратиреоидного гормона или его аналога, фолликулостимулирующего гормона человека или его аналога, ростового фактора, такого как фактор роста тромбоцитов (PDGF), обестатин, трансформирующий фактор роста α (TGF-α), трансформирующий фактор роста β (TGF-β), эпидермальный фактор роста (EGF), сосудистый эндотелиальный фактор роста (VEGF), соматомедин, такой как инсулиноподобный ростовой фактор I (IGF-I), инсулиноподобный ростовой фактор II (IFG-II), эритропоэтин (ЕРО), тромбопоэтин (ТРО) или ангиопоэтин, интерферона, проурокиназы, урокиназы, тканевого активатора плазминогена (t-PA), ингибитора 1 активатора плазминогена, ингибитора 2 активатора плазминогена, фактора фон Виллебрандта, цитокина, например интерлейкина, такого как интерлейкин (IL) 1, IL-1Ra, IL-2, IL-4, IL-5, IL-6, IL-9, IL-11, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-20 или IL-21, колониестимулирующего фактора (CFS), такого как GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор), фактора стволовых клеток, фактора некроза опухоли, такого как TNF-α, лимфотоксина-α, лимфотоксина-β, CD40L (лиганд кластера дифференцировки 40) или CD30L, ингибитора протеаз, например, апротинина, фермента, такого как супероксиддисмутаза, аспарагиназа, аргиназа, аргининдеаминаза, аденозиндеаминаза, рибонуклеаза, каталаза, уриказа, билирубиноксидаза, трипсин, папаин, щелочная фосфатаза, β-глюкуронидаза, пурин-нуклеозид-фосфорилаза или батроксобин, опиоида, например, эндорфинов, энкефалинов или неприродных опиоидов, гормона или нейропептида, например кальцитонина, глюкагона, гастринов, адренокортикотропного гормона (АСТН), холецистокининов, лютеинизирующего гормона, гонадотропин-рилизинг-гормона, хорионического гонадотропина, кортикотропин-рилизинг-фактора, вазопрессина, окситоцина, антидиуретических гормонов, тиреотропного гормона, тиреотропин-рилизинг-гормона, релаксина, пролактина, пептида YY, нейропептида Y, панкреатического полипептида, лептина, CART (кокаин/амфетамин-регулируемый транскрипт), CART-родственного пептида, перилипина, пептидных гормонов, действующих на рецепторы меланокортина, таких как α-MSH (меланоцит-стимулирующий гормон) или АСТН, меланин-концентрирующих гормонов, натрийуретических пептидов, адреномедуллина, эндотелина, секретина, амилина, вазоактивного интестинального пептида (VIP), полипептида, активирующего аденилатциклазу гипофиза, (РАСАР), бомбезина, бомбезиноподобных пептидов, тимозина, гепаринсвязывающего белка, растворимого CD4, гипоталамического рилизинг-фактора, меланотонинов и их аналогов.
Конформационная стабильность основанных на белках лекарственных средств важна для поддержания биологической активности и для сведения к минимуму необратимой потери структуры, обусловленной денатурацией и образованием фибрилл. Особенно лабильными в отношении конформационного изменения, обусловленного сложными особенностями рефолдинга, являются большие полипептиды и белки. Кроме этого, полипептиды с известной предысторией образования фибрилл, такие как инсулин и амилин, являются особенно чувствительными в отношении дестабилизации третичной структуры (т.е. образования состояния расплавленной глобулы).
Эффективные количества в каждом конкретном случае будут зависеть от тяжести заболевания или повреждения, а также массы и общего состояния здоровья субъекта.
В одном из аспектов изобретения фармацевтическая композиция содержит терапевтически активный полипептид в концентрации от 0,1% мас./мас. до 50% мас./мас.
Эффективные количества в каждом конкретном случае будут зависеть от тяжести заболевания или повреждения, а также массы и общего состояния здоровья субъекта.
Термин "примерно", использованный в данном описании, означает допустимый разброс (reasonable vicinity) установленной количественной величины, как например, плюс или минус 10%.
Согласно настоящему изобретению также предложен способ получения фармацевтического раствора путем:
a) получения водного раствора терапевтически активного полипептида, возможно содержащего эксципиенты,
b) подведения величины рН к заданному значению рН, которое на 1 единицу, предпочтительно на 2 единицы и более предпочтительно на 2,5 единицы рН выше или ниже pI полипептида,
c) удаления воды из (дегидратации) раствора полипептида с применением стандартных методик сушки, таких как сублимационная и распылительная сушка, и
d) смешивания и растворения полипептида в полуполярном протонном неводном растворителе, например посредством перемешивания, переворачивания (tumbling) или других способов смешивания,
e) возможно фильтрования или центрифугирования неводного раствора полипептида для удаления нерастворившихся неорганических солей,
f) возможно удаления остаточных количеств воды посредством, например, добавления твердых поглотителей влаги или вакуумной сушки,
g) возможно добавления дополнительных эксципиентов, таких как гидрофторалкановые пропелленты и сорастворители, для использования в дозирующих ингаляторах под давлением для растворов или добавления детергентов, полимеров, липидов и сорастворителей для пероральных лекарственных форм.
Согласно настоящему изобретению также предложен способ получения фармацевтического раствора путем:
a) получения водного раствора терапевтически активного полипептида, возможно содержащего эксципиенты,
b) подведения величины рН к заданному значению рН, которое на 1 единицу, предпочтительно на 2 единицы и более предпочтительно на 2,5 единицы рН выше или ниже pI полипептида,
c) удаления воды из (дегидратации) раствора полипептида с применением стандартных методик сушки, таких как сублимационная и распылительная сушка, и
d) смешивания и растворения полипептида в полуполярном протонном неводном растворителе, например посредством перемешивания, переворачивания или других способов смешивания,
e) возможно фильтрования или центрифугирования неводного раствора полипептида для удаления нерастворившихся неорганических солей,
f) возможно удаления остаточных количеств воды посредством, например добавления твердых поглотителей влаги или вакуумной сушки,
g) возможно добавления дополнительных эксципиентов, таких как гидрофторалкановые пропелленты и сорастворители, для использования в дозирующих ингаляторах под давлением для растворов или добавления детергентов, полимеров, липидов и сорастворителей для пероральных лекарственных форм,
при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
Согласно настоящему изобретению также предложен способ получения фармацевтической композиции путем:
a) получения водного раствора терапевтически активного полипептида, возможно содержащего стабилизаторы, такие как цинк и глицилглицин,
b) подведения величины рН к заданному значению рН, которое на 1 единицу, предпочтительно на 2 единицы и более предпочтительно на 2,5 единицы рН выше или ниже pI полипептида, например, путем добавления к раствору нелетучего основания или нелетучей кислоты, таких как соляная кислота или гидроксид натрия,
c) удаления воды из (дегидратации) раствора полипептида с применением стандартных методик сушки, таких как сублимационная и распылительная сушка,
d) смешивания и растворения полипептида в полуполярном протонном неводном растворителе, например посредством перемешивания, переворачивания или других способов смешивания,
e) возможно фильтрования или центрифугирования неводного раствора полипептида для удаления нерастворившихся неорганических солей,
f) возможно удаления остаточных количеств воды посредством, например добавления твердых поглотителей влаги или вакуумной сушки,
g) возможно добавления дополнительных эксципиентов, таких как гидрофторалкановые пропелленты и сорастворители, для использования в дозирующих ингаляторах под давлением для растворов или добавления детергентов, полимеров, липидов и сорастворителей для пероральных лекарственных форм.
Согласно настоящему изобретению также предложен способ получения фармацевтической композиции путем:
а) получения водного раствора терапевтически активного полипептида, возможно содержащего стабилизаторы, такие как цинк и глицилглицин,
b) подведения величины рН к заданному значению рН, которое на 1 единицу, предпочтительно на 2 единицы и более предпочтительно на 2,5 единицы рН выше или ниже рI полипептида, например, путем добавления к раствору нелетучего основания или нелетучей кислоты, таких как соляная кислота или гидроксид натрия,
c) удаления воды из (дегидратации) раствора полипептида с применением стандартных методик сушки, таких как сублимационная и распылительная сушка,
d) смешивания и растворения полипептида в полуполярном протонном неводном растворителе, например посредством перемешивания, вращения, переворачивания или других способов смешивания,
e) возможно фильтрования или центрифугирования неводного раствора полипептида для удаления нерастворившихся неорганических солей,
f) возможно удаления остаточных количеств воды посредством, например добавления твердых поглотителей влаги или вакуумной сушки,
g) возможно добавления дополнительных эксципиентов, таких как гидрофторалкановые пропелленты и сорастворители, для использования в дозирующих ингаляторах под давлением для растворов или добавления детергентов, полимеров, липидов и сорастворителей для пероральных лекарственных форм,
при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
В одном из аспектов изобретения полипептид добавляют в водный раствор. Водный раствор может представлять собой чистую воду, или он может содержать эксципиенты или щелочной раствор. В одном из аспектов изобретения рН раствора полипептида подводят щелочным раствором, содержащим нелетучее основание. Нелетучее основание может быть выбрано из группы, состоящей из солей щелочных металлов, гидроксидов щелочных металлов, солей щелочноземельных металлов, гидроксидов щелочноземельных металлов и аминокислот или их комбинации. Например, рН может быть подведен гидроксидом натрия, гидроксидом калия, гидроксидом кальция, оксидом кальция или любой их комбинацией. В другом аспекте изобретения рН раствора полипептида подводят нелетучей кислотой, выбранной из соляной кислоты, фосфорной кислоты и серной кислоты.
В одном из аспектов изобретения неводный раствор полипептида содержит глицилглицин. Глицилглицин может действовать как акцепторная молекула для восстанавливающих примесей в растворителях, таких как, например глицеральдегид. В одном аспекте глицилглицин добавляют к раствору пропиленгликоля, содержащему инсулин, например, в концентрации глицилглицина в растворе от примерно 4 мМ до примерно 200 мМ.
В одном из аспектов изобретения неводный раствор полипептида содержит Твин 80 и олеиновую кислоту. Когда Твин 80 и олеиновую кислоту добавляют к неводному раствору полипептида, раствор полипептида образует микроэмульсию по мере разбавления водной средой для последующего перорального введения. Микроэмульсия могла бы действовать как усилитель всасывания и, кроме того, определять более воспроизводимую кинетику всасывания. Концентрация Твина 80 в растворе, например, будет составлять примерно 30-70% мас./мас., а концентрация олеиновой кислоты, например, будет составлять 10-30% мас./мас.
В одном аспекте изобретение относится к фармацевтической композиции для лечения диабета 1 типа, диабета 2 типа и других состояний, вызывающих гипергликемию у пациентов, нуждающихся в таком лечении.
В одном аспекте изобретение относится к фармацевтической композиции по изобретению с фармацевтически приемлемым носителем и/или фармацевтически приемлемой добавкой, при этом композиция может быть предложена для лечения диабета 1 типа, диабета 2 типа и других состояний, вызывающих гипергликемию у пациентов, нуждающихся в таком лечении.
В одном из аспектов изобретения предложен способ лечения диабета 1 типа, диабета 2 типа и других состояний, вызывающих гипергликемию у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции по изобретению.
В одном из аспектов изобретения предложен способ лечения диабета 1 типа, диабета 2 типа и других состояний, вызывающих гипергликемию у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции по изобретению возможно вместе с фармацевтически приемлемым носителем и/или фармацевтическими приемлемыми добавками.
В одном из аспектов изобретения предложен способ изготовления фармацевтической композиции по изобретению для применения в лечении диабета 1 типа, диабета 2 типа и других состояний, которые вызывают гипергликемию.
В одном из аспектов изобретения предложен способ изготовления фармацевтической композиции для применения в лечении диабета 1 типа, диабета 2 типа и других состояний, которые вызывают гипергликемию.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Композиции по изобретению могут быть введены, например, подкожно, перорально, назально или легочным путем.
Для подкожного введения, композицию по изобретению готовят по аналогии с препаратом известных терапевтически активных полипептидов. Кроме того, что касается подкожного введения, композиции по изобретению вводят аналогично введению известных терапевтически активных полипептидов и, как правило, эта процедура известна практикующим врачам.
В одном из аспектов изобретения, где терапевтически активным пептидом является инсулиновый пептид, композиции по изобретению могут быть введены посредством ингаляции эффективной дозы для увеличения уровней инсулинового пептида в кровотоке и/или для снижения уровней глюкозы в кровотоке. Такое введение может оказаться эффективным для лечения таких расстройств, как диабет или гипергликемия. Для достижения эффективных доз, например, инсулина, необходимо ввести посредством ингаляции дозу композиции по изобретению, содержащую более чем от примерно 0,5 мкг/кг до примерно 50 мкг/кг инсулина. Терапевтически эффективное количество может быть определено хорошо осведомленным практикующим врачом, который учтет факторы, включая уровень инсулина, уровни глюкозы в крови, физическое состояние пациента, состояние легких пациента или тому подобное.
Композиция по изобретению может быть доставлена посредством ингаляции для достижения быстрого всасывания терапевтически активного полипептида, такого как инсулин. Введение посредством ингаляции может приводить к фармакокинетике, сравнимой с таковой при подкожном введении инсулина. Ингаляция композиций по изобретению, в которых терапевтическим полипептидом является инсулиновый пептид, вызывает быстрое повышение уровня циркулирующего инсулина с последующим быстрым снижение уровней глюкозы в крови. Различные ингаляционные устройства обычно дают схожую картину фармакокинетики, когда сопоставляются схожие размеры частиц и схожие уровни их осаждения в легких.
Согласно изобретению доставка композиции может быть осуществлена с использованием любого из ряда ингаляционных устройств, известных в данной области техники для введения терапевтического агента, такого как инсулиновый пептид, посредством ингаляции. Эти устройства включают дозирующие ингаляторы, небулайзеры, сухие порошковые генерирующие устройства, распыляющие устройства и тому подобное. Композиции по данному изобретению в одном аспекте доставляют посредством дозирующего ингалятора под давлением или распыляющего устройства. Имеется несколько желательных характеристик ингаляционного устройства в отношении введения композиции по изобретению. Например, предпочтительно, обеспечивающее доставку ингаляционное устройство должно быть надежным в эксплуатации, давать воспроизводимые и достоверные результаты. С помощью ингаляционного устройства следует доставлять небольшие частицы, например, частицы размером менее примерно 10 мкм, например, примерно 1-5 мкм, для достижения хорошей вдыхаемости. Некоторыми конкретными примерами имеющихся в продаже ингаляционных устройств, подходящих для применения в этом изобретении, являются Turbohaler™ (Astra), Rotahaler® (Glaxo), Diskus® (Glaxo), ингалятор Spiros™ (Dura), устройства, поставляемые на рынок Nektar, 3M Drug Delivery Systems и Bespak, AERx™ (Aradigm), небулайзер Ultravent® (Mallinckrodt), небулайзер Acorn II® (Marquest MedicalProducts), дозирующий ингалятор Ventolin® (Glaxo), порошковый ингалятор Spinhaler® (Fisons) или тому подобное.
Дозирующие ингаляторы под давлением (pMDI) являются хорошо известными устройствами для введения фармацевтических продуктов в респираторный тракт посредством ингаляции. pMDI содержат выдерживающую давление емкость для аэрозоля, обычно заполненную продуктом, таким как лекарственное средство, растворенное в сжиженном пропелленте, (композиции-растворы) или микронизированные частицы, суспендированные в сжиженном пропелленте, (композиции-суспензии), при этом контейнер оборудован дозирующим клапаном. Композиции-растворы характеризуются тем преимуществом, что образуют гомогенную смесь с активным ингредиентом и эксципиентами, полностью растворенными в пропелленте-разбавителе или его смеси с подходящими сорастворителями, такими как этанол. Благодаря композициям-растворам также устраняются проблемы физической стабильности, характерные для композиций-суспензий, поскольку обеспечивается более однообразное равномерное дозирование.
Гидрофторалканы и, в частности, 1,1,1,2-тетрафторэтан (HFA 134а) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227) и их смеси признаны наилучшими кандидатами на роль не-CFC (не-хлорфторуглеродных) пропеллентов. Приведение в действие дозирующего клапана позволяет высвободить небольшую часть распыляемого продукта, тем самым под давлением сжиженного пропеллента частицы растворенного или микронизированного лекарственного средства переносятся из контейнера к пациенту. Для направления распыляемого аэрозоля в ротоглотку пациента используют клапан-пускатель. Контейнеры могут состоять из алюминия или нержавеющей стали с внутренней поверхностью, на которую нанесено инертное органическое покрытие, оборудованы дозирующим клапаном с камерой для отмеривания 63 микролитров, снабженной прокладкой из бутилкаучука, как описано в WO 03/078538.
Как признано среди специалистов в данной области техники, композиция по изобретению, количество доставляемой композиции и продолжительность введения однократной дозы зависят от типа применяемого ингаляционного устройства. Для некоторых систем доставки аэрозолей, таких как небулайзеры, частота введения и длительность промежутка времени, в течение которого система приводится в действие, будут зависеть главным образом от концентрации терапевтического полипептида в аэрозоле.
Например, при более высоких концентрациях терапевтического полипептида в распыляемом растворе можно использовать более короткие периоды введения. Такие устройства, как дозирующие ингаляторы, могут обеспечивать более высокие концентрации аэрозольных частиц и могут быть задействованы в течение более коротких периодов времени, чтобы доставить желаемое количество полипептида. Такие устройства, как порошковые ингаляторы, доставляют активный агент до тех пор, пока из этого устройства не вытеснится весь загруженный в него агент. Для этого типа ингалятора количество композиции по изобретению в заданном количестве порошка определяет дозу, доставляемую за одно введение.
Размер частиц полипептида, такого как инсулин, в композиции, доставляемой посредством ингаляционного устройства, является критичным в том, что касается способности, например, инсулина входить в легкие и в нижние дыхательные пути или альвеолы. Полипептид в композиции по данному изобретению может быть изготовлен в составе композиции таким образом, чтобы по меньшей мере примерно 10% доставляемого полипептида осаждались в легком, например, примерно от 10 до примерно 20% или больше. Известно, что максимальную эффективность осаждения в легких для людей, вдыхающих через рот, получают, используя размеры частиц от примерно 2 мкм до примерно 3 мкм. Осаждение в легких значительно уменьшается, когда размеры частиц превышают примерно 5 мкм. Размеры частиц ниже примерно 1 мкм вызывают уменьшение осаждения в легких, и становится затруднительной доставка частиц в достаточном количестве для проявления терапевтического эффекта. Таким образом, частицы доставляемого ингаляцией полипептида характеризуются размером менее примерно 10 мкм, например, в диапазоне от примерно 1 мкм до примерно 5 мкм. Композицию полипептида выбирают так, чтобы получить желаемый размер частиц в выбранном ингаляционном устройстве.
Раствор полипептида возможно может быть объединен с фармацевтическими носителями или эксципиентами, подходящими для введения в дыхательные пути или в легкое. Такие носители могут служить просто в качестве наполнителей, когда желательно снизить концентрацию терапевтического полипептида, такого как инсулин, в жидкости, которая будет доставлена пациенту, но кроме этого они могут служить для повышения стабильности композиций.
Подходящие вещества включают углеводы, например, (а) моносахариды, такие как фруктоза, галактоза, глюкоза, D-манноза, сорбоза и тому подобное; дисахариды, такие как лактоза, трегалоза, целлобиоза и тому подобное; циклодекстрины, такие как 2-гидроксипропил-циклодекстрин; и полисахариды, такие как раффиноза, мальтодекстрины, декстраны и тому подобное; (b) аминокислоты, такие как глицин, аргинин, аспарагиновая кислота, глутаминовая кислота, цистеин, лизин, гистидин, аргинин и тому подобное; (с) органические соли, полученные из органических кислот и оснований, такие как цитрат натрия, аскорбат натрия, глюконат магния, глюконат натрия, трометамина гидрохлорид и тому подобное; (d) пептиды и белки, такие как аспартам, сывороточный альбумин человека, желатин и тому подобное; (е) альдиты, такие как маннит, ксилит и тому подобное. Предпочтительная группа носителей включает лактозу, трегалозу, раффинозу, мальтодекстрины, глицин, цитрат натрия, трометамина гидрохлорид, сывороточный альбумин человека и маннит.
Подобные вещества-носители можно объединять с терапевтическим полипептидом, таким как инсулиновый пептид, перед дегидратированием, например, распылительной сушкой, т.е. путем добавления вещества-носителя к раствору полипептида, который подготавливают для распылительной сушки. В этом случае вещество-носитель будет сформировано в частицы одновременно с белков и будет составлять часть этих частиц.
Обычно, в случае когда носитель формируют посредством распылительной сушки вместе с полипептидом, полипептид будет присутствовать в каждой индивидуальной частице с весовым процентным содержанием в диапазоне от 5% до 95%, предпочтительно от 20% до 80%. Остальную часть частицы в первую очередь будет занимать вещество-носитель (обычно составляя от 5% до 95%, в типичном случае составляя от 20% до 80% по массе), но также будет включен буфер(ы) и могут быть включены другие компоненты, которые описаны выше.
Кроме того, неводные инсулиновые композиции могут быть объединены с другими активными компонентами. Например, может оказаться желательным объединить небольшие количества амилина или активных аналогов амилина в инсулиновых композициях для улучшения лечения диабета. Амилин представляет собой гормон, который секретируется с инсулином из панкреатических β-клеток у нормальных индивидуумов (не страдающих диабетом). Считается, что амилин модулирует активность инсулина in vivo, и предполагается, что одновременное введение амилина с инсулином могло бы улучшить регулирование глюкозы в крови. Комбинирование амилина с инсулином в композициях по настоящему изобретению позволит получить особенно удобный продукт для достижения такого одновременного введения. Амилин может быть объединен с инсулином таким образом: от 0,1% по массе до 10% по массе (из расчета на общую массу инсулина в дозе), предпочтительно от 0,5% по массе до 2,5% по массе. Амилин имеется в продаже у таких поставщиков, как Amylin Corporation, San Diego, California, и может быть легко изготовлен в композициях по настоящему изобретению. Например, амилин можно растворить в водных или других подходящих растворах вместе с инсулином, и возможно с носителями, и этот раствор высушить распылительной сушкой с получением порошкообразного продукта.
Аэрозоль, включающий в себя высушенный распылительной сушкой полипептид, может быть получен посредством пропускания суспензии или раствора полипептида через сопло под давлением. Размер и конфигурация сопла, приложенное давление и скорость подачи жидкости могут быть выбраны с целью достижения желаемого выхода и размера частиц. Электрораспыление может быть произведено, например, посредством приложения электического поля к капилляру или сопло.
Предпочтительно, чтобы частицы, например, инсулина, доставляемые посредством распыляющего устройства, имели размер частиц менее примерно 10 мкм, например, в диапазоне от примерно 1 мкм до примерно 5 мкм.
Фармацевтические композиции по настоящему изобретению, содержащие дегидратированный, например, высушенный распылительной сушкой полипептид, растворенный в полуполярном протонном органическом растворителе, таком как полиол, также могут быть введены парентерально пациентам, нуждающимся в таком лечении.
Парентеральное введение может быть осуществлено путем подкожной, внутримышечной или внутривенной инъекции посредством шприца, возможно шприца-ручки (pen-like syringe). Альтернативно, парентеральное введение может быть осуществлено посредством инфузионного насоса.
Композиции по изобретению могут быть использованы вместе с такими помпами, как инсулиновые помпы. Инсулиновые помпы могут быть предустановленными и одноразовыми, или препараты инсулина доставляются из сменного резервуара. Инсулиновые помпы можно крепить на коже, имплантировать или носить отдельно, и путь доставки инсулинового препарата от места размещения в помпе к пациенту может быть до некоторой степени извилистым. Неограничивающие примеры инсулиновых помп описаны в US 5957895, US 5858001, US 4468221, US 4468221, US 5957895, US 5858001, US 6074 US, US 5858001, US 5527288 и US 6074369.
Инъекционные композиции по настоящему изобретению, содержащие дегидратированный, например, высушенный распылительной сушкой полипептид, могут быть приготовлены с использованием традиционных методик фармацевтической промышленности, включающих в себя растворение и смешивание ингредиентов в полуполярном протонном органическом растворителе, таком как полиол, как целесообразно, для получения желаемого конечного продукта.
В настоящее время, инъекция представляет собой типичный способ введения биологически активного белка в системное кровообращение. Реципиент может испытывать дискомфорт или боль от инъекции. По этой и другим причинам могут существовать проблемы с соблюдением больным режима и схемы лечения при использовании инъекции в качестве способа введения. Одной из альтернатив инъекции является пероральное введение биологически активных полипептидов. В случае инсулина пероральная доставка может иметь преимущества помимо удобства и вопросов соответствия режиму лечения. Инсулин, всасываемый в желудочно-кишечном тракте, с точки зрения физиологии имитирует инсулин, секретируемый поджелудочной железой, поскольку и тот и другой высвобождаются в воротную вену и переносятся непосредственно в печень. Всасывание в системе кровообращения воротной вены поддерживает градиент уровней инсулина воротная вена - периферическая кровь (peripheral-portal insulin gradient), который регулирует секрецию инсулина. При первом прохождении инсулина через печень приблизительно 60% инсулина удерживается и метаболизируется, тем самым снижая частоту возникновения периферической гиперинсулинемии, фактора при диабет-ассоциированных системных осложнениях. Пугающим и не редким осложнением лечения инсулином и другими пероральными антидиабетическими агентами является гипогликемия.
Однако пероральная биодоступность полипептидов является чрезвычайно низкой ввиду обширного протеолитического расщепления в желудочно-кишечном тракте и низкой эпителиальной проницаемости. Например, изучения ферментативного расщепления показывают, что нативный инсулин интенсивно расщепляется в присутствии трипсина и α-химотрипсина. Поэтому стабилизация полипептидов против протеолитического расщепления с применением методов белковой инженерии, таких как пегилирование и внесение мутаций в "горячие" точки, является широко используемой стратегией улучшения пероральной биодоступности. Другая стратегия снижения протеолитического расщепления заключается в инкорпорировании полипептида внутрь наночастиц, микрочастиц, микроэмульсий, микроэмульсионных предконцентратов, липосом и тому подобного. Лекарственное средство не только становится защищенным от враждебного окружения в желудке и желудочно-кишечном тракте, но также эти частицы могли бы поступать из энетрального пути в системное кровообращение через пейеровы бляшки.
В одном из воплощений фармацевтическая неводная композиция представляет собой микроэмульсионный преконцентрат. Это есть композиция, которая самопроизвольно образует эмульсию по мере разбавления в водной среде, например в воде или желудочно-кишечном соке, например, переходя в микроэмульсии типа масло-в-воде (o/w). Микроэмульсии понимаются как термодинамически стабильные системы со средним доменным размером эмульгированной фазы в низшем нм диапазоне, например, в диапазоне 20-400 нм.
В общем случае микроэмульсионный предконцентрат содержит один или более чем один гидрофильный компонент, один или более чем один липофильный компонент, одно или более чем одно неионное поверхностно-активное вещество и/или поверхностно-активное вещество совместного действия (сосурфактант) и активный ингредиент, например терапевтический пептид или белок, полностью растворенный в смеси предконцентрата. В дополнение к этому, микроэмульсионный преконцентрат может содержать, как целесообразно, традиционные адъюванты и добавки.
Эти само-(микро)-эмульгирующие предконцентраты можно проглатывать предполагая, что микроэмульсия образуется в желудочно-кишечном тракте. Микроэмульсионный предконцентрат может быть введен, будучи инкапсулированным в мягкую желатиновую капсулу с энтеросолюбильным покрытием.
Сообщается, что многие микроэмульсии увеличивают биодоступность некоторых терапевтических соединений после перорального введения.
Примером композиции микроэмульсионного предконцентрата является:
a) по меньшей мере один полуполярный протонный органический растворитель, такой как полиол (например, пропиленгликоль и/или глицерин);
b) один или более чем один гидрофильный компонент, такой как глицерин и/или пропиленгликоль;
b) один или более чем один липофильный компонент, такой как масла (например, моно-, диглицериды и/или триглицериды);
c) одно или более чем одно неионное поверхностно-активное вещество, такое как полоксамеры и/или полисорбаты;
d) одно или более чем одно поверхностно-активное вещество совместного действия, такое как этанол;
e) дегидратированный терапевтически активный полипептид (например, инсулин);
f) одна или более чем одна добавка, такая как антиоксиданты и/или стабилизаторы.
Фармацевтические композиции по настоящему изобретению, содержащие дегидратированный, например, высушенный распылительной сушкой терапевтически активный полипептид, растворенный в полуполярном протонном органическом растворителе, таком как полиол, также могут быть введены трансбуккально или сублингвально в форме аэрозолированного спрея пациентам, нуждающимся в таком лечении. Композиция Oral-lyn™, разработанная Generex Biotechnology Corporation, представляет собой пример трансбуккальной аэрозольной композиции, вводимой посредством дозирующего ингалятора под давлением (pMDI). В качестве пропеллентов обычно используют гидрофторалканы (HFA), такие как HFA 134а и 227. В одном из воплощений терапевтически активные полипептиды по данному изобретению обычно обладают высокой растворимостью в воде при величинах рН, более чем на 1 единицу ниже или выше pI. Поскольку вода очень плохо смешивается с HFA пропеллентами, предпочтительно использовать такой растворитель для белка, как пропиленгликоль и этанол. Указанный растворитель обладает способностью смешиваться с HFA пропеллентами. Тип дозирующих ингаляторов для растворов, как правило, предпочтительнее, чем тип pMDI для суспензий, который проявляет тенденцию к большему разбросу в однородности дозы вследствие расслаивания суспензии или осаждения частиц.
В растворах для такого типа pMDI могут быть использованы стабилизаторы и другие добавки, такие как усилители проницаемости, в дополнение к терапевтически активному полипептиду.
Помимо использования системы под давлением терапевтически активный полипептид альтернативно может быть введен трансбуккально или сублингвально как поддающийся перекачиванию помпой, например, Coro Nitro Pump Spray® для сублингвального введения нитроглицерина.
Чтобы предотвратить осаждение в легком перорального распыляемого аэрозоля, следует предпочтительно иметь капли диаметром более 10 мкм.
В неинвазивной доставке белков/пептидов большой интерес приобретают мукоадгезионные системы доставки лекарственных средств. Они могут увеличивать время удержания (residence time) доставляемой системы на тканях слизистых. Сообщается о нескольких биоадгезионных системах доставки для усиления биодоступности белков и пептидов, например, после перорального введения.
В предпочтительном воплощении неводная биоадгезионная композиция, без добавок, содержит активный белок или пептид, по меньшей мере один биоадгезионный полимер и один или более чем один полуполярный протонный органический растворитель, такой как полиол(ы). Кроме того, такая композиция может, если необходимо, содержать традиционные адъюванты и добавки. Биоадгезионным полимером могут быть, например, блоксополимеры поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид) (такие как полоксамеры), поливинилпирролидон (такой как повидон или PVP), полиакриловая кислота, поликарбофил (такой как карбопол или карбомер), хитозан, любые виды содержащих тиоловые группы полимеров (такие как тиомеры), целлюлоза, альгинаты, гидроксиэтилцеллюлоза или другие биоадгезионные полимеры.
Композиция может представлять собой лекарственную форму в жидкой, полутвердой или твердой форме.
Эти новые композиции будут иметь преимущество по сравнению, например, с традиционными биоадгезионными гидрогелями, поскольку можно обойтись без использования водной среды, необходимой в этих (последних) композициях, и поскольку будет достигнуто увеличение их стабильности при хранении, а также увеличение их биодоступности (благодаря полиолу).
Пример биоадгезионной композиции:
a) дегидратированный терапевтически активный полипептид (например, инсулин);
b) по меньшей мере один полуполярный протонный органический растворитель, такой как полиол (например, пропиленгликоль и/или глицерин);
c) биоадгезионный полимер (например, повидон и/или полоксамер);
d) добавки.
В одном воплощении неводная композиция содержит комбинацию дегидратированного терапевтически активного полипептида, по меньшей мере один полуполярный протонный органический растворитель, такой как полиол, и один или более чем один традиционный усилитель проницаемости. Примерами усилителей проницаемости являются, но этим не ограничиваются, жирные кислоты, пальмитоил-карнитина хлорид, этиленгликоль-бис(бета-аминоэтиловый эфир)-N,N,N′,N′-тетрауксусная кислота (EGTA), EDTA, соли желчных кислот, ионные, а также неионные поверхностно-активные вещества, такие как фосфолипиды и алкилгликозиды, полимеры, хитозан, лимонная кислота и салицилат натрия. В дополнение к этому композиция может содержать, как целесообразно, традиционные адъюванты и добавки.
Композиции по настоящему изобретению могут быть введены в форме, выбранной, например, из таблетки, капсулы, суппозитория, жидкости, спрея или аэрозоля для трансбуккального и перорального введения.
В предпочтительном воплощении твердые лекарственные формы на основе полуполярного протонного органического растворителя(ей), такого как полиолы, содержат по меньшей мере один полиол и один или более чем один твердый при комнатной температуре эксципиент, например, полоксамер, ПЭГ или стеарат ПЭГ.
В другом воплощении композиция содержит дегидратированный терапевтически активный полипептид, по меньшей мере один полуполярный протонный органический растворитель, например, по меньшей мере один полиол, и по меньшей мере один твердый при комнатной температуре неионный эксципиент, например, полоксамеры или полиоксиэтиленгликоли, или смесь твердых эксципиентов. Примерами твердых полоксамеров являются плюроник F-127, плюроник F-68. Примерами твердых ПЭГ являются ПЭГ 3350, ПЭГ 4000, ПЭГ 8000. К тому же, композиция в твердой форме может содержать, как целесообразно, традиционные адъюванты и добавки, такие как связующие вещества, глиданты и смазывающие вещества, для обеспечения эффективного таблетирования; и разрыхлители для обеспечения распадаемости таблетки в пищевом тракте.
Таблетки и капсулы могут иметь энтеросолюбильное покрытие, которое разрушается или становится проницаемым при контактировании с водным окружением определенного рН, что делает возможным избирательное высвобождение составляющих лекарственной формы в желаемом месте желудочно-кишечного тракта (например, в тонком и толстом кишечнике) благодаря выбору полимера, растворимого при рН, подходящем для конкретной области. Примеры подходящих энтеросолюбильных полимеров включают, но этим не ограничиваются, целлюлозы ацетат-фталат, гидроксипропилметилцеллюлозы фталат, поливинилацетат-фталат, гидроксипропилметилцеллюлозы фталат, сополимер метакриловой кислоты, щеллак, метилцеллюлозы фталат, целлюлозы ацетат-тримеллитат, гидроксипропилметилцеллюлозы ацетат-сукцинат, целлюлозы ацетат-фталат, целлюлозы ацетат-сукцинат, целлюлозы ацетат-малат, целлюлозы бензоат-фталат, целлюлозы пропионат-фталат, карбоксиметилэтилцеллюлоза, этилгидроксиэтилцеллюлозы фталат, щеллак, сополимер стирола и акриловой кислоты, сополимер метилакрилата и акриловой кислоты, сополимер метилакрилата и метакриловой кислоты, сополимер бутилакрилата и стирол-акриловой кислоты, сополимер метакриловой кислоты и метилметакрилата, сополимер метакриловой кислоты и этилакрилата, сополимер метилакрилат-метакриловой кислоты и октилакрилата, сополимер винил-ацетата и ангидрида малеиновой кислоты, сополимер стирола и ангидрида малеиновой кислоты, сополимер стирола и сложного моноэфира малеиновой кислоты, сополимер простого винил-метилового эфира и ангидрида малеиновой кислоты, сополимер этилена и ангидрида малеиновой кислоты, сополимер простого винилбутилового эфира и ангидрида малеиновой кислоты, сополимер акрилонитрил-метилакрилата и ангидрида малеиновой кислоты, сополимер бутил-акрилат-стирола и ангидрида малеиновой кислоты, фталат поливинилового спирта, поливинил-ацеталь фталат, поливинил-бутилат фталат и поливинил-ацетоацеталь фталат или их комбинации.
В предпочтительном воплощении лекарственная форма представляет собой мягкую желатиновую капсулу, содержащую жидкость.
Кроме того, данное изобретение относится к следующим далее воплощениям.
1. Фармацевтическая неводная композиция, содержащая смесь
a) дегидратированного терапевтически активного полипептида, предпочтительно содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от pI полипептида в водном растворе и где указанное заданное значение рН предпочтительно находится в диапазоне от примерно 6,0 до примерно 9,0.
2. Фармацевтическая неводная композиция, содержащая смесь
а) дегидратированного терапевтически активного полипептида, предпочтительно содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от pI полипептида в водном растворе и где указанное заданное значение рН предпочтительно находится в диапазоне от примерно 6,0 до примерно 9,0,
при условии, что полипептид не является инсулинотропным пептидом, GLP-1(7-37) или его аналогом либо производным, или эксендином или его аналогом либо производным.
3. Фармацевтическая композиция, соответствующая воплощению 1 или 2, где органический растворитель выбран из группы, состоящей из полиолов.
4. Фармацевтическая композиция, соответствующая воплощению 3, где органический растворитель выбран из группы, состоящей из диолов и триолов.
5. Фармацевтическая композиция, соответствующая воплощению 4, где органический растворитель выбран из группы, состоящей из пропиленгликоля и глицерина.
6. Фармацевтическая композиция, соответствующая воплощению 5, где органическим растворителем является пропиленгликоль.
7. Фармацевтическая композиция, соответствующая воплощению 5, где органическим растворителем является глицерин.
8. Фармацевтическая композиция, соответствующая любому из воплощений 1-7, где полипептид сушат распылительной сушкой.
9. Фармацевтическая композиция, соответствующая любому из воплощений 1-7, где полипептид сушат сублимационной сушкой.
10. Фармацевтическая композиция, соответствующая любому из воплощений 1-9, где полипептид дегидратирован при рН, отличающемся по меньшей мере на 1,5 единицы рН от pI полипептида.
11. Фармацевтическая композиция, соответствующая любому из воплощений 1-10, где полипептид дегидратирован при рН, отличающемся по меньшей мере на 2 единицы рН от pI полипептида.
12. Фармацевтическая композиция, соответствующая любому из воплощений 1-11, где полипептид дегидратирован при рН, лежащем по меньшей мере на 2,5 единицы рН выше pI полипептида.
13. Фармацевтическая композиция, соответствующая любому из воплощений 1-12, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 20 мг/мл.
14. Фармацевтическая композиция, соответствующая любому из воплощений 1-12, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 30 мг/мл.
15. Фармацевтическая композиция, соответствующая любому из воплощений 1-12, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 40 мг/мл.
16. Фармацевтическая композиция, соответствующая любому из воплощений 1-12, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 50 мг/мл.
17. Фармацевтическая композиция, соответствующая любому из воплощений 1-12, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 60 мг/мл.
18. Фармацевтическая композиция, соответствующая любому из воплощений 1-17, где заданное значение рН находится в диапазоне от примерно 6,5 до примерно 8,5.
19. Фармацевтическая композиция, соответствующая любому из воплощений 1-17, где заданное значение рН находится в диапазоне от примерно 7,2 до примерно 8,3.
20. Фармацевтическая композиция, соответствующая любому из воплощений 1-17, где заданное значение рН находится в диапазоне от примерно 7,0 до примерно 8,5.
21. Фармацевтическая композиция, соответствующая любому из воплощений 1-20, где органический растворитель присутствует в количестве по меньшей мере 20% мас./мас.
22. Фармацевтическая композиция, соответствующая любому из воплощений 1-20, где органический растворитель присутствует в количестве по меньшей мере 30% мас./мас.
23. Фармацевтическая композиция, соответствующая любому из воплощений 1-20, где органический растворитель присутствует в количестве по меньшей мере 40% мас./мас.
24. Фармацевтическая композиция, соответствующая любому из воплощений 1-20, где органический растворитель присутствует в количестве по меньшей мере 50% мас./мас.
25. Фармацевтическая композиция, соответствующая любому из воплощений 1-20, где органический растворитель присутствует в количестве по меньшей мере 80% мас./мас.
26. Фармацевтическая композиция, соответствующая любому из воплощений 1-25, содержащая менее 10% (мас./мас.) воды.
27. Фармацевтическая композиция, соответствующая любому из воплощений 1-25, содержащая менее 5% (мас./мас.) воды.
28. Фармацевтическая композиция, соответствующая любому из воплощений 1-25, содержащая менее 2% (мас./мас.) воды.
29. Фармацевтическая композиция, соответствующая любому из воплощений 1-28, где композиция предложена для лечения диабета или гипергликемии посредством легочного, парентерального, назального или перорального введения.
30. Фармацевтическая композиция, соответствующая любому из воплощений 1-28, где композиция предложена для лечения диабета или гипергликемии посредством легочного введения.
31. Фармацевтическая композиция, соответствующая любому из воплощений 1-28, где предложена для лечения диабета или гипергликемии посредством перорального введения.
32. Фармацевтическая композиция, соответствующая любому из воплощений 1-31, где полипептид является растворимым в воде полипептидом.
33. Фармацевтическая композиция, соответствующая любому из воплощений 1-32, где полипептид выбран из группы, состоящей из инсулиновых пептидов, амилина, аналогов амилина, производных амилина, α-MSH, аналогов α-MSH, производных α-MSH и/или любой их комбинации.
34. Фармацевтическая композиция по любому из п.п.1-33, где инсулиновый пептид представляет собой аналог инсулина.
35. Фармацевтическая композиция, соответствующая любому из воплощений 1-34, где инсулиновый пептид представляет собой аналог инсулина, выбранный из группы, состоящей из человеческого AspB28 инсулина; человеческого LysB28ProB29 инсулина; человеческого LysB3GluB29 инсулина и человеческого А14GuВ25НisдезВ30 инсулина.
36. Фармацевтическая композиция, соответствующая любому из воплощений 1-35, где композиция адаптирована для лечения посредством легочного введения, перорального введения, назального введения или трансбуккального введения.
37. Фармацевтическая композиция, соответствующая любому из воплощений 1-35, где композиция адаптирована для легочного применения.
38. Фармацевтическая композиция, соответствующая любому из воплощений 1-35, где композиция адаптирована для назального применения.
39. Фармацевтическая композиция, соответствующая любому из воплощений 1-35, где композиция адаптирована для перорального применения.
40. Фармацевтическая композиция, соответствующая любому из воплощений 1-35, где композиция адаптирована для трансбуккального применения.
41. Способ лечения диабета у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции, соответствующей любому из воплощений 1-40.
42. Способ лечения или предупреждения гипергликемии, диабета 2 типа, сниженной толерантности к глюкозе и диабета 1 типа у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции, соответствующей любому из воплощений 1-40.
43. Способ замедления или предупреждения прогрессирования заболевания при диабете 2 типа у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции, соответствующей любому из воплощений 1-40.
44. Фармацевтическая композиция, соответствующая любому из воплощений 1-40, для применения в качестве лекарственного средства для лечения или предупреждения гипергликемии, диабета 2 типа, сниженной толерантности к глюкозе и диабета 1 типа.
45. Фармацевтическая композиция, соответствующая любому из воплощений 1-40, для применения в качестве лекарственного средства для замедления или предупреждения прогрессирования заболевания при диабете 2 типа.
Все ссылки, включая публикации, заявки на патент и патенты, приведенные в данном описании, включены тем самым посредством ссылки во всей своей полноте и в том же объеме, как если бы каждая ссылка была отдельно и конкретно указана как включенная посредством ссылки и представленная во всей своей полноте в данном описании (в максимальном объеме, предусмотренном законодательством).
Все заголовки и подзаголовки использованы в данном описании только для удобства, и их никоим образом не следует истолковывать как ограничивающие данное изобретение.
Применение любого и всех примеров или типичных формулировок (например, "такой как"), приведенных в данном описании, предназначено главным образом для лучшего освещения изобретения и не представляет собой ограничение объема изобретения, если не заявлено иное. Никакие формулировки в данном описании не следует истолковывать как указывающие на какой-либо не заявленный элемент изобретения, который является существенным для применения данного изобретения.
Упоминание и включение патентных документов в данное описание делается только для удобства и не отражает какую-либо оценку действительности, патентоспособности и/или правомерности таких патентных документов.
Это изобретение включает все модификации и эквиваленты предмета изобретения, перечисленные в формуле изобретения, прилагаемой к нему, как предусмотрено законодательством.
ПРИМЕРЫ
Общая методика
Анализ образования фибрилл с использованием тиофлавина Т (ТhТ): принцип и примеры
Низкая физическая стабильность пептида может приводить к образованию амилоидных фибрилл, которые можно наблюдать в виде хорошо упорядоченных, нитеподобных макромолекулярных структур в образце, со временем приводящих к образованию геля. Это традиционно может быть оценено путем визуальной проверки образца. Однако этот вид измерения является очень субъективным и зависящим от наблюдателя. Поэтому гораздо более предпочтительно применение низкомолекулярного индикаторного зонда. Таким зондом является тиофлавин Т (ТhТ), который характеризуется отчетливой картиной флуоресценции в связанном с фибриллами состоянии (Naiki et al. (1989) Anal. Biochem. 177, 244-249; LeVine (1999) Methods. Enzymol. 309, 274-284).
Динамический (ускоренный) ТhТ-анализ
Временной ход процесса формирования фибрилл может быть описан сигмоидальной кривой, задаваемой следующим выражением (Nielsen et al. (2001) Biochemistry 40, 6036-6046), cn.f Фиг.6:
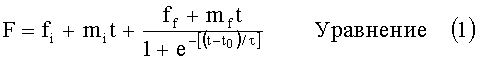
Здесь F представляет собой флуоресценцию ТhТ в момент времени t. Постоянная t0 представляет собой промежуток времени, необходимый для достижения 50% максимальной флуоресценции. Двумя важными параметрами, описывающими процесс формирования фибрилл, являются лаг-период (lag-time), рассчитываемый как t0-2τ, и кажущаяся константа скорости kарр=1/τ (см. Фиг.11).
Предполагается, что образование частично свернутого промежуточного пептидного соединения является общим механизмом, инициирующим формирование фибрилл. Некоторые из этих промежуточных соединений служат центрами формирования матрицы, на которой может происходить дальнейшая сборка промежуточных соединений и формирование фибрилл. Лаг-период соответствует интервалу времени, в течение которого накапливается критическая масса центров, а кажущаяся константа скорости представляет собой скорость, с которой формируются сами фибриллы.
Подготовка образца
Перед проведением каждого анализа готовили свежие образцы. Тиофлавин Т добавляли к образцам из концентрированного раствора в Н2О до конечной концентрации 1 мкМ. Аликвоты образца по 200 мкл помещали в 96-луночный микротитрационный планшет (Packard OptiPlate™-96, белый полистирол). Обычно в каждую колонку лунок помещали по восемь копий каждого образца (соответствующего одному тестируемому условию). Планшет герметично закрывали, используя Scotch Pad (Qiagen).
Инкубация и измерение флуоресценции
Инкубацию при заданной температуре, встряхивание и измерение эмиссии флуоресценции ТhТ проводили на планшетном флуоресцентном ридере Fluoroskan Ascent FL (Thermo Labsystems). Температуру устанавливали при 37°С. Для всех представленных данных параметр кругового встряхивания (orbital shaking) устанавливали на отметке 960 об/мин с амплитудой 1 мм. Измерение флуоресценции проводили, используя фильтр 444 нм для возбуждения, а для измерения эмиссии использовали фильтр 485 нм.
Каждое измерение инициировали инкубацией планшета при заданной температуре анализа в течение 10 мин. Измерения на планшете проводили каждые 20 минут, обычно в течение 45 часов. В каждом промежутке между измерениями планшет встряхивали и нагревали, как описано.
Статический ThT-анализ
Подготовка образца и измерение флуоресценции
Образцы, содержащие инсулин аспарт в неводном пропиленгликоле, хранили при 5 и 40°С в течение до 1 месяца включительно. Перед измерением образцы разбавляли деионизованной водой до предполагаемой концентрации (включая сформировавший фибриллы белок и нативный белок) 1 мг/мл. Измерение флуоресценции проводили в кварцевых полумикрокюветах (Hellma, Germany) с длиной пути 0,3 см для возбуждающего излучения люминесцентного спектрометра модели Perkin-Elmer LS 50 В. Спектры эмиссии от 470 до 560 нм с возбуждением при 450 нм и шириной щели 5 нм регистрировали незамедлительно после добавления 4 мкл 1 мМ концентрированного раствора ТhТ к 196 мкл разбавленного раствора образца. Концентрация ТhТ в реакционной смеси составляла 20 мкмоль/л. Результаты представляли в виде соотношения I482 нм/[концентрация белка (мг/мл) × длина светового пути для кюветы (см)], т.е. результаты нормировали на концентрацию белка 1 мг/мл и длину светового пути для кюветы 1 см.
ПРИМЕР 1
А) Растворение человеческого инсулина и подведение заданного значения рН до 7,0
9,5 г человеческого инсулина диспергировали в 200 г охлажденной во льду воды. Суспензию помещали в ледяную баню, и начальное измеренное значение рН составляло 5,12. рН подводили до 7,04, используя 5,8 г охлажденного во льду 0,2 н. гидроксида натрия. Раствор оставляли в ледяной бане на следующие 2 часа и затем добавляли деминерализованную воду до общего веса 240 г.
Проводили дальнейшую обработку 50 г раствора с рН 7,04. рН подводили от 7,04 до 7,50 охлажденным во льду 1 н. NH4OH и затем помещали в холодильник на ночь. На следующий день измеренное значение рН составило 7,32, и рН подводили охлажденным во льду 1 н. NH4OH до рН 8,06. Затем добавляли воду до 60,0 г. Конечная концентрация человеческого инсулина составляла приблизительно 30 мг/мл.
B) Сушка водного раствора инсулина
Сухие твердые микрочастицы получали, используя распылительную минисушилку Büchi B-290 (Büchi, Labortechnik AG Flawil, Switzerland), оборудованную 0,7 мм двухжидкостным соплом с параллельным потоком (co-current two-fluid nozzle). Раствор человеческого инсулина распыляли в струе горячего воздуха в сушильной камере со скоростью подачи жидкости 2 мл/мин и распыляемым воздушным потоком 600-800 литров/час.
Температура высушивающего воздуха на входе составляла 150°С, а скорость потока высушивающего воздуха составляла 35 м3/час. Температура на выходе составляла приблизительно 70°С.
Твердые микрочастицы улавливали центробежным сепаратором (cyclone), соединенным с сушильной камерой, и далее собирали и хранили в сухих условиях.
C) Проверка заданного значения рН твердого порошка инсулина
Высушенный распылительной сушкой человеческий инсулин повторно растворяли в деминерализованной воде в концентрации 40 мг/мл, 80 мг/мл и 160 мг/мл для изучения того, как различные концентрации влияют на измеряемую величину рН:
к 25,3 мг добавляли 633 мкл воды: измеренное значение рН составило 6,95;
к 43,5 мг добавляли 545 мкл воды: измеренное значение рН составило 6,95;
к 81,7 мг добавляли 510 мкл воды: измеренное значение рН составило 7,01.
ПРИМЕР 2
Солюбилизация инсулина аспарта с заданным значением рН, лежащим в диапазоне от рН 5,4 до рН 7,4, в 1,2-пропандиоле (пропиленгликоле)
Перед распылительной сушкой готовили различные растворы инсулина аспарта с разными заданными значениями рН.
Раствор А, заданное значение рН 5,35:
16 г инсулина аспарта суспендировали в 150 мл воды в ледяной бане. Далее постепенно добавляли 2,6 мл охлажденного во льду концентрированного водного аммиака (25% мас./мас.) до тех пор, пока значение рН не становилось равным 7,53, и получали прозрачный раствор. Окончательно добавляли воду до конечной концентрации инсулина аспарта 40 мг/мл.
Раствор В, заданное значение рН 6,04:
16 г инсулина аспарта суспендировали в 150 мл воды в ледяной бане. Постепенно добавляли сначала 2,2 мл охлажденного во льду 1 н. NaOH и затем 750 мкл охлажденного во льду концентрированного водного аммиака (25% мас./мас.) до тех пор, пока значение рН не становилось равным 7,52, и получали прозрачный раствор. Окончательно добавляли воду до конечной концентрации инсулина аспарта 40 мг/мл.
Раствор С, заданное значение рН 6,27:
16 г инсулина аспарта суспендировали в 150 мл воды в ледяной бане. Постепенно добавляли сначала 4,4 мл охлажденного во льду 1 н. NaOH и затем 750 мкл охлажденного во льду концентрированного водного аммиака (25% мас./мас.) до тех пор, пока значение рН не становилось равным 7,48, и получали прозрачный раствор. Окончательно добавляли воду до конечной концентрации инсулина аспарта 40 мг/мл.
Раствор D, заданное значение рН 6,66:
16 г инсулина аспарта суспендировали в 150 мл воды в ледяной бане. Постепенно добавляли сначала 6,6 мл охлажденного во льду 1 н. NaOH и затем 370 мкл охлажденного во льду концентрированного водного аммиака (25% мас./мас.) до тех пор, пока значение рН не становилось равным 7,47, и получали прозрачный раствор. Окончательно добавляли воду до конечной концентрации инсулина аспарта 40 мг/мл.
Раствор Е, заданное значение рН 7,47:
16 г инсулина аспарта суспендировали в 150 мл воды в ледяной бане. Постепенно добавляли 9,6 мл охлажденного во льду 1 н. NaOH до тех пор, пока значение рН не становилось равным 7,49 и получали прозрачный раствор.
Сухие порошки получали, используя распылительную минисушилку Büchi В-290 (Büchi, Labortechnik AG Flawil, Switzerland), оборудованную 0,7 мм двухжидкостным соплом с параллельным потоком. Подаваемую жидкость (раствор А, В, С, D и Е) распыляли в струе горячего воздуха в сушильной камере со скоростью подачи жидкости 2 мл/мин и распыляемым воздушным потоком 600-800 литров/час.
Температура высушивающего воздуха на входе составляла 150°С, а скорость потока высушивающего воздуха составляла 35 м3/час. Температура на выходе варьировала от 41 до 61°С.
Сухие порошки улавливали центробежным сепаратором, соединенным с сушильной камерой, и далее собирали и хранили в сухих условиях.
Содержание влаги в сухих микрочастицах определяли по потере веса при сушке при 110°С в течение как минимум 3 часов, используя термогравиметрический анализатор PerkinElmer Pyris TGA1. Регистрировали изменение веса в результате потери влаги и выражали в процентном отношении к весу.
Заданное значение рН высушенного распылительной сушкой инсулина измеряли, растворяя высушенные распылительной сушкой порошки в деминерализованной воде до концентрации приблизительно 40 мг/мл и измеряя рН с использованием потенциометра (Radiometer, Denmark).
Растворимость различных порошков инсулина аспарта измеряли, добавляя твердый порошок во флакон с завинчивающейся крышкой (обычно 200 мг порошка), затем 2 г 1,2-пропандиола (пропиленгликоля). Порошок и 1,2-пропандиол (пропиленгликоль) встряхивали на миксере Swelab 820 при 15 об/мин (Boule Medical AB) при температуре окружающей среды в течение по меньшей мере 48 часов. Если 1,2-пропандиол становился прозрачным, во флакон добавляли еще порошка. Затем нерастворившийся инсулин аспарт отделяли от солюбилизированного инсулина аспарта центрифугированием при 4000 об/мин в течение 0,5 часа. Концентрацию инсулина аспарта в супернатанте измеряли с использованием HPLC. Результаты HPLC-анализа показаны на Фиг.1.
ПРИМЕР 3
Солюбилизация инсулина аспарта с заданным значением рН 7.5 в различных органических полуполярных протонных растворителях
Растворимость порошка инсулина аспарта с заданным значением рН 7,5 в различных органических полуполярных протонных растворителях (этандиоле (этиленгликоле), 1,4-бутандиоле, 1,3-бутандиоле, 1,3-пропандиоле, пропантриоле (глицерине), 1,2-пропандиоле (пропиленгликоле)) измеряли, как описано в Примере 2.
Результаты исследования растворимости показаны на Фиг.2.
ПРИМЕР 4
Оценка in vitro композиции инсулина аспарта и 10% пропиленгликоля в модели мешочка из кишечника крысы
Свежеиссеченный тонкий кишечник крысы промывали в охлажденном во льду физиологическом растворе. Затем из кишечника готовили мешочки каждый длиной 4 см. Кратко, один конец куска кишки длиной 4 см перевязывали нитью, затем 0,25 мл содержащего инсулин тестируемого раствора (1 мМ) помещали в кишку и затем другой конец перевязывали точно таким же образом. После этого заполненные мешочки из кишечника инкубировали в течение 2 ч в 0,5 мл культуральной среды, рН 7,4, при 37°С. Через 2 ч инкубационную среду анализировали, используя HPLC и MALDI, на предмет проницаемости для инсулина. Результаты HPLC-анализов показаны на Фиг.3. Наивысшая проницаемость инсулина через слизистую оболочку кишечника наблюдается в присутствии 10% PG.
MALDI-MS (масс-спектрометрия с ионизацией посредством лазерной десорбции из матрицы) использовали для анализа продуктов расщепления. Аликвоты (1 мкл) подкисленных растворов образцов и образцов сравнения помещали на пластину РАС384 MALDI, через 30 с промокали фильтровальной бумагой и дважды промывали 5 мкл 15 мМ фосфата аммония в 0,1%-ной TFA (трифторуксусная кислота). Образцы анализировали, используя Autoflex TofTof (Bruker Daltonics, USA). Результаты показаны на Фиг.4. Очевидно, что PG уменьшает расщепление инсулина в желудочно-кишечном тракте.
ПРИМЕР 5
Оценка in vivo композиции инсулина аспарта и пропиленгликоля на крысах после перорального введения
Использовали крыс Sprague-Dawley. Крыс не кормили перед экспериментом, но им предоставляли свободный доступ к питьевой воде. Крыс разбивали на 4 когорты. В 2-х когортах крыс кормили через желудочный зонд, используя человеческий А14GluВ25НisдезВ30 инсулин (8 мМ) (1,2 мл/кг), растворенный либо в воде, либо в 1,2-пропандиоле (пропиленгликоле). Две другие когорты получали чистую воду или 1,2-пропандиол (пропиленгликоль) (1,2 мл/кг) в качестве контроля соответственно. С интервалами в 20 минут в течение периода времени 240 минут отбирали образцы крови из хвостовой вены и анализировали уровень глюкозы. Результаты выражали в виде Δ (изменения) уровня глюкозы в крови (ммоль/л). Результаты показаны на Фиг.5.
ПРИМЕР 6
Спектроскопия кругового дихроизма инсулина аспарта в пропиленгликоле (PG)
Анализ кругового дихроизма в дальней и ближней УФ-областях использовали для мониторинга конформационной стабильности. Спектры кругового дихроизма в дальней и ближней УФ-областях получали на спектрофотометре кругового дихроизма Jasco J-715 (Jasco, Tokyo, Japan). Образцы инсулина сканировали в кювете 0,5 или 0,02 см, используя ширину полосы (bandwidth) 2,0 нм, время отклика 2 с, шаг сканирования (data pitch) 0,5 нм и скорость сканирования 20 нм/мин. Спектры буфера регистрировали и вычитали из спектра каждого образца.
Регистрируя спектры в дальней УФ-области, зондируют пептидный амидный хромофор, и они могут быть использованы для оценки вторичной структуры белка, причем отрицательные полосы спектра при 209 нм и 222 нм указывают на наличие α-спиральной структуры. Небольшое изменение интенсивности наблюдается в спектре Аспарта (Фиг.6) в 100%-ном PG по сравнению со спектром в 100%-ной воде, что наводит на мысль о большем содержании α-спиральной структуры в инсулине в 100%-ном PG. Однако это различие не кажется существенным при сравнении различных препаратов Аспарта в PG. Спектры Аспарта в воде и спектры Аспарта, разведенного до 2% PG из образца с 100% PG, очень похожи, демонстрируя, что возможные минорные изменения в содержании α-спирали являются обратимыми.
Спектр CD в области 250-350 нм является отражением локального окружения боковых цепей остатков тирозина в дополнение к локальному окружению дисульфидных связей. Спектр кругового дихроизма в дальней УФ-области (Фиг.7) инсулина аспарта в 100%-ном PG очень похож на спектр, наблюдаемый для инсулинов в денатурирующих растворителях, например в присутствии GuHCI (гуанидин гидрохлорид), с увеличенной амплитудой при 250 нм и 270 нм. Однако когда инсулин в 100%-ном PG разбавлен водой до 2% PG, спектр сохраняет форму, наблюдаемую для инсулина в чистой воде. Это указывает на то, что несмотря на влияние PG на окружение боковых цепей, эти структурные эффекты являются обратимыми.
Принимая во внимание данные CD как для FUV, так и NUV, можно считать, что вторичная структура пептидного остова является более или менее неизменной в 100%-ном PG. Значительные изменения в окружении боковых цепей в том же самом образце подтверждают, что инсулин приобретает структуру так называемой расплавленной глобулы, в которой сворачивание остова остается интактным, но структура боковых цепей теряет устойчивость. Однако данные структурные изменения являются обратимыми, когда Аспарт в PG разводят в воде.
ПРИМЕР 7
Стабильность инсулина аспарта при хранении в растворе пропиленгликоля по сравнению с водным раствором
Дегидратированный порошок инсулина аспарта (IA) с заданным значением рН 7,5 растворяли или в чистом пропиленгликоле, или в водном 0,1 М трисбуфере, рН 7,5. Концентрация инсулина в растворах составляла приблизительно 35 мг/мл. Растворы инкубировали при температуре окружающей среды и 40°С в течение до 40 недель включительно. Содержание растворимых связанных ковалентной связью ди- и полимерных продуктов анализировали стерической эксклюзионной хроматографией (SEC). Образцы подвергали SEC при комнатной температуре, используя колонку Waters (7,8×300 мм) для HMWP инсулина (Waters Corporation, Milford, MA, USA) при скорости потока 1 мл/мин с элюентом, содержащим 15 объемов ледяной уксусной кислоты, 15 объемов ацетонитрила и 70 объемов раствора L-аргинина (0,65 г/л). Детекцию выполняли при 276 нм. Содержание продуктов деамидирования и других родственных инсулину веществ анализировали обращено-фазовой высокоэффективной жидкостной хроматографией (RP-HPLC). Количество фибрилл в образцах измеряли посредством статического ТhТ-анализа.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛИЗИРОВАННЫЕ ПО ОТНОШЕНИЮ К ПРОТЕАЗАМ АЦИЛИРОВАННЫЕ АНАЛОГИ ИНСУЛИНА | 2009 |
|
RU2571857C2 |
| ХРОМАТОГРАФИЧЕСКИЕ СПОСОБЫ И СОЕДИНЕНИЯ, ОЧИЩЕННЫЕ ЭТИМИ СПОСОБАМИ | 2010 |
|
RU2508294C2 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ ИНСУЛИН, НИКОТИНАМИД И АМИНОКИСЛОТУ | 2010 |
|
RU2533217C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИНСУЛИНА И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2015 |
|
RU2684456C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНСУЛИНОВЫХ СОЕДИНЕНИЙ | 2002 |
|
RU2376379C2 |
| Водная композиция инсулина аспарта и инъецируемый инсулиновый препарат | 2022 |
|
RU2832344C2 |
| АНАЛОГИ ИНСУЛИНА, УСТОЙЧИВЫЕ К ПРОТЕАЗАМ | 2007 |
|
RU2524150C2 |
| Аналоги инсулина | 2017 |
|
RU2769476C2 |
| Конъюгат физиологически активного вещества длительного действия и его применение | 2018 |
|
RU2773823C2 |
| ПРОИЗВОДНЫЕ ИНСУЛИНА, СОДЕРЖАЩИЕ ДОПОЛНИТЕЛЬНЫЕ ДИСУЛЬФИДНЫЕ СВЯЗИ | 2011 |
|
RU2598273C2 |
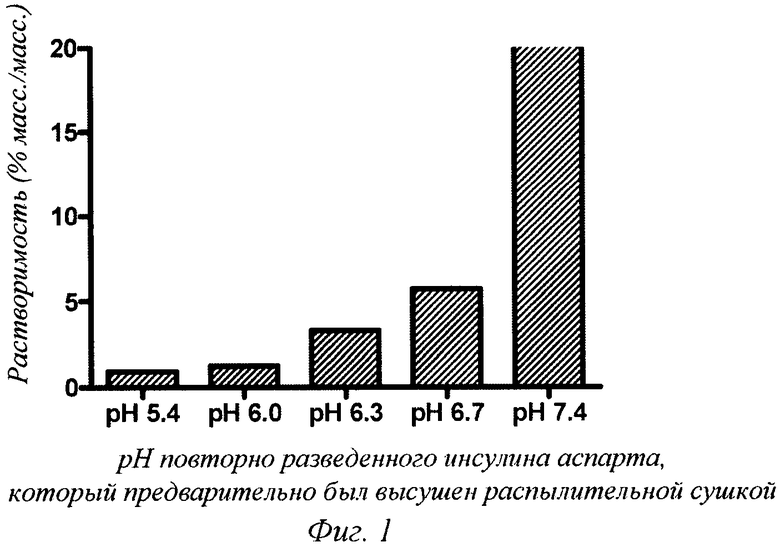
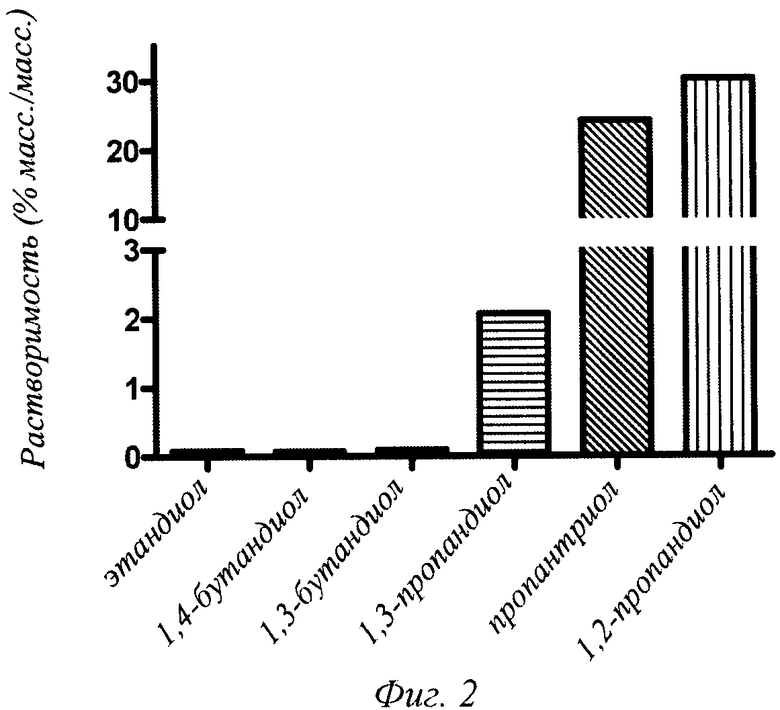
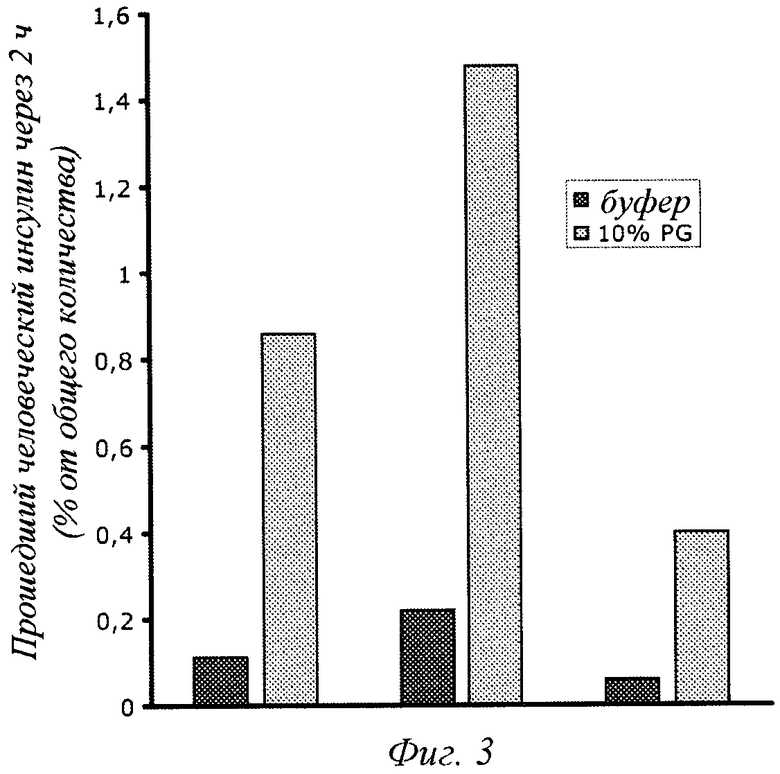
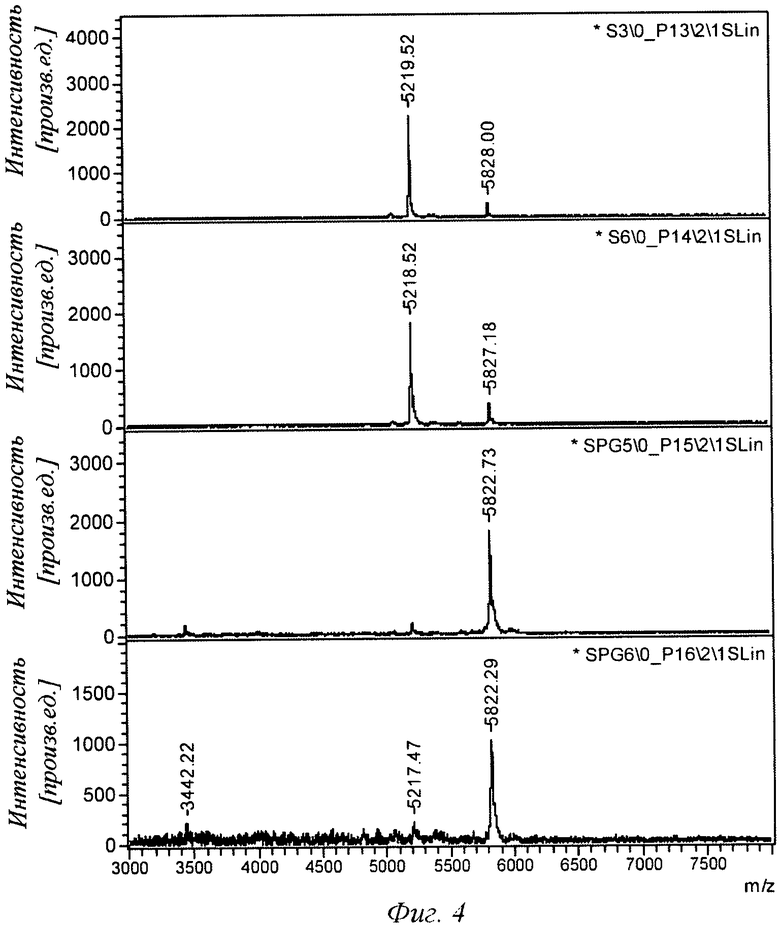
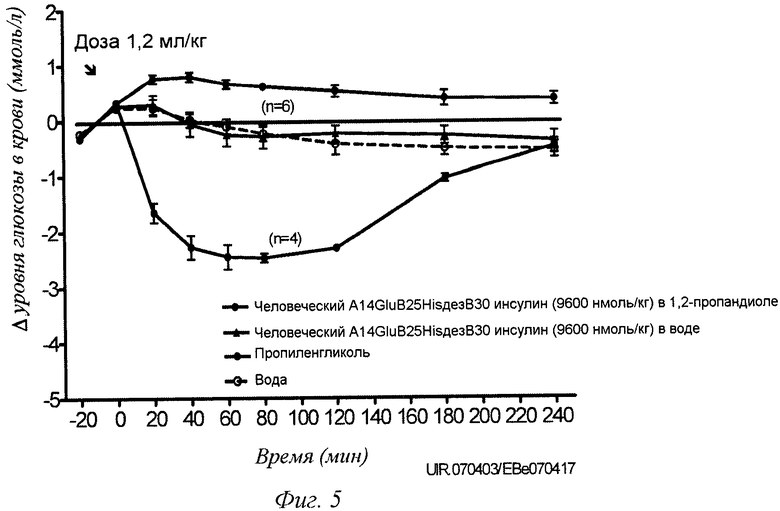
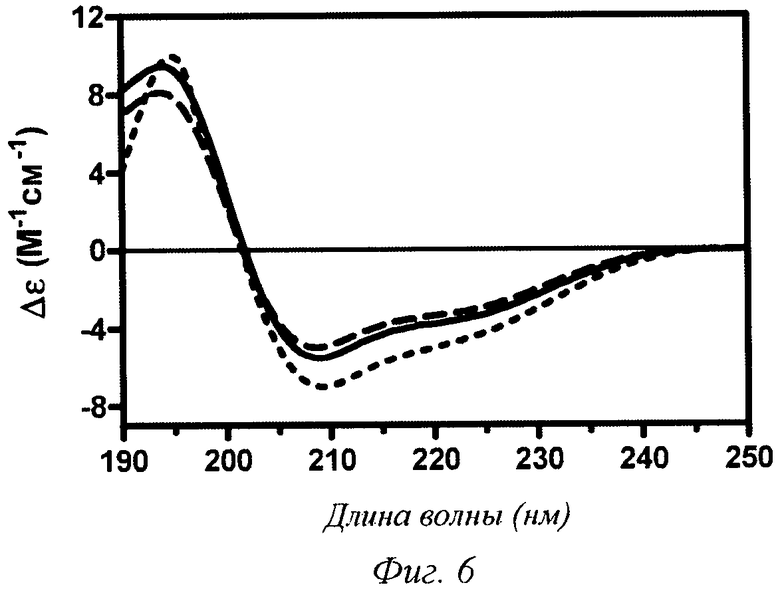
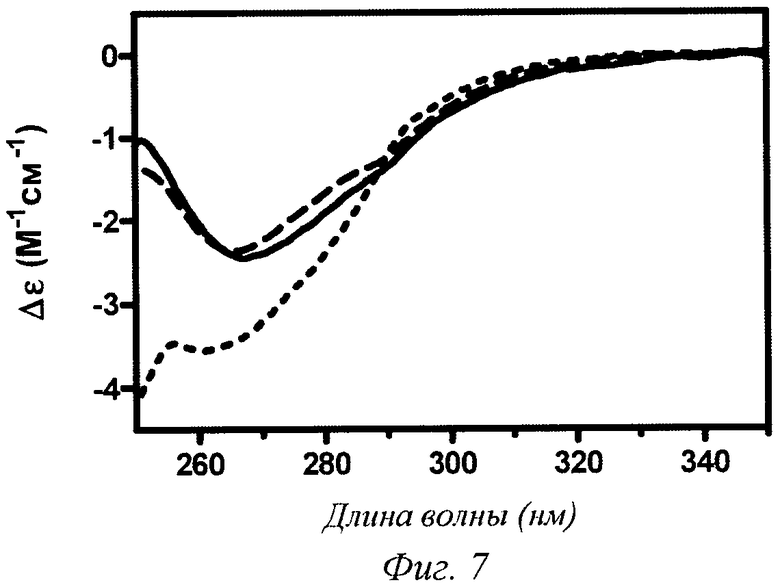
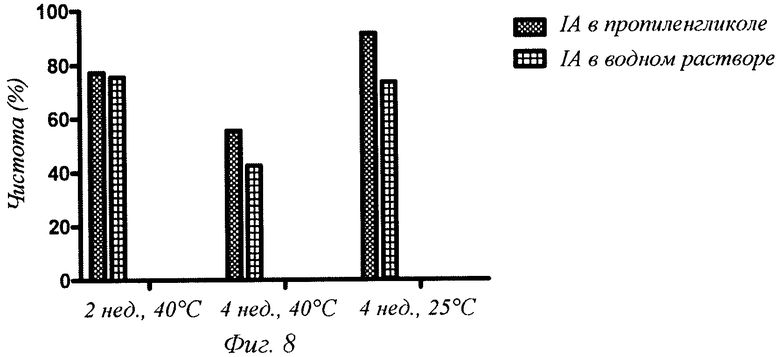
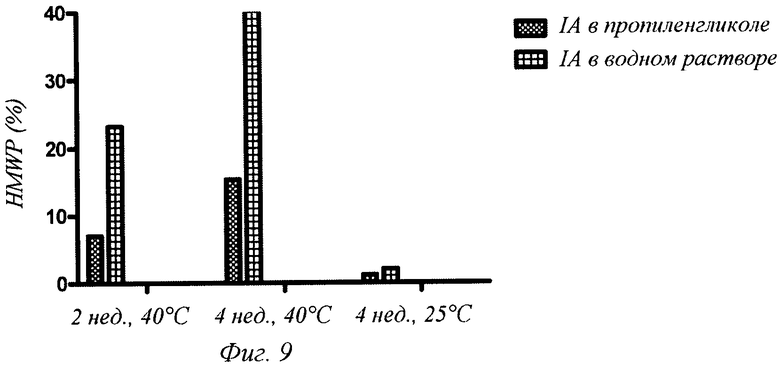
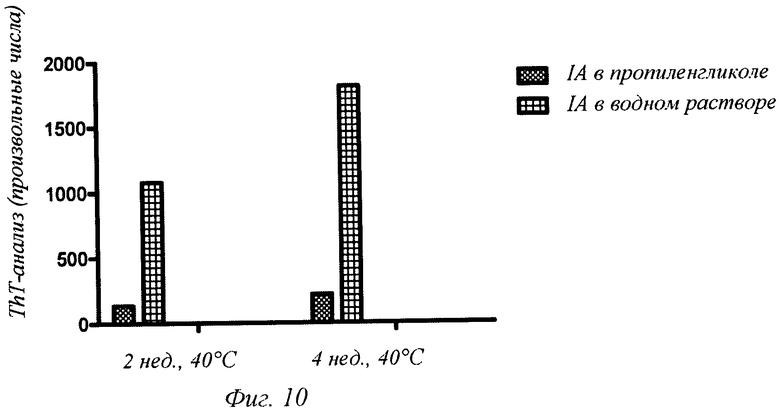
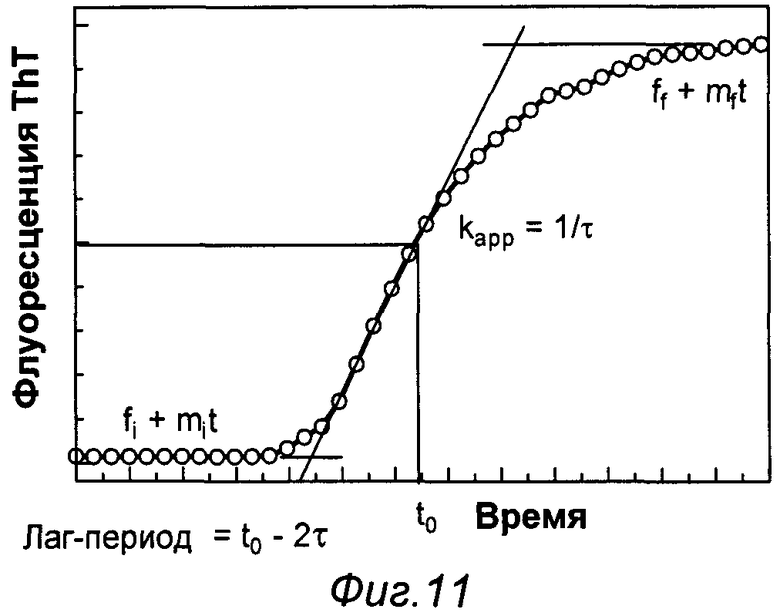
Группа изобретений относится к неводной фармацевтической композиции, содержащей дегидратированный активный полипептид, содержащий 10-100 аминокислот, и по меньшей мере один полуполярный протонный органический растворитель, причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от pI полипептида в водном растворе и к способу получения композиции. Группа изобретений обеспечивает улучшенную стабильность неводной композиции терапевтического пептида. 2 н. и 37 з.п. ф-лы, 7 пр., 11 ил., 1 табл.
1. Фармацевтическая неводная композиция, содержащая смесь
a) дегидратированного терапевтически активного полипептида, содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от pI полипептида в водном растворе.
2. Фармацевтическая композиция по п.1, содержащая смесь
а) дегитратированного терапевтически активного полипептида, предпочтительно содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя, причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от pI полипептида в водном растворе, а заданный рН предпочтительно находится в диапазоне от приблизительно 6,0 до приблизительно 9,0.
3. Фармацевтическая композиция по п.1, содержащая смесь
а) дегидратированного терапевтически активного полипептида, предпочтительно содержащего 10-100 аминокислот, и
b) по меньшей мере одного полуполярного протонного органического растворителя,
причем полипептид дегидратирован при заданном рН, отличающемся по меньшей мере на 1 единицу рН от рI полипептида в водном растворе, а заданный рН предпочтительно находится в диапазоне от приблизительно 6,0 до приблизительно 9,0,
при условии, что указанный полипептид отличается от инсулинотропного пептида, GLP-1 (7-37) или его аналога либо производного, или эксендина или его аналога либо производного.
4. Фармацевтическая композиция по п.1 где органический растворитель выбран из группы, состоящей из полиолов.
5. Фармацевтическая композиция по п.1, где органический растворитель выбран из группы, состоящей из диолов и триолов.
6. Фармацевтическая композиция по п.1, где органический растворитель выбран из группы, состоящей из пропиленгликоля и глицерина.
7. Фармацевтическая композиция по п.6, где органический растворитель представляет собой пропиленгликоль.
8. Фармацевтическая композиция по п.6, где органический растворитель представляет собой глицерин.
9. Фармацевтическая композиция по п.1, где полипептид дегидратирован распылительной сушкой.
10. Фармацевтическая композиция по п.1, где полипептид дегидратирован сублимационной сушкой.
11. Фармацевтическая композиция по п.1, где полипептид дегидратирован при рН, отличающемся по меньшей мере на 1,5 единицы рН от pI полипептида.
12. Фармацевтическая композиция по п.1, где полипептид дегидратирован при рН, отличающемся по меньшей мере на 2 единицы рН от pI полипептида
13. Фармацевтическая композиция по п.1, где полипептид дегидратирован при рН, отличающемся по меньшей мере на 2,5 единицы рН от рI полипептида
14. Фармацевтическая композиция по п.1, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 20 мг/мл.
15. Фармацевтическая композиция по п.1, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 30 мг/мл.
16. Фармацевтическая композиция по п.1, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 40 мг/мл.
17. Фармацевтическая композиция по п.1, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 50 мг/мл.
18. Фармацевтическая композиция по п.1, где растворимость дегидратированного полипептида в органическом растворителе составляет по меньшей мере 60 мг/мл.
19. Фармацевтическая композиция по п.1, где заданное значение рН находится в диапазоне от примерно 6,0 до примерно 9,0.
20. Фармацевтическая композиция по п.1, где заданное значение рН находится в диапазоне от примерно 6,5 до примерно 8,5.
21. Фармацевтическая композиция по п.1, где заданное значение рН находится в диапазоне от примерно 7,2 до примерно 8,3.
22. Фармацевтическая композиция по п.1, где заданное значение рН находится в диапазоне от примерно 7,0 до примерно 8,5.
23. Фармацевтическая композиция по п.1, где органический растворитель присутствует в количестве по меньшей мере 20% мас./мас.
24. Фармацевтическая композиция по п.1, где органический растворитель присутствует в количестве по меньшей мере 30% мас./мас.
25. Фармацевтическая композиция по п.1, где органический растворитель присутствует в количестве по меньшей мере 40% мас./мас.
26. Фармацевтическая композиция по п.1, где органический растворитель присутствует в количестве по меньшей мере 50% мас./мас.
27. Фармацевтическая композиция по п.1, где органический растворитель присутствует в количестве по меньшей мере 80% мас./мас.
28. Фармацевтическая композиция по п.1, содержащая менее 10% мас./мас. воды.
29. Фармацевтическая композиция по п.1, содержащая менее 5% мас./мас. воды.
30. Фармацевтическая композиция по п.1, содержащая менее 2% мас./мас. воды.
31. Фармацевтическая композиция по п.1, где композиция адаптирована для лечения посредством легочного введения, перорального введения, назального введения или трансбуккального введения.
32. Фармацевтическая композиция по п.1, где композиция адаптирована для лечения посредством перорального введения.
33. Фармацевтическая композиция по п.1, где полипептид является растворимым в воде полипептидом.
34. Фармацевтическая композиция по п.1, где полипептид выбран из группы, состоящей из инсулиновых пептидов, амилина, аналогов амилина, производных амилина, α-MSH (меланоцит-стимулирующий гормон), аналогов α-MSH, производных α-MSH и/или любой их комбинации.
35. Фармацевтическая композиция по п.1, где полипептид представляет собой аналог инсулина.
36. Фармацевтическая композиция по п.35, где инсулиновый пептид представляет собой аналог инсулина, выбранный из группы, состоящей из человеческого AspB28 инсулина, человеческого LysB28ProB29 инсулина, человеческого LysB3GluB29 инсулина и человеческого A14GluB25HisдезB30 инсулина.
37. Фармацевтическая композиция по любому из пп.1-36 для применения в качестве лекарства для лечения или предупреждения гипергликемии, диабета 2 типа, сниженной толерантности к глюкозе и диабета 1 типа.
38. Фармацевтическая композиция по любому из пп.1-36 для применения в качестве лекарств для замедления или предупреждения прогрессирования заболевания при диабете 2 типа.
39. Способ получения фармацевтической композиции, включающий следующие стадии:
а) получение водного раствора терапевтически активного полипептида, возможно содержащего эксципиенты,
b) подведение величины рН к заданному значению рН, которое на 1 единицу, предпочтительно на 2 единицы и более предпочтительно на 2,5 единицы рН выше или ниже pI полипептида.
с) удаление воды из(дегидратации)раствора полипептида с применением стандартных методик сушки, таких как сублимационная и распылительная сушка, и
d) смешивание и растворение полипептида в полуполярном протонном неводном растворителе, например, посредством перемешивания, переворачивания (tumbling) или других способов смешивания.
е) возможно фильтрование или центрифугирование неводного раствора полипептида для удаления нерастворившихся неорганических солей.
f) возможно удаление остаточных количеств воды посредством, например, добавления твердых поглотителей влаги или вакуумной сушки.
g) возможно добавление дополнительных эксципиентов, таких как гидрофторалкановые пропелленты и сорастворители, для использования в дозирующих ингаляторах под давлением для растворов или добавления детергентов, полимеров, липидов и сорастворителей для пероральных лекарственных форм.
| CHIN JT et al | |||
| On protein solubility in organic solvent | |||
| Biotechnol | |||
| Bioeng | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| WO2004105790 A1, 09.12.2004 | |||
| TEAGARDEN DL, BAKER DS | |||
| Practical aspects of lyophilization using non-aques co-solvent systems | |||
| Eur | |||
| J | |||
| Pharm | |||
| Sci, Mar., 15(2):115-33, 2002 | |||
| US 20020055496 A1, 09.05.2002 | |||
| WO 200704948 A2, 26.04.2007 | |||
| СПОСОБ ПРИГОТОВЛЕНИЯ ГОТОВОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ИНСУЛИНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 2002 |
|
RU2252782C2 |
Авторы
Даты
2013-01-20—Публикация
2008-05-30—Подача