Данное изобретение относится к новым производным человеческого инсулина, которые растворимы и имеют пролонгированный профиль действия, к новому способу получения таких производных, к фармацевтическим композициям, их содержащим, и к использованию таких производных инсулина при лечении диабета.
Многих пациентов, больных диабетом, лечат многократными ежедневными инъекциями инсулина по схеме, включающей одну или две ежедневные инъекции пролонгированного инсулина, которые покрывают базальную потребность, дополняемую инъекциями ударной дозы быстродействующего инсулина, который покрывает потребность, связанную с приемом пищи.
Композиции пролонгированного инсулина хорошо известны в данной области техники. Так, один основной тип пролонгированных инсулиновых композиций включает инъекцируемые водные суспензии кристаллического инсулина или аморфного инсулина. В этих композициях обычно используемыми соединениями инсулина являются протамин-инсулин, цинк-инсулин или протамин-цинк-инсулин.
Существуют определенные недостатки, связанные с использованием инсулиновых суспензий. Так, для того чтобы осуществить точное дозирование, инсулиновые частицы должны быть гомогенно суспендированы путем осторожного встряхивания, прежде чем определенный объем суспензии будет отбираться из пузырька или удаляться из картриджа. Кроме того, чтобы избежать образования вздутия или коагуляции, при хранении инсулиновых суспензий, температура должна поддерживаться в более узких пределах, чем для растворов инсулина.
Хотя ранее полагали, что протамины неиммуногенны, теперь оказалось, что протамины могут быть иммуногенными для человека, и что их использование для медицинских целей может привести к образованию антител (Samuel et al., Studies on the immunogenecity of protamines in humans and experimental animals by means of amicro-compliment fixation test, Clin. Exp. Immunol. 33. pp. 252-260 (1978)).
Кроме того, существует доказательство того, что протамининсулиновый комплекс сам по себе иммуногенен (Kurtz et al., circulating IgG antibody to protamine in patients treated with protamin-insulins. Diabetologia, 25, pp. 322-324 (1983)). Поэтому, некоторым пациентам следует избегать использования пролонгированных композиций инсулина.
Другим типом пролонгированных инсулиновых композиций являются растворы, имеющие значение pH ниже физиологического pH, при котором инсулин может осаждаться из-за повышения значения pH, когда раствор инъецируют. Недостаток этих растворов заключается в том, что распределение частиц по размеру осадка, образуемого в ткани при инъекции, и поэтому хронометраж медикамента зависит от притока крови к месту инъекции и других параметров в некоторой степени непредсказуемым способом.
WO 91/12817 (Novo Nordisk A.S.) раскрывает пролонгированные, растворимые инсулиновые композиции, включающие комплексы инсулина с кобальтом (III). Пролонгирование этих комплексов промежуточно и биодоступность понижена.
Человеческий инсулин имеет три первичные аминогруппы: N-концевая группа A-цепи и B-цепи и ε-аминогруппа LysB29. Известно несколько производных инсулина, в которых одна или несколько этих групп замещены. Так, пат. США N 3528960 (Eli Lilly) относится к N-карбоксиароил инсулинам, в которых одна, две или три первичные аминогруппы молекулы инсулина имеют карбоксиароильную группу. В частности, не раскрываются NεB29-замещенные инсулины.
Согласно пат. Великобритании N 1492997 (Nat. Res. Dev. Corp.) обнаружено, что инсулин с карбамильным замещением при NεB29 имеет улучшенный профиль гипогликемического действия.
В выложенной заявке на пат. Японии N 1-254699 (Kodama Co., Ltd) раскрывается инсулин, в котором жирная кислота связана с аминогруппой PheB1 или с ε-аминогруппой LysB29 или с обеими этими группами. Цель получения производных инсулина заключается в получении фармакологически приемлемого, стабильного препарата инсулина.
Инсулины, которые в B30 положении имеют аминогруппу, имеющую по крайней мере, пять углеродных атомов, которая необязательно может быть кодирована триплетом нуклеотидов, описаны в выложенной заявке на пат. Японии N 57-067548 (Shionogi). Заявляются инсулиновые аналоги, подлежащие использованию при лечении сахарного диабета, в частности, пациентов, которые инсулинорезистентны вследствие генерации антител бычьего или свиного инсулина.
Под термином "производное инсулина", используемом здесь, понимают соединение, имеющее молекулярную структуру, аналогичную молекулярной структуре человеческого инсулина, включая дисульфидные мостики между CysA7 и CysB7 и между CysA20 и CysB19 и внутренний дисульфидный мостик между CysA6 и CysA11, и которое имеет активность инсулина.
Однако все же существует потребность в пролонгированных инъекцируемых инсулиновых композициях, которые представляли бы растворы и которые содержали инсулины, которые остаются в растворе после инъекции и обладают минимальными воспалительными и иммуногенными свойствами.
Одна из целей настоящего изобретения заключается в разработке производных человеческого инсулина, с пролонгированным профилем действия, которые растворимы при физиологических значениях pH.
Другая цель настоящего изобретения заключается в разработке фармацевтической композиции, включающей производные человеческого инсулина согласно данному изобретению.
Следующей целью настоящего изобретения является разработка способа получения производных человеческого инсулина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Неожиданно, оказалось, что некоторые производные человеческого инсулина, в которых ε-аминогруппа LysB29 имеет липофильный заместитель, имеют пролонгированный профиль действия и являются растворимыми при физиологических значениях pH.
Таким образом, в самом широком аспекте, настоящее изобретение относится к инсулиновому производному, имеющему последовательность N 1, в которой Xaa в положении A21 и B3, независимо, представляет собой любой аминокислотный остаток, который может быть кодирован генетическим кодом, за исключением Lys, Arg и Cys;
Xaa в положении B1 является Phe или удален;
Xaa в положении B30 является
(a) не-кодируемой, липофильной аминокислотой, имеющей от 10 до 24 углеродных атомов, и в этом случае ацильная группа карбоновой кислоты с вплоть до 5 углеродных атомов связана с ε-аминогруппой LysB29,
(b) любым аминокислотным остатком, который может быть кодирован генетическим кодом, за исключением Lys, Arg и Cys, и в этом случае ε-аминогруппа LysB29 имеет липофильный заместитель или
(c) удален, и в этом случае ε-аминогруппа LysB29 имеет липофильный заместитель; и любым его Zn2+ комплексам, при условии, что когда Xaa в положении B30 является Thr или Ala, Xaa в положениях A21 и B3 оба являются Asn , и Xaa в положении B1 является Phe, тогда инсулиновое производное представляет собой Zn2+ комплекс.
В предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором B30 аминокислотный остаток удален или представляет собой любой аминокислотный остаток, который может быть кодирован генетическим кодом, за исключением Lys, Arg и Cys; A21 и B3 аминокислотные остатки, независимо, являются любыми аминокислотными остатками, которые могут быть кодированы генетическим кодом, за исключением Lys, Arg и Cys; PheB1 может быть удален; ε-аминогруппа LysB29 имеет липофильный заместитель, который включает, по крайней мере, 6 углеродных атомов; и 2-4 Zn2+ ионов могут быть связаны с каждым гексамером инсулина с учетом того, что когда B30 является Thr или Ala и A21 и B3 оба являются Asn, и PheB1 не удален, тогда 2-4 Zn2+ ионов связаны с каждым гексамером инсулинового производного.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислотный остаток удален или является любым аминокислотным остатком, который может быть кодирован генетическим кодом, за исключением Lys, Arg и Cys; A21 и B3 аминокислотные остатки, независимо, являются любыми аминокислотными остатками, которые могут быть кодированы генетическим кодом, за исключением Lys, Arg и Cys, с учетом того, что если B30 аминокислотный остаток является Ala или Thr, то тогда, по крайней мере, один из остатков A21 и B3 отличен от Asn; PheB1 может быть удален; и ε-аминогруппа LysB29 имеет липофильный заместитель, который включает, по крайней мере, 6 углеродных атомов.
В другом варианте воплощения изобретения, изобретение относится к производному человеческого инсулина, в котором B30 аминокислотный остаток удален или является любым аминокислотным остатком, который может быть кодирован генетическим кодом, за исключением Lys, Arg и Cys; A21 и B3 аминокислотные остатки, независимо, являются любыми аминокислотными остатками, которые могут быть кодированы генетическим кодом, за исключением Lys, Arg и Cys; PheB1 может быть удален; ε-аминогруппа LysB29 имеет липофильный заместитель, который включает, по крайней мере, 6 углеродных атомов; и 2-4 Zn2+ ионов могут быть связаны с каждым гексамером инсулина.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором B30 аминокислотный остаток удален.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором B30 аминокислотный остаток является Asp.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором B30 аминокислотный остаток Glu.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором B30 аминокислотный остаток Thr.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором B30 аминокислотный остаток является липофильной аминокислотой, имеющей, по крайней мере, 10 углеродных атомов. В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является липофильной α-аминокислотой, имеющей от 10 до 24 углеродных атомов.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является неразветвленной (цепь), насыщенной, алифатической α-аминокислотой, имеющей от 10 до 24 углеродных атомов.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является D- или L- Nε-додеканоиллизином.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминодекановой кислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминоундекановой кислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминододекановой кислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминотридекановой кислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминотетрадекановой кислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминопентадекановой кислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминогексадекановой кислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B30 аминокислота является α-аминокислотой.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором A21 аминокислотный остаток является Ala.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором A21 аминокислотный остаток является Gln.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором A21 аминокислотный остаток является Gly.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором A21 аминокислотный остаток является Ser.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B3 аминокислотный остаток является Asp.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B3 аминокислотный остаток является Gln.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором B3 аминокислотный остаток является Thr.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который является ацильной группой, соответствующей карбоновой кислоте, имеющей, по крайней мере, 6 углеродных атомов.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который является ацильной группой, разветвленной или неразветвленной, которая соответствует карбоновой кислоте, имеющей углеродную цепь из 8-24 атомов углерода.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который является ацильной группой, соответствующей жирной кислоте, имеющей, по крайней мере, 6 углеродных атомов.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который является ацильной группой, соответствующей линейной, насыщенной карбоновой кислоте, имеющей 6-24 атомов углерода.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который является ацильной группой, соответствующей линейной, насыщенной карбоновой кислоте, имеющей 8-12 атомов углерода.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который является ацильной группой, соответствующей линейной, насыщенной карбоновой кислоте, имеющей 10-16 атомов углерода.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который представляет собой олигооксиэтиленовую группу, содержащую вплоть до 10, предпочтительно вплоть до 5, оксиэтиленовых звеньев.
В другом предпочтительном варианте воплощения, изобретение относится к производному инсулина, в котором ε-аминогруппа LysB29 имеет липофильный заместитель, который представляет собой олигооксипропиленовую группу, содержащую вплоть до 10, предпочтительно вплоть до 5, оксипропиленовых звеньев.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором каждый гексамер инсулина связывает 2 Zn2+ иона.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором каждый гексамер инсулина связывает 3 Zn2+ иона.
В другом предпочтительном варианте воплощения, изобретение относится к производному человеческого инсулина, в котором каждый гексамер инсулина связывает 4 Zn2+ иона.
В другом предпочтительном варианте воплощения, изобретение относится к использованию производного человеческого инсулина согласно изобретению для получения лекарственного препарата для лечения диабета.
В другом предпочтительном варианте воплощения, изобретение относится к фармацевтической композиции для лечения диабета у пациентов, в случае необходимости такого лечения, включающей терапевтически эффективное количество производного человеческого инсулина согласно изобретению вместе с фармацевтически приемлемым носителем.
В другом предпочтительном варианте воплощения, изобретение относится к фармацевтической композиции для лечения диабета у пациентов, в случае необходимости такого лечения, включающей терапевтически эффективное количество производного человеческого инсулина согласно изобретению, в смеси с инсулином или аналогом инсулина, который имеет быстрое начало действия, вместе с фармацевтически приемлемым носителем.
В другом предпочтительном варианте воплощения, изобретение относится к фармацевтической композиции, включающей производное человеческого инсулина согласно изобретению, которое растворимо при физиологических значениях pH.
В другом предпочтительном варианте воплощения, изобретение относится к фармацевтической композиции, включающей производное человеческого инсулина согласно изобретению, которое растворимо при pH значениях в интервале от около 6,5 до около 8,5.
В другом предпочтительном варианте воплощения, изобретение относится к пролонгированной фармацевтической композиции, включающей производное человеческого инсулина согласно изобретению.
В другом предпочтительном варианте воплощения, изобретение относится к фармацевтической композиции, которая представляет собой раствор, содержащий от около 120 нмол/мл до около 1200 нмол/мл, предпочтительно около 600 нмол/мл производного человеческого инсулина согласно изобретению.
В другом предпочтительном варианте воплощения, изобретение относится к способу лечения диабета у пациентов, в случае необходимости такого лечения, включающему введение пациенту терапевтически эффективного количества производного инсулина согласно изобретению фармацевтически приемлемым носителем.
В другом предпочтительном варианте воплощения, изобретение относится к способу лечения диабета у пациентов, в случае необходимости такого лечения, включающему введение пациенту терапевтически эффективного количества производного инсулина согласно этому изобретению, в смеси с инсулином или аналогом инсулина, который имеет быстрое начало действия, вместе с фармацевтически приемлемым носителем.
Примерами предпочтительных производных человеческого инсулина согласно настоящему изобретению, в которых отсутствуют связанные Zn2+ ионы, являются следующие:
NεB29-тридеканоил дез(B30) человеческий инсулин,
NεB29-тетрадеканоил дез(B30) человеческий инсулин,
NεB29-деканоил дез(B30) человеческий инсулин,
NεB29-додеканол дез(B30) человеческий инсулин,
NεB29-тридеканоил GlyA21 дез(B30) человеческий инсулин,
NεB29-тетрадеканоил GlyA21 дез(B30) человеческий инсулин,
NεB29-деканоил GlyA21 дез(B30) человеческий инсулин,
NεB29-додеканол GlyA21 дез(B30) человеческий инсулин,
NεB29-тридеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-тетрадеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-деканол GlyA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-додеканол GlyA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-тридеканоил AlaA21 дез(B30) человеческий инсулин,
NεB29-тетрадеканоил AlaA21 дез(B30) человеческий инсулин,
NεB29-деканоил AlaA21 дез(B30) человеческий инсулин, -додеканол AlaA21 дез(B30) человеческий инсулин,
-додеканол AlaA21 дез(B30) человеческий инсулин,
NεB29-тридеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-тетрадеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-деканоил AlaA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-додеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин,
NεB29-тридеканоил GlnB3 дез(B30) человеческий инсулин,
NεB29-тетрадеканоил GlnB3 дез(B30) человеческий инсулин,
NεB29-деканоил GlnB3 дез(B30) человеческий инсулин,
NεB29-додеканоил GlnB3 дез(B30) человеческий инсулин,
NεB29-тридеканоил GlyA21 человеческий инсулин,
NεB29-тетрадеканоил GlyA21 человеческий инсулин,
NεB29-деканоил GlyA21 человеческий инсулин,
NεB29-додеканоил GlyA21 человеческий инсулин,
NεB29-тридеканоил GlyA21 GlnB3 человеческий инсулин,
NεB29-тетрадеканоил GlyA21 GlnB3 человеческий инсулин,
NεB29-деканоил GlyA21 GlnB3 человеческий инсулин,
NεB29-додеканоил GlyA21 GlnB3 человеческий инсулин,
NεB29-тридеканоил AlaA21 человеческий инсулин,
NεB29-тетрадеканоил AlaA21 человеческий инсулин,
NεB29-деканоил AlaA21 человеческий инсулин,
NεB29-додеканоил AlaA21 человеческий инсулин,
NεB29-тридеканоил AlaA21 GlnB3 человеческий инсулин,
NεB29-тетрадеканоил AlaA21 GlnB3 человеческий инсулин,
NεB29-деканоил AlaA21 GlnB3 человеческий инсулин,
NεB29-додеканоил AlaA21 GlnB3 человеческий инсулин,
NεB29-тридеканоил GlnB3 человеческий инсулин,
NεB29-тетрадеканоил GlnB3 человеческий инсулин,
NεB29-деканоил GlnB3 человеческий инсулин,
NεB29-додеканоил GlnB3 человеческий инсулин,
NεB29-тридеканоил GluB30 человеческий инсулин,
NεB29-тетрадеканоил GluB30 человеческий инсулин,
NεB29-деканоил GluB30 человеческий инсулин,
NεB29-додеканоил GluB30 человеческий инсулин,
NεB29-тридеканоил GlyA21 GluB30 человеческий инсулин,
NεB29-тетрадеканоил GlyA21 GluB30 человеческий инсулин,
NεB29-деканоил GlyA21 GluB30 человеческий инсулин,
NεB29-додеканоил GlyA21 GluB30 человеческий инсулин,
NεB29-тридеканоил GlyA21 GlnB3 GluB30 человеческий инсулин,
NεB29-тетрадеканоил GlyA21 GlnB3 GluB30 человеческий инсулин,
NεB29-деканоил GlyA21 GlnB3 GluB30 человеческий инсулин,
NεB29-додеканоил GlyA21 GlnB3 GluB30 человеческий инсулин,
NεB29-тридеканоил AlaA21 GluB30 человеческий инсулин,
NεB29-тетрадеканоил AlaA21 GluB30 человеческий инсулин,
NεB29-деканоил AlaA21 GluB30 человеческий инсулин,
NεB29-додеканоил AlaA21 GluB30 человеческий инсулин,
NεB29-тридеканоил AlaA21 GlnB3 GluB30 человеческий инсулин,
NεB29-тетрадеканоил AlaA21 GlnB3 GluB30 человеческий инсулин,
NεB29-деканоил AlaA21 GlnB3 GluB30 человеческий инсулин,
NεB29-додеканоил AlaA21 GlnB3 GluB30 человеческий инсулин,
NεB29-тридеканоил GlnB3 GluB30 человеческий инсулин,
NεB29-тетрадеканоил GlnB3 GluB30 человеческий инсулин,
NεB29-деканоил GlnB3 GluB30 человеческий инсулин,
NεB29-додеканоил GlnB3 GluB30 человеческий инсулин.
Примерами предпочтительных производных человеческого инсулина согласно данному изобретению, в которых два Zn2+ иона связаны с гексамером инсулина, являются следующие;
( NεB29-тридеканоил дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил дез(B30) человеческий инсулин)6, 2Zn2+,
(  -тридеканоил GlyA21 дез(B30) человеческий инсулин)6, 2Zn2+,
-тридеканоил GlyA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlyA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlyA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlyA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил AlaA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил AlaA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил AlaA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил AlaA21 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlnB3 дез(B30) человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlyA21 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlyA21 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlyA21 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlyA21 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlyA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlyA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlyA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlyA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил AlaA21 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил AlaA21 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил AlaA21 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил AlaA21 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил AlaA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил AlaA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил AlaA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил AlaA21 GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlnB3 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlyA21 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlyA21 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlyA21 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlyA21 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил AlaA21 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил AlaA21 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил AlaA21 GluB30 человеческий инсулин)6, 2Zn2+,
(  -додеканоил AlaA21 GluB30 человеческий инсулин)6, 2Zn2+,
-додеканоил AlaA21 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тридеканоил GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-тетрадеканоил GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-деканоил GlnB3 GluB30 человеческий инсулин)6, 2Zn2+,
( NεB29-додеканоил GlnB3 GluB30 человеческий инсулин)6, 2Zn2+.
Примерами предпочтительных производных человеческого инсулина согласно данному изобретению, в которых три Zn2+ иона связаны с гексамером инсулина, являются следующие:
( NεB29-тридеканоил дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тетрадеканоил дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-деканоил дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-додеканоил дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тридеканоил GlyA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тетрадеканоил GlyA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-деканоил GlyA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-додеканоил GlyA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тридеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тетрадеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-деканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-додеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тридеканоил AlaA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тетрадеканоил AlaA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-деканоил AlaA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-додеканоил AlaA21 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тридеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тетрадеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-деканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-додеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тридеканоил GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-тетрадеканоил GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29-деканоил GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил GlnB3 дез(B30) человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил GlyA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил GlyA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил GlyA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил GlyA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил GlyA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил GlyA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил GlyA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил GlyA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил AlaA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил AlaA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил AlaA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил AlaA21 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил AlaA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил AlaA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил AlaA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил AlaA21 GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил GlnB3 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил GlyA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил GlyA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил GlyA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил GlyA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
(  -додеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
-додеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил AlaA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил AlaA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил AlaA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил AlaA21 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тридеканоил GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -тетрадеканоил GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -деканоил GlnB3 GluB30 человеческий инсулин)6, 3Zn2+,
( NεB29 -додеканоил GlnB3 GluB30 человеческий инсулин)6, 3Zn2+.
Примерами предпочтительных производных человеческого инсулина согласно данному изобретению, в которых четыре Zn2+ иона связаны с примерами предпочтительных производных человеческого инсулина согласно данному изобретению, в которых четыре Zn2+ иона связаны с гексамером инсулина, являются следующие:
( NεB29 -тридеканоил дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тетрадеканоил дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -деканоил дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -додеканоил дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тридеканоил GlyA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тетрадеканоил GlyA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -деканоил GlyA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -додеканоил GlyA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тридеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тетрадеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -деканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -додеканоил GlyA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тридеканоил AlaA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тетрадеканоил AlaA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -деканоил AlaA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -додеканоил AlaA21 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тридеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29 -тетрадеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил AlaA21 GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GlnB3 дез(B30) человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GlyA21 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GlyA21 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил GlyA21 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GlyA21 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GlyA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GlyA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил GlyA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GlyA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил AlaA21 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил AlaA21 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил AlaA21 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил AlaA21 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил AlaA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил AlaA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил AlaA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил AlaA21 GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GlnB3 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GlyA21 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GlyA21 GluB30 человеческий инсулин)6, 4Zn2+,
(  -деканоил GlyA21 GluB30 человеческий инсулин)6, 4Zn2+,
-деканоил GlyA21 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GlyA21 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GlyA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил AlaA21 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил AlaA21 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил AlaA21 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил AlaA21 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил AlaA21 GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тридеканоил GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-тетрадеканоил GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-деканоил GlnB3 GluB30 человеческий инсулин)6, 4Zn2+,
( NεB29-додеканоил GlnB3 GluB30 человеческий инсулин)6, 4Zn2+.
Краткое описание чертежей
Настоящее изобретение более подробно иллюстрируется следующими рисунками.
Фиг. 1 иллюстрирует конструкцию плазмиды pEA5.3.2;
Фиг. 2 иллюстрирует плазмиду pEA108; и
Фиг. 3 иллюстрирует плазмиду pEA11З.
Терминология
Три буквы кодов и одна буква кодов для аминокислотных остатков, используемых здесь, являются такими как установлено в In. Viol. Chem. 243, p. 3558 (1968).
В ДНК последовательностях, A - аденин, C - цитозин, G - гуанин и T - тимин.
Используют следующие акронимы:
ДМСО (DMSO) для диметилсульфоксида, ДМФ (DMF) для диметилформамида, БОК (Boc) для трет-бутоксикарбонила, ОФ-ЖХВР (RP-HPLC) для жидкостной хроматографии высокого разрешения с обращенной фазой, X-OSu представляет собой N-гидроксисукцинимид эфир, X - ацильная группа, и ТФК (TFK) для трифторуксусной кислоты.
Получение липофильных производных инсулина
Предлагаемые производные инсулина могут быть получены так, как описано ниже:
1. Инсулиновые производные с аминокислотным остатком в положении B30, который может быть кодирован генетическим кодом, например треонин (человеческий инсулин) или аланин (свиной инсулин).
1.1. Исходя из человеческого инсулина.
Человеческий инсулин обрабатывают Boc-реагентом (например, ди-трет-бутилдикарбонатом) с образованием (A1,B1)-диBoc человеческого инсулина, т.е., человеческого инсулина, в котором N-концевые концы обеих цепей защищены Boc-группой. После необязательной очистки, например с помощью ЖХВР, вводят ацильную группу в ε-аминогруппу LysB29, подвергая продукт взаимодействию с N-гидроксисукцинимид эфиром формулы X-OSu, в котором X есть ацильная группа, которую вводят. На конечной стадии, для удаления Boc-групп используют ТФК, и продукт, NεB29-X человеческий инсулин, выделяют.
1.2 Исходя из одноцепочечного предшественника инсулина.
Одноцепочечный предшественник инсулина, удлиненный в положении B1 удлинением (Ext), которое связано с B1 при помощи аргининового остатка и в котором мостик от B30 к A1 представляет собой аргининовый остаток, т.е., соединение общей формулы Ext-Arq-B(1-30)-Arg-A(1-21), может быть использован в качестве исходного вещества. При ацилировании этого исходного вещества N-гидроксисукцинимид эфиром общей формулы X-OSu, в котором X есть ацильная группа, вводят ацильную группу X в ε-аминогруппу LysB29 и в N-концевую аминогруппу предшественника. При обработке этого ацилированного предшественника формулы (NεB29-X), X-Ext-Arg-B(1-30)-Arg-A(1-21) трипсином в смеси воды и подходящего смешивающегося с водой органического растворителя, например ДМФ (DMF), ДМСО (DMSO) или низший спирт, получают интермедиат формулы (NεB29-X), ArgB31 инсулин. Обработка этого интермедиата карбоксипептидазой B дает требуемый продукт, (NεB29-X) инсулин.
2. Производные инсулина без аминокислотного остатка в положении B30, т. е., дез(B30) инсулины.
2.1 Исходя из человеческого инсулина или свиного инсулина.
При обработке карбоксипептидазой A в аммонийном буфере человеческий инсулин и свиной инсулин оба дают дез(B30) инсулин. После необязательной очистки, дез(B30) инсулин обрабатывают Boc-реагентом (например, ди-трет-бутилкарбонатом) с образованием (A1, B1)-диBoc дез(B30) инсулина, т. е., дез(B30) инсулина, в котором N-концевые концы обеих цепей защищены Boc-группой. После необязательной очистки, например с помощью ЖХВР, вводят ацильную группу в ε-аминогруппу LysB29, подвергая продукт взаимодействию с N-гидроксисукцинимид эфиром формулы X-OSu, в котором X есть ацильная группа, которую вводят. На конечной стадии, для удаления Boc-групп используют ТФК, и продукт, (NεB29-X) дез(B30) инсулин, выделяют.
2.2 Исходя из одноцепочечного предшественника человеческого инсулина.
Одноцепочечный предшественник человеческого инсулина, который удлиняют в положении B1 удлинением (Ext), которое связано с B1 при помощи аргининового остатка и которое имеет мостик от B30 к A1, может быть полезным исходным веществом. Предпочтительно, мостик представляет собой пептид формулы Yn-Arg, где Y является кодируемой аминокислотой, за исключением лизина и аргинина, и n есть нуль или целое число между 1 и 35. Когда n>1, Y-и могут обозначать различные аминокислоты. Предпочтительными примерами мостика от B30 к A1 являются: AlaAlaArg, SerArg, SerAspAspAlaArg и Arg (European Patent N 163529). Обработка такого предшественника общей формулы Ext-Arg-B(1-30)-Yn-Arg-A(1-21) лизил эндопептидазой, например, Achromobacter lyticus протеазой, дает Ext-Arg-B(1-29)-Thr-Yn-Arg-A(1-21) дез(B30) инсулин. Ацилирование этого интермедиата N-гидроксисукцинимид эфиром общей формулы X-OSu, в котором X есть ацильная группа, вводит ацильную группу X в ε-аминогруппу LysB29 и в N-концевую аминогруппу A-цепи и B-цепи с получением (NεB29-X) X-Ext-Arg-B(1-29)-X-Thr-Yn-Arg-A(1-21) дез(B30) инсулин. Обработка этого интермедиата трипсином в смеси воды и подходящего органического растворителя, например ДМФ (DMF), ДМСО (DMSO) или низший спирт, дает требуемое производное, (NεB29-X) дез (B30) человеческий инсулин.
Данные по NεB29 модифицированным инсулинам.
Некоторые экспериментальные данные по NεB29 модифицированным инсулинам даны в таблице 1.
Липофильность производного инсулина относительно человеческого инсулина, k'отн., измеряют на Lichrosorb ОФ18 (5 мкм, 250 х 4 мм) ЖХВР колонке при изократическом элюировании при 40oC, используя смеси A) 0,1 М натрий фосфатного буфера, pH 7,3, содержащего 10% ацетонитрила, и B) 50% ацетонитрила в воде, в качестве элюентов. Элюирование контролируют путем последующего УФ-поглощения элюата при 214 нм. Мертвое время, t0, определяют путем инъецирования 0,1 мМ нитрата натрия. Время удерживания для человеческого инсулина, tчел, доводят, по крайней мере, до 2t0, варьируя отношение между растворами A и B. k'отн = (tпроизв - t0)/(tчел - t0).
Степень пролонгирования гипогликемического действия (понижение уровня глюкозы в крови) изучают на кроликах. Каждое производное инсулина испытывают с помощью подкожной инъекции 12 нмол каждому из шести кроликов в испытании на замедление раз в день. Отбор проб крови на анализ содержания глюкозы проводят до инъекции и через 1, 2, 4 и 6 часов после инъекции. Найденные значения глюкозы выражают как процент от исходных значений. Индекс замедления, который рассчитывают из значений содержания глюкозы в крови, представляет собой градуированный Индекс замедления (пролонгации), смотри p. 211 Markussen et al., Protein Engineering 1 (1987) 205-213. Кривая градуирована так, чтобы значение 100 соответствовало бычьему ультраленте инсулину и значение 0 соответствовало инсулину Актрапид (ActrapidR) (Novo Nordisk A/S, 2880 Bagsvaerd, Denmark).
Производные инсулина, представленные в таблице 1, вводят в растворах, содержащих 3Zn2+ на гексамер инсулина, за исключением производных, специально оговоренных как несодержащих Zn.
Для сильно пролонгированных аналогов модель кролика является неадекватной, поскольку уменьшение уровня глюкозы в крови от начального слишком мало для того, чтобы установить индекс замедления (пролонгирования). Пролонгирование таких аналогов лучше характеризовать путем исчезновения дозы у свиней. T50% представляет собой время, когда 50% A14 Tyr (125I) аналога исчезнет от места инъекции, измеряемого с помощью внешнего γ-счетчика (Ribel, U. et al. , The Pig as a Model for Subcutaneous Absorption in Man. In: M. Serrano-Rios and P.J. Lefebre (Eds): Diabetes 1985; Proceedings of the 12th Congress of the International Diabetes Federation, Madrid, Spain, 1985 (Excerpta Medica, Amsterdam, (1986) 891-96).
В таблице 2 представлены T50% значения ряда очень пролонгированных инсулиновых аналогов. Аналоги вводили в раствор, содержащий 3Zn2+ на гексамер инсулина.
Растворимость
Растворимость всех NεB29 модифицированных инсулинов, представленных в таблице 1, которые содержат 3Zn2+ иона на гексамер инсулина, превышает 600 нмол/мл в нейтральном (pH 7,5), водном, фармацевтическом составе, который дополнительно содержит 0,3% фенола в качестве консерванта и 1,6% глицерина для достижения изотоничности. 600 нмол/мл является концентрацией человеческого инсулина, установленной в 100 IU (М.Е.)/мл композиций, обычно используемых в клинических условиях.
ε-B29 аминогруппа может быть компонентом амидной связи, сульфонамидной связи, карбамидом, тиокарбамидом или карбаматом. Липофильный заместитель, который несет ε-B29 аминогруппа, может быть алкильной группой.
Фармацевтические композиции, содержащие производное человеческого инсулина согласно настоящему изобретению, могут быть введены пациентам парентерально, при необходимости такого лечения. Парентеральное введение может быть осуществлено путем подкожной, внутримышечной или внутривенной инъекции с помощью шприца, произвольно с помощью шприца, подобного ручке. Альтернативно, парентеральное введение может быть осуществлено при помощи инфузионного насоса. Дополнительный выбор представляет собой композиция, которая может быть порошком или жидкостью для введения производного человеческого инсулина в форме назального аэрозоля.
Инъецируемые композиции человеческого инсулина данного изобретения можно получить, используя обычные методы фармацевтической индустрии, которая включает растворение и смешение ингредиентов, как целесообразно, с получением требуемого продукта.
Так, согласно одной методике, производное человеческого инсулина растворяют в количестве воды, которое несколько меньше, чем конечный объем композиции, которую следует получить. Добавляют изотонический агент, консервант и буфер, как требуется, и доводят значение pH раствора - если необходимо - используя кислоту, например хлористоводородную кислоту, или основание, например водный гидроксид натрия, при необходимости. Наконец, объем раствора доводят водой, получая требуемую концентрацию ингредиентов.
Примерами изотонических агентов являются хлорид натрия, маннит и глицерин.
Примерами консервантов являются фенол, м-крезол, метил п-гидроксибензоат и бензиловый спирт.
Примерами подходящих буферов являются ацетат натрия и фосфат натрия.
Композицию для назального введения производного инсулина согласно данному изобретению можно, например, получить, как описано в Евр. пат. N 272097 (Novo Nordisk A/S).
Композиции инсулина данного изобретения можно использовать при лечении диабета. Уровень оптимальной дозы для любого пациента будет зависеть от ряда факторов, включая эффективность применяемого конкретного производного человеческого инсулина, возраст, вес тела, физическую активность и диету пациента, от возможной комбинации с другими лекарственными средствами, и тяжести случая диабета. Рекомендуется, чтобы суточная доза производного человеческого инсулина данного изобретения для каждого индивидуального пациента определялась специалистами в данной области техники аналогичным путем, также как это делается для известных инсулиновых композиций.
Где целесообразно, производные человеческого инсулина данного изобретения могут быть использованы в смеси с другими типами инсулина, например человеческого инсулина или свиного инсулина или аналоги инсулина с более быстрым началом действия. Примеры таких инсулиновых аналогов описаны, например, в заявках на Европейский патент, имеющих публикацию N EP 214826 (Novo Nordisk A/S), EP 375437 (Novo Nordisk A/S) и EP 383472 (Eli Lilly & Co).
Данное изобретение более подробно иллюстрируется нижеследующими примерами, которые, однако, не следует рассматривать как ограничивающие объем его защиты. Признаки, раскрытые в вышеприведенном описании и в нижеследующих примерах, как раздельно, так и в любом их сочетании, могут служить материалом для реализации изобретения в его разных формах.
Примеры
Плазмиды и ДНК вещество
Все плазмиды экспрессии представляют cPOT тип. Такие плазмиды описаны в заявке на EP патент N 171142 и отличаются тем, что содержат Schizosaccharomyces pombe триозе фосфат изомеразный ген (POT) для цели селекции плазмиды и стабилизации. Плазмида, содержащая POT-ген, доступна из депонированного E. Coli штамма (ATCC 39685). Кроме того, плазмиды содержат S. cerevisiae триозе фосфат изомеразный промотор и терминатор (PTP1 и TTP1). Они идентичны pMT742 (Egel. Mitani, M., et al., Gene 73 (1988) 113- 120) (см. фиг. 1), за исключением области, определяемой ECoRI-XbaI сайтами рестрикции, окружающими кодирующую область сигнал/лидер/продукт.
Синтетические ДНК-фрагменты синтезируют на автоматическом синтезаторе ДНК (Applied Biosystems модель 380A), используя фосфорамидитную химию и коммерчески доступные реагенты (Beaucage, S.L. и Caruthers, M.H., Tetrahedron Letters 22 (1981) 1859-1869).
Все другие используемые способы и вещества общеизвестны в данной области (смотри например, Sambrook, J. , Fritsch, E.F. и Maniatis, J., Molecular Cloning: A Laborital Manual, Cold Spring Harbor Laboratory Press, New York, 1989).
Аналитические методы
Молекулярные массы полученных инсулинов получены с помощью МС (MS) (масс-спектроскопии), либо с помощью метода ПДМС (PDMS) (масс-спектроскопия с помощью плазменной десорбции), используя Bio-Ion 20 установку (Bio-Ion Nordic AB, Uppsala, Sweden) или с помощью ESMS (электрораспылительная масс-спектроскопия), используя API III Biomolecular Mass Analyzer (Perkin-Elmer Science Instruments, Thornhill, Canada).
Пример 1
Синтез предшественника AlaA21 AspB3 человеческого инсулина из дрожжевого штамма yEA002, используя LaC212spx3 сигнал/лидер (Последовательность N 2).
Следующую Полимеразную Цепную Реакцию (PCR, ПЦР) проводят, используя Gene Amp PCR набор реагентов (Perkin Elmer, 761 Main Avewalk, CT 07859, USA), согласно инструкциям производителя. Во всех случаях, PCR смесь покрывают слоем 100 мкл минерального масла (Sigma Chemical Co., St. Louis, MO, USA).
2,5 мкл олигонуклеотида #98 (2,5 пмол)
2,5 мкл олигонуклеотида #128 (2,5 пмол)
10 мкл 10X PCR буфера
16 мкл dNTP смеси
0,5 мкл Taq фермента
58,5 мкл воды
Проводят один цикл: 94oC в течение 45 сек., 49oC в течение 1 мин., 72oC в течение 2 мин.
Впоследствии, 5 мкл олигонуклеотидов #16 и #126 добавляют и проводят 15 циклов: 94oC в течение 45 сек., 45oC в течение 1 мин., 72oC в течение 1,5 мин. PCR смесь нагружают на 2,5% агарозный гель и подвергают электрофорезу, используя стандартную технику (Sambrook et al., Molecular Cloning, Cold Spring Harbor Laboratory Press, 1989). Полученный фрагмент ДНК вырезают из агарозного геля и выделяют, используя Gene Clean набор (Bio 101 Inc., PO BOX 2284, Lajolla, CA 92038, USA) согласно инструкциям производителя. Очищенный PCR ДНК фрагмент растворяют в 10 мкл воды и буфера для эндонуклеазной рестрикции и расщепляют эндонуклеазами рестрикции NcoI и XbaI согласно стандартным техникам, проводимым на 2,5% агарозном геле, и очищают, используя указанный Gene Clean набор.
Плазмида pAL188 состоит из ДНК последовательности длиной 412 bp, включающей EcoRI/NcoI фрагмент, кодирующий синтетический дрожжевой сигнал/лидер ген LaC212spx3 (описанный в примере 3 WO 89/02463), за которым следует синтетический NcoI/XbaI фрагмент, кодирующий инсулиновый предшественник M15, который имеет SerAspAspAlaLys мостик, связывающий B29 и A1 аминокислотные остатки (смотри SEQ ID NOS 14, 15 и 16), включенные в EcoRI/XbaI фрагмент вектора (фагмида) pBlueScript IISK (+/-) (Stratagene, USA). Плазмида pAK188 представлена на фиг. 1.
Плазмиду pAK188 также расщепляют эндонуклеазами рестрикции NcoI и XbaI и фрагмент вектора длиной 3139 bp выделяют. Два ДНК фрагмента лигируют вместе, используя T4 ДНК лигазу и стандартные условия (Sambrook et al., Molecular Cloning, Cold Spring Harbor Laboratory Press, 1989). Смесь лигирования трансформируют в компетентный E.coli штамм (R-, M+) с последующей селекцией на устойчивость к ампициллину. Плазмиды изолируют из образовавшихся E.coli колоний, используя стандартную ДНК минипрепаративную технику Sambrook et al. , Molecular Cloning, Cold Spring Harbor Laboratory Press, 1989), проверяя соответствующими эндонуклеазами рестрикции, т.е. EcoRI, XbaI, NcoI и HpaI. Как показано с помощью ДНК секвенирования (Sequenase, U.S. Biochemical Corp. ), отобранная плазмида содержит правильную последовательность предшественника AlaA21, AspB3 человеческого инсулина, и ее обозначают pEA5.3.
Плазмида pKFN1627 представляет собой E.coli-S.cerevisiae шаттл-вектор, идентичный плазмиде pKFN1003, описанный в ЕП N 375718, за исключением короткой ДНК последовательности против хода транскрипции от уникального XbaI сайта. В pKFN1003, эта последовательность представляет собой фрагмент длиной 178 bp, кодирующий синтетический апротининовый ген, слитый в рамке считывания (fused in-frame) с сигнал/лидер последовательностью дрожжевого спаривающего фактора альфа 1. В pKFN1627, соответствующая последовательность длиной 184 bp кодирует инсулиновый предшественник M15 (GluB1, GluB28) (т.е. B(1-29, GluB1, GluB28)-SeeAspAspAlaLys-A(1-21), слитый в рамке с последовательностью спаривающего фактора альфа 1 (смотри SEQ ID NOS 17, 18 и 19). Вектор pKFN1627 показан на фиг. 1.
pEA5.3 расщепляют эндонуклеазами рестрикции EcoRI и XbaI и изолируют образующийся ДНК фрагмент длиной 412 bp. Дрожжевой вектор экспрессии pKFN1627 расщепляют эндонуклеазами рестрикции NcoI и XbaI и с NcoI и EcoRI и изолируют ДНК фрагмент длиной 9273 bp из первого переваривания, и изолируют ДНК фрагмент длиной 1644 bp из второго переваривания. Затем EcoRI/XbaI фрагмент длиной 412 bp лигируют с двумя другими фрагментами, то есть NcoI/XbaI фрагмент длиной 9273 bp и NcoI/EcoRI фрагмент длиной 1644 bp, используя стандартные методики.
Смесь лигирования трансформируют в E.coli как описано выше. Плазмиду из образующейся E.coli изолируют, используя стандартные методики, и проверяют с помощью соответствующих эндонуклеаз рестрикции, т. е. EcoRI, XbaI, NcoI, HpaI. Как установлено с помощью анализа ДНК последовательности (используя секвеназный набор, как описано производителем, U.S. Biochemical), отобранная плазмида содержит правильную последовательность ДНК предшественника AlaA21 AspB3 человеческого инсулина и подлежит включению после ДНК, кодирующей LaC212spx3 сигнал/лидер ДНК. Плазмиду обозначают pEA5.3.2 и она показана на фиг. 1. ДНК последовательность, кодирующая комплекс LaC212spx3 сигнал/лидер/предшественник AlaA21 AspB3 человеческого инсулина и его аминокислотная последовательность, являются SEQ ID NOS 20, 21 и 22. Плазмиду pEA5.3.2 трансформируют в S. cerevisiae штамм MT663, как описано в заявке на ЕП, имеющей публикацию N 214826, и полученный штамм обозначают yEA002.
Пример 2
Синтез предшественника AlaA21 ThrB3 человеческого инсулина из дрожжевого штамма yEA005, используя LaC212spx3 сигнал/лидер. (Последовательность N 3).
ДНК, кодирующую предшественник AlaA21 ThrB3 человеческого инсулина, конструируют тем же самым способом, как описано для ДНК, кодирующей предшественник AlaA21 AspB3 человеческого инсулина в примере 1. ДНК последовательность, кодирующая комплекс LaC212spx3 сигнал/лидер/предшественник AlaA21 ThrB3 человеческого инсулина и его аминокислотная последовательность, являются SEQ ID NOS 23, 24 и 25. Плазмида pEA8.1.1., как показано, содержит требуемую последовательность, трансформированную в S. cerevisiae штамм MT663, как описано в примере 1 и полученный штамм обозначают yEA005.
Пример 3
Синтез предшественника GlyA21 AspB3 человеческого инсулина из дрожжевого штамма yEA007, используя LaC212spx3 сигнал/лидер. (Последовательность N 4).
ДНК, кодирующую предшественник GlyA21 AspB3 человеческого инсулина, конструируют тем же самым способом, как описано для ДНК, кодирующей предшественник AlaA21 AspB3 человеческого инсулина в примере 1. ДНК последовательность, кодирующая комплекс LaC212spx3 сигнал/лидер/предшественник GlyA21 AspB3 человеческого инсулина и его аминокислотная последовательность, являются SEQ ID NOS 26, 27 и 28. Плазмида pEA1.5.6., как показано, содержит требуемую последовательность, трансформированную в S. cerevisiae штамм MT663, как описано в примере 1 и полученный штамм обозначают yEA007.
Пример 4
Синтез предшественника GlyA21 ThrB3 человеческого инсулина из дрожжевого штамма yEA006, используя LaC212spx3 сигнал/лидер. (Последовательность N 5).
ДНК, кодирующую предшественник GlyA21 ThrB3 человеческого инсулина, конструируют тем же самым способом, как описано для ДНК, кодирующей предшественник AlaA21 и AspB3 человеческого инсулина в примере 1. ДНК последовательность, кодирующая комплекс LaC212spx3 сигнал/лидер/предшественник GlyA21 ThrB3 человеческого инсулина и его аминокислотную последовательность, являются SEQ ID NOS 29, 30 и 31. Плазмида pEA4.4.11., как показано, содержит требуемую последовательность, трансформированную в S. cerevisiae штамм MT663, как описано в примере 1 и полученный штамм обозначают yEA006.
Пример 5
Синтез одноцепочечного предшественника ArgB1 ArgB31 человеческого инсулина, имеющего N-концевое удлинение (GluGluAlaGluAlaGluAlaArg) из дрожжевого штамма yEA113, используя альфа фактор лидер. (Последовательность N 6).
Следующую Полимеразную Цепную Реакцию (PCR, ПЦР) проводят, используя Gene Amp PCR набор реагентов (Perkin Elmer, 761 Main Avewalk, CT 06859, USA), согласно инструкциям производителя. Во всех случаях, РСR смесь покрывают слоем 100 мкл минерального масла (Sigma Chemical Co., St. Louis, MO, USA). Плазмида pAK220 (которая идентична pAK188) состоит из ДНК последовательности длиной 412 bp, кодирующей синтетический дрожжевой сигнал/лидер LaC212spx3 (описанный в примере 3 WO 89/02463), за которым следует инсулиновый предшественник M15 (смотри SEQ ID NOS 14, 15 и 16), вставленный в вектор (фагмида) pBlueScript IISK(+/-) (Stratagene, USA)
5 мкл олигонуклеотида #220 (100 пмол)
5 мкл олигонуклеотида #263 (100 пмол)
10 мкл 10X PCR буфера
16 мкл dNTP смеси
0,5 мкл Taq фермента
0,5 мкл pAK220 плазмиды (идентичная pAK188) в качестве матрицы (0,2 мкг ДНК)
63 мкл воды
В общем осуществляют 16 циклов, причем каждый цикл включает 1 минуту при 95oC; 1 минуту при 40oC и 2 минуты при 72oC. Затем PCR смесь нагружают на 2% агарозный гель и подвергают электрофорезу, используя стандартные техники. Полученный фрагмент ДНК вырезают из агарозного геля и изолируют, используя Gene Clean набор (Bio 101 Inc. 101 Inc., PO BOX 2284, La jolla, CA 92038, USA) согласно инструкциям производителя. Очищенный PCR ДНК фрагмент растворяют в 10 мкл воды и буфера для эндонуклеазной рестрикции и расщепляют эндонуклеазами рестрикции HindIII и XbaI согласно стандартным техникам. HinsIII/XbaI ДНК фрагмент, используя указанный Gene Clean набор.
Плазмида pAK406 состоит из ДНК последовательности длиной 520 bp, включающей EcoRI/HindIII фрагмент, полученный из pMT636 (описанный в WO 90/10075), кодирующий дрожжевой альфа фактор лидер и часть инсулинового предшественника, лигированный с HindIII/XbaI фрагментом из pAK188, кодирующим остатком инсулинового предшественника M15 (смотри SEQ ID NOS 32, 33 и 34), вставленной в вектор cPOT. Вектор pAK406 показан на фиг. 2.
Плазмида pAK233 состоит из ДНК последовательности длиной 412 bp, кодирующей синтетический дрожжевой сигнал/лидер LaC212spx3 (описанный в примере 3 WO 89/02463), за которой следует ген инсулинового предшественника B(1-29)-GluLysArg-A(1-21) (A21-Gly) (смотри SEQ ID NOS 35, 36 и 37), вставленной в вектор cPOT. Плазмида pAK233 показана на фиг. 2.
Плазмиду pAK233 расщепляют эндонуклеазами рестрикции NcoI и XbaI и фрагмент вектора длиной 9273 bp изолируют. Плазмиду pAK406 расщепляют эндонуклеазами рестрикции NcoI и HindIII и фрагмент вектора длиной 2012 bp изолируют. Эти два ДНК фрагмента лигируют вместе с HindIII/XbaI PCR фрагментом, используя T4 ДНК лигазу и стандартные условия. Затем смесь лигирования трансформируют в компетентный E.coli штамм (R-, M+) с последующей селекцией на устойчивость к ампициллину. Плазмиды изолируют из полученных E.coli колоний, используя стандартную ДНК минипрепаративную технику и проверяют с помощью соответствующих эндонуклеаз рестрикции, т.е., EcoRI, XbaI, NcoI и HindIII. Отобранная плазмида, как показано с помощью анализов по секвенированию последовательностей ДНК, содержит правильную последовательность для ДНК одноцепочечного предшественника ArgB31 человеческого инсулина, и которая подлежит включению после ДНК, кодирующей S. cerevisiae альфа фактор ДНК. Плазмиду обозначают pEA108 и она показана на фиг. 2. ДНК последовательность, кодирующая комплекс альфа фактор лидер/одноцепочечного предшественника ArgB31 человеческого инсулина и его аминокислотная последовательность являются SEQ ID NOS 38, 39 и 40. Плазмиду pEA108 трансформируют в S. cerevisiae штамм MT663 как описано в примере 1 и полученный штамм обозначают yEA108.
Следующую Полимеразную Цепную Реакцию (PCR, ПЦР) проводят, используя Gene Amp PCR набор реагентов (Perkin Elmer, 761 Main Avewalk, CT 06859, USA), согласно инструкциям производителя. Во всех случаях, PCR смесь покрывают слоем 100 мкл минерального масла (Sigma Chemical Co., St. Louis, MO, USA).
5 мкл олигонуклеотида #220 (100 мпол)
5 мкл олигонуклеотида #307 (100 пмол)
10 мкл 10X dNTP, буфера
16 мкл dNTP смеси
0,5 мкл Taq фермента
0,2 мкл pEA108 плазмиды в качестве матрицы (0,1 мкг ДНК)
63 мкл воды
В общем осуществляют 16 циклов, причем каждый цикл включает 1 минуту при 95oC; 1 минуту при 40oC и 2 минуты при 72oC. Затем PCR смесь нагружают на 2% агарозный гель и подвергают электрофорезу, используя стандартные техники. Полученный фрагмент ДНК вырезают из агарозного геля и изолируют, используя Gene Clean набор (Bio 101 Inc., PO BOX 2284, La Jolla, CA 92038, USA) согласно инструкциям производителя. Очищенный PCR ДНК фрагмент растворяют в 10 мкл воды и буфера для эндонуклеазной рестрикции и расщепляют эндонуклеазами рестрикции NcoI и XbaI, согласно стандартным методикам. NcoI/XbaI ДНК фрагмент очищают, используя указанный Gene Clean набор.
Плазмида pAK401 состоит из ДНК последовательности длиной 523 bp, включающей EcoRI/NcoI фрагмент, полученный из pMT636 (описанный в WO 90/10075) (сконструированный путем введения NcoI сайта на 3'-конце альфа лидера с помощью сайт направленного мутагенеза), кодирующий альфа фактор лидер, с последующим NcoI/XbaI фрагментом из pAK188, кодирующим инсулиновый предшественник M15 (смотри SEQ ID NOS 41, 42 и 43), вставленная в вектор (фагмида) pBlueScript IISK(+/-) (Stratagene, USA). Плазмида pAK401 показана на фиг. 3.
Плазмиду pAK401 расщепляют эндонуклеазами рестрикции NcoI и XbaI и фрагмент вектора длиной 3254 bp изолируют и лигируют вместе с NcoI/XbaI PCR фрагментом. Затем смесь лигирования трансформируют в компетентный E.coli штамм и плазмиды изолируют из полученных E.coli. колоний, используя стандартную ДНК минипрепаративную технику и проверяют с помощью соответствующих эндонуклеаз рестрикции, т.е. EcoRI, XbaI, NcoI. Отобранную плазмиду, обозначенную p113A (показанную на фиг. 3), расщепляют EcoRI и XbaI и фрагмент длиной 535 bp изолируют.
Плазмиду pAK233 расщепляют эндонуклеазами рестрикции NcoI и XbaI, и EcoRI/NcoI и фрагменты длиной 9273 и 1644 bp изолируют. Эти два ДНК фрагмента лигируют вместе с EcoRI/XbaI фрагментом из p113A, используя T4 ДНК лигазу и стандартные условия. Затем смесь лигирования трансформируют в компетентный E. coli штамм (R-, M+) с последующей селекцией на устойчивость к ампициллину. Плазмиды изолируют из полученных E.coli колоний, используя стандартную ДНК минипрепаративную технику и проверяют с помощью соответствующих эндонуклеаз рестрикции, т. е. , EcoRI, XbaI, Ncol и HindIII. Отобранная плазмида, как показано с помощью анализов по секвенированию последовательностей ДНК, содержит правильную последовательность ДНК одноцепочечного предшественника ArgB31 человеческого инсулина с N-концевым удлинением GluGluAlaGluAlaGluAlaArg и которая подлежит включению после ДНК, кодирующей S. cerevisiae альфа фактор ДНК. Плазмиду обозначают pEA113 и она показана на фиг. 3. ДНК последовательность, кодирующая (комплекс) альфа фактор лидер/одноцепочечного предшественника ArgB-1ArgB31 человеческого инсулина, имеющего N-концевое удлинение (GluGluAlaGluAlaGluAlaArg), и его аминокислотную последовательность, являются SEQ ID NOS 44, 45 и 46. Плазмиду pEA113 трансформируют в S. cerevisiae штамм MT663 как описано в примере 1 и полученный штамм обозначают yEA113.
Пример 6
Синтез одноцепочечного предшественника ArgB-1 ArgB31 человеческого инсулина, имеющего N-концевое удлинение (GluGluAlaGluAlaGluAlaGluArg) из дрожжевого штамма yEA136, используя альфа фактор лидер (Последовательность N 7).
Следующие ПЦР (PCR) осуществляют, используя Gene Amp PCR набор реагентов
5 мкл олигонуклеотида #220 (100 пмол)
5 мкл олигонуклеотида #389 (100 пмол)
10 мкл 10X PCR буфера
16 мкл dNTP смеси
0,5 мкл Taq фермента
2 мкл pEA113 плазмиды в качестве матрицы (0,5 мкг ДНК)
63 мкл воды
В общем осуществляют 12 циклов, причем каждый цикл включает 1 минуту при 95oC; 1 минуту при 37oC и 2 минуты при 72oC.
ДНК, кодирующую альфа фактор лидер/ArgB-1 ArgB31 одноцепочечный предшественник человеческого инсулина, имеющий N-концевое удлинение (GluGluAlaGluAlaGluAlaGluArg), конструируют тем же самым способом, как описано для ДНК, кодирующей альфа фактор лидер/ArgB-1 ArgB31 одноцепочечный предшественник человеческого инсулина, имеющий N-концевое удлинение (GluGluAlaGluAlaGluAlaArg) в примере 5. Плазмиду обозначают pEA136. ДНК последовательность, кодирующая альфа фактор лидер/ArgB-1 ArgB31 одноцепочечный предшественник человеческого инсулина, имеющий N-концевое удлинение (GluGluAlaGluAlaGluAlaGluArg), и его аминокислотная последовательность, являются SEQ ID NOS 47, 48 и 49. Плазмиду pEA136 трансформируют в S. cerevisiae штамм MT663 как описано в примере 1 и полученный штамм обозначают yEA136.
Пример 7
Синтез (A1,B1)-диBoc человеческого инсулина
5 г свободного от цинка человеческого инсулина растворяют в 41,3 мл ДМСО. К раствору добавляют 3,090 мл уксусной кислоты. Реакцию проводят при комнатной температуре и инициируют добавлением 565 мг ди-трет-бутил пирокарбоната, растворенного в 5,650 мл ДМСО. Реакцию продолжают в течение 5 1/2 часов и затем останавливают добавлением 250 мл этаноламина. Продукт осаждают добавлением 1500 мл ацетона. Осадок отделяют центрифугированием и сушат в вакууме. Получают 6,85 г вещества.
(A1,B1)-диBoc инсулин очищают с помощью ЖХВР с обращенной фазой следующим образом: Неочищенный продукт растворяют в 100 мл 25% этанола в воде, доводят pH до 3,0 с помощью HCl и вводят в колонку (5 см диаметром, 30 см высотой), наполненную частицами октадецилдиметилсилил-замещенного диоксида кремния (средний размер частиц 15 мкм, размер пор 100  ) и уравновешенную элюирующим буфером. Элюирование проводят, используя смеси этанола и 1 мМ водного HCl, 0,3 М KCl при потоке 2 л/ч. Инсулин элюируют путем увеличения содержания этанола от 30% до 45%. Соответствующую фракцию разбавляют 20% этанолом и осаждают при pH 4.8. Осажденное вещество выделяют центрифугированием и сушат в вакууме. Таким образом получают 1,701 г (A1,B1)-диBoc человеческого инсулина при чистоте 94,5%.
) и уравновешенную элюирующим буфером. Элюирование проводят, используя смеси этанола и 1 мМ водного HCl, 0,3 М KCl при потоке 2 л/ч. Инсулин элюируют путем увеличения содержания этанола от 30% до 45%. Соответствующую фракцию разбавляют 20% этанолом и осаждают при pH 4.8. Осажденное вещество выделяют центрифугированием и сушат в вакууме. Таким образом получают 1,701 г (A1,B1)-диBoc человеческого инсулина при чистоте 94,5%.
Пример 8
Синтез ( NεB29-бензоил человеческий инсулин)6, 3Zn2+.
400 мг (A1, B1)-диBoc человеческого инсулина растворяют в 2 мл ДМСО (DMSO). К раствору добавляют 748 мкл смеси N-метилморфолина и ДМСО (1:9, об/об). Реакцию проводят при 15oC и инициируют путем добавления 14,6 мг N-гидроксисукцинимид эфира бензойной кислоты, растворенного в 132 мкл ДМФ. Реакцию останавливают через 2 часа путем добавления 100 мл ацетона. Осажденное вещество отделяют центрифугированием и сушат в вакууме. Собирают 343 мг вещества.
Boc защищающие группы элиминируют путем добавления 4 мл ТФК. Растворенное вещество инкубируют в течение 30 минут и затем осаждают путем добавления 50 мл ацетона. Осадок отделяют центрифугированием и сушат в вакууме.
NεB29-бензоил человеческий инсулин очищают с помощью ЖХВР с обращенной фазой, как описано в примере 7. Получают 230 мг вещества. Перекристаллизацией из 15% водного этанола, содержащего 6 мМ Zn2+ и 50 мМ цитрата при pH 5,5 получают кристаллы названного соединения, которые выделяют с помощью центрифугирования и сушат в вакууме. Выход 190 мг.
Молекулярная масса, установленная с помощью МС: 5911, теория: 5911.
Пример 9
Синтез (NεB29-литохолоил человеческий инсулин)6, 3Zn2+
400 мг (A1, B1)-диBoc человеческого инсулина растворяют в 2 мл ДМСО (DMSO). К раствору добавляют 748 мкл смеси N-метилморфолина и ДМСО (1:9, об/об). Реакцию проводят при 15oC и инициируют путем добавления 31,94 мг N-гидроксисукцинимид эфира литохолевой кислоты, растворенного в 300 мкл ДМФ. Реакцию останавливают через 2 часа путем добавления 100 мл ацетона. Осажденное вещество отделяют центрифугированием и сушат в вакууме. Собирают 331 мг вещества.
Boc защищающие группы элиминируют путем добавления 4 мл ТФК. Растворенное вещество инкубируют в течение 30 минут и затем осаждают путем добавления 50 мл ацетона. Осадок отделяют центрифугированием и сушат в вакууме. Выход 376 мг.
NεB29-литохолоил человеческий инсулин очищают с помощью ЖХВР с обращенной фазой, как описано в примере 7. Получают 67 мг вещества при чистоте 94%. Перекристаллизацией из 15% водного этанола, содержащего 6 мМ Zn2+ и 50 мМ цитрата при pH 5,5 получают кристаллы названного соединения, которые выделяют с помощью центрифугирования и сушат в вакууме. Выход 49 мг.
Молекулярная масса, установленная с помощью МС: 6160, теория: 6166.
Пример 10
Синтез (NεB29-деканоил человеческий инсулин)6, 3Zn2+
400 мг (A1, B1)-диBoc человеческого инсулина растворяют в 2 мл ДМСО (DMSO). К раствору добавляют 748 мкл смеси N-метилморфолина и ДМСО (1:9, об/об). Реакцию проводят при 15oC и инициируют путем добавления 18,0 мг N-гидроксисукцинимид эфира декановой кислоты, растворенного в 132 мкл ДМФ. Реакцию останавливают через 60 минут и продукт осаждают путем добавления 100 мл ацетона. Осажденное вещество отделяют центрифугированием и сушат в вакууме. Собирают 420 мг промежуточного продукта.
Boc защищающие группы элиминируют путем добавления 4 мл ТФК. Растворенное вещество инкубируют в течение 30 минут и затем продукт осаждают путем добавления 50 мл ацетона. Осадок отделяют центрифугированием и сушат в вакууме. Выход неочищенного продукта составляет 420 мг. Неочищенный продукт очищают с помощью ЖХВР с обращенной фазой, как описано в примере 7. Получают 254 мг названного продукта. Чистота составляет 96,1%. Перекристаллизацией из 15% водного этанола, содержащего 6 мМ Zn2+ и 50 мМ цитрата при pH 5,5 получают кристаллы названного соединения, которые выделяют с помощью центрифугирования и сушат в вакууме. Выход составляет 217 мг.
Молекулярная масса, установленная с помощью МС: 5962, теория: 5962.
Пример 11
Синтез дез(B30) человеческого инсулина
Синтез дез(B30) человеческого инсулина проводят как описано Markussen (Methods in diabetes research, Vol. 1, Laboratory methods, part B, 404-410. Ed: J. Larner and S. Phol, John Wiley & Sons, 1984). 5 г человеческого инсулина растворяют в 500 мл воды, в то время как значение pH раствора поддерживают при 2,6 путем добавления 0,5 М серной кислоты. Впоследствии, инсулина высаливают путем добавления 100 г сульфата аммония и осадок отделяют центрифугированием. Осадок растворяют в 800 мл 0,1 М гидрокарбоната аммония и значение pH раствора доводят до 8,4 с помощью 1 М аммиака.
50 мг бычьей карбоксипептидазы A суспендируют в 25 мл воды и отделяют центрифугированием. Кристаллы суспендируют в 25 мл воды и добавляют 1 М аммиак до тех пор пока не получат прозрачный раствор при конечном pH 10. Раствор карбоксипептидазы добавляют к раствору инсулина в проводят реакцию в течение 24 часов. В качестве консерванта во время реакции добавляют несколько капель толуола. Через 24 часа дез(B30) человеческий инсулин кристаллизуют путем постепенного добавления 80 г хлорида натрия при перемешивании раствора. Затем значение pH доводят до 8,3 и проводят кристаллизацию в течение 20 часов при осторожном перемешивании. Кристаллы отделяют на 1,2 мкм фильтре, промывают 250 мл охлаждаемого льдом 2-пропанолом и, наконец, сушат в вакууме.
Пример 12
Синтез (A1,B1)-диBoc дез(B30) человеческого инсулина
Названное соединение синтезируют способом, сходным со способом, описанным в примере 7, используя в качестве исходного вещества дез(B30) свиной инсулин. Неочищенный продукт осаждают ацетоном и сушат в вакууме. (A1,B1)-диBoc-дез(B30) человеческий инсулин очищают с помощью ЖХВР с обращенной фазой, как описано в примере 7.
Пример 13
Синтез NεB29-деканоил дез(B30) человеческий инсулин
400 мг (A1, B1)-диBoc-дез(B30) человеческого инсулина используют в качестве исходного вещества для синтеза NεB29-деканоил дез(B30) человеческого инсулина, следуя методике, описанной в примере 10. Неочищенный продукт осаждают ацетоном, сушат в вакууме и снимают защиту, используя ТФК. Полученный продукт осаждают ацетоном и сушат в вакууме. Затем NεB29-деканоил дез(B30) человеческий инсулин очищают с помощью ЖХВР с обращенной фазой, как описано в примере 10.
Молекулярная масса, установленная с помощью МС: 5866, теория: 5861.
Пример 14
Синтез NεB29-додеканоил дез(B30) человеческого инсулина
a. Иммобилизация A. lyticus протеазы
13 мг A. Lyticus протеазы, растворенной в 5 мл водного 0,2 М NaHCO3 буфере, pH 9,4, смешивают с 4 мл осажденного геля MiniLeakR Medium, который был промыт тем же самым буфером (MiniLeak представляет собой Сефарозу CL 6B, активированную дивинилсульфоном, получаемую от KemEnTec, Copenhagen). Гель выдерживают в суспензии при осторожном перемешивании в течение 24 часов при комнатной температуре. Затем гель отделяют фильтрацией, промывают водой и суспендируют в 20 мл 1 М этаноламинового буфера, pH 9,4, и выдерживают в суспензии в течение 24 часов при комнатной температуре. Наконец, гель промывают водой, а затем 0,1 М уксусной кислотой и хранят при 4oC. Активность фермента в фильтрате составляла 13% активности фермента в исходном растворе, что указывает на то, что выход реакции иммобилизации составляет около 87%.
b. Иммобилизация свиного трипсина.
Свиной трипсин иммобилизуют на MiniLeakR Low до степени замещения 1 мг на мл геля, используя условия, описанные выше для иммобилизации A. lyticus.
c. Синтез Glu(GluAla)3Arg-B(1-29), ThrArg-A(1-21) инсулина, используя иммобилизованную A. lyticus протеазу.
К 200 мг предшественника Glu(GluAla)3Arg-B(1-29), ThrArg-A(1-21) одноцепочечного человеческого инсулина, растворенного в 20 мл 0,1 М NaHCO3 буфере, pH 9,0, добавляют 4 мл геля, несущего иммобилизованную A. lyticus протеазу. После выдерживания геля в суспензии в реакционной смеси в течение 6 часов при комнатной температуре гидролиз заканчивают, получая Glu(GluAla)3Arg-B(1-29), ThrArg-A(1-21) человеческий инсулин (реакция прослеживается ЖХВР с обращенной фазой). После гидролиза, гель удаляют фильтрацией. К фильтрату добавляют 5 мл этанола и 15 мкл 1 М ZnCl2 и доводят pH до 5,0, используя HCl. Осадок продукта формируется при стоянии на протяжении ночи при 4oC при осторожном перемешивании. Продукт отделяют путем центрифугирования. После одной промывки 1 мл охлаждаемого льдом 20% этанола и сушки в вакууме выход составил 190 мг.
d. Синтез NαA1,NαB1,NεB29-тридодеканоил Glu(GluAla)3Arg-B(1-29), Thr-Arg-A(1-21) человеческого инсулина, используя N-гидроксисукцинимид эфир додекановой кислоты
190 мг (30 мкмол) Glu(GluAla)3Arg-B(1-29), ThrArg-A(1-21) инсулина растворяют в 1 мл ДМСО и 1,05 мл 0,572 М раствора N,N-диизопропилэтиламина в ДМФ. Раствор охлаждают до 15oC и добавляют 36 мг (120 мкмол) N-гидроксисукцинимид эфира додекановой кислоты, растворенного в 0,6 мл ДМСО. Реакцию заканчивают в течение 24 часов. Липофильное названное соединение не выделяют.
e. Синтез NεB29-додеканоил дез(B30) инсулина
Продукт предыдущей стадии d, содержащийся в приблизительно 2,65 мл ДМСО/ДМФ/N, N-диизопропилэтиламина, разбавляют 10,6 мл 50 мМ глицинового буфера, включающего 20% этанола, и pH доводят до 10 с помощью NaOH. После стояния в течение 1 часа при комнатной температуре добавляют 1 мл MiniLeak геля, несущего 1 мг иммобилизованного трипсина на 1 мл геля. Реакционную смесь осторожно перемешивают в течение 48 часов при комнатной температуре. Для того, чтобы выделить требуемый продукт реакционную смесь подвергают хроматографированию на колонке ЖХВР с обращенной фазой (5 см в диаметре, высотой 30 см), наполненной частицами октадецилдиметилсилил-замещенного диоксида кремния (средний размер частицы 15 мкм, размер пор 100  ). Для элюирования используют 20 мМ трис/HCl буферы, доведенные до pH 7,7 и включающие повышающуюся концентрацию этанола от 40% до 44% (об/об), со скоростью 2000 мл/ч. Основной пик элюирования при около 43-44% этанола содержал названное соединение. Фракции, содержащие основной пик, объединяют, добавляют воду для уменьшения концентрации этанола до 20% (об/об), и pH доводят до 5,5. Раствор оставляют на ночь при -20oC, при этом продукт осаждается. Осадок отделяют центрифугированием при -8oC и сушат в вакууме. Выход названного соединения составляет 90 мг. Молекулярная масса, установленная с помощью МС: 5892, теория: 5890.
). Для элюирования используют 20 мМ трис/HCl буферы, доведенные до pH 7,7 и включающие повышающуюся концентрацию этанола от 40% до 44% (об/об), со скоростью 2000 мл/ч. Основной пик элюирования при около 43-44% этанола содержал названное соединение. Фракции, содержащие основной пик, объединяют, добавляют воду для уменьшения концентрации этанола до 20% (об/об), и pH доводят до 5,5. Раствор оставляют на ночь при -20oC, при этом продукт осаждается. Осадок отделяют центрифугированием при -8oC и сушат в вакууме. Выход названного соединения составляет 90 мг. Молекулярная масса, установленная с помощью МС: 5892, теория: 5890.
Пример 15
Синтез NεB29-(N-миристоил-α-глютамил) человеческого инсулина
500 мг (A1,B1)-диBoc человеческого инсулина растворяют в 2,5 мл ДМСО и добавляют 428 мкл этил диизопропиламина, разбавленного 2,5 мл ДМСО/ДМФ 1/1 (об/об). Температуру доводят до 15oC и добавляют 85 мг N-миристоил-Glu(OBut) N-гидроксисукцинимид эфира, растворенного в 2,5 мл ДМСО/ДМФ 1/1 (об/об). После 30 минут реакционную смесь выливают в 60 мл воды, pH доводят до 5 и осадок выделяют центрифугированием. Осадок сушат в вакууме. Высушенную реакционную смесь растворяют в 25 мл ТФК и раствор оставляют в течение 30 минут при комнатной температуре. ТФК удаляют путем испарения в вакууме. Гелеобразный остаток растворяют в 60 мл воды и pH доводят до 11,2, используя концентрированный аммиак. Названное соединение кристаллизуют из этого раствора путем доведения pH до 8,5, используя 6N HCl. Продукт отделяют центрифугированием, один раз промывают 10 мл воды и сушат в вакууме. Выход 356 мг. Чистота по данным ЖХВР 94%.
Продукт этого примера представляет собой человеческий инсулин, в котором ε-аминогруппа LysB29 имеет заместитель следующей структуры: CH3(CH2)12CONHCH(CH2CH2COOH)CO-.
Молекулярная масса, установленная с помощью МС: 6146, теория: 6148.
Пример 16
Синтез NεB29-ундеканоил дез(B30) человеческого инсулина
Названное соединение синтезируют аналогично NεB29-додеканоил дез(B30) человеческому инсулину, как описано в примере 14, используя N-гидроксисукцинимид эфир ундекановой кислоты вместо N-гидроксисукцинимид эфир додекановой кислоты.
Молекулярная масса, установленная с помощью МС: 5876, теория: 5876.
Пример 17
Синтез NεB29-тридеканоил дез(30) человеческого инсулина
Названное соединение синтезируют аналогично NεB29-додеканоил дез(B30) человеческому инсулину, как описано в примере 14, используя N-гидроксисукцинимид эфир тридекановой кислоты вместо N-гидроксисукцинимид эфир додекановой кислоты.
Молекулярная масса, установленная с помощью МС: 5899, теория: 5904.
Пример 18
Синтез NεB29-миристоил дез(30) человеческого инсулина
Названное соединение синтезируют аналогично NεB29-додеканоил дез(B30) человеческому инсулину, как описано в примере 14, используя N-гидроксисукцинимид эфир миристиновой кислоты вместо N-гидроксисукцинимид эфир додекановой кислоты.
Молекулярная масса, установленная с помощью МС: 5923, теория: 5918.
Пример 19
Синтез NεB29-пальмитоил дез(30) человеческого инсулина
Названное соединение синтезируют аналогично NεB29-додеканоил дез(B30) человеческому инсулину, как описано в примере 14, используя N-гидроксисукцинимид эфир пальмитиновой кислоты вместо N-гидроксисукцинимид эфир додекановой кислоты.
Молекулярная масса, установленная с помощью МС: 5944, теория: 5946.
Пример 20
Синтез NεB29-субероил-D-тироксин человеческого инсулина
a. Получение N-(сукцинимидилсубероил)-D-тироксина.
Дисукцинимидил суберат (1,0 г, Pierce) растворяют в ДМФ (50 мл), и добавляют D-тироксин (2,0 г, Aldrich) при перемешивании при 20oC. Тироксин медленно растворяется, и после 20 часов растворитель удаляют испарением в вакууме. Маслянистый остаток кристаллизуют из 2-пропанола, получая 0,6 г N-(сукцинимидилсубероил)-D-тироксина, т. пл. 128-133oC.
b. Реакция (A1,B1)-диBoc человеческого инсулина с N-(сукцинимидилсубероил)-D-тироксином.
(A1, B1)-диBoc человеческий инсулин растворяют в сухом ДМФ (10 мл) при добавлении триэтиламина (20 мкл) при комнатной температуре. Затем, добавляют N-(сукцинимидилсубероил)-D-тироксин (80 мг). Реакцию контролируют с помощью ЖХВР с обращенной фазой, и когда реакция завершается на около 90%, растворитель удаляют в вакууме. К остатку после испарения добавляют безводную трифторуксусную кислоту (5 мл) и раствор выдерживают в течение 1 часа при комнатной температуре. После удаления трифторуксусной кислоты в вакууме остаток растворяют в смеси 1 М уксусной кислоты (5 мл) и ацетонитрила (1,5 мл), очищают при помощи препаративной ЖХВР с обращенной фазой и обессоливают на PD-колонке. Выход NεB29-субероил-D-тироксин человеческого инсулина составляет 50 мг.
Продукт этого примера представляет собой человеческий инсулин, в котором ε-аминогруппа LysB29 имеет заместитель следующей структуры: Тирокс-CO(CH2)6CO-, в котором Тирокс представляет тироксин, который связан с октандионовой кислотной частью через амидную связь с его α-аминогруппой.
Молекулярная масса, установленная с помощью МС: 6724, теория: 6723.
Пример 21
Синтез NεB29-(2-сукциниламидо)миристиновая кислота человеческого инсулина
a. Получение метилового эфира α-аминомиристиновой кислоты, HCl.
К метанолу (5 мл, Merck) при -10oC, по каплям при энергичном перемешивании добавляют тионил хлорид (0,2 мл, Aldrich). Затем, добавляют α-аминомиристиновую кислоту (0,7 г, полученную из α-бромо кислоты путем взаимодействия с аммиаком. Реакционную смесь перемешивают при комнатной температуре в течение ночи, и затем выпаривают досуха. Неочищенный продукт (0,7 г) используют непосредственно в стадии b.
b. Получение метилового эфира N-сукциноил-α-аминомиристиновой кислоты
Метиловый эфир α-аминомиристиновой кислоты, HCl (0,7 г) растворяют в хлороформе (25 мл, Merck). Добавляют триэтиламин (0,35 мл, Fluka), затем ангидрид янтарной кислоты (0,3 г, Fluka). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, концентрируют досуха, и остаток рекристаллизуют из смеси этилацетат/петролейный эфир (1/1). Выход: 0,8 г.
c. Получение метилового эфира N-(сукцинимидилсукциноил)-α-аминомиристиновой кислоты
Метиловый эфир N-сукциноил-α-аминомиристиновой кислоты (0,8 г) растворяют в сухом ДМФ (10 мл, Merck, высушенный над 4  молекулярном сите). Добавляют сухой пиридин (80 мкл, Merck), и ди(N-сукцинимидил)карбонат (1,8 г, Fluka), и реакционную смесь перемешивают в течение ночи при комнатной температуре. Остаток после испарения очищают с помощью флеш-хроматографии на силикагеле 60 (Merck), и рекристаллизуют из смеси 2-пропанол/петролейный эфир (1/1). Выход метилового эфира N-(сукцинимидилсукциноил)-α-амино-миристиновой кислоты: 0,13 г, т. пл. 64-66oC.
молекулярном сите). Добавляют сухой пиридин (80 мкл, Merck), и ди(N-сукцинимидил)карбонат (1,8 г, Fluka), и реакционную смесь перемешивают в течение ночи при комнатной температуре. Остаток после испарения очищают с помощью флеш-хроматографии на силикагеле 60 (Merck), и рекристаллизуют из смеси 2-пропанол/петролейный эфир (1/1). Выход метилового эфира N-(сукцинимидилсукциноил)-α-амино-миристиновой кислоты: 0,13 г, т. пл. 64-66oC.
b. Взаимодействие (A1,B1)-диBoc человеческого инсулина с метиловым эфиром N-(сукцинимидилсукциноил)-α-аминомиристиновой кислоты
Реакцию проводят как в примере 20b., но используя метиловый эфир N-(сукцинимидилсукциноил)-α-аминомиристиновой кислоты (16 мг) вместо N-(сукцинимидилсубероил)-D-тироксина. После удаления трифторуксусной кислоты в вакууме остаток после испарения обрабатывают 0,1 М гидроксидом натрия при 0oC, омыляя метиловый эфир. Когда омыление согласно контролю с помощью ЖХВР с обращенной фазой будет завершено, значение pH раствора доводят до 3, и раствор лиофилизуют. После очистки с помощью препаративной ЖХВР с обращенной фазой и обессоливания на PD-10 колонке выход NεB29-(2-сукциниламидо)миристиновая кислота человеческого инсулина составляет 39 мг.
Продукт этого примера представляет собой человеческий инсулин, в котором ε-аминогруппа LysB29 имеет заместитель следующей структуры: CH3(CH2)11CH(COOH)NHCOCH2CH2CO-.
Молекулярная масса, установленная с помощью МС: 6130, теория: 6133.
Пример 22
Синтез NεB29-октилоксикарбонил человеческого инсулина
Синтез проводят как в примере 20 b., но используя н-октилоксикарбонил N-гидроксисукцинимид (9 мг, полученный из н-октил хлороформиата (Aldrich) и N-гидроксисукцинимида), вместо N-(сукцинимидилсубероил)-D-тироксина. Выход  -октилоксикарбонил человеческого инсулина составил 86 мг.
-октилоксикарбонил человеческого инсулина составил 86 мг.
Продукт этого примера представляет собой человеческий инсулин, в котором ε-аминогруппа LysB29 имеет заместитель следующей структуры: CH3(CH2)7OCO-.
Молекулярная масса, установленная с помощью МС: 5960, теория: 5964.
Пример 23
Синтез NεB29-(2-сукциниламидо)пальмитиновая кислота человеческого инсулина
a. Получение метилового эфира N-(сукцинимидилсукциноил)- α-аминопальмитиновой кислоты.
Это соединение получают как описано в примере 21 a.-c., используя α-амино пальмитиновую кислоту вместо α-амино миристиновой кислоты.
b. Взаимодействие (A1, B1)-диBoc человеческого инсулина с метиловым эфиром N-(сукцинимидилсукциноил)-α-аминопальмитиновой кислоты
Реакцию проводят как в примере 21 d., но используя метиловый эфир N-(сукцинимидилсукциноил)-α-аминопальмитиновой кислоты вместо метилового эфира N-(сукцинимидилсукциноил)- α-аминомиристиновой кислоты, получая NεB29-(2-сукциниламидо)пальмитиновая кислота человеческий инсулин.
Продукт этого примера представляет собой человеческий инсулин, в котором ε-аминогруппа LysB29 имеет заместитель следующей структуры: CH3(CH2)13CH(COOH)NHCOCH2CH2CO-.
Пример 24
Синтез NεB29-(2-сукциниламидоэтилокси)пальмитиновая кислота человеческого инсулина
a. Получение метилового эфира N-(сукцинимидилсукциноил)-2-аминоэтилокси пальмитиновой кислоты
Это соединение получают как описано в примере 21 a. - c., используя 2-аминоэтилокси пальмитиновую кислоту (синтезированную по обычной методике, описанной R. TenBrink, J, Org. Chem. 52 (1987) 418-422) вместо α-амино миристиновой кислоты.
b. Взаимодействие (A1, B1)-диBoc человеческого инсулина с метиловым эфиром N-(сукцинимидилсукциноил)-2-аминоэтилоксипальмитиновой кислоты
Реакцию проводят как в примере 21 d., но используя метиловый эфир N-(сукцинимидилсукциноил)-2-аминоэтилоксипальмитиновой кислоты вместо метилового эфира N-(сукцинимидилсукциноил)-α-аминомиристиновой кислоты, получая NεB29-(2-сукциниламидоэтилокси)пальмитиновая кислота человеческий инсулин.
Продукт этого примера представляет собой человеческий инсулин, в котором ε-аминогруппа LysB29 имеет заместитель следующей структуры: CH3(CH2)13CH(COOH)NHCH2CH2 OCOCH2CH2CO-.
Пример 25
Синтез NεB29-литохолоил-α-глутамил дез(B30) человеческого инсулина
Синтез проводят как в примере 13, используя α-N-гидрокси-сукцинимид эфир N-литохолоил-L-глутаминовой кислоты, γ-трет-бутиловый эфир вместо N-гидроксисукцинимидного эфира декановой кислоты.
Продукт этого примера представляет собой дез(B30) человеческий инсулин, в котором ε-аминогруппа LysB29 имеет заместитель следующей структуры: литохолоил-NHCH(CH2CH2COOH)CO-.
Молекулярная масса, установленная с помощью МС: 6194, теория: 6193.
Пример 26
Синтез NεB29-3,3',5,5'-тетраиодотироацетил человеческого инсулина
Синтез проводят как в примере 10, используя N-гидроксисукцинимидный эфир 3,3',5,5'-тетраиодотироуксусной кислоты вместо N-гидроксисукцинимидного эфира декановой кислоты.
Молекулярная масса, установленная с помощью МС: 6536, теория: 6538.
Пример 27
Синтез NεB29-L-тироксил человеческого инсулина
Синтез проводят как в примере 10, используя Boc-L-тироксин N-гидроксисукцинимидный эфир вместо N-гидроксисукцинимидного эфира декановой кислоты.
Молекулярная масса, установленная с помощью МС: 6572, теория: 6567.
Пример 28
Фармацевтическая композиция, включающая 600 нмол/мл NεB29-деканоил дез(B30) человеческого инсулина, 1/3Zn2+ в растворе.
NεB29-деканоил дез(B30) человеческий инсулин (1,2 мкмол) растворяют в воде (0,8 мл) и значение pH доводят до 7,5 путем добавления 0,2 М гидроксида натрия. Добавляют 0,01 М ацетата цинка (60 мкл) и раствор, содержащий 0,75% фенола и 4% глицерина (0,8 мл). Значение pH раствора доводят до 7,5, используя 0,2 М гидроксида натрия и объем раствора доводят водой до 2 мл.
Полученный раствор стерилизуют фильтрацией и асептически переносят в катридж или пузырек.
Пример 29
Фармацевтическая композиция, включающая 600 нмол/мл NεB29-деканоил человеческого инсулина, 1/2Zn2+ в растворе.
1,2 мкмол названного соединения растворяют в воде (0,8 мл) и значение pH доводят до 7,5 путем добавления 0,2 М гидроксида натрия. Добавляют раствор, содержащий 0,75% фенола и 1,75% хлорида натрия (0,8 мл). Значение pH раствора доводят до 7,5, используя 0,2 М гидроксида натрия и объем раствора доводят водой до 2 мл.
Полученный раствор стерилизуют фильтрацией и асептически переносят в катридж или пузырек.
Пример 30
Фармацевтическая композиция, включающая 600 нмол/мл NεB29-литохолоил человеческого инсулина в растворе
1,2 мкмол названного соединения суспендируют в воде (0,8 мл) и растворяют, доводя значение pH раствора до 8,5, используя 0,2 М гидроксида натрия. Затем к раствору добавляют 0,8 мл исходного для разведения раствора, содержащего 0,75% крезола и 4% глицерина в воде. Наконец, значение pH снова доводят до 8,5 и объем раствора доводят водой до 2 мл.
Полученный раствор стерилизуют фильтрацией и асептически переносят в катридж или пузырек.
2. Дополнительные экспериментальные данные
Пример 31
Фармацевтическая композиция, включающая раствор 600 нмоль/мл NεB29-гексадеканоил человеческого инсулина, 1/3 ионов цинка на мономер инсулина, 16 мМ м-крезола, 16 мМ фенола, 1,6% глицерина, 10 мМ хлорида натрия и 7 мМ фосфата натрия.
1,2 мкмоль NεB29-гексадеканоил человеческого инсулина растворяют в воде (0,5 мл), добавлением 0,2 М гидроксида натрия доводят pH до 8,0 и добавляют 40 мкл 0,01 М ацетата цинка. Далее к раствору добавляют 100 мкл 0,32 М фенола, 200 мкл 0,16 М м-крезола, 800 мкл 4% глицерина, 33,3 мкл 0,6 М хлорида натрия и 140 мкл 0,1 М фасфата натрия (pH 7,5). Величину pH раствора доводят до 7,5 добавлением 0,1 М соляной кислоты и объем доводят до 2 мл водой.
Пример 32
Определение растворимости NεB29-тетрадеканоил дез(B30) человеческого инсулина и NεB29-гексадеканоил человеческого инсулина в различных композициях, содержащих их.
Тестируют NεB29-тетрадеканоил дез(B30) человеческий инсулин и NεB29-гексадеканоил человеческий инсулин в различных композициях. Композиции готовят как описано в примере 31 с необходимым количеством компонентов. Ацетат цинка либо не добавляют или добавляют в количестве, соответствующем 1/3 Zn2+ на мономер инсулина. Хлорид натрия используют в количествах, дающих конечную концентрацию 5, 25, 50, 75, 100 или 150 мМ хлорида натрия, соответственно. Инсулин, не содержащий ионов цинка, добавляют в количестве, дающем конечную концентрацию в композиции 1000 нмоль/мл. В некоторых случаях образуется осадок. Полученные растворы и суспензии хранят при 4oC в течение недели и измеряют концентрацию инсулина в растворе каждой композиции с помощью метода эксклюзионной по размерам жидкостной хроматографии высокого разрешения по отношению к стандарту - человеческому инсулину (колонка: Waters ProteinPak 250х8 мм, элюент: 2,5 М уксусная кислота, 4 мМ аргинин, 20% ацетонитрил, скорость потока: 1 мл/мин, объем инъекции: 40 мкл, определение: УФ абсорбция при 276 нм). Результаты в нмоль/мл показаны в табл. 3.
Данные, представленные в таблице показывают, что растворимость ацилированного инсулина повышается при добавлении цинка. Это противоречит данным, опубликованным для человеческого, свиного и бычьего инсулина (J. Brange: Galenics of insulin, page 19, Springer Verlag (1987); J. Marcussen et al. Protein Engineering 1 (1987) 205-213).
Пример 33
Препаративная кристаллизация не содержащего цинка NεB29-тетрадеканоил дез(B30) человеческого инсулина.
10 г NεB29-тетрадеканоил дез(B30) человеческого инсулина растворяют в 120 мл 0,02 М NH4Cl буфере, доведенном до pH 9,0 NH3 в смеси этанол/вода (1: 4, об/об). Осторожное перемешивание сохраняют в течение всего процесса кристаллизации. Кристаллизацию инициируют добавлением 20 мл 2,5 М NaCl, растворенного в смеси этанол/вода, (1:4, об/об). В растворе появляется легкое замутнение. Далее, добавляют 20 мл 2,5 М хлорида натрия, растворенного в смеси этанол/вода (1:4, об/об) с постоянной скоростью 5 мл/ч, что вызывает медленную кристаллизацию. Для снижения растворимости инсулина затем доводят pH до 7,5, используя 1 н соляную кислоту. В конце температуру снижают до 4oC и перемешивание продолжают в течение ночи. Кристаллы собирают фильтрованием, дважды промывают по 25 мл 0,2 м NaCl в смеси этанол/вода (1:4, об/об), сушат отсасыванием растворителя в вакууме и лиофилизируют.
Масса влажной фильтровальной лепешки составляет 19,33 г.
Масса лиофилизированной фильтровальной лепешки составляет 9,71 г.
Пример 34
Синтез LysB29(Nε-[Nα-тетрадеканоил-Glu-Gly] ) дез(B30) человеческого инсулина.
500 мг (A1,B1)-ди-Boc человеческого инсулина растворяют в смеси 186 мкл 4-метилморфолина и 1314 мкл ДМСО. Реакцию инициируют добавлением 144 мг тетрадеканоил-Glu(γ-Oтретбутил)-Gly-OSu, растворенного в 1000 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа добавлением 100 мл ацетона. Продукт реакции, осажденный добавлением нескольких капель концентрированной HCl, далее отделяют центрифугированием. Осадок затем суспендируют в 100 мл ацетона, отделяют центрифугированием и сушат в вакууме. Получают 637 мг продукта.
Boc-защищающие группы удаляют добавлением 5 мл ТФУК. Растворенный продукт выдерживают в течение 30 мин и затем осаждают добавлением 100 мл ацетона и нескольких капель концентрированной HCl. Осадок затем суспендируют в 100 мл ацетона и отделяют центрифугированием. Осажденный продукт растворяют в 200 мл 25% этанола при pH 8, полученном добавлением NH4OH, и очищают с использованием ЖХВР с обращенной фазой. Растворенный материал вводят в колонку (диаметр 5 см, высота 30 см), заполненную частицами октадецилдиметилсилилзамещенного силикагеля (средний размер частиц 15 мкм, размер пор 100  ) и уравновешивают 0,02 М бис-Трис, 30% этанолом, с pH, доведенным до 7,3 соляной кислотой, при температуре 40oC. Элюирование осуществляют смесью 70% этанола в воде и бис-Трис буфером. Скорость потока составляет 2 л/час. Инсулин элюируют, увеличивая содержание этанола от 30% до 50% и эффлюент фиксируют по его абсорбции в УФ при 280 нм. Соответствующие фракции разбавляют до 20% этанолом с pH 4,5 и замораживают при -20oC. Осажденный материал выделяют уравновешиванием образца при 1oC и последующим центрифугированием при той же температуре. Осадок сушат в вакууме. Получают 292 мг целевого соединения с чистотой 95,5%.
) и уравновешивают 0,02 М бис-Трис, 30% этанолом, с pH, доведенным до 7,3 соляной кислотой, при температуре 40oC. Элюирование осуществляют смесью 70% этанола в воде и бис-Трис буфером. Скорость потока составляет 2 л/час. Инсулин элюируют, увеличивая содержание этанола от 30% до 50% и эффлюент фиксируют по его абсорбции в УФ при 280 нм. Соответствующие фракции разбавляют до 20% этанолом с pH 4,5 и замораживают при -20oC. Осажденный материал выделяют уравновешиванием образца при 1oC и последующим центрифугированием при той же температуре. Осадок сушат в вакууме. Получают 292 мг целевого соединения с чистотой 95,5%.
Молекулярная масса, установленная с помощью МС: 6102+6, теор.: 6103.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 20.
Величина T50%, определенная по методике, описанной на стр. 36 описания, для указанного в заголовке соединения при подкожной инъекции свиньям составляет, 11,9 ч. Используют композицию, подобную описанной в таблице 2.
Пример 35
Синтез LysB29(Nε-тетрадеканоил-Glu) дез(B30) человеческого инсулина.
500 мг (A1,B1)-ди-Boc человеческого инсулина растворяют в смеси 186 мкл 4-метилморфолина и 1314 мкл ДМСО. Реакцию инициируют добавлением 85 мг Nα-тетрадеканоил-Glu(O-третбутил)-OSu, растворенного в 1000 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Промежуточный продукт выделяют и защитные группы удаляют ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 356 мг целевого соединения с чистотой 94,1%.
Молекулярная масса, установленная с помощью МС: 6053+6, теор.: 6046.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 24.
Величина T50%, определенная по методике, описанной на стр. 36 описания, для указанного в заголовке соединения при подкожной инъекции свиньям составляет 8,8 ч. Используют композицию, подобную описанной в таблице 2.
Пример 36
Синтез LysB29(Nε-[Nα-тетрадеканоил-Glu(-)-OH]) человеческого инсулина.
400 мг (A1,B1)-ди-Boc человеческого инсулина растворяют в смеси 232 мкл этилдиизопропиламина, 1880 мкл ДМСО и 2088 мкл 1-метил-2-пирролидона. Реакцию инициируют добавлением 138 мг Nα-тетрадеканоил-Glu(OSu)-O-трет-бутила, растворенного в 800 мкл 1-метил-2-пирролидона. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Защитные группы удаляют у промежуточного продукта добавлением ТФА до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой. Получают 222 мг целевого соединения с чистотой 95,5%.
Молекулярная масса, установленная с помощью МС: 6150+6, теор.: 6147.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 21.
Величина T50%, определенная по методике, описанной выше, для указанного в заголовке соединения при подкожной инъекции свиньям составляет 8,0 ч. Используют композицию, подобную описанной в примере 31.
Пример 37
Синтез LysB29(Nε-[Nα-гексадеканоил-Glu(-)-OH]) человеческого инсулина.
400 мг (A1,B1)-ди-Boc человеческого инсулина растворяют в смеси 232 мкл этилдиизопропиламина, 880 мкл ДМСО и 2088 мкл 1-метил-2-пирролидона. Реакцию инициируют добавлением 73 мг Nα-гексадеканоил-Glu(OSu)-O-трет-бутила, растворенного в 800 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа.
Все остальные стадии способа проводят, как описано в примере 34.
Получают 476 мг промежуточного продукта. Защитные группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 222 мг целевого соединения с чистотой 81,2%.
Молекулярная масса, установленная с помощью МС: 6179+6, теор.: 6175.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 67.
Величина T50%, определенная по методике, описанной выше, для указанного в заголовке соединения при подкожной инъекции свиньям составляет 13 ч. Используют композицию, подобную описанной в примере 31.
Пример 38
Синтез LysB29( Nε-[ Nα-октадеканоил-Glu(-)-OH]) дез(B30) человеческого инсулина.
400 мг (A1,B1)-ди-Boc дез(B30) человеческого инсулина растворяют в смеси 232 мкл этилдиизопропиламина, 3000 мкл ДМСО и 268 мкл диметилформамида. Реакцию инициируют добавлением 114 мг Nα-октадеканоил-Glu(OSu)-O-трет-бутила, растворенного в 500 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Получают 420 мг промежуточного продукта Защитные - группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 169 мг целевого соединения с чистотой 98,3%.
Молекулярная масса, установленная с помощью МС: 6103+6, теор.: 6102.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 185.
Величина T50%, определенная по методике, описанной выше, для указанного в заголовке соединения при подкожной инъекции свиньям составляет 9,7 ч. Используют композицию, подобную описанной в примере 31.
Пример 39
Синтез LysB29(Nε-[Nα-тетрадеканоил-Glu(-)-OH] ) дез(B30) человеческого инсулина.
400 мг (A1,B1)-ди-Boc дез(B30) человеческого инсулина растворяют в смеси 232 мкл этилдиизопропиламина и 3000 мкл ДМСО. Реакцию инициируют добавлением 138 мг Nα-тетрадеканоил-Glu(OSu)-O-трет-бутила, растворенного в 768 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Получают 505 мг промежуточного продукта. Защитные группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 237 мг целевого соединения с чистотой 96,7%.
Молекулярная масса, установленная с помощью МС: 6053+6, теор.: 6046.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 21.
Величина T50%, определенная по методике, описанной выше, для указанного в заголовке соединения при подкожной инъекции свиньям составляет 12,8 ч. Используют композицию, подобную описанной в примере 31.
Пример 40
Синтез LysB29( Nε-[ Nα-гексадеканоил-Glu(-)-OH]) дез(B30) человеческого инсулина.
400 мг (A1,B1)-ди-Boc дез(B30) человеческого инсулина растворяют в смеси 232 мкл этилдиизопропиламина, 3000 мкл ДМСО и 400 мкл диметилформамида. Реакцию инициируют добавлением 73 мг Nα-гексадеканоил-Glu(Osu)-O-трет-бутила, растворенного в 400 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Защитные группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 153 мг целевого соединения с чистотой 95,2%.
Молекулярная масса, установленная с помощью МС: 6073+6, теор.: 6074.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 67.
Величина T50%, определенная по методике, описанной выше, для указанного в заголовке соединения при подкожной инъекции свиньям составляет 18,0 ч. Используют композицию, подобную описанной в примере 31.
Пример 41
Синтез LysB29(Nε- Nα-литохолоил-Glu(-)-OH]) дез(B30) человеческого инсулина.
400 мг (A1,B1)-ди-Boc дез(B30) человеческого инсулина растворяют в смеси 148 мкл 4-метилморфолина и 3452 мкл ДМСО. Реакцию инициируют добавлением 132 мг Nα-литохолоил-Glu(OSu)-O-трет-бутила, растворенного в 400 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Получают 493 г промежуточного продукта. Защитные группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 209 мг целевого соединения с чистотой 97,4%.
Молекулярная масса, установленная с помощью МС: 6185+6, теор.: 6194.
Пример 42
Синтез LysB29(Nε-[Nα-тетрадеканоил-Aad(-)-OH] ) дез(B30) человеческого инсулина.
Aad представляет собой 5-аминогексадионовую кислоту. 347 мг (A1,B1)-ди-Boc дез(B30) человеческого инсулина растворяют в смеси 129 мкл 4-метилморфолина и 2645 мкл ДМСО. Реакцию инициируют добавлением 58 мг Nα-тетрадеканоил-Aad(OSu)-O-трет-бутила, растворенного в 694 мкл ДМФ. Активированный эфир получают по способу, который хорошо известен, как способ получения производных аспаргиновой кислоты (L. Benoiton: Can J. Chem. 40 570-72 (1962); R.Roeske: J. Jrg. Chem. 28 1251-93 (1963)). Реакцию проводят при 15oC и останавливают через 4,5 часа.
Все остальные стадии способа проводят, как описано в примере 34. Защитные группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 149 мг целевого соединения с чистотой 97,9%.
Молекулярная масса, установленная с помощью МС: 6061+6, теор.: 6060.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 21.
Величина T50% определенная по методике, описанной выше, для указанного в заголовке соединения при подкожной инъекции свиньям составляет 16,1 ч. Используют композицию, подобнию описанной в примере 31.
Пример 43
Синтез LysB29(Nε-[ Nα-тетрадеканоил-γ-карбокси-Glu) дез(B30) человеческого инсулина.
400 мг (A1,B1)-ди-Boc дез(B30) человеческого инсулина растворяют в смеси 190 мкл триэтиламина и 3000 мкл ДМСО. Реакцию инициируют добавлением 83 мг γ-карбокси-Glu-N-тетрадеканзир-γ,γ-ди-O-трет-бутил-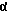 -(OSu) (например (тBuOCO)2CHCH2-CH(COOSu)-NH-CO(CH2)12CH3, растворенного в 800 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Защитные группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
-(OSu) (например (тBuOCO)2CHCH2-CH(COOSu)-NH-CO(CH2)12CH3, растворенного в 800 мкл ДМФ. Реакцию проводят при 15oC и останавливают через 4,5 часа. Все остальные стадии способа проводят, как описано в примере 34. Защитные группы удаляют у промежуточного продукта добавлением ТФУК до очистки ЖХВР с обращенной фазой и целевой продукт выделяют осаждением и вакуумной сушкой.
Получают 63 мг целевого соединения с чистотой 95,2%.
Молекулярная масса, установленная с помощью МС: 6090+6, теор.: 6091.
Липофильность целевого соединения относительно человеческого инсулина k'отн., определенная по методике, представленной выше, составляет 10.
Пример 44
Многоцелевой, в неконтролируемых условиях, открытый титрационный тест NεB29-тетрадеканоил дез(B30) человеческого инсулина, содержащего 2 иона Zn2+ на гексамер инсулина (код: NN304), который вводят в режиме базальная доза/болюс пациентам, страдающим диабетом Типа I.
Первая цель проведения эксперимента: получить клинические данные при использовании NN304 для определения основного направления при определении дозы, необходимой для лечения пациентов, страдающих диабетом Типа I, принимающих NPH инсулин в режиме болюс/базальная доза (один или два раза в день) для перевода их на режим с использованием NN304 (один раз в день).
Вторая цель эксперимента: оценить эффективность в отношении метаболического контроля лечения NN304 в режиме болюс/вечерняя доза в течение от 4 до 14 дней (измеряют как профиль содержания глюкозы в крови по 9 показателям), с последующей 2-х недельной оптимизацией режима болюс/NPH. Следят за частотой случаев гипогликемии в течение лечения в режиме болюс/вечерняя доза NN304.
Метод оценки.
Многоцелевой, в неконтролируемых условиях, открытый титрационный анализ экспериментальной группы пациентов, страдающих диабетом Типа I.
Тестируемые субъекты
Двадцать два пациента (мужчины и женщины) от 25 до 54 лет, имеющие отрицательный показатель по С-пептиду, страдающие диабетом Типа I в течение 24 месяцев или более, получающие лечение NPH инсулином в соответствии с режимом болюс/базальная (минимально возможная доза) один или два раза в день.
Методика лечения
Индивидуально титруют 100 U/мл NN304. В качестве базального инсулина в период теста используют NPH-инсулин. Пациенты в течение теста используют совместимый с пищей инсулин в соответствии с индивидуальными назначениями. Инсулины вводят подкожной инъекцией: базальный инсулин - в бедро, инсулин, совместимый с пищей, - в брюшную полость.
Методика теста
Тест состоит из 2-х недельного+3 дня периода лечения в режиме болюс/базальная доза NPH (один или два раза в день) с последующей стадией титрационного исследования лечения в режиме болюс/базальная вечерняя доза NN304 в течение максимально двух недель. Пациентов выдерживают в режиме болюс/вечерняя доза NN304 в течение 2 дней и возвращают в режим болюс/базальная доза NPH (один или два раза в день).
Общая продолжительность лечения NN304 составляет минимально 6 дней и максимально 16 дней.
Определяемые параметры
Эффективность: экспересс-анализ содержания глюкозы в крови, профиль глюкозы в крови по 9 показателям, профиль инсулина по 9 показателям, HbA1c.
Безопасность: физическое состояние, показатели жизненно важных функций, ЭКГ, профиль содержания глюкозы в крови, гематология, биохимия, содержание жиров, анализ мочи, тест на беременность, неблагоприятные побочные действия и частота гипогликемии.
Обсуждение полученных результатов по эффективности.
Лечение NN304 позволяет снизить уровень глюкозы в крови до уровня, который достигается при лечении NPH и только у одного пациента наблюдали неблагоприятные последствия при лечении NN304.
В общем, требуется среднее увеличение дозы NN304 в 2,2 раза по отношению к дозе NPH для получения стабильных уровней глюкозы в крови, независимо от дневного режима введения инсулина. Однако изменения дозы в значительной степени зависит от конкретного пациента и для одного из исследованных пациентов потребовалась доза NN304 меньше, чем доза NPH. Не наблюдали никаких различий в средних уровнях глюкозы в крови или метаболическом контроле у пациентов при лечении NN304, которые до этого получали NPH один или два раза в день. Однако введение один раз в день NN304 пациентам, получавшим дважды в день NPH, требует увеличенного болюса инсулина для получения метаболического контроля. Лечение NN304 пациентов, поучавших NPH только один раз в день, эффективно в отношении метаболического контроля при слегка пониженном болюсе инсулина. Наблюдали лишь незначительные изменения средних уровней глюкозы в крови у пациентов, получавших NPH один раз в день, при лечении NN304 по сравнению с лечением NPH. На основании полученных данных можно сделать вывод о практически полном отсутствии различий при лечении NN304 и лечении NPH.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОНЪЮГАЦИИ ПЕПТИДОВ, ОПОСРЕДОВАННОЙ ТРАНСГЛУТАМИНАЗОЙ | 2005 |
|
RU2385879C2 |
| ОЧИСТКА ИНСУЛИНА | 2012 |
|
RU2603752C2 |
| ПРОИЗВОДНЫЕ ИНСУЛИНА | 2004 |
|
RU2518460C2 |
| ПРОИЗВОДНЫЕ ИНСУЛИНА | 2004 |
|
RU2352581C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2013 |
|
RU2670106C2 |
| ЛЕЧЕНИЕ САХАРНОГО ДИАБЕТА С ИСПОЛЬЗОВАНИЕМ ИНЪЕКЦИЙ ИНСУЛИНА С ЧАСТОТОЙ МЕНЕЕ ОДНОГО РАЗА В ДЕНЬ | 2009 |
|
RU2540922C2 |
| ЛИПОФИЛЬНЫЕ ПРОИЗВОДНЫЕ ПЕПТИДНЫХ ГОРМОНОВ | 1996 |
|
RU2171261C2 |
| ИНСУЛИНОВЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ УГЛЕВОДЫ | 1997 |
|
RU2204411C2 |
| ПРЕПАРАТ ИНСУЛИНА, СОДЕРЖАЩИЙ NaCl, ПАРЕНТЕРАЛЬНАЯ ГОТОВАЯ ФОРМА, СПОСОБ ПОВЫШЕНИЯ ХИМИЧЕСКОЙ СТАБИЛЬНОСТИ ПРЕПАРАТА ИНСУЛИНА | 1997 |
|
RU2182015C2 |
| НЕ СОДЕРЖАЩИЕ ЦИНК КРИСТАЛЛЫ ИНСУЛИНА ДЛЯ ПРИМЕНЕНИЯ В ЛЕГОЧНЫХ КОМПОЗИЦИЯХ | 1998 |
|
RU2198181C2 |
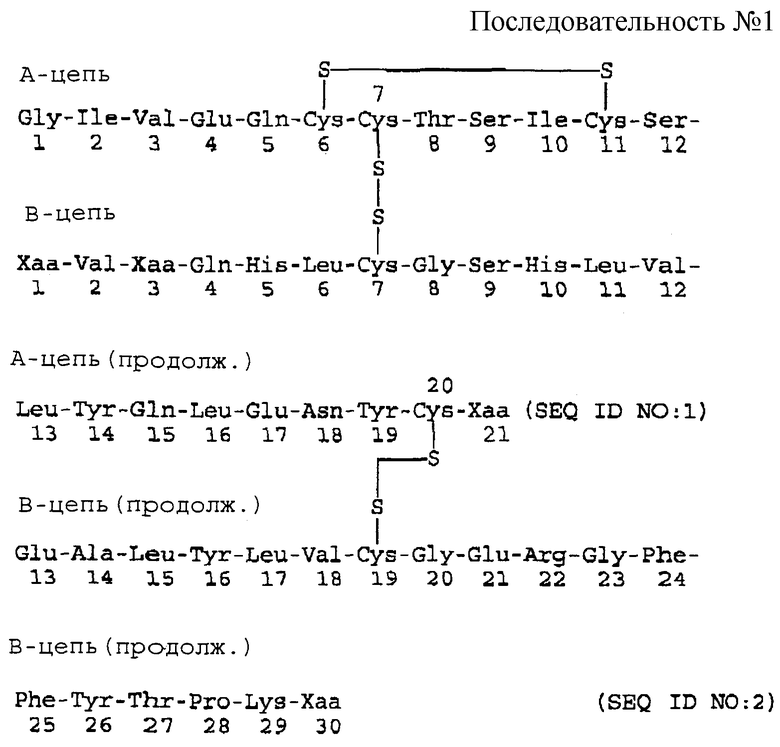










































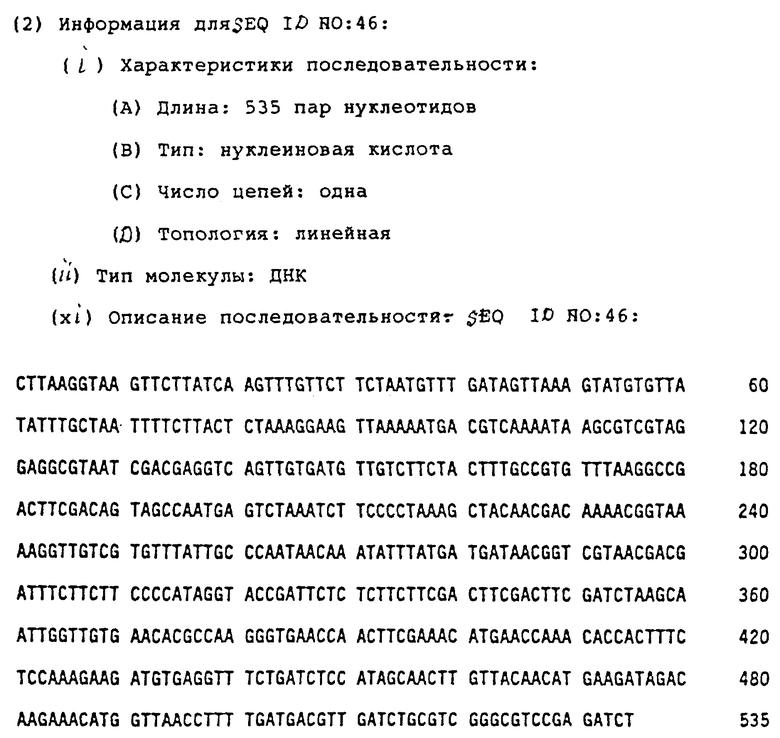











Описаны новое производное инсулина, имеющее аминокислотную последовательность SEQ ID NO : 2, где Xаа в положениях А21 и В3 являются независимо любым аминокислотным остатком, который может быть кодирован генетическим кодом, за исключением Lys, Arg, Cys; Xаа в положении В1 является Phe или удалена; Хаа в положении В30 является (а) любым аминокислотным остатком, который может быть кодирован генетическим кодом, за исключением Lys, Arg, Cys, и в этом случае ε- аминогруппа LysВ29 имеет липофильный заместитель или (в) удалена, и в этом случае ε- аминогруппа LysВ29 имеет липофильный заместитель; и любые его комплексы с Zn2+, при условии, что когда Хаа в положении В30 оба являются Thr, Ala, Хаа в положении А21 и В3 оба являются Asn, Хаа в положении В1 являются Phe, тогда производное инсулина представляет собой Zn2+комплекс. Также раскрыты растворимая пролонгированная фармацевтическая композиция на его основе и способ пролонгирования гипогликемического действия. Изобретение может быть использовано в медицине при лечении диабета. 3 с. и 17 з.п. ф-лы, 3 табл., 3 ил. 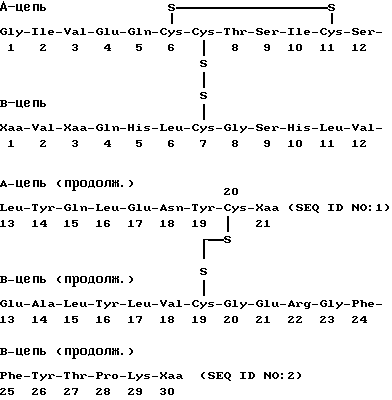

в которой Xaa в положениях A21 и B3 являются независимо любым аминокислотным остатком, который может быть кодирован генетическим кодом, за исключением Lys, Arg и Cys;
Xaa в положении B1 является Phe или удалена; Xaa в положении B30 является (a) любым аминокислотным остатком, который может быть кодирован генетическим кодом, за исключением Lys, Arg и Cys, и, в этом случае ε-аминогруппа LysB29 имеет липофильный заместитель; или (в) удалена, и в этом случае ε-аминогруппа LysB29 имеет липофильный заместитель; и любые его комплексы с Zn2+, при условии, что когда Xaa в положении B30 является Thr или Ala, Xaa в положении A21 и B3 оба являются Asn, и Xaa в положении B1 является Phe, тогда производное инсулина представляет собой Zn2+ комплекс.
Приоритеты по пунктам:
17.09.93 по пп.1 - 20;
02.02.94 по пп.1 - 20 (уточнение притязаний).
| Patent Abstracts of Japan, vo1 | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Способ получения человеческого инсулина формулы I @ -Т @ -ОН или его производных | 1982 |
|
SU1554766A3 |
| RU 95110109 А1, 10.05.1997 | |||
| Огнетушитель | 0 |
|
SU91A1 |
| ПРИБОР ДЛЯ РАСШИФРОВКИ ОСЦИЛЛОГРАММ | 1967 |
|
SU214826A1 |
| ЭЛЕКТРОМАГНИТНЫЙ ПРИВОД ТРУБОПРОВОДНОЙ | 0 |
|
SU375437A1 |
| РЕАГЕНТ-СОБИРАТЕЛЬ | 0 |
|
SU383472A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
2001-03-27—Публикация
1994-09-16—Подача