Изобретение относится к биотехнологии, в частности к способам увеличения пролиферативной активности клеток беспозвоночных животных, а именно эмбриональных клеток морских ежей, и может быть использовано в клеточной биологии и морской биотехнологии для получения постоянных клеточных культур морских беспозвоночных с последующим использованием их в научных и практических целях, для получения биологически активных веществ.
Проблема увеличения пролиферативной активности клеток беспозвоночных животных очень актуальна, так как для решения многих задач вирусологии и биотехнологии требуются постоянные линии клеток морских беспозвоночных с высоким потенциалом роста, которые в настоящее время практически отсутствуют.
Известны способы увеличения пролиферативной активности клеток морских беспозвоночных путем введения в культуральную среду различных биологически активных веществ: факторов роста для клеток моллюсков (Odintsova N.A., Nesterov A. M. , Korchagina D.A. A growth factor from tissues of the mussel Mytilus edulis. Соmр. Bioch. Physiol., 1993, v. 105 A, N 4, p. 667-671), лектинов для клеток губок (Pomponi S., Willoughby R., Kaaighn M.E., Wright A. E. Development of techniques for in vitro production of bioactive natural products from marine spongers. Invert. Cell Cult. Novel directions and biotechnology applications, 1997; К.Maramorosch, J.Mitsuhashi (eds.). Sci. Publishers, Inc. USA, р. 231-236) или моллюсков и иглокожих (Odintsova N. A., Belogortseva N.I., Ermak A.V., Molchanova V. I., Luk'yanov P.A. Adhesive and growth properties of lectin from the ascidian Didemnum Ternatanum on cultivated marine invertebrate cells. Biochem. Biophys. Acta., 1999, v. 1448, p. 381-389).
Однако в вышеуказанных способах отмечено лишь незначительное увеличение пролиферативной активности клеток - удвоение количества клеток происходит в течение 2-3 недель.
Известен способ увеличения пролиферативной активности клеток морских беспозвоночных путем использования оптимальных субстратов, в частности коллагена для клеток моллюсков (Odintsova N.A., Ermak A.V., Tsal L.G. Substrate selection for long-term cultivation of marine invertebrate cells. Соmр. Bioch. Physiol., 1994, v. 107A, N 4, p. 613-619).
Недостатком данного способа является медленный рост клеток, за 20 дней их количество возрастало всего в 2 раза. Кроме того, этот метод не применим для стимулирования клеток иглокожих, так как коллаген токсичен для данной группы животных.
Наиболее близким по технической сущности к изобретению является способ увеличения пролиферативной активности клеток морских беспозвоночных, (устриц), описанный в статье Эллис (Ellis L.L. Electroporation of oyster cells. In vitro Cell Devel. Biol., 1991, v.27, N 2, p. 42A), основными особенностями которого являются: введение чужеродных генов (онкогенов ras и mуе) в соматические клетки устрицы электропорацией.
Несмотря на то, что эти чужеродные гены работали в исследуемой системе, они практически не оказывали влияния на увеличение пролиферативной активности клеток. Кроме того, для электропорации нужно специальное дорогостоящее оборудование, что значительно усложняет процесс получения трансгенных клеток. В результате из-за низкой эффективности и сложности самого способа данный метод не нашел практического применения.
Задача изобретения - разработка нового способа увеличения пролиферативной активности клеток морских беспозвоночных.
Поставленная задача решается тем, что в известном способе увеличения пролиферативной активности клеток морских беспозвоночных, включающем введение чужеродного гена, согласно изобретению в качестве чужеродного гена берут ген gal4 в составе плазмиды pMA563, а в качестве клеток морских беспозвоночных берут эмбриональные клетки морских ежей, полученные путем диссоциации бластул, с последующей обработкой полученных трансгенных клеток 5-10%-ным раствором полиэтиленгликоля.
Применение в способе в качестве чужеродного гена - гена gal4 позволило значительно повысить пролиферативную активность клеток морских ежей, за счет того, что белок, кодируемый этим геном, является универсальным активатором транскрипции эукариот. Промоторы генов ростовых факторов морских ежей содержат мотив, с которым связывается этот белок, активируя экспрессию генов. Ген gal4 вводят в составе генно-инженерной конструкции (Ptashne M., Gann A. Activators and targets. Nature (London), 1990, v. 346, p. 329-331) - плазмиды, содержащей полнофункциональный ген (рМА563). Встраивание чужеродного гена (gаl4) и его экспрессия были доказаны методами геноспецифической полимеразной цепной реакцией (ПЦР) и реакцией обратной транскрипции (ОТ ПЦР).
Использование клеток морских ежей обеспечивает значительное увеличение пролиферативной активности, так как морские ежи являются источником ценных биологически активных веществ, в частности плоский морской еж Echinarachnus mirabilis содержит эхинохром, обладающий уникальными терапевтическими свойствами. Продукция биологически активных веществ, представляющих фармакологический и промышленный интерес, "в пробирке" может стать альтернативой химическому синтезу или аквакультуре. В способе могут быть использованы клетки морских ежей различных видов, в частности Strongylocentrotus inlermedius, Strongylocentrotus nudus и Echinarachnius mirabilis.
Достижение заявленного технического результата обеспечивается использованием в качестве объекта исследования эмбриональных клеток морских ежей, полученных путем диссоциации именно бластул, а использование для трансформации эмбриональных клеток более ранних или более поздних стадий развития не приводит к желаемому результату.
Обработка полученных трансгенных клеток раствором полиэтиленгликоля (ПЭГ) в концентрации 5-10% улучшает эффективность способа. Трансформация клеток геном gаl4 в составе плазмиды рМА563 без последующей обработки ПЭГом или при концентрациях меньше 5% не эффективна. Концентрации ПЭГа больше 10% токсичны для клеток морских беспозвоночных.
Предпочтительно использовать ПЭГ с молекулярной массой 3000 или 4000. ПЭГ с молекулярной массой меньше 3000 и больше 4000 не обеспечивает повышение пролиферативной активности эмбриональных клеток морских ежей, полученных путем диссоциации бластул.
Известно использование гена gal4 для клеток другого беспозвоночного, в частности для мухи-дрозофилы. Однако ген gal4 в данном способе помогает переносу чужеродного гена, а не способствует увеличению пролиферативной активности клеток (Porth P. Gal4 in the Drosophila female germiline. Mechanism of Devel., 1998, v. 78, p. 113-118).
Способ осуществляется следующим образом.
Морских ежей (Strongylocentrotus intermedium, Strongylocentrotus nudus и Echinarachnius mirabilis} индуцируют к нересту электрическим шоком или инъекциями в полость животных 0.5 М раствора КСl. Оплодотворенные яйцеклетки выращивают до стадии бластулы, диссоциируют их на клетки, инкубируют с геном gаl4 в составе плазмиды, затем добавляют автоклавированный полиэтиленгликоль (3000 или 4000), приготовленный на морской воде до конечной концентрации 5-10% и инкубируют при 15-20oС в течение 20-30 минут. В качестве контроля используют необработанные клетки и клетки, трансформированные урезанным геном gаl4 в составе плазмиды рМА564. Эффективность способа оценивают с помощью известной методики путем прямого подсчета числа клеток в камере Горяева и оценке уровня синтеза ДНК (Odintsova N.A., Belogortseva N.I., Ermak A.V., Molchanova V. I. , Luk'yanov P.A. Adhesive and growth properties of lectin from the ascidian Didemnum Tematanum on cultivated marine invertebrate cells. Biochem. Biophys. Acta., 1999, v. 1448, p. 381-389).
Пример 1. Берут морских ежей Strongylocentrotus intermedius. Нерест морских ежей индуцируют инъекциями в полость животных 0.2-0.4 мл 0.5 М раствора КСl. Искусственно оплодотворенные яйцеклетки выращивают до стадии бластулы, помещая их на 12 часов в сосуды со стерильной морской водой при 17oС, затем полученные бластулы собирают с помощью капроновой ткани с размером ячеи 50 мкм, промывают в искусственной морской воде, после чего центрифугируют для концентрирования в небольшом объеме.
Бластулы диссоциируют на клетки обработкой 0.1%-ным раствором коллагеназы в течение 20-30 мин при 15oС. Полученную клеточную суспензию пипетируют в течение 1 мин для разделения оставшихся агрегатов на отдельные клетки, центрифугируют в течение 10 минут при 2000 g, промывают дважды в стерильной морской воде, содержащей пенициллин 500 ед/мл и гентамицин 40 мкг/мл, а затем переводят в питательную среду. В качестве питательной среды используют модифицированную стандартную среду Лейбовича (L 15-M)(Odintsova N.A., Ermak A.V., Tsal L.G. Substrate selection for long-term cultivation of marine invertebrate cells. Соmр. Bioch. Physiol., 1994, v. 107A, N 4, p. 613-619).
Берут три параллели суспензии диссоциированных клеток в количестве 10-15•106 клеток/мл, каждую, затем:
- в первую, добавляют ген gаl4 в составе плазмиды рМА563 (1 мкг/мл);
- во вторую, добавляют урезанный ген gal4 в составе плазмиды рМА564 (1 мкг/мл);
- в третью, вообще не добавляют чужеродный ген.
Через 1 мин добавляют ПЭГ (3000), приготовленный на морской воде, до конечной концентрации 5% и инкубируют в камере при 17oС в течение 15-20 минут, затем по каплям добавляют 9 объемов стерильной морской воды и осаждают клетки при 500 g в течение 50-60 секунд. Осадок клеток ресуспендируют в питательной среде в концентрации 2-3•106 клеток/мл и переносят в сосуды для культивирования. Дальнейшую инкубацию клеток проводят при 17-18oС. Через сутки питательную среду заменяют на свежую, а затем смену среды проводят каждые 2-3 дня. Количество клеток в сливах просчитывают в камере Горяева. В течение всего периода культивирования клеток их жизнеспособность оценивают с помощью окраски витальным красителем трипановым синим.
Для оценки количества клеток в данном эксперименте использовали только две параллели - 1 и 3 (клетки, обработанные геном gal4 в составе плазмиды рМА563, и контрольные клетки). Количество трансгенных клеток, обработанных плазмидой рМА563, в фазе экспоненциального роста удваивалось каждые 2 дня, см. фиг.1 (•). Общее количество трансгенных клеток за время культивирования (2 месяца) возросло примерно в 9 раз (рМА563), тогда как в контроле только в 3 раза, и контрольные клетки деградировали за 2 недели, фиг.1 (▪).
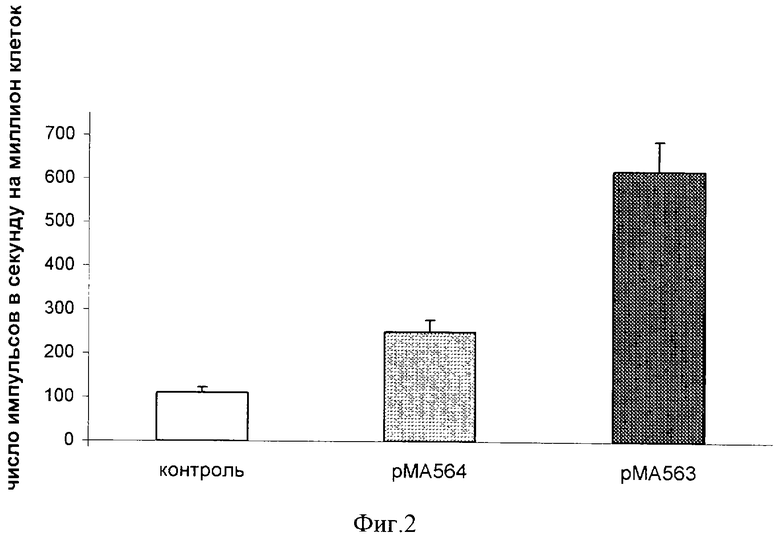
На фиг.2 представлены результаты определения синтеза ДНК в клетках всех трех параллелей, культивированных трое суток. Уровень синтеза ДНК в трансгенных клетках, обработанных плазмидой рМА563, увеличивался в 5 раз по сравнению с таковым контрольных клеток, а в трансгенных клетках, обработанных плазмидой рМА564, - 2.5 раза (фиг.2).
Пример 2. Нерест плоских морских ежей Echinarachnius mirabilis, индуцируют электрическим шоком. Искусственно оплодотворенные яйцеклетки выращивают до стадии бластулы (11-12 ч после оплодотворения при 17oС) и диссоциируют на клетки, как описано в примере 1. Все последующие процедуры, такие же как в примере 1, за исключением того, что используют ПЭГ с м.м. 4000 при конечной концентрации 10%.
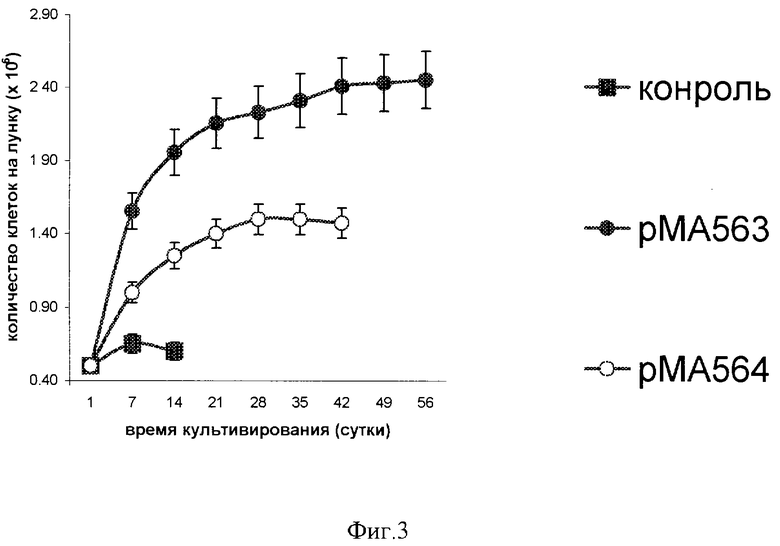
Количество клеток определяли во всех трех параллелях. Количество трансгенных клеток, обработанных плазмидой рМА563, в фазе экспоненциального роста удваивалось каждые 3 дня, см. фиг.3 (•), а их общее количество за 2 месяца культивирования возросло в 4,5 раза, тогда как в трансгенных клетках, обработанных плазмидой рМА564, - в 2,8 раза (о), а в контроле рост клеток был незначительным (в пределах ошибки эксперимента).
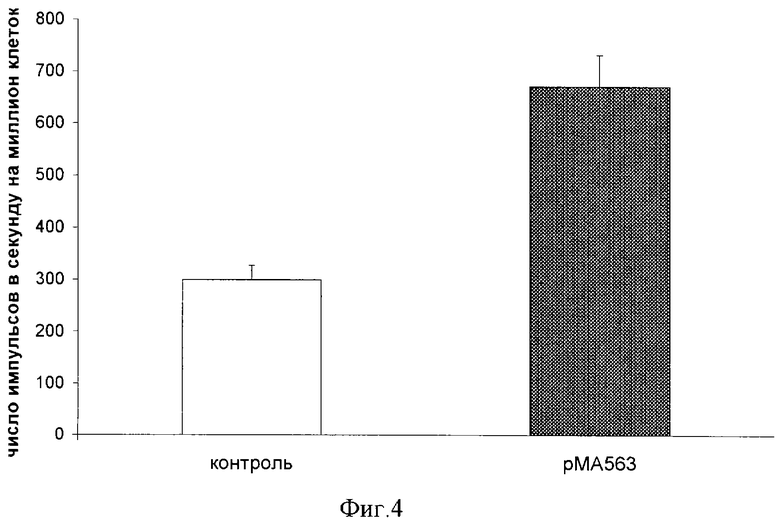
Синтез ДНК определяли в клетках 1-й и 3-й параллели (клетки, обработанные геном gаl4 в составе плазмиды рМА563, и контрольные клетки). Уровень синтеза ДНК в трансгенных клетках, обработанных плазмидой рМА563, возрастал в 2,5 раза по сравнению с контрольными клетками, см. фиг.4.
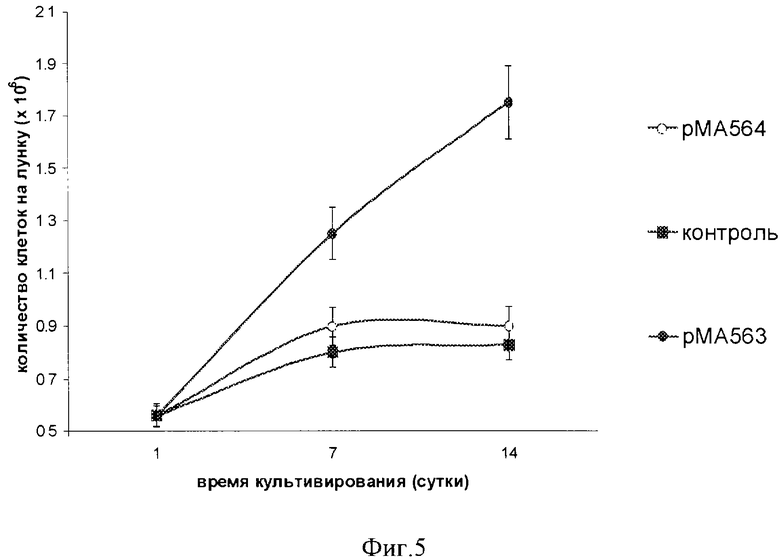
Пример 3. Источником материала служат эмбрионы морских ежей Strongylocentrotus nudux на стадии бластулы, полученные путем искусственного оплодотворения, как описано в примере 1. Все процедуры такие же, как и в примере 1, за исключением того, что используют ПЭГ (м.м. 4000) при его конечной концентрации 7.5%. Количество клеток определяли во всех трех параллелях. Общее количество клеток в трансгенных клетках, обработанных плазмидой рМА563, за 14 суток культивирования возросло в 3.6 раза (•), тогда как в трансгенных клетках, обработанных плазмидой рМА564 (о) и контрольных клетках (▪) - в 1.6-1.7 раза, см. фиг.5.
Таким образом, как видно из приведенных примеров, заявляемый способ расширяет ассортимент методов, которые позволяют получить быстрорастущие клетки, а именно позволяет значительно повысить пролиферативную активность клеток различных видов морских ежей и получить клетки с высоким потенциалом роста. Все ранее предложенные методы показывают гораздо более низкую эффективность по сравнению с заявляемым способом. Трансформация эмбриональных клеток морского ежа полнофункциональным геном gаl4 в составе плазмиды рМА563 приводит к увеличению пролиферативной активности в 4-5 раз и синтеза ДНК в 2-5 раз. Удвоение количества клеток происходит за 2-6 суток.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КРИОСОХРАНЕНИЯ КЛЕТОК МОРСКИХ БЕСПОЗВОНОЧНЫХ | 2006 |
|
RU2314687C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИНИМАЛЬНОГО ЗНАЧЕНИЯ СОЛЕНОСТИ МОРСКОЙ ВОДЫ, НЕОБХОДИМОГО ДЛЯ ВОСПРОИЗВОДСТВА ДАННЫХ МОРСКИХ БЕСПОЗВОНОЧНЫХ И/ИЛИ ИЗМЕНЕНИЯ АДАПТИВНЫХ ВОЗМОЖНОСТЕЙ ИХ РАННИХ СТАДИЙ РАЗВИТИЯ | 1992 |
|
RU2080785C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФУНКЦИОНАЛЬНОГО ПРОДУКТА ИЗ МИДИИ MYTILUS GALLOPROVINCIALIS | 2020 |
|
RU2743060C1 |
| Способ получения эмбриональных клеток двустворчатого моллюска МIZUснорестеN YeSSoeNSIS | 1990 |
|
SU1745767A1 |
| Способ получения нафтохинонов из морских ежей | 2016 |
|
RU2645077C1 |
| Способ определения гонадотропной активности химических соединений | 1989 |
|
SU1741687A1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ДВУСТВОРЧАТЫХ МОЛЛЮСКОВ | 2013 |
|
RU2538396C1 |
| ТРАНСГЕНЕЗ У МЛЕКОПИТАЮЩИХ ПУТЕМ ИНТРАЦИТОПЛАЗМАТИЧЕСКОЙ ИНЪЕКЦИИ СПЕРМЫ | 1999 |
|
RU2267270C2 |
| СПОСОБ КРИОСОХРАНЕНИЯ МОРСКИХ МИКРОВОДОРОСЛЕЙ | 2012 |
|
RU2496318C1 |
| Способ получения кальцийсодержащей композиции из панциря морских ежей | 2015 |
|
RU2611847C1 |
Изобретение относится к биотехнологии, в частности к способам увеличения пролиферативной активности клеток беспозвоночных животных, а именно эмбриональных клеток морских ежей. Предлагаемый способ предусматривает введение в эмбриональные клетки морских ежей, полученные путем диссоциации бластул, чужеродного гена ga14 в составе плазмиды рМА563. Далее трансгенные клетки обрабатывают 5-10%-ным раствором полиэтиленгликоля с молекулярной массой 3000-4000. Предложенный способ позволяет значительно повысить пролиферативную активность клеток морских ежей и получить клетки с высоким потенциалом роста. Изобретение может быть использовано в клеточной биологии и морской биотехнологии для получения постоянных клеточных культур морских беспозвоночных с последующим использованием их в научных и практических целях и для получения биологически активных веществ. 1 з.п. ф-лы, 5 ил.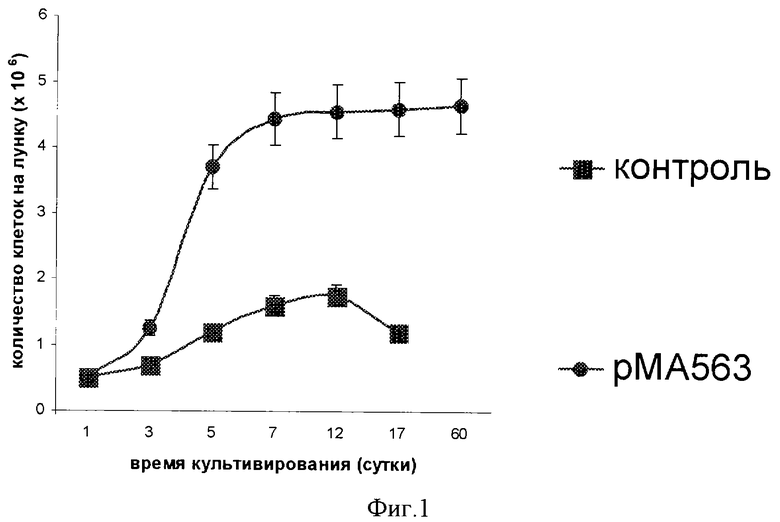
| ELLIS L.L | |||
| Electroporation of oyster cells, In vitro Cell Devel | |||
| Biol., 1991, v.27, n.2, p.42A | |||
| ODINTSOVA N | |||
| A | |||
| et al | |||
| A growth factor from tissues of the mussel Mutilis edulis, Соmр | |||
| Bioch | |||
| Physiol., 1993, v.105 A, n.4, p.667-671 | |||
| ODINTSOVA N | |||
| A | |||
| et al | |||
| Adhesive and growth properties of lectin from the ascidian Didemnum Ternatanum on cultivated marine invertebrate ceels, Biochem | |||
| Biophys | |||
| Acta., 1999, v.1448, p.381-389 | |||
| СПОСОБ СТИМУЛЯЦИИ ПРОЛИФЕРАТИВНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ | 2000 |
|
RU2167196C1 |
Авторы
Даты
2003-06-10—Публикация
2002-04-04—Подача