Изобретение относится к фармацевтическим препаратам 8 -хлор-6,11-дигидро-11-(4-пиперидилиден)-5Н-бензо[5,6] циклогепта[1,2-b] пиридина, известного под названием дескарбоэтоксилоратадин (ДКЛ).
ДЕСКАРБОЭТОКСИЛОРАТАДИН
ДКЛ является метаболическим производным лоратадина - антагониста рецептора гистамина Н-1. Рецепторы гистамина Н-1 являются посредниками в антагонистическом отклике обычных антигистаминов. Показано, что лоратадин сравним по антигистаминной активности с терфенадином и астемизолом и в пересчете на миллиграмм вещества является вчетверо более сильнодействующим, чем терфенадин, в ингибировании аллергического бронхоспазма.
Показано также, что лоратадин эффективен при лечении многих расстройств, в том числе катаров верхних дыхательных путей, хронической крапивницы, сезонного аллергического ринита и сезонного и хронического ринита. Благодаря своему антигистаминному действию, лоратадин может быть полезен также при лечении аллергической астмы, диабетической ретинопатии и других нарушений состояния мелких сосудов, связанных с сахарным диабетом.
Употребление антигистаминов часто связано с отрицательными побочными эффектами, к которым относятся, например, седативное действие, головные боли, сухость во рту, запоры или поносы, увеличение веса и желудочно-кишечные расстройства. Лоратадин относится к классу антигистаминов, называемых неседативными антигистаминами. Этот класс включает также два других хорошо известных антигистамина, а именно, терфенадин и астемизол. Показано, что лоратадин обладает значительно меньшим седативным действием по сравнению с терфенадином, и что явления усталости, головные боли и тошнота, связанные с лоратадином, сравнимы с аналогичными явлениями, наблюдаемыми при употреблении терфенадина.
Как недостаток неседативных антигистаминов отмечено, что соединения этого класса вызывают другие сильные электрофизиологичекие побочные эффекты. Эти побочные эффекты включают фибрилляции желудочков и сердечные аритмии, например, желудочковые тахиаритмии или трепетание-мерцание желудочков. Сообщается о возникновении некоторых из этих серьезных сердечно-сосудистых побочных эффектов у "здоровых" пациентов, принимавших терфенадин одновременно с кетоконазолом либо эритромицином. Аритмии наблюдались также при совместном приеме астемизола с эритромицином и астемизола с эритромицином и кетоконазолом. Кроме того, известно, что кетоконазол, интраконазол и эритромицин, взятые каждый в отдельности, интерферируют с цитохромом Р450 и, таким образом, ингибируют метаболизм неседативных антигистаминов, например, терфенадина и астемизола. Поэтому, ввиду подобия фармакологического действия лоратадина, терфенадина и астемизола, необходимо также избегать употребления лоратадина одновременно с кетоконазолом, интраконазолом или макролидными антибиотиками, например, эритромицином.
Еще одним недостатком как астемизола, так и лоратадина является то, что прием каждого из этих лекарственных средств связан с ростом как меланом, так и фибросарком. Дозировка лоратадина при этом наблюдении составляла 10 мг в день.
Хотя лоратадин хорошо абсорбируется, он подвергается экстенсивному метаболизму с образованием в качестве основного метаболита фармакологически активного дескарбоэтоксилоратадина (ДКЛ). Следует отметить, что патент США 5595997, выданный 21 января 1997 г., указывает, что ДКЛ, обеспечивая эффективную неседативную антигистаминную терапию, в то же время позволяет избегнуть многих, часто сильных отрицательных, побочных эффектов, обычно связанных с употреблением как антигистаминов вообще, так и других неседативных антигистаминов, например, лоратадина, терфенадина и астемизола, в частности.
Важное значение имеет то, что, как показано, ДКЛ в 5-7 раз менее активен в отношении провоцирования опухолей и что ДКЛ является по крайней мере в 12 раз более мощным рецептором гистамина по сравнению с лоратадином. Таким образом, фармацевтические препараты, содержащие ДКЛ или его фармацевтически приемлемую соль в качестве активного ингредиента, весьма желательны.
Краткое описание изобретения
Признавая целесообразность фармацевтических препаратов, содержащих ДКЛ, мы пришли к заключению, что в типичных условиях производства и хранения ДКЛ неустойчив и теряет свойства в присутствии лактозы - соединения, обычно употребляемого в качестве наполнителя в различных фармацевтических формах, например, в таблетках, капсулах или порошках. Со временем лактоза и ДКЛ образуют коричневый продукт, что соответствует высокой степени разложения ДКЛ. Интенсивность коричневой окраски, как правило, зависит от количества присутствующего ДКЛ, условий хранения, например, влажности и температуры, а также от длительности хранения.
Стабильность фармацевтического продукта можно определить как способность определенной композиции в конкретной упаковке сохранять соответствие физическим, химическим, микробиологическим, терапевтическим и токсикологическим требованиям (хотя имеются исключения) и сохранять, по крайней мере, 90% уровня активности, указанного в описании продукта. Таким образом, например, допустимый срок употребления определяется как время, в течение которого фармацевтический продукт остается стабильным при условии хранения в рекомендуемых условиях.
На стабильность фармацевтического продукта могут влиять различные факторы, в том числе стабильность терапевтического ингредиента (ингредиентов), потенциальное взаимодействие между терапевтическими и неактивными ингредиентами и т.д. Кроме того, как указано выше, химические взаимодействия и потеря качества продукта могут ускоряться или инициироваться физическими факторами, например, теплом, светом и влажностью.
Не намереваясь ограничиваться никакой конкретной теорией, отметим, что в данном случае принято считать, что лактоза может вступать в реакцию с ДКЛ, разлагая его с образованием енамина. Такая реакция может проходить также с участием других реакционноспособных наполнителей, например, других моно- или дисахаридов. Поэтому весьма желательными являются устойчивые фармацевтические препараты ДКЛ или его фармацевтически приемлемой соли в форме смесей, гранулированных или прессованных.
Настоящее изобретение относится к устойчивым фармацевтическим препаратам ДКЛ, в которых ДКЛ находится в смеси с одним или несколькими наполнителями, включающими смесевые, гранулированные или прессованные дозированные формы, но не ограниченным ими, в которых исключена несовместимость между ДКЛ и реакционноспособными наполнителями, например, лактозой и другими моно- или дисахаридами.
Соответственно, предпочтительный вариант осуществления настоящего изобретения обеспечивает устойчивые фармацевтические препараты, практически не содержащие реакционноспособных наполнителей, например, лактозы или других моно- или дисахаридов, в смешанной или гранулированной форме, содержащие дескарбоэтоксилоратадин либо его фармацевтически приемлемую соль и один или несколько фармацевтически приемлемых инертных наполнителей. В другом варианте осуществления настоящее изобретение относится к химически устойчивым фармацевтическим препаратам в смешанных или гранулированных дозированных формах, которые практически не содержат реакционноспособных наполнителей и содержат от приблизительно 1% (мас.) до приблизительно 50% (мас.) ДКЛ либо его фармацевтически приемлемой соли и от приблизительно 99% (мас.) до приблизительно 50% (мас.) по крайней мере одного фармацевтически приемлемого инертного наполнителя. Препараты обеспечивают эффективное неседативное антигистаминное действие, но исключают отрицательные побочные эффекты, часто сильные, связанные с употреблением других антигистаминов. Таким образом, раскрываемые препараты обладают преимуществом при лечении многочисленных расстройств, вызываемых гистаминами, включающих аллергический ринит, аллергическую астму, крапивницу, симптоматический дермографизм, диабетическую ретинопатию и другие нарушения состояния мелких сосудов, связанные с сахарным диабетом, но не исчерпывающихся перечисленными заболеваниями.
Кроме того, поскольку раскрываемые препараты исключают эффекты, связанные с другими неседативными антигистаминами, исключено также взаимодействие между этими препаратами и агентами, ингибирующими цитохром Р450. Перечень таких агентов включает кетоконазол, интраконазол и макролиды, например, эритромицин, но он не исчерпывается указанными средствами.
Помимо активного ингредиента ДКЛ, раскрываемые препараты могут содержать также терапевтически эффективное количество нестероидного противовоспалительного агента или другого анальгетика ненаркотического типа, например, ацетилсалициловой кислоты, ацетаминофена, ибупрофена, кетопрофена или напроксена. Такие комбинированные препараты обладают преимуществом при лечении кашля, насморка, простуды и/или гриппа и дискомфорта, головных и других болей, лихорадочных состояний и общего недомогания, связанного с такими заболеваниями.
Другие комбинированные препараты, эффективные при лечении этих симптомов, могут содержать, наряду с анальгетиками, терапевтически эффективное количество одного или нескольких других активных компонентов, например, противоотечного или противозастойного средства, например, псевдоэфедрина, средства против кашля, например, декстрометорфана, либо отхаркивающего средства, например, гуаифенезина.
Интересен тот факт, что, как показали наши исследования, в отсутствие несвязанной воды разложение ДКЛ в препаратах, содержащих лактозу, идет очень медленно либо не происходит вообще. Хотя в типичных условиях упаковки и хранения дозированные формы фармацевтических препаратов ДКЛ могут подвергаться воздействию несвязанной воды, например, в виде атмосферной влаги, известны технологии производства и хранения, в которых воздействие несвязанной воды ограничено или исключено.
Кроме того, хотя для приготовления раскрываемых фармацевтических препаратов ДКЛ могут быть использованы другие наполнители, кроме лактозы, без отрицательных последствий для технологичности и терапевтической эффективности препаратов, лактоза, высушенная методом распылительной сушки, по-прежнему остается предпочтительным наполнителем. Высушенная методом распылительной сушки лактоза относится к лучшим наполнителям для прессованных форм по своей текучести и весьма эффективна для препаратов малых доз (менее 50 мг на дозу), где прессуемость активного ингредиента не играет большой роли. См., например, Р. Шангроу, "Выбор процессов приготовления и наполнителей с особым рассмотрением прямого прессования", материал курса "Технология гранулирования, таблетирования и капсулирования", Центр профессионального усовершенствования, Ист-Брунсвик, шт. Нью-Джерси (1996) (R. Shangraw, Selection of Manufacturing Process and Excipients with an Emphasis on Direct Compression, Course material from Granulation, Tableting and Capsule Technology, Center for Professional Advancement, East Brunswick, N.J. (1996)). Поэтому желательно по возможности включать лактозу в число доступных потенциальных наполнителей при разработке твердых дозированных форм.
Соответственно, еще один вариант осуществления настоящего изобретения охватывает негигроскопичные фармацевтические препараты, содержащие ДКЛ или его фармацевтически приемлемую соль и, по крайней мере, один фармацевтически приемлемый наполнитель. Негигроскопичные фармацевтические препараты в соответствии с настоящим изобретением могут содержать наполнители, практически не содержащие несвязанную воду, т. е. воду, которая может участвовать во взаимодействии ДКЛ с реакционноспособными наполнителями, к примеру, во взаимодействии ДКЛ с лактозой; такие наполнители включают лактозу и другие реакционноспособные наполнители, например, другие моно- или дисахариды.
Следует отметить, что негигроскопичные фармацевтические препараты в соответствии с настоящим изобретением могут, тем не менее, содержать некоторые гигроскопичные ингредиенты; однако препарат в целом должен быть практически негигроскопичным. Далее, наполнители, пригодные для использования в таких негигроскопичных фармацевтических препаратах, включают гидратированные наполнители, например, моногидрат альфа-лактозы и т.п.
Традиционно при приготовлении фармацевтических препаратов или композиций активный ингредиент или терапевтический агент (например, ДКЛ) размалывают и/или просеивают для уменьшения размеров частиц и получения более узкого распределения частиц по размерам (узкой гранулометрической фракции). Чаще всего это выполняют с целью оптимизации различных физико-химических характеристик композиции, таких как облегчение растворения, равномерность содержания, биодоступность активного ингредиента и т.п. Однако удельная поверхность частиц ДКЛ в фармацевтическом препарате или композиции может оказать влияние на взаимодействие между ДКЛ и реакционноспособными наполнителями, например, лактозой.
Таким образом, еще один вариант осуществления настоящего изобретения охватывает фармацевтические препараты для лечения расстройств, вызываемых гистаминами, содержащие ДКЛ или его фармацевтически приемлемую соль, состоящую из крупных частиц, и фармацевтически приемлемый носитель. Фармацевтически приемлемые носители, пригодные для использования в этих препаратах, могут содержать один или несколько наполнителей, выбранных из группы, состоящей из инертных и реакционноспособных наполнителей, например, лактозы или других моно- или дисахаридов. Эти "крупнозернистые" фармацевтические препараты ДКЛ имеют приемлемые физико-химические характеристики (с точки зрения легкости растворения, равномерности содержания, биодоступности и т.п.), но исключают несовместимость с реакционноспособными наполнителями, например, лактозой.
В предпочтительном варианте осуществления изобретения ДКЛ или его фармацевтически приемлемая соль, присутствующая в препарате, имеет распределение частиц по размерам, в котором более чем приблизительно 40% по массе ДКЛ или его фармацевтически приемлемой соли содержит частицы размером 250 мкм или более.
Другой способ ингибирования или предотвращения взаимодействия между ДКЛ и реакционноспособными наполнителями, например, лактозой, в фармацевтическом препарате заключается в предотвращении контакта ДКЛ с реакционноспособными наполнителями в препарате. Один из способов достижения такого положения является нанесение на частицы ДКЛ инертного или нереакционноспособного покрытия перед смешиванием с реакционноспособными наполнителями. Предпочтительно, чтобы инертное покрытие не оказывало существенного влияния на фармакодинамические характеристики препарата (например, время до начала действия и адсорбцию in vivo).
Соответственно, еще один вариант осуществления настоящего изобретения относится к твердым фармацевтическим препаратам для лечения расстройств, вызываемых гистаминами, содержащим терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли с покрытием, которые содержат ДКЛ или его фармацевтически приемлемую соль в оболочке из инертного покрывающего агента и фармацевтически приемлемый носитель. В предпочтительном варианте ДКЛ или его фармацевтически приемлемую соль вначале гранулируют с инертным наполнителем, например, крахмалом, а затем на полученные гранулы наносят инертный или нереакционноспособный покрывающий агент. Затем полученный ДКЛ с покрытием можно смешивать с другими компонентами, в том числе с реакционноспособными наполнителями.
Пригодные инертные покрывающие агенты и методы нанесения покрытия на частицы или гранулы хорошо известны. Инертные покрывающие агенты, как правило, содержат инертный пленкообразующий агент, диспергированный в подходящем растворителе, и может, кроме того, содержать фармацевтически приемлемые добавки, например, красители и пластификаторы. Предпочтительно покрытие на частицы или гранулы ДКЛ наносят, используя способы нанесения пленки из водной или неводной среды либо микрокапсулирования. Перечень подходящих инертных пленкообразующих агентов включает (но не ограничен этими материалами) производные целлюлозы, например, метилцеллюлозу, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, метилгидроксиэтилцеллюлозу и натрийкарбоксиметилцеллюлозу; винилпроизводные, например, поливинилпирролидон; гликоли, например, полиэтиленгликоль, акриловые полимеры, например, сополимер диметиламиноэтилметакрилата со сложным эфиром метакриловой кислоты и сополимер этилакрилата с метилакрилатом; и другие углеводородные полимеры, например, мальтодекстрины и полидекстрозу. Предпочтительно инертный покрывающий агент содержит гидрофильный пленкообразующий агент, например, гидроксипропилметилцеллюлозу, так что абсорбция in vivo существенно не замедляется.
После нанесения на частицы или гранулы ДКЛ инертного покрывающего агента, ДКЛ в оболочке может быть переработан известными стандартными способами, в том числе (но не только) смешиванием, гранулированием, прессованием и сочетаниями этих способов, совместно с другими инертными и реакционноспособными наполнителями, например, лактозой, с получением различных дозированных форм, например, таблеток, капсулированных таблеток, капсул, пастилок и т.п.
ДКЛ может быть также приготовлен в виде быстрорастворимых дозированных препаратов, например, таких, которые описаны в патенте США 4371516 на имя Грегори и др. (Gregory et al.). Быстрорастворимые дозированные формы ДКЛ могут обладать особыми преимуществами в некоторых случаях употребления, поскольку эти дозированные формы обеспечивают быстрое поглощение ДКЛ в организме пациента. Термин "быстрорастворимый" в рамках настоящего описания означает, что дозированная форма или фармацевтический препарат быстро, например, в течение 10 с, распадается в воде. Время распада можно измерять, используя хорошо известные в практике методики, например, такие, которые изложены в патенте США 4371516. ДКЛ может быть введен также в "шипучие" дозированные формы, которые могут быть приготовлены хорошо известными способами. Шипучие дозированные формы содержат обычно, помимо активного ингредиента (например, ДКЛ), бикарбонат натрия и лимонную кислоту, винную кислоту либо бифосфат натрия. При смешении с водой выделяется диоксид углерода в результате реакции кислоты с основанием. Следует отметить, что быстрорастворимые или шипучие дозированные формы ДКЛ не должны приготовляться с добавкой реакционноспособных наполнителей, например, лактозы или других моно- или дисахаридов.
Соответственно, еще один вариант осуществления настоящего изобретения охватывает быстрорастворимые твердые фармацевтические дозированные формы для лечения расстройств, вызываемых гистаминами, содержащие матричную систему, несущую терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли, в которых матричная система содержит фармацевтически приемлемый водорастворимый или диспергируемый в воде носитель, не взаимодействующий с ДКЛ или его фармацевтически приемлемой солью.
Подходящие носители или быстрорастворимые инертные носители для использования в быстрорастворимых фармацевтических дозированных формах в соответствии с настоящим изобретением включают (но не ограничены ими) полипептиды, например, желатин, в частности, гидролизованный желатин; полисахариды, например, гидролизованный декстран или декстрин; альгинаты, например, альгинат натрия; и смеси этих веществ. Носитель может содержать также другие инертные добавки, например, поливиниловый спирт, поливинилпирролидон, гуммиарабик, маннит, сорбит, глицин и их смеси. См. патент США 4371516. Кроме того, носитель может содержать также фармацевтически приемлемые вспомогательные вещества, например, красители, отдушки, консерванты и т.п.
Еще один вариант осуществления настоящего изобретения предусматривает безводные фармацевтические препараты дескарбоэтоксилоратадина для лечения расстройств, вызываемых гистаминами, содержащие терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель или наполнитель. Носители или наполнители, пригодные для использования в безводных препаратах в соответствии с настоящим изобретением, включают инертные наполнители, пригодные для приготовления устойчивых фармацевтических препаратов, практически не содержащих реакционноспособных наполнителей в соответствии с настоящим изобретением, а также лактозы или других реакционноспособных наполнителей, например, моно- и дисахаридных наполнителей.
Безводные фармацевтические препараты следует приготовлять и хранить так, чтобы сохранять их практически безводное состояние. Например, такие препараты можно приготовлять с применением безводных или низкой влажности ингредиентов в условиях низкой влажности, так, чтобы получаемые фармацевтические препараты были практически безводными, т.е. не содержали несвязанной воды.
Кроме того, как и в случае других раскрываемых фармацевтических препаратов в смесевой, гранулированной или прессованной формах, практически не содержащих реакционноспособных наполнителей, негигроскопичные и безводные фармацевтические препараты ДКЛ могут содержать терапевтически эффективное количество противовоспалительного агента нестероидного типа или другого ненаркотического анальгетика, а также терапевтически эффективное количество одного или нескольких других активных компонентов, например, противоотечного или противозастойного средства, средства против кашля или отхаркивающего. Примеры таких терапевтических агентов включают все агенты, пригодные для препаратов ДКЛ, практически не содержащих реакционноспособные наполнители, например, лактозу.
Безводные фармацевтические препараты ДКЛ, приготовленные в соответствии с настоящим изобретением, должны приготовляться и храниться так, чтобы сохранить их безводное состояние. Соответственно, эти препараты следует упаковывать с применением известных материалов, предотвращающих воздействие влаги на препараты, обеспечивающих включение их в соответствующие наборы. Такие виды упаковки включают (но не ограничиваются ими) герметически уплотняемую фольгу, пластмассы и т.п., и упаковку единичиных доз, например, в блистеры или полоски. Эти формы упаковки могут также быть использованы для любых других дозированных форм, раскрываемых в настоящем описании.
Многочисленные другие преимущества и признаки настоящего изобретения ясны из нижеследующего подробного описания предпочтительных вариантов осуществления и пунктов формулы.
Подробное описание предпочтительного варианта осуществления изобретения
Хотя настоящее изобретение может быть осуществлено во множестве различных форм, ниже представлены предпочтительные варианты его осуществления. Следует понимать, однако, что настоящее описание необходимо рассматривать как пример, иллюстрирующий принципы изобретения, которое не ограничивается приведенными вариантами осуществления.
Как указано выше, фармацевтические препараты или композиции ДКЛ, содержащие лактозу или другие реакционноспособные наполнители, более быстро теряют качество под воздействием несвязанной воды, например, влажности. Добавление воды (например, 5%) широко распространено в фармацевтической практике в качестве способа моделирования длительного хранения с целью определения таких характеристик, как допустимый срок хранения или устойчивость композиции во времени. См. , например, Йенс Т. Картенсен, "Устойчивость лекарственных средств: Принципы и практика", изд. 2 (Jens Т. Cartensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80). Действительно, воздействие воды и температуры ускоряет исследование.
Дале, влияние воды на препарат имеет большое значение в связи с тем, что условия, способствующие влагопоглощению, например, воздействие окружающей влажности, обычно имеют место в процессах приготовления, переработки, упаковывания, хранения, перевозок и употребления препарата. Таким образом, ясно, что применения лактозы или других реакционноспособных наполнителей, например, моно- или дисахаридных наполнителей, в фармацевтических препаратах, содержащих ДКЛ, следует избегать в связи с существенным воздействием влаги и/или воды, которое испытывают препараты в нормальных условиях производства, упаковывания и хранения.
Стабильность фармацевтического продукта можно определить как способность определенной композиции в конкретной упаковке сохранять соответствие физическим, химическим, микробиологическим, терапевтическим и токсикологическим требованиям (хотя имеются исключения) и сохранять, по крайней мере, 90% уровня активности, указанного в описании продукта. Таким образом, например, допустимый срок употребления определяется как время, в течение которого фармацевтический продукт остается стабильным при хранении в рекомендуемых условиях.
На стабильность фармацевтического продукта могут влиять различные факторы, в том числе стабильность терапевтического ингредиента (ингредиентов), потенциальное взаимодействие или несовместимость между терапевтическими и неактивными ингредиентами (например, взаимодействие между ДКЛ и определенными наполнителями, например, лактозой) и т.д.
Разложение ДКЛ не происходит в присутствии других нереакционноспособных наполнителей. Термины "инертный наполнитель" и "нереакционноспособный наполнитель" в значении, употребляемом здесь, означают компоненты, включающие (но не ограниченные ими) связующие/наполнители, дезинтегрирующие добавки, смазывающие вещества, вещества, препятствующие слеживанию, диспергирующие вещества, консерванты, пленкообразующие покрывающие агенты, пластификаторы, поверхностно-активные вещества и т.п., совместимые и не реагирующие с ДКЛ в типичных условиях производства, упаковки и хранения. Инертные наполнители и нереакционноспособные наполнители, которые могут быть использованы в настоящем изобретении, хорошо известны в практике и включают (но не ограничиваются) мальтодекстрин, целлюлозу, фосфат кальция, дигидрофосфат кальция, карбонат кальция, тальк, стеарат кальция, дигидросульфат кальция и кукурузный крахмал. Кроме того, инертные или нереакционноспособные наполнители обеспечивают получение фармацевтического препарата, по своей технологичности и терапевтическому эффекту сравнимого с препаратами, содержащими лактозу.
Термин "инертный носитель" в значении, употребляемом здесь, означает носитель (основу), содержащий один или несколько инертных наполнителей или нереакционноспособных наполнителей.
Употребляемый здесь термин "реакционноспособный(ые) наполнитель(и)" относится к наполнителям, вступающим в реакцию с ДКЛ в присутствии несвязанной воды и охватывает, например, лактозу и другие моно- или дисахаридные наполнители. Термины "практически не содержащий реакционноспособных наполнителей", "практически не содержащий лактозы" и "не содержащий лактозы (свободный от лактозы)", употребляемые здесь, означают, что количество реакционноспособных наполнителей (наполнителя) или, соответственно, лактозы, в случае их присутствия в дозированной форме ДКЛ, недостаточно для возникновения несовместимости между ДКЛ и конкретным наполнителем (наполнителями), например, лактозой, которая, как обнаружено авторами настоящего изобретения, отрицательно влияет на эффективность ДКЛ, вызывая ее снижение до уровня ниже 90% исходного значения на протяжении срока хранения дозированной формы фармацевтического препарата. См. стандарты, изложенные в Фармакопее США (USP XXI/NF XVI). Как правило, количество любого реакционноспособного наполнителя, присутствующее в препаратах согласно настоящему изобретению, практически не содержащих реакционноспособных наполнителей, должно быть менее приблизительно 20% (мас.), предпочтительно менее приблизительно 10% (мас.) и более предпочтительно менее приблизительно 1% (мас.).
Термин "несвязанная вода", употребляемый здесь, относится к воде, не присутствующей в форме стабильного гидрата одного или нескольких компонентов фармацевтического препарата, например, моногидрата альфа-лактозы. Аналогично, термин "безводный", употребляемый здесь, означает, что количество несвязанной воды в случае ее присутствия в дозированной форме или фармацевтическом препарате ДКЛ, недостаточно для инициирования и/или ускорения несовместимости между ДКЛ и реакционноспособными наполнителями, например, лактозой. Далее, "безводные условия" в значении, употребляемом здесь, означают практическое отсутствие несвязанной воды, в том числе в виде влажности. Термин "негигроскопичный" в значении, употребляемом здесь, означает, что общая композиция или фармацевтический препарат практически негигроскопичны, т. е. не поглощают несвязанную воду в количествах, достаточных для инициирования и/или ускорения несовместимости между ДКЛ и реакционноспособными наполнителями, например, лактозой.
Термин "практически не содержащий несвязанной воды" означает, как правило, присутствие менее приблизительно 5% (мас.), предпочтительно менее приблизительно 1% (мас.), более предпочтительно менее приблизительно 0,1% (мас.) воды.
ДКЛ может присутствовать в фармацевтических препаратах, приготовленных в соответствии с настоящим изобретением, либо в виде свободного основания, либо в виде его фармацевтически приемлемой соли. "Фармацевтически приемлемая соль" означает соль, приготовленную из фармацевтически приемлемых нетоксичных органических или неорганических кислот или оснований. Примеры таких органических кислот включают, например, алифатические, ароматические, карбоновые и сульфоновые органические кислоты, например, муравьиную, уксусную, пропионовую, янтарную, гликолевую, глутаминовую, глюкуроновую, малеиновую, фуранкарбоновую, бензойную, антраниловую, салициловую, фенилуксусную, миндальную, эмбоновую, метансульфоновую, этансульфоновую, бензолсульфоновую, пантотеновую, стеариновую, сульфаниловую, галактуроновую и альгиновую. Примерами неорганических кислот являются хлороводородная, бромоводородная, иодоводородная, серная и фосфорная. Примеры органических оснований включают, например, N, N-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумаин (N-метилглюкамин), лизин и прокаин. Примеры неорганических оснований включают соли металлов: лития, алюминия, кальция, магния, калия, натрия и цинка.
Фармацевтические препараты в соответствии с настоящим изобретением могут также содержать (1) терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли и (2) терапевтически активное количество, по крайней мере, одного противовоспалительного агента нестероидного типа или ненаркотического анальгетика или его фармацевтически приемлемой соли.
Кроме того, раскрываемые препараты могут содержать (1) терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли и (2) терапевтически активное количество противоотечного или противозастойного средства или его фармацевтически приемлемой соли.
"Терапевтически эффективное количество" в случае ДКЛ или его фармацевтически приемлемой соли означает такое количество, которое обеспечивает терапевтический эффект при лечении и ведении расстройств, вызываемых гистаминами, которые включают (но не ограничены) аллергический ринит и другие аллергические расстройства, например, крапивницу, симптоматический дермографизм, дерматиты, аллергическую астму, диабетическую ретинопатию и другие нарушения состояния мелких сосудов, связанные с сахарным диабетом, и симптомы, связанные с аллергическим ринитом, например, кашель, насморк, симптомы простуды и/или гриппа, в том числе (но не только) чиханье, ринорея (слизетечение из носа), слезотечение и раздражение кожи.
Величина профилактической или терапевтической дозы ДКЛ при остром или хроническом течении заболевания варьирует в зависимости от тяжести состояния, подлежащего лечению. Дозировка и, возможно, также частота приема также варьируют в зависимости от возраста, массы тела и чувствительности конкретного пациента. В общем случае суммарная суточная доза при вышеописанных расстройствах лежит в пределах от приблизительно 0,1 мг до приблизительно 10 мг и принимается однократно или в несколько приемов. Предпочтительно суточная доза для перорального приема составляет от 0,1 до 5 мг и, более предпочтительно, от 0,2 до 1 мг.
Кроме того, рекомендуется, чтобы дети, пациенты в возрасте свыше 65 лет, а также пациенты с нарушениями функций почек и печени получали вначале уменьшенную дозу, а затем доза устанавливалась в зависимости от индивидуальной чувствительности или реакции крови. Для специалистов должно быть ясно, что в особых случаях может оказаться необходимым применение дозировок, лежащих за пределами вышеуказанных диапазонов. Далее, подразумевается, что клиницист или лечащий врач знает, как и когда следует прервать, уточнить или ограничить режим приема лекарства в зависимости от индивидуальной реакции пациента.
Термин "Терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли" охватывается вышеуказанными дозами. Кроме того, выражения "содержать (1) терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли и (2) терапевтически активное количество, по крайней мере, одного противовоспалительного агента нестероидного типа или ненаркотического анальгетика или его фармацевтически приемлемой соли" и "содержать (1) терапевтически эффективное количество ДКЛ или его фармацевтически приемлемой соли и (2) терапевтически активное количество противоотечного или противозастойного средства или его фармацевтически приемлемой соли" также охватываются вышеуказанными диапазонами дозирования и схемами приема.
Фармацевтические композиции в соответствии с настоящим изобретением можно принимать любым подходящим способом, обеспечивающим введение в организм пациента терапевтически эффективной дозы ДКЛ. Как правило, описанные здесь фармацевтические препараты ДКЛ соответствуют композициям для перорального приема. Пригодные дозированные формы включают таблетки, пастилки, облатки, капсулированные таблетки, капсулы, в том числе твердые и мягкие желатиновые капсулы, и т.д. Однако предпочтительной дозированной формой является таблетированная форма, ввиду ее преимуществ как для пациента (например, точность дозировки, компактность, портативность, приятный вкус и простота приема), так и для производителя (например, простота и экономичность приготовления, стабильность и удобство упаковки, перевозки и реализации).
Фармацевтические препараты, практически не содержащие реакционноспособных наполнителей, могут дополнительно содержать "фармацевтически приемлемый инертный носитель", и подразумевается, что это выражение охватывает один или несколько инертных наполнителей, в том числе крахмалы, полиолы, гранулирующие агенты, микрокристаллическую целлюлозу, разбавители, смазывающие агенты, связующие, дезинтегрирующие агенты и т.п., кроме лактозы. Безводные, негигроскопичные и другие препараты в соответствии с настоящим изобретением могут содержать любой "фармацевтически приемлемый носитель", и подразумевается, что это выражение охватывает один или несколько инертных наполнителей, а также реакционноспособные наполнители, например, моногидрат альфа-лактозы. При желании таблетированные дозированные формы раскрываемых здесь препаратов могут быть покрыты оболочкой с использованием стандартных способов с применением водных или неводных растворителей, при этом оговаривается, что неводные способы нанесения оболочки следует использовать для таблеток описанных препаратов, которые не свободны практически от реакционноспособных наполнителей. Понятие "фармацевтически приемлемый носитель" охватывает также средства регулирования выделения (ДКЛ из препарата).
Препараты в соответствии с настоящим изобретением могут содержать в качестве необязательных компонентов другие терапевтические ингредиенты, агенты, препятствующие слеживанию, консерванты, подслащивающие добавки, красители, отдушки, осушители, пластификаторы и т.д. Однако каждый из таких необязательных компонентов должен быть совместим с ДКЛ в целях обеспечения стабильности композиции.
Примеры наполнителей, пригодных для использования в качестве фармацевтически приемлемых носителей и фармацевтически приемлемых инертных носителей и вышеупомянутых дополнительных ингредиентов, включают (но не ограничены):
СВЯЗУЮЩИЕ: кукурузный крахмал, картофельный крахмал, другие виды крахмала, желатин, натуральные и синтетические каучуки, например, гуммиарабик, альгинат натрия, альгиновая кислота, порошкообразный трагакант, смола гуараны, целлюлоза и ее производные (например, этилцеллюлоза, ацетат целлюлозы, кальциевая соль карбоксиметилцеллюлозы, натриевая соль карбоксиметилцеллюлозы), поливинилпирролидон, метилцеллюлоза, предварительно желатинизированный крахмал (например, STARCH 1500® и STARCH 1500 LM®, реализуемые на рынке фирмой Colorcon Ltd. ), гидроксипропилметилцеллюлоза, микрокристаллическая целлюлоза (например, AVICEL, как AVICEL-PH-101, -103 и -105, реализуемые на рынке фирмой FMC Corporation, Marcus Hook, PA, USA) или их смеси;
НАПОЛНИТЕЛИ: тальк, карбонат кальция (например, гранулы или порошок), дикальцийфосфат, трикальцийфосфат, сульфат кальция (например, гранулы или порошок), микрокристаллическая целлюлоза, порошкообразная целлюлоза, декстраты, каолин, маннит, кремневая кислота, сорбит, крахмал, предварительно желатинизированный крахмал или их смеси;
ДЕЗИНТЕГРИРУЮЩИЕ АГЕНТЫ: агар-агар, альгиновая кислота, карбонат кальция, микрокристаллическая целлюлоза, натриевая соль кроскарбоксиметилцеллюлозы, кросповидон, полакрилин-калий, натриевая соль гликолята крахмала, крахмал из картофеля или тапиоки, другие виды крахмала, предварительно желатинизированный крахмал, глины, другие альгины, другие целлюлозы, смолы или их смеси;
СМАЗЫВАЮЩИЕ АГЕНТЫ: стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновая кислота, лаурилсульфат натрия, тальк, гидрогенизированные растительные масла, например, арахисовое, хлопковое, подсолнечное, кунжутное, оливковое, кукурузное и соевое), стеарат цинка, этилолеат, этиллаурат, агар, силикагель (AEROSIL 200, W.R. Grace Co., Baltimore, MD USA), коагулированный аэрозоль синтетического диоксида кремния (Deaussa Co., Piano, TX USA), пирогенный диоксид кремния (САВ-O-SIL, Cabot Co., Boston, MA USA) или их смеси;
АГЕНТЫ, ПРЕПЯТСТВ0УЮЩИЕ СЛЕЖИВАНИЮ: силикат кальция, силикат магния, диоксид кремния, коллоидный диоксид кремния, тальк или их смеси;
АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ: бензалконий хлорид, бензетоний хлорид, бензойная кислота, бензиловый спирт, бутилпарабен, цетилпиридиний хлорид, крезол, хлорбутанол, дегидроуксусная кислота, этилпарабен, метилпарабен, фенол, фенилэтиловый спирт, фенилмеркурацетат, фенилмеркурнитрат, сорбат калия, пропилпарабен, бензоат натрия, дегидроацетат натрия, пропионат натрия, сорбиновую кислоту, тимерсол, тимол или их смеси и
ПОКРЫВАЮЩИЕ АГЕНТЫ: натриевая соль карбоксиметилцеллюлозы, ацетат-фталат целлюлозы, этилцеллюлоза, желатин, фармацевтическая глазурь, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, метилцеллюлоза, полиэтиленгликоль, поливинилацетат-фталат, шеллак, сахароза, диоксид титана, карнаубский воск, микрокристаллический воск или их смеси.
Раскрытые здесь препараты могут быть приготовлены с включением в их состав любых упомянутых компонентов любым методом, принятым в фармации, при условии практического отсутствия реакционноспособных наполнителей, сохранения негигроскопичной или безводной природы данного препарата. Таблетки, например, могут быть приготовлены прессованием или литьем, с добавкой одного или нескольких необязательных вспомогательных ингредиентов, совместимых с природой конкретного препарата и с принципами настоящего изобретения. Прессованные таблетки могут быть приготовлены путем прессования в соответствующей машине активного ингредиента в сыпучей форме, например, порошкообразной или гранулированной, смешанной (не обязательно) со связующим, смазывающим агентом, инертным разбавителем, поверхностно-активным или диспергирующим агентом либо с другим совместимым наполнителем, как описано выше. Желательно, чтобы каждая таблетка содержала от приблизительно 0,1 мг до приблизительно 10 мг, а более желательно - от приблизительно 0,1 мг до приблизительно 5 мг активного ингредиента - ДКЛ или его фармацевтически приемлемой соли.
Следует отметить, что все компоненты, составляющие дозированные формы ДКЛ, изготовленные в соответствии с любым из вариантов осуществления настоящего изобретения, предпочтительно соответствуют стандартам на фармацевтические ингредиенты и их сочетания, изложенные в фармакопее США (USP/NF), или превосходят эти стандарты. Целью USP/NF является установление обязательных стандартов и технических условий на материалы и вещества и их препараты, используемые в практике врачебного искусства. USP/NF определяет наименования, определения, описания и стандарты идентификации, качество, прочность, чистоту, упаковку и маркировку таких материалов и веществ. Кроме того, там, где это возможно, приводится информация по обращению и хранению, формулы их производства и приготовления и методы испытаний.
Препараты ДКЛ, описанные и заявленные в настоящем описании, соответствуют фармацевтическим стандартам, изложенным в USP/NF (например, в USP XXI/NF XVI), на каждый из ингредиентов и на каждую из различных дозированных форм, приготовленных с использованием этих ингредиентов. Действительно, утверждается, что раскрытые препараты ДКЛ представляют собой фармацевтически приемлемые дозированные формы, приготовленные из фармацевтически приемлемых ингредиентов в фармацевтически приемлемых сочетаниях и фармацевтически приемлемых количествах, по крайней мере, соответствующих стандартам, изложенным в USP XXI/NF XVI.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ СОВМЕСТИМОСТИ НАПОЛНИТЕЛЕЙ
I. Первое исследование для определения химической совместимости ДКЛ с обычными наполнителями было проведено методом дифференциальной сканирующей калориметрии (ДСК). При исследовании в качестве активного компонента лекарственного средства был использован дескарбоэтоксилоратадин (партия 589-YF-15A).
Испытанные наполнители:
Микрокристаллическая целлюлоза AVICELTM·;
Крахмал STARCH 1500®;
Лактоза (моногидрат альфа-лактозы).
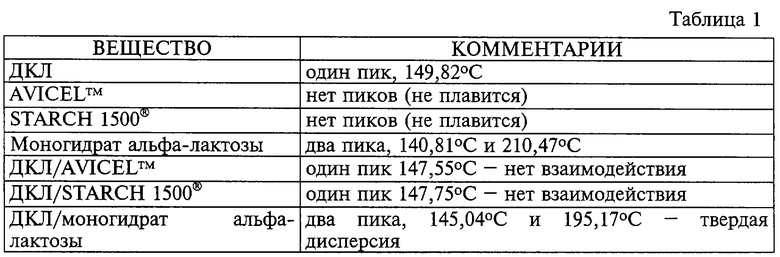
Методика: Различные наполнители смешивали с ДКЛ (80% наполнителя и 20% лекарственного вещества) сухим способом. Эксперименты по ДСК выполняли на каждой смеси, а также на чистом лекарственном веществе.
Результаты: на кривой ДСК чистого ДКЛ обнаружен один эндотермический пик плавления при 149,82oС. Для сухой смеси с лактозой низкотемпературный эндотермический пик плавления лактозы и эндотермический пик плавления ДКЛ сливаются, давая один пик плавления, характеризующий твердую дисперсию. Более высокотемпературный пик плавления лактозы также смещается в сторону низких температур. Такая картина указывает на взаимодействие активного компонента лекарственного средства с наполнителем.
На кривой ДСК сухой смеси ДКЛ с AVICELTM имеется один эндотермический пик при 147,55oС, что примерно соответствует температуре плавления ДКЛ в отсутствие AVICELTM. Поскольку присутствие AVICELTM отрицательно влияет на базовую линию, незначительное отличие температуры плавления можно приписать погрешности экстраполяции начальной температуры. Поэтому эндотермический пик для смеси совпадает, по-видимому, с пиком чистого ДКЛ, и никакого взаимодействия с AVICELTM не обнаружено.
Как и в случае смеси с AVICELTM, сухая смесь ДКЛ с крахмалом STARCH 1500® дает один пик при 147,75oС. Таким образом, взаимодействия ДКЛ со STARCH 1500® не происходит. Эти результаты представлены в табл. 1.
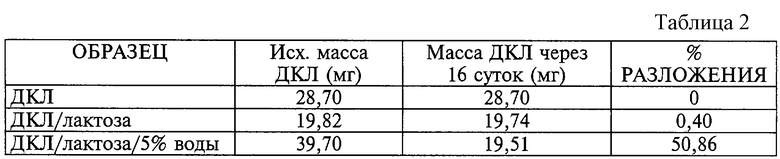
II. Второе исследование было проведено с целью определения стабильности композиции, состоящей из ДКЛ и лактозы, в присутствии 5% воды и в отсутствие воды. Для исследования был использован дескарбоэтоксилоратадин (партия 589-YF-15A).
Методика: Был приготовлен ряд закрытых сосудов из желтого стекла, содержащих ДКЛ и лактозу. Содержимое сосудов: (1) сухой ДКЛ; (2) 20% сухого ДКЛ и 80% лактозы; (3) 20% ДКЛ, 80% лактозы и 5% воды. Сосуды были выдержаны в термостате при 60oС в течение 16 сут и затем их содержимое было проанализировано методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с детектированием на длине волны 254 нм.
Результаты: Существенное разложение было отмечено только в сосуде, содержавшем 5% воды. Этот образец представляет наихудший случай взаимодействия лекарственного вещества с наполнителем, представленный в работе "Устойчивость лекарственных средств" (Drug Stability, Carstensen et al., pp. 379-380). Таким образом, эти данные указывают, что в обычных условиях ускоренного исследования взаимодействия с наполнителем присутствие моногидрата альфа-лактозы отрицательно влияет на стабильность ДКЛ, в то время как твердая смесь ДКЛ с лактозой в отсутствие 5% воды не обнаруживает этой высокой степени разложения. Эти результаты представлены в табл. 2.
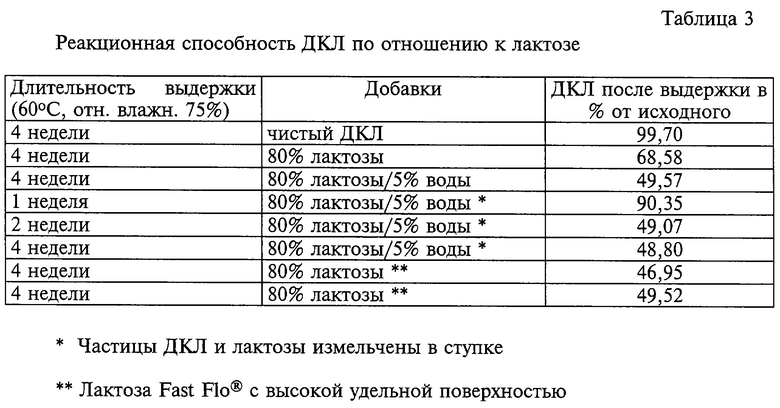
III. Третье исследование было проведено для оценки реакционной способности ДКЛ и лактозы в присутствии преднамеренно введенной воды и в отсутствие воды. Оценивали также влияние уменьшения размера частиц путем измельчения смесей ДКЛ/лактоза в ступке перед выдерживанием. Образцы выдерживали в закрытых сосудах (аналогичных вышеупомянутым) при условиях ускоренного испытания (60oС, относительная влажность 75%) в течение различных периодов времени, а затем испытывали для определения степени прохождения реакции между ДКЛ и лактозой. Результаты представлены в табл. 3.
Как видно из этих результатов, скорость реакции и степень полноты взаимодействия ДКЛ с лактозой уменьшаются в отсутствие добавки воды. Кроме того, уменьшение размеров частиц ДКЛ и лактозы дает одну и ту же степень полноты реакции после 2 и 4 недель выдержки в условиях ускоренного испытания. Ввиду отсутствия сравнительных данных нет возможности определить, увеличилась ли скорость реакции по сравнению с неизмельченным материалом. Однако следует отметить, что образцы, содержащие лактозу с большой удельной поверхностью, вступают в реакцию даже в отсутствие добавки воды. Этот результат показывает, что скорость реакции зависит от удельной поверхности, если она превышает некоторое пороговое значение; так, лактоза Fast Flo®, несмотря на ее положительные характеристики в отношении сыпучести и прессуемости, вызывает увеличение скорости разложения.
Как показано в табл. 4, реакционная способность лоратадина по отношению к лактозе в аналогичных условиях, в том числе в образцах с добавкой 5% воды, пренебрежимо мала.
ПРИМЕРЫ
Ниже более подробно описаны различные варианты осуществления настоящего изобретения с помощью примеров фармацевтических препаратов ДКЛ, практически не содержащих реакционноспособных наполнителей, приведенных в качестве иллюстраций, но не ограничивающих объем притязаний изобретения.
Пример 1
Прессованные таблетки ДКЛ могут быть приготовлены с применением обычного способа влажного гранулирования так, чтобы каждая единица дозировки содержала от 0,1 до 10 мг ДКЛ (см. табл. 5).
Гуммиарабик и равную массу крахмала смешивают для получения пасты, которую используют для гранулирования ДКЛ. Смесь высушивают и протирают через сетку. Добавляют остальные материалы и тщательно смешивают. Полученную массу прессуют в таблетки, используя штамп диаметром 9/32 дюйма (7 мм).
Пример 2
Прессованные таблетки ДКЛ могут быть приготовлены с применением обычного способа сухого гранулирования так, чтобы каждая единица дозировки содержала от 0,1 до 10 мг ДКЛ (см. табл. 6).
Крахмал подсушивают до содержания влаги 10%, а затем тщательно смешивают с ДКЛ. Полученную смесь прессуют в заготовки (блоки), а затем размалывают в тонкий порошок. Затем прессуют таблетки, используя штамп диаметром 9/32 дюйма (7 мм).
Пример 3
Прессованные таблетки ДКЛ могут быть приготовлены с применением обычного способа прямого прессования так, чтобы каждая единица дозировки содержала от 0,1 до 10 мг ДКЛ (см. табл. 7).
Все ингредиенты смешивают в соответствующем смесителе. Полученную смесь прессуют в таблетки, используя штамп диаметром 9/32 дюйма (7 мм).
Пример 4
Таблетки ДКЛ, пригодные для разжевывания, могут быть приготовлены с применением обычного способа прямого прессования так, чтобы каждая единица дозировки содержала от 0,1 до 10 мг ДКЛ (см. табл. 8).
Все ингредиенты смешивают в соответствующем смесителе. Полученную смесь прессуют в таблетки, используя штамп диаметром 9/32 дюйма (7 мм).
Пример 5
Мягкие желатиновые капсулы с ДКЛ могут быть приготовлены со смесью ДКЛ и усваиваемого масла, например, соевого масла, лецитина, хлопкового масла или оливкового масла, при этом смесь вводят в желатин с помощью давления так, чтобы каждая единица дозировки содержала от 0,1 до 10 мг ДКЛ. Капсулы промывают и сушат.
Пример 6
Этот пример приведен в качестве иллюстрации безводного фармацевтического препарата ДКЛ, содержащего лактозу. Прессованные таблетки ДКЛ могут быть приготовлены с применением обычного способа сухого гранулирования так, чтобы каждая единица дозировки содержала от 0,1 до 10 мг ДКЛ (см. табл. 9).
Все ингредиенты тщательно смешивают и прессуют в заготовки. Заготовки затем измельчают и просеивают для получения гранул размером от 14 до 16 меш (1,4-1,2 мм), которые затем прессуют в таблетки, используя вогнутый штамп диаметром 9/32 дюйма (7 мм).
Таблетки и капсулы другой эффективности могут быть приготовлены путем варьирования отношения массы активного ингредиента к массе наполнителей или к массе готовой таблетки.
Хотя настоящее изобретение описано в форме конкретных вариантов осуществления, следует понимать, что эти варианты приведены только для целей иллюстрации, и что изобретение не обязательно ограничено ими. Модификации и видоизменения, не выходящие за пределы объема притязаний, определяемого нижеследующими пунктами формулы изобретения, ясны для сведущего специалиста из настоящего описания.






Фармацевтические препараты дескарбоэтоксилоратадина (ДКЛ), метаболической производной лоратадина, для лечения аллергических ринитов и других расстройств, вызываемых гистаминами. Препараты включают не содержащие лактозы, негигроскопичные и безводные устойчивые фармацевтические композиции ДКЛ. Изобретение позволяет избежать несовместимости между ДКЛ и реакционноспособными наполнителями, например, лактозой и другими моно- и дисахаридами. 8 с. и 22 з.п. ф-лы, 9 табл.
Приоритет по пунктам:
07.12.1997 - по пп. 1-10;
21.07.1997 - по пп. 11-13;
03.04.1997 - по пп. 14-22;
21.07.1997 - по пп. 23-30.
| WO 9620708, 21.01.1997 | |||
| ЕР 0396404, 07.11.1990 | |||
| 0 |
|
SU152897A1 | |
| Энциклопедия лекарств, изд-е | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2003-08-10—Публикация
1998-02-06—Подача