Настоящее изобретение относится к новый белкам, обладающим люциферазной активностью, а также к ДНК и векторам, кодирующим их экспрессию. Главным образом настоящее изобретение предусматривает люциферазы с более низким значением КМ в отношении субстратного АТФ, чем существующие нативные и рекомбинантные люциферазы дикого и измененного дикого типов.
Люциферазы светляков катализируют окисление люциферина в присутствии АТР, Мg2+ и молекулярного кислорода, в результате чего возникает свечение. Такая реакция имеет квантовый выход около 0.88 (см. Deluca и McElroy (1978), а также Seliger и McElroy (1960), и такое светоиспускательное свойство обеспечивает их применение в люминометрических анализах, в которых измеряют уровни содержания АТФ.
Люциферазу получают непосредственно из тела светляков или путем экспрессии из микроорганизмов, включающих конструкции рекомбинантной ДНК, кодирующие энзим. Важными разновидностями, из которых может быть получен энзим или кодирующая его ДНК, являются Японские GENJI и HEIKE светляки Luciola cruciata и Luciola lateralis, Восточно-Европейский светляк Luciola mingrelica, Северно-Американский светляк (Photinus pyralis), а также личинка светляка обыкновенного и личинка Европейского светляка Lampyris noctiluca.
Термостойкость люцифераз дикого и рекомбинантного типов такова, что они теряют активность очень быстро при воздействии температур выше примерно 30oС, особенно около 35oС, и это приводит к дефициту энзима при использовании при высоких температурах окружающего воздуха. Известно, что люцифераза Японского светляка может быть термостабилизирована путем мутации в положении 217 для замены треонинового остатка на изолейциновый остаток (Kajiyama и Nakano (1993) Biochemistry 32, стр. 13795-13799); при этом также повышаются рН стабильность и удельная активность.
В совместно поданной заявке на патент GB 9405750.2 описывается аминокислотная замена, способствующая повышению термостойкости, inter alia, Photinus pyralis, которая может использоваться для изменения в положении 217 с получением люциферазы, которая относительно термостабильна при 50oС или выше.
Настоящее изобретение относится к дальнейшему улучшению свойств люциферазных энзимов, обеспечивающему их пригодность для использования в анализах, основанных на детекции аденозин трифосфата при относительно низких уровнях его содержания. Такое усиление свойств обеспечивается заменой аминокислоты в положении, соответствующем позиции 270 в аминокислотной последовательности люциферазы Photinus pyralis, в результате чего константа Микаэлиса-Ментена (Michaelis-Menten) (КМ) энзима понижается по сравнению с соответствующей люциферазой, имеющей последовательность дикого типа. Это соответствует аминокислоте 272 в Luciola mingrelica, Luciola cruciata и Luciola lateralis. Это также соответствует аминокислоте 270 в Lampris Noctiluca.
Усиление согласно настоящему изобретению, кроме этого, обеспечивает люциферазы, характеризующиеся способностью окислять Д-люциферин с испусканием света с длинами волн, которые отличаются от длин волн для люциферазы дикого типа, что позволяет использовать их в качестве специфических меток в анализах связывания, в которых длина волны испускаемого света является характеристикой присутствия конкретного меченого материала, или позволяет использовать ДНК кодирующие люциферазы в качестве ДНК-репортера для клеток, полученных методами генной инженерии, или клеток, являющихся их производными.
Таким образом, в соответствии с первым аспектом настоящего изобретения обеспечивается белок, обладающий люциферазной активностью и примерно 60% гомологией аминокислотной последовательности с аминокислотной последовательностью Photinus pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis, характеризующийся тем, что аминокислотный остаток, соответствующий остатку 270 в люциферазе Photinus pyralis и остатку 272 в люциферазах Luciola mingrelica, Luciola cruciata и Luciola lateralis, представляет собой аминокислоту, отличную от глютамата. Предпочтительно, такой белок характеризуется тем, что он содержит консервированную аминокислотную последовательность F (1) ХЕ (2) FL, в которой (1) представляет собой D или Е, (2) представляет собой Т или L, а Х представляет собой аминокислоту, отличную от глютамата, причем символы F, E, L, D и Т относятся к соответствующей аминокислоте согласно однобуквенному аминокислотному коду.
Предпочтительной аминокислотой Х, как установлено к настоящему времени, является лизин или его аналог, либо модификации. Другие предпочтительные аминокислоты включают аргинин, глютамин и аланин.
В соответствии с еще более предпочтительными формами настоящего изобретения белок изобретения также содержит аминокислоту в положении, соответствующем аминокислоте 217 люцифераз светляков Luciola или 215 разновидности Photinus pyralis, которая заменена на гидрофобную аминокислоту, предпочтительно, изолейцин, лейцин или валин или их аналоги, и/или содержит аминокислоту в положении, соответствующем аминокислоте 356 люциферазы светляка Luciola или 354 Photinus pyralis, которая заменена на аминокислоту, отличную от глютамата, особенно, на лизин, аргинин, лейцин, изолейцин или гистидин, или на их аналоги или модификации.
В соответствии со вторым аспектом изобретения обеспечивается ДНК, кодирующая белок изобретения, а в соответствии с третьим аспектом предусматривается вектор, особенно плазмида, содержащий luc ген (ген, кодирующий люциферазу) в такой форме, которая способна экспрессировать белок изобретения. Такие формы характеризуются наличием вектора, содержащего последовательности ДНК, способные контролировать экспрессию белка изобретения таким образом, что при введении в клетку-хозяина микроорганизма белок способен легко экспрессироваться требуемым образом, если это необходимо, путем присоединения подходящих индукторов.
Все luc гены для Photinus pyralis, Luciola mingrelica, Luciola cruciata и Luciola lateralis известны и могут быть выделены стандартными методами молекулярной биологии. То же относится к Lampris noctiluca. luc ген Photinus pyralis коммерчески доступен от Promega в виде плазмиды pGEM-luc. Таким образом, удобные методы и источники получения исходного материала для продуцирования ДНК изобретения представляют собой (1) использование геномной ДНК встречающегося в природе светляка и амплификацию ее luc гена с использованием, например, РСК, (II) pGEM и (III) pGLf 37 плазмиды Kajiyama и Nakano. Другие гены, кодирующие белки, обладающие люциферазной активностью, т.е. активностью в окислении люциферина с испусканием света, также являются подходящими источниками исходного материала для получения ДНК и, в конечном счете, через экспрессию гена, белка изобретения.
Подходящие векторы для использования в манипуляциях с ДНК гена дикого типа или другого luc гена, направленных на получение ДНК изобретения, представляют собой любой вектор, в котором может содержаться такая ДНК при осуществлении замены глютамата природного происхождения на другую аминокислоту. В случае химически индуцированного мутагенеза, например, с использованием такого агента, как гидроксиламин, указанная операция не имеет решающего значения и существует большое число подходящих векторов, известных специалисту в данной области, обеспечивающих легкую манипуляцию с геном до и после процесса мутагенеза. Может оказаться предпочтительным специально мутировать luc ген по глютаматной позиции и в таком случае требуется проведение операции сайтнаправленного мутагенеза. Такие операции легче всего осуществлять в векторах, и они хорошо известны специалистам в данной области.
Подходящие векторы для экспрессии luc генов дикого и известного типа и генов настоящего изобретения включают рКК223-3, pDR 540, имеющийся в распоряжении Boehringer Mannheim и рТ7-7, причем два первых вектора содержат tac промотор, находящийся под контролем лактозного репрессора, что позволяет индуцировать экспрессию в присутствии изопропил-тиогалактозида (IPTG). рТ7-7 может контролироваться Т7-РНК полимеразным промотором и таким образом обеспечивает основу для очень высокого уровня генной экспрессии в E.coli клетках, содержащих Т7 РНК полимеразу. Было установлено, что наивысшая экспрессия в присутствии таких векторов имеет место тогда, когда luc гены вводятся в рТ7-7 вектор.
Экспрессия люциферазы из luc гена, вставленного в рКК223-3 и рDR 540, приводит в результате к экспрессии люциферазы с N-терминальной последовательностью дикого типа, тогда как экспрессия из luc гена, вставленного в рТ7-7, приводит в результате к синтезу слитого белка с экстра N-терминальными аминокислотами A-R-I-Q. Сайт связывания рибосомы и старт-кодон luc гена каждого из соответствующих векторов с присутствующим в них luc геном (названных конструкциями pPW 204, pPW 116 и pPW 304) показаны в табл. 1, приведенной в Примерах. pPW 601, на которую ссылаются ниже, получают удалением уникального Xh о I сайта pPW 116.
Третий аспект настоящего изобретения предусматривает клетки, способные экспрессировать белки изобретения; способы получения таких белков с использованием таких клеток и диагностические наборы и реагенты, содержащие белки изобретения. Также предусматриваются способы анализа, в которых содержание АТР измеряют с использованием реагентов люциферин/люцифераза, как хорошо известно в данной области, причем такие методы характеризуются тем, что люцифераза представляет собой белок изобретения. Люциферазные препараты изобретения характеризуются относительно низким значением КМ в сравнении с соответствующими люциферазами дикого типа и рекомбинантными люциферазами и предпочтительные люциферазы с двойной и тройной заменами (т.е. 215, 270, 354 замененная Photinus или 217, 272, 356 замененная Luciola или 215, 270, 354 замененная L. noctiluca) также характеризуются относительной термостабильностью при 30-70oС, особенно при 37-60oС и особенно при 40-50oС. Таким образом, настоящее изобретение не должно рассматриваться как препятствие к использованию авторами изобретения и другими исследователями результатов по улучшению термостабильности, полученных в других современных и предыдущих работах.
Любая клетка, способная к экспрессии гетерологического белка с использованием ДНК последовательностей в его ДНК или в таких векторах, как плазмиды, содержащиеся в клетке, могут использоваться для экспрессии белков изобретения. Типичными представителями таких клеток являются такие дрожжевые и бактериальные клетки, как Saccharomyces cerevisiae и Escherichia coli, однако специалисты в данной области должны иметь в виду, что большое число организмов-хозяев может оказаться пригодным для целей, касающихся экспрессии белка.
Белок может экспрессироваться, как белок со структурой, аналогичной нативной и известной рекомбинантной люциферазам, или может экспрессироваться в виде слияния или конъюгата таких белков с другими аминокислотами, пептидами, белками или другими химическими субстанциями, например, с указанной выше последовательностью A-R-I-Q.
Специалист в данной области должен иметь в виду, что некоторые хозяева могут отдавать предпочтение конкретному кодону, например, бактерии в некоторых случаях используют другие кодоны, чем дрожжи, и таким образом, ДНК, введенная в организм такого хозяина, может с успехом подвергаться изменению с получением перерожденного кодона для данной аминокислоты, что обеспечивает более благоприятную экспрессию в таком хозяине. Разумеется, что такие перерожденные ДНК охватываются сферой ДНК изобретения.
Е. coli BL 21 (ДЕЗ) представляет собой один из примеров подходящего хозяина и содержит Т7 РНК полимеразу, устойчиво интегрированную в ее хромосому под контролем индуцируемого lac UV5 промотора, и, таким образом, является совместимой с рТ7-7 производными конструкциями. В-штаммы Е. coli, подобные BL 21, характеризуются отсутствием Ion протеазы и ompT внешне-мембранной протеазы. Такие дефекты способствуют стабилизации экспрессии и аккумуляции посторонних белков в E.coli. Анализы сырых экстрактов E.coli BL 21 (ДЕЗ), содержащих каждую из описанных выше трех экспрессионных конструкций, показали, что наивысшие уровни экспрессии люциферазы достигаются из клеток, содержащих конструкцию рР W304 (см. табл. 2). Специалист в данной области может обнаружить и другие подходящие линии клеток, например, клетки E.coli JM109, используемые в приведенных ниже примерах.
Далее, исключительно в целях иллюстрации, будут описаны белки, ДНК, векторы и клетки изобретения со ссылкой на следующие, не ограничивающие сферу изобретения. Примеры, чертежи, таблицы и перечень последовательностей. Специалисту в данной области должно быть ясно, что могут использоваться и другие белки, конъюгаты белков, ДНК, векторы и клетки, а также методы анализа и диагностические наборы, включающие любые из упомянутых выше.
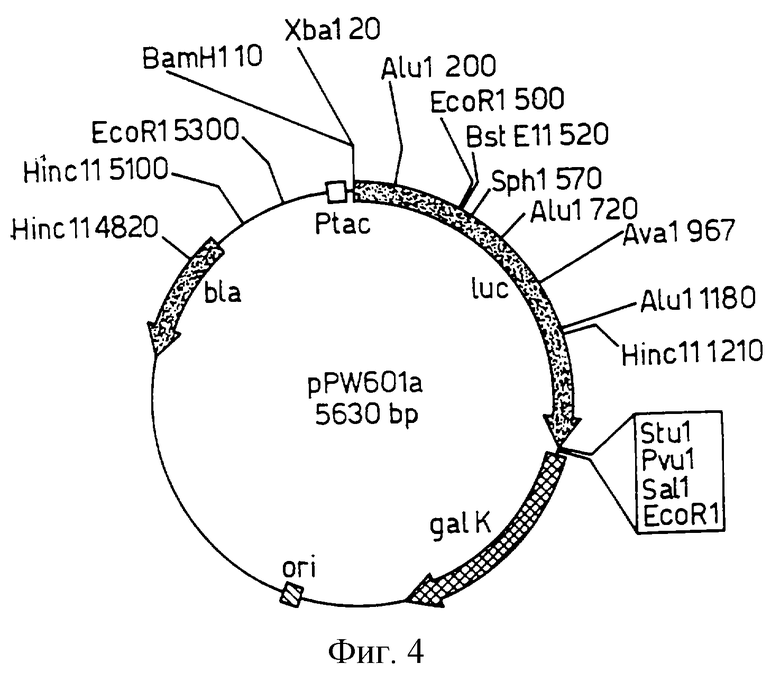
Фиг. 1 изображает рестрикционную карту плазмиды pPW 204, полученной из рКК223-3 путем инсерции luc гена, как описано в приведенных ниже Примерах.
Фиг. 2 изображает рестрикционную карту плазмиды pPW 116, полученной из рDR 540 путем инсерции luc гена, как описано в следующих ниже Примерах.
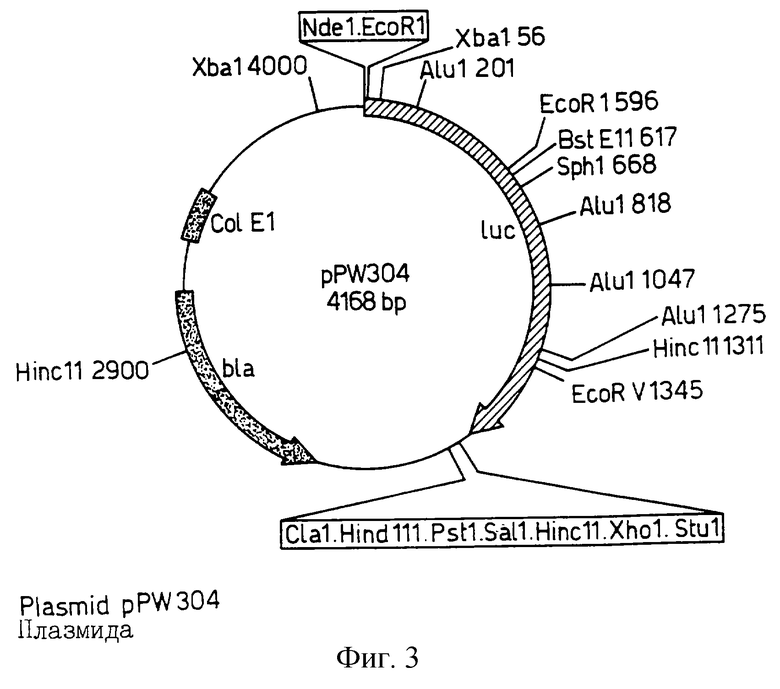
Фиг. 3 изображает рестрикционную карту плазмиды pPW 304, полученной из рТ7-7 путем инсерции luc гена, как описано в приведенных ниже Примерах.
Фиг. 4 изображает рестрикционную карту плазмиды pPW 601a, полученную из рDR 540, и фрагмент Bam H1/Sst 1 из pGEM-luc с удаленным сайтом Xho.
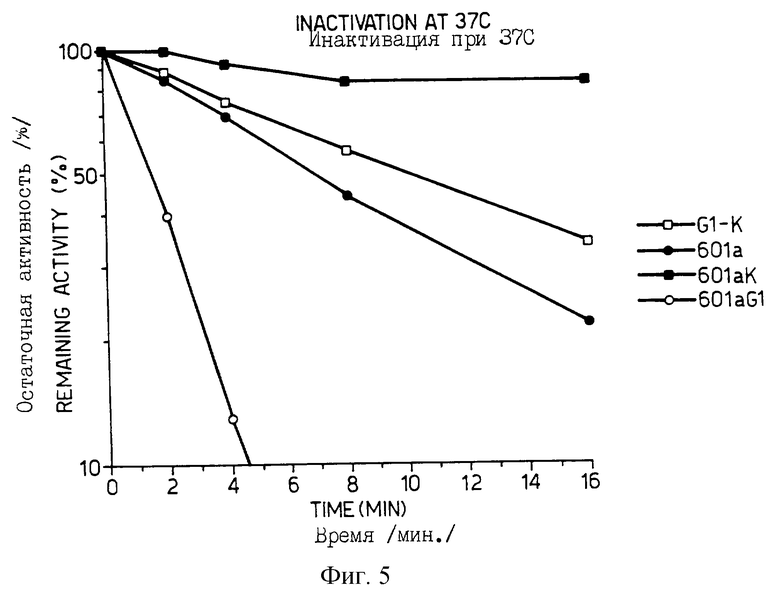
Фиг.5 изображает график термической инактивации рекомбинантных люцифераз дикого типа Photinus /Sigma/, люциферазы изобретения с измененным значением КМ, термостабильного 354 лизинового мутанта, описанного в совместно поданной GB 9405750.2 и КМ/354 лизинового двойного мутанта настоящего изобретения, подвергнутого инкубации при заданной температуре в течение 16 минут в соответствии с описанным в приведенных ниже Примерах.
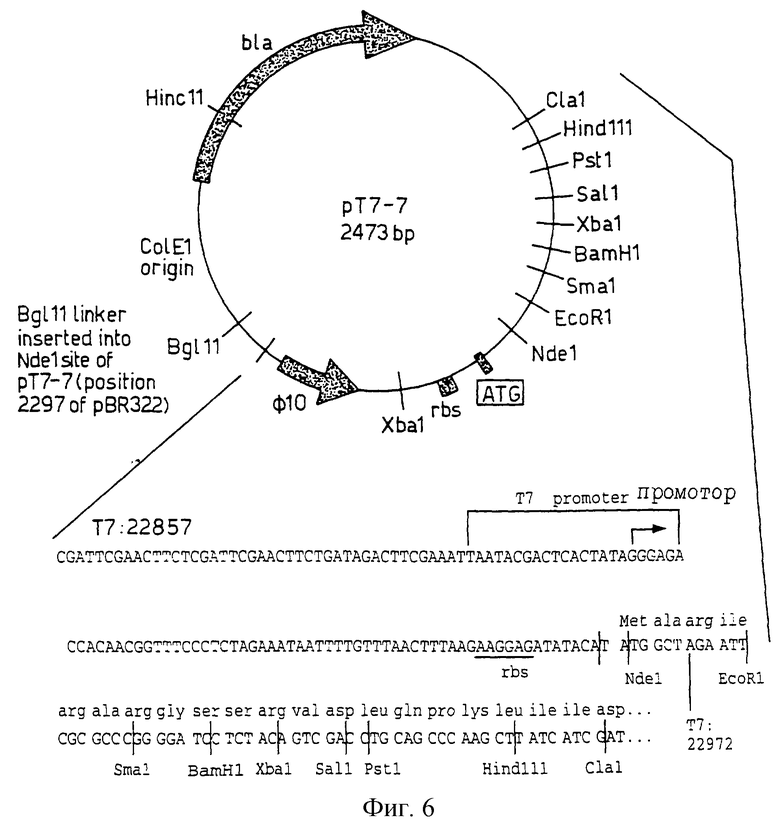
Фиг.6 изображает рестрикционную карту рТ7-7 после Tabor.
Перечень последовательностей
Перечень последовательностей, приведенный в конце описания, содержит следующие ДНК и аминокислотные последовательности:
SEQ 1Д 1: изображает последовательность ДНК для ДНК, кодирующей люциферазу изобретения, в которой Photinus pyralis кодон дикого типа мутирован в положениях 811-813, в случае лизина только основание в позиции 811 мутировано на А. Изображена также позиция введения термостабильности в положениях 1063-65.
SEQ 1Д 2: изображает аминокислотную последовательность белка изобретения, в которой аминокислотный 270 глютамат дикого типа Photinus pyralis заменен на остаток Хаа, отличный от глютамата.
SEQ 1Д 3: изображает последовательность олигонуклеотида, используемого для SDM мутации pPW 601a с заменой глютамата в положении 270 на лизин.
SEQ 1Д 4: изображает аминокислотную последовательность белка изобретения, в которой глютамат 270 аминокислоты дикого типа Photinus pyralis заменен на лизин и аминокислота в положении 354 заменена на лизин.
SEQ 1Д 5: изображает последовательность олигонуклеотида, используемого для SDM мутации pPW 601a с заменой глютамата в положении 354 на лизин.
ПРИМЕРЫ
Пример 1: Получение плазмид, содержащих ДНК изобретения
Плазмиды рКК223-3 и рDR 540 получали от Боэрингер Маннхейм, pDR 540 также выпускается фирмой Фармациа Биотех Ст. Албанс, Великобритания. Фагмидную pBluescript IISK/+/ получали от Стратаген Ла Йолла, США. E.coli штамм BL 21 /ДЕЗ/ использовали для экспрессии люциферазы из рТ7-7 производных плазмид, а E.coli штамм JM109/4/ использовали в экспериментах по клонированию и для экспрессии люциферазы из pDR 540 производных плазмид.
Плазмиду рТ7-7 (см. Текущие протоколы в сборнике "Молекулярная биология", т. 11, раздел 16.2.1) получали от Стан Табор, Отделение биологической химии. Гарвардская медицинская школа, Бостон, Масс. 02115, и (как показано на фиг.6) она содержит Т7 РНК полимеразный промотор ⊘ 10 и сайт начала трансляции для 10 белка Т7 гена (Т7 bp 22857-22972), вставленный между Pyull и ClaI сайтами рТ7-5. Уникальные рестрикционные сайты для создания слитых белков (после заполнения на 5' окончаниях) представляли собой Рамку 0: EcoR1, Рамку 1: NdcI, SmaI, ClaI, Рамку 2: Bam HI, Sa1I, Hind 111. SacI сайт исходного полилинкера удаляли делецией и дополнительный Xbal сайт создавали в обратном направлении от инициирующего кодона.
Как отмечалось в преамбуле к чертежам, рР W204 получали из рКК223-3, pPW 116 получали из pDR 540, pPW 304 - из рТ7-7; причем каждую из них получали инсерцией luc гена производного из Промега pGEM-luc с использованием стандартных рестрикционно-эндонуклеазных методов и методов лигирования, тогда как pPW 601 создавали клонированием luc гена и Bam HI/Sst 1 фрагмента из рGЕМ-luc в рDR 540 и pPW 601а при удалении уникального XhoI сайта в полилинкере плазмиды. pPW 601а содержит уникальный сайт распознования для Аyа 1, который упрощает SДM методику для замен люциферазной аминокислоты 354.
Для получения pPW 304, рТ7-7 переваривали с EcoR1, концы заполняли с использованием фрагмента Кленова, продукт переваривали с Sa1I и ДНК очищали на геле; pGEM-luc переваривали с Bam H1, образовавшиеся выступы переваривали с МВ11, продукт переваривали с Sa1I и полученный 1.Kb фрагмент очищали и лигировали в очищенную рТ7-7 ДНК.
Трансформацию плазмид в ВМН 71-18 mut S клетки осуществляли с использованием Bio-Rad Gene Pulser версии 2-89. Для получения pPW 601 клонов производили сбор клеток и создавали очищенный смешанный плазмидный пул, содержащий мутированные и родительские плазмиды, и вторичный рестрикционный перевар с Av аl осуществляли до трансформации в E.coli JM109 клетки. Такие клетки высеевали на селективную среду (L В агар + 50 мкг/мл ампициллина), и клоны подвергали скринингу путем очистки их плазмидной ДНК и анализа на желаемое изменение. Плазмидную ДНК очищали с использованием щелочного лизиса (Birnboim и До1у /1979/ Nucleic Acids Res. 7, стр. 1513).
Относительные уровни экспрессии люциферазы из каждой из конструкций pPW 204, pPW 116 и pPW 304 составляли 0.1:0.5:1.0 из E.coli BL 21 /ДЕЗ/. Клетки выращивали в L В при 37oС до значения ОД 600 порядка 0.3, затем индуцировали с помощью IРТG и выращивание продолжали в течение 4 часов, после чего получали сырой экстракт и измеряли люциферазную активность.
Таблица 1: Сайты связывания рибосомы (подчеркнуты) и инициирующие кодоны в экспрессионных конструкциях, используемых в Примере 1.

Неполную очистку люцифераз осуществляли на E.coli JM 109 клетках, собранных в ранней стационарной фазе и затем ресуспендированных в 50 мМ Трис НС1 рН 8.0, содержащей 50 мМ КСl, 0.5 мМ дитиотреитола и 1 мМ ЕДТА (Буффер А). Клетки разрушали дезинтеграцией на ультразвуковом дезинтеграторе М SE Soniprep (амплитуда 14 мкм) и лизат центрифугировали с 30000 х г в течение 1 часа. Затем супернатант сырого экстракта подвергали фракционированию в присутствии сульфата аммония и фракции, осажденные в области насыщения 35-55%, содержали люциферазную активность и их растворяли в Буффере А и подвергали диализу в течение ночи противотоком к 500 мл 50 мМ Трис-НСl буффера рН 8.0, содержащего 0.4 мМ ДТТ (Буффер В).
Полную очистку люцифераз проводили путем загрузки осажденного и диализированного энзима в Моно Q (HR 10/10) анионообменную колонку, проводя элюирование линейным градиентом 0-200 мМ NaC1 в Буффере В (объемная скорость 4 мл/мин; фракции объемом 2 мл). Целевые фракции, содержащие люциферазную активность, дополняли 50% глицерина (об./об.) и хранили при -20oС.
Люциферазу светляков (полученную из кристаллической суспензии, каталожный L 9009), а также соэнзим А и АТР получали от Сигма Кэмикал Ко. Калиевую соль люциферина жуков получали от Промега Корпорэйшн, Мэдисон Висконсин, США. Клеточные экстракты готовили в соответствии с описанием в техническом бюллетене Промега 101. Аликвоты E.coli культур подвергали лизису в реагенте для лизиса клеточных культур (25 мМ Трис-фосфат, рН 7.8, 2 мМ ДТТ, 2 мМ ЕДТА, 10% глицерина, 1% Тритона Х-100, 2.5 мг/мл BSA, 1.25 мг/мл лизозима) в течение 10 минут при комнатной температуре, центрифугировали при силе в 16000 г в течение 2 минут и затем хранили до проведения анализа на льду.
Люциферазную активность клеточных линий оценивали мониторингом биолюминесценции, испускаемой колониями, путем их переноса на найлоновые фильтры (Хибонд N, Амершам) и последующего смачивания фильтров 0.5 мМ люциферина в 100 мМ натрий цитратного буффера рН 5.0 (Wood и De Luca, /1987/ Anal Biochem 161, стр. 501-507) при комнатной температуре. Анализы люциферазы in vitro проводили при 21oС с использованием 100 мкл аналитического буффера (20 мМ Трицина рН 7.8, содержащего 1 мМ MgSO4, 0.1 мМ ЕДТА, 33.3 мМ ДТТ, 0.27 мМ соэнзима А, 0.47 мМ Д-люциферина, 0.53 мМ АТР и 1-5 мкл образца). Конечное значение рН аналитической смеси составляло 7.8 и световые измерения проводили на люминометре БиоОрбит 1250 или в титрационных микропланшетах с использованием лабораторной системы Люминоскан RS планшетный люминометр.
Белок определяли по методу Bradford (1976) Anal.Biochem, 72, стр. 248-254, используя в качестве стандарта BSA. Для осуществления не-специфических химических мутаций ДНК, плазмиды, содержащие luc гены, обрабатывали в соответствии с методом Kironde с сотр. (1989) Biochem. J. 259, стр. 421-426 с использованием 0.8 М гидроксиламина, 1 мМ ЕДТА в 0.1 мМ фосфата натрия, рН 6.0, в течение 2 часов при 65oС.
КМ мутант вначале создавали путем гидроксиламин-индуцированного мутагенеза luc гена в pPW 304 с получением плазмиды 304 G1, несущей единственную замену основания в последовательности ДНК в положении 811 SEQ IД 1, в результате чего происходила замена аминокислотного глютамата на лизин в положении 270. Фрагмент ДНК размером 1.1 кь (BstE II/Stu I) клонировали из pPW 304 и использовали для замены соответствующего фрагмента в рР601а с образованием pPW 601G1, обеспечивая таким образом luc ген, кодирующий люциферазу, без четырех дополнительных аминокислот, кодируемых pPW 304 (без включения М из M-A-R-1-Q).
Мутагенезированную плазмиду обессоливали в колонке Nick сорта G60 ДНК (Фармация) с последующим трансформированием в E.coli BL 21 (ДЕЗ). Люцифераза, экспрессированная из такой системы, демонстрировала фенотип с низким значением КМ, идентичный фенотипу исходного мутанта.
Секвенирование двунитевой ДНК осуществляли путем дидеоксицепной терминации по методу Sanger с сотр. (1977) Prac. Nat. Acad. Sci (США) 74, 5463-5467 с использованием (альфа-32 Р) dATP и электрофорезом в полиакриламидных гелях в присутствии 8М мочевины (6% вес./об.). Применяли также автоматическое секвенирование с использованием автоматического секвенсора ДНК модели 373 А (Эпплайд Биосистемс).
Анализ на определение значения КМ такой люциферазы по отношению к АТР осуществляли при 21oС с использованием 100 мкл аналитического буффера (20 мМ трицина рН 7.8, содержащего 1.0 мМ MgSO4, 0.1 мМ ЕДТА, 33 мМ дитиотриэтола, 270 мкМ соэнзима А, 470 мкМ Д-люциферина и 6.25-400 мкМ АТР), применяя люминометр для измерения срm.
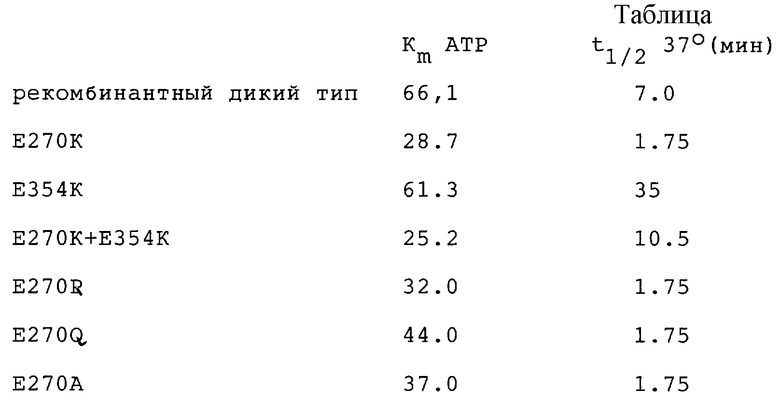
Установленное значение КМ для 601а-рекомбинантного дикого типа составило 66,1 мкМ (s.e.4.1); для 601 аК (термостабильный мутант с лизином в положении 354) - 61.3 (s.e. 4.7) и для 601aG1 (изменение КМ, вызванное 270 лизином) - 28.7 (s. e. 0.9), что иллюстрирует тот факт, что замена в положении 270 изменяет концентрацию АТР, более чем на половину делая ее оптимальной для энзима.
Эффект 270 замены на термостабильность люциферазы является отрицательным, причем, при 37oС t1/2, активность достигается только через 2 минуты по сравнению с значением активности дикого типа на 7 минуте, однако при 30oС удельная активность 270 выше, чем у дикого типа.
Пример 2: Получение "двух-мутантной" 270К:354К Photinus pyralis люциферазы
С целью компенсации пониженной термостабильности люциферазы с заменой в положении 270, получали двух-замененную люциферазу с использованием сайт-направленного мутагенеза для внесения методами генной инженерии лизиновой замены в положении 354 в 270-лизиновые люциферазы, кодирующие ДНК и плазмиду, описанные в Примере 1. Такая операция включает мутацию с использованием специально обозначенных олигонуклеотидов для превращения рPW601аG1 в pPW601a в G1K.
Олигонуклеотид, используемый для осуществления 354 лизиновой замены с помощью SДМ, представлял собой 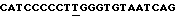 /SEQ IД 5/, причем подчеркнутый Т является ошибочно спаренным.
/SEQ IД 5/, причем подчеркнутый Т является ошибочно спаренным.
Сайт-направленный мутагенез, требуемый для превращения глютамата 354 из рР W601аЕ270К, и в случае необходимости для прямого синтеза 270 мутанта из pPW601a, в желаемые аминокислоты осуществляли с использованием следующего протокола с обозначением нуклеотидов, когда это требуется.
Протокол сайт-направленного мутагенеза: Отобранную плазмиду денатурировали и отжигали с селекционными и мутагенными олигонуклеотидами для желаемой замены. Синтезировали и лигировали цепь мутантной ДНК и всю первичную рестрикцию переваривали с рестрикционной эндонуклеазой. Олигонуклеотидные праймеры для секвенирования и SДМ синтезировали с использованием синтезатора ДНК модели 380А фирмы Эпплайд Биосистемс. ДНК олигонуклеотидные праймеры предназначены для разрушения либо уникального Аyа 1 сайта внутри luc гена, или уникального Scal сайта внутри гена для β-лактамазы; присутствие таких сайтов используется для селекции от плазмид, не подвергнутых мутагенезу. Точные протоколы соответствовали описанным для Набора сайт - направленного мутагенеза TransformerRTM (Версия 2.0), продаваемого Клонтех Лабораториз Инк. (США) под каталожным номером К1600-1.
Рестрикционная карта для pPW 601, полученной из рДR540 и клонированного luc гена, показана на фиг.4. Сайт-направленный мутагенез проводили в соответствии с описанным выше и в инструкциях Клонтех с целью превращения вставленного luc гена дикого типа Photinus в последовательность, представленную в SEQ 1Д 1 с экспрессированным белком с аминокислотной последовательностью, модифицированной в положении 270, обозначенном как Хаа в SEQ 1Д 2 с заменой на лизин.
Исследования по определению КМ проводили, как описано в Примере 1, тогда как исследования по термической инактивации проводили с использованием сырых экстрактов при 37oС в лизисном буффере (25 мМ Трис фосфата рН 7.8, 2 мМ ДТТ, 2 мМ ЕДТА, 10% глицерина и 1% Тритона-Х-100), отбирая через различные промежутки времени аликвоты энзима и анализируя их, как описано выше (в присутствии 530 мкМ АТР). Строили график зависимости остаточной активности от времени.
Значение КМ для 601аG1К, объекта двойной замены настоящего примера, было определено, как равное 25.2 мкМ (s.e. 1.5), что опять составляет менее половины соответствующих значений для 354 лизинового мутанта и люциферазы дикого типа.
Величины t1/2, т. е. время, после которого активность люциферазы понижается при непрерывном нагревании на 50% от исходного значения, имели следующие значения:
601а (рекомбинантный дикий тип) - t1/2 достигается через 7,0 мин.
601aG1 (270 КМ замена) - t1/2 достигается через 1,75 мин.
601аК (354 термостабильная замена) - t1/2 достигается через 35 мин.
601аGIК (270 + 354 замены) - t1/2 достигается через 10,5 мин.
Приведенные выше данные включены в следующую ниже таблицу (плюс другие данные) совместно со значениями КМ.














Изобретение относится к области получения новых белков методами генетической инженерии и может быть использовано в любых анализах, основанных на определении аденозинтрифосфата (АТФ). Предложены мутантные формы фермента люциферазы с повышенным сродством к АТФ, получаемые путем замены аминокислотного остатка глутамата, относящегося к консервативной области последовательности фермента дикого типа и соответствующего остатку в положении 270 люциферазы Photinus pyralis, другим аминокислотным остатком, введение которого обеспечивает снижение значения KМ, в частности, остатком лизина, аргинина, глутамина или аланина. В результате введения дополнительных мутаций, предусматривающих замену остатка глутамата в положении, соответствующем остатку 354 люциферазы Photinus pyralis, остатком лизина и/или замену остатка в положении, соответствующем остатку 215 люциферазы Photinus pyralis, остатком гидрофобной аминокислоты, предложенные мутантные формы фермента дополнительно приобретают повышенную термостойкость. Получены последовательности ДНК, кодирующие указанные мутеины люциферазы, а также плазмидные векторные конструкции, обеспечивающие экспрессию соответствующих рекомбинантных белков в трансформированных клетках E. coli. 5 с. и 9 з.п. ф-лы, 6 ил., 2 табл.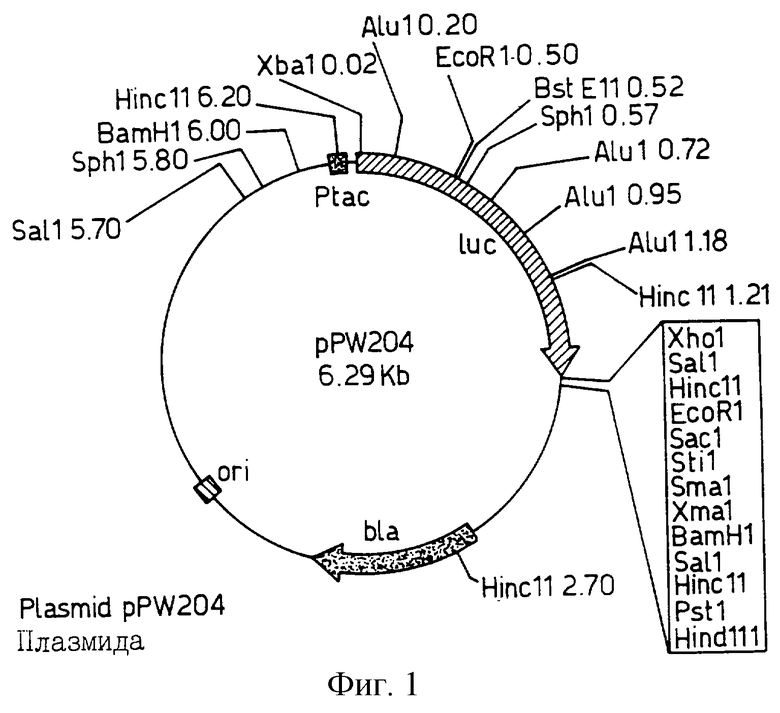
Приоритет по пунктам:
GB 9501172.2, 20.01.1995 по пп. 1-13;
РСТ/GB 96/00099, 19.01.1996 по п. 14.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ЕР 0524448 А, 27.01.1993 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ЕР 0449621 А, 02.10.1991. | |||
Авторы
Даты
2003-08-20—Публикация
1996-01-19—Подача