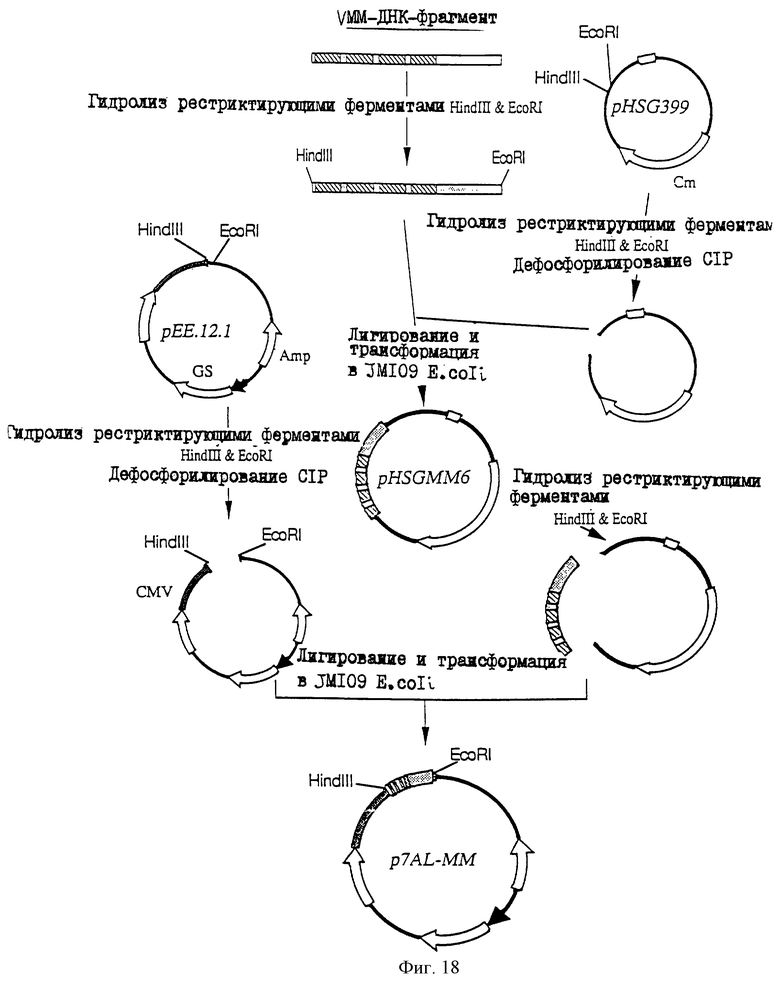
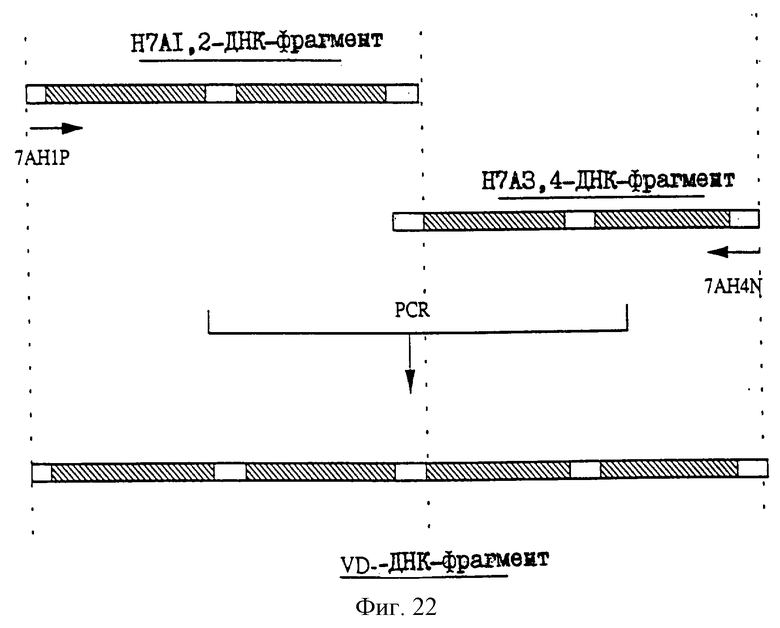
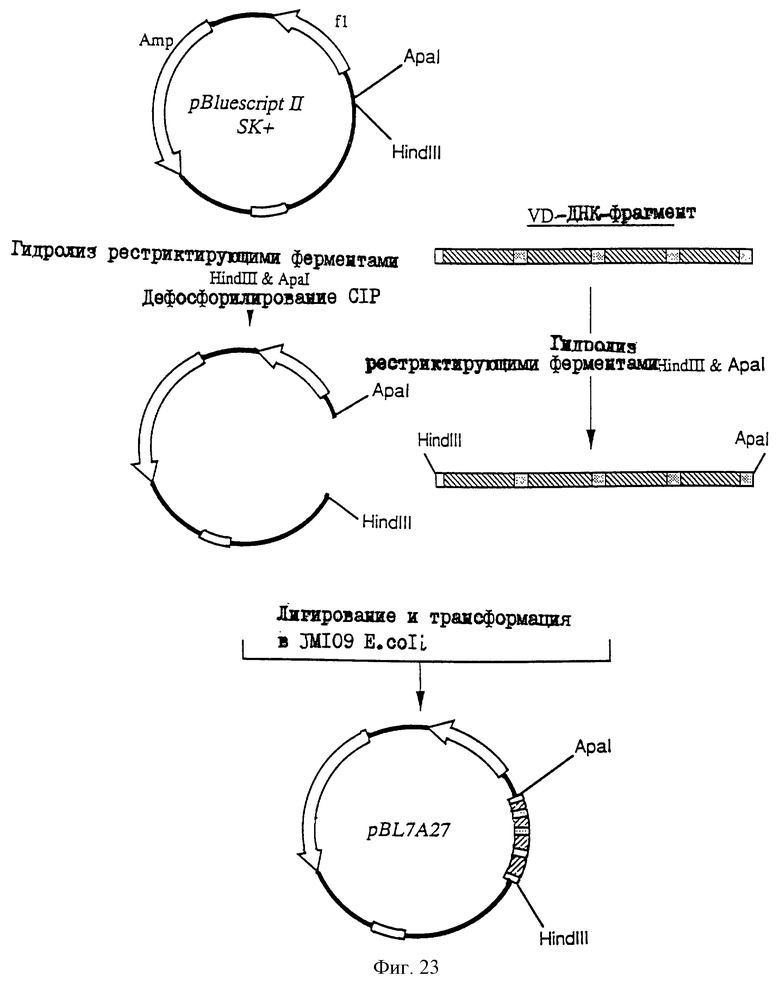
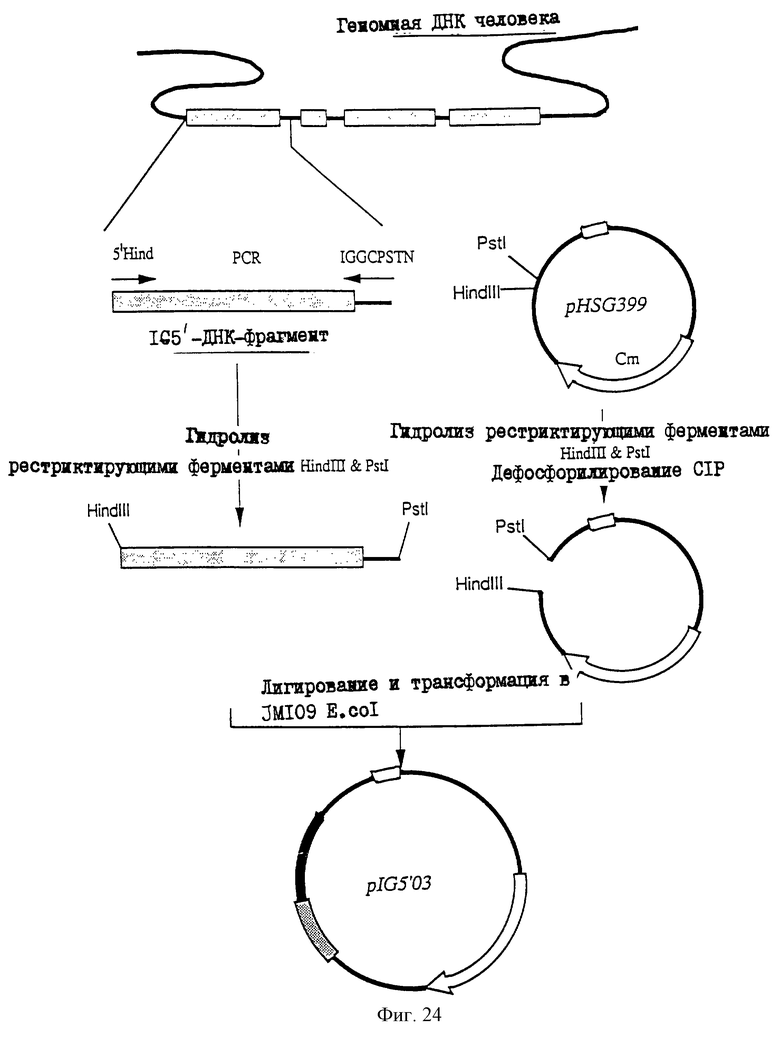
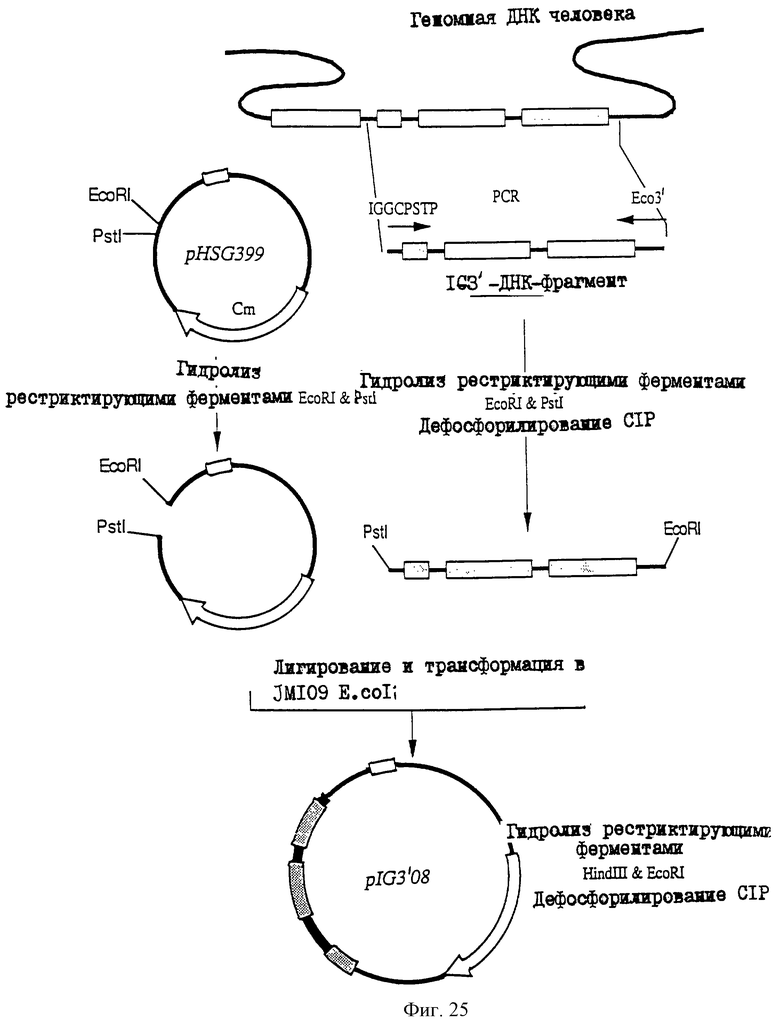
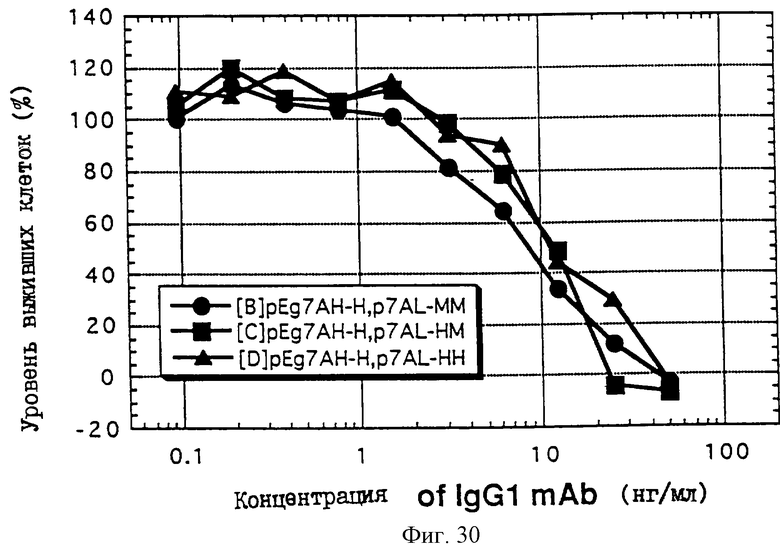
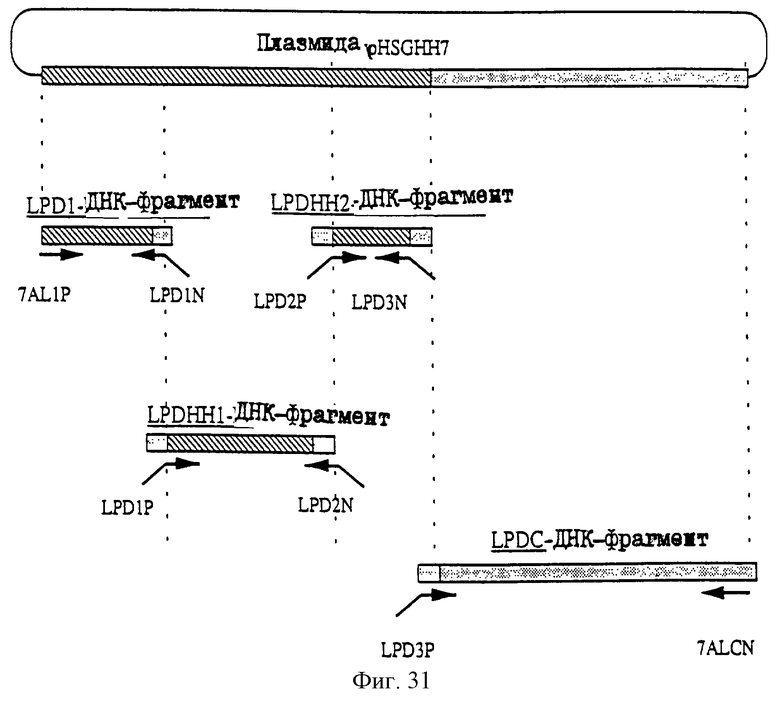
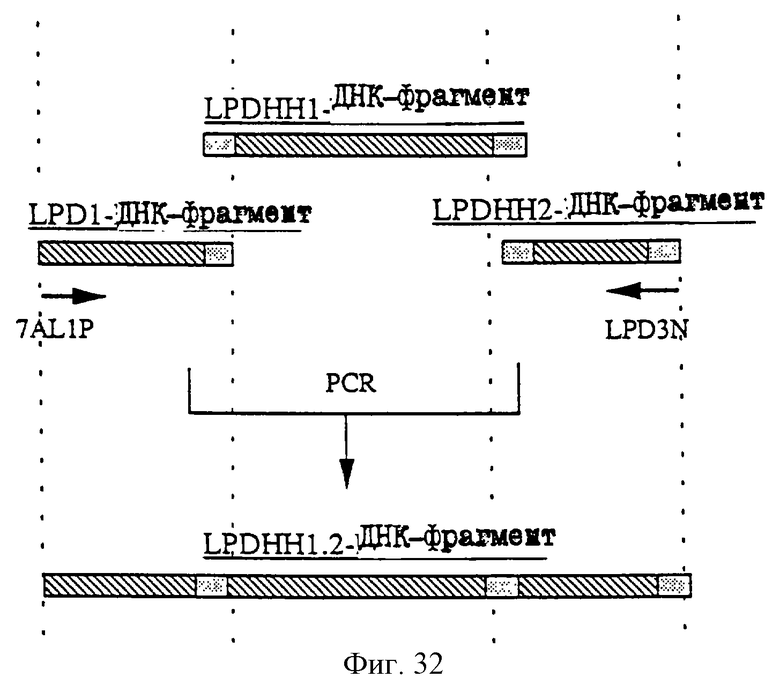
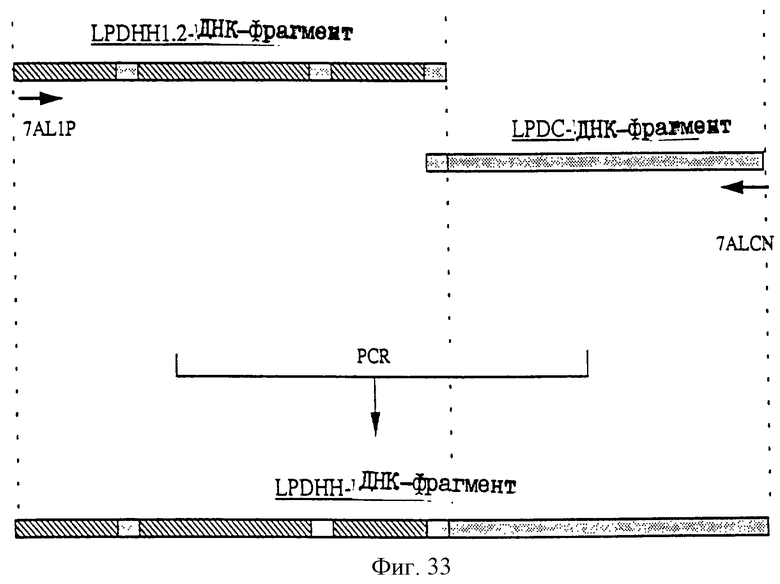
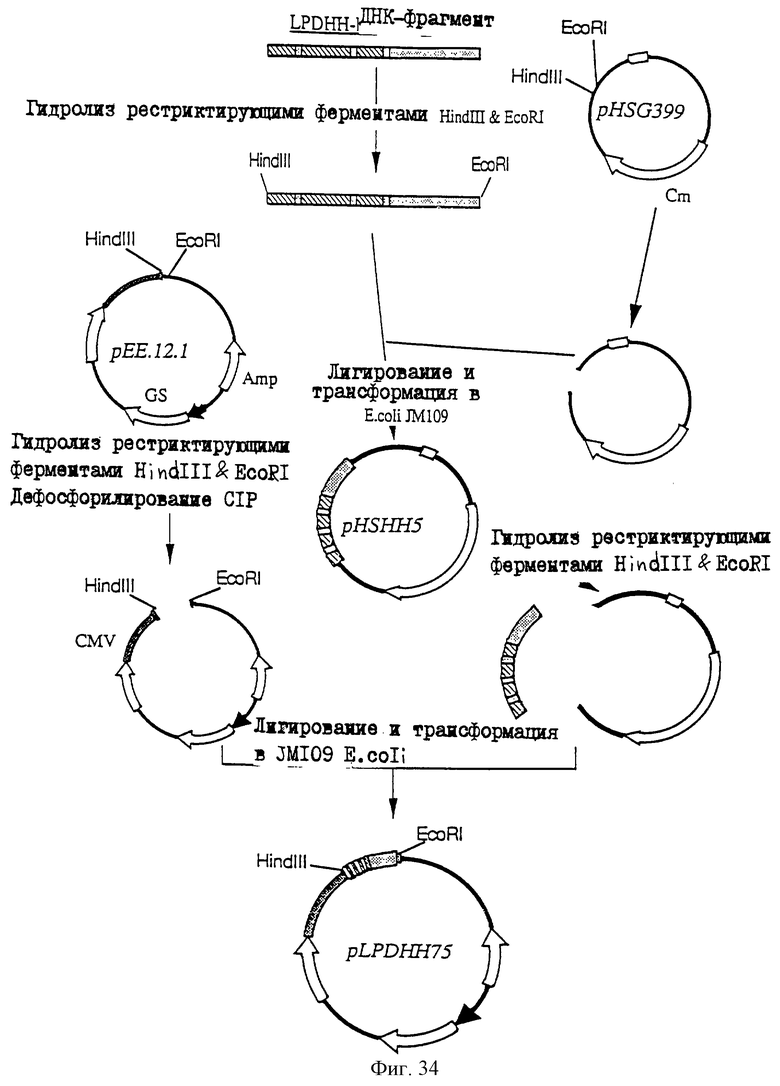
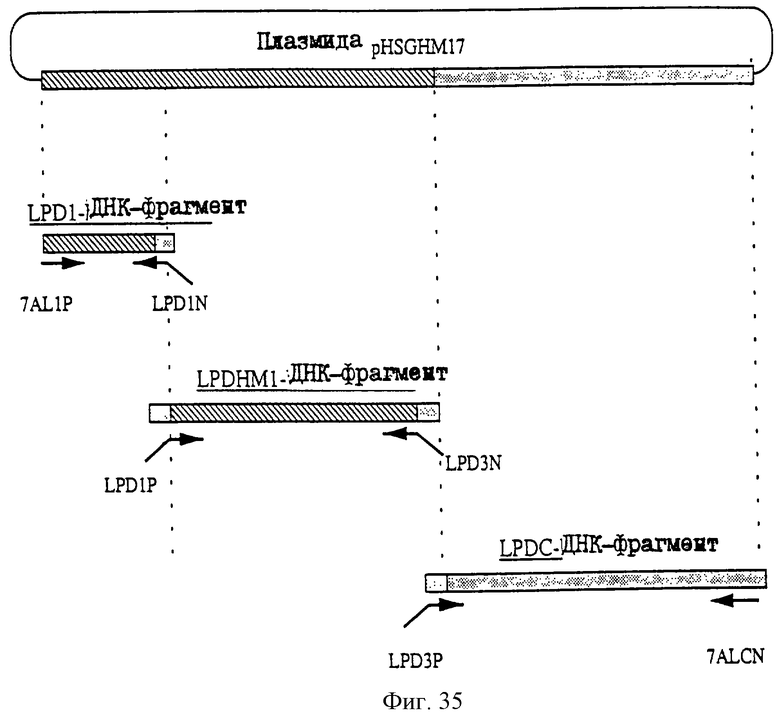
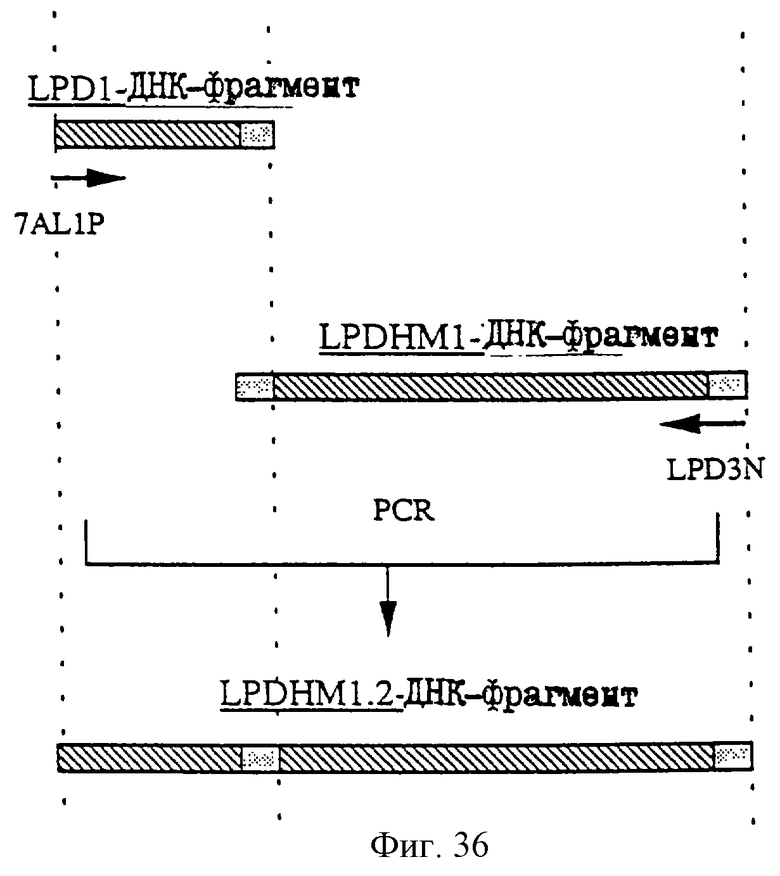
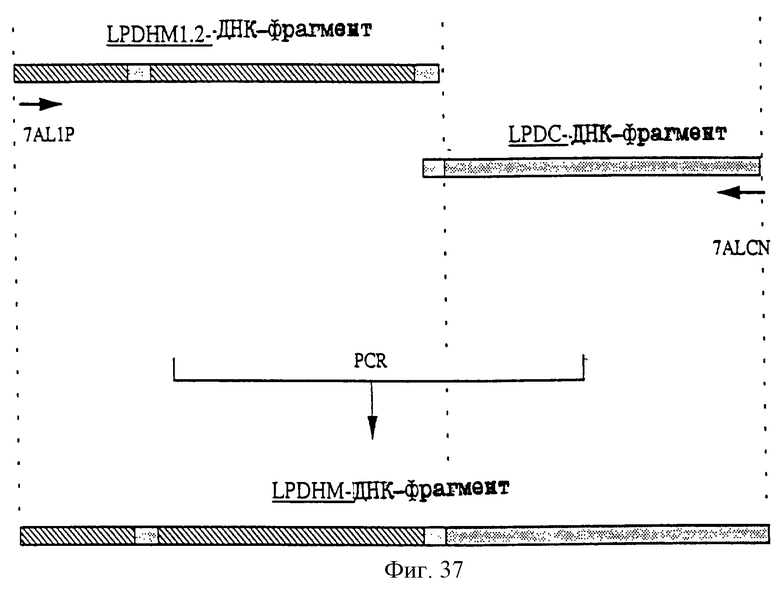
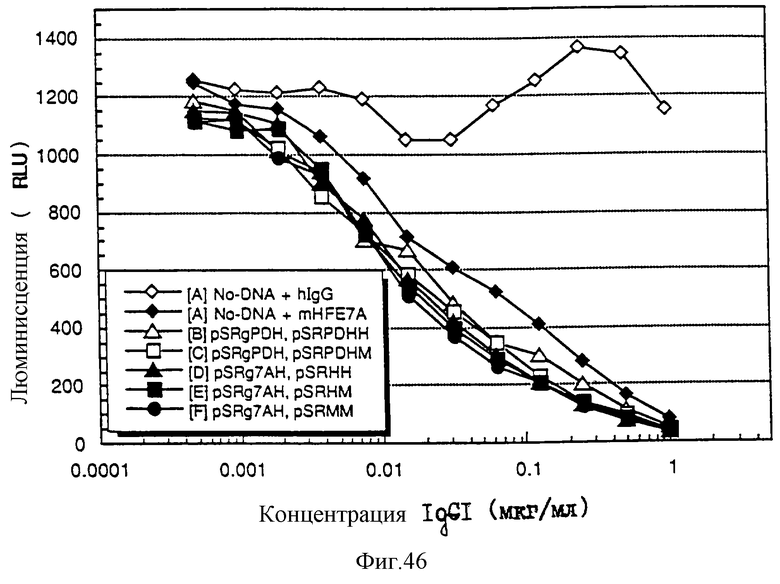
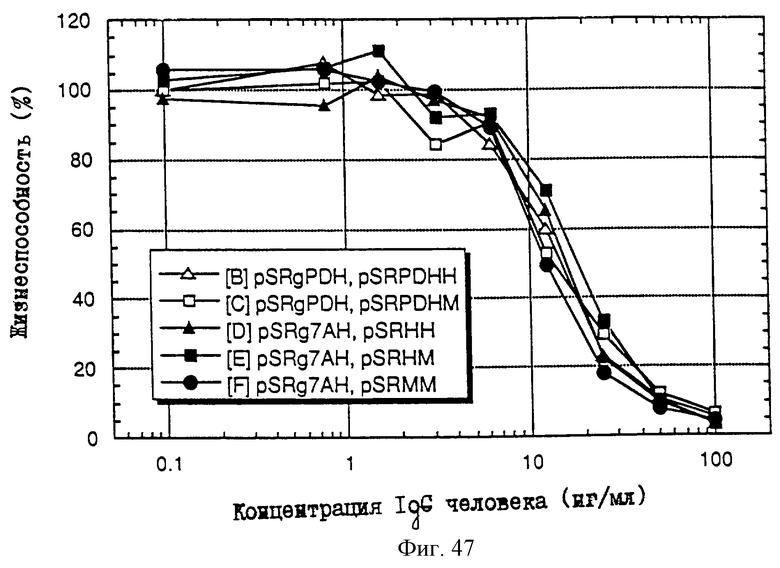
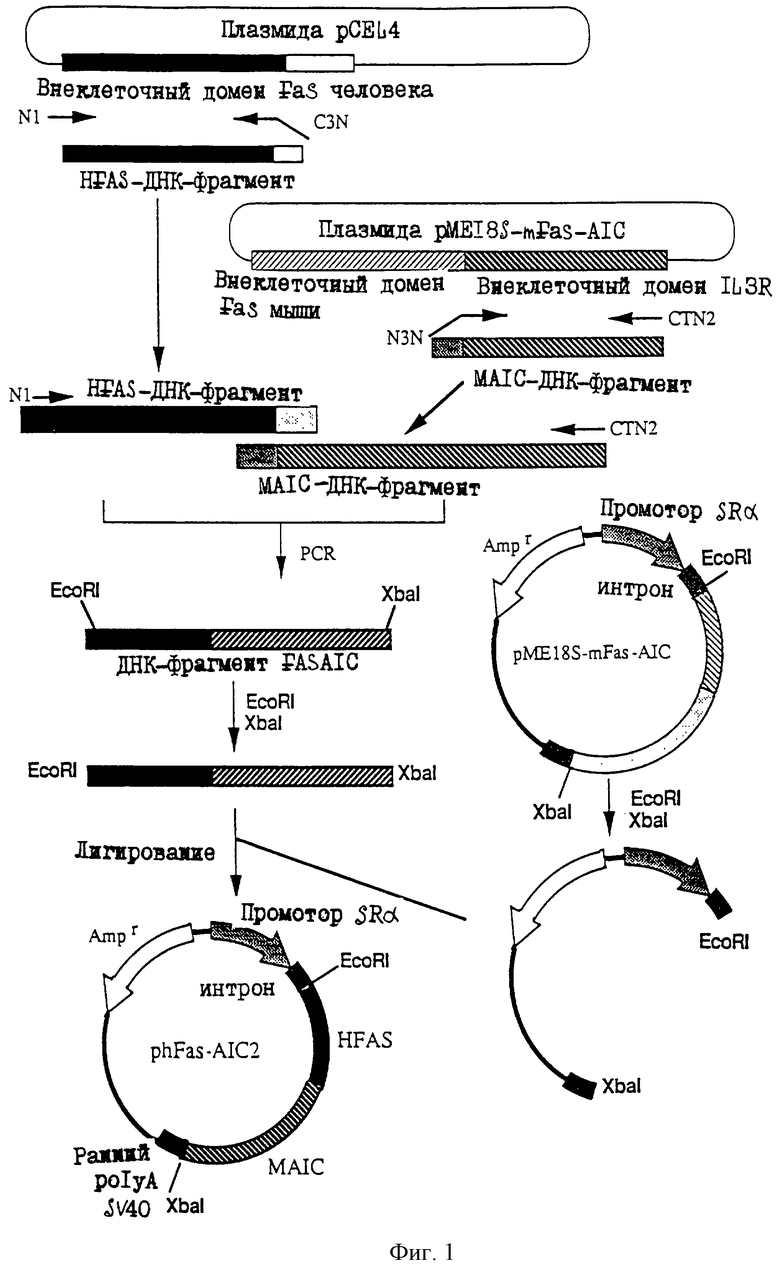
1. Антитело, регулирующее апоптоз, относящееся к классу IgG и продуцируемое гибридомой HFE7A, депонированной под номером FERM ВР-5828, содержащее антигенсвязывающую область, специфичную для эпитопа Fas-антитела, консервативного для примата и животного, не относящегося к приматам. 2. Антитело по п. 1, которое является "гуманизированным". 3. Антитело по любому из предыдущих пунктов, которое обладает способностью индуцировать апоптоз в аномальных клетках, экспрессирующих Fas, и которое обладает способностью ингибировать апоптоз в нормальных клетках. 4. Антитело по любому из предшествующих пунктов для оценки состояний у человека, обусловленных взаимодействием Fas/Fas-лиганд, где указанная оценка проводится на животных, являющихся моделями таких состояний. 5. Антитело, регулирующее апоптоз, относящееся к классу IgG, имеющее, по крайней мере, шесть CDR антитела, где указанное антитело является специфичным для Fas человека и где CDR являются идентичными CDR антитела, продуцированного гибридомой HFE7A, депонированной под номером FERM ВР-5828. 6. Антитело по п. 5, которое является "гуманизированным". 7. Антитело по п. 5 или 6, которое обладает способностью индуцировать апоптоз в аномальных клетках, экспрессирующих Fas, и которое обладает способностью ингибировать апоптоз в нормальных клетках. 8. Антитело по любому из пп. 5-7 для оценки состояний у человека, обусловленных взаимодействием Fas/Fas-лиганд, где указанная оценка проводится на животных, являющихся моделями таких состояний. 9. Антитело, регулирующее апоптоз, относящееся к классу IgG, имеющее антигенсвязывающую область, специфичную для эпитопа Fas-антигена, где указанный эпитоп является консервативным для примата и животного, не относящегося к приматам, содержащее легкую полипептидную цепь и тяжелую полипептидную цепь, где указанная тяжелая цепь имеет общую формулу (I)
-FRH1-CDRH1-FRH2-CDRH2-FRH3-CDRH3-FRH4-, (I)
где FRH1 представляет любую аминокислотную последовательность, состоящую из, 18-30 аминокислот;
CDRH1 представляет последовательность, определенную в SEQ ID No: 2;
FRH2 представляет любую аминокислотную последовательность, состоящую из 14 аминокислот;
CDRH2 представляет последовательность, определенную в SEQ ID No: 3;
FRН3, представляет любую аминокислотную последовательность, состоящую из 32 аминокислот;
CDRН3 представляет последовательность, определенную в SEQ ID No: 4;
FRH4 представляет любую аминокислотную последовательность, состоящую из 11 аминокислот, и где каждая аминокислота связывается с другой аминокислотой посредством пептидной связи,
а легкая цепь имеет следующую общую формулу (II)
-FRL1-CDRL1-FRL2-CDRL2-FRL3-CDRL3-FRL4-, (II)
где frl1 представляет любую аминокислотную последовательность, состоящую из 23 аминокислот;
CDRL1 представляет последовательность, определенную в SEQ ID No: 5;
FRL2 представляет любую аминокислотную последовательность, состоящую из 15 аминокислот;
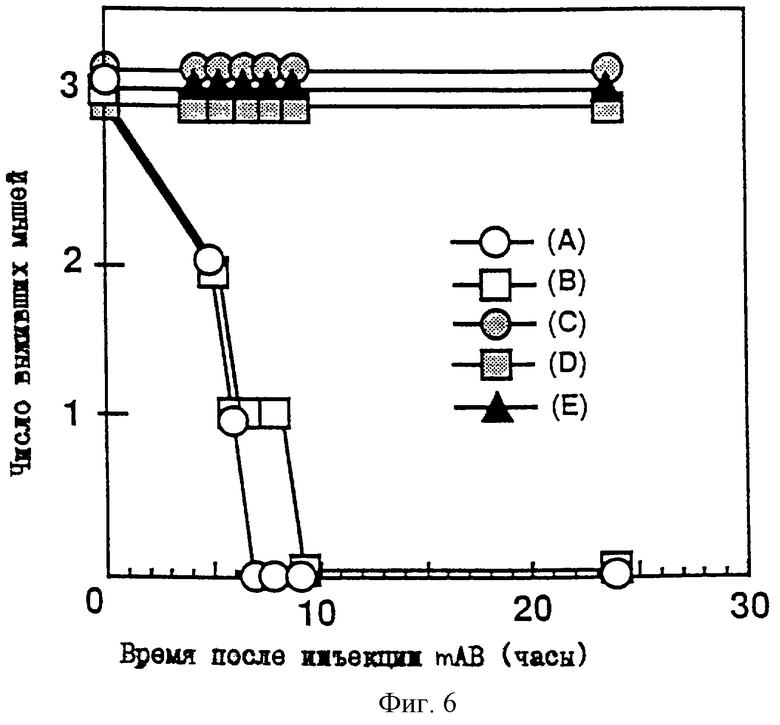
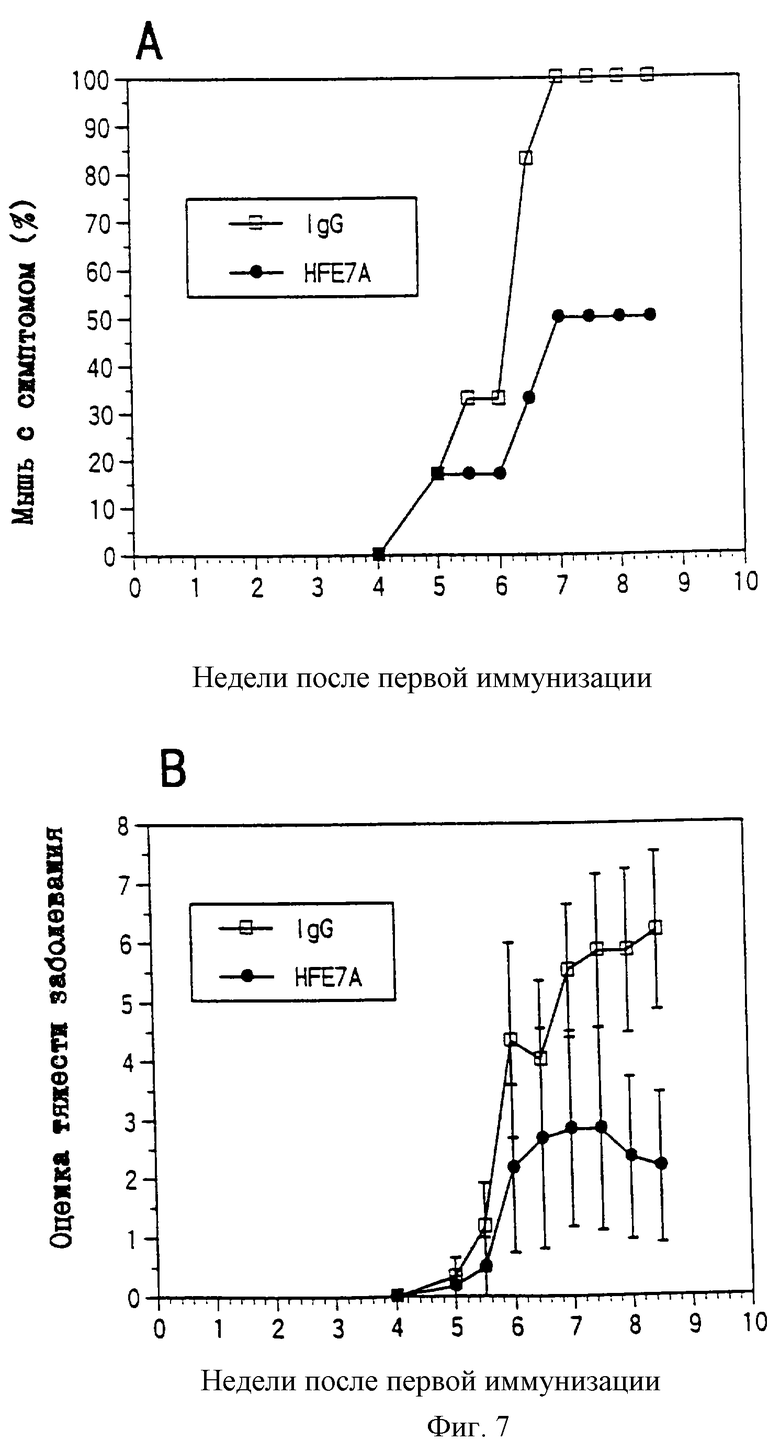
CDRL2 представляет последовательность, определенную в SEQ ID No: 6;
FRL3 представляет любую аминокислотную последовательность, состоящую из 32 аминокислот;
CDRL3 представляет последовательность, определенную в SEQ ID No: 7;
FRL4 представляет любую аминокислотную последовательность, состоящую из 10 аминокислот,
и где каждая аминокислота связывается с другой аминокислотой посредством пептидной связи. 10. Антитело по п. 9, где указанным приматом является человек. 11. Антитело по п. 9 или 10, где указанным животным, не относящимся к приматам, является грызун. 12. Антитело по п. 11, где указанным грызуном является мышь. 13. Антитело по п. 9, которое является "гуманизированным". 14. Антитело, охарактеризованное в п. 9, опосредующее свое действие через Fas-фрагмент, индуцирующее апоптоз в Т-клетках, экспрессирующих Fas, или ослабляющее аутоиммунные симптомы у gid/gld-мышей MRL; или не способное индуцировать расстройства печени; или оказывающее терапевтическое или профилактическое действие на молниеносный гепатит; или предупреждающее действие на инициацию коллаген-индуцированного артрита; или индуцирующее апоптоз в синовиальных клетках пациента с ревматоидным артритом. 15. Антитело по любому из пп. 9-14, которое обладает способностью индуцировать апоптоз в аномальных клетках, экспрессирующих Fas, и которое обладает способностью ингибировать апоптоз в нормальных клетках. 16. Антитело по любому из пп. 9-15 для оценки терапии состояний у человека, обусловленных взаимодействием Fas/Fas - лиганд, где указанная оценка проводится на животных, являющихся моделями таких состояний. 17. Гуманизированное антитело, регулирующее апоптоз, относящееся к классу IgG, имеющее антигенсвязующую область, специфичную для эпитопа Fas- антигена, который является консервативным для приматов и животных, не относящихся к приматам, где указанное антитело может быть получено путем введения соответствующих CDR, взятых из антитела, специфичного для эпитопа Fas-антигена, в каждую, по крайней мере, одну легкую цепь человека или ее фрагмент, и, по крайней мере, одну тяжелую цепь человека или ее фрагмент, причем указанное антитело содержит легкую цепь, имеющую аминокислотную последовательность, выбранную из аминокислотной последовательности 1-218 SEQ ID No: 50, аминокислотной последовательности 1-218 SEQ ID No: 52, аминокислотной последовательности 1-218 SEQ ID No: 54, аминокислотной последовательности 1-218 SEQ ID No: 107, аминокислотной последовательности 1-218 SEQ ID No: 109 в Списке последовательностей, тяжелая цепь имеет последовательность, выбранную из аминокислотной последовательности 1-451 SEQ ID No: 89 или аминокислотной последовательности 1-451 SEQ ID No: 117 в Списке последовательностей. 18. Гуманизированное антитело по п. 17, где важные аминокислоты, взятые из каркасных областей антитела, из которых могут быть получены CDR, также вводят в тяжелые и легкие цепи для сохранения структуры в сайте распознавания эпитопа. 19. Гуманизированное антитело по п. 17 или 18, которое связывается с антигеном, содержащим аминокислотную последовательность SEQ ID No: 1 в Списке последовательностей. 20. ДНК, кодирующая полипептидную часть антитела по п. 9, включающая нуклеотидную последовательность 100-753 SEQ ID No: 49, нуклеотидную последовательность 100-753 SEQ ID No: 51; нуклеотидную последовательность 100-753 SEQ ID No: 53, нуклеотидную последовательность 100-753 SEQ ID No: 106; нуклеотидную последовательность 100-753 SEQ ID No: 108; нуклеотидную последовательность 84-2042 SEQ ID NO: 88 или нуклеотидную последовательность 84-2042 SEQ ID No: 116 в Списке последовательностей. 21. Рекомбинантный ДНК-вектор, экспрессирующий антитело, охарактеризованное в п. 9, для встраивания в клетку, содержащий ДНК, имеющую последовательность, выбранную из группы, содержащей нуклеотидную последовательность 100-753 SEQ ID No: 49, нуклеотидную последовательность 100-753 SEQ ID No: 51; нуклеотидную последовательность 100-753 SEQ ID No: 53, нуклеотидную последовательность 100-753 SEQ Nо: 106; нуклеотидную последовательность 100-753 SEQ ID 108, нуклеотидную последовательность 84-2042 SEQ ID NО: 88 или нуклеотидную последовательность 84-2042 SEQ ID No: 116 в Списке последовательностей, выбранной из группы, состоящей из pHSGMM6, pHSGHM17, pHSGHH7, pHSHM2, pHSHH5, pgHSL7A62, pgHPDHV3. 22. Штамм E. coli SANK73697, депонированный под номером FERM ВР-6071, трансформированный плазмидой pHSGMM6, продуцирующий антитело по п. 9. 23. Штамм E. coli SANK73597, депонированный под номером FERM ВР-6072, трансформированный плазмидой pHSGHM17, продуцирующий антитело по п. 9. 24. Штамм E. coli SANK73497, депонированный под номером FERM ВР-6073, трансформированный плазмидой pHSGHH7, продуцирующий антитело по п. 9. 25. Штамм E. coli SANK70198, депонированный под номером FERM ВР-6272, трансформированный плазмидой pHSHM2, продуцирующий антитело по п. 9. 26. Штамм E. coli SANK70398, депонированный под номером FERM ВР-6274, трансформированный плазмидой pHSHH5, продуцирующий антитело по п. 9. 27. Штамм E. coli SANK73397, депонированный под номером FERM ВР-6074, трансформированный плазмидой pgHSL7A62, продуцирующий антитело по п. 9. 28. Штамм E. coli SANK70298, депонированный под номером FERM ВР-6273, трансформированный плазмидой pgHPDHV3, продуцирующий антитело по п. 9. 29. Способ продуцирования антитела по п. 9, являющегося анти-Fas антителом, предусматривающий культивирование штамма E. coli по любому из пп. 22-28 с последующим выделением из культуры анти-Fas антитела. 30. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19. 31. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas -лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанное состояние выбирают из группы, включающей: аутоиммунные заболевания, аллергию, атопию, артериосклероз, миокардит, кардиомиопатию, гломерулярный нефрит, гипопластическую анемию, гепатиты, синдром приобретенного иммунодефицита, и отражение органа после его трансплантации. 32. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанное аутоиммунное заболевание выбирают из группы, включающей: системную красную волчанку, болезнь Хасимото, ревматоидный артрит, гомологичную болезнь или реакцию "трансплантат против хозяина", синдром Шегрена, пернициозную анемию, болезнь Адиссона, склеродермию, синдром Гудпасчера, болезнь Крона, аутоиммунную гемолитическую анемию, бесплодие, тяжелую псевдопаралитическую миастению, рассеянный склероз, базедову болезнь, тромбоцитопеническую пурпуру или инсулинзависимый сахарный диабет. 33. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является аллергия. 34. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является ревматоидный артрит. 35. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является артериосклероз. 36. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанное состояние выбирают из группы, включающей миокардит и кардиомиопатию. 37. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является гломерулярный нефрит. 38. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является гипопластическая анемия. 39. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является гепатит. 40. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанное состояние выбирают из группы, включающей молниеносные гепатиты, хронические гепатиты, вирусные гепатиты, гепатиты С, гепатиты В, гепатиты D и алкогольные гепатиты. 41. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas-лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является отторжение органа после его трансплантации. 42. Средство для лечения или профилактики состояний, обусловленных аномалиями системы Fas/Fas -лиганд, содержащее в качестве активного ингредиента антитело по любому из пп. 1-19, где указанным состоянием является синдром приобретенного иммунодефицита. 43. Антитело, охарактеризованное в любом из пп. 1-19, в качестве активного начала при производстве лекарственного препарата для лечения или профилактики состояния по любому из пп. 30-42. 44. Гибридома HFE7A, депонированная под номером FERM ВР-5828, обладающая способностью продуцировать антитело по п. 9. 45. Способ продуцирования антитела, охарактеризованного в п. 9 и имеющего антигенсвязывающую область, специфичную для эпитопа Fas-антигена, где указанный способ предусматривает культивирование гибридомы HFE7A, депонированной под номером FERM ВР-5828, и сбор продуцированного антитела.
Приоритет по пунктам:
01.04.1997 - по пп. 1, 2, 4, 9, 10, 11, 12, 13, 16 и 45;
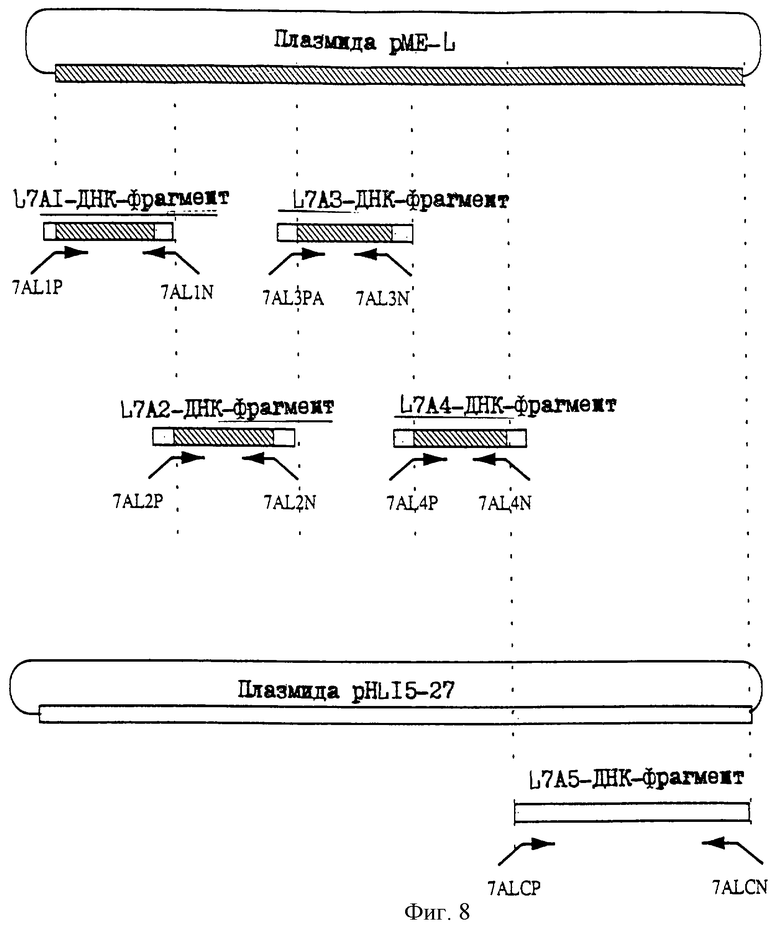
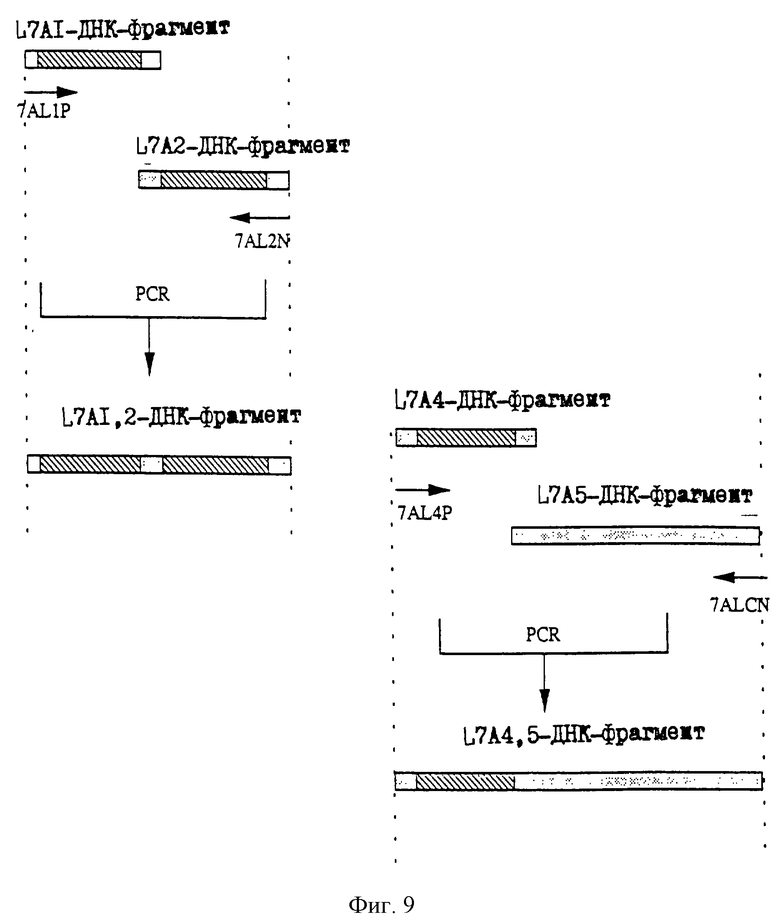
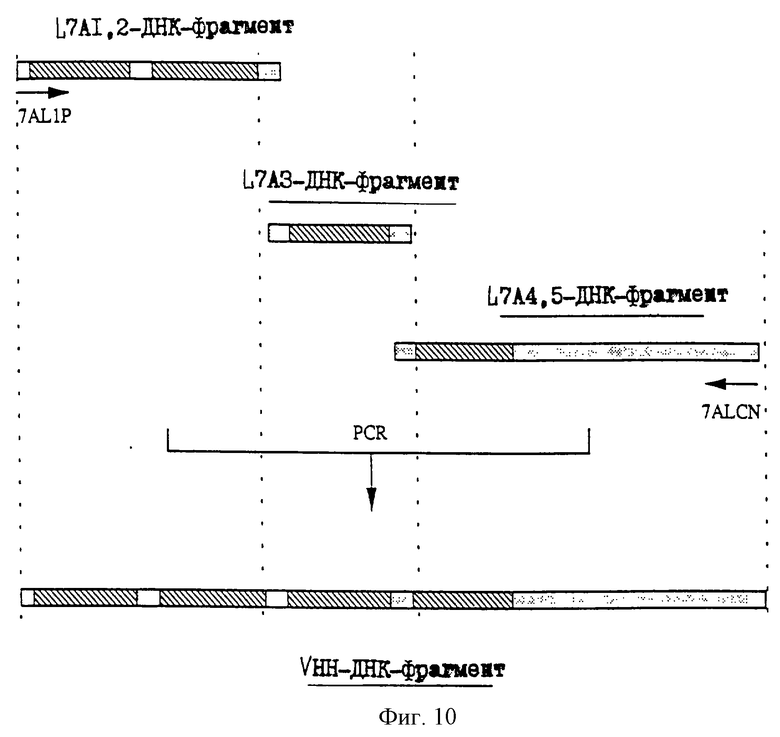
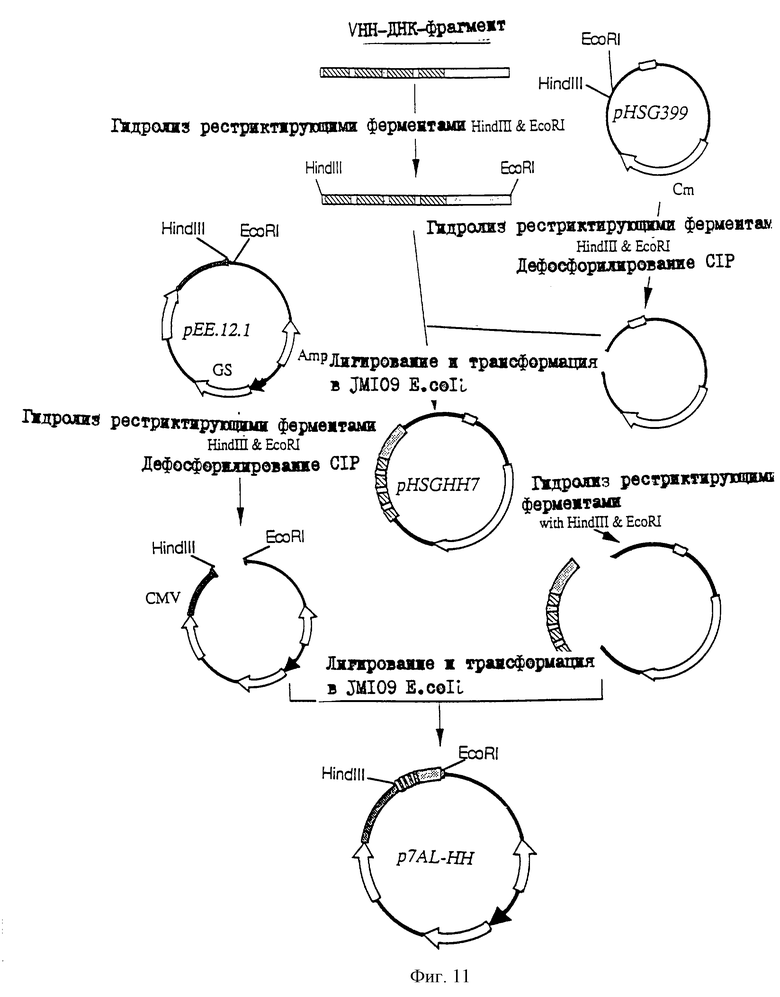
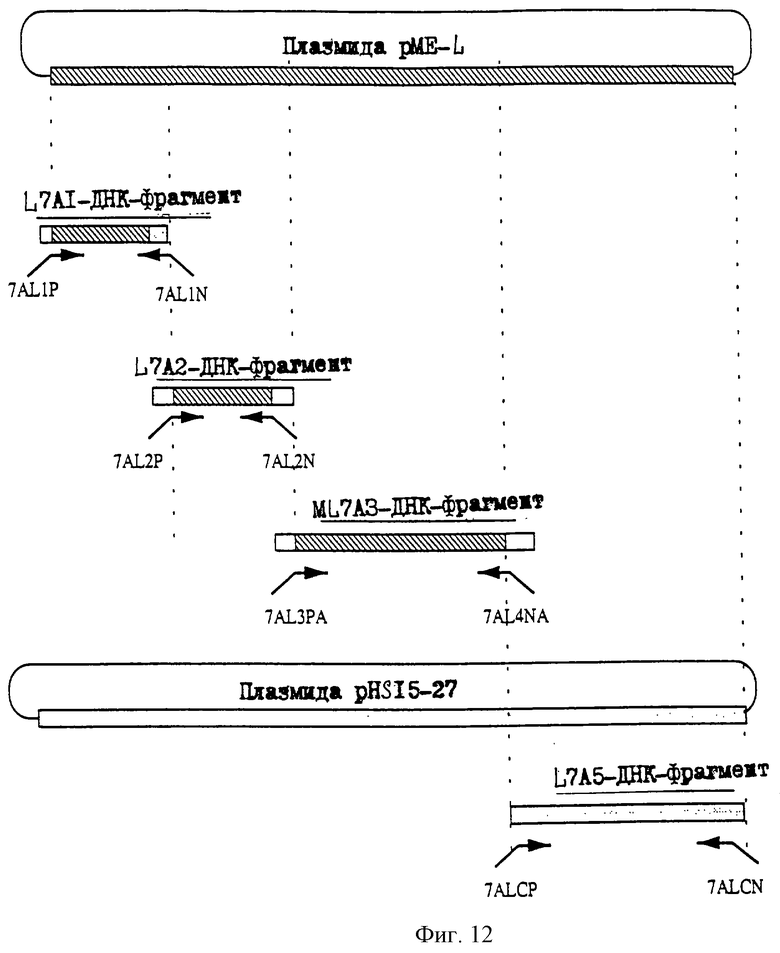
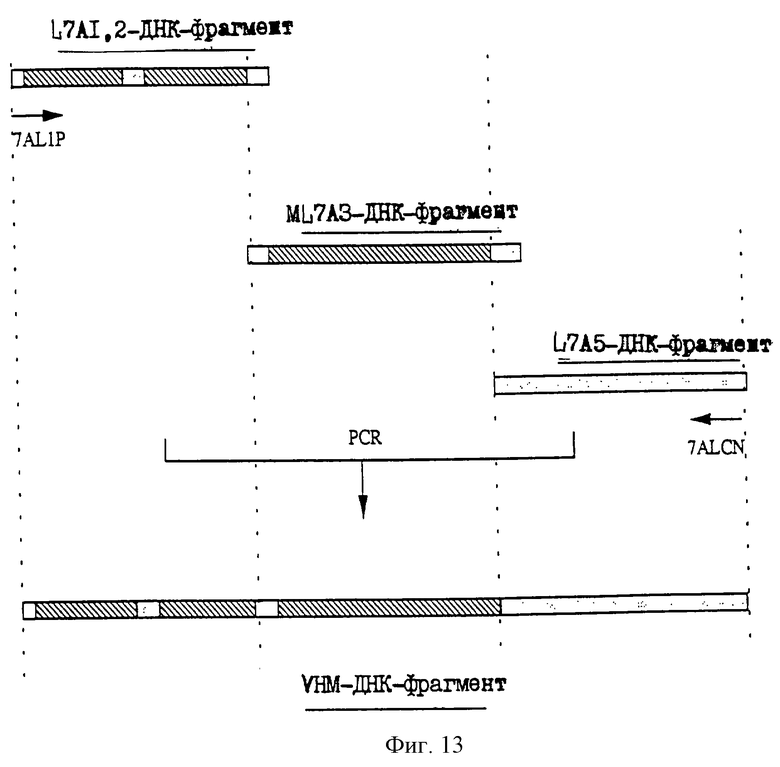
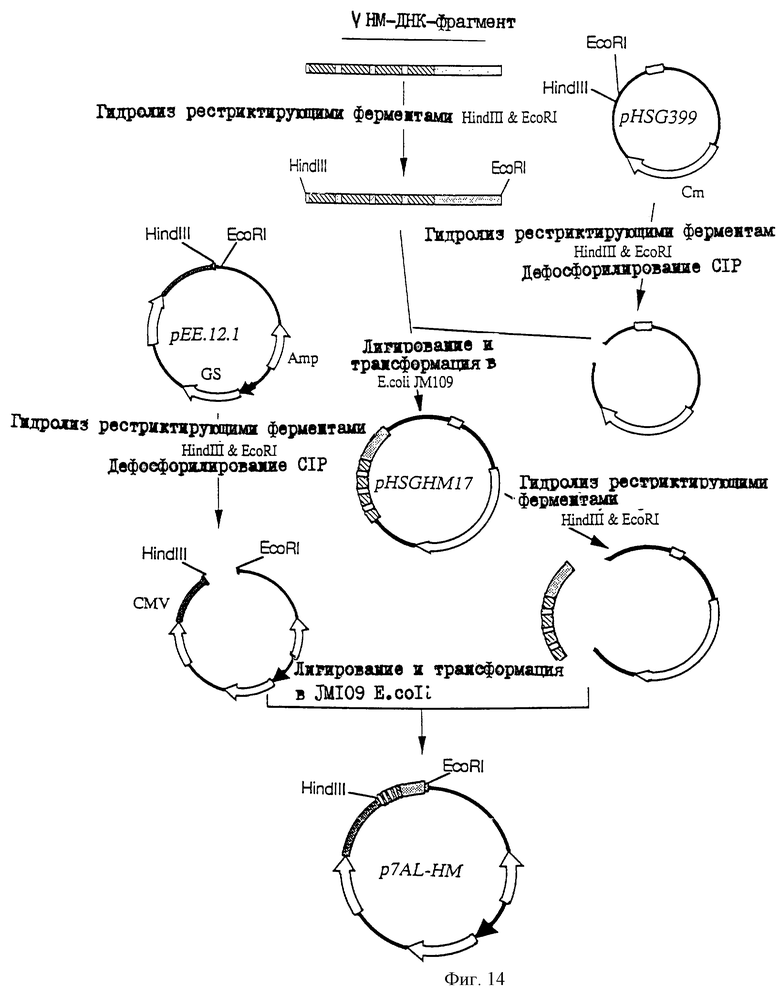
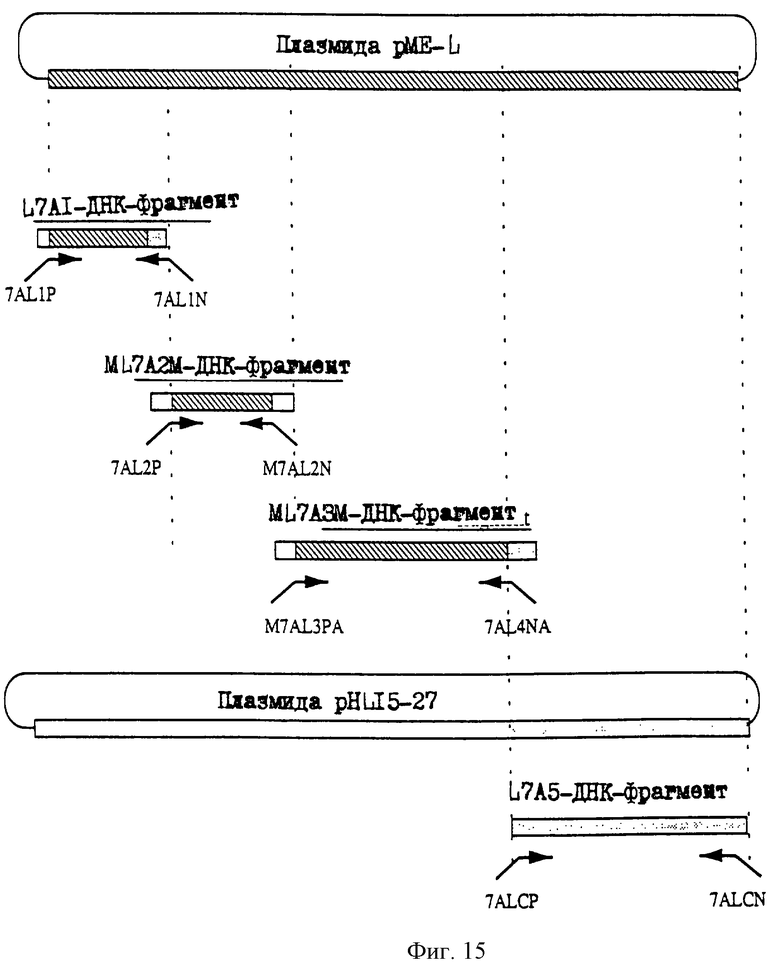
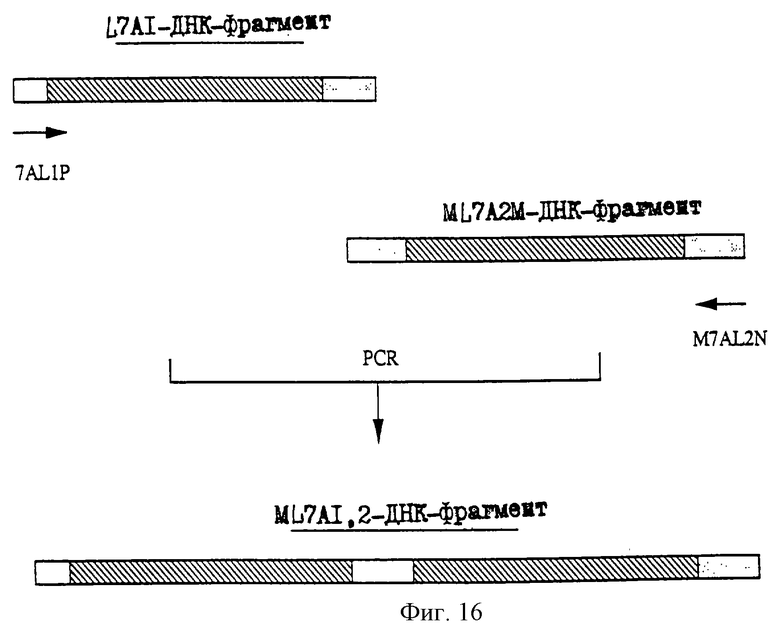
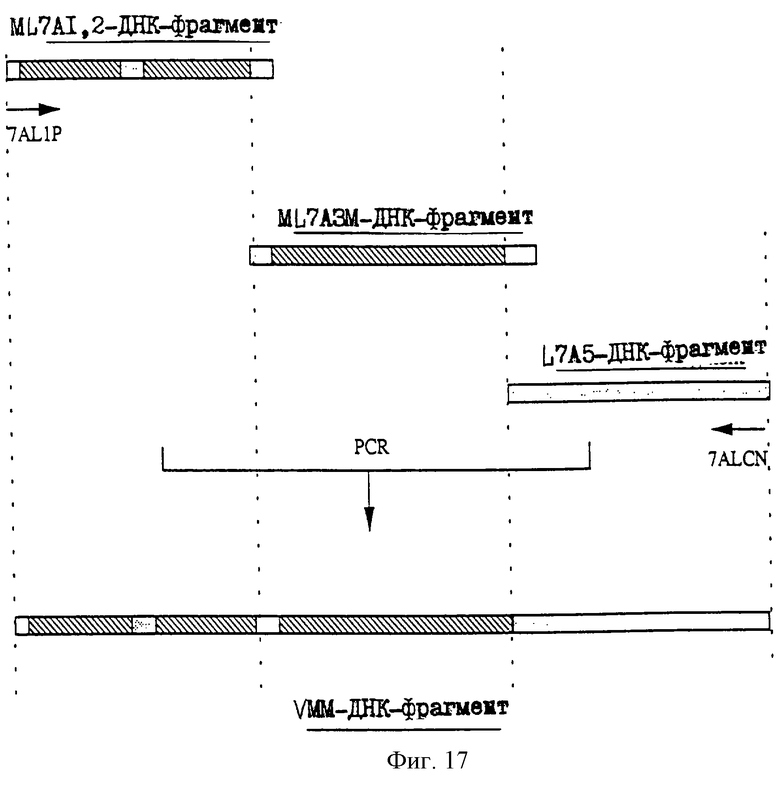
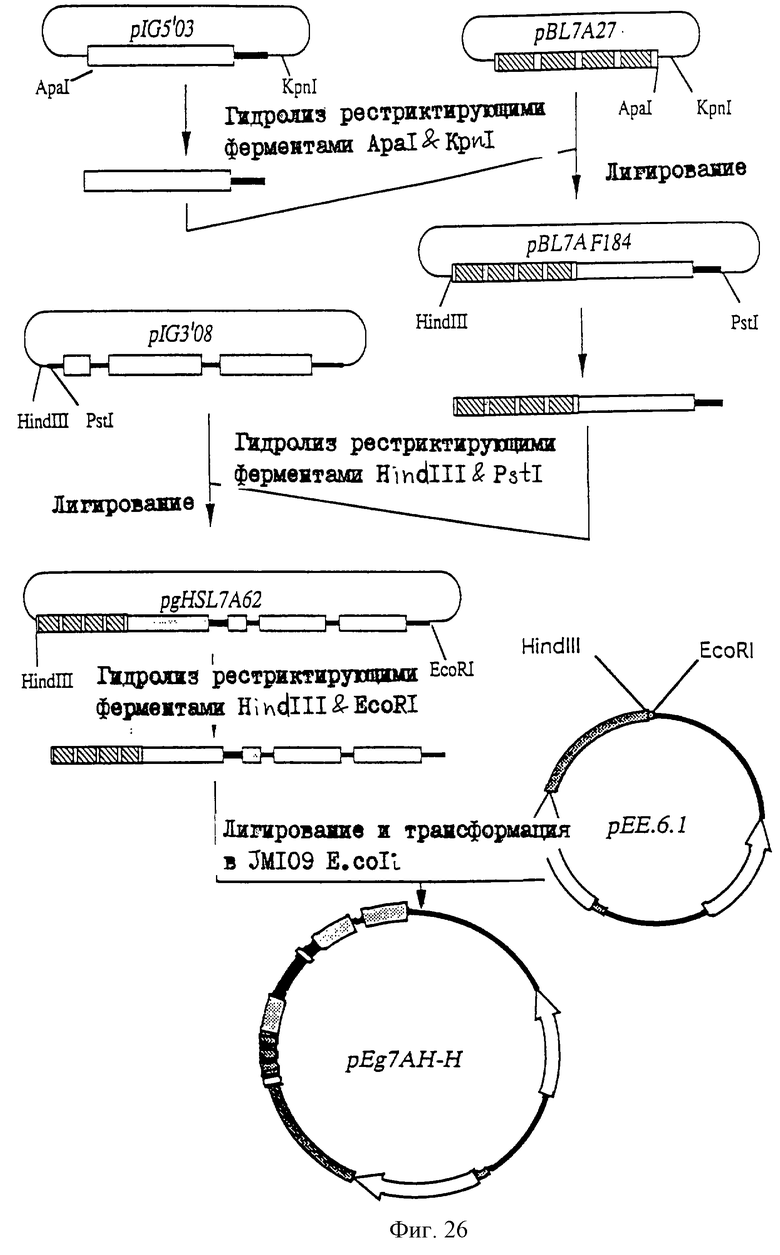
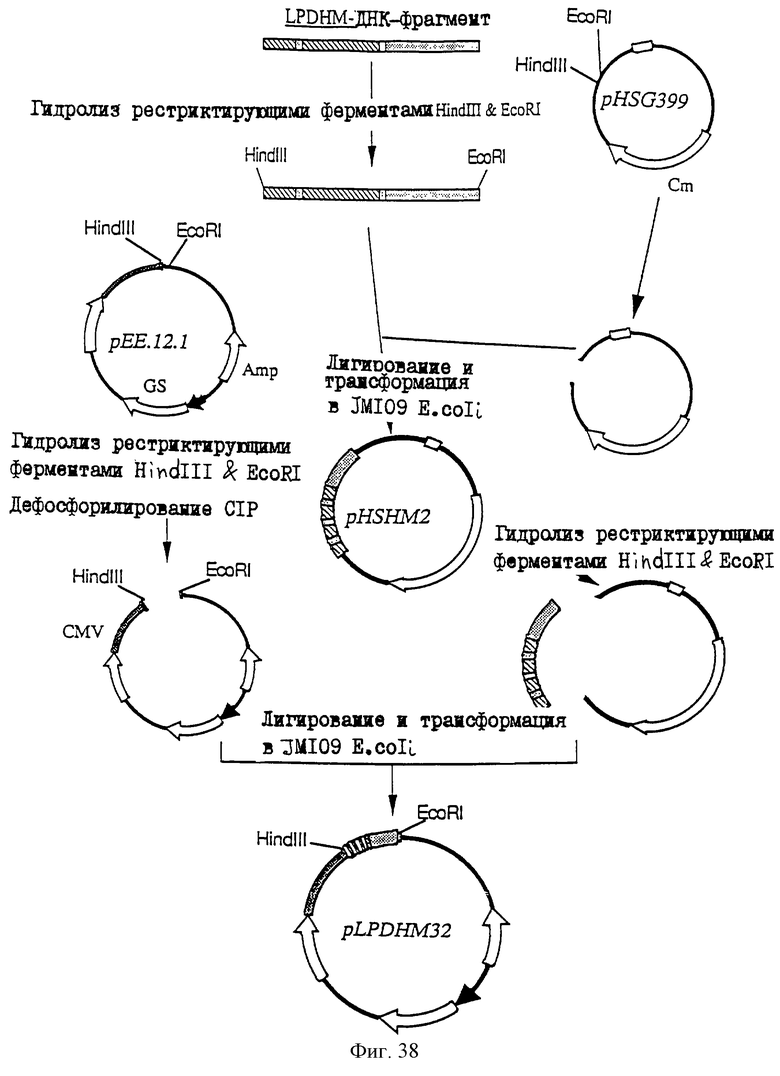
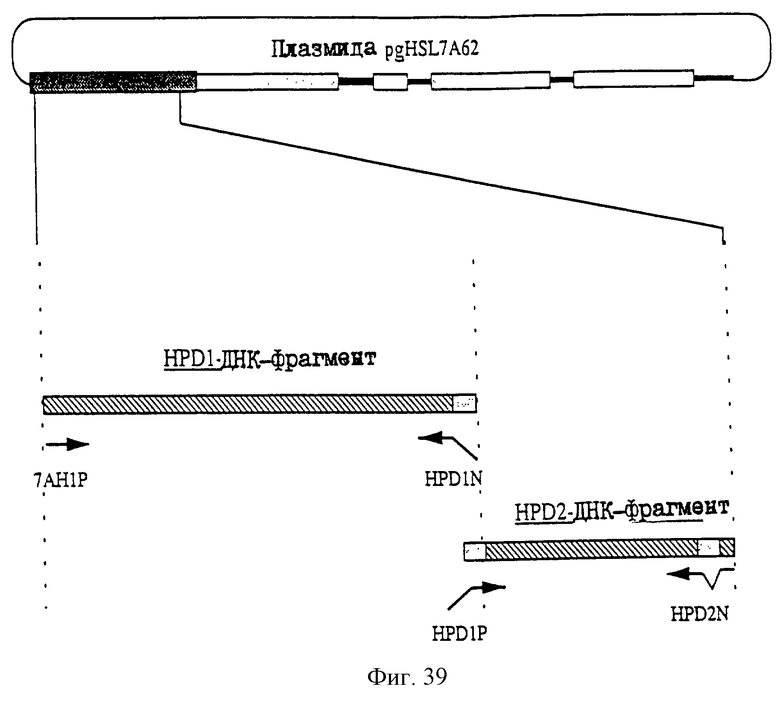
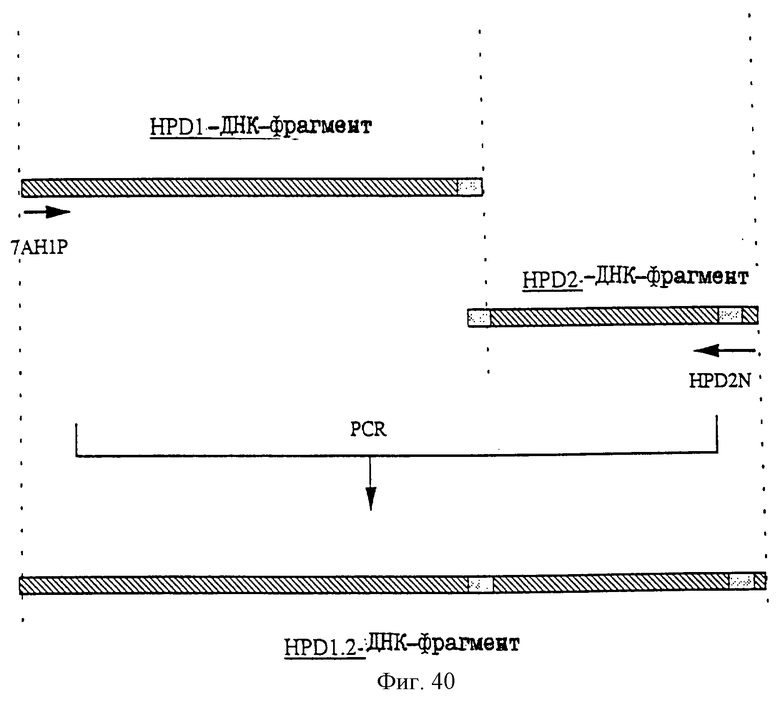
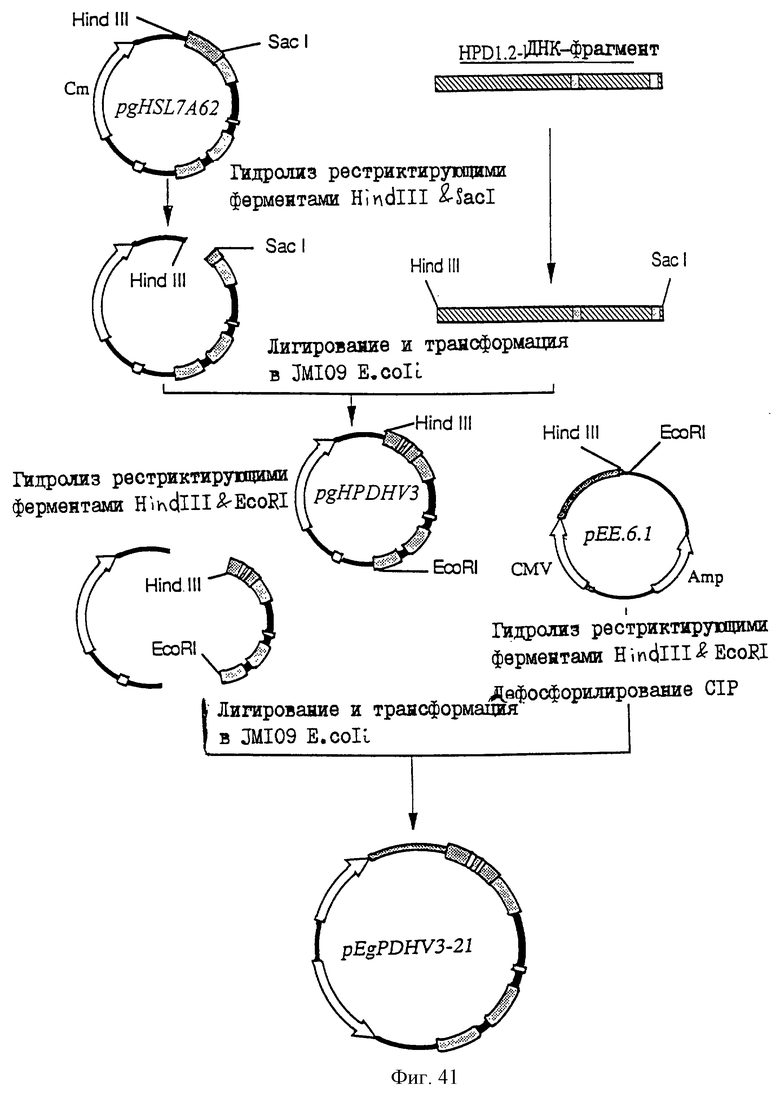
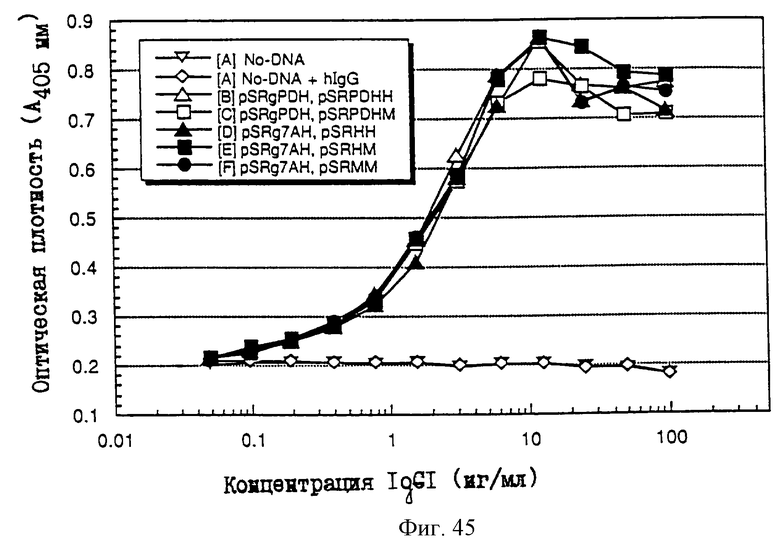
25.06.1997 - по пп. 3 и 15;
08.10.1997 - по пп. 14, 23, 24, 25 и 28;
31.06.1998 - по пп. 5-8, 17-22, 26, 27 и 29-44.