Область техники
Настоящее изобретение относится к способу получения молекулярного йода in situ в желудке млекопитающего с целью использования его в качестве эффективного терапевтического средства, например, для лечения синдрома фиброзно-кистозной мастопатии, а также других заболеваний, которые требуют хронического или острого введения йода с целью лечения при контролируемом отношении количества молекулярного йода к общему содержанию йода, минимально равном 0,80-1,0, и предпочтительно 0,9-1,0. Настоящее изобретение также относится к фармацевтическому составу, который может быть введен млекопитающему перорально с целью образования эффективного йодного лекарственного препарата, который после контакта с желудочным соком в желудке млекопитающего дает отношение количества молекулярного йода к общему содержанию йода, минимально равное 0,8. Способ и фармацевтические составы для перорального введения согласно настоящему изобретению образуют молекулярный йод внутри организма только при контакте с желудочным соком в желудке млекопитающего и с отношением количества молекулярного йода к общему содержанию йода, минимально равным 0,8.
Уровень техники
Йод, в том числе йод, связанный с органическими веществами, неорганический йод и молекулярный йод, то есть I2, применяли для лечения заболеваний человека. Йодсодержащие соединения широко использовали в качестве отхаркивающих средств. Патенты США 4187294; 4338304 и 4394376 раскрывают роль составов, содержащих йод, связанный с белками, в лечении гиперхолестеринемии, диабета и гиперлипидемии. Патент США 4259322 раскрывает сущность средства для лечения туберкулеза, содержащего йодид натрия. Позже патенты США 4816255; 5171582; 5250304 и 5389385 раскрыли сущность составов, содержащих "элементарный йод" (I2) в воде и предназначенных для перорального приема людьми с целью лечения разнообразных заболеваний людей. Патент США 5589198 раскрывает преимущества использования элементарного йода или "металлического йода" в фармацевтически приемлемых носителях при лечении синдрома фиброзно-кистозной мастопатии.
Большая часть предшествующей литературы ссылается на "йод" неточно. Слово "йод" использовалось в литературе для обозначения нескольких различных видов химических веществ, которые содержат атомы йода. Многие различные соединения с определенными и принципиально различными свойствами содержат йод. Например, литература по йодной дезинфекции четко показывает, что биоцидная эффективность различных видов йода очень различна; молекулярный йод (I2) является активным биоцидным средством, тогда как йодид (I-) не обладает биоцидной активностью вообще или обладает малой биоцидной активностью. Традиционная точка зрения в области токсикологии (R.С. Haynes Jr. и F. Murad, "Thyroid and Antithyroid Drugs" в книге Goodmans and Gilman's the Pharmacological Basis of Therapeutics, Eds. A.G. Gilman et al., 7th ed., pp. 682-815, W. B. Saunders, Philadelphia) состояла в том, что молекулярный йод и йодид имеют идентичные профили токсичности; однако для обоснования этого предположения не было приведено прямых экспериментальных данных. В действительности, токсичность и терапевтическая эффективность этих различных видов йода может очень сильно варьироваться, как и их биоцидная активность. К сожалению, фармацевтическая литература о йоде не выявила различий между свойствами многих различных видов химических соединений, содержащих атомы йода.
Наиболее серьезное беспокойство по поводу введения фармацевтических средств, содержащих йод, связано с потенциальной возможностью токсических реакций. В этой связи полагают, что йодид является формой йода, ответственной за "отравление йодидом" или "йодизм". Не существует возможности предсказать, у какого из больных возникнет неблагоприятная реакция на йодид, а у каждого отдельного индивидуума чувствительность к йоду время от времени может колебаться. При "йодизме" может возникнуть группа симптомов. Симптомы могут включать жжение во рту и глотке; болезненность зубов и десен; повышенную саливацию; ринит, раздражение дыхательных путей; кашель; головную боль; увеличение желез; воспаление гортани, глотки и миндалин; поражения кожи; раздражение желудка; диарею; повышение температуры тела; анорексию и депрессию; также могут возникать тяжелые, а иногда смертельные, дерматиты (йодные дерматиты). По существу, потребление человеком йода в количествах, превышающих диапазон 0,150-1,0 мг/день, определенный исследователями ФДА (J. A. Pennington, "A review of iodine toxicity reports", J. Am. Dietetic Assoc. , v. 90, pp.1571-1581), представляет угрозу для здоровья.
Научные исследования сравнительной токсичности молекулярного йода и йодида при приеме внутрь были выполнены в начале 1990-х годов (Karia Thrall, Ph. D. Thesis, "Formation of Organic By-Products Following Consumption of Iodine Disinfected Drinking Water", Summary and Conclusion Section, Oregon State University, Department of Chemistry, 1992). Эти исследования включали эксперименты по проверке доминирующего мнения о том, что йодид и молекулярный йод являются токсикологически и физиологически эквивалентными. Одной из ключевых диагностических оценок, использованных в этих исследованиях для оценки токсичности йодных соединений, был вес щитовидной железы млекопитающих. Подострое введение йодида самцам крыс приводило к увеличению веса их щитовидных желез при концентрации йодида, равной 10 мг/кг; молекулярный йод не влиял на вес щитовидной железы даже в концентрации 100 мг/кг (Sherer et al., Journal of Toxicology and Environmental Health, v.32, pp.89-101, 1991). В этом исследовании Шерера (Sherer) не было выявлено устойчивого повышения уровней гормонов щитовидной железы до тех пор, пока животные не подвергались действию повторных дневных доз молекулярного йода, равных 10 мг на 1 кг веса тела. Из этих исследований можно сделать вывод, что йодид может влиять на вес щитовидной железы млекопитающих в концентрациях, которые в 10 раз меньше, чем вызывающие сопоставимый эффект концентрации молекулярного йода. Другой способ подтверждения этого состоит в том, что необходимо в 10 раз больше молекулярного йода, чем йодида, чтобы повлиять на функцию щитовидной железы у животных при пероральном введении составов, содержащих йод.
Тело человека содержит примерно 18-20 мг йода. Йод является неотъемлемым компонентом тироксина и трийодтиронина. Эти гормоны необходимы для поддержания нормальной метаболической активности, и они влияют почти на все ткани млекопитающих. Избыток йода может привести к дисбалансу гормонов щитовидной железы. Пониженная токсичность по отношению к щитовидной железе, которую обнаруживал молекулярный йод по сравнению с йодидом в исследованиях Шерера и соавт. , имеет важное значение для разработки фармацевтических средств для перорального приема, содержащих йод. Эти исследования показали, что, при прочих равных условиях, молекулярный йод является предпочтительной формой йода для лекарственного препарата, получаемого перорально. Это особенно важно для таких болезненных состояний, которые требуют хронического введения вышеуказанных фармацевтических средств, содержащих йод.
Первое наблюдение относительно связи йода со здоровьем молочной железы человека было сделано в 1896 г. д-ром Битсоном, который лечил метастатический рак молочной железы, используя в высоких дозах высушенную щитовидную железу. Высушенная щитовидная железа содержит огромное количество связанного с белком йода. Первое сообщение о связи состояния дефицита йода и доброкачественной дисплазии молочной железы было сделано в 1966 г. врачом, который описал 71% частоту улучшений у женщин с диспластической мастодинией, которых лечили йодом (Vishnyakova V.V. et al., "On the Treatment of Dyshormonal Huperplasia of Mammary Glands", Vestin. Sakad. Med. Mauk., USSR, v.21, p.19, 1966). Лечение дисплазии молочных желез с использованием традиционных средств китайской медицины, типа водоросли Sargassum, которая содержит высокую концентрацию йода, дало частоту излечений, равную 65,4%. Ghent (US Pat. 5389385 и 5589198) обнаружили, что использование элементарного йода лечит различные заболевания человека. Научная литература дает четкие доказательства того, что йод в нескольких различных формах является эффективным терапевтическим средством для лечения многих различных заболеваний млекопитающих.
Модели синдрома фиброзно-кистозной мастопатии на животных изучаются более 40 лет. "Модель дефицита йода на крысе" была использована для определения корреляции дефицита йода с дисплазией молочной железы. Несколько исследований дали доказательства того, что йод может вызывать обратное развитие дисплазии молочной железы. Исследования на людях показали улучшение или полное устранение синдрома фиброзно-кистозной мастопатии через несколько месяцев терапии йодом. К другим болезненным состояниям млекопитающих, которые лечили йодом, относятся кисты яичников, предменструальный синдром, рак молочной железы и эндометриоз.
Для удобства некоторые термины, используемые в описании, примерах и прилагаемой формуле изобретения, определены ниже.
Термин "молекулярный йод", использованный здесь, относится к двухатомному йоду, который обозначают химическим символом I2 и который существует в виде жидкости.
Термин "элементарный йод", использованный здесь, относится к твердому двухатомному йоду, который обозначают химическим символом I2.
Термин "йодид" или "йодидный анион" относится к форме йода, которую обозначают символом I-. Подходящие противоионы для йодидного аниона включают натрий, калий, кальций и тому подобные.
Термин "трийодид" относится к форме йода, которую обозначают химическим символом I. Специалистам в данной области техники известно, что "трийодид" образуется в результате взаимодействия одного йодидного аниона и одной молекулы молекулярного йода по закону действующих масс, и что трийодид быстро диссоциирует на йодидный анион и молекулу молекулярного йода.
Термин "общее содержание йода", использованный здесь, относится к следующим видам йода: молекулярному йоду, йодиду, йоду в форме комплексов с органическими веществами, ковалентно связанным формам йода, йодиту, трийодиду, полийодидам, содержащим более 5 атомов йода, и элементарному йоду.
Термин "скорость образования йода", использованный здесь, обозначает скорость, с которой молекулярный йод образуется в жидкой среде, в частности в желудке млекопитающего.
Термин "отношение молекулярного йода", использованный здесь, обозначает отношение количества молекулярного йода (I2) ко всем другим видам йода, таким как йодид, трийодид и полийодиды, содержащие более 5 атомов йода.
Элементарный йод имеется в продаже в виде сине-черных кристаллов с сильным металлическим блеском. Основная трудность при приготовлении подходящего состава для перорального введения, содержащего молекулярный йод, связана с основными физико-химическими свойствами этого элемента. Все твердые формы элементарного йода легко возгоняются с образованием фиолетовых паров. Действительно, атмосферный йод является основным компонентом глобального круговорота йода. К сожалению, легкая возгонка элементарного йода приводит к характерной для него нестабильности, которая осложняет или препятствует использованию его как такового в качестве активного ингредиента в фармацевтических препаратах. С элементарным йодом сочетают другие химические вещества с целью создания стабильных препаратов, содержащих молекулярный йод. Существует три различных типа или категории составов, содержащих йод, для перорального введения, которые использовались для лечения болезненных состояний у млекопитающих: (1) йод, связанный с органическими веществами, в том числе ковалентно связанный йод и йод в виде гидрофобных/ионных комплексов, (2) неорганический йод и (3) водный раствор молекулярного йода.
Органические соединения йода, которые использовались "без маркировки" в качестве пищевых йодсодержащих добавок, были разработаны для использования в качестве контрастирующих средств при рентгенографии (рентгенонепроницаемые вещества). Например, лимфография используется для выявления и оценки аномалий лимфатической системы и для ориентировки при хирургическом удалении лимфатических узлов. Рентгенонепроницаемые вещества на основе йода также используются при некоторых других диагностических процедурах, например холецистографии, миелографии, урографии, ангиографической холангиографии. Для этой цели было использовано несколько различных органических йодсодержащих соединений, в том числе β-(4-гидрокси-3,5-дийодфенил)-α-фенилпропионовая кислота, β-(3-амино-2,4,6-трийодфенил)-α-этилпропионовая кислота, йодфенилундецилат, 3,5-диацетамидо-2,4,6-трийодбензоат, 3,5-диацетамидо-2,4,6-трийодбензойная кислота и этиозидированное масло. Атомы йода в этих соединениях ковалентно связаны с органическими молекулами. В качестве терапевтических средств использовались и другие формы органического йода, в том числе протеинсвязанный йод, высушенная щитовидная железа и йод, метаболически включенный в куриные яйца.
Составы, содержащие неорганический йод, которые использовались в качестве оральных терапевтических средств, включают йодиды натрия или калия, настойку йода или раствор Люголя и органические йодиды, которые освобождают йодид. Водные рецептуры такого типа фактически содержат очень малое и/или непредсказуемое отношение количества молекулярного йода к общему содержанию йода. Фактически эти рецептуры обычно содержат меньшую молярную концентрацию молекулярного йода, чем другие формы йода. Например, раствор Люголя содержит примерно 129000 промилле общего йода, но только 170 промилле молекулярного йода, то есть его доля равна 0,0013.
Чистых водных растворов молекулярного йода в продаже нет. Известно, что молекулярный йод нестабилен в воде, и эта нестабильность является функцией рН. Молекулярный йод гидратируется водой и, в водной системе, претерпевает ряд реакций, изображенных ниже в виде уравнений 1-3.
I2+H2O=HOI+I-+H+ (1)
3HOI=IO+2I-+3H+ (2)
I2+I-=I (3)
Невозможно изготовить и разлить по флаконам стабильный водный раствор, который содержит долю молекулярного йода, равную минимум 0,8. Для клинических применений это ограничение ранее относилось к приготовлению водных растворов йода непосредственно перед употреблением и приемом его внутрь. Элементарный йод очень медленно растворяется в воде. Длительное время, необходимое для растворения элементарного йода, приводит к потере некоторого количества ранее образовавшегося молекулярного йода из-за его реакции с водой, как показано выше в уравнении (1). В результате этого существуют проблемы с устойчивостью и простотой использования этого способа. Составы, которые содержат несколько различных фармакологически активных веществ с различными профилями токсичности, не являются предпочтительными в качестве фармацевтических средств.
Идеальный лекарственный препарат обеспечивает желаемый эффект у всех больных, не вызывая токсических эффектов. Взаимосвязь между желательными и нежелательными эффектами лекарственного препарата называют его терапевтическим индексом или селективностью. Терапевтический индекс лекарственного препарата часто выражают как отношение средней токсической дозы к средней эффективной дозе. В клинических исследованиях селективность лекарственного препарата часто выражают косвенно, суммируя картину и природу неблагоприятных эффектов, вызываемых терапевтическими дозами лекарственного препарата, и указывая долю больных с неблагоприятными побочными эффектами. Каждый отдельный вид йода следует считать отдельным уникальным лекарственным препаратом, так как было показано, что они имеют разную токсичность при приеме внутрь и разные профили терапевтических индексов. Поэтому предпочтительное "йодное" лекарственное средство представляет собой состав, в котором все или преобладающее большинство атомов йода присутствуют в желаемой форме.
Современный уровень техники демонстрирует, что молекулярный йод является эффективным терапевтическим средством при многих болезненных состояниях. Например, Eskin et al. (Biological Trace Element Research, v.49, pp.9-18, 1995) показали, что молекулярный йод является "определенно более эффективным в отношении снижения гиперплазии протоков и перилобулярного фиброза молочных желез, чем йодид". Научная литература также свидетельствует, что токсичность йодида при приеме внутрь выше, чем у молекулярного йода. Другим подтверждением является то, что современный уровень техники демонстрирует, что у животных и людей из всех форм йода наибольшим терапевтическим эффектом при пероральном введении обладает молекулярный йод; молекулярный йод является также наименее токсичной формой йода при оральном введении. Поэтому современный уровень техники свидетельствует, что из всех форм йода предпочтительным для пероральных йодсодержащих фармацевтических средств является молекулярный йод. Это различие в токсичности особенно важно при таком режиме лечения, который требует хронического введения.
Таким образом, токсичность фармацевтических йодсодержащих средств для перорального введения непосредственно связана с соотношением и концентрацией различных видов йода, присутствующих в них; известная нестабильность I2-формы создает трудности при разработке йодсодержащих фармацевтических составов для перорального введения с предпочтительным терапевтическим индексом. Настоящее изобретение описывает способы решения проблем, которые существуют на данном уровне техники, с доставкой молекулярного йода в приемлемом стабильном фармацевтическом средстве для перорального применения.
Краткое описание графических материалов
Чертеж изображает концентрацию свободного молекулярного йода, образующегося из 0,375 мМ раствора йодата натрия при добавлении йодида натрия в концентрации 20 ммоль/л. Чертеж также изображает концентрацию йодида, который не окислен до молекулярного йода.
Сущность изобретения
Настоящее изобретение относится к новому фармацевтическому составу для перорального приема млекопитающим, который превращается в эффективное йодсодержащее лекарственное средство при контакте с желудочным соком млекопитающего с отношением количества молекулярного йода к общему содержанию йода, равным от 0,8 до 1,0. Настоящее изобретение также относится к способу получения эффективного йодсодержащего лекарственного препарата in situ, в желудке млекопитающего для лечения синдрома фиброзно-кистозной мастопатии и других заболеваний, которые требуют хронического или острого введения йода с лечебной целью. Фармацевтические составы для перорального приема согласно настоящему изобретению образуют молекулярный йод только при контакте с желудочным соком в желудке млекопитающего в фармацевтически приемлемой дозе с отношением количества молекулярного йода к общему содержанию йода, превышающим 0,8. Следует понимать, что в настоящее время невозможно создать и/или разлить по флаконам стабильный водный раствор, содержащий молекулярный йод с отношением количества молекулярного йода к общему содержанию йода, равным или превышающим 0,8.
Йод возгоняется при комнатной температуре и реагирует с водой так, как это описано выше. Эти два свойства делают очень трудным разработку рецептуры, содержащей молекулярный йод; особенно трудно приготовить составы, в которых большая часть йода находится в молекулярной форме. Фармацевтический состав согласно настоящему изобретению не включает элементарного йода или молекулярного йода in situ. Данное изобретение обеспечивает резко повышенную стабильность по сравнению с составом, который содержит молекулярный йод. Данным изобретением обеспечивается регулирование образования молекулярного йода, что приводит к образованию молекулярного йода с отношением количества молекулярного йода к общему содержанию йода, лежащим между 0,8 и 1,0, и более предпочтительно - между 0,9 и 1,0, при контакте с желудочным соком.
В соответствии со способом согласно настоящему изобретению терапевтический йод вводят млекопитающему путем включения в пищу млекопитающего эффективного количества окислителя и восстановителя для разных форм йода, которые будут вызывать окислительно-восстановительные реакции при контакте с желудочным соком, имеющимся в желудке млекопитающего, так что in situ будет образовываться молекулярный йод с отношением количества молекулярного йода к общему содержанию йода, превышающим по меньшей мере 0,8.
Фармацевтический состав согласно настоящему изобретению не включает ни элементарного йода, ни водного раствора молекулярного йода; составам, описанным здесь, необходима среда, обеспечиваемая жидким содержимым желудка, для начала образования молекулярного йода. Состав согласно настоящему изобретению может быть создан в форме набора не реагирующих между собой компонентов, которые реагируют с жидким содержимым желудка с образованием молекулярного йода in situ. Фармацевтический состав согласно настоящему изобретению может быть включен в отдельный порошок, капсулу, таблетку, жидкость или эмульсию; кроме того, может быть использована комбинация этих физических форм. В зависимости от фармацевтически приемлемой среды, в которую включается компоненты состава, фармацевтический состав согласно настоящему изобретению может быть водным или неводным.
Преимущества образования молекулярного йода in situ внутри желудка при контакте с желудочным соком: 1) получение стабильного, фармацевтически приемлемого состава; 2) получение контролируемой дозы молекулярного йода in situ и 3) возможность регулирования доли молекулярного йода при уровнях, превышающих 0,8.
Способы, описанные выше, позволяют добиться точного режима дозировки и уменьшить нежелательные токсические побочные эффекты, связанные с йодидом, трийодидом и полийодидами. Кроме того, повышается терапевтическая эффективность в отношении ряда болезненных состояний типа синдрома фиброзно-кистозной мастопатии.
Подробное описание изобретения
Способ, описанный в этой заявке, описывает систему образования молекулярного йода in situ, в желудке. При разработке такого состава необходимо учесть состав жидкого содержимого желудка. Низкий рН жидкого содержимого желудка влияет на этот тип химических реакций. Принципиальные степени окисления йода равны -1, +1, +3, +5 и +7. Соединения, которые представляют эти состояния, включают KI, ICl, ICl3, IF5 и Na5IO6 соответственно. Известна двуокись йода IO2, и, по-видимому, она является единственным представителем степени окисления +4.
Молекулярный йод (I2) может образовываться либо при восстановлении форм йода с положительной степенью окисления, либо при окислении йодидного аниона (I-). Альтернативно можно использовать окислитель и восстановитель, если они оба содержат йод. Окислительно-восстановительные потенциалы для разных степеней окисления йода в кислом растворе представлены ниже: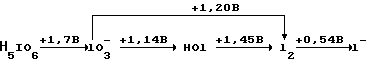
Существует много видов соединений, содержащих йод с различными степенями окисления. Положительные степени окисления обычно обнаруживаются в неорганических соединениях, таких как кислоты, соли, окислы или галогениды. Отрицательные степени окисления проявляются в таких видах йодных соединений, которые имеют форму йодидных солей или органических йодсодержащих соединений.
Степени окисления йода и некоторые виды йодсодержащих соединений, которые являются примерами этих степеней окисления, приведены ниже:
+7: ортойодная кислота (Н5IO6), метайоднокислый калий (КIO4), метайоднокислый натрий (NaIO4);
+5: йодноватая кислота (НIO3), йодат калия (КIO3), вторичный кислый йодат калия (KHI2O6), йодат натрия (NаIO3), окись йода (I2O5);
+3: треххлористый йод (IСl3);
+1: однобромистый йод (IBr), однохлористый йод (ICl);
-1: йодистоводородная кислота (HI), йодид натрия, йодид калия, йодид аммония, йодид алюминия (АlI3), трийодид бора (ВI3), йодид кальция (CaI2), йодид магния (MgI2), йодоформ (СНI3), тетрайодэтилен (С2I4), йодуксусная кислота, йодзамещенный этиловый спирт, йодуксусный ангидрид.
Молекулярный йод может образовываться при окислительно-восстановительных реакциях в соответствии с вышеуказанными окислительно-восстановительными потенциалами полуреакций для разных форм йода. Другой вид этой формулировки следующий: вещества с более низкими окислительными потенциалами могут восстанавливать окисленные формы йода в молекулярный йод, а вещества с более высоким окислительным потенциалом, чем у йодида, могут окислять йодид до молекулярного йода. Существует много химических веществ, известных специалистам в данной области техники, которые будут действовать таким образом.
Для способа образования йода in situ желательно создание состава, который нетоксичен при контакте с жидкостями, содержащимися в желудке. Другим параметром этого способа является скорость, с которой образуется молекулярный йод при контакте состава с жидким содержимым желудка. Еще одной важной чертой этого способа является получение воспроизводимого количества молекулярного йода.
Подходящие окислители для способа образования молекулярного йода in situ включают перекись водорода, йодат, другие перекисные соли щелочных металлов типа гидроперекиси кальция и пероксидазы, которые способны окислять йодид.
Предпочтительным окислителем для настоящего изобретения является перекись водорода. Любой материал, который служит источником окислительной перекисной функции при приеме внутрь, подходит для настоящего изобретения. Термин "источник перекиси водорода" для целей настоящего изобретения и при использовании здесь должен означать любой материал, отдельно или в комбинации, который является фармацевтически приемлемым для использования в качестве предшественника для окислительной перекисной функции, включая перкарбонаты, перфосфаты, перекись мочевины, перекисные кислоты, алкилперекиси, пероксикислоты и пербораты. Можно использовать смеси двух или нескольких из этих веществ.
Предпочтительным окислителем для настоящего изобретения для использования в комбинации с йодидным анионом является йодат. Йодатный анион состоит из одного атома йода и трех атомов кислорода и имеет связанный с ним отрицательный заряд при рН, равном 7,0. Предпочтительные источники йодата включают йодат натрия, йодат кальция и йодат калия. Термин "источник йодата" для целей настоящего изобретения и при использовании здесь должен означать любое вещество отдельно или в комбинации, которое фармацевтически приемлемо для использования в качестве предшественника для освобождения или доставки йодата при контакте с жидким содержимым желудка.
Подходящие восстановители для способа образования молекулярного йода in situ включают йодид, тиосульфат натрия, аскорбиновую кислоту, простые восстанавливающие сахара, такие как лактоза, имидазол и другие восстановители, хорошо известные специалистам в данной области техники.
Окислитель и восстановитель, используемые для получения молекулярного йода, можно комбинировать в сухом виде с другими хорошо известными фармацевтическими наполнителями для облегчения производства капсул, таблеток и пилюль. Примеры таких хорошо известных нетоксичных наполнителей включают различные фосфатные соли, сахарозу, лактозу, мальтодекстрины, маннит, декстраты, декстрозу, глюкозу, лимонную кислоту, сорбит, микрокристаллическую целлюлозу, крахмалы, карбонат натрия, карбонат магния, карбонат калия, карбонат кальция, карбоксиметилцеллюлозу, кросс-карамелизированную целлюлозу, полиэтиленгликоль, борную кислоту, лейцин, хлорид натрия, бензоат, ацетат, олеат, стеарат магния, стеариновую кислоту, тальк и гидрированные растительные масла, гидроксиметилцеллюлозу, целлюлозу. Специалистам в данной области техники известны и другие наполнители, которые могут быть использованы для целей данной заявки.
Предпочтительные наполнители должны иметь следующие характеристики: (1) не влиять на стабильность окислителя и восстановителя; (2) не нарушать взаимодействия между окислителем и восстановителем; (3) не влиять на выход молекулярного йода; (4) не реагировать с молекулярным йодом таким образом, который влияет на абсолютную концентрацию молекулярного йода и (5) не влиять на отношение количества молекулярного йода к общему содержанию йода после образования его в желудке и в то время, пока молекулярный йод перерабатывается в желудке или тонком кишечнике млекопитающего.
Альтернативно можно включить компоненты способа генерации молекулярного йода in situ в жидкость, которую принимают внутрь до, после или одновременно с порошком, капсулой, таблеткой или другой жидкостью. Приемлемы различные жидкие составы, хорошо известные специалистам в данной области техники, обеспечивающие поддержание стабильности реагентов и образования йода. Примеры таких жидких составов могут включать (1) суспензию порошков в вязкой гидрофобной жидкости, такой как минеральное масло, или (2) эмульсии гидрофобных молекул в водной фазе.
Два диапазона дозировок молекулярного йода рассматриваются в этой заявке: диапазон для хронического введения и диапазон для острого введения. Лечение язв желудка, которые вызваны присутствием Helicobacter pylori в слизистой желудка, может быть примером болезненного состояния, которое требует острого введения. Лечение дисплазии молочных желез является примером заболевания, которое требует хронического введения. Количество молекулярного йода, которое необходимо обеспечить ежедневно для лечения дисплазии молочных желез, находится между 0,5 и 12,0 мг/день для млекопитающего женского пола весом около 45 кг с предпочтительным диапазоном потребления йода с пищей между 2,0 и 7,5 мг в день. Количество молекулярного йода, которое необходимо обеспечить ежедневно для профилактики дисплазии молочных желез, лежит между 125 мкг и 1,5 мг в день для млекопитающего женского пола весом около 45 кг при предпочтительном диапазоне потребления йода с пищей между 225 и 1250 мкг в день. Количество молекулярного йода, поставляемого в день при остром введении, может лежать между 15 и 125 мг при предпочтительном диапазоне потребления йода с пищей между 20 и 55 мг в день.
Важным параметром любого йодсодержащего фармацевтического препарата является терапевтический индекс. Терапевтический индекс для йодсодержащих фармацевтических средств пропорционален отношению количества молекулярного йода к общему количеству йода, обеспечиваемому вышеуказанным фармацевтическим средством. Чем выше отношение количества молекулярного йода к общему содержанию йода, тем выше терапевтический индекс йодсодержащего состава. Отношение количества молекулярного йода к общему содержанию йода, которое обеспечивается йодсодержащими фармацевтическими средствами, описанными в этой заявке, находится между 0,8 и 1,0, предпочтительное отношение - между 0,90 и 1,0. Для лечения болезненных состояний, которые требуют хронического введения йода, таких как синдром фиброзно-кистозной мастопатии, особенно предпочтительно, если будет создан состав, который обеспечивает отношение между 0,95 и 1,0. Так как молекулярный йод является наименее токсичной формой йода, хроническое введение перорального йодсодержащего терапевтического средства должно быть основано на использовании молекулярного йода.
Чтобы ограничить токсичность нежелательного йодида, необходимо ограничить концентрацию йодида (который сохраняется после образования молекулярного йода in situ). Количество йодида в таком составе должно обеспечивать не более 1000 мкг/день йодида при остром введении, предпочтительно он должен давать не более 150 мкг/день при хроническом применении и наиболее предпочтительно он должен давать не более 50 мкг/день. Поэтому, как описано в этой заявке, концентрация йодида в йодсодержащем фармацевтическом средстве для острого введения, которое содержит 20 мг общего йода, должно быть меньше 1 мг или 5% и предпочтительно концентрация йодида должна быть равна 150 мкг (или 0,75%) или меньше от общего веса присутствующего йода.
Отношение количества молекулярного йода к общему содержанию йода имеет предпочтительное значение, лежащее между 0,80 и 1,0, а наиболее предпочтительно отношение, лежащее между 0,90 и 1,0. Чем выше отношение количества молекулярного йода к общему содержанию йода, тем выше терапевтический индекс для йодсодержащего состава.
Скорость образования йода должна быть высокой, чтобы минимум 75% равновесной концентрации йода образовывалось в течение первых 10 минут контакта между специфическими генерирующими йод химическими агентами и жидким содержимым желудка. Если используются таблетки или капсулы, тогда минимум 70% образующегося молекулярного йода должно появиться в течение первых 45 минут контакта с жидким содержимым желудка, а предпочтительно в течение первых 20 минут.
Стабильность состава должна быть такой, чтобы минимум 90% способности к образованию молекулярного йода сохранялось после хранения в соответствующей таре при 25oС при относительной влажности воздуха 75% в течение минимум 3 месяцев, а предпочтительно 6 месяцев. Очень важно, чтобы отношение количества образовавшегося молекулярного йода к общему содержанию йода значительно не изменялось во время хранения.
Подробное описание предпочтительных примеров осуществления
Пример 1.
Эксперимент был предназначен для того, чтобы определить, может ли пероксидаза хрена (ПОХ) использоваться для катализа окисления смеси йодида/перекиси водорода в условиях, которые имитируют желудок человека. Второй целью эксперимента было определить, может ли такой состав генерировать молекулярный йод в жидком содержимом желудка даже в присутствии муцина.
Общее содержание йода было измерено путем титрования тиосульфатом, как описано в Фармакопее Соединенных Штатов Америки (ФСША). Содержание молекулярного йода измеряли по способу Готтарди (Gottardi W., Fresenius Z. Anal. Chem. , v. 314, pp.582-585, 1983), который основан на измерении окислительно-восстановительного потенциала, концентрации йодида и рН. Два рН-метра фирмы Corning модели 345 были использованы в комбинации с платиновым электродом сравнения (Fisher Cat. 13-620-115), каломельным электродом (Fisher Cat. 13-620-51), ионселективным йодидным электродом (Corning Model 476127); насыщенный раствор элементарного йода при 25oС был использован для калибровки системы.
Известно, что пероксидаза хрена катализирует образование йода в присутствии перекиси водорода посредством окисления йодида. Имитацию желудочного сока (ИЖС), описанную в ФСША, готовили следующим образом: 2,0 г хлорида натрия растворяли в 750 мл дистиллированной воды, а затем добавляли 7,0 мл соляной кислоты, содержащей 3,2 г пепсина, вместе с количеством воды, достаточным для того, чтобы довести общий объем до 1000 мл. Пероксидазу хрена (ПОХ) растворяли в ИЖС в концентрации 1,0 мг/мл. Активность пероксидазы хрена и поглощение света с длиной волны 406 нм регистрировали в течение часа. Происходило снижение абсорбции света всего на 20%, что свидетельствует, что третичная структура ПОХ относительно стабильна в присутствии ИЖС. Скорость, с которой пероксидаза хрена катализирует образование йода, соответственно снижалась к исходу часа примерно на 33%.
5 г лимонной кислоты и 1 г цитрата натрия смешивали в 1 л воды для получения буфера с рН 3,0. Готовили второй идентичный буфер, который содержал 10% муцина свиньи. Смесь двух порошков, йодида натрия (1 г) и ПОХ (5 мг), готовили и впоследствии использовали в качестве единого реагента. Инициировали следующую реакцию. 500 мл буфера или 500 мл 10% муцина смешивали с 1,0 г смеси йодида/ПОХ и 1,0 мл 30% перекиси водорода. Концентрацию молекулярного йода регистрировали как функцию времени по способу Готтарди. Через 8 мин в контрольном буфере концентрация молекулярного йода была равна 30,1 промилле; та же реакция в 10%-ном муцине свиньи дала концентрацию молекулярного йода, равную 38,1 промилле.
Этот эксперимент демонстрирует, что ПОХ может быть использована для катализа окисления йодида перекисью водорода в желудке, и она может образовывать молекулярный йод в желудочном соке и в присутствии муцина. Дополнительные эксперименты с использованием раствора Люголя, разведенного в имитации желудочного сока в различных пропорциях в присутствии 10%-ного
муцина, не дали измеримого выхода молекулярного йода. Этот эксперимент доказывает, что образование молекулярного йода в желудке in situ может давать преимущества, по сравнению с доставкой молекулярного йода в желудок.
Пример 2.
Был разработан эксперимент с целью сравнить различия, если они существуют, между образованием молекулярного йода in situ и доставкой молекулярного йода в окружающую среду, которая имитирует жидкое содержимое желудка человека. Второй целью было определить, можно ли создать значительные концентрации молекулярного йода в среде, обнаруживаемой в желудке человека.
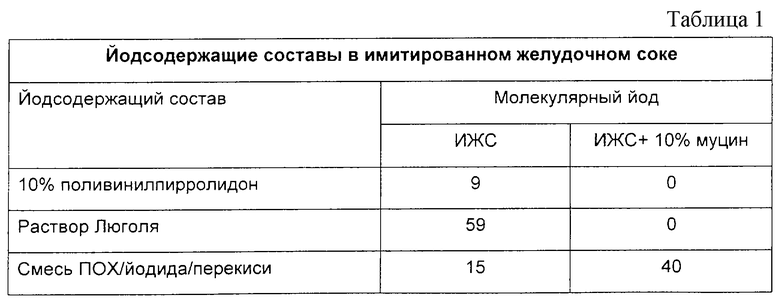
Определяли эффект ИЖС, содержавшей 10% муцина свиньи, на три типа йодсодержащих составов. Этими тремя типами йодсодержащих составов были (1) раствор Люголя, разведенный так, чтобы он давал примерно 150 промилле титруемого йода; (2) 10% йодистый поливинилпирролидон, разведенный так, чтобы он давал примерно 150 промилле титруемого йода, и (3) смесь ПОХ (1,5 мг/л), йодида натрия (2 г/л) и перекиси водорода (0,08% веса к объему), которая дает примерно 150 промилле титруемого йода. Концентрацию молекулярного йода определяли потенциометрически для этих трех различных йодсодержащих составов в отсутствие и в присутствии 10%-ного муцина свиньи, результаты представлены в табл.1 (см. в конце описания).
Этот эксперимент демонстрирует, что можно образовать значительные концентрации молекулярного йода в среде, обнаруживаемой в желудке, и что может быть предпочтительным образование вышеуказанного йода in situ, а не доставка его в желудок в водном составе.
Пример 3.
Этот эксперимент был предназначен для того, чтобы определить предпочтительное соотношение молекулярных концентраций йодида и йодата для включения в подходящий фармацевтический состав, такой, чтобы молекулярный йод был основной формой йода, образующейся при смешивании этого состава с желудочным соком.
ИЖС готовили, как описано в ФСША, а йодат натрия растворяли в ИЖС до конечной концентрации 0,375 ммоль/л. Осуществляли последовательное добавление йодида натрия к раствору йодата. Йодид натрия добавляли к раствору йодата в различных аликвотах, так что концентрация добавленного йодида находилась в диапазоне между 0,25 и 3,0 ммоль/л. После каждого добавления йодида производили химический анализ образовавшегося раствора.
Концентрация молекулярного йода возрастала почти линейно в диапазоне концентраций йодида от 0,0 до 1,75 ммоль/л, а затем выходила на плато. Наиболее очевидным объяснением этого наблюдения является то, что, как только большая часть йодата была восстановлена, дальнейшее добавление йодида не обеспечивало заметного образования молекулярного йода. Вместо возрастания концентрации молекулярного йода возрастала концентрация йодида. Концентрация йодида натрия возрастала почти линейно между концентрациями йодида 1,75 и 3,0 мМ, тогда как при идентичных условиях концентрация молекулярного йода возрастала меньше чем на 5%. Чертеж демонстрирует результаты этого анализа. При исходной концентрации йодида, равной 1,75 мМ, концентрация молекулярного йода была равна 1,01 мМ; это эквивалентно примерно 96% теоретически ожидаемого максимального выхода молекулярного йода.
Этот эксперимент повторили с использованием 2,5 мМ йодата натрия и концентрации йодида натрия, которая варьировала между 0 и 25 мМ. Результаты были качественно идентичными. При добавлении йодида концентрация молекулярного йода линейно возрастала в диапазоне концентраций йодида от 0 до 12,5 мМ. После того как большая часть йодата была восстановлена, дальнейшее добавление йодида не вызывало существенного возрастания концентрации молекулярного йода. Концентрация йодида натрия возрастала почти линейно при концентрациях йодида натрия от 12,5 до 25,0 мМ без соответствующего возрастания концентрации молекулярного йода. При начальной концентрации йодида, равной 12,5 мМ, концентрация молекулярного йода была равна 7,17 мМ; это эквивалентно 95% теоретически ожидаемого максимального выхода молекулярного йода.
Эти результаты свидетельствуют, что можно генерировать молекулярный йод в среде, обнаруживаемой в желудке человека, таким образом, чтобы фактическая концентрация йодида не зависела от добавляемых химических веществ. Например, при использовании 0,375 мМ йодата и 1,75 мМ йодида натрия, не было обнаружимой концентрации йодида, тогда как концентрация молекулярного йода была равна примерно 1,1 мМ. Соответственно при 2,5 мМ йодата и 12,5 мМ йодида не было обнаружимой концентрации йодида, тогда как концентрация молекулярного йода была равна примерно 7,3 мМ. Этот эксперимент выявляет предпочтительное отношение молярных концентраций йодида и йодата с целью создания состава, который обеспечивает главным образом молекулярный йод и при этом ограничивает концентрацию йодида. Ограничение концентрации йодида важно для тех болезненных состояний, которые требуют хронического введения.
Пример 4.
Приготавливали порошкообразную смесь, содержащую стеарат магния, сорбит, йодид натрия и йодат натрия. На аналитических весах (AND Company Ltd.; Модель FX-3000) отвешивали следующие количества каждого материала: 25 г стеарата магния, 1000 г сорбита, 55 г йодида натрия и 15,75 г йодата натрия. Стандартные желатиновые капсулы заполняли 1 г смеси и помещали в широкогорлые полиэтиленовые флаконы с завинчивающейся крышкой, содержавшие одноразовый влагопоглощающий картридж (Fisher Cat. 08-594-14А). Полиэтиленовые флаконы помещали в термостат при 40oС и 75% относительной влажности воздуха. Еженедельно в течение трехмесячного периода вынимали три капсулы, давали им остыть до комнатной температуры и растворяли в имитации желудочного сока. Сразу же после растворения определяли концентрацию молекулярного йода посредством потенциометрического измерения. Концентрация молекулярного йода не изменялась в течение трехмесячного периода. Процент от концентрации, измеренной в 1 день, изображали на графике как функцию времени. На графике не было обнаружено тенденции к изменению концентрации молекулярного йода с течением времени.
Пример 5.
Пероксидазу сои (Е.С. 1.11.1.7) использовали совместно с перекисью водорода и йодидом для образования молекулярного йода in situ. Рассчитывали отношение количества молекулярного йода к общему содержанию йода. Было определено несколько различных условий протекания реакции в цитратно-карбонатном буфере при значениях рН, равных 1,7, 4,5 и 5,0. Концентрации различных реагентов при рН 5,0 приведены в табл. 2.
Реакции при рН 5,0 инициировали путем добавления 0,2 мл пероксидазы сои (5 мг/мл) и осторожного перемешивания. Концентрацию молекулярного йода измеряли через 20 минут потенциометрическим способом Готтарди. Концентрация молекулярного йода при трех условиях протекания реакции при рН 5,0 была следующей: в реакции (1) 43 промилле, в реакции (2) 51 промилле и в реакции (3) 159 промилле. Отношение количества молекулярного йода к общему содержанию йода для трех реакций было равно 1,02, 1,0 и 0,94 соответственно.
Другую реакцию инициировали при рН 4,5 с использованием следующих условий эксперимента. К 1200 мл воды добавляли следующие химические вещества: 4,65 г лимонной кислоты, 2,0 г карбоната натрия, 0,252 г йодида натрия, 6 мг лактопероксидазы (Е. С. 1.11.1.7) и 80 мг перекиси мочевины. Через 20 минут определенная потенциометрическим способом Готтарди концентрация молекулярного йода была равна 172 промилле. Отношение количества молекулярного йода к общему содержанию йода было равно 0,97.
Пример 6.
Йодсодержащее фармацевтическое средство должно всасываться для обеспечения терапевтического эффекта. Ghent (патент США 4816255; 5171582) показал, что раствор Люголя является эффективным терапевтическим средством для лечения синдрома фиброзно-кистозной мастопатии. Этот эксперимент был предназначен для того, чтобы продемонстрировать, что биодоступность молекулярного йода, образованного in situ, по меньшей мере эквивалентна биодоступности раствора Люголя.
Самок крыс линии Sprague-Dawley весом 150-250 г и в возрасте 6-7 недель покупали в фирме Charles River Canada, Inc. (Квебек, Канада). Крыс содержали раздельно в проволочных сетчатых клетках из нержавеющей стали, оборудованных автоматической системой подачи воды. После процедуры рандомизации все клетки четко метили при помощи карточек с цветовыми кодами с указанием номера опыта, группы, номера животного, пола и вида воздействия. Каждое животное по прибытии также идентифицировали при помощи индивидуальной бирки на ухе. Параметры окружающей среды устанавливали следующими: 21±3oС, 50±20% относительная влажность воздуха, 12 часов света, 12 часов темноты и 10-15 смен воздуха в час. Животных обеспечивали Кормом для грызунов (W) # 8728, сертифицированным фирмой Teklad (Медисон, Висконсин), по потребности. Животных по потребности обеспечивали водой из муниципального водопровода, очищенной посредством обратного осмоса и обработанной ультрафиолетовым излучением. Животным давали возможность акклиматизироваться в этой среде в течение минимум двух недель до начала эксперимента.
Крысам в каждой экспериментальной группе давали дозу, равную 1,0 мл на 250 г. Концентрация лекарственного препарата на основе йода была равна либо 0,1 мг/кг (низкая доза Н), либо 1,0 мг/кг (высокая доза В). Использовали различные типы лекарственных препаратов на основе йода. Известно, что раствор Люголя является эффективным лекарственным средством против синдрома фиброзно-кистозной мастопатии, и его использовали в качестве положительного контроля. Составы, которые содержали йодид натрия и йодат натрия, отдельно или в комбинации с другими агентами, использовали в качестве экспериментальных воздействий. Соотношение йодида и йодата регулировали так, чтобы практически весь йодид был преобразован в молекулярный йод. Экспериментальные воздействия включали: (1) NaI/NaIO, смешивавшиеся перед введением через желудочный зонд; (2) NaI/NaIO в 0,7% HCI, вводившиеся через желудочный зонд по отдельности; (3) NaI/NaIO в 1% крахмале и (4) NaI/NaIO в 1% сорбите.
До воздействия у животных забирали кровь на анализ. Животным вводили препараты через желудочный зонд и через 2 часа вновь забирали кровь на анализ, после чего животных безболезненно умерщвляли. Кровь перерабатывали с получением проб сыворотки, и эти пробы замораживали. Замороженные пробы анализировали с использованием окислительно-восстановительной реакции между церием и мышьяком, катализируемой йодидом. Этот способ обеспечивает количественную меру общего количества йода, абсорбированного сывороткой. Результаты этих измерений приведены в табл. 3.
Степень всасывания у крыс составов, содержавших NaI/NaIO, была эквивалентна или больше, чем раствора Люголя. Это свидетельствует, что йод в этих лекарственных препаратах доступен для ткани млекопитающего.
Пример 7.
Исследование с семидневным введением препаратов с различными концентрациями йода было выполнено для определения острой токсичности составов, содержащих NaI/NaIO, при пероральном введении. Двадцать самок крыс линии Sprague-Dawley были разделены на 4 группы по пять животных в каждой группе. Животных отбирали и обрабатывали, как описано выше в примере 6. Крысам один раз в день давали состав, содержавший NaI/NaIO, или воду (контрольная группа). Рецептуры составов, содержавших NaI/NaIO, были составлены так, чтобы практически все атомы йода были преобразованы в молекулярный йод при использовании. Дозы, использованные в трех группах, подвергавшихся воздействию, были равны: (1) 0,1 мг/кг; (2) 1,0 мг/кг и (3) 10 мг/кг. Каждому животному давали примерно 2 мл препарата на 250 г веса.
В течение периода воздействия два раза в день через клетку оценивали клинические симптомы (плохое самочувствие, поведенческие изменения и т.п.). Гастроскопические и биомикроскопические исследования были выполнены на всех животных до начала эксперимента и по завершении периода воздействия. Животных безболезненно умерщвляли по завершении эксперимента при помощи метоксифлурана. Сразу же после умерщвления производили исследование тканей тела.
Ни у одного из животных не обнаруживалось клинически аномальных признаков. Во время некропсии также не было обнаружено аномалий. Высокие дозы препарата, содержавшего йодид/йодат, не проявляют острой токсичности.
Пример 8.
Самки крыс линии Spague-Dawley (всего 44) весом 200-250 г были закуплены в фирме Charles River Canada, Inc. (Квебек, Канада). Крыс содержали раздельно в проволочных сетчатых клетках из нержавеющей стали, оборудованных автоматической системой подачи воды. Параметры окружающей среды устанавливали следующими: 21±3oС, 50±20% относительная влажность воздуха, 12 часов света, 12 часов темноты и 10-15 смен воздуха в час.
Животных кормили Кормом Ремингтона с низким содержанием йода # 170360 (фирмы Teklad, Медисон, Висконсин) по потребности. Животных в первые пять дней содержания в клетке по потребности обеспечивали водой из муниципального водопровода, обработанной перхлоратом (400 мг/дл NaClO4). Одна из групп крыс получала нормальный корм (Корм для грызунов (W) # 8728, сертифицированный фирмой Teklad) и воду из муниципального водопровода. Животным давали возможность акклиматизироваться в этой среде в течение минимум двух недель до начала эксперимента. Ежедневно в течение пяти дней до начала эксперимента животные получали эстроген (25 мкг 17β- эстрадиола), суспендированный в 100 мкл кунжутного масла, путем внутримышечной инъекции. В течение 2-недельного эксперимента ежедневно инъецировали эстроген (2,5 мкг 17β-эстрадиола), суспендированный в 100 мкл кунжутного масла. Каждый день брали вагинальные мазки, чтобы гарантировать, что у крыс в течение всего эксперимента была постоянная течка.
Молекулярный йод генерировали у крыс in situ посредством введения через желудочный зонд водного раствора, содержавшего йодид натрия и йодат натрия (с молярным отношением I-/IO, равным 5/1), такого, чтобы фактически 100% вводимого йодида было преобразовано в молекулярный йод. Крысам вводили молекулярный йод один раз в день. У животных убирали пищу каждое утро и через десять часов каждой крысе вводили 80 мкг/кг молекулярного йода. Эквивалентную дозу йодида (80 мкг/кг) вводили контрольной группе крыс. Отрицательный контроль состоял из крыс, которым вводили водопроводную воду. Крыс ежедневно взвешивали. В конце второй недели исследования крыс безболезненно умерщвляли и окрашивали микроскопические срезы тканей молочных желез гематоксилином и эозином, прежде чем их анализировал патологоанатом. Ткань молочной железы оценивали в соответствии со способами, описанными Eskin et al. (Biological Trace Element Research, 1995, v. 49, p. 9-18).
Исследовали четыре группы животных: (1) получавших нормальную пищу без обработки перхлоратом; (2) получавших корм с пониженным содержанием йода и воду через желудочный зонд; (3) получавших корм с пониженным содержанием йода и йодид через желудочный зонд и (4) получавших корм с пониженным содержанием йода и йод через желудочный зонд. В каждой группе было 10 животных. Были небольшие, но статистически достоверные различия в весе тела между различными группами в начале и в конце экспериментального воздействия. Однако все веса были в пределах нормы. Средний вес в четырех группах был следующим: (1) 208±5,6 в начале, 237±7,4 в конце; (2) 212±6,3 в начале, 239±6,8 в конце; (3) 214±6,5 в начале, 235±7,1 в конце и (4) 216±6,6 в начале, 241±6,9 в конце.
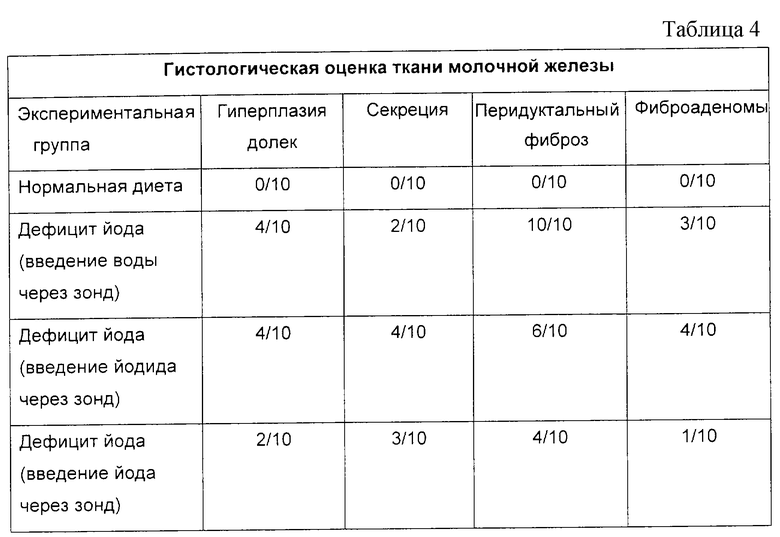
Ткань молочной железы оценивали по степени выраженности гиперплазии долек, секреции, перидуктального фиброза и фиброаденоматозных изменений. Система оценки гиперплазии долек, секреции, перидуктального фиброза оценивала их как положительные только в том случае, если животные обнаруживали состояния от средних до тяжелых. Микроскопические фиброаденомы были обнаружены в некоторых образцах и количественно оценены. Результаты гистологической оценки приведены в табл. 4.
Было показано, что дефицит йода приводит к нарушению структуры и функции молочных желез у крыс, особенно альвеолярных клеток. При стимуляции эстрогеном, физиологической или внешней, молочные железы, по-видимому, становятся высокочувствительными к йодной депривации. В широкомасштабных опытах на людях было показано, что дисплазия и атипия, вызываемые дефицитом йода в молочных железах, обратимы при лечении йодом. Несколько исследователей использовали крысу для моделирования синдрома фиброзно-кистозной мастопатии у людей. Группа крыс, получавшая нормальный корм, не обнаруживала аномальных признаков. Ткань молочной железы крыс, получавших корм с недостатком йода, которым через зонд вводили воду, обнаруживала атипичную ткань, являющуюся признаком синдрома фиброзно-кистозной мастопатии, вызываемой недостатком йода. Крысы, получавшие корм с недостатком йода, которым через зонд вводили йодид, обнаруживали повышенную секрецию и фиброаденомы. Такое возрастание секреции ткани молочной железы и фиброаденомы молочной железы, связанные с лечением йодидом, ранее были обнаружены в экспериментах Eskin et al. (Biological Trace Element Research, 1995, v. 49, p. 9-18). В противоположность йодиду введение через зонд смеси йодида/йодата (то есть введение йода) уменьшало частоту возникновения гиперплазии, повышенной секреции, перидуктального фиброза и фиброаденом. Это свидетельствует о том, что генерация молекулярного йода in situ может привести к обратному развитию синдрома фиброзно-кистозной мастопатии. Результаты этого эксперимента подтверждают, что образование молекулярного йода in situ является эффективным способом лечения синдрома фиброзно-кистозной мастопатии и других болезненных состояний, обусловленных дефицитом йода.
Пример 9.
Был приготовлен гранулированный препарат, содержавший йодидный анион и йодатный анион, и была исследована его стабильность при 40oС. В кухонный миксер были добавлены следующие химические вещества: 100 мл деионизированной воды, 1,0 г йодата натрия, 3,63 г йодида натрия, 5,0 г трехосновного фосфата натрия и капля гидроокиси натрия. Вещества тщательно перемешивали до тех пор, пока они не превратились в смесь. Добавили 25 г гидроксипропилметилцеллюлозы и материал перемешивали до тех пор, пока он не стал однородным. Во время перемешивания медленно добавили дополнительно 450 г микрокристаллической целлюлозы. Эти гранулы пропустили через сито номер 5, а затем высушили в вакууме при температуре 50oС. После высушивания материала в течение 12 часов его пропустили через сито номер 20.
Сорок пять проб по 1 г сухого гранулированного препарата отвесили в стеклянные бутылочки и затем поместили в сушильный шкаф с температурой 40oС. Еженедельно в течение трех месяцев вынимали по три пробы и определяли количество йода, титруемого тиосульфатом, после растворения в 1 л имитации желудочного сока. Результаты этих измерений приведены в табл. 5.
Пример 10.
Раствор йодата натрия с концентрацией 5 ммоль/л готовили в 200 мл ИЖС (без пепсина) в стеклянном флаконе с тефлоновым покрытием и завинчивающейся крышкой. К этому раствору пипеткой по каплям добавляли концентрированный раствор аскорбиновой кислоты. Концентрацию йодида (определявшуюся при помощи йодидселективных электродов) и свободного молекулярного йода (определявшуюся потенциометрически) определяли после каждого добавления аскорбиновой кислоты. Электроды, использовавшиеся для измерений концентрации йодида и свободного молекулярного йода, контактировали с раствором через непроницаемый для воздуха канал, встроенный в верхнюю часть контейнера с тефлоновым покрытием. Концентрация молекулярного йода возрастала почти линейно как функция количества добавленной аскорбиновой кислоты до тех пор, пока его концентрация не достигала максимума, равного 2,38 ммоль/л. После того как содержание молекулярного йода достигало максимума, его концентрация снижалась по мере повышения концентрация аскорбиновой кислоты. Не обнаруживалось йодида до тех пор, пока концентрация молекулярного йода не достигала значения 2,38 ммоль/л. Концентрация йодида возрастала с увеличением концентрации аскорбиновой кислоты до тех пор, пока не достигала максимума, равного 4,82 ммоль/л, после чего она оставалась постоянной независимо от возрастания концентрации аскорбиновой кислоты.
Эксперимент повторили с использованием другой пары окислитель-восстановитель. Йодат и тиосульфат натрия были использованы вместо йодата и аскорбиновой кислоты. Был повторен точно такой же эксперимент, за исключением того, что к герметизированному контейнеру по каплям добавляли концентрированный тиосульфат натрия. Опять концентрация молекулярного йода достигала максимального значения, равного 2,26 ммоль/л, а затем снижалась. По мере того как концентрация молекулярного йода снижалась от ее максимального значения, концентрация йодида возрастала от 0 до 4,7 ммоль/л.
Пример 11.
Отношение количества молекулярного йода к общему содержанию йода определяли как функцию отношения йодидного аниона к йодатному аниону в ИЖС (без пепсина). Были выполнены следующие эксперименты для определения присутствия различных видов йода: титрование йода тиосульфатом, потенциометрический анализ молекулярного йода и определение йодидного аниона при помощи ионселективного электрода. Было обнаружено, что практически все начальное количество атомов йода было выявлено посредством этих трех видов измерений. Количество трийодида и других полийодидов рассчитывали по значениям тиосульфата и молекулярного йода. Отношение количества молекулярного йода к общему содержанию йода определяли путем деления массы молекулярного йода на сумму масс йодида, молекулярного йода и трийодида.
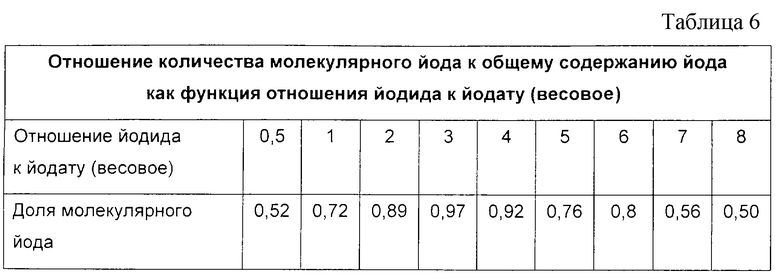
Весовое отношение йодидного аниона к йодатному аниону варьировало от 0,5 до 8. Было обнаружено, что отношение количества молекулярного йода к общему содержанию йода варьировало так, как показано в табл. 6.
Дополнительные эксперименты показали, что весовое соотношение реагентов, йодида и йодата, равное примерно 0,78 (I-/IO), дало отношение количества молекулярного йода к общему содержанию йода, равное 0,8.
Пример 12.
Самок крыс линии Sprague-Dawley весом 200-250 г закупали в фирме Charles River Canada, Inc. (Квебек, Канада). Крыс обрабатывали точно так же, как описано в примере 8, и подвергали идентичным процедурам в отношении дозировок перхлората и эстрогена.
Каждой крысе через желудочный зонд вводили водный раствор, который содержал йодид натрия и йодат натрия (молярное отношение I-/IO, равное 5/1), причем фактически 100% вводимого йодида и йодата преобразовывалось в молекулярный йод при контакте с жидким содержимым желудка. Крысам вводили молекулярный йод один раз в день. Каждое утро от крыс убирали корм и через десять часов каждой крысе вводили одну из трех концентраций молекулярного йода: 0,0010, 0,010 и 0,10 мг/кг. Контрольной группе крыс вводили дозу йодида (100 мкг/кг). Отрицательный контроль состоял из крыс, которым вводили водопроводную воду. Через 4 недели крыс безболезненно умерщвляли и микроскопические срезы тканей молочных желез окрашивали гематоксилином и эозином перед оценкой их патологоанатомом. Ткань молочной железы оценивали, как описано в примере 8.
Исследовали 6 групп животных: группы (1)-(3) получали ежедневно дозы одной из трех концентраций молекулярного йода; (4) получали нормальную пищу без обработки перхлоратом; (5) получали корм с недостатком йода и воду через желудочный зонд и (6) получали корм с недостатком йода и йодид (100 мкг/кг). В течение всего эксперимента вес тела крыс находился в пределах нормы. Ткань молочной железы оценивали на гиперплазию долек, секрецию, перидуктальный фиброз и фиброаденоматозные изменения, как описано в примере 8. Микроскопические фиброаденомы были выявлены в нескольких образцах и оценены количественно. Результаты гистологической оценки приведены в табл. 7.
Крысы, содержавшиеся на нормальной диете, не проявляли клинически аномальных признаков. Как и ожидалось, у крыс, находившихся на диете с пониженным содержанием йода и не получавших лечения (введение воды через зонд), была обнаружена ткань молочной железы, гистология которой соответствовала синдрому фиброзно-кистозной мастопатии. Ежедневное лечение йодидом (100 мкг/кг) существенно не снижало образования фиброаденом. Ежедневное лечение молекулярным йодом в концентрации 1 мкг/кг существенно не снижало образования фиброаденом и перидуктального фиброза. Ежедневное лечение молекулярным йодом в концентрациях 10 и 100 мкг/кг значительно снижало образование фиброаденом и перидуктального фиброза.
Пример 13.
Самок крыс линии Sprague-Dawley весом 200-250 г закупали в фирме Charles River Canada, Inc. (Квебек, Канада). Крысам создавали дефицит йода с использованием строго определенных процедур, ранее описанных в примерах 8 и 12. Крысам вводили пять различных составов: (1) воду; (2) йодид в концентрации 0,1 мг/кг (вводившийся в форме йодида натрия); (3) эмульсию в минеральном масле, которая служила средством доставки молекулярного йода в концентрации 0,01 мг/кг; (4) эмульсию в минеральном масле, которая доставляла молекулярный йод в концентрации 0,001 мг/кг и (5) эмульсию в минеральном масле, которая доставляла молекулярный йод в концентрации 0,10 мг/кг.
Минеральное масло (50 мл) тщательно перемешивали с порошком аравийской камеди (125 г) в сухой ступке. К стерильной дистиллированной воде (250 мл) добавляли карбонат натрия (50 мг) и смесь йодида натрия/йодата натрия (молярное соотношение I-/IO, равное 5/1), и этот раствор тщательно перемешивали с смесью минерального масла/аравийской камеди. Образовавшуюся смесь эмульгировали в высокоскоростном миксере (фирмы Lightnin, модель L1U08). После эмульгирования добавляли стерильную дистиллированную воду в количестве, необходимом для того, чтобы конечный объем был равен 1000 мл. Концентрация смеси йодида/йодата, добавленной к трем различным эмульсиям в минеральном масле, была рассчитана так, чтобы 1 мл содержал одно из трех следующих значений: 0,25, 2,5 или 25 мкг атомов йода.
Каждой крысе через желудочный зонд один раз в день вводили один из трех тестируемых составов. Отрицательный контроль состоял из крыс, которым вводили воду. Положительный контроль состоял из крыс, которым вводили йодид. Через 4 недели крыс безболезненно умерщвляли, а микроскопические срезы тканей молочной железы окрашивали гематоксилином и эозином до того, как их анализировал патологоанатом (см. табл. 8).
Результаты эксперимента явно схожи с наблюдениями, произведенными в предыдущем примере, что доказывает, что водный состав является удовлетворительным носителем для доставки смеси йодида/йодата.
Пример 14.
Фармацевтические препараты для перорального введения, которые разработаны в виде твердых дозировочных форм, должны удовлетворять специфическим регулирующим постановлениям в отношении их стабильности. Стабильность таких фармацевтических препаратов обычно оценивается как при комнатной температуре, так и при повышенных температурах, чтобы оценить реальную стабильность таких составов. Раствор йодида и раствор йодата гранулировали вместе с несколькими различными сахарами, чтобы оценить химическую стабильность комбинации этих двух химических веществ в приемлемой фармацевтической дозировочной форме. Использовали следующие сахара: сахарозу, глюкозу, декстрозу, галактозу, сорбит, мальтодекстрин, фруктозу и лактозу. В каждом случае первым агентом, подлежащим гранулированию, был йодат натрия. Каждый сахар перед гранулированием смешивали с карбонатом натрия в соотношении 50/50. После гранулирования с йодатом натрия смесь сахара и карбоната подвергали вакуумной сушке в течение минимум 5 дней при 40oС. Гранулы хранили при комнатной температуре в вакуумном дессикаторе.
Затем высококонцентрированный раствор йодида натрия распылением наносили на смеси сахаров и карбоната, которые предварительно были гранулированы с йодатом натрия. Йодид натрия распыляли очень медленно с использованием пульверизатора, подавая объем жидкости, который составлял примерно 1% веса сахара. После добавления йодида натрия смеси сахаров и карбоната высушивали под вакуумом при 40oС в течение как минимум одной недели. Йодат натрия добавляли в такой концентрации, чтобы его конечная концентрация в высушенной смеси сахара и карбоната была равна примерно 0,34 вес.%. Йодид натрия использовали в такой концентрации, чтобы его конечная концентрация в высушенной смеси сахара и карбоната была равна примерно 1,32%.
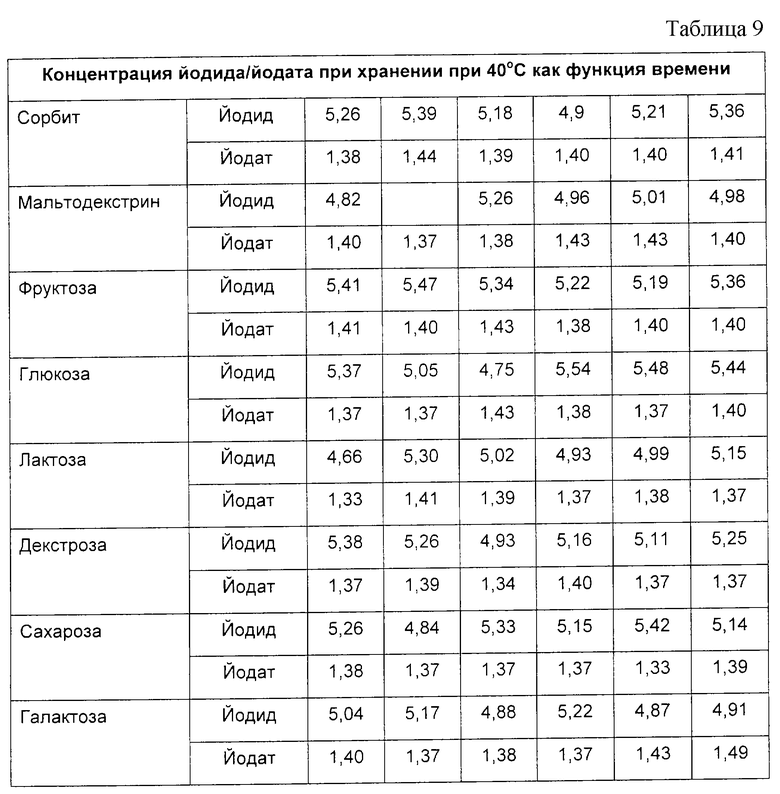
Все смеси сахаров и карбоната хранили в открытом стеклянном контейнере при 40oС и при комнатной температуре в герметически укупоренном стеклянном контейнере. Концентрацию йодида и йодата в каждой из смесей сахара и карбоната измеряли ежемесячно в течение шести месяцев. Содержание йодида измеряли с использованием ионселективного электрода. Содержание йодата измеряли при помощи титрования тиосульфатом. Результаты измерений на материалах, хранившихся при 40oС, приведены в табл. 9.
Данные четко свидетельствуют, что смесь йодида/йодата может быть стабилизирована таким способом, который пригоден для использования в промышленной фармацевтической дозировочной форме.
Изобретение не следует истолковывать как ограниченное вышеприведенными примерами. Другие примеры осуществления находятся в объеме нижеследующей формулы изобретения.





Предложен новый фармацевтический состав для перорального введения молекулярного йода и способы его введения. Состав представляет собой сочетание аниона йода с определенным окислителем или катиона йода с определенным восстановителем, причем весовое соотношение йодидного аниона к йодатному аниону (I-/IO) составляет 0,78-6,0, при этом в желудке образуется молекулярный йод в контролируемом отношении молекулярного йода к общему йоду, превышающем по меньшей мере 0,80 от теоретически ожидаемого максимального выхода. Изобретение позволяет получать стабильный фармацевтический состав с повышенной биодоступностью и при этом контролировать дозу поступающего молекулярного йода, а также снизить нежелательные побочные эффекты. 3 с. и 17 з.п.ф-лы, 1 ил. 9 табл.
| Ксензенко В.И | |||
| и др | |||
| Химия и технология брома, иода и их соединений | |||
| - М.: Химия, 1979, с.213-221, 268 | |||
| US 4849237, 18.07.1998 | |||
| US 5589198, 31.12.1996. |
Авторы
Даты
2003-10-10—Публикация
1998-10-27—Подача