Изобретение относится к новым химическим соединениям - производным антра[2,1-d]изотиазол-3,6,11-триона общей формулы I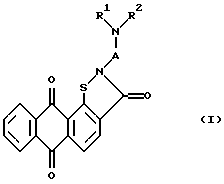
где А - низший алкилен, R1 и R2 (независимо) - низший алкил или R1 и R2 вместе с атомом азота образуют шестичленный насыщенный гетероцикл, который дополнительно может содержать гетероатом, такой как атом кислорода, и их фармакологически приемлемым солям.
Предпочтительно, указанные соединения ингибируют агрегацию тромбоцитов, а также снижают активность ряда тиолзависимых ферментов, в частности таких как обратная транскриптаза вируса иммунодефицита человека (ОТ ВИЧ) и каспаза-3.
Данное изобретение может быть использовано в биохимии, физиологии и медицине.
Результаты многочисленных исследований свидетельствуют о том, что повышенная агрегация тромбоцитов играет ключевую роль в патогенезе многих сердечно-сосудистых заболеваний (например, таких как артериальные тромбозы, инфаркт миокарда, нестабильная стенокардия). Соединения, способные предотвращать активацию тромбоцитов, которая может быть вызвана эндогенными индукторами, например аденозин-5'-дифосфатом (АДФ), в настоящее время находят широкое применение для эффективного воздействия на патологические изменения системы гемостаза (М.Д. Машковский. Лекарственные средства, т.1, Торсинг, Харьков, 1998 г. , стр. 462-475 [1]; Б.А. Сидоренко, Д.В. Преображенский. Клиническое применение антитромботических препаратов, М., 1998 г. [2]).
Известно, что некоторые бициклические соединения, содержащие атомы азота и серы и используемые в качестве субстанций при получении лекарственных средств, обладают способностью ингибировать агрегацию тромбоцитов.
Так, известен 5-[(2-хлорфенил)метил]-4,5,6,7-тетрагидротиено[3,2-с]пиридин (тиклопидин) формулы II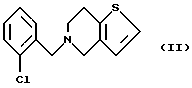
в качестве блокатора P2Y(12) рецепторов АДФ тромбоцитов (F. Storey. "The P2Y12 receptor as a therapeutic target in cardiovascular disease". Platelets 2001, v. 12, 4, p. 197-209 [3]; патент США 4963559, 514-301, оп.1990 г. [4]; [1] с.474).
Показано, что блокатор кальциевых каналов - D-цис-3-ацетокси-2,3-дигидро-5-[2-(диметиламино)этил] -2-(2-метоксифенил)- 1,5-бензотиазепин-4(5Н)-она гидрохлорид (дилтиазем) формулы III
обладает антитромботическим действием (A.R. Dehpour, T. Samadian et al. "Effects of diltiazem and verapamil on ADP-induced rabbit platelet shape change and aggregation" Gen. Pharmacol., 1995, v.26, 6, p.1295-1299 [5]).
Вышеуказанные соединения в условиях in vitro ингибируют агрегацию тромбоцитов, вызванную АДФ, при концентрации >300 мкМ.
В биохимических исследованиях нашли широкое применение низкомолекулярные ингибиторы тиолзависимых ферментов - так называемые "SH-метки". К ним относятся такие соединения, как N-этилмалеимид, 4-нитро-7-хлорбенз-2,1,3-оксадиазол, 5,5'-дитиобис(2-нитробензойная кислота) и др. (например, E. Scoffone, A. Fontana "Identification of specific amino acid residues". Mol. Biol. Biochem. Biophys. , 1970, v.8, p. 185-210 [6]; K.K. Han, A. Delacourte, B. Hemon "Chemical modification of thiol group(s) in protein: application to the study of anti-microtubular drugs binding," Соmр. Biochem. Physiol. В 1987, v.88, 4, p.1057-1065 [7]; A.F. Carne. "Chemical modification of proteins. " Methods Mol. Biol., 1994, v.32, p.311-320 [8]). Как правило, данные соединения отличаются достаточно высокой реакционной способностью по отношению к тиольным группам белков и низкомолекулярных тиолов и обладают низкой специфичностью действия на ферменты. Остается актуальным поиск новых эффективных ингибиторов тиолзависимых ферментов.
Известны различные 1,2-гетаннелированные производные 9,10-антрахинона, обладающие противоопухолевым действием (например, A.L. Jones, I.E. Smith. "Navelbine and the anthrapyrazoles." Hematol. Oncol. Clin. North Am., 1994, v. 8, 1, p.141-152 [9]; H. Gogas, J.L. Mansi. "New drugs. The anthrapyrazoles. " Cancer Treat. Rev., 1996, v.21, 6, p.541-552 [10]; P. Chang, C.-F. Chen. "Antineoplastic anthraquinones. II. Design and synthesis of 1,2-heteroannelated anthraquinones". J. Heterocycl. Chem., 1996, v.33. p.367-371 [11]).
Способность данных соединений ингибировать агрегацию тромбоцитов, а также их влияние на активность ОТ ВИЧ и каспазы-3 не изучены.
Известны производные антрахинона - митоксантрон формулы IV и бисантрен формулы V
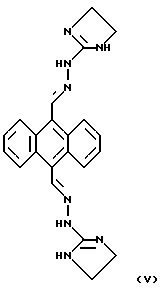
ингибирующие агрегацию тромбоцитов под действием АДФ (данные не приведены) и коллагена (IC50~40-140 и 14-23 мкМ соответственно в зависимости от концентрации индуктора агрегации) (P. Frank, R.F. Novak. "Mitoxantrone and bisantrene inhibition of platelet aggregation and prostaglandin E2 production in vitro. " Biochem. Pharmacol, 1985, v.34, 19, p.3609-3614 [12]). Влияние данных соединений на активность ОТ ВИЧ и каспазы-3 не исследовано.
Показано, что 1,2-бензизотиазол-3-он и его 2-аминопроизводное общей формулы VI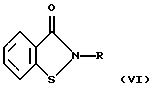
где R=Н или NH2,
обладают способностью ингибировать агрегацию тромбоцитов в условиях in vitro, вызванную АДФ (IC50>200 мкМ) (K.H. Baggaley, P.D. English et al. "Inhibitors of blood platelet aggregation. Effects of some 1,2-benzisothiazol-3-ones on platelet responsiveness to adenosine diphosphate and collagen." J. Med. Chem., 1985, v.28, 11, p.1661-1667 [13]; P. Vicini, C. Manotti et al. "Synthesis and antiplatelet effects of 2-amino-1,2-benzisothiazolin-3-one." Arzneim.-Forsch./Drug Res., 1997, v.47, 11, p. 1218-1221 [14]).
Влияние бензизотиазолонов общей формулы VI на активность ОТ ВИЧ и каспазы-3 не исследовано.
Известны производные антра[2,1-d]изотиазол-3,6,11-триона общей формулы VII
где R - Н, метил, бензил, фенил или замещенный фенил,
в качестве продуктов химического синтеза (F. A. Kucherov, S. G. Zlotin. "Synthesis of linear and angular anthraquinonoisothiazole-3-ones, their S-oxides and S, S-dioxides. " Russ. Chem. Bull., 2001, v.50, 9, р. 1657-1662 [15] ). Фармакологические и биохимические свойства данных соединений не изучены.
Известно, что ряд производных изотиазол-3-она оказывают ингибирующее действие на активность некоторых тиолзависимых ферментов, в частности p56 (lck) тирозиновой протеинкиназы (J. M. Trevillyan, X. G. Chiou et al. "Inhibition of p56 (lck) tyrosine kinase by isothiazolones." Arch. Biochem. Biophys. , 1999, v.364, 1, p.19-29 [16]), теломеразы (N. Hayakawa, K. Nozawa et al. "Isothiazolone derivatives selectively inhibit telomerase from human and rat cancer cells in vitro." Biochemistry, 1999, v.38, 35, p.11501-11507 [17]), а также предотвращают образование стромелизина из простромелизина (E. C. Amer, M. A. Pratta et al. "Isothiazolones interfere with normal matrix metalloproteinase activation and inhibit cartilage proteoglycan degradation. " Biochem J. , 1996, v.318, pt.2, p.417-424 [18]). Установлено, что данный эффект может быть обусловлен взаимодействием таких соединений с функционально важной меркаптогруппой цистеина, приводящим к раскрытию изотиазольного цикла с образованием тиолдисульфидной связи с белком [16, 17, 18].
Наиболее близким к соединениям настоящего изобретения по структуре и свойствам является 2-[3-(пиперидино-1)пропил]-1,2-бензизотиазол-3-он VIII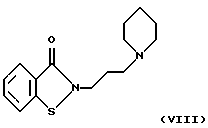
который ингибирует агрегацию тромбоцитов под действием коллагена или аденозин-5'-дифосфата (АДФ) ([13] - прототип).
Данное соединение, согласно опубликованным данным, обладает недостаточно выраженными фармакологическими свойствами (IC50=57 мкМ в условиях in vitro). Его влияние на активность тиолзависимых ферментов не изучено.
Целью изобретения является создание новых гетероциклических соединений в ряду аннелированных производных изотиазолона, обладающих улучшенными фармакологическими свойствами.
Указанная цель достигается новыми производными антра[2,1-d]изотиазол-3,6,11-триона вышеуказанной общей формулы I, где А - низший алкилен, R1 и R2 (независимо) - низший алкил или R1 и R2 вместе с атомом азота образуют шестичленный насыщенный гетероцикл, который дополнительно может содержать гетероатом, такой как атом кислорода, и их фармакологически приемлемыми солями. Предпочтительно данные соединения ингибируют агрегацию тромбоцитов, а также снижают активность ряда тиолзависимых ферментов.
В частности, соединения настоящего изобретения ингибируют ОТ ВИЧ и каспазу-3 - ферменты, содержащие функционально важные остатки цистеина и представляющие фармакологический интерес. ОТ ВИЧ (РНК-зависимая ДНК-полимераза) катализирует образование провирусной ДНК на матрице вирусной РНК, способствуя репликации ВИЧ, и является в настоящее время одной из ключевых мишеней в химиотерапии СПИД (например, H. Jonckheere, J. Anne, E. De Clercq. "The HIV-1 reverse transcription (RT) process as target for RT inhibitors." Med. Res. Rev., 2000, v.20, 2, p. 129-154 [19]). Каспаза-3 (эффекторная цистеиновая протеаза, активирующаяся при апоптозе) катализирует расщепление белков после остатков аспарагиновой кислоты (G.M. Cohen "Caspases: the executioners of apoptosis." Biochem. J., 1997, v.326, pt.1, p.1-16 [20]). Соединения, ингибирующие данный фермент, обладают цитопротекторным действием и рассматриваются как потенциальные фармакологические средства для лечения инфаркта миокарда, церебральной ишемии, болезни Альцгеймера, остеоартрита, цирроза печени и других заболеваний (например, T. Rudel. "Caspase inhibitors in prevention of apoptosis." Herz, 1999, v.24, 3, p.236-241 [21]; N. Guttenplan, C. Lee, W. H. Frishman. "Inhibition of myocardial apoptosis as a therapeutic target in cardiovascular disease prevention: focus on caspase inhibition." Heart Dis., 2001, v.3, 5, p.313-318 [22]; H.J. Rideout, L. Stefanis. "Caspase inhibition: a potential therapeutic strategy in neurological diseases." Histol. Histopathol., 2001, v.l6, 3, p.895-908 [23]).
Производные антра[2,1-d]изотиазол-3,6,11-триона общей формулы I, где А - низший алкилен, причем А≠CH2, a R1 и R2 имеют вышеуказанные значения, были синтезированы способами, основанными на известных реакциях, таких как ацилирование первичных аминов с помощью хлорангидрида замещенной антрахинонкарбоновой кислоты [15], нуклеофильное замещение ароматической нитрогруппы на алкилтиогруппу (S.G. Zlotin, P.G. Kislitsin et al. "Synthetic utilization of polynitroaromatic compounds. 1. S-derivatization of 1-substituted 2,4,6-trinitrobenzenes with thioles. " J. Org. Chem., 2000, v.65, 25, p. 8439-8443 [24] ), циклизации амидов о-(алкилтио)аренкарбоновых кислот в изотиазолоны под действием сульфурилхлорида (патент Японии 07330745 [95330745] , C07D 275/04, 1995; Chem. Abstr. 1996, v.124, 289523j [25]; Европейский патент 657438, C07D 275/04, on. 1995 г. [26]) и алкилирования аминов алкилгалогенидами (E. K. Harvill, R. M. Herbst, E. G. Schviner. "Halogenoalkyltetrazoles and aminoalkyltetrazoles", J. Org. Chem., 1952, v. l7, 12, p.1597 [27]).
В частности, производные антра[2,1-d]изотиазол-3,6,11-триона общей формулы I, где А - низший алкилен, причем А≠СН2, а R1 и R2 имеют вышеуказанные значения, получены способом, заключающимся в том, что амин, содержащий первичную аминогруппу, общей формулы IX
Н2N-А-NR1R2 (IX),
где A, R1 и R2 имеют вышеуказанные значения,
ацилируют хлорангидридом 1-нитро-9,10-диоксо-9,10-дигидроантрацен-2-карбоновой кислоты в смеси бензол/вода, полученный соответствующий N-замещенный 1-нитро-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамид обрабатывают последовательно карбонатом калия и тиоэтилатом натрия в среде диметилформамида (ДМФА), полученный соответствующий N-замещенный 1-этилтио-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамид вводят во взаимодействие с сульфурилхлоридом в среде безводного хлористого метилена с последующим выделением целевого продукта в виде свободного основания или фармакологически приемлемой соли (например, гидрохлорида, фумарата или цитрата) (способ А, схема 1, см. в конце описания).
Производные антра[2,1-d]изотиазол-3,6,11-триона общей формулы I, где А - низший алкилен, причем А≠СН2, R1 и R2 (независимо) - низший алкил или вместе с атомом азота образуют шестичленный насыщенный гетероцикл, были получены также альтернативным способом, заключающимся в том, что аминоалкилгалогенид общей формулы X
H2N-A-Hal (X),
где А имеет вышеуказанные значения и Hal - атом хлора или брома,
взятый в виде соли, ацилируют хлорангидридом 1-нитро-9,10-диоксо-9,10-дигидроантрацен-2-карбоновой кислоты в смеси бензол/вода в присутствии карбоната калия, полученный соответствующий N-замещенный 1-нитро-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамид обрабатывают карбонатом калия и тиометилатом натрия в среде ДМФА, полученный соответствующий N-замещенный 1-метилтио-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамид вводят во взаимодействие с сульфурилхлоридом в среде безводного хлористого метилена, после чего полученный промежуточный 2-(галоидалкил)антра[2,1-d] изотиазол-3,6,11(2Н)-трион подвергают реакции с амином общей формулы XI
HNR1R2 (XI),
где R1 и R2 имеют вышеуказанные значения,
в среде ДМФА в присутствии карбоната калия и при необходимости иодида щелочного металла, такого как иодид калия, при температуре 50-55oС с последующим выделением целевого продукта в виде свободного основания или фармакологически приемлемой соли (способ Б, схема 2, смотри в конце описания).
Исходный хлорангидрид 1-нитро-9,10-диоксо-9,10-дигидро-антрацен-2-карбоновой кислоты был получен известным способом - обработкой соответствующей кислоты хлористым тионилом в среде абсолютного бензола при температуре кипения реакционной смеси [15].
Производные антра[2,1-d]изотиазол-3,6,11-триона общей формулы I, где А= СН2, а R1 и R2 имеют вышеуказанные значения, были получены известным способом по реакции Манниха конденсацией производного изотиазол-3-она с вторичными аминами в присутствии формальдегида (E.D. Weiler, G.A. Miller "Isothiazoles VII: N-Hydroxyalkylation and Mannich Reaction of 4-Isothiazolin-3-ones." J. Heterocycl. Chem., 1976, v.l3, 5, p.1097-1098 [28]).
В частности, исходный антра[2,1-d]изотиазол-3,6,11(2Н)-трион вводили во взаимодействие со вторичным амином вышеуказанной общей формулы XI, где R1 и R2 имеют вышеприведенные значения, в присутствии водного раствора формальдегида при 45-50oС с последующим выделением целевого продукта в виде свободного основания или фармакологически приемлемой соли (способ В, схема 3, смотри в конце описания).
Исходный антра[2,1-d] изотиазол-3,6,11(2Н)-трион был получен известным способом - обработкой 1-метилтио-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамида сульфурилхлоридом в среде безводного хлористого метилена [15].
Изобретение иллюстрируется следующими примерами.
Пример 1. 2-[2-(Диметиламино)этил] антра[2,1-d] изотиазол-3,6,11(2Н)-триона гидрохлорид (4) (способ А).
a) N-[2-(Диметиламино)этил] -нитро-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамида гидрохлорид (2).
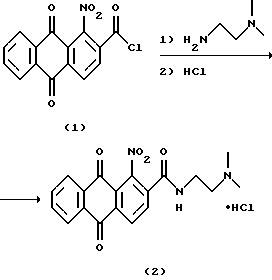
К суспензии хлорангидрида 1-нитро-9,10-диоксо-9,10-дигидро-антрацен-2-карбоновой кислоты [15] (0,30 г, 0,95 ммоль) в гетерофазной системе бензол/вода (1: 1, об.) при интенсивном перемешивании добавляют 0,11 мл (0,088 г, 1,00 ммоль) 2-(диметиламино)этиламина. Смесь перемешивают 2 ч при 25oС, осадок отфильтровывают, промывают последовательно водой (2 x 10 мл), 10% НСl (2 x 10 мл) и этиловым спиртом (2 x 10 мл) и сушат на воздухе. Получают 0,31 г соединения 2, (выход 82%). Т. пл. 282-285oС.
Спектр ЯМР 1Н (ДМСО-(d6, δ, м.д., J, Гц): 2,82 (д, 6 Н, НМе2Н+, J=4,4); 3,26 (м, 2 Н, -CH2NMe2); 3,64 (м, 2 H, NHCH2-); 7,92-8,00 (м, 2 Н, Н-6, Н-7); 8,09-8,23 (м, 2 Н, Н-5, Н-8); 8,43 (д, 1 Н, Н-3, J=7,7); 8,50 (д, 1 Н, Н-4, J=7,7); 9,54 (т, 1 H, NHCH2-, J=4,9); 10,73 (уш, с, 1 Н, NМе2H+).
Найдено (%): С 56,73; Н 4,51; Cl 8,64; N 10,51. C19H18ClN3O5.
Вычислено (%): С 56,51; Н 4,49; Cl 8,78; N 10,41.
б) N-[2-(Диметиламино)этил] -1-этилтио-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамид (3)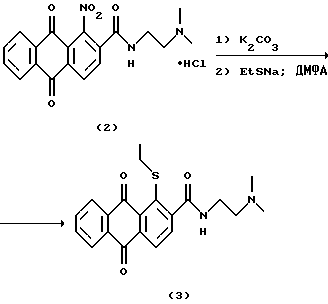
К суспензии амида 2 (0,74 г, 1,83 ммоль) в ДМФА (10 мл) прибавляют карбонат калия (0,27 г, 1,9 ммоль) и перемешивают 30 мин при 25oС, после чего прибавляют тиоэтилат натрия (0,2 г, 2,38 ммоль) и перемешивают еще 12 ч при 25oС. Реакционную массу выливают в 10% раствор соляной кислоты (50 мл) и перемешивают 30 мин. Выпавший осадок отфильтровывают, промывают водой (3 x 15 мл), перекристаллизовывают из смеси тетрагидрофуран (ТГФ)/этанол (1:2) и высушивают. Получают 0,57 г соединения 3 (выход 81%). Т. пл. 161 - 162oС.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 1,10 (т, 3 Н, SCH2СН3, J=7,7); 2,25 (с, 6 Н, -NMe2); 2,45-2,53 (м, 2 H, -CH2NMe2); 2,89 (кв, 2 H, SCH2CH3, J= 7,7); 3,34-3,43 (м, 2 Н, NCH2-); 7,73 (д, 1 Н, Н-3, J=7,7); 7,86-7,97 (м, 2 Н, Н-6, Н-7); 8,12-8,21 (м, 2 Н, Н-5, Н-8); 8,15 (д, 1 Н, Н-4, J=7,7); 8,59 (т, 1 Н, NHCH2-, J=5,5).
Найдено (%): С 66,05; Н 5,82; N 7,44; S 8,41. C21H22O3S.
Вычислено (%): С 65,95; Н 5,80; N 7,32; S 8,38.
в) 2-[2-(Диметиламино)этил] антра[2,1-d] изотиазол-3,6,11(2Н)-триона гидрохлорид (4).

К суспензии амида 3 (0,57 г, 1,49 ммоль) в абсолютном СН2Сl2 (8 мл) при интенсивном перемешивании прибавляют сульфурилхлорид (0,15 мл, 1,84 ммоль). После быстрого растворения осадка через 5-8 сек из красного раствора начинается выпадение продукта реакции. Реакционную массу перемешивают 1,5 ч при 20oС, разбавляют петролейным эфиром (50 мл), осадок отфильтровывают, промывают петролейным эфиром (3 x 15 мл), перекристаллизовывают из диметилсульфоксида (ДМСО) и высушивают. Получают 0,23 г соединения 4 (выход 39%). Т. пл. 317-319oС.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 2,50 (с, 6 Н, -NMe2); 3,42-3,53 (м, 2 Н, -CH2NMe2); 4,31 (т, 2 Н, NCH2-, J=4,9); 7,93-8,04 (м, 2 Н, Н-8, Н-9); 8,14-8,30 (м, 2 Н, Н-7, Н-10); 8,21 (д, 1 Н, H-4,J=7,7); 8,37 (д, 1 Н, H-5,J=7,7).
Найдено (%): С 58,77; Н 4,52; Cl 8,95; N 7,21; S 8,07. С19Н17СlNО3S.
Вычислено (%): С 58,68; Н 4,41; Cl 9,12; N 7,20; S 8,25.
Пример 2. 2-[2-(Диметиламино)этил] антра[2,1-d1]изотиазол-3,6,11(2Н)-трион (5).

Гидрохлорид 4 (0,5 г, 1,29 ммоль) суспендируют в 10 мл воды и при перемешивании прибавляют ацетат натрия (0,12 г, 1,36 ммоль), после чего весь осадок переходит в раствор. Продукт экстрагируют из воды этилацетатом (5 x 5 мл), органические фракции объединяют, сушат безводным сульфатом магния, отгоняют растворитель в вакууме, остаток высушивают и получают 0,24 г соединения 5 (выход 53%). Т. пл. 168-170oС.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 2,37 (с, 6 Н, -NMe2); 2,73 (т, 2 Н, -CH2NMe2, J= 5,3); 4,06 (т, 2 Н, NCH2-, J=5,3); 7,81-7,91 (м, 2 Н, Н-8, Н-9); 8,26-8,38 (м, 2 Н, Н-7, Н-10); 8,30 (д, 1 Н, Н-4, J=6,5); 8,42 (д, 1 Н, Н-5, J=6,5).
Найдено (%): С 64,92; Н 4,51; N 8,02; S 9,12. С19Н16О3S.
Вычислено (%): С 64,76; Н 4,58; N 7,95; S 9,10.
Пример 3. 2-[2-(Диметиламино)этил] антра[2,1-d] изотиазол-3,6,11(2Н)-триона фумарат (6).
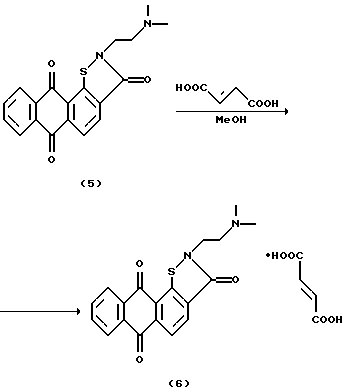
К суспензии триона 5 (0,1 г, 0,28 ммоль) в 5 мл абсолютного метанола прибавляют 2,1 мл 2% раствора фумаровой кислоты (0,033 г, 0,28 ммоль) в абсолютном метаноле. Смесь перемешивают при 35oС 1 ч, отгоняют растворитель в вакууме, остаток высушивают. Получают 0,13 г соединения 6 (выход 98%). Т. разл. >270oС.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 2,45 (с, 6 Н, -NMe2); 2,74-2,96 (м, 2 Н, -CH2NMe2); 4,08 (т, 2 Н, NCH2-, J=4,5); 6,59 (с, 2 Н, (СН)2(СООН)2); 7,93-8,08 (м, 2 Н, Н-8, Н-9); 8,14-8,31 (м, 2 Н, Н-7, Н-10); 8,21 (д, 1 Н, Н-4, J=7,7); 8,37 (д, 1 Н, Н-5, J=7,7).
Найдено (%): С 59,10; Н 4,31; N 5,93; S 6,78. C23H20N2O7S.
Вычислено (%): С 58,97; Н 4,30; N 5,98; S 6,84.
Пример 4. 2-[2-(Диметиламино)этил] антра[2,1-d] изотиазол-3,6,11(2Н)-триона цитрат (7).
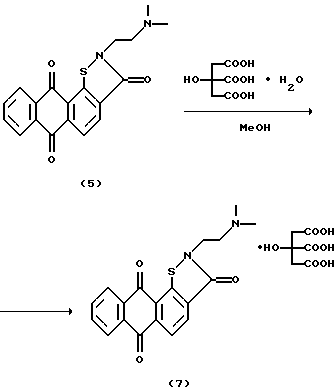
К суспензии триона 5 (0,1 г, 0,28 ммоль) в 5 мл абсолютного метанола прибавляют 3,7 мл 2% раствора лимонной кислоты (0,058 г, 0,28 ммоль) в абсолютном метаноле. Смесь перемешивают при 35oС 1 ч, отгоняют растворитель в вакууме, остаток высушивают. Получают 0,15 г соединения 7 (выход 98%). Т. разл. >270oС.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 2,62 (с, 6 Н, -NMe2); 2,65 (с, 4 Н, (НО)С(СН2)(СООН)3); 3,05-3,21 (м, 2 Н, -CH2NMe2); 4,08-4,24 (м, 2 Н, NCH2-); 3,19 (с, 2 Н, (НО)С(СН2)(СООН)3); 7,93-8,08 (м, 2 Н, Н-8, Н-9); 8,14-8,27 (м, 2 Н, Н-7, Н-10); 8,17 (д, 1 Н, Н-4, J=7,3); 8,34 (д, 1 Н, Н-5, J=7,3).
Найдено (%): С 55,42; Н 4,12; N 5,23; S 5,91. C25H24N2O10S.
Вычислено (%): С 55,14; Н 4,44; N 5,14; S 5,89.
Пример 5. 2-[2-(4-Морфолинил)этил]антра[2,1-d]изотиазол-3,6,11(2Н)-трион (11) (способ Б).
а) N-(2-Хлорэтил)-1-нитро-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамид (8).

К суспензии хлорангидрида 1-нитро-9,10-диоксо-9,10-дигидро-антрацен-2-карбоновой кислоты [15] (0,30 г, 0,95 ммоль) в гетерофазной системе бензол/вода (1:1, об.) при интенсивном перемешивании последовательно добавляют 2-хлорэтиламина гидрохлорид (0,12 г, 1,03 ммоль) и карбонат калия (0,3 г, 2,17 ммоль). Смесь перемешивают 2 ч при 25oС, отфильтровывают, промывают последовательно водой (2 x 10 мл), 10% НСl (2 x 10 мл) и этиловьм спиртом (2 x 10 мл). Осадок сушат на фильтре и получают 0,28 г соединения 8 (выход 84%). Т. пл. 259-262oС.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 3,59 (м, 2 Н, -CH2Cl); 3,74 (м, 2 Н, NHCH2-); 7,92-8,02 (м, 2 Н, Н-6, Н-7); 8,10-8,25 (м, 2 Н, Н-5, Н-8); 8,17 (д, 1 Н, Н-3, J=7,7); 8,48 (д, 1 Н, Н-4,J=7,7); 9,34 (т, 1 Н, NHCH2-, J=4,4).
Найдено (%): С 57,01; Н 3,21; Cl 9,74; N 7,96. С17Н11СlN2О5.
Вычислено (%): С 56,92; Н 3,09; Cl 9,88; N 7,81.
б) N-(2-Хлорэтил)-1-метилтио-9,10-диоксо-9,10-дигидроантрацен-2-карбоксамнд (9).

К суспензии амида 8 (0,5 г, 1,39 ммоль) в ДМФА (8 мл) прибавляют тиометилат натрия (0,12 г, 1,71 ммоль) и перемешивают 10 ч при 20oС. Реакционную массу выливают в 10% НС1 (30 мл) и перемешивают 30 мин. Выпавший осадок отфильтровывают, промывают водой (3 x 15 мл), перекристаллизовывают из смеси ТГФ/этанол (1: 2) и высушивают. Получают 0,37 г соединения 9 (выход 75%). Т. пл. 193-195oС.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 2,42 (с, 3 Н, -SСН3); 3,62 (м, 2 Н, -СН2Сl); 3,79 (м, 2 Н, NHCH2-); 7,76 (д, 1 Н, Н-3, J=7,2); 7,85-7,98 (м, 2 Н, Н-6, Н-7); 8,10-8,21 (м, 2 Н, Н-5, Н-8); 8,14 (д, 1 Н, Н-4, J=7,2); 8,98 (т, 1 Н, NHCH2-, J=5,4).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн,%): 361 [M]+/Cl37 (4,1%), 359 [M] +/Cl35 (14,7%), 346 (11,9%, [М]+/Сl37-Me), 344 (28,3%, [M]+/Cl35-Me), 324 (1,6%, [M] +/Cl37-С137, [M]+/Cl35-Cl35), 323 (40,5%, [M]+/Cl37-Cl37-H, [M] +/Cl35-Cl35-H), 308 (100%, [М]+-Cl-Me-H).
Найдено (%): С 60,12; Н 3,93; Cl 9,72; N 3,90; S 8,86. C18H14ClNO3S.
Вычислено (%): С 60,08; Н 3,92; Cl 9,85; N 3,89; S 8,91.
в) 2-(2-Хлорэтил)антра[2,1-d]изотиазол-3,6,11(2Н)-трион (10).

К суспензии амида 9 (0,5 г, 1,39 ммоль) в абсолютном СН2Сl2 (8 мл) при интенсивном перемешивании прибавляют SO2Cl2 (0,15 мл, 1,84 ммоль). Осадок практически сразу растворяется и через 5-8 сек из красного раствора начинается выпадение продукта реакции. Реакционную массу перемешивают 2 ч при 20oС, разбавляют петролейным эфиром (30 мл), осадок отфильтровывают, промывают петролейным эфиром (3 x 10 мл), перекристаллизовывают из ДМСО и высушивают. Получают 0,33 г соединения 10 (выход 69%). Т. пл. 261-264oС.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 4,00 (т, 2 Н, CH2Cl, J=4,7); 4,24 (т, 2 Н, NCH2-, J=4,7); 7,93-8,03 (м, 2 Н, Н-8, Н-9); 8,13-8,27 (м, 2 Н, Н-7, Н-10); 8,18 (д, 1 Н, Н-4, J=5,9); 8,36 (д, 1 Н, Н-5, J=5,9).
Найдено (%): С 59,67; Н 3,01; Cl 10,62; N 4,37; S 9,51. C17H10ClNO3S.
Вычислено (%): С 59,39; Н 2,93; Cl 10,31; N 4,07; S 9,33.
г) 2-[2-(4-Морфолинил)этил]антра[2,1-d]изотиазол-3,6,11(2Н)-трион (11).

К суспензии изотиазолона 10 (0,30 г, 0,87 ммоль) в ДМФА (5 мл) прибавляют морфолин (0,12 мл, 0,12 г, 1,35 ммоль), карбонат калия (0,13 г, 0,94 ммоль) и каталитическое количество иодида калия (5-10 мг). Реакционную смесь перемешивают при 50-55oС в течение 48 ч, выливают в воду, перемешивают 30 мин при 20oС, выпавший осадок отфильтровывают и хроматографируют на колонке с силикагелем (L 40/100; элюент - смесь толуол/этилацетат 2:1, затем - этилацетат). Фракции, содержащие целевой продукт, упаривают при пониженном давлении, остаток сушат на воздухе. Получают 0,10 г изотиазолона 11 (выход 31%). Т. пл. 208-212oС.
Спектр ЯМР 1H(CDCl3, δ, м.д., J, Гц): 2,53-2,72 (м, 4 Н, -СН2OСН2-); 2,79 (т, 2 Н, -СН2М(СН3)2-, J=4,8); 3,74-3,87 (м, 4 Н, -CH2NCH2-); 4,08 (т, 2 Н, NCH2-, J=4,8); 7,79-7,96 (м, 2 Н, Н-8, Н-9); 8,22-8,47 (м, 4 Н, Н-7, Н-10, Н-4, Н-5).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн,%): 394 (0,3%) [М]+ 308 (2,8%, [М] +-N(CH2CH2)2O), 294 (9,21%, [М]+-H2CN(CH2CH2)2O), 281 (6,1%, [М] +-H2CCHN(CH2CH2)2O), 264 (5,1%), 238 (15,8%), 113 (74,2%, H2CCHN(CH2CH2)20), 100 (100%, H2CN(CH2CH2)2O).
Найдено (%): С 64,11; Н 4,62; N 7,22; S 8,17. C21H18N2O4S.
Вычислено (%): С 63,94; Н 4,60; N 7,10; S 8,13.
Пример 6. 2-[(Диэтиламино)метил]антра[2,1-d]изотиазол-3,6,11-трион (13), 2-[(1-пиперидинил)метил] антра[2,1-d] изотиазол-3,6,11-трион (14), 2-[(4-морфолинил)метил]антра[2,1-d]изотиазол-3,6,11-трион (15) (способ В).

а) 2-[(Диэтиламино)метил]антра[2,1-d]изотиазол-3,6,11-трион (13).
Изотиазолон 12 (0,3 г, 1,06 ммоль) [15] перемешивают в ДМСО при 45-50oС до полного растворения, после чего к раствору последовательно прибавляют диэтиламин (0,15 мл, 0,11 г, 1,5 ммоль) и 38% водный раствор формальдегида (0,3 мл, 4,1 ммоль). Реакционную массу перемешивают при 45-50oС в течение 6 ч, раствор охлаждают до 20oС и оставляют на 3 ч. Выпавший мелкокристаллический осадок отфильтровывают, промывают этанолом (3 x 10 мл), сушат на воздухе. Получают 0,14 г продукта 13 (выход 35%). Т. пл. 158-160oС.
Спектр ЯМР 1Н (СОСl3, δ, м.д., J, Гц): 1,20 (т, 6 Н, N(СН2СН3)2, J=7,2); 2,80 (кв, 4 Н, N(СН2СН3)2); 4,85 (с, 2 Н, NCH2NEt2); 7,81-7,92 (м, 2 Н, Н-8, Н-9); 8,25-8,46 (м, 4 Н, Н-4, Н-5, Н-7, Н-10).
Найдено (%): С 65,72; Н 5,01; N 7,72; S 8,68. C20H18N2O3S.
Вычислено (%): С 65,55; Н 4,95; N 7,64; S 8,75.
б) 2-[(1-Пиперидинил)метил]антра[2,1-d]изотиазол-3,6,11-трион (14).
В вышеописанных условиях из изотиазолона 12 (0,3 г, 1,06 ммоль) и пиперидина (0,15 мл, 0,13 г, 1,5 ммоль) получают 0,22 г продукта 14 (выход 55%). Т. пл. 199 -202oС.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,35-1,55 (м, 2 Н, N(CH2CH2)2CH2); 1,56-1,76 (м, 4 Н, N(СН2СН2)2СН2); 2,67-2,84 (м, 4 Н, N(CH2CH2)2CH2); 4,76 (с, 2 Н, NCH2N); 7,79-7,95 (м, 2 Н, Н-8, Н-9); 8,22-8,50 (м, 4 Н, Н-4, Н-5, Н-7, Н-10).
Найдено (%): С 66,55; Н 4,62; N 7,45; S 8,51. C21H18N2O3S.
Вычислено (%): С 66,65; Н 4,79; N 7,40; S 8,47.
в) 2-[(4-Морфолинил)метил)]антра[2,1-d]изотиазол-3,6,11-трион (15).
В вышеописанных условиях из изотиазолона 12 (0,3 г, 1,06 ммоль) и морфолина (0,13 мл, 0,13 г, 1,5 ммоль) получают 0,26 г продукта 15 (выход 63%). Т. пл. 230-232oС.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 2,69-2,85 (м, 4 Н, N(CH2CH2)2O); 3,65-3,83 (м, 4 Н, N(CH2CH2)2O); 4,74 (с, 2 H, NCH2N); 7,78-7,93 (м, 2 Н, Н-8, Н-9); 8,21-8,46 (м, 4 Н, Н-4, Н-5, Н-7, Н-10).
Найдено (%): С 63,25; Н 4,20; N 7,31; S 8,54. C20H16N2O4S.
Вычислено (%): С 63,14; Н 4,24; N 7,36; S 8,43.
Пример 7. Ингибирование агрегации тромбоцитов человека, вызываемое производными антра[2,1-d]изотиазол-3,6,11-триона.
Влияние соединения настоящего изобретения на агрегацию тромбоцитов человека изучали известным турбидиметрическим способом Борна. Для этого венозную кровь, взятую утром у здоровых доноров, центрифугировали при 450 g при комнатной температуре в пластиковой посуде в течение 10 мин, используя в качестве антикоагулянта цитрат натрия. Супернатант, то есть богатую тромбоцитами плазму, отбирали и центрифугировали при 650 g в течение 30 мин, получая бедную тромбоцитами плазму. Концентрацию тромбоцитов доводили в богатой тромбоцитами плазме до 2,5-108 клеток/мл с помощью разведения бедной тромбоцитами плазмой и приливали полученную суспензию в кювету объемом 0,5 мл. Концентрацию АДФ подбирали в каждом эксперименте так, чтобы агрегация была обратимой и максимум приходился на 2 мин после добавления АДФ. В данном эксперименте АДФ в конечной концентрации 12,5 мкМ инициировал агрегацию тромбоцитов, степень которой составляла ~60%. Светорассеяние суспензии тромбоцитов измеряли с помощью агрегометра, разработанного в лаборатории биоорганической химии биологического факультета МГУ им. М.В. Ломоносова. Изучаемое соединение (в виде водного раствора, при необходимости содержащего ДМСО до 0,2%) добавляли в пробу до внесения индуктора агрегации (АДФ).
Полученные результаты показывают, что исследуемые соединения в описанных условиях ингибировали агрегацию тромбоцитов. Значение концентрации, при которой достигалось полумаксимальное ингибирование (IС50), для соединений 5, 11 и 14 составило 4,5; 7 и 23 мкМ соответственно. Известный аналог, согласно данным прототипа, в близких условиях имел значение IС50, равное 57 мкМ.
Пример 8. Влияние производных антра[2,1-d]изотиазол-3,6,11-триона на активность тионзависимых ферментов.
а) Ингибирование активности ОТ ВИЧ.
В качестве источника ОТ ВИЧ использовали клетки BL21(DE3)plysS, которые трансформировались плазмидой pBRP-HR и культивировались в объеме 250 мл. Экспрессию гена ОТ индуцировали добавлением изопропилтио-β-D-галактозида. Фермент очищали известным способом с помощью аффинной хроматографии на колонке с Ni-N-тетраацетатагарозой. За единицу активности ОТ принимали количество фермента, катализирующего включение в ДНК 1 нмоля dNTP за 10 мин при 37oС.
Смесь для определения активности фермента содержала 50 мМ трис-HCl, рН 8,0; 5 мМ.
MgCl2, 75 мМ КСl, 10 мМ ДТТ, 0,05% NP-40, по 50 мкМ дезоксинуклеозид-5'-трифосфатов (dATP, dGTP, dCTP, TTP), 2000000 cpm 32P-ATP, 1 мкг активированной ДНК и100 нМ ОТ (объем пробы 20 мкл). Через 20-30 мин при 37oС смесь наносили на фильтры Ватман 3ММ и отмывали 3 раза трихлоруксусной кислотой (10, 5 и 5%). Фильтры сушили и количество включенной метки определяли на сцинтилляционном счетчике в толуольном сцинтилляторе.
Исследуемые соединения вносили в пробу в виде 10 мМ водных растворов (при необходимости для повышения растворимости добавляли диметилсульфоксид в таком количестве, чтобы его концентрация в пробе не превышала 1-2%). Преинкубацию соединений с ферментом проводили как в отсутствие, так и в присутствии ДНК, энзиматическую реакцию начинали добавлением в пробу дезоксинуклеозид-5'-трифосфатов.
Полученные результаты показывают, что исследуемые производные антра[2,1d] изотиазол-3,6,11-триона общей формулы I при конечной концентрации в пробах, равной 50-1000 мкМ, в описанных условиях оказывают ингибирующее действие на активность ОТ. Так, активность фермента в присутствии 500 мкМ соединения 5 в условиях без предварительной инкубации составила 63,2 и 73,6% от исходного значения (в отсутствие и в присутствии ДНК соответственно). В результате предварительной инкубации в течение 5-20 мин ингибирующее действие соединения усиливалось, активность ОТ составляла 55,3 и 45,1% от исходного значения (в отсутствие и в присутствии ДНК соответственно).
б) Ингибирование активности каспазы-3.
В работе использовали крыс линии Вистар средней массой 180-200 г. Для активации каспазы-3 животным вводили внутрибрюшинно бактериальный липополисахарид из E. coli в дозе 20 мкг/кг. Через 12 ч после инъекции крыс декапитировали и проводили перфузию печени через портальную вену 0,9% раствором NaCl. В дальнейшем печень гомогенизировали в 5 объемах буфера (100 мМ HEPES, рН 7,4, 140 мкМ NaCl, 1 мМ фенилметилсульфонилфторида, по 10 мкг/мл апротинина, пепстатина и лейпептина) и центрифугировали 30 мин при 13000g при 4oС. Полученный супернатант использовали для определения активности каспазы-3.
Активность каспазы-3 определяли известным спектрофотометрическим способом с использованием Ac-DEVD-pNa в качестве субстрата. Супернатант печени (400 мкг белка) инкубировали 1 ч при 37oС в 100 мМ HEPES, рН 7,4, содержащем 200 мкМ Ac-DEVD-pNa и 0,1% CHAPS. Реакцию останавливали, охлаждая пробы на льду. Для осаждения нерастворившихся компонентов, пробы центрифугировали при 13000g 10 мин при 4oС. Абсорбцию pNa, образовавшегося в результате ферментативного расщепления Ac-DEVD-pNa, измеряли при 405 нм.
Исследуемые соединения растворяли в воде (при необходимости добавляли ДМСО до конечной концентрации 10% в пробе). Полученные растворы соединений инкубировали с супернатантами печени в вышеуказанном буфере. Влияние соединений на активность каспазы-3 печени крыс определяли при двух способах инкубации: с предварительной инкубацией с супернатантами печени при комнатной температуре в течение 30 мин и без предварительной инкубации. В дальнейшем активность каспазы-3 определяли вышеописанным способом. В качестве известного ингибитора фермента (для контроля) использовали 5 мкМ Ac-DEVD-CHO.
Определение содержания белка в пробах осуществляли по способу Бредфорда.
Полученные результаты показывают, что исследуемые производные антра[2,1-d] изотиазол-3,6,11-триона при конечной концентрации в пробах, равной 30-300 мкМ, в описанных условиях оказывают ингибирующее действие на активность каспазы-3 печени крыс. Так, активность фермента в условиях без предварительной инкубации в присутствии 100 мкМ соединения 5 составила 33,8% от исходного значения. В результате предварительной инкубации в течение 30 мин при 22oС ингибирующее действие данного соединения усилилось (активность каспазы-3 составляла 29,7% от исходного значения).
Пример 9. Взаимодействие производных антра[2,1d]изотиазол-3,6,11-триона с низкомолекулярными тиолами
Изучение взаимодействия производных антра[2,1-d]изотиазол-3,6,11-триона с низкомолекулярными тиолами (дитиотреитолом и глутатионом) проводили с помощью спектрометрии в УФ и видимой областях спектра с использованием соединения 5. Реакционная смесь (3 мл) содержала 85 мкМ соединение 5, 100 мкМ глутатион или дитиотреитол, 25 мМ Трис-НСl (рН 7,6) или 100 мМ КОН (рН 13) и 5% этанол.
В ходе проведенных экспериментов не наблюдались изменения оптической плотности реакционной смеси в описанных условиях при рН 7,6 в присутствии дитиотреитола или глутатиона, а также при рН 13 в присутствии глутатиона при указанных значениях длин волн. При рН 13 в присутствии дитиотреитола наблюдались значительные изменения оптической плотности реакционной смеси при длинах волн, соответствующих максимумам поглощения соединения 5 в УФ-спектре (см. таблицу). Данные изменения оптической плотности развивались в течение 20 мин и свидетельствуют о протекании химической реакции между соединением 5 и дитиотреитолом в щелочной среде.
Полученные результаты показывают, что в описанных условиях при физиологических значениях рН производные антра[2,1-d]изотиазол-3,6,11-триона не вступают в химическую реакцию с низкомолекулярными тиолами.
Пример 10. Острая токсичность производных антра[2,1-d] изотиазол-3,6,11-триона.
Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД50 с использованием беспородных мышей обоего пола средней массой 20 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч, по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значения ЛД50 для исследуемых соединений составляют не менее 30-50 мг/кг. Для известного аналога определение острой токсичности не проводилось.
Производные антра[2,1-d] изотиазол-3,6,11-триона ингибируют агрегацию тромбоцитов в условиях in vitro в концентрациях, более низких по сравнению с соответствующими концентрациями известного аналога. Кроме того, соединения настоящего изобретения могут быть использованы в биохимических исследованиях для изучения строения и механизма действия тиолзависимых ферментов (например, обратной транскриптазы ВИЧ и каспазы-3).
Таким образом, производные антра[2,1-d]изотиазол-3,6,11-триона общей формулы (I) расширяют ассортимент эффективных ингибиторов агрегации тромбоцитов и ингибиторов тиолзависимых ферментов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНГИБИРОВАНИЯ КАСПАЗ | 2002 |
|
RU2233326C1 |
| ИНГИБИТОР АГРЕГАЦИИ ТРОМБОЦИТОВ, ОБЛАДАЮЩИЙ АНТИМЕТАСТАТИЧЕСКИМ ДЕЙСТВИЕМ | 2001 |
|
RU2192857C1 |
| ПРОИЗВОДНЫЕ (1,2,3-ТРИАЗОЛИЛ)-1,2,5-ОКСАДИАЗОЛА, ПОТЕНЦИРУЮЩИЕ NO-ЗАВИСИМУЮ АКТИВАЦИЮ РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 2000 |
|
RU2158265C1 |
| ПРОИЗВОДНЫЕ ТЕТРАФУРАЗАНО[3,4-b:3',4'-f:3",4"-j:3'",4'"-N][1,4,5,8,9,12,13,16]ОКТААЗАБ ИЦИКЛО[14.2.2]ЭЙКОЗА-4,8,12-ТРИЕНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2167161C1 |
| СПОСОБ ПРЯМОГО ИНГИБИРОВАНИЯ КАСПАЗ | 2002 |
|
RU2232809C1 |
| Тримерные четвертичные соли пиридиния, обладающие биоцидным действием | 2021 |
|
RU2773080C1 |
| СПОСОБ ПОЛУЧЕНИЯ СМЕСЕВОГО ПЛАСТИФИКАТОРА (ВАРИАНТЫ) | 2000 |
|
RU2169140C1 |
| N-НИТРООКСАЗОЛИДИНЫ-1,3 И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2181719C2 |
| СПОСОБ ПОЛУЧЕНИЯ СМЕСЕВОГО ПЛАСТИФИКАТОРА | 1999 |
|
RU2148574C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(АДАМАНТИЛ-1)-БЕНЗОЛСУЛЬФОХЛОРИДА | 2000 |
|
RU2177941C1 |




Изобретение относится к новым химическим соединениям - производным антра[2,1-d]изотиазол-3,6,11-триона общей формулы I, где А - низший алкилен, R1 и R2 (независимо) - низший алкил или R1 и R2 вместе с атомом азота образуют шестичленный насыщенный гетероцикл, который дополнительно может содержать гетероатом, такой как атом кислорода, и их фармакологически приемлемым солям. Предпочтительно указанные соединения ингибируют агрегацию тромбоцитов, а также снижают активность ряда тиолзависимых ферментов, в частности, таких как обратная транскриптаза вируса иммунодефицита человека (ОТ ВИЧ) и каспаза-3. Данное изобретение может быть использовано в биохимии, физиологии и медицине. 3 з.п.ф-лы, 1 табл.

отличающиеся тем, что А - низший алкилен; R1 и R2 (независимо) - низший алкил или R1 и R2 вместе с атомом азота образуют шестичленный насыщенный гетероцикл, который может содержать дополнительно гетероатом, такой, как атом кислорода, и их фармакологически приемлемые соли.
| Kucherov F.A., Zlotin S.G | |||
| , Russ | |||
| Chem | |||
| Bull., 2001, v.50, № 9, p.1657-1662 | |||
| Радиатор для центрального отопления | 1923 |
|
SU753A1 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ ТИАЗОЛА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АКТИВНОСТЬ АГОНИСТА 5-НТ*003-РЕЦЕПТОРА НА ЕГО ОСНОВЕ | 1995 |
|
RU2098418C1 |
Авторы
Даты
2003-10-10—Публикация
2002-06-27—Подача