Изобретение относится к биохимии, в частности к усовершенствованному способу ингибирования цистеиновых аспартат-специфичных протеаз (каспаз).
Изобретение может быть использовано в биохимии, клеточной биологии, физиологии и фармакологии для изучения и направленной регуляции процессов, связанных с индукцией, развитием и/или предотвращением программированной клеточной гибели (апоптоза), а также для исследования строения и механизма действия каспаз.
В настоящее время установлено, что апоптоз в клетках животных и человека в большинстве случаев связан с протеолитической активацией каскада каспаз - семейства цистеиновых протеаз, катализирующих расщепление субстратов после остатков аспарагиновой кислоты (G.M.Cohen "Caspases: the executioners of apoptosis" Biochem. J., 1997, v.326, pt.1, p.1-16 [1]; N.A.Thomberry, Y.Lazebnik "Caspases: enemies within" Science, 1998, v.281(5381), p.1312-1316 [2]; Y.Shi "Mechanisms of caspase activation and inhibition during apoptosis" Mol. Cell, 2002, v.9, №3, p.459-470 [3]).
В зависимости от гомологии и субстратной специфичности выделяют три основные группы каспаз - 1) протеазы, вовлеченные в процесс воспаления (каспазы 1, 4, 5 и 13), 2) так называемые инициирующие или сигнальные (каспазы 6 и 8-10) и 3) эффекторные протеазы (каспазы 2, 3, 7). Каспаза-3 играет одну из ключевых ролей в осуществлении программированной клеточной гибели различных типов клеток. Соединения, ингибирующие данный фермент, обладают цитопротекторным действием и рассматриваются как потенциальные фармакологические средства для лечения инфаркта миокарда, церебральной ишемии, болезни Альцгеймера, остеоартрита, цирроза печени и других заболеваний (напр., T.Rudel "Caspase inhibitors in prevention of apoptosis" Herz, 1999, v.24, №3, p.236-241 [4]; N.Guttenplan, C.Lee, W.H.Frishman "Inhibition of myocardial apoptosis as a therapeutic target in cardiovascular disease prevention: focus on caspase inhibition" Heart Dis., 2001, v.3, №5, p.313-318 [5]; H.J.Rideout, L.Stefanis “Caspase inhibition: a potential therapeutic strategy in neurological diseases" Histol. Histopathol., 2001, v.l6, №3, p.895-908 [6]).
В многочисленных исследованиях для изучения возможного участия каспаз в определенных физиологических процессах, в частности в апоптозе, применяют известные способы ингибирования данных ферментов с помощью производных олигопепетидов, содержащих реакционноспособные группировки, такие как альдегидная, галоидметилкетонная и др. (напр., [4]).
Несмотря на определенную специфичность и эффективность способов ингибирования каспаз с помощью соединений данного класса в условиях in vitro, в физиологических и фармакологических исследованиях они нашли ограниченное применение по целому ряду причин, основными из которых являются плохая биодоступность при пероральном введении используемых соединений.
В настоящее время проводится поиск способов ингибирования каспаз с помощью соединений других классов, способных эффективно снижать активность данных ферментов.
Известен способ ингибирования каспаз путем введения в среду, содержащую соответствующие ферменты, N,N,N’,N’-тетраэтилтиурамдисульфида (дисульфирама) формулы (I):
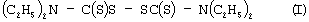
(C.S.Nobel, M.Kimland et al. "Disulfiram is a potent inhibitor of proteases of the caspase family" Chem. Res. Toxicol., 1997, v.10, №12, p.1319-1324 [7]).
Указанный способ при использовании 10 мкМ дисульфирама позволяет снизить активность каспазы-3 ~ на 70%.
Описан способ ингибирования каспазы-3 путем введения в среду (препарат из печени мышей), содержащую фермент, 1-(4-аминофенил)метил-3-(3-нитрофенил)-1,3-дигидроимидазо[4,5-b]пиридин-2-она (ZNC-2381) формулы (II):
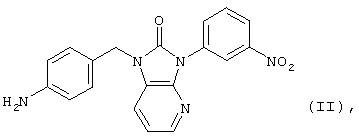
(Y.Segawa, N.Tsuzuike et al. "Effects of a novel hepatoprotective drug, ZNC-2381, on fasinduced hepatocellular caspase-3 activity and apoptosis in mice" Pharmacology, 2001, v.62, №2, p.80-86 [8]).
Данный способ при использовании 10 мкМ ZNC-2381 приводит к снижению активности каспазы-3 на 41,6%.
Известны производные 1,2-изотиазол-3-она общей формулы (III):
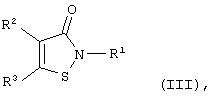
где если R1 - фенил, незамещенный или содержащий в качестве заместителя атом хлора, метильную, трифторметильную, этоксикарбонильную или метоксигруппу, то R2 - H, фенил, этоксикарбонильная, метокси- или цианогруппа и R3 - фенил, незамещенный или содержащий в качестве заместителя атом хлора, метил, трифторметил или метоксигруппу, или R2 и R3 вместе с соседними атомами углерода образуют бензольный или пиридиновый цикл, который может быть замещен метоксигруппой, или если R1 - бензил, тиазолил, пиридил, бензотиазолил или фенил, содержащий в качестве заместителя 4-F, 4-Br, 4-J, 2 низших алкила, 4-аминокарбонильную, 4-[(диметил)амино]карбонильную, нитро-, амино-, 4-цианогруппу, 2-3 метоксигруппы или одновременно метоксикарбонильную и метоксигруппу, то R2+R3=-CH=CH-CH=N-, ингибирующие деградацию протеогликана хряща под действием интерлейкина-1β (S.W.Wright, J.J.Petraitis et al. "Heteroaryl-fused 2-phenylisothiazolone inhibitors of cartilage breakdown" J. Med. Chem., 1994, v.37, №19, p.3071-3078 [9]; S.W.Wright, J.J.Petraitis et al. ""Metabolism resistant isothiazolone inhibitors of cartilage breakdown" Bioorg. Med. Chem., 1995, v.3, №3, p.227-234 [10]; S.W.Wright, J.J.Petraitis et al. "2,5-Diarylisothiazolone: novel inhibitors of cytokine-induced cartilage destruction" Bioorg. Med. Chem., 1996, v.4, №6, p.851-858 [11]; E.C.Amer, M.A.Pratta et al. "Isothiazolones interfere with normal matrix metalloproteinase activation and inhibit cartilage proteoglycan degradation" Biochem. J., 1996, v.318, pt.2, p.417-424 [12].
Известны производные 1,2-бензизотиазол-3-она общей формулы (IV):
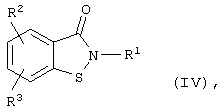
где R1=-R4-NR5R6, где R4 - С1-12-алкилен, R5 и R6 - низшие алкилы или NR5R6 образуют насыщенный азотсодержащий гетероцикл, такой как пирролидин, азепин и др., а R2 и R3 (независимо) - Н, атом галогена, низший алкил, низший алкоксил, нитро-, амино- или ациламиногруппы, или R2 и R3, расположенные у соседних атомов углерода, вместе с данными атомами образуют аннелированные алкиленовые или оксиалкиленовые циклы и др. и их фармакологически-приемлемые соли, ингибирующие агрегацию тромбоцитов (патент ФРГ №2602643, C 07 D 275/04, oпубл. 1984 г. [13]; выложенная заявка ФРГ №2652201, C 07 D 417/02, oпубл. 1977 г. [14]; K.H.Baggaley, P.D.English et al. “Inhibitors of blood platelet aggregation. Effects of some 1,2-benzisothiazol-3-ones on platelet responsiveness to adenosine diphosphate and collagen” J. Med. Chem., 1985, v.28, №11, p.1661-1667 [15]).
Известны нитропроизводные 1,2-бензизотиазол-3-она вышеуказанной общей формулы (IV), где R1=Н, низший алкил, фенил и др., и, по крайней мере, один из радикалов R2 или R3=NО2, а другой - NO2, NH2, Сl или Н, в качестве продуктов химического синтеза (патент Канады №2151074, C 07 D 275/04, oпубл. 1996 [16]; выложенные заявки ФРГ №3202298, C 07 D 275/04, oпубл. 1983 г. [17]; №4339270, С 09 В 29/09, oпубл. 1995 г. [18]; патент Японии №07330745 (95,330745), C 07 D 275/04, oпубл. 1995 г. [19]; Европейский патент №454621, C 07 D 275/04, oпубл. 1991 г. [20]).
Влияние соединений общих формул (III) и (IV) на активность каспаз не исследовано.
Наиболее близким к описываемому является известный способ ингибирования каспаз (преимущественно каспазы-3 и каспазы-7) путем введения в среду, содержащую соответствующие ферменты, производных изатина, в том числе соединения формулы (V):
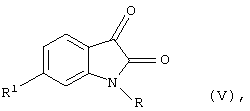
где R=СН3 и R1= 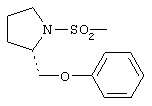 (патенты США №6214858, 514/418, oпубл. 2001 г. [21]; №6403792, 544/144, oпубл. 2002 г. [22]; D.Lee, S.A.Long et al. "Potent and selective nonpeptide inhibitors ofcaspases 3 and 7" J. Med. Chem., 2001, v.44, №12, p.2015-2026 [23] - прототип).
(патенты США №6214858, 514/418, oпубл. 2001 г. [21]; №6403792, 544/144, oпубл. 2002 г. [22]; D.Lee, S.A.Long et al. "Potent and selective nonpeptide inhibitors ofcaspases 3 and 7" J. Med. Chem., 2001, v.44, №12, p.2015-2026 [23] - прототип).
Несмотря на высокую эффективность вышеуказанного способа при ингибировании гомогенной рекомбинантной каспазы-3 (для соединения формулы (V) (IC50=3,1 нМ) при добавлении цитозоля хондроицитов в среду инкубации согласно приведенным данным [23] активность указанного соединения снижалась в 160 раз (IC50=7,5±3,5 мкМ). Описанный эффект авторы объясняют неспецифическим взаимодействием данного производного изатина с другими белками.
Задачей описываемого изобретения является разработка способа, позволяющего более эффективно ингибировать каспазы в присутствии других белков.
Указанная задача решается с помощью описываемого способа ингибирования каспаз путем введения азотсодержащего соединения в среду, содержащую активированные каспазы, отличающегося тем, что в качестве азотсодержащего соединения вводят изотиазол-3-он вышеуказанной общей формулы (III), где если R1 - фенил, незамещенный или содержащий в качестве заместителя атом хлора, метальную, трифторметильную, этоксикарбонильную или метоксигруппу, то R2 - Н, фенил, этоксикарбонильная, метокси- или цианогруппа и R3 - фенил, незамещенный или содержащий в качестве заместителя атом хлора, метил, трифторметил или метоксигруппу, или R2 и R3 вместе с соседними атомами углерода образуют аннелированный бензольный или пиридиновый цикл, который может быть замещен атомом галогена, нитро-, амино- или метоксигруппой, или, если R1 - C1-4-алкил, бензил, тиазолил, пиридил, бензотиазолил или фенил, содержащий в качестве заместителя 4-F, 4-Br, 4-J, 2 C1-4-алкила, 4-аминокарбонильную, 4-[(диметил)амино]карбонильную, нитро-, амино-, 4-цианогруппу, 2-3 метоксигруппы или одновременно метоксикарбонильную и метоксигруппу, то R2+R3=-CH=CH-CH=N-, или если R1 - -R4-NR5R6, где R4 – С1-12-алкилен, R5 и R6 - С1-4-алкилы или NR5R6 образуют насыщенный азотсодержащий гетероцикл, такой как пирролидин, пиперидин, азепин, то R2 и R3 вместе с соседними атомами углерода образуют аннелированный бензольный цикл, который может содержать 1-2 заместителя, выбранных из группы: атом галогена, С1-4-алкил, C1-4-алкоксил, нитро-, амино- или ациламиногруппа, или его биохимически приемлемую соль (напр., ацетат, сукцинат, гемисукцинат, малеат, цитрат, сульфат, гемисульфат, гидрохлорид и др.).
В качестве каспазы предпочтительно используют каспазу-3.
Описываемый способ ингибирования каспаз позволяет более эффективно снижать активность данных ферментов в присутствии других белков.
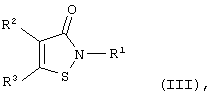
Производные изотиазол-3-она общей формулы (III), где R1=Н, C1-4-алкил, фенил, незамещенный или содержащий в качестве заместителя атом хлора, метильную, трифторметильную, этоксикарбонильную или метоксигруппу, R2 и R3 (независимо) = Н, C1-4-алкил, фенил, незамещенный или содержащий в качестве заместителя атом хлора, метил, трифторметил или метоксигруппу, атом хлора, C1-4-алкоксикарбонильная, метокси- или цианогруппа, получают известными способами, основанными на реакции амидов 3,3’-дитиодипропионовой кислоты с хлором или сульфурилхлоридом (S.N.Lewis, G.A.Miller et al. "Isothiazoles: 4-Isothiazolin-3-ones. A general synthesis from 3,3’-dithiodipropionamides" J.Heterocyclic Chem., 1971, v.8, p.571-580 [24]; патент США №5023275, А 61 К 31/165, oпубл. 1991 г. [25]; Европейский патент №489347, C 07 D 275/02, oпубл. 1992 г. [26]) или реакции солей 3-хлор- или 3-алкоксиизотиазолия с водой в присутствии оснований (патенты США №4262127, C 07 D 275/06, oпубл. 1981 г. [27]; №4508908, C 07 D 275/02, oпубл. 1984 г. [28]).
Производные изотиазол-3-она общей формулы (IV), где R1=Н, С1-4-алкил, фенил, -R4-NR5R6, где R4 - C1-12-алкилен, R5 и R6 - низшие алкилы или NR5R6 образуют насыщенный азотсодержащий гетероцикл, такой как пирролидин, азепин и др., а R2 и R3 (независимо) = Н, атом галогена, C1-4-алкил, С1-4-алкоксил, нитро-, амино- или С1-4-ациламиногруппы, или R2 и R3, расположенные у соседних атомов углерода, вместе с данными атомами образуют аннелированные алкиленовые или оксиалкиленовые циклы, получают известными способами, основанными на реакции 2-(хлорсульфанил)бензоилхлоридов с аминами (выложенная заявка ФРГ №3150629; C 07 D 275/04; oпубл. 1983 г. [29]); реакции 2-(алкилтио)бензамидов с хлором или сульфурилхлоридом ([18]; E.A.Serebryakov, P.G.Kislitsin et al. "Selective synthesis of 1,2-benzisothiazol-3-one-l-oxide nitro derivatives". Synthesis, 2001, №11, р.1659-1664 [30]); реакции 2-(алкилсульфинил)бензамидов с трихлоруксусным ангидридом ([9]; S.W.Wright, M.M.Abelman et al. "Benzyl and t-butyl sulfoxides as sulfenyl halide equivalents: A convenient preparation of benzisothiazolones", Tetrahedron Lett., 1992, v.33, №2, p.153 [31]; патент США №5324483, C 08 F 283/00, oпубл. 1994 г. [32]); реакции 2-(алкилтио)бензальдоксимов с полифосфорной кислотой (L.K.A.Rahman, R.M.Scrowston "7-Substituted benzo[b]thiophenes and 1,2-benzisothiazoles. Part 2: Chloro and nitroderivatives", J. Chem. Soc., Perkin Trans. I, 1984, №3, р.385-390 [33]); реакции 2-хлорбензальдегидов со смесью серы и аммиака (выложенная заявка ФРГ №4339270, С 09 В 29/09, oпубл. 1995 г. [20]; J.Markert, H.Hagen, "Darstellung von 1,2-Benzisothiazolen und einige folgereaktionen" Lieb. Ann. Chem., 1980, №5, р.768-778 [34]); реакции 2,2’-дитиобензамидов с кислородом и щелочью в присутствии азот-, серо- или фосфорсодержащих нуклеофилов (заявка РСТ №98/28283, C 07 D 275/04, oпубл. 1998 г. [35]); реакции 2,2’-дитиобис(бензамидов) с бромом в среде дихлорметана (J.A.Loo, Т.Р.Holler et al. "Biophysical characterization of zink ejection from HIV nucleocapsid protein by anti-HIV 2,2’-bithiobis(benzamides) and benzisothiazolones" J. Med. Chem., 1996, v.39, p.4313-4320 [36]; P.W.K.Woo, Y.-M.Pu, C.C.Huang "Synthesis of carbon-14 labeled CI-1012 and CI-1013, potential anti-HIV agents", J. Lab. Сотр. Radiopharmac., 1999, v.42, p.827-834 [37]) или реакции 2,2’-дитиобис(бензоилхлоридов) с хлором и первичными аминами (J.A.Turpin, Y.Song et al. "Synthesis and biological properties of novel pyridinioalkanoyl thiolesters (PATE) as anti-HIV-1 agents that target the viral nucleocapsid protein zink fingers" J. Med. Chem., 1999, v.42, p.67-86 [38]).
Изобретение иллюстрируется следующим примером.
Пример 1. Ингибирующее действие 1,2-изотиазол-3-онов общей формулы (IV) на активность каспаз печени крыс.
В работе использовали крыс линии Вистар средней массой 180-200 г. Для активации каспазы-3 животным вводили внутрибрюшинно бактериальный липополисахарид из E.coli в дозе 20 мкг/кг. Через 12 ч после инъекции крыс декапитировали и проводили перфузию печени через портальную вену 0,9% раствором NaCl. В дальнейшем печень гомогенизировали в 5 объемах буфера (100 мМ HEPES, рН 7,4, 140 мкМ NaCl, 1 мМ фенилметилсульфонилфторида, по 10 мкг/мл апротинина, пепстатина и лейпептина) и центрифугировали 30 мин при 13000g при 4°С. Полученный супернатант использовали для определения активности каспаз с помощью специфических субстратов.
Показано, что печень животных содержит каспазы 1 (ICE), 3, 7 и другие изоформы, причем каспаза-3 находится преимущественно в цитозоле гепатоцитов, в то время как каспаза-7 ассоциирована почти исключительно с митохондриальной и микросомальной фракциями. При индукции апоптоза каспаза-7 активируется и транслоцируется в эндоплазматический ретикулум (N.Rouquet, J.С.Pages et al. "ICE inhibitor YVADcmk is a potent therapeutic agent against in vivo liver apoptosis" Curr. Biol. 1996, v.6, №9, p.1192-1195 [39]; J.M.Chandler, G.M.Cohen, M.MacFarlane "Different subcellular distribution of caspase-3 and caspase-7 following Fas-induced apoptosis in mouse liver" J. Biol. Chem. 1998, v.273, №18, p.10815-10818 [40]).
Активность каспазы-3 и 7 определяли известным спектрофотометрическим способом с использованием (N-ацетил-L-аспартил)-L-глутамил-L-валил-L-аспарагиновой кислоты п-нитроанилида (Ac-DEVD-pNa) в качестве субстрата (R.V.Talanian, C.Quinlan et al. "Substrate specificities of caspase family proteases" J. Biol. Chem. 1997, v.272, №15, p.9677-9682 [41]).
Супернатант печени (400 мкг белка) инкубировали 1 ч при 37°С в 100 мМ HEPES, рН 7,4, содержащем 200 мкМ Ac-DEVD-pNa и 0,1% CHAPS. Реакцию останавливали, охлаждая пробы на льду. Для осаждения нерастворившихся компонентов пробы центрифугировали при 13000g в течение 10 мин при 4°С. Абсорбцию pNa, образовавшегося в результате ферментативного расщепления Ac-DEVD-pNa, измеряли при 405 нм. Аналогичным образом определяли активность каспазы-1 с использованием в качестве субстрата (N-ацетил-L-тирозил)-L-валил-L-аланил-L-аспарагиновой кислоты п-нитроанилида (Ac-YVAD-pNa) [41].
Исследуемые соединения растворяли в воде (при необходимости добавляли ДМСО до конечной концентрации 10% в пробе). Полученные растворы соединений инкубировали с супернатантами печени в вышеуказанном буфере. Влияние соединений на активность каспаз печени крыс определяли при двух способах инкубации - с предварительной инкубацией с супернатантами печени при комнатной температуре в течение 30 мин и без предварительной инкубации. В дальнейшем активность каспаз 3 и 7 определяли вышеописанным способом. В качестве известного ингибитора данных изоформ фермента (для контроля) использовали 5 мкМ Ac-DEVD-CHO [41].
Определение белка в пробах осуществляли по известному способу Бредфорда.
Полученные результаты показывают, что исследуемые производные изотиазол-3-она при конечной концентрации в пробах, равной 1-100 мкМ, в описанных условиях оказывают ингибирующее действие на активность каспаз печени крыс. Так, активность каспазы-3 (частично дополненная активностью каспазы-7, перешедшей в цитозоль) в условиях без предварительной инкубации в присутствии 10 мкМ 2-метил-, 2-фенил- и 2-бензил-6-нитробензизотиазол-3-она составила 10,22±1,43, 9,68±1,43 и 7,08±1,70% от исходного значения соответственно. В результате предварительной инкубации в течение 30 мин при 22°С ингибирующее действие 2-фенил- и 2-бензил-6-нитробензизотиазол-3-она усилиливалось (активность каспазы-3 и частично каспазы-7 составляла 4,84±0,80 и 4,30±0,64% от исходного значения соответственно). Согласно способу-прототипу активность каспазы-3 в присутствии 7,5±3,5 мкМ производного изатина и других белков цитозоля хондроицитов составляла 50%.
5-Нитроизатин, который согласно известным данным [23] снижал активность очищенной каспазы-3 (IC50=3 мкМ), в вышеописанных условиях проявлял значительно более слабые ингибирующие свойства (IC50~100 мкМ). Это соответствует опубликованным данным о существенном уменьшении ингибирующей активности производных изатина в присутствии цитозоля хондроицитов, содержащего другие белки.
Таким образом, описываемый способ ингибирования каспаз (в частности, каспазы-3) с помощью соответствующих замещенных 1,2-изотиазол-3-онов и 1,2-бензизотиазол-3-онов позволяет эффективно снижать активность данного класса протеаз в присутствии других белков.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРЯМОГО ИНГИБИРОВАНИЯ КАСПАЗ | 2002 |
|
RU2232809C1 |
| 1,3-ДИОКСО -2,3-ДИГИДРО-1H-ПИРРОЛО[3,4-C]ХИНОЛИНЫ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБЫ ЛЕЧЕНИЯ (ВАРИАНТЫ) | 2003 |
|
RU2257385C2 |
| АННЕЛИРОВАННЫЕ КАРБАМОИЛАЗАГЕТЕРОЦИКЛЫ, ФОКУСИРОВАННАЯ БИБЛИОТЕКА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ | 2005 |
|
RU2281947C1 |
| ФЕНИЛЗАМЕЩЕННЫЕ НАФТОПИРАНОВЫЕ СОЕДИНЕНИЯ ИЛИ ИХ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2071472C1 |
| ИМИДАЗОПИРИДИНОВЫЕ ИНГИБИТОРЫ IAP | 2007 |
|
RU2466131C2 |
| 1-СУЛЬФОНИЛ-1,3-ДИГИДРОИНДОЛ-2-ОНЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2003 |
|
RU2259999C2 |
| ПРОИЗВОДНЫЕ ПИРАНО-ХИНОЛИНОВ, СПОСОБ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2125573C1 |
| ПЕСТИЦИДЫ | 1994 |
|
RU2142938C1 |
| ИНГИБИТОРЫ IAP | 2006 |
|
RU2451025C2 |
| ПРОИЗВОДНЫЕ 1-[2-(ЗАМЕЩЕННЫЙ ВИНИЛ)]-5Н-2,3-БЕНЗОДИАЗЕПИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ, ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 1996 |
|
RU2161607C2 |
Изобретение относится к биотехнологии, в частности касается ингибирования цистеиновой аспартат-специфичной протеазы (каспазы), и может быть использовано в биохимии, клеточной биологии, физиологии и фармакологии для изучения и направленной регуляции процессов, связанных с индукцией, развитием и/или предотвращением программированной клеточной гибели (апоптоза). Способ ингибирования каспаз осуществляют введением азотсодержащего соединения в среду - производное 1,2-изотиазол-3-она общей формулы (1), где если R1 - фенил, незамещенный или содержащий в качестве заместителя атом хлора, метильную, трифторметильную, этоксикарбонильную или метоксигруппу, то R2 - Н, фенил, этоксикарбонильная, метокси- или цианогруппа и R3 - фенил, незамещенный или содержащий в качестве заместителя атом хлора, метил, трифторметил или метоксигруппу, или R2 и R3 вместе с соседними атомами углерода образуют аннелированный бензольный или пиридиновый цикл, который может быть замещен атомом галогена, нитро-, амино- или метоксигруппой, или если R1 – C1-4-алкил, бензил, тиазолил, пиридил, бензотиазолил или фенил, содержащий в качестве заместителя 4-F, 4-Br, 4-J, 2 C1-4-алкила, 4-аминокарбонильную, 4-[(диметил)амино]карбонильную, нитро-, амино-, 4-цианогруппу, 2-3 метоксигруппы или одновременно метоксикарбонильную и метоксигруппу, то R2 + R3 = -CH=CH-CH=N-, или если R1 - -R4-NR5R6, где R4 – С1-12-алкилен, R5 и R6 – C1-4 -алкилы или NR5R6 образуют насыщенный азотсодержащий гетероцикл, такой как пирролидин, пиперидин, азепин, то R2 и R3 вместе с соседними атомами углерода образуют аннелированный бензольный цикл, который может содержать 1-2 заместителя, выбранных из группы: атом галогена, С1-4-алкил, С1-4-алкоксил, нитро-, амино- или ациламиногруппа, или его биохимически приемлемую соль. Изобретение позволяет эффективно снижать активность каспаз в присутствии других белков (для известного производного изатина IC50 = 7,5±3,5 мкМ; в присутствии 10 мкМ соединений, применяемых в описываемом способе, в частности, 2-фенил- и 2-бензил-6-нитро-1,2-бензизотиазол-3-она, активность каспазы-3 составляла 4,84±0,80 и 4,30±0,64% от исходного значения соответственно).
Способ ингибирования каспаз путем введения азотсодержащего соединения в среду, содержащую соответствующие ферменты, отличающийся тем, что в качестве азотсодержащего соединения вводят производное 1,2-изотиазолона общей формулы
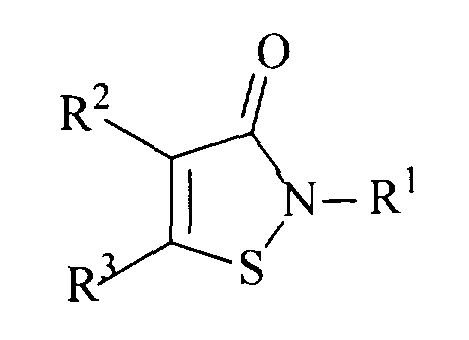
где если R1 – фенил, незамещенный или содержащий в качестве заместителя атом хлора, метильную, трифторметильную, этоксикарбонильную или метоксигруппу, то R2 - Н, фенил, этоксикарбонильная, метокси- или цианогруппа и R3 - фенил, незамещенный или содержащий в качестве заместителя атом хлора, метил, трифторметил или метоксигруппу, или R2 и R3 вместе с соседними атомами углерода образуют аннелированный бензольный или пиридиновый цикл, который может быть замещен атомом галогена, нитро, амино или метоксигруппой, или, если R1– C1-4-алкил, бензил, тиазолил, пиридил, бензотиазолил или фенил, содержащий в качестве заместителя 4-F, 4-Br, 4-J, 2 C1-4-алкила, 4-аминокарбонильную, 4-[(диметил)амино]карбонильную, нитро-, амино-, 4-цианогруппу, 2-3 метоксигруппы или одновременно и метоксикарбонильную и метоксигруппу, то R2 + R3 = -CH=CH-CH=N-, или, если R' - R4 NR5 R6, где R4 – С1-12-алкилен , R5 и R6 – С1=4-алкилы или NR5 R6 образуют насыщенный азотсодержащий гетероцикл, такой, как пирролидин, пиперидин, азепин, то R2 и R3 вместе с соседними атомами углерода образуют аннелированный бензольный цикл, который может содержать 1 - 2 заместителя, выбранных из группы: атом галогена, С1-4-алкил, C1-4-алкоксил, нитро-, амино- или С1-4-ациламиногруппа, или его биохимически приемлемую соль.
| US 6403792 A, 11.06.2002 | |||
| NOBEL C | |||
| S., KIMLAND M | |||
| et al | |||
| Disulfiram is a potent inhibitor of proteases of the caspase family | |||
| Chem | |||
| Res | |||
| Toxicol | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Молокоотсос-шприц для парентерального введения стерильного молока | 1924 |
|
SU1319A1 |
| US 6214858 A, 10.04.2001 | |||
| WRIGHT S.W., PETRAITIS | |||
| J.J | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Bioorg | |||
| Med | |||
| Chem., 1996, v.4, №6, p.851-858 | |||
| ГРАЧЕВА И..М., КРИВОВА А.Ю | |||
| Технология ферментных препаратов | |||
| - М., 2000, с | |||
| Способ отковки в штампах заготовок для спиральных сверл | 1921 |
|
SU367A1 |
Авторы
Даты
2004-07-27—Публикация
2002-11-26—Подача