Область техники
Данное изобретение относится к новым способам получения 2-хиноксалинкарбоновой кислоты, более конкретно к микробиологическому окислению 2-метилхиноксалина до 2-хиноксалинкарбоновой кислоты.
Уровень техники
В существующем уровне техники известны способы микробиологического окисления определенных ароматических гетероциклов, в частности способы микробиологического окисления метильных групп определенных ароматических гетероциклов, такие как, например, описанные в следующих статьях: "Gene Order of the TOL Catabolic Plasmid Upper Pathway Operon and Oxidation of Both Toluene and Benzyl Alcohol by the xylA Product," S. Harayama et al., J. Bacteriol., 167(2): 455-461 (1986) и "Enzymatic Oxidation of Methyl Groups on Aromatic Heterocycles: A Versatile Method for the Preparation of Heteroaromatic Carboxylic Acids," A. Keiner, Angew. Chem. Int. Ed. Engl., 31(6):774-775 (1992).
В патенте США 4859592 описан микробиологический способ получения пиколиновой кислоты, которая затем может быть превращена в продукты пиридина химическими способами.
В патентах США 5104798; 5213973 и 5236832 описаны микробиологические способы окисления метильных групп определенных ароматических гетероциклов с 5- или 6-членным кольцом до соответствующих карбоновых кислот, которые осуществляют с помощью бактерий видов Pseudomonas при использовании толуола, ксилола или цимола в качестве индуктора. Как отмечено в данном описании, в существующем уровне техники известно, что окисление метильных групп толуола до бензойной кислоты с помощью штамма Pseudomonas putida ATCC 33015 включает три стадии, катализируемые толуолмонооксигеназой, спиртдегидрогеназой и альдегиддегидрогеназой соответственно.
Как было описано ранее в указанной выше статье Harayama et al., TOL-плазмида pWWO P. putida mt-2 представляет собой передающийся внехромосомный элемент, который кодирует все типы ферментов, требуемых для окислительного катаболизма определенных ароматических углеводородов, включая толуол, м-ксилол и п-ксилол. Бактерии, несущие TOL-плазмиды, например Р. putida ATCC 33015, могут превращать определенные ароматические углеводороды в соответствующие ароматические карбоновые кислоты: как хуl оперон, который кодирует ферменты разложения ксилола, так и гены, которые отвечают за регулирование хуl гена, находятся в TOL-плазмиде pWWO. Гены, находящиеся в TOL-плазмиде pWWO, которые кодируют ферменты, требуемые для указанного выше окисления, должны быть индуцированы для получения таких ферментов. Поэтому описание такой индукции имеется в указанных выше патентах США 5104798; 5213973 и 5236832.
Как описано в статье Gaucher et al., в Dev. Ind. Microbiol., 22:219-232 (1981), грибки Penicillium griseofulvum содержат три фермента для превращения м-крезола в м-гидроксибензойную кислоту: м-крезол метилгидроксилазу, (м-гидроксибензиловый спирт)дегидрогеназу и м-гидроксибензальдегидгидроксилазу.
Повторяя сказанное, в существующем уровне техники известно, что определенные грибки и бактерии содержат ферменты для окисления метильных групп определенных ароматических колец до соответствующих карбоновых кислот. Хотя известно, что метильные группы гетероароматических колец могут быть окислены до соответствующих карбоновых кислот с использованием микроорганизмов, специалистам в данной области будет понятно, что выход химических и оптических продуктов окисления с помощью микроорганизмов обычно варьируется в существенной степени в зависимости, например, от определенного выбранного микроорганизма, концентрации субстрата, структуры субстрата и так далее.
В настоящее время обнаружено, что ряд микроорганизмов, включая грибки и бактерии, в существенной степени, окисляют 2-метилхиноксалин до 2-хиноксалинкарбоновой кислоты. Кроме того, данный способ позволяет удобным образом выделять 2-хиноксалинкарбоновую кислоту.
В заявке на патент США 60/073801 ("заявка 801") от 5 февраля 1998, в настоящее время являющейся заявкой РСТ PCT/IB99/00067 от 18 января 1999, описано использование 2-хиноксалинкарбоновой кислоты в качестве промежуточного соединения при синтезе новых дигидроксигексановых кислот, которые пригодны для лечения, например, воспаления и других иммунных расстройств. 2-Хиноксалинкарбоновая кислота, полученная по способу данного изобретения, может быть использована для синтеза таких дигидроксигексановых кислот.
Все документы, упомянутые в данном описании, включая указанные выше, упомянуты здесь для сведения в их полном объеме.
Описание изобретения
Данное изобретение относится к микробиологическому способу получения 2-хиноксалинкарбоновой кислоты из 2-метилхиноксалина.
Более конкретно данное изобретение относится к микробиологическим способам получения соединения формулы I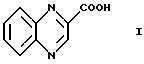
посредством приведения в контакт соединения формулы II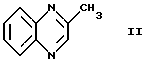
с микроорганизмом, способным осуществлять окисление метильной группы соединения формулы II до карбоксильной группы соединения формулы I, и инкубированием полученной смеси в подходящих условиях с получением некоторого количества соединения формулы I.
Соответственно в данном изобретении предлагаются способы проведения микробиологического окисления соединения формулы II, 2-метилхиноксалина, которые включают
взаимодействие соединения формулы II с микроорганизмом или его мутантом, который известен или может быть получен иным образом специалистами в соответствующей области техники и который способен, несмотря на мутацию, выполнять данное окисление ("его (микроорганизма) подходящий мутант"), и
инкубирование полученной смеси в условиях, достаточных для получения некоторого количества соединения формулы I, т.е. 2-хиноксалинкарбоновой кислоты,
где указанный микроорганизм выбирают из группы, включающей Absidia glauca ATCC 22752, Absidia glauca ATCC 74480, Absidia pseudocylindrospora ATCC 24169, Absidia repens ATCC 14849, Absidia repens ATCC 74481, Actinomucor elegans ATCC 6476, Alternaria solani ATCC 11078, Aspergillus tamarii ATCC 16865, Coniophora puteana ATCC 12675, Cunninghamella echinulata ATCC 8688a, Cunninghamella echinulata ATCC 8688b, Cunninghamella echinulata ATCC 8983, Cunninghaniella echinulata ATCC 9244, Cunninghamella echinulata ATCC 9245, Cunninghamella echinulata ATCC 10028b, Cunninghamella echinulata ATCC 26269, Cunninghamella echinulata ATCC 36190, Cunninghamella echinulata ATCC 36112, Cunninghamella homothallica ATCC 16161, Cylindrocarpon destructans ATCC 66963, Diplodia gossypina ATCC 20575, Epicoccum neglectum ATCC 12723, Glomerella lagenaria ATCC 14724, Penicillium claviforme ATCC 10426, Penicillium duclauxii ATCC 10440, Penicillium glabrum ATCC 11080, Pseudocochliobolus lunatus ATCC 24155, Pseudomonas putida ATCC 33015, Pseudomonas putida АТСС 202190, Rhodococcus rhodochrous ATCC 19067 и Thamnostylum piriforme ATCC 8686 и их подходящие мутанты, при условии, что если указанный микроорганизм представляет собой Pseudomonas putida ATCC 33015 или Pseudomonas putida ATCC 202190, то указанный Pseudomonas putida ATCC 33015 или указанный Pseudomonas putida ATCC 202190 должен быть индуцирован взаимодействием с индуктором до приведения указанных Pseudomonas putida ATCC 33015 или Pseudomonas putida ATCC 202190 в контакт с 2-метилхиноксалином.
Кроме того, рассматриваемые способы включают необязательно выделение желаемого продукта, 2-хиноксалинкарбоновой кислоты, любым подходящим способом. Например, реакционная смесь может быть экстрагирована органическим растворителем, предпочтительно этилацетатом, и затем экстрагированный материал может быть подвергнут хроматографии. Альтернативно 2-хиноксалинкарбоновая кислота может быть адсорбирована из реакционной смеси на смолу, предпочтительно полимерную адсорбирующую смолу, затем элюирована органическим растворителем, предпочтительно этилацетатом, и кристаллизована из элюата с использованием органического растворителя или комбинации органических растворителей, предпочтительно этилацетата и метанола. Далее 2-хиноксалинкарбоновая кислота, полученная по способу данного изобретения, может быть обработана подходящим основанием, например гидроксидом натрия, с образованием соли, например натриевой соли 2-хиноксалинкарбоновой кислоты. Щелочная соль 2-хиноксалинкарбоновой кислоты затем может быть выделена из биоконверсионной среды путем удаления клеток из среды фильтрованием или центрифугированием с последующей концентрацией среды, не содержащей клеток, например, выпариванием.
Рассматриваемый микроорганизм предпочтительно является интактным микроорганизмом.
В предпочтительном варианте данного изобретения микроорганизм является грибком.
В предпочтительном варианте данного изобретения, в котором микроорганизм является грибком, этот грибок выбирают из группы, включающей роды Absidia, Aspergillus, Alternaria, Penicillium, Diplodia и Cunninghamella.
В особенно предпочтительном варианте данного изобретения, в котором микроорганизм является грибком, грибок выбирают из рода Absidia. В наиболее предпочтительном варианте данного изобретения, в котором микроорганизм является грибком из рода Absidia, этот микроорганизм представляет собой A. glauca ATCC 22752 или A. glauca ATCC 74480, или их подходящий мутант, или, кроме того, любой депозит A. glauca ATCC 22752 или его подходящий мутант, полученный согласно условиям Будапештского Соглашения.
В другом наиболее предпочтительном варианте данного изобретения, в котором микроорганизм является грибком рода Absidia, указанный микроорганизм представляет собой A. repens ATCC 14849 или А. repens ATCC 74481, или их подходящий мутант, или, кроме того, любой депозит A. repens ATCC 14849 или его подходящий мутант, полученный согласно условиям Будапештского Соглашения.
Предпочтительная плотность клеток для грибковых культур данного изобретения составляет от около 10 до около 30 г сухой массы клеток на литр.
В другом предпочтительном варианте данного изобретения микроорганизм является бактерией.
В предпочтительном варианте данного изобретения, в котором микроорганизм является бактерией, указанную бактерию выбирают из группы, включающей роды Pseudomonas и Rhodococcus.
В особенно предпочтительном варианте данного изобретения, в котором микроорганизм является бактерией, эта бактерия является бактерией рода Pseudomonas.
В наиболее предпочтительном варианте данного изобретения, в котором микроорганизм является бактерией рода Pseudomonas, этот микроорганизм представляет собой Р. putida АТСС 33015 или Р. putida ATCC 202190, или его подходящий мутант, или, кроме того, любой депозит Р. putida АТСС 33015 или его подходящий мутант, полученный согласно условиям Будапештского Соглашения.
Предпочтительной плотностью клеток для бактериальных культур данного изобретения является такая плотность, которая дает оптическую плотность от около 10 до около 30 при 650 нм.
Как обсуждалось ранее, в вариантах данного изобретения, в которых микроорганизм является Р. putida АТСС 33015 или Р. putida АТСС 202190, или его подходящим мутантом, микроорганизм или его подходящий мутант индуцируют до или во время взаимодействия. Предпочтительно, чтобы контактирование происходило после завершения индукции микроорганизма. Предпочтительные индукторы включают п-ксилол и м-ксилол. Особенно предпочтительным индуктором является п-ксилол.
В предпочтительном варианте данного изобретения, в котором микроорганизм представляет собой Р. putida ATCC 33015 или Р. putida ATCC 202190 или их подходящий мутант, и микроорганизм культивируют в среде для выращивания в пробирке, индуктор добавляют к указанной среде для выращивания до приведения микроорганизма в контакт с 2-метилхиноксалином и инкубируют в указанной среде для выращивания в течение времени, достаточного для практического завершения указанной индукции. Клетки индуцированного микроорганизма собирают центрифугированием содержимого пробирки, удаляя, например декантируя, использованную среду для выращивания (и, тем самым, рассматриваемый индуктор), промыванием осадка клеток в пробирке после центрифугирования и повторным суспендированием осадка в пробирке в водной среде, такой как ЗФРД (Biowhittaker), перед приведением в контакт указанного 2-метилхиноксалина с указанным микроорганизмом.
В другом предпочтительном варианте настоящего изобретения, в котором микроорганизм представляет собой Р. putida ATCC 33015 или Р. putida ATCC 202190 или их подходящий мутант, и микроорганизм культивируют в среде для выращивания в ферментере, индуктор непрерывно или ежеминутно добавляют к указанной среде для выращивания до приведения в контакт микроорганизма с 2-метилхиноксалином, и инкубируют в указанной среде для выращивания в течение времени, необходимого для практически полного завершения индукции, а затем прекращают добавление перед приведением 2-метилхиноксалина в контакт с указанным микроорганизмом.
В еще одном предпочтительном варианте реализации настоящего изобретения рассматриваемое приведение в контакт осуществляют добавлением 2-метилхиноксалина в среду для выращивания, содержащую микроорганизм, где микроорганизм является грибком. В предпочтительном варианте данного изобретения, в котором приведение в контакт осуществляют добавлением 2-метилхиноксалина в среду для выращивания, содержащую указанный грибок, среда для выращивания представляет собой среду, содержащую кукурузный экстракт. Особенно предпочтительная среда, содержащая кукурузный экстракт, включает от около 20 до около 40 г/л кукурузного экстракта и около 20 г/л декстрозы, имея рН около 4,85. Другая предпочтительная среда для выращивания содержит около 20 г/л препарата Pharmamedia® (Traders Protein) и около 20 г/л декстрозы, имея рН около 7,2.
В еще одном предпочтительном варианте данного изобретения приведение в контакт осуществляют добавлением соединения формулы II, адсорбированного на смолу. См. , например, статью J.T. Vicenzi et al., "Large-scale stereoselective enzymatic ketone reduction with In situ product removal via polymeric adsorbent resins". Enzyme and Microbial Technology, 20:494-499 (1997).
И еще в одном предпочтительном варианте данного изобретения приведение в контакт осуществляют добавлением 2-метилхиноксалина в водную среду, содержащую промытые клетки микроорганизма.
В другом предпочтительном варианте данного изобретения микроорганизм промывают перед приведением микроорганизма в контакт с 2-метилхиноксалином. В предпочтительном варианте данного изобретения, в котором микроорганизм промывают перед приведением микроорганизма в контакт с 2-метилхиноксалином, промытый микроорганизм иммобилизуют перед приведением в контакт.
В еще одном предпочтительном варианте данного изобретения микроорганизм выращивают в среде, содержащей кукурузный экстракт, в течение от около 24 ч до около 72 часов перед приведением в контакт, которое осуществляют добавлением 2-метилхиноксалина к среде.
Способы данного изобретения, кроме того, необязательно включают выделение или отделение 2-хиноксалинкарбоновой кислоты, например, осуществляемое экстрагированием органическим растворителем, адсорбцией на смолу, кристаллизацией или, как описано ранее, при использовании щелочной соли 2-хиноксалинкарбоновой кислоты, концентрацией посредством выпаривания среды, не содержащей клеток, или подобными способами.
Данное изобретение также включает применение 2-хиноксалинкарбоновой кислоты в синтезе новых дигидроксигексановых кислот, описанном в указанной выше заявке 801 по любому из способов, описанных в заявке 801 или по любому другому подходящему способу.
Специалисту в данной области будут понятны термины, использованные для описания данного изобретения; тем не менее некоторые из используемых терминов описаны ниже.
Термин "интактный микроорганизм" означает, что клетки микроорганизма, по существу, находятся в состоянии своей врожденной (и/или индуцированной, в зависимости от обстоятельств) механической, физической и биохимической целостности.
Термин "микробиологическое окисление" означает процесс окисления согласно данному изобретению, выполняемый с помощью интактного микроорганизма или любого препарата на его основе и т.п.
Термин "микроорганизм" включает любой интактный микроорганизм или его подходящую композицию, включая, например, промытый микроорганизм, не содержащий, например, ферментационной среды, среды для выращивания, культурального бульона и т.п., в некоторых случаях, где микроорганизм иммобилизован, например, в колонке, присоединен к гранулам и т.п.
Подробное описание изобретения
Если не указано иначе, в данном описании и формуле изобретения используются следующие обозначения и сокращения:
oС - градус Цельсия;
% - процент;
АЦН - ацетонитрил;
ДМСО - диметилсульфоксид;
ЗФРД - забуференный фосфатом физиологический раствор по Дульбекко;
EtOAc - этилацетат;
EtOH - этанол;
г - грамм;
ВЭЖХ - высокоэффективная жидкостная хроматография (жидкостная хроматография высокого разрешения);
л - литр;
MeОН - метанол;
мг - миллиграмм;
мин - минута или минуты;
мм - миллиметр;
ммоль - миллимоль;
мл - миллилитр;
м-ксилол - мета-ксилол;
н. - нормальная (концентрация);
нМ - наномоль (концентрация);
ЗФР - забуференный фосфатом физиологический раствор;
п-ксилол - пара-ксилол;
об/мин - число оборотов в минуту;
ТФК - трифторуксусная кислота;
мкл - микролитр;
об/об - объем на объем;
American National Can® находится в Menasha, Wisconsin, USA;
Becton Dickinson® Labware находится в Franklin Lakes, New Jersey, USA;
Becton Dickinson® Microbiology Systems, Sparks, Maryland, USA;
Biowhittaker® находится в Walkersville, Maryland, USA;
Column Engineering®,, Inc. находится в Ontario, California, USA;
IEC® Centrifuge находится в Needham Heights, Massachusetts, USA;
Rohm and Haas® находится в Philadelphia, Pennsylvania, USA и
Traders Protein® находится в Memphis, Tennessee, USA.
ATCC обозначает American Type Culture Collection (Американская коллекция типовых культур), которая находится в 10801 University Boulevard, Manassas, Virginia, 20110-2209, USA. В таблице 1 перечислены микроорганизмы, описанные в данном изобретении и их депозитор(ы) (см. www.ATCC.com).
Как описано ранее, данное изобретение относится к микробиологическим способам получения соединения формулы I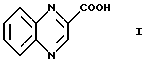
посредством приведения в контакт соединения формулы II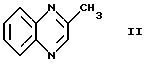
с микроорганизмом, способным к осуществлению окисления метильной группы соединения формулы II, 2-метилхиноксалина, до карбоксильной группы соединения формулы I, 2-хиноксалинкарбоновой кислоты, и инкубированием полученной смеси в подходящих условиях с получением 2-хиноксалинкарбоновой кислоты.
Способы данного изобретения легко осуществляются. Микроорганизм культивируют, при необходимости индуцируя его, например, если микроорганизм представляет собой Р. putida АТСС 33015 или Р. putida ATCC 202190, или его подходящий мутант, и затем приводят в контакт с 2-метилхиноксалином, чтобы окислить метильную группу 2-метилхиноксалина до -СООН-группы 2-хиноксалинкарбоновой кислоты. 2-Хиноксалинкарбоновая кислота затем может быть подвергнута, например, дальнейшей обработке по методикам, описанным в упомянутой выше "заявке 801", с получением в итоге новых дигидроксигексановых кислот, описанных в "заявке 801", которые используют при лечении воспаления и других иммунных расстройств. Активность, способы оценки активности, дозировки, дозированные формы, способы введения и другая информация, касающаяся новых дигидроксигексановых кислот, раскрытых в "заявке 801", представлена в этой заявке ("заявке 801").
Как описано выше, в способах данного изобретения могут быть использованы любые подходящие микроорганизмы или их подходящие мутанты. Исходя из данного описания, специалисту в данной области техники будет понятно, что условия данных способов могут быть выбраны в зависимости, например, от вида микроорганизма и его конкретного препарата. Например, рН, температура, концентрация компонентов и так далее, например, ферментационной среды и органического растворителя, а также концентрации 2-метилхиноксалина и индуктора (при его использовании) выбирают таким образом, чтобы обеспечить конкретный желаемый результат при использовании выбранного микроорганизма.
Предпочтительные грибки включают представителей родов Absidia, Actlnomucor, Alternaria, Aspergillus, Coniophora, Cunninghamella, Cylindrocarpon, Diplodia, Epicoccum, Fusarium, Glomerella, Penicillium, Pseudocochilobolus, Thamnostylum и Verticillum, причем их виды не ограничены, при условии, что микроорганизмы или их мутанты, способны осуществлять данное окисление.
Особенно предпочтительными грибками являются грибки родов Absidiar Alternaria, Aspergillus, Cunninghamella, Diplodia и Penicillium.
Наиболее предпочтительны грибки, принадлежащие к роду Absidia.
Более конкретно предпочтительные грибки включают А. glauca АТСС 22752, A. glauca ATCC 74480, А. pseudocylindrospora АТСС 24169, A. repens АТСС 14849, А. repens АТСС 74481, A. elegans АТСС 6476, A. solani АТСС 11078, A. tamarii АТСС 16865, С. puteana АТСС 12675, С. echinulata АТСС 8688а, С. echinulata АТСС 8688b, С. echinulata АТСС 8983, С. echinulata АТСС 9244, С. echinulata АТСС 9245, С. echinulata АТСС 10028b, С. echinulata АТСС 26269, С. echinulata АТСС 36190, С. echinulata АТСС 36112, С. homothallica АТСС 16161, С. destructans АТСС 66963, D. gossypina АТСС 20575, Е. neglectum АТСС 12723, G. lagenaria АТСС 14724, Р. clavlforme АТСС 10426, P. duclauxii АТСС 10440, Р. glabrum АТСС 11080, P. lunatus АТСС 24155 и Т. piriforme АТСС 8686 и их подходящие мутанты.
Более предпочтительные грибки включают A. glauca АТСС 22752, A. glauca АТСС 74480, A. repens АТСС 14849, А. repens АТСС 74481, А. solani АТСС 11078, A. tamarii АТСС 16865, С. echinulata АТСС 8983, D. gossypina ATCC 20575 и Р. glabrum ATCC 11080 и их подходящие мутанты.
Особенно предпочтительные грибки включают A. glauca ATCC 22752, А. glauca АТСС 74480, A. repens ATCC 14849 и А. repens ATCC 74481 и их подходящие мутанты.
Наиболее предпочтительные грибки включают A. repens ATCC 14849 и A. repens ATCC 74481 и их подходящие мутанты.
Предпочтительные бактерии включают бактерии, принадлежащие к родам Bacillus, Brevibacterium, Micrососсus, Pseudomonas и Rhodococcus, причем их виды не ограничены, при условии, что микроорганизмы или их мутанты способны осуществлять данное окисление.
Особенно предпочтительные бактерии включают бактерии, принадлежащие к родам Pseudomonas и Rhodococcus.
Наиболее предпочтительные бактерии включают бактерии рода Pseudomonas.
Более конкретно предпочтительные бактерии включают Р. putida АТСС 33015, Р. putida АТСС 202190 и R. rhodochrous АТСС 19067 и их подходящие мутанты.
Особенно предпочтительными бактериями являются Р. putida АТСС 33015 и Р. putida АТСС 202190 и их подходящие мутанты.
Как описано ранее, данное изобретение включает применение любых подходящих мутантов любых подходящих микроорганизмов. Кроме того, группы мутантов с более желательными свойствами, например способные окислять большее количество субстрата по сравнению с родительским штаммом, также могут быть использованы в данных способах, и эти новые штаммы могут быть получены по известным методикам, включая, например, стандартный мутагенез и методики селекции, и рекомбинантные методики, включая, например, сайт-направленный мутагенез.
Стандартные методики мутагенеза включают химический мутагенез с использованием N-метил-N'-нитрозогуанидина (Delic et al. (1970), Mutat. Res., 9: 167), азотистой кислоты (Crueger and Crueger (1984), Biotechnology: A Textbook of Industrial Microbiology, p.16, Sinauer Associates, Inc., Sunderland, MA, USA) и облучение ультрафиолетовыми лучами (Thrum (1984), in Biotechnology of Industrial Antibiotics (Vandamne, ed.), Marcel Dekker, New York, pp.373-374).
Методики селекции включают простую реизоляцию штамма с помощью селекции отделенной колонии, селекции колоний с определенной морфологией и селекции колоний с устойчивостью к аналогам компонентов, присутствующих или предположительно присутствующих в пути биосинтетического метаболизма соединения формулы I (Crueger and Crueger (1984), Biotechnology: A Textbook of Industrial Microbiology, p.24-25, Sinauer Associates, Inc., Sunderland, MA, USA).
Эти новые штаммы используют в способах данного изобретения, поскольку они, например, имеют улучшенные свойства по сравнению с соответствующими родительскими штаммами, например они дают большее количество 2-хиноксалинкарбоновой кислоты, демонстрируют меньшее нежелательное врожденное разрушающее действие на 2-метилхиноксалин и/или 2-хиноксалинкарбоновую кислоту, и/или промежуточные соединения, которые могут быть получены в способе данного изобретения в зависимости, например, от определенного выбранного организма. Кроме того, если мутант используют благодаря его способности давать больше 2-хиноксалинкарбоновой кислоты, для получения материала, необходимого для выработки требуемого количества 2-хиноксалинкарбоновой кислоты по способу данного изобретения, необходимо выращивать меньшее количество культуры, что дает существенную экономию средств.
Как описано ранее, в способе данного изобретения может быть использована любая подходящая композиция микроорганизма, такая как, например, микроорганизм в среде для выращивания, промытый микроорганизм, не содержащий, например, ферментационной среды, культурального бульона и так далее, или иммобилизованный микроорганизм, например, в колонке, присоединенный к гранулам, и так далее.
Из данного описания специалисту в данной области будет понятна методика получения подходящего иммобилизованного интактного микроорганизма, такого как описан, например, у А. Bauer et al., в статье "Polyvinyl alcohol-immobilized whole-cell preparations for biotransformation of nitriles", опубликованной в Biotechnology Letters, 18(3):343-348 (1996).
Предпочтительные интактные микроорганизмы включают такие, которые, по существу, окисляют 2-метилхиноксалин до продукта, конкретно 2-хиноксалинкарбоновой кислоты, при этом оставляя продукт, по существу, неизменным, то есть свободным от врожденной активности, которая может разрушать или иным образом негативно воздействовать на желаемый продукт на любой стадии данных способов.
Микроорганизмы, подходящие для применения в микробиологическом окислении согласно данному изобретению, могут быть получены любым подходящим способом, известным специалисту в данной области. Пример подходящего способа получения микроорганизма из коммерчески доступного исходного образца представлен ниже. Основываясь на данном описании, содержащем приведенные ниже способы, специалисту в данной области будут понятны методы модификации любой части данных способов, например способа получения микроорганизма, свободного или иммобилизованного; способа приведения в контакт 2-хиноксалинкарбоновой кислоты с микроорганизмом; компонентов и условий среды для выращивания, например температуры, рН, и так далее; соответствующих концентраций 2-метилхиноксалина, индуктора (при его использовании) или условий инкубирования для достижения желаемого результата с использованием любого подходящего микроорганизма.
В вариантах данного изобретения, в которых микроорганизм является грибком, предпочтительная концентрация 2-метилхиноксалина составляет от около 0,01 до около 2,5 г/л, особенно предпочтительная концентрация составляет от около 0,1 до около 2,0 г/л. В вариантах данного изобретения, в которых микроорганизм является грибком, выбранным из группы, включающей A. repens ATCC 14849, А. repens ATCC 74481, A. glauca ATCC 22752, A. glauca ATCC 74480 и их подходящие мутанты, предпочтительная концентрация 2-метилхиноксалина составляет от около 0,1 до около 2,0 г/л.
В вариантах данного изобретения, в которых микроорганизм является бактерией, предпочтительная концентрация 2-метилхиноксалина составляет от около 0,01 до около 1,5 г/л и особенно предпочтительная концентрация составляет от около 0,1 до около 1,0 г/л. В вариантах данного изобретения, в которых бактерию выбирают из группы, включающей Р. putida ATCC 33015, Р. putida ATCC 202190 и их подходящие мутанты, предпочтительная концентрация 2-метилхиноксалина составляет от около 0,1 до около 1,0 г/л.
Кроме того, как описано ранее, бактерии, несущие TOL плазмид, например Р. putida АТСС 33015 или Р. putida ATCC 202190, необходимый для рассматриваемого окисления, должны быть индуцированы. В вариантах данного изобретения, в которых Р. putida АТСС 33015 или Р. putida АТСС 202190 культивируют в среде в ферментере, индуктор, предпочтительно п-ксилол, добавляют с предпочтительной скоростью добавления от около 4,5 ммоль/л•час до около 6,5 ммоль/л•час и с особенно предпочтительной скоростью от около 4,9 ммоль/л•час до около 6,1 ммоль/л•час.
В вариантах данного изобретения, в которых Р. putida АТСС 33015 или Р. putida АТСС 202190 находятся в среде в колбе, индуктор, предпочтительно п-ксилол, добавляют к среде непрерывно в газообразном виде. Как будет понятно специалисту в данной области из данного описания и из указанных выше статей и патентов (например, патента США 5236832), концентрацию индуктора обычно выбирают такую, чтобы она была меньше минимальной ингибирующей концентрации ферментов, ответственных за окисление. См. также Claus and Walker, J. Gen. Microbiol., 36:107-122 (1964).
В данном изобретении может быть использован любой подходящий способ приведения в контакт субстрата, 2-метилхиноксалина, с микроорганизмом. Субстрат может контактировать с микроорганизмом в любом подходящем порядке. Например, 2-метилхиноксалин может быть добавлен в среду, такую как культуральный бульон, содержащую микроорганизм, свободный или иммобилизованный, или некоторые его комбинации, или среда может содержать 2-метилхиноксалин, и микроорганизм может быть затем добавлен в такую среду, или 2-метилхиноксалин и микроорганизм могут быть добавлены вместе в такую среду, или либо 2-метилхиноксалин, либо микроорганизм могут быть добавлены в подходящий растворитель, содержащий другой реагент, или 2-метилхиноксалин может быть адсорбирован на смолу и так далее. Из данного описания специалисту в данной области будет понятно, как можно, при желании, модифицировать любую часть данных способов желаемым образом.
Как описано ранее, в данном изобретении предпочтительно, чтобы микроорганизм являлся A. glauca ATCC 22752. Как указано ранее, лиофилизированный образец A. glauca ATCC 22752 был депонирован в ATCC по условиям Будапештского Договора от 13 января 1999. Эта вновь депонированная культура получила новый депозитный номер ATCC 74480. Следовательно, для данного изобретения также предпочтительно, чтобы микроорганизм представлял собой A. glauca ATCC 74480. Все ограничения доступа широкой общественности к депонированной таким образом культуре микроорганизма будут окончательно сняты после опубликования патента по данной заявке.
Также, как описано ранее, в данном изобретении особенно предпочтительно, чтобы микроорганизм представлял собой А. repens ATCC 14849. Лиофилизированный образец A. repens ATCC 14849 был депонирован в ATCC по условиям Будапештского Договора от 13 января 1999. Эта вновь депонированная культура получила новый депозитный номер АТСС 74481. Следовательно, для данного изобретения также предпочтительно, чтобы микроорганизм представлял собой A. repens АТСС 174481. Все ограничения доступа широкой общественности к депонированной таким образом культуре микроорганизма будут окончательно сняты после опубликования патента по данной заявке.
Культуры грибков A. repens АТСС 14849 (или A. repens АТСС 74481, A. glauca АТСС 22752 или A. glauca АТСС 74480) могут быть получены из АТСС, и пример подходящего способа получения из таких доступных штаммов представлен ниже. Исходные культуры могут быть получены из рисовых культур, например, следующим образом: колбы Эрленмейера (250 мл), содержащие около 50 г коричневого риса и около 20 мл дистиллированной воды, помещают в автоклав при температуре около 121oС приблизительно на 30 мин, суспензию вегетативных клеток или спор A. repens АТСС 14849 (или A. repens АТСС 74481, A. glauca АТСС 22752 или A. glauca АТСС 74480) получают добавлением либо аликвоты жидкой культуры, либо мазка выращенной на агаровой среде культуры на скошенном агаре к стерильной дистиллированной воде. Каждую колбу с рисом засевают 5 мл суспензии спор или клеток и инкубируют в течение примерно 10 дней при температуре около 28oС, после чего исходный раствор со спорами получают, промывая рисовую культуру 0,5% раствором Tween 80 в дистиллированной воде, сливая суспензию спор с риса и добавляя от около 10% до около 20% глицерина. Исходный раствор со спорами хранят при температуре около -70oС.
Как будет понятно специалисту в данной области, для любых выбранных грибков и, как специально описано в примерах для предпочтительных A. glauca АТСС 22752 или АТСС 74480 и особенно предпочтительных A. repens АТСС 14849 или АТСС 74481, подходящим способом получения выбранного грибка является следующий способ: грибок высевают из замороженной исходной культуры вегетативных клеток или спор, такой как описана выше, в колбу или стеклянную пробирку с металлической крышкой, содержащую среду для выращивания (содержащую аликвоту стерильного раствора, который включает Tween 80, глицерин и дистиллированную воду), состав которой более подробно описан ниже. Ферментацию проводят при температурах в интервале от около 22 до около 32oС, предпочтительно при температуре около 29oС, при подходящем взбалтывании со скоростью предпочтительно от около 200 до около 220 об/мин и более предпочтительно при около 210 об/мин. При желании рН среды для выращивания может поддерживаться посредством использования подходящих буферов, введенных в ферментационную среду и/или по мере необходимости периодически доводиться до нужного уровня с помощью добавления либо основания, либо кислоты. Предпочтительный диапазон рН составляет от рН около 6 до рН около 7.
В данном изобретении может быть использована любая подходящая продолжительность выращивания микроорганизма (грибка или бактерии), приведения в контакт микроорганизма с 2-метилхиноксалином и инкубирования 2-метилхиноксалина с микроорганизмом. Подходящий рост микроорганизма может быть достигнут, например, в течение 24 часов, после чего к культуре может быть добавлен либо (а) 2-метилхиноксалин в чистом виде, либо (b) подходящая аликвота раствора 2-метилхиноксалина в подходящем, т.е. не влияющем нежелательно на рост или функцию микроорганизма, растворителе, предпочтительно EtOH, или (с) 2-метилхиноксалин, адсорбированный на смолу. Инкубация может затем проводиться в течение, например, от около 2 до около 24 дней, в зависимости, например, от сосуда, в котором происходит биоконверсия, среды и условий инкубирования, например температуры, рН и условий перемешивания. Инкубационный бульон затем может быть экстрагирован с использованием любой подходящей методики экстрагирования, например (а) методики, в которой подходящий растворитель, такой как, например, EtOAc, метилизобутилкетон, метилэтилкетон, дихлорметан и т.п. , предпочтительно EtOAc, удаляет органические компоненты из инкубационного бульона, или (b) адсорбции продукта, 2-хиноксалинкарбоновой кислоты, на подходящую смолу, предпочтительно полимерную адсорбирующую смолу, предпочтительно смолу, выбранную из числа смол Amberlite® (Rohm and Haas), наиболее предпочтительно XAD4 (из числа смол Amberlite). После экстрагирования инкубационного бульона подходящим органическим растворителем и разделения органической и водной фаз соединения, составляющие органический остаток, могут быть определены с использованием любой подходящей методики, например хроматографии. Альтернативно после экстрагирования 2-хиноксалинкарбоновой кислоты из инкубационного бульона с помощью смолы 2-хиноксалинкарбоновая кислота может быть элюирована из нее с помощью подходящего растворителя, предпочтительно EtOAc или МеОН, и затем кристаллизована, например, из EtOAc с помощью, например, EtOAc и МеОН.
В способе данного изобретения может быть использована любая подходящая среда для выращивания, и подходящая среда для выращивания содержит источник или источники усвояемого углерода, усвояемого азота и неорганических солей, содержащих необходимые минералы. Обычно многие углеводы, такие как, например, глюкоза, мальтоза, манноза, сахароза, крахмал, глицерин, просяное желе, патока, соя и так далее, могут быть использованы в качестве источников усвояемого углерода. Источники усвояемого азота включают, например, такие материалы, как гидролизаты дрожжей и казеина, первичные дрожжи, дрожжевые экстракты, хлопковая мука, сухой соевый остаток, проростки пшеницы, экстракты мяса, пептон, кукурузный экстракт, сухой кукурузный остаток и соли аммиака. Подходящие неорганические соли, которые являются питательными веществами для использования в среде для выращивания культуры данного изобретения, включают, например, обычные соли, содержащие натрий, железо, магний, калий, кобальт, фосфат и так далее.
Более конкретно компоненты среды для выращивания, подходящей для использования в данном изобретении, когда микроорганизм является грибком, включают, например, кукурузный экстракт, сухой кукурузный остаток, Pharmamedia® и солодовый экстракт. Среда на основе кукурузного экстракта содержит 40 г/л кукурузного экстракта и около 20 г/л декстрозы, и ее рН доводят до 4,85 перед стерилизацией. Среда на основе сухого кукурузного остатка содержит от около 20 до около 40 г/л сухого кукурузного остатка и около 20 г/л декстрозы, и ее рН доводят до 4,85 перед стерилизацией. Другая подходящая среда для использования в способах данного изобретения содержит около 20 г/л Pharmamedia® и около 20 г/л декстрозы, и ее рН доводят до 7,2 перед стерилизацией. Среда на основе солодового экстракта содержит около 10 г/л солодового экстракта, около 10 г/л декстрозы, около 5 г/л пептона и около 2 г/л дрожжевого экстракта, и ее рН доводят до 7 перед стерилизацией. Другая подходящая среда для использования в способах данного изобретения содержит около 20 г/л декстрозы, около 5 г/л питательной соевой муки, около 5 г/л дрожжевого экстракта, около 5 г/л NaCl и около 5 г/л К2НРO4, ее рН доводят до 7,0 с помощью H2SO4 перед стерилизацией. Особенно предпочтительная среда для выращивания грибков, подходящая для данного способа, представляет собой вышеупомянутую среду на основе сухого кукурузного остатка.
Как описано ранее, в данном изобретении особенно предпочтительно, чтобы микроорганизм являлся Р. putida ATCC 33015. Лиофилизированный образец Р. putida ATCC 33015 был депонирован в ATCC по условиям Будапештского Договора от 13 января 1999. Эта вновь депонированная культура получила новый депозитный номер ATCC 202190. Следовательно, для данного изобретения также предпочтительно, чтобы микроорганизм представлял P. putida ATCC 202190. Все ограничения доступа широкой общественности к депонированной таким образом культуре микроорганизма будут окончательно сняты после опубликования патента по данной заявке.
Кроме того, среда для выращивания, подходящая для использования в данном изобретении, когда микроорганизм является бактерией, включает любые подходящие известные среды, например Nutrient Broth (около 32 г/л, Becton Dickinson Microbiology Systems) и глицерин (около 5 г/л). Как будет понятно специалисту в данной области, для любой выбранной бактерии, как конкретно описано в примерах для Р. putida ATCC 33015, подходящим способом получения выбранной бактерии является следующий: бактерию высевают из замороженной исходной культуры, полученной по известным в данной области техники методикам (примерно 17% глицериновый исходный раствор), в колбу или стеклянную пробирку с металлической крышкой или ферментер, содержащие среду для выращивания (содержащую аликвоту стерильного раствора, который включает Tween 80, глицерин и дистиллированную воду), состав которой описан ниже. Ферментацию проводят при температурах в интервале от около 20 до около 40oС, предпочтительно при температурах от около 25 до около 32oС, при подходящем взбалтывании, со скоростью предпочтительно от около 200 до около 220 об/мин и наиболее предпочтительно около 210 об/мин. При желании рН среды для выращивания может поддерживаться посредством использования подходящих буферов, введенных в ферментационную среду и/или
по мере необходимости периодически доводиться до нужного уровня с помощью добавления либо основания, либо кислоты. Предпочтительно инокулят составляет от около 1 до около 20% об/об (инокулят/среда). Предпочтительный интервал рН составляет от рН около 6 до рН около 8.
Необходимо отметить, что ссылки на конкретные буферы, среды, реагенты, условия приведения в контакт или культивирования, количество субстрата, количество индуктора, если он используется, и так далее, в любой части данного описания не рассматриваются как ограничивающие и включают все такие родственные материалы, которые очевидны специалисту в данной области и которые могут представлять интерес или ценность в конкретном контексте данного описания. Например, часто можно заменить одну буферную систему или культуральную среду на другую, так чтобы использовать различные, но известные способы достижения тех же целей, на достижение которых направлено использование предлагаемых способа, материала и композиции. Более того, должно быть понятно, что данное изобретение включает применение данного способа в промышленных масштабах.
Рассматриваемое микробиологическое окисление дополнительно включает, необязательно, выделение желаемого продукта, 2-хиноксалинкарбоновой кислоты. 2-Хиноксалинкарбоновая кислота может быть выделена, как описано ниже, из среды, в которой проводится новый процесс микробиологического окисления и, более конкретно, из любых промежуточных соединений, которые могут быть получены, но не превращены полностью в 2-хиноксалинкарбоновую кислоту, в зависимости, например, от выбранного микроорганизма и условий инкубирования.
В данном изобретении могут быть использованы любые подходящие способы выделения и/или очистки любых промежуточных соединений или желаемого продукта рассматриваемого способа, включая фильтрование, экстрагирование, кристаллизацию, хроматографию на колонке, тонкослойную хроматографию, препаративную жидкостную хроматографию низкого давления, ВЭЖХ, адсорбцию на смолу или любую подходящую комбинацию таких способов.
Подробные примеры, представленные ниже, демонстрируют, что ряд микроорганизмов, особенно грибки и бактерии, окисляют 2-метилхиноксалин до 2-хиноксалинкарбоновой кислоты, которая затем может быть отделена от нежелательного непрореагировавшего 2-метилхиноксалина или любых промежуточных соединений и затем подвергнута взаимодействию по хорошо известным в данной области техники методикам с получением, например, соединений, описанных в "заявке 801".
Хотя данное описание в первую очередь относится к использованию в рассматриваемых способах интактных микроорганизмов, специалисту в данной области будет понятно, что рассматриваемые микробиологические процессы могут быть выполнены с подходящими препаратами рассматриваемых микроорганизмов, например препаратами разрушенных и дегидратированных клеток, экстрагированными материалами, содержащими микробиологические ферменты, способные осуществлять данное окисление, или с самими ферментами вместе с любыми необходимыми кофакторами, и так далее. Данное изобретение иллюстрируется следующими примерами. Подразумевается, что различные варианты в предшествующем и последующем описании данного изобретения не ограничивают область данного изобретения, а только иллюстрируют его. Следовательно, должно быть понятно, что данное изобретение не ограничено конкретными деталями этих примеров.
ПРИМЕР 1.
ОКИСЛЕНИЕ 2-МЕТИЛХИНОКСАЛИНА В ПРОБИРКЕ С КУЛЬТУРОЙ С ПРИМЕНЕНИЕМ A. repens ATCC 14849
А. Биоконверсия с использованием грибка A. repens ATCC 14849.
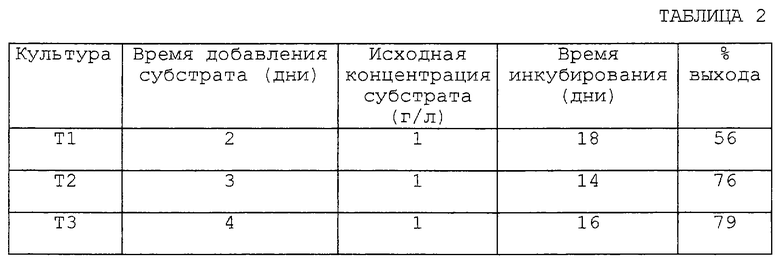
Три испытуемых культуры (T1, T2 и Т3) получают следующим образом. 2,5 мл стерильной среды для выращивания (около 20 г/л декстрозы, около 5 г/л питательной соевой муки, около 5 г/л дрожжевого экстракта, около 5 г/л NaCl и около 5 г/л К2НРO4, с рН, доведенным до около 7,0 с помощью H2SO4 перед стерилизацией) добавляют в каждую из трех 16 x 125 мм стеклянных пробирок, каждая из которых имеет металлическую крышку (T1, T2 и Т3), с последующим добавлением спор (около 1% об/об исходной культуры спор) A. repens ATCC 14849 в T1, T2 и Т3.
Три пробирки с культурой инкубируют при температуре около 29oС, взбалтывая со скоростью 210 об/мин. Через 48 часов (T1), 72 часа (T2) или 96 часов (Т3) в пробирки с культурой добавляют 0,05 мл исходного раствора (50 мг/мл в 100% EtOH, конечная концентрация около 1 мг/мл) 2-метилхиноксалина.
После дальнейшей инкубации при температуре около 29oС (см. таблицу 2) ферментационный бульон, содержащийся в пробирках с культурой, доводят до рН 2 с помощью 4 н. НСl. Содержимое каждой пробирки экстрагируют равными объемами EtOAc (чистый), добавляют EtOAc, пробирку с культурой встряхивают и затем центрифугируют со скоростью 2000 об/мин (IEC Centrifuge). Слой EtOAc удаляют и водный слой экстрагируют во второй раз. Объединенные органические экстракты сушат в атмосфере азота на водяной бане при температуре 50oС.
В. Выход 2-хиноксалинкарбоновой кислоты по данным ВЭЖХ с обращенной фазой.
Каждый экстракт, полученный как описано выше, повторно суспендируют в приблизительно 1 мл смеси АЦН:вода (1:9 об/об) и 20 мл каждого повторно суспендированного экстракта анализируют, впрыскивая в колонку для ВЭЖХ (колонка для ВЭЖХ Inertsil® C8 C8, 4,6 x 250 мм, Column Engineering, Inc.). Соединения, содержащиеся в каждом впрыснутом ресуспендированном экстракте, отделяют изократно со скоростью около 1,0 мл в минуту в подвижной фазе (АЦН: 0,05% водная ТФК, 1: 4, об/об). При таких условиях 2-хиноксалинкарбоновая кислота элюируется примерно через 8,6 мин, а 2-метилхиноксалин элюируется примерно через 15 мин. Выход 2-хиноксалинкарбоновой кислоты определяют по данным анализа ВЭЖХ для нескольких наборов экспериментальных условий (т.е. T1, T2 и Т3), результаты представлены в таблице 2.
Как видно из данных для T1, Т 2 и ТЗ, представленных в таблице 2, анализ с помощью ВЭЖХ показал, что данный микробиологический способ дает выход желаемой 2-хиноксалинкарбоновой кислоты 56, 76 и 79% соответственно.
Следовательно, введение интактного микроорганизма, например A. repens ATCC 14949 приводит к окислению 2-метилхиноксалина до 2-хиноксалинкарбоновой кислоты, и значительное количество 2-хиноксалинкарбоновой кислоты остается незатронутым.
ПРИМЕР 2.
ОКИСЛЕНИЕ 2-МЕТИЛХИНОКСАЛИНА В ПРОБИРКЕ С КУЛЬТУРОЙ С ПРИМЕНЕНИЕМ А. repens ATCC 14849 В ЧЕТЫРЕХ РАЗЛИЧНЫХ СРЕДАХ ДЛЯ ВЫРАЩИВАНИЯ
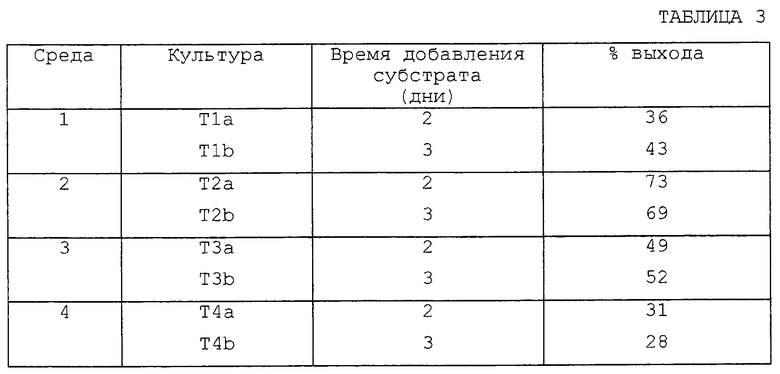
А. Получение четырех различных сред для выращивания.
Среду 1 готовят с 40 г/л кукурузного экстракта и 20 г/л декстрозы и доводят рН до 4,85 перед стерилизацией.
Среду 2 готовят с 40 г/л сухого кукурузного остатка и 20 г/л декстрозы и доводят рН до 4,85 перед стерилизацией.
Среду 3 готовят с 20 г/л Pharmamedia® и 20 г/л декстрозы и доводят рН до 7,2 перед стерилизацией.
Среду 4 готовят с 10 г/л солодового экстракта, 10 г/л декстрозы, 5 г/л пептона и 2 г/л дрожжевого экстракта и доводят рН до 7 перед стерилизацией.
В. Биоконверсия с использованием грибка A. repens ATCC 14849.
Восемь испытуемых культур (T1a, T1b, Т2а, Т2b, Т3а, Т3b, Т4а и Т4b) получают следующим образом. 2,5 мл стерильной среды для выращивания (Среда 1, Среда 2, Среда 3 и Среда 4 соответственно) добавляют в каждую из восьми 16 x 125 мм стеклянных пробирок, каждая из которых имеет металлическую крышку (T1a, T1b, Т2а, Т2b, Т3а, Т3b, Т4а и Т4b), с последующим добавлением спор (1% об/об исходной культуры спор) A. repens ATCC 14849 в каждую пробирку с культурой.
Восемь пробирок с культурой инкубируют при температуре около 29oС, взбалтывая со скоростью 210 об/мин. Через либо 48 часов (T1a, Т2а, Т3а и Т4а), либо 72 часа (T1b, T2b, Т3b и Т4b) в пробирки с культурой добавляют около 0,05 мл исходного раствора (около 50 мг/мл в ДМСО, конечная концентрация около 1 мг/мл) 2-метилхиноксалина.
После дальнейшей инкубации при температуре около 29oС в течение 12 дней ферментационный бульон, содержащийся в пробирках с культурой, экстрагируют и объединенные органические экстракты сушат, как описано в примере 1.
С. Выход 2-хиноксалинкарбоновой кислоты по данным ВЭЖХ с обращенной фазой.
Каждый экстракт, полученный, как описано выше, затем обрабатывают и анализируют с помощью ВЭЖХ с обращенной фазой, как описано в примере 1. Выход 2-хиноксалинкарбоновой кислоты определяют по данным анализа ВЭЖХ для нескольких наборов экспериментальных условий (т.е. T1a, T1b, Т2а, Т2b, Т3а, Т3b, Т4а и Т4b), результаты представлены в таблице 3.
Как видно из данных, представленных в таблице 3, анализ с помощью ВЭЖХ показал, что рассматриваемый микробиологический способ, в котором микроорганизм представляет собой A. repens ATCC 14849, дает выход 2-хиноксалинкарбоновой кислоты во всех тестируемых средах. Данные, представленные в таблице 3, также показывают, что из четырех тестируемых сред среда 2 дает наиболее высокий % выхода желаемого продукта, 2-хиноксалинкарбоновой кислоты.
ПРИМЕР 3.
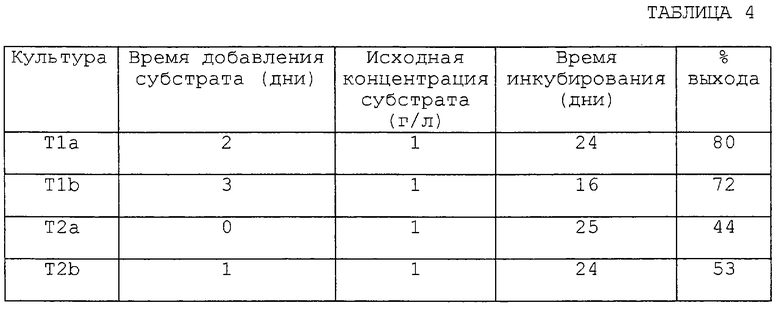
ОКИСЛЕНИЕ 2-МЕТИЛХИНОКСАЛИНА В КОЛБЕ С КУЛЬТУРОЙ С ПРИМЕНЕНИЕМ А. repens ATCC 14849 ИЛИ A. glauca ATCC 22752 А. Биоконверсия с использованием грибка A. repens ATCC 14849 или грибка A. glauca ATCC 22752.
Четыре испытуемые культуры (T1a, T1b, T2a и Т2b) получают следующим образом. 25 мл стерильной среды для выращивания (20 г/л декстрозы, 5 г/л питательной соевой муки, 5 г/л дрожжевого экстракта, 5 г/л NaCl и 5 г/л К2НРO4, с рН, доведенным до около 7,0 с помощью H2SO4 перед стерилизацией) добавляют в каждую из четырех конических колб (300 мл) с последующим добавлением спор (1% об/об исходной культуры спор) либо A. repens ATCC 14849 (T1a, T1b), либо A. glauca ATCC 22752 (T2a, T2b).
Четыре колбы с культурами инкубируют при температуре около 29oС, взбалтывая со скоростью 210 об/мин. Немедленно после засевания (T2a) или через 24 часа (T2b) в колбы с культурой A. glauca ATCC 22752 добавляют около 0,5 мл исходного раствора (50 мг/мл в 100% EtOH, конечная концентрация около 1 мг/мл) 2-метилхиноксалина, а через 48 часов (T1a) или 72 часа (T1b) в колбы с культурой A. repens ATCC 14849 добавляют около 0,5 мл исходного раствора (50 мг/мл в 100% EtOH, конечная концентрация около 1 мг/мл) 2-метилхиноксалина.
После дальнейшей инкубации при температуре около 29oС в течение 24 (T1a), 16 (T1b), 25 (T2a) или 24 (T2b) дней ферментационный бульон, содержащийся в колбах с культурой, доводят до рН 2 с помощью 4 н. НСl. Содержимое каждой пробирки экстрагируют двумя аликвотами EtOAc по 25 мл и растворитель удаляют из объединенных экстрактов EtOAc при пониженном давлении с получением неочищенных продуктов.
В. Выход 2-хиноксалинкарбоновой кислоты по данным ВЭЖХ с обращенной фазой.
Каждый экстракт, полученный, как описано выше, повторно суспендируют в приблизительно 5 мл МеОН:АЦН (3:2 об/об) и разбавляют в отношении 1:19 водой для проведения анализа с помощью ВЭЖХ. Анализ с помощью ВЭЖХ проводят, как описано в примере 1. Выход 2-хиноксалинкарбоновой кислоты определяют по данным анализа ВЭЖХ для нескольких наборов экспериментальных условий (т.е. T1a, T1b, T2a и Т2b), результаты представлены в таблице 4.
Как видно из данных, представленных в таблице 4, введение интактного микроорганизма, например A. glauca ATCC 22752 или A. repens ATCC 14849 приводит к окислению 2-метилхиноксалина до 2-хиноксалинкарбоновой кислоты. Процент исходного материала, т.е. 2-метилхиноксалина, который остается в T1a, T1b, T2a и T2b, составляет 7, 7, 6 и 6% соответственно.
ПРИМЕР 4.
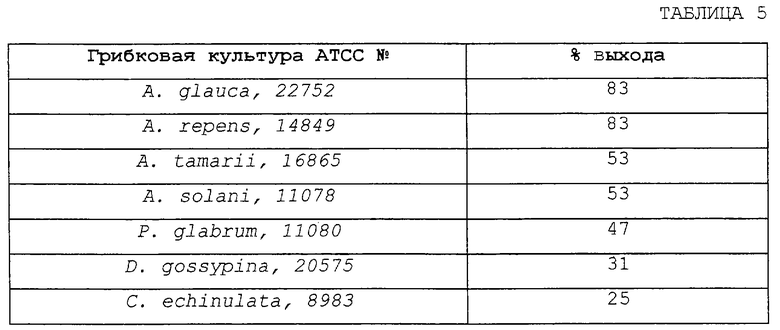
СКРИНИНГ МИКРОБИОЛОГИЧЕСКОГО ПРЕВРАЩЕНИЯ 2-МЕТИЛХИНОКСАЛИНА В 2-ХИНОКСАЛИНКАРБОНОВУЮ КИСЛОТУ
Клетки различных микроорганизмов выращивают в пробирках, содержащих 2,5 мл среды на основе декстрозы и питательной соевой муки, описанной в примере 1. Каждую пробирку засевают спорами вегетативных клеток (1% об/об спор вегетативных клеток исходной культуры) различных микроорганизмов, хранящимися в виде замороженной суспензии в глицерине, и инкубируют при температуре 29oС при перемешивании (210 об/мин) на роторном шейкере. Через 48 часов в каждую пробирку добавляют 0,05 мл 10 мг/мл раствора 2-метилхиноксалина в ДМСО. Через 4 дня инкубирования содержимое каждой пробирки экстрагируют и отдельные экстракты анализируют с помощью ВЭЖХ, как описано в примере 1. Выходы 2-хиноксалинкарбоновой кислоты определяют с помощью ВЭЖХ, результаты анализа представлены в таблице 5.
ПРИМЕР 5.
ОКИСЛЕНИЕ 2-МЕТИЛХИНОКСАЛИНА В КОЛБАХ С КУЛЬТУРОЙ С ПРИМЕНЕНИЕМ Р. putida ATCC 33015
Клетки Р. putida ATCC 33015 выращивают в Среде 5 (Nutrient Broth (около 32 г/л) и глицерин (около 5 г/л)). Шесть конических колб (300 мл), содержащих около 30 мл среды, засевают 0,10 мл суспензии клеток Р. putida ATCC 33015 в глицерине, предварительно сохранявшейся при температуре -70oС. После добавления около 2 мл п-ксилола, содержащегося в 15 мл конической полипропиленовой центрифужной пробирке (Falcon®, Becton Dickinson Labware), колбы запечатывают Parafilm® (American National Can) и перемешивают (скорость 225 об/мин) на роторном шейкере в течение около 18 часов при температуре около 29oС. Данные культуры, находящиеся в колбах, имеют оптическую плотность около 1,9, измеренную при 650 нм. Клетки собирают из шести колб центрифугированием, промывают один раз 250 мл ЗФРД и повторно суспендируют в 20 мл ЗФР (Biowhittaker) в 300 мл конической колбе.
Биоконверсию начинают добавлением около 0,1 мл 100 мг/мл раствора 2-метилхиноксалина в ДМСО, что соответствует начальной концентрации около 0,5 г/л. Инкубирование продолжают в течение 4 дней при температуре около 29oС при перемешивании со скоростью 225 об/мин. Образцы бульона, в котором произошла биоконверсия, отбирают в различные моменты времени и, после удаления клеток центрифугированием и разбавления МеОН в необходимом объеме, анализируют с помощью ВЭЖХ. Около 20 мкл каждого из этих образцов анализируют впрыскиванием в колонку для ВЭЖХ Inertsil® C8 (4,6 x 250 мм). Каждую колонку элюируют со скоростью 1,0 мл/мин подвижной фазой, состоящей из АЦН:0,05% водной ТФК (1: 4, об/об). Выход 2-хиноксалинкарбоновой кислоты составляет 86, 90 и 94% через 1, 2 и 4 дня инкубирования соответственно.
ПРИМЕР 6.
ОКИСЛЕНИЕ 2-МЕТИЛХИНОКСАЛИНА В ФЕРМЕНТЕРЕ С КУЛЬТУРОЙ С ПРИМЕНЕНИЕМ Р. putida ATCC 33015
Р. putida ATCC 33015 выращивают в ферментере, содержащем 10 л среды 5. Ферментер засевают шестью культурами Р. putida, каждая из которых выращена в конической колбе (300 мл), содержащей 50 мл среды 5. Каждую колбу с культурой засевают 175 мкл исходного раствора спор Р. putida ATCC 33015, вставляют 15 мл полипропиленовую центрифужную пробирку, содержащую 2 мл п-ксилола, и колбу запечатывают Parafilm®. Колбы с культурой инкубируют при температуре около 29oС в течение 17 часов при взбалтывании со скоростью 210 об/мин. После засевания ферментера 6 культурами, содержащимися в колбах, в ферментер добавляют п-ксилол в виде 2 мл аликвот каждые 20 мин в течение 2 часов. Затем в ферментер добавляют 2,5 мл аликвоты п-ксилола каждые 20 мин в течение 3,5 часов. Затем добавление ксилола прекращают и добавляют 2-метилхиноксалин через 5,25 часов (1,95 г) и 7,75 часов (7,76 г) после засевания. Инкубирование продолжают в течение 22 часов после последнего добавления 2-метилхиноксалина. Образец инкубационной среды центрифугируют для удаления клеток, разбавляют МеОН и анализируют с помощью ВЭЖХ по методике примера V. Данный анализ показал 81% выход 2-хиноксалинкарбоновой кислоты.

Изобретение относится к области биотехнологии и может быть использовано для получения 2-хиноксалинкарбоновой кислоты. Способ получения последней предусматривает контактирование 2-метилхиноксалина с микроорганизмом, обеспечивающим его окисление до кислоты. Показана возможность использования одиннадцати штаммов восьми видов микроорганизмов (грибки, бактерии). Полученную смесь инкубируют в среде для выращивания микроорганизмов, помещенную в колбу или ферментер. После завершения инкубирования целевой продукт при необходимости выделяют путем экстракции и очищают. Способ позволяет упростить технологию получения кислоты с выходом 81-90% в зависимости от длительности культивирования. 3 с. и 26 з.п. ф-лы, 5 табл.
| ЕР 0622360 В1, 02.11.1994 | |||
| US 5104798 А, 14.04.1992. |
Авторы
Даты
2003-10-10—Публикация
2000-02-11—Подача