Изобретение относится к новому способу микробиологического окисления метильных групп ароматических 5- или 6-циклических гетероциклов до соответствующей карбоновой кислоты, причем гетероцикл у углеродного атома, соседнего с окисляемой метильной группой, не имеет заместителя. Этот гетероцикл служит субстратом для реакции, осуществляемой с помощью использующих толуол, ксилол или цимол микроорганизмов рода Pseudomonas после предварительной индукции энзимов последних.
Эти гетероциклические карбоновые кислоты представляют, например, важные промежуточные продукты в производстве лекарств. Так, никотиновая (3-пиридинкарбоновая) кислота является важным промежуточным продуктом в производстве амида никотиновой кислоты, представляющего собой витамин комплекса витамина В и имеющего большое значение в питании человека и животных (Ullmann, т.19, 1980, с.603).
Далее, 2-пиразинкарбоновая кислота, например, является важным промежуточным продуктом в производстве туберкулостатического средства пиразинамида (амида 2-пиразинкарбоновой кислоты) (Romps Chemie Lexikon, т.5, 1987). 4-Тиазолкарбоновая кислота служит для получения тиабендазола высокоэффективного противоглистного средства, которое в свою очередь служит в качестве исходного вещества в получении других новых противоглистных средств, например, камбендазола (Ullmann, т.23, 1980, с.46). 2-Тиофенкарбоновая кислота обладает противоаллергическим действием (Ullmann, т.23, 1980, с.219).
Подробные исследования процесса окисления метильных групп до сих пор проводились только с ароматическими углеводородами.
Получение карбоновых кислот путем микробиологического окисления метилированных ароматических углеводородов подробно описано в трудах Раймонда и его сотрудников (Raymond с сотр. Process Biochem. 1969, с.71-74).
В патенте США N 3383289 описан способ биохимического окисления метильных групп в ароматических углеводородах с помощью грамположительного штамма микроорганизмов рода Nocardia.
Недостаток этого способа заключается в том, что, например, при окислении метильных групп ароматических углеводородов раскрывается бензольное кольцо соответствующей кислоты.
Для Pseudomonas putida АТСС 33015 известно, что метильная группа толуола в результате трехстадийного биохимического окисления превращается в бензольную кислоту. При этом метильная группа под воздействием толуол-моноксигеназы сначала превращается в бензиловый спирт, а потом на двух последующих стадиях под каталитическим действием спиртной и альдегидной дегидрогеназы переводится в кислоту.
В этом штамме как ксил-гены, кодирующие энзимы деструкции ксилола, так и гены, регулирующие ксил-гены, располагаются на плазмиде pWWO. Эта архетипическая тол-плазмида уже подробно исследована молекулярно-биологическими методами (Harayama с сотр. J.Bacteriol. 171, 1989, с. 5048-5055; Burlage с сотр. Appl. Environ Microbiol. 55. 1989, с.1323-1328).
Из литературы известны также микробиологические способы окисления метильных групп N-гетероцикла. Согласно патенту СССР N 417468 2-метилпиридин с помощью грамположительного штамма микроорганизмов рода Nocardia можно окислять до соответствующей кислоты.
В патенте СССР N 228688 описан микробиологический способ получения никотиновой кислоты из 3-метилпиридина с помощью грамположительного микроорганизма рода Mycobacterium. Из патента СССР N 302341 известен микробиологический способ получения никотиновой кислоты с помощью грамположительных бактерий рода Nocardia.
Недостатки окисления метильных групп N-гетероциклов с помощью грамположительных бактерий заключаются в том, что в случае использования этих бактерий, использующих алканы, соотношение алкана с окисляемым веществом должно быть строго согласовано, чтобы обеспечить биотрансформацию, и что необходимо предотвратить биотрансформацию субстрата в отсутствии алкана, т.е. что используемый для индукции алкан должен присутствовать и при реакции взаимодействия субстрата с микроорганизмами. Сравнительные опыты, проведенные с грамположительными бактериями Nocardia, с одной стороны, и с предлагаемыми грамотрицательными бактериями Pseudomonas, с другой, однозначно показали, что в случае использования бактерий Nocardia даже в присутствии алкана, например, додекана, 3-метилпиридин не окисляется до никотиновой кислоты.
Далее, в патенте США N 4859592 описан способ получения пиколиновой кислоты с помощью Pseudomonas putida, согласно которому из алкилзамещенного ароматического углеводорода в присутствии молекулярного кислорода на первой стадии под воздействием диоксигеназы образуется семиальдегид 2-оксимуконовой кислоты, который на второй стадии с помощью аммиака или первичного амина переводится в 2-пиколиновую кислоту.
Недостаток этого способа в том, что соответствующая пиколиновая кислота образуется только на второй стадии в результате реакции семиальдегида 2-оксимуконовой кислоты с аммиаком.
Поэтому задача предлагаемого изобретения заключается в устранении вышеописанных недостатков и в разработке простого одноступенчатого способа микробиологического окисления метильных групп, при применении которого удается выделить соответствующие кислоты с хорошими выходом и чистотой без раскрытия ароматического гетероцикла.
Другая задача заключается в разработке способа, согласно которому соединение, необходимое для индукции энзимов, после последней в течение реакции окисления субстрата может не присутствовать, и тем самым степень окисления не зависит от количества присутствующего индуктора энзима.
Итак, предметом изобретения является микробиологический способ окисления метильных групп ароматических 5- или 6-циклических гетероциклов до соответствующей карбоновой кислоты, причем гетероцикл у углеродного атома, соседнего с окисляемой метильной группой, не имеет заместителя, и метилированный гетероцикл служит субстратом для реакции окисления, осуществляемой с помощью использующих толуол, ксилол или цимол микроорганизмов рода Pseudomonas после предварительной индукции энзимов последних.
Целесообразно осуществлять реакцию окисления с помощью использующих толуол, ксилол или цимол микроорганизмов вида Pseudomonas putida.
Предпочтительно используется использующий ксилол микроорганизм штамма Pseudomonas putida с обозначением АТСС 33015 или эффективный мутант этого микроорганизма, или же использующий цимол микроорганизм штамма Pseydomonas putida с обозначением DMSD 5709, или эффективный мутант этого микроорганизма. Реакция окисления, в частности, осуществляется с помощью штамма Pseudomonas putida ATCC 33105.
Штамм Pseudomonas putida (DSM 5709) был депонирован в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen (DSM) und Zellkulturen GmbH) Машеродервег 16, 3300 г. Брауншвейг, ФРГ, 22.12.89 за N DSM 5709.
Штамм Pseudomonas putida ATCC 33105 был депонирован в Американской коллекции типовых культур (American Type Culture Collection) 12301 Парклоун Драйф. Роквиль, шт. Мэриленд 20852, США, за N АТСС 33015.
Индукцию энзима можно провести как с помощью соединений, служащих микроорганизму источником углерода и энергии, например p-ксилола, m-ксилола, p-цимола, m-цимола или толуола, так и с помощью соединений, не служащих источником углерода и энергии, например моно- и дизамещенных метил-, этил- и хлортолуолов, бензиловых спиртов и p-хлорбензальдегида, индуцирующее энзимы действие которых в процессе деструкции ароматических углеводородов уже описано (Abril M.-A. с сотр. J.Bacteriol. т.171, 1989, 6782-6789).
Индукцию энзима предпочтительно осуществляют с помощью p-ксилола, m-ксилола, 2-хлортолуола или 2-бромтолуола.
Используемые для индукции соединения либо присутствуют в течение реакции окисления субстрата, либо их подача приостанавливается до начала этой реакции.
Выбираемая концентрация индуктора должна быть ниже минимальной концентрации, при которой ингибируются отвечающие за реакцию энзимы.
В зависимости от варианта выполнения способа подачу используемых для индукции энзима соединений в течение реакции предпочтительно прекращают либо приостановкой подачи соединений, либо удалением клеток центрифугированием.
Названные штаммы, как правило, выращивают с p-ксилолом, m-ксилолом, p-цимолом, m-цимолом или толуолом в качестве единственного источника углерода и энергии на минеральной среде (Kulla с сотр. Arch. Microbiol. 135, 1983, с. 1-70 или на комплексной среде (Nutrient Broth Nr 2, Oxoid Ltd. Великобритания) или на минимальной среде, состав которой указан ниже. Ростовой субстрат по данным Claus и Walker (J.Gen. Microbiol. 36, 1964, с.107-122) подавали в среду в газообразном виде со скоростью пропускания газа 0,5 объем/мин.
До ввода субстрата клетки выращивают на культуральной среде до оптической плотности 1-200, предпочтительно 5-100, при длине волны 650 нм.
Целесообразно осуществить реакцию с однократным или непрерывным вводом субстрата так, чтобы его концентрация в культуральной среде не превышала 20% предпочтительно 5% (мас./объем). В зависимости от варианта выполнения способа субстрат можно ввести и одновременно с индуктором энзима, например, с использованием смеси индуктора и субстрата.
Реакцию целесообразно осуществить при значении рН 4-11, предпочтительно 6-10.
Целесообразно осуществить реакцию при температуре 15-50оС, предпочтительно 25-40оС.
Реакция осуществляется за 1-24 ч.
В качестве субстрата для реакции целесообразно использовать метилированные ароматические 5-циклические гетероциклы, содержащие один или несколько гетероатомов, выбранных из группы, включающей кислород, азот и серу, такие как метилированные тиофены, фураны, пирролы, тиазолы, пиразолы или имидазолы, не имеющие заместителя у атома углерода, смежного с окисляемой метильной группой. Предпочтительно применяются фураны, тиофены, пирролы и тиазолы, в частности 3,5-диметилпиразол, 5-метилтиазол, 4-метилтиазол, 2,5-диметилтиофен, 2-метилтиофен, 3-метилтиофен, 2,5-диметилфуран, 2,5-диметилпиррол.
Целесообразно осуществить реакцию с ароматическими метилированными 6-циклическими гетероциклами, содержащими один или несколько атомов азота в качестве гетероатома, таким как метилированные пиридины, пиримидины, пиразины или пиридазины, не имеющие заместителя у атома углерода, смежного с окисляемой метильной группой. Предпочтительно применяются пиридины, пиразины и пиримидины, например, 2-метилпиридин, 3-метилпиридин, 4-метилпиридин, 2,5-диметилпиридин, 2,4-диметилпиридин, 6-хлор-3-метилпиридин, 2-хлор-3-этил-5-метилпиридин, 4,6-диметилпиримидин, 2-метилпиразин, 2,5-диметилпиразин, 2,6-диметилпиразин, 2,3,5-триметилпиразин и 2-хлор-3,6-диметилпиразин.
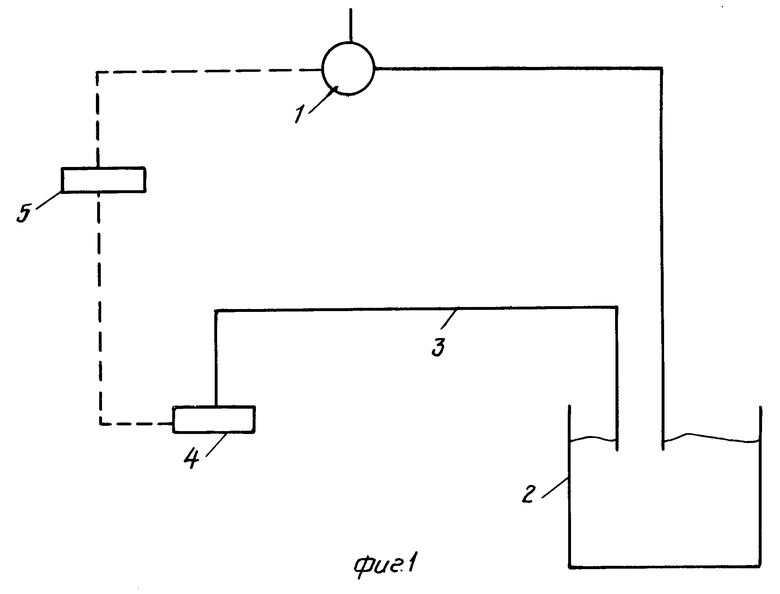
На фиг.1 изображен предпочтительный вариант выполнения способа.
Согласно этому варианту выполнения индуктор энзима и/или метилированный гетероцикл в качестве субстрата вводят в биореактор 2, причем количество подаваемого вещества регулируется через концентрацию индуктора в отходящем воздухе 3 биореактора 2. Концентрацию индуктора энзима в отходящем воздухе 3 предпочтительно измеряют с помощью измерителя 4. В качестве измерителя 4 можно использовать, например, фотометр для ультрафиолетового света, газохроматограф или газохроматограф, соединенный с масс-спектрометром. Рекомендуется соединить измеритель 4 через систему 5 управления, регулирующую количество подаваемого индуктора энзима и/или метилированного гетероцикла, с насосом 1, с помощью которого осуществляют подачу индуктора энзима и/или метилированного гетероцикла в биореактор 2. Подачу индуктора энзима и/или метилированного гетероцикла целесообразно регулировать с помощью названной системы соединенных между собой устройств. В предпочтительном случае, используя эту систему, концентрацию индуктора в отходящем воздухе 3 поддерживают на постоянном уровне.
Целесообразно осуществить регулирование концентрации индуктора в отходящем воздухе 3 так, чтобы она колебалась в пределах 0,001-10 ммоль/л отходящего воздуха, предпочтительно 0,1-3 ммоль/л отходящего воздуха.
Индуктор и/или метилированный гетероцикл, служащий субстратом, вводятся в биореактор 2 предпочтительно в виде смеси.
Целесообразное соотношение индуктора и субстрата составляет 5:1-3:1.
Согласно этому варианту выполнения способа целесообразно ввести индуктор и/или метилированный гетероцикл в биореактор 2 через приточный воздух.
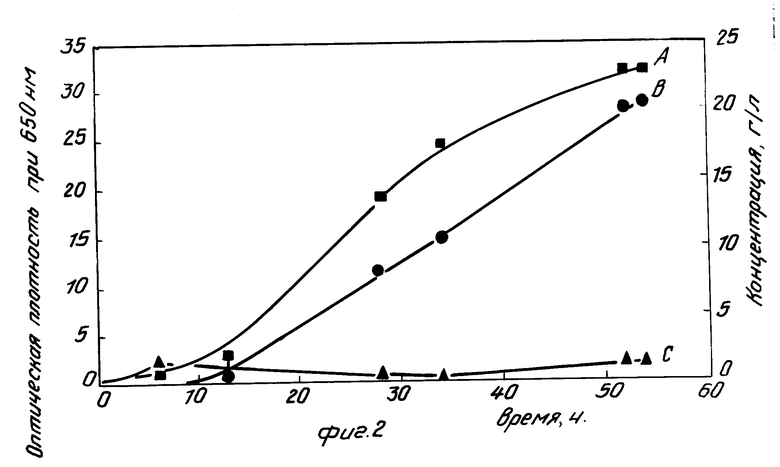
На фиг. 2 изображены результаты биотрансформации согласно предпочтительному варианту выполнения способа.
После реакции выделяют соответствующие кислоты известными приемами, например, экстракцией органическими растворителями или в случае образования соли гетероциклической карбоновой кислоты с щелочным металлом путем концентрирования свободной от клеток культуральной среды. Названную соль получают для установления значения рН культуральной среды, например, путем добавления гидроокиси щелочного металла.
Согласно изобретению предлагается простой одноступенчатый микробиологический способ окисления метильных групп ароматических 5- или 6-циклических гетероциклов, с помощью которого выделяются соответствующие кислоты с высокими выходом и степенью чистоты. Другое преимущество этого способа заключается в том, что ароматический гетероцикл не раскрывается, и степень конверсии не зависит от количества энзима.
П р и м е р 1. 5-Метил-2-пиразинкарбоновая кислота.
Штамм Pseudomonas putida ATCC 33015 выращивают на комплексной среде (100 мл) "Nutrient Broth Nr.2" (фирмы Oxoid Ltd. Англия) в ферментере при значении рН 7,0 и температуре 30оС, причем вводят индуктор энзима p-ксилола в газообразном виде в соответствии с данными авторов Claus и Walker (J. Gen. Microbiol. 36, 1964, с.107-122) до достижения концентрации 1 ммоль/л.
Затем клетки два раза промывают минеральной средой (Kulla с сотр. Arch. Microbiol. 135, 1983, с.1-7) и выращивают до оптической плотности 10 при 650 нм в 100 мл минеральной среды. К полученной клеточной взвеси добавляют 1 ммоль 2,5-диметилпиразина, что соответствует концентрации субстрата 0,108% (мас. /объем) в 100 мл. После инкубации в течение 4 ч при 30оС в отсутствии индуктора энзима получают 0,9 ммоль 5-метил-2-пиразинкарбоновой кислоты, что соответствует выходу 90% считая на исходный 2,5-диметилпиразин.
П р и м е р 2. Согласно примеру 1 в качестве индуктора энзима используют также нижеуказанные соединения, которые вместе с соответствующими концентрациями приведены в табл.1.
П р и м е р 3. 5-Метил-2-пиразинкарбоновая кислота.
Штамм Pseudomonas putida ATCC 33015 выращивают в соответствии с примером 1, но с тем отличием, что минеральная среда (Kulla с сотр. Arch. Microbiol. 135, 1983, с. 1-7) содержит p-ксилол как единственный источник углерода и энергии. Затем к полученной взвеси клеток (100 мл) с оптической плотностью 10 добавляют 10 ммоль 2,5-диметилпиразина, что соответствует концентрации 0,108% (мас./объем). В течение реакции окисления субстрата приостанавливают подачу p-ксилола. В этих условиях 1 ммоль 2,5-диметилпиразина в течение 4 ч превращается в 0,9 ммоль 5-метил-2-пиразинкарбоновой кислоты, что соответствует выходу 90% считая на исходный 2,5-диметилпиразин.
П р и м е р 4. Штамм Pseudomonas putida DSM 5709 выращивают аналогично примеру 3, но с p-цимолом в качестве единственного источника углерода и энергии. По истечении 16 ч получают 0,5 ммоль 5-метил-2-пиразинкарбоновой кислоты, что соответствует выходу 50% считая на исходный 2,5-диметилпиразин.
П р и м е р ы 5-28 проводили в соответствии с примером 3 с использованием 1 ммоль субстрата на 100 мл взвеси клеток. Полученные при этом результаты приведены в табл.2.
П р и м е р 5. Получение 5-метил-2-пиразинкарбоновой кислоты.
Бактерии штамма Pseudomonas putida ATCC 33015 выращивают на минимальной среде, состав которой указан ниже, в биореакторе 2 емкостью 20 л при рабочем объеме 15 л.
Температура составляет 30оС. Значение рН путем введения гидроокиси калия поддерживают на уровне 7,0. Скорость подачи газа составляет 20 л/мин. В качестве субстрата используют смесь 4 ч. (объем/объем) p-ксилола и 1 ч. 2,5-диметилпиразина. Эту смесь вводят в биореактор 2 с помощью насоса 1. Система подачи субстрата через измеритель 4 для контроля подаваемого количества ксилола в отходящем воздухе 3 биореактора соединена с системой 5 управления. С помощью последней поддерживают концентрацию ксилола в отходящем воздухе 3 на уровне 0,2 ммоль/л (фиг.1).
Биотрансформацию прекращают только по завершении роста бактерий. На фиг. 2 показаны результаты подобного рода биотрансформации.
Кривая А на фиг.2 означает оптическую плотность при 650 нм.
Кривая В на фиг.2 означает концентрацию 2,5-диметилпиразина, г/л.
Кривая С на фиг.2 означает концентрацию калиевой соли 5-метил-2-пиразинкарбоновой кислоты, г/л.
Согласно указанному приему получают 5-метил-2-пиразинкарбоновую кислоту с концентрацией 38 г/л.
Состав среды, г/л:
MgCl2˙6H2O 0,8
CaCl2 0,16
(NH4)SO4 2
NH4Cl 5
Na2SO4 0,25
KH2SO4 0,4
Na2HPO4 0,9
Микроэлементы, мл/л 1
FeEDTA, мл/л 15
Состав раствора микроэлементов, г/л:
KOH 15
EDTA Na2˙2H2O 10
ZnSO4˙7H2O 9
MnCl2˙4H2O 4
H3BO3 2,7
CoCl2˙6H2O 1,8
CuCl2˙2H2O 1,5
NiCl2˙6H2O 0,18
Na2MoO4˙2H2O 0,2
Состав FeEDTA, г/л:
EDTA Na2 2H2O 5
FeSO4 7H2O 2
Сравнительные примеры
П р и м е р 6. Бактерии штамма Pseudomobas putida ATCC 33015.
Биотрансформацию 3-метилпиридина с помощью бактерий штамма Pseudomonas putida ATCC 33015 проводят согласно примеру 3, используя 1 ммоль 3-метилпиридина. По истечении инкубационного периода в 8 ч получают 0,25 ммоль никотиновой кислоты, что соответствует выходу 25% считая на исходный 3-метилпиридин.
П р и м е р 7. Бактерии штамма Phodoccocus rhodochrous и Nocardia.
Бактерии штамма Phodoccocus rhodochrous DSM 43002 (ATCC 19149) выращивают на минеральной среде согласно примеру 3 с использованием 0,4% додекана в качестве источника углерода и энергии, а затем их промывают в той же среде, но в отсутствии додекана. Ко взвесям клеток (100 мл) с оптической плотностью 10 при 650 нм в трех отдельных колбах добавляют следующие соединения: а) 1 ммоль 3-метилпиридина, б) 1 ммоль 3-метилпиридина и 0,055 ммоль додекана, в) 1 ммоль 3-метилпиридина и 5,5 ммоль додекана.
По истечении инкубационного периода в 8 ч при 30оС ни в одной из смесей не обнаруживается никотиновая кислота.


Использование: биотехнология. Сущность изобретения: метилированное производное тиофена, фурана, пиррола, тиазола, пиридина, пиримидина или пиразина, не имеющее заместителя у соседнего с окисляемой метильной группой углеродного атома, инкубируют с ассимилирующим ксилол штаммом микроорганизма Pseudomonas putida АТСС 33015 или с ассимилирующим цимол штаммом микроорганизмов Pseudomonas putida DSM 5709. Окисляющие культуры микроорганизмов предварительно подвергают обработке для индукции микробных ферментов. Инкубацию проводят при pH 4 - 11 и температуре от 15°С до 50°С. Субстрат-гетероцикл вводят однократно или непрерывно до концентрации его в культуральной среде не более 5 мас.%/ объем. Получают соответствующую карбоновую кислоту с выходом 40 - 90%. 3 з. п. ф-лы, 2 ил., 2 табл.
| 1972 |
|
SU417468A1 | |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1995-06-19—Публикация
1991-02-12—Подача