Изобретение относится к новому упрощенному способу получения известного соединения, относящегося к кетиминам. Конкретно, изобретение относится к синтезу (+) энантиомера N-[4-(3,4-дихлорфенил)-3,4-дигидро-1. (2Н)-нафталинилиден] метанамина, важного промежуточного соединения при производстве цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина (сертралина). Сертралин гидрохлорид является активным ингредиентом антидепрессанта Zoloft®.
Наиболее широко используемый в настоящее время способ коммерческого получения N-[4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинилиден]метанамина, дающего цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин (сертралин) включает реакцию конденсации 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинона с монометиламином, катализатором которой является тетрахлорид титана, как описано у W.R. Welch, Jr. et al. в патенте США 4536518 и в Journal of Medicinal Chemistry, 1984, том 27, 11, стр.1508. Альтернативный способ получения N-[4-(3,4-дихлорфенил)-3, 4-дигидро-1(2Н)-нафталинилиден] метанамина описан в патенте США 4855500, J.C. Spavins, в котором для содействия реакции конденсации между 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталиноном и монометиламином используют дегидратационные свойства молекулярных сит с соответствующими ячейками. Молекулярные сита подходящего типа (особенно те, которые имеют размер пор около 3 ангстремов) взаимодействуют in situ со смесью 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинона и монометиламина и адсорбируют воду, образовавшуюся в результате реакции конденсации.
Существенная экономия может быть получена при проведении процесса, подобного тем, которые описаны в предыдущем параграфе, с использованием оптически чистого (+) энантиомера исходного тетралона или оптически обогащенной (+) энантиомером смеси (+) и (-) энантиомеров тетралона вместо рацемического тетралона. Использование хирального исходного материала исключает необходимость разрешения конечного продукта, а также исключает получение промежуточных соединений, имеющих нежелательную стереохимию.
Данное изобретение относится к способу получения оптически чистого (+) энантиомера N-[4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинилиден] метанамина, изображенного ниже,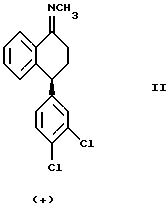
или оптически обогащенной (+) энантиомером смеси указанного выше соединения формулы II и его противоположного энантиомера, включающему взаимодействие оптически чистого (+) энантиомера 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинона ("тетралона"), изображенного ниже,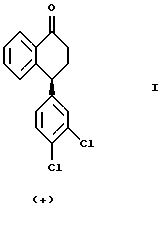
или оптически обогащенной (+) энантиомером смеси (+) и (-) энантиомеров тетралона с монометиламином и либо тетрахлоридом титана, либо молекулярными ситами, в растворителе, выбранном из тетрагидрофурана ("ТГФ"), дихлорметана и ароматических растворителей, таких как толуол, ксилолы и дихлорбензол, при температуре от около -20oС до около 60oС, предпочтительно от около 0oС до около 50oС.
Более конкретный вариант реализации данного изобретения относится к способу, описанному выше, в котором: (а) кетиминовый продукт формулы II, который получен в данном способе, гидрируют с получением смеси цис (+) сертралина ("сертралин") и транс (-) сертралина; (b) сертралин необязательно выделяют из данной смеси; и (с) сертралин необязательно превращают в его гидрохлорид или манделат.
Термины "сертралин" и "цис (+) сертралин" в данном описании оба относятся к цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамину.
Термин "транс (+) сертралин" в данном описании относится к транс-(1R)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамину.
Термин "цис(-)сертралин" в данном описании относится к цис-(1R) (4R)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамину.
Термин "транс (-) сертралин" в данном описании относится к транс-(1S)(4R)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамину.
Термин "рацемический цис сертралин" в данном описании относится к оптически неактивной смеси цис (+) сертралина и цис (-) сертралина.
Термин "рацемический транс сертралин" в данном описании относится к оптически неактивной смеси транс (+) сертралина и транс (-) сертралина.
Термин "рацемический сертралин" в данном описании относится к оптически неактивной смеси рацемического цис сертралина и рацемического транс сертралина.
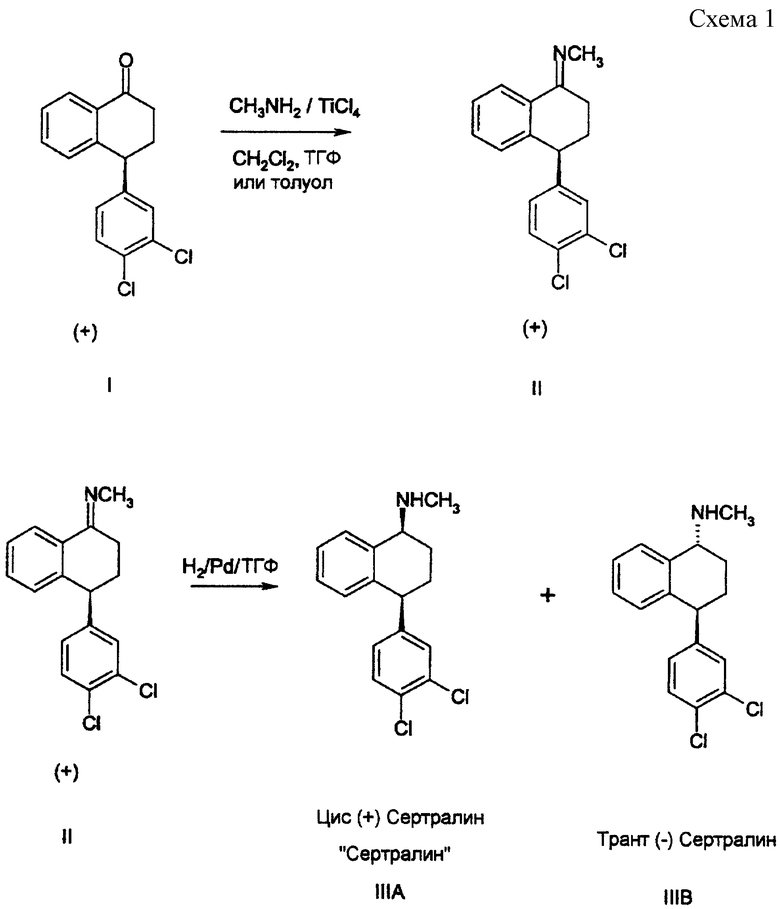
Способы данного изобретения, а также применение кетимина, полученного такими способами, в синтезе сертралина проиллюстрированы на схемах, приведенных в конце описания, и описаны ниже.
Согласно способу данного изобретения исходный материал, оптически чистый (+) 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинон, или оптически обогащенную (+) энантиомером смесь (+) и (-) энантиомеров этого соединения, смешивают с 1,5-25 эквивалентами монометиламина и растворителем, выбранным из дихлорметана, ТГФ и ароматических растворителей, таких как толуол, ксилолы и дихлорбензол. Тетрахлорид титана (0,2-1,2 эквивалента) или молекулярные сита добавляют в реакционную смесь, и данную смесь подвергают взаимодействию при температуре от около -20oС до около 60oС, предпочтительно от около 0oС до около 50oС в течение от около 1 до около 24 часов. Твердые побочные продукты (двуокись титана и гидрохлорид монометиламина) могут быть удалены из реакционной смеси фильтрацией и промыты реакционным растворителем. Для способствования фильтрации может быть использован подходящий ускоритель фильтрования. Обесцвечивающий уголь или подходящий растворитель фильтрования могут добавляться в продукт, содержащий растворитель, полученную при этом смесь перемешивают и фильтруют, и фильтровальный осадок промывают тем же растворителем.
Растворитель, содержащий (+) кетимин формулы II или оптически обогащенную (+) энантиомером смесь (+) и (-) энантиомеров этого соединения, может быть затем отогнан (либо при атмосферном, либо при пониженном давлении), и затем, по существу, замещен гексаном до конечного объема в 3-10 литров на килограмм исходного материала. Кетимин гранулируют при температуре от около -10oС до около 30oС, фильтруют и промывают гексаном или гептаном. Такой продукт, увлажненный растворителем, может быть использован непосредственно на следующей стадии (т.е. стадии гидрирования), или при необходимости хранения он может быть высушен в вакууме или при атмосферном давлении при максимальной температуре 80oС.
Если в качестве растворителя для реакции получения кетимина используют ТГФ, растворитель, содержащий кетимин, может быть отогнан (либо при атмосферном, либо при пониженном давлении), а полученный концентрированный раствор использован непосредственно на следующую стадию. Высушенный или увлажненный растворителем кетимин с предыдущей стадии смешивают с ТГФ. Раствор гидрируют в подходящем оборудовании, используя вплоть до 30% (масса/масса) катализатора гидрирования, такого как палладий на угле, увлажненный водой, или палладий на карбонате кальция, увлажненный водой, или один из аналогичных катализаторов, содержащих платину, с получением смеси цис (+) сертралина и транс (-) сертралина. Давление водорода в реакции гидрирования составляет от около 1 до около 8 атмосфер, предпочтительно от около 1 до около 5 атмосфер, и температура составляет от около 0oС до около 70oС, предпочтительно от комнатной температуры до около 60oС. Время реакции обычно составляет от около 1 до около 24 часов. Катализатор затем отфильтровывают и промывают тем же растворителем, который используют для реакции гидрирования, и далее фильтрат обрабатывают, как описано ниже.
Если в качестве растворителя для реакции получения кетимина используют толуол, растворитель, содержащий кетимин, может быть отогнан (либо при атмосферном, либо при пониженном давлении), а сконцентрированный раствор затем подвергнут гидрированию, как описано выше, но с использованием толуола в качестве растворителя при гидрировании с получением смеси цис (+) сертралина и транс (-) сертралина.
Реакция гидрирования также может проводиться в других растворителях, таких как этанол, изопропиловый эфир, метил трет-бутиловый эфир и подобные, хотя, в зависимости от растворителя, используемого в реакции получения кетимина, может быть предпочтительным отделять кетимин в высушенном виде до смешивания его с растворителем, используемым при гидрировании. После завершения реакции гидрирования для удаления катализатора проводят фильтрование. Избыток монометиламина удаляют с помощью перегонки и/или замещения исходного растворителя (используемого в реакции получения кетимина) другим подходящим растворителем, таким как низший алканол, тетрагидрофуран, метилэтилкетон или толуол.
Предпочтительный интервал температур для реакции гидрирования составляет от около 0oС до около 70oС, а предпочтительный интервал давления водорода составляет от около 1 атмосферы до около 8 атмосфер. Наиболее предпочтительные температуры составляют от комнатной температуры до около 60oС, и наиболее предпочтительное давление водорода составляет от около 1 атмосферы до около 5 атмосфер.
Предпочтительные катализаторы для восстановления или восстановительного аминирования, описанного выше, включают платину, палладий и другие промоторы из числа драгоценных металлов на подложках, таких как уголь, графит, карбонат кальция или другие подобные подложки, которые хорошо известны в области каталитического гидрирования.
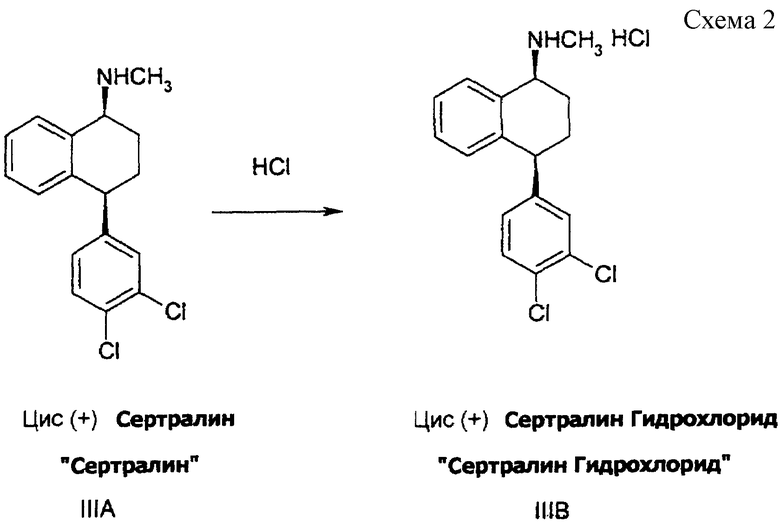
Гидрохлорид сертралина может быть получен следующим образом. Хлороводород либо в виде газа, либо в виде водного раствора смешивают с фильтратом, полученным после реакции гидрирования, и полученный продукт селективно кристаллизуют для выделения цис (+) сертралина ("сертралин"), гранулируют при температуре от около -10oС до 30oС, фильтруют и промывают реакционным растворителем. Полученный сертралин гидрохлорид, увлажненный растворителем, может быть использован непосредственно для дальнейшей обработки или, при необходимости хранения, высушен при температуре менее чем 80oС, либо при атмосферном, либо при пониженном давлении.
Если в качестве растворителя в реакции гидрирования используют толуол, сертралин манделат может быть получен смешиванием фильтрата, полученного после гидрирования, с 0,9-1,5 эквивалентами D-(-)-миндальной кислоты при температуре от около 0oС до около 80oС, либо непосредственно, либо в виде суспензии/раствора в этаноле. Полученный продукт представляет собой сертралин манделат (т.е. цис (+) сертралин манделат), содержащий только следы транс (-) сертралин манделата. Это возможно благодаря тому, что D-(-)-миндальная кислота превращает как транс (-) сертралин, так и цис (-) сертралин в цис (+) сертралин манделат ("сертралин манделат"). Полученный продукт затем гранулируют при температуре от около -10oС до около 30oС, фильтруют и промывают этанолом. Полученный таким образом сертралин манделат затем может быть использован непосредственно в увлажненном растворителем виде, для дальнейшей обработки, или высушен при температуре менее чем 80oС, либо при атмосферном, либо при пониженном давлении.
Описанная выше реакция с D-(-)-миндальной кислотой также может быть проведена в ряде других растворителей (например, ТГФ, этанол, метанол, изопропанол, этилацетат, ацетон, изопропиловый эфир или метил трет-бутиловый эфир), хотя в зависимости от растворителя, используемого при гидрировании, может быть предпочтительно выделять свободное основание сертралина после реакции гидрирования.
В альтернативном концентрированию и выделению твердого кетиминового продукта в реакции получения кетимина варианте смесь растворитель/кетимин после данной реакции может быть использована непосредственно без выделения на следующей стадии синтеза при получении сертралина, где проводят каталитическое гидрирование кетимина с получением смеси цис (+) и транс (-) сертралина с использованием того же растворителя. Гидрирование может успешно проводиться либо после завершения образования кетимина, либо одновременно с образованием кетимина по методике восстановительного аминирования. Восстановительное аминирование включает смешивание (+) тетралона с монометиламином (в идеальном случае 2,5-3,5 мольных эквивалента) и подходящим катализатором гидрирования, таким как указанные выше катализаторы в атмосфере водорода в подходящем органическом растворителе, таком как толуол или ТГФ, до тех пор, пока не прекратится поглощение водорода или не появятся другие признаки завершения реакции. Эту реакцию обычно проводят при температуре от около 20oС до около 100oС, предпочтительно от комнатной температуры до около 70oС, при давлении от около 1406 кг/см2 (20 psig) до около 7031 кг/см2 (100 psig), предпочтительно, от около 1406 кг/см2 (20 psig) до около 4219 кг/см2 (60 psig). При этих условиях (+) тетралон превращается в соответствующий (+) кетимин и немедленно восстанавливается до желаемой смеси цис (+) сертралина и транс (-) сертралина.
Следующие примеры иллюстрируют новые способы настоящего изобретения, но не ограничивают их объем.
ПРИМЕР 1
(+) энантиомер N-[4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинилиден] метанамина
К 18,0 г соединения I в 18,5 мл толуола при температуре -10oС в атмосфере азота добавляют 8,64 г (4,5 эквивалента) монометиламина и смесь перемешивают в течение 10 мин. По каплям добавляют тетрахлорид титана (4,57 г, 0,56 эквивалента), сохраняя температуру ниже 15oС. Реакционной смеси дают нагреться до температуры окружающей среды и затем перемешивают в течение 1,5 ч. Реакционную смесь фильтруют в атмосфере азота, фильтровальный осадок промывают толуолом и основную часть толуола удаляют отгонкой в вакууме. Когда останется приблизительно 90 мл толуола вакуум нарушают и добавляют 72 мл гексана. Этот процесс продолжают до тех пор, пока не будет удален весь толуол, при необходимости добавляя гексан. После завершения отгонки продукт оставляют в холодильнике в течение ночи, а затем гранулируют в 72 мл гексана в течение 2 ч при температуре 0oС. Полученную смесь фильтруют и промывают холодным гексаном. Получают светло-желтое твердое вещество, имеющее массу во влажном состоянии (мас.) 15,59 г. Продукт сушат в течение 2 дней в вакуумной печи, после чего получают 14,96 г продукта. Фильтрат упаривают, добавляют 20 мл гексана и смесь оставляют в холодильнике в течение 2 дней. Затем ее перемешивают в течение 1 ч при температуре 0oС, фильтруют и промывают холодным гексаном. Масса во влажном состоянии полученного твердого вещества составляет 1,54 г. Продукт сушат в вакууме в течение ночи с получением 1,53 г (88%) желтого твердого вещества.
ЯМР подтверждает получение целевого соединения.
ПРИМЕР 2
Сертралин манделат
К Pd/C (0,740 г, 50% увлажнение водой) добавляют 14,8 г соединения II и 65 мл ТГФ в атмосфере азота. Смесь гидрируют при давлении 2812 кг/см2 (40 psig) в течение 5 ч. После завершения реакции смесь фильтруют через целит, и лепешку катализатора промывают ТГФ. Растворитель отгоняют. К остатку добавляют этанол (EtOH) (74 мл) и растворитель отгоняют. К полученному продукту добавляют EtOH (74 мл) и D-(-)-миндальную кислоту (7,40 г) и смесь перемешивают в течение 18 часов при температуре окружающей среды. Затем добавляют EtOH (14 мл) и смесь перемешивают в течение 1 часа. Полученную смесь фильтруют, и твердый продукт промывают EtOH. Масса во влажном состоянии продукта составляет 21,62 г. Продукт сушат в вакууме с получением 17,34 г (78%) твердого вещества.
ЯМР подтверждает получение манделата сертралина.
Изобретение относится к новому улучшенному способу получения (+)-энантиомера N-[4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинилиден] метанамина взаимодействием (+)-энантиомера 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинона с монометиламином и хлоридом титана или молекулярными ситами. 4 с. и 5 з.п. ф-лы.
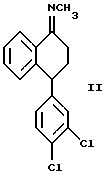
или оптически обогащенной (+)-энантиомером смеси указанного соединения формулы II и его противоположного энантиомера, который включает взаимодействие оптически чистого (+)-энантиомера 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталинона ("тетралона") формулы I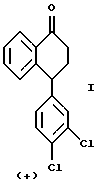
или оптически обогащенной (+) смеси (+) и (-)-энантиомеров тетралона с монометиламином и либо тетрахлоридом титана, либо молекулярными ситами.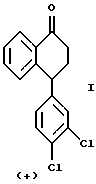
или оптически обогащенной (+)-энантиомером смеси (+)- и (-)- энантиомеров тетралона с монометиламином и либо тетрахлоридом титана, либо молекулярными ситами и подходящим катализатором гидрирования в подходящем органическом растворителе в атмосфере водорода при давлении от около 1406 (20 psig) до около 7031 кг/см2 (100 psig) при температуре от комнатной температуры до около 70oС.
| Движитель воздушный или водяной | 1932 |
|
SU30081A1 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА | 1992 |
|
RU2099339C1 |
| WO 9301161 A, 21.01.1993 | |||
| WO 9301162 A, 21.01.1993 | |||
| US 4536518 A, 20.08.1985 | |||
| US 4855500 A, 08.08.1989. | |||
Авторы
Даты
2002-04-20—Публикация
2000-06-08—Подача