1. Область изобретения
Данное изобретение относится к герметизированным ингаляторам с нормируемой дозировкой и аэрозольным препаратам для ингаляционной терапии.
2. Предпосылки создания изобретения
Исходя из соображений охраны окружающей среды, хлоруглеводородные и хлорфторуглеродные пропелленты для аэрозольных препаратов для медицинского использования были большей частью заменены гидрофторалканами, такими как 1,1,1,2-тетрафторэтан ("HFA-134a") и 1,1,1,2,3,3,3-гептафторпропан ("HFA-227ea"), которые, как было установлено, являются безопасными для использования в герметичных ингаляторах с нормированной дозировкой.
Такие медицинские аэрозольные препараты являются обычно препаратами типа растворов или суспензий. Препарат каждого типа состоит по меньшей мере из лекарственного вещества и пропеллента. Некоторые препараты включают также одно или более вспомогательных веществ для специальных целей, таких как сорастворитель или поверхностно-активное вещество (ЕР 0372777). Обычные препараты растворов для аэрозолей содержат сорастворитель, более полярный чем пропеллент, в низкой концентрации. Обычные препараты суспензий для аэрозолей содержат поверхностно-активное вещество, а не сорастворитель, на основе той теории, что поверхностно-активное вещество должно предотвращать аггломерацию частиц, их адгезию на стенках контейнера для аэрозольного препарата и обеспечивать смазку дозирующего клапана ("клапана-пускателя") (US 3014844).
Этанол использовали в качестве сорастворителя. Однако в предшествующих разработках (см., например, ЕР 0616525) указывалось на использование этанола в концентрации не более 5% для препаратов растворов для аэрозолей β-агонистов. Исторически концентрации этанола более 5% использовались только для препаратов на основе стероидов с гидрофторалкановыми пропеллентами.
Лекарственное средство β-агонист, формотерол ("эформотерол" в Европе) и его производные, как было показано, трудно изготовить в форме общепринятых аэрозолей. Такие препараты имели короткий срок хранения и требовали охлаждения. Охлаждение является нежелательным, так как многим пациентам необходимо носить аэрозольные баллончики с собой. Поэтому остается насущная потребность в аэрозольных лекарственных формах лекарственных средств β-агонистов, таких как формотерол и его производные, которые остаются химически и физически стабильными во время хранения при комнатных условиях температуры и влажности.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Объектом данного изобретения является создание герметизированного ингалятора с нормированной дозировкой, содержащего стабильный препарат лекарственного средства β-агониста, который не требует применения охлаждения.
Другим объектом данного изобретения является создание стабильного препарата лекарственного средства β-агониста, пригодного для использования в виде аэрозоля, который не требует применения охлаждения.
Получение вышеуказанных объектов и других объектов было неожиданно достигнуто путем нижеследующего. Данное изобретение представляет новый герметизированный ингалятор с нормированием дозы, состоящий из контейнера, оборудованного дозирующим клапаном и содержащего аэрозольный препарат под давлением, изготовленный из композиции, содержащей:
лекарственное средство β-агонист;
по меньшей мере один фторалкановый пропеллент и
более 5% по весу от общего веса аэрозольного препарата растворителя, который способен солюбилизировать или растворять лекарственный препарат β-агонист.
Данное изобретение, кроме того, представляет новый герметизированный ингалятор с нормированной дозировкой, состоящий из контейнера, оборудованного дозирующим клапаном и содержащего аэрозольный препарат под давлением, изготовленный из композиции, включающей:
частицы лекарственного средства β-агониста;
по меньшей мере один фторалкановый пропеллент и
поверхностно-активное вещество, которое способно к образованию суспензии частиц лекарственного средства β-агониста.
Данное изобретение также представляет новый аэрозольный препарат, адаптированный для использования в герметичном аэрозольном контейнере, причем указанный аэрозольный препарат изготовлен из композиции, содержащей:
лекарственное средство β-агонист;
по меньшей мере один фторалкановый пропеллент и
более 5% по весу от общего веса аэрозольного препарата растворителя, который способен солюбилизировать или растворять лекарственное средство β-агонист.
Данное изобретение, кроме того, представляет новый аэрозольный препарат, адаптированный для использования в герметизированном аэрозольном контейнере, причем указанный аэрозольный препарат изготовлен из композиции, содержащей:
частицы лекарственного средства β-агониста;
по меньшей мере один фторалкановый пропеллент и
поверхностно-активное вещество, которое способно к образованию суспензии частиц лекарственного средства β-агониста.
Данные аэрозольные лекарственные препараты являются неожиданно стабильными в условиях температуры до примерно 40oС и примерно 75% относительной влажности в течение по меньшей мере примерно четырех недель.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
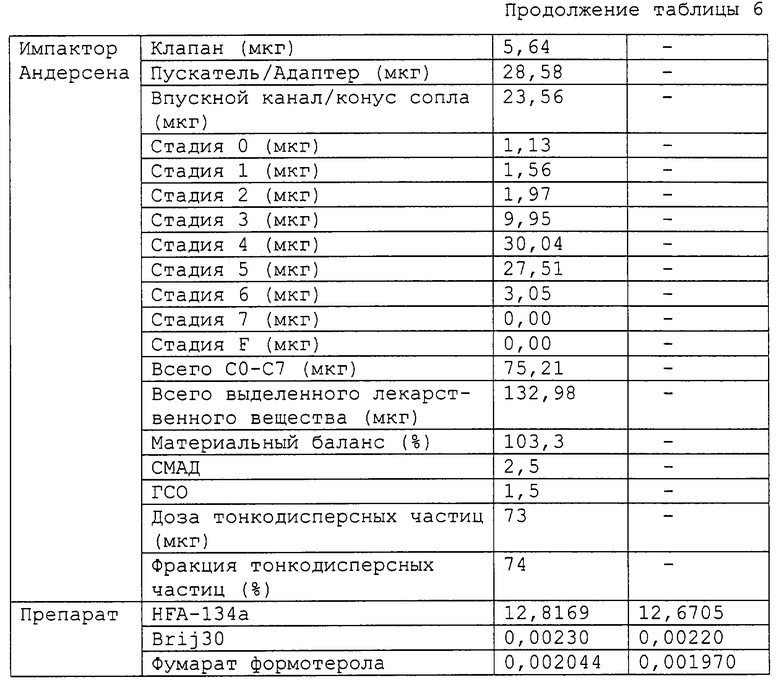
Фиг. 1 показывает хроматограмму фумарата формотерола, изготовленного в виде суспензии.
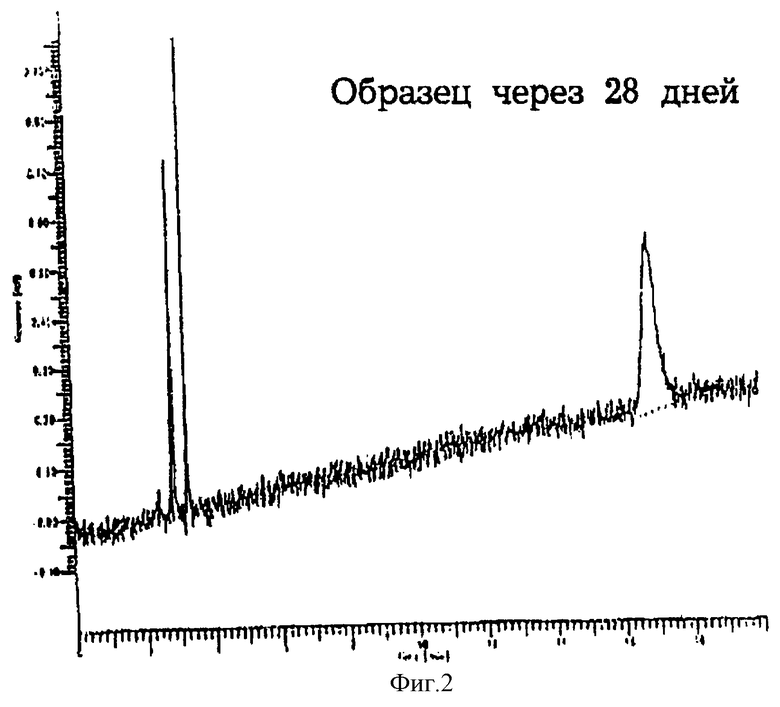
Фиг. 2 показывает хроматограмму фумарата формотерола после хранения в течение 28 дней при 40oС и 75% относительной влажности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Неожиданно было обнаружено, что стабильность аэрозольных препаратов растворов лекарственных средств β-агонистов может быть значительно улучшена путем использования более чем 5% по весу растворителя, способного солюбилизировать или растворять лекарственное средство β-агонист. Лекарственное средство β-агонист может быть в любой форме, которая пригодна для введения в легкие или носовые ходы человека, такой как форма основания или форма слабой кислоты. Данное изобретение будет описано со ссылкой на лекарственное вещество β-агонист, формотерол. Термин "формотерол", как он понимается здесь, означает формотерол в форме основания, а также формотерол в форме слабой кислоты, если не указано иначе. Предпочтительной формой слабой кислоты формотерола является фумарат формотерола.
Количество лекарственного вещества β-агониста, использованное в аэрозольном препарате, будет зависеть от типа выбранного лекарства. Для фумарата формотерола используемая концентрация составляет обычно примерно 1% по весу или менее, предпочтительно от примерно 0,01% до примерно 0,02% по весу от общего веса аэрозольного препарата.
Может использоваться любой растворитель, который пригоден для ингаляции и способен солюбилизировать или растворять выбранное лекарственное средство β-агонист. Примеры подходящих растворителей включают спирты, простые эфиры, углеводороды и перфторуглеродные соединения. Предпочтительно, когда растворитель является полярным спиртом с короткой цепью. Более предпочтительно, когда растворитель является алифатическим спиртом, имеющим от одного до шести атомов углерода, таким как этанол или изопропанол. Наиболее предпочтительным растворителем является этанол. Примеры подходящих углеводородов включают н-бутан, изобутан, пентан, неопентан и изопентаны. Примеры подходящих простых эфиров включают диметиловый эфир и диэтиловый эфир. Примеры подходящих перфторуглеродных соединений включают перфторпропан, перфторбутан, перфторциклобутан и перфторпентан.
Растворитель обычно присутствует в количестве от примерно 6% до примерно 30% по весу от общего веса аэрозольного препарата. Предпочтительно, когда растворитель присутствует в количестве от примерно 10% до примерно 15% по весу. На основе описания, представленного здесь, опытному специалисту будет ясно, что более низкие концентрации лекарственного вещества обычно требуют более низких концентраций растворителя, и наоборот, для получения стабильного раствора.
Можно использовать любой фторалкановый пропеллент, который пригоден для ингаляции. Примеры подходящих фторалканов включают HFA-134a, HFA-227ea, HFA-125 (пентафторэтан), HFA-152а (1,1-дифторэтан) и HFA-32 (дифторметан). Для модификации характеристик пропеллента, когда необходимо, могут быть добавлены углеводород и/или алифатические газы. Предпочтительно, аэрозольные препараты по существу не содержат хлорфторуглеродов. Однако, если желательно, могут использоваться и хлорфторуглероды.
Пропеллент для препаратов - растворов обычно присутствует в количестве от примерно 70% до примерно 94% по весу от веса аэрозольного препарата. Предпочтительный аэрозольный препарат состоит из HFA-134a в количестве менее чем примерно 90% по весу, этанола в количестве более примерно 10% по весу и фумарата формотерола в количестве примерно 0,01% по весу. Особенно предпочтительный аэрозольный препарат состоит из примерно 85% по весу HFA-134a, примерно 15% по весу этанола и примерно 0,01% по весу фумарата формотерола.
Герметизированные ингаляторы с нормированной дозировкой хорошо известны специалистам.
Может использоваться любой герметизированный ингалятор с нормированной дозировкой, который пригоден для введения лекарственных веществ в легкие или нос пациента. Герметизированные ингаляторы с нормированной дозировкой обычно снабжены дозирующим клапаном, имеющим выходное отверстие для аэрозоля диаметром примерно 460 мкм. Однако при высоких концентрациях растворителя, используемых в данном изобретении, может быть желательно, чтобы растворитель испарялся как можно быстрее после ингаляции. Это может быть достигнуто путем уменьшения диаметра выходного отверстия для аэрозоля, например до 250 мкм, в сочетании с использованием концентраций растворителя от примерно 10 до примерно 15% по весу. На основе описания, представленного здесь, опытный специалист без проведения комплексных экспериментов будет способен так отрегулировать композицию компонентов, чтобы в выбранный дозирующий клапан поступала желаемая доза. Например, композиция может быть изменена так, чтобы отрегулировать давление паров препарата. Аэрозольный состав и дозирующий клапан обычно выбираются так, чтобы обеспечивалось терапевтически эффективное количество лекарственного средства β-агониста на одно введение в действие ингалятора. Примером терапевтически эффективного количества фумарата формотерола является примерно 12 мкг на одно введение в действие.
Также неожиданно было обнаружено, что стабильные аэрозольные препараты суспензий частиц лекарственного средства β-агониста могут быть составлены путем использования лекарственного средства β-агониста в сочетании с поверхностно-активным веществом, которое способно к образованию суспензии частиц лекарственного средства β-агониста. Данное изобретение будет описано со ссылкой на лекарственное средство β-агонист, формотерол.
Пропеллент может быть любым из пропеллентов, описанных здесь в отношении аэрозольных препаратов - растворов. Однако пропеллент в суспензионных аэрозольных препаратах может применяться в количествах до 99,9% по весу от общего веса аэрозольного препарата.
Количество лекарственного средства β-агониста, примененного в аэрозольном препарате, будет зависеть от типа выбранного лекарственного средства. Что касается фумарата формотерола, применяемая концентрация обычно составляет около 1% по весу или менее, предпочтительно от примерно 0,01% до примерно 0,02% по весу от веса всего аэрозольного препарата.
Размер частиц лекарственного средства β-агониста должен быть подходящим для ингаляции в нос или легкие. Подходящий средний размер частиц составляет примерно 100 мкм и менее, предпочтительно, примерно 20 мкм и менее, и более предпочтительно, в интервале от примерно 1 до примерно 10 мкм.
Может использоваться любое поверхностно-активное вещество, которое пригодно при введении в легкие пациента и которое способно к образованию суспензии частиц лекарственного средства β-агониста. Примеры подходящих поверхностно-активных веществ включают полиатомные спирты, такие как полиэтиленгликоль (ПЭГ 300), моноэтиловый простой эфир диэтиленгликоля (Transcutol), полиоксиэтилен(20)сорбитан-монолаурат (Tween 20) или -моноолеат (Tween 80), пропоксилированный полиэтиленгликоль (Antarox 31R1), полиоксиэтилен-4-лауриловый простой эфир (Brij 30) и поверхностно-активные вещества, имеющие похожий ГЛБ. Предпочтительно, поверхностно-активным веществом является полиоксиэтилен-4-лауриловый простой эфир (Brij 30). Это поверхностно-активное вещество обычно присутствует в количестве примерно 1% по весу или менее.
Предпочтительный суспензионный препарат включает HFA-134a в количестве более 99% по весу, поверхностно-активное вещество Brij-30 в количестве 0,002% по весу или более и фумарат формотерола в количестве примерно 1% по весу или менее. Особенно предпочтительный суспензионный препарат содержит примерно 99% по весу HFA-134a, примерно 0,02% по весу Brij-30 и примерно 0,02% по весу фумарата формотерола. Особенно предпочтительный препарат в 19 мл контейнере содержит примерно 12,6 г/контейнер HFA-134a, примерно 0,002 г/контейнер Brij-30 и примерно 0,002 г/контейнер фумарата формотерола.
Последующие примеры представлены просто чтобы проиллюстрировать конкретные варианты осуществления данного изобретения, но не для того, чтобы ограничить объем притязаний, определенный формулой изобретения, который подтверждается всем описанием.
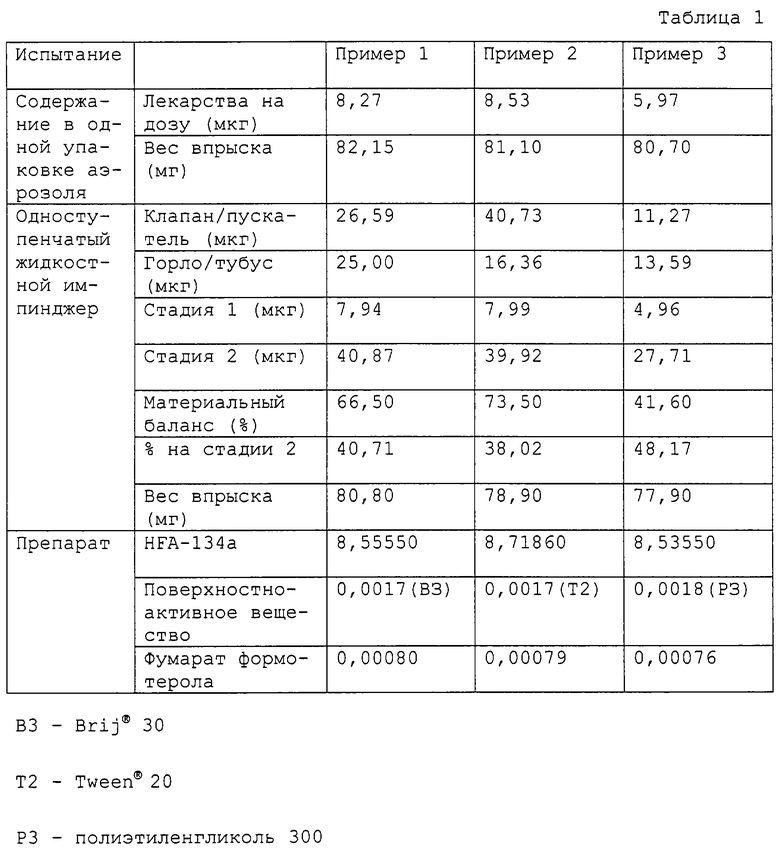
Примеры 1-3
Три суспензионных аэрозоля по данному изобретению были приготовлены путем соединения компонентов, представленных в табл. 1, с применением следующих стадий:
1. Отвешивание растворителя или поверхностно-активного вещества в покрытый пластиком стеклянный флакон или в алюминиевый контейнер.
2. Добавление отвешенного лекарственного вещества.
3. Опрессовка клапана на флаконе или контейнере.
4. Добавление известного количества пропеллента через клапан во флакон или контейнер.
5. Обработка препарата ультразвуком в течение примерно 5 минут.
Использован алюминиевый контейнер ингалятора с нормированной дозировкой Presspart, 19 мл с дозирующим клапаном Веspak BK357, 63 мкл, если не указано иначе.
Свойства примера аэрозольных препаратов определяли, используя один или более из следующих признаков:
внешний вид (не должно присутствовать наружных признаков негерметичности или деформации);
допустимые утечки в соответствии со стандартами United States Pharmacopea 23 и National Formulary 18;
содержимое контейнера, которое должно быть в пределах 10% от среднего значения;
количество лекарственного средства на контейнер, которое должно быть в пределах 25% от среднего значения;
химическое исследование должно выявлять содержание в пределах 90-110% от заявленного на этикетке;
вес на нормируемую дозу;
содержание в одном распылении и постоянство содержания в соответствии со стандартами Pharmacopeial Forum, vol. 22, no. 6 и
распределение по аэродинамическому размеру и определение воды.
Результаты испытаний показаны в табл. 1. Путем сравнения процента отложения на стадии 2 было определено, что препараты, содержащие Brij-30 и Tween-20, превосходили препараты, содержащие ПЭГ 300. Кроме того, данные показали, что при препарате с Tween-20 лекарственное вещество отлагалось в большем количестве на исполнительном механизме. Поэтому, для сведения к минимуму отложения на этом типе исполнительного механизма, Brij-30 был более полезным поверхностно-активным веществом в этих препаратах, чем Tween-20.
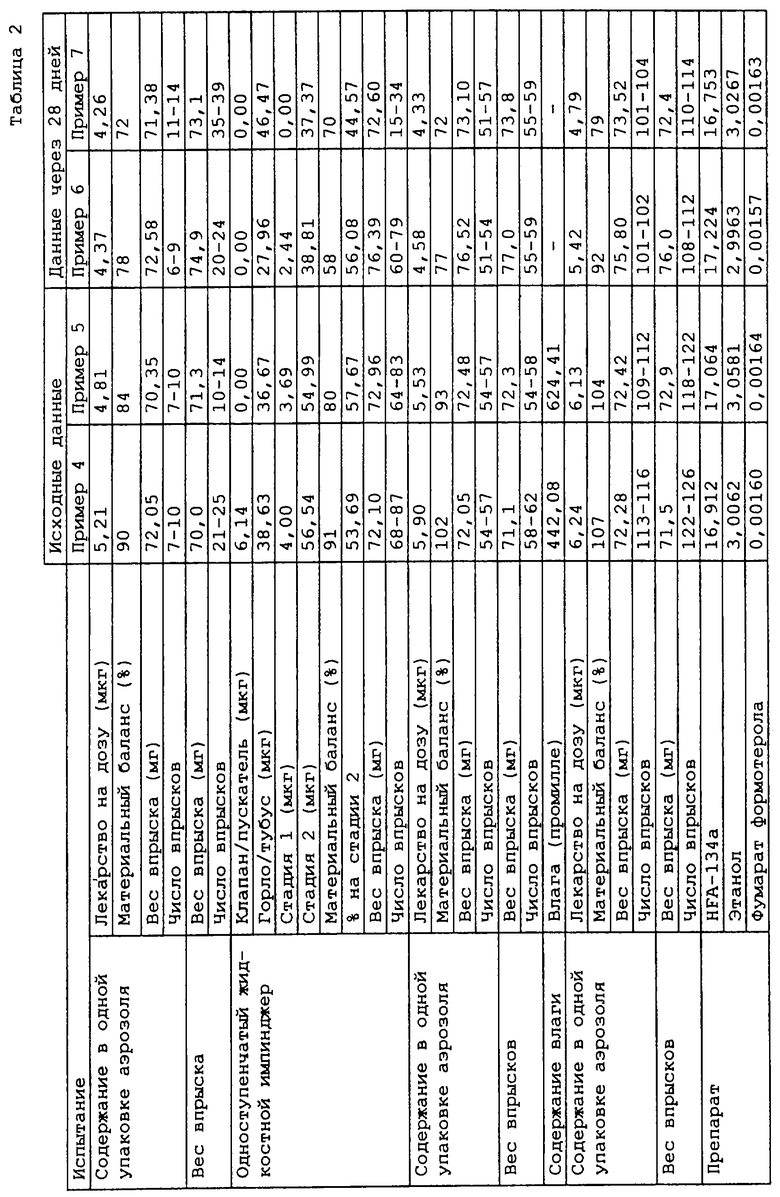
Примеры 4-7
Четыре раствора для аэрозолей по данному изобретению приготавливали путем соединения компонентов, представленных в табл. 2, используя метод, описанный в примере 1. Для определения стабильности аэрозольных препаратов - растворов образцы примеров 6 и 7 хранили в течение 1 месяца (28 дней) при 40oС и 75% относительной влажности, которые считаются здесь ускоренным режимом. Перед исследованием препараты аэрозолей - растворы уравновешиваются при комнатной температуре в течение ночи. Свойства препаратов аэрозолей - растворов определяли как в примере 1, и результаты показаны в табл. 2.
Данные показывают, что доза, выпускаемая (по определению в одном распылении) после хранения в ускоренном режиме была ниже, чем получаемая с исходными образцами, из-за адсорбции лекарственного средства на материале прокладки клапана. Однако в препаратах аэрозолей - растворах не показано признаков химического разрушения.
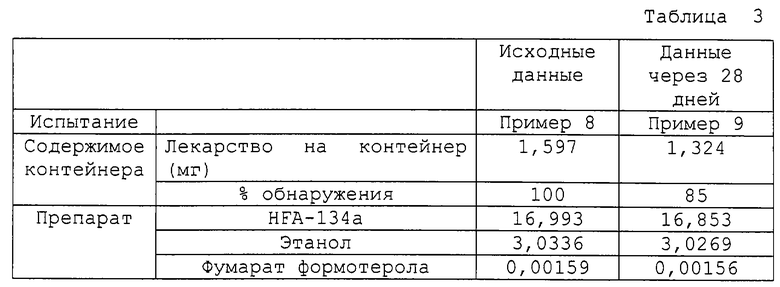
Примеры 8 и 9
Два раствора для аэрозолей по данному изобретению были приготовлены путем соединения компонентов, приведенных в табл. 3, с использованием метода, описанного в примере 1. Для определения стабильности препаратов аэрозолей - растворов образец примера 9 хранили в течение 1 месяца (28 дней) при 40oС и 75% относительной влажности, которые считаются здесь ускоренным режимом. Перед исследованием препараты аэрозолей - растворы уравновешиваются при комнатной температуре в течение ночи. Свойства препаратов аэрозолей - растворов определяли как в примере 1, и результаты показаны в табл. 3.
Лекарственное вещество не могло быть выделено из материалов прокладки во время этого исследования, что давало в результате потерю примерно 15% по весу. Однако в препаратах аэрозолей - растворах не выявлено признаков химического разрушения.
Примеры 10-13
Четыре суспензии для аэрозолей по данному изобретению приготавливали соединением компонентов, представленных в табл. 4, с использованием метода, описанного в примере 1. Для определения стабильности аэрозольных препаратов - суспензий образцы примеров 12 и 13 хранили в течение 1 месяца (28 дней) при 40oС и 75% относительной влажности, которые считаются здесь ускоренным режимом. Перед исследованием препараты аэрозолей - суспензии уравновешиваются при комнатной температуре в течение ночи. Свойства препаратов аэрозолей - суспензий определяли как в примере 1, и результаты показаны в табл. 4.
Через 28 дней хранения выпускаемая доза (по определению в одном распыления) в примерах 12 и 13 была меньше, чем получаемая с исходными примерами 10 и 11, но не снижена до такой степени, как с примерами препаратов - растворов.
Примеры 14-17
Четыре суспензии для аэрозолей по данному изобретению приготавливали соединением компонентов, представленных в табл. 5, с использованием метода, описанного в примере 1. Для определения стабильности аэрозольных препаратов - суспензий образцы примеров 16 и 17 хранили в течение 1 месяца (28 дней) при 40oС и 75% относительной влажности, которые считаются здесь ускоренным режимом. Перед исследованием препараты аэрозолей - суспензии уравновешиваются при комнатной температуре в течение ночи. Свойства препаратов аэрозолей - суспензий определяли как в примере 1, и результаты показаны в табл. 5.
Данные исследования показывают, что после хранения в условиях ускоренного режима в образцах примеров 16 и 17 было примерно 10% потерь лекарственного вещества относительно исходных примеров 14 и 15.
Это значение находится в приемлемых пределах и было в области 100% материального баланса (содержимое контейнера - лекарственного вещества на контейнер). Кроме того, применялся принятый в США (USP) метод определения размера частиц (импактор Андерсена). Результаты показали, что не было химической (в виде появления известного продукта разложения или потери первоначального соединения) или физической нестабильности после хранения, включая (1) как, например, увеличение размера частиц (СМАД - средний по массе аэродинамический диаметр), (2) изменение в распределении (ГСО - геометрическое стандартное отклонение), (3) изменение в дозе тонкодисперсных частиц или (4) изменение во фракции тонкодисперсных частиц.
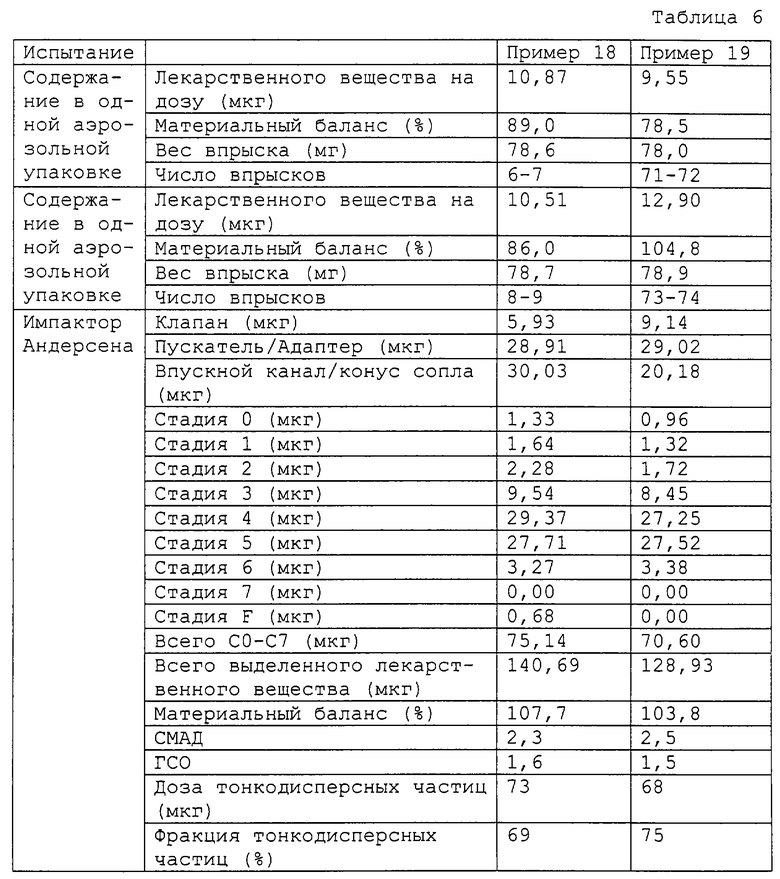
Примеры 18 и 19
Два суспензионных аэрозоля по данному изобретению приготавливали соединением компонентов, представленных в табл. 6, с использованием метода, описанного в примере 1. Свойства препаратов суспензионных аэрозолей определяли как в примере 1, и результаты показаны в табл. 6.
Пример 20
Препарат суспензионного аэрозоля готовили путем соединения 99,96% по весу HFA-134a, 0,02% по весу фумарата формотерола и 0,02% по весу Brij-30, используя метод, описанный в примере 1. Хроматограммы ВЭЖХ суспензионного аэрозоля перед хранением и после хранения в течение 28 дней при 40oС и 75% относительной влажности получали в виде фиг.1 и 2 соответственно. На каждой фигуре наблюдался только единственный пик, представляющий неповрежденное лекарственное средство. Не было обнаружено пиков, представляющих продукты распада лекарственного средства (появление которых ожидалось примерно через 13 минут). Таким образом, суспензионный аэрозоль формотерола проявлял долгосрочную стабильность.
Хотя изобретение было описано детально со ссылками на конкретные варианты его осуществления, для специалистов в данной области будет очевидно, что в данном изобретении могут быть осуществлены различные изменения и модификации без отклонения от его сущности и объема.


Изобретение относится к области фармакологии и касается аэрозольного препарата. Изобретение заключается в том, что представлены аэрозольные препараты, пригодные для ингаляционной терапии, содержащие лекарственное средство β-агонист в суспензии или растворе с нормированной доставкой в герметизированном ингаляторе. Изобретение обеспечивает стабильность в условиях температуры до примерно 90oС и примерно 75% относительно влажности в течение по меньшей мере примерно четырех недель. 2 с. и 32 з.п. ф-лы, 2 ил., 6 табл.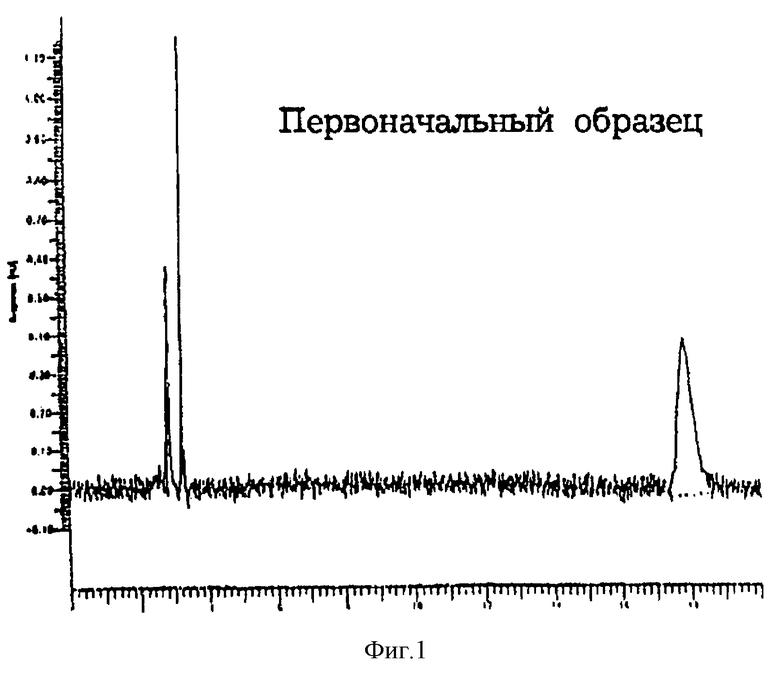
| АЭРОЗОЛЬНАЯ ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ ДЛЯ ИНГАЛЯЦИЙ (ВАРИАНТЫ) | 1992 |
|
RU2098082C1 |
| СОСТАВ АЭРОЗОЛЯ, НАХОДЯЩИЙСЯ ПОД ДАВЛЕНИЕМ | 1992 |
|
RU2122852C1 |
| ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ АЭРОЗОЛЯ | 1993 |
|
RU2126248C1 |
| Рекомбинантная плазмидная ДНК рСЕК 10,кодирующая синтез фрагмента Кленова ДНК-Полимеразы 1 Е.coLI,и способ ее конструирования | 1986 |
|
SU1392094A1 |
| СПОСОБ КОРРЕКЦИИ ПОСТГЕМОРРАГИЧЕСКОГО СИНДРОМА У БОЛЬНЫХ ЯЗВЕННЫМ ГАСТРОДУОДЕНАЛЬНЫМ КРОВОТЕЧЕНИЕМ | 1993 |
|
RU2082457C1 |
| US 5833950 А, 10.11.1998. | |||
Авторы
Даты
2003-10-20—Публикация
1999-06-18—Подача