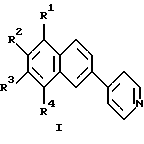
Изобретение относится к области органической химии, а именно к новому типу соединений - к 4-(2-нафтил)пиридинам общей формулы I: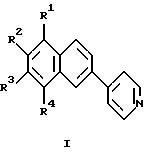
где R2 - R4 - атом водорода, низший алкил, R1 - атом водорода, низший алкил, алкиламиногруппа, диалкиламиногруппа, которые могут быть использованы в качестве люминофоров, а также в органическом синтезе в химической и фармацевтической промышленности, так как их структура открывает широкие возможности для получения разнообразных производных. Настоящее изобретение также относится к способу получения таких соединений.
Указанный тип производных пиридина, их свойства и способ получения в литературе не описаны. Заявляемый новый тип соединений имеет структуру, относящуюся к 4-нафтилпиридинам. Полученные соединения содержат неизвестное ранее сочетание таких типов связей, совокупность которых составляют фрагменты замещенного нафталина и связанного с ним фрагмента пиридина, причем нафталин связан с пиридином через положение 2, а пиридин с нафталином через положение 4, что позволяет отнести эти соединения к новому типу производных пиридина.
Изучены 4-фенилпиридин и его производные, которые широко используют в органическом синтезе, в том числе для синтеза биологически активных соединений [SU авторское свидетельство 164284, кл. С 07 D 213/10, 1964; SU, авторское свидетельство, 512209, кл. С 07 D 213/10, 1976; SU, авторское свидетельство, 527425, кл. С 07 D 213/10, 213/12, 1977; RU, патент, 2150466, кл. С 07 D 213/10, 213/12, 2000; см. также, например, Speciale S.G., Liang C.L., Sonsalla P. К. , Edwards R.H., German D.C. Neuroscience 1998, 84, 4, 1177-1185; Cassarino D.S., Parks J.К., Parker W.D., Bermet J.P. Biochim. Biophys. Acta 1999, 1453, 49-62. и др.].
Изучение люминесцентных свойств 4-фенилпиридина показало, что он не обладает люминесценцией в безводных органических растворителях (циклогексане, диэтиловом эфире, ацетонитриле, этаноле), но в присутствии воды или в кислой среде протонированная форма этого соединения флуоресцирует с квантовым выходом 0,2, а спектр флуоресценции имеет широкую бесструктурную полосу с максимумом на 380 нм [S. Hotchandani, А.С. Testa, J. Photochem. Photobiolog. A: Chem. 1991, 55, 323].
Способность незамещенного нафталина к люминесценции широко известна [Б. М. Красовицкий, Б.М. Болотин. Органические люминофоры. - М.: Химия, 1984; Р. Н. Нурмухаметов. Поглощение и люминесценция ароматических соединений. - М.: Химия, 1971]. В отличие от 4-фенилпиридина он проявляет люминесцентные свойства в безводных органических растворителях.
Известен 2-(2-нафтил)пиридин, особенностью строения которого является наличие нафталинового ядра в положении 2 пиридинового цикла и который получают взаимодействием 2-ацетилнафталина, акролеина и аммиака при 430oС в присутствии катализатора, состоящего из окиси алюминия, нитрата магния и тетрафторида титана с выходом до 70% [патент DE, 2639701 С2, кл. С 07 D 213/12, 1976]. Свойства 2-(2-нафтил)пиридина в указанном патенте не исследовались.
Интегрированный в более сложные структуры биологически активных соединений скелет 4-(2-нафтил)пиридина встречается достаточно часто [например, заявка на патент US 20010020097, A1 (C 07 D 277/82), 2001; патент US 6333351, 514/538 (С 07 С 229/06), 2001; патент US 6313152, 514/357 (А 61 К 031/44), 2001; и др. ] . Структурный остов заявляемых соединений имеет значительное сходство как с эндогенными биоактивными фенилалкил- и индолилалкиламинами, так и с экзогенным нейротоксином N-метил-4-фенилтетрагидропиридином, что позволяет рассчитывать на реализацию антагонистического действия производных 4-(2-нафтил)пиридина, в частности, в отношении природных паркинсонизм-индуцирующих аналогов соли N-метил-4-фенилпиридиния, а также эндогенных арилалкиламинов.
Задачей настоящего изобретения является создание нового типа производных пиридина - 4-(2-нафтил)пиридинов, обладающих выраженной способностью к люминесценции, что позволит использовать их в качестве люминофоров, и имеющих структуру, способную к дальнейшей химической модификации, что позволит использовать их также в качестве объекта исследований при изучении влияния различных заместителей в нафталиновом и пиридиновом циклах на люминесцентные свойства; задачей изобретения является также разработка способа получения целевых продуктов с высоким выходом из доступных веществ.
Решение поставленной задачи достигается структурой заявляемого нового типа производных пиридина общей формулы I и способом их получения, заключающимся в том, что смесь четвертичной соли 1-алкил-4-метилпиридиния и четвертичной соли 2-алкилизохинолиния или самого изохинолина подвергают взаимодействию с раствором сульфита алкиламмония или диалкиламмония и свободного основания или с раствором свободного основания и сульфитом щелочного металла при нагревании до 100-230oС с последующим выделением целевого продукта.
Описываемый способ основан на неизвестной ранее реакции трансформации цикла четвертичной соли изохинолиния II или самих изохинолинов III с участием метильной группы четвертичной соли 4-метилпиридиния IV под действием сульфитов. При этом первоначально происходит, по-видимому, присоединение сульфит-иона к пиридиновому ядру II или III, затем в результате нуклеофильной атаки метильной группы 4-метилпиридиния IV происходит раскрытие пиридинового кольца II или III с последующим замыканием его в бензольный цикл.
Образующиеся в результате реакции дезалкилирования солей изохинолиния II или не вступившие в реакцию изохинолины III могут быть снова использованы для синтеза 4-(2-нафтил)пиридинов I. Это позволяет получить выход целевых продуктов в пересчете на вступившие в реакцию изохинолиновые основания до 65%.
Пример 1. 4-(2-нафтил)пиридин.
К 542 мг (2 ммоль) иодида 2-метилизохинолиния и 470 мг (2 ммоль) иодида 1-метил-4-метилпиридиния, растворенным в 0,2 мл воды, добавляют 2,6 мл 68% раствора СН3NН3НSO3, 5,4 мл 40% водного раствора СН3NН2. Смесь нагревают в запаянной ампуле при 190oС в течение 40 часов. После вскрытия содержимое ампулы экстрагируют бензолом. Экстракт сушат MgSO4 и упаривают в вакууме. Остаток очищают методом колоночной хроматографии на SiO2 (Kieselgel 60, 0,063-0,100 mm, Merck), элюент бензол, затем бензол - этилацетат в соотношении 1:1. Выход 4-(2-нафтил)пиридина 268 мг (65%), т. пл. 104-105oС. Спектр ПМР (CDCl3, δ, м.д., J, Гц): 7,53-7,57 (м, 2Н, Н(С-6), Н(С-7)); 7,63 (д, 2 Н, Н(С-3'), Н(С-5'), J=J=4,7); 7,75 (д.д, 1Н, Н(С-3), J=8,5, J=1,7); 7,89-7,90 и 7,92-7,94 (2м, 2 Н, Н(С-5), Н(С-8)); 7,96 (д, 1 H, H(C-4), J=8,5); 8,12 (с, 1 Н, H(С-1)); 8,71(д, 2 H, H(C-2'), H(C-6'), J=J=4,7). Спектр ЯМР13С (CDCl3, δ, м.д.): 121,76 (С-3', С-5'); 124,46 (С-3); 126,37 (С-1); 126,65 и 126,78 (С-6, С-7); 127,67 и 128,39 (С-5, С-8); 128,89 (С-4); 133,37 и 133,40 (С-9, С-10); 135,32 (С-2); 148,17 (С-4'); 150,28 (С-2', С-6'). Масс спектр (m/z, Iотн, %): 205 [М]+ (100), 204 (41), 177 (11), 176 (15), 152 (11), 151 (12), 88 (11), 76 (24), 75 (10), 58 (11).
Найдено, %: С 87,96; H 5,31; N 6,65
C15H11N.
Вычислено, %: С 87,77; Н 5,40; N 6,82.
Пример 2.
Получен аналогично примеру 1 из йодида 2-метилизохинолиния и йодида 1-этил-4-метилпиридиния. Выход 4-(-2-нафтил)пиридина 59%, т. пл. 104-105oС.
Пример 3.
Получен аналогично примеру 1 из йодида 2-этилизохинолиния и йодида 1-метил-4-метилпиридиния. Выход 4-(-2-нафтил)пиридина 55%, т. пл. 104-105oС.
Пример 4.
Получен аналогично примеру 1 из йодида 2-метилизохинолиния и йодида 1-изопропил-4-метилпиридиния. Выход 4-(-2-нафтил)пиридина 58%, т. пл. 104-105oС.
Пример 5.
Получали аналогично примеру 1 из йодида 2-изопропилизохинолиния и йодида 1-метил-4-метилпиридиния. Выход 4-(-2-нафтил)пиридина 58%, т. пл. 104-105oС.
Пример 6.
Получен аналогично примеру 1 из йодида 2-изопропилизохинолиния и йодида 1-изопропил- 4-метилпиридиния. Выход 4-(-2-нафтил)пиридина 50%, т. пл. 104-105oС.
Пример 7.
Получен аналогично примеру 1 из изохинолина и йодида 1-метил-4-метилпиридиния при нагревании в течение 240 часов. Выход 4-(-2-нафтил)пиридина 48%, т.пл. 104-105oС.
Пример 8. N-метил-N-[6-(4-пиридил)-1-нафтил]амин.
Получен аналогично примеру 1 из йодида 5-гидрокси-2-метилизохинолиния и йодида 1-метил-4-метилпиридиния. После вскрытия содержимое ампулы экстрагируют горячим бензолом. Экстракт сушат MgSO4 и упаривают в вакууме. Остаток очищают методом колоночной хроматографии на SiO2 (Kieselgel 60, 0,063-0,100 mm, Merck). Градиентное элюирование от бензола к этилацетату (до 100% последнего) дало N-метил-N-[6-(4-пиридил)-1-нафтил]амин с выходом 22%, т. пл. 167-168oС. Спектр ПМР (CDCl3, δ, м.д., J, Гц): 3,07(с, 3 Н, СН3); 6,67 (д, 1 Н, Н(С-6), J=7,5)); 7,33 (д, 1 Н, Н(С-8), J=8,1); 7,46 (м, 1 Н, Н(С-7); 7,66 (д, 2 Н, Н(С-3'), Н(С-5'), J=J=4,6); 7,71 (д.д, 1 Н, Н(С-3), J=8,7, J=1,6); 7,92 (д, 1 H, H(C-4), J=8,8); 8,09 (д. 1Н, (C-1), J=1,6); 8,71 (д, 2 Н, Н(С-2'), Н(С-6'), J=J=4,6). Масс спектр (m/z, Iотн, %): 234 [M]+ (100), 233 (64), 232(21), 206 (21), 205 (21), 204 (15), 192 (40), 191 (12), 117 (24), 5 8 (22).
Найдено. %: С 81,98; H 6,00; N 11,75.
C16H14N2.
Вычислено, %: С 82,02; Н 6,02; N 11,96.
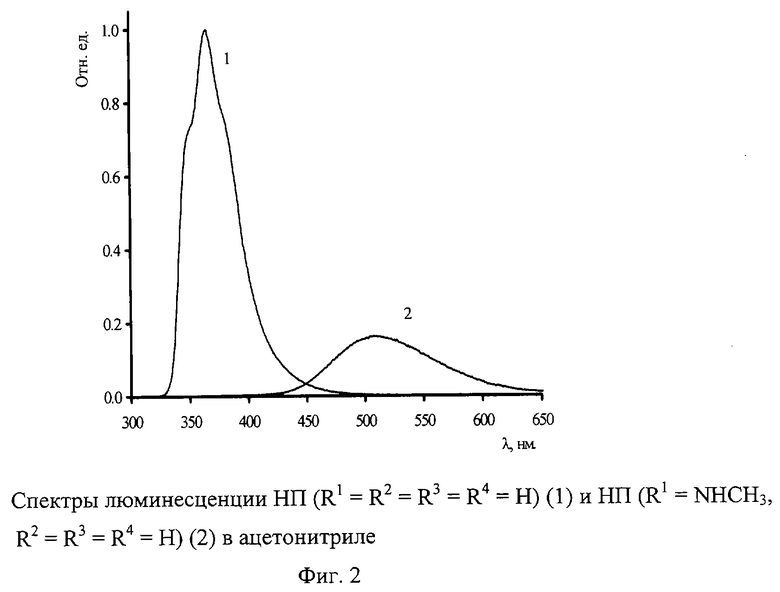
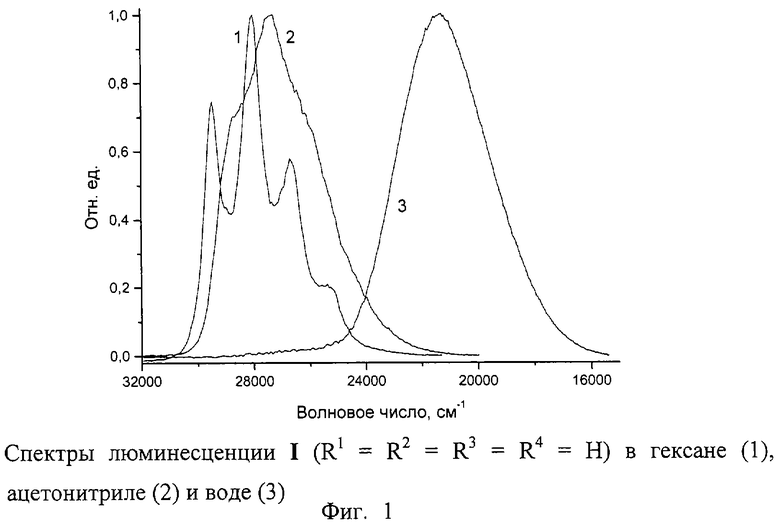
Полученные новые соединения были исследованы в качестве люминофоров. Нами было найдено, что спектры люминесценции 4-(2-нафтил)пиридинов существенно отличаются как от спектров незамещенного нафталина, так и от спектров 4-фенилпиридина. На фиг.1 в качестве примера приведены спектры люминесценции незамещенного I (R1= R2= R3=R4=Н) в гексане, ацетонитриле и воде. Из фиг.1 видно, что в отличие от 4-фенилпиридина 4-(2-нафтил)пиридин в безводных органических растворителях обладает сильной люминесценцией, которая по форме напоминает люминесценцию незамещенного нафталина в этих растворителях, но имеет значительный батохромный сдвиг за счет влияния пиридинового остатка.
Здесь следует также отметить хорошо разрешенную колебательную структуру спектра люминесценции I в гексане, что указывает на плоскую структуру I в возбужденном синглетном состоянии.
Добавление к этим органическим растворам кислоты резко изменяет спектр люминесценции за счет образования протонированной по атому азота пиридинового остатка формы I, появление которой регистрируется по изменению в спектре поглощения. Появляется интенсивная люминесценция с максимумом на 470 нм. Такая же люминесценция наблюдается в водном растворе I (фиг.1) или в другом органическом растворителе со следами воды. Эта люминесценция чувствительна к изменению рН. С ростом рН наблюдается гипсохромный сдвиг максимума люминесценции.
С другой стороны, спектры поглощения I в органических растворителях практически нечувствительны к присутствию воды.
Исследование спектров люминесценции замещенных I показало, что введение алкильных заместителей (в нафталиновый бицикл) практически не влияет на люминесцентные свойства, но введение алкил- или диалкиламиногруппы вызывает значительное смещение λмакс в длинноволновую область. Интенсивность люминесценции при этом уменьшается (фиг.2). Можно отметить, что на сегодня соединений, обладающих люминесцентными свойствами в длинноволновой области, заметно меньше, чем проявляющих коротковолновую люминесценцию.
Спектры люминесценции измеряли на спектрофлуориметрах Элюмин-2М и "Shimadzu RF-5000". Спектры поглощения измеряли на спектрофотометре Specord-M40.
Таким образом, получен новый тип производных пиридина - 4-(2-нафтил)пиридины, установлено их строение и обнаружена их ярко выраженная способность к люминесценции, что позволит использовать заявленные соединения в качестве люминофоров. Разработан способ получения заявленных соединений высокой степени чистоты и с хорошими выходами (до 65%) из доступных веществ (продукты коксохимического производства).
Заявленные соединения имеют структуру, способную к дальнейшей химической модификации, что позволит использовать их также в качестве объекта исследований при изучении влияния различных заместителей на люминесцентные свойства, что важно для разработчиков новых люминофоров, поиску которых посвящено большое количество работ [например, Б.М. Красовицкий, Б.М. Болотин. Органические люминофоры. - М.: Химия, 1984, 334 с.; Б.М. Красовицкий, Л. М. Афанасиади. Препаративная химия органических люминофоров. - Харьков: Фолио, 1997, 208 с.).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 4-АРИЛПИРИДИНОВ | 1999 |
|
RU2150466C1 |
| ТРИСДИКЕТОНАТНЫЕ КОМПЛЕКСЫ ЛАНТАНИДОВ С ЛИГАНДАМИ ПИРИДИНОВОГО РЯДА В КАЧЕСТВЕ ЛЮМИНОФОРОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2463304C1 |
| СИММЕТРИЧНЫЕ ЦИАНИНОВЫЕ КРАСИТЕЛИ С ТЕРМИНАЛЬНЫМИ АЗОТСОДЕРЖАЩИМИ ГРУППАМИ В N-ЗАМЕСТИТЕЛЯХ ГЕТЕРОЦИКЛИЧЕСКИХ ОСТАТКОВ В КАЧЕСТВЕ ЛЮМИНОФОРОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2472822C1 |
| 18(15)-КРАУН-6(5)-СОДЕРЖАЩИЕ СТИРИЛОВЫЕ КРАСИТЕЛИ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ РЕАГЕНТОВ НА КАТИОНЫ АММОНИЯ, ЩЕЛОЧНЫХ ИЛИ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2012574C1 |
| ОПТИЧЕСКИЕ СЕНСОРНЫЕ МАТЕРИАЛЫ НА КАТИОНЫ ТЯЖЕЛЫХ И ПЕРЕХОДНЫХ МЕТАЛЛОВ НА ОСНОВЕ ДИТИАКРАУНСОДЕРЖАЩИХ БУТАДИЕНИЛЬНЫХ КРАСИТЕЛЕЙ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2292368C1 |
| КРАУНСОДЕРЖАЩИЕ СТИРИЛОВЫЕ КРАСИТЕЛИ С АММОНИЙНОЙ ГРУППОЙ В N-ЗАМЕСТИТЕЛЕ ГЕТЕРОЦИКЛИЧЕСКОГО ОСТАТКА В КАЧЕСТВЕ ФОТО- И ТЕРМОЧУВСТВИТЕЛЬНЫХ СОЕДИНЕНИЙ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2278134C1 |
| ХЕМОСЕНСОРНЫЕ ОПТОМАТЕРИАЛЫ ДЛЯ ОПРЕДЕЛЕНИЯ КАТИОНОВ МЕТАЛЛОВ БОЛЬШОГО ИОННОГО РАДИУСА И ИОНОВ ДИАММОНИЯ НА ОСНОВЕ КРАУНСОДЕРЖАЩИХ БИССТИРИЛОВЫХ КРАСИТЕЛЕЙ, ИММОБИЛИЗОВАННЫХ В ПОЛИМЕРНЫЕ ПЛЕНКИ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2389745C2 |
| N-АЛКИЛАЗАКРАУНСОДЕРЖАЩИЕ СТИРИЛОВЫЕ КРАСИТЕЛИ В КАЧЕСТВЕ ОПТИЧЕСКИХ МОЛЕКУЛЯРНЫХ СЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ КАТИОНОВ ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2398800C2 |
| 5'-АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ N-АЛКИЛБЕНЗОМОНОАЗАКРАУН-СОЕДИНЕНИЙ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1999 |
|
RU2161153C1 |
| СТИРИЛОВЫЕ КРАСИТЕЛИ С АММОНИЙНОЙ ГРУППОЙ В N-ЗАМЕСТИТЕЛЕ ГЕТЕРОЦИКЛИЧЕСКОГО ОСТАТКА В КАЧЕСТВЕ ФОТОЧУВСТВИТЕЛЬНЫХ СОЕДИНЕНИЙ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2383571C1 |
Изобретение относится к новым 4-(2-нафтил)пиридинам формулы (I), где R2-R4-атом водорода, низший алкил, R1 - атом водорода, низший алкил, алкиламиногруппа, диалкиламиногруппа. Соединения формулы (I) обладают люминесценцией и могут быть использованы в качестве люминофоров. Способ получения соединений формулы (I) заключается в том, что смесь соединений формулы (II) или формулы (III) с соединением формулы (IV) подвергают взаимодействию с водным или с добавлением органических растворителей раствором сульфита алкиламмония или диалкиламмония и свободного основания или раствором свободного основания и сульфита щелочного металла при нагревании до 100-230oС. В указанных формулах R2-R4 имеют вышеуказанные значения; R5 - алкил, алкоксил; Х - анион; R6 - атом водорода или низший алкил, в случае получения соединений формулы (I), в которых R1 - атом водорода или низший алкил, или R6 представляет гидроксил, в случае получения соединений формулы (I), в которых R1 - алкиламино- или диалкиламиногруппа. 2 с.п.ф-лы, 2 ил.
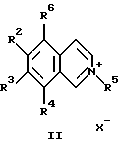
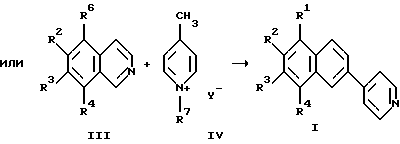
в которой R1-R4 - атом водорода, низший алкил;
R1 - атом водорода, низший алкил, алкиламиногруппа, диалкиламиногруппа.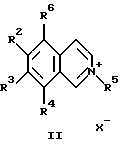
или изохинолина общей формулы III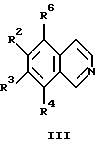
в которых R1-R4 являются такими, как определено в п.1;
R5 - алкил, алкоксил;
Х - анион;
R6 - атом водорода или низший алкил, в случае получения соединений формулы I, в которых R1 - атом водорода или низший алкил, или R6 представляет гидроксил, в случае получения соединений формулы I, в которых R1 - алкиламино- или диалкиламиногруппа,
с пиридиниевой солью общей формулы IV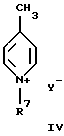
в которой R7 - алкил, алкоксил;
Y - анион,
подвергают взаимодействию с водным или с добавлением органических растворителей раствором сульфита алкиламмония или диалкиламмония и свободного основания или раствором свободного основания и сульфита щелочного металла при нагревании до 100-230oС.
| СПОСОБ ПОЛУЧЕНИЯ 4-АРИЛПИРИДИНОВ | 1999 |
|
RU2150466C1 |
| Способ получения 4-фенилпиридина | 1975 |
|
SU527425A1 |
| СПОСОБ УТИЛИЗАЦИИ КИСЛЫХ ГАЗОВ, СОДЕРЖАЩИХ СЕРОВОДОРОД И АММИАК, ПО МЕТОДУ КЛАУСА НИЖЕ ТОЧКИ РОСЫ | 2017 |
|
RU2639701C1 |
Авторы
Даты
2003-10-20—Публикация
2001-03-06—Подача