Изобретение относится к многокомпонентной системе для опосредуемого медиатором ферментативного окисления субстратов, а также к способу ферментативного окисления.
Многокомпонентные системы для опосредуемого медиатором ферментативного окисления субстратов, а также соответствующие способы в целом являются известными. В данном случае в качестве медиаторов, как правило, применяют такие соединения, которые могут быть окислены оксидоредуктазами, т.е. прежде всего субстраты ферментативных катализаторов окисления. Основное отличие таких медиаторов состоит в том, что окисленная форма медиатора (активированный медиатор, например, радикал медиатора или катион медиатора) обладает достаточно продолжительным временем жизни для того, чтобы после взаимодействия с оксидоредуктазой диффундировать в субстрат собственно окислительной системы и вступить во взаимодействие с ним. При взаимодействии активированного медиатора с субстратом последний окисляется медиатором. В результате окисления субстрата медиатор может либо регенерироваться (каталитическая окислительная система), либо инактивироваться (стехиометрическая окислительная система). Если медиатор регенерируется, то он может быть использован в новом цикле катализа. Электроны, переносимые медиатором от субстрата на оксидоредуктазу, передаются, как и в прямом ферментативном методе окисления, на конечные акцепторы электронов, такие как кислород или пероксид.
В методах, в которых в качестве конечного акцептора электронов служит пероксид (вводимый непосредственно или высвобождаемый из предшественников), в качестве оксидоредуктаз могут использоваться только пероксидазы. Несмотря на известность целого ряда таких методов, всем им присущи многочисленные недостатки.
Технология получения пероксидаз является слишком дорогостоящей для того, чтобы их можно было бы использовать в различных процессах, таких как отбеливание бумаги, или в моющих средствах. Кроме того, увеличение количества пероксидаз является проблематичным, поскольку в концентрациях, необходимых для эффективного осуществления процесса, пероксид оказывает инактивирующее действие на пероксидазу. Многие описанные в качестве медиаторов пероксидазы являются непригодными с технической точки зрения, поскольку они имеют интенсивную окраску, не безопасны в токсикологическом или экотоксикологическом отношении, не поддаются вовсе или лишь слабо поддаются биологическому разложению и не могут быть получены в достаточных количествах или достаточно дешевым методом. Поэтому методы, в которых в качестве конечного акцептора электронов служит пероксид, до настоящего времени были непригодны для рентабельного промышленного применения.
В методах, в которых в качестве конечного акцептора электронов, поступающих из окисленного субстрата, служит кислород, в качестве оксидоредуктаз используются оксидазы. Описаны две группы оксидаз, которые могут применяться в опосредуемом медиатором ферментативном методе окисления, а именно лакказы (Boubonnais и Paice, FEBS LETTERS, том. 267(1), стр. 99-102 (1990), WO 94/29510) и тирозиназы (WO 94/29510). В отличие от пероксидаз, в которых в качестве активного окислительно-восстановительного центра служит простетическая гемсодержащая группа, в случае лакказ и тирозиназ перенос электронов катализируется с помощью четырех ионов меди, содержащихся в соответствующих четырех связывающих медь доменах этих оксидаз (оксидазы "голубой меди"). При этом от медиатора отбираются один за другим в общей сложности четыре электрона, которые затем переносятся с помощью четырехэлектронного переноса на молекулы кислорода. При этом кислород восстанавливается с образованием воды, а оксидаза регенерируется и может использоваться в новом реакционном цикле. Ряд медиаторов, которые катализируют перенос электронов от окисляющегося субстрата на оксидазы, описаны, например, в WO 94/29510, WO 97/06244, WO 96/10079 или WO 95/01426.
Известно, что такие опосредуемые медиатором ферментативные методы окисления с использованием оксидаз и кислорода применяют для ожижения угля (WO 94/29510), для отбеливания целлюлозы (WO 94/29510), при органическом синтезе (Potthast и др., J. Org. Chem., том 60, стр. 4320-4321 (1995)), в качестве системы отбеливания в моющих средствах и средствах для мытья посуды (WO 97/06244), для отбеливания джинсовой ткани (WO 96/12846), для предупреждения повторного окрашивания при стирке (WO 98/23716) или для разложения полициклических ароматических углеводородов (Johannes и др., Appl. Microbiol. Biotechnol., том 46, стр. 313-317 (1996)).
Поскольку, однако, медиаторы обладают свойствами, которые находятся в противоречии с условиями технического применения, ферментативные методы окисления, основанные на применении оксидаз, имеют ряд следующих серьезных недостатков:
- гидроксибензотриазол (ГБТ), описанный в WO 94/29510 в качестве наиболее эффективного медиатора, не является биологически разлагаемым (Amann, 9-й Международный симпозиум по химии лесоматериалов и технической целлюлозы (Int. Symp. on Wood and Pulp. Chem.), F4-1 - F4-5 (1997));
- многие медиаторы, такие как ГБТ и виолуровая кислота, в своей активной форме инактивируют применяемые оксидазы (Amann, 9-й Международный симпозиум по химии лесоматериалов и технической целлюлозы (Int. Symp. on Wood and Pulp. Chem. ), F4-1 - F4-5 (1997)), и поэтому при использовании соответствующего метода имеет место большой расход фермента;
- одна из групп медиаторов, обладающих очень высокой активностью, отличается наличием группы N-О- и при этом содержит по крайней мере один атом N на молекулу медиатора (WO 94/29510). Поэтому при применении соединений, содержащих группу N-О-, возникают известные проблемы, связанные с токсичностью и биологической разлагаемостьтю. Кроме того, биологические системы очистки сточных вод в целлюлозной промышленности часто не приспособлены для переработки дополнительных N-содержащих продуктов;
- некоторые медиаторы, такие, например, как ABTS, образуют радикалы интенсивной окраски, что приводит к нежелательному окрашиванию окисляемого субстрата;
- большинство медиаторов содержат N- или S-атомы, и поэтому их получение является относительно дорогостоящим.
Эти недостатки в настоящее время ограничивают широкое промышленное применение таких систем для окисления субстратов.
У Archibald и Roy (Archibald и Roy, Appl. Environ. Microbiol., том 58, стр. 1496-1499 (1992)) описан метод, согласно которому в качестве медиатора для взаимодействия оксидазы с окисляемым субстратом служит окислительно-восстановительный каскад, состоящий из фенолов и Mn2+/Mn3+. В качестве конечного акцептора электронов используется система кислорода. В качестве оксидазы используется лакказа. Сначала лакказа окисляет фенолы, такие как мета-гидроксибензойная кислота или мета-крезол, служащие в качестве первичного субстрата. Затем в присутствии комплексообразующего вещества, такого как ионы пирофосфата, с участием окисленных фенолов может происходить вторичное окисление Mn2+ до Mn3+. Однако при этом не говорится, что для такой системы могут использоваться и нефенольные субстраты. Помимо этого не существует никаких подтверждений, что с помощью системы, в которой для окисления лигнина используются только лакказа, Мn2+ и комплексообразующее вещество, можно осуществлять делигнификацию. Эта опосредуемая медиатором система ферментативного окисления не имеет существенного технического преимущества по отношению к другим упомянутым системам, поскольку в качестве медиаторов используются только комбинации из фенолов, комплексообразующих веществ и ионов Мn, а необходимость применения фенольных медиаторов препятствует применению этого метода по токсикологическим причинам. Кроме того, практическое применение этой системы затруднено также продолжительным временем реакции, составляющем более 15 ч.
Исходя из вышеизложенного, в основу настоящего изобретения была положена задача разработать многокомпонентную систему для опосредуемого медиатором ферментативного окисления субстратов, которая не имела бы недостатков, присущих известным многокомпонентным системам, и которая, кроме того, допускала бы простую и дешевую переработку окисляемого субстрата.
Указанная задача решается с помощью многокомпонентной системы, включающей катализатор окисления, окислитель и медиатор, отличающейся тем, что
а) катализатор окисления выбирают из группы марганцевых оксидаз,
б) окислитель выбирают из группы, включающей кислород и кислородсодержащие соединения,
в) медиатор выбирают из группы соединений, содержащих ионы марганца.
Многокомпонентная система по изобретению предпочтительно включает комплексообразующее вещество, выбранное из группы комплексообразующих веществ, которые могут образовывать комплексы с ионами Мn.
В контексте настоящего изобретения под марганцевыми оксидазами понимают такие оксидазы, которые непосредственно окисляют Мn или ионы Мn и акцептированные при этом электроны переносят на кислород. Предпочтительно применяют такие оксидазы, которые обладают способностью в присутствии кислорода и комплексообразующих веществ окислять Мn2+ до Мn3+.
Предпочтительными являются марганцевые оксидазы, которые в качестве окислительно-восстановительной каталитической группы содержат ионы меди.
Марганцевые оксидазы могут быть получены, например, из известных микроорганизмов. Для этой цели такие микроорганизмы культивируют в условиях, в которых они продуцируют марганцевые оксидазы. В композиции по изобретению в качестве марганцевых оксидаз в наиболее простом случае могут применяться клеточные препараты, полученные механическим, ферментативным или химическим путем из полных микроорганизмов, содержащих марганцевые оксидазы. Однако можно также применять содержащую марганцевую оксидазу надосадочную жидкость культуры или выделенные марганцевые оксидазы.
Марганцевые оксидазы могут продуцироваться, например, такими микроорганизмами, как Leptothrix discophora, Bacillus SG-1 и Pseudomonas sp. (Nealson и др. , Metal ions and bacteria, стр. 383-341, под ред. Beveridge и Doyle, изд-во John Wiley and Sons, Inc., New York (1989)). Гены, кодирующие марганцевые оксидазы из Leptothrix discophora и Bacillus SG-1, были клонированы и секвенированы (Corstjens и др., Geomicrobiol. Journal, том 14, стр. 91-108 (1997) и van Waasbergen и др., Journal of Bacteriology, том 178(12), стр. 3517-3530 (1996)). Оба гена кодируют протеины, которые содержат присутствующую в оксидазах "голубой меди" связывающую медь последовательность мотива, и их активность в качестве марганцевых оксидаз усиливают добавлением меди.
Наряду с упомянутыми продуцирующими марганцевые оксидазы микроорганизмами в качестве источника марганцевых оксидаз также могут применяться и другие микроорганизмы. Так, например, в качестве источника ферментов в способе по изобретению могут применяться микроорганизмы, у которых марганцевые оксидазы откладываются в споры, такие как, например, Bacillus SG-1, а также выделенные споры.
Кроме того, могут применяться марганцевые оксидазы, которые получают рекомбинантным методом. Под рекомбинантным методом получения следует понимать любые методы, с помощью которых гены, кодирующие марганцевые оксидазы, выделяют из природных продуцентов и затем с помощью известных методов встраивают в соответствующие продуцирующие штаммы, которые, в частности, могут представлять собой также и исходные продуценты ферментов.
В композиции по изобретению в качестве медиатора служат ионы марганца. Их можно использовать в процессе с любой степенью окисления.
Предпочтительно применяют ионы марганца со степенью окисления +2 или +3.
Марганец со степенью окисления +2 предпочтительно применяют в виде сульфата марганца или хлорида марганца.
Марганец со степенью окисления +3 предпочтительно применяют в форме растворимого марганецсодержащего комплекса. Примерами такого марганецсодержащего комплекса являются марганец/формиат, марганец/лактат, марганец/оксалат или марганец/малонат.
Медиатор (например, ион Мn3+) акцептирует электрон у окисляемой субстанции. В результате этого субстанция окисляется, а сам ион Мn восстанавливается (например, до иона Мn2+). В этой форме ион Мn переносит акцептированный электрон на марганцевую оксидазу, отдает его и снова окисляется до исходной степени окисления (например, до иона Мn3+). Для марганцевой оксидазы окислителем служит кислород, являющийся тем самым конечным акцептором электронов.
Кислород может образовываться непосредственно в ходе реакции с помощью известных химических или ферментативной вырабатывающих кислород систем. Он может образоваться также в результате электрогидролиза воды или его можно добавлять в среду непосредственно в газообразной или жидкой форме.
Предпочтительно кислород используют либо непосредственно в газообразной форме, либо в сжиженном виде, либо в виде содержащей кислород газовой смеси, например воздуха. Особенно предпочтительно вводить кислород в виде содержащей кислород газовой смеси, такой как воздух.
Непосредственное окисление марганцевой оксидазой Мn2+ до Мn3+ предпочтительно осуществляют в присутствии комплексообразующего вещества.
В качестве комплексообразующих веществ предпочтительно применяют такие соединения, которые образуют комплексы с Mn3+ и в результате этого приобретают стабильность.
Предпочтительно применяют комплексообразующие вещества, которые не содержат азота, легко поддаются биологическому разложению и токсикологически безопасны. Такими комплексообразующими веществами являются, например, формиат, лактат, малонат или оксалат.
Система по изобретению обладает по сравнению с известными системами следующими преимуществами:
- при использовании композиции по изобретению не возникает проблема, связанная с инактивацией оксидоредуктаз, как это имеет место, например, при использовании пероксида в качестве акцептора электронов, поскольку в данном случае окислителем и конечным акцептором электронов является кислород;
- добавление кислорода в достаточных количествах является технологически простой операцией;
- марганцевые оксидазы в отличие от пероксидаз, а также марганцевых пероксидаз не требуют для своей активации присутствия простетических групп, таких как гемсодержащие группы. Поэтому марганцевые оксидазы могут быть получены без затруднений в промышленном масштабе с помощью обычных промышленных систем;
- система по изобретению не требует использования N- или S-содержащих или окрашенных либо плохо поддающихся биологическому разложению, или токсически не безопасных медиаторов. В качестве окислительно-восстановительного медиатора служат лишь ионы марганца, которые меняют две степени окисления, предпочтительно степени окисления +2 и +3. В отличие от инактивации известных медиаторов, например, в результате химической реакции, не происходит инактивация этого марганцевого медиатора.
Композиция по изобретению позволяет осуществлять окисление различных субстратов. Предпочтительно ее следует применять для окисления таких субстратов, которые могут окисляться ионами Mn. Особенно предпочтительно ее следует применять для окисления таких субстратов, которые могут окисляться ионами Mn3+.
Многокомпонентная система по изобретению может использоваться, например, в качестве отбеливающей системы в моющих средствах и средствах для мытья посуды, для отбеливания целлюлозы, для отбеливания джинсовой ткани, для обработки сточных вод, в органическом синтезе, для предупреждения повторного окрашивания при стирке или для разложения полициклических ароматических углеводородов. Еще одной возможностью применения является, например, ожижение угля. Соответствующие методы описаны в уровне техники для опосредуемых медиаторами ферментативных методов окисления с использованием оксидаз и кислорода.
Специалист легко может модифицировать известный метод с использованием представленных в настоящем описании компонентов и условий осуществления процесса, чтобы предлагаемую композицию можно было применять в указанных выше целях.
Кроме того, настоящее изобретение относится к способу окисления субстрата, отличающемуся тем, что марганцевая оксидаза в присутствии кислорода и при необходимости комплексообразутощего вещества, способного образовывать комплекс с ионами Мn, образует Мn3+ путем непосредственного окисления Мn2+, ион Мn3+ окисляет субстрат, при этом он сам восстанавливается до Мn2+ и снова может использоваться для непосредственного окисления марганцевой оксидазой.
В способе по изобретению субстрат предпочтительно применяют в форме водного раствора, смеси или суспензии.
В способе по изобретению предпочтительно применяют от 0,001 до 50 мг активной марганцевой оксидазы на литр объема реакционной смеси.
Марганцевую оксидазу предпочтительно вносят в реакционную смесь в форме гранул, в форме раствора, в форме суспензии или в сочетании с носителем.
Особенно предпочтительно марганцевую оксидазу вносят в реакционную смесь в форме суспензии, которая содержит от 0,5 до 50 мас.% фермента в неионогенном поверхностно-активном веществе.
В способе по изобретению в качестве окислительно-восстановительного медиатора предпочтительно применяют марганец со степенями окисления Мn2+ или Mn3+. Ионы марганца со степенью окисления 2+ или 3+ можно применять непосредственно в виде ионов с такой степенью окисления, или они могут быть получены в процессе реакции из ионов марганца с другими степенями окисления, такими как Mn4+ или Mn7+.
Марганец со степенью окисления +3 предпочтительно добавляют в реакционную смесь в форме растворимого марганецсодержащего комплекса, такого как марганец/формиат, марганец/лактат, марганец/оксалат или марганец/малонат.
В способе по изобретению предпочтительно применяют марганец со степенью окисления +2. Особенно предпочтительно применяют сульфат марганца или хлорид марганца.
В способе по изобретению применяют ионы марганца в концентрациях от 0,005 мМ до 50 мМ. Предпочтительно применяют ионы марганца в концентрациях от 0,05 мМ до 5 мМ и наиболее предпочтительно в концентрациях от 0,1 мМ до 1 мМ.
В зависимости от конкретного применения необходимый марганец может уже содержаться в окисляемом субстрате. Примером возможного применения способа по изобретению, в котором, как правило, не требуется добавления ионов марганца извне, является отбеливание целлюлозы. Древесина и получаемая из нее целлюлоза часто уже в естественном состоянии содержат ионы марганца в количестве, достаточном для осуществления способа окисления по изобретению.
В способе по изобретению кислород предпочтительно добавляют при парциальном давлении 0,05-5 бар. Особенно предпочтительно кислород добавляют при парциальном давлении 0,1-2,5 бара. Наиболее предпочтительно кислород добавляют при парциальном давлении 0,2-1 бар.
В способе по изобретению указанные комплексообразующие вещества предпочтительно применяют в концентрациях от 1 мМ до 500 мМ. Более предпочтительно соответствующие комплексообразующие вещества применяют в концентрациях от 5 мМ до 100 мМ и особенно предпочтительно в концентрациях от 10 мМ до 50 мМ.
Способ окисления по изобретению может применяться для окисления всех соединений, которые могут окисляться ионами Mn3+. Предлагаемый способ может применяться, например, для окисления лигнина при производстве бумаги и целлюлозы, в качестве окислительных систем в моющих средствах и средствах для мытья посуды, для ферментативного отбеливания окрашенных тканей, для ферментативного отбеливания текстиля, в качестве системы предотвращения повторного окрашивания при стирке, для специфического окисления органических молекул-мишеней в органическом синтезе, для окислительной очистки сточных вод, для разложения хлорированных углеводородов, для расщепления полициклических ароматических углеводородов и для ожижения угля.
Ниже изобретение проиллюстрировано на примерах.
Пример 1
Выделение микроорганизмов, продуцирующих марганцевую оксидазу
1.а. Выделение микроорганизмов, окисляющих марганец
Окисляющие марганец микроорганизмы, прежде всего грибы и бактерии, выделяли на индикаторных пластинах согласно методу Krumbein и Altmann (Krumbein и Altmann,  wiss. Meeresunters., том 25, стр. 347-356 (1973)).
wiss. Meeresunters., том 25, стр. 347-356 (1973)).
В присутствии ионов марганца со степенью окисления Mn3+-Mn7+ бербелиновый синий при рН 4-7 представляет собой краситель, имеющий интенсивную синюю окраску. При повышенных концентрациях на бербелиновом синем в присутствии соответствующих ионов Mn образуется окрашенный в синий цвет продукт окисления со значением рН до 10.
Для скрининга на планшетах питательную среду дополняли бесцветным бербелиновым синим (N, N'-диметиламино-п,п'-трифенилметан-о"-сульфоновая кислота). При концентрациях 10-4-10-5 г бербелинового синего на 100 мл питательной среды еще не происходит ингибирования роста бактерий.
Для выделения гетеротрофных окисляющих марганец бактерий использовали следующую среду:
3,5 г/л бакто-пептона Difco,
0,8 г/л MnSO4•H2O,
100 мг/л FeSO4•7H2O,
15 г/л бакто-агара Difco,
750 мл морской воды,
245 мл дистиллированной воды,
10 мл маточного раствора бербелинового синего (4 г/л),
рН 7,6.
На такие индикаторные пластины наносили содержащие бактерии образцы, такие как образцы морской воды, образцы осадочных отложений, образцы почвы, образцы из отвалов руды и т.д. в соответствующих разведениях или концентрациях таким образом, чтобы на одной индикаторной пластине росло 100-300 отдельных колоний.
Бактерии, которые после инкубации в течение 5-10 дней на таких индикаторных пластинах образовывали колонии синего цвета (т.е. активность в отношении окисления марганца связана с клетками) или вокруг колоний которых в надосадочной жидкости образовывались синие ореолы (т.е. окисляющие марганец ферменты выделялись в надосадочную жидкость культуры), подвергали дальнейшему анализу.
1. б. Подтверждение присутствия марганцевых оксидаз в микроорганизмах, окисляющих бербелиновый синий
Микроорганизмы, которые выделяли согласно описанному в 1.а методу, могут продуцировать марганцевые оксидазы, однако синяя окраска также может быть вызвана марганцевыми пероксидазами или окислением Fe2+. Активность марганцевых оксидаз выявляли согласно методу, описанному Boogerd и de Vrind (Boogerd и de Vrind, J. Bacteriol., том 169(2), стр. 489-494 (1987)):
Сначала исследуемые микроорганизмы выращивали в течение 10 дней каждый раз в 1 л не содержащей агара и бербелинового синего среды, используемой для выделения. Затем клетки отделяли путем центрифугирования (15 мин, 10000•g, 4oС). Клеточный дебрис, полученный из клеток, которые образовывали колонии синего цвета на описанных в 1.а индикаторных пластинах, подвергали гель-электрофорезу согласно описанному ниже методу. Для клеток, которые на индикаторных пластинах образовывали ореолы синего цвета, не содержащую клеток надосадочную жидкость концентрировали до одной пятидесятой первоначального объема путем ультрафильтрации с использованием УФ-мембраны, удерживающей частицы с молекулярной массой более 10000 Да. Концентрат или клеточный дебрис смешивали с равным объемом буфера (0,125 М Трис/Cl, рН 6,8, 20% глицерина, 2% ДСН, 10% 2-меркаптоэтанола, 0,01% бромфенолового синего). Аликвоты по 50 мкл таких смесей разделяли путем электрофореза на 10%-ном полиакриламидном геле. После электрофореза гель промывали четыре раза в течение 15 мин деионизированной водой. Затем гель инкубировали в течение 2 ч в 100 мкМ MnCl2 в 10 мМ Hepes-буфере, рН 7,5. В результате этой процедуры в образцах, содержащих марганцевые оксидазы, в области, где после электрофореза в геле были локализованы марганцевые оксидазы, образовывался осадок оксида марганца коричневого цвета. Обнаруженное таким путем образование оксида марганца было обусловлено непосредственно марганцевыми оксидазами, окисляющими Mn2+, поскольку пероксид отсутствовал и в образце не присутствовали другие ионы, отличные от Mn2+.
Пример 2
Получение и выделение марганцевых оксидаз
Согласно описанному в примере 1 методу могут быть выделены изоляты Bacillus, которые в своих спорах имеют отложения марганцевой оксидазы. Для технических применений такие содержащие марганцевую оксидазу споры использовали непосредственно или содержащие марганцевую оксидазу оболочки спор сначала подвергали обработке, после чего использовали. Такие споры или оболочки спор получали следующим образом.
Культивирование
Для получения содержащих марганцевую оксидазу спор соответствующий штамм Bacillus культивировали в аэробных условиях при 25oС в следующей среде:
2 г/л пептона (фирма Difco), 0,5 г/л дрожжевого экстракта (фирма Difco), 10 мкг/л Fe-ЭДТК, 100 мкг/л стерилизованного фильтрацией MnCl2•4H2O в 50 мМ Трис в 80%-ной природной морской воде, рH 7,0.
После культивирования в течение 10 дней более 95% всех клеток образуют споры.
Обработка спор
Споры собирали путем центрифугирования (30 мин, l0000•g, 4oС), промывали деионизированной водой и суспендировали в 10 мМ Трис/Cl, рH 7,0 (0,1 г/мл). Для получения оболочек спор этот продукт подвергали дальнейшей обработке согласно описанному ниже методу. Если в способе по изобретению использовались непосредственно споры, то их подвергали дальнейшей обработке следующим образом.
К суспензии добавляли 50 мкг/мл лизоцима, продукт инкубировали в течение 30 мин при 37oС, после чего споры промывали 1 М NaCl, 0,15 M NaCl, 0,1%-ным ДСН и пять раз деионизированной водой. Очищенные таким образом споры хранили в деионизированной воде при 4oС до применения согласно изобретению.
Получение оболочек спор
Всю процедуру, если не указано иное, проводили при комнатной температуре. За исключением 1%-ного раствора ДСН и используемой для промывки деионизированной воды все растворы содержали 10 мМ ЭДТК, рН 7,5 и фенилметилсульфонилфторид (ФМСФ) (0,3 мас.%). Очищенные споры суспендировали согласно описанному выше методу в 10 мМ Трис, рН 7,0 (0,1 г/мл) и к ним добавляли равные объемы стеклянных бусинок (диаметром 10-50 мкм). Затем суспензию в течение 15 мин с 30-секундными интервалами при 0oС облучали ультразвуком с максимальной амплитудой в ультразвуковом устройстве для разрушения клеток (фирма Sonifier). После обработки суспензию инкубировали в течение 5 мин на льду и затем надосадочную жидкость отделяли от добавленных к ней стеклянных бусинок. После этого стеклянные бусинки дважды промывали 10 мМ Трис с рН 7,0 в объеме, равном их объему. Объединяли первую надосадочную жидкость и надосадочные жидкости, полученные после процедуры промывки, и центрифугировали в течение 15 мин при 15000•g. Затем отделяли надосадочную жидкость, осадок суспендировали в 10 мМ Трис, рН 7,5 и в течение 30 мин обрабатывали при 37oС лизоцимом (100 мкг/мл). Продукт еще раз центрифугировали в течение 15 мин при 15000•g. Осадок, содержащий оболочки спор, промывали 1 М NaCl, 0,14 М NaCl, 1%-ным ДСH и 5 раз деионизированной водой.
2.б. Марганцевая оксидаза из Leptothrix discophora
Согласно описанному в примере 1 методу могут быть получены изоляты образующих чехол (влагалище) микроорганизмов, таких как Leptothrix discophora, которые продуцируют марганцевые оксидазы. Такие изоляты могут быть получены также из коммерческих коллекций штаммов (Leptothrix discophora ATCC 51168, Leptothrix discophora ATCC 51169). Особенно пригодными для получения марганцевых оксидаз являются штаммы Leptothrix discophora, которые утратили способность образовывать чехол. Такие штаммы возникают спонтанно, если образующие чехол штаммы непрерывно в течение продолжительного времени культивируют в лабораторных условиях (Adams и Ghiorse, Arch. Microbiol., том 145, стр. 126-135 (1986)). Такие производные, утратившие способность образовывать чехол, секретируют марганцевые оксидазы в культуральную среду.
В следующем примере описано получение в надосадочной жидкости культуры и выделение из нее марганцевых оксидаз с использованием утратившего способность образовывать чехол штамма Leptothrix discophora, депонированного в соответствии с Будапештским договором в немецкой коллекции микроорганизмов и клеточных культур (DSMZ GmbH, D-38124, Брауншвейг) под регистрационным номером DSMZ 12667.
Культивирование:
Для получения марганцевой оксидазы Leptothrix discophora культивировали в среде, включающей следующие компоненты на литр деионизированной воды:
0,25 г/л пептона Difco,
0,25 г/л дрожжевого экстракта Difco,
0,25 г/л глюкозы,
0,6 г/л MgSO4•7H2O,
0,07 г/л CaCl2•H2O,
0,015 г/л MgSO4•4H2O.
Перед автоклавированием среды значение рН доводили до 7,6 с помощью 1 М раствора NaOH.
Для получения марганцевой оксидазы 45 л описанной среды инфицировали двумя литрами предварительной культуры Leptothrix discophora в такой же среде. Культивирование осуществляли в течение 40 ч при 26oС при пропускании воздуха (0,2 объема воздуха/объем среды/мин).
Получение фермента из надосадочной жидкости культуры:
Через 40 ч культивирование прекращали. Клетки Leptothrix discophora отделяли от надосадочной жидкости культуры путем центрифугирования. Содержащую марганцевую оксидазу надосадочную жидкость, в которой отсутствовали клетки, концентрировали до объема 0,5 л путем ультрафильтрации с использованием УФ-мембраны, удерживающей частицы с молекулярной массой более 10000 Да. Сконцентрированную надосадочную жидкость использовали в качестве источника марганцевых оксидаз в приведенных ниже примерах.
Пример 3
Количественная оценка активности марганцевых оксидаз с помощью N,N,N', N'-тетраметил-пара-фенилендиамина (ТМФД)
Ионы Mn3+ обладают способностью окислять бесцветное соединение ТМФД. Продукт окисления, "вустерский синий", имеет интенсивную синюю окраску, усиление этой окраски может быть оценено фотометрическим путем при длине волны 610 нм.
Процедура измерений:
Для каждого измерения готовили свежий маточный раствор ТМФД, представляющий собой 2,1 мМ раствор ТМФД в дистиллированной воде. Предназначенные для оценки препараты ферментов разбавляли в 10 мМ HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) (рН 7,5) таким образом, чтобы оптическая плотность (ОП610), измеряемая при длине волны 610 нм в течение 10-минутного периода с помощью описанной ниже процедуры оценки активности, находилась в интервале 0,5-1,5.
В качестве источника марганца служил 10 мМ раствор MnSO4 в дистиллированной воде.
Для определения активности марганцевой оксидазы в образцах ферментов параллельно каждый раз смешивали 3 мл разбавленного раствора фермента в HEPES (см. выше) с 0,3 мл маточного раствора ТМФД. К одному из параллельных образцов в момент времени 0 добавляли 10 мкл маточного раствора MnSO4. Оба образца смешивали и инкубировали в течение 10 мин при 40oС. Через 10 мин образцы центрифугировали в течение короткого промежутка времени (15 с, 5000 об/мин), после чего определяли ОП610 в образце надосадочной жидкости объемом 1 мл, содержащем MnSO4. В качестве контроля служил сравнительный образец, не содержащий MnSO4. Усиление абсорбции при 610 нм на 1,0 соответствует образованию 100 мкМ "вустерского синего". За 1 единицу (1 ед) марганцевой оксидазы принимали такое количество фермента, которое приводит в течение 1 мин к образованию 1 мкМ "вустерского синего" из ТМФД.
Для проведения измерений, описанных ниже, применяли каждый раз концентрированную содержащую марганцевую оксидазу надосадочнуго жидкость культуры из примера 2. б и 50 мкл суспензии оболочек спор из примера 2.а. Были получены следующие результаты:
Фермент из - ОП610
Leptothrix discophora - 1,03
Bacillus - 0,85
Пример 4
Окисление находящегося в гомогенном состоянии субстрата, представляющего собой вератриловый спирт, в зависимости от различных концентраций марганца и комплексообразующего вещества
Процедура:
Из субстрата, представляющего собой вератриловыи спирт (3,4-диметоксибензиловый спирт (фирма Aldrich)) готовили маточный раствор в этаноле (0,25 г/мл).
Реакцию окисления проводили при 45oС при слабом перемешивании. Для этого каждый раз в 22,23 мл раствора, включающего комплексообразующее вещество (50 мМ формиат, лактат, малат или оксалат; во всех случаях при значении рН 7,5), смешивали с MnSO4(0,00, 0,05, 0,50 мМ MnSO4). Затем каждый раз добавляли по 0,268 мл маточного раствора вератрилового спирта. Смеси давали прийти в равновесное состояние в течение 10 мин при 45oС, затем начинали реакцию путем добавления 2,5 мл раствора фермента (марганцевая оксидаза из Leptothrix discophora, 10 ед/мл).
Через 8 ч реакционную смесь анализировали с помощью ЖХВР на предмет образования вератрилового альдегида. Для этого 0,8 мл тестируемой смеси смешивали с 0,4 мл раствора H2SO4 (0,5 моля/л). 20 мкл этого образца вносили в разделительную колонку LiChospher 60 RP Select B (Merck 50940) и элюировали смесью Н2О/МеОН (65:35). Скорость потока при этом составляла 1 мл/мин. Продукт в элюате обнаруживали с помощью УФ-детектора при длине волны 275 нм.
В табл. 1 представлены количества (в %) вератрилового спирта, которые согласно способу по изобретению в указанных ниже условиях окислялись в течение 8 ч до вератрилового альдегида.
Пример 5
Отбеливание целлюлозы
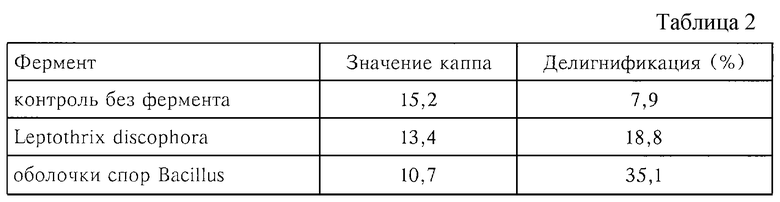
Подвергнутую делигнификации с помощью кислорода крафтцеллюлозу из древесины мягких пород с содержанием лигнина, характеризующегося значением каппа 16,5, промывали и с помощью 30 мМ Na-оксалатного буфера (рН 7,5) доводили до концентрации целлюлозы 5%. После этого добавляли MnSO4 (0,5 мМ). Суспензию гомогенизировали в течение 60 с с помощью соответствующей мешалки. Затем в два параллельных образца добавляли каждый раз по 5 ед марганцевой оксидазы (Leptothrix, Bacillus) на 1 г целлюлозы. Третий образец, в который не добавляли фермент, служил в качестве контроля. Образцы еще раз гомогенизировали в течение 60 с и помещали в стальной автоклав, в котором может поддерживаться определенная температура и который может продуваться газом. Автоклав закрывали, устанавливали давление кислорода на уровне 3 бара и проводили инкубацию в автоклаве в течение 4 ч при 45oС. Затем выгружали реакционную смесь. Целлюлозу промывали 10 объемами проточной воды с температурой 50oС, после чего из целлюлозы при 70oС с помощью водного щелочного раствора NaOH экстрагировали фрагменты лигнина. Для экстракции использовали 20 г NaOH на 1 кг целлюлозы. После экстракции целлюлозу снова промывали 10 объемами проточной воды с температурой 50oС. Затем согласно стандартному методу SCAN-C 1: 77 "Скандинавского совета по древесной массе и бумаге" определяли содержание лигнина в образцах целлюлозы, характеризующееся так называемым значением каппа (см. табл.2).
По сравнению с контрольным образцом применение способа окисления по изобретению позволяет дополнительно увеличить степень делигнификации на 10,9-27,2%.
Пример 6
Предотвращение повторного окрашивания
Опыты для подтверждения возможности предотвращения повторного окрашивания с помощью окислительной системы по изобретению проводили в обогреваемых стеклянных стаканах (объемом 100 мл). В качестве контроля использовали смесь, представляющую собой раствор 0,25 г имеющегося в продаже моющего средства в 50 мл воды. Опыты с марганцевой оксидазой проводили в 50 мл 30 мМ Na-малонатного буфера (рН 7,5), содержащего 0,5 мМ МnSO4. Смеси объемом 50 мл сначала нагревали до 45oС, а затем в эти смеси, содержащие буфер, добавляли при необходимости каждый раз по 0,5 ед/мл марганцевой оксидазы. В смеси помещали образцы ткани из хлопка (каждый по 5 г), а затем к каждой смеси добавляли 10 мл предварительно нагретого до 45oС раствора, содержащего 15 мкМ Cibacron Marine C-B (фирма Ciba) в качестве тестируемого красителя. После выдержки в течение 1 ч при 45oС образцы ткани извлекали из смесей и промывали каждый раз 1 л проточной воды при температуре 50oС.
Затем образцы ткани промывали и сушили. После этого спектроскопическим методом оценивали светлость исходных образцов и обработанных образцов.
В табл. 3 приведено сравнение светлости обработанных образцов хлопчатобумажной ткани и необработанных образцов:
Приведенные в таблице данные свидетельствуют о том, что окислительная система по изобретению позволяет предупреждать перенос внесенных частиц красителя на образцы хлопчатобумажной ткани. Этот эффект по своему качеству сопоставим с действием имеющихся в продаже моющих средств.
Пример 7
Выведение пятен (применение в качестве моющего средства)
Для демонстрации эффективности предлагаемого способа по выведению пятен проводили опыты стиркой. Для этого на образцах хлопчатобумажной ткани белого цвета (7,5•7,5 см) создавали стандартные (нормированные) загрязнения путем нанесения капель объемом по 0,3 мл водного раствора, содержащего 100 част. /млн красителя Эванса синего (полученного от компании Wako Pure Chemical Industry Co., Осака). Затем эти образцы ткани в стеклянных стаканах (объемом 100 мл), имеющих подогрев, при перемешивании (магнитная мешалка) обрабатывали согласно изобретению марганцевой оксидазой, MnSO4 и соответствующим комплексообразующим веществом в присутствии кислорода. В качестве контроля служили растворы, в которых а) использовался только малонатный буфер или которые б) не содержали MnSO4, или в которые в) не добавляли марганцевую оксидазу.
Опыты проводили в 50 мл 30 мМ Na-малонатного буфера (рН 7,5) с добавлением 0,5 мМ MnSO4 и соответственно без добавления MnSO4. Растворы объемом 50 мл сначала нагревали до 45oС, затем в растворы, которые должны были содержать марганцевую оксидазу, добавляли каждый раз по 1 ед/мл марганцевой оксидазы из Bacillus, соответственно из Leptothrix. В растворы вносили загрязненные образцы хлопчатобумажной ткани. После выдержки в течение 1 ч при 45oС образцы текстильной ткани извлекали из растворов и каждый промывали 1 л проточной воды при температуре 50oС. Затем образцы текстильной ткани сушили.
Для определения различий в окраске образцов по сравнению с контрольным образцом, тестированным без добавления марганцевой оксидазы и MnSO4, с помощью дифференциального колориметра (типа CR-200, фирма Minolta) измеряли значения Y, у и х высушенных на воздухе образцов. Для оценки отбеливающего эффекта, достигаемого способом по изобретению, вычисляли значение коэффициента Z (Z=(1-x-y)Y/y).
В табл.4 представлены характеристики степени белизны тестированных образцов по сравнению с характеристиками степени белизны контрольных образцов без использования фермента и MnSO4.
Из представленных в таблице данных видно, что степень белизны образцов с использованием марганцевых оксидаз и MnSO4 на 1,6 и 2,7 пункта выше, чем 30 образцов без использования фермента и без использования MnSO4.
Пример 8
Органический синтез
В представленном ниже примере рассмотрена возможность использования способа по изобретению для направленного синтеза органических соединений.
а) Окисление спиртовых групп до альдегидов
В 22 мл 30 мМ раствора малоната, рН 7,5, содержащего 0,5 мМ MnSO4, добавляли при 45oС 269 мг (1,6 ммоля) 3,4-диметоксибензиловото спирта в 1 мл этанола. После выдержки в течение 10 мин добавляли марганцевую оксидазу (40 ед). После проведения реакции в течение 24 ч реакционный раствор экстрагировали хлороформом и исследовали с помощью ЯМР-спектроскопии. В том случае, когда присутствовала марганцевая оксидаза из Leptothrix, выход 3,4-диметоксибензальдегида составлял 32%, а в том случае, когда присутствовала марганцевая оксидаза из Bacillus, выход 3,4-диметоксибензальдегида составлял 27%.
б) Окисление спиртов до кетонов
В 22 мл 30 мМ раствора малоната, рН 7,5, содержащего 0,5 мМ МnSО4, добавляли при 45oС 196 мг (1,6 ммоля) 1-фенилэтанола. После выдержки в течение 10 мин добавляли марганцевую оксидазу (40 ед). После проведения реакции в течение 24 ч реакционный раствор исследовали с помощью ЖХВР. В том случае, когда присутствовала марганцевая оксидаза из Leptothrix, выход ацетофенона составлял 17%, а в том случае, когда присутствовала марганцевая оксидаза из Bacillus, выход ацетофенона составлял 19%.
В обоих примерах установлена возможность успешного применения способа окисления по изобретению для синтеза определенных соединений. Использованные субстраты в данном случае служат лишь в качестве примеров для демонстрации окислительных возможностей способа и не ограничивают диапазон возможных синтезируемых продуктов.
Пример 9
Отбеливание джинсовой ткани
Вырезанный квадратный кусок окрашенной джинсовой ткани (9 г/160 см2) выдерживали при 45oС в закрытом стакане объемом 500 мл в общем объеме жидкости 11,5 мл с марганцевой оксидазой, 0,2 мМ MnSO4 и 15 мМ раствора комплексообразующего вещества (оксалат). Значение рН смеси составляло 7,0 (15 мМ оксалат). На 1 г ткани добавляли 10 ед марганцевой оксидазы. После выдержки в течение 4 ч куски ткани промывали проточной водой до тех пор, пока промывочная вода не становилась бесцветной. Куски ткани сушили в плоской сушилке, затем разглаживали и оценивали с помощью оптического спектрофотометра.
Степень отбеливания определяли с помощью спектрофотометра типа СМ 3700d (фирма Minolta) согласно инструкциям производителя. Измерения проводили без глянца и без УФ. Светлость образцов оценивали в виде процента общей отражательной способности по сравнению со стандартом белизны (R 457). Величина L* представляет собой меру светлости (белый=100, черный=0).
Данные для обработанной ткани сравнивали с данными для необработанной контрольной ткани. Изменение светлости (ΔL*) образцов по сравнению с необработанными контролями рассчитывали с помощью программного обеспечения РР2000 (фирма Opticontrol):
- ΔL*
Контроль - 0
Leptothrix - 23,14
Bacillus - 28,72
Изменение светлости ΔL*, составляющее примерно 5, уже может быть 20 определено визуально, т.е. использование обеих марганцевых оксидаз позволяет достичь значительного отбеливающего эффекта.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕРМЕНТАТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ЭЛЕКТРОПРОВОДЯЩИХ ПОЛИМЕРОВ | 2010 |
|
RU2446213C2 |
| КАТАЛИЗАТОР ОКИСЛЕНИЯ МОНООКСИДА УГЛЕРОДА | 2000 |
|
RU2180610C1 |
| Тест-полоска для определения содержания этилового спирта в крови электрохимическим способом с помощью портативной амперометрической ячейки | 2019 |
|
RU2713111C1 |
| СПОСОБ ДЛЯ БЫСТРОЙ ОБРАБОТКИ СТОЧНЫХ ВОД И СОСТАВ ДЛЯ НЕГО | 2011 |
|
RU2617937C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДАЗ ГРИБА MICROTHIELAVIA OVISPORA VKM F-1735, ОБЕСЦВЕЧИВАЮЩИХ ПРОМЫШЛЕННЫЕ КРАСИТЕЛИ БЕЗ МЕДИАТОРА | 2021 |
|
RU2773712C1 |
| КОМПОЗИЦИЯ, ОТВЕРЖДАЕМАЯ ОКИСЛЕНИЕМ | 2014 |
|
RU2651357C2 |
| СПОСОБ ОБЕСКИСЛОРОЖИВАНИЯ ВОДЫВСЕСОЮЗНАЯ- , -•- , f -• • • .! i* S ^ -' 1 • ' *" /*' I S !*, П.1:>&П'и-и;(п;1';Ь.НйН БИВЛ;'Ю'ГЕКА | 1971 |
|
SU321476A1 |
| ФЕРМЕНТАТИВНОЕ СРЕДСТВО ДЛЯ КРАШЕНИЯ | 2001 |
|
RU2311898C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИТНОГО МАТЕРИАЛА ДЛЯ ЭЛЕКТРОДА СУПЕРКОНДЕНСАТОРА | 2012 |
|
RU2495509C1 |
| СПОСОБ ГАЛЬВАНИЧЕСКОГО ОСАЖДЕНИЯ ПОКРЫТИЙ ИЗ ЦИНКА И ЦИНКОВОГО СПЛАВА ИЗ ЩЕЛОЧНОЙ ВАННЫ ДЛЯ НАНЕСЕНИЯ ПОКРЫТИЯ С ПОНИЖЕННЫМ РАЗЛОЖЕНИЕМ ОРГАНИЧЕСКИХ ДОБАВОК В ВАННЕ | 2018 |
|
RU2724765C1 |



Изобретение относится к биотехнологии; многокомпонентная система для опосредуемого медиатором ферментативного окисления включает а) катализатор окисления, который выбирают из группы марганецзависимых оксидаз, б) окислитель, который выбирают из группы, включающей кислород и кислородсодержащие соединения, в) медиатор - из группы соединений, содержащих ионы Mn. Способ окисления субстрата марганецзависимой оксидазой протекает в присутствии кислорода и ионов Мn. Изобретение обеспечивает простую и дешевую переработку окисляемого субстрата. 2 с. и 9 з.п. ф-лы, 4 табл.
| OKAZAKI, M | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| US 5691193 A, 25.11.1997 | |||
| WO 9209741 А, 11.06.1992. | |||
Авторы
Даты
2004-02-20—Публикация
2000-02-17—Подача