Область техники, к которой относится изобретение.
Изобретение относится к биотехнологии, в частности к способу получения оксидаз гриба Microthielavia ovispora VKM F-1735, показана способность оксидаз культуральной жидкости указанного штамма обесцвечивать промышленные красители без использования медиаторов.
Возможно применение оксидаз, продуцируемых штаммом гриба предлагаемым способом, в технологиях, применяемых в пищевой и текстильной промышленностях, рыбовладельческих хозяйствах, очистке сточных вод, косметологии, создании биосенсоров и тест-систем без дополнительных затрат, связанных с использованием медиаторов.
Уровень техники.
Промышленные красители трифенилметанового ряда и азокрасители, являются ароматическими соединениями, часто используемыми в текстильной, бумажной и пищевой промышленностях, при производстве пластмасс и для нужд бактериологии, микроскопии и ветеринарии [1-3]. Загрязнение воды и почвы этими веществами происходит в результате выброса промышленных отходов или сброса неочищенных сточных вод текстильных, деревообрабатывающих и пищевых предприятий, рыбных хозяйств и заводов по производству красителей [4-9]. Попадая в водные экосистемы, красители адсорбируются на твердых поверхностях, а также на тканях и органах живых организмов [7, 10]. Человек и животные, употребляющие пищевые продукты, содержащие красители, подвергаются токсичному, канцерогенному, тератогенному и мутагенному влияниям некоторых красителей и промежуточных продуктов их разложения [7]. Присутствие красителя в воде приводит к уменьшению водного биоразнообразия, блокируя прохождение солнечного света через воду и создавая проблемы для фотосинтеза водных растений и водорослей [7, 11].
Одним из наиболее известных промышленно ценных ферментов, которые окисляют широкий спектр ароматических субстратов, являются лакказы (ЕС 1.10.3.2, n-дифенол: оксидоредуктазы кислорода, фенолоксидазы, голубые оксидазы), активно используемые в современных биотехнологиях, количество которых с каждым годом неуклонно растет [12-16]. Обладая высоким окислительно-восстановительным потенциалом и, как следствие, широкой субстратной специфичностью, а также стабильностью, грибные лакказы имеют значительные преимущества перед бактериальными лакказами и лакказоподобными ферментами [15-17]. Являясь внеклеточными ферментами, оксидазы грибов более устойчивы к условиям окружающей среды (солям, растворителям, поверхностно-активным веществам, рН среды, температуре и т.д.) по сравнению с внутриклеточными ферментами, что объясняет удобство использования оксидаз в промышленных процессах, протекающих в нефизиологических условиях [12-16]. Использование лакказ в биотехнологиях для деградации промышленных красителей перспективно из-за низких энергетических затрат и снижения степени загрязнения окружающей среды по сравнению с известными физико-химическими методами деградации красителей [1, 3, 7].
Большинство известных грибных лакказ эффективно обесцвечивает промышленные красители только в присутствии медиатора, требующего дополнительных затрат [12, 13]. Благодаря высокой адаптации и толерантности к условиям окружающей среды аскомицеты и их лакказы/оксидазы наиболее привлекательны для технологии биоремедиации почв и водных ресурсов, загрязненных стойкими промышленными красителями. Согласно литературным данным в настоящий момент имеется скудная информация о лакказах аскомицетов, эффективно обесцвечивающих красители в отсутствие каких-либо редокс-медиаторов: лакказы грибов Paraconiothyrium variabile [18], Setosphaeria turcica [19] и Arthrographis sp.[20, 21].
Лакказа гриба Paraconiothyrium variabile с молекулярным весом 84 kDa была выделена из культуральной жидкости гриба, полученной после 10 суток погруженного культивирования на богатой углеводами среде, содержащей мясной пептон - 5.0 г/л, казеиновый пептон - 5.0 г/л, D(+)глюкозу - 20.0 г/л и индукторы лакказ (250 мкМ CuSO4⋅5H2O and 100 мкМ 2,5-ксилидин [18]. 60.5% обесцвечивание 60 мг/л малахитового зеленого наблюдалось в присутствии 4 Ед/мл чистого фермента при 30°С при рН 5.0 после 15 мин инкубирования. Недостатком данной работы является необходимая для получения лакказного препарата сложная среда, включающая дорогие компоненты, а также проведение дополнительных стадий очистки для получения конечного препарата. Также не уточняется концентрация фермента и субстрат для определения активности ферментного препарата в реакционной смеси, что затрудняет проводить сравнение.
Рекомбинантная лакказа Stlac2 (100 мг/мл с удельной активностью 127.78 Ед/мг в реакции с АБТК в качестве субстрата) из Setosphaeria turcica с молекулярным весом 100 kDa, наиболее активная при рН 4.5 и 60°С, была способна обесцвечивать за 3 часа инкубирования до 80%, 70% и 45% малахитового зеленого в концентрациях 20, 50 и 100 мг/л, соответственно в оптимальных условиях реакции [19] без использования медиатора. Наиболее быстрая скорость деколоризаци наблюдалась в первые 15 мин инкубирования. Дальнейшее инкубирование реакционной смеси приводило к быстрому ингибированию обесцвечивания красителя. Таким образом, 100% обесцвечивание не было достигнуто в ходе эксперимента. Активность рекомбинантной лакказы Stlac2 в отношении других промышленных красителей не показана.
Исследована продукция лакказы грибом Arthrographis sp.и ее способность к обесцвечиванию промышленных красителей [20, 21]. Культивирование гриба проводили 12-15 сут в среде (пептон 0.1-2% (w/v), дрожжевой экстракт 0.25-0.5% (w/v), КН2РО4 - 0.01-0.25%, MgCl2 - 0.0001-0.05% (w/v), глюкоза - 1-5% (w/v)), содержащей индукторы лакказной активности: CuSO4⋅5H2O в концентрации 0.0025-0.025% (w/v) или 100-1000 μΜ 2,5-ксилидина после 72 ч культивирования. Ультрафильтрат культуральной жидкости (с конечной активностью 100 Ед/мл в реакции с АБТК) 50 мг/л азокрасителей в отсутствии и в присутствии 5.0 мМ гидроксибензотриазола в качестве медиатора, инкубировали при 30°С 12 ч при рН 4.0. 90% обесцвечивание акридинового оранжевого, бриллиантового синего, цибаркона синего, бенгальского розового, эритрозина, малахитового зеленого, нейтрального красного, ремазол бриллиантового синего, Конго красного наблюдалось после 24 ч инкубирования красителя с культуральной жидкостью без медиатора. Лакказа, выделенная из культуральной жидкости, имела молекулярную массу 63 кДа и рН-оптимум активности в диапазоне рН 3.0-6.0. Недостатком данной работы является дорогостоящий многокомпонентный состав среды для культивирования гриба с целью получения лакказной активности, а также длительность достижения максимальной лакказной продукции гриба. 100% разложения также не было достигнуто при более высокой рабочей активности лакказы (100 Ед/мл).
На сегодняшний день известны лакказы двух представителей рода Thielavia. Так внеклеточная лакказа из Thielavia sp.имела молекулярную массу около 70 кДа и максимальную активность в реакциях с АВТК и 2,6-диметоксифенолом при рН 5.0 и 6.0, соответственно, а также оптимальную температуру 70°С [22]. Очищенный фермент (3 Ед/мл в реакции с 2,6-диметоксифенолом) показал 90% обесцвечивание 50 мг/л RBBR (Ремазола бриллиантового синего R) в отсутствие редокс-медиатора после 24 ч инкубирования при 30°С. Обесцвечивающая активность фермента в отношении других промышленных красителей не исследовалась. Лакказа была очищена из 3-х суточной культуральной жидкости гриба, выращенного в богатой углеводами среде - мальт экстракте. Очищенный ферментный препарат получали в 3 стадии очистки: ультрафильтрации с мембраной 10 кДа, анионо-обменной хроматографии с использованием колонки HiTrap QFF (5 mL, GE Healthcare) и катионо-обменной хроматографии на колонке HiTrap SPFF (5 mL, GE Healthcare), что делает способ получения более дорогим.
Несколько рекомбинантных лакказ из гриба Thielavia arenaria (синоним Canariomyces arenarius) были получены и охарактеризованы [23]. Лакказы этого гриба имели молекулярную массу около 80 кДа и были наиболее активны предпочтительно при рН от 4.5 до 6.5 и при температурах от 40 до 50°С. Была показана способность лакказ Thielavia arenaria к отбеливанию джинсовой ткани в присутствии медиаторов в течение 24 часов инкубирования. Информации о деколоризующей активности выделенной лакказы в отношении других промышленных красителей не представлено в литературе.
Рекомбинантная лакказа аскомицета Thielavia arenaria RF5597 с молекулярным весом 80 кДа была наиболее активна при 60-70°С в диапазоне рН 5.0-7.0 [24, 25]. Лакказа с активностью 20-200 нкат/мл была способна обесцвечивать ткани, окрашенные индигокармином, ремазолом бриллиантовым синим, цибарконом бриллиантовым красным исключительно только в присутствии медиатора.
Большинство из описанных способов погруженного культивирования аскомицетов с целю получения лакказной активности требуют дорогостоящих источников углерода и энергии (глюкоза, пептон, дрожжевой экстракт, мальт экстракт, мясо-пептонный бульон), индукторов лакказ (солей меди и ароматических соединений), а также длительного культивирования и дорогостоящих этапов очистки. В некоторых случаях для достижения эффективной деколоризации красителей лакказами необходимы дорогостоящие редокс-медиаторы.
Информация о лакказах или оксидазах грибов вида Microthielavia {Thielavia) ovispora на сегодняшний день полностью отсутствует.
Сущность изобретения.
Технической задачей, на решение которой направлено предлагаемое изобретение, является разработка способа получения оксидаз штамма гриба Microthielavia ovispora VKM F-1735, обесцвечивающих промышленные красители без медиаторов.
Предложен способ получения оксидаз штамма гриба Microthielavia ovispora VKM F-1735, активно обесцвечивающих промышленные красители в отсутствие медиаторов, характеризующийся тем, что погруженное культивирование штамма гриба Microthielavia ovispora VKM F-1735 проводят в минеральной среде с добавлением в качестве натурального источника углерода и энергии размельченных семян гороха до получения максимальной лакказной активности в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
Натуральный источник углерода и энергии берут в концентрациях 20-80 г/л. Причем преимущественно в качестве натурального источника углерода и энергии применяют горох.
При этом культивирование мицелия гриба осуществляют в минеральной среде следующего состава (г/л): ΝΗ4ΝO3 - 0,2; KН2РO4 - 0,2; K2НРO4 - 0,02; MgSO4⋅7H2O - 0,12.
Культуральную жидкость гриба отделяют от мицелия центрифугированием.
Используемый в качестве продуцента оксидазы штамм гриба Microthielavia ovispora VKM F-1735 получен из коллекции ВКМ ИБФМ РАН.
Контроль за ходом культивирования штамма проводят по лакказной активности культуральной жидкости, которую определяют по степени окисления 1 мкМ АБТК (ε436=29300 M-1см-1) в 20 мМ Na-ацетатном буфере, рН 5.0 [26].
Измерения проводят в кварцевой кювете (1 см) при 25°С на спектрофотометре Shimadzu UV-160 (Япония) при 436 нм. За единицу активности лакказы принимают скорость превращения 1 мкМ субстрата 1 мл культуральной жидкости за 1 мин.
В частности, культивирование проводят в 100 мл минеральной среды в медицинских колбах объемом 750 мл при 29°С и перемешивании (200 об/мин) в течение 4 суток с конечным выходом лакказной активности в культуральной жидкости гриба 1.6 Ед/мг (в реакции с АБТК) в среде, содержащей 80 г/л размельченных семян гороха.
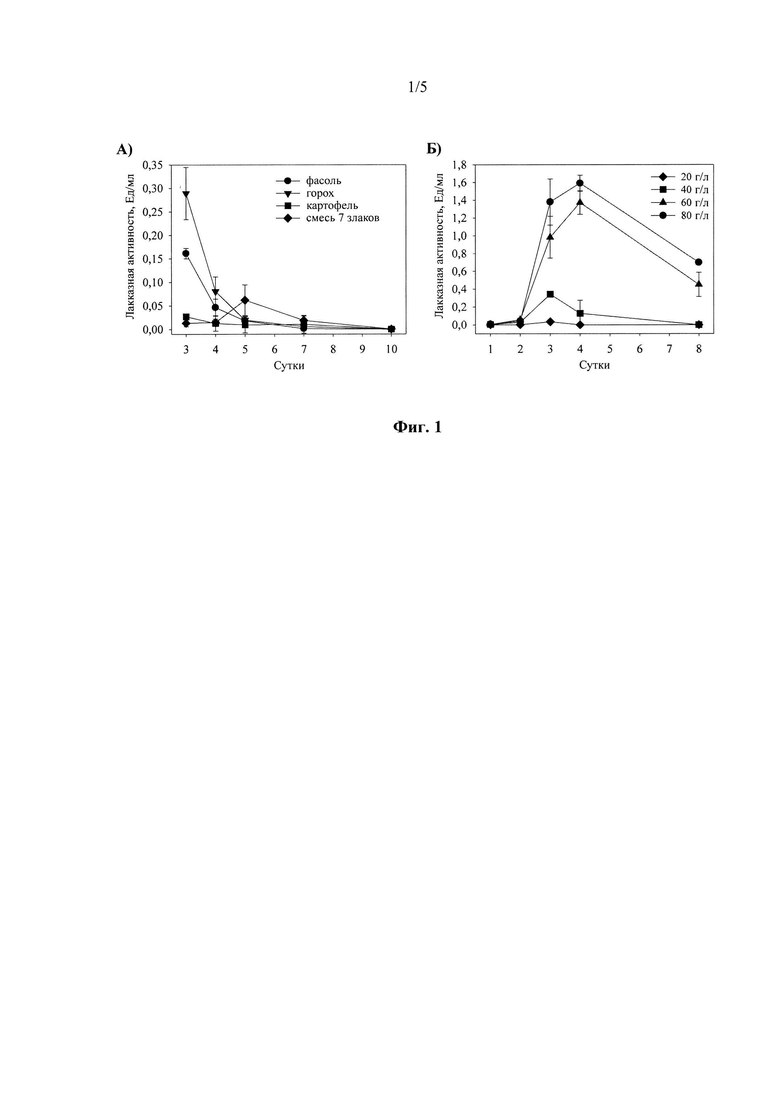
Исходя из среды обитания штамма гриба М. ovispora VKM F-1735 (паразит растений, выделен из ризосферы дуба) тестирование различных источников углерода и энергии растительного происхождения в концентрации 20 г/л (картофель, семена гороха и фасоли, смесь семян 7 зерновых культур (рожь, пшеница, овес, ячмень, гречиха, рис и кукуруза)) позволило выявить максимальную лакказную активность гриба при погруженном культивировании в присутствии размельченных семян гороха (Фиг. 1А)
Тестирование различных концентраций размельченных семян гороха (20, 40, 60 и 80 г/л) позволило выявить оптимальную концентрацию субстрата (80 г/л), при которой наблюдалась максимальная лакказная активность (1.6 Ед/мл в реакции с АБТК) культуральной жидкости штамма на 4-е сут погруженного культивирования гриба (Фиг. 1Б).
Проведенная в настоящей работе оптимизация условий погруженного культивирования М. ovispora VKM F-1735 в присутствии натуральных источников углерода и энергии (семян зерновых и бобовых культур и картофеля) не имеет аналогов для других представителей родов Microthielavia и Thielavia.
В описании известных способов [18-25] нет совпадений со способом, предлагаемым авторами изобретения, в том числе используются и иные штаммы грибов.
Культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде, использовалась для исследования рН-оптимума, субстратной избирательности продуцируемых оксидаз, активности и стабильности оксидаз при различных температурах, рН, в присутствие органических растворителей и детергентов (Фиг. 2), влияния солей на активность оксидаз (Таблица 1), а также трансформации и обесцвечивания промышленных красителей (Фиг. 3-5).
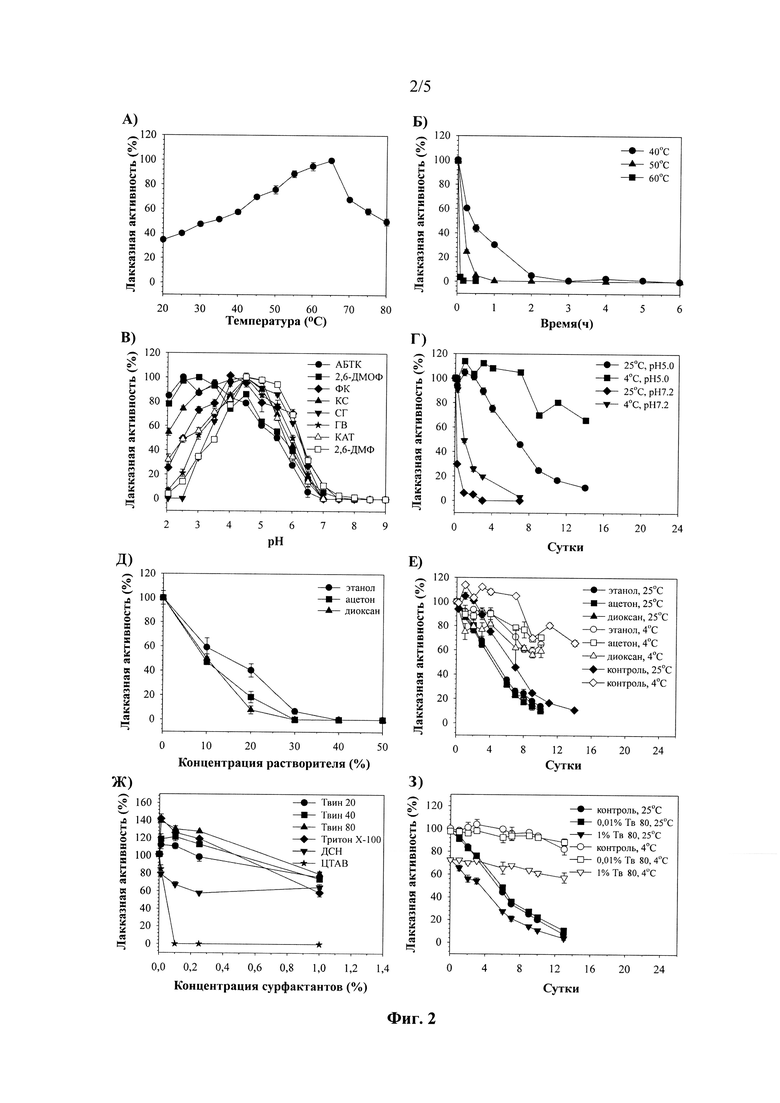
Лакказная активность культуральной жидкости наблюдалась в протестированном диапазоне температур 20-80°С. Максимальная лакказная активность культуральной жидкости достигалась при 65°С (Фиг. 2А). Время полужизни оксидаз культуральной жидкости гриба в ходе инкубировании при 40 и 50°С составило 0.45 и 0.15 ч, соответственно (Фиг. 2Б). При 60°С полная потеря лакказной активности культуральной жидкостью наблюдалось через 0.15 ч инкубирования.
Оксидазы культуральной жидкости гриба М. ovispora VKM F-1735 были активны в диапазоне рН 2.0-7.5 в отношении всех протестированных субстратов лакказ (Фиг. 2В). рН-оптимум окисления АБТК культуральной жидкости штамма гриба находился в области рН 2.5. Максимальная активность оксидаз гриба с 2,6-диметоксифенолом, 2,6-диметилфенолом, сирингалдазином, конифериловым спиртом, гваяколом и катехолом зарегистрирована при рН 4.5. Оптимальное окисление феруловой кислоты оксидазами культуральной жидкости гриба М. ovispora VKM F-1735 проходило при рН 4.0.
Период полу-жизни оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 при инкубации в буфере с рН 5.0 составил более 2 недель при 4°С и около 6 часов - при комнатной температуре (Фиг. 2Г). Снижение оксидазной активности культуральной жидкости грибов на 50% наблюдалось при рН 7.2 через 4 часа в ходе инкубации при комнатной температуре и 1 день - при 4°С (Фиг. 2Г).
Этанол, ацетон и диоксан ингибируют оксидазы культуральной жидкости гриба М. ovispora VKM F-1735 при увеличении концентрации растворителя (Фиг. 2Д). Полная инактивация оксидаз наблюдалась при использовании 30% диоксана и ацетона или 40% этанола. Хранение культуральной жидкости гриба в присутствии 10% органических растворителей приводило к снижению ее лакказной активности на 50% после 5 дней хранения при комнатной температуре и на 40% - при 4°С после 10 дней хранения (Фиг. 2Е)
Ионные детергенты в среде ингибировали активность оксидаз гриба М. ovispora VKM F-1735 с ростом концентрации детергента (Фиг. 2Ж). Неионные детергенты в концентрациях 0,01-0,25% оказывали активирующее действие на оксидазы гриба. Максимальные активирующие эффекты на активность оксидаз наблюдались для Твина 80 и Тритона XI00 - до 140 и 144% активности, соответственно (Фиг. 2Ж). Повышение концентрации неионных детергентов в среде приводило к ингибированию активности оксидаз М. ovispora VKM F-1735. Хранение культуральной жидкости М. ovispora VKM F-1735 в присутствии различных концентраций Твина 80 показало отсутствие какого-либо влияния на стабильность оксидаз при снижении уровня лакказной активности культуральной жидкости на 30% при увеличении концентрации Твина до 1%. (Фиг. 2З).
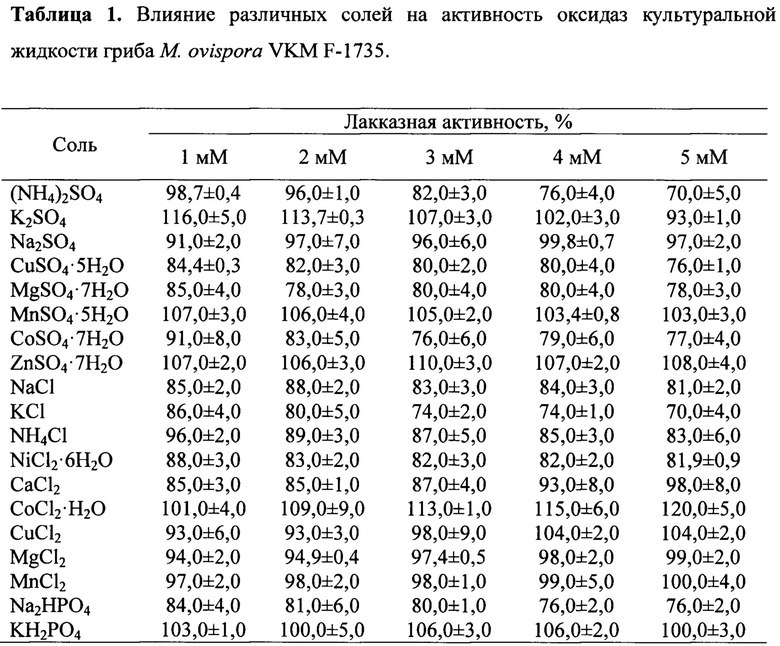
Исследование влияния различных солей в концентрациях 1-5 мМ на лакказную активность культуральной жидкости М. ovispora VKM F-1735 (Таблица 1) показало различный эффект солей на активность оксидаз. Наличие 9 протестированных солей в среде (Na2SO4, MnSO4⋅5H2O, ZnSO4⋅7H2O, NaCl, CuCl2, CaCl2, KH2PO4, MgCl2; MnCl2) не приводило к значительным изменениям в активности оксидаз гриба. Другая группа солей ингибировала оксидазы на 0.2-30.0% с увеличением концентрации соли ((NH4)2SO4, CuSO4⋅5H2O, CoSO4⋅7H2O, MgSO4⋅7H2O, NH4Cl, KCl, CoSO4⋅7H2O, NiCl2⋅6H2O, Na2HPO4). Соли третьей группы незначительно активировали оксидазы: 1 мМ K2SO4 повышал лакказную активность культуральной жидкости на 16%, а 5 мМ СоС12⋅Н2O - на 20%.
В настоящей работе впервые показана продукция оксидаз представителем рода Microthielavia, активно окисляющих промышленные красители с их последующей деколоризацией.
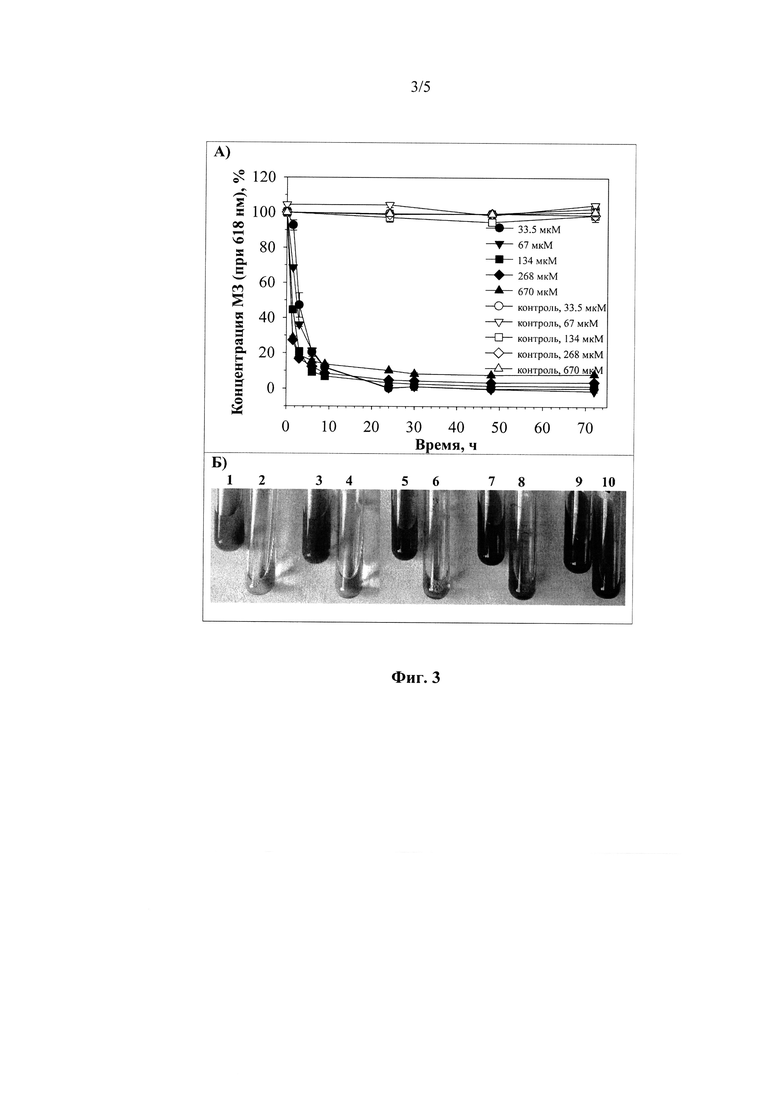
Оксидазы культуральной жидкости М. ovispora VKM F-1735 (0.26 Ед/мл) способны окислять малахитовый зеленый (МЗ) в отсутствие какого-либо редокс-медиатора (Фиг. 3). Исследование динамики обесцвечивания МЗ (33,5 мкМ (12,5 мг/л), 67 мкМ (25 мг/л), 134 мкМ (50 мг/л), 268 мкМ (100 мг/л) и 670 мкМ (250 мг/л)) оксидазами культуральной жидкости гриба в ходе инкубации при 29°С показали, что через 6 часов более 90% всех испытанных концентраций МЗ обесцвечивались по сравнению с контрольными вариантами. Причем 50% обесцвечивание красителя достигалось после 1.0-2.9 ч инкубации реакционной смеси. Полное обесцвечивание достигалось через 30 ч инкубации.
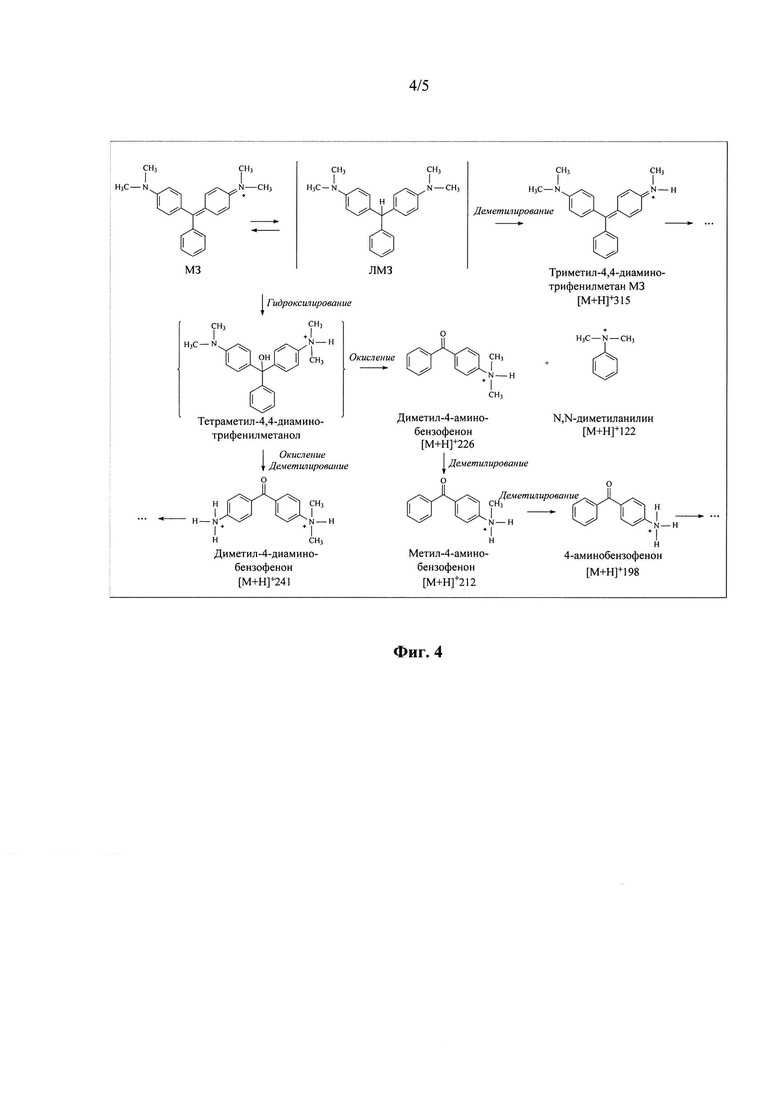
В ходе трансформации малахитового зеленого оксидазами культуральной жидкости гриба М. ovispora VKM F-1735 найдено 6 соединений - интермедиатов последовательного гидроксилирования, деметилирования и окисления МЗ, появляющихся и исчезающих в реакционной смеси, что свидетельствует о полной деградации токсичного красителя: [М+Н]+122(78%), 123(100%), 121(36%), 93(61%); [М+Н]+198(100%), 199(55%), 197(89%), 179(50%), 169(20%), 120(20%), 105(81%); [М+Н]+212(86%), 134(31%), 105(100%); [М+Н]+226(47%), 148(22%), 105(100%); [М+Н]+241(100%), 226(73%), 105(9%); [М+Н]+315(100%), 300(79%), 237(92%), 208(75%), 194(48%) (Фиг. 4).
Авторами было показано, что полученный оксидазный препарат гриба М. ovispora VKM F-1735 способен деколоризовать из 21 протестированного промышленного красителя (в концентрации 670 мкМ) 5 соединений в отсутствии редокс-медиатора: малахитовый зеленый, бромфеноловый синий, бромкрезоловый зеленый, арсеназо III, эриохром черный (Фиг. 5). Еще 8 красителей оксидазы культуральной жидкости гриба были способны трансформировать с усилением или изменением окраски: бриллиантовый зеленый, фуксин, Кумасси синий, генциан фиолетовый, Конго красный, Судан черный, Судан желтый, эозин (Фиг. 5).
Таким образом, оксидазы, продуцирующиеся в ходе погруженного культивирования гриба М. ovispora VKM F-1735, способны осуществлять трансформацию широкого спектра промышленных красителей без дополнительного использования медиаторов, что удешевляет процесс деколоризации или трансформации красителей и дает возможность применения оксидаз в технологии биоремедиации почв и водных ресурсов, загрязненных стойкими промышленными красителями, в пищевой и текстильной промышленностях, рыбовладельческих хозяйствах, косметологии, для создания биосенсоров и тест-систем без дополнительных затрат, связанных с использованием медиаторов.
Работа поддержана Фондом содействия развитию малых форм предприятий в научно-технической сфере (проект №15500ГУ/2020, в рамках программы "УМНИК-2019").
Перечень фигур.
Фиг. 1 Динамика лакказной активности гриба Microthielavia ovispora VKM F-1735 при погруженном культивировании в присутствии 20 г/л различных источников углерода и энергии (А) и различных концентраций размельченных семян гороха (Б).
Фиг. 2 Влияние различных условий среды на активность и стабильность оксидаз культуральной жидкости Microthielavia ovispora VKM F-1735: А и Б -температурные эффекты; В и Г - рН-эффекты; Д и Ε - действие органических растворителей; Ж - влияние различных ионных и неионных детергентов на активность оксидаз, 3 - - влияние Твина 80 на стабильность оксидаз. Сокращения: АБТК - 2,2'-азино-бис (3-этилбензотиазолин-6-сульфоновая кислота); 2,6-ДМОФ -2,6-диметоксифенол; ФК - феруловая кислота; КС - конифериловый спирт; СГ -сирингалдазин; ГВ - гваякол; КАТ - катехол; 2,6-ДМФ - 2,6-диметилфенол, ЦТАБ -цетилтриметиламмония бромид, ДСН - додецилсульфат натрия, Тв 80 - Твин 80.
Фиг. 3 Обесцвечивание малахитового зеленого в различных концентрациях оксидазами культуральной жидкости Microthielavia ovispora VKM F-1735, измеренное спектрофотометрически при 618 нм (А), и видимое обесцвечивание МЗ в соответствующих экспериментальных пробирках через 9 часов инкубации (Б: 1, 3, 5, 7 и 9 - контрольные варианты, содержащие 33.5, 67, 134, 268 и 670 мкМ МЗ соответственно; 2, 4, 6, 8 и 10 - экспериментальные варианты, содержащие культуральную жидкость М. ovispora VKM F-1735 и МЗ в концентрации 33.5, 67, 134, 268 и 670 мкМ, соответственно).
Фиг. 4 Предположительные пути трансформации малахитового зеленого оксидазами гриба Microthielavia ovispora VKM F-1735 (М3-малахитовый зеленый, ЛМ3-лейкомалахитовый зеленый).
Фиг. 5 Тестирование деколоризующей активности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 на основе хромогенной реакции в отношении 670 мкМ промышленных красителей (после 24 часов инкубирования): 1 - малахитового зеленого, 2 - бриллиантового зеленого, 3 -фуксин, 4 - бромфеноловый синий, 5 - Кумасси синий, 6 - генциан фиолетовый, 7 -бромкрезоловый зеленый, 8 - Конго красный, 9 - Судан черный, 10 - Судан желтый, 11 - арсеназо III, 12 - амидо черный, 13 - эриохром черный, 14 - феноловый красный, 15 - крезоловый красный, 16 - толуидиновый синий, 17 - метиленовый синий, 18 - эритрозин, 19 - флуоресцеин, 20 - эозин, 21 - резазурин.
Сведения, подтверждающие возможность осуществления изобретения.
Пример 1. Культивирование гриба Microthielavia ovispora VKM F-1735 с использованием свежеразмельченных семян фасоли в качестве единственного источника углерода и энергии с целью повышения лакказной активности гриба.
С целью хранения культуру гриба поддерживали в пробирках со скошенным глюкозо-картофельным агаром (глюкоза - 10 г/л, свежий мелко-натертый картофель 200 г/л, агар - 20 г/л) и хранили при 4°С.
Инокулят грибной культуры выращивали в медицинских колбах объемом 750 мл при перемешивании (200 об/мин) в течение 7 суток при 29°С в 100 мл соево-глицериновой среды [27]. Среда содержала (г/л): ΝΗ4ΝO3 - 0.2, KН2РO4 - 0.2, K2НРO4 - 0.02, MgSO4⋅7H2O - 0.1, пептон - 0.5, соевую муку - 0.5 и глицерин - 4.0, рН 5.0. Полученный мицелий вносили в медицинские колбы объемом 750 мл из расчета 10 мл гомогенизированного мицелия на 100 мл среды.
Погруженное культивирование грибного мицелия Microthielavia ovispora VKM F-1735 осуществляли в медицинских колбах объемом 750 мл (перемешивание 200 об/мин, 29°С) в 100 мл жидкой минеральной среды (ΝΗ4ΝO3 - 0,2; KН2РO4 - 0,2; K2НРO4 - 0,02; MgSO4⋅7Н2O - 0,12 г/л), содержащей в качестве источника углерода свежеразмельченные семяна фасоли в концентрации 20 г/л (Фиг. 1А). Культивирование гриба проводили 3 суток по достижении максимальной лакказной активности в культуральной жидкости гриба - 0.153 Ед/мл.
Пример 2. Культивирование гриба Microthielavia ovispora VKM F-1735 с использованием размельченных семян гороха в качестве единственного источника углерода и энергии.
Культивирование штамма гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян гороха 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 0.258 Ед/мл (Фиг. 1А).
Пример 3. Культивирование гриба Microthielavia ovispora VKM F-1735 с использованием свежих мелко-натертых клубней картофеля в качестве источника углерода и энергии.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л свежих мелко-натертых клубней картофеля 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 0.03 Ед/мл (Фиг. 1А).
Пример 4. Культивирование гриба Microthielavia ovispora VKM F-1735 с использованием смеси размельченных семян 7 зерновых культур (рожь, пшеница, овес, ячмень, гречиха, рис и кукуруза) в качестве единственного источника углерода и энергии.
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л смеси размельченных семян 7 зерновых культур осуществляли 5 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 0.07 Ед/мл (Фиг. 1 А).
Пример 5. Культивирование штамма Microthielavia ovispora VKM F-1735 с использованием свежеразмельченных семян гороха в качестве единственного источника углерода и энергии с целью повышения лакказной активности гриба.
Погруженное культивирование гриба проводили, как описано в примере 1, в присутствии свежеразмельченных семян гороха в различных концентрациях (Фиг. 1Б):
1) в присутствии 20 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 0.03 Ед/мл;
2) в присутствии 40 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 0.37 Ед/мл;
3) в присутствии 60 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 1.4 Ед/мл;
4) в присутствии 80 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 1.6 Ед/мл.
Пример 6. Определение температурного оптимума оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735.
Измеряли спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) температурный оптимум культуральной жидкости гриба в кварцевой кювете с длиной оптического пути 10 мм при 25°С в 20 мМ Na-ацетатном буфере с рН 5.0.
В качестве субстрата использовали 0.1 мМ АБТК в реакционной смеси. Лакказную активность культуральной жидкости гриба с АБТК определяли по скорости образования продукта с использованием коэффициента молярной экстинкции ε436=29300 Μ-1см-1 [26]. За единицу активности лакказы принимали среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости. Реакцию начинали добавлением в реакционную смесь культуральной жидкости гриба М. ovispora VKM F-1735.
Для исследования температурного оптимума оксидаз использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
Максимальная лакказная активность культуральной жидкости гриба Μ ovispora VKM F-1735 зарегистрирована при 65°С (Фиг. 2А).
Пример 7. Определение стабильности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 при различных температурах.
Измерение лакказной активности образцов проводили, как описано в примере 6.
Для исследования стабильности оксидаз в зависимости от температуры использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
Термостабильность оксидаз исследовали путем измерения лакказной активности культуральной жидкости (с начальной активностью 0.14 Ед/мл без температурной обработки) с помощью АБТК после предварительной инкубации ферментного препарата при 40, 50 и 60°С. Ферментные препараты готовили путем разведения исходной культуральной жидкости в 20 мМ Na-ацетатном буфере (рН 5.0) или 50 мМ трис-HCl (рН 7.2) до конечной лакказной активности 0.14 Ед/мл. 100 мкл подготовленного ферментного препарата добавляли в 900 мкл 20 мМ Na-ацетатный буфер с рН5.0, содержащий 0.1 мМ АБТК в 1 мл кювете при 25°С.Лакказная активность необработанного температурой ферментного препарата принималась за 100%.
100 мкл предварительно обработанной культуральной жидкости М. ovispora VKM F-1735 добавляли к 900 мкл 20 мМ Na-ацетатного буфера (рН 5.0), содержащего 0.1 мМ АБТК в кювете объемом 1 мл при 25°С. Лакказная активность необработанной культуральной жидкости (0.14 Ед/мл в реакционной смеси с АБТК) принималась за 100%.
Максимальная стабильность оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 была получена при хранении ферментного препарата при рН 5.0 и 4°С (Фиг. 2Г).
Пример 8. Определение рН-оптимума оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735.
рН-оптимум культуральной жидкости гриба измеряли спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) в кварцевой кювете с длиной оптического пути 10 мм при 25°С в универсальном Бриттон-Робинсон буфере [28] в интервале рН от 2.5 до 9.0. Бриттон-Робинсон буфер был получен смешиванием 0.1 Μ борной, 0.1 Μ ортофосфорной и 0.1 Μ уксусной кислот.
В качестве субстратов использовали 0.01 мМ АБТК, сирингалдазин, 2,6-диметоксифенол, 2,6-диметилфенол, конифериловый спирт, феруловую кислоту, катехол и гваякол (Фиг. 2 В).
Активность культуральной жидкости гриба с субстратами определяли по скорости образования продуктов с использованием коэффициентов молярной экстинкции (для АБТК - ε436=29300 М-1см-1 [26], для 2,6-диметоксифенола - ε470=35645 М-1см-1 [29], 2,6-диметилфенола - ε420=13360 M-1см-1 [30], сирингалдазина - ε525=65000 М-1см-1 [31], катехола - ε392=1456 М-1cm-1 [32], гваякола - ε436=6400 Μ-1см-1 [29]) или по скорости окисления субстрата (конифериловый спирт - ε263=13090 M-1см-1 [33]; феруловая кислота - ε287=12483 Μ-1см-1 [29]).
За единицу активности лакказы принимали среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости. Реакцию начинали добавлением в реакционную смесь культуральной жидкости штамма М. ovispora VKM F-1735.
Для исследования рН-оптимума лакказной активности использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
рН-оптимум окисления АБТК оксидазами культуральной жидкости гриба М. ovispora VKM F-1735 находился в области 2.5.
Максимальная активность оксидаз гриба с 2,6-диметоксифенолом зарегистрирована при рН 4.5.
С сирингалдазином оксидазы культуральной жидкости штамма наиболее активны при рН 4.5.
Максимальное окисление кониферилового спирта оксидазами культуральной жидкости гриба осуществлялось при рН 4.5.
Оптимальное окисление феруловой кислоты оксидазами культуральной жидкости гриба осуществлялось при рН 4.0.
рН-оптимум окисления 2,6-диметилфенола оксидазами культуральной жидкости гриба находился в районе 4.5.
Максимальная лакказная активность культуральной жидкости гриба с катехолом зарегистрирована при рН 4.5.
С гваяколом максимальная активность оксидаз культуральной жидкости гриба наблюдалась при рН 4.5.
Пример 9. Определение рН-стабильности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735.
рН-стабильность оксидаз гриба определяли путем измерения остаточной лакказной активности предварительно разведенной исходной культуральной жидкости гриба М. ovispora VKM F-1735, полученной, как описано выше (Пример 6) после продолжительной инкубации ферментного препарата в 20 мМ Na-ацетатном буфере (рН 5.0) или трис-HCl буфере (рН 7.2) в стерильных условиях при 25 и 4°С, соответственно (Фиг. 2Г).
Ферментный препарат получали путем разведения исходной культуральной жидкости в 20 мМ Na-ацетатном буфере (рН 5.0) или трис-HCl буфере (рН 7.2) до конечной удельной лакказной активности препарата 0.14 Ед/мл. Полученные препараты стерилизовали посредством шприцевых фильтров Whatman с диаметром пор мембраны 0.2 мкм, разделяли на аликвоты по 1.0 мл в пробирки объемом 1.5 мл и инкубировали в соответствующих условиях. Использовали не менее трех образцов для каждого условия.
Для измерения активности лакказы 100 мкл инкубированного раствора фермента добавляли к 900 мкл 20 мМ Na-ацетатного буфера (рН 5.0), содержащего 0.1 мМ АБТК, перемешивали, окисление тестировали спектрофотометрически, как описано выше.
Максимальная стабильность оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 зарегистрирована при инкубировании в 20 мМ Na-ацетатном буфере (рН 5.0) при 4°С. Время полу-жизни оксидаз составило 14 суток.
Пример 10. Определение активности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 в присутствие органических растворителей.
Измерение лакказной активности образцов проводили, как описано в примере 6.
Для исследования активности оксидаз в зависимости от концентрации различных органических растворителей использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
Активность оксидаз культуральной жидкости грибов измеряли в 20 мМ Na-ацетатном буфере (рН 5.0) в присутствии 0.1 мМ АБТК (в качестве субстрата), различных концентраций органических растворителей (0, 10, 20, 30, 40 и 50%) и культуральной жидкости с конечной активностью лакказы 0.14 Ед/мл (без растворителя) в 1 мл кювете при 25°С, как описано выше. В качестве растворителей использовали этанол, ацетон и диоксан. Оксидазную активность культуральной жидкости гриба в отсутствие органического растворителя принимали за 100%.
Среди всех протестированных органических растворителей минимальное ингибирующее действие на оксидазы гриба М. ovispora VKM F-1735 показано для этанола (Фиг. 2Д). Полная инактивация оксидаз культуральной жидкости наблюдалось при 30% диоксане или ацетоне и при 40% этаноле.
Пример 11. Определение стабильности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 в присутствие 10% органических растворителей.
Измерение лакказной активности образцов проводили, как описано в примере 6.
Стабильность оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 определяли путем измерения их остаточной лакказной активности в реакции с 0.1 мМ АБТК в 20 мМ Na-ацетатном буфере (рН 5.0) в кювете при 25°С после продолжительной инкубации культуральной жидкости М. ovispora VKM F- 1735 в присутствии 10% (ν/ν) органических растворителей (этанола, диоксана или ацетона).
Экспериментальные растворы ферментов включали культуральную жидкость гриба с конечной лакказной активностью 0.14 Ед/мл (в отсутствие органического растворителя) и 20 мМ Na-ацетатный буфер (рН 5.0), содержащий 10% (ν/ν) органический растворитель. Полученные препараты фильтровали с использованием шприцевых фильтров Whatman 0.2 мкм, делили на аликвоты по 1 мл в 1.5 мл пробирки типа Эппендорфф и инкубировали при 25 или 4°С, соответственно.
Использовали не менее трех образцов для каждого условия. Для измерения остаточной активности лакказы 100 мкл каждого из инкубированных растворов ферментов добавляли к 900 мкл 20 мМ Na-ацетатного буфера (рН 5.0), содержащего 0.1 мМ АБТК в кювете и перемешивали при 25°С. Активность регистрировали спектрофотометрически, как описано выше. Оксидазную активность культуральной жидкости гриба в начальной точке эксперимента принимали за 100%
В ходе инкубирования оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 в присутствии 10% органических растворителей наблюдалось снижение их активности, при этом большая активность оксидаз сохранялась при 4 °С (Фиг. 2Е). Максимальная стабильность оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 наблюдалась в присутствие 10% ацетона при 4°С: 70% остаточной активности зарегистрировано после 10 суток инкубирования (Фиг. 2Е).
Пример 12. Определение активности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 в присутствие различных детергентов.
Измерение лакказной активности образцов проводили, как описано в примере 6.
Для исследования активности оксидаз в зависимости от концентрации различных детергентов использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
Активность оксидаз культуральной жидкости грибов измеряли в 20 мМ Na-ацетатном буфере (рН 5.0) в присутствии 0.1 мМ АБТК (в качестве субстрата), различных концентраций детергентов (0.01, 0.1, 0.25 и 1%) и культуральной жидкости с конечной активностью лакказы 0.14 Ед/мл (без детергента) в 1 мл кювете при 25°С, как описано выше. В качестве детергентов использовали Твин 20, Твин 40, Твин 80, Тритон Х100, ДСН и ЦТАБ. Оксидазную активность культуральной жидкости гриба в отсутствие детергента принимали за 100%.
В присутствие ионных детергентов (ДСН и ЦТАБ) наблюдалось значительное ингибирование активности оксидаз культуральной жидкости гриба М. ovispora VKM F-1735: 100% ингибирование в присутствии 0.1% ЦТАБ, и 62% - при 0.25 ДСН (Фиг. 2Ж). Минимальное ингибирование активности оксидаз культуральной жидкости гриба (20%) зарегистрировано в присутствие 1% Твина 80.
Пример 13. Определение стабильности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 в присутствие различных концентраций Твина 80.
Стабильность оксидаз гриба определяли путем измерения остаточной лакказной активности предварительно разведенной исходной культуральной жидкости гриба М. ovispora VKM F-1735, полученной, как описано выше (Пример 6) после продолжительной инкубации ферментного препарата в 20 мМ Na-ацетатном буфере (рН 5.0) в присутствие 0.01 или 1% Твина 80 в стерильных условиях при 25 и 4°С, соответственно (Фиг. 23).
Ферментный препарат получали путем разведения исходной культуральной жидкости в 20 мМ Na-ацетатном буфере (рН 5.0) до конечной удельной лакказной активности препарата 0.14 Ед/мл (без детергента). Полученные препараты стерилизовали посредством шприцевых фильтров Whatman с диаметром пор мембраны 0.2 мкм, разделяли на аликвоты по 1.0 мл в пробирки объемом 1.5 мл и инкубировали в соответствующих условиях. Использовали не менее трех образцов для каждого условия.
Для измерения активности лакказы 100 мкл инкубированного раствора фермента добавляли к 900 мкл 20 мМ Na-ацетатного буфера (рН 5.0), содержащего 0.1 мМ АБТК, перемешивали, окисление тестировали спектрофотометрически, как описано выше.
Максимальная стабильность оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 зарегистрирована при инкубировании в 20 мМ Na-ацетатном буфере (рН 5.0) в присутствие 0.01% Твина 80 при 4°С (95% остаточной активности после 13 суток инкубирования) и в присутствие 1% Твина 80 при 4°С (60% остаточной активности после 13 суток инкубирования).
Пример 14. Определение активности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 в присутствие различных солей.
Измерение лакказной активности образцов проводили, как описано в примере 6.
Для исследования активности оксидаз в зависимости от концентрации различных солей использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
Активность оксидаз культуральной жидкости грибов измеряли в 20 мМ Na-ацетатном буфере (рН 5.0) в присутствии 0.1 мМ АБТК (в качестве субстрата), различных концентраций солей (1, 2, 3, 4 и 5 мМ) и культуральной жидкости с конечной активностью лакказы 0.14 Ед/мл (без соли) в 1 мл кювете при 25°С, как описано выше. В качестве солей использовали Na2SO4, MnSO4⋅5H2O, ZnSO4⋅7H2O, NaCl, CuCl2, СаС12, KH2PO4, MgCl2, MnCl2, (NH4)2SO4, CuSO4⋅5H2O, CoSO4⋅7H2O, MgSO4⋅7H2O, NH4C1, KCl, CoSO4⋅7H2O, NiCl2⋅6H2O, Na2HPO4, K2SO4, CoCl2⋅H2O. Оксидазную активность культуральной жидкости гриба без соли принимали за 100%.
Среди всех протестированных минеральных солей соли (NH4)2SO4, CuSO4⋅5H2O, CoSO4⋅7H2O, MgSO4⋅7H2O, NH4Cl, KCl, CoSO4⋅7H2O, NiCl2⋅6H2O и Na2HPO4 ингибировали активность оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 в диапазоне от 0.2-30.0% с увеличением их концентрации (Таблица 1). 1 мМ K2SO4 и 5 мМ СоС12⋅Н2O незначительно активировали оксидазы на 16% и 20%, соответственно.
Пример 15. Определение динамики обесцвечивания малахитового зеленого в присутствие оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 без медиатора.
Для исследования динамики обесцвечивания малахитового зеленого оксидазами М. ovispora VKM F-1735 использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
Обесцвечивание малахитового зеленого в концентрациях 33.5, 67, 134, 268 и 670 мкМ оксидазами культуральной жидкости М. ovispora VKM F-1735 изучали спектрофотометрически (Shimadzu UV/Vis UV-1800) путем измерения интенсивности поглощения характеристического пика малахитового зеленого при 618 нм в реакционной смеси, содержащей краситель и культуральную жидкость гриба в 20 мМ Na-ацетатном буфере (рН 5.0) в ходе инкубирования при 29°С. Конечная лакказная активность приготовленной реакционной смеси составила 0.26 Ед/мл в реакции с 0.1 мМ АБТК в качестве субстрата. Интенсивность поглощения экспериментальной реакционной смеси выражали в процентах от поглощения контрольных вариантов, содержащих малахитовый зеленый и 20 мМ Na-ацетатный буфер (рН 5.0), инкубированных в одинаковых условиях в каждый момент времени.
Оксидазы культуральной жидкости гриба М. ovispora VKM F-1735 обесцвечивали до 85-90% малахитового зеленого в диапазоне концентраций 33.5-670 мкМ за 6 часов инкубирования. Полное обесцвечивание 33.5-67 мкМ малахитового зеленого достигалось через 30 часов инкубирования. На 4 сутки зарегистрировано 90% обесцвечивание 670 мкМ красителя, 95% обесцвечивание 268 мкМ красителя и 98% обесцвечивание 134 мкМ красителя.
Пример 16. Осуществление трансформации малахитового зеленого оксидазами культуральной жидкости гриба Microthielavia ovispora VKM F-1735 в отсутствие медиатора.
Для исследования способности оксидаз культуральной жидкости гриба трансформировать малахитовый зеленый использовали 4 сут культуральную жидкость гриба М. ovispora VKM F-1735, полученную на пике лакказной активности при погруженном культивировании в минеральной среде в присутствии 80 г/л размельченных семян гороха в качестве единственного источника углерода и энергии. Реакционная смесь содержала 67 мкМ малахитовый зеленый, культуральную жидкость (0.14 Ед/мл в реакции с АБТК) и 20 мМ Na-ацетатный буфер (рН 5.0). Реакцию начинали добавлением ферментного препарата, инкубировали при 29°С. Реакцию останавливали через 2 и 6 часов инкубирования путем добавления в реакционную смесь этилацетата.
Интермедиаты трансформации экстрагировали из культуральной жидкости этилацетатом. Нейтральные экстракты получали непосредственно из культуральной жидкости, кислые экстракты - после предварительного подкисления культуральной жидкости соляной кислотой до рН 2.0.
Идентификацию и препаративное выделение интермедиатов трансформации малахитового зеленого проводили методом тонкослойной хроматографии (ТСХ) экстрактов на пластинках 60 F254 с силикагелем ("Merck", Германия). Для идентификации интермедиатов на старт наносили по 10 мкл полученных экстрактов. Экстракты разгоняяли на расстояние 5.5 см в системе растворителей бензол - диоксан - уксусная кислота в соотношении 90:9:1. Для идентификации соединений использовали УФ-свет и бензидиновый реактив (0.5 г бензидина растворяли в 1.4 мл концентрированной НСl и выдерживали 15 минут при комнатной температуре, затем доводили до 100 мл дистиллированной водой). Перед окрашиванием бензидиновый реактив смешивали с 10% раствором NaNO3 в соотношении 1:1. Идентификация метаболитов проводили с помощью величины Rf соединения, равной отношению расстояния, пройденного веществом в данной системе растворителей, к расстоянию, пройденному фронтом растворителя.
Для препаративного выделения метаболитов на старт наносили экстракт полоской в 4 см и элюировали в той же системе растворителей при длине фронта 11 см. Носитель с пятном интермедиата счищали с пластинки и дважды ресуспендировали в 2 мл метанола, центрифугировали при 4000 g в течение 15 мин. Надосадочную жидкость отбирали, переносили в колбу и упаривали на роторном испарителе.
Очищенные препараты интермедиатов анализировали методом масс-спектрометрии на приборе низкого разрешения LCQ Advantage MAX (Thermo Finnigan), используя одноканальный шприцевой насос для прямой инфузии метанольного раствора образца в область химической ионизации при атмосферном давлении (APCI). В ходе анализа использовали различные условия работы источника ионов: нормализованная энергия столкновений - от 20 до 40% при скорости высушивающего газа 65 мл/мин и температуре капилляра 220°С. Сбор и обработку масс-спектрометрических данных проводили с помощью программного обеспечения Xcalibur™. Детекцию проводили как в положительных, так и в отрицательных ионах. МС/МС спектры получали, используя в качестве предшественников как протонированные [М+Н]+, так и депротонированные молекулы [М-Н]-. Идентификацию метаболитов осуществляли с использованием стандартных образцов исследуемых соединений, а также с привлечением данных библиотеки масс-спектров и опубликованных исследований.
Оксидазы культуральной жидкости гриба М. verrucaria F-3851, полученные при погруженном культивировании в минеральной среде в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии, способны трансформировать малахитовый зеленый при рН 5.0 (Фиг. 4) с образованием и последующим разложением следующих интермедиатов:
- [М+Н]+122(78%), 123(100%), 121(36%), 93(61%);
- [М+Н]+198(100%), 199(55%), 197(89%), 179(50%)), 169(20%), 120(20%), 105(81%);
- [М+Н]+212(86%), 134(31%), 105(100%);
- [М+Н]+226(47%), 148(22%), 105(100%);
- [М+Н]+241(100%), 226(73%), 105(9%);
- [М+Н]+315(100%), 300(79%), 237(92%), 208(75%), 194(48%).
Пример 17. Определение деколоризующей активности оксидаз культуральной жидкости гриба Microthielavia ovispora VKM F-1735 в отношении промышленных красителей в отсутствие медиатора.
Деколоризующую активность оксидаз культуральной жидкости гриба М. ovispora VKM F-1735 определяли с помощью хромогенной реакции в 96-луночных ИФА-планшетах (Greiner BioOne, Sigma-Aldrich) при 25°C. В качестве промышленных красителей использовали бриллиантовый зеленый, малахитовый зеленый, Кумасси синий, генциан фиолетовый, фуксин, бромфеноловый синий, бромкрезоловый зеленый, феноловый красный, крезоловый красный, Конго красный, Судан черный, Судан желтый, арсеназо III, амидо черный, эриохром черный, толуидиновый синий, метиленовый синий, эритрозин, флуоресцеин, эозин, резазурин и кармин.
Для исследования деколоризующей активности оксидаз использовалась культуральная жидкость гриба М. ovispora VKM F-1735, полученная при погруженном культивировании мицелия в присутствии 80 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде.
Общий объем каждой реакционной смеси составил 150 мкл, включающий 670 мкМ краситель, культуральную жидкость гриба (с конечной активностью 0.03 Ед/мл в реакции с 0.1 мМ АБТК) и 20 мМ Na-ацетатный буфер с рН 5.0. Реакцию начинали внесением культуральной жидкости гриба. Обесцвечивание красителя наблюдали визуально после 5 мин, 30 мин, 3.5 часа, 8.5 часов и 24 часа инкубирования.
Оксидазы культуральной жидкости гриба М. ovispora VKM F-1735 проявляли деколоризующую активность в отношении 5 красителей в концентрации 670 мкМ без использования редокс-медиатора (Фиг. 5): малахитовый зеленый, бромфеноловый синий, бромкрезоловый зеленый, арсеназо III, эриохром черный.
Оксидазы культуральной жидкости гриба М. ovispora VKM F-1735 модифицировали 8 исходных красителей в концентрации 670 мкМ без применения редокс-медиатора (бриллиантовый зеленый, фуксин, Кумасси синий, генциан фиолетовый, Конго красный, Судан черный, Судан желтый, эозин) с изменением или увеличением их интенсивности окраски (Фиг. 5).
Таким образом, показано, что предлагаемый способ получения оксидаз гриба Microthielavia ovispora VKM F-1735, основанный на применении натурального источника углерода и энергии, без использования дорогостоящих компонентов среды (глюкозы, аспарагина, тиамина), индукторов лакказ (солей меди, марганца, кальция, лития, ароматических соединений), органических растворителей и дополнительных стадий очистки, обеспечивает высокую деколоризующую активностью культуральной жидкости в отношении промышленных красителей без применения дополнительных дорогостоящих редокс-медиаторов.
В настоящей работе впервые для представителей родов Microthielavia и Thielavia представлены данные о возможности обесцвечивания и модификации цвета промышленных красителей культуральной жидкостью гриба Microthielavia ovispora VKM F-1735.
Преимущество полученного оксидазного препарата заключается в его способности к окислению промышленных красителей в отсутствии в реакционной среде дополнительного редокс-медиатора, что снижает стоимость процессов. Впервые показано влияние различных условий среды на активность оксидаз культуральной жидкости Microthielavia ovispora VKM F-1735.
В тексте использованы следующие сокращения:
АБТК - 2,2-Азино-бис(3-этилбензотиазолин 6-сульфоновая кислота)
ИФА - иммуноферментный анализ
ЦТАБ - цетилтриметиламмония бромид
ДСН - додецилсульфат натрия
ИФА - иммуноферментный анализ
М3-малахитовый зеленый
Использованная литература
1 Legerská В., Chmelová D., Ondrejovič Μ. Degradation of synthetic dyes by laccases - a mini-review. Nova Biotech. Chim., 2016, Vol.15, P. 90-106. https://doi.org/10.1515/nbec-2016-0010.
2 Hassaan M.A., Nemr A.E1. Health and environmental impacts of dyes: mini review. Am. J. Environ. Sci. Eng., 2017, Vol.1, P. 64-67. https://doi.org/10.11648/j.ajese.20170103.11.
3 Vikrant K., Giri B.S., Raza N., Roy K., Kim K.H., Rai B.N., Singh R.S. Recent advancements in bioremediation of dye: current status and challenges. Biores. Technol., 2018, Vol.253, P. 355-367. https://doi.org/10.1016/j.biortech.2018.01.029.
4 Hassan M.M., Carr C.M. A critical review on recent advancements of the removal of reactive dyes from dye house effluent by ion-exchange adsorbents. Chemosphere, 2018, Vol.209, P. 201-219. https://doi.org/10.1016/j.chemosphere.2018.06.043.
5 Srivastava S., Sinha R., Roy D. Toxicological effects of malachite green. Aqua. Toxicol., 2004, Vol.66, P. 319-329. https://doi.org/10.1016/j.aquatox.2003.09.008.
6 de Campos Ventura-Camargo В., Marin-Morales M.A. Azo dyes: characterization and toxicity - a review. Textil. Light Ind. Sci. Technol., 2013, Vol.2, P. 85-103. https://www.researchgate.net/publication/282815745_Azo_Dyes_Characterization_ and_Toxicity-_A_Review.
7 Lellis В., Fávaro-Polonio C.Z., Pamphile J.A., Polonio J.C. Effects of textile dyes on health and the environment and bioremediation potential of living organisms. Biotechnol. Res. Innov., 2019, Vol.3, P. 275-290. https://doi.org/10.1016/j.biori.2019.09.001.
8 Zhou X., Zhang J., Pan Z., Li D. Review of methods for the detection and determination of malachite green and leuco-malachite green in aquaculture. Crit. Rev. Anal. Chem. 2019, Vol.49, P. 1-20. https://doi.org/10.1080/10408347.2018.1456314.
9 Dubreil E., Mompelat S., Kromer V., Guitton Y., Danion M., Morin Т., Hurtaud-Pessel D., Verdon E. Dye residues in aquaculture products: targeted and metabolomics mass spectrometric approaches to track their abuse. Food Chem., 2019, Vol.294, P. 355-367. https://doi.org/10.1016/j.foodchem.2019.05.056,
10 Elmoubarki R., Mahjoubi F.Z., Tounsadi H., Moustadraf J., Abdennouri M, Zouhri Α., El Albani Α., Barka N. Adsorption of textile dyes on raw and decanted Moroccan clays: kinetics, equilibrium and thermodynamics. Water Res. Ind., 2015, Vol.9, P. 16-29. https://doi.org/10.1016/j.wri.2014.11.001.
11 Wu L., Lin Z.Z., Zhong H.P., Chen X.M., Huang Z.Y. Rapid determination of malachite green in water and fish using a fluorescent probe based on CdTe quantum dots coated with molecularly imprinted polymer. Sens. Act. В Chem., 2017, Vol.239, P. 69-75. https://doi.org/10.1016/j.snb.2016.07.166.
12 Baldrian P. Fungal laccases-occurrence and properties. FEMS Microbiol. Rev., 2006, Vol.30, P. 215-242. https://doi.org/10.1111/j.1574-4976.2005.00010.x.
13 Kudanga T.G., Nyanhongo S., Guebitz G.M., Burton S. Potential applications of laccase-mediated coupling and grafting reactions: a review. Enz. Microbiol. Technol., 2011, Vol.48, P. 195-208. https://doi.org/10.1016/j.enzmictec.2010.11.007.
14 Polak J., Jarosz-Wilkolazka A. Fungal laccases as green catalysts for dye synthesis. Proc. Biochem., 2012, Vol.47, P. 1295-130. https://doi.org/10.1016/j.procbio.2012.05.006.
15 Margot J., Bennati-Granier C, Maillard J., Blanquez P., Barry D.A., Holliger C. Bacterial versus fungal laccase: potential for micropollutant degradation. AMB Express, 2013, Vol.3, P. 63-77. https://doi.org/10.1186/2191-0855-3-63.
16 Zucca P., Cocco G., Sollai F., Sanjust E. Fungal laccases as tools for biodegradation of industrial dyes. Biocatalysis, 20,e-rot fungus Partus tigrinus CBS 577.79. Antonie Van Leeuwenhoek, 2007, Vol.91, P. 57-69.
17 MatĔé D., Garciá-Burgos C, Garciá-Ruiz E., Ballesteros A.O., Camarero S., Alcalde M. Laboratory evolution of high-redox potential laccases. Chem. Biol., 2013, Vol.17, P. 1030-1041. https://doi.org/10.1016/j.chembiol.2010.07.010.
18 Forootanfar H., Faramarzi M.A., Shahverdi A.R., Yazdi M.T. Purification and biochemical characterization of extracellular laccase from the ascomycete Paraconiothyrium variabile. Biores. Technol., 2011, Vol.102, P. 1808-1814. https://doi.org/10.1016/j.biortech.2010.09.043.
19 Liu Ν., Shen S., Jia H., Yang В., Guo X., Si H., Cao Z., Dong J. Heterologous expression of Stlac2, a laccase isozyme of Setosphearia turcica, and the ability of decolorization of malachite green. Int. J. Biol. Macromol., 2019, Vol.138, P. 21-28. https://doi.org/l0.1016/j.ijbiomac.2019.07.029.
20 Sonawane V.C. Method of obtaining the laccase enzyme of Arthrographis sp.DE112011102717T5, Date of publication: 2013-08-08
21 Sonawane V.C. Method for obtaining laccase enzyme from Arthrographis sp.WO 2012023021 A1, Date of publication: 2012-02-23
22 Mtibaà R., Barriuso J., de Eugenio L., Aranda E., Belbahri L., Nasri M., Jesus Martinez M., Mechichi T. Purification and characterization of a fungal laccase from the ascomycete Thielavia sp.and its role in the decolorization of a recalcitrant dye. Int. J. Biol. Macromol., 2018, Vol.120, P. 1744-1751. https://doi.org/10.1016/j.ijbiomac.2018.09.175.
23 Paloheimo M., Puranen Т., Valtakari L., Kruus K., Kallio J., Mäntylä Α., Fagerström R., Ojapalo P., Vehmaanperä J. Novel laccase enzymes and their uses. CA2579752C, Date of publication: 30.03.2006.
24 Paloheimo M., Valtakari L., Puranen Т., Kruus K., Kallio J., Maentylae Α., Fagerstroem R., Ojapalo P., Vehmaanperae J. Novel laccase enzyme and use thereof. CA2580211С, Date of publication: 2015-12-01
25 Paloheimo M., Valtakari L., Puranen Т., Kruus K., Kallio J., Maentylae Α., Fagerstroem R., Ojapalo P., Vehmaanperae J. New laccase enzyme, and its use. DK1799816T3, Date of publication: 2015-11-02
26 Perez J., Jeffries T.W. Mineralization of C-ring-labeled synthetic lignin correlates with the production of lignin peroxidase, not of manganese peroxidase or laccase. Appl. Environ. Microbiol., 1990, Vol.56, P. 1806-1812.
27 Myasoedova N.M., Gasanov N.B., Chernykh A.M., Kolomytseva M.P., Golovleva L.A. Selective regulation of laccase isoform production by the Lentinus strigosus 1566 fungus. Appl. Biochem. Microbiol. (Rus), 2015, Vol.51, P. 222-229. https://d0i.0rg/10.1134/S0003683815020131.
28 Xu F. Oxidation of phenols, anilines, and benzenethiols by fungal laccases: correlation between activity and redox potentials as well as halide inhibition. Biochemistry, 1996, Vol.35, P. 7608-7614.
29 Eggert С, Temp U., Eriksson K.E. The ligninolytic system of the white rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase. Appl. Environ. Microbiol., 1996, Vol.62, P. 1151-1158.
30 Chernykh A.M., Myasoedova N.M., Kolomytseva M.P., Ferraroni M., Scozzafava Α., Briganti F., Golovleva L.A. Laccase isoforms with unusual properties from the basidiomycete Steccherinum ochraceum strain 1833. J. Appl. Microbiol., 2008, Vol.105, P. 2065-2075.
31 Leonowicz Α., Grzywnowicz K. Quantitative estimation of laccase forms in some white-rot fungi using syringaldazine as a substrate. Enz. Microb. Technol., 1981, Vol.3, P. 55-58.
32 Quaratino D., Federici F., Petruccioli M., Fenice M., D'Annibale A. Production, purification and partial characterisation of a novel laccase from the white-rot fungus Panus tigrinus CBS 577.79. Antonie Van Leeuwenhoek, 2007, Vol.91, P. 57-69.
33 Sterjiades R., Dean J.F.D., Eriksson K.-E.L. Laccase from Sycamore maple {Acer pseudoplatanus) Polymerizes monolignols. Plant Physiol., 1992, Vol.99, P. 1162-1168.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения оксидаз Curvularia geniculata ВКМ F-3561, активных с фенольными соединениями в нейтральных условиях среды | 2017 |
|
RU2664483C2 |
| ШТАММ RHIZOCTONIA SOLANI F-895 - ПРОДУЦЕНТ АЛКАЛОФИЛЬНЫХ ЛАККАЗ, АКТИВНЫХ С ФЕНИЛПРОПАНОИДАМИ | 2015 |
|
RU2647767C2 |
| Способ получения лакказ гриба Myrothecium verrucaria ВКМ F-3851, трансформирующие фенольные соединения в нейтрально - щелочных условиях среды | 2016 |
|
RU2663342C2 |
| ТЕРМОСТАБИЛЬНАЯ ЛАККАЗА III ГРИБА Steccherinum ochraceum LE (BIN) 1833 D И СПОСОБ ПОЛУЧЕНИЯ ЛАККАЗ | 2008 |
|
RU2385930C1 |
| РЕКОМБИНАНТНАЯ ДВУХДОМЕННАЯ ЛАККАЗА БАКТЕРИИ Streptomyces griseoflavus Ac-993, ОБЛАДАЮЩАЯ ВЫСОКОЙ ТЕРМОСТАБИЛЬНОСТЬЮ И ЩЕЛОЧНЫМ ОПТИМУМОМ pН ОКИСЛЕНИЯ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ; ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ДВУХДОМЕННУЮ ЛАККАЗУ БАКТЕРИИ Streptomyces griseoflavus Ac-993; СПОСОБ ПОЛУЧЕНИЯ ДВУХДОМЕННОЙ ЛАККАЗЫ БАКТЕРИИ Streptomyces griseoflavus Ac-993 | 2012 |
|
RU2539780C2 |
| Штамм Fomes fomentarius ВКПМ F-1531 - продуцент фенолоксидазных ферментов | 2021 |
|
RU2770690C1 |
| ШТАММ БАЗИДИАЛЬНОГО ГРИБА Trametes hirsuta (Wulfen) Pilát- ПРОДУЦЕНТ ГОЛУБОЙ ЛАККАЗЫ | 2006 |
|
RU2345135C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕХНИЧЕСКОГО ПРЕПАРАТА ЛАККАЗЫ | 2006 |
|
RU2345134C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИГНИНОЛИТИЧЕСКИХ ФЕРМЕНТОВ | 1992 |
|
RU2021371C1 |
| КЛЕТКА МИЦЕЛИАЛЬНОГО ГРИБА Penicillium canescens - ПРОДУЦЕНТ КСИЛАНАЗЫ И ЛАККАЗЫ, СПОСОБ ПОЛУЧЕНИЯ КОМБИНИРОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА КСИЛАНАЗЫ И ЛАККАЗЫ | 2012 |
|
RU2538149C2 |

Изобретение относится к области биотехнологии, в частности к способу получения оксидаз гриба Microthielavia ovispora VKM F-1735, показана способность оксидаз культуральной жидкости указанного штамма обесцвечивать или модифицировать окраску промышленных красителей без использования редокс-медиаторов. Возможно применение оксидаз, продуцируемых штаммом гриба предлагаемым способом, в технологиях, применяемых в пищевой и текстильной отраслях промышленности, рыбовладельческих хозяйствах, очистке сточных вод, косметологии, создании биосенсоров и тест-систем без дополнительных затрат, связанных с использованием редокс-медиаторов. Погруженное культивирование гриба Microthielavia ovispora VKM F-1735 проводят в минеральной среде с добавлением в качестве натурального источника углерода и энергии размельченных семян гороха до получения максимальной лакказной активности в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия. Оксидазы полученной культуральной жидкости гриба Microthielavia ovispora VKM F-1735 способны осуществлять обесцвечивание или модификацию с последующим изменением цвета или интенсивности широкого спектра промышленных красителей в концентрациях до 670 мкМ без дополнительного использования медиаторов, что снижает стоимость технологических процессов. Впервые для представителей родов Microthielavia и Thielavia представлены данные о возможности обесцвечивания и модификации цвета промышленных красителей оксидазами культуральной жидкостью гриба Microthielavia ovispora VKM F-1735, показано влияние различных условий среды на лакказную активность полученного препарата. Показана способность оксидаз культуральной жидкости гриба, полученной указанным способом, осуществлять полную деградацию малахитового зеленого в концентрациях до 134 мкМ в жидкой среде. 5 ил., 1 табл.
Способ получения лакказ штамма гриба Microthielavia ovispora VKM F-1735, обесцвечивающих или модифицирующих окраску промышленных красителей без использования редокс-медиаторов, характеризующийся тем, что погруженное культивирование гриба Microthielavia ovispora VKM F-1735 проводят в минеральной среде с добавлением в качестве натурального источника углерода и энергии 80 г/л размельченных семян гороха до получения максимальной лакказной активности в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
| FOROOTANFAR H., et al., Purification and biochemical characterization of extracellular laccase from the ascomycete Paraconiothyrium variabile | |||
| Biores | |||
| Technol., 2011, Vol.102, p | |||
| Химический огнетушитель | 1924 |
|
SU1808A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| MTIBAA R., et al., Mechichi T | |||
| Purification and characterization of a fungal laccase from the ascomycete | |||
Авторы
Даты
2022-06-08—Публикация
2021-05-19—Подача