Изобретение относится к медицине, конкретно к экспериментальной гинекологии, и касается способов моделирования хронического воспаления придатков матки.
Известен способ моделирования острого воспалительного процесса придатков матки [1]. Сущность способа состоит в следующем. Для опыта используют чистопородных половозрелых крольчих. Под местной инфильтрационной анестезией 20-30 мл 0,5% раствора новокаина проводят нижнесрединную лапаротомию в асептических условиях. Одну из маточных труб выводят в рану и тщательно обкладывают стерильными салфетками Под ампулярный конец трубы вблизи фимбрий подводят кетгутовую лигатуру и перевязывают трубу в указанном отделе, второй конец этой же лигатуры проводят на расстояние 0,2 см от места перевязки трубы, но не перевязывают. После такой предварительной подготовки, необходимой для предупреждения попадания микробов в брюшную полость, стенку трубы прокалывают тонкой инъекционной иглой, которую затем продвигают на 2 см проксимально и вводят из шприца "Рекорд" 0,2 мл суточной культуры золотистого стафилококка (штамм 209), содержащей 100 млн микробных тел. После извлечения иглы выше места прокола производят перевязку трубы, предварительно наложенной лигатурой. Вторая труба служит контролем Брюшную полость ушивают наглухо.
Данная модель позволяет изучить течение острого воспаления придатков, оценить воздействие различных фармакологических препаратов и немедикаментозной терапии. Однако данная модель имеет ряд недостатков: обезболивание местной анестезией 0,5% раствором новокаина не обеспечивает полной обездвижимости животных в станке на время операции, не всегда предохраняет от развития болевого шока, удлиняется время операции, перевязка маточной трубы перед введением культуры стафилококка нарушает каналикулярный путь распространения инфекции и способствует механической травматизации тканей. Кроме того, клиническое течение воспаления придатков матки у женщин характеризуется преимущественным вовлечением обеих маточных труб, а в существующей методике инфицирование одностороннее.
По назначению наиболее близким прототипом является способ моделирования асептического хронического воспаления придатков матки [2]. В качестве экспериментальных животных были выбраны беспородные белые крысы-самки массой 200-220 г. Под ингаляционным масочным наркозом парами эфира производят лапаротомию, рога матки выводят и обкладывают стерильными салфетками. Тонкой инъекционной иглой прокалывают маточный рог в непосредственной близости от яйцевода и продвигают иглу дистальнее. С помощью инсулинового шприца с обеих сторон в рог матки в непосредственной близости от яйцевода и в область яичниковой сумки вводят по 0,1 мл 0,5% раствора каррагенина, который состоит из комплекса фракций сульфатированной галактозы, выделенной из морских водорослей.
Однако экспериментальное хроническое воспаление придатков матки, созданное введением каррагенина, несмотря на стабильность воспроизведения, чаще сопровождается развитием воспалительных инфильтратов больших размеров, состоящих из лимфоидных, плазматических, тучных клеток и фибробластов, формируются эпигелиоидные гранулемы. Подобная воспалительная реакция тканей характерна для определенного вида инфекции и, в частности, для генитального туберкулеза и актиномикоза, удельный вес которых в этиологической структуре воспаления придатков матки составляет не более 10-15%. Гораздо чаще в клинической практике наблюдаются негранулематозные воспалительные процессы придатков матки.
Задачей, решаемой данным изобретением, является приближение экспериментальной модели к клиническому и морфологическому течению хронического воспаления придатков матки у женщин и расширение области использования модели хронического воспаления придатков матки.
Поставленная задача решается способом моделирования хронического воспаления придатков матки путем нижнесрединной лапаротомии с протяженностью разреза 1,5-2 см (микролапаротомия) под ингаляционным наркозом парами эфира у беспородных половозрелых крыс-самок, находящихся в фазах покоя (метаэструс, диэструс) астрального цикла, выведения рогов матки с яйцеводами и яичниками, введением в оба яйцевода флогогена в виде 0,1 мл суточной культуры золотистого стафилококка - штамм 209, содержащего 50 млн. микробных тел, одномоментного точечного десерозирования медицинским скарификатором в 8-10 точках висцеральной брюшины яйцеводов с двух сторон, покровного эпителия яичников медицинским скарификатором с двух сторон, распыления над десерозированными участками медицинского талька в дозе 0,1 мг/см2, послойным закрытием отдельными кетгутовыми швами раны передней брюшной стенки и выведением животных из эксперимента декапитацией под ингаляционным наркозом парами эфира на 30-40-е сутки.
Новым является то, что животных вводят в эксперимент в фазы покоя эстрального цикла, для снижения толерантности к инфекции, нижнесрединный лапаротомный разрез выполняют протяженностью 1,5-2 см, вводят флогоген в виде 0,1 мл суточной культуры золотистого стафилококка - штамм 209, содержащего 50 млн микробных тел непосредственно в оба яйцевода, одномоментно проводят десерозирование висцеральной брюшины яйцеводов и покровного эпителия яичников медицинским скарификатором с двух сторон в 8-10-ти точках, распыляют над десерозированными участками медицинский тальк в дозе 0,1 мг/см2, послойно закрывают отдельными кетгутовыми швами рану передней брюшной стенки.
Данные отличительные признаки не вытекают явным образом для специалиста из уровня техники и позволяют достичь нового положительного эффекта, а именно - приближения модели к клиническому течению хронического воспаления придатков матки.
Предлагаемый способ апробирован на 52-х беспородных половозрелых белых крысах-самках в отделе экспериментальной физиологии и хирургии Центральной научно-исследовательской лаборатории Сибирского государственного медицинского университета. Таким образом, техническое решение соответствует критериям изобретения "новизна", "изобретательский уровень", "промышленно применим".
Способ осуществляют следующим образом
В качестве экспериментального материала используют половозрелых белых беспородных крыс-самок (массой 200-220 г), находящихся в фазах покоя (метаэструс, диэструс) астрального цикла.
Крысу фиксируют в станке в положении на спине. Операционное поле широко и тщательно выбривают. Кожу обрабатывают спиртом и 5-% йодной настойкой. Под ингаляционным наркозом парами эфира производят нижнюю срединную лапаротомию с протяженностью разреза не более 1,5-2 см. Рога матки с яйцеводами и яичниками выводят и обкладывают стерильными салфетками, увлажненными стерильным 0,9% раствором натрия хлорида. Тонкой инъекционной иглой прокалывают яйцевод и продвигают иглу дистальнее. При помощи инсулинового шприца (фирма-производитель MISAWA MEDICAL INDASTRY CO LTD, TOKYO, JAPAN) вводят 0,1 мл суточной культуры золотистого стафилококка (штамм 209), содержащей 50 млн микробных тел. Аналогично проводят инфицирование второго яйцевода. Тотчас же после инфицирования выполняют точечное десерозирование висцеральной брюшины яйцеводов, покровного эпителия яичников стерильным медицинским скарификатором с двух сторон в 8-10-ти точках. И сразу же после этого над десерозированными участками распыляют медицинский тальк в дозе 0,1 мг/см2. Затем послойно отдельными кетгутовыми швами закрывают рану передней брюшной стенки: брюшину, апоневроз и мышцу вместе, кожу - отдельно. Шов на коже обрабатывают йодонатом и крысу помещают в клетки. Антибиотикотерапию и другие лечебные мероприятия не применяют.
Экспериментальных животных содержат в стандартных условиях вивария на обычном питании с добавлением овощей и творога, при дозированном освещении (12: 12, свет с 8 часов). Ежедневно всех животных осматривают, отмечают их общее состояние, внешний вид, поведение, пищевую возбудимость и двигательную активность. Измеряют массу тела и температуру в ампулярном отделе прямой кишки. Определяют количество лейкоцитов в периферической крови и проводят кольпоцитологическое исследование для диагностики фазы эстрального цикла. Животных выводят из эксперимента декапитацией под ингаляционным наркозом парами эфира в фазу диэструса, которую определяют кольпоцитологачески, на 30-40-е сутки опыта.
Конкретный пример
В качестве экспериментального материала использовалась половозрелая белая беспородная крыса-самка массой 210 г., находящиеся в фазе диэструса эстрального цикла, полученная в Центральном виварии Сибирского государственного медицинского университета. Эксперимент выполнялся на базе отдела экспериментальной физиологии и хирургии центральной научно-исследовательской лаборатории Сибирского государственного медицинского университета.
Крысу фиксировали в станке в положении на спине. Операционное поле широко и тщательно выбривали. Кожу обрабатывали спиртом и 5-% йодной настойкой. Под ингаляционным наркозом парами эфира производили нижнюю срединную лапаротомию, с протяженностью разреза 2 см. Рога матки с придатками выводили и обкладывали стерильными салфетками, увлажненными стерильным 0,9% раствором натрия хлорида. Тонкой инъекционной иглой прокалывали яйцевод и продвигали иглу дистальнее. При помощи инсулинового шприца (фирма-производитель MISAWA MEDICAL INDASTRY СО LTD, TOKYO, JAPAN) вводили 0,1 мл суточной культуры золотистого стафилококка (штамм 209), содержащей 50 млн микробных тел. Разведение культуры и установление количества микробных тел в единице объема производилось на кафедре микробиологии Сибирского государственного медицинского университета непосредственно перед опытом. Аналогично проводилось инфицирование второго яйцевода. Тотчас же после инфицирования выполнялось точечное десерозирование висцеральной брюшины яйцеводов, покровного эпителия яичников стерильным медицинским скарификатором с двух сторон в 8-ми точках. И сразу же после этого над десерозированными участками распылялся медицинский тальк в дозе 0,1 мг/см2 при помощи пластикового инсуфлятора. Затем послойно непрерывным швом закрывали рану передней брюшной стенки (брюшину, апоневроз и мышцу вместе, кожу - отдельно) кетгутом 4/0. Шов на коже обрабатывали йодонатом и животных помещали в клетки. Антибиотикотерапию и другие лечебные мероприятия не применяли.
Экспериментальное животное содержали в стандартных условиях вивария на обычном питании с добавлением овощей и творога, при дозированном освещении (12: 12, свет с 8 часов). Ежедневно животное осматривали, отмечали его общее состояние, внешний вид, поведение, пищевую возбудимость и двигательную активность. Массу тела измеряли на медицинских весах, температуру - максимальным ртутным термометром в ампулярном отделе прямой кишки. Определяли количество лейкоцитов в периферической крови и проводили кольпоцитологическое исследование для диагностики стадии астрального цикла.
Выводили животное из эксперимента на 40-е сутки (в стадию диэструса, которую определяли кольпоцитологически) путем декапитации под ингаляционным наркозом парами эфира.
Тотчас после взятия яйцеводы и яичники фиксировали в жидкости Карнуа, заливали в парафин и после приготовления срезов толщиной 4-5 мкм окрашивали гематоксилином и эозином и по Ван-Гизону. Гистологические исследования проводились на кафедре гистологии, цитологии и эмбриологии Сибирского государственного медицинского университета.
Визуально в брюшной полости у животного, умерщвленного на 40-е сутки, обращал на себя внимание выраженный спаечный процесс. Имелись непрозрачные с множественными мелкими визуализируемыми сосудами спайки, плоскостные и паутинные. Яичники и яйцеводы были интимно спаяны с окружающим сальником, слева определялся гидросальпинкс (фиг.1).
При гистологическом исследовании яичников и яйцеводов животных на 40-е сутки белочная оболочка утолщена, сформированы грубые фиброзные спайки с окружающим сальником, множественные включения "тальковых телец" в них (фиг. 2). В области спаек нередко выявлялись клеточные инфильтраты (фиг.3). Между сальником и покровным эпителием яичников определялись множественные осумкованные полости, содержавшие скопления макрофагов группами по 5-7 и более клеток. В корковом веществе яичников было уменьшено количество примордиальных и растущих фолликулов, увеличено - атретических фолликулов и тел (фиг. 4). Довольно часто встречались "тальковые тельца" (фиг.5), выявлялись гигантские клетки "инородных тел" (фиг.6). Часть подверженных атрезии фолликулов характеризовалась явлениями кариорексиса фолликулярного эпителия, дегенерацией овоцита (фиг.7). В корковом и мозговом веществе яичника обнаруживались тромбоз мелких венозных сосудов, кариопикноз интерстициальных клеток (фиг. 8). Отмечались пролиферативные изменения соединительной ткани в корковом и мозговом слоях яичника.
Результаты исследований
Эксперимент был проведен на 52 половозрелых беспородных крысах-самках, у которых было создано хроническое воспаление придатков матки.
Контролем служили интактные животные (24 особи) одного возраста с подопытными и содержавшиеся вместе с ними в условиях вивария. Взятие контрольного материала производили в динамике одновременно с экспериментальным для учета возрастных изменений.
При вскрытии брюшной полости визуально изучали состояние органов брюшной полости: наличие и характер выпота, состояние брюшины, величину, положение и подвижность рогов матки, яйцеводов и яичников, выраженность спаечного процесса.
Тотчас после взятия яйцеводы и яичники фиксировали в жидкости Карнуа, заливали в парафин и после приготовления срезов толщиной 4-5 мкм окрашивали гематоксилином и эозином и по Ван-Гизону. Гистологические исследования проводились на кафедре гистологии, цитологии и эмбриологии Сибирского государственного медицинского университета.
Визуально в брюшной полости у животных, умерщвленных на 30-е и 40-е сутки, обращал на себя внимание выраженный спаечный процесс. Имелись непрозрачные с множественными мелкими визуализируемыми сосудами спайки, плоскостные и паутинные. Яичники и яйцеводы были интимно спаяны с окружающим сальником, в ряде случаев с образованием кист с серозно-геморрагическим содержимым, а также иногда и гидросальпинксов.
При гистологическом исследовании яичников и яйцеводов животных на 30-40-е сутки белочная оболочка утолщена, сформированы грубые фиброзные спайки с окружающим сальником, множественные включения "тальковых телец" в них. Между сальником и покровным эпителием яичников определялись множественные осумкованные полости, содержавшие скопления макрофагов группами по 5-7 и более клеток. В корковом веществе яичников было уменьшено количество примордиальных и растущих фолликулов, увеличено - атретических фолликулов и тел. Также довольно часто встречались инкапсулированные "тальковые тельца", выявлялись гигантские клетки "инородных тел", нагруженные тальковыми тельцами. Часть подверженных атрезии фолликулов характеризовалась явлениями кариорексиса фолликулярного эпителия, дегенерацией овоцита. Отмечались пролиферативные и фиброзные изменения соединительной ткани в корковом и мозговом слоях яичника, а также в собственной пластинке слизистой яйцеводов.
Таким образом, для приближения экспериментальной модели к клиническому и морфологическому течению хронического воспаления верхнего отдела генитального тракта предложено комбинировать монокультуральное воспаление с одномоментным десерозированием висцеральной брюшины яйцеводов и покровного эпителия яичников, а также распылением над изучаемыми органами медицинского талька в дозе 0,1 мг/см2. Это позволяет создать модель хронического воспаления придатков матки с выраженным спаечным процессом. В качестве экспериментальных животных выбраны белые крысы-самки, поскольку у белых беспородных крыс, в отличие от крольчих, овуляция спонтанная, а не индуцированная самцом, кожа у крыс морфологически приближается к коже человека, что очень важно, учитывая ее роль в реализации положительных эффектов физиотерапевтических воздействий. Для снижения толерантности животных к инфекции эксперимент осуществляют в фазы покоя (метаэструс, диэструс) эстрального цикла. Выбор инфекта обусловлен тем, что по-прежнему остается высокой роль аэробной инфекции и в частности золотистого стафилококка в развитии воспалительных заболеваний придатков матки и поэтому для создания экспериментальной модели взят золотистый стафилококк (штамм 209), обладающий плазмокоагулирующими и гемолитическими свойствами, лецитиназной активностью, способностью ферментировать маннит, не лизирующийся имеющимися фагами. Возбудитель чувствителен к β-лактамным антибиотикам. Комбинирование инфекционного агента с тальком позволяет приблизить экспериментальную модель к клиническому течению хронического воспаления придатков матки у женщин.
Как показали экспериментальные исследования, предлагаемая модель имеет характерные для клинического течения хронических воспалительных заболеваний придатков матки у женщин патогенетические признаки - контаминация слизистой оболочки яйцеводов с инфекционным фактором при его введении в дистальные отделы рогов матки, восходящее, двухстороннее инфицирование, негранулематозный тип воспалительного процесса в тканях яичников и яйцеводов на 30-40-е сутки. Адекватное обезболивание исключало развитие болевого шока.
По предложенной методике нами создана модель хронического воспаления придатков матки у 52-х экспериментальных животных (беспородные белые половозрелые крысы-самки массой 200-220 г.). Необходимо отметить относительную простоту воспроизведения модели воспаления придатков матки, отсутствие летальных исходов у экспериментальных животных и стабильное воспроизведение полученных результатов.
Данная модель хронического воспаления придатков матки с выраженным спаечным процессом позволяет провести апробацию терапевтического действия ряда новых препаратов, в сочетании с методами физиотерапевтического лечения.
Литература
1. Самородинова Л.А. Методика создания экспериментального инфекционного сальпингита//Бюлл. эксперим. биол. и медицины. -1966. - 2. - С.123-124.
2. Тихоновская О. А. Моделирование острого и хронического воспаления придатков матки // Молодежь и научно-технический прогресс. - Тез. докл. - Томск, 1986. - С.76.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ АУТОИММУННОГО ООФОРИТА | 2010 |
|
RU2439712C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ В ЭКСПЕРИМЕНТЕ | 2012 |
|
RU2533739C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ С ПРЕОБЛАДАНИЕМ ФОЛЛИКУЛЯРНЫХ КИСТ | 2005 |
|
RU2282249C1 |
| СПОСОБ ПРОФИЛАКТИКИ РАЗВИТИЯ СПАЕЧНОГО ПРОЦЕССА В МАЛОМ ТАЗЕ И НАРУШЕНИЙ ОВАРИАЛЬНО-МЕНСТРУАЛЬНОГО ЦИКЛА У ЖЕНЩИН, ПЕРЕНЕСШИХ ЭНДОСКОПИЧЕСКИЕ ОПЕРАЦИИ НА ЯИЧНИКАХ С ИСПОЛЬЗОВАНИЕМ ЭЛЕКТРОКОАГУЛЯЦИИ | 2003 |
|
RU2238687C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ | 1997 |
|
RU2141367C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ ЭНДОМЕТРИЯ У КРЫС | 2015 |
|
RU2580986C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ РАКА ЯИЧНИКА В ЭКСПЕРИМЕНТЕ У КРЫС | 2020 |
|
RU2743219C1 |
| Способ моделирования экспериментального хронического эндометрита у крыс | 2023 |
|
RU2823135C1 |
| СПОСОБ ПРОФИЛАКТИКИ РЕЦИДИВА ПОСЛЕОПЕРАЦИОННЫХ СПАЕК В ОРГАНАХ БРЮШНОЙ ПОЛОСТИ | 2009 |
|
RU2393865C1 |
| СПОСОБ И СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННЫХ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ ЭНДОМЕТРИЯ | 2004 |
|
RU2275194C1 |






Изобретение относится к медицине, к экспериментальной гинекологии, и может быть использовано для моделирования хронического воспаления придатков матки. Лапаротомный разрез выполняют протяженностью 1,5-2 см, вводят суточную культуру золотистого стафилококка, штамм 209 в дозе 0,1 мл, содержащей 50 млн микробных тел, непосредственно в яйцеводы, одномоментно десерозируют в 8-10 точках висцеральную брюшину яйцеводов и покровный эпителий яичников медицинским скарификатором, после чего распыляют над десерозированными участками медицинский тальк в дозе 0,1 мг/см2, операционную рану послойно ушивают отдельными кетгутовыми швами, животных выводят из эксперимента на 30-40-е сутки путем декапитации под ингаляционным наркозом парами эфира. Данное изобретение направлено на приближение экспериментальной модели к клиническому и морфологическому течению хронического воспаления придатков матки у женщин и расширение области использования модели хронического воспаления придатков матки. 8 ил.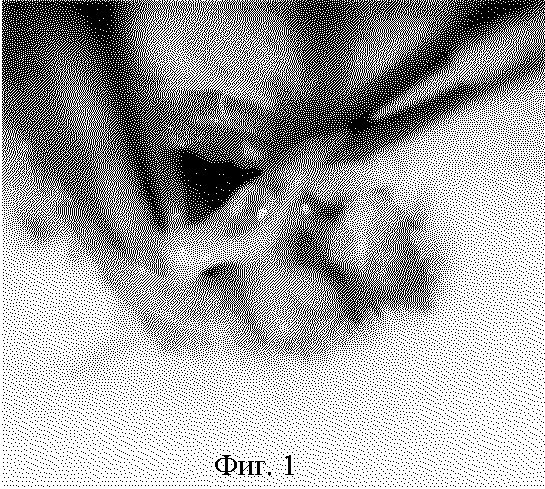
Способ моделирования хронического воспаления придатков матки путем проведения у белых беспородных половозрелых крыс-самок нижнесрединной лапаротомии, выведения рогов матки с яйцеводами и яичниками, введения флогогена, ушивания операционной раны и выведения животных из эксперимента, отличающийся тем, что лапаротомный разрез выполняют протяженностью 1,5-2 см, вводят суточную культуру золотистого стафилококка, штамм № 209 в дозе 0,1 мл, содержащей 50 млн микробных тел, непосредственно в яйцеводы, одномоментно десерозируют в 8-10 точках висцеральную брюшину яйцеводов и покровный эпителий яичников медицинским скарификатором, после чего распыляют над десерозированными участками медицинский тальк в дозе 0,1 мг/см2, операционную рану послойно ушивают отдельными кетгутовыми швами, животных выводят из эксперимента на 30-40 сутки путем декапитации под ингаляционным наркозом парами эфира.
| ТИХОНОВСКАЯ О.А | |||
| Моделирование острого и хронического воспаления придатков матки | |||
| Молодежь и научно-технический прогресс | |||
| Тезисы докладов научно-практической конференции | |||
| - Томск: Издательство Томского университета, 1986, с | |||
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
| RU 2142163 C1, 27.11.1999 | |||
| ГАРМАШЕВА Н.Д | |||
| Экспериментальный инфекционный эндометрит | |||
| - Л.: Медицина, 1947, с | |||
| Приспособление, заменяющее сигнальную веревку | 1921 |
|
SU168A1 |
| КЕИТ Л | |||
| и др | |||
| Причины инфекционных заболеваний малого таза | |||
| Репродуктивное здоровье | |||
| Пер | |||
| с англ | |||
| - М.: Медицина, 1988, т.1, гл.1, с | |||
| Устройство для разметки подлежащих сортированию и резанию лесных материалов | 1922 |
|
SU123A1 |
| СМЕТНИК В.П | |||
| и др | |||
| Неоперативная гинекология | |||
| СПб.: СОТИС, 1995, с | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| МАИБОРОДА А.А | |||
| и др | |||
| Способ моделирования воспаления | |||
| Восточно-Сибирский журнал инфекционной патологии, 1995, № 1, с | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
Авторы
Даты
2004-02-20—Публикация
2002-06-28—Подача