Изобретение относится к молекулярной биологии, вирусологии и медицинской биотехнологии и предназначено для экспресс-диагностики ортопоксвирусных инфекций за счет мультиплексного ПЦР-анализа.
Отказ от вакцинации против натуральной оспы постепенно привел к формированию большой прослойки людей, чувствительных как к вирусу натуральной оспы (ВНО), так и другим ортопоксвирусам, что создало благоприятную почву для все более широкого распространения в человеческой популяции ранее относительно неопасных инфекций типа оспы обезьян и оспы коров [1, 2, 3, 4]. Начавшаяся в 1996г. в Конго и продолжающаяся до сих пор необычно массовая вспышка оспы обезьян среди людей [4, 5] подтвердила возможность такого развития событий. Более того, ВНО рассматривают как возможный агент биотеррористических атак [6, 7]. В связи со всем вышесказанным возникла потребность в эффективных методах быстрой диагностики и видовой идентификации ортопоксвирусов, патогенных для человека.
Классическим способом лабораторной диагностики ортопоксвирусных инфекций является реакция торможения гемагглютинации (РТГА). Для получения окончательного ответа при этом требуется повторное взятие крови у больного через 5-6 суток. Следует учесть, что в данном способе, в зависимости от качества материала кожных поражений и срока болезни, отрицательный результат (низкие титры антигемагглютининов) не исключает наличия инфекции [8].
Другим классическим приемом лабораторной диагностики является метод выделения вируса на хорионаллантоисной оболочке (ХАО) развивающихся куриных эмбрионов. С помощью данного подхода возможно осуществлять дифференциацию ортопоксвирусов между собой. Способ обладает высокой чувствительностью, но, несмотря на это, недостатком его является необходимость работы с живым высокопатогенным вирусным материалом. Время исследования составляет от 3 до 6 суток [9].
Известен способ обнаружения оспенного антигена методом иммунофлуоресценции, эффективность которого зависит от вида исследуемого материала. Так, например, достоверность результатов исследования материалов из пустул и корок невелика из-за примеси лейкоцитов, обладающих аутофлуоресценцией [10, 11].
Применение методов иммунной электронной микроскопии и иммуноферментного анализа для видовой идентификации ортопоксвирусов требует наличия видоспецифичных моноклональных антител для каждого вида ортопоксвирусов. Возможность их применения показана лишь на весьма ограниченном количестве ортопоксвирусов. К тому же, применение таких методов для видовой диагностики ограничено ввиду близкого антигенного родства представителей Orthopoxvirus [12, 13, 14].
Метод амплификации фрагментов ДНК в полимеразной цепной реакции (ПЦР) позволяет извлекать специфичные фрагменты ДНК из следовых количеств анализируемого генетического материала и в течение короткого времени.
Разработка ПЦР в применение к идентификации ортопоксвирусов позволит проводить детекцию ортопоксвирусов с последующей их идентификацией непосредственно в клинических материалах, для чего не требуется какой-либо наработки тестируемого вируса, что особенно важно в случае высокопатогенных штаммов.
После определения нуклеотидных последовательностей геномов ряда ортопоксвирусов [15-18, 19, 20, 21, 22-26] появилась возможность выявления видоспецифичных различий определенных локусов и разработки методов видовой идентификации этих вирусов. Было предложено использовать единые для всех видов ортопоксвирусов пары олигонуклеотидных праймеров для ПЦР-амплификации сегментов ДНК в районе генов гемагглютинина [27], белка тел включения типа А [28] и гомолога рецептора фактора некроза опухолей [29]. После проведения амплификации полученные фрагменты ДНК требовалось гидролизовать определенными рестриктазами, чтобы по картине расположения субфрагментов осуществить видовую идентификацию ортопоксвирусов. Однако при анализе достаточно большого набора изолятов какого-либо вида ортопоксвирусов выявлялась их гетерогенность по спектру получающихся субфрагментов, что вносило некоторую неоднозначность в трактовку получаемых результатов.
Технической задачей изобретения является создание способа одностадийной экспресс-идентификации ортопоксвирусов с помощью мультиплексного ПЦР-анализа. Данный подход позволит усовершенствовать (адаптировать) технику ПЦР-анализа для рутинного использования в диагностике ортопоксвирусных инфекций за счет применения только одного мультиплексного ПЦР анализа (МПЦР). МПЦР позволит выявить вирусный материал в одной реакционной смеси, не прибегая к использованию дополнительных (рестрикционных) методов анализа, тем самым, сократив время диагностики, процент финансовых затрат и технологических ошибок.
Поставленная задача решается путем подбора пар праймеров, специфичных для каждого вида ортопоксвирусов, а также пары, являющейся родоспецифичной.
Введение дополнительной пары праймеров к высококонсервативному району данных вирусов в качестве положительного контроля позволит увеличить чувствительность способа, сократив вероятность появления ложноотрицательных результатов.
Выбор праймеров ограничивался несколькими критериями, такими как видоспецифичная амплификация вирусных ДНК и получение ПЦР-продуктов разной длины (характерной для каждого вида ортопоксвируса).
Для этого ранее опубликованные нуклеотидные последовательности ДНК различных штаммов ортопоксвирусов: натуральной оспы, штаммов: India-1967 [23], Bangladesh-1975 [21], Garcia-1966 [25]; оспы обезьян, штамм Zaire-96-1-16 [26]; оспы коров, штамм GRI-90 [24]; осповакцины штаммов Copenhagen [20], Ankara [19], Tian-tan [EMBL:AF 095689] были выравнены с помощью программы Aligment Servise [30] для нахождения потенциальных видоспецифичных районов и использования их в дальнейшем для составления олигонуклеотидов к МПЦР.
Предполагаемые пары праймеров в дальнейшем анализировали, используя программу “Oligo” (версия 3.3) [31, 32].
Затем последовательности праймеров, рассчитанные для каждого вида ортопоксвирусов, были проверены на наличие гомологии/комплементарности между собой и с последовательностями других поксвирусов, взятых в GenBank.
Отсутствие гомологии с другими видами ортопоксвирусов и родами поксвирусов являлось одним из критериев отбора олигонуклеотидов.
Таким образом, для каждого вида ортопоксвирусов была подобрана пара праймеров, которая высококонсервативна к своему виду и не имеет гомологии с другими видами.
Последовательности праймеров и соответствующие им расчетные длины амплификационных продуктов представлены в табл.1.
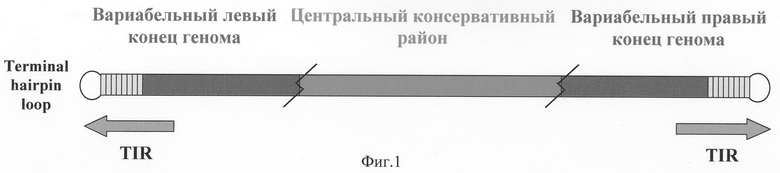
Видоспецифичные различия ортопоксвирусов определяются концевыми вариабельными районами вирусного генома, тогда как центральная часть является высококонсервативной по нуклеотидной последовательности (фиг.1). Поэтому именно в концевых областях и удалось обнаружить потенциальные участки для видоспецифичной амплификации вирусных ДНК (фиг.2).
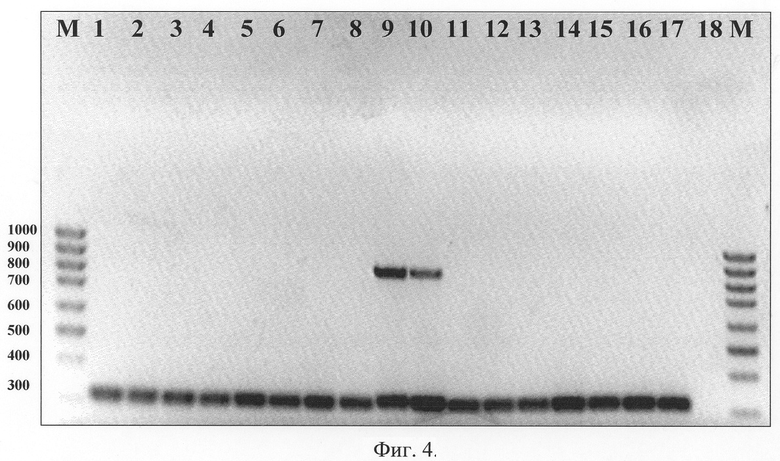
Так, для вируса осповакцины районом для проведения ПЦР была выбрана область рамки C9L (по номенклатуре генов вируса осповакцины штамма Copenhagen) на левом вариабельном конце генома вирусов. Для оспы коров - район рамки B9R (по номенклатуре генов вируса оспы коров штамма GRI-90), а для натуральной оспы - район рамок B10R, B11R (по номенклатуре генов вируса натуральной оспы штамма India) на правом вариабельном конце генома вирусов. В случае вируса оспы обезьян, был взят район OPT E5R (по номенклатуре генов вируса оспы обезьян штамма Zaire-96-1-16). Область находится в консервативном центральном районе ортопоксвирусного генома и имеет несколько коротких делений [33]. Данный факт позволил рассчитать видоспецифичные праймеры к вирусу оспы обезьян (фиг.3). За счет наличия у других видов ортопоксвирусов небольшой вставки в районе выбранных праймеров при проведении ПЦР образуется продукт только в случае вируса оспы обезьян (фиг.4).
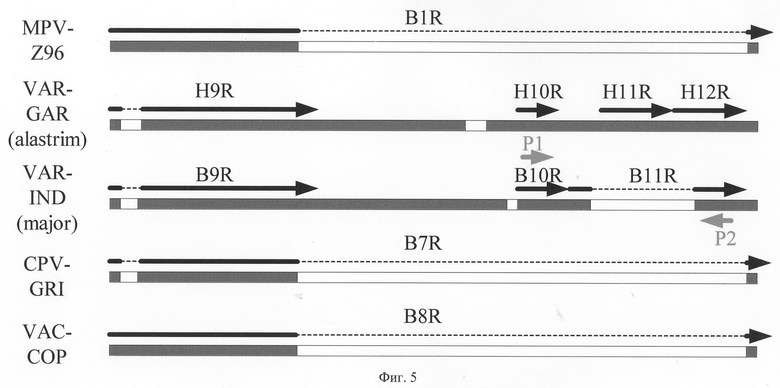
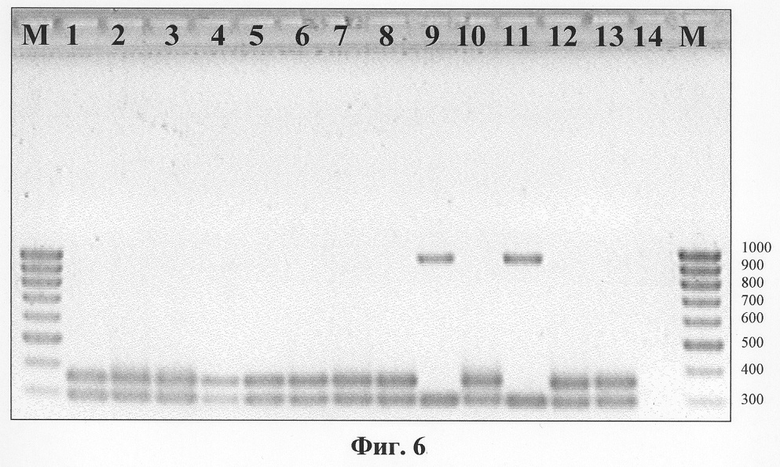
На фиг.5 приведена схема подбора олигонуклеотидов для вируса натуральной оспы, а на фиг.6 - результаты амплификации с подобранной парой праймеров. Важной особенностью выбранной для ВНО пары праймеров является то, что в процессе ПЦР удается дискриминировать такие подтипы ВНО как major и minor. Для штаммов ВНО minor Brazil-128 и Butler образуются ПЦР-продукты размером 982 п.н., а для ВНО major - 356 п.н. (фиг.6, табл. 2).
В случае ВОВ выбран район OPT C9L (фиг.7), значительно отличающийся по нуклеотидной последовательности от других видов ортопоксвирусов [24, 25]. Тем не менее, один из используемых праймеров (Р2) гомологичен последовательности ДНК ВОО, но другой праймер видоспецифичен для ВОВ (фиг.7). Поэтому ПЦР-амплификат образуется только на ДНК ВОВ (фиг.8).
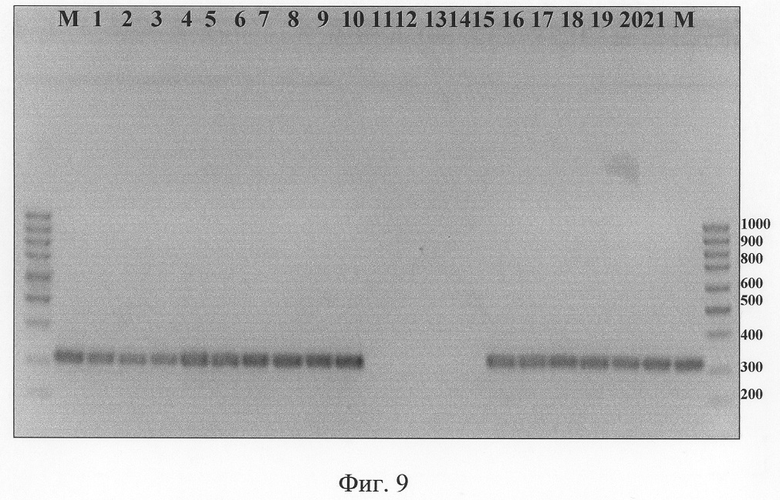
Родоспецифичные праймеры были рассчитаны к району гена малой субъединицы рибонуклеотид редуктазы (OPT - F4L), являющегося высококонсервативным. В МПЦР-анализе данные праймеры применялись для дискриминации ортопоксвирусов от других родов поксвирусов, а также для определения наличия ортопоксвирусной ДНК в образце (как внутренний положительный контроль, для того чтобы исключить возможное появление ложноотрицательных результатов). В качестве негативных конролей использовали ДНК вируса миксомы кролика, штамм Lausanne (род Leporipoxvirus), вируса фибромы Шоупа, штамм Kasza (род Leporipoxvirus), танапоксвирус (род Yatapoxvirus) и вируса оспы кур, штамм FP9 (род Avipoxvirus). Результат амплификации представлен на фиг.9.
Рассчитанные олигонуклеотиды были синтезированы на автоматическом синтезаторе 394 DNA/RNA synthesizer (Applied Biosystems) с использованием стандартной фосфоамидитной процедуры.
Ортопоксвирусные ДНК, использованные для тестирования, приведены в табл.2.
Для проведения мультиплексного ПЦР-анализа использовали одновременно все пять пар праймеров (табл. 1), одна из которых является родоспецифичной и при амплификации дает продукт длиной 292 п.н. Остальные пары праймеров являются видоспецифичными и при амплификации дают продукты соответствующей длины (см. табл. 1).
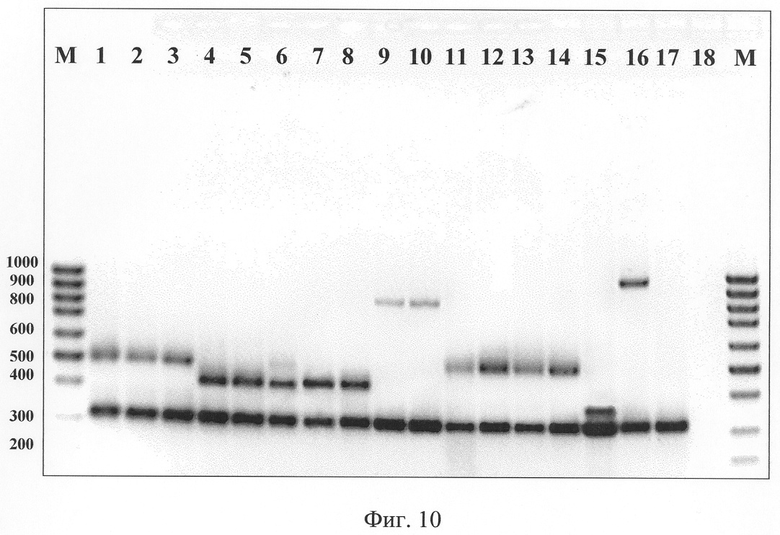
Пример мультиплексного ПЦР-анализа набора штаммов ортопоксвирусов представлен на фиг.10. Видно, что все ортопоксвирусы, патогенные для человека, образуют характеристичные по размеру фрагменты ДНК. Близкородственный вирус эктромелии (ВЭ), непатогенный для человека, можно рассматривать как внутренний отрицательный видовой контроль, так как в разработанном МПЦР образуется лишь родоспецифичный фрагмент ДНК (фиг.10).
Таким образом, сущность изобретения заключается в том, что разработана стратегия подбора родоспецифичного и видоспецифичных праймеров для рутинной идентификации ортопоксвирусов при проведении мультиплексного ПЦР-анализа. В результате создан набор из пяти пар олигонуклеотидов-праймеров, включающий последовательность, видоспецифичную для вируса осповакцины
5'→3' 5' ggtgtagtcgtaatcgtaatcgtctaatt 3'
3'←5' 5' aagatactctatgatagttgtaaaacatttaacatc 3';
последовательность, видоспецифичную для вируса оспы коров
5'→3' 5' atcagatggaattatctctcacccg 3'
3'←5' 5' gataatttgatccatctcgtccacc 3';
последовательность, видоспецифичную для вируса натуральной оспы
5'→3' 5' cgtcactgagtttacagatagcggtt 3'
3'←5' 5' gccaacgttatcatatattggagacg3;
последовательность, видоспецифичную для вируса оспы обезьян
5'→3' 5' atgttgatattaataatcgtattgtggtt3'
3'←5' 5' aaagtcaatacactcttaaagattctcaa3';
последовательность, родоспецифичную для всех ортопоксвирусов
5'→3' 5' cgttggaaaacgtgagtccgg 3'
3'←5' 5' attggcgttttttgcagccag 3'.
Изобретение иллюстрируется следующими графическими материалами.
Фиг.1. Схема организации генома ортопоксвирусов. TIR-обращенные (инвертированные) концевые повторы. Terminal harping loop - обращенная концевая шпилька-последовательность около 100 неполностью спаренных нуклеотидов [9].
Фиг.2. Графическое выравнивание левых (А) и правых (В) концевых видоспецифичных районов генома вирусов оспы коров CPV-GRI, осповакцины VAC-COP, натуральной оспы VAR-IND и оспы обезьян MPV-ZAI. Стрелками обозначены направление и размер ОРТ, внутри которых проводили видоспецифичную ПЦР-амплификацию. Над стрелками приведены названия соответствующих ОРТ. Тонкими линиями обозначены районы делеций в ДНК одних вирусов относительно других. Окружностями обозначены концевые шпильки вирусных ДНК.
Фиг.3. Сравнение нуклеотидной последовательности OPT E5R ВОО штамм Zaire-96-1-16 [EMBL: AF380138] (MPV-ZAI) с соответствующими районами генома ВОО, штамм 86-21 [20] (MPV-86); BOB, штаммы: Copenhagen [EMBL: M35027] (VAC-COP), Tian-tan [EMBL:AF 095689] (VAC-TT), Ankara [EMBL: U9488] (VAC-ANK); BHO, штаммы: India-1967 [EMBL: X69198] (VAR-IND), Bangladesh-1975 [EMBL: L22579] (VAR-BSH), Garcia-1966 [EMBL: Y16780] (VAR-GAR); вирус оспы верблюдов, штаммы: М9б [EMBL: AF438165] (CmPV-M96), CMS [EMBL: AY009089] (CmPV-CMS); BOK, штаммы: Brighton [EMBL: CV32634] (CPV-BRI), Larkin [EMBL: CV32635] (CPV-LAR); вирус эктромелии, штамм Naval (ECT-NAV). Идентичные нуклеотиды в сравниваемых последовательностях вирусного генома по отношению к последовательности OPT E5R MPV-ZAI обозначены точками, делеций - прочерком. Цифры слева и справа от нуклеотидных последовательностей обозначают положение нуклеотидов в анализируемом сегменте ДНК. Полужирным курсивом приведены последовательности олигонуклеотидных праймеров P1 и P2 для ПЦР-амплификации, специфичной для MPV.
Фиг.4. Результат электрофоретического разделения в 2% геле агарозы фрагментов ДНК, полученных после ПЦР при использовании олигонуклеотидных праймеров, рассчитанных для района ОРТ E5R MPV-ZAI, одновременно с праймерами для родоспецифичной идентификации ортопоксвирусов. 1. BOB, штамм Copenhagen; 2. BOB, штамм Л-ИВП; 3. Вирус оспы буйволов, штамм ВР-1; 4. BOK, штамм Puma-73; 5. BOK, штамм GRI-90; 6. BOK, штамм Turkmenia; 7. BOK, штамм Humburg; 8. BOK, штамм ЕР-1; 9. BOO, штамм Zaire-96-1-16; 10. BOO, штамм Congo-8; 11. BOB, штамм Chambon St-Yves; 12. BOB, штамм ЕМ-63; 13. BOB, штамм Western Reserve; 14. Вирус оспы кроликов, штамм Utrecht; 15. ВНО, штамм Ind-3а; 16. ВНО, штамм Butler; 17. Вирус эктромелии, штамм МР-1; 18. Отрицательный контроль. М. ДНК-маркер, длина в п.н. показана слева.
Фиг.5. Графическое выравнивание видоспецифичного районого вируса натуральной оспы VAR-IND (подвид variola major) и VAR-GAR (подвид variola alastrim) с соответствующими районами генома вирусов оспы коров CPV-GRI, осповакцины VAC-COP, оспы обезьян MPV-Z96. Черными стрелками обозначены направление и размер ОРТ. Над стрелками приведены названия соответствующих OPT. P1 (5'→3'), р2 (3'←5')-видоспецифичные олигонуклеотиды для вируса натуральной оспы.
Фиг.6. Результат электрофоретического разделения в 2% геле агарозы фрагментов ДНК, полученных после ПЦР при использовании олигонуклеотидных праймеров, рассчитанных для района OPT B10R-B11R VAR-IND, одновременно с праймерами для родоспецифичной идентификации ортопоксвирусов. Анализировали амплификаты, полученные на ДНК разных штаммов ВНО: 1. Ngami; 2. Ind-За; 3. Kuw-5; 4. 12-62; 5. 6-58; 6. M-Abr-60; 7. Congo-9; 8. M-Sur-60; 9. Butler; 10. M-Sok-60; 11. Brazil-128; 12. India-164; 13. Aslam; 14. Отрицательный контроль; М. ДНК-маркер, длина в п.н. показана справа.
Фиг.7. Сравнение нуклеотидной последовательности OPT C9L ВОВ штамм Copenhagen [EMBL: M35027] (VAC-COP) с соответствующими районами генома ВОВ, штаммы: Tian-tan [EMBL:AF 095689] (VAC-TT), Ankara [EMBL: U9488] (VAC-ANK); BOO, штамм Zaire-96-1-16 [EMBL: AF380138] (MPV-ZAI); BHO, штаммы: India-1967 [EMBL: X69198] (VAR-IND), Bangladesh-1975 [EMBL: L22579] (VAR-BSH), Garcia-1966 [EMBL: Y16780] (VAR-GAR); BOK, штамм GRI-1990 [EMBL: Y11842] (CPV-GRI); вирус оспы верблюдов, штаммы: М96 [EMBL: AF438165] (CmPV-M96), CMS [EMBL: AY009089] (CmPV-CMS); вирус эктромелии, штамм Naval (ECT-NAV). Идентичные нуклеотиды в сравниваемых последовательностях вирусного генома по отношению к последовательности ОРТ C9L VAC-COP обозначены точками, делеции - прочерком. Цифры слева и справа от нуклеотидных последовательностей обозначают положение нуклеотидов в анализируемом сегменте ДНК. Полужирным курсивом приведены последовательности олигонуклеотидных праймеров P1 и P2 для ПЦР-амплификации, специфичной для VAC.
Фиг.8. Результат электрофоретического разделения в 2% геле агарозы фрагментов ДНК, полученных после ПЦР при использовании олигонуклеотидных праймеров, рассчитанных для района OPT C9L VAC-COP, одновременно с праймерами для родоспецифичной идентификации ортопоксвирусов. 1. BOB, штамм Copenhagen; 2. BOB, штамм Л-ИВП; 3. Вирус оспы буйволов (ВОБ), штамм ВР-1; 4. BOK, штамм Puma-73; 5. BOK, штамм GRI-90; 6. BOK, штамм Turkmenia; 7. BOK, штамм Humburg; 8. BOK, штамм ЕР-1; 9. BOO, штамм Zaire-96-1-16; 10. BOO, штамм Congo-8; 11. BOB, штамм Chambon St-Yves; 12. BOB, штамм ЕМ-63; 13. BOB, штамм Western Reserve; 14. Вирус оспы кроликов, штамм Utrecht; 15. ВНО, штамм Ind-3а; 16. ВНО, штамм Butler; 17. Вирус эктромелии, штамм МР-1; 18. Отрицательный контроль. М. ДНК-маркер, длина в п.н. показана слева.
Фиг.9. Результат электрофоретического разделения в 2% геле агарозы фрагментов ДНК, полученных после ПЦР при использовании олигонуклеотидных праймеров, рассчитанных на консервативный родоспецифичный район OPT F4L. 1. BOB, штамм Copenhagen; 2. BOB, штамм Л-ИВП; 3. ВОБ, штамм ВР-1; 4. ВОК, штамм Puma-73; 5. ВОК, штамм GRI-90; 6. ВОК, штамм Turkmenia; 7. ВОК, штамм Humburg; 8. ВОК, штамм ЕР-1; 9. BOO, штамм Zaire-96-1-16; 10. BOO, штамм Congo-8; 11. Вирус миксомы кроликов, штамм Lausanne; 12. Вирус фибромы Шоупа, штамм Kasza; 13. Вирус оспы птиц, штамм FP9; 14. Танапокс вирус; 15. BOB, штамм Chambon St-Yves; 16. BOB, штамм ЕМ-63; 17. BOB, штамм Western Reserve; 18. Вирус оспы кроликов, штамм Utrecht; 19. ВНО, штамм Ind-За; 20. ВНО, штамм Butler; 21. Вирус эктромелии, штамм МР-1; М. ДНК-маркер, длина в п.н. показана справа.
Фиг.10. Результат электрофоретического разделения в 2% геле агарозы фрагментов ДНК, полученных после ПЦР при использовании 4 пар олигонуклеотидных праймеров для видоспецифичной и одной пары - для родоспецифичной идентификации ортопоксвирусов. 1. BOB, штамм Copenhagen; 2. BOB, штамм Л-ИВП; 3. ВОБ, штамм ВР-1; 4. ВОК, штамм Puma -73; 5. ВОК, штамм GRI-90; 6. ВОК, штамм Turkmenia; 7. ВОК, штамм Humburg; 8. ВОК, штамм ЕР-1; 9. BOO, штамм Zaire-96-1-16; 10. BOO, штамм Congo-8; 11. BOB, штамм Chambon St-Yve; 12. BOB, штамм ЕМ 63; 13. BOB, штамм Western Reserve (VAC-WR); 14. Вирус оспы кроликов, штамм Utrecht; 15. ВНО, штамм Ind-За; 16. ВНО, штамм Butler; 17. Вирус эктромелии, штамм МР-1; 18. Отрицательный контроль; М. ДНК-маркер, длина в п.н. показана справа.
Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления.
Пример 1. Методика получения набора праймеров для дифференциальной диагностики ортопоксвирусов.
На основе теоретического изучения доступных нуклеотидных последовательностей ДНК различных штаммов ВОК, BOB, BOO, BHO были синтезированы праймеры для проведения мультиплексного ПЦР-анализа (табл. 1).
Отработка условий амплификации проводилась при использовании ДНК 55 штаммов 6 различных видов ортопоксвирусов (табл. 2). Использовали экспериментальные образцы ВОВ и ВОК, полученные из оспин с ХАО развивающихся куриных эмбрионов (РКЭ), а также клинические образцы BHO (корочки кожного поражения, полученные от людей, болевших натуральной оспой в 1975 г., и сохраненные в Российской коллекции вируса натуральной оспы) и ВОВ (корочки кожных поражений). В качестве негативных контролей были использованы ДНК поксвирусов других родов: вируса миксомы кролика, штамм Lausanne (получена от G. McFadden, Robarts Research Institute, London, Canada) и вируса фибромы Шоупа, штамм Kasza (получена от D. Evans, University of Guelph, Guelph, Canada) (род Leporipoxvirus), вируса оспы кур, штамм FP9 (род Avipoxvirus) (получена от М. Skinner, Institute of Animal Health, Newbury, UK) и танапоксвируса (род Yatapoxvirns) (получена от J. Esposito, CDC, Atlanta, USA).
Ниже в примерах (2-4) приведена методика индикации генетического материала ортопоксвирусов в пробе.
Пример 2. Выделение ортопоксвирусных ДНК.
1. Оспины с ХАО РКЭ или фрагменты накожных корочек, выделенных от людей, гомогенизируют в растворе, содержащем 200 мкл лизирующего буфера (100 мМ Tris-HCl (pH 8.0), 100 мМ ЭДТА, 100 мМ NaCl, 1% SDS) и 20 мкл раствора протеиназы К (10 мг/мл).
2. Инкубируют 10 мин при 56°С.
3. Центрифугируют 7 мин при 18000 g.
4. К супернатанту добавляют 400 мкл смеси фенол/хлороформа (1:1).
5. Перемешивают на Vortex в течение 1 мин, затем центрифугируют материал при 450 g 1 мин.
6. Водную фазу (верхнюю) отбирают в новые пробирки, затем остатки фенола экстрагируют изоамиловым спиртом.
7. Добавляют 1/10 по объему 3М раствор ацетата натрия (рН 5.5) и два объема этанола (96%).
8. Центрифугируют с последующим удалением водной фазы.
9. Пробирку переворачивают вверх дном и высушивают осадок при комнатной температуре в течение 20 мин.
10. Осадок ДНК растворяют в 15 мкл воды.
Пример 3. ПЦР анализ.
Состав реакционной смеси
Растворы № 1 и 2 соответственно для амплификации:


Условия проведения реакции:
Амплификация проводится с горячим стартом по следующей схеме.
Раствор №1 и раствор №2 готовить во льду. Затем раствор №2 быстро перемешать с раствором №1 и сразу поместить пробы в термостат на 93°С - 2 мин. Далее проводить амплификацию по следующей схеме - 30 циклов: 93°С -30 с, 50°С - 45 с, 72°С - 2 мин. Заключительная стадия: 72°С - 10 мин.
Пример 4. Анализ продуктов амплификации.
Анализ продуктов амплификации проводится в 2% агарозном геле (фиг.4, 6, 8-10). Длина полученного ПЦР-фрагмента в исследуемых образцах должна соответствовать расчетной для каждого вида ортопоксвируса, а в отрицательном контроле (реакционная смесь, не содержащая ДНК матрицу) продукты амплификации отсутствуют.
Таким образом, впервые разработан метод видоспецифичной экспресс-диагностики ортопоксвирусов, патогенных для человека, использующий одностадийный мультиплексный ПЦР.
Основными преимуществами метода являются:
- высокая надежность метода, основанная на одновременном анализе нескольких участков ортопоксвирусного генома (родоспецифичный и видоспецифичный);
- быстрота проведения анализа;
- простота выполнения методики, исключающая необходимость привлечения высококвалифицированного персонала;
- относительная дешевизна метода.
Литература
1. Baxby D., Bennett M. // Arch. Virol. - 1997. - Vol. 13 (Suppl.). - P.1-12.
2. Breman J.G. Monkeypox: an emerging infection for humans? Eds W.M.Scheld et. al. Emerging infection 4. - ASM Press. - Washington D.C. - 2000. - P.45-67.
3. Meyer H., Schay C., Mahnel H. et. al. // Arch. Virol. - 1999. - Vol. 144. - P.491-501.
4. Mukinda V.В., Mwema G., Kilundu M. et. al. // Lancet. - 1997. - Vol. 349. - P.1449-1450.
5. Hutin Y.J.F., Williams R.J., Malfait P. et. al. // Emerg. Infect. Dis. - 2001. - Vol. 7. - P.434-438.
6. Breman J.G.. Henderson D.A. // N. Engl. J. Med. - 2002. - Vol. 346. - P.1300-1308.
7. Spencer R.C., Lightfoot N.F. // J. Infect. - 2001. - Vol. 43. - P.104-110.
8. Мацевич Г.Р., Радюк С.Н., Рыжов К.А. и др. // Вопр. вирусол. - 1996. - №5. - С.195-197.
9. Маренникова С.С., Щелкунов С.Н. Патогенные для человека ортопоксвирусы. - КМК Scientific Press Ltd. - Москва. - 1998. - 386 С.
10. Авакян А.А., Альтштейн А.Д., Кириллова Ф.М. и др. // Вопр. вирусол. - 1981. - №2. - С.196-203.
11. Мальцева Н.Н. Экспресс-диагностика заболеваний, вызванных ортопокс- и некоторыми герпес вирусами. - 1980. - Дисс. докт., M.
12. Маренникова С.С., Мацевич Г.Р., Хабахпашев Н.А. и др. // Вопр. вирусол. - 1986. - №6. - С.689-690.
13. Маренникова С.С., Янова Н.Н., Жукова О.А. // Ж. микробиол. - 1990. - №8. - С.57-62.
14. Marennikova S.S., Nagieva F.G., Matsevich G.R. et. al. // Acta. Virol. - 1988. - №32. P.19-26
15. Сафронов П.Ф., Рязанкина О.И., Петров Н.А. и др. // Молекул, биол. - 1999. - Т.33. - №2. - С.291-302.
16. Сафронов П.Ф., Тотменин А.В., Рязанкина О.И. и др. // Молекул, биол. - 1999. - Т. 33. - №2. - С.303-313.
17. Щелкунов С.Н. // Молекул. биол. - 1996. - Т. 30. - Вып.1. - С.5-32.
18. Щелкунов С.Н., Маренникова С.С., Блинов В.М. и др. // Докл. Акад. наук. - 1993. - Т. 328. - №5. - С.629- 632.
19. Antoine G., Scheiflinger F., Dorner F. et. al. // Virology. - 1998. - Vol. 244. - P.365-396.
20. Goebel S.J., Johnson G.P., Perkus M.E. et. al. // Virology. - 1990. - Vol. 179. - P.247-266.
21. Massung R.F., Liu L.I., Qi J. et. al. II Virology. - 1994. - Vol. 201. - P.215-240.
22. Shchelkunov S.N., Massung R.F., Esposito J.J. // Virus. Res. - 1995. - Vol. 36. - С.107-118.
23. Shchelkunov S.N., Resenchuk S.M., Totmenin A.V. et. al. // FEBS Lett. - 1993. - Vol. 327. - P.321-324.
24. Shchelkunov S.N., Safronov P.F., Totmenin A.V. et. al. // Virology. - 1998. - Vol. 243. - P.432-460.
25. Shchelkunov S.N., Totmenin A.V., Loparev V.N. et. al. // Virology. - 2000. - Vol. 66. - P. 361-386.
26. Shchelkunov S.N., Totmenin A.V., Babkin I.V. et. al. // FEBS Lett. - 2001. - Vol. 509. - P.66-70.
27. Ropp S.L., Jin Q.I., Knight J.C. et. al. // J. Clin. Microbiol. - 1995. - Vol. 33. - P.2069-2076.
28. Meyer H., Ropp S.L., Esposito J.J. // J. Virol. Meth. - 1997. - Vol. 64. - P. 217-221.
29. Loparev V.N., Massung R.F., Esposito J.J. et. al. // J. Clin. Microbiol. - 2001. - Vol. 39. - P.94-100.
30. Resenchuk S.M., Blinov V.M. // Comput. Appl. Biosci. - 1995. - Vol. 11. - P.7-11.
31. Breslauer et al. // Proc. Natl. Acad. Sci. USA. - 1986. - Vol. 83. - P.3746.
32. Freier et al. // Proc. Natl. Acad. Sci. USA. - 1986. - Vol. 83. - P.9373.
33. Douglass N.J., Richardson M., Dumbell K.R. // J. Gen. Virol. - 1994. - Vol. 75. - P.1303-1309.



| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНОМЕЧЕНЫХ ЗОНДОВ ДЛЯ ВИДОСПЕЦИФИЧНОЙ ЭКСПРЕСС-ИДЕНТИФИКАЦИИ ОРТОПОКСВИРУСОВ НА ОСНОВЕ МУЛЬТИПЛЕКСНОЙ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ | 2010 |
|
RU2427648C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pFastBac-B17R, СОДЕРЖАЩАЯ ФРАГМЕНТ ГЕНОМА ВИРУСА ОСПЫ КОРОВ, КОДИРУЮЩИЙ АЛЬФА/БЕТА-ИНТЕРФЕРОНСВЯЗЫВАЮЩИЙ БЕЛОК И ШТАММ БАКУЛОВИРУСА BvB17RG, ПРОДУЦИРУЮЩИЙ РАСТВОРИМЫЙ АЛЬФА/БЕТА-ИНТЕРФЕРОНСВЯЗЫВАЮЩИЙ БЕЛОК ВИРУСА ОСПЫ КОРОВ | 2009 |
|
RU2405824C1 |
| НАБОР ОЛИГОНУКЛЕОТИДОВ-ПРАЙМЕРОВ, БИОЧИП И СПОСОБ ВИДОВОЙ ИДЕНТИФИКАЦИИ ОРТОПОКС- И ГЕРПЕСВИРУСОВ, ПАТОГЕННЫХ ДЛЯ ЧЕЛОВЕКА | 2006 |
|
RU2318875C1 |
| ШТАММ "ВНИИЗЖ 2003" ВИРУСА ОСПЫ КОЗ VARIOLA VIRUS CAPRINUM ДЛЯ ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ И СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ОСПЫ КОЗ | 2008 |
|
RU2389791C1 |
| ВИРУСВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ОСПЫ ОВЕЦ И ОСПЫ КОЗ КУЛЬТУРАЛЬНАЯ СУХАЯ | 2009 |
|
RU2403064C1 |
| Набор олигонуклеотидных праймеров для выявления ДНК ортопоксвирусов методом изотермической амплификации в режиме реального времени | 2024 |
|
RU2823776C1 |
| Рекомбинантный штамм VACΔ6 вируса осповакцины с нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R, B8R для получения живой культуральной аттенуированной вакцины против натуральной оспы и других ортопоксвирусных инфекций человека | 2016 |
|
RU2621868C1 |
| ВИРУС-ВАКЦИНА ПРОТИВ ОСПЫ КОЗ КУЛЬТУРАЛЬНАЯ СУХАЯ | 2008 |
|
RU2396977C1 |
| НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНЫХ ЗОНДОВ ДЛЯ ВИДОСПЕЦИФИЧНОЙ ЭКСПРЕСС-ИДЕНТИФИКАЦИИ ВИРУСА МАРБУРГ МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2011 |
|
RU2458143C1 |
| НАБОР РОДО- И ВИДОСПЕЦИФИЧНЫХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ ДЛЯ ДЕТЕКЦИИ И ВИДОВОЙ ИДЕНТИФИКАЦИИ ИЕРСИНИЙ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2006 |
|
RU2354700C2 |




Изобретение относится к молекулярной биологии, вирусологии и медицинской биотехнологии и предназначено для экспресс-диагностики ортопоксвирусных инфекций за счет мультиплексного ПЦР-анализа. Подобраны пары праймеров, специфичные для каждого вида ортопоксвирусов. Введение дополнительной пары праймеров к высококонсервативному району данных вирусов в качестве положительного контроля позволяет увеличить чувствительность способа, сократив вероятность появления ложноотрицательных результатов. Данный подход позволяет усовершенствовать технику ПЦР-анализа для рутинного использования в диагностике ортопоксвирусных инфекций за счет применения только одного мультиплексного ПЦР-анализа (МПЦР). Мультиплексный ПЦР-анализ позволяет выявить вирусный материал в одной реакционной смеси, не прибегая к использованию дополнительных способов анализа, тем самым сокращается время диагностики и процент технологических ошибок. 2 табл., 10 ил.
Набор олигонуклеотидов-праймеров для видоспецифичной экспресс-идентификации ортопоксвирусов, содержащий 5 пар дезоксирибо-олигонуклеотидов, включающий последовательность, видоспецифичную для вируса осповакцины
5'→3' 5' ggtgtagtcgtaatcgtaatcgtctaatt 3'
3'←5' 5' aagatactctatgatagttgtaaaacatttaacatc 3';
последовательность, видоспецифичную для вируса оспы коров
5'→3' 5' atcagatggaattatctctcacccg 3'
3'←5' 5' gataatttgatccatctcgtccacc 3';
последовательность, видоспецифичную для вируса натуральной оспы
5'→3' 5' cgtcactgagtttacagatagcggtt 3'
3'←5' 5' gccaacgttatcatatattggagacg 3;
последовательность, видоспецифичную для вируса оспы обезьян
5'→3' 5' atgttgatattaataatcgtattgtggtt 3'
3'←5' 5' aaagtcaatacactcttaaagattctcaa 3';
последовательность, родоспецифичную для всех ортопоксвирусов
5'→3' 5' cgttggaaaacgtgagtccgg 3'
3'←5' 5' attggcgttttttgcagccag 3'.
| Мальцева Н.Н | |||
| Экспресс-диагностика заболеваний, вызванных ортопокс и некоторыми герпес-вирусами | |||
| Вопросы вирусологии | |||
| - М., 1980, с.25-30. |
Авторы
Даты
2004-06-20—Публикация
2002-07-15—Подача