Изобретение относится к разработке набора олигонуклеотидных праймеров для выявления ДНК ортопоксвирусов в образцах нуклеиновых кислот, выделенных из содержимого кожных поражений (в зависимости от стадии болезни - везикул, пустул, корочки, соскоб со дна пузырьков, макул или папул) или образцов мазков с задней стенки глотки и миндалин или образцов цельной венозной крови (ЭДТА) или аутоптатов легких, печени и селезенки человека при проведении диагностических исследований и эпидемиологического мониторинга.
Симптоматика ортопоксвирусной инфекции имеет широкий спектр проявлений таких, как сыпь, боль в горле, лихорадка, боли в мышцах и спине, увеличение лимфатических узлов. Данные симптомы характерны также и для менее опасных заболеваний (ветряная оспа, корь и т.д.), что затрудняет дифференциальную диагностику без подтверждающего анализа. Родоспецифичные праймеры позволят на ранних этапах заболевания отсеять в первую очередь наличие ортопоксвирусной инфекции.
Представителями рода Orthopoxvirus (сем. Poxvirus) являются вирусы - коровьей оспы (Cowpox virus), оспы обезьян (Monkeypox virus), натуральной оспы (Variola virus) и осповакцины (Vaccina virus) и др., которые в той или иной степени вносили или вносят вклад в эпидемиологическую обстановку в мире [1]. Два из этих вирусов относятся к I группе патогенности (согласно Российской классификации патогенных микроорганизмов) - вирусы натуральной оспы и оспы обезьян.
Ортопоксвирусы представляют собой оболочечные вирусы «кирпичной формы» (350×270 нм), содержащие двухцепочечный ДНК-геном размером около 200 т.п.н., концы которого соединены ковалентными связями [2]. Геном ортопоксвирусов кодирует 150-200 различных генов. В отличие от других ДНК-вирусов, ортопоксвирусы реплицируются в цитоплазме инфицированных клеток в так называемых вирусных фабриках (тельцах включения Гварниери) [3].
Последний случай естественного заражения вирусом натуральной оспы был зарегистрирован в Сомали в 1977 г [4]. Уже в 1980 г. тридцать третья сессия Всемирной ассамблеи здравоохранения официально объявила о победе над вирусом, но несмотря на это данный вирус может стать возбудителем возвращающейся инфекции в результате природных катаклизмов или халатных действий людей, что может повлечь за собой чрезвычайные эпидемические ситуации [5].
Небольшие вспышки инфекции, вызванных вирусом оспы обезьян наблюдались главным образом во влажных тропических лесах Центральной и Западной Африки (Сьерра-Леоне, Центрально-Африканская Республика, Конго, Либерия, Кот-д'Ивуар, Камерун, Нигерия и Габон) [6]. По данным Всемирной организации здравоохранения (ВОЗ) с начала мая 2022 г. отмечаются случаи заболевания вирусом оспы обезьян в неэндемичных странах. В период с 2022 по 2023 гг. заболевание затронуло более 100 стран мира [7].
Вирус оспы коров пока идентифицирован только в Европе и соседних странах Западной Азии, а также в Египте [8, 9]. Вирус имеет широкий спектр хозяев, и летальные инфекции наблюдались у ряда животных. Кроме того, имеются данные о передаче вируса обезьянам Старого и Нового Света в вольерах на открытом воздухе [10]. Во всех случаях источником заражения считается прямой или косвенный контакт приматов с грызунами.
Коровью оспу, как и обезьянью оспу, можно рассматривать как возникающую или вновь возникающую болезнь.
Вирус осповакцины и его производные используются не только для вакцинации против натуральной оспы, но также служат вектором в молекулярной биологии и исходным материалом для разработки современных вакцин против инфекционных агентов, а также в терапии рака [11]. Иногда сообщается о лабораторных инфекциях ортопоксвирусами у неиммунизированных лиц [12].
В литературе имеются данные о разработанных наборах реагентов для выявления ДНК вируса оспы обезьян, основанные на методе изотермической амплификации [13-14]. Для вирусов натуральной оспы, оспы коров и осповакцины в настоящее время имеются данные только о коммерческих или разработанных наборах методом ПЦР.
Известен набор реагентов для обнаружения ДНК методом изотермической амплификации, опосредованной двойной генной петлей, набор и метод обнаружения вируса оспы обезьян (патент Китая №CN116144839, МПК C12Q1/6844, 23.05.2023 г.) [15]. Реагенты содержат группу праймеров для обнаружения вирусов оспы обезьян, включающую внешние, внутренние и петлевые праймеры. Область обнаружения содержит гены F8L, и каждый ген вирулентности содержит праймеры для амплификации. из нескольких сайтов. Четыре праймера для амплификации и два петлевых праймера разработаны в соответствии с характеристикой синергетической регуляции вируса оспы обезьян. Метод имеет преимущества, заключающиеся в высокой точности, высокой скорости обнаружения и способности специфично обнаруживать вирус оспы обезьян.
Известен другой набор реагентов для обнаружения ДНК вируса оспы обезьян методом изотермической амплификации и способ его обнаружения (патент Китая № CN116287438, МПК C12Q1/6844, 23.06.2023 г.) [16]. Способ обнаружения включает следующие этапы: S1, экстракцию нуклеиновой кислоты вируса оспы обезьян с использованием реагента для экстракции нуклеиновой кислоты, включающего соляную кислоту, уксусную кислоту, хлорид натрия, Твин 20, Тритонкс-100 и вода; s2, конструирование праймера и иммунохроматографического зонда и амплификацию нуклеиновой кислоты вируса оспы обезьян, экстрагированной на этапе S1, с использованием технологии улучшенной рекомбинантно-зависимой амплификации; 5'-конец одного из праймеров модифицируют биотином, а 5'-конец иммунохроматографического зонда модифицируют FAM и S3, проводят анализ результатов иммунохроматографии и оценивают наличие вируса оспы обезьян в пробе. Согласно этому способу операция экстракции нуклеиновой кислоты является простой, удобной, эффективной и быстрой, а чувствительность обнаружения высокой.
Известен набор праймеров для петлевой изотермической амплификации для обнаружения ДНК вируса оспы обезьян и применение комбинации праймеров для петлевой изотермической амплификации (патент Китая № CN115961092, МПК C12Q1/6844, 23.06.2023 г.) [17]. Комбинация праймеров включает праймер для специфической амплификации гена N4R вируса оспы обезьян; комбинация праймеров включает внешний праймер, внутренний праймер и петлевой праймер, внешние праймеры включают MPXV-F3 и MPXV-B3 (метоксиполиксин-F3); нуклеотидная последовательность MPXV-F3 показана в SEQ ID NO: 1, а нуклеотидная последовательность MPXV-B3 показана в SEQ ID NO: 2. Способ обнаружения вируса оспы обезьян с помощью петлевой изотермической амплификации. впервые раскрыт в результате обширных и глубоких исследований и испытаний; праймер с хорошей специфичностью к MPXV обнаружен посредством сравнения и скрининга. Данный праймер не осуществляет специфическую амплификацию только нуклеиновой кислоты, содержащей MPXV. Метод имеет хорошую воспроизводимость и чувствительность.
Наиболее близким аналогом (прототипом) является композиция генных праймеров для обнаружения вируса узелкового заболевания кожи крупного рогатого скота, вируса оспы овец, вируса оспы коз и вируса оспы оленей и ее применение (патент Китая № CN115992295, МПК C12Q1/6844, 21.04.2023 г.) [18]. Изобретение раскрывает набор праймеров LAMP (петлевая изотермическая амплификация) и способ обнаружения для одновременного обнаружения вирусов оспы жвачных. Изобретение включает из следующих праймеров: внешние праймеры F3 и B3, внутренние праймеры FIP и BIP и праймеры петли LF и LB. Праймерная композиция может быть использована для обнаружения вирусов оспы жвачных и может эффективно определять, несет ли подлежащий обнаружению образец вирусы узелкового заболевания кожи крупного рогатого скота, вирусы оспы овец, вирусы оспы коз и вирусы оспы оленей одновременно. Комбинация праймеров обладает характеристиками хорошей специфичности, высокой чувствительности, быстротой диагностики и стабильности.
Недостатком известных выше приведенных аналогов и прототипа является применение их только для выявления ДНК вируса оспы обезьян или для поксвирусов вирусов имеющих селькохозяйственное значение. Разработанный нами набор олигонуклеотидных праймеров позволяет выявлять ДНК представителей рода ортопоксвирусов, способных поражать людей, что ускорит постановку первичного диагноза и принятие решении о дальнейшей детальной диагностики (ПЦР на различные виды ортопоксвирусов).
Техническим результатом заявляемого изобретения является создание родоспецифических праймеров для выявления ортопоксвирусов в образцах нуклеиновых кислот, выделенных из содержимого кожных поражений или образцов мазков с задней стенки глотки и миндалин или образцов цельной венозной крови (ЭДТА) или аутоптатов легких, печени и селезенки человека при проведении диагностических и эпидемиологических исследований методом изотермической амплификации.
Указанный технический результат достигается созданием набора олигонуклеотидных праймеров для выявления ДНК ортопоксвирусов методом изотермической амплификации в режиме реального времени, содержащий 5 праймеров: внешние -O-F3 и O-B3, внутренние O-FIP и O-BIP, петлевой праймер - O-LF, имеющие следующие нуклеотидные последовательности SEQ ID NO: 1-5 соответственно:
SEQ ID NO:1. Последовательности олигонуклеотидов родоспецифичных к ортопоксвирусам (прямой внешний праймер О-F3 5`→3`).
О-F3: 5`-GCCTTATCGAATACTCTTCCG-3`
SEQ ID NO:2. Последовательности олигонуклеотидов родоспецифичных к ортопоксвирусам (обратный внешний праймер О-B3 5`→3`):
5`-ATGAGAGAGGATCATAAGTCTT-3`
SEQ ID NO:3. Последовательности олигонуклеотидов родоспецифичных к ортопоксвирусам (прямой внутренний праймер О-FIP 5`→3`):
5`- TTCGTATTGAATCAGTGGGGCTTTTTCGATGTCTACACAGGCA -3`
SEQ ID NO:4. Последовательности олигонуклеотидов родоспецифичных к ортопоксвирусам (обратный внутренний праймер О-BIP 5`→3`):
5`- TTGGCAGTACTCATTAATAACGGTTTTTTGATGATGTTATTCCGGCTAA -3`
SEQ ID NO:5. Последовательности олигонуклеотидов родоспецифичных к ортопоксвирусам (петлевой праймер О-LF 5`→3`):
5`- GACAGGGTTAGCACCTTTCCAA -3`
Технология получения набора олигонуклеотидных праймеров для выявления ДНК ортопоксвирусов методом изотермической амплификации в режиме реального времени
Дизайн праймеров
Дизайн праймеров, необходимых для получения клонируемых фрагментов гена OPG065 осуществляли при помощи программы Primer Explorer V5, используя известные нуклеотидные последовательности геномов различных ортопоксвирусов (вирус осповакцины, оспы коров, оспы обезьян и натуральной оспы), доступные в базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank). При конструировании олигонуклеотидных праймеров учитывались следующие требования: отсутствие протяженных участков повторяющихся нуклеотидов, отсутствие комплементарных последовательностей длиной более трех оснований внутри олигонуклеотидов, высокое содержание GC-оснований (не менее 50 %). Для определения температуры отжига праймеров использовали on-line приложение OligoCalc URL (http://www.basic.northwestern.edu/biotools/oligocalc.html). Анализ возможности образования олигонуклеотидами вторичных структур, понижающих эффективность изотермической амплификации, проверяли также с помощью программы VectorNTI v.8 (InforMax, США).
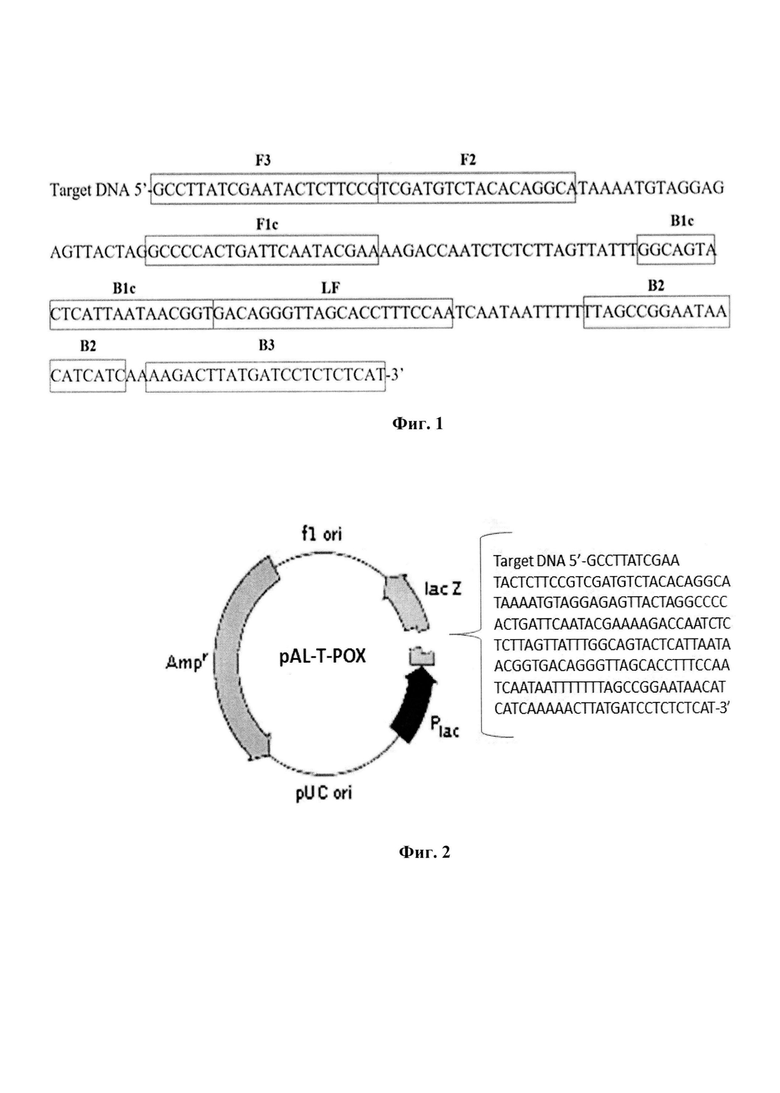
В результате были получены 5 олигонуклеотидных праймеров (производства ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора): внешние - O-F3 и O-B3, внутренние O-FIP (состоящий из участков F1c и F2) и O-BIP (B1c и B2), петлевой праймер - О-LF. Структура разработанных праймеров представлена в таблице 1. Области наложения праймеров и участков праймеров на нуклеотидную последовательность гена OPG065 вируса осповакцины изображены на Фиг.1.
Таблица 1. Структура разработанных олигонуклеотидных праймеров
Получение положительного контроля
Получение ампликона для клонирования проводили методом ПЦР с использованием разработанных праймеров - О-F3 и О-B3, и ДНК вируса осповакцины.
Реакционная смесь для ПЦР из расчета на 1 реакцию:
• 5x Screen Mix-HS (Evrogen, Россия) - 5 мкл;
• Праймер О-F3 (2 о.е.) - 1 мкл;
• Праймер О-B3 (2 о.е.) - 1 мкл;
• вода очищенная - 16 мкл;
• Образец- 2 мкл.
Амплификацию проводили в термоциклере T100 («BioRad», США).
Таблица 2. Температурно-временной режим амплификации
Для визуализации результатов ПЦР использовался метод гель-электрофореза в 2% агарозном геле. Для наблюдения за электрофорезом в пробу добавляют краситель, который передвигается со скоростью несколько большей, чем скорость движения наиболее подвижных макромолекул. Также добавляли ДНК-маркер для сопоставления размеров ампликонов. Гель-электрофорез проводили в течении 30 минут при постоянном напряжении 5 В/см в буфере 1х TAE, затем визуализировали результаты в трансиллюминаторе. Полученные ампликоны вырезались скальпелем и элюировались с помощью набора для элюции ДНК из агарозного геля BioSilica (Новосибирск, Россия), согласно инструкции производителя.
Клонирование свеженаработанного ампликона в плазмиду pAL-T проводили с использованием набора для клонирования Quick-TA kit (Евроген, Россия) с дальнейшей химической трансформации клеток XL1-Blue (Евроген, Россия). Оба процесса проводились по инструкциям производителя и включали следующие этапы:
• В стерильной пробирке объемом 0,2 мл готовили реакционную смесь: 2 мкл деионизированная вода, 2 мкл 5X Quick ligation buffer, 1 мкл вектор pAL-T, 4 мкл ПЦР продукт, 1 мкл Quick-TA T4 DNA ligase;
• Перемешивали компоненты реакции, сбрасывали капли и инкубировали в течение 10 минут при комнатной температуре;
• Затем помещали на лед пробирки с компетентными клетками до полного размораживания содержимого, перемешивали суспензию клеток легким встряхиванием;
• Добавляли в пробирку с клетками раствор рекомбинантной плазмидой и аккуратно перемешивали;
• Инкубировали во льду в течение 30 минут;
• Переносили пробирку в водяную баню (42°C) на 30 секунд;
• Быстро переносили пробирку из водяной бане в лед и инкубировали их в течение 5 минут;
• Добавляли 1 мл среды SOC, перемешивали содержимое и инкубировали при 37°C в течение 60 минут в качалке для культивирования (250 об/мин);
• Затем центрифугировали пробирку при 3000 об/мин;
• Засевали клетки на чашки петри с агаризировнаной средой LB и ампициллином (100 мкг/мл).
Выделение плазмидной ДНК проводили с помощью набор diaGene для выделения плазмидной ДНК из бактерий («ДИАЭМ», Россия).
Для подтверждения правильной встройки целевого фрагмента проводили определение нуклеотидных последовательности. Cеквенирование продуктов амплификации проводили по обеим цепям модифицированным методом Сэнгера на основе капиллярного электрофореза с помощью автоматического секвенатора 3130xl Genetic Analyzer («Applied Biosystems», США). Анализ полученных нуклеотидных последовательностей проводили с использованием программы UniproUGENE v. 1.30 и MEGA7.
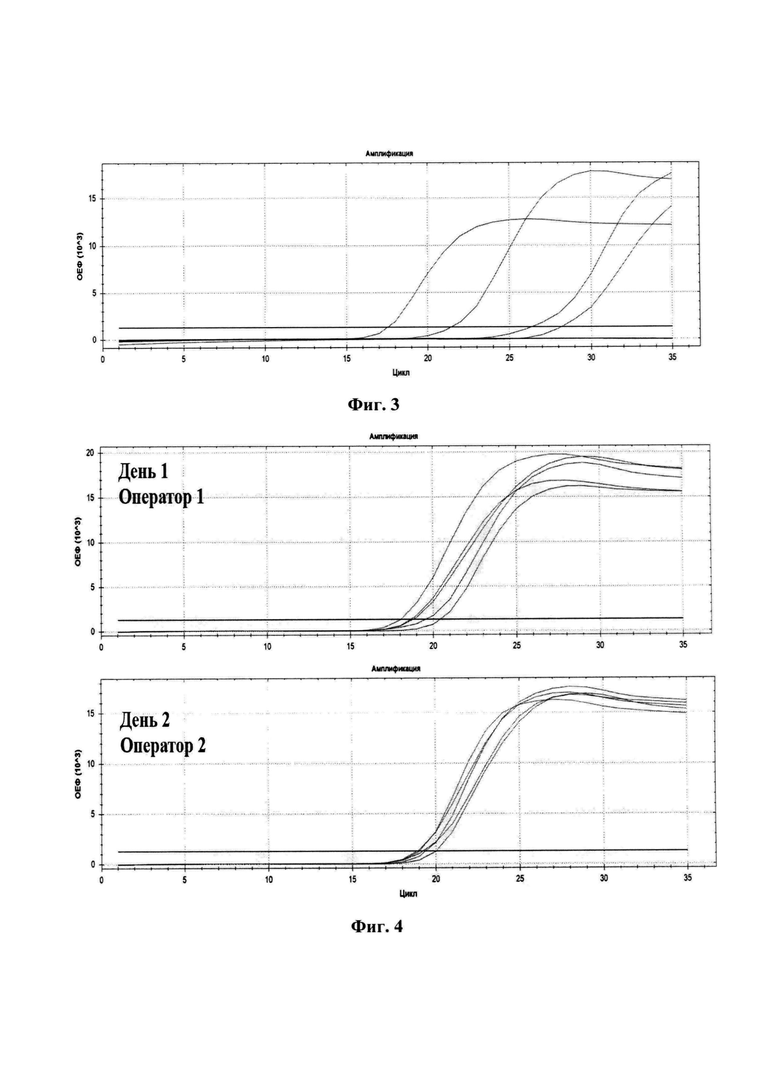
Схема рекомбинантной плазмиды pAL-T-POX представлена на Фиг.2.
Проведение реакции изотермической амплификации
Метод основывается на проведении петлевой изотермической амплификацией с использованием 5 праймеров, которые направлены на распознание 7 регионов таргетной ДНК. Bst ДНК-полимераза, обладающая способностью к расплетанию цепей, инициирует синтез, и два праймера формируют петлеобразную структуру для облегчения последующих раундов амплификации. Для детекции продуктов амплификации применяется интеркалирующий флуоресцентный краситель и накопление флуоресцентного сигнала соответствует наличию в реакционной смеси специфических продуктов амплификации.
Для изотермической ПЦР использовали реакционную смесь следующего состава:
БиоМастер LAMP (2x) (Биолабмикс, Россия) - 12,5 мкл;
Праймер F3 (2 о.е.) - 1 мкл;
Праймер B3 (2 о.е.) - 1 мкл;
Праймер FIP (8 о.е.) - 1 мкл;
Праймер BIP (8 о.е.) - 1 мкл;
Праймер LF (2 о.е.) - 1 мкл;
H2O - 1,5 мкл;
Интеркалирующий краситель EvaGreen (20х) (Biotium, США) - 1 мкл
Образец - 5 мкл.
Амплификацию и регистрацию результатов проводили на приборе CFX 96 (BioRad, США) по каналу FAM.
Таблица 3. Программа изотермической амплификации
флуоресценции
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию (или отсутствию) значения порогового цикла "Ct" в соответствующей графе в таблице результатов).
Результат подлежит учету в случае:
• наличие положительного сигнала на канале FAM в пробах с положительным контрольным образцом (ПКО);
• отсутствия положительного сигнала на канале FAM в пробах с отрицательным контрольным образцом (ОКО).
Результат считать положительным в случае, если кривая накопления флуоресценции для соответствующего образца имеет характерную «сигмовидную» форму и пересекает пороговую линию.
Статистическая обработка
Статистическую обработку данных осуществляли с использованием программного обеспечения Microsoft Excel.
Коэффициент вариации для повторяемости рассчитывали по формуле: CVp, % = Сt (станд.отклон) / Ct (ср.знач.) × 100 % для 5 проб.
Коэффициент вариации для воспроизводимости рассчитывали по формуле: CVp, % = Сt (станд.отклон) / Ct (ср.знач.) ×100 % для 10 проб.
Изобретение иллюстрируется следующими графическими материалами.
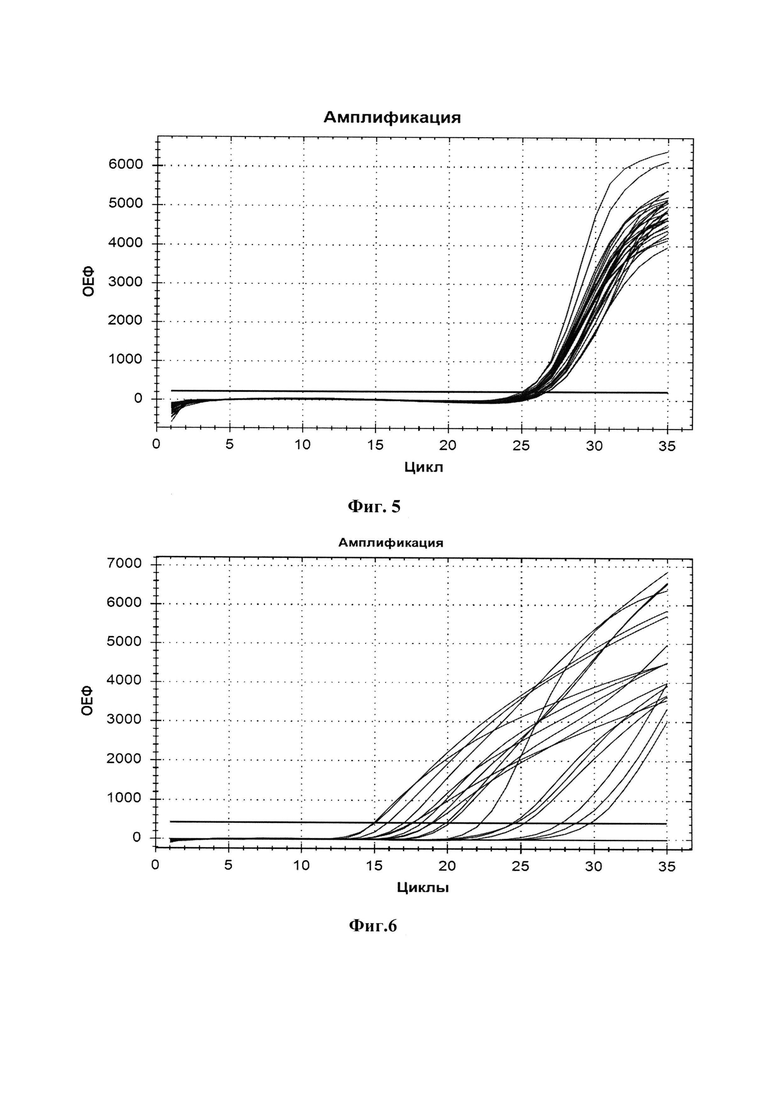
На Фиг. 1. олигонуклеотидная последовательность клонированного в плазмиду ампликона с указанием областей локализации праймеров на фрагменте гена OPG065 вируса осповакцины. На Фиг. 2. упрощенная схема плазмидной ДНК pAL-T-POX с указанием места вирусоспецифической вставки для контроля аналитической чувствительности разработанного набора праймеров. На Фиг. 3. представлен результат изотермической амплификации с детекцией в режиме реального времени (на приборе CFX96) для оценки чувствительности разработанного набора олигонуклеотидных праймеров. На Фиг. 4. показана оценка повторяемости и воспроизводимости результатов изотермической амплификации при использовании набора праймеров. На Фиг. 5. показан результат анализа для определения коэффициента сбоя системы при проведении изотермической амплификации. На Фиг. 6. представлен результат оценки специфичности к генетическому материалу различных ортопоксвирусов разработанного набора праймеров. На Фиг. 7. представлены последовательности олигонуклеотидных праймеров специфичных к ДНК ортопоксвирусов SEQ ID: NO:1-5: праймеры внешние - О-F3 и О-B3, внутренние О-FIP и О-BIP, петлевой праймер - О-LF.
Пример 1. Определение аналитической чувствительности изотермической амплификации с использованием разработанных олигонуклеотидных праймеров
Оценку аналитической чувствительности осуществляли проведением реакции изотермической амплификации, где в качестве исследуемых образцов использовали разведения положительного контроля pAL-T-POX с шагом 10 от концентрации 107 копий/мл до 10 копий/мл. Результат оценки аналитической чувствительности представлен в таблице 4 и Фиг. 3.
Таблица 4. Результат оценки аналитической чувствительности
FAM
Образцы, содержащие pAL-T-POX в концентрации от 107 копий/мл до 104 копий/мл определены как положительные. Образцы, содержащие pAL-T-POX в концентрации от 103 копий/мл до 101 копий/мл определены как отрицательные. Установлена аналитическая чувствительность (предел детекции) - 104 копий/мл.
Пример 2. Определение повторяемости и воспроизводимости изотермической амплификации с использованием разработанных олигонуклеотидных праймеров
Для оценки повторяемости 5 образцов pAL-T-POX с концентрацией 1,0х106 копий/мл одновременно протестированы одним оператором. Коэффициент вариации для повторяемости рассчитывали по формуле: CVp, % = Сt (стандотклон) / Ct (ср.знач.) × 100 % для 5 проб.
Для оценки воспроизводимости во второй день на другом приборе дополнительно протестированы 5 образцов pAL-T-POX с концентрацией 1,0х106 копий/мл другим оператором. Коэффициент вариации для воспроизводимости рассчитывали по формуле: CVp, % = Сt (стандотклон) / Ct (ср.знач.) × 100 % для 10 проб.
Таблица 5. Результаты оценки повторяемости, воспроизводимости и коэффициенты вариации для этих показателей
обр
FAM
Сt FAM
Сt
FAM
вариации (СV, %) для восп
Оператор 1
Оператор 2
Максимальный коэффициент вариации для повторяемости составил 4,24 %, коэффициент вариации для воспроизводимости 3,30 %.
Пример 3. Подтверждение отсутствия кросс-контаминации изотермической амплификации с использованием разработанных олигонуклеотидных праймеров
Исследование на наличие кросс-контаминации проводили одновременно с оценкой повторяемости и воспроизводимости. Испытуемые пробы были зашифрованы (обезличены) сотрудниками, не принимающими участия в постановках реакций и учете результатов. Результаты анализа на кросс-контаминацию представлены в таблице 6.
Таблица 6. Результат оценки кросс-контаминации изотермической амплификации с использованием разработанного набора праймеров
каналу FAM
Все исследованные образцы, содержащие pAL-T-POX были определены как положительные. Все образцы воды очищенной были определены как отрицательные. Случаев кросс-контаминации не выявлено.
Пример 4. Определение коэффициента сбоя системы изотермической амплификации с использованием разработанных олигонуклеотидных праймеров
При выявлении возможного сбоя системы было использовано 30 образцов pAL-T-POX с концентрацией 3,0х104 копий/мл (равной 3-кратной аналитической чувствительности (пределу детекции)).
Таблица 7. Результаты определения коэффициента сбоя системы
FAM
Из 30 образцов стандартного образца pAL-T-POX с концентрацией 3,0х104 копий/мл - 30 образцов были определены как положительные, сбоя системы при использовании разработанного набора олигонуклеотидных праймеров не выявлено.
Пример 5. Определение диагностической специфичности изотермической амплификации с использованием разработанных олигонуклеотидных праймеров
Для определения диагностической специфичности использованы образцы мазков с задней стенки глотки здоровых доноров и образцы мазков с задней стенки глотки здоровых доноров искусственно контаминированные, ДНК вируса осповакцины (ВОВ), оспы коров (ВОК), оспы обезьян (ВОО) и ДНК вируса простого герпеса 1 типа (таблица 8). Результаты оценки диагностической специфичности представлены в таблице 9.
Таблица 8. Перечень использованных образцов для определения диагностической специфичности
Таблица 9. Результат анализа для определения диагностической специфичности
FAM
Из 18 образцов, контаминированных ДНК ортопоксвирусов (6 образцов мазков с задней стенки глотки искусственно контаминированные ДНК ВОК, 6 образцов мазков с задней стенки глотки искусственно контаминированные ДНК ВОО и 6 образцов мазков с задней стенки глотки искусственно контаминированные ДНК ВОВ) в 18 образцах выявлена ДНК ортопоксвирусов (совпадение 100%).
Из 20 образцов, не содержащих ДНК ортопоксвирусов (10 образцов мазков с задней стенки глотки здоровых доноров, 10 образцов мазков с задней стенки глотки искусственно контаминированные ДНК вируса простого герпеса 1 типа), в 20 образцах не выявлена ДНК ортопоксвирусов (совпадение 100%).
Источники научно-технической и патентной информации
1. Buller, R. Mark L. (2017). Infectious Diseases // Poxviruses., 1452-1457.e1. doi:10.1016/B978-0-7020-6285-8.00170-2
2. Garon CF, Barbosa E, Moss B. Visualization of an inverted terminal repetition in vaccinia virus DNA. Proc Natl Acad Sci U S A. 1978;75:4863-4867.
3. Moss B. Poxvirus entry and membrane fusion. Virology. 2006;344:48-54.
4. Shchelkunova GA, Shchelkunov SN. 40 Years without Smallpox. Acta Naturae. 2017 Oct-Dec;9(4):4-12.
5. Fenner F., Henderson D.A., Arita I., Jezek Z., Ladnyi I.D., Smallpox and Its Eradication. Geneva: World Health Organization, 1988. 1460 p. 1988
6. Ferdous J, Barek MA, Hossen MS, Bhowmik KK, Islam MS. A review on monkeypox virus outbreak: New challenge for world. Health Sci Rep. 2022 Dec 25;6(1):e1007. doi: 10.1002/hsr2.1007.
7. WHO. [Электронный ресурс]. URL: https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON385 (дата обращения 22.03.2024).
8. Vorou RM, Papavassiliou VG, Pierroutsakos IN. Cowpox virus infection: an emerging health threat. Curr Opin Infect Dis. 2008;21:153-156.
9. Amer M, El-Gharib I, Rashed A, Farag F, Emara M. Human cowpox infection in Sharkia Governorate, Egypt. Int J Dermatol. 2001;40:14-17.
10. Mätz-Rensing K, Ellerbrok H, Ehlers B, Pauli G, Floto A, Alex M, Czerny CP, Kaup FJ. Fatal poxvirus outbreak in a colony of New World monkeys. Vet Pathol. 2006;43:212-218.
11. Shen Y, Nemunaitis J. Fighting cancer with vaccinia virus: teaching new tricks to an old dog. Mol Ther. 2005;11:180-195.
12. Wlodaver CG, Palumbo GJ, Waner JL. Laboratory-acquired vaccinia infection. J Clin Virol. 2004;29:167-170.
13. Yu, C.; Zuo, L.; Miao, J.; Mao, L.; Selekon, B.; Gonofio, E.; Nakoune, E.; Berthet, N.; Wong, G. Development of a Novel Loop-Mediated Isothermal Amplification Method for the Rapid Detection of Monkeypox Virus Infections. Viruses 2023, 15, 84. https://doi.org/10.3390/v15010084
14. Li, Z., Sinha, A., Zhang, Y. et al. Extraction-free LAMP assays for generic detection of Old World Orthopoxviruses and specific detection of Mpox virus. Sci Rep 13, 21093 (2023). https://doi.org/10.1038/s41598-023-48391-z
15. Патент Китая №CN116144839, МПК C12Q1/6844, 23.05.2023 г.
16. Патент Китая № CN116287438, МПК C12Q1/6844, 23.06.2023 г.
17. Патент Китая № CN115961092, МПК C12Q1/6844, 23.06.2023 г.
18. Патент Китая № CN115992295, МПК C12Q1/6844, 21.04.2023 г. (прототип).
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Набор
олигонуклеотидных праймеров для выявления ДНК ортопоксвирусов методом
изотермической амплификации в режиме реального времени.xml"
softwareName="WIPO Sequence" softwareVersion="2.3.0"
productionDate="2024-03-19">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2024-03-20</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>1</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2024-03-19</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Федеральное бюджетное учреждение
науки «Государственный научный центр вирусологии и биотехнологии
«Вектор» Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор»
Роспотребнадзора)</ApplicantName>
<ApplicantNameLatin>State Research Center of Virology and
Biotechnology "Vector"</ApplicantNameLatin>
<InventionTitle languageCode="ru">Набор олигонуклеотидных праймеров
для выявления ДНК ортопоксвирусов методом изотермической амплификации
в режиме реального времени</InventionTitle>
<SequenceTotalQuantity>5</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gccttatcgaatactcttccg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgagagaggatcataagtctt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>43</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..43</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ttcgtattgaatcagtggggctttttcgatgtctacacaggca</INSD
Seq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>49</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..49</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ttggcagtactcattaataacggttttttgatgatgttattccggctaa
</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gacagggttagcacctttccaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---


Изобретение относится к медицинской биотехнологии и вирусологии. Предложен набор олигонуклеотидных праймеров для выявления ДНК ортопоксвирусов, выделенных из образцов, которые содержат 5 праймеров: внешние - O-F3 и O-B3, внутренние O-FIP и O-BIP, петлевой праймер - O-LF, имеющих следующие нуклеотидные последовательности SEQ ID NO: 1-5 соответственно. Изобретение позволяет с помощью родоспецифических праймеров выявлять ортопоксвирусы в образцах нуклеиновых кислот, выделенных из содержимого кожных поражений, или образцов мазков, или образцов цельной венозной крови (ЭДТА), или аутоптатов легких, печени и селезенки человека при проведении диагностических и эпидемиологических исследований методом изотермической амплификации. 9 табл., 7 ил., 5 пр.
Набор олигонуклеотидных праймеров для выявления ДНК ортопоксвирусов методом изотермической амплификации в режиме реального времени, содержащий 5 праймеров: внешние - O-F3 и O-B3, внутренние O-FIP и O-BIP, петлевой праймер - O-LF, имеющих следующие нуклеотидные последовательности SEQ ID NO: 1-5 соответственно.
| CN 115992295, A, 21.04.2023 | |||
| CN 113373268 A, 10.09.2021 | |||
| Способ выявления РНК вируса SARS-CoV2 с помощью мультиплексной изотермической петлевой амплификации с обратной транскрипцией | 2020 |
|
RU2761170C1 |
| US 20070054263 A1, 08.03.2007 | |||
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫСОКОЧУВСТВИТЕЛЬНОГО ЭКСПРЕСС-ВЫЯВЛЕНИЯ ДНК ВИРУСА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ МЕТОДОМ ПЕТЛЕВОЙ ИЗОТЕРМИЧЕСКОЙ АМПЛИФИКАЦИИ В ПРИСУТСТВИИ ДНК ВНУТРЕННЕГО КОНТРОЛЬНОГО ОБРАЗЦА | 2022 |
|
RU2799410C1 |
| Макарова Ю | |||
| А | |||
| и др | |||
| Изотермическая петлевая амплификация: эффективный метод экспресс-диагностики в онкологии, Онкоурология, Том 14, N 2 (2018), с | |||
| Шланговое соединение | 0 |
|
SU88A1 |
Авторы
Даты
2024-07-30—Публикация
2024-04-27—Подача