Изобретение относится к модификации углеводного метаболизма растений с применением техники рекомбинантной ДНК, к самой рекомбинантной ДНК с целью ее использования для такой модификации, а также же растениям и частям растений, обладающим измененной генетической конституцией. Упомянутые растения могут быть использованы для экстрагирования из них определенных соединений углеводной природы или, альтернативно, они могут быть подвержены обработке для получения пищевых продуктов, кормов или их ингредиентов, которые будут характеризоваться улучшенными свойствами в связи с присутствием в процессе их приготовления упомянутых углеводных соединений.
Уровень техники
Трегалоза представляет собой общее название, данное D-глюкозил-D-глюкозидам, которые включают дисахариды, построенные на основе двух молекул глюкозы, соединенных α-, α,β- и β,β-связями. Трегалоза, и в особенности α- трегалоза 1-(O-a-D-глюкопиранозил)-1'-O-α-D-глюкопираноза), представляет собой широко распространенный натуральный дисахарид.
Химический синтез трегалозы весьма сложен (требуется введение защищающих группировок) и неэффективен. В настоящее время в качестве естественного источника трегалозы используют грибы и дрожжи Saccharomyces cerevisiae, которые обладают способностью аккумулировать свыше 10% своего сухого веса в виде трегалозы. Однако получение трегалозы затруднено высокой активностью трегалозы, которая приводит к быстрому метаболизму трегалозы. Элбейн (Elbein A.D. Adv. Carbohydrate Chem. and Biochem., 1974, 30, 227-256) приводит в своем обзоре данные по встречаемости и метаболизму в живых организмах дисахарида трегалозы, в частности α,α-трегалозы. В растительном мире наличие трегалозы было показано у некоторых видов низших растений, а также у множества видов высших растений, принадлежащих к семенным растениям; Echinops persicus; Carex brunescens; Fagus silvaticus.
Однако эти результаты на были ни разу подтверждены другими авторами (Kendall et al., Phytochemictry, 1990, 29, N 8, 2525-2528). Так, например, в указанной выше публикации Кендалл с соавт., говоря о встречаемости трегалозы в семенных растениях, отмечает, что наличие ее было точно подтверждено только в случае семян тмина обыкновенного (Carum carvi). Сообщение о наличии трегалозы в подсолнечнике (Cegla et al., J. Am. Oil Chem. Soc., 1977, 54, 150 et seq.) было оспорено Кандлером с сотр. (Kandler et al., in: The Biochemictry of Plants, Vol. 3: Carbohydrates: Structure and Functions; Preiss. J. ed. , p. 228. Academic Press), согласуясь с данными Кендалла и сотр. (Kendall et al., 1990, выше). Сообщение о нахождении трегалозы в буке (Fagus silvaticus) и капусте также не было подтверждено другими авторами (Kendall et al., 1990, приведенная выше публикация, а также содержащиеся в ней ссылки).
Несмотря на очевидную редкую встречаемость трегалозы в высших растениях, имеются сообщения о наличии деградирующей активности в отношении трегалозы в значительном числе исследованных семейств растений. Стабильная высокая трегалазная активность была обнаружена в трех линиях пшеницы, сосне бангковой и Selaginella lepidophilla.
Стабильная низкая трегалазная активность была найдена в люцерне, черной мексиканской сахарной кукурузе и канадской сосне. Лабильная, умеренная активность была обнаружена в двух различных суспензиях канолы (canola), однако, по-видимому, она не имеет отношения к специфической трегалазной активности. Ячмень, костер, соя культурная и черная ель, как было показано, вовсе не содержит трегалазной активности (Kendall, 1990, выше).
Считается, что в организмах, способных к образованию трегалозы, биосинтез ее приводится через образование 6-фосфата, тогда как формой для ее хранения является свободный сахар. В этой связи есть основания полагать, что организмы, способные продуцировать и/или хранить трегалозу, содержат фосфатазу, способную к расщеплению трегалозо-6-фосфата (Elbein, 1974, выше). Однако относительно наличия специфических трегалозо-фосфат-фосфатаз в высших растениях известно также очень немного.
В заявке на Международный патент WO 93/17093 A1, опубликованной 2 сентября 1993 г., описывается образование трегалозы в дрожжах, трансгенных относительно дрожжевых генов, кодирующих трегалозо-фосфат-синтазу. Было высказано предположение, что трегалоза может также образовываться в высших растениях с использованием таких дрожжевых генов, однако упомянутая заявка не содержит настоящего раскрытия вопроса продукции трегалозы в растениях. При этом было отмечено, что WO93/17093 A1 была опубликована раньше даты подачи заявки, однако после наступления приоритетной даты заявки.
Настоящее изобретение относится к способу получения трегалозы в растении-хозяине, связанному с наличием в упомянутом растении-хозяине гена, экспрессируемого в растении, который включает в своей последовательности:
(а) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(б) последовательность ДНК, кодирующую активность трегалозо-фосфат-синтазы, и факультативно
(в) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине.
Другой вариант изобретения относится к продуцированию в высших растениях трегалозы в связи с наличием в упомянутом растении-хозяине экспрессируемого в растении гена, который включает в своей последовательности:
(г) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(д) последовательность ДНК, кодирующую активность трегалозо-фосфат-синтазы, и факультативно
(е) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине, а также
ген, экспрессируемый в растении, который включает в своей последовательности;
а) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(б) последовательность ДНК, кодирующую последовательность РНК, которая по крайней мере частично комлементарна последовательности РНК, кодирующей фермент сахарозо-фосфат-синтазу (СФС), встречающийся в естественных условиях в упомянутом растении-хозяине, и факультативно
(в) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине.
Еще один вариант изобретения относится к продуцированию трегалозы в растении-хозяине в связи с наличием в упомянутом растении-хозяине экспрессируемого в растении гена, который включает в своей последовательности:
(г) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(д) последовательность ДНК, кодирующую активность трегалозо-фосфат-синтазы, и факультативно
(е) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине, а также
ген, экспрессируемый в растении, который включает в своей последовательности:
(а) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(б) последовательность ДНК, кодирующую последовательность РНК, которая по крайней мере частично комплементарна последовательности РНК, кодирующей фермент АДФ-глюкозо-пирофосфорилазу, встречающийся в естественных условиях в упомянутом растении-хозяине, и факультативно
(в) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине.
Еще один вариант изобретения включает продуцирование трегалозы в растении-хозяине в связи с наличием в упомянутом растении-хозяине экспрессируемого в растении гена, который включает в своей последовательности:
(а) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(б) последовательность ДНК, кодирующую активность трегалозо-фосфат-синтазы, и факультативно
(в) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине, а также
ген, экспрессируемый в растении, который включает в своей последовательности:
(г) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(д) последовательность ДНК, кодирующая последовательность РНК, которая по крайней мере частично комплементарна последовательности РНК, кодирующей фермент сахарозо-фосфат-синтазу, встречающийся в естественных условиях в упомянутом растении-хозяине, и факультативно
(е) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине, а также
ген, экспрессируемый в растении, который включает в своей последовательности:
(ж) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(3) последовательность ДНК, кодирующую последовательность РНК, которая по крайней мере частично комплементарна к последовательности РНК, кодирующей фермент АДФ-глюкозо-пирофосфорилазу, встречающийся в естественных условиях в упомянутом растении-хозяине, и факультативно
(и) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине.
Изобретение относится также к экспрессируемым в растениях генам, которые используются в процессе получения трегалозы, равно, как и к различным сочетаниям экспрессируемых в растениях генов, а также к клонируемым плазмидам, к применяемым для трансформации векторам, микроорганизмам, индивидуальным растительным клеткам, несущим в соответствии с настоящим изобретением экспрессируемые в растениях гены.
Изобретение относится, кроме того, к рекомбинантной геномной ДНК из растений, которая содержит экспрессируемый в растении ген трегалозо-фосфат-синтазы, который не является для него естественным. Изобретение также включает в свои рамки рекомбинантную геномную ДНК из растений, которая содержит экспрессируемый в растении ген трегалозо-фосфат-синтазы, который не является для него естественным, а также экспрессируемый в растении ген, способный привести к ингибированию биосинтеза активной СФС, и/или экспрессируемый в растениях ген, способный привести к ингибированию биосинтеза активной АГФ-азы.
Изобретение относится, кроме того, к способу получения растения, подходящего для применения с целью продуцирования трегалозы, который включает следующие стадии:
(1) введения в реципиентную растительную клетку экспрессируемого в растении гена, который включает в своей последовательности:
(а) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(б) последовательность ДНК, кодирующую активность трегалозо-фосфат-синтазы, и факультативно
(в) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине, а также
ген, экспрессируемый в растении, который включает в своей последовательности:
(г) регион инициации транскрипции, функционирующий в упомянутом растении-хозяине;
(д) последовательность ДНК, кодирующую селективный ген-маркер, функционирующий в упомянутом растении-хозяине, и факультативно
(е) последовательность терминации транскрипции, функционирующую в упомянутом растении-хозяине, и
(2) выращивания растения из трансформированной клетки в условиях, позволяющих проводить отбор в присутствии отобранного маркерного гена.
Изобретение относится также к растениям, которые в результате генетической модификации продуцируют трегалозу (имеют повышенный уровень ее).
Кроме того, изобретение охватывает растения, имеющие геномную рекомбинантную ДНК, которая содержит в соответствии с настоящим изобретением экспрессируемый в растениях ген.
Настоящее изобретение относится также к растениям, имеющим в геноме рекомбинантную ДНК, содержащую экспрессируемый в растениях ген, и которые продуцируют трегалозу.
Изобретение относится также к растениям, имеющим геномную рекомбинантную ДНК, содержащую экспрессируемый в растениях ген, и которые обладают повышенной засухоустойчивостью.
Кроме того, настоящее изобретение относится к тем частям растений, которые укладываются в рамки настоящего изобретения, таким, как клетки или протопласты, или их культуры, цветы, фрукты, листья, пыльца, корни (включая культуры, имеющие корни с корневыми волосками), семена, стебли, клубни (включая так называемые микроклубеньки) и другие.
Изобретение включает также в свои рамки способ консервирования растений или частей растений в присутствии трегалозы, который включает следующие стадии:
(1) выращивания в соответствии с настоящим изобретением растения, которое продуцирует трегалозу;
(2) сбора растений или частей растений, которые содержат трегалозу, и
(3) воздушной сушки растений или частей растений или альтернативно
(4) лиофильной сушки растений или частей растений.
Кроме того, изобретение относится к растениям или частям растений, которые могут быть сохранены с помощью метода, раскрытого в настоящем изобретении.
Кроме того, изобретение включает способ продуцирования трегалозы, который включает стадии:
(1) выращивания растения, которое благодаря присутствию геномной рекомбинантной ДНК, способно к продуцированию трегалозы (повышенных уровней ее),
(2) сбора упомянутых выше растений или частей растений,
(3) выделения трегалозы из упомянутых выше растений или упомянутых частей растений.
Изобретение также относится к способу продуцирования трегалозы, который включает стадии:
(1) выращивания культуры растительных клеток, которые благодаря присутствию в клетках геномной рекомбинантной ДНК способны к продуцированию трегалозы (повышенных уровней ее),
(2) выделения трегалозы из упомянутой культуры растительных клеток.
Изобретение, кроме того, относится к выделенной последовательности нуклеиновой кислоты, кодирующей активность трегалозо-фосфат-синтазы. Предпочтение среди таких выделенных последовательностей нуклеиновых кислот отдается последовательности, выделенной из E.coli, а наиболее предпочтительной является последовательность, отраженная в SEQID NO:2. Другой предпочтительный вариант включает последовательность нуклеиновой кислоты, которая кодирует аминокислотную последовательность, отраженную в SEQID NO:3.
Описанные ниже фигуры иллюстрируют приведенное изобретение.
Фиг. 1. Схематическое изображение участков пути биосинтеза сахарозы и крахмала в накапливающих тканях растений. На фигуре показано, что углевод, полученный в листе в результате фотосинтеза, транспортируется затем в виде сахарозы через флоэмную ткань. При вхождении в сайт накапливания он расщепляется с помощью инвертазы, локализованной в ограничивающей мембране, с получением моносахаров - глюкозы и фруктозы. В результате прохождения различных стадий энзиматических реакций указанные моносахара превращаются в крахмал и/или сахарозу, как условно изображено на фигуре. При этом, по-видимому, метаболиты глюкозы - Г-6-Ф и УДФГ используются как субстраты для ТФС фермента, возникающего в результате введения в растение с помощью генно-инженерных методов экспрессируемого в растении гена otsA. На фигуре представлено, насколько повышается количество доступных в качестве субстратов Г-6-Ф и УДФГ при снижении уровня ферментов СФС и АГФ-азы. Их ингибирование выражено при гибридизации.
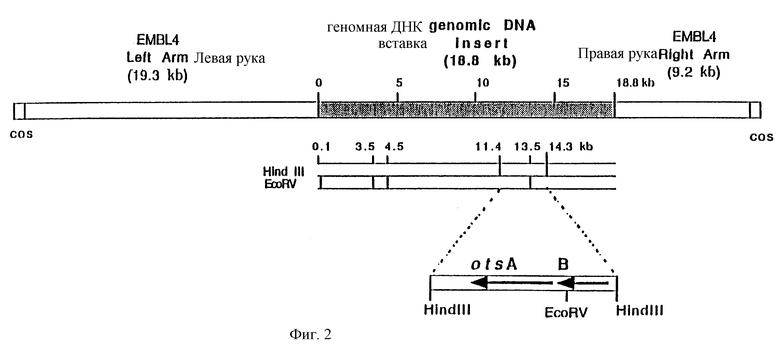
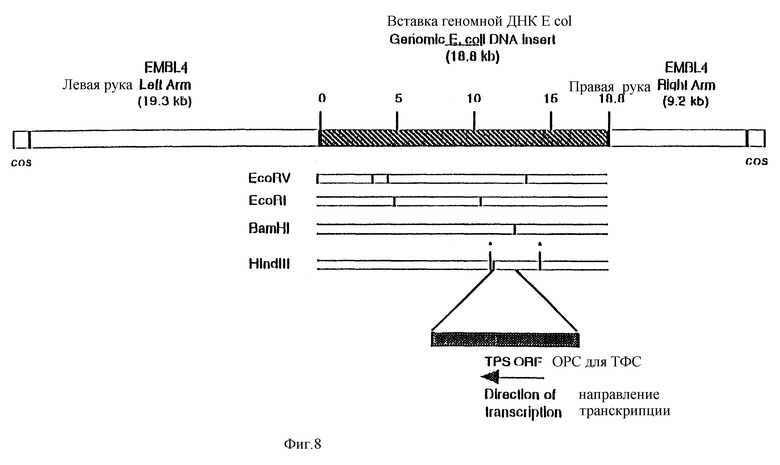
Фиг. 2. Полученная Кохара с сотр. (Kohara et al., 1987) схематическая карта EMBL 4 клона 77F11, содержащего otsBA оперон из E.coli. Вставка размером 18,8 kb закрашена. Указаны сайты рестрикции для рестрикционных эндонуклеаз EcoRV и Hind III, которые используются для клонирования гена otsA, равно как и расстояния до них в kb относительно левого сайта вставки. Отмечены также гены otsA и B, а стрелки указывают направление транскрипции (см. фиг. 8, расширенная карта).
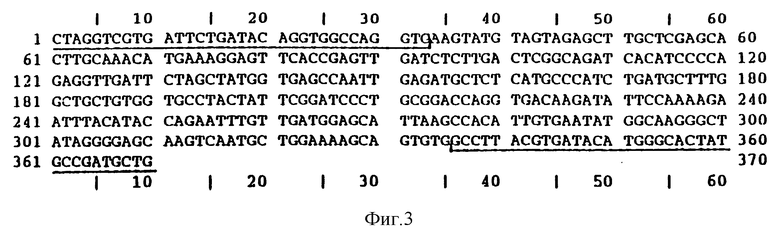
Фиг. 3. Последовательность клонируемой кДНК для СФС из картофеля. Подчеркнуты: последовательности кДНК для СФС из кукурузы, использованные в качестве олигонуклеотидов в полимеразной цепной реакции (ПЦР) амплификации.
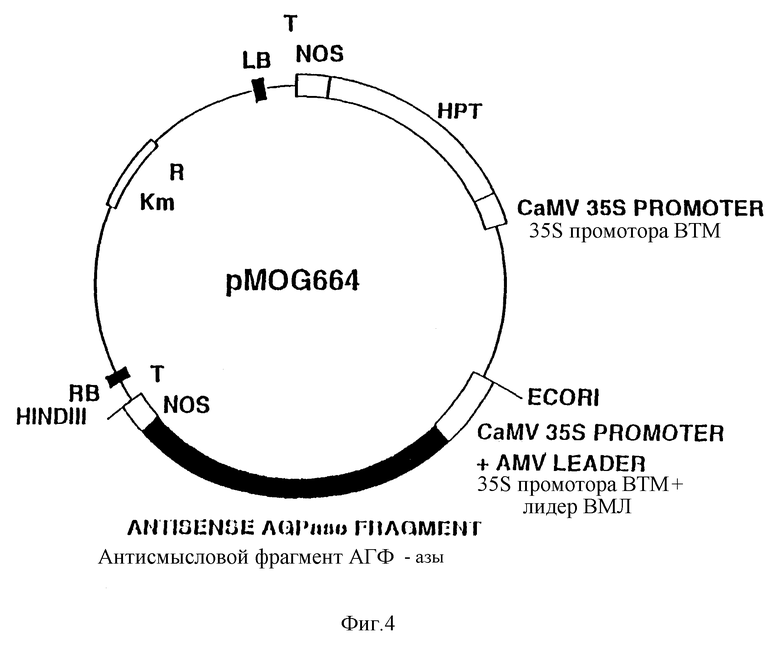
Фиг. 4. Схематическое изображение бинарного вектора pMOG664.
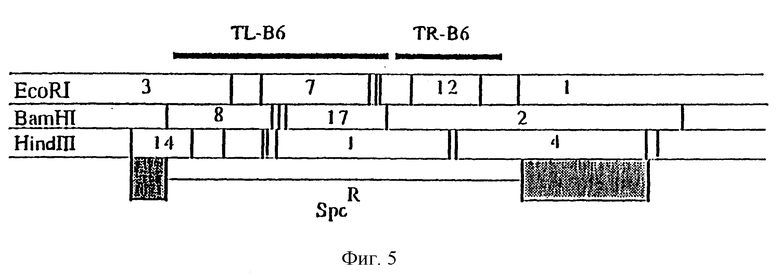
Фиг. 5. Рестрикционная карта участков pTi B6, показывающая два фрагмента, клонированных в pMOG579.
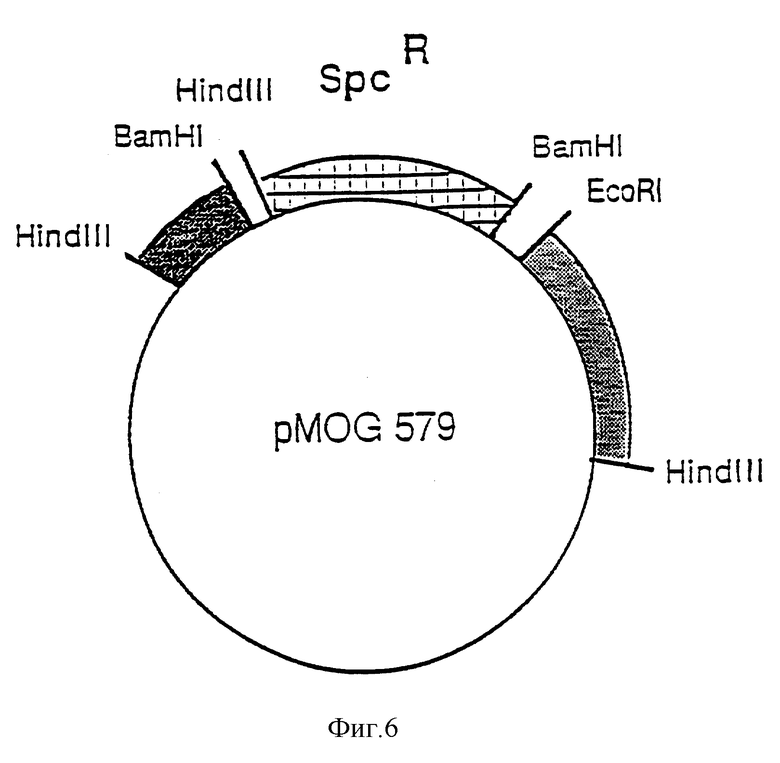
Фиг. 6. Схематическое изображение рМОG579, используемого для конструирования в Agrobacterium, штамм MOG101, хелперной плазмиды без T-региона.
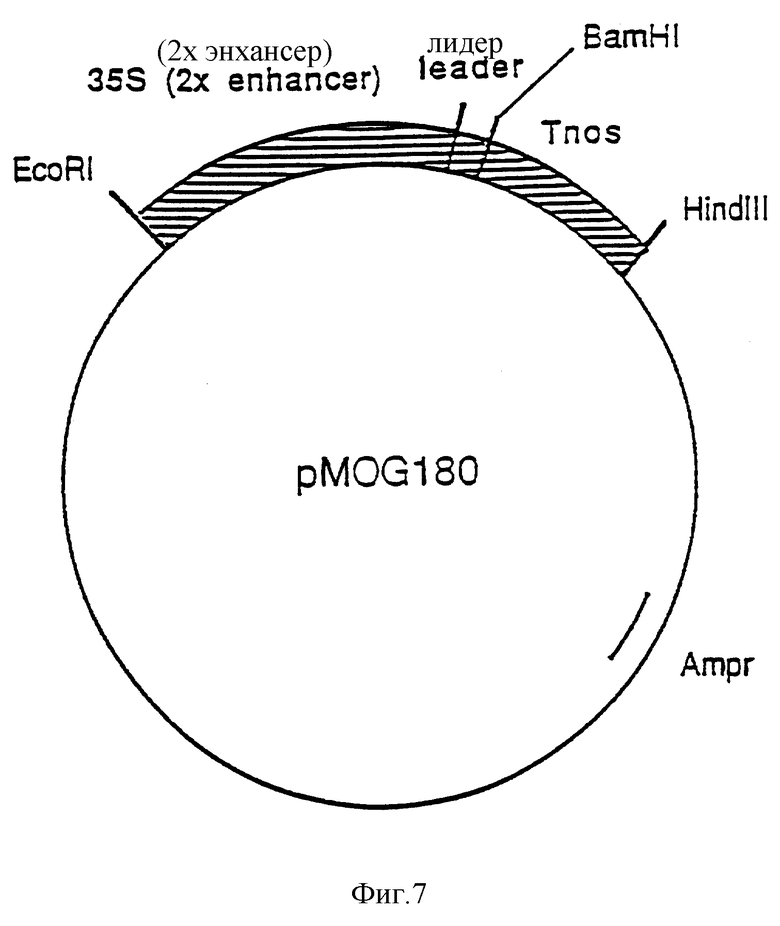
Фиг. 7. Схематическое изображение вектора экспрессии pMOG180.
Фиг. 8. Полученная Кохара с сотр. (Kohara et al., 1987) расширенная карта EMBL 4 клона 7F11, содержащего otsBA оперон из E.coli. Указано также местоположение открытой рамки для считывания (ОРС) ТФС (*: Hind III сайты не присутствуют на карте Кохара, ниже).
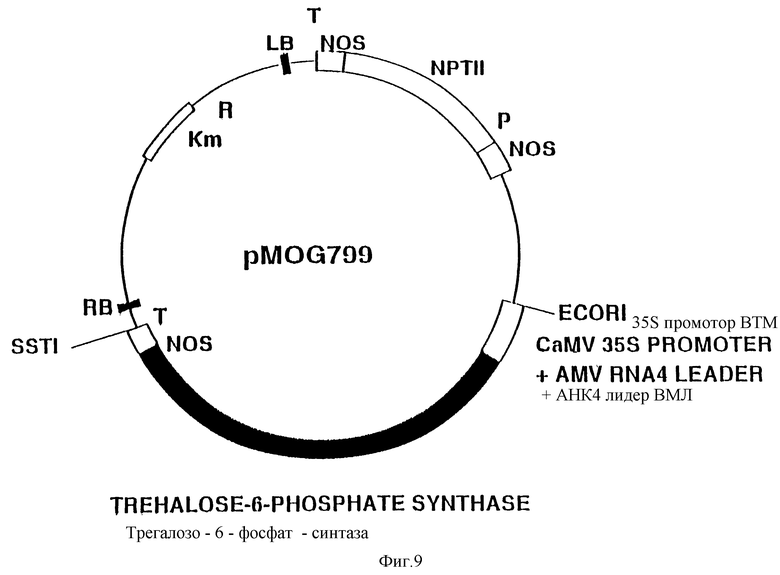
Фиг. 9. Схематическое изображение бинарного вектора pMOG799.
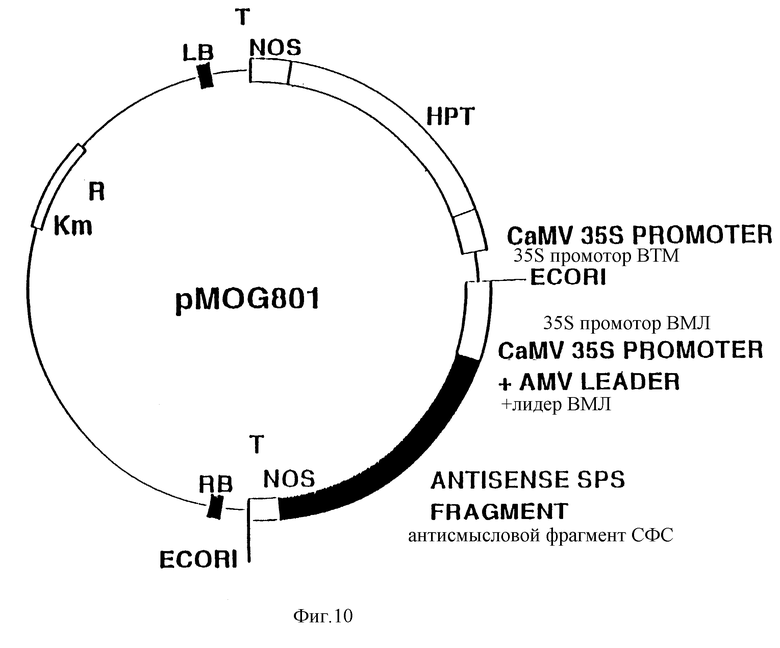
Фиг. 10. Схематическое изображение бинарного вектора pMOG801.
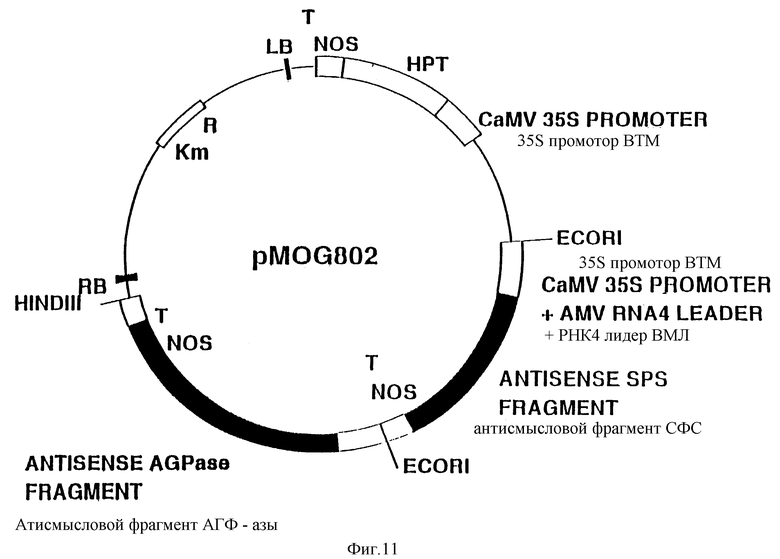
Фиг. 11. Схематическое изображение бинарного вектора pMOG802.
Предпочтительный вариант настоящего изобретения включает растение картофеля, способное продуцировать в своих клубнях трегалозу в связи с наличием в упомянутом растении картофеля экспрессируемого в растении гена, который включает в своей последовательности:
(а) регион инициации транскрипции, привнесенный от 35S РНК CaMV, фланкированный в верхнем направлении двойным энхансером,
(б) последовательность ДНК, кодирующую трегалозо-фосфат-синтазу в гене otsA, локализованном на ots BA опероне E.coli,
(в) последовательность терминации транскрипции, полученную на основе нопалинсинтазного (nos) гена из Agrobacterium. Клубни трансгенных растений, содержащих экспрессируемый в растениях ТФС-ген, продуцируют трегалозу, тогда как контрольные растения, не имеющие такого гена, ее не образуют. Очевидно, что трегалозо-фосфат, образуемый трансгенными клубнями, превращается затем в трегалозу. Очевидно также, что нет необходимости во введении извне трегалозо-фосфат-фосфатазной активности, поскольку она, по всей видимости, имеется в растениях картофеля.
На фиг. 1 также проиллюстрирован подход, примененный для улучшения доступности субстрата для ТФС. При этом два гена, оказывающие влияние на доступность глюкозо-6-ф (Г-6-Ф) и УДФГ, подвергли клонированию вместе с антисмысловым СФС геном и антисмысловой АФГ-азой под контролем 35S промотора CaMV с целью экспрессии в растении-хозяине. При введении его в растение-хозяин, содержащее в соответствии с настоящим изобретением экспрессируемый в растении ТФС ген, повышается доступность субстрата для ТФС, а отсюда также увеличивается уровень синтеза трегалозы. Для любого специалиста со средним уровнем знаний в данной области очевидно, что другие антисмысловые гены также могут находить применение для блокирования синтеза сахарозы или крахмала, с целью улучшения доступности субстрата.
Несмотря на то, что изобретение содержит подробное описание применительно к растениям картофеля, которые содержат экспрессируемый в растении ген трегалозо-фосфат-синтазы из E. coli под контролем 35S промотора CaMV, выполняющего функцию региона инициации транскрипции, каждому специалисту со средним уровнем знания в данной области ясно, что и другие семенные растения-хозяева так же подходят для целей продуцирования трегалозы. Среди семенных растений предпочтительными являются Angiospermae, а именно Dicotyledoneae, включающие в том числе в качестве репрезентативного семейства Solanaceae, а также Monocotyledoneae включающие в том числе Graminae в качестве репрезентативного семейства. К подходящим растениям-хозяевам относятся в контексте настоящего изобретения растения (а также части и клетки упомянутых растений) и их потомство, генетически модифицированные с применением техники рекомбинантной ДНК с целью индукции или повышения до нужного уровня продукции трегалозы в том или ином растении или органе растения; эти растения могут быть использованы либо непосредственно (в случае тех видов растений, которые продуцируют ее в съедобных частях), либо после очистки трегалозы из упомянутого растения-хозяина (которая может быть выделена как из съедобных, так и несъедобных растений-хозяев). Зерновые со съедобными частями включают в соответствии с настоящим изобретением те растения, которые имеют в качестве съедобных частей цветы, такие как подсолнечник (Brassica oleraceae), артишок (Cynara scolymus), фрукты, такие как яблоки (Malus, в т.ч. domestica), бананы (Musa, в т.ч. acuminata) ягоды (такие как смородина, Rikes, в т. ч. rubrum), вишни (такие как черешня, Prunus, в т.ч. avium), огурцы (Cucumis, в т.ч. sativus), виноград (Vitis, в т.ч. vinifera), лимоны (Citrus limon), дыня (Cucumis melo), орехи (такие как грецкий орех, Juglans, в т.ч. regia; арахис, Arachis hupogeae), апельсины (Citrus, в т.ч. maxima), персики (Prunus, в т.ч. persica), груши (Pyra, в т.ч. communis), перец (Solanum, в т. ч. capsicum), сливы (Prunus, в т.ч. domestica), земляника (Fragaria, в т. ч. moschata), томаты (Lycopersicon, в т.ч. esculentus), листья, такие как люцерна (Medicago sativa), капуста (такие как Brassica oleracea), цикорный салат (Cichoreum, в т.ч. endivia), лук-порей (Allium porrum), латук (Lactuca sativa), шпинат (Spinacia oleraceae), табак (Nicotiana tabacum), корни, такие как маранта (Maranta arundinacea), свекла (Beta vulgaris), морковь (Daucus carota), маниок (Manihot esculenta), репа (Brassica rapa), редис (Raphanus sativus), ямс (Dioscorea esculenta), батат (Ipomoea batatas) и семена, такие как бобы (Phaseolus vulgaris), горох (Pisum sativum), соя культурная (Glycin max), пшеница (Triticum aestivum), ячмень (Hordeum vulgare), кукуруза (Zea mays), рис (Oryza sativa), клубни, такие как кольраби (Brassica oleraceae), картофель (Solanum tuberosum) и др. Съедобные части растений могут быть сохранены высушиванием в присутствии повышенных количеств трегалозы, образованной в них в связи с наличием экспрессируемого в растении гена трегалозо-фосфат-синтазы.
Это может быть использовано для продуцирования повышенных уровней трегалозы посредством подведения ДНК, кодирующей активность ТФС, под контроль промотора, специфичного для органа или ткани растения; при этом выбор метода такого введения может быть легко сделан любым специалистом, обладающим средним уровнем знаний в данной области.
При этом может быть использован любой ген трегалозо-фосфат-синтазы, функционирующий под контролем регуляторных элементов, необходимых для экспрессии ДНК, специфической или конститутивной, в растительных клетках, главное, что должно приниматься во внимание, это способность продуцировать активный фермент трегалозо-фосфат-синтазу. Нуклеотидная последовательность нуклеиновой кислоты представлена на SEQID NO : 2, при этом любая открытая рамка считывания в соответствии с настоящим изобретением может быть изменена, что не сопровождается обязательными изменениями в аминокислотной последовательности кодируемого белка. Этот факт объясняется вырожденностью генетического кода. Так, открытая рамка считывания, кодирующая активность трегалозо-фосфат-синтазы, может быть адаптирована к выбору используемого в растении-хозяине кодона.
Для идентификации активности трегалозо-фосфат-синтаз в других организмах и далее для выделения этих ферментов может быть также использована нуклеиновая кислота, последовательность которой представлена на SEQID NO: 2, при этом для упомянутого выделения используется техника гибридизации ДНК из таких источников с ДНК- или РНК фрагментом, выделенным из гена Е.соli. Предпочтительно провести скрининг таких последовательностей ДНК в ходе гибридизации при строгом соблюдении определенных условий (таких, как температура и ионная сила гибридизационной смеси). Природа гибридизации (т.е. состав смеси: ДНК: ДНК, или ДНК: РНК, или РНК: РНК), а также длина наименьшего вводимого в гибридизационную смесь фрагмента определяют, есть ли необходимость в поддержании в ходе нее строгого режима. При этом каждый специалист со средним уровнем знаний в данной области может без труда установить необходимый для каждого конкретного случая режим гибридизации.
В качестве источника для выделения активной трегалозо-фосфат-синтазы могут использоваться микроорганизмы (бактерии, дрожжи, грибы), растения, животные и др. Выделенные из других источников последовательности ДНК, которые кодируют трегалозо-фосфат-синтазную активность, могут быть использованы аналогичным образом с применением метода продуцирования трегалозы в соответствии с настоящим изобретением.
Изобретение также включает в свои рамки те последовательности нуклеиновых кислот, которые были получены в результате модификации последовательности нуклеиновой кислоты, отображенной на SEQIDNO: 2 за счет мутации одного или более кодонов, что приводит к изменению аминокислотной последовательности в кодируемом белке, если только такая мутация, затрагивающая аминокислотную последовательность, не устраняет полностью активность трегалозо-фосфат-синтазы.
В принципе по методу настоящего изобретения может быть использовано любое растение-хозяин в сочетании с любым экспрессируемом в растении геном трегалозо-фосфат-синтазы. При доступности в других источниках трегалозных генов эти источники также могут использоваться для получения описываемой комбинации их с экспрессируемым в растении трегалозо-фосфат-синтазным геном.
Приведенные в примерах настоящего изобретения результаты ингибирования эндогенного гена сахарозо-фосфат-синтазы и гена АДФ-глюкозо-пирофосфорилазы показывают, что ингибирование эндогенных генов с целью повышения доступности субстрата может быть проведено с использованием большого числа способов, выбор которых не представляется существенным для настоящего изобретения. Предпочтительным способом для достижения ингибирования гена является так называемый "антисмысловой подход". В этом случае на основе последовательности ДНК получают РНК, которая хотя бы частично комплементарна той РНК, которая кодирует ту энзиматическую активность, которую предстоит блокировать (т.е., в наших примерах, АГФ-азу или СФС). При этом предпочтительно использовать гомологичные антисмысловые гены, поскольку они более эффективны, чем гетерологичные гены. Выделение антисмыслового СФС гена из картофеля с использованием последовательности СФС-гена из кукурузы в качестве пробы дает представление о применимости этой стратегии. При этом не следует полагать, что для практического применения способа настоящего изобретения необходимы гомологичные антисмысловые фрагменты. Альтернативным способом блокирования синтеза нежелательных энзиматических активностей является введение в геном растения-хозяина дополнительно копии гена, уже имеющегося в растении-хозяине. Нередко отмечалось, что такая дополнительная копия гена заглушает эндогенный ген: это явление известно в литературе как со-супрессивный эффект, или как ко-супрессия.
В принципе, и двудольные, и однодольные растения, поддающиеся трансформации, могут быть модифицированы за счет введения в соответствии с настоящим изобретением в реципиентную клетку экспрессируемого в растении гена и выращивания нового растения, которое несет в себе и экспрессирует данный ген. В соответствии с настоящим изобретением предпочтительными являются те растения, которые способны осуществлять превращение трегалозо-фосфата в трегалозу и которые либо вовсе не содержат, либо содержат на очень низком уровне деградирующую активность в отношении трегалозы. Тем не менее, растения, которые не обладают способностью превращать трегалозо-фосфат в трегалозу, также входят в рамки настоящего изобретения. Эти растения могут быть далее модифицированы за счет введения дополнительных генов, которые кодируют фосфатазы и которые, в свою очередь, осуществляют превращение трегалозо-фосфата в трегалозу. В принципе, настоящее изобретение относится также к растениям, содержащим трегалазы, поскольку такие растения могут представлять удобную возможность для продуцирования трегалозы посредством ингибирования активности таких ферментов, например, за счет ингибирования экспрессии генов, кодирующих трегалазы, с использованием "антисмыслового подхода".
Способ введения в реципиентную растительную клетку экспрессируемого в растении гена трегалозо-фосфат-синтазы не важен для настоящего изобретения, существенно только, чтобы при этом произошло стабильное включение гена в геном упомянутого растения. Кроме использования штаммов рода Agrobacterium применима также другая техника для целей введения ДНК в растительные клетки, в частности трансформация протопластов с помощью кальций/полиэтиленгликолевого метода, электропорация и микроинъекция, а также бомбардировка частицами (покрытыми оболочкой) (Potrykus, Bio/Technol., 1990, 8, 535-542).
В дополнение к методам так называемой непосредственной трансформации ДНК широко применяются системы трансформации на основе векторов, таких, например, как вирусные векторы [в частности, вектор из вируса табачной мозаики (BTM, CaMV)] и бактериальные векторы (в частности, из бактерий рода Agrobacterium) (Potrykus, Bio/Technol., 1990, 8, 535-542). После проведения селекции и/или скрининга на основе тех клеток или частей растений, которые были трансформированы, может быть регенерировано целое растение, с использованием для этого известных в технике методов (Horsch et al., Science, 1985, 225, 1229-11231).
Было показано, что однодольные растения могут быть трансформированы, и при этом из трансформированных клеток можно получить фертильные трансгенные растения. Развитие систем культур репродуцирующихся тканей для таких растений в совокупности с имеющимися мощными методами введения генетического материала в растительные клетки позволили упростить процесс трансформации. В настоящее время среди методов трансформации однодольных растений предпочтение отдается бомбардировке микрочастицами эксплантата или суспензии клеток, а также непосредственному введению ДНК или электропорации (Shimamoto, et al., Neture, 1989, 338, 274 - 276). Так, трансгенные растения кукурузы были получены при введении bar-гена Streptomyces hydroscopicus, который кодирует фосфинотрицин-ацетилтрансферазу (фермент, инактивирующий гербицид фосфинотрицин) в эмбриогенные клетки культуральной суспензии клеток кукурузы в случае бомбардировки их микрочастицами (Gordon-Kamm, Plant Cell, 1990, 2, 603 - 618). В литературе уже имеются сообщения о введении генетического материала в алейроновые протопласты других однодольных растений, таких как пшеница и ячмень (Lee, Plant Mol. Biol., 1989, 13, 21 - 30). Растения пшеницы были регенерированы из эмбриогенной культуральной суспензии за счет отбора только постаревших тканей компактного и узелкового каллюса с целью получения эмбриогенных суспензионных культур (Vasil, Bio/Technol., 1990, 8, 429 - 434). При сочетании их с соответствующими системами трансформации для этих культур возможно применение настоящего изобретения к однодольным растениям. Кроме того, эти методы применимы также для целей трансформации и регенерации двудольных.
Однодольные растения, включающие коммерчески важные культуры, такие как зерновые, пригодны для использования с целью введения в них ДНК с помощью штаммов Agrobacterium (Европейский патент 159 418 B1; Gould J., Michael D., Hasegama O., Ulian EC, Peterson G., Smith RH, Plant Physiol., 1991, 95, 426 - 434).
Относительно выбора растения-хозяина следует отметить предпочтительность тех видов растений, которые содержат невысокую деградирующую активность в отношении трегалозы, либо вовсе не содержат ее. Однако растения, проявляющие трегалазную активность, не исключаются из числа тех растений-хозяев, которые пригодны для продуцирования трегалозы, но в этом случае, если указанная активность мешает накоплению трегалозы, необходимо добиться ингибирования трегалазы. Такое ингибирование может быть получено с применением известного в технике "антисмыслового подхода", который проиллюстрирован в настоящем описании с различными целями.
Следует отметить, что изобретение не ограничивается использованием только 35S промотора ВТМ в качестве региона инициации транскрипции. Могут также применяться подходящие для целей контроля экспрессируемых в растении генов последовательности ДНК, которые включают, в том числе, гены-маркеры, такие как регионы инициации транскрипции, энхансеры, нетранскрибируемые лидеры и др., которые могут быть получены из любого экспрессируемого в растении гена, таких как, например, эндогенные гены растений, гены, экспрессируемые в растительных клетках в естественных условиях, в частности те, которые локализованы на T-ДНК Agrobacterium дикого типа, гены вирусов растений, а также эукариотические гены, которые включают регион инициации транскрипции, совпадающий с консенсусной последовательностью инициации транскрипции в эукариотических клетках. Изобретение относится также к гибридным промоторам, сочетающим в себе функциональные участки различных промоторов или их синтезированные эквиваленты. Кроме конститутивных промоторов с целью контроля экспрессии экспрессируемых в растении генов в соответствии с настоящим изобретением могут использоваться индуцибельные промоторы либо промоторы, регулируемые каким-либо иным, т.е. зависимым от времени или специфичным для данных клеток, образом для поддержания соответствующего характера экспрессии, существенным является лишь способность их экспрессироваться в тех частях растений, которые содержат субстрат для ТФС.
Для целей селекции или скрининга трансформированных клеток предпочтительно включать в систему для трансформации ген-маркер, связанный в соответствии с настоящим изобретением с экспрессируемым в растении геном, который переносится в растительную клетку. Выбор подходящего гена-маркера для проведения трансформации растительной клетки представляется делом техники, которое по силам любому специалисту со средним уровнем знаний в данной области; так, например, в качестве примеров таких традиционно используемых в экспериментах по трансформации генов-маркеров можно привести гены неомицинфосфотрансферазы, которые придают клеткам устойчивость к канамицину (EP-B 131 623), ген глютатион-S-трансферазы из печени крыс, который сообщает устойчивость к гербицидам, полученным на основе глютатиона (EP-A 256 223), ген глютаминсинтетазы, который, определяя суперэкспрессию этого фермента, придает устойчивость к ингибиторам глютаминсинтетазы, таким, как фосфинотрицин (WO 87/05327), ген ацетилтрансферазы из Streptomyces viridochromogenes, который придает устойчивость к селективному агенту фосфинотритрицину (EP-A 275 957), ген, кодирующий 5-энолшикимат-3-фосфат-синтазу (EPSPS), придающий толерантность к N-фосфонометилглицину, bar-ген, придающий устойчивость к Bialaphos (WO 91/02071) и др. При этом выбор того или иного гена не существенен, если достигается его функционирование (причем селективное) в сочетании с выбранными растительными клетками.
Ген-маркер и интересующий ген не должен быть обязательно связаны, поскольку показано, что при трансформации растений совместная трансформация несвязанных генов также может проходить успешно (патент США 4 399 216).
Предпочтительным материалом для трансформации, особенно в случае двудольных культур, являются листовые пластинки, которые могут быть легко трансформированы, а, кроме того, характеризуются высокой регенерирующей способностью (Horsch et al., Science, 1985, 227, 1229 - 1231).
В том случае, когда продуцирование трегалозы достигается с применением экспрессируемого в растении трегалозо-фосфат-синтазного гена как единственного гена модификации углеводов, настоящее изобретение иллюстрируется примерами, включающими другие экспрессируемые в растении антисмысловые гены, способные воздействовать в плане повышения доступности субстрата для трегалозо-фосфат-синтазы. В качестве специфических примеров таких генов могут быть названы экспрессируемые в растении антисмысловые гены для СФС из кукурузы и картофеля, а также для АГФ-азы из картофеля. Даун-регуляция ферментов модификации углеводов с использованием антисмыслового подхода не ограничивается приведенными специфическими примерами. Так, например, экспрессируемые в растении антисмысловые гены, частично комплементарные к нужному гену, могут использоваться для ингибирования экспрессии гена-мишени, при этом экспрессируемый в растении антисмысловый ген продуцирует транскрипт, который является в достаточной степени комплементарным к транскрипту гена-мишени и достаточно длинным для целей ингибирования экспрессии упомянутого гена-мишени.
Для настоящего изобретения не существенно, каким образом наличие двух или более генов в одном растении оказывает рассматриваемое воздействие. Это воздействие может быть достигнуто, в том числе, с применением одного из нижеследующих методов:
(а) трансформации растительной линии полигенной конструкцией, содержащей для введения более одного гена;
(б) совместной трансформации одновременно различными конструкциями одной и той же клеточной линии;
(в) последовательных стадий трансформации одного и того же растения вводимыми генами;
(г) скрещивания двух растений, каждое из которых содержит по отличающемуся друг от друга гену для целей введения в то же растение.
Область применения настоящего изобретения охватывает как сельское хозяйство, так и садоводство, в частности, в связи с улучшением свойств растений, модифицированных по способу настоящего изобретения, равно как и ту область промышленности, где трегалоза применяется или может применяться. Трегалазо-фосфат и трегалоза могут применяться сами по себе в очищенном виде или в виде добавок, а также в виде продукта, запасенного для хранения в тех или иных частях растений. Части растений, несущие трегалозо-фосфат или трегалозу (повышенные уровни этих продуктов) могут использоваться либо сами по себе, либо консервироваться, причем уже без добавления трегалозы.
Трегалоза также может быть очищена из растений или частей растений, продуцирующих ее, и затем применяться в процессах промышленной обработки. В пищевой промышленности трегалоза может использоваться путем добавления трегалозы к продуктам перед высушиванием. Высушивание продуктов представляет собой важный способ консервирования, применяемый в промышленности. При этом трегалоза, по всей видимости, наиболее полезна для консервирования пищевых продуктов с применением традиционной воздушной сушки, позволяя быстрое восстановление продукта высокого качества при добавлении воды (Roser et al., July 1991, Trends in Food Science and Technology, pp. 166 - 169). Получаемый при этом положительный эффект включает сохранение естественных ароматических веществ/запаха, вкуса свежего продукта и питательной ценности (наличие белков и витаминов). Было показано, что трегалоза обладает способностью стабилизировать белки и мембраны, образуя при этом химически инертную, стабильную стеклоподобную массу. Низкое содержание воды в таких глубоко высушенных продуктах препятствует протеканию химических реакций, которые могли бы вызвать их порчу.
Полевые сельскохозяйственные культуры, такие как зерновые, маниок, картофель, сахарная свекла и сахарный тростник уже давно используются в качестве естественного источника для промышленного производства углеводов (крахмалов и сахарозы). Достижение цели продуцирования трегалозы такими видами растений, в которых с помощью генно-инженерных методов был создан механизм биосинтеза трегалозы, дает основание для использования таких созданных генно-инженерными методами культур растений с целью получения трегалозы.
Все приведенные в настоящем описании ссылки указывают на тот уровень техники в данной области, к которому относится и настоящее изобретение. Все публикации, независимо от того, патенты это или любого другого рода материалы, которые уже цитировались или будут цитироваться в настоящем описании позже, включены в качестве ссылок.
Приведенные ниже примеры даны лишь с целью облегчения понимания настоящего изобретения и никоим образом не нацелены на ограничение его области.
Экспериментальная часть
Манипуляция с ДНК
Все процедуры, проводившиеся с ДНК (выделение ДНК из E.coli, рестрикция, лигирование, трансформация и т.д.), выполняются в соответствии со стандартно применяемыми для этого протоколами (Sambrook et al., Molecular Cloning: a laboratory manual, 1989, 2nd ed., Cold Spring Harbor Laboratory Press, CSH, New York).
Штаммы
Во всех примерах для клонирования использовали E.coli K-12, штамм DH5α. В экспериментах по трансформации растений использовали Agrobacterium tumefaciens, штамм MOG101, который представляет собой неонкогенный хелперный штамм октопинового типа, полученный на основе LBA1010 (Koekman et al., Plasmid, 1982, 7, 119) посредством замещения T-ДНК маркером устойчивости к спектиномицину.
Конструирование штамма Agrobacterium MOG101.
Для переноса генных конструкций в растения картофеля и табака была использована система на основе бинарного вектора (Hoekema A., Hirsch P.R., Hooykaas P. J. J. , and Schieperoort R.A., Neture, 1983, 303, 179). Хелперную плазмиду, придающую Agrobacterium tumefaciens вирулентность, получают из октопиновой Ti-плазмиды pTiB6, MOG101 представляет собой штамм Agrobacterium tumefaciens, который несет неонкогенную Ti-плазмиду (Koekman et al., 1982, приведенная выше ссылка), из которой был полностью удален T-регион и замещен бактериальным маркером устойчивости к спектиномицину, полученным из транспозона Tn 1831 (Hooykaas et al., Plasmid, 1980, 4, 64 - 75).
Ti-плазмида pTiB6 содержит два смежных T-региона - TL (T-левый) и TR (T-плавый). Для получения производной плазмиды, не содержащей TL- и TR-регионов, был сконструирован промежуточный вектор pMOG579. Плазмида pMOG579 представляет собой производную от плазмиды pBR322, которая содержит 2 фрагмента Ti-плазмиды, гомологичных к фрагментам, локализованным слева и справа от T-регионов в pTiB6 (затененные участки на фиг. 5 и 6). Эти два фрагмента на плазмиде pMOG579 разделяются BamHI-HindIII фрагментом из транспозона Tn 1831 размером в 2,5 Kb (Hooykaas et al., Plasmid, 1980, 4, 64 - 75), несущим маркер устойчивости к спектиномицину (фиг. 6). Плазмиду вводят в Agrobacterium tumefaciens, штамм LBA1010 [C58-C9 (pTi B6) = обработанный штамм C58, в который введена pTiB6 (Koekman et al., 1982, приведенная выше ссылка)] из E.coli при проведении трех родительских скрещиваний с использованием в качестве хелпера HB101 8pRK2013. Трансконъюгаты отбирают на основе устойчивости к рифампицину (20 мг/л) и спектиномицину (250 мг/л). Двойная рекомбинация между pMOG579 и pTiB6 приводит к потере устойчивости к карбенициллину (pBR322 маркер) и делеции целого T-региона. Из 5000 реплик-трансконъюгатов, обладающих устойчивостью к спектиномицину, при помещении на карбенициллин (100 мг/л) лишь две проявили к нему чувствительность. Саузерн-анализ (данные не приведены) показал, что в результате двойной гибридизации происходит делеция всего T-региона. Полученный при этом штамм обозначается как MOG101. Этот штамм и конструкции, создаваемые на его основе, аналогичны таковым относительно штамма GV2260 (Deblaere et al., Nucl. Acid Res., 1985, 13, 4777 - 4788).
Альтернативным хелперным штаммом для MOG101 может быть LBA4404; этот штамм также может применяться для введения бинарной плазмиды, такой, в частности, как pMOG799, и последующей трансформации растения. Доступны также и другие подходящие хелперные штаммы.
Конструирование вектора экспрессии pMOG180
Вектор экспрессии pMOG180 является производным от pMOG18 (EP 0 479 359 A1, пример 26), в котором ген, кодирующий GUS, удален, а между РНК4 лидером ВМЛ (A1MV) и 3' nos терминатором могут быть вставлены другие гены в виде BamH1 фрагмента.
С этой целью синтезируют EcoR1/Ncol фрагмент MOG18, содержащий последовательности 35S промотора и РНК4 лидера ВМЛ (AlMV) с применением технологии ПЦР (полимеразой цепной реакции) со следующими праймерами:
5' ГTTTЦТАЦАГГАЦГГАГГАТЦЦТГГААГТАTTTГАААГА 3' И 5' ЦАГЦТАТГАЦЦАТГАТТАЦГ 3', что приводит к мутации Ncol сайта в BamH1 сайт. После этого pMOG18 вектор разрезают с помощью EcoR1 и BamH1, после чего может быть проведено лигирование по этим сайтам рестрикции свежесинтезированного EcoRI/BamH1 фрагмента. Для недопущения индукции в результате ПЦР случайных мутаций в промоторных последовательностях EcoR1/EcoRV фрагмент в синтезированном после проведения ПЦР EcoR1/BamH1 фрагменте замещают последовательностями дикого типа из pMOG18. Проводят секвенирование короткого фрагмента EcoR1/BamH1 с целью проверки на наличие мутаций. Полученный вектор экспрессии представляет собой плазмиду pMOG180 (фиг. 7).
Тройное скрещивание
Бинарные векторы активируют при тройных скрещиваемых штамма E.coli HB101, несущего плазмиду pRK2013 (Ditta G., Stanfield S., Corbin D., and Helinski D. R., et al., Proc. Natl. Acad. Sci. USA, 1980, 77, 7347) в Agrobacterium tumefaciens, штамм MOG101, и используют в этом виде для трансформации.
Трансформация табака (Nicotiana tabacum SRI)
Трансформацию табака проводят при совместном культивировании ткани растения со штаммом Agrobacterium tumefaciens MOG101 (Hoekema et al., Nature, 1983, 303, 179-180), содержащим интересующий бинарный вектор, как выше было описано. При этом для совместного культивирования с целью трансформации табака (Nicotiana tabacum cv. Petit Havana SRI) используют листовые пластинки табака по способу, описанному Хоршем с соавт. (Horsch et al., Science, 1985, 227, 1229-1231). Из побегов восстанавливают трансгенные растения при выращивании на селективной среде, содержащей либо канамицин, либо гигромицин, в зависимости от того, какой устойчивостью обладает присутствующий в бинарной плазмиде ген, затем окореняют растение и переносят на почву.
Трансформация картофеля
Трансформацию картофеля (Solanum tuberosum cv. Desiree) проводят штаммом Agrobacterium MOG101, содержащим интересующий бинарный вектор (Hoekema, A., Huisman, M.J., Molendijk, Z., Van den Elzen, P.J.M., and Cornelissen, B.J.C. , Bio/ Technology, 1989, 7, 273). В качестве основной культуральной среды используют MS30R30, которая состоит из MS-среды (Murashige, T., and Skoog, F. , Physiol. Plan., 1962, 14, 473), дополненной сахарозой в количестве 30 г/л, R3 витаминами (Ooms, J., Burrell, M.M., Karp, A., Bevan M., and Hille, J. , Theor. appl. Genet., 1987, 73, 744), 5 мкМ зеатин рибозида (3P) и 0,3 мкМ индолуксусной кислоты (ИУК). При необходимости для затвердевания среды вносят 0,7 г/л агара (Daichin).
Клубни Solanum tuberosum cv. Desiree очищают и подвергают поверхностной стерилизации в течение 20 минут в 0,6% растворе гипохлорита, содержащем 0,1% Твин-20. Картофель тщательно промывают в больших объемах стерильной воды в течение периода времени не менее двух часов. После этого нарезают диски толщиной примерно 2 мм из цилиндрических кусочков картофельной ткани, приготовленной с помощью пробкового бура. Диски инкубируют в течение 20 минут в суспензии, состоящей из MS30R3 среды без 3P и ИУК, которая содержит в 1 мл 106 - 107 бактериальных клеток Agrobacterium MOG101, содержащих бинарный вектор. Затем диски последовательно промакивают досуха о стерильную фильтровальную бумагу и переносят на твердую среду MS30R3, содержащую 3P и ИУК. По прошествии 2 дней диски переносят на свежую среду, которая содержит 100 мг/л цефотаксима и 50 мг/л ванкомицина. Через неделю диски снова переносят на такую же среду, но с содержанием 10 мг/л канамицина для целей селекции трансгенных побегов. Через 4 - 8 недель срезают побеги, появившиеся из дисков, и помещают их в среду для корнеобразования (среда MS30R3 без 3P и ИУК, но содержащая 100 мг/л цефотаксима и 100 мг/л канамицина). Побеги размножают аксенично меристемными срезами и переносят на почву после развития корней. Там, где это удобно, вместо 100 мг/л канамицина используют гигромицин в количестве 10 мг/л.
Трансформацию картофеля сорта Кардал (cv. Kar dal) проводят в принципе так же, как и сорта Дезире (cv. Desiree), за исключением некоторых модификаций, а именно:
фитогормоны в среде представлены в основной культуральной среде следующим образом: зеатин рибозид 3,5 мг/л; ИУК (индолуксусная кислота) 0,03 мг/л;
используемая для трансформации суспензия Agrobacterium содержит от 105 до 106 бактерий на миллилитр;
концентрация канамицина в среде для корнеобразования составляет 50 мг/л.
Метод определения трегалозы
Трегалозу определяют по методу Хоттигера с соавт (Hottiger et al., J. Bact. , 1987, 169, 5518). Ткань картофельных клубней замораживают в жидком азоте растирают в порошок с помощью ступки и пестика и проводят последовательную экстракцию 500 мМ трихлоруксусной кислотой, примерно 3 объемами, в течение 60 минут при комнатной температуре. Полученный после центрифугирования твердый материал снова подвергают экстракции таким же способом. Полученные после двух экстракций объединенные супернатанты исследуют на наличие антрон-положительного материала (Spiro R.G., Meth. Enzymol., 1966, 8, 3). Качественное определение трегалозы проводят методом ТСХ. Экстракты деионизируют (Мерк, ионнообменник V) и вносят на пластинки с силикагелем 60 (Мерк). После проведения хроматографии пластинки обрабатывают смесью н-бутанол-пиридин-вода (15: 3: 2, объем/объем). Для визуализации пятен их опрыскивают 5 мг/мл валинина в концентрированной H2SO4 и нагревают при температуре 130oC. В качестве стандарта используют коммерчески доступную трегалозу (Сигма).
Альтернативно, трегалозу можно определить количественно методом анионообменной хроматографии с использованием импульсного амперометрического детектора. Для приготовления экстрактов добавляют 1 мл кипящей воды к 1 г замороженного материала, после чего полученную массу нагревают в течение 15 минут при температуре 100oC. Образцы (25 мкл) анализируют на жидкостном хроматографе Дионекс DX-100 (Dionex Dx-100), снабженном колонкой карбопак PA-1 Дионекс 35391 размером 4 х 250 мм (Dionex 35391 carbopac PA-1) и предварительной колонкой карбопак PA-1 Дионекс 43096 размером 4 х 50 мм (Dionex 43096 carbopac PA-1). Элюцию проводят 100 мМ NaOH со скоростью 1 мл/мин. Сахара обнаруживают с помощью импульсного амперометрического детектора (Дионекс, PAD-2). В качестве стандарта используют коммерчески доступную трегалозу (Сигма).
Определение активности фермента
Во всех определениях в качестве контроля используют нетрансгенный материал клубней или нетрансгенный материал табака. Содержание белка во всех образцах определяют по методу Брэдфорда (Bradford, Anal. Biochem, 1976, 72. 248). Для тестирования экстрактов клубней гомогенизируют замороженные ломтики картофельных клубней приблизительно по 100 мг весом в 100 мкл 20 мМ HEPES, pH 7,4 и центрифугируют (Эппендорф, 5 минут при максимальной скорости). Супернатант используют для тестирования активности.
СФС-активность
СФС активность определяют по существу так, как это описано в литературе (Amir, J. and Preiss J., Plant Physiol., 1982, 69, 1027-1030). В зависимости от состава реакционной смеси при его изменении могут определяться две различные активные формы СФС; Vmax и Vsel. Для определения Vmax реакционная смесь в общем объеме, равном 50 мкл, содержит 3,2 мМ УДФ-глюкозы, 81 мкМ [14C] -УДФ-глюкозы, 3,2 мМ фруктозо-6-фосфата, 16 мМ глюкозо-6-фосфата, 100 мМ HEPES, pH 7,4, 20 мМ MgCl2 и 5 мМ ЭДТА. При определении Vsel реакционная смесь содержит половинную концентрацию фруктозо-6-фосфата и глюкозо-6-фосфата, кроме того, в нее вносится 5 мМ неорганического фосфата. В качестве контроля проводят определение СФС активности в Vmax реакционной среде без добавления фруктозо-6-фосфата и глюкозо-6-фосфата. Реакция проходит при комнатной температуре в течение 30 минут, затем ее останавливают нагреванием смеси до температуры 95oC в течение 5 минут. Продукты реакции обрабатывают щелочной фосфатазой, а полученную [14C]-сахарозу отделяют от субстратов с помощью ионообменной хроматографии. Количество радиоактивно меченой сахарозы, образованной в ходе реакции, измеряют на сцинтилляционном счетчике.
ТФС-активность
ТФС активность измеряют с применением способа, аналогичного таковому, описанному для СФС. После ионообменной хроматографии образцы содержат как дефосфорилированную сахарозу, так и трегалозу. Для определения того, какая часть в образованных продуктах представлена трегалозой, образцы разделяют методом ТСХ, как это уже было описано. Экстракты деионизируют (Мерк, ионообменник V) и наносят на пластинки с силикагелем 60 (Мерк). После хроматографирования пятна, содержащие [14C]-сахарозу и [14C]-трегалозу, соскребают с пластинок и измеряют величину радиоактивной метки на сцинтилляционном счетчике.
Активность АГФ-азы
Активность АГФ-азы определяют по методу Мюллера-Ребера с соавт. (Muller-Rober B. , Sonnewald, U. , and Willmitzer. Z., EMBO J., 1992, 11, 1229). Образование глюкозо-1-фосфата из АДФ-глюкозы определяют в НАД-сопряженной глюкозо-6-фосфат-дегидрогеназной системе. Реакционная среда для тестирования содержит 80 мМ HEPES, pH 7,4, 10 мМ MgCl2, 1 мМ АДФ-глюкозы, 0,6 мМ НАД, 10 мкМ глюкозо-1,6-дифосфата, 3 мМ ДТТ, 0,02% бычьего сывороточного альбумина, 1 ед. фосфоглюкомутазы из мышцы кролика (Сигма), 2,5 ед НАД-сопряженной глюкозо-6-фосфат дегидрогеназы из Leuconostoc mesenteroides и экстракт из клубней. Реакция запускается с момента добавления пирофосфата натрия до конечной концентрации 2 мМ. Восстановление НАД определяют спектрофотометрически, при длине волны 340 нм и при температуре 30oC. Единица активности АГФ-азы определяется как количество нмолей глюкозо-1-фосфата, образованных в минуту при температуре 30oC.
Пример I. Клонирование otsA гена E.coli полной длины
В E. coli трегалозо-фосфат-синтаза (ТФС) кодируется otcA геном, расположенным на опероне otsBA. Локализация и направление транскрипции этого оперона на хромосоме E.Coli уже известны (Kaasen J., Falkenberg P., Styrvold O. B., and Strom A.B., J.Bact., 1992, 174, 889). Ген otsBA локализован на 42' и в соответствии с данными Каасена охватывается фрагментом размером 18,8 kb в геномном клоне EMBL 4, обозначенном на карте Кохара в соавт. как 7F11 (Kohara Y., Akiyama K., and Isono K., Cell, 1987, 50, 495). Из лизата ламбда клона 7F11 получают ДНК, которую затем расщепляют рестриктазой HindIII. Выделенный HindIII фрагмент размером 2,9 kb (как это уже было отмечено Каасеном с соавт., на карте Кохара с соавт. во вставке отсутствует "правая рука" HindIII сайта на расстоянии 14,3 kb) клонируют в pCU18, линеаризованном с применением HindIII. Далее проводят секвенирование HindIII вставки размером 2,9 kb в полученной плазмиде, обозначенной pMOG674. Было показано, что последовательность содержит часть ara H гена в опероне транспорта арабинозы (Scripture J.B., Voelker C., Miller S., O'Donnell R.T., Polgar Z., Rade J., Horazdovsky B. F., and Hogg R.W., J. Mol. Biol., 1987, 197, 137), otsB ген, кодирующий ТФФ, с той же локализацией, как и указывал Каасен с соавт., и часть otsA гена, кодирующего ТФС. Было показано, что в отличие от данных Каасена с соавт. ots A не ограничивается HindIII фрагментом размером 2,9 kb. Для завершения характеристики последовательности был выделен и частично секвенирован перекрывающийся Bam H1/EcoR1 фрагмент. Полная последовательность otsA гена, кодирующего ТФС, показана на SEQIDNO: 2. Положение otsA гена в клоне 7F11, определенное на основании данных по сайтам рестрикции рестрикционных эндонуклеаз, показано на фиг. 8. Кроме того, на "левой руке" сайта в HindIII фрагменте размером 2,9 kb был обнаружен дополнительный HindIII сайт, не отмеченный на карте Кохара с соавт.
В плазмиде pMOG180 HindIII сайт был заменен SstI сайтом посредством клонирования олигонуклеотидного дуплекса
SstI
5' AGCTCACGAGCTCTCAGG 3' (SEQIDNO: 8)
3' GTGCTCGAGAGTCCTCGA 5' (SEQIDNO: 9)
в pMOG180, разрезанной с использованием HindIII. Полученный вектор обозначен как pMOG746. Олигонуклеотидный дуплекс
клонируют в векторе pMOG746, линеаризованном с помощью Bam H1. Вектор вместе с олигонуклеотидным дуплексом, ориентированным в нужном направлении (верность ориентации тестируется методом переваривания рестрикционными ферментами), обозначаются как pMOG747. HindIII фрагмент плазмиды pMOG674 размером 2,9 kb клонируют в pMOG747, линеаризованной с применением HindIII, что приводит к образованию вектора pMOG748. Выделяют EcoRV/SstI и SstI/SmaI фрагменты pMOG748, размером соответственно около 2,4 kb и 3,5 kb, которые затем лигируют и трансформируют в E. coli, что приводит к делетированию HindIII фрагмента размером 2,9 kb на 3'-конце. Полученная плазмида обозначается как pMOG749. 5'-конец otsA гена синтезируют методом ПЦР с использованием синтетических олигонуклеотидов ТФС1 и ТФС2, а также pMOG749 в качестве матрицы.
TPS1 5' GAGAAAATACCCGGGGTGATGAC 3' (SEQIDNO: 12)
TPS2 5' GATAATCGTGGATCCAGATAATGTC 3' (SEQIDNO: 13)
Результаты секвенирования подтвердили, что ПЦР фрагмент размером 0,4 kb имеет верную последовательность. BamH1/HindIII фрагмент pMOG749 размером 1 kb клонируют вместе с Xm-a1/Bam H1 ПЦР фрагментом размером 0,4 kb в pMOG747, линеаризованном с применением Xma1 и HindIII. В полученной плазмиде, после расщепления ее ферментами HindIII и SstI клонируют синтетический дуплекс ТФSC/7, который кодирует три аминокислоты на C-конце ТФС.
LysLeuAlaStop
TPS 6/7: 5' AGCTGGCGTGAGGAGCGGTTAATAAGCTTGAGCT 3'
3' CCGCACTCCTCGCCAATTATTCGAAC 5'
В полученной плазмиде, после расщепления ее рестриктазами HindIII и SstI, клонируют HindIII/SstI фрагмент размером 0,25 kb в плазмиде pMOG749, которая включает терминатор из нопалинсинтазного гена (NOS) Agrobacterium tumefaciens, что приводит к получению плазмиды pMOG798. Эта плазмида содержит ots A-ген E.coli в правильной ориентации под контролем 35S промотора вируса мозаики цветной капусты (CaMV), содержащего двойной энхансер (Guilley et al., Cell, 1982, 30, 763), лидерную последовательность РНК4 из вируса мозаики люцерны (AMV) (Brederode et al., Nucl. Acids Res., 1980, 8, 2213) и терминирующую последовательность транскрипции нопалинсинтазы из Agrobacterium tumefaciens. Полигенный экспрессирующий кластер полностью клонируют в виде E. coR1/SstI фрагмента в бинарном векторе pMOG23, линеаризованном с применением EcoR1 и SstI. Полученный бинарный вектор pMOG799 (фиг. 9) используют для трансформации картофеля и табака, штамм E.coli, несущий pMOG799, был депонирован в Коллекции Утрехта, Нидерланды, 23 августа 1993 г, под депозитным номером CBS 430.93 (Centraal Bureau voor Schimmelcultures, Phabagen collections, Padualaan 8, Utrecht, The Netherlands); pMOG23 был депонирован в CDS 29 июня 1990 г. под депозитным номером CBS 102.907.
Пример II. Образование трегалозы в табаке, трансформированном с использованием pMOG799
С использованием Agrobacterium tumefaciens, несущей бинарный вектор pMOG799, проводят трансформацию листовых дисков табака. На наличие трегалозо-фосфат-синтазной активности (ТФС) было проанализировано 20 отдельных трансгенных побегов. Было показано, что некоторые растения табака, растущие in vitro, имеют очень толстые корни, в отличие от нетрансформированных растений. При исследовании корней в таких трансгенных растениях табака было выявлено превышение содержания трегалозы над уровнем ее в нетрансгенных растениях (табл. 1).
Пример III. Образование трегалозы в растениях картофеля, трансформированных с использованием pMOG799.
Проводят трансформацию дисков картофельных клубней бинарным вектором pMOG799 при использовании для этой процедуры Agrobacterium tumefaciens. С использованием канамицина отбирают трансгенные побеги. На наличие трегалозо-фосфат-синтазной активности (ТФС) было проанализировано 20 отдельных трансгенных побегов. Было показано, что побеги, содержащие этот фермент, вырастают до зрелых растений. Анализ зрелых клубней полученных таким образом трансгенных растений картофеля выявляет повышение уровня трегалозы в сравнении с нетрансгенными контрольными растениями. При этом трансгенную линию растений pMOG799.1 размножают для целей дальнейших исследований.
Пример IV. Конструирование pMOG664.
Синтезируют два олигонуклеотида, соответствующих последовательности кДНК для малой субъединицы АДФ-глюкозопирофосфорилазы (АГФ-азы B) из клубней картофеля, сорт Дезире (cv. Desiree) (Muller-Rober, B., Kossmann, J., Hannah. L. C.. Willmitzer, Z., and Sonnewald, U., Mol. Gen. Genet., 1990, 224, 136-146):
5' TCCCCATGGAATCAAAGCATCC 3' (SEQIDNO: 4)
5' GATTGGATCCAGGGCACGGCTG 3' (SEQIDNO: 5)
Синтез проводят с учетом введения в состав олигонуклеотидов на их концах подходящих сайтов рестрикции (BamH1 и Ncol, на схеме подчеркнуты) для создания условий, благоприятствующих группированию в полигенном кластере экспрессии в антисмысловом направлении после расщепления упомянутыми ферментами. Указанные олигонуклеотиды используют для целей амплификации методом ПЦР фрагмента ДНК размером 1 kb с использованием в качестве матрицы ДНК, выделенной из библиотеки кДНК растений картофеля, сорт Дезире (cv. Desiree), полученной из ткани 2-месячного листа (Clontech). Результаты проведенного секвенирования показали, что этот фрагмент идентичен последовательности АГФ-азы B в растениях картофеля, сорт Дезире (cv. Desiree) (Muller-Rober, B., Kossmann, J. , Hannah, L.C., Willmitzer, S., and Sonnewald, U., Mol, Gen. Genet. , 1990, 224, 136-146). После расщепления упомянутого фрагмента ферментами BamH1 и Hcol проводят его клонирование в pMOG18, линеаризовнном с применением BamH1 и Ncol. Далее осуществляют клонирование EcoR1/BamH1 фрагмента полученной плазмиды размером 1,85 kb [содержащего 35S промотор CaMV, PHK4 лидер из ВМЛ (AMV) и фрагмент АГФ-азы в антисмысловой ориентации], а также BamH1/HindIII фрагмента, содержащего терминатор нопалинсинтазного (NOS) гена из Agrobacterium tumefaciens, с применением процедуры трехкратного лигирования в бинарном векторе pMOG22, линеаризованном с помощью EcoR1 и HindIII. Бинарный вектор pMOG22 содержит экспрессируемый в растении HPT11 ген, используемый для селекции трансгенных растений на гигромицине [pMOG22 был депонирован в Центральном Коллекторе культур 29 января 1990 г., под депозитным номером 101.90 (Centraal Bureau voor Schimmelcultures)]. Полученный бинарный вектор pMOG664 (фиг. 4) был использован для трансформации растений картофеля.
Пример V. Конструирование pMOG801
Был проведен синтез множества олигонуклеотидов, комплементарных к последовательности кДНК для сахарозо-фосфатсинтазы (СФС) из кукурузы (Worrell, A. C. , Bruneau, J.-M., Summerfalt, K., Boorsig, M., and Voelker, T.A., Plant CM. 1991, 3, 1121). Их последовательность выглядит следующим образом:
5' CTAGGTCGTGATTCTGATACAGGTGGCCAGGTG 3' (SEQIDNO: 6)
5' CAGCATCGGCATAGTGCCCATGTATCACGTAAGGC 3' (SEQIDNO: 7)
Указанные олигонуклеотиды используют для целей амплификации методом ПЦР фрагмента ДНК размером 370 н.п. с использованием в качестве матрицы ДНК, выделенной из библиотеки кДНК растений картофеля, сорт Дезире (cv. Desiree), полученной из ткани 2-месячного листа (Clontech). В результате секвенирования этого фрагмента было показано, что он гомологичен СФС последовательности из растений кукурузы [см. фиг. 3 и ссылку: Воррел с соавт. (Worrell et al. , 1991)]. ПЦР фрагмент используют для скрининга ламбда gt 10 библиотеки кДНК растений картофеля, сорт Дезире (cv. Desire), полученной из ткани 2-месячного листа (Clontech). Далее проводят секвенирование одного клона, показывающего положительные результаты гибридизации. Было показано, что последовательность фрагмента ДНК размером 654 н.п. на 65% идентична последовательности соответствующей части СФС в растениях кукурузы [начало от нуклеотида под No. 349, как показано на фиг. 11, в соответствии с данными Воррелла с соавт. (Worrell et al., 1990)]. EcoR1 вставку из этого клона клонируют в pMOG180, расщепляют с использованием BamHI, проводят трехкратное лигирование с указанным ниже синтетическим олигонуклеотидным дуплексом.
5' GATCGTCAGATCTAGC 3' (SEQIDNO: 14)
3' CAGTCTAGATCGTTAA 5' (SEQIDNO: 15)
Плазмиду, несущую СФС фрагмент в антисмысловой ориентации относительно 35S промотора CaMV, обозначили как pMOG787. EcoR1/HindIII фрагмент плазмиды pMOG787 клонируют в бинарном векторе pMOG22, линеаризованном с помощью EcoR1, применяя трехкратное лигирование с синтетическим линкером:
5' AGCTTCCCCCCCG 3' (SEQIDNO: 16)
3' AGGGGGGGCTTAA 5' (SEQIDNO: 17)
Бинарный вектор pMOG22 содержит экспрессируемый в растении ген HPT11 для целей селекции трансгенный растений на гигромицине [pMOG22 был депонирован в Центральном Коллекторе Культур 29 января 1990 г. под депозитным номером 101.90 (Centraal Bureau voor Schimmelcultures)]. Полученный в результате описанных процедур бинарный вектор pMOG801 (фиг. 10) был применен для трансформации растений картофеля.
Пример VI. Конструирование pMOG802
EcoR1 фрагмент плазмиды pMOG801, содержащий полигенный кластер экспрессии СФС, клонируют в бинарном векторе pMOG664 (содержит антисмысловой полигенный кластер экспрессии АГФ-азы), линеаризованном с помощью EcoR1. Полученный бинарный вектор получил название pMOG802 (фиг. 11).
Пример VII. Продуцирование трегалозы в растениях картофеля, трансформированных с применением pMOG799 и pMOG664
Диски картофельных клубней растительной линии pMOG799.1, экспрессирующей ТФС (пример IX), трансформируют с применением бинарного вектора pMOG664, который содержит антисмысловой полигенный кластер экспрессии АГФ-азы. Трансгенные побеги, отобранные при добавлении гигромицина в количестве 10 мг/л, исследуют с помощью метода ПЦР на наличие ТФС и антисмысловой АГФ-азной последовательностей. Те трансгенные растения, которые содержат оба упомянутых вида последовательностей, анализируют на наличие ТФС и АГФ-азной активностей.
В результате анализа трансгенных клубней на наличие АГФ-азной активности было показано, что в индивидуальных трансгенных линиях происходит снижение уровня активности в сравнении с нетрансгенным контролем. С применением нозерн-блоттинга было продемонстрировано, что в трансгенных растениях имеет место также снижение в сравнении с нетрансгенными контрольными растениями уровня мРНК для АГФ-азы. Уровень трегалозы в клубнях трансгенных растений, которые, как было выявлено, обладают активностью ТФС и сниженным уровнем АГФ-азы, повышен в сравнении с его значением, показанным для клубней трансгенной растительной линии MOG799.1.
Пример VIII. Продуцирование трегалозы в растениях картофеля, трансформированных с использованием pMOG799 и pMOG801
Диски картофельных клубней устойчивой к канамицину растительной линии MOG799.1, экспрессирующей ТФС (пример IX), трансформируют с применением для этой процедуры бинарного вектора pMOG801, который содержит антисмысловой полигенный кластер экспрессии СФС. Трансгенные побеги, отобранные в присутствии 10 мг/л гигромицина, исследуют методом ПЦР на наличие ТФС и антисмысловой СФС последовательностей. Трансгенные растения, содержащие оба упомянутых вида последовательностей, анализируют далее на наличие ТФС и СФС активностей.
При исследовании трансгенных клубней на наличие СФС активности было показано, что в индивидуальных трансгенных линиях имеет место снижение рассматриваемой активности в сравнении с нетрансгенным контролем. С применением метода нозерн-блоттинга было показано, что уровень мРНК для СФС в трансгенных растениях также снижен в сравнении с его значением, характерным для нетрансгенных контрольных растений. Уровень трегалозы в клубнях трансгенных растений картофеля, которые, как было выявлено, обладают активностью ТФС и сниженным уровнем СФС, повышен в сравнении с его значением, показанным для клубней трансгенной растительной линии MOG799.1.
Пример IX. Продуцирование трегалозы в растениях картофеля, трансформированных с применением pMOG799 и pMOG802
Диски картофельных клубней устойчивой к канамицину растительной линии MOG799.1, экспрессирующей ТФС (пример IX), трансформируют с применением для этой процедуры бинарного вектора pMOG802, который содержит антисмысловые полигенные кластеры экспрессии СФС и АГФ-азы. Трансгенные побеги, отобранные в присутствии 10 мг/л гигромицина, исследуют методом ПЦР на наличие ТФС, антисмысловой АГФ-азной и антисмысловой СФС последовательностей. Трансгенные растения, содержащие все три упомянутых конструкции, анализируют далее на наличие ТФС, АГФ-азной и СФС активностей.
При исследовании трансгенных клубней на наличие АГФ-азной и СФС активности было отмечено снижение активности обоих ферментов в индивидуальных трансгенных линиях в сравнении с нетрансгенным контролем. С применением метода нозерн-блоттинга было показано, что уровень мРНК для АГФ-азы и СФС в трансгенных растениях также снижен в сравнении с их значениями, характерными для нетрансгенных контрольных растений. Уровень трегалозы в клубнях трансгенных растений картофеля, которые, как было выявлено, обладают активностью ТФС и сниженным уровнем СФС, повышен в сравнении с его значением, показанным для клубней трансгенных растений линии MOG799.1.
Депонированные штаммы:
pMOG22; Депозитный N CBS 101.90 [стр. 23 (оригинала), строки 18 - 21; стр. 24 (оригинала), строки 21 - 23]
pMOG23; Депозитный N CBS 102.90 [стр. 22 (оригинала), строка 10]
pMOG799; Депозитный N CBS 430.93 [стр. 22 (оригинала), строка 6].
Данные по аккумуляции трегалозы в табаке и картофеле
Растения табака были трансформированы pMOG799, как описано в примере II данной патентной заявки. Из анализа листьев этих растений табака были получены следующие данные (количество трегалозы измеряли как процентное содержание по массе свежего растения):
Линия - Содержание трегалозы
799-1 - 0,004
799-3 - 0,002
799-5 - 0,008
799-15 - 0,006
799-24 - 0,002
799-26 - 0,005
799-32 - 0,006
799-40 - 0,012
дикого типа - 0,000
Растения картофеля были трансформированы pMOG845, являющейся производной плазмиды pMOG799, в которой промотор 35S был заменен на клубнеспецифический промотор папаина. Из последующего анализа клубней трансформированных растений были получены следующие данные (количество трегалозы измеряли как процентное содержание по массе свежего растения):
Линия - Содержание трегалозы
845-1-1 - 0,0050
845-1-2 - 0,0048
845-1-3 - 0,0017
845-2-1 - 0,0012
845-13-1 - 0,0010
дик.т.-1 - ≤ 0,0010
дик.т.-2 - ≤ 0,0010
дик.т.-3 - ≤ 0,0010
Перечень последовательностей приведен в конце описания.











Изобретение может быть использовано в сельском хозяйстве и пищевой промышленности. При введении в растительную клетку нуклеиновой кислоты, кодирующей трегалозофосфатсинтазу Е.соli, можно получить растение с повышенным содержанием трегалозы. Трегалоза может быть применена, например, в качестве добавки к пищевым продуктам или кормам, если ее извлечь из растения. За счет более высокого содержания в частях растений трегалозы достигается продолжительность хранения содержащей ее продукции, т.к. наличие трегалозы стабилизирует низкий уровень содержания влаги в продукте, т.е. обеспечивает его консервацию. 6 с. и 3 з.п. ф-лы, 11 ил.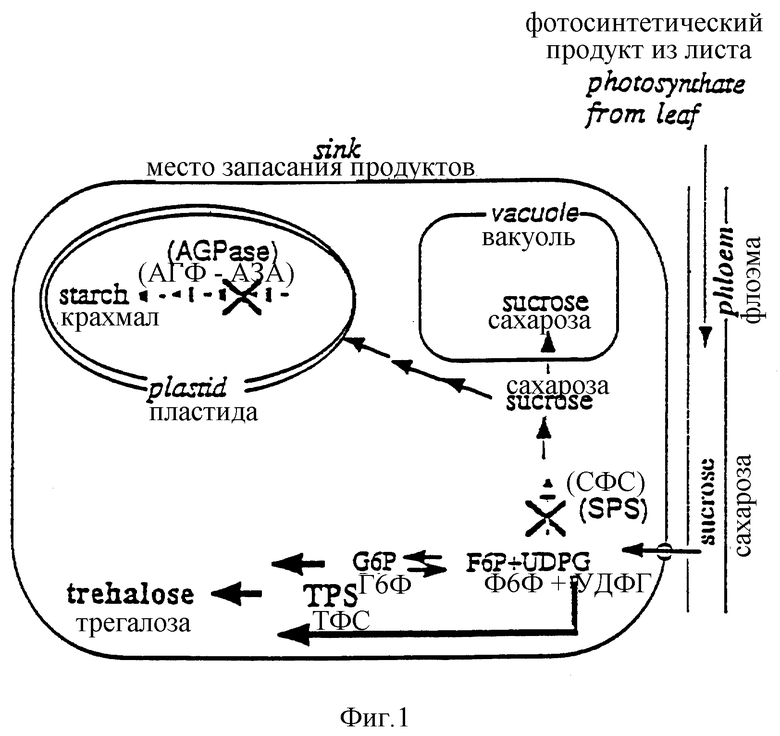
| Способ определения прироста содержания солей в конденсате | 1970 |
|
SU451896A1 |
| Биохимия растений./ Пер | |||
| с англ | |||
| под ред | |||
| Кретовича В.П | |||
| - М.: Мир, 1968, с.130. | |||
Авторы
Даты
1999-12-27—Публикация
1994-06-30—Подача