Настоящее изобретение относится к способам ингибирования образования цветков и к способам индуцирования образования цветков у растений, а также к способам улучшения способности к хранению запасающих органов полезных растений и к способам уменьшения прорастания клубней у клубневых растений. Настоящее изобретение также относится к последовательностям ДНК, кодирующим цитрат-синтазу растений, и к новым плазмидам, содержащим эти последовательности ДНК, которые в результате интеграции с геномом растения изменяют активность цитрат-синтазы у растения, а также к трансгенным растениям, у которых изменения активности цитрат-синтазы получают путем введения указанных последовательностей ДНК.
Вследствие непрерывного возрастания потребности в продовольствии, являющегося результатом постоянного роста численности населения земного шара, одной из задач биотехнологических исследований является стремление увеличить урожайность полезных растений. Одной из возможностей достижения этого является, например, изменение характера цветения полезных сельскохозяйственных растений. Возрастание количества цветков является, например, желательным для растений, цветки, плоды или семена которых имеют сельскохозяйственное значение. Более раннее образование цветков приводит к укорачиванию периода между посевом и цветением, что, таким образом, позволяет культивировать растения в климатических зонах с укороченными периодами вегетации или применять два посева в течение одного вегетационного периода. Ингибирование образования цветков может быть целесообразным в отношении растений, которые размножаются преимущественно вегетативным способом, и может привести к увеличению накопления запасаемых веществ в запасающих органах. Одним из примеров такого полезного сельскохозяйственного растения является картофель.
Однако направленное изменение характера цветения у растений до настоящего времени не было возможным, поскольку процесс индуцирования образования цветков у растений оставался до сих пор недостаточно ясным. В качестве индукторов образования цветков рассматриваются различные вещества, такие как, например, углеводы, цитокинины, ауксин, полиамины и кальций. Однако в целом было признано, что цветение представляет собой сложный процесс, являющийся результатом взаимодействия нескольких факторов, которые еще недостаточно изучены (Bernier и др., (1993), Plant Cell, 5:1147-1155).
В настоящее время для изменения характера цветения, как правило, применяют химические вещества. Так, например, известно, что ингибирование образования цветков у сахарного тростника, приводящее к значительному увеличению получения сахара, может быть достигнуто путем экзогенного внесения различных синтетических регуляторов роста (монурона, диурона, диквата). Применение таких синтетических веществ, однако, обычно связано со значительными затратами и опасностью для окружающей среды, которую трудно оценить.
В связи с этим желательно разработать способы, позволяющие осуществлять направленное изменение характера цветения, в частности ингибирование или индуцирование образования цветков различных полезных растений, исключив при этом использование синтетических веществ.
Таким образом, целью настоящего изобретения является разработка способов, позволяющих получать растения с измененной характеристикой цветения, в частности растения, у которых ингибируют образование цветков, или растения с более ранним образованием цветков и их увеличенным количеством.
В настоящем изобретении описаны способы генетической инженерии, которые приводят к изменению характеристики цветения растений в результате изменения активности фермента, вовлеченного в процессы дыхания в клетках.
Неожиданно было установлено, что сильное ингибирование активности цитрат-синтазы в клетках растений картофеля приводит к полному ингибированию образования цветков у этих растений и что увеличение активности цитрат-синтазы в клетках трансформированных растений картофеля также приводит к изменению характера цветения растений, в частности к более раннему образованию цветков и к увеличению их количества.
Для получения растений со сниженной активностью цитрат-синтазы из различных видов растений выделяли последовательности ДНК, кодирующие ферменты с ферментативной активностью цитрат-синтазы. Этими последовательностями являются последовательности ДНК из растений семейства пасленовых (Solanaceae), в частности из Solanum tuberosum и Nicotiana tabacum, и последовательности из растений семейства маревых (Chenopodiacae), в частности из сахарной свеклы (Beta vulgaris).
Следовательно, предметом настоящего изобретения являются последовательности ДНК из растений семейства пасленовых, в частности из видов Solanum tuberosum и Nicotiana tabacum, и из растений семейства маревых, в частности из вида Beta vulgaris, кодирующие ферменты, обладающие ферментативной активностью цитрат-синтазы, и которые после интеграции с геномом растения позволяют получать транскрипты, у которых может быть подавлена активность эндогенной цитрат-синтазы, или получать транскрипты, в клетках которых может быть повышена активность цитрат-синтазы. В частности, изобретение относится к последовательностям ДНК, кодирующим протеин, имеющий одну из аминокислотных последовательностей, представленных в Seq ID N 1, Seq ID N 2 или Seq ID N 3, или протеин, имеющий практически идентичную аминокислотную последовательность, и к последовательностям ДНК, имеющим одну из нуклеотидных последовательностей, представленных в Seq ID N 1, Seq ID N 2 или Seq ID N 3, или практически идентичную нуклеотидную последовательность. Изобретение также относится к производным последовательностей, представленных в Seq ID N 1-3, которые могут быть получены из них в результате вставки (инсерции), делеции или замещения одного или более нуклеотидов или путем рекомбинации и которые кодируют протеины, обладающие ферментативной активностью цитрат-синтазы.
Рекомбинантные молекулы ДНК, например, плазмиды, и бактерии, содержащие эти последовательности ДНК или их участки, либо их производные, также являются предметом настоящего изобретения.
Термин "практически идентичные" в отношении ДНК и аминокислотных последовательностей означает, что рассматриваемые последовательности имеют высокую степень гомологичности и что существует функциональная и/или структурная эквивалентность между рассматриваемыми последовательностями ДНК или аминокислотными последовательностями. Под высокой степенью гомологичности понимается, что последовательность идентична по крайней мере на 40%, предпочтительно более чем на 60% и особенно предпочтительно более чем на 80%. Последовательности, которые являются гомологичными последовательностям по изобретению и отличаются от последовательности ДНК или аминокислотной последовательности по изобретению по одной или нескольким позициям, как правило, являются вариациями или производными этой последовательности и представляют собой модификации, выполняющие ту же функцию. Кроме того, они также могут быть вариациями естественного происхождения, например последовательностями из других организмов, или мутациями, причем эти мутации могут быть вызваны естественным путем или быть интродуцированы в результате направленного мутагенеза. Эти вариации также могут представлять собой последовательности, полученные искусственным путем.
Протеины, кодирующие различные варианты последовательности ДНК по изобретению, обладают определенными общими характеристиками. Последние могут включать, например, ферментативную активность, иммунологическую реактивность, конформацию и т.д., и физические свойства, такие как, например, подвижность при гель-электрофорезе, хроматографическое поведение, коэффициенты седиментации, растворимость, спектроскопические характеристики, стабильность и т.д.
Было установлено, что ингибирование образования цветков происходит в трансформированных растениях, если последовательности ДНК, кодирующие цитрат-синтазу, вводят в клетки растения и экспрессируют в антисмысловой ориентации, что приводит к уменьшению цитрат-синтазной активности в клетках.
В контексте настоящего изобретения ингибирование образования цветков означает, что у трансформированных растений цветки либо более не развиваются совсем или образуется меньше цветков, чем у нетрансформированных растений, либо некоторые цветки могут образовываться, но не превращаются в цветки с нормальными функциями. Ингибирование образования цветков также означает, что у растений цветки все же развиваются, но они являются стерильными и не приводят к образованию семян или плодов, или они способны функционировать только в ограниченной степени и приводят к образованию меньшего количества семян по сравнению с растениями дикого типа. В частности, ингибирование образования цветков означает, что формируются мужские стерильные цветки или цветки, в мужских репродуктивных органах которых формируется только небольшое количество способной к оплодотворению пыльцы. Термин также означает, что у растений формируются цветки, в которых женские репродуктивные органы отсутствуют, не обладают нормальными функциями или их функции понижены по сравнению с растениями дикого типа.
Ингибирование образования цветков также означает, что трансформированные растения, если они обладают способностью к зацветанию, зацветают позднее, чем нетрансформированные растения, как правило, позднее на несколько дней, предпочтительно позднее на одну или несколько недель, наиболее предпочтительно позднее на 2-4 недели.
Следовательно, предметом настоящего изобретения является применение последовательностей ДНК, кодирующих цитрат-синтазу, для ингибирования образования цветков у растений и применение таких последовательностей для экспрессии нетранслируемой мРНК, которая препятствует синтезу эндогенных цитрат-синтаз в клетках.
Настоящее изобретение также относится к способу ингибирования образования цветков у растений, отличающемуся тем, что в клетках растений снижают активность цитрат-синтазы, причем это снижение получают предпочтительно путем ингибирования экспрессии последовательностей ДНК, кодирующих цитрат-синтазы.
Наиболее предпочтительными являются способы, в которых ингибирование образования цветков достигают путем ингибирования экспрессии генов эндогенной цитрат-синтазы, применяя антисмысловую РНК.
Настоящее изобретение относится, в частности, к способам ингибирования образования цветков у растений, отличающимся тем, что
а) ДНК, комплементарную присутствующему в клетке гену цитрат-синтазы, стабильно интегрируют в геном клетки растения,
б) указанную ДНК экспрессируют присущим ей образом или ее индуцируют путем комбинации с соответствующими элементами, контролирующими транскрипцию,
в) экспрессию генов эндогенной цитрат-синтазы ингибируют в результате антисмыслового эффекта и
г) растения регенерируют из трансгенных клеток.
Экспрессию ДНК, комплементарной гену цитрат-синтазы, присутствующему в клетке, как правило, получают путем интегрирования в геном растений рекомбинантной двухцепочечной молекулы ДНК, включающей полигенный экспрессирующий кластер, имеющий следующие составляющие и экспрессирующий их:
А) промотор, функционирующий в растениях,
Б) последовательность ДНК, кодирующую цитрат-синтазу, которую сливают с промотором в антисмысловой ориентации так, чтобы транскрибировалась некодирующая цепь, и при необходимости
В) функционирующий в растениях сигнал для прекращения транскрипции и полиаденилирования молекулы РНК.
Такие молекулы ДНК также являются предметом изобретения. Настоящее изобретение относится к таким молекулам ДНК, которые содержат описанные полигенные экспрессирующие кластеры в форме плазмиды pKS-CSa (DSM 8880), содержащей кодирующую область для цитрат-синтазы картофеля, и плазмиды TCSAS (DSM 9359), содержащей кодирующую область для цитрат-синтазы табака, строение которых описано в примерах 3 и 8 соответственно.
В принципе, в качестве промотора может быть использован любой активный в растениях промотор. Промотор должен гарантировать, что выбранный ген экспрессируется в растении. Возможно применение как таких промоторов, которые гарантируют существенную экспрессию во всех тканях растения, как, например, промотор 35S вируса мозаики цветной капусты, так и таких промоторов, которые гарантируют экспрессию только в определенной ткани, на определенной стадии развития растения или в момент времени, определенный внешними воздействиями. Промотор может быть гомологичным или гетерологичным по отношению к трансформируемому растению.
Применение тканеспецифичных промоторов является предпочтительным предметом изобретения.
Последовательность ДНК, кодирующая протеин, обладающий ферментативной активностью цитрат-синтазы, может, в принципе, иметь происхождение из любого выбранного организма, предпочтительно из растений. Предпочтительно, чтобы используемая последовательность имела происхождение из тех видов растений, которые применяют для трансформации, или из близкородственных видов растений.
Предпочтительный пример осуществления указанного выше способа состоит в том, что в качестве последовательности ДНК, кодирующей цитрат-синтазу, применяют последовательность ДНК, имеющую происхождение из растения семейства Solanaceae или семейства Chenopodiaceae, в частности из Solanum tuberosum, Nicotiana tabacum или Beta vulgaris. Наиболее предпочтительные примеры выполнения изобретения включают применение последовательности ДНК, кодирующей протеин, имеющий одну из аминокислотных последовательностей, представленных в Seq ID N 1, Seq ID N 2 или Seq ID N 3, или практически идентичную аминокислотную последовательность, в частности последовательность ДНК, которая идентична или практически идентична одной из последовательностей ДНК, представленных в Seq ID N 1, Seq ID N 2 или Seq ID N 3.
Кроме того, используя стандартные способы и уже известные последовательности ДНК, кодирующие цитрат-синтазы, могут быть выделены из любых организмов, предпочтительно из растений, другие последовательности ДНК, которые кодируют протеины, обладающие ферментативной активностью цитрат-синтазы. Эти последовательности также могут применяться в способах по настоящему изобретению.
Антисмысловая ориентация по отношению к промотору кодирующей последовательности ДНК, указанная в п. Б), приводит к образованию нетранслируемой мРНК в трансформированных клетках растений, что препятствует синтезу эндогенной цитрат-синтазы.
Вместо полных последовательностей ДНК, представленных в Seq ID N 1, Seq ID N 2 и Seq ID N 3, в соответствии с настоящим изобретением для антисмыслового ингибирования также можно применять их частичные последовательности. Могут быть использованы последовательности, минимальная длина которых составляет 15 пар оснований. Однако ингибирующее действие не исключено и в том случае, когда используют более короткие последовательности. Предпочтительно применяют более длинные последовательности, состоящие из 100-500 пар оснований, в частности для эффективного антисмыслового ингибирования предпочтительно использовать последовательности, имеющие более 500 пар оснований. Как правило, применяют последовательности, имеющие менее 5000 пар оснований, предпочтительно последовательности, которые имеют менее 2500 пар оснований.
В способе по настоящему изобретению также возможно применять последовательности ДНК, имеющие высокую степень гомологичности с последовательностями ДНК по настоящему изобретению, но которые не являются полностью идентичными. Минимальная гомологичность должна быть выше чем приблизительно 65%. Предпочтительно использовать последовательности, гомологичные на 95-100%.
Также могут использоваться последовательности ДНК, образованные из последовательностей, представленных в Seq ID N 1, Seq ID N 2 или Seq ID N 3, путем вставки, делеции или замещения так, чтобы не было нарушено ингибирующее действие антисмысловой последовательности.
Фрагменты ДНК, применяемые для конструирования антисмысловых конструкций, также могут быть фрагментами синтетической ДНК, получаемыми с использованием современных методов синтеза ДНК.
Растения, получаемые с помощью описанного способа и которые характеризуются тем, что они проявляют пониженную активность цитрат-синтазы в клетках в результате экспрессии антисмысловой РНК, которая комплементарна последовательностям ДНК, кодирующим протеин, обладающий ферментативной активностью цитрат-синтазы, также являются предметом изобретения. Такие растения также отличаются тем, что они содержат стабильно интегрированный в геном полигенный экспрессирующий кластер, содержащий следующие последовательности:
А) промотор, функционирующий в растениях,
Б) последовательность ДНК, кодирующую цитрат-синтазу, которую сливают с промотором в антисмысловой ориентации так, чтобы транскрибировалась некодирующая цепь, и при необходимости
В) функционирующий в растениях сигнал для прекращения транскрипции и полиаденилирования молекулы РНК.
Растения предпочтительно представляют собой указанные выше растения.
Как описано в примерах выполнения изобретения при использовании картофеля в качестве примера, в растениях картофеля ингибирование образования цветков в трансформированных растениях происходит вследствие снижения активности цитрат-синтазы в результате антисмыслового эффекта. В частности, трансформированные растения картофеля проявляют более или менее выраженные фенотипы в зависимости от степени снижения активности цитрат-синтазы. Существенное снижение активности цитрат-синтазы приводит к полному ингибированию образования цветков. Растения с менее выраженным ингибированием могут образовывать почки, из которых тем не менее не развиваются цветки с нормальной функцией. Также могут быть получены растения, на которых развиваются цветки, но женские репродуктивные органы которых не обладают нормальной функцией.
Сходные эффекты наблюдают у трансгенных растений табака, которые обладают пониженной активностью цитрат-синтазы. В данном случае также развиваются цветки, женские репродуктивные органы которых сильно уменьшены в размере.
Ингибирование образования цветков путем снижения активности цитрат-синтазы представляет интерес, однако не только для картофеля или табака, но имеет более широкое значение для селекции растений и сельского хозяйства. Например, можно отметить возможность достижения хронологически заданной индукции или ингибирования цветения путем комбинации последовательностей ДНК по настоящему изобретению с экзогенно регулируемыми элементами контроля. Это может играть роль для повышения морозостойкости.
Способы по настоящему изобретению могут быть использованы как в отношении двудольных, так и в отношении однодольных растений. Растениями, которые представляют особый интерес, являются полезные растения, такие как некоторые виды зерновых культур (например, рожь, пшеница, кукуруза, овес, ячмень, маис, рис и т.д.), некоторые виды фруктовых культур (например, абрикос, персик, яблоневые, слива и т.д.), некоторые виды овощных культур (например, томат, брокколи, спаржа и т.д.), декоративные растения или другие типы растений, имеющие экономическое значение (например, картофель, табак, рапс, соя, подсолнечник, сахарный тростник и т.д.).
Применение настоящего изобретения, в частности, в отношении сахарной свеклы представляет особенный интерес, поскольку в данном случае путем ингибирования образования цветков может быть предотвращено "стеблевание". Поскольку стеблевание индуцируют низкие температуры, семена высаживают относительно поздно (в апреле/мае), чтобы предотвратить стеблевание. Уменьшение стеблевания сахарной свеклы может быть достигнуто путем ингибирования цитрат-синтазы. Это позволяет высаживать семена сахарной свеклы раньше, что впоследствии приводит к повышению урожая благодаря увеличению вегетационного периода.
Кроме ингибирования образования цветков у трансформированных растений картофеля, которые обладают пониженной активностью цитрат-синтазы в клетках, наблюдали снижение прорастания клубней и снижение респирации в клетках клубней по сравнению с нетрансформированными растениями. Это приводит к снижению потерь при хранении и повышению стойкости клубней при хранении. Следовательно, способ по настоящему изобретению также пригоден для получения растений с повышенной устойчивостью при хранении запасающих органов, причем повышенная устойчивость при хранении, как это понимается в контексте настоящего изобретения, означает, что хранящиеся запасающие органы трансформированных растений имеют меньшую потерю массы сырой ткани и массы в сухом состоянии после периода хранения по сравнению с таковой для нетрансформированных растений. Под запасающими органами понимаются обычные органы растений, собираемые в виде урожая, такие как семена, плоды, клубни и корнеплоды.
В частности, способ пригоден для получения трансгенных растений картофеля, клубни которых характеризуются повышенной устойчивостью при хранении, уменьшенными потерями при хранении и пониженной способностью клубней к прорастанию по сравнению с растениями дикого типа. Пониженная способность клубней к прорастанию означает, что на клубнях трансформированных растений образуются ростки, которые имеют меньшую массу сырой ткани и массу в сухом состоянии по сравнению с ростками нетрансформированных растений. Экономическая выгода этого очевидна.
Следовательно, предметом изобретения также являются способы повышения устойчивости при хранении запасающих органов растений, отличающиеся тем, что активность цитрат-синтазы в клетках этих растений снижена, причем снижение активности предпочтительно достигается путем ингибирования экспрессии последовательностей ДНК, кодирующих цитрат-синтазы.
Наиболее предпочтительными являются способы, в которых активность цитрат-синтазы понижают путем ингибирования экспрессии генов эндогенной цитрат-синтазы при использовании антисмысловой РНК.
Настоящее изобретение относится, в частности, к способам повышения устойчивости при хранении запасающих органов растений, отличающимся тем, что
а) ДНК, комплементарную присутствующему в клетке гену цитрат-синтазы, стабильно интегрируют в геном клетки растения,
б) указанную ДНК экспрессируют присущим ей образом или ее индуцируют путем комбинации с соответствующими элементами, контролирующими транскрипцию,
в) экспрессию генов эндогенной цитрат-синтазы ингибируют в результате антисмыслового эффекта и
г) растения регенерируют из трансгенных клеток.
Такие способы могут быть использованы в отношении всех типов растений, у которых развиваются запасающие органы, предпочтительно в отношении полезных сельскохозяйственных растений и наиболее предпочтительно в отношении некоторых видов зерновых культур (например, ржи, ячменя, пшеницы, кукурузы, риса и т.д.), некоторых видов фруктовых культур, овощных культур, растений, у которых образуются клубни, таких как, например, картофель или маниок, и растений, у которых образуются корнеплоды в качестве запасающих органов, в частности сахарной свеклы.
Предметом изобретения также являются способы получения трансгенных клубневых растений, клубни которых обладают пониженным прорастанием, отличающихся тем, что активность цитрат-синтазы в клетках этих растений снижена, причем снижение активности предпочтительно достигается путем ингибирования экспрессии последовательностей ДНК, кодирующих цитрат-синтазы.
Наиболее предпочтительными являются способы, в которых активность цитрат-синтазы понижают путем ингибирования экспрессии генов эндогенной цитрат-синтазы при использовании антисмысловой РНК.
Настоящее изобретение относится, в частности, к способам получения трансгенных клубневых растений, клубни которых обладают пониженным прорастанием, отличающимся тем, что
а) ДНК, комплементарную присутствующему в клетке гену цитрат-синтазы, стабильно интегрируют в геном клетки растения,
б) указанную ДНК экспрессируют присущим ей образом или ее индуцируют путем комбинации с соответствующими элементами, контролирующими транскрипцию,
в) экспрессию генов эндогенной цитрат-синтазы ингибируют в результате антисмыслового эффекта и
г) растения регенерируют из трансгенных клеток.
Такие способы предпочтительно могут быть применены для получения трансгенных растений картофеля и маниока.
Указанное выше в отношении способа ингибирования образования цветков также применимо и к различным вариантам осуществления данных способов, в частности в отношении выбора и длины используемой последовательности ДНК, которая кодирует цитрат-синтазу, и выбора промотора.
В качестве альтернативы снижению активности цитрат-синтазы в клетках растений с использованием антисмыслового эффекта это снижение может также быть достигнуто путем введения последовательности ДНК, кодирующей рибозиму, которая специфично расщепляет транскрипты генов эндогенной цитрат-синтазы эндонуклеотидным образом. Рибозимы представляют собой каталитически активные молекулы РНК, которые обладают способностью расщеплять молекулы РНК в специфических последовательностях-мишенях. Применяя методы генетической инженерии, оказывается возможным изменять специфичность рибозим. Существуют различные классы рибозим. При практическом применении для целенаправленного расщепления транскрипта определенного гена предпочтительно используют представителей двух различных групп рибозим. Первая группа включает рибозимы, которые могут быть отнесены к интронам группы I рибозим. Вторая группа включает рибозимы, имеющие основную характерную структурную особенность - последовательность-мотив, так называемую "молотообразную головку". Специфическое распознавание молекулы РНК-мишени может быть модифицировано путем изменения последовательностей, прилегающих к последовательности-мотиву. Путем спаривания оснований последовательностей молекулы-мишени эти последовательности определяют сайт, в котором происходит каталитическая реакция и, следовательно, расщепление молекулы-мишени. Поскольку требования к последовательности для эффективного расщепления чрезвычайно низки, то в принципе представляется возможным получить специфические рибозимы для практически любой молекулы РНК.
Генетически модифицированные растения, у которых активность цитрат-синтазы существенно понижена, следовательно, также могут быть получены путем введения в растения и экспрессии рекомбинантной двухцепочечной молекулы ДНК, содержащей:
а) промотор, функционирующий в растениях,
б) последовательность ДНК, кодирующую каталитическую область рибозимы и "по соседству" с которой располагают последовательности ДНК, гомологичные последовательностям молекулы-мишени, и при необходимости
в) функционирующий в растениях сигнал для прекращения транскрипции и полиаденилирования молекулы РНК.
Под последовательности, определенные в п. б), подпадают, например, каталитическая область сателлитной ДНК вируса SCMo (Davies и др., 1990, Virology, 177:216- 224) или таковая сателлитной ДНК вируса TobR (Steinecke и др. , 1992, EMBO J., 11: 1525-1530; Haseloff и Gerlach, 1988, Nature 334: 585-591).
Последовательности ДНК, расположенные по соседству с каталитической областью, образованы из последовательностей ДНК, которые гомологичны последовательностям генов эндогенной цитрат-синтазы.
Указанное выше для конструирования антисмысловых структур применимо и к последовательностям, указанным в п.п. а) и в).
Еще одним предметом настоящего изобретения является экспрессия в смысловой ориентации последовательностей ДНК, кодирующих протеины, обладающие ферментативной активностью цитрат-синтазы, в клетках растений, чтобы повысить активность этой цитрат-синтазы. Для этого последовательность ДНК, кодирующую цитрат-синтазу, сливают с промотором в смысловой ориентации, т.е. 3'-конец промотора связывают с 5'-концом последовательности, кодирующей ДНК. Это приводит к экспресии мРНК, кодирующей цитрат-синтазу, и, следовательно, к увеличению синтеза этого фермента.
Неожиданно было установлено, что в результате увеличения активности цитрат-синтазы в клетках трансформированных растений происходит изменение характера цветения по сравнению с нетрансформированными растениями. В частности, индуцируется образование цветков. Под этим в контексте настоящего изобретения понимают следующее:
а) более раннее образование цветков (в этом случае это означает, что трансформированные растения зацветают раньше по сравнению с нетрансформированными растениями, как правило, раньше на несколько дней, предпочтительно раньше на одну или несколько недель), и/или
б) увеличение образования цветков (в этом случае это означает, что трансформированные растения образуют больше цветков, предпочтительно по крайней мере на 10% больше цветков по сравнению с нетрансформированными растениями).
Такой эффект является желательным для ряда культивируемых и полезных растений, таких как некоторые виды овощных культур, например томаты, перец, тыква, дыня, огурец антильский, кабачок, рапс, некоторые виды зерновых культур, кукуруза или хлопчатник, и различных видов декоративных растений.
Еще одним предметом настоящего изобретения является, следовательно, применение последовательностей ДНК, кодирующих протеины, обладающие ферментативной активностью цитрат-синтазы, для индуцирования образования цветков у растений и способы индуцирования образования цветков у растений, отличающиеся тем, что активность цитрат-синтазы в клетках этих растений увеличена. Активность цитрат-синтазы увеличивают предпочтительно путем введения в клетки растений молекулы рекомбинантной ДНК, содержащей кодирующую область для цитрат-синтазы и приводящей к экспрессии цитрат-синтазы в трансформированных клетках.
Такие способы предпочтительно включают следующие стадии:
а) стабильную интеграцию в геном растительной клетки ДНК, которая является гомологичной или гетерологичной таковой, присущей данному организму, и которая кодирует протеин, обладающий цитрат-синтазной активностью,
б) экспрессию этой ДНК присущим ей образом или в результате индукции путем соединения с соответствующими элементами, контролирующими транскрипцию,
в) увеличение вследствие этого активности цитрат-синтазы в клетках и
г) регенерацию растений из трансгенных клеток.
Экспрессии ДНК, которая кодирует протеин, обладающий ферментативной активностью цитрат-синтазы, как правило, достигают путем интеграции в геном растений рекомбинантной двухцепочечной молекулы ДНК, включающей полигенный экспрессирующий кластер, имеющий следующие составляющие и экспрессирующий их:
А) промотор, функционирующий в растениях,
Б) последовательность ДНК, кодирующую цитрат-синтазу, которую сливают с промотором в смысловой ориентации, и при необходимости
В) функционирующий в растениях сигнал для прекращения транскрипции и полиаденилирования молекулы РНК.
Такие молекулы ДНК также являются предметом изобретения. Настоящее изобретение относится к таким молекулам ДНК, которые содержат указанные полигенные экспрессирующие кластеры в форме плазмиды pHS-mCS, которая содержит кодирующую область для цитрат-синтазы из S.cerevisiae, и плазмиды pEC-mCS, которая содержит кодирующую область для цитрат-синтазы из E.coli.
Кодирующие цитрат-синтазу последовательности ДНК, приведенные в п. а) указанного способа, могут быть как гомологичными или нативными, так и гетерологичными или чужеродного происхождения по отношению к растению-хозяину, которое должно быть трансформировано. Они могут иметь происхождение как из про-, так и из эукариот. Известны, например, последовательности ДНК, кодирующие цитрат-синтазу, из следующих организмов: Bacillus subtilis (U05256 и U05257), E. coli (V01501), R.prowazekii (М17149). P.aeruginosa (M29728), A. anitratum (M33037) (см. Schendel и др. (1992) Appl. Environ. Microbiol. 58: 335-345 и указанные в этом документе ссылки), Haloferax volcanii (James и др. (1992) Biochem. Soc. Trans. 20: 12), Arabidopsis thaliana (Z17455) (Unger и др. (1989) Plant Mol. Biol. 13: 411-418), B.coagulans (M74818), C. burnetii (M36338) (Heinzen и др. (1991) Gene 109: 63- 69), M.smegmatis (X60513), T. acidophilum (X55282), T.thermophila (D90117), свинья (M21197) (Bloxham и др. (1981) Proc. Natl. Acad. Sci. 78:5381-5385), N.crassa (M84187) (Ferea и др. (1994), Mol. Gen. Genet. 242:105-110) и S.cerevisiae (Z11113, Z23259, M14686, M54982, X00782) (Suissa и др. (1984) EMBO J. 3: 1773-1781). Числа в скобках в каждом случае представляют собой регистрационные номера, под которыми указанные последовательности зарегистрированы в банке данных GenEMBL. Последовательности могут быть выделены из указанных организмов с помощью современных методов молекулярной биологии или могут быть получены искусственным путем.
Предпочтительный пример осуществления способа по настоящему изобретению включает применение последовательностей ДНК, кодирующих цитрат-синтазы, которые по сравнению с цитрат-синтазами, обычно встречающимися в растениях, являются дерегулируемыми или нерегулируемыми, т.е. их ферментативная активность не регулируется регуляторными механизмами, которые оказывают воздействие на активность цитрат-синтазы в клетках растений. Дерегулируемые означает, в частности, что эти ферменты не ингибируются в той же степени ингибиторами или не активируются активаторами, которые в норме ингибируют или активируют цитрат-синтазы растений. В контексте настоящего описания под нерегулируемыми цитрат-синтазами понимают такие цитрат-синтазы, которые не поддаются регулированию ингибиторами или активаторами в клетках растений.
Предпочтительно применяют прокариотные, в частности бактериальные последовательности ДНК, которые кодируют цитрат-синтазы, поскольку они обладают тем преимуществом, что протеины, которые кодируются этими последовательностями, не поддаются регулированию или слабо регулируются в клетках растений. Поэтому возможно, что увеличение активности цитрат-синтазы происходит вследствие экспрессии дополнительной цитрат-синтазы в клетках растений.
В предпочтительном примере осуществления указанного способа применяют последовательности ДНК из E.coli, которые кодируют протеин с цитрат-синтазной активностью, в частности ген glt A (Sarbjit и др., 1983, Biochemistry 22:5243-5249).
Еще один предпочтительный пример способа по настоящему изобретению относится к применению последовательностей ДНК из Saccharomyces cerevisiae, которые кодируют цитрат-синтазу, в частности к применению последовательностей ДНК, описанных у Suissa и др., (1984, EMBO J. 3: 1773-1781).
В случае, когда применяют последовательности ДНК растительного происхождения, предпочтительно используют последовательности ДНК, кодирующие протеин, имеющий одну из аминокислотных последовательностей, приведенных в Seq ID N 1, или Seq ID N 2, или Seq ID N 3, или практически идентичную аминокислотную последовательность. Также могут применяться более короткие последовательности ДНК, кодирующие только части аминокислотных последовательностей, приведенных в Seq ID N 1, или Seq ID N 2, или Seq ID N 3, при условии, что образовавшийся протеин гарантирует получение ферментативной активности цитрат-синтазы.
Наиболее предпочтительный пример осуществления относится к способу, в котором последовательность ДНК, кодирующая активность цитрат-синтазы, включает нуклеотидную последовательность, приведенную в Seq ID N 1, или Seq ID N 2, или Seq ID N 3, или практически идентичную нуклеотидную последовательность либо ее часть, причем эта часть является достаточно длинной, чтобы кодировать протеин, проявляющий цитрат-синтазную активность.
Кроме того, с помощью стандартных методов с использованием уже известных последовательностей ДНК, кодирующих цитрат-синтазу, могут быть выделены другие последовательности ДНК, которые кодируют протеины, обладающие активностью цитрат-синтазы, из любых организмов, предпочтительно из растений и прокариотных организмов. Эти последовательности также могут быть применены в способах по настоящему изобретению.
Применяя способы по настоящему изобретению, можно увеличить цитрат-синтазную активность в принципе в каждом компартменте трансформированной клетки. Предпочтительно увеличение активности должно происходить в митохондриях, глиоксисомах или цитозоле. Чтобы гарантировать локализацию цитрат-синтазы в определенном компартменте трансформированных клеток, кодирующая последовательность должна быть связана с последовательностями, необходимыми для локализации в соответствующем компартменте. Такие последовательности известны. Для локализации цитрат-синтазы, например, в митохондриях необходимо, чтобы экспрессируемый протеин имел на N-конце митохондриальную последовательность-мишень (сигнальную последовательность), гарантирующую транспортировку в митохондрии экспрессированного в цитозоле протеина. Если применяемый ген уже не включает последовательность, кодирующую сигнальный пептид, то такая последовательность должна быть интродуцирована с применением методов генетической инженерии. Последовательность, которая кодирует митохондриальную последовательность-мишень, известна, например, из публикации Braun и др. , (1992, EMBO J. 11: 3219-3227). Эта последовательность должна быть связана с кодирующей областью таким образом, чтобы полипептид, кодируемый последовательностью-мишенью, находился в той же самой рамке считывания, что и последующая последовательность ДНК, кодирующая цитрат-синтазу.
Если применяют бактериальные последовательности ДНК, кодирующие цитрат-синтазу, то в них предпочтительно удаляют все 5'-нетранслируемые области. Если бактериальный фермент имеет сигнальные последовательности, то их предпочтительно заменяют на сигнальные последовательности растений.
Указанное выше в отношении способов по настоящему изобретению для ингибирования образования цветков равным образом применимо и к выбору соответствующих регулирующих транскрипцию последовательностей, в частности промоторов для экспрессии последовательности ДНК, кодирующей цитрат-синтазу, и сигналов для окончания транскрипции.
Описанный способ может быть применен как к двудольным, так и к однодольным растениям. Растениями, которые представляют особый интерес, являются такие полезные растения, как некоторые виды зерновых культур (например, рожь, пшеница, кукуруза, ячмень, маис и т.д.), некоторые виды фруктовых культур (например, абрикос, персик, яблоневые, слива и т.д.), некоторые виды овощных культур (например, томат, перец, тыква, дыня, огурец антильский, кабачок, брокколи, спаржа и т.д.), декоративные растения или другие типы растений, имеющие экономическое значение (например, табак, рапс, соя, хлопчатник, подсолнечник и т.д.).
Предметом настоящего изобретения также являются растения, получаемые с применением описанного способа, отличающиеся тем, что они проявляют повышенную активность цитрат-синтазы в клетках в результате дополнительной экспрессии последовательности ДНК, кодирующей протеин, обладающий ферментативной активностью цитрат-синтазы. Такие растения также отличаются тем, что они содержат стабильно интегрированный в геном полигенный экспрессирующий кластер, содержащий следующие последовательности:
А) промотор, функционирующий в растениях,
Б) последовательность ДНК, кодирующую цитрат-синтазу, которую сливают с промотором в смысловой ориентации, и при необходимости
В) функционирующий в растениях сигнал для прекращения транскрипции и полиаденилирования молекулы РНК.
Растения предпочтительно представляют собой указанные выше растения.
При соединении последовательностей ДНК по изобретению с экзогенно регулируемыми контролирующими элементами для транскрипции, например, температурно-индуцируемыми промоторами, при применении описанных способов для ингибирования или индуцирования образования цветков также может существовать возможность индукции хронологически определенного цветения или ингибирования цветения в зависимости от того, сливают ли последовательность ДНК с промотором в смысловой или в антисмысловой ориентации. Так, среди прочих, известны промоторы для специфической экспрессии в цветочных почках (Huisjer и др. , 1992, EMBO J. 11: 1239-1249) или в активных в отношении фотосинтеза тканях, например промотор ST-LS1 (Stockhaus и др., 1989, EMBO J. 8: 2445-2451). Для предотвращения прорастания клубней картофеля и снижения потерь при хранении в результате метаболизма запасенных веществ приемлемыми промоторами являются таковые, которые гарантируют активацию транскрипции в запасающих органах. Для картофеля известны промоторы, которые гарантируют специфическую экспрессию в клубне, например промоторы гена пататина класса I. Примером является промотор гена пататина В33 Solanum tuberosum (Rocha-Sosa и др., 1989, EMBO J. 8:23-29). Путем комбинации с экзогенно регулируемыми контролирующими элементами, например промоторами, индуцируемыми повреждением, или температурно-регулируемыми промоторами, может быть решена проблема вегетативного размножения в случае растений картофеля, клубни которых не прорастают вследствие ингибирования цитрат-синтазы. В случае сахарной свеклы аналогичным образом, применяя специфический для свеклы промотор, можно снизить респирацию и в результате уменьшить потери урожая вследствие разложения сахара в корнеплоде.
Для осуществления интродукции чужеродного гена в высшие растения приемлемо большое число векторов клонирования, которые содержат сигнал репликации для E. coli и ген-маркер для селекции трансформированных бактериальных клеток. Примерами таких векторов являются pBR322, серии pUC, серии M13mp, pACYC184 и т.д. Требуемая последовательность может быть введена в вектор в соответствующем сайте рестрикционного расщепления. Полученную плазмиду используют для трансформации клеток E.coli. Трансформированные клетки E.coli выращивают в соответствующей среде, затем собирают и лизируют. Плазмиду регенерируют. Аналитические методы, применяемые для характеризации полученной плазмиды ДНК, обычно включают рестрикционный анализ, гель-электрофорез и другие методы биохимии и молекулярной биологии. После каждой операции плазмида ДНК может быть расщеплена и объединена с другими последовательностями ДНК. Каждая последовательность плазмидной ДНК может быть клонирована в такой же или в других плазмидах. Для введения ДНК в клетку-хозяина растения пригодны многочисленные методики. Эти методики включают трансформацию клеток растений с помощью Т-ДНК с использованием Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве агентов трансформации, слияние протопластов, инъекцию, электропорацию ДНК, введение ДНК с использованием биобаллистического метода и другие возможности.
При инъекции и электропорации ДНК в клетки растений не предъявляется специальных требований к используемым плазмидам. Могут быть использованы простые плазмиды, такие, как, например, производные pUC. Однако, если из трансформированных таким образом клеток необходимо регенерировать целые растения, то необходимо наличие селектируемого гена-маркера. В соответствии с методом введения требуемых генов в клетку растения могут оказаться необходимыми другие последовательности ДНК. Если, например, для трансформации клетки растения применяют Ti- или Ri-плазмиду, то по крайней мере правая пограничная область Т-ДНК Ti- или Ri-плазмиды, хотя часто и правая и левая пограничные области, должна быть присоединена в качестве фланкирующей (прилегающей) области к интродуцируемым генам.
Если для трансформации применяют агробактерии, то интродуцируемую ДНК нужно клонировать в специальных плазмидах, либо в промежуточном векторе, либо в бинарном векторе. Промежуточные векторы могут быть интегрированы в Ti- или Ri-плазмиду агробактерии путем гомологичной рекомбинации, поскольку их последовательности гомологичны последовательностям Т-ДНК. Они также содержат vir-область, необходимую для переноса Т-ДНК. Промежуточные векторы не могут реплицироваться в агробактериях. С помощью плазмиды-хелпера промежуточный вектор может быть перенесен в Agrobacterium tumefaciens (конъюгация). Бинарные векторы могут реплицироваться как в E.coli, так и в агробактериях. Они содержат ген-маркер селекции и линкер (лигирующий агент) или полилинкер, которые ограничены справа и слева пограничными областями Т-ДНК. Они могут быть трансформированы непосредственно в агробактериях (Holsters и др. (1978) Mol.Gen.Genet. 163: 181-187). Агробактерия, которая служит в качестве клетки-хозяина, может содержать плазмиду, несущую vir-область. Vir-область необходима для переноса Т-ДНК в клетку растения. Может присутствовать дополнительная Т-ДНК. Трансформированную таким образом агробактерию применяют для трансформации растительных клеток.
Применение Т-ДНК для трансформации клеток растений интенсивно исследовалось и должным образом описано в ЕР 120516; Hoekema, в The Binary Plant Vector System Offsetdrukkerij Kanters B.V., Alblasserdam (1985), часть V; Fraley и др. , Crit. Rev. Plant Sci., 4: 1-46 и An и др. (1985) EMBO J. 4: 277-287.
Для переноса ДНК в клетку растения может оказаться целесообразным совместно культивировать растительные эксплантаты и Agrobacterium tumefaciens или Agrobacterium rhizogenes. Целые растения затем могут быть регенерированы из инфицированного растительного материала (например, кусочков листьев, сегментов стеблей, корней или также протопластов или суспензионно-культивируемых клеток растений) в пригодной для этой цели среде, которая может содержать антибиотики или биоциды для селекции трансформированных клеток. Полученные таким образом растения далее могут быть исследованы на наличие интродуцированной ДНК.
Если интродуцированная ДНК интегрирована в геном клетки растения, то как правило эта интеграция стабильна и сохраняется даже в следующих поколениях клетки, которую первоначально трансформировали. Она обычно содержит маркер селекции, который делает трансформированную клетку растения устойчивой к биоциду или антибиотику, такому как канамицин, G 418, блеомицин, гигромицин или фосфинотрицин и т. д. Таким образом, индивидуально подобранный маркер должен позволять отличать трансформированные клетки от клеток, которые лишены интродуцированной ДНК.
Трансформированные клетки развиваются внутри растения обычным образом (см. также McCormick и др., (1986) Plant Cell Reports 5:81-84). Образовавшиеся растения могут быть выращены нормальным образом и скрещены с растениями, которые имеют такой же трансформированный генетический код или другие генетические коды. Образовавшиеся в результате этого гибридные особи обладают соответствующими фенотипическими свойствами.
Должно быть выращено два или более поколений, чтобы гарантировать, что фенотипическая особенность стабильно сохраняется и наследуется. Также должен быть собран урожай семян, чтобы удостовериться, что сохраняется соответствующий фенотип или другие характеристики.
Помимо уже указанного применения последовательности ДНК по настоящему изобретению также могут быть интродуцированы в плазмиды, что позволяет осуществить мутагенез или модификацию последовательности путем вставки, делеции или рекомбинации последовательностей ДНК в системах прокариот или эукариот. Последовательности также могут снабжены контролирующими элементами для экспрессии в клетках про- и эукариот и могут быть введены в соответствующие клетки.
Последовательности ДНК по изобретению также могут применяться для выделения из генома растений различных видов гомологичных последовательностей, также кодирующих цитрат-синтазу. В этом контексте гомология означает последовательность, идентичную по крайней мере на 60%, предпочтительно более чем на 80% и особенно предпочтительно более чем на 95%. Идентификацию и выделение таких последовательностей проводят в соответствии со стандартными способами (см. , например, Sambrook и др., 1989, Molecular Cloning, A Laboratory Manual, 2-е изд., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). В свою очередь на основе этих последовательностей можно получить конструкции для трансформации растений или микроорганизмов.
Депонирование
Полученные и применяемые в объеме настоящего изобретения плазмиды были депонированы в Немецкой коллекции микроорганизмов (German Collection of Microorganisms) (DSM) в Брунсвике, Федеративная республика Германия, признанной в качестве международного депозитария в соответствии с требованиями Будапештского Договора о Международном признании депозита микроорганизмов для целей процедуры патентования. Следующие плазмиды были депонированы в Немецкой коллекции микроорганизмов (DSM) 28.12.1993 г. под депозитными номерами:
Плазмида pPCS - (DSM 8879)
Плазмида pKS-CSa - (DSM 8880)
Следующие плазмиды были депонированы в Немецкой коллекции микроорганизмов (DSM) 10.08.1994 г. под депозитными номерами:
Плазмида pTCS - (DSM 9357)
Плазмида pSBCS - (DSM 9358)
Плазмида TCSAS - (DSM 9359)
Используемые сокращения
БСА - бычий сывороточный альбумин
ЭДТК - (этилендинитрил) тетрауксусная кислота
50х раствор Денхарта - 5 г фиколя (тип 400, фирмы Pharmacia), 5 г поливинилпирролидона, 5 г бычьего сывороточного альбумина (фракция V, фирма Sigma), вода до 500 мл
ФАДН2 - флавинадениндинуклеотид, восстановленный
МОПС - 3-(N-морфолино)пропансульфоновая кислота
НАДН - b-никотинамидадениндинуклеотид, восстановленный
ПЦР - полимеразная реакция синтеза цепи (полимеразно-цепьевая реакция)
ФМСФ - фенилметилсульфонилфторид
Вирус SCMo - "вирус мозаики клевера подземного"
ДСН - додецилсульфат натрия
20хSSC 175,3 г NaCl, 88,2 г цитрата натрия, до 1000 мл воды, pH 7,0 с 10Н NaOH
TobR - "вирус кольцевой пятнистости табака"
Тризин - N-трис (гидроксиметил) метилглицин
Описание чертежей
На фиг. 1 представлена схема плазмиды pPCS (DSM 8879). Замкнутая линия соответствует последовательности pBluescript KS. Жирная линия соответствует кДНК, кодирующей цитрат-синтазу из Solanum tuberosum. Показаны сайты рестрикционного расщепления сегмента-вставки.
На фиг. 2 представлена схема плазмиды pKS-CSa (DSM 8880).
Строение плазмиды:
A соответствует фрагменту А: промотор CaMV 35S, нуклеотиды 6909-7437 (Frank и др., (1980) Cell 21:285-294);
B соответствует фрагменту B: кДНК из Solanum tuberosum, кодирующая цитрат-синтазу; BamHI/SalI-фрагмент из pPCS, приблизительно 1900 пар оснований. Ориентация по отношению к промотору: антисмысловая;
C соответствует фрагменту C: нуклеотиды 11748-11939 из Т-ДНК Ti-плазмиды pTiACH5 (Gielen и др., (1984) EMBO J. 3:835-846).
На фиг. 3 представлена схема плазмиды pSBCS(DSM 9358). Замкнутая линия соответствует последовательности pBluescript SK. Жирная линия соответствует кДНК, кодирующей цитрат-синтазу из Beta vulgaris L. Показаны сайты рестрикционного расщепления сегмента-вставки.
На фиг. 4 представлена схема плазмиды pTCS (DSM 9357). Замкнутая линия соответствует последовательности pBluescript SK. Жирная линия соответствует кДНК, кодирующей цитрат-синтазу из Nicotiana tabacum. Показаны сайты рестрикционного расщепления сегмента-вставки.
На фиг. 5 представлена схема плазмиды TCSAS (DSM 9359).
Строение плазмиды:
A соответствует фрагменту A: промотор CaMV 35S, нуклеотиды 6909- 7437 (Frank и др., (1980) Cell 21:285- 294);
B соответствует фрагменту B: кДНК из Nicotiana tabacum, кодирующая цитрат-синтазу; BamHI/SalI-фрагмент из pTCS, приблизительно 1800 пар оснований. Ориентация по отношению к промотору: антисмысловая;
C соответствует фрагменту C: нуклеотиды 11748-11939 из Т-ДНК Ti-плазмиды pTiACH5 (Gielen и др., (1984) EMBO J. 3: 835-846).
На фиг. 6 представлены результаты эксперимента, полученные методом назерн-блоттинга. В каждом случае для анализа использовали 2 мкг поли (A+)-мРНК из различных трансгенных растений картофеля (полосы 4-8)и трех нетрансформированных растений картофеля (полосы 1-3).
Полосы 1, 2 и 3 соответствуют дикому типу Solanum tuberosum сорта Desiree.
Полоса 4 соответствует картофелю трансгенной линии Т6.
Полоса 5 соответствует картофелю трансгенной линии Т21.
Полоса 6 соответствует картофелю трансгенной линии Т29.
Полоса 7 соответствует картофелю трансгенной линии Т50.
Полоса 8 соответствует картофелю трансгенной линии Т55.
Для гибридизации применяли радиоактивно меченную кДНК цитрат-синтазы картофеля.
На фиг. 7 показаны трансгенные растения картофеля линии Т6 (NN 3 и 4) и Т29 (NN 5 и 6), которые трансформировали плазмидой pKS-CSa, в сравнении с растениями дикого типа (NN 1 и 2). Растения выращивали в теплице при относительной влажности 60%, при 22oC в течение 16-часового светового периода и при 15oC в течение 8-часового темного периода.
На фиг. 8 показано в виде диаграммы количество цветков, образовавшихся на растениях картофеля, которые трансформировали плазмидой pKS-CSa, в сравнении с растениями дикого типа. Показано количество растений с полностью развитыми открытыми цветками во время периода цветения. Пять трансгенных линий (Т6, Т21, Т29, Т50 и Т55) сравнивали с растениями дикого типа. Трансгенная линия Т21 представляет собой трансгенную линию, в которой отсутствует ингибирование цитрат-синтазы (100% активность цитрат-синтазы). В течение периода исследования ни на одном растении линии Т29 не развились цветки, а растения линии Т6 и Т50 начали цвести приблизительно лишь на 3 недели позднее растений дикого типа. День 1 обозначает первый день, в который на растениях были обнаружены хорошо выраженные почки.
"wt" обозначает дикий тип.
t6, t21, t29, t50, t55 обозначают трансгенные линии Т6, Т21, Т29, Т50 и Т55.
На фиг. 9 представлены продольные срезы цветочных почек растений дикого типа и для сравнения трансгенных растений линии Т29.
A: Цветочная почка растения дикого типа
B: Увеличенное изображение строения завязи почки из A
C: Цветочная почка растения трансгенной линии Т29
D: Увеличенное изображение строения завязи почки из C
an: пыльники
ov: завязь
ре: лепестки
se: чашелистики
Хорошо видно повреждение ткани завязей трансгенных растений.
На фиг. 10 показан процесс прорастания клубней растений картофеля линии Т6 (слева), которые трансформировали плазмидой pKS-CSa, в сравнении с клубнями растений дикого типа (справа). Клубни хранили в течение 9 месяцев в темноте при комнатной температуре.
На фиг. 11 показан цветок растения табака, которое трансформировали плазмидой TCSAS (слева), в сравнении с цветком нетрансформированного растения табака (справа). Пестик цветка трансформированного растения намного короче пестика цветка растения дикого типа.
На фиг. 12 представлена схема плазмиды pHS-mCS.
Строение плазмиды:
A соответствует фрагменту A: промотор CaMV 35S, нуклеотиды 6909-7437 (Frank и др., (1980) Cell 21:285-294);
B соответствует фрагменту B: фрагмент ДНК длиной 99 пар оснований, кодирующий митохондриальную последовательность-мишень матричной процессинг-пептидазы (МПП) (Braun и др., 1992, EMBO J. 11: 3219- 3227);
C соответствует фрагменту C: последовательность ДНК из Saccharomyces cerevisiae, кодирующая цитрат-синтазу (нуклеотиды 376-1818; Suissa и др., 1984, EMBO J. 3: 1773-1781); ориентация по отношению к промотору: смысловая;
D соответствует фрагменту D: нуклеотиды 11748-11939 из Т-ДНК Ti-плазмиды pTiACH5 (Gielen и др., (1984) EMBO J. 3:835-846).
На фиг. 13 показаны два трансгенных растения картофеля из двух независимых линий, которые трансформировали плазмидой pHS-mCS (в середине и справа), в сравнении с растением дикого типа (слева). Растения выращены в теплице, и их возраст составляет приблизительно 6 недель. В то время как у растения дикого типа еще не сформированы соцветия, каждое из двух трансгенных растений картофеля уже имеет полностью развитые соцветия.
На фиг. 14 представлена схема плазмиды pEC-mCS.
Строение плазмиды:
A соответствует фрагменту A: промотор CaMV 35S, нуклеотиды 6909-7437 (Frank и др., (1980) Cell 21: 285-294);
B соответствует фрагменту B: фрагмент ДНК длиной 99 пар оснований, кодирующий митохондриальную последовательность-мишень матричной процессинг-пептидазы (МПП) (Braun и др., 1992, EMBO J. 11: 3219-3227);
C соответствует фрагменту C: последовательность ДНК из E.coli, кодирующая цитрат-синтазу (нуклеотиды 306-1589; Sarbjit и др., 1983, Biochemistry 22: 5244-5249); ориентация по отношению к промотору: смысловая;
D соответствует фрагменту D: нуклеотиды 11748-11939 из Т-ДНК Ti-плазмиды pTiACH5 (Gielen и др., (1984) EMBO J. 3: 835-846).
Для пояснения примеров ниже представлены наиболее важные использованные методики.
1. Процедура клонирования
Для клонирования в E.coli применяли вектор pBluescript KS и вектор pBluescript SK (фирмы Stratagene, США).
Для трансформации растений генные конструкции клонировали в бинарном векторе pBinAR.
2. Штаммы бактерий
Для векторов pBluescript и для векторов pBinAR использовали штамм E.coli DH5 α (Bethesda Research Laboratories, Gaithersburg, США). Для эксцизии in vivo использовали штамм E.coli XL1-Blue.
Трансформацию плазмид в растениях картофеля и растениях табака осуществляли с использованием штамма Agrobacterium tumefaciens C58C1 (Rocha-Sosa и др., (1989) EMBO J. 8: 23-29).
3. Трансформация Agrobacterium tumefaciens
ДНК переносили путем непосредственной трансформации в соответствии с методами Hofgen & Willmitzer (1988, Nucleic Acids Res. 16: 9877).
ДНК плазмиды трансформированных агробактерий выделяли в соответствии с методом Birnboim & Doly (1979, Nucleic Acids Res. 7: 1513-1523) и анализировали после соответствующего рестрикционного расщепления с помощью гель-электрофореза.
4. Трансформация картофеля
Десять порезанных скальпелем маленьких листьев стерильной культуры картофеля (Solanum tuberosum L., сорта Desiree) помещали в 10 мл среды MS (Murashige & Skood (1962) Physiol. Plant. 15: 473) с 2%-ной сахарозой, содержащей 50 мкл выращенной в течение ночи при селекции культуры Agrobacterium tumefaciens. После осторожного встряхивания в течение 3-5 минут полученную систему подвергали дальнейшей инкубации в темноте в течение 2 дней. После этого для индукции каллюса листья переносили в среду MS, содержащую 1,6% глюкозы, 5 мг/л нафтилуксусной кислоты, 0,2 мг/л бензиламинопурина, 250 мг/л клафорана, 50 мг/л канамицина и 0,80% бактоагара. После инкубации в течение 1 недели при 25oC и освещенности 3000 люкс для индукции побегообразования листья переносили в среду MS, содержащую 1,6% глюкозы, 1,4 мг/л зеатинрибозы, 20 мг/л нафтилуксусной кислоты, 20 мг/л гиббериллиновой кислоты, 250 мг/л клафорана, 50 мг/л канамицина и 0,80% бактоагара.
5. Трансформация табака
Выращенную в течение ночи культуру соответствующего клона Agrobacterium tumefaciens отделяли путем центрифугирования (6500 об/мин; 3 мин) и бактерии ресуспендировали в среде YEB. Листья табака стерильной культуры табака (Nicotiana tabacum, сорт Samsun NN) нарезали небольшими кусочками площадью приблизительно 1 см2 и погружали в бактериальную суспензию. Кусочки листьев затем вносили в среду MS (0,7% агара) и инкубировали в течение 2 дней в темноте. Затем кусочки листьев для индукции побегообразования переносили в среду MS (0,7% агара), содержащую 1,6% глюкозы, 1 мг/л бензиламинопурина, 0,2 мг/л нафтилуксусной кислоты, 500 мг/л клафорана и 50 мг/л канамицина. Среду меняли каждые 7-10 дней. Если побеги развивались, кусочки листьев переносили в стеклянные сосуды, содержащие эту же среду. Сформировавшиеся побеги отрезали и помещали в среду MS с добавлением 2%-ной сахарозы и 250 мг/л клафорана и регенерировали из них целые растения.
6. Определение активности цитрат-синтазы в тканях трансгенных растений картофеля и табака и нетрансформированных растениях картофеля и табака
Для определения цитрат-синтазной активности получали сырые экстракты из клубней, листьев и цветков и выделяли митохондрии из клубней картофеля. Для получения сырых экстрактов исследуемый материал замораживали в жидком азоте, гомогенизировали в буфере для экстракции (Neuhaus и Stitt 1 (1990) Planta 182: 445-454), центрифугировали и для последующей оценки активности использовали жидкий супернатант. Для выделения митохондрий из клубней картофеля 100-200 г свежесобранных клубней очищали и гомогенизировали в 100 мл "размельчающего буфера" (0,4 М маннит, 1 мМ ЭДТК, 25 мМ МОПС, 0,1% БСА, 10 мМ b-меркаптоэтанол, 0,05 мМ ФМСФ, pH 7,8). Гомогенат фильтровали через 4 слоя марли из хлопка и центрифугировали в течение 4 мин при 3500g. Супернатант фильтровали через 2 слоя: "Miracloth" (фирма Calbiochem) и вновь центрифугировали в течение 30 мин при 18000g. Дебрисы ресуспендировали с использованием мягкой кисти в 2 мл ресуспендирующего буфера (0,4 М маннит, 20 мМ тризин, 2 мМ ЭДТК, pH 7,2). После двухкратной гомогенизации в гомогенизаторе типа "поттер" экстракт наносили на перколл с переменным градиентом и центрифугировали в 1 течение 1 часа при 72000g. Митохондрии удаляли из интерфазы 28%/45%, промывали и центрифугировали дважды по 15 мин при 14500g в "буфере для промывки" (0,4 М маннит, 5 мМ МОПС, 0,1% БСА, 0,2 мМ ФМСФ, pH 7,5). Далее митохондрии ресуспендировали в 100 мкл ресуспендирующего буфера. Для определения активности цитрат-синтазы 5 мкл суспензии митохондрий экстрагировали в 100 мкл буфера для экстракции (Neuhaus и Stitt (1990) Planta 182:445-454).
Активность цитрат-синтазы определяли путем спектрофотометрии при 412 нм и 30oC в соответствии с методом Srere (1967, Methods in Enzymology 13:3- 22).
7. Экстракции РНК и эксперименты с применением назерн-блоттинга
РНК выделяли из замороженного растительного материала, как описано у Logemann и др. (1987, Anal. Biochem. 163: 21-26). РНК денатурировали в 40%-ном формамиде. Затем РНК разделяли с помощью гель-электрофореза на формальдегид/агарозных гелях и после прохода геля блоттировали на найлоновой мембране (Hybond N; Amersham, Великобритания). Гибридизацию с радиоактивно меченным образцом ДНК проводили в соответствии со стандартными методами.
8. Культивирование растений
Растения картофеля (Solanum tuberosum) выращивали в теплице при относительной влажности 60% и при температуре 22oC в течение 16-часового светового периода и при температуре 15oC в течение 8-часового темного периода. Растения табака (Nicotiana tabacum) выращивали в теплице при относительной влажности 60% и при температуре 25oC в течение 14-часового светового периода и при температуре 20oC в течение 10-часового темного периода.
Примеры
Пример 1
Клонирование кДНК цитрат-синтазы из картофеля
Для идентификации кДНК из картофеля, кодирующей цитрат-синтазу, сначала амплифицировали фрагмент ДНК с уже известной кДНК цитрат-синтазы из Arabidopsis thaliana (резушка Таля) (Unger и др. (1989) Plant Mol.Biol. 13: 411-418). Для этого целую ДНК экстрагировали из зеленой (хлорофиллсодержащей) растительной ткани растений Arabidopsis thaliana и получали из нее поли(A+)-мРНК. Затем ее использовали для получения кДНК. Применяя олигонуклеотиды
5'-AAGTGGATCCATGGTGTTTTTCCGCAGCGTAT-3' (Seq ID N 4) и
5'-CATAGGATCCTTAAGCAGATGAAGCTTTCTTA-3' (Seq ID N 5),
которые комплементарны 5'- или 3'-концу кодирующей области кДНК цитрат-синтазы из Arabidopsis thaliana (Unger и др. (1989) Plant Mol. Biol. 13: 411-418), фрагмент ДНК длиной 1438 пар оснований, кодирующий цитрат-синтазы из Arabidopsis thaliana, выделяли из этого препарата кДНК с помощью "полимеразно-цепьевой реакции" (ПЦР). В используемые нуклеотиды с обоих концов амплифицированного фрагмента ДНК дополнительно вводили сайты расщепления BamHI. Образовавшийся в результате ПЦР фрагмент ДНК разлагали с помощью BamHI и лигировали с плазмидой pUC9.2, расщепленной с помощью BamHI. Инсерционную кДНК этой плазмиды далее применяли в качестве гетерологичного образца для идентификации кДНК, кодирующей цитрат-синтазу картофеля.
Для получения библиотеки кДНК из листьев растений картофеля выделяли поли(A+)-мРНК. Начиная с поли(A+)-мРНК, получали кДНК, снабженную EcoRI/NotI-линкерами, и помещали с ними библиотеку кДНК в вектор Lambda ZAP II (Strategene, США) (Kossmann и др. (1992) Planta 188: 7-12). Применяя гетерологичный образец из Arabidopsis thaliana, исследовали 250000 бляшек из этой библиотеки кДНК на присутствие последовательностей ДНК, гомологичных этому образцу. Для этого бляшки переносили на фильтры из нитроцеллюлозы и денатурировали путем обработки NaOH. Затем фильтры нейтрализовали и ДНК фиксировали на фильтрах, применяя тепловую обработку. Фильтры предварительно гибридизировали в течение 2 ч при 42oC в составе, содержащем 25% формамида, 0,5% БСА, 1% ДСН, 5xSSC, 5х раствор Денхарта, 40 мМ натрий-фосфатного буфера с pH 7,2 и 100 мкг/мл ДНК спермы лосося. Затем фильтры после добавления меченной по P32 кДНК, кодирующей цитрат-синтазу из Arabidopsis thaliana, гибридизировали в течение ночи при 42oC в составе, содержащем 25% формамида, 0,5% БСА, 1% ДСН, 5xSSC, 5х раствор Денхарта, 40 мМ натрий-фосфатного буфера с pH 7,2 и 100 мкг/мл ДНК спермы лосося. Фильтры промывали в течение 30 мин в 5xSSC и 0,5% ДСН при 42oC ив течение 20 мин в 3xSSC и 0,5% ДСН при 42oC.
Клоны фага из библиотеки кДНК, прошедшие гибридизацию с использованием кДНК из Arabidopsis thaliana, в дальнейшем очищали с применением стандартных методик. Используя метод эксцизии in vivo, из позитивных клонов фага получали клоны E. coli, которые содержат двухцепочечную плазмиду pBluescript с соответствующей кДНК-вставкой в сайте расщепления EcoRI полилинкера. После контроля размера и типа рестрикции вставок соответствующий клон подвергали секвенированию.
Пример 2
Секвенирование кДНК-вставки плазмиды pPCS (DSM 8879)
Плазмиду pPCS (фиг. 1) выделяли из клона E.coli, полученного в соответствии с примером 1, и определяли ее кДНК-вставку стандартными методиками, используя дидезокси-метод (Sanger и др. (1977) Proc. Natl. Acad. Sci. USA 74: 5463-5467). Длина вставки составляет 1891 пару оснований. Нуклеотидная последовательность соответствует приведенной ниже последовательности (Seq ID N 1).
Пример 3
Конструирование плазмиды pKS-CSa (DSM 8880) и перенос плазмиды в растения картофеля
Фрагмент ДНК длиной приблизительно 1,9 т.п.н., имеющий приведенную ниже последовательность (Seq ID N 1) и содержащий область клонирования для цитрат-синтазы картофеля, выделяли из плазмиды pPCS путем разложения посредством BamHI/SalI. Этот фрагмент ДНК клонировали в векторе pBinAR (Hofgen и Willmitzer (1990) Plant Sci. 66: 221-230), расщепленном с использованием BamHI/SalI. Вектор pBinAR имеет происхождение из бинарного вектора Binl9 (Bevan (1984) Nucleic Acids Res. 12: 8711- 8721).
Образовавшаяся плазмида, обозначенная как pKS-CSa, показана на фиг. 2.
Путем вставки фрагмента кДНК получают полигенный экспрессирующий кластер, который конструируют следующим образом из фрагментов A, B и C (фиг. 2).
Фрагмент A (529 пар оснований) содержит промотор 35S вируса мозаики цветной капусты (CaMV). Фрагмент включает нуклеотиды CaMV от 6909 до 7437 (Franck и др. (1980) Cell 21: 285-294).
Фрагмент B содержит протеин-кодирующую область цитрат-синтазы картофеля. Его выделяли, как описано выше, в виде BamHI/Sall-фрагмента из pPCS и сливали в антисмысловой ориентации с промотором в векторе pBinAR.
Фрагмент C (192 пары оснований) содержит сигнал полиаденилирования гена 3 Т-ДНК Ti- плазмиды pTiACH5 (Gielen и др. (1984) EMBO J. 3: 835-864). Размер плазмиды pKS-CSa составляет приблизительно 12,9 т.п.н.
Вектор pKS-CSa переносили в растения картофеля, применяя Agrobacterium tumefaciens-конвейерную трансформацию. Интактные растения регенерировали из трансформированных клеток. В результате этой трансформации трансгенные растения картофеля проявляли различную степень уменьшения мРНК, кодирующей цитрат-синтазу (см. фиг. 6). В экспериментах с использованием назерн-блоттинга гибридизировали 2 мкг поли(A+)-мРНК с зондом для цитрат-синтазы картофеля. Транскрипт, кодирующий цитрат-синтазу и характерный для растений дикого типа (полосы с 1 по 3), короче по сравнению с антисмысловым транскриптом полигенного экспрессирующего кластера (см., например, полосу 6), из чего видно, что уменьшение эндогенных транскриптов, происходящее в различных трансгенных растениях, различно.
Исследовали цитрат-синтазную активность различных тканей трансгенных растений картофеля, проявивших снижение мРНК, кодирующей цитрат-синтазу. Результаты этих исследований листьев, клубней и митохондрий, выделенных из клубней, приведены в табл. 1.
Снижение активности цитрат-синтазы оказывает значительный эффект на образование цветков у трансгенных растений, выраженность которого зависит от степени ингибирования активности цитрат-синтазы.
У трансформированных растений картофеля, у которых сильно снижена активность цитрат-синтазы (см. табл. 1), образование цветков ингибируется в значительной степени или полностью (см. фиг. 7).
Растения, у которых активность цитрат-синтазы снижена только в относительно небольшой степени, проявляют замедленное образование цветков, и у них образуется меньше цветков или развиваются только цветочные почки, которые в дальнейшем погибают, не превращаясь в цветки с нормальными функциями. Это видно на фиг. 8. На ней показано количество растений с полностью развитыми открытыми цветками во время одного периода цветения. Проведено сравнение 5 трансгенных линий (Т6, Т21, Т29, Т50 и Т55) с растениями дикого типа. Трансгенная линия Т21 представляет собой трансгенную линию, у которой отсутствует ингибирование цитрат-синтазы (100% активность цитрат-синтазы). Во время эксперимента ни у одного растения линии Т29 не развились цветки, а у растений линий Т6 и Т50 образование цветков началось только приблизительно на 3 недели позднее, чем у растений дикого типа.
У других растений цветки развиваются, но не становятся функциональными, поскольку женские репродуктивные органы (завязи) серьезно повреждены. У этих растений завязи распадаются в процессе формирования. Это показано на фиг. 9. На этой фигуре показаны в сравнении продольные срезы через цветочные почки растений дикого типа и трансгенных растений линии Т29. Ткани завязей трансгенных растений серьезно повреждены по сравнению с растениями дикого типа.
Следовательно, применяя настоящее изобретение, также можно в соответствии со способом по изобретению получать растения, у которых активность цитрат-синтазы ингибирована в различной степени, так что из трансгенных растений можно было бы выбрать таковые с нужным фенотипом, например с полным ингибированием образования цветков, или те, у которых начало образования цветков задержано по сравнению с нетрансформированными растениями, или те, у которых развиваются почки, не превращающиеся в цветки с нормальными функциями.
Снижение активности цитрат-синтазы также может оказывать существенное воздействие на различные свойства клубней трансформированных растений картофеля. Например, клубни трансформированных растений картофеля характеризуются меньшими потерями при хранении после относительно длинных периодов хранения по сравнению с клубнями нетрансформированных растений. Это выражается в меньшем снижении массы сырой ткани и массы в сухом состоянии в процессе хранения. В следующей таблице показаны значения массы сырой ткани и массы в сухом состоянии клубней трансформированных растений картофеля (линия Т6) и растений дикого типа сорта Desiree. Клубни хранили в течение 9 месяцев при комнатной температуре. Массы клубней даны в процентах по отношению к массам сырой ткани клубней в начале хранения. Указанные величины приведены в виде средних значений, полученных по 3-12 измерениям, со стандартными отклонениями. Значения массы в сухом состоянии и массы сырой ткани клубней растений дикого типа после 9 месяцев хранения приняты за 100% (табл. 2).
У клубней трансформированных растений картофеля также обнаружено изменение характеристик прорастания. Ростки этих клубней существенно меньше по сравнению с таковыми у клубней дикого типа и имеют существенно меньшую массу сырой ткани и массу в сухом состоянии. В следующей таблице представлены значения массы сырой ткани и массы в сухом состоянии ростков клубней трансформированных растений картофеля (линия Т6) и растений дикого типа сорта Desiree. Ростки взяты от клубней, хранившихся в темноте в течение 9 месяцев при комнатной температуре. Массы ростков для каждого случая даны в граммах. Указанные величины приведены в виде средних значений, полученных по 3-12 измерениям, со стандартными отклонениями (табл. 3).
Измененные характеристики прорастания также представлены на фиг. 10. В каждом случае показано по 3 клубня трансформированных растений картофеля линии Т6 и по 3 клубня растения дикого типа сорта Desiree. Клубни хранили в темноте в течение 9 месяцев при комнатной температуре. На клубнях трансформированных растений (слева) ростки существенно меньше и короче по сравнению с таковыми на клубнях дикого типа (справа).
Пример 4
Клонирование кДНК, кодирующей цитрат-синтазу табака (Nicotiana tabacum)
Для идентификации кДНК из Nicotiana tabacum, кодирующей цитрат-синтазу, создавали банк кДНК листовой ткани табака, как это описано в примере 1 для картофеля. Используя радиоактивный ДНК-зонд для последовательностей, кодирующих цитрат- синтазу, подвергали скринингу 250000 бляшек из этого банка кДНК. В качестве зонда применяли кодирующую цитрат-синтазу кДНК из Solanum tuberosum (1,4 т.п.н., фрагмент NruI/HindII из плазмиды pPCS; см. примеры 1 и 2 и Seq ID N 1). Идентификацию и выделение клонов фага, гибридизированных с примененным радиоактивным ДНК-зондом, проводили аналогично описанному в примере 1 с тем отличием, что бляшки переносили на найлоновые мембраны и для предгибридизации и гибридизации использовали следующий буфер: 0,25 М натрийфосфатный буфер с pH 7,2, 10 мМ ЭДТК, 7% ДСН, 10 мг БСА.
Используя метод эксцизии in vivo, из позитивных клонов фага получали клоны E.coli, которые содержат двухцепочечную плазмиду pBluescript с соответствующей кДНК-вставкой. После контроля размера и типа рестрикции вставок соответствующий клон подвергали секвенированию.
Пример 5
Секвенирование кДНК-вставки плазмиды pTCS (DSM 9357)
Плазмиду pTCS (фиг. 4) выделяли из клона E.coli, полученного в соответствии с примером 4, и определяли ее кДНК-вставку стандартными методиками, используя дидезокси-метод (Sanger и др. (1977) Proc. Natl. Acad. Sci. USA 74: 5463-5467). Длина вставки составляет 1747 пар оснований. Нуклеотидная последовательность соответствует приведенной ниже последовательности (Seq ID N 3).
Пример 6
Клонирование кДНК, кодирующей цитрат-синтазу сахарной свеклы (Beta vulgaris L.)
Для идентификации кДНК из сахарной свеклы, кодирующей цитрат-синтазу, создавали банк кДНК листовой ткани сахарной свеклы (Beta vulgaris L. культивируемая линия 5S0026), выделяя поли(A+)-мРНК листовой ткани и используя ее для синтеза кДНК с помощью имеющихся в продаже наборов (Pharmacia LKB, Stratagen, США) в соответствии с методом Gubler и Hoffmann (1983, Gene 25: 263-269). Используя радиоактивные ДНК-зонды для последовательностей, кодирующих цитрат-синтазу, подвергали скринингу 250000 бляшек из этого банка кДНК, как описано в примере 4. В качестве зонда использовали смесь, состоящую из кодирующей цитрат-синтазу радиоактивно меченной кДНК из Solanum tuberosum (см. примеры 1, 2 и 4 и Seq ID N 1) и кодирующей цитрат-синтазу радиоактивно меченной кДНК из Nicotiana tabacum (см. примеры 4 и 5 и Seq ID N 3). Идентификацию и выделение клонов фага, гибридизированных с примененным радиоактивным образцом ДНК, проводили аналогично описанному в примере 1. Используя метод эксцизии in vivo, из позитивных клонов фага получали клоны E. coli, которые содержат двухцепочечную плазмиду pBluescript с соответствующей кДНК-вставкой. После контроля размера и типа рестрикции вставок соответствующий клон подвергали секвенированию.
Пример 7
Секвенирование кДНК-вставки плазмиды pSBCS (DSM 9358)
Плазмиду pSBCS (фиг. 3) выделяли из клона E.coli, полученного в соответствии с примером 6, и определяли ее кДНК-вставку стандартными методиками, используя дидезокси-метод (Sanger и др. (1977) Proc. Natl. Acad. Sci. USA 74: 5463-5467). Длина вставки составляет 1551 пару оснований. Нуклеотидная последовательность соответствует приведенной ниже последовательности (Seq ID N 2).
Пример 8
Конструирование плазмиды TCSAS (DSM 9359) и перенос плазмиды в растения табака
Фрагмент ДНК длиной приблизительно 1,800 т.п.н., имеющий приведенную ниже последовательность (Seq ID N 3) и содержащий кодирующую область для цитрат-синтазы Nicotiana tabacum, выделяли из плазмиды pTCS путем разложения посредством BamHI/SaII. Этот фрагмент ДНК клонировали в векторе pBinAR, расщепленном с использованием BamHI/Sall (Hofgen и Willmitzer (1990) Plant Sci. 66: 221-230). Вектор pBinAR имеет происхождение из бинарного вектора Bin19 (Bevan (1984) Nucleic Acids Res. 12: 8711-8721). Образовавшаяся плазмида, обозначенная как TCSAS, показана на фиг. 5.
Путем вставки фрагмента кДНК получают полигенный экспрессирующий кластер, который конструируют следующим образом из фрагментов A, B и C (фиг. 5).
Фрагмент A (529 пар оснований) содержит промотор 35S вируса мозаики цветной капусты (CaMV). Фрагмент включает нуклеотиды CaMV от 6909 до 7437 (Franck и др. (1980) Cell 21: 285-294).
Фрагмент B в дополнение к фланкирующим областям содержит протеин-кодирующую область цитрат-синтазы из Nicotiana tabacum. Его выделяли аналогично описанному выше в виде BamHI/SalI-фрагмента из pTCS и сливали в антисмысловой ориентации с промотором в векторе pBinAR.
Фрагмент C (192 пары оснований) содержит сигнал полиаденилирования гена 3 Т-ДНК Ti-плазмиды pTiACH5 (Gielen и др. (1984) EMBO J. 3: 835-864).
Размер плазмиды TCSAS составляет приблизительно 12,75 т.п.н.
Плазмиду переносили в растения табака, применяя конвейерную трансформацию агробактерий, как описано выше. Целые растения регенерировали из трансформированных клеток.
Успех генетической модификации растений оценивали, анализируя целую РНК на отсутствие эндогенной мРНК, кодирующей цитрат-синтазу. Определяли активность цитрат-синтазы в различных тканях трансгенных растений табака. Результаты этих исследований показали, что с помощью указанного способа могут быть получены растения табака, цитрат-синтазная активность которых снижена в различной степени.
Следовательно, так же как и в случае растений картофеля, могут быть получены различные линии табака, отличающиеся по степени снижения активности цитрат-синтазы.
У табака также обнаружены трансформированные растения с измененной характеристикой цветения. Особый интерес представляет тот факт, что могут быть получены линии, у которых формируются цветки с сильно укороченными пестиками по сравнению с таковыми у цветков нетрансформированных растений. Это видно на фиг. 11, на которой показаны цветки трансформированных и нетрансформированных растений табака. Это означает, что ингибирование образования цветков в результате снижения активности цитрат-синтазы как у табака, так и у картофеля, в первую очередь воздействует на женские органы цветков. Еще одним фенотипическим проявлением этих линий является то, что у них формируется существенно меньше семян по сравнению с растениями дикого типа, а количество семян определяют по отношению к общей массе образовавшихся семян.
Пример 9
Конструирование плазмиды pHS-mCS и перенос плазмиды в растения картофеля
Для конструирования плазмиды pHS-mCS сначала интегрировали в векторе pUC18 последовательность ДНК, кодирующую митохондриальную последовательность-мишень матричной процессинг-пептидазы (МПП). Эту последовательность выделяли путем полимеразной реакции синтеза цепи (ПЦР) из плазмиды pBluescript, которая содержит последовательность кДНК МПП (Braun и др., 1992, EMBO J. 11:3219-3227), используя следующие олигонуклеотиды:
олигонуклеотид a): 5'-GATC GGT АСС ATG TAG AGA TGC GCA TCG TCT-3'(Seq ID N 6) и
олигонуклеотид б): 5'-GTAC GGA TCC CTT GGT TGC AAC AGC AGC TGA-3' (Seq ID N 7).
Полученный фрагмент ДНК содержал нуклеотиды с 299 по 397 последовательности, приведенной у Braun и др. (1992, EMBO J. 11: 3219-3227), кодирующей матричную процессинг-пептидазу. На 5'-конце олигонуклеотидной последовательности а) вставляли сайт расщепления Asp718. На 3'-конце олигонуклеотидной последовательности б) вставляли сайт расщепления BamHI.
Фрагмент ДНК, полученный путем ПЦР, расщепляли с помощью Asp718 и BamHI и клонировали в векторе pUC18, расщепленном с помощью Asp718 и BamHI. Полученный вектор обозначили как рМТР.
Кодирующую цитрат-синтазу последовательность ДНК из Saccharomyces cerevisiae клонировали в плазмиде рМТР позади митохондриальной последовательности-мишени в той же самой рамке считывания. Для этого геномную ДНК получали из дрожжей современными способами и выделяли фрагмент длиной 1443 пары оснований, содержащий кодирующую область цитрат-синтазы дрожжей при помощи PCR, используя олигонуклеотиды:
олигонуклеотид в): 5'-CTAG GGA ТСС ATG TCA GCG ATA TTA TCA ACA ACT AGC AAA AGT-3' (Seq ID N 8) и
олигонуклеотид г): 5'-GATT GGA TCC TTA GTT CTT ACT TTC GAT TTT CTT TAC CAA CTC-3' (Seq ID N 9).
В частности, последовательность включает нуклеотиды 376-1818 последовательности, приведенной у Suissa и др. (1984, EMBO J. 3: 1773-1781). Примененные олигонуклеотиды вводят сайт расщепления BamHI на оба конца амплифицированной последовательности ДНК. Полученный фрагмент ДНК расщепляли с помощью рестрикционной эндонуклеазы BamHI и затем лигировали с вектором рМТР, расщепленным BamHI, и трансформировали в клетках E.coli. Путем определения типа рестрикции выбирали клон, в котором вставка ПЦР-фрагмента происходила таким путем, что кодирующая область присоединялась к митохондриальной последовательности-мишени в смысловой ориентации, т.е. таким образом, что 5'-конец кодирующей области соединялся с 3'-концом последовательности-мишени. Полученную плазмиду обозначили как pMTP-YCS.
Применяя рестрикционные эндонуклеазы Asp718 и Xbal, из вектора pMTP-YCS выделяли фрагмент длиной приблизительно 1550 пар оснований, содержащий митохондриальную последовательность-мишень и кодирующую область цитрат-синтазы дрожжей. Этот фрагмент лигировали с бинарным вектором pBinAR (Hofgen и Willmitzer, 1990, Plant Sci. 66: 221-230), расщепленным с помощью Asp718 и XbaI. Полученная плазмида pHS-mCS показана на фиг. 12. Бинарный вектор pBinAR имеет происхождение из бинарного вектора Bin19. Вектор содержит промотор 35S и сигнал окончания транскрипции, между которыми расположен полилинкер, который может использоваться для вставки различных последовательностей ДНК.
Путем вставки фрагмента кДНК, кодирующей цитрат-синтазу дрожжей, с митохондриальной последовательностью-мишенью на N-конце получают полигенный экспрессирующий кластер, который конструируют следующим образом из фрагментов A, B, C и D (фиг. 12).
Фрагмент A (529 пар оснований) содержит промотор 35S вируса мозаики цветной капусты (CaMV). Фрагмент включает нуклеотиды CaMV от 6909 до 7437 (Franck и др. (1980) Cell 21: 285-294).
Фрагмент B содержит фрагмент ДНК длиной 99 пар оснований, кодирующий митохондриальную последовательность-мишень матричной процессинг-пептидазы (нуклеотиды 299-397 последовательности, приведенной у Braun и др. (1992, EMBO J. 11: 3219-3227).
Фрагмент C содержит кодирующую область цитрат-синтазы из Saccharomyces cerevisiae (нуклеотиды 376-1818 последовательности, приведенной у Suissa и др. (1984, EMBO J. 3: 1773-1781), слитый в смысловой ориентации с 3'-концом последовательности-мишени и в той же самой рамке считывания, что и последовательность-мишень.
Фрагмент D (192 пары оснований) содержит сигнал полиаденилирования гена 3 Т-ДНК Ti-плазмиды pTiACH5 (Gielen и др. (1984) EMBO J. 3: 835-846).
Размер плазмиды pHS-mCS составляет приблизительно 12,5 т.п.н.
Из этого полигенного экспрессирующего кластера с помощью промотора 35S транскрибируют транскрипт, кодирующий цитрат-синтазу дрожжей и содержащий на его N-конце аминокислотную последовательность, гарантирующую транспорт протеина в митохондрии.
Плазмиду переносили в растения картофеля, применяя конвейерную трансформацию агробактерий, как описано выше. Из трансформированных клеток регенерировали целые растения.
В результате трансформации трансгенные растения картофеля обладали способностью к экспрессии в их клетках цитрат-синтазы дрожжей. Это было продемонстрировано с помощью вестерн-блоттинга с использованием поликлональных антител, специфически распознающих цитрат-синтазу дрожжей.
Трансформированные растения картофеля, которые проявили высокую способность к экспрессии цитрат-синтазы дрожжей, обладают измененными характеристиками цветения по сравнению с нетрансформированными растениями картофеля. С одной стороны было установлено, что трансформированные растения начинали формировать цветки существенно раньше (в тепличных условиях в среднем на 2-4 недели) и образовывали больше цветков по сравнению с нетрансформированными растениями.
Более раннее образование цветков у трансгенных растений картофеля показано на фиг. 13. На ней представлены два трансгенных растения картофеля, которые были трансформированы плазмидой pHS-mCS, в сравнении с растением дикого типа сорта Desiree.
У трансгенных растений также образовывалось существенно больше цветков.
В частности после увядания первых соцветий у трансгенных растений, как правило, развивались вторые соцветия, а в некоторых случаях даже третьи соцветия. В противоположность этому растения дикого типа цветут только один раз и погибают после того, как эти соцветия увядают.
Пример 10
Конструирование плазмиды pEC-mCS и перенос плазмиды в растения картофеля
Для получения плазмиды pEC-mCS последовательность ДНК из E.coli, кодирующую цитрат-синтазу, клонировали в плазмиде рМТР, описанной в примере 9, позади митохондриальной последовательности-мишени в той же самой рамке считывания. Для этого из штамма E.coli DH5 α получали современными методами геномную ДНК и выделяли с помощью ПЦР фрагмент длиной приблизительно 1280 пар оснований, содержащий кодирующую область цитрат-синтазы из E.coli, используя олигонуклеотиды
олигонуклеотид д): 5'-GTAGGGATCC ATGGCTGATA CAAAAGCAA-3' (Seq ID N 10) и
олигонуклеотид е): 5'- GATTGGATCCTTAACGCTTGATATCGCTT-3' (Seq ID N 11).
Последовательность, в частности, содержит нуклеотиды 306-1589 последовательности, приведенной у Sarbjit и др., (1983, Biochemistry, 22: 5243-5249). Примененные олигонуклеотиды вводят сайт расщепления BamHI на оба конца амплифицированной последовательности ДНК. Полученный фрагмент ДНК расщепляли с помощью рестрикционной эндонуклеазы BamHI и затем лигировали с вектором рМТР, расщепленным BamHI, и интродуцировали в клетки E.coli при трансформации. Путем определения типа рестрикции выбирали клон, в котором вставка ПЦР-фрагмента происходила таким путем, что кодирующая область присоединялась к митохондриальной последовательности-мишени в смысловой ориентации, т. е. таким образом, что 5'-конец кодирующей области соединялся с 3'-концом последовательности-мишени. Полученную плазмиду обозначили как pMTP-ECCS. Применяя рестрикционные эндонуклеазы Asp718 и XbaI, из этого вектора выделяли фрагмент, содержащий митохондриальную последовательность-мишень и кодирующую область цитрат-синтазы E.coli. Этот фрагмент лигировали с бинарным вектором pBinAR, расщепленным с помощью Asp718 и XbaI (Hofgen и Willmitzer, 1990, Plant Sci. 66: 221-230). Полученная плазмида pEC-mCS показана на фиг. 14.
Путем вставки фрагмента ДНК, кодирующей цитрат-синтазу E.coli, с митохондриальной последовательностью-мишенью на N-конце получают полигенный экспрессирующий кластер, который конструируют следующим образом из фрагментов A, B, C и D (фиг. 14).
Фрагмент A (529 пар оснований) содержит промотор 35S вируса мозаики цветной капусты (CaMV). Фрагмент включает нуклеотиды CaMV 6909-7437 (Franck и др. (1980) Cell 21: 285-294).
Фрагмент B содержит фрагмент ДНК длиной 99 пар оснований, кодирующий митохондриальную последовательность-мишень матричной процессинг-пептидазы (нуклеотиды 299-397 последовательности, приведенной у Braun и др. (1992, EMBO J. 11: 3219-3227).
Фрагмент C содержит кодирующую область цитрат-синтазы из E. coli (нуклеотиды 306-1589 последовательности, приведенной у Sarbjit и др., 1983, Biochemistry, 22: 5243-5249), слитую в смысловой ориентации с 3'-концом последовательности-мишени и в той же самой рамке считывания, что и последовательность-мишень.
Фрагмент D (192 пары оснований) содержит сигнал полиаденилирования гена 3 Т-ДНК Ti-плазмиды pTiACH5 (Gielen и др. (1984) EMBO J. 3: 835-846).
Размер плазмиды pEC-mCS составляет приблизительно 12,4 т.п.н.
Из этого полигенного экспрессирующего кластера с помощью промотора 35S транскрибируют транскрипт, кодирующий цитрат-синтазу E.coli и содержащий на его N-конце аминокислотную последовательность, гарантирующую транспорт протеина в митохондрии.
Плазмиду переносили в растения картофеля, применяя конвейерную трансформацию агробактерий, как описано выше. Из трансформированных клеток регенерировали целые растения и анализировали их на цитрат-синтазную активность.
Перечень последовательностей приведен в конце описания.
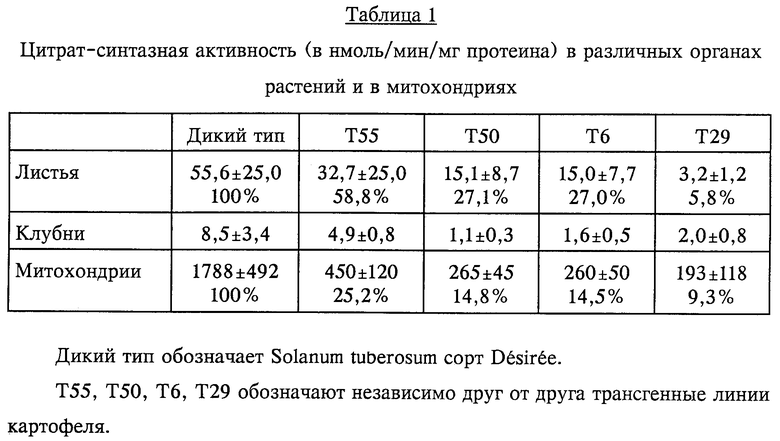
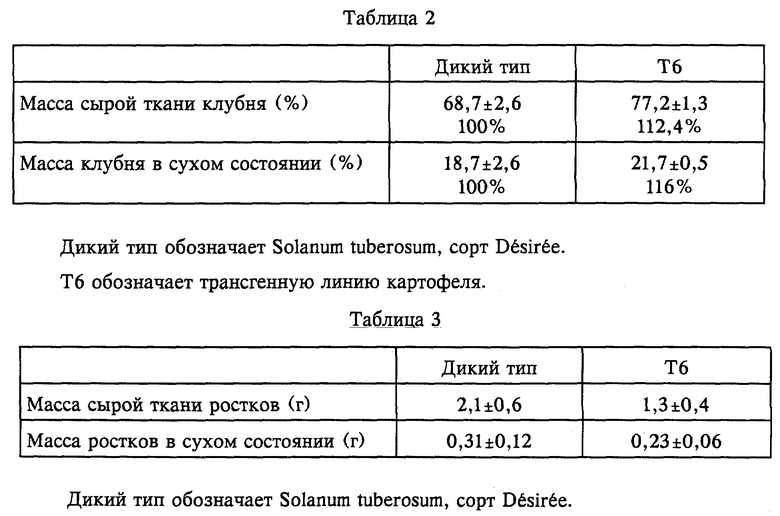















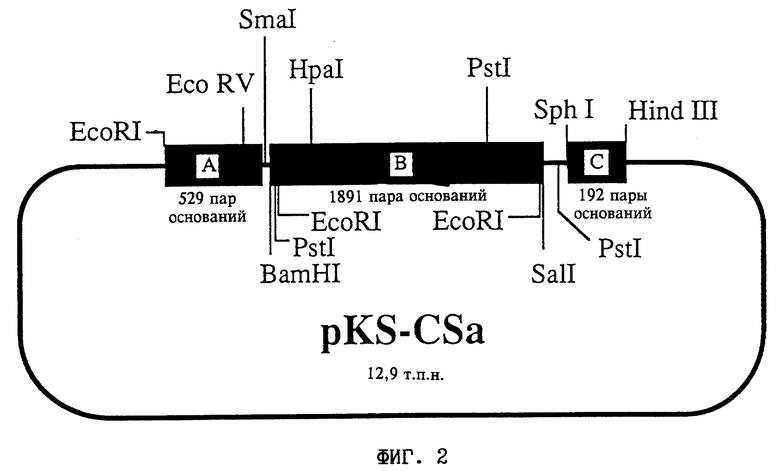
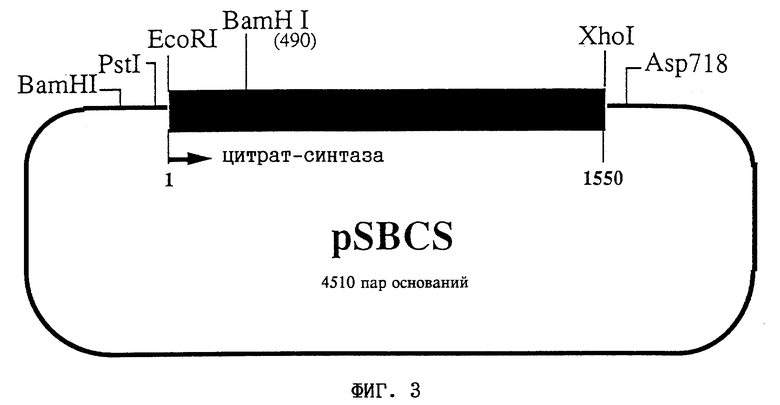
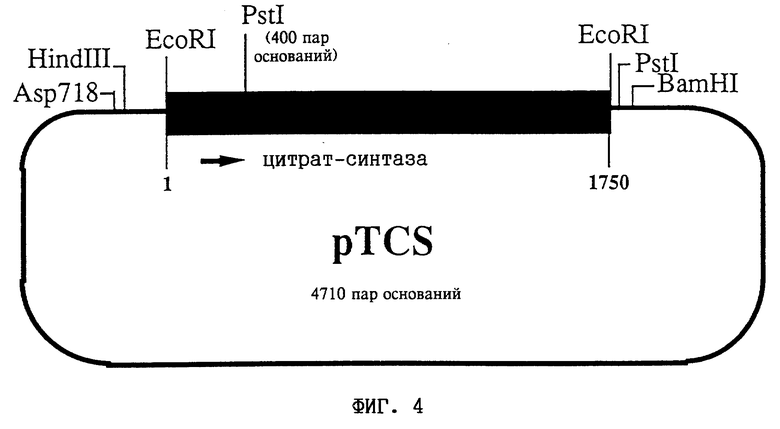
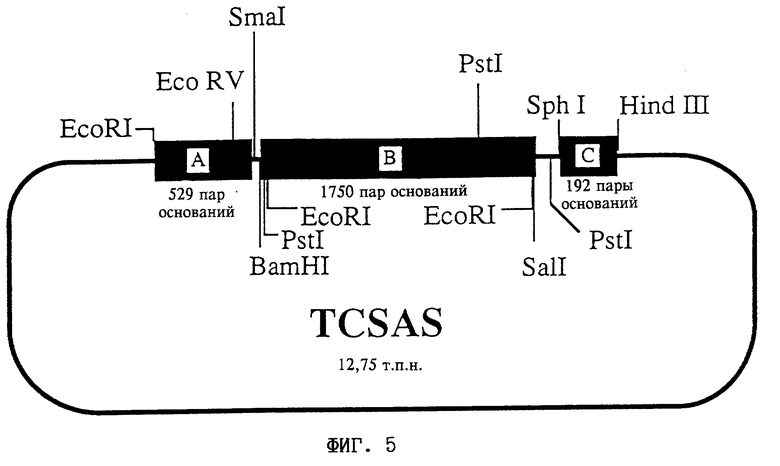
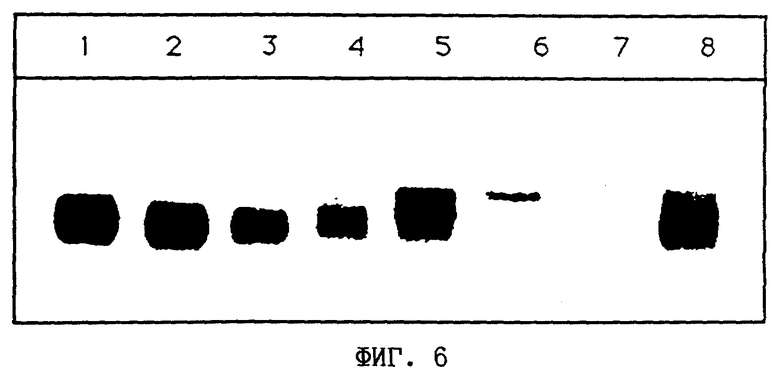
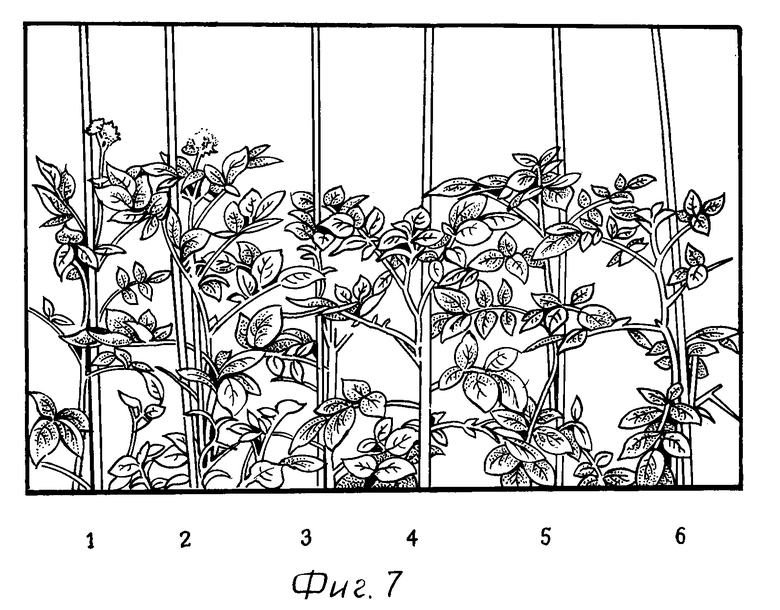
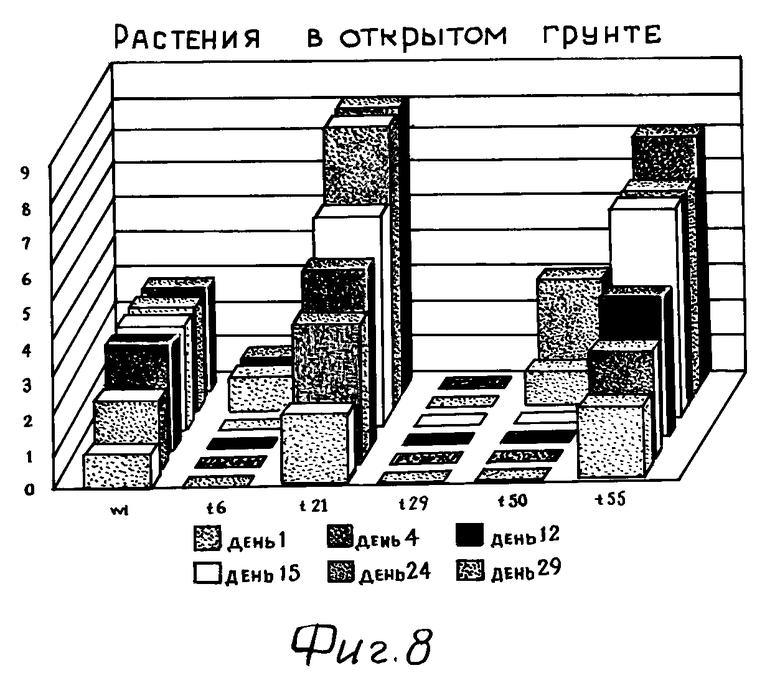
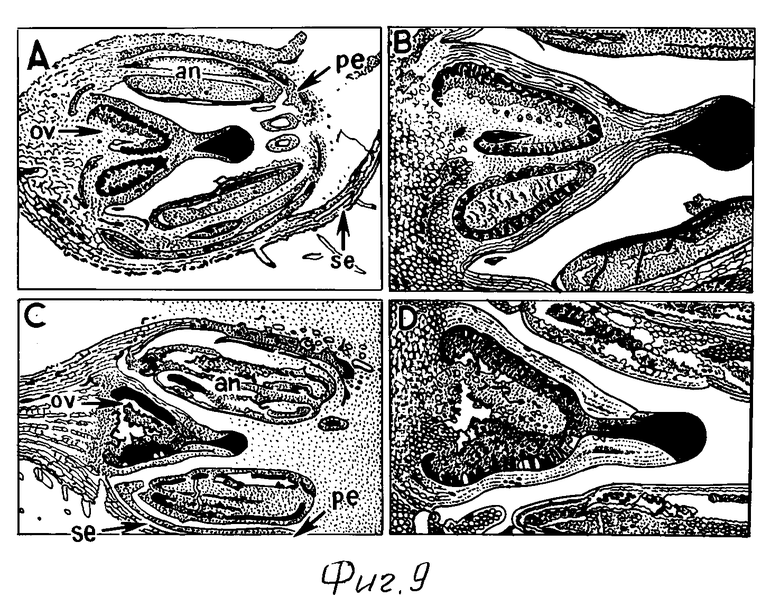
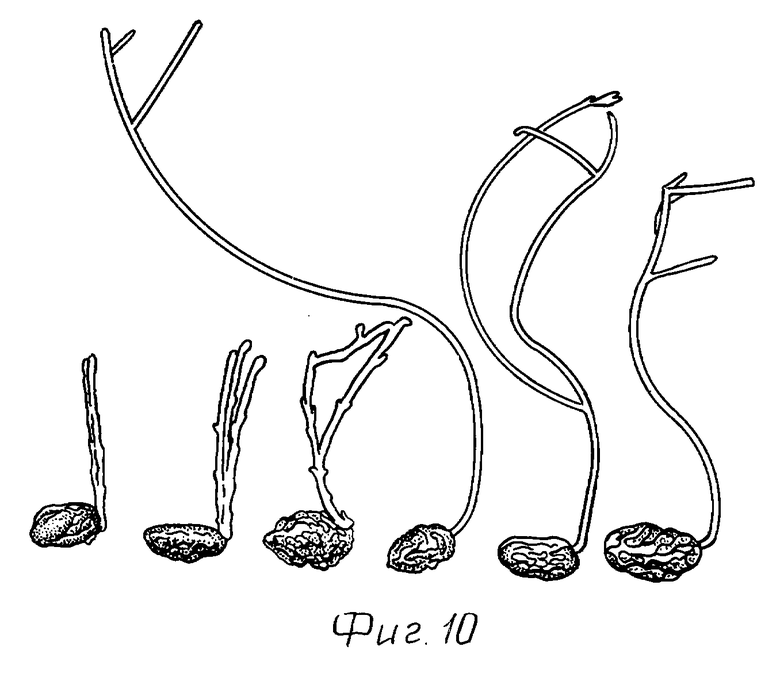
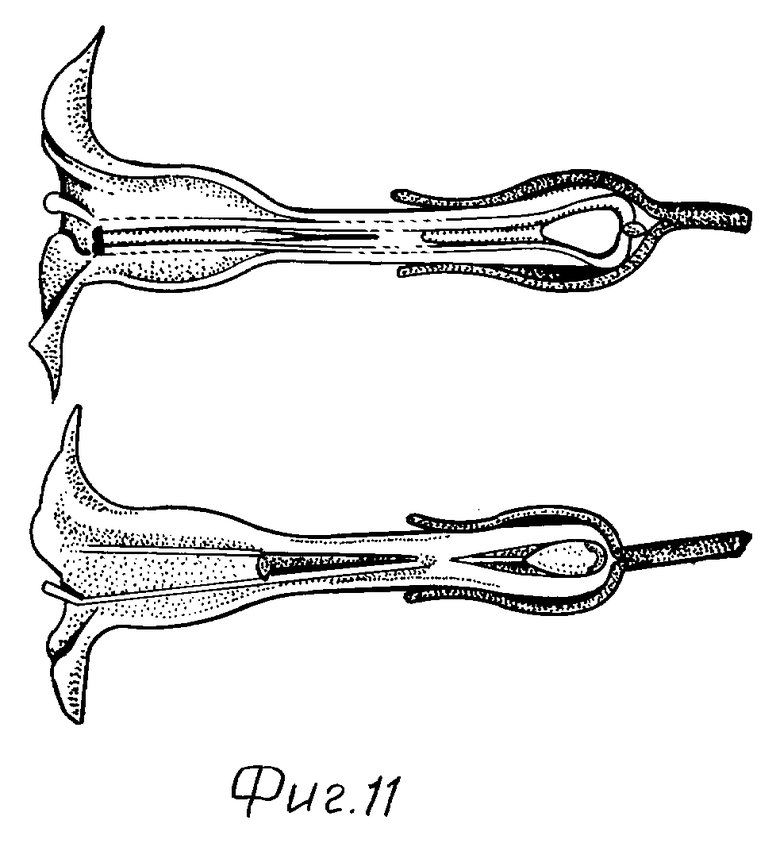
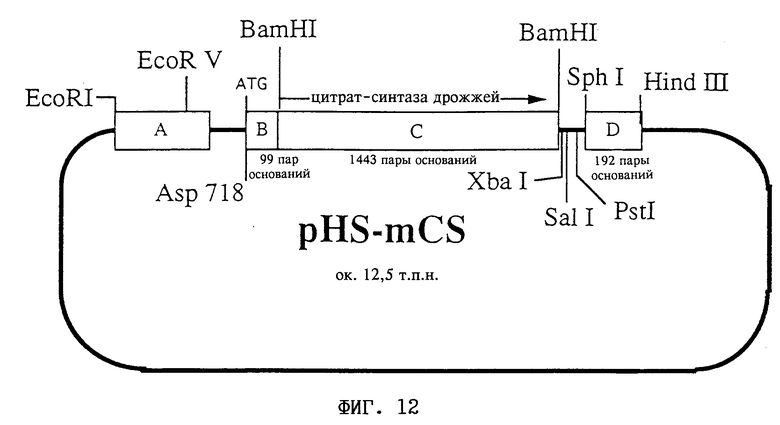
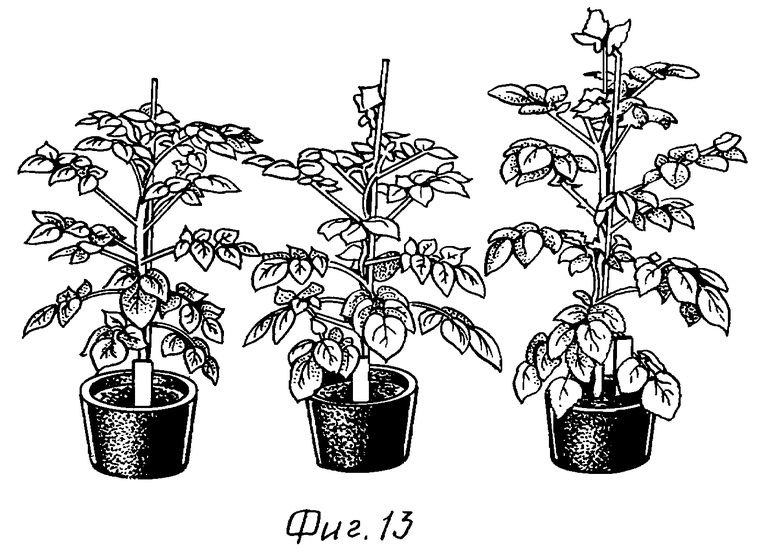
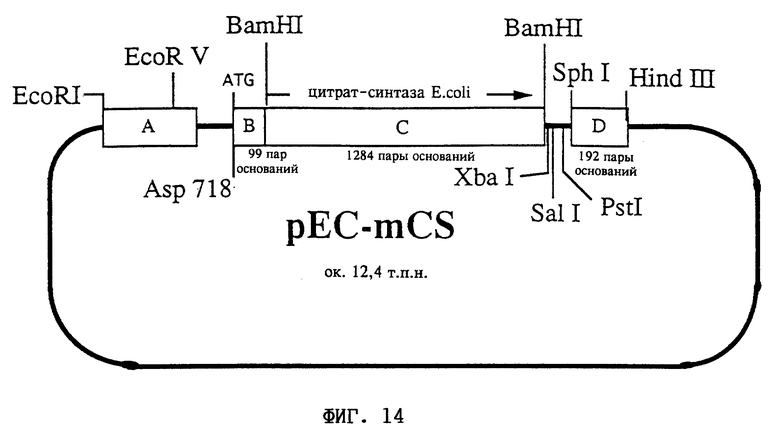
Изобретение предназначено для увеличения урожайности растений. Последовательности ДНК, кодирующие протеин, обладающий цитрат-синтазной активностью, стабильно интегрируют в геном клетки растения. Из клетки затем регенерируют целое растение. Благодаря повышению уровня продукции цитрат-синтазы в клетках растений у них индуцируется ускоренное и в большем количестве образование цветков. 8 з.п. ф-лы, 14 ил., 3 табл.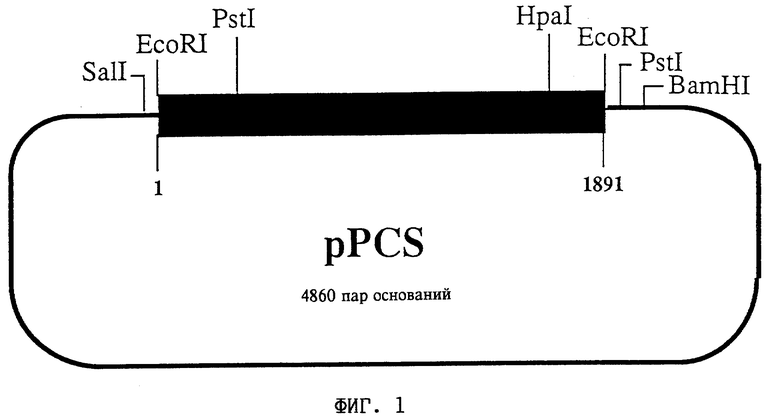
Приоритет по пунктам и признакам:
09.03.94 по пп. 1 - 3, а также признака, относящегося к последовательности SEQID 1 в пп.4 и 5;
22.09.94 по пп. 7 - 9, а также признаков, относящихся к последовательностям SEQID 2 и SEQID 3 в пп.4 - 5;
07.03.95 по п.6.
| Муромцев Г.С | |||
| и др | |||
| Основы сельскохозяйственной биотехнологии | |||
| - М.: Агропромиздат, 1990, с.363 - 364. |
Авторы
Даты
2000-02-20—Публикация
1995-03-07—Подача