Настоящее изобретение относится к производным пирролоиндола, пиридиноиндола и азепиноиндола, к способам их получения и промежуточным соединениям для их получения, к фармацевтическим композициям, содержащим указанные соединения, и к их применению в медицине. Активные соединения настоящего изобретения полезны при лечении ожирения и других расстройств.
Обнаружено, что ожирение является болезненным процессом, происходящим под влиянием факторов окружающей среды, при котором традиционные способы снижения массы тела с помощью режима питания и физических упражнений должны дополняться лекарственными препаратами (S. Parker, "Obesity: Trends and Treatments", Scrip Reports, PJB Publications Ltd, 1996).
При отнесении кого-либо, как имеющего избыточную массу тела или страдающего от ожирения, такое определение основывается на его индексе массы тела (BMI), который вычисляют делением массы тела (кг) на рост в квадрате (м2). Таким образом, единицами BMI являются кг/м2 и можно рассчитать интервал BMI, связанный с минимальной смертностью в каждом десятилетии жизни. Определение наличия избыточной массы тела дают при BMI в интервале 25-30 кг/м2, а ожирения - при BMI, превышающем 30 кг/м2. Проблемы, связанные с таким определением, состоят в том, что указанное определение не принимает в расчет соотношение в массе тела между мышцами и жиром (жировой тканью). С учетом этого обстоятельства наличие ожирения можно также определить на основании содержания жира в теле: при его содержании свыше 25% и 30% у мужчин и женщин соответственно.
Когда BMI возрастает, возрастает опасность смерти по разным причинам, которые не зависят от других факторов риска. Наиболее обычными заболеваниями при ожирении являются сердечно-сосудистые заболевания (в частности, гипертензия), диабет (ожирение ускоряет развитие диабета), заболевания желчного пузыря (в частности, рак) и заболевания в половой сфере. Исследования показали, что даже небольшое снижение массы тела может соответствовать значительному снижению опасности развития ишемической болезни сердца.
Соединения, имеющиеся на рынке как средства против ожирения, включают орлистат (Reductil®) и сибутрамин. Орлистат (ингибитор липазы) непосредственно ингибирует поглощение жира и часто имеет тенденцию к неприятному (хотя и относительно безвредному) побочному действию, такому как диарея. Сибутрамин (смешанный ингибитор повторного поглощения - 5-НТ норадреналина) может вызвать у некоторых пациентов повышение кровяного давления и частоты сердечных сокращений. Есть сообщения, что ингибиторы высвобождения и повторного поглощения серотонина фенфлурамин (Pondimin®) и дексфенфлурамин (Redux®) снижают потребление пищи и массу тела на длительное время (свыше 6 месяцев). Однако оба препарата отменены после сообщений предварительных данных о связанных с их применением нарушениях функций сердечных клапанов. Следовательно, существует потребность в разработке безопасного средства против ожирения.
Найдено, что неселективные агонисты и неполные агонисты 5-НТ2C-рецепторов м-хлорфенилпиперазин (mСРР) и трифторметилфенилпиперазин (TFMPP) снижают потребление корма у крыс (G.A. Kennett and G. Curzon, Psychopharmacol., 1988, 96, 93-100; G.A. Kennett, С.Т. Dourish and G. Curzon, Eur. J. Pharmacol., 1987, 141, 429-435) и ускоряют появление поведенческих последствий насыщения (S.J. Kitchener and С.Т. Dourish, Psychopharmacol., 1994, 113, 369-377). Последние результаты исследований с mСРР на здоровых добровольцах и страдающих ожирением также показали снижение потребления пищи. Так, однократная доза mСРР снижает потребление пищи у женщин-добровольцев (A.E.S. Waish et al., Psychopharmacol., 1994, 116, 120-122) и снижает аппетит и массу тела у мужчин и женщин, страдающих ожирением, при лечении в подострый период в течение 14 дней (Р.A. Sargeant et al., Psychopharmacol., 1997, 133, 309-312). Анорексичное действие mСРР отсутствует при применении к мышам-мутантам с выведенными из строя 5-НТ2C-рецепторами (L.H. Tecott et al., Nature, 1995, 374, 542-546) и нейтрализуется антагонистом 5-НТ2C-рецепторов SB-242084 у крыс (G.A. Kennett et al., Neuropharmacol., 1997, 36, 609-620). Следовательно оказалось, что mСРР снижает потребление пищи посредством агонистического действия на 5-НТ2C-рецепторы.
К другим соединениям, предложенным в качестве агонистов 5-НТ2C-рецепторов для лечения ожирения, относятся замещенные 1-аминоэтилиндолы, описанные в ЕР-А-0655440. В СА-2132887 и СА-2153937 сообщается, что трициклические производные 1-аминоэтилпиррола и трициклические производные 1-аминоэтилпиразола связываются с 5-НТ2C-рецепторами и могут применяться при лечении ожирения. В WO-A-98/30548 описаны аминоалкилиндазолы в качестве агонистов 5-НТ2C-рецепторов для лечения заболеваний ЦНС и регулирования нарушений аппетита. В J. Med. Chem., 1965, 8, 700 описан 2-(2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)этиламин. Получение пиридо[1,2-а]индолов для лечения цереброваскулярных нарушений описано в ЕР-А-0252643 и ЕР-А-0167901. В ЕР-А-0279125 описано получение 10-[(ациламино)этил]тетрагидропиридо[1,2-а]индолов в качестве агентов против ишемии.
Целью настоящего изобретения является разработка селективных лигандов, непосредственно действующих на 5-НТ2-рецепторы для применения в терапии и, в частности, для применения в качестве средств против ожирения. Другой целью данного изобретения является разработка непосредственно действующих лигандов, селективных в отношении 5-НТ2B- и/или 5-НТ2C-рецепторов, для применения в терапии и, в частности, для применения в качестве средств против ожирения. Еще одной целью данного изобретения являются селективные лиганды, непосредственно действующие на 5-НТ2C-рецепторы, предпочтительно агонисты 5-НТ2С-рецепторов, для применения в терапии и, в частности, для применения в качестве средств против ожирения.
Соответственно настоящее изобретение относится к химическому соединению формулы (I)
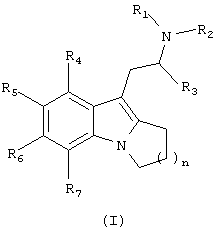
где n равно 1, 2 или 3;
R1 и R2 независимо выбирают из водорода и алкила;
R3 представляет собой алкил;
R4-R7 независимо выбирают из водорода, галогена, гидрокси, алкила, арила, алкокси, арилокси, алкилтио, арилтио, алкилсульфоксила, алкилсульфонила, арисульфоксила, арилсульфонила, амино, моноалкиламино, диалкиламино, нитро, циано, карбоксальдегида, алкилкарбонила, арилкарбонила, аминокарбонила, моноалкиламинокарбонила, диалкиламинокарбонила, алкоксикарбониламино, аминокарбонилокси, моноалкиламинокарбонилокси, диалкиламинокарбонилокси, моноалкиламинокарбониламино и диалкиламинокарбониламино, или R5 и R6 вместе образуют карбоциклическое или гетероциклическое кольцо, и к их фармацевтически приемлемым солям и пролекарствам.
Используемый здесь термин "алкил" относится к разветвленному или неразветвленному, циклическому или ациклическому, насыщенному или ненасыщенному (например, алкенил или алкинил) углеводородному радикалу. Когда алкильная группа является циклической, она предпочтительно представляет собой группу (С3-C12), предпочтительно (С5-С10) и более предпочтительно C5, С6 или С7. Когда алкильная группа является ациклической, она предпочтительно представляет собой группу (C1-С10), более предпочтительно (C1-С6), еще более предпочтительно метил, этил, пропил (н-пропил или изопропил) или бутил (н-бутил, изобутил или трет-бутил), предпочтительно метил.
Используемый здесь термин "низший алкил" означает метил, этил, пропил (н-пропил или изопропил) или бутил (н-бутил, изобутил или трет-бутил).
Используемый здесь термин "арил" означает ароматическую группу, такую как фенил или нафтил, или гетероароматическую группу, содержащую один или несколько гетероатомов, предпочтительно один, такую как пиридил, пирролил, фуранил и тиенил.
Алкильные и арильные группы могут быть замещенными или незамещенными. Когда группы являются замещенными, в них, как правило, будут присутствовать 1-3 заместителя, предпочтительно один заместитель. Заместителями могут являться углеродсодержащие группы, такие как
алкил,
арил,
арилалкил (например, замещенный и незамещенный фенил, замещенный и незамещенный бензил);
атомы галогена и галогенсодержащие группы, такие как
галогеналкил (например, трифторметил);
кислородсодержащие группы, такие как
спиртовые (например, гидрокси, гидроксиалкил, арил(гидрокси)алкил),
простые эфирные группы (например, алкокси, арилокси, алкоксиалкил, арилоксиалкил),
альдегидные группы (например, карбоксальдегид),
кетогруппы (например, алкилкарбонил, алкилкарбонилалкил, арилкарбонил, арилалкилкарбонил, арилкарбонилалкил),
кислотные группы (например, карбокси, карбоксиалкил),
группы производные кислот, такие как сложноэфирные (например, алкоксикарбонил, алкоксикарбонилалкил, алкилкарбонилокси, алкилкарбонилоксиалкил),
амидные группы (например, аминокарбонил, моно- или диалкиламинокарбонил, аминокарбонилалкил, моно- или диалкиламинокарбонилалкил, ариламинокарбонил),
карбаматные группы (например, алкоксикарбониламино, арилоксикарбониламино, аминокарбонилокси, моно- или диалкиламинокарбонилокси, ариламинокарбонилокси) и
уреагруппы (например, моно- или диалкиламинокарбониламино или ариламинокарбониламино);
азотсодержащие группы, такие как
аминогруппы (например, амино, моно- или диалкиламино, аминоалкил, моно- или диалкиламиноалкил),
азидные группы,
нитрильные группы (например, циано, цианоалкил),
нитро;
серосодержащие группы, такие как
тиольные, тиоэфирные, сульфоксидные и сульфоновые (например, алкилтио, алкилсульфинил, алкилсульфонил, алкилтиоалкил, алкилсульфинилалкил,
алкилсульфонилалкил, арилтио, арилсульфинил, арилсульфонил, арилтиоалкил, арилсульфинилалкил, арилсульфонилалкил);
и гетероциклические группы, содержащие один или несколько гетероатомов, предпочтительно один гетероатом (например, тиенил, фуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, оксадиазолил, тиадиазолил, азиридинил, азетидинил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, тетрагидрофуранил, пиранил, пиронил, пиридил, пиразинил, пиридазинил, пиперидил, гексагидроазепинил, пиперазинил, морфолинил, тианафтил, бензофуранил, изобензофуранил, индолил, оксииндолил, изоиндолил, индазолил, индолинил, 7-азаиндолил, бензопиранил, кумаринил, изокумаринил, хинолинил, изохинолинил, нафтиридинил, циннолинил, хиназолинил, пиридопиридил, бензоксазинил, хиноксалинил, хроменил, хроманил, изохроманил, фталазинил и карболинил).
Используемый здесь термин "алкокси" обозначает алкил-O-группу, а "алкоил" обозначаает группу алкил-СО-. Алкоксизаместители или алкоксисодержащие заместители могут быть замещены одной или несколькими алкильными группами.
Используемый здесь термин "галоген" обозначает радикал, образованный фтором, хлором, бромом или иодом, предпочтительно радикал, образованный фтором, хлором или бромом.
Используемый здесь термин "пролекарство" относится к любому фрамацевтически приемлемому пролекарству соединения формулы (I).
Используемый здесь термин "фармацевтически приемлемая соль" обозначает любую фармацевтически приемлемую соль соединения формулы (I). Соли можно получить из фармацевтически приемлемых нетоксичных кислот и оснований, в том числе из неорганических и органических кислот и оснований. К таким кислотам относятся уксусная, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, дихлоруксусная, муравьиная, фумаровая, глюконовая, глутаминовая, гиппуровая, бромоводородная, хлороводородная, изэтионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, слизевая, азотная, щавелевая, памовая, пантотеновая, фосфорная, янтарная, серная, винная, п-толуолсульфоновая и подобные кислоты. Особенно предпочтительны фумаровая, хлороводородная, бромоводородная, фосфорная, янтарная, серная и метансульфоновая кислоты. Приемлемые соли оснований включают соли щелочных металлов (например, натрия, калия), щелочноземельных металлов (например, кальция, магния) и соли алюминия.
В предпочтительном варианте изобретения соединения формулы (I) выбирают из соединений, в которых n равно 1.
Предпочтительно соединения формулы (I) выбирают из соединений, в которых R1 такой же, как R2. Предпочтительно как R1, так и R2 представляют собой водород. В одном из вариантов изобретения R1 представляет собой водород, a R2 представляет собой алкил (предпочтительно низший алкил и более предпочтительно метил), необязательно замещенный арилом (предпочтительно замещенной или незамещенной фенильной или тиенильной группой) или циклоалкильной группой (предпочтительно насыщенной и более предпочтительно выбранной из С3-, С4-, C5-, С6- и С7-циклоалкильных групп).
Предпочтительно соединения формулы (I) выбирают из соединений, в которых R3 представляет собой низший алкил, предпочтительно метил или этил, более предпочтительно метил. Атом углерода, к которому присоединен R3, является асимметричным атомом углерода. Предпочтительно, чтобы этот асимметричный атом углерода находился в (S)-конфигурации, где стереохимия определяется в отношении соединения, где R3 представляет собой незамещенную алкильную группу.
R4-R7 независимо выбирают из водорода, галогена, гидрокси, алкила (в том числе циклоалкила, галогеналкила (такого как трифторметил) и арилалкила), арила, алкокси (включая арилалкокси), арилокси, алкилтио, арилтио, алкилсульфоксила, алкилсульфонила, арисульфоксила, арилсульфонила, амино, моноалкиламино, диалкиламино, нитро, циано, карбоксальдегида, алкилкарбонила, арилкарбонила, аминокарбонила, моноалкиламинокарбонила, диалкиламинокарбонила, алкоксикарбониламино, аминокарбонилокси, моноалкиламинокарбонилокси, диалкиламинокарбонилокси, моноалкиламинокарбониламино и диалкиламинокарбониламино, или R5 и R6 вместе образуют карбоциклическое или гетероциклическое кольцо.
В одном из вариантов воплощения изобретения R4-R7 независимо выбирают из водорода, галогена, гидрокси, алкила (в том числе циклоалкила, галогеналкила (такого как трифторметил) и арилалкила), арила, алкокси (включая арилалкокси), арилокси, алкилтио, алкилсульфоксила и алкилсульфонила.
Предпочтительно R4 выбирают из водорода и галогена, предпочтительно, выбирают водород.
Предпочтительно R3 отличен от водорода и предпочтительно представляет галоген, алкил, алкокси, алкилтио, алкилсульфонил, моноалкиламино и диалкиламино, и предпочтительнее галоген (предпочтительно фтор, хлор и бром), алкил (предпочтительно низший алкил и предпочтительно трифторметил), алкокси (предпочтительно низший алкокси) и алкилтио (предпочтительно низший алкилтио).
Предпочтительно выбирать R6 из галогена (предпочтительно фтора и хлора) и водорода. В предпочтительном варианте воплощения изобретения R6 является заместителем, отличным от водорода.
Предпочтительно R7 представляет собой водород.
В одном из вариантов воплощения изобретения два или три заместителя из R4, R5, R6 и R7 предпочтительно два или три заместителя из R4, R6 и R7 и предпочтительно по меньшей мере R4 и R7, представляют собой водород.
В одном из вариантов воплощения изобретения R5 и R6 вместе могут образовывать карбоциклическое или гетероциклическое кольцо, предпочтительно гетероциклическое кольцо. Указанное кольцо может являться 4-, 5-, 6- или 7-членным, предпочтительно 5- или 6-членным, и предпочтительно 5-членным. Кольцо может быть алифатическим или ароматическим, предпочтительно алифатическим. Когда кольцо гетероциклическое, оно может содержать 1, 2 или 3 гетероатома, предпочтительно 1 или 2 гетероатома. Гетероатомы выбирают из О, S или N. Кольцо может быть замещенным или незамещенным, как указано выше в определении "алкильных" групп и "арильных" групп. В предпочтительном варианте воплощения изобретения R5 и R6 вместе образуют метилендиоксигруппу, которая образует кольцо с соседними атомами углерода фенильной группы, с которой она связана. Используемый термин "карбоциклическое кольцо" обозначает кольцо, в котором каждый из атомов является атомом углерода.
В предпочтительном варианте воплощения изобретения соединения формулы (I) выбирают из: 1-(7-хлор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина, 1-(6,7-дифтор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина, 1-(7-бром-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина, 1-(7-метокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина и 1-(7-метилтио-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина, и в особенности среди их (S)-энантиомеров. Когда соединения формулы (I) находятся в форме солей, предпочтительными солями являются фумараты.
Соединения изобретения могут содержать один или несколько асимметричных атомов углерода так, что указанные соединения могут существовать в различных стереоизомерных формах. Соединения могут представлять собой рацематы или оптически активные формы. Оптически активные формы можно получить разделением рацематов или асимметричным синтезом.
В предпочтительном варианте воплощения изобретения соединение формулы (I) находится в форме (S)-энантиомера, по существу свободного от (R)-энантиомера. Используемый здесь термин "по существу, свободный от (R)-энантиомера" означает, что композиция, включающая соединение формулы (I), содержит большую часть (S)-энантиомера соединения формулы (I) относительно (R)-энантиомера соединения формулы (I). В предпочтительном варианте воплощения настоящего изобретения используемый здесь термин "по существу, свободный от (R)-энантиомера" означает, что композиция содержит по меньшей мере 90 мас.% (S)-энантиомера и 10 мас.% или менее (R)-энантиомера. В еще более предпочтительном варианте воплощения изобретения термин "по существу, свободный от (R)-энантиомера" означает, что композиция содержит по меньшей мере 99 мас.% (S)-энантиомера и 1 мас.% или менее (R)-энантиомера. В еще более предпочтительном варианте термин "по существу, свободный от (R)-энантиомера" означает, что композиция содержит 100 мас.% (S)-энантиомера. Вышеуказанные проценты берутся относительно общего количества соединения формулы (I), присутствующего в композиции.
В соответствии с другим аспектом, изобретение относится к соединению формулы (I) для применения в терапии.
Соединения формулы (I) могут быть использованы для лечения (в том числе для профилактики) расстройств, связанных с функцией 5-НТ2-рецепторов. Соединения могут действовать как агонисты или антагонисты рецепторов. Предпочтительно соединения можно использовать для лечения (в том числе для профилактики) расстройств, связанных с функцией 5-НТ2B- и/или 5-НТ2С-рецепторов. Предпочтительно соединения можно использовать для лечения (в том числе для профилактики) расстройств, при которых требуется агонист 5-НТ2C-рецепторов.
Соединения формулы (I) могут быть использованы для лечения или для профилактики расстройств центральной нервной системы, таких как депрессия, атипичная депрессия, биполярные расстройства, тревожные состояния, обсессивно-кумпульсивные расстройства, социальные фобии или панические состояния, расстройства сна, половая дисфункция, психозы, шизофрения, мигрень и другие состояния, связанные с головной болью или другой болью, повышенное внутричерепное давление, эпилепсия, личностные расстройства, возрастные расстройства поведения, расстройства поведения, связанные со слабоумием, психоорганические расстройства, психические расстройства у детей, агрессивность, возрастные расстройства памяти, синдром хронической усталости, лекарственная и алкогольная зависимость, ожирение, булимия, нервно-психическая анорексия или предменструальное напряжение; повреждения центральной нервной системы, такие как травма, удар, нервнодегенеративных болезней или болезней ЦНС вследствие отравления или инфекции, таких как энцефалит или менингит; сердечно-сосудистых нарушений, таких как тромбоз; расстройств желудочно-кишечного тракта, таких как нарушение двигательной функции желудка и перистальтики кишечника; несахарный диабет и апноэ во сне.
В соответствии с другим аспектом изобретение относится к применению соединения формулы (I) для получения лекарственного средства для лечения (в том числе для профилактики) вышеуказанных расстройств. В предпочтительном варианте воплощения изобретение относится к применению соединения формулы (I) для получения лекарственного средства для лечения (в том числе для профилактики) ожирения.
В соответствии с другим своим аспектом изобретение относится к способу лечения (в том числе к способу профилактики) расстройства, выбранного из вышеуказанных расстройств, включающему введение пациенту, нуждающемуся в таком лечении, эффективной дозы соединения формулы (I). В предпочтительном варианте воплощения изобретение относится к способу лечения (в том числе к способу профилактики) ожирения.
В соответствии с другим аспектом изобретение относится к фармацевтической композиции, включающей соединение формулы (I) в сочетании с фармацевтически приемлемым носителем или наполнителем, и к способу получения такой композиции, включающему объединение соединения формулы (I) с фармацевтически приемлемым носителем или наполнителем.
В соответствии с другим аспектом изобретение относится к способу получения соединения формулы (I).
Соединения изобретения можно получить в соответствии с приведенной ниже схемой реакций 1. R1-R7 имеют значения, указанные ранее. Альдегид (III) можно получить взаимодействием индола (II) с, например, оксихлоридом фосфора в диметилформамиде. Хлорид (IV) можно получить из альдегида (III) взаимодействием с подходящим бромхлоралканом, иодхлоралканом или хлоралкансульфонатом в присутствии основания, такого как гидроксид калия, в растворителе, таком как диметилсульфоксид. Образования иодида (V) можно достичь взаимодействием хлорида (IV) с иодидом, таким как иодид натрия, в растворителе, таком как ацетонитрил. Альдегид (VI) можно получить взаимодействием иодида (V) с гидридом триалкилолова в присутствии такого реагента, как 1,1'-азобис(циклогексанкарбонитрил) или азобисизобутиронитрил, в растворителе, таком как толуол. Нитроалкен (VII) можно получить взаимодействием альдегида (VI) с нитроалканом. Соединения формулы (I) можно получить взаимодействием нитроалкена (VII) с восстановителем, таким как алюмогидрид лития, в растворителе - простом эфире.
Схема реакций 1

Соединения формулы (I) (R1 и/или R2 = алкил) можно получить из соединений формулы (I) (R1=R2=Н) стандартными способами, такими как восстановительное алкилирование подходящим альдегидом или кетоном в присутствии восстановителя, такого как триацетоксиборогидрид натрия, муравьиная кислота или цианоборогидрид натрия.
Если в любом способе, указанном здесь, заместитель R4, R5, R6 или R7 является другим, чем тот, который требуется, такой заместитель можно превратить в нужный заместитель известными способами. Может также потребоваться введение защитной группы в заместитель R4, R5, R6 или R7 для защиты от воздействия условий, в которых осуществляют реакцию. В таком случае после завершения реакции защитную группу можно удалить.
Способы, описанные выше, можно осуществить с получением соединения изобретения в форме свободного основания или в форме кислотно-аддитивной соли. Если соединение изобретения получают в форме кислотно-аддитивной соли, свободное основание можно получить обработкой основанием раствора кислотно-аддитивной соли. Напротив, если продукт представляет собой свободное основание, кислотно-аддитивную соль, в частности фармацевтически приемлемую кислотно-аддитивную соль, можно получить растворением свободного основания в подходящем органическом растворителе и обработкой раствора кислотой согласно традиционным методам получения кислотно-аддитивных солей из основного соединения.
Композиции настоящего изобретения можно составить обычным способом с использованием одного или нескольких фармацевтически приемлемых носителей. Так, активные соединения изобретения можно ввести в композиции для перорального, буккального, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного), трансдермального или ректального введения, или ввести в формы, подходящие для введения путем ингаляции или инсуффляции.
Для перорального введения фармацевтические композиции могут быть в форме, например, таблеток или капсул, получаемых обычными способами с фармацевтически приемлемыми наполнителями, такими как связывающие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие агенты (например, стеарат магния, тальк или кремнезем); разрыхляющие агенты (например, картофельный крахмал или натрийкрахмалгликолят); или смачивающие агенты (например, лаурилсульфат натрия). На таблетки можно нанести покрытие способами, хорошо известными в технике. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий, или их можно представить в виде сухих продуктов для соединения с водой или другим подходящим растворителем перед применением. Такие жидкие препараты можно получить обычными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные растворители (например, миндальное масло, эфиры жирных кислот или этиловый спирт); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота).
Для буккального введения композиция может быть в форме таблеток или лепешек, полученных обычным способом.
Активные соединения изобретения можно ввести в композиции для парентерального введения инъекцией, включая обычные методики катетеризации или инфузии. Композиции для инъекций могут находиться в виде стандартной лекарственной формы, например, в ампулах или в упаковках для многократного применения, с добавлением консерванта. Композиции могут быть в таких формах как суспензии, растворы или эмульсии в масляных или водных растворителях и могут содержать агенты для получения композиции, такие как суспендирующие, стабилизирующие или диспергирующие агенты.
С другой стороны, активный ингредиент может находиться в форме порошка для восстановления лекарственной формы перед применением с помощью подходящего растворителя, например стерильной апирогенной воды.
Активные соединения изобретения можно также ввести в композиции для ректального введения, такие как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды.
Для интраназального введения или введения ингаляцией активные соединения изобретения обычно доставляют в виде раствора или суспензии из емкости с насосом для разбрызгивания, которую пациент сжимает или на которую надавливает, или представляют в виде аэрозольного спрея в емкости под давлением или распылителе с применением подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением стандартную дозу можно контролировать с помощью установленного клапана для подачи отмеренного количества препарата. Емкость под давлением или распылитель может содержать раствор или суспензию активного соединения. Капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе можно наполнить порошкообразной смесью соединения изобретения и подходящей порошковой основы, такой как лактоза или крахмал.
Предлагаемая доза активных соединений изобретения для перорального, парентерального или буквального введения для среднего взрослого человека для лечения состояний, перечисленных выше (например, ожирения), составляет 0,1-500 мг активного ингредиента на единичную дозу, которую можно вводить, например 1-4 раза в сутки.
Далее изобретение описано подробнее с помощью приведенных примеров. Следует иметь в виду, что это только примеры, и можно осуществить изменения в деталях без отхода от объема изобретения.
Экспериментальная часть
Методы анализа
1. Связывание с серотониновыми рецепторами
Связывание соединений формулы (I) с серотониновыми рецепторами определяют in vitro стандартными способами. Препараты исследуют с помощью анализов, указанных ниже.
Способ (а). Для определения связывания с 5-НТ2C-рецепторами 5-НТ2C-рецепторы метят радиоактивным [3H]-5-HT. Сродство связывания соединений в отношении 5-НТ2C-рецепторов в клеточной линии СНО определяют согласно методу, описанному в D. Hoyer, G. Engel and H.O. Kalkman, European J. Pharmacol., 1985, 118, 13-23.
Способ (b). Для определения связывания с 5-НТ2B-рецепторами 5-НТ2B-рецепторы метят радиоактивным [3H]-5-НТ. Сродство связывания соединений в отношении 5-НТ2B-рецепторов человека в клеточной линии СНО определяют согласно методу, описанному в К. Schmuck, С. Ullmer, P. Engels and H. Lubbert, FEBS Lett., 1994, 342, 85-90.
Способ (с). Для определения связывания с 5-НТ2A-рецепторами 5-НТ2A-рецепторы метят радиоактивным [125I]-DOI. Сродство связывания соединений в отношении 5-НТ2A-рецепторов в клеточной линии СНО определяют согласно методу, описанному в D.J. McKenna and S.J. Peroutka, J. Neurosci., 1989, 9, 3482-90.
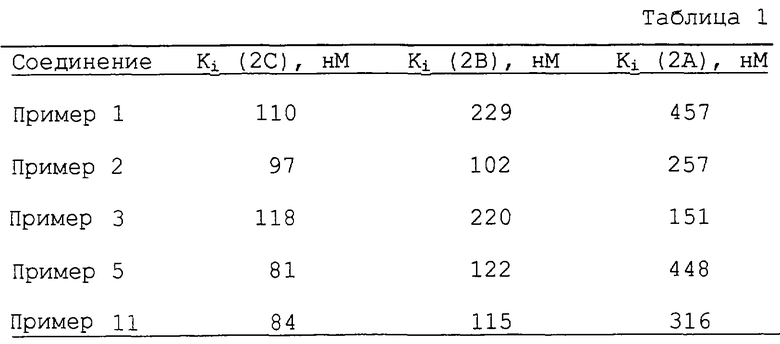
Активность соединений формулы (I), определенная таким образом, показана в таблице 1.
2. Функциональная активность
Функциональную активность соединений формулы (I) анализируют с использованием аппарата для прочтения флуориметрических изображений (FLIPR). Клетки СНО, экспрессирующие 5-НТ2C- или 5-HT2A-рецепторы человека, подсчитывают и помещают в стандартные 96-луночные титрационные микропланшеты за день до испытаний, с получением слитого монослоя. Затем клетки окрашивают чувствительным к кальцию красителем Fluo-3-АМ. Незахваченный краситель удаляют с использованием автоматического устройства для промывки планшетов, и планшеты оставляют с буфером для анализа (сбалансированный солевой раствор Хэнкса, содержащий 20 мМ Hepes и 2,5 мМ пробенецида) при общем объеме 100 мкл/лунку. В каждую лунку 96-луночного планшета для FLIPR в ходе измерений флуоресценции добавляют лекарственное средство (растворенное в 50 мкл буфера для анализа) со скоростью 70 мкл/с. Измерения проводят с интервалом в 1 с и измеряют максимальный сигнал флуоресценции (приблизительно 10-15 с после добавления лекарственного средства) и сравнивают с ответом, полученным от 10 мкМ 5-НТ (принимаемым за 100%), относительно которой выражают процент ответа (относительная эффективность). Кривые зависимости ответа от дозы строят с использованием Graphpad Prism (Graph Software Inc.).
Активность соединений, определенная таким образом, показана в таблице 2.

3. Эффективность in vivo
Эффективность in vivo агонистов 5-НТ2C анализируют по способности соединений индуцировать три специфические поведенческие реакции (5-НТ2C-синдром) у крыс.
5-НТ2C-Синдром является быстрым способом скрининга для оценки эффективности in vivo агонистов 5-HT2C по их способности индуцировать три специфические поведенческие реакции у крыс. Животным или подкожно или р.о. вводят дозу или положительный контроль (mСРР), или испытываемого соединения, или растворителя. Наблюдают за животными на открытом помосте, как правило, через 30, 60 и 180 мин после введения дозы, и оценивают степень синдрома в течение 2 мин по шкале 0-3 в зависимости от наличия и тяжести выворачивания конечностей, сгорбленного положения тела и ретропульсии - трех специфических поведенческих реакций, составляющих синдром. Результаты анализируют с использованием анализа дисперсии по Kruskal-Wallis после соответствующих тестов post-hoc. Весь статистический анализ проводят с использованием версии 7.0 Excel (Microsoft Corp.) и версии 5.0 Statistica (Statsoft, Inc.).
Активность соединения примера 3, определенная таким образом, показывает, что при дозе 20 мг/кг, s.c. соединение сохраняет значительную фармакологическую эффективность по меньшей мере в течение 180 минут.
Примеры синтеза
Пример 1. Гидрохлорид
(RS)-1-(7-хлор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина

5-Хлориндол-3-карбоксальдегид
К диметмлформамиду (20 мл) при перемешивании при 0°С добавляют по каплям оксихлорид фосфора (4,6 мл, 49 ммоль). Смесь перемешивают в течение 10 мин, и добавляют по каплям раствор 5-хлориндола (5,0 г, 33 ммоль) в диметилформамиде (5 мл). Смесь нагревают при 45°С в течение 45 мин, охлаждают до комнатной температуры и затем обрабатывают раствором гидроксида натрия (5,9 г, 148 ммоль) в воде (20 мл). Смесь нагревают при 50°С в течение 10 мин, охлаждают до комнатной температуры, выливают на измельченный лед (100 мл) и фильтруют. Остаток на фильтре перекристаллизовывают (метанол) и получают продукт в виде белого твердого вещества (3,5 г, 59%); Т.пл. 215-216°С; найдено: С - 60,13; Н - 3,40; N - 7,75%. Для C9H6ClNO вычислено: С - 60,19; Н - 3,37; N - 7,79%.
5-Хлор-1-(3-хлорпропил)индол-3-карбоксальдегид
К смеси порошка гидроксида калия (85%, 2,6 г, 39 ммоль) и метилсульфоксида (20 мл) при перемешивании добавляют по каплям раствор 5-хлориндол-3-карбоксальдегида (3,5 г, 19 ммоль) в метилсульфоксиде (5 мл). Смесь перемешивают в течение 30 мин и добавляют по каплям 1-бром-3-хлорпропан (2,9 мл, 29 ммоль). Смесь перемешивают в течение 1 ч и обрабатывают этилацетатом (3×40 мл) и водой (100 мл). Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме. Твердый остаток перекристаллизовывают (2-пропанол) и получают продукт в виде белого твердого вещества (4,1 г, 82%); Т.пл. 107-108°С; найдено: С - 56,51; Н - 4,26; N - 5,44%. Для C12H11Cl2NO вычислено: С - 56,27; Н - 4,33; N - 5,47%.
5-Хлор-1-(иодпропил)индол-3-карбоксальдегид
Раствор 5-хлор-1-(3-хлорпропил)индол-3-карбоксальдегида (3,8 г, 15 ммоль) и иодида натрия (4,5 г, 30 ммоль) в ацетонитриле (50 мл) при перемешивании в атмосфере аргона кипятят с обратным холодильником в течение 18 час, охлаждают до комнатной температуры и обрабатывают эфиром (3×30 мл) и водой (50 мл). Объединенные органические экстракты промывают (водный раствор метабисульфита натрия, вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме и получают продукт в виде желтого масла (5,0 г, 96%), которое сразу же используют.
7-Хлор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-карбоксальдегид
К раствору 5-хлор-1-(3-иодпропил)индол-3-карбоксальдегида (5,0 г, 14 ммоль) в толуоле (75 мл) при перемешивании при кипячении с обратным холодильником в атмосфере аргона добавляют по каплям в течение 2 ч раствор 1,1'-азо-бис(циклогексанкарбонитрила) (3,5 г, 14 ммоль) и гидрида три-н-бутилолова (7,8 мл, 29 ммоль) в толуоле (75 мл). Смесь перемешивают в течение 3 ч, охлаждают до комнатной температуры и добавляют фторид калия (3,5 г, 60 ммоль) и воду (15 мл). Смесь перемешивают в течение 18 ч и фильтруют через слой кизельгура. Остаток на фильтре промывают (этилацетат) и фильтрат концентрируют в вакууме, остаток очищают колоночной хроматографией [SiO2; этилацетат:гексан (9:1)] и перекристаллизовывают (метанол), и получают продукт в виде белого твердого вещества (1,1 г, 36%); Т.пл. 179-180°С; найдено: С - 65,54; Н - 4,61; N - 6,38%. Для C12H10ClNO вычислено: С - 65,61; Н - 4,59; N - 6,37%.
1-(7-Хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
Раствор 7-хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегида (1,0 г, 4,6 ммоль) и ацетата аммония (0,4 г, 5,2 ммоль) в нитроэтане (10 мл) при перемешивании нагревают при 100°С в течение 1 часа, охлаждают до комнатной температуры, разбавляют метанолом (30 мл), охлаждают до 0°С и фильтруют. Остаток на фильтре перекристаллизовывают (толуол) и получают продукт в виде желтых игольчатых кристаллов (0,58 г, 46%); Т.пл. 162-163°С; найдено: С - 60,68; Н - 4,67; N - 9,98%. Для C14H13ClN2O2 вычислено: С - 60,77; Н - 4,73; N - 10,12%.
Гидрохлорид (RS)-1-(7-хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина
К раствору алюмогидрида лития (1,0 М раствор в ТГФ, 2,7 мл, 2,7 ммоль) в дополнительном количестве ТГФ (5 мл) в атмосфере аргона при перемешивании добавляют по каплям раствор 1-(7-хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена (0,5 г, 1,8 ммоль) в ТГФ (10 мл). Смесь кипятят с обратным холодильником в течение 4 ч и охлаждают до 0°С. К смеси добавляют по каплям водный раствор калийнатрийтартрата (50 мл) и смесь перемешивают в течение 30 мин и фильтруют через кизельгур. Фильтрат экстрагируют дихлорметаном (3×30 мл). Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия), концентрируют в вакууме, остаток обрабатывают раствором хлороводорода в эфире (1,0 М, 2 мл, 2 ммоль) и концентрируют в вакууме. Концентрат перекристаллизовывают (2-пропанол) и получают названное в заголовке соединение в виде белого твердого вещества (0,23 г, 45%); Т.пл. 272-273°С; найдено: С - 57,86; Н - 6,37; N - 9,41%. Для C14H17ClN2·HCl·0,25H20 вычислено: С - 58,03; Н - 6,39; N - 9,67%.
Пример 2. Гидрохлорид (RS)-1-(6,7-дифтор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина
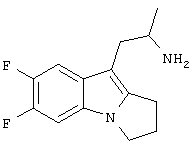
5,6-Дифториндол-3-карбоксальдегид
5,6-Дифториндол-3-карбоксальдегид получают из 5,6-дифториндола в соответствии со способом, описанным в примере 1, и получают 2,9 г (78%) продукта в виде бледно-желтого твердого вещества; Т.пл. 236-238°С; найдено: С - 58,34; Н - 2,79; N - 7,27%. Для C9H5F2NO·0,25H20 вычислено: С - 58,23; Н - 2,99; N - 7,55%.
5,6-Дифтор-1-(3-хлорпропил)индол-3-карбоксальдегид
5,6-Дифтор-1-(3-хлорпропил)индол-3-карбоксальдегид получают из 5,6-дифтор-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 2,9 г (78%) продукта в виде желтого твердого вещества; Т.пл. 111-113°С; найдено: С - 55,87; Н - 3,94; N - 5,40%. Для C12H10ClF2NO вычислено: С - 55,94; Н - 3,91; N - 5,44%.
5,6-Дифтор-1-(3-иодпропил)индол-3-карбоксальдегид
5,6-Дифтор-1-(3-иодпропил)индол-3-карбоксальдегид получают из 5,6-дифтор-1-(3-хлорпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, со следующими изменениями: сырой продукт очищают колоночной хроматографией [SiO2; гексан:этилацетат (3:2)], и получают продукт в виде желтого твердого вещества (2,7 г, 87%). Образец, перекристаллизованный из этилацетата и гексана, имеет Т.пл. 95-97°С; найдено: С - 41,42; Н - 2,94; N - 3,99%. Для C12H10F2INO вычислено: С - 41,28; Н - 2,89; N - 4,01%.
6,7-Дифтор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
6,7-Дифтор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид получают из 5,6-дифтор-1-(3-иодпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, со следующими изменениями: сырой продукт очищают колоночной хроматографией [SiO2; гексан:этилацетат (1:1)], и получают продукт в виде бледно-желтого твердого вещества (1,1 г, 66%), который сразу же используют без дополнительной очистки.
1-(6,7-Дифтор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
1-(6,7-Дифтор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен получают из 6,7-дифтор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 1, со следующими изменениями: реакционную смесь перемешивают при 100°С в течение 1 ч, охлаждают до комнатной температуры и обрабатывают этилацетатом (3×30 мл) и водой. Объединенные органические экстракты промывают (рассол), сушат (сульфат магния) и концентрируют в вакууме, и получают сырой продукт, который очищают колоночной хроматографией [SiO2; гексан:этилацетат (3:1)], и получают продукт в виде желтого твердого вещества (0,9 г, 72%). Образец, перекристаллизованный из метанола, имеет Т.пл. 156-8°С; найдено: С - 62,63; Н - 5,42; N - 9,30%. Для C14H12F2N202·0,3C6H14 вычислено: С - 62,40; Н - 5,37; N - 9,21%.
Гидрохлорид (RS)-1-(6,7-дифтор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина
Гидрохлорид (RS)-1-(6,7-дифтор-2,3-дигидро-1Н-пирроло-[1,2-а]индол-9-ил)-2-пропиламина получают из 1-(6,7-дифтор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена в соответствии со способом, описанным в примере 1, со следующими изменениями: реакционную смесь кипятят с обратным холодильником в течение 4 ч, охлаждают до 0°С и выливают в водный раствор калийнатрийтартрата (150 мл) и диэтиловый эфир (100 мл). Смесь перемешивают в течение 30 мин, фильтруют через целит® и фильтрат экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают (рассол), сушат (сульфат магния) и концентрируют в вакууме, остаток обрабатывают раствором хлороводорода в эфире (1,0 М, 2 мл, 2 ммоль) и концентрируют в вакууме. Остаток перекристаллизовывают (этилацетат, 2-пропанол) и получают названное в заголовке соединение в виде белого твердого вещества (0,55 г, 63%); Т.пл. 264-266°С; найдено: С - 58,67; Н - 6,09; N - 9,65%. Для C14H16F2N2·HCl вычислено: С - 58,64; Н - 5, 98; N - 9,76%.
Пример 3. Фумарат (RS)-1-(7-метокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина
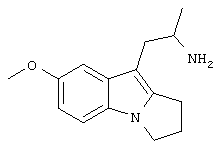
5-Метоксииндол-3-карбоксальдегид
5-Метоксииндол-3-карбоксальдегид получают из 5-метоксииндола в соответствии со способом, описанным в примере 1, и получают 5,1 г (85%) продукта в виде белого твердого вещества; Т.пл. 179-180°С; найдено: С - 68,37; Н - 5,15; N - 7,98%. Для C10H9NO2 вычислено: С - 68,56; Н - 5,18; N - 7,99%.
1-(3-Хлорпропил)-5-метоксииндол-3-карбоксальдегид
1-(3-Хлорпропил)-5-метоксииндол-3-карбоксальдегид получают из 5-метоксииндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, со следующими изменениями: реакционную смесь перемешивают в течение 18 ч, выливают в смесь воды со льдом (100 мл) и фильтруют. Остаток на фильтре перекристаллизовывают [изопропиловый эфир:2-пропанол (1:1)] и получают продукт в виде белого кристаллического вещества (4,6 г, 63%); Т.пл. 75-76°С; ЯМР δн (400 МГц, СDСl3) 2,29 (2Н, квинтет, J 6 Гц), 3,46 (2Н, т, J 6 Гц), 3,87 (3Н, с), 4,36 (2Н, т, J 6 Гц), 6,95 (1Н, дд, J 2,5, 9 Гц), 7,27 (1Н, д, J 9 Гц), 7,69 (1Н, с), 7,77 (1H, д, J 2,5 Гц), 9,94 (1H, с).
1-(3-Иодпропил)-5-метоксииндол-3-карбоксальдегид
1-(3-Иодпропил)-5-метоксииндол-3-карбоксальдегид получают из 1-(3-хлорпропил)-5-метоксииндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, со следующими изменениями: реакционную смесь кипятят с обратным холодильником в течение 18 час, охлаждают до комнатной температуры и обрабатывают эфиром (3×30 мл) и водой (50 мл). Объединенные органические экстракты промывают (водный раствор метабисульфита натрия, вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией [SiO2; гептан:этилацетат (3:1)] и получают продукт в виде желтого масла (4,9 г, 78%), который сразу же используют.
7-Метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
7-Метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид получают из 1-(3-иодпропил)-5-метоксииндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 0,41 г (13%) продукта в виде белого твердого вещества; Т.пл. 151-152°С; найдено: С - 72,25; Н - 6,10; N - 6,46%. Для C13H13NO2 вычислено: С - 72,54; Н - 6,09; N - 6,50%.
1-(7-Метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
1-(7-Метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен получают из 7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 1, со следующими изменениями: реакционную смесь нагревают при 100°С в течение 1 ч, охлаждают до комнатной температуры и обрабатывают этилацетатом (2×20 мл) и водой (30 мл). Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия), концентрируют в вакууме и остаток очищают колоночной хроматографией [SiO2; этилацетат:гептан (1:1)], и получают продукт в виде желтых игольчатых кристаллов (0,46 г, 91%); Т.пл. 143°С; найдено: С - 66,32; Н - 5,89; N - 10,27%. Для C15H16N2O3 вычислено: С - 66,16; Н - 5,92; N - 10,28%.
Фумарат (RS)-1-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина
Фумарат (RS)-1-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина получают из 1-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена в соответствии со способом, описанным в примере 1, со следующими изменениями: реакционную смесь кипятят с обратным холодильником в течение 4 ч, охлаждают до 0° С и постепенно добавляют водный раствор калийнатрийтартрата (50 мл). Смесь перемешивают в течение 30 мин, фильтруют через слой кизельгура и фильтрат экстрагируют дихлорметаном (3×30 мл). Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме. Концентрат растворяют в 2-пропаноле (1 мл) и при 50°С добавляют к раствору фумаровой кислоты (0,17 г, 1,5 ммоль) в 2-пропаноле (20 мл). Раствор охлаждают до 0°С и фильтруют. Остаток на фильтре промывают (2-пропанол, эфир) и сушат, и получают названное в заголовке соединение в виде белого твердого вещества (0,22 г, 42%); Т.пл. 194-196°С; найдено: С - 63,27; Н - 6,80; N - 7,69%. Для C19H24N2O5 вычислено: С - 63,32; Н - 6,71; N - 7,77%.
Пример 4. Гемифумарат (RS)-1-(8-хлор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина
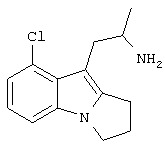
4-Хлориндол-3-карбоксальдегид
4-Хлориндол-3-карбоксальдегид получают из 4-хлориндола в соответствии со способом, описанным в примере 1, и получают 7,8 г (100%) продукта, который используют без дополнительной очистки.
4-Хлор-1-(3-хлорпропил)индол-3-карбоксальдегид
4-Хлор-1-(3-хлорпропил)индол-3-карбоксальдегид получают из 4-хлориндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 3,8 г (45%, в расчете на 4-хлориндол) продукта в виде белого твердого вещества; Т.пл. 89°С; найдено: С - 56,16; Н - 4,23; N - 5,40%. Для C12H11Cl2NO вычислено: С - 56,27; Н - 4,33; N - 5,47%.
4-Хлор-1-(3-иодпропил)индол-3-карбоксальдегид
4-Хлор-1-(3-иодпропил)индол-3-карбоксальдегид получают из 4-хлор-1-(3-хлорпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 4,2 г (83%) продукта в виде желтого твердого вещества, которое сразу же используют без дополнительной очистки.
8-Хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
8-Хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид получают из 4-хлор-1-(3-иодпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 1,0 г (39%) продукта в виде белого твердого вещества; Т.пл. 160-161°С; найдено: С - 65,70; Н - 4,54; N - 6,34%. Для C12H10NClO вычислено: С - 65,61; Н - 4,59; N - 6,37%.
1-(8-Хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
1-(8-Хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен получают из 8-хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 3, и получают 1,1 г (95%) продукта в виде желтых игольчатых кристаллов; Т.пл. 137-138°С; найдено: С - 60,68; Н - 4,73; N - 9,95%. Для C14H13N2ClO2 вычислено: С - 60,77; Н - 4,73; N - 10,12%.
Гемифумарат (RS)-1-(8-хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина
Гемифумарат (RS) -1- (8-хлор-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина получают из 1-(8-хлор-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена в соответствии со способом, описанным в примере 3, и получают 0,71 г (53%) продукта в виде белого твердого вещества. Образец, перекристаллизованный из 2-пропанола, показывает Т.пл. 207-208°С; найдено: С - 61,67; Н - 6,31; N - 8,79%. Для C14H17N2Cl·0,5C4H404·0,25H20 вычислено: С - 61,73; Н - 6,31; N - 9,00%.
Пример 5. Фумарат (RS)-1-(7-бром-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина

5-Броминдол-3-карбоксальдегид
5-Броминдол-3-карбоксальдегид получают из 5-броминдола в соответствии со способом, описанным в примере 1, и получают 5,1 г (89%) продукта в виде бежевого твердого вещества, которое используют без дополнительной очистки. ИК νmax (вазелиновое масло)/см-1 3222, 2925, 2855, 1712, 1644, 1524, 1459, 1441, 1378, 1290, 1129, 1096, 856, 799, 782, 728, 673, 609 и 573; ЯМР δн (400 МГц, СDСl3) 6,31 (1Н, дд, J 2, 8,5 Гц), 6,41 (1Н, д, J 8,5 Гц), 7,13 (1Н, д, J 2 Гц), 7,26 (1Н, с), 8,84 (1Н, с), 11,21 (1Н, с).
5-Бром-1-(3-хлорпропил)индол-3-карбоксальдегид
5-Бром-1-(3-хлорпропил)индол-3-карбоксальдегид получают из 5-броминдол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, со следующими изменениями: реакционную смесь перемешивают в течение 18 ч, выливают в смесь воды со льдом (200 мл) и фильтруют. Остаток на фильтре промывают (вода, гептан), сушат и очищают колоночной хроматографией (SiO2, этилацетат) и получают 4,6 г (77%) продукта в виде белого твердого вещества. ИК νmax (вазелиновое масло)/см-1 2925, 2855, 1660, 1610, 1532, 1469, 1402, 1378, 1302, 1171, 1195, 1035, 968, 818, 786, 722, 666, 622 и 610; ЯМР δн (400 МГц, CDCl3) 2,32 (2Н, м), 3,48 (2Н, т, J 6,5 Гц), 4,41 (2Н, т, J 6,5 Гц), 7,28 (1Н, д, J 9 Гц), 7,44 (1Н, дд, J 2, 8,5 Гц), 7,76 (1Н, с), 8,47 (1Н, д, J 3 Гц), 9,98 (1Н, с).
5-Бром-1-(3-иодпропил)индол-3-карбоксальдегид
5-Бром-1-(3-иодпропил)индол-3-карбоксальдегид получают из 5-бром-1-(3-хлорпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 6,0 г (100%) продукта в виде желтого масла, которое сразу же используют.
7-Бром-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
7-Бром-2,3-дигидро-1H-пирроло[1,2-а]индол-9-карбоксальдегид получают из 5-бром-1-(3-иодпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 1,2 г (32%) продукта в виде белого твердого вещества; Т.пл. 189-191°С; ИК νmax (вазелиновое масло)/см-1 2925, 2855, 1651, 1606, 1534, 1452, 1442, 1397, 1377, 1360, 1314, 1288, 1245, 1050, 1038, 802, 775 и 571; ЯМР δн (400 МГц, CDCl3) 2,72 (2Н, м), 3,25 (2Н, т, J 7,5 Гц), 4,08 (2Н, т, J 7 Гц), 7,07 (1Н, д, J 8,5 Гц), 7,29 (1Н, д, J 8,5 Гц), 8,31 (1Н, с), 9,90 (1H, с).
1-(7-Бром-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
1-(7-Бром-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен получают из 7-бром-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 1,1 г (81%) продукта в виде желтых игольчатых кристаллов; Т.пл. 173°С; найдено: С - 52,44; Н - 4,10; N - 8,75%. Для С14Н13N2ВrО вычислено: С - 52,36; Н - 4,08; N - 8,72%.
Фумарат (RS)-1-(7-бром-2,3-дигидро-1H-пирроло[1,2-а]-индол-9-ил)-2-пропиламина
Фумарат (RS)-1-(7-бром-2,3-дигидро-1H-пирроло[1,2-а]-индол-9-ил)-2-пропиламина получают из 1-(7-бром-2,3-дигидpo-1H-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена в соответствии со способом, описанным в примере 3, и получают 0,38 г (60%) продукта в виде белого твердого вещества; Т.пл. 181-183°С; ИК νmax (вазелиновое масло)/см-1 2925, 2855, 1702, 1632, 1580, 1524, 1464, 1378, 1317, 1277, 1222, 1167, 1100, 1049, 986, 897, 783, 722, 652 и 504; ЯМР δн (400 МГц, ДМСО-d6) 1,14 (3Н, д, J 7 Гц), 2,56 (2Н, м), 2,96 (3Н, м), 3,79 (1Н, м), 4,05 (2Н, т, J 7 Гц), 6,46 (2Н, с), 7,15 (1Н, дд, J 2, 8,5 Гц), 7,27 (1Н, д, J 8,5 Гц), 7,72 (1Н, д, J 2 Гц).
Пример 6. Фумарат (RS)-1-(7-метил-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина
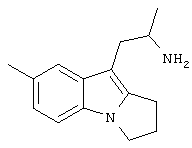
5-Метилиндол-3-карбоксальдегид
5-метилиндол-3-карбоксальдегид получают из 5-метилиндола в соответствии со способом, описанным в примере 1, и получают 2,06 г (42%) продукта в виде розового твердого вещества; Т.пл. 148-149°С; ИК νmax (вазелиновое масло)/см-1 3145, 2924, 1639, 1523, 1450, 1133, 805 и 616; ЯМР δн (400 МГц, ДМСО-d6) 2,41 (3Н, с), 3,32 (3Н, с), 7,08 (1Н, д, J 6,7 Гц), 7,39 (1H, д, J 8,2 Гц), 7,90 (1H, с), 8,22 (1Н, с), 9,90 (1H, с) и 12,01 (1H, уш.с); найдено: С - 75,24; Н - 5,67; N - 8,83%. Для С10Н9NO вычислено: С - 75,45; Н - 5,70; N - 8,97%.
1-(3-Хлорпропил)-5-метилиндол-3-карбоксальдегид
1-(3-Хлорпропил)-5-метилиндол-3-карбоксальдегид получают из 5-метилиндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 2,26 г (76%) продукта в виде не совсем белого твердого вещества; Т.пл. 89-90°C; ИК νmax (вазелиновое масло)/см-1 2956, 1659, 1536, 1403, 1171, 820 и 786; ЯМР δн (400 МГц, СDСl3) 2,27-2,34 (2Н, м), 2,47 (3Н, с), 3,46 (2Н, т, J 6,2 Гц), 4,38 (2Н, т, J 6,6 Гц), 7,16 (1H, д, J 10 Гц), 7,28 (1H, д, J 8,4 Гц), 7,70 (1H, с), 8,12 (1H, с) и 9,97 (1H, с); найдено: С - 66,12; Н - 6,00; N - 5,88%. Для C13H14ClNO вычислено: С - 66,24; Н - 5,99; N - 5,94%.
1-(3-Иодпропил)-5-метилиндол-3-карбоксальдегид
1-(3-Иодпропил)-5-метилиндол-3-карбоксальдегид получают из 1-(3-хлорпропил)-5-метилиндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают продукт в виде розового масла, которое сразу же используют без дополнительной очистки.
7-Метил-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
7-Метил-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид получают из 1-(3-иодпропил)-5-метилиндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 0,74 г (40%) продукта в виде белого твердого вещества; Т.пл. 148-149°С; ИК νmax (вазелиновое масло)/см-1 2953, 1643, 1448, 1357, 1033 и 814; ЯМР δн (400 МГц, CDCl3) 2,45 (3Н, с), 2,68-2,73 (2Н, м), 3,27 (2Н, т, J 7,7 Гц), 4,09 (2Н, т, J 7,5 Гц), 7,04 (1Н, д, J 8,5 Гц), 7,13 (1Н, д, J 8,6 Гц), 8,00 (1Н, с) и 9,96 (1Н, с).
1-(7-Метил-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
1-(7-Метил-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен получают из 7-метил-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 0,73 г (68%) продукта в виде оранжевого твердого вещества; Т.пл. 138-139°С; ИК νmax (вазелиновое масло)/см-1 2925, 1634, 1458, 1266, 1042, 977 и 799; ЯМР δн (400 МГц, СDСl3) 2,42 (3Н, с), 2,46 (3Н, с), 2,65-2,70 (2Н, с), 3,10 (2Н, т, J 7,0 Гц), 4,13 (2Н, т, J 7,0 Гц), 7,04 (1Н, д, J 7,0 Гц), 7,15 (1Н, д, J 8,0 Гц), 7,41 (1Н, с) и 8,39 (1Н, с); найдено: С - 70,57; Н - 6,76; N - 11,14%. Для C15H16N2O2 вычислено: С - 70,29; Н - 6,29; N - 10,92%.
Фумарат (RS)-1-(7-метил-2,3-дигидро-1Н-пирроло[1,2-а]-индол-9-ил)-2-пропиламина
Фумарат (RS)-1-(7-метил-2,3-дигидро-1Н-пирроло[1,2-а]-индол-9-ил)-2-пропиламина получают из 1-(7-метил-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена в соответствии со способом, описанным в примере 3, и получают 0,61 г (71%) названного в заголовке соединения в виде не совсем белого твердого вещества; Т.пл. - темнеет при 140°С, плавится при 156-157°С; ИК νmax (вазелиновое масло)/см-1 2922, 1697, 1461, 1378, 979, 791 и 652; ЯМР δн (400 МГц, ДМСО-d6) 1,25 (3Н, д, J 6,5 Гц), 2,47 (3Н, с), 2,63-2,67 (1Н, м), 2,80-2,85 (1Н, м), 2,94-3,08 (3Н, м), 3,43-3,53 (2Н, м), 4,10 (2Н, т, J 7,4 Гц), 6,52 (2Н, с), 6,97 (1Н, д, J 8,1 Гц), 7,26 (1Н, д, J 7,9 Гц) и 7,36 (1Н, с); найдено: С - 64,71; Н - 7,30; N - 8,12%. Для C15H20N2O·C4H404·0,5Н20 вычислено: С - 64,57; Н - 7,13; N - 7,93%.
Пример 7. Фумарат (RS)-1-[6,7-(метилендиокси)-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил]-2-пропиламина

5,6-(Метилендиокси)индол-3-карбоксальдегид
5,6-(Метилендиокси)индол-3-карбоксальдегид получают из 5,6-(метилендиокси)индола в соответствии со способом, описанным в примере 1, и получают 1,9 г (85%) продукта в виде желтого твердого вещества; Т.пл. - темнеет и разлагается при 180-190°С; ИК νmax (вазелиновое масло) /см-1 3233, 2925, 1630, 1472, 1294, 1177 и 937; ЯМР δн (400 МГц, ДМСО-d6) 6,01 (2Н, с), 7,03 (1Н, с), 7,46 (1Н, с), 8,08 (1Н, с), 9,83 (1Н, с) и 12,90 (1Н, уш.с).
1-(3-Хлорпропил)-5,6-(метилендиокси)индол-3-карбоксальдегид
1-(3-Хлорпропил)-5,6-(метилендиокси)индол-3-карбоксальдегид получают из 5,6-(метилендиокси)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 2,06 г (79%) продукта в виде светло-коричневого кристаллического вещества; Т.пл. 108-109°С; ИК νmax (вазелиновое масло)/см-1 2924, 1656, 1534, 1250, 1163 и 939; ЯМР δн (400 МГц, CDCl3) 2,27-2,30 (2Н, м), 3,47 (2Н, т, J 6 Гц), 4,30 (2Н, т, J 6 Гц), 5,98 (2Н, с), 6,82 (1Н, с), 7,59 (1Н, с), 7,70 (1Н, с) и 9,90 (1Н, с); найдено: С - 58,92; Н - 6,40; N - 5,23%. Для C13H12ClNO3 вычислено: С - 58,77; Н - 4,55; N - 5,27%.
1-(3-Иодпропил)-5,6-(метилендиокси)индол-3-карбоксальдегид
1-(3-Иодпропил)-5,6-(метилендиокси)индол-3-карбоксальдегид получают из 1-(3-хлорпропил)-5,6-(метилендиокси)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают продукт в виде коричневого твердого вещества, которое сразу же используют без дополнительной очистки.
6,7-(Метилендиокси)-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
Указанное соединение получают из 1-(3-иодпропил)-5,6-(метилендиокси)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 1,0 г (75%) продукта в виде не совсем белого твердого вещества; Т.пл. 169-170°С; ИК νmax (вазелиновое масло)/см-1 2924, 1639, 1645, 1244, 1133 и 944; ЯМР δн (400 МГц, CDCl3) 2,68 (2Н, квинт, J 7,2 Гц), 7,20 (2Н, т, J 7,2 Гц), 4,05 (2Н, т, J 7,1 Гц), 5,95 (2Н, с), 6,70 (1H, с), 7,63 (1Н, с) и 9,89 (1Н, с).
1-[6,7-(Метилендиокси)-2,3-дигидро-1Н-пирроло[1,2-а]-индол-9-ил]-2-нитро-1-пропен
1-[6,7-(Метилендиокси)-2,З-дигидро-1Н-пирроло[1,2-а]-индол-9-ил]-2-нитро-1-пропен получают из 5,6-(метилендиокси)-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 0,76 г (62%) продукта в виде оранжевого твердого вещества; Т.пл. - темнеет при 202-210°С; ИК νmax (вазелиновое масло)/см-1 2924, 1635, 1458, 1246, 1197 и 861; ЯМР δн (400 МГц, СDСl3) 2,40 (3Н, с), 2,65 (2Н, квинт, J 7,4 Гц), 3,06 (2Н, т, J 7,6 Гц), 4,07 (2Н, т, J 7,1 Гц), 5,95 (2Н, с), 6,71 (1H, с), 7,00 (1Н, с) и 8,30 (1Н, с); найдено: С - 62,31; Н - 5,25; N - 9,93%. Для C15H14N2O4 вычислено: С - 62,93; Н - 4,93; N - 9,78%.
Фумарат (RS)-1-[(6,7-метилендиокси)-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил]-2-пропиламина
Фумарат (RS)-1-[(6,7-метилендиокси)-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил]-2-пропиламина получают из 1-[6,7-(метилендиокси)-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил]-2-нитро-1-пропена в соответствии со способом, описанным в примере 3, и получают 0,13 г (14%) названного в заголовке соединения в виде не совсем белого твердого вещества; Т.пл. - темнеет при 135-140°С; ИК νmax (вазелиновое масло)/см-1 2923, 1632, 1466, 1235, 1039 и 652; ЯМР δн (400 МГц, ДМСО-d6) 1,12 (3Н, д, J 6,6 Гц), 2,46-2,53 (1H, м), 2,63-2,69 (1H, дд, J 14,1, 8,4 Гц), 2,81-2,93 (3Н, м), 3,26-3,39 (2Н, м), 3,94 (2Н, т, J 7,0 Гц), 5,89 (2Н, с), 6,40 (2Н, с), 6,89 (1H, с) и 7,01 (1H, с); найдено: С - 58,48; Н - 5,79; N - 7,25%. Для C15H18N2O2·C4H4O4·H2O вычислено: С - 58,16; Н - 6,16; N - 7,14%.
Примеры 8 и 9. Энантиомер 1 и энантиомер 2 фумарата 1-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина

(RS)-1-(7-Метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-(трифторацетамидо)пропан
К раствору (RS)-1-(7-метокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина (0,28 г, 1,1 ммоль) в дихлорметане (10 мл) при перемешивании при 0°С добавляют по каплям трифторуксусный ангидрид (0,18 мл, 1,3 ммоль). Смесь перемешивают в течение 1 ч, концентрируют в вакууме и остаток очищают колоночной хроматографией (SiO2; эфир), и получают продукт (0,39 г, 100%) в виде бежевого твердого вещества; Т.пл. 131-3°С; ИК νmax (вазелиновое масло)/см-1 3307, 3105, 2925, 2855, 2727, 1784, 1695, 1501, 1377, 1249, 1228, 1194, 1171, 1041, 844, 784 и 724; ЯМР δн (400 МГц, CDCl3) 1,24 (3Н, д, J 6,5 Гц), 2,60 (2Н, м), 2,92 (4Н, м), 3,85 (3Н, с), 4,03 (2Н, т, J 7 Гц), 4,36 (1Н, м), 6,37 (1Н, д, J 6,5 Гц, NH), 6,79 (1Н, дд, J 2,5, 8,5 Гц), 6,96 (1Н, д, J 3 Гц), 7,11 (1Н, д, J 9 Гц).
Энантиомер 1 и энантиомер 2 1-(7-метокси-2,3-дигидро-1H-пирроло [1,2-а]индол-9-ил)-2-трифторацетамидо)пропана
(RS)-(7-Метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-(трифторацетамидо)пропан (0,10 г, 0,29 ммоль) растворяют в дихлорметане (500 мкл), и половину полученного раствора загружают в колонку с Chiralcel OD (300 мм × 4,6 мм) [10-мкл впрыскивания; 1,0 мл/мин; гексан:2-пропанол (90:10); 220 нм], и получают после удаления растворителя энантиомер 1 (7-метокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-(трифторацетамидо)пропана (0,018 г, 36%) в виде не совсем белого твердого вещества; ЖХ: [Chiralcel OD; гексан:2-пропанол (90:10); 1,0 мл/мин; 220 нм] 99,1% (11,59 мин) и 0,9% (15,90 мин); [Supelcosil ABZ+; метанол: 10 мМ водный раствор ацетата аммония (80:20)] 96,4% (3,08 мин); и (S или R)-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-(трифторацетамидо)пропан (0,018 г, 36%, избыток энантиомера 92%) в виде бледно-зеленого твердого вещества; ЖХ: [Chiralcel OD; гексан:2-пропанол (90:10); 1,0 мл/мин; 220 нм] 4,0% (11,47 мин) и 96,0% (15,76 мин); [Supelcosil ABZ+; метанол: 10 мМ водный раствор ацетата аммония (80:20)], 94% (3,09 мин).
Энантиомер 1 фумарата 1-(7-метокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина
К раствору элюированного первым энантиомера трифторацетамида (0,018 г, 0,05 ммоль) в метаноле (10 мл) добавляют карбонат калия (0,02 г, 0,14 ммоль) и 5 капель воды и полученную суспензию перемешивают в течение 18 ч. Растворитель удаляют в вакууме и остаток растворяют в этилацетате, раствор сушат (сульфат магния), концентрируют в вакууме, и остаток очищают колоночной флэш-хроматографией [SiO2; этилацетат → этилацетат:метанол:0,880 раствор аммиака (90:8:2)], и получают бесцветное масло (0,0055 г). Это масло растворяют в 2-пропаноле (0,1 мл) и при 50°С добавляют к раствору фумаровой кислоты (0,0039 г, 0,034 ммоль) в 2-пропаноле (1 мл), и смесь упаривают до остаточного количества растворителя. Добавляют эфир и смесь фильтруют. Остаток на фильтре промывают холодным эфиром и получают продукт (0,0035 г, 43%) в виде белого твердого вещества. ЖХ: [Supelcosil ABZ+; метанол:10 мМ водный раствор ацетата аммония (70:30)] 94% (1,95 мин); ЖХ (образец, обработанный избытком трифторуксусного ангидрида): [Chiralcel OD; гексан:2-пропанол (90:10); 1,0 мл/мин; 220 нм] >99% (12,28 мин); m/z (ES+) 308 [(M+Na+MeCN)+, 5%], 245 (MH+, 7%) и 228 [(МН-NH3)+ 100%].
Энантиомер 2 фумарата 1-(7-метокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина
Энантиомер 2 фумарата 1-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина получают из элюируемого вторым энантиомера трифторацетамида в соответствии со способом, описанным выше, и получают 0,0018 г (25%) продукта в виде белого твердого вещества. ЖХ: [Supeicosil ABZ+; метанол:10 мМ водный раствор ацетата аммония (80:20)] 98% (1,69 мин); ЖХ (образец, обработанный избытком трифторуксусного ангидрида): [Chiralcel OD; гексан:2-пропанол (90:10); 1,0 мл/мин; 220 нм] 1% (12,58 мин) и 99% (17,07 мин); m/z (ES+) 245 (МН+, 5%) и 228 [(МН-NН3)+, 100%].
Пример 10. Фумарат (RS)-1-(7-бензилокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина

5-Бензилоксииндол-3-карбоксальдегид
5-Бензилоксииндол-3-карбоксальдегид получают из 5-бензилоксииндола в соответствии со способом, описанным в примере 1, и получают сырой продукт в виде бледно-коричневого твердого вещества, которое сразу же используют без дополнительной очистки.
5-Бензилокси-1-(3-хлорпропид)индол-3-карбоксальдегид
5-Бензилокси-1-(3-хлорпропил)индол-3-карбоксальдегид получают из 5-бензилоксииндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 4,4 г (68% в расчете на 5-бензилоксииндол) продукта в виде коричневых игольчатых кристаллов; Т.пл. 134-135°С; ИК νmax (вазелиновое масло)/см-1 2924, 1655, 1527, 1228, 1036, 787 и 707; ЯМР δн (400 МГц, CDCl3) 2,28 (2Н, м), 3,45-3,48 (2Н, т, J 5,9 Гц), 4,37 (2Н, т, J 6,5 Гц), 5,13 (2Н, с), 7,05 (1H, дд, J 9,1, 2,5 Гц), 7,28-7,48 (6Н, м), 7,70 (1H, с), 7,91 (1H, д, J 2,5 Гц) и 9,96 (1H, с); найдено: С - 69,62; Н - 5,58; N - 4,30%. Для C19H18ClNO2 вычислено: С - 69,62; Н - 5,53; N - 4,27%.
5-Бензилокси-1-(3-иодпропил)индол-3-карбоксальдегид
Указанное соединение получают из 5-бензилокси-1-(3-хлорпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают продукт в виде масла, которое сразу же используют без дополнительной очистки.
7-Бензилокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
7-Бензилокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид получают из 5-бензилокси-1-(3-иодпропил)индол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 1,55 г (40%) продукта в виде не совсем белого твердого вещества; Т.пл. 165-166°С; ИК νmax (вазелиновое масло)/см-1 2925, 1640, 1458, 1228, 1136, 1033 и 723; ЯМР δн (400 МГц, CDCl3) 2,68-2,72 (2Н, м), 3,27 (2Н, т, J 7,5 Гц), 4,10 (2Н, т, J 7,6 Гц), 5,12 (2Н, с), 6,92 (1H, д, J 2,6 Гц), 6,95-7,48 (6Н, м), 7,82 (1H, с) и 9,89 (1H, с); найдено: С - 78,02; Н - 5,92; N - 4,70%. Для C19H17NO2 вычислено: С - 78,33; Н - 5,88; N - 4,81%.
1-(7-Бензилокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
1-(7-Бензилокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен получают из 7-бензилокси-2,3-дигидро-1H-пирроло[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 0,71 г (74%) продукта в виде темно-коричневого твердого вещества; Т.пл. 146-147°С (разл.); ИК νmax (вазелиновое масло)/см-1 2925, 1626, 1465, 1267, 1208 и 885; ЯМР δн (400 МГц, CDCl3) 2,37 (3Н, с), 2,67-2,70 (2Н, м), 3,09 (2Н, т, J 7,1 Гц), 4,12 (2Н, т, J 7,1 Гц), 5,11 (2Н, с), 6,95 (1Н, дд, J,8,7, 2,5 Гц), 7,13-7,47 (7Н, м) и 8,35 (1Н, с); найдено: С - 72,17; Н - 5,77; N - 7,95%. Для С21Н20N2O3 вычислено: С - 72,40; Н - 5,79; N - 8,04%.
Фумарат (RS)-1-(7-бензилокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина
Указанное соединение получают из 1-(7-бензилокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена в соответствии со способом, описанным в примере 3, и получают 0,17 г (18%) названного в заголовке соединения в виде не совсем белого твердого вещества; Т.пл. - темнеет при 180°С, плавится при 188-198°С; ИК νmax (вазелиновое масло)/см-1 2923, 1626, 1464, 1222, 736 и 650; ЯМР δн (400 МГц, ДМСО-d6) 1,13 (3Н, д, J 6,6 Гц), 2,50-2,56 (2Н, м), 2,68-2,74 (1Н, м), 2,87-2,96 (3Н, м), 3,33-3,39 (1H, м), 3,99 (2Н, т, J 7,5 Гц), 5,09 (2Н, с), 6,43 (2Н, с), 6,74-6,77 (1Н, дд, J 8,6, 2,5 Гц) и 7,15-7,48 (7Н, м); найдено: С - 67,84; Н - 6,37; N - 6,30%. Для C21H24N2O·C4H4O4·0,5H2O вычислено: С - 67,40; Н - 6,56; N - 6,29%.
Пример 11. Фумарат (RS)-1-(7-метилтио-2,3-дигидро-1H-пирроло[1,2-а]индол-9-ил)-2-пропиламина

5-Метилтиоиндол-3-карбоксальдегид
5-Метилтиоиндол-3-карбоксальдегид получают из 5-метилтиоиндола (Heterocycles, 1992, 34, 1169-1175) в соответствии со способом, описанным в примере 1, и получают 1,85 г (86%) продукта в виде белого твердого вещества; Т.пл. 182-183°С; ИК νmax (вазелиновое масло)/см-1 3172, 2926, 2807, 1632, 1440, 1130 и 972; ЯМР δн (400 МГц, ДМСО-d6) 2,50 (3Н, с), 7,24 (1Н, дд, J 11,4, 2,8 Гц), 7,50 (1Н, д, J 11,5 Гц), 7,96 (1Н, с), 8,28 (1H, с) и 9,92 (1H, с).
1-(3-Хлорпропил)-5-метилтиоиндол-3-карбоксальдегид
1-(3-Хлорпропил)-5-метилтиоиндол-3-карбоксальдегид получают из 5-метилтиоиндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 2,36 г (94%) продукта в виде бледно-желтого твердого вещества; Т.пл. 64-65°С; ИК νmax (вазелиновое масло)/см-1 2924, 2809, 1656, 1534, 1399, 1172, 1027, 813 и 786; ЯМР δн (400 МГц, CDCl3) 2,27-2,33 (2Н, м), 2,54 (3Н, с), 3,46 (2Н, т, J 5,7 Гц), 4,38 (2Н, т, J 6,5 Гц), 7,29 (2Н, с), 7,71 (1Н, с), 8,22 (1H, с) и 9,96 (1Н, с).
1-(3-Иодпропил)-5-метилтиоиндол-3-карбоксальдегид
1-(3-Иодпропил)-5-метилтиоиндол-3-карбоксальдегид получают из 1-(3-хлорпропил)-5-метилтиоиндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают продукт в виде бледно-коричневого масла, которое сразу же используют без дополнительной очистки.
7-Метилтио-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид
7-Метилтио-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-карбоксальдегид получают из 1-(3-иодпропил)-5-метилтиоиндол-3-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 0,80 г (40%) продукта в виде бледно-желтого твердого вещества; Т.пл. 140-141°С; ИК νmax (вазелиновое масло)/см-1 2924, 2724, 1639, 1465, 1029 и 820; ЯМР δн (400МГц, CDCl3) 2,53 (3Н, с), 2,68-2,76 (2Н, м), 3,28 (2Н, т, J 7,5 Гц), 4,12 (2Н, т, J 7,1 Гц), 7,14-7,22 (2Н, м), 8,12 (1H, с) и 9,90 (1H, с).
1-(7-Метилтио-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен
1-(7-Метилтио-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропен получают из 7-метилтио-2,3-дигидро-lH-пирроло-[1,2-а]индол-9-карбоксальдегида в соответствии со способом, описанным в примере 1, и получают 0,60 г (80%) продукта в виде оранжевого твердого вещества; Т.пл. 135-136°С; ИК νmax (вазелиновое масло)/см-1 2924, 1636, 1475, 1277, 979 и 800; ЯМР δн (400 МГц, СDСl3) 2,41 (3Н, с), 2,52 (3Н, с), 2,66-2,70 (2Н, м), 3,10 (2Н, т, J 7,2 Гц), 4,14 (2Н, т, J 7,1 Гц), 7,17-7,23 (2Н, м), 7,54 (1Н, с) и 8,35 (1Н, с).
Фумарат (RS)-1-(7-метилтио-2,3-дигидро-1Н-пирроло-[1,2-а]индол-9-ил)-2-пропиламина
Фумарат (RS)-1-(7-метилтио-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина получают из 1-(7-метилтио-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-нитро-1-пропена в соответствии со способом, описанным в примере 3, и получают 0,23 г (30%) названного в заголовке соединения в виде бледно-желтого кристаллического вещества; Т.пл. 204-206°С (разл); ИК νmax (вазелиновое масло)/см-1 3052, 2924, 1612, 1463, 1310, 992 и 788; ЯМР δн (400 МГц, ДМСО-d6) 1,14 (3Н, д, J 6,1 Гц), 2,46 (3Н, с), 2,50-2,55 (2Н, м), 2,71-2,76 (1Н, м), 2,89-2,99 (3Н, м), 3,34-3,36 (1Н, м), 4,02 (2Н, т, J 7,1 Гц), 6,43 (2Н, с), 7,04 (1Н, дд, J 8,4, 1,9 Гц), 7,24 (1Н, д, J 8,1 Гц) и 7,50 (1H, д, J 1,4 Гц).
Пример 12. Гидрохлорид (RS)-N-(2-метилпропил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина

Смесь (RS)-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина (0,030 г, 0,12 ммоль), 3-метилпропаналя (0,021 мл, 0,24 ммоль) и метанола (1 мл) встряхивают в течение 3 ч. К смеси добавляют борогидридсодержащую смолу амберлит IRA-400 (2,5 ммоль/г -ВН4, 0,12 г, 0,3 ммоль) и смесь встряхивают в течение 18 ч. К смеси добавляют РS-бензальдегид (2,5 ммоль/г -СНО, 0,12 г, 0,3 ммоль) и смесь встряхивают в течение 18 ч и фильтруют. Остаток на фильтре промывают дихлорметаном (2 × 1 мл) и метанолом (2 × 1 мл) и фильтрат концентрируют в вакууме. Концентрат растворяют в дихлорметане (2 мл), и добавляют амберлист-15 (0,5 г). Смесь встряхивают в течение 1 ч и фильтруют. Остаток на фильтре промывают дихлорметаном (2 × 1 мл) и метанолом (2 × 1 мл), суспендируют в метанольном растворе аммиака (2 М, 1 мл, 2 ммоль), встряхивают в течение 1 ч и фильтруют. Остаток на фильтре промывают (дихлорметан), и фильтрат концентрируют в вакууме. Концентрат обрабатывают раствором хлороводорода в эфире (1 М, 1 мл, 1 ммоль) и концентрируют в вакууме, и получают продукт в виде бежевого твердого вещества (0,02 г, 49%); Т.пл. 178-181°С; ЯМР δн (400 МГц, ДМСО-d6) 1,01 (6Н, м), 1,17 (3Н, д, J 6,5 Гц), 2,56 (2Н, м), 2,77 (1Н, м), 2,77 (1Н, м), 2,86 (1Н, м), 2,93 (2Н, м), 3,22 (1Н, м), 3,39 (1Н, м), 3,51 (1Н, м), 3,78 (3Н, с), 4,02 (2Н, т, J 7 Гц), 6,71 (1Н, дд, J 2,5, 8,5 Гц), 7,11 (1Н, с), 7,19 (1H, д, J 8,5 Гц).
Пример 13. Гидрохлорид (RS)-N-(циклопропилметил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина

Гидрохлорид (RS)-N-(циклопропилметил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина получают из (RS)-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина и циклопропилкарбоксальдегида в соответствии со способом, описанным в примере 12, и получают 0,024 г (54%) продукта в виде бежевого твердого вещества; Т.пл. 149-151°С; ЯМР δн (400 МГц, ДМСО-d6) 0,41 (2Н, дд, J 5, 9 Гц), 0,62 (2Н, д, J 9 Гц), 1,15 (3Н, д, J 6,5 Гц), 2,56 (2Н, м), 2,73 (1H, дд, J 10,5, 14 Гц), 2,93 (6Н, м), 3,78 (3Н, с), 4,02 (2Н, т, J 7 Гц), 6,71 (1H, дд, J 2,5, 9 Гц), 7,07 (1Н, д, J 2,5 Гц), 7,19 (1H, д, J 9 Гц).
Пример 14. Гидрохлорид (RS)-N-(циклогексилметил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина

Гидрохлорид (RS)-N-(циклогексилметил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина получают из (RS)-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина и циклогексилкарбоксальдегида в соответствии со способом, описанным в примере 12, и получают 0,023 г (50%) продукта в виде бежевого твердого вещества; Т.пл. 210-3°С; ЯМР δн (400 МГц, ДМСО-d6) 1,01 (2Н, м), 1,17 (3Н, д, J 6,5 Гц), 1,22 (3Н, м), 1,73 (6Н, м), 2,55 (2Н, м), 2,77 (1H, м), 2,84 (2Н, м), 2,93 (2Н, м), 3,24 (1H, м), 3,39 (1H, м), 3,78 (3Н, с), 4,02 (2Н, т, J 7 Гц), 6,70 (1H, дд, J 2,5, 8,5 Гц), 7,13 (1H, д, J 2,5 Гц), 7,18 (1H, д, J 8,5 Гц).
Пример 15. Гидрохлорид (RS)-N-(2,2-диметилпропил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина
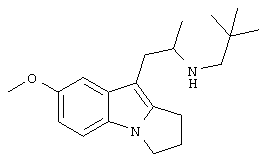
Гидрохлорид (RS)-N-(2,2-диметилпропил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина получают из (RS)-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина и 2,2-диметилпропиональдегида в соответствии со способом, описанным в примере 12, и получают 0,030 г (70%) продукта в виде бежевого твердого вещества; Т.пл. 226-228°С; ЯМР δн (400 МГц, ДМСО-d6) 1,07 (9Н, с), 1,17 (3Н, д, J 6,5 Гц), 2,56 (2Н, м), 2,65 (2Н, м), 2,80 (1Н, дд, J 11,5, 13,5 Гц), 2,89 (2Н, т, J 6,5 Гц), 2,94 (1Н, м), 3,25 (1Н, м), 3,79 (3Н, с), 4,02 (2Н, т, J 7 Гц), 6,71 (1Н, дд, J 2,5, 8,5 Гц), 7,17 (1Н, с), 7,20 (1H, д, J 8,5 Гц).
Пример 16. Гидрохлорид (RS)-N-(3-метилбутил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина
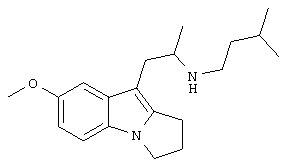
Гидрохлорид (RS)-N-(3-метилбутил)-1-[(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)]-2-пропиламина получают из (RS)-(7-метокси-2,3-дигидро-1Н-пирроло[1,2-а]индол-9-ил)-2-пропиламина и 3-метилбутиральдегида в соответствии со способом, описанным в примере 12, и получают 0,016 г (38%) продукта в виде бежевого твердого вещества; Т.пл. 118-121°С; ЯМР δн (400 МГц, ДМСО-d6) 0,92 (6Н, д, J 14,5 Гц), 1,17 (3Н, д, J 6,5 Гц), 1,55 (2Н, м), 1,67 (2Н, м), 2,55 (2Н, м), 2,74 (1Н, дд, J 10, 14 Гц), 2,94 (2Н, м), 2,97 (2Н, м), 3,19 (1Н, дд, J 4, 14 Гц), 3,78 (3Н, с), 4,02 (2Н, т, J 7 Гц), 6,71 (1Н, дд, J 2,5, 8,5 Гц), 7,08 (1Н, д, J 2,5 Гц), 7,19 (1Н, д, J 8,5 Гц).
Пример 17. Фумарат (RS)-1-(2-метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)-2-пропиламина

5-Метоксииндол-3-карбоксальдегид
К диметилформамиду при перемешивании добавляют по каплям оксихлорид фосфора. Смесь перемешивают в течение 10 мин и добавляют по каплям раствор 5-метоксииндола в диметилформамиде. Смесь нагревают при 40°С в течение 45 мин, охлаждают до комнатной температуры и затем обрабатывают раствором гидроксида натрия в воде. Смесь нагревают при 50°С в течение 10 мин, охлаждают до комнатной температуры, выливают на измельченный лед и фильтруют. Остаток на фильтре перекристаллизовывают (метанол) и получают продукт в виде белого твердого вещества.
5-Метокси-1-(4-хлорбутил)индол-3-карбоксальдегид
К смеси измельченного гидроксида калия и метилсульфоксида при перемешивании добавляют по каплям раствор 5-метоксииндол-3-карбоксальдегида в метилсульфоксиде. Смесь перемешивают в течение 30 мин и добавляют по каплям 1-бром-4-хлорбутан. Смесь перемешивают в течение 1 ч и обрабатывают этилацетатом и водой. Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме, и получают продукт.
5-Метокси-1-(4-иодбутил)индол-3-карбоксальдегид
Раствор 5-метокси-1-(4-хлорбутил)индол-3-карбоксальдегида и иодида натрия в ацетонитриле при перемешивании в атмосфере аргона кипятят с обратным холодильником в течение 18 ч, охлаждают до комнатной температуры и обрабатывают эфиром и водой. Объединенные органические экстракты промывают (водный раствор метабисульфита натрия, вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме, и получают продукт.
2-Метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-карбоксальдегид
К раствору 5-метокси-1-(4-иодбутил)индол-3-карбоксальдегида в толуоле при перемешивании и кипячении с обратным холодильником в атмосфере аргона добавляют по каплям в течение 2 ч раствор 1,1'-азобис(циклогексанкарбонитрила) и гидрида три-н-бутилолова в толуоле. Смесь перемешивают в течение 3 ч, охлаждают до комнатной температуры и добавляют фторид калия и воду. Смесь перемешивают в течение 18 ч и фильтруют через слой кизельгура. Остаток на фильтре промывают (этилацетат), фильтрат концентрируют в вакууме и остаток очищают колоночной хроматографией, и получают продукт.
1-(2-Метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)-2-нитро-1-пропен
Раствор 2-метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-карбоксальдегида и ацетата аммония в нитроэтане при перемешивании нагревают при 100°С в течение 1 ч, охлаждают до комнатной температуры и обрабатывают этилацетатом и водой. Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме, и получают продукт.
Фумарат (RS)-1-(2-метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)-2-пропиламина
К раствору алюмогидрида лития в тетрагидрофуране при перемешивании в атмосфере аргона добавляют по каплям раствор 1-(2-метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)-2-нитро-1-пропена в тетрагидрофуране. Смесь кипятят с обратным холодильником в течение 4 ч и охлаждают до 0°С. К смеси добавляют по каплям водный раствор калийнатрийтартрата и смесь перемешивают в течение 30 мин и фильтруют через кизельгур. Фильтрат экстрагируют дихлорметаном. Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме, остаток растворяют в горячем 2-пропаноле, и этот раствор при 50°С при перемешивании добавляют по каплям к раствору фумаровой кислоты в 2-пропаноле. Смесь охлаждают до 0°С и фильтруют. Остаток на фильтре промывают (2-пропанол, эфир) и сушат, и получают продукт.
Пример 18. Фумарат (RS)-1-(2-метокси-7,8,9,10-тетрагидро-6Н-азепино[1,2-а]индол-11-ил)-2-пропиламина
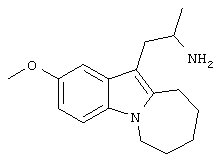
5-Метоксииндол-3-карбоксальдегид
К диметилформамиду при перемешивании добавляют по каплям оксихлорид фосфора. Смесь перемешивают в течение 10 мин и добавляют по каплям раствор 5-метоксииндола в диметилформамиде. Смесь нагревают при 40°С в течение 45 мин, охлаждают до комнатной температуры и затем обрабатывают раствором гидроксида натрия в воде. Смесь нагревают при 50°С в течение 10 мин, охлаждают до комнатной температуры, выливают на измельченный лед и фильтруют. Остаток на фильтре перекристаллизовывают (метанол) и получают продукт в виде белого твердого вещества.
5-Метокси-1-(5-хлорпентил)индол-3-карбоксальдегид
К смеси измельченного гидроксида калия и метилсульфоксида при перемешивании добавляют по каплям раствор 5-метоксииндол-3-карбоксальдегида в метилсульфоксиде. Смесь перемешивают в течение 30 мин и добавляют по каплям 1-бром-5-хлорпентан. Смесь перемешивают в течение 1 ч и обрабатывают этилацетаом и водой. Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме и получают продукт.
5-Метокси-1-(5-иодпентил)индол-3-карбоксальдегид
Раствор 5-метокси-1-(5-хлорпентил)индол-3-карбоксальдегида и иодида натрия в ацетонитриле при перемешивании в атмосфере аргона кипятят с обратным холодильником в течение 18 ч, охлаждают до комнатной температуры и обрабатывают эфиром и водой. Объединенные органические экстракты промывают (водный раствор метабисульфита натрия, вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме и получают продукт.
2-Метокси-7,8,9,10-тетрагидро-6Н-азепино[1,2-а]индол-11-карбоксальдегид
К раствору 5-метокси-1-(5-иодпентил)индол-3-карбоксальдегида в толуоле при перемешивании и кипячении с обратным холодильником в атмосфере аргона добавляют по каплям в течение 2 ч раствор 1,1'-азобис(циклогексанкарбонитрила) и гидрида три-н-бутилолова в толуоле. Смесь перемешивают в течение 3 ч, охлаждают до комнатной температуры и добавляют фторид калия и воду. Смесь перемешивают в течение 18 ч и фильтруют через слой кизельгура. Остаток на фильтре промывают (этилацетат), фильтрат концентрируют в вакууме и остаток очищают колоночной хроматографией и получают продукт.
1-(2-Метокси-7,8,9,10-тетрагидро-6Н-азепино[1,2-а]-индол-11-ил)-2-нитро-1-пропен
Раствор 2-метокси-7,8,9,10-тетрагидро-6Н-азепино[1,2-а]индол-11-карбоксальдегида и ацетата аммония в нитроэтане при перемешивании нагревают при 100°С в течение 1 ч, охлаждают до комнатной температуры и обрабатывают этилацетатом и водой. Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия) и концентрируют в вакууме и получают продукт.
Фумарат (RS)-1-(2-метокси-7,8,9,10-тетрагидро-6Н-азепино[1,2-а]индол-11-ил)-2-пропиламина
К раствору алюмогидрида лития в тетрагидрофуране при перемешивании в атмосфере аргона добавляют по каплям раствор 1-(2-метокси-7,8,9,10-тетрагидро-6Н-азепино[1,2-а]индол-11-ил)-2-нитро-1-пропена в тетрагидрофуране. Смесь кипятят с обратным холодильником в течение 4 ч и охлаждают до 0°С. К смеси добавляют по каплям водный раствор калийнатрийтартрата и смесь перемешивают в течение 30 мин и фильтруют через кизельгур. Фильтрат экстрагируют дихлорметаном. Объединенные органические экстракты промывают (вода, рассол), сушат (сульфат натрия), концентрируют в вакууме, остаток растворяют в горячем 2-пропаноле, и этот раствор при 50°С при перемешивании добавляют по каплям к раствору фумаровой кислоты в 2-пропаноле. Смесь охлаждают до 0°С и фильтруют. Остаток на фильтре промывают (2-пропанол, эфир) и сушат и получают продукт.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
| ТРИЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ И ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2023712C1 |
| НОВЫЕ ИНДОЛИЗИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2013 |
|
RU2646223C2 |
| ПРОИЗВОДНЫЕ ПИРИДАЗИНОХИНОЛИНА | 1994 |
|
RU2279432C2 |
| ЗАМЕЩЕННЫЕ 4-ИМИДАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2456281C2 |
| ПРОИЗВОДНЫЕ 3-ОКСО-1-ЦИКЛОБУТЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2296753C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ КАТЕПСИНА S | 2001 |
|
RU2278863C2 |
| КОНЪЮГАТЫ VAR2CSA-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2714933C2 |
| РАЦЕМИЧЕСКИЕ И ОПТИЧЕСКИЕ АКТИВНЫЕ ПРОИЗВОДНЫЕ ТЕТРАЛИНА И 7-ГИДРОКСИТЕТРАЛИНА | 1992 |
|
RU2073673C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИН-2,4-ДИАМИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2672916C2 |
Изобретение относится к химическим соединениям общей формулы I: 
где n равно 1, 2 или 3; R1 и R2 независимо выбирают из водорода и алкила; R3 представляет собой алкил; R4-R7 независимо выбирают из водорода, галогена, гидрокси, алкила, арила, алкокси, арилокси, алкилтио, арилтио, алкилсульфоксила, алкилсульфонила, арисульфоксила, арилсульфонила, амино, моноалкиламино, диалкиламино, нитро, циано, карбоксальдегида, алкилкарбонила, арилкарбонила, аминокарбонила, моноалкиламинокарбонила, диалкиламинокарбонила, алкоксикарбониламино, аминокарбонилокси, моноалкиламинокарбонилокси, диалкиламинокарбонилокси, моноалкиламинокарбониламино и диалкиламинокарбониламино, или R5 и R6 вместе образуют карбоциклическое или гетероциклическое кольцо, его фармацевтически приемлемые соли и пролекарства и способу лечения и фармацевтической композиции, обладающей свойствами агониста 5-НТ2. 3 н. и 27 з.п.ф-лы, 2 табл.
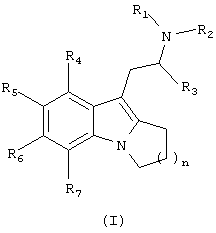
где n=1, 2 или 3;
R1 и R2 независимо выбирают из водорода и алкила;
R3 представляет собой алкил;
R4-R7 независимо выбирают из водорода, галогена, гидрокси, алкила, арила, алкокси, арилокси, алкилтио, арилтио, алкилсульфоксила, алкилсульфонила, арисульфоксила, арилсульфонила, амино, моноалкиламино, диалкиламино, нитро, циано, карбоксальдегида, алкилкарбонила, арилкарбонила, аминокарбонила, моноалкиламинокарбонила, диалкиламинокарбонила, алкоксикарбониламино, аминокарбонилокси, моноалкиламинокарбонилокси, диалкиламинокарбонилокси, моноалкиламинокарбониламино и диалкиламинокарбониламино, или R5 и R6 вместе образуют карбоциклическое или гетероциклическое кольцо,
и его фармацевтически приемлемые соли и пролекарства.
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ПИРРОЛОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2014332C1 |
| ПРОИЗВОДНЫЕ 5-АРИЛИНДОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АГОНИСТОВ СЕРОТОНИНА (5-НТ) | 1993 |
|
RU2134266C1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| US 3250783 A, 09.08.1989 | |||
| ЛИСТОПОДАЮЩИЙ МЕХАНИЗМ ПЕЧАТНЫХ МАШИН | 0 |
|
SU167901A1 |
| СПОСОБ ВОЗВЕДЕНИЯ КУПОЛЬНОГО СООРУЖЕНИЯ | 0 |
|
SU327307A1 |
| BOS M.j EHK et | |||
| al | |||
| European journal of Medicinal chemistry | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| BOS et | |||
| al | |||
| j | |||
| Med | |||
| chem | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
Авторы
Даты
2004-07-10—Публикация
1999-09-01—Подача