Изобретение относится к области медицины, а именно к аллергологии, пульмонологии, дерматологии, ветеринарии, биологии, и может быть использовано для выявления причинно-значимых аллергенов у больных с аллергическими заболеваниями, для изучения механизмов действия различных фармакологических препаратов (в частности, блокаторов гистаминных рецепторов) и т.д. с помощью реакций непрямой дегрануляции тучных клеток крыс, либерации различных биологически активных веществ из тучных клеток крыс и т.п. реакций.
Наиболее близким к заявленному решению по совокупности существенных признаков является способ получения перитонеальных тучных клеток лабораторных крыс [1]. Способ, принятый за прототип, включает следующие действия. Для получения перитонеальных тучных клеток крысы используют крыс, преимущественно самцов, массой 140-200 г. Животных забивают путем кровопускания из сонной артерии, после чего им вводят внутрибрюшинио питательный раствор для культивирования тучных клеток - 6-8 мл подогретого (37°С) раствора Тироде без глюкозы или раствора “Хемоцелл”. После введения указанного раствора в продолжение 1-1 1/2 мин производят легкий массаж передней стенки живота и затем по его средней линии делают (с помощью ножниц) послойный разрез длиной 1,5-2 см. Тушку осторожно переворачивают разрезом вниз с тем, чтобы из нее свисали петли кишечника. Подставляют к петлям пробирку, смоченную гепарином, и собирают перитонеальную взвесь, содержащую тучные клетки. Для получения антикоагулирующего эффекта ее осторожно перемешивают и в продолжение всего исследования хранят при 37°С.
Способ-прототип [1] не позволяет получить технический результат, достигаемый при использовании заявленного способа, по следующим причинам. Наружный массаж брюшной полости крысы, предусмотренный методикой способа-прототипа, способствует механическому разрушению межклеточных связей тучных клеток и клеток брюшины. Однако при подобном воздействии происходит высвобождение тучных клеток только с отделов брюшины, доступных воздействию при наружном массаже брюшной полости, в частности с отделов брюшины, покрывающих вентральные участки кишечной стенки, а также с отделов брюшины, обращенных к вентральной поверхности стенки живота. Это обусловливает относительно низкий выход тучных клеток крыс. Кроме того, используемый метод забивания крысы является относительно сложным по технике выполнения и мало гуманным по отношению к экспериментальному животному.
Задачей изобретения является создание способа получения перитонеальных тучных клеток лабораторных крыс, обеспечивающего повышение выхода тучных клеток крыс при отсутствии негативного воздействия на функциональные и физиологические свойства указанных клеток, необходимые для постановки лабораторных реакций, за счет создания условий для механического разрушения межклеточных связей тучных клеток и клеток брюшины в межкишечных петлях, в отделах брюшины, покрывающих дорзальные участки кишечной стенки, и в брыжейке, а также за счет изменения адгезивных свойств тучных клеток и клеток брюшины.
Поставленная задача решается тем, что в способе получения перитонеальных тучных клеток лабораторных крыс, включающем забивание крысы, введение внутрибрюшинного питательного раствора для культивирования тучных клеток, массаж живота крысы, вскрытие брюшной полости и сбор перитонеальной взвеси, содержащей тучные клетки, согласно изобретению перед началом процедуры забивания крысе дополнительно вводят прозерин. Наиболее эффективно, когда прозерин вводят крысе за 1-10 мин до начала процедуры забивания в дозе 0,1-0,4 мг/кг массы тела животного. При этом оптимальным является введение прозерина крысе подкожно в виде 0,05%-ного раствора. Наиболее эффективным является также забивание крысы путем ее усыпления под наркозом.
Выявление в совокупности действий заявленного способа причинно-значимых параметров (т.е. параметров, влияющих на достижение технического результата) осуществляли следующим образом. В качестве потенциальных причинно-значимых параметров рассматривали:
- введение прозерина (параметр, отражающий действие);
- время между введением прозерина и началом процедуры усыпления животного (количественный параметр, отражающий условие осуществления действия);
- дозу прозерина (количественный параметр, отражающий условие осуществления действия).
Оценивали наличие или отсутствие влияния каждого из рассматриваемых параметров на достижение заявленного технического результата. Кроме того, производили выбор оптимальных значений количественных параметров, как оптимальных условий осуществления заявленного дополнительного (по отношению к методике прототипа) действия способа, обеспечивающих наибольшую эффективность при реализации последнего.
Было проведено две серии опытов с введением прозерина перед началом процедуры усыпления животного (наличие параметра - действия). В каждой из серий осуществляли варьирование одного из указанных количественных параметров-условий при оптимальном значении другого количественного параметра-условия. Экспериментальные исследования выполняли на белых лабораторных крысах-самцах массой 150-170 г. Каждое значение варьируемого параметра-условия испытывали на группе животных, состоящей из 5 особей. Крыс усыпляли с помощью ингаляционного эфирного наркоза.
В I серии опытов крысам вводили подкожно 0,05%-ный раствор прозерина в дозе 0,3 мг/кг массы тела животного за 1, 5, 10, 15, 20, 30 и 60 мин до начала процедуры усыпления (опытные группы). Нижняя граница (1 мин) исследуемого временного интервала, установленная по результатам хронометрирования автора изобретения, представляет собой минимальное время, необходимое для подготовки крысы к усыплению под наркозом (отбор необходимой для опыта крысы, помещение отобранной крысы в емкость небольшого объема, внесение в емкость марлевого тампона, пропитанного эфиром, герметизация емкости). Верхняя граница (60 мин) исследуемого временного интервала лимитирована фармакокинетическими свойствами препарата. Во II серии опытов крысам вводили подкожно 0,05%-ный раствор прозерина в дозах 0,05; 0,1; 0,2; 0,3; 0,4; 0,5 и 1,0 мг/кг массы тела животного за 5 мин до начала процедуры усыпления (опытные группы). Контрольную группу для I и II серий опытов составляли животные, которым прозерин не вводили (отсутствие параметра - действия). В каждой из опытных групп каждой серии опытов и в контрольной группе определяли выход тучных клеток крыс (среднее значение), количество крыс, у которых наблюдались побочные проявления действия прозерина (по результатам наблюдений), а также процент поврежденных тучных клеток крыс. Выход тучных клеток определяли путем микроскопии в камере Горяева. Определение процента поврежденных тучных клеток проводили с помощью приемов, предусмотренных в ходе постановки реакции непрямой дегрануляции тучных клеток крыс (в модификации Л.М. Ишимовой и Л.И. Зеличенко) [1]. При этом перитонеальную взвесь, полученную от крысы, наносили на предметные стекла, предварительно окрашенные 0,3%-ным раствором нейтрального красного, приготовленным на абсолютном спирте, и накрывали покровными стеклами. Проводили микроскопию препаратов и подсчитывали количество поврежденных тучных клеток в процентах от общего числа сосчитанных тучных клеток.
Статистическую обработку результатов проводили с использованием критериев Стьюдента, Вилкоксона-Манна-Уитни, Фишера [3, 4].
Результаты исследований приведены в табл. 1, 2.
Из данных, представленных в табл. 1 (I серия опытов), видно, что при введении прозерина за 1-60 мин до начала процедуры усыпления (при оптимальной дозе препарата), выход тучных клеток крыс в пределах всего анализируемого временного интервала превышает аналогичный показатель, полученный в контрольной группе (без введения прозерина). При этом путем статистической обработки данных с использованием критерия Вилкоксона-Манна-Уитни установлено, что различия между значением указанного показателя каждой из опытных групп и значением этого показателя в контрольной группе являются статистически достоверными. Из данных табл. 1 также следует, что время между ведением прозерина и началом процедуры усыпления, составляющее 1-10 мин, является оптимальным, т.к. позволяет получить максимальное количество тучных клеток крыс при отсутствии каких-либо клинически проявляющихся побочных эффектов действия прозерина, а также при минимальном количестве поврежденных тучных клеток (0,5-1,2%). При увеличении временного промежутка между введением прозерина и началом процедуры усыпления свыше 10 мин нарастает частота побочных проявлений действия прозерина как на уровне организма крыс, так и на клеточном уровне. Так, начиная с 15 мин, увеличивается количество особей, у которых наблюдается двигательное возбуждение, понос, частое мочеиспускание, гиперсаливация, рвота, что усложняет проведение эксперимента. В это же время возрастает процент поврежденных тучных клеток (разрыв мембран, выход гранул из клетки), не превышая, при этом, предусмотренную методикой постановки реакции непрямой дегрануляции тучных клеток крыс [1] допустимую дегрануляцию в контролях (10%). Таким образом, указанный негативный эффект прозерина не приводит к значимому ухудшению качества получаемых тучных клеток крыс и не является принципиальным препятствием для их использования для постановки реакции непрямой дегрануляции тучных клеток крыс и в других диагностических тестах.
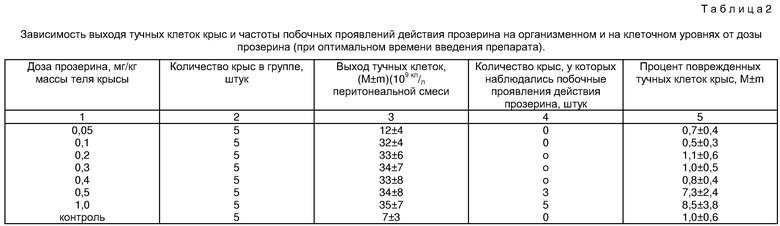
Данные, представленные в табл. 2 (II серия опытов), показывают, что при введении прозерина в дозах 0,05-1 мг/кг массы тела крысы (при оптимальном времени введения), количество полученных тучных клеток крыс значимо выше, чем в отсутствие указанного препарата. При этом различия между значением указанного показателя в каждой из опытных групп и значением этого показателя в контрольной группе так же, как и в I серии опытов, являются статистически достоверными (статистическая обработка с помощью критерия Вилкоксона-Манна-Уитни). Из табл.1 также видно, что использование прозерина в дозах 0,1-0,4 мг/кг массы тела крысы является оптимальным, т.к. обеспечивает максимальный выход тучных клеток при отсутствии каких-либо клинически проявляющихся побочных эффектов прозерина, а также при минимальном количестве поврежденных тучных клеток (0,5-1,1%). При введении прозерина в дозах менее 0,1 мг/кг массы тела животного выход тучных клеток снижается, оставаясь при этом достоверно более высоким, чем аналогичный показатель контрольной группы (различия статистически достоверны). При увеличении дозы препарата свыше 0,4 мг/кг массы тела крысы нарастает частота побочных проявлений действия прозерина как на уровне организма крыс, так и на клеточном уровне. Так, при использовании прозерина в дозах 0,5 и 1,0 мг/кг массы тела крысы количество животных, у которых отмечены побочные эффекты действия прозерина (двигательное возбуждение, понос, частое мочеиспускание, гиперсаливация, рвота) составляет, соответственно, 3 и 5 особей. При указанных дозах возрастает также процент поврежденных тучных клеток (разрыв мембран, выход гранул из клетки), не превышая, при этом, предусмотренную методикой постановки реакции непрямой дегрануляции тучных клеток крыс [1] допустимую дегрануляцию в контролях (10%). Указанный негативный эффект прозерина так же, как и в I серии опытов, значимо не ухудшает качество получаемого клеточного материала и не является принципиальным препятствием для его дальнейшего использования в диагностических тестах.
Таким образом, экспериментальные исследования показали, что в заявленном способе причинно-значимым параметром является дополнительное (по отношению к методике способа-прототипа) действие “введение прозерина”. Оптимальные условия осуществления указанного действия (оптимальное время между введением препарата и началом процедуры усыпления и оптимальная доза препарата) обеспечивают дополнительное усиление технического результата (максимальный выход тучных клеток крыс), а также достижение дополнительных преимуществ (отсутствие побочных проявлений действия прозерина на организменном и на клеточном уровнях, которые сами по себе не являются принципиальным препятствием для реализации заявленного способа).
Достижение обеспечиваемого изобретением технического результата обусловлено следующим. Известно, что прозерин [N-(мета-Диметилкарбамоилоксифенил)-триметиламмоний метилсульфат] относится к препаратам - ингибиторам ацетилхолинестеразы. Он препятствует разрушению ауетилхолина, способствуя, тем самым, его накоплению в области синапсов и усилению его действия на ацетилхолиновые рецепторы на различных мышцах, в т.ч. на мышцах кишечника, вызывая их сокращение [2]. Однако не обнаружено источников информации, где было бы указано, что прозерин способствует высвобождению каких-либо клеток с поверхности брюшины при сокращении кишечника, а также источников, где были бы описаны изменения функциональных и/или физиологических свойств тучных клеток крыс, ответственных за прикрепление этих клеток к брюшине, под воздействием прозерина.
Увеличение выхода тучных клеток крыс при введении прозерина в брюшную полость крысы перед ее усыплением может быть вызвано следующим. Сокращение кишечника и механическое воздействие сокращающихся петель кишечника на брюшину в результате усиленной перистальтики под действием прозерина способствует разрушению межклеточных связей тучных клеток и клеток брюшины, что приводит к механическому отделению дополнительного количества тучных клеток с поверхности брюшины. При этом механическое сокращение кишечника при введении прозерина, по-видимому, воздействует не только на отделы брюшины, покрывающие вентральные участки кишечной стенки, и на отделы брюшины, обращенные к вентральной поверхности стенки живота, но и на межкишечные петли, на отделы брюшины, покрывающие дорзальные участки кишечной стенки, а также на брыжейку, т.е. на области брюшины, практически недоступные для воздействия при наружном массаже брюшной полости. Кроме того, при сокращении кишечника высвобождаются биологически активные вещества (цитокины, интерлейкины, хемокины и т.п.), которые могут приводить к ослаблению способности тучных клеток крыс удерживаться на поверхности брюшины вследствие изменения функциональных и/или физиологических свойств тучных клеток, ответственных за прикрепление последних к брюшине. Подобное изменение свойств тучных клеток может быть обусловлено, в частности, тем, что указанные биологически активные вещества могут воздействовать непосредственно на адгезивные молекулы тучных клеток, блокируя их адгезивные свойства, и/или тем, что эти биологически активные вещества могут уменьшать синтез и экспрессию адгезивных молекул на поверхности тучных клеток. Возможно также, что указанные биологически активные вещества могут влиять не только на адгезивные свойства тучных клеток крыс, но и на адгезивные свойства клеток брюшины, к которым прикрепляются тучные клетки. Вместе с тем, экспериментальные данные (табл. 3) позволили сделать вывод, что прозерин не оказывает влияния на клеточные механизмы, отвечающие за дегрануляцию тучных клеток крыс. Все это способствует увеличению выхода тучных клеток крыс при относительно высоком качестве получаемого клеточного материала (сопоставимом с качеством клеточного материала, полученного с помощью способа-прототипа).
Кроме того, заявленная последовательность действий и условий их осуществления обеспечивают дополнительное усиление технического результата, а также достижение дополнительных преимуществ в частных конкретных случаях реализации изобретения. Так, именно в заявленном (оптимальном) временном интервале между введением прозерина и началом процедуры усыпления (1-10 мин) ацетилхолин в организме крысы накапливается в концентрациях, необходимых и достаточных для того, чтобы обеспечить максимально возможное под действием препарата сокращение кишечной стенки, оставаясь, при этом, в пределах диапазона физиологически безвредных для организма крыс концентраций указанного вещества. Это обусловливает максимальный выход тучных клеток крыс при отсутствии каких-либо побочных эффектов на организменном уровне, а также при минимальном количестве поврежденных тучных клеток (0,5-1,2%). Учитывая, что указанный процент поврежденных тучных клеток не отличается от значения (1,0%) аналогичного показателя в контроле (без введения прозерина), а также то, что тучные клетки нормальных крыс не имеют тенденции к спонтанной дегрануляции [1], можно сделать вывод об отсутствии какого-либо повреждающего действия в отношении тучных клеток со стороны ацетилхолина при оптимальном времени введения последнего. В данном случае, по-видимому, имеет место механическое повреждение клеток при манипулировании с растворами в ходе осуществления способа. При увеличении временного периода между введением прозерина и началом процедуры усыпления свыше 10 мин происходит накопление ацетилхолина в концентрациях, превышающих физиологически безвредные для организма крыс концентрации указанного вещества. Это приводит к тому, что действие прозерина распространяется на другие участки мускулатуры крысы (скелетная мускулатура, мочевыводящие пути, терминальные отделы кишечника), обуславливая возникновение нежелательных в данном случае побочных эффектов (двигательное возбуждение, понос, частое мочеиспускание, гиперсаливация, рвота). Кроме того, накапливающийся в избыточных концентрациях ацетилхолин становится определяющим фактором повреждающего действия в отношении тучных клеток крыс, вызывая дегрануляцию указанных клеток (не превышающую процент допустимой дегрануляции в контролях [1]) за счет действия на их ацетилхолиновые рецепторы.
Аналогичным образом, именно в заявленном (оптимальном) интервале доз прозерина (0,1-0,4 мг/кг массы тела крысы) ацетилхолин накапливается в концентрациях, необходимых и достаточных для обеспечения максимально возможного под действием препарата сокращения кишечной стенки, не выходя, при этом, за пределы диапазона физиологически безвредных для организма крыс концентраций указанного вещества. Это приводит к достижению результата, аналогичного описанному выше для оптимального временного диапазона (максимальное количество получаемых тучных клеток крыс при отсутствии каких-либо побочных эффектов на организменном и на клеточном уровнях). При введении прозерина в дозах менее 0,1 мг/кг массы тела животного указанный препарат в организме крысы не достигает концентраций, необходимых и достаточных для обеспечения максимально возможного под действием препарата сокращения кишечной стенки, что обусловливает более низкий выход тучных клеток крыс. Использование прозерина в дозах, превышающих верхнюю границу интервала оптимальных значений (т.е. свыше 0,4 мг/кг массы тела животного), приводит к накоплению ацетилхолина в концентрациях, превышающих физиологически безвредные для организма крыс концентрации. Это приводит, как описано выше, к возникновению нежелательных побочных эффектов, проявляющихся как на уровне организма, так и на клеточном уровне. Таким образом, реализация заявленного способа при оптимальных условиях его осуществления, обеспечивая отсутствие нежелательных побочных проявлений действия прозерина как на организменном, так и на клеточном уровнях, способствует, тем самым, упрощению процедуры получения тучных клеток крыс и дополнительному повышению качества получаемого клеточного материала.
Подкожное введение прозерина в виде раствора обеспечивает возможность более точной дозировки препарата у лабораторных животных и более быстрое его действие по сравнению с пероральным приемом. Усыпление крыс под наркозом технически более просто (по сравнению с процедурой забивания, предусмотренной в способе-прототипе) и более гуманно по отношению к экспериментальным животным.
Таким образом, введение дополнительного (по сравнению с совокупностью действий способа-прототипа) действия обеспечивает создание условий для механического разрушения межклеточных связей тучных клеток крыс и клеток брюшины в межкишечных петлях; в отделах брюшины, покрывающих дорзальные участки кишечной стенки; в брыжейке, а также возможность изменения адгезивных свойств тучных клеток и клеток брюшины. Это, в свою очередь, позволяет повысить выход тучных клеток крыс при отсутствии негативного воздействия на функциональные и физиологические свойства указанных клеток, необходимые для постановки лабораторных реакций. При этом, из известного уровня техники не выявляется, по мнению заявителя, влияния предписываемых изобретением преобразований, характеризуемых отличительными от прототипа существенными признаками, на достижение технического результата.
Способ осуществляют следующим образом. Для получения перитонеальных тучных клеток крысы используют лабораторных белых крыс, преимущественно самцов, массой 140-200 г. За 1-10 мин до начала процедуры усыпления крысе вводят подкожно 0,05%-ный раствор прозерина в дозе 0,1-0,4 мг/кг массы тела животного. Затем крысу усыпляют под наркозом. Для усыпления применяют, например, ингаляционный эфирный, хлороформный наркоз [5], наркоз с помощью фторотана и т.п. При этом животное помещают в емкость небольшого объема, предусматривающую возможность ее герметизации, или под стеклянный колпак, в которые вносят средство для наркоза, например марлевый тампон, пропитанный одним из указанных средств. После окончания процедуры усыпления крысе вводят внутрибрюшинно 6-8 мл подогретого до 37°С раствора Тироде без глюкозы или раствора “Хемоцелл”. Состав раствора “Хемоцелл” г,: желатина 8,5; NaCl 8,5; КСl 0,38; СаСl2 0,7 и дистиллированная вода до 1 л. После введения указанного раствора производят легкий массаж передней стенки живота крысы в течение 1-2 мин. Затем проводят послойное вскрытие брюшной полости путем разреза (например, с помощью ножниц) передней стенки живота по средней линии (длина разреза 1,5-2 см). Тушку осторожно переворачивают разрезом вниз так, чтобы из нее свисали петли кишечника. Подставляют к петлям емкость (например, лабораторный стаканчик, пробирку и т.п.), смоченную антикоагулянтом, например гепарином, и собирают в нее перитонеальную взвесь, содержащую тучные клетки. Для получения антикоагулирующего эффекта ее осторожно перемешивают и хранят при 37°С в продолжение всего исследования. Выход тучных клеток крыс составляет в среднем (39±3)·109 клеток/л перитонеалыюй взвеси.
Пример
Белой лабораторной крысе-самцу массой 170 г за 5 мин перед усыплением ввели подкожно 0,1 мл 0,05%-ного раствора прозерина (что составило 0,05 мг/крысу или 0,3 мг/кг массы тела крысы). Крысу усыпили под эфирным наркозом. При этом животное поместили в емкость небольшого объема, предусматривающую возможность ее герметизации, внесли в указанную емкость марлевый тампон, пропитанный эфиром (15 мл), и загерметизировали емкость. После окончания процедуры усыпления крысе ввели внутрибрюшинно 8 мл подогретого до 37°С раствора “Хемоцелл” следующего состава г,: желатина 8,5; NaCl 8,5; КСl 0,38; СаСl2 0,7 и дистиллированная вода до 1 л. После введения раствора “Хемоцелл” выполнили легкий массаж передней стенки живота крысы в течение 2 мин, затем по его средней линии сделали с помощью ножниц послойный разрез длиной 2 см. Тушку осторожно перевернули разрезом вниз так, чтобы из нее свисали петли кишечника. Подставляя к петлям лабораторный стаканчик, смоченный гепарином, собрали в него перитонеальную взвесь, содержащую тучные клетки. Для получения антикоагулирующего эффекта полученную перитонеальную взвесь осторожно перемешали. Получили 6,5 мл перитонеальной взвеси. Выход тучных клеток составил 37·109 клеток/л перитонеальной взвеси.
Заявленный способ был применен на 50 крысах для получения перитонеальной взвеси, содержащей тучные клетки. Аналогичный клеточный материал был получен у 50 крыс по методике способа-прототипа [1]. Выход тучных клеток крыс при использовании заявленного способа и способа-прототипа составил соответственно (39±3)·109 клеток/л перитонеальной взвеси и (8±1)·109 клеток/л перитонеальной взвеси.
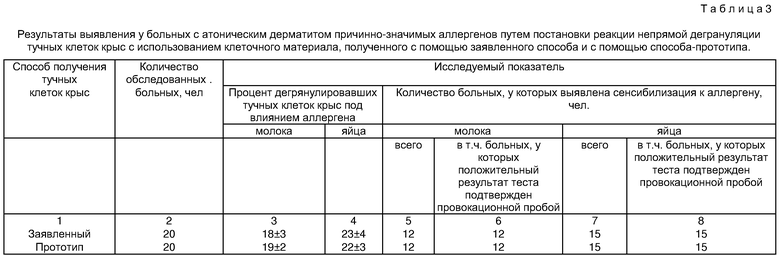
Качество полученного с помощью заявленного способа клеточного материала оценивали путем постановки реакции непрямой дегрануляции тучных клеток крыс (в модификации Л.М. Ишимовой и Л.И. Зеличенко [1]) для выявления причинно-значимых аллергенов у 20 больных с атоническим дерматитом. Параллельно у этих же больных осуществляли постановку указанного диагностического теста с использованием клеточного материала, полученного по методике способа-прототипа [1]. В качестве специфических аллергенов (пищевого происхождения), рассматриваемых как факторы сенсибилизации, в обоих случаях использовали аллергены коровьего молока и белка куриного яйца. В обоих случаях определяли процент дегранулировавших под влиянием аллергена тучных клеток крыс и количество больных с положительными результатами указанного теста (т.е. количество больных, у которых выявлена сенсибилизация к исследуемому аллергену). Положительный результат теста непрямой дегрануляции тучных клеток крыс в обоих случаях подтверждали с помощью провокационной пробы с соответствующим пищевым аллергеном. Проводили сопоставление результатов обследования, полученных с помощью двух вариантов теста, и по результатам сопоставления судили о качестве клеточного материала, полученного по методике заявленного способа.
Результаты проведенного обследования представлены в табл. 3. Из данных табл. 3 видно, что значения анализируемых показателей, полученные при обследовании одних и тех же больных с применением двух вариантов теста (с использованием клеточного материала, полученного, соответственно, с помощью заявленного способа и с помощью способа-прототипа), либо совпадают, либо различия между ними являются статистически недостоверными. Отсутствие статистически значимых различий между полученными при использовании двух вариантов теста величинами исследуемых показателей (процент дегранулировавших тучных клеток крыс и количество больных с положительным результатом теста) свидетельствует о том, что прозерин значимо не влияет на функциональные и/или физиологические свойства тучных клеток, необходимые для постановки диагностических тестов, в частности теста непрямой дегрануляции указанных клеток.
Таким образом, заявленный способ при его реализации обеспечивает повышение выхода тучных клеток крыс в среднем в 5 раз по сравнению со способом-прототипом. При этом относительно высокое качество получаемого по методике заявленного способа клеточного материала обусловливает сопоставимость результатов диагностических тестов, в которых использован указанный материал, с аналогичными результатами тестов, которые ставятся с применением клеточного материала, полученного по способу-прототипу.
Источники информации
1. Фрадкин В.А. Аллергодиагностика in vitro. - М.: Медицина, 1975. - С.106-108.
2. Машковский М.Д. Лекарственные средства. В двух частях. -12-е изд., перераб. и доп. - М.: Медицина, 1993.4.1. - С.248-250.
3. Гублер Е.В. Вычислительные методы анализа и распознавания патологических процессов. - Л.: Медицина, 1978. - С.70-86.
4. Методы исследования в иммунологии /Под ред. И. Лефковитса, Б. Перниса. - М.: Мир, 1981.-С.432-435.
5. Ветеринарный энциклопедический словарь. - М.: Советская энциклопедия, 1981. - С.327-328.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ СЕНСИБИЛИЗИРУЮЩИХ СВОЙСТВ КСЕНОБИОТИКОВ | 1991 |
|
RU2012876C1 |
| Биологически активная субстанция и фармацевтическая композиция в виде стерильной водной дисперсии для конъюнктивального в виде капель и субъюнктивального, пара-, ретробульбарного инъекционного введения при проведении терапии сосудистых и дисметаболических офтальмологических заболеваний | 2021 |
|
RU2771678C1 |
| Способ диагностики лимфоцитарного хориоменингита | 1978 |
|
SU774544A1 |
| Субстанция для получения средства, повышающего жизнеспособность и подвижность сперматозоидов млекопитающих | 2018 |
|
RU2725491C2 |
| Белково-пептидный комплекс, повышающий жизнеспособность фолликулов в яичниках млекопитающих | 2017 |
|
RU2660587C1 |
| ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО ХОЛЕСТЕРИНОРЕГУЛИРУЮЩЕГО ДЕЙСТВИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ НАРУШЕНИЕМ ОБМЕНА ХОЛЕСТЕРИНА В ОРГАНИЗМЕ | 1993 |
|
RU2043111C1 |
| КОМПЛЕКСНЫЙ АНТИБАКТЕРИАЛЬНЫЙ ПРЕПАРАТ ДЛЯ ЖИВОТНЫХ | 2014 |
|
RU2554797C1 |
| СПОСОБ НЕЙРОПРОТЕКЦИИ В ЭКСПЕРИМЕНТЕ | 2015 |
|
RU2616509C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО КОМПЛЕКСА И БИОЛОГИЧЕСКИ АКТИВНЫЙ БЕЛКОВО-ПОЛИПЕПТИДНЫЙ КОМПЛЕКС | 2010 |
|
RU2428196C1 |
| ВЕЩЕСТВО ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ИЛИ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 1990 |
|
RU2050156C1 |

Изобретение относится к области медицины и может быть использовано для выявления причинно-значимых аллергенов у больных с аллергическими заболеваниями, для изучения механизмов действия различных фармакологических препаратов. Сущность изобретения состоит в том, что за 1-10 мин до начала процедуры крысе дополнительно вводят прозерин в дозе 0,1-0,4 мг/кг веса подкожно в виде 0,05%-ного раствора. Техническим результатом является повышение выхода тучных клеток крыс при отсутствии негативного воздействия на функциональные и физиологические свойства указанных клеток. 4 з.п. ф-лы, 3 табл.
| КЛИМЕНКО Н.А | |||
| Содержание тучных клеток в брюшной полости белых мышей в динамике сенсибилизации | |||
| Сб | |||
| научн | |||
| тр | |||
| Харьковского медицинского института, 1974, вып.114, с.19-21 | |||
| ВАСАДЗЕ О.Г | |||
| Тучные клетки при экспериментальном асептическом перитоните, вызванном внутрибрюшинном введением крахмала, Патол | |||
| физиол | |||
| и эксперим | |||
| терапия, 1981, вып.5, с.61 и 62. |
Авторы
Даты
2004-08-10—Публикация
2002-12-23—Подача