Область техники, к которой относится изобретение
Изобретение относится к фармацевтическим препаратам и их применению в медицине и, в частности, касается использования лизостафина в способе лечения стафилококковой инфекции у млекопитающих, в том числе человека, а также фармацевтических препаратов, используемых в данном способе.
Уровень техники
Лизостафин представляет собой фермент, идентифицированный в бактериях вида Staphylococcus simulans (ранее известном как S. staphylolyticus), который обладает антимикробной активностью вследствие своей протеолитической активности в отношении глицин-содержащих мостиков в пептидогликане клеточной стенки бактерий [Zygmunt и соавт., Progr. Drug. Res., 16:309-333 (1972)].
In vitro лизостафин является особенно активным в отношении Staphylococcus aureus в следствие относительно высокого содержания глицина в мостиках клеточной стенки данного вида, хотя была продемонстрирована активность в отношении стафилококков других видов (Ibid.).
Активность лизостафина была также исследована на моделях инфекций на животных. Исследования, в которых внутрибрюшинное введение препарата следовало за внутрибрюшинной инфекцией, аналогичны экспериментам in vitro и в данном описании не рассматриваются. Было два сообщения о 50%-ной выживаемости леченых мышей, согласно которым животных инфицировали внутрибрюшинно с последующими однократным или многократными подкожными введениями при общей дозе приблизительно 1 мг/кг препарата лизостафина [Schuhardt и соавт., J. Bacteriol., 88:815-816 (1964); Harrison и соавт., Can. J. Microbiol., 13:93-97 (1967)]. В одном из данных исследований было сообщение о том, что общая доза 6 мг/кг защищает 100% мышей [Harrison и соавт., Ibid.]. Вирулентность контрольного бактериального заражения, использованного в обоих исследованиях, представляется крайне низкой, поскольку ни одна из нелеченых инфицированных мышей не погибла в течение короткого периода времени.
В ряде экспериментов использовали модель подострой инфекции на мышах для определения бактериальной нагрузки в почках после инфекции штаммом S. aureus Giorgio [Dixon и соавт., Jale J. Biol. Med., 41:62-68 (1968); Schaffner и соавт., Yale J. Biol. Med., 39:230-244 (1967); Harrison и соавт., J. Bacteriol., 93:520-524 (1967)]. При внутривенном введении препарата лизостафина через 6 часов после инфекции было отмечено значительное снижение числа бактерий в почках при дозах 1,5 мг/кг или выше. Однако развившиеся инфекции были более резистентными, было отмечено только очень незначительное снижение числа бактерий в случаях, когда лечение задерживали на 24 часа или более, даже при дозах 125 или 250 мг/кг препарата лизостафина. Эффект многократных введений не был изучен.
В единственном исследовании Goldberg и соавт., Antimicrob. Ag. Chemother., 1967:45-53 (1967), использовали ограниченное число собак в модели нехарактерного эндокардита. Модель на собаках в дальнейшем не разрабатывалась. Эксперимент Goldberg и соавт. не был сравнительным и вследствие этого имеет ограниченное применение при оценке введения лизостафина. Однако высокие дозы лизостафина (по меньшей мере, 50 мг/кг/введение) были только умеренно эффективными, что оценивали по состоянию здоровья собак и по уровню снижения числа бактерий в сердечных клапанах и почках.
В соответствии с этим из данных, полученных в исследованиях предшествующего уровня техники с использованием моделей на животных, не следует, что применение лизостафина было бы эффективным и практическим подходом к очищению различных органов от развившихся инфекций.
Целью ограниченных исследований, проведенных на человеке, была ликвидация назального носительства S. aureus посредством наружного введения лизостафина в ноздри [Martin и соавт., J. Lab. Clin. Med., 70:1-8 (1967); Martin и соавт., J. Lab. Clin. Med., 71:791-797 (1968); Quickel и соавт., Appl. Microbiol, 22:446-450 (1971)]. Назальное носительство само по себе не является болезненным состоянием. Оно представляет фактор риска в плане инфекции пациентов, которых лечат колонизированными бактериями сотрудники медико-санитарной помощи, или самоинфекции в случае колонизированного пациента.
В уровне техники описано лечение одного пациента с очень тяжелым заболеванием с помощью однократной дозы парентерально введенного лизостафина с последующим введением антибиотика гентамицина через три дня. Пациент умер, но с проявлением снижения бактериемии [Stark и соавт., N. Engl. J. Med., 291:239-240 (1974)].
Иммуногенные проявления, наблюдаемые во время цикла исследований животных и человека, были отмечены, как требующие особого внимания. Причиной, по меньшей мере, некоторых из данных явлений может быть загрязнение препаратов лизостафина посторонними субстанциями.
Никакая дальнейшая разработка фермента как терапевтического агента не проводилась, в связи с отсутствием желаемой эффективности в описанных исследованиях. Кроме того, это может быть обусловлено трудностью получения и очистки лизостафина.
Стафилококковый ген лизостафина к настоящему времени уже секвенирован и клонирован (патент США N 4931390). Лизостафин для использования в качестве лабораторного реагента был получен путем ферментации непатогенного рекомбинантного штамма Bacillus sphaericus, из которого он был легко очищен.
Сущность изобретения
Задачей для специалистов остается создание терапевтического агента, который может быть введен парентерально и который может быть использован при лечении стафилококковой инфекции в целом, а также инфекции специфических тканей, как при эндокардите.
Поставленная задача решена путем применения лизостафина с целью лечения стафилококковой инфекции у млекопитающих, в том числе человека, а также фармацевтических препаратов, используемых в данном лечении. Данное изобретение касается также способов лечения определенных болезненных состояний, включая стафилококковый эндокардит, стафилококковую бактериемию и стафилококковую инфекцию почек, легких, кожи, кости, ожогов, ран и протезных устройств. Изобретение охватывает применение лизостафина в широком смысле, включая не только лизостафин дикого типа, но и рекомбинантный лизостафин, варианты лизостафина с последовательностями аминокислот, отличающимися от опубликованной "природной последовательности" зрелого пептида (патент США No 4931390), вследствие генетических мутаций (таких как замены, инсерции и делеции), посттрансляционного процессинга, генетической инженерии химерных слитых белков и т.п. или комбинации данных типов изменений.
Введение относительно низких доз лизостафина (до 50 мг/кг) парентеральным путем является чрезвычайно эффективным терапевтическим способом лечения стафилококковых инфекций, особенно инфекций, устойчивых при лечении и/или обычно связанных с высокой заболеваемостью и летальностью. Кроме того, лизостафин, как показано, является эффективным в отношении стафилококковых бактерий, которые являются, по меньшей мере, частично резистентными к имеющимся антимикробным агентам, таким как β-лактамные антибиотики, включая пенициллиназа-устойчивые пенициллины, ванкомицин и т.п.
Изобретение далее включает комбинированную терапию, содержащую чередующееся или одновременное введение лизостафина и одного или более иных антимикробных агентов. Особенно предпочтительными антибиотиками для введения в сочетании с лизостафином, согласно данному изобретению, являются рифамицины (выделенные из микроорганизмов или полученные синтетическим или полусинтетическим путем, такие как рифампин) и гликопептиды (группа молекул, в которых природные молекулы обычно содержат гептапептид и одну или более структур сахара), как полученные и выделенные из природных источников (такие как ванкомицин, тейкопланин и др.), так и полусинтетические препараты.
Наличие клонированных, рекомбинантных лизостафинов и их вариантов далее расширяет объем данного изобретения. Были идентифицированы близкие ферменты, и они могут быть использованы в комбинации с лизостафином или вместо него.
Клонирование и секвенирование гена лизостафина позволяет выделить варианты фермента, которые могут обладать свойствами, близкими или отличными от свойств лизостафина дикого типа. Был охарактеризован один из данных измененных ферментов, несущий изменение одной аминокислоты и являющийся результатом данной работы, и показано, что он имеет сильную антистафилококковую активность in vitro и на модели инфекции на животных.
Другие аналоги лизостафина, включая существующие в естественных условиях ферменты с последовательностью, гомологичной лизостафину, и с активностью эндопептидазы или даже химерные ферменты, полученные при слиянии домена связывания одного фермента с каталитическим доменом другого, будут сильными агентами, способными лечить трудноизлечимые бактериальные заболевания, вызываемые стафилококками или другими патогенными бактериями.
Перечень фигур чертежей и иных материалов
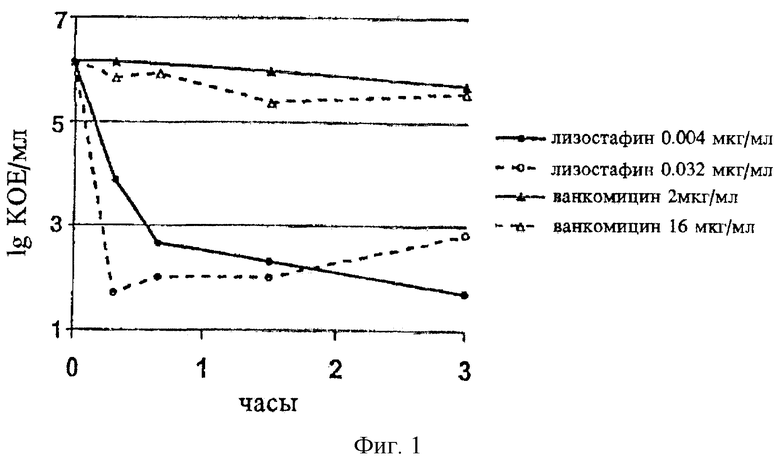
На фиг.1 в графической форме представлена бактерицидная активность лизостафина в отношении метициллин-резистентного штамма S.aureus по сравнению с ванкомицином.
На фиг.2 представлен график, отражающий бактерицидную активность лизостафина в отношении ряда штаммов S. aureus с различной резистентностью к антимикробным агентам.
Сведения, подтверждающие возможность осуществления изобретения
Определения
Использованные в данной заявке термины применяют, где возможно, в значении их нормального и обычного употребления. Некоторые термины используют для описания класса действий или соединений для получения общего описания отдельных моментов или научных феноменов, которые логически группируются вместе.
Аналог лизостафина - любой фермент, включая лизостафин (дикий тип), любой мутант или вариант лизостафина, любой рекомбинантный или близкой фермент, который сохраняет протеолитическую способность in vitro и in vivo протеолитического воздействия на глицин-содержащие мостики в пептидогликане клеточной стенки стафилококков. Варианты могут быть созданы путем посттрансляционного процессинга белка (либо ферментами, присутствующими в штамме-продуценте, либо с помощью ферментов или реагентов, введенных на какой-либо стадии процесса) или посредством мутации структурного гена. Мутации могут включать направленную делецию, инсерцию, удаление домена и мутации, связанные с заменой. Аналоги лизостафина, рассматриваемые в данном изобретении, могут быть экспрессированы рекомбинантным путем или иным образом.
Парентеральное - введение посредством инъекции, включая внутривенную, внутримышечную, подкожную, внутриглазничную, интраспинальную, внутрибрюшинную и посредством прямой перфузии, или доставку к органам или тканям путем инъекции (например, интрамедуллярной).
Staphylococcus aureus представляет собой высоко вирулентный патоген человека. Он является причиной ряда заболеваний человека, от локализованных кожных инфекций до опасных для жизни бактериемии и инфекций жизненно важных органов. Без принятия быстрых мер борьбы инфекция S. aureus может быстро распространиться от исходной области инфекции в другие органы. Хотя центры инфекции могут не быть очевидными, органы, особенно чувствительные к инфекции, включают сердечные клапаны, почки, легкие, кости, мозговые оболочки и кожу у пациентов с ожогами. Хирургические или травматические раны и любой участок, в котором присутствует чужеродное тело, также часто инфицируются. Данные инфекции, которые могут возникать в обществе или во время пребывания в больнице, являются причиной высокой заболеваемости и смертности, которая может доходить до 60% в случае тяжелых инфекций в некоторых популяциях даже при использовании самых лучших способов лечения из имеющихся. Другие виды стафилококков (коагулаза-отрицательные стафилококки, такие как S.epidermidis) являются менее вирулентными, но могут колонизировать катетеры или протезные устройства, что может иметь летальные последствия, например, когда устройство представляет собой имплантированный сердечный клапан.
Резистентность к имеющимся антимикробным агентам, очевидно, возникает особенно легко у стафилококков, начиная с резистентности к пенициллину у S. aureus; данная резистентность появилась на заре эры антибиотиков. В действительности все стафилококковые инфекции, появляющиеся как в обществе, так и в больницах, больше не являются чувствительными к пенициллинам первого поколения вследствие продукции пенициллиназы; штаммы, которые являются резистентными также к пенициллиназа-устойчивым пенициллинам (таким как метициллин), также представляют собой в настоящее время важную проблему, особенно в случае внутрибольничных инфекций. [Центры по контролю и профилактике болезней (Centers for Disease Control and Prevention), 1997. Пониженная чувствительность Staphylococcus aureus к ванкомицину (Reduced susceptibility of Staphylococcus aureus to vancomycin) - Япония, 1996. Еженедельный отчет о заболеваемости и смертности (Morbidity and Mortality Weekly Report), 46:624-626 (1997)].
Ванкомицин стал препаратом первой линии обороны в отношении стафилококковой инфекции, особенно в больницах. Однако, как представляется очевидным из высоких уровней заболеваемости, никакое имеющееся в данное время лечение не является идеальным для ряда заболеваний, таких как вызываемые S. aureus эндокардит и бактериемия, при которых требуется быстрое снижение числа бактерий для предупреждения необратимого повреждения сердца и других органов, в которые инфекция часто заносится с током крови. Одна причина провала имеющихся в настоящее время препаратов состоит в том, что они действуют относительно медленно, особенно in vivo, когда быстрая стерилизация инфицированных участков может быть необходимой для полного и быстрого выздоровления пациента. В такой угрожающей жизни ситуации и при ряде других инфекций (например, при которых схема лечения является очень длительной, таких как остеомиелит) новые терапевтические препараты или новые комбинации терапевтических препаратов могут существенно улучшить исход болезни пациента.
Было показано, что лизостафин является высоко активным в средних дозах. Это продемонстрировано ниже на модели очень тяжелой хорошо охарактеризованной инфекции на животных - эндокардите у кроликов, вызываемом метициллин-резистентным S. aureus (MRSA). В частности, нами продемонстрирована полная стерилизация вегетаций в сердечном клапане почти у всех животных, которых лечили согласно одной из схем введения препарата, что является беспрецедентным результатом, не наблюдаемым при использовании имеющихся в настоящее время антимикробных агентов. Далее нами показано в данном контексте, что комбинация даже более низкой ежедневной дозы лизостафина со стандартным терапевтическим агентом потенцирует антимикробную активность компонентов в данной модельной системе.
Дозы лизостафина, которые мы использовали, были значительно ниже, чем дозы, для которых ранее был показан только ограниченный эффект очищения органов от бактерий на моделях на животных [Zygmunt и соавт., Progr. Drug. Res., 16:309-333 (1972); Goldberg и соавт., Antimicrob. Ag.Chemother., 1967:45-53(1967)].
Ниже нами также была продемонстрирована активность в отношении стафилококков in vitro и на модели острой инфекции на мышах измененной формы лизостафина, полученной посредством мутагенеза рекомбинантного штамма Bacillus sphaericus, несущего ген лизостафина. Вследствие этого другим реализованным аспектом изобретения является получение фармацевтических препаратов аналогов лизостафина, либо лизостафина или иных ферментов с активностью эндопептидазы пептидогликана, включая генетически модифицированные ферменты, содержащие от одной до пяти замен аминокислот, ферменты с делециями или инсерциями до 10 аминокислот, включая делеции или инсерции по N-концу, или химерные ферменты, которые являются результатом слияния каталитического и связывающего доменов различных ферментов, в качестве терапевтических агентов для лечения инфекций у человека и животных.
Например, было описана другая глицилглицин-эндопептидаза (ALE-1 из Staphylococcus capitis EPK1). ALE-1 отличается от лизостафина, хотя два фермента имеют существенную гомологию аминокислот [Sugai и соавт., J. Bacteriol., 179:1193-1202 (1997)]. Другой гидролазой пептидогликана с меньшей степенью гомологии с лизостафином, но тоже обладающей активностью эндопептидазы, является зооцин А, продуцируемый Streptococcus zooepidemicus 4881 [Simmonds и соавт., Applied and Environmental Microbiology, 62:4536-4541 (1996); Simmonds и соавт., Gene, 189:255-261 (1997)]. Химерные белки могут быть получены путем слияния домена данных или близких ферментов с доменом аналога лизостафина.
Поскольку определенные иммунологические побочные эффекты, отмеченные в гораздо более ранних исследованиях, могут иметь значение в одних, но не в других ситуациях (таких как критические или экстренные ситуации), ожидается, что соответствующим образом очищенные препараты аналогов лизостафина, полученные при ферментации безвредных рекомбинантных штаммов бактерий, будут менее способны к индукции иммуногенных или других побочных эффектов.
Эффективные фармацевтические препараты данных антимикробных ферментов включают водные растворы или сухие препараты (например, лиофилизированные, кристаллические или аморфные, содержащие или не содержащие дополнительные растворимые вещества для осмотического равновесия) для восстановления жидкостями, пригодные для парентеральной доставки активного агента. Доставку предпочтительно осуществляют внутривенным (i.v.), внутримышечным (i.m.), подкожным (s.c.) или внутрибрюшинным (i.p.) способами или подоболочечно, или путем ингаляции или прямой инстилляции в инфицированный участок, чтобы обеспечить в крови или ткани уровни, превышающие минимальную ингибирующую концентрацию (МИК) активного агента, и таким образом снизить титры бактерий с целью излечения или облегчения течения инфекции.
Более того, активный аналог лизостафина может быть введен совместно, одновременно или поочередно с другими антимикробными агентами для более эффективного лечения инфекционного заболевания. Препараты могут находиться или быть восстановленными в маленьких объемах жидкости, пригодных для болюсной внутривенной или периферической инъекции или при добавлении большего объема для капельного внутривенного введения, или могут находиться или быть восстановленными в большем объеме для введения путем медленного внутривенного вливания. Агенты для совместного введения с лизостафином или другими антибактериальными ферментами могут находиться в одном препарате с данным ферментом в виде фиксированной комбинации или могут быть использованы для приготовления перед применением в любых имеющихся и применяемых на практике препаратах и в любых способах введения, известных как обеспечивающие адекватные уровни данных агентов в областях инфекции.
Подходящие дозы и схемы введения лизостафина могут изменяться в зависимости от тяжести инфекции и чувствительности инфицирующего организма и, в случае комбинированной терапии, могут зависеть от определенного антимикробного агента(ов), используемого в комбинации. Дозы могут находиться в интервале от 0,5 до 200 мг/кг/день, предпочтительно от 3 до 25-50 мг/кг/день, которые вводят как разовую или разделенную дозы, предпочтительно путем непрерывного вливания или деления на две-четыре дозы в день.
Примеры
Все эксперименты проводят с использованием аналогов лизостафина, полученных при ферментации рекомбинантных штаммов В. sphaericus, сконструированных таким образом, что они содержат ген лизостафина, описанный Recsei (патент США N 4931390), или его мутант. В частности, аналоги лизостафина, полученные при ферментации В. sphaericus, отличаются от опубликованной последовательности тем, что имеют на 2 аминокислоты меньше или до двух дополнительных аминокислот на N-конце.
В частности, представленные данные в значительной мере получены из исследований с использованием препаратов аналогов лизостафина, полученных рекомбинантным образом, в которых основной компонент представляет собой структуру, в которой отсутствуют две N-концевые аминокислоты относительно опубликованной последовательности. Однако результаты не ограничиваются данными препаратами. Аналогичные результаты могут быть получены с любым препаратом, имеющим подходящую чистоту и активность.
Пример 1
Активность лизостафина in vitro
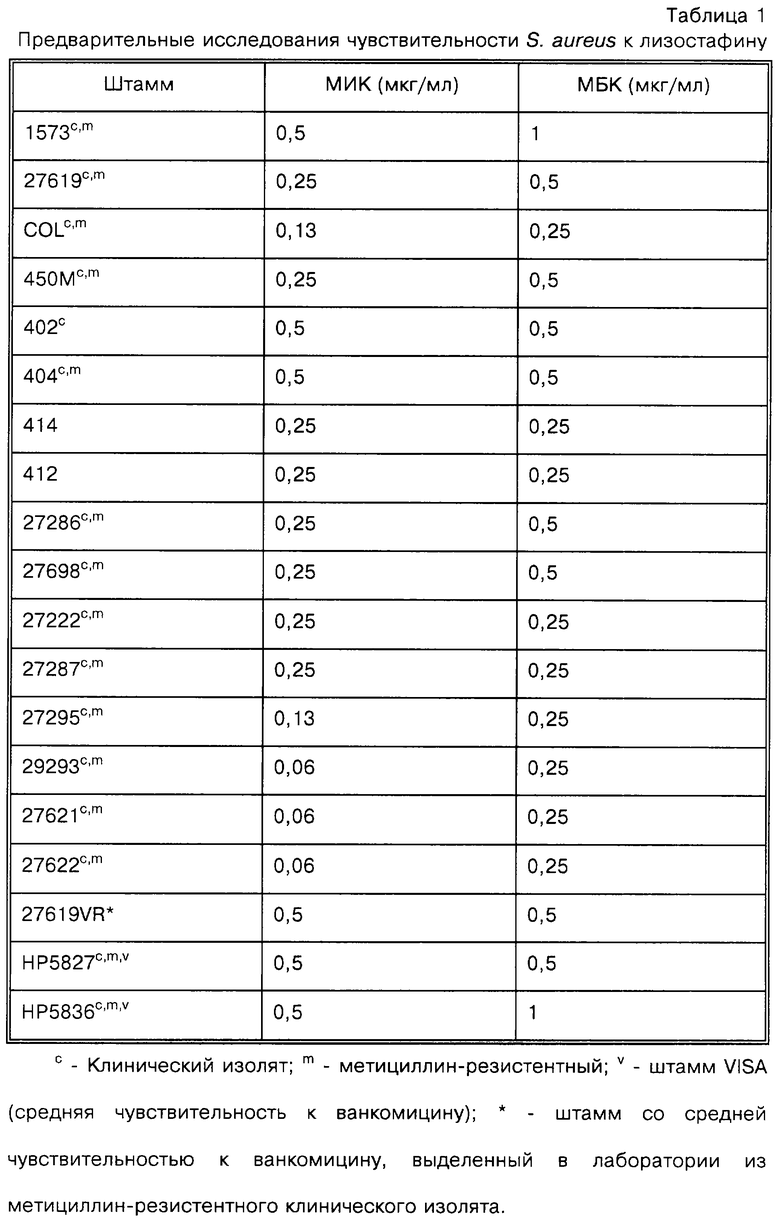
Как представлено в таблице 1, эксперименты показывают, что препарат лизостафина является активным и бактерицидным in vitro в отношении клинических изолятов S. aureus; минимальные ингибирующие концентрации (МИК) и минимальные бактерицидные концентрации (МБК) определяют как <1,0 мкг/мл, используя стандартные способы микроразведений в бульоне [Национальный комитет по клиническим лабораторным стандартам (National Committee for Clinical Laboratory Standard), 1993. Одобренный стандарт М7-А3. Методы анализа антимикробной чувствительности бактерий с аэробным ростом с использованием разведений (Approved Standard M7-A3. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically) - Третье издание. Национальный комитет по клиническим лабораторным стандартам, Villanova, PA; Национальный комитет по клиническим лабораторным стандартам (National Committee for Clinical Laboratory Standards), 1992.
Экспериментальное руководство М26-Т (Tentative Guideline M26-T). Способы определения бактерицидной активности антимикробных агентов (Methods for determining bactericidal activity of antimicribial agents). Национальный комитет по клиническим лабораторным стандартам (National Committee for Clinical Laboratory Standards), Villanova, PA].
Более того, показывают, что лизостафин является активным в отношении ряда изолятов Staphylococcus epidermidis (коагулазо-отрицательный вид) при МИК ≤8 мкг/мл для 11 из 13 тестированных изолятов. МИК определяют как самую низкую концентрацию из исследованных, которая полностью ингибирует видимый рост бактерий, и МБК - как самую низкую концентрацию, которая уничтожает 99,9% исходного инокулюма в течение 24 часов обработки. Как показано в таблице 1, на чувствительность к лизостафину не влияет резистентность или пониженная чувствительность к метициллину и/или ванкомицину. Штаммы S. aureus, которые являются метициллин-резистентными, а также имеют только среднюю чувствительность к ванкомицину, в последнее время возникают в США. [Центры по контролю и профилактике болезней, 1997 (Centers for Disease Control and Prevention, 1997), Еженедельнный отчет о заболеваемости и смертности (Morbidity and Mortality Weekly Report), 46:813-815 (1997)]
 .
.
Лизостафин прилипает к пластмассовым материалам и может быть выведен из раствора, что может влиять на его определяемую активность. Вследствие этого некоторые определения МИК проводят также с добавлением 0,1% бычьего сывороточного альбумина (БСА) к разбавителю. В других отношениях способ является идентичным вышеописанному. Как показывают в таблице 2, активность лизостафина in vitro в отношении исследованных штаммов повышается в 8-64 раза при анализе в присутствии БСА. Поскольку данное наблюдение связано с аффинностью лизостафина к пластмассовым материалам, можно ожидать, что в целом штаммы стафилококков являются более чувствительными к лизостафину, чем описано ранее.

Данные результаты демонстрируют очень высокую активность лизостафина в отношении современных клинических изолятов Staphylococcus aureus с множественной устойчивостью к антибиотикам.
Бактерицидную активность лизостафина в отношении S. aureus изучают также в экспериментах с учетом зависимости гибели от времени. В одном эксперименте данного типа штамм S.aureus AG461, метициллин-резистентный клинический изолят из Генуи, Италия, вносят в бульон Mueller-Hinton (Difco) и выращивают при 37°С при осторожном встряхивании до получения приблизительно 108 жизнеспособных клеток/мл (КОЕ/мл (КОЕ - колониеобразующие единицы)), что определяют по поглощению культуры при 600 нм. Затем культуру разводят свежим бульоном до приблизительно 106 КОЕ/мл и аликвоты по 5 мл помещают в ряд различных колб для обработки различными концентрациями антибактериальных агентов. Инкубирование продолжают при осторожном встряхивании при 37°С и отбирают образцы через интервалы времени для определения жизнеспособных клеток. Серийные 10-кратные разведения образцов делают в стерильном физиологическом растворе (0,9% NaCl в дистиллированной воде) и аликвоты по 0,1 мл соответствующих разведений в двух повторностях помещают на чашки с триптическим соевым агаром (Remel), используя способ внесения в агар. (В данном способе помещаемую на чашку аликвоту вносят в 2,5 мл агара для верхнего слоя, который перемешивают и выливают в чашку. Агар для верхнего слоя состоит из расплавленного триптического соевого агара (Difco), разведенного в 2 раза триптическим соевым бульоном Difco для получения конечной концентрации агара 0,75%, мас./об.). Чашки инкубируют в течение 24-48 ч при 36°С и вручную подсчитывают колонии. Все разведения лизостафина делают в присутствии 0,1-0,2% БСА для предотвращения адсорбции лизостафина на пластмассовых материалах. Ванкомицин (Sigma Chemical Co.) разводят в стерильной дистиллированной воде.
Как показано на фиг.1, лизостафин в концентрациях 0,004 и 0,032 мкг/мл обладает быстрым бактерицидным действием, уничтожая, по меньшей мере, 99,9% бактерий в течение одного часа контактирования. По сравнению с этим бактерицидное действие ванкомицина является пониженным и значительно более медленным при очень низком уровне уничтожения бактерий, отмечаемом в течение трех часов контактирования, даже при использовании ванкомицина в значительно более высоких концентрациях (2 и 16 мкг/мл). Различные концентрации лизостафина и ванкомицина, которые используют, составляют один и восемь раз превышают их соответствующие МИК.
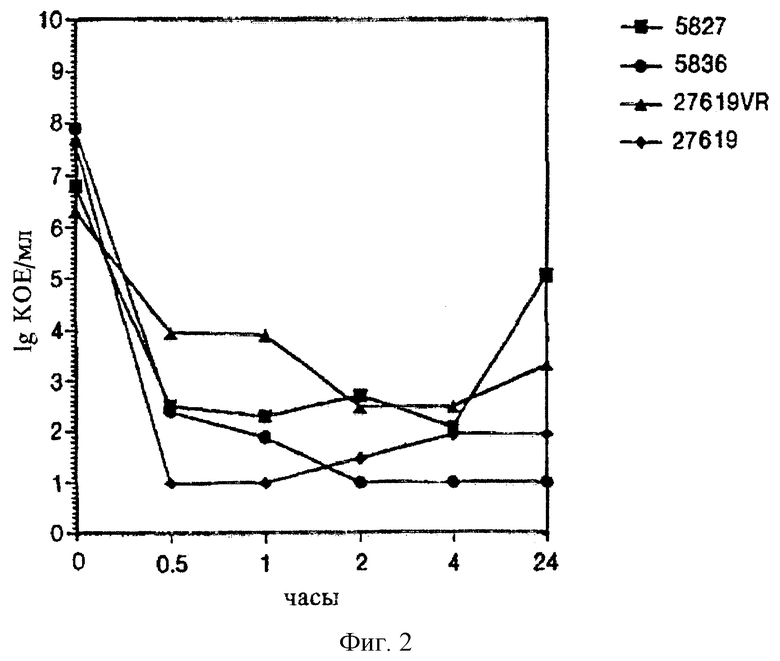
В другом эксперименте (фиг.2) три разных метициллин-резистентных клинических изолята S. aureus и четвертый штамм 27619VR - полученный в лабораторных условиях штамм "VISA" (т.е. штамм со средней резистентностью к ванкомицину), выделенный из метициллин-резистентного клинического изолята, вносят в бульон Mueller-Hinton с добавлением катионов (Becton Dickinson) и выращивают при 37°С в течение ночи. Затем их разводят свежим бульоном и инкубируют при 37°С при осторожном встряхивании до тех пор, пока не определят, что они достигли логарифмической фазы роста. Как показано на фиг.2, титры бактерий в данное время находятся в интервале от 2×106 до 9×107 КОЕ/мл. Лизостафин добавляют к каждой культуре в концентрации 1 мкг/мл. Через интервалы времени отбирают образцы, делают серийные разведения в 0,9% NaCl и высевают на агар Mueller-Hinton (Becton Dickinson). Чашки с агаром инкубируют в течение 48 ч при 37°С и вручную подсчитывают колонии. Как показано на фиг.2, все данные штаммы быстро погибают под действием лизостафина.
Данные результаты демонстрируют, что лизостафин обладает сильной и быстрой бактерицидной активностью в отношении современных клинических изолятов S. aureus, включая штаммы, резистентные к метициллину, и штаммы, резистентные к метициллину и обладающие средней резистентностью к ванкомицину.
Исследования на моделях животных
Пример 2
Сравнительная эффективность лизостафина на модели инфекции S. aureus на мышах
Эффективность лизостафина сравнивают с эффективностью ванкомицина на модели острой инфекции на мышах. S. aureus Smith культивируют в течение ночи при умеренном перемешивании в телячьем бульоне (Difco) и разводят бульоном, содержащим 5% свиного желудочного муцина (Difco). Самцов мышей Swiss-Webster (Taconic Farms, Germantown, NY) массой приблизительно 20 г инфицируют внутрибрюшинно 105-106 жизнеспособных клеток, что приблизительно в десять раз превышает инокулюм, который воспроизводимо убивает всех нелеченых животных в течение 48 ч. Каждая группа лечения содержит шесть мышей. Лизостафин вводят внутривенно (в 0,1 мл 5% декстрозы для инъекций) или подкожно (в 0,2 мл) в течение 10 мин после инфекции. Ванкомицин вводят подкожно.
Как показано в табл.3, лизостафин защищает 100% инфицированных мышей при введении в дозе 0,16 мг/кг внутривенно или в дозе 2,5 мг/кг при подкожном введении. Ванкомицин, который у мышей является полностью биодоступным при подкожном введении и обладает близкой активностью как при подкожном, так и при внутривенном введении, имеет 100%-ную эффективность в дозе 2,5 мг/кг. Все нелеченые мыши погибают менее чем через 24 ч.
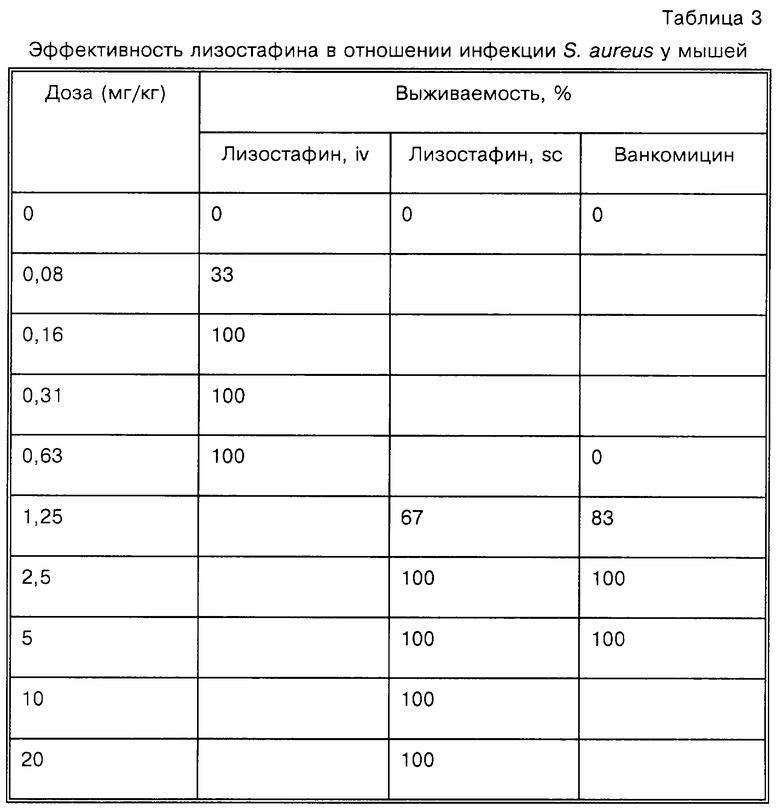
Данный пример демонстрирует, что лизостафин является эффективным в отношении инфекции S. aureus на модели острой инфекции на мышах при использовании высоковирулентной ударной дозы бактерий. При внутривенном введении эффективными являются чрезвычайно низкие дозы очищенного рекомбинантного лизостафина. При оценке по массе лизостафин в 16 раз более эффективен, чем ванкомицин, по молярности - лизостафин приблизительно в 200 раз более эффективен, чем ванкомицин.
Пример 3
Активность варианта фермента лизостафина in vitro и in vivo
Штамм Bacillus sphaericus, содержащий клонированный ген лизостафина, который описан в патенте США N 4931390, мутагенизируют обработкой N,N’-нитрозогуанидином. Проводят скрининг выживших колоний на присутствие литической активности, помещая их на газон убитых нагреванием клеток штамма S. aureus RN4880 и инкубируя в течение ночи при 32°С. Колонии, образующие большие зоны лизиса, сохраняют.
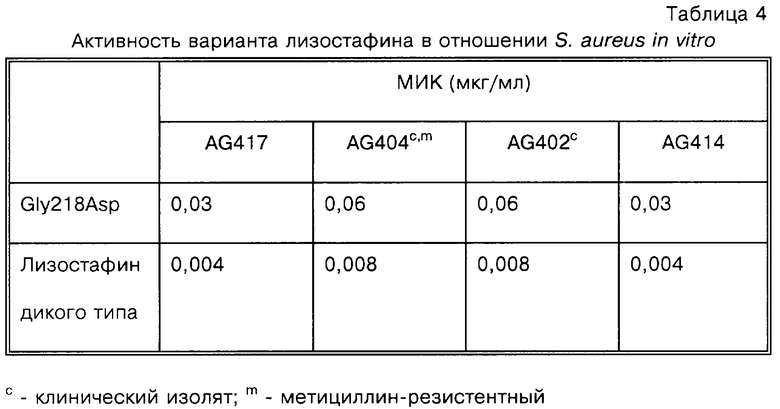
Один из данных клонов характеризуют далее. Ген лизостафина секвенируют и обнаруживают, что он содержит единственную мутацию Г-А (А вместо Г) в кодоне, соответствующем положению 218 зрелого белка лизостафина, что приводит к изменению кодона из ГГТ (глицин) в ГАТ (аспарагиновая кислота). При ферментации данного мутантного штамма получают достаточно материала для анализа in vitro и in vivo.
Как показано в табл.4, вариант фермента обладает высокой активностью в отношении S. aureus in vitro, хотя препарат лизостафина дикого типа является несколько более активным. В данном эксперименте МИК определяют путем макроразведений в бульоне в конечных объемах 1 мл в стеклянных пробирках. Другие аспекты способа описывают выше.
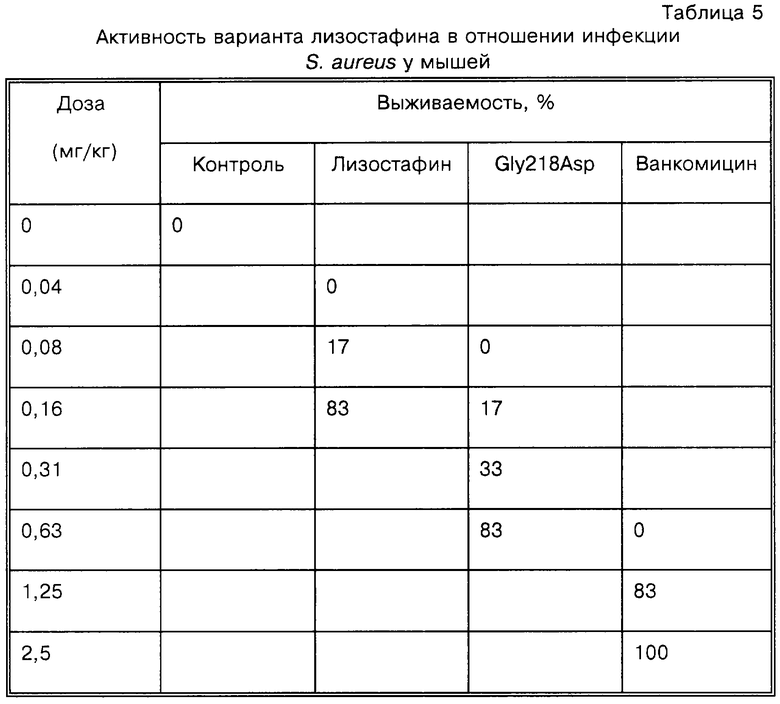
Как показано в табл.5, вариант фермента лизостафина является также высокоактивным в отношении S. aureus на модели острой инфекции на мышах. В данном случае снова вариант является несколько менее активным, чем лизостафин дикого типа, но он является более активным, чем ванкомицин.
Пример 4
Антимикробная активность сыворотки кролика, леченного лизостафином
Новозеландскому белому кролику массой приблизительно 5 кг проводят внутривенное вливание 125 мг лизостафина. Образцы крови берут через интервалы до 4 ч и готовят сыворотку; делают двукратные серийные разведения и определяют бактерицидный титр сыворотки в отношении метициллин-резистентного штамма S. aureus (MRSA 27619). Бактерицидный титр сыворотки представляет собой максимальное разведение, которое уничтожает 99,9% инокулюма за 24 ч. В данном тесте выживаемость бактерий определяют в основном, как в способе определения минимального бактерицидного эффекта за исключением того, что лунки для микротитрования содержат различные разведения сыворотки, а не различные концентрации раствора очищенного антимикробного агента.
Как показано в табл.6, сыворотка содержит высоко бактерицидные концентрации лизостафина в течение всего периода времени. В частности, в точках времени от 30 мин до 120 мин титр превышает 1:256 (максимальное из использованных разведений), указывая на то, что разведения, по меньшей мере, в 256 раз сохраняют способность убивать 99,9% бактерий. В самой последней точке времени, 240 мин, титр составляет 1:64.
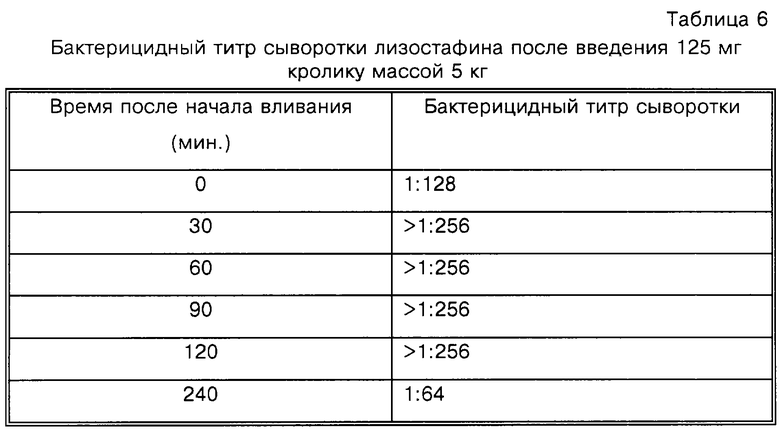
Данный пример демонстрирует, что лизостафин поддерживает бактерицидную активность в сыворотке кроликов и что он присутствует и сохраняет активность в кровотоке в течение, по меньшей мере, 4 ч после инъекции.
Пример 5
Эффективность лизостафина в отношении экспериментального эндокардита у кроликов
Эндокардит клапана аорты получают у новозеландских кроликов массой приблизительно 3 кг. Кроликам дают наркоз и правую сонную артерию хирургически выделяют и канюлируют полиэтиленовым катетером, который продвигают в левый желудочек сердца. Через, по меньшей мере, 24 ч кроликов внутривенно инфицируют 106-107 клеток метициллин-резистентного штамма S. aureus (MRSA 27619). Через двадцать четыре часа животных случайным образом разбивают на группы по различному типу лечения: нелеченый контроль (9 кроликов); положительный контроль, ванкомицин, 30 мг/кг, два раза в день (15); лизостафин, 5 мг/кг, три раза в день (11); лизостафин 5 мг/кг, один раз вдень (10); лизостафин 5 мг/кг, один раз вдень + ванкомицин, 30 мг/кг, два раза в день (11). Всех кроликов, у которых не подтверждают инфекцию путем предварительного анализа культуры крови, исключают. Кроме того, у всех кроликов, включенных в анализ, при вскрытии подтверждают развившуюся инфекцию эндокардита, что определяют по присутствию вегетации в аорте, указывающих на имеющееся или ранее существовавшее болезненное состояние.
Все введения делают внутривенно и проводят в течение трех дней.
Состояние здоровья кроликов оценивают через интервалы времени. Кроликов умерщвляют через 18 ч после последнего введения. Вегетации на аорте удаляют, взвешивают и обрабатывают с целью определения числа жизнеспособных бактерий, которое выражают как IgKOE/г. Пределом определения является 102 КОЕ/г (IgKOE/г=2,0). Средние значения титров бактерий/г сравнивают с помощью одностороннего анализа дисперсии. Критерий Стьюдента-Ньюмана-Кеулса используют для приведения для множества сравнений. Сравнение скоростей стерилизации выполняют с помощью точного критерия Фишера. Статистическую значимость определяют как значение Р≤0,05.
Как показано в табл.7, схема введения 5 мг/кг лизостафина три раза в день является наиболее эффективным лечением. Впечатляющие статистические данные таковы, что это лечение полностью стерилизует вегетацию на сердечном клапане у всех кроликов, за исключением одного. Это значительно превосходит стандартную схему лечения, используемую в качестве положительного контроля в данной модели инфекции - 30 мг/кг ванкомицина два раза в день. Схема введения 5 мг/кг лизостафина один раз в день является менее эффективной, чем схема введения три раза в день, но почти такой же хорошей, как ванкомицин, в плане снижения числа бактерий в вегетациях; в действительности эффект статистически не отличается от ванкомициновой группы. При схеме введения лизостафина один раз в день также достигают полной стерилизации вегетации у некоторых животных. Введение лизостафина один раз в день в дополнение к стандартной схеме лечения ванкомицином приводит к резкому снижению среднего значения количества бактерий, почти до уровня, наблюдаемого при введении лизостафина 3 раза в день. Однако в плане числа полностью стерилизованных вегетаций схема введения лизостафина три раза в день однозначно превосходит все остальные.
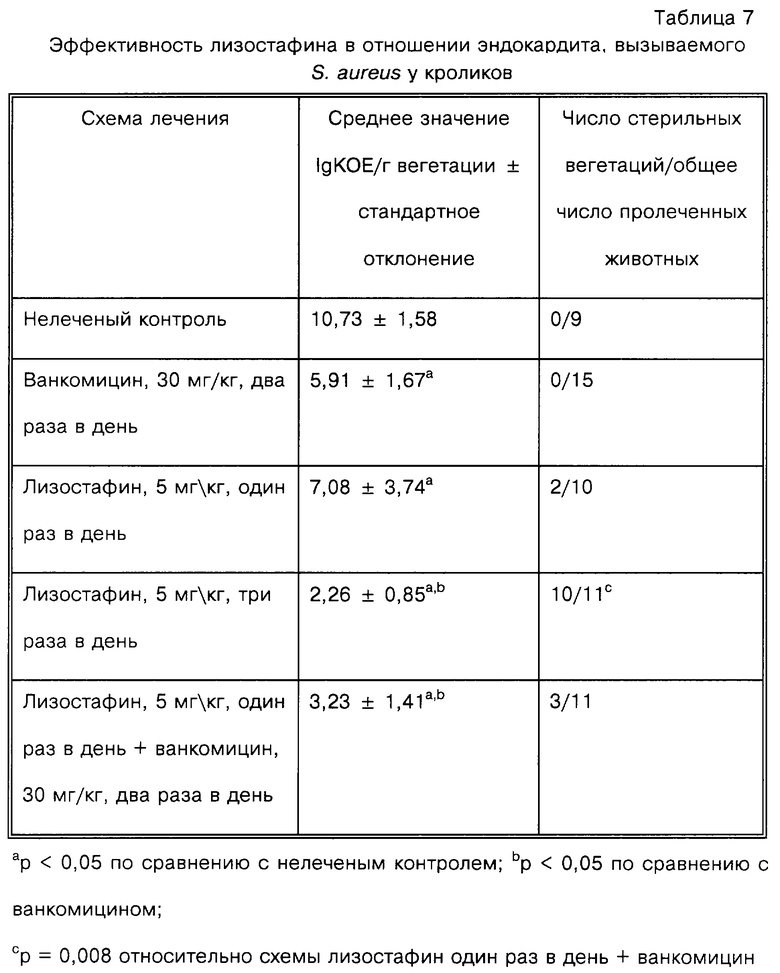
Абсцессы в почках также оценивают на присутствие стафилококков. Схема введения лизостафина три раза в день резко снижает бактериальную нагрузку по сравнению с нелеченой контрольной группой до менее 102 КОЕ/г ткани в группе лизостафина по сравнению с более чем 108 КОЕ/г в контролях.
Наблюдение за животными показывает, что все кролики, леченные по схеме введения лизостафина три раза в день, хорошо чувствуют себя на ранних стадиях цикла лечения.
Данные результаты нельзя было ожидать на основании предшествующих исследований. В частности, стерилизация фактически всех вегетаций никогда не наблюдалась или не описывалась ранее ни с каким антимикробным агентом на данной модели инфекции. Тот факт, что стерилизация происходит в течение относительно короткого периода лечения (3 дня), указывает на то, что лизостафин действует in vivo очень быстро и предполагает, что аналоги лизостафина с антимикробной активностью могли бы значительно улучшить результаты лечения пациентов с серьезными стафилококковыми инфекциями, при которых необходимо быстрое снижение бактериальной нагрузки.
Приведенные выше данные демонстрируют эффективность аналогов лизостафина в отношении S.aureus, включая MRSA (метициллин-резистентный S.aureus). Штаммы, обладающие резистентностью как к метициллину, так и к ванкомицину, представляют собой недавно возникшую проблему. Вариант штамма данного типа отбирают после циклов роста в содержащей гликопептид среде. МИК ванкомицина для полученного штамма составляет 8 мкг/мл, как описывают также для существующих в естественных условиях штаммов VISA, выделенных у пациентов в США и Японии. (Центры по контролю и профилактике болезней (Centers for Disease Control and Prevention), Еженедельный отчет о заболеваемости и смертности) Morbidity and Mortality Weekly Report, 46:813-815). Считают, что изоляты стафилококков являются чувствительными к ванкомицину, если МИК меньше или равна 4 мкг/мл, и являются полностью резистентными, если МИК больше или равна 32 мкг/мл (Национальный комитет по клиническим лабораторным стандартам (National Committee for Clinical Laboratory Standards), 1993. Одобренный стандарт М2-А5. Действующие стандарты для тестов на чувствительность с использованием дисков с антимикробными агентами (Approved Standard M2-A5. Performance standards for antimicrobial disk susceptibility tests) - Пятое издание. Национальный комитет по клиническим лабораторным стандартам (National Committee for Clinical Laboratory Standards), Villanova, PA).
Как показано в табл.8, лизостафин является эффективным при лечении кроликов с инфекционным эндокардитом, вызываемым метициллин-резистентным штаммом VISA.
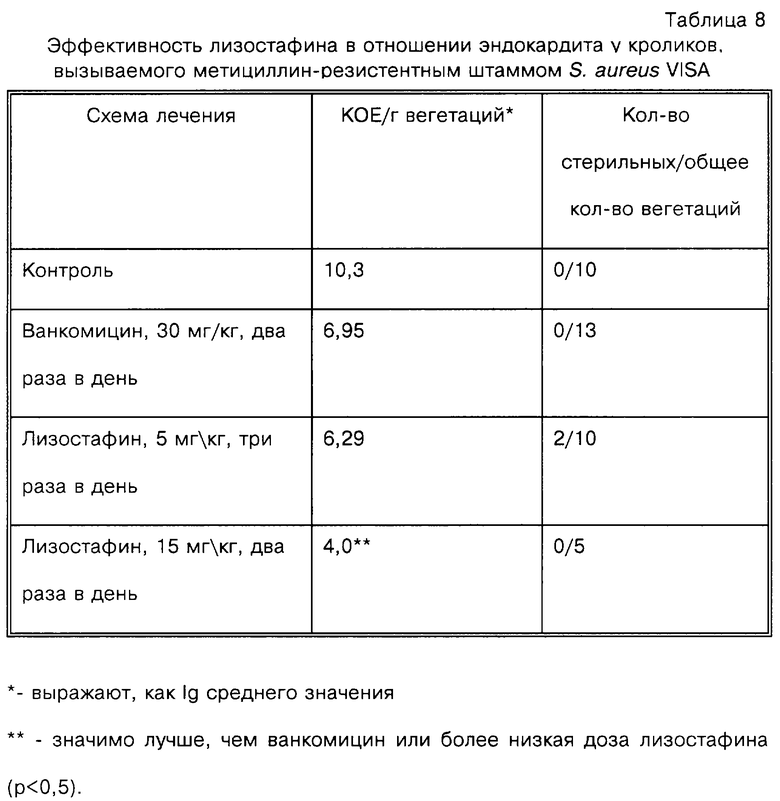
Против штамма VISA лизостафин при введении в дозе 5 мг/кг три раза в день обладает такой же эффективностью, как ванкомицин, в отношении снижения бактериальной нагрузки в вегетациях аорты. Лизостафин при введении в дозе 15 мг/кг три раза в день является более эффективным, чем ванкомицин при стандартной схеме введения (статистически значимо), а также значимо более эффективным, чем лизостафин при введении в дозе 5 мг/кг три раза в день. Более того, ванкомицин, даже при введении в дозе 30 мг/кг два раза в день, не может обеспечивать полную стерилизацию вегетации сердечного клапана ни у одного из исследуемых животных. С другой стороны, полная стерилизация достигается у некоторых животных при схеме введения лизостафина три раза в день.
Модель эндокардита на кроликах в настоящее время очень хорошо стандартизована и принята в качестве жесткого теста на способность антимикробных агентов излечивать тяжелые инфекции у человека. Предшествующая работа с лизостафином на развившихся инфекциях показывает ограниченное снижение бактериальной нагрузки в почках на модели на мышах и в сердечных клапанах, и других органах на модели эндокардита на собаках при дозах, находящихся в интервале от 50 до 250 мкг/кг/курс лечения. Несмотря на высокие дозы, использованные в данных предшествующих исследованиях, эффективности величины доз, требующихся для лечения тяжелых стафилококковых инфекций, не наблюдают. Ранее полученные результаты не привели бы к предсказанию быстрой тотальной стерилизации действительно всех вегетаций сердечных клапанов, как теперь показано при использовании очень небольших доз лизостафина на модели эндокардита на кроликах.
Результаты, представленные в данном контексте, демонстрируют не только неожиданную эффективность лизостафина в отношении эндокардита, вызываемого S.aureus, но и показывают, что данная эффективность значительно превосходит ожидаемую при стандартных способах лечения.
Имеющиеся в настоящее время способы лечения часто не являются эффективными при опасных для жизни инфекциях, которые могут привести к необратимому повреждению ткани и при которых, вследствие этого, необходимо быстрое снижение числа бактерий с целью предупреждения такого повреждения, а также распространения инфекции в другие жизненно важные органы. Представленные выше результаты указывают, что аналоги лизостафина в виде монотерапии или в комбинации с другими агентами имеют потенциальную эффективность для лечения таких инфекций. Более того, на основании данных результатов и активности in vitro лизостафина в отношении стафилококков следует ожидать, что аналоги лизостафина в виде монотерапии или в комбинации с другими агентами будут применяться против видов стафилококков, отличных от S. aureus. Среди агентов, пригодных для применения вместе с лизостафином, находятся ванкомицин и другие гликопептиды, рифампин и другие рифамицины, а также другие противоинфекционные агенты, которые обладают активностью в отношении стафилококков.
Аналоги лизостафина могут быть использованы не только для лечения стафилококкового эндокардита, но и других потенциально летальных стафилококковых заболеваний, таких как бактериемия и инфекции других жизненно важных органов, таких как почки, легкие, кожа и кости. Данные способы применимы также при лечении инфекций ожогов, ран и протезных устройств. Эти же самые способы могут применяться, в частности, при лечении таких заболеваний, как остеомиелит, который является результатом инфекции того типа и тяжести, который требует длительного лечения используемыми в настоящее время антимикробными агентами. Данное изобретение далее распространяется на применение аналогов лизостафина при лечении таких инфекций и заболеваний, которые вызывают стафилококки, резистентные к традиционно применяемым антибиотикам.
Предложено: новые способы лечения эндокардита, остеомиелита или бактериемии, вызванные штаммом стафилококка, который устойчив к ванкомицину (или как вариант - к метициллину), включающие внутривенное или подкожное введение лизостафина или его варианта. Изобретение расширяет арсенал способов лечения перечисленных заболеваний. 2 н. и 12 з.п. ф-лы, 2 ил., 8 табл.
Авторы
Даты
2004-08-27—Публикация
1998-07-21—Подача