Настоящее изобретение касается нейротропина-3 (NT-3) нового нейротропного фактора, который относится к генному семейству BDNF/NGF. Ген, кодирующий NT-3, был клонирован и секвенирован, и рекомбинантный NT-3 был экспрессирован в клетках млекопитающих. Рекомбинантный NT-3, как оказалось, обладает спектром биологической активности, которая отличается от активности BDNF и NGF. Настоящее изобретение обеспечивает последовательности нуклеиновых кислот, кодирующие NT-3, для получения в основном чистого белка NT-3, пептидных фрагментов или производных, производимых ими в большом количестве, а также антител, направленных против белка NT-3 и его производных. Продукты гена NT-3 по изобретению могут быть использованы для диагностики и лечения различных неврологических нарушений, включая, в частности, периферийные невропатии, болезнь Альцхаймера и болезнь Паркинсона.
2. Предпосылки изобретения
2.1. Роль нейротропных факторов в нервной системе
Развитие и деятельность нервной системы зависит от белков, известных как нейротропные факторы. Широко распространенная гибель нейронных клеток сопровождает нормальное развитие центральной и периферийной нервных систем, и, очевидно, играет решающую роль в регулировании количества нейронов, которые защищают данную мишенную область (Berg, D.K. 1982, Newronal Development 297 - 331; Cowan et. al., 1984, 225 1258-65). Исследование периферийных мишенных тканей экстирпацией и трансплантацией во время их развития показало, что гибель нейронных клеток происходит вследствие конкуренции среди нейронов за ограниченные количества факторов их выживания ("нейротропных факторов"), продуцируемых в областях их защиты. Эти наблюдения привели к идентификации фактора нервного роста (NGF); который пока еще остается лучше всего охарактеризованной нейротропной молекулой (Lebi-Montalcini and Angeletti, P.U. 1968, Physiol Rev. 48 534-69; Thoenen, H. and Barde J.A. 1980, Rev. 60 1284-335). Пониманию роли и механизма действия NGF значительно помогло счастливое открытие богатого источника этого белка в подчелюстных железах самца мыши, которое позволило осуществить очистку и клонирование (Ullrich et. al., 1983, Nature 303:821-5; Scott et. al., 1983, Nature 302 538-40) NGF, так же как генерирование нейтрализующих его антител. Поскольку NGF только поддерживает ограниченное количество нейронных популяций, было постулировано существование дополнительных нейротропных факторов (Varon, S. and Adler, R., 1981, Adv. Cellular Neurobiol. 2:115-63, Barde et. al., 1987, Prog Brain Res. 71:185-9; Shider, W.D. and Johnson, E.M., 1989, Ann. Neurol., 26:489-506). Хотя теперь ясно, что такие факторы действительно существуют, их крайне низкое содержание препятствовало их характеристике на молекулярном уровне. Тем не менее, очистка небольших количеств двух таких белков, а именно мозгового нейротропного фактора (BDNF) и цилиарного нейротропного фактора (CNTF), недавно позволила осуществить их частичное секвенирование на нуклеиновые кислоты (Leibrock et. al., 1989, Nature, 341:149-52; Stockli et al. , 1989, Nature, 342: 21-28 and Lin et. al., Science 246 : 1023-25). Несмотря на специфичность конкретных нейронных популяций, BDNF и NGF (но не CNTF) показали достаточную структурную гомологию, чтобы рассматривать их как членов одного генного семейства (Leibrock et. al., 1989, Nature, 341 149-52).
2.2. Другие нейротропные факторы
За прошедшее десятилетие было множество сообщений о нейротропной активности, выявленной в экстрактах большого разнообразия тканей и в кондиционированной культуральной среде многих различных типов клеток. Почти во всех случаях, однако, прогресс в очистке и характеристике этих активностей был замедлен тем, что такие активности присутствуют в крайне малых количествах, в пределах от пикограммов до нанограммов на грамм ткани. Кроме того, в то время как для периферийных нейронов были поставлены адекватные биоопыты, для нейронов центральной нервной системы проведение надежных, воспроизводимых и специфичных опытов оказалось проблематичным. Тогда как отдельные типы периферийных нейронов были обнаружены в виде дискретных, легко иссекаемых ганглиев, нейроны центральной нервной системы (ЦНС) неизменно являются высоко гетерогенными в их распределении. Так, требуются специфичные маркеры для идентификации или обогащения некоторых классов нейронов ЦНС. Прогресс в получении таких маркеров, например, антител, направленных на клеточную поверхность или цитоструктурные компоненты, или специфичных гистокрасок, весьма невелик. Соответственно, крайне трудным оказалось охарактеризовать нейротропные факторы, которые: (I) не так обильны, как NGF, (II) трудны для опытов, и (III) отсутствуют в достаточном количестве для обеспечения производства антител.
2.2.1 Сравнение извлеченного из мозга росткового фактора и фактора нервного роста
Нейротропная активность, способная поддерживать жизнеспособность нейронов дорсальных корневых ганглиев эмбрионов цыплят, была идентифицирована в "кондиционированной среде", в которой выращивали клетки C-6 крысиной глиомы. (Barde et. al. , 1978, Nature 274 818). Эта активность не нейтрализовалась антителами к мышиному NGF, указывая на присутствие другого нейротропного фактора в кондиционированной среде. Подобные активности, не блокируемые NGF антителами, были впоследствии описаны в культурах астроглиальных клеток нормального мозга взрослых крыс (Lindsay, 1979, Nature, 282 80-82, Lindsay et al. , 1982, Brain Res. 243 329-343) и в экстрактах из мозга развивающейся и взрослой крысы (Barde et al., 1980, Proc. Natl. Acad. Sci. USA 77 1199-1203), и из развивающегося и зрелого спинного мозга цыпленка (Lindsay and Peters, 1984, Neuroscience, 12 45-51). Однако ни в одном из случаев не был выделен или идентифицирован активный фактор (факторы) и остается под вопросом, относятся ли замеченные активности к одному и тому же, или к разным факторам.
Использовав мозг свиньи в качестве исходного материала, Barde и др. (1982, EMBO 1: 549-553) сообщил о факторе, теперь называемом мозговым (извлеченном из мозга) нейротропным фактором (BDNG), который, очевидно, содействовал выживанию нейронов дорсальных корневых ганглиев из цыплячьих эмбрионов E10/E11. Было обнаружено, что нейротропная активность расположена на высокоосновном белке (изоэлектрическая точка с pH более 10,1), который мигрирует при электрофорезе в геле SDS (натрия додецилсульфат) в виде одной полосы молекулярным весом 12,3 кД. Очищенный фактор был оценен как 1,4 • 106, но выход был очень низок, приблизительно только 1 μг BDNF, очищенного из 1,5 кг свиного мозга. Кроме того, поскольку последней процедурой в этом процессе очистки был гелевый электрофорез, то активность BDNF не могла полностью ренатурировать вторично к присутствию остаточного SDS (Barde and Thoenen, 1985 в "Hormones and Cell regulation", vol. 9, Dumont et al., eds Elsevier Science Publishers, 385-390). Отмечено, что высокоосновная природа и молекулярный размер BDNF очень похожи на NGF мономер. Однако BDNF показал, что он обладает свойствами, которые отличаются от известных свойств NGF тем, что (а) в биоопыте на ганглиях дорсального корня цыпленка, антитела к NGF не проявили действия на биологическую активность BDNF, (б) в том же опыте, эффекты BDNF и NGF оказались дополняющими, и (с) в отличие от NGF было обнаружено, что BDNF не оказывает влияния на выживание симпатических нейронов E 12 эмбриона цыпленка. В дополнение, при предыдущих исследованиях мозговых экстрактов наблюдалось, что нейротропная активность в этих источниках действует, очевидно, на сенсорные нейроны на более поздних стадиях развития, чем связанных с NGF. С использованием диссоциированных культур нейронов эмбрионов цыплят, выращиваемых на поликатионном субстрате, таком, как полилизин или полиорнитин, было обнаружено, что BDNF поддерживает выживание более 30% E10 - E11 (т.е. десятого или 11-го дня развития эмбриона) нейронов ганглиев дорсального корня, но, похоже, слабо влияет на выживание тех же нейронов у E6 (Barde et al., 1980, Proc. Natl. Acad. USA 77 1199-1203 см. выше). При подобных условиях NGF поддерживает выживание 30 - 40% E6 DRG нейронов. Любопытно, что позднее было обнаружено, что при культурировании на субстрате, покрытом внеклеточным маточным гликопротеином ламинином, как NGF, так и BDNF поддерживали выживание около 50% DRG нейронов из цыплячьих эмбрионов возраста E6 - E12 (Lindsay et al., 1985, Develop. Biol., 112 319-328). В более позднем исследовании было обнаружено, что действие NGF и BDNF является дополняющим, когда оба присутствуют в насыщенных концентрациях.
Предыдущие исследования Levi-Montalcini (1966, "The Harvey lectures" 60: 217-259) нейронной специфичности NGF предполагали, что NGF не является вездесущим нейротропным фактором даже для сенсорных нейронов, поскольку NGF, как оказалось, не оказывает влияния на нейроны определенных сенсорных ганглиев головы цыпленка, особенно нодозного ганглия десятого черепного нерва. Позднее, исследования "ин виво" (Johnson et al., 1980, Science 210: 916-918, Pearson et al., 1983, Development Biol., 96:32-36) показали, что удаление во время эмбриогенеза не оказало действия на выживание нейронов в большинстве головных сенсорных ганглиев крысы, тогда как подобная обработка значительно уменьшила нейронное количество на сенсорных ганглиях, извлеченных из нейронного гребня. Более тщательные исследования "ин витро" (Lindsay and Rohrer, 1985, Develop Biol., 112:30-48, Davies and Lindsay, 1985, Develop Biol., 111:62-72, Lindsay et al., 1985, J. Cell Sci. Suppl. 3: 115-129) ясно показали, что NGF поддерживает выживание большинства извлеченных из нейронного гребня сенсорных нейронов, но не оказывает видимого эффекта на выживание головных сенсорных нейронов, выделенных из нейронных плакод.
Первой демонстрацией нейронной специфичности BDNF, отличающейся от NGF, был опыт "ин витро", при котором очищенный BDNF поддерживал выживание 40 - 50% сенсорных нейронов, диссоциированных из нодозного ганглия, извлеченного из нейронной плакоды цыплячьего эмбриона E6, E9 или E12 (Lindsay et al., 1985, J. Cell Sci. Suppl., 3:115-129) NGF не оказал видимого эффекта на эти нейроны как сам по себе, так и совместно с BDNF. Позднее, при исследованиях культур эксплантантов было показано, что BDNF, вероятно поддерживает выживание и отрастание нейритов от других сенсорных ганглиев, извлеченных из нейронной плакоды, включая височные, коленчатые и вентролатеральные тройничные ганглии (Davies et al., 1986, J. Neurosci, 6:1897-1904), ни один из которых не проявил чувствительности к NGF. Во всех вышеупомянутых исследованиях нейтрализующие антитела к NGF не оказывали действия на наблюдаемую активность BDNF. В дополнение к этим воздействиям на культурируемые нейроны из периферийных ганглиев, было обнаружено, что BDNF стимулирует выживание и нейронную дифференциацию клеток, культурированных из нейронного гребня перепелки (Kalcheim and Gendreau, 1988, Development Brain. Res., 41 : 79-86).
До настоящего изобретения, неспособность получать достаточные количества BDNF для иммунизации препятствовала производству анти-BDNF антител в сравнении с анти-NGF антителами по их действию на нейронные популяции и не позволяла осуществить эксперименты по BDNF/NGF перекрестной нейтрализации. Два недавних исследования, проведенных с BDNF (Kalcheim et al., 1987, EMBO, 6: 2871-2873), Hofer and Barde 1988 Nature 331:261-262/ показали, однако, физиологическую роль, играемую BDNF в развитии птичьей периферийной нервной системы (ПНС). Если "ин ово" (в яйце) помещали механический барьер между E3/E4 DRG (3-ий или 4-ый эмбриональный день дорсальных корневых ганглиев) и их мишенью центральной нервной системой в нервной трубке, то наблюдали гибель многих DRG нейронов (Kalcheim and Douarin, 1986, Develop Biol., 116: 451-466). Предположили, что эта гибель нейронов может быть вызвана отсутствием происходящего от ЦНС (нервной трубки) нейротропного фактора. В последующем наблюдали, что BDNF, прикрепленный к покрытой ламинином сиаластиковой мембране, может предотвращать эту гибель клеток (Kalcheim et al., 1987, EMBO, 6:2871-2873).
Было обнаружено, что инъекции BDNF в развивающиеся яйца перепелки снижают естественную гибель клеток в нодозных ганглиях, эффект, не наблюдавшийся с NGF (Hofer and Barde, 1988, Nature, 331:261-262). В дополнение к этому действию на периферийные сенсорные нейроны происхождения как из нейронного гребня, так и нейронной плакоды, было обнаружено, что BDNF поддерживает выживание развивающихся нейронов ЦНС. Джонсон и др. (1986, J. Neurosci, 6 3031-3938) представил данные, указывающие, что BDNF поддерживает выживание клеток ганглия сетчатки, культурированных из E17 эмбрионов крыс. Это продолжило предыдущие исследования, показавшие, что кондиционированная среда и мозговые экстракты, приготовленные из мишенных областей клеток ганглия сетчатки, очевидно, поддерживают выживание этих нейронов (McCaffery et al., 1982, Ex. Brain. Res. , 48: 37-386, Sarthy et al., 1983, J. Neurosci., 3: 2532-2544, Turner et al., 1983, Dev. Brain. Res).
В дополнение к его действию на выживание развивающихся в культуре нейронов, оказалось, что BDNF воздействует на нейроны периферийной и центральной нервной системы, которые находятся в культуре в зрелом состоянии. Было показано, что BDNF как и NGF, стимулирует аксонную регенерацию в культуре из DPG нейронов взрослой крысы (Lindsay., 1988, J. Neurosci., 8: 2394-2405), хотя зрелые сенсорные нейроны не проявили потребности в нейротропных факторах для поддержания "ин витро" более 3 или 4 недель. Кроме того, в культурах сетчатки взрослых крыс наблюдалось, что BDNF способствует как выживанию, так и удлинению аксонов из клеток ганглия сетчатки (Thanos et al., 1989, Eur. J. Neurosci., 1: 19-26). Сравнение биологического действия NGF и BDNF представлено в табл. I.
2.2.2. Нейронные мишени мозгового нейротропного фактора
Сенсорные нейроны периферийных нервных ганглиев происходят, как было обнаружено, из двух четко отличающихся, временных эмбриологических структур, а именно, из нейронного гребня и нейронных плакод. Нейронный гребень дает начало как нейронам, так и сателлитным клеткам автономных ганглиев и сенсорных ганглиев позвоночного нерва, т.е. DRG. Вклад нейронного гребня и нейронных плакод в формирование сенсорных ганглиев черепного нерва было изучено с использованием химерной (перепелка / цыпленок) трансплантационной системы, придуманной Le Douarin (1973, Develop Biol., 20: 217-222, Noden, 1978, Develop Biol. , 67: 313-329, Narayanan and Narayanan, 1980, Anat. Rec., 196: 71-82, Ayer-Le Lievu and Le Douarin, 1982, Develop Biol., 94: 291-310, D'Amico-Martel and Noden, 1983, Am. J. Anat, 166: 445-468). Как отмечено у Lindsay и др. (1985, J. Cell Sci. Suppl., 3: 115-129), теперь полагают, по крайней мере, для птиц, что нейроны дистальных ганглиев VII-го, IX-го и X-го черепных нервов (коленчатый, височный и нодозный ганглии, соответственно) и нейроны вестибулоакустического комплекса VIII-го черепного нерва имеют исключительно плакодное происхождение. Тройничный ганглий V-го черепного нерва содержит нейроны как гребешкового, так и плакодного происхождения (с нейронами плакодного происхождения, преобладающими на вентролатеральном полюсе максилло-мандибулярной доли), тогда как было обнаружено, что сателлитные клетки всех черепных ганглиев - полностью гребневого происхождения.
Из экспериментов "ин витро" с использованием как эксплантированных, так и диссоциированных, обогащенных нейронами культур сенсорных нейронов позвоночного и черепных нервов, было найдено, что сенсорные нейроны происходящие из нейронного гребня реагируют на NGF, напротив, нейроны, происходящие из нейронных плакод (включая нейроны вентролатеральной части тройничного ганглия и всю нейронную популяцию вестибулярного, коленчатого, височного и нодозного ганглиев), в основном, не отвечают на NGF во время эмбрионального развития. В контрасте к отличиям их потребностей и реакции на NGF, было обнаружено, что (см. Табл. I) как сенсорные нейроны плакодного, так и сенсорные нейроны гребневого происхождения отвечают на активность BDNF в отношении выживаемости и развития нейритов (Lindsay et al., 1985, J. Cell Sci. Suppl. , 3: 115-129, Lindsay et al., 1985, Develop Biol., 112: 319-328, Kalcheim and Gendrean, 1988, Develop Brain. Res., 41: 79-86).
Tebar и Barde, (1988, J. Neurosci, 8: 3337-3342) исследовали параметры связывания радиоактивно помеченного BDNF к нейронам ганглия дорсального корня эмбриона цыпленка; их результаты согласуются с существованием двух классов BDNF рецепторов, одного - с высокой аффинностью к BDNF, и другого - с низкой аффинностью. На симпатических нейронах не наблюдалось рецепторов с высокой аффинностью.
Barde et al. , 1987, Prog. Brain. Res., 71: 185-189) сделал дальнейший обзор известных нейронных мишеней BDNF. До настоящего изобретения, идентификация клеток, синтезирующих BDNF, была невозможна из-за отсутствия проб нуклеиновых кислот или антител, специфичных к BDNF. Попытки приготовить поликлональные или моноклональные антитела к BDNF были безуспешными. Эта неудача в получении антител воспрепятствовала молекулярному клонированию BDNF, определению физиологического эффекта лишения развивающихся нейронов BDNF "ин виво", количественному определению BDNF в тканях с использованием иммунологических исследований, и локализации BDNF с использованием иммунной цитохимии.
2.2.3. Клонирование гена, кодирующего мозговой нейротропный фактор
Клонирование гена BDNF было впервые осуществлено, как описано в патентной заявке США серийный номер 07/400591, поданной 30.08.89, которая полностью включена в настоящее описание путем ссылки. Вкратце, из свиного мозга были очищены крошечные количества белка BDNF, которые позволили определить фрагменты аминокислотных последовательностей, которые, в свою очередь, могли быть использованы для конструирования соответствующих олигонуклеотидов. Эти синтетические олигонуклеотиды затем использовали в качестве праймеров в цепной реакции полимеризации (PCR) с кДНК-матрицей, полученной из клеток, продуцирующих BDNF. PCR-продукты были использованы в качестве зондов для обеспечения клонирования полной кДНК и/или геномных генов BDNF различных видов животных, включая человека, свинью, крысу и мышь, и определили последовательности этих генов. Экспрессия рекомбинантных BDNF была осуществлена в COS клетках.
3. Краткое содержание изобретения
Настоящее изобретение касается нейротропина-3 (NT-3), недавно открытого члена генного семейства BDNF. Оно основано, отчасти, на идентификации областей с гомологией нуклеиновокислотных последовательностей BDNF и NGF (заявка США 07/400591, см. выше). Согласно настоящему изобретению, эти гомологичные области могут быть использованы для идентификации новых членов генного семейства BDNF/NGF, такую методику использовали для идентифицирования NT-3. Настоящее изобретение обеспечивает гены и генные продукты относящихся к BDNF/NGF нейротропных факторов, идентифицированных таким методом.
Настоящее изобретение касается, отчасти, молекул рекомбинантной ДНК, кодирующих NT-3. В частности, вариант выполнения изобретения предусматривает, что ДНК, кодирующая NT-3, извлекается из человеческой ДНК, или ДНК морской свинки, или ДНК крысы. Настоящее изобретение также обеспечивает векторы экспрессии рекомбинантной ДНК, включающие по меньшей мере часть нуклеиновых последовательностей, в основном, таких, как описано на Фиг. 2 (NT-3 морской свинки), Фиг. 7 (NT-3 крысы), или Фиг. 11 (NT-3 человека). Настоящее изобретение также обеспечивает векторы экспрессии рекомбинантной ДНК, которые могут быть использованы для производства рекомбинантного NT-3 протеина относящихся к нему пептидов.
В альтернативном выполнении настоящее изобретение обеспечивает NT-3 протеины и соответствующие пептиды, а также способы получения и приготовления таких пептидов и протеинов. Настоящее изобретение также относится к антителам, направленным против NT-3 протеинов и пептидов.
Согласно изобретению, NT-3 могут быть использованы для диагностики и/или лечения неврологических нарушений, включая, но не ограничиваясь этим, периферийные нейропатии, такие как диабетические нейропатии, токсические и пищевые нейропатии, наследственные нейропатии и нейропатии, связанные со СПИДом, а также дегенеративных заболеваний, таких как болезнь Альцхаймера. Было показано, что NT-3 поддерживает выживание допаминэргических нейронов; соответственно, в предпочтительном выполнении изобретения, NT-3 может быть использован для лечения болезни Паркинсона. Поскольку установлено, что NT-3 проявляет спектр активности, отличающийся от специфичности BDNF или NGF, NT-3 обеспечивает новые и ценные возможности для стимулирования роста и "ремонта" центральной нервной системы.
4. Описание фигур
Фиг. 1. Сравнение последовательностей BDNF и NGF различных видов животных. Анализ последовательности гена, кодирующего BDNF и дедукция аминокислотной последовательности выявили, что этот белок имеет множество структурных подобий с NGF. Первичная последовательность зрелого BDNF, так же как общая структура и вероятный характер процесса от предшествующего белка, предполагает со значительной уверенностью, что гены NGF и BDNF могут быть получены из общего предшественника-гена. Внутри области зрелых полипептидов, если в последовательность NGF для оптимизирования совместимости введено только три разрыва, то всего 51 аминокислотных тождественностей являются общими для ранее известных NGF многих видов, и для свиного и человеческого BDNF. Эти тождественности включают все шесть цистеиновых остатков, предполагая, что NGF и BDNF имеют очень похожую вторичную структуру. Кроме того, четыре сегмента из шести или более аминокислот также видны на этой фиг., у которых NGF всех приведенных выше в списке видов и из свиного BDNF являются также идентичными, или отличаются не более чем на примерно одну консервативную аминокислотную замену. Таким образом, разумно заключить, что NGF и BDNF являются тесно связанными членами генного семейства.
Фиг. 2. Геномная последовательность и выведенная аминокислотная последовательность NT-3 морской свинки. Аминокислотная последовательность начинается с первого АТГ-кодона, находящегося после 3 рамочных стоп-кодонов. Подчеркнутые последовательности указывают расположение праймеров, используемых на первом круге PCR. Единственная консенсусная последовательность N-гликозилирования подчеркнута дважды, а стрелки показывают предположительный старт получаемой зрелой NT-3.
Фиг. 3. Сравнение аминокислотных последовательностей между NT-3 зрелой мыши, NGF (Scott et al., 1983, Nature 302: 538-540) и BDNF (Leibrock et al., 1989, Nature, 341: 149-152). Показанная здесь последовательность BDNF зрелой мыши является на 100% идентичной последовательности свиного BDNF. Жирным шрифтом и тенями указаны аминокислоты, обнаруженные в идентичных положениях у всех трех белков, а стрелки показывают на все протеиновые остатки. Звездочками помечены разрывы, введенные для оптимизации структуры. V1 - V4 показывает 4 изменяемые области (домена), состоящие из более трех смежных аминокислот.
Фиг. 4. Тканевое распределение NT-3 мРНК у мыши. Двадцать микрограммов общей РНК наносили на каждую дорожку и гибридизировали меченой 32P пробой двухнитевой ДНК. (A) Во всех тканях видна единственная полоса, соответствующая примерно 1,4 кб (тысяч оснований), слабейший сигнал наблюдался в легких и сильнейший в сердце. Скелетную мышцу брали из бедра. (B) В головном мозгу сильнейший сигнал был получен из аммонова рога и мозжечка.
Фиг. 5. Выживание сенсорных нейронов, выделенных из нодозных ганглиев, полученных от цыпленка на 8-й день эмбрионального развития. 5 тыс. клеток были помещены в чашку на полиорнитин-ламининовый субстрат, а выжившие нейроны подсчитывали через 24 часа. Используемая BDNF втрое больше минимальной концентрации, требуемой для получения максимального выживания. Не был обнаружен ни один выживший без добавления нейрон, или с кондиционированной средой, используемой при разведении 1 : 50 с нетрансфецированными COS клетками, или клетками, трансфецированными контрольной ДНК.
Фиг. 6. (A) PCR-продукт, полученный с использованием дегенеративных 1B и 2C праймеров (обозначенных R1B(2C) обнаруживает новый ген, NT-3, так же как и NGF и BDNF гены в геномной ДНК крысы. (B) Карта рестрикции крысиного NT-3 геномного клона. Два независимых клона бактериофагов, специфически гибридизирующихся к R1B/2C зонду, были выделены из геномной библиотеки крысы. Схематически представлена карта рестрикции одного из этих клонов, содержащего вставку размером 19,5 кб. Утолщенная линия указывает открытую рамку считывания (ORF) NT-3 (см. Фиг. 7A). Указано положение пробы R1B/2C.
Фиг. 7. Последовательность крысиного NT-3 и его гомология к крысиному NGF и крысиному BDNF. (A) нуклеотидная и аминокислотная последовательность NT-3. ORF, охватывающая последовательность ДНК, кодируемую NT-3 геном, с аминокислотной трансляцией, указанной выше последовательности ДНК, звездочками отмечены начало и конец открытой рамки считывания. Аминокислоты пронумерованы с позицией +1, относящейся к первому остатку зрелого NT-3 (119 аминокислот). Сайт расщепления, использованный для освобождения зрелого NT-3, взят в рамку, так же как консервированный сайт гликозилирования выше этого сайта расщепления; другой потенциальный сайт расщепления, подобным образом расположенный у предлагаемого промежуточного сайта прессинга а NGF (Darling et al. , 1987. , Cold Spring Harb Symp. Anant Biol. 1: 427-34), но который не консервирован в BDNF, взят в рамку и помечен "? CLEAVE". Шесть цистеинов в зрелом NT-3 подчеркнуты. Метиониновый кодон инициации короткой предшествующей формы NT-3 (в позиции - 139), который отмечает стартовый сайт "B" как обсуждается в тексте, также подчеркнут. На этой фиг. указана граница сайт-акцептор предлагаемой вставки/ интрон, расположенный вверх от стартового сайта "B". (B) Сравнительный анализ последовательностей крысиного NT-3 с крысиным NGF и крысиными BDNF. Компьютерная программа секвенирующего анализа МакВектора (купленная у Интернешнал Биотехнолоджиез Инк.) была использована для проведения матричного сравнительного анализа ORF крысиного NT-3 с ORF генов NGF и BDNF (с использованием размера окна 20 и минимальной совместимостью 20%). Значительные совместимости видны по диагонали этой матрицы и представлен внизу схематически продукт- NT-3 протеин; две гомологичные области вверх по зрелому NT-3, которые видны в сравнении с NGF и BDNF обозначены I и II. Как показано на этой фигуре, область I простирается вверх от стартового сайта "B", используемого для генерирования короткой предшествующей формы NT-3, подтверждая точку зрения, что существует более длинный предшественник. (C) Сравнение последовательностей NT-3, NGF и BDNF в гомологичных областях I и II. Последовательности в этих областях выравнены для максимизации гомологии, с разрывами, вставленными для такого выравнивания, которые обозначены "-". Совпадения BDNF или NGF с последовательностью NT-3 указаны звездочками, тогда как совпадения NGF с BDNF помечены точками в последовательности NGF. "+" вверху последовательности указывает остатки, которые полностью консервированы между крысиными NT-3, NGF и BDNF последовательностями всех исследованных видов животных. Показаны следующие сайты, определенные для NGF, ранее предсказанные BDNF и предложенные здесь для NT-3: стартовый сайт "B" метионинового кодона инициации, сайт расщепления сигнальной последовательности (Edwards et al. , 1988, Mol. Cell. Biol., 8: 2456-64); предложенный промежуточный сайт расщепления NGF, который отсутствует у BDNF, но имеется у NT-3; сайт-акцептор гликозилирования; сайт протеолитического расщепления, который освобождает зрелые факторы. (D) Сравнение последовательностей зрелых форм NT-3, NGF и BDNF. Консервированные цистеины помечены жирными квадратиками. "Звездочка", "точка" и "-", - как в (C). Указан также C-терминальный сайт расщепления, присутствующий только в последовательности NGF.
Фиг. 8. Сравнение активностей NGF, BDNF и NT-3 по результатам исследований на эксплантированных эмбриональных (8 день) ганглиях цыпленка. Фотомикрографии ганглиев дорсального корня (DRG) (панели A-D), нодозных ганглиев (панели E-H), и ганглиев симпатической цепи (SG) (панели 1-L) культивировали 24 часа (DRG и NG) или 48 часов. (SG) как в отсутствие любого нейтропного фактора (Контроль: A, E, 1) так и в присутствии супернатантов COS - клеток, содержащих NGF (B, F, Y), или BDNF (C, G, K), или NT-3 (D, H, L). Почти нет отрастания нейритов в контрольных культурах (500 μл COS-клеточного супернатанта от mock-трансфецированных клеток). NGF (10 μл COS - клеточного супернатанта) вызвал обильное отрастание нитей от DRG и SG, но не от NG. Увеличение количества NGF COS-клеточного супернатанта от 20 до 500 μл не оказало действия на NG. BDNF (10 μл COS-клеточного супернатанта) вызвало отрастания нитей от DRG и NG, но не от SG, более высокое количество (от 20 до 500 μл) не оказало влияния на SG. NT-3 (20 μл COS-клеточного супернатанта на DRS и NG, и 200 μл на SC) вызвало отрастание нитей у всех трех типов ганглиев, хотя инициация роста была более медленной и менее обильной, чем от SG. Ганглии культивировали в виде эксплантантов в коллагеновом геле (Lindsay R.M. и Rohrer H., 1985, Dev. Biol. 112: 30-48) в среде F14, с добавлением 5% лошадиной сыворотки, как было описано ранее (Lindsay и др. 1985, Dev. Biol. 112: 319-28). Цена деления = 200 μл.
Фиг. 9. NT-3 способствует выживанию и отрастанию нейритов в высокообогащенных культурах DRG нейронов. Фотомикрографии обогащенных нейронами (более 95% нейронов) культур диссоциированных DRG эмбриона (8 дней) цыпленка, обработанных в течение 48 часов или (A) супернатантом (500 μл) из mock-трансфецированных COS-клеток, или (B, C) супернатантом (50 μл) из NT-3 трансфецированных клеток. A и B - микрографии в темном поле; в A (контрольная культура) выжило менее 5% нейронов на чашке; в B число нейронов, перенесших этот процесс, составило примерно 60% от помещенных на чашку нейронов. Из кривой реакции на дозировку обнаружено, что максимальный эффект NT-3 оказывает на цыплячьи E8 DRG-нейроны. (C) Фазоконтрастная микрография той же культуры, что и в B, но при большем увеличении. Обратите внимание на большое количество ярких нейронных клеточных тел и фактическое отсутствие каких-либо не-нейронных клеток. Культуры были созданы, как описано ранее (Lindsay et al., 1985, Dev. Biol. 112: 319-28). Цена деления = 150 μл. (C)
Фиг. 10. Сравнение, путем назерн-блоттинга, экспрессии NT-3, NGF и BDNF в тканях грызунов. Из указанных тканей крыс (левые панели) или мышей (правые панели) была приготовлена РНК (Auffray, C. и Rougeon F., 1980, Eur. J. Biochem. , 107: 303-14). Десять микрограмм РНК из указанных источников затем фракционировали на 1%-ных формальдегид-агарозных гелях и переносили на нейлоновую мембрану в 10X SSC; тройные назерн-блоты гибридизировали (Mahmoud, M. и Lin V. K. , 1989, Biotechniques 7: 331-3) при 68oC с 32P-меченого (Feinbern, A. P. и Vogelstein, 1984, Anal. Biochem, 137: 266-7) крысиного NT-3, крысиного BDNF и крысиного NGF фрагментов ДНК, а затем промывали при 68oC в 2X SSC, 0,1% SDS. Фрагменты ДНК для NT-3, BDNF и NGF извлекли из экспрессионных конструкций, содержащих эти гены в pCDM18, xhoI инсерты размером примерно 775 бр в этих конструкциях были очищены на геле перед радиомечением. Включена картинка геля, окрашенного этид-бромидом, позволяющая сравнить общее количество РНК на образец.
Фиг. 11. Сравнительные последовательности ДНК крысиного и человеческого NT-3 генов. Прогнозируемый сайт начала трансляции указан "PREPRO-" и прогнозируемое начало зрелого NT-3 указан словом "MATURE". Зрелые крысиный и человеческий NT-3 протеины имеют идентичные аминокислотные последовательности, тогда как их "рrерrо" - области отличаются в одиннадцати положениях, которые подчеркнуты.
Фиг. 12. Экспрессия человеческого NT-3 полипептида, обнаруженная метаболическим мечением. 5 • 105 COS-M5 клеток на чашку посеяны в 60 мм чашки Петри и выращивались в течение ночи при 37oC в полной ДМЕМ среде с 10% общей бычьей сыворотки (FBS). Эти клетки трансфецировали (с использованием CaPO4 метода, описанного Chen и Okayama, 1987, Mol. Cell. Biol. 7: 2745-52) с 20 μл плазмид pC8-hN3 (P1), содержащих ген человеческого NT-3 при регулировании промотором цитомегаловируса или же mock-трансфецировались (без плазмидной ДНК). Через 48 часов, клетки промывали и инкубировали в течение 1 часа в 1 мл свободной от метионина и цистеина среде ДМЕМ с 1% бычьей сыворотки. К каждой культуре добавляли смесь 35S метионина и 35S цистеина (по 100 μл Ci каждого, от New England Nuclear), затем клетки инкубировали дальше в течение 4 часов при 37oC, в полученной среде. Образцы по 50 μл смешивали с 25 μл буфера двойной силы образца, содержащего Na-додецил-сульфат (SDS), кипятили 5 минут и подвергали электрофорезу на 15%-ном полиакриламидном геле в присутствии SDS (Laemueli, 1970, Nature, 227: 680-685). Эти протеины с помощью электрофореза (3 часа, 100 мА) переносили на нейлоновую мембрану ("иммобилон" от "Миллипор"), с использованием буферов, описанных Towbin et al. , 1979, Proc. Natl. Acad. Sci USA. 76: 4350-4354. Фильтры высушивали воздухом, и меченые белки обнаруживали авторадиографией (16 часов при температуре окружающей среды, с использованием Кодак X-AR пленки с усиливающим экраном - Cronex, Du Pont).
Фиг. 13. Линейный график, показывающий количество выживших тирозин гидроксилазных клеток на культуру без NT-3 супернатанта (O) или с разведениями 1:300, 1:100, 1:50 или 1:25 содержащего NT-3 супернатанта.
Фиг. 14. Линейный график, аналогично описанию Фиг. 13, за исключением того, что клетки находились в чашках с плотностью 9000.000 на чашку.
Фиг. 15-A. Сравнение синтетических транскриптов NT-3, BDNF и NGF. Гибридизация дот-блоттингом с использованием радиомеченых олигонуклеотидов, гомологичных обменной последовательности у 5' конца всех трех транскриптов контролирует, чтобы равные количества (2 нг) синтетических транскриптов NT-3, BDNF и NGF, вначале подсчитанные спектрофотометрически, использовались в виде определенных стандартов.
-B. Определение уровней NT-3, BDNF и NGF мРНК в общей РНК, приготовленной из головного мозга взрослой крысы, в сравнении с определенными стандартами синтетических РНК, 10 мкг общей РНК. выделенной из головного мозга взрослой крысы, и 4, 10 и 20 пг синтетических транскриптов, соответствующих каждому нейротропину, были подвергнуты назерн-блоттингу и гибридизации к радиомеченым зондам, специфичным к каждому нейротропину.
Фиг. 16. Экспрессия генов NT-3, BDNF, NGFR и в общей РНК (по 10 μг на дорожку), приготовленной из крысиных эмбрионов (A), развивающегося головного мозга крысы (B) и в выбранных перинатальных и взрослых тканях (C). Ткани: A. BR: образец взрослого головного мозга, стандартизированный на Фиг. 1B; PLAC: плацента, EMB: весь эмбрион, SP.C: спинной мозг; THY: тимус, LIV: печень; HRT: сердце; BR: головной мозг. Размеры транскриптов указаны справа в тысячах оснований (кб).
Фиг. 17. Экспрессия генов NT-3, BDNF, NGF и NGFR в общей РНК (по 10 μг на дорожку), приготовленной из дискретных областей нервной системы новорожденных (A) и взрослых (B).
Области: A. BR: образец взрослого головного мозга, стандартизированного на Фиг. 17B; CBL: мозжечок; HBR: задний мозг; MBR: средний мозг; DIEN: промежуточный мозг; STR: striatum; H1P: аммонов рог; CTX: неокортекс; ADR: надпочечник; RET: сетчатка; SC.N: седалищный нерв; SP.C: спинной мозг.
Фиг. 18. Количественное определение уровней транскриптов NT-3, BDNF и NGF (фиг. 18A, 18B) в участках ЦНС и периферийных тканях, новорожденных и взрослых. Денситометрическое сканирование многих продуктов назерн-блоттинга, включая описанные на Фиг. 16, 17, 19 и у Мэзонпьера (Maisonpierre et al., 1990, Science, 247: 1446-1451), было использовано для получения результатов. Все уровни стандартизированы относительно уровней нейротропина во взрослом головном мозге; уровни во взрослом головном мозге, сходные у трех нейротропинов (см. текст) установлены за единицу для каждого нейротропина. Значения вне масштаба включены на верху сломанных вертикальных полос. Невральные и не-невральные образцы указаны на фигуре. Образцы: BRN: головной мозг, не включающий мозжечок, CBL: мозжечок, HBR: задний мозг, MBR: средний мозг, DIB: промежуточный мозг, STR: Striatum, H1P: аммонов рог, CTX: неокортекс, OLF: обонятельная луковица, SP.C: спинной мозг, SC.N: седалищный нерв, RET: сетчатка, ADR: надпочечник, HRT: сердце, LIV: печень, THY: тимус, SKN: кожа, MUS: скелетная мышца, LNG: легкое, INT: кишечник, KID: почка, SPL: селезенка.
Фиг. 19. Экспрессия генов NT-3, BDNF и NGF и NGFR в период развития спинного мозга (A, E), мозжечка (B, F) и аммонова рога (C, G). 10 г общей РНК, приготовленной из указанных временных моментов развития сравнили с экспрессией различных транскриптов. Денситометрическое количественное определение уровней транскриптов нейротропина показано в E, F, G.
Подробное описание изобретения
Настоящее изобретение касается нейротропина-3, нового члена BDNF/NGF семейства нейротропных молекул, а также других членов BDNF/NGF семейства, которые могут быть идентифицированы с использованием аналогичной методики. Для большей ясности описания, но не для ограничения, детальное описание изобретения разделено на следующие подразделы:
(I) идентификация дополнительных членов семейства BDNF/NGF
(II) клонирование нейротропина-3
(III) экспрессия нейротропина-3
(IV) исследование биологической активности нейротропина-3
(V) гены и белки нейротропина-3
(VI) генерирование антител против нейротропина-3, и
(VII) применение изобретения
5.1. Идентифицирование дополнительных членов семейства BDNF/NGF
NGF и BDNF являются основными протеинами с примерно 120 аминокислотами, которые содержат около 50% идентичности аминокислотной последовательности, включая абсолютное консервирование шести цистеиновых остатков, которые, в активном NGF, образуют три дисульфидных мостика, как было показано Bradshow, A. . 1978, Ann. Rev. Biochem, 47: 191-216; Leibrock et al., 1989, Nature, 341: 149-52). Сравнение последовательностей NGF от эволюционно дивергентных видов обнаружило, что аминокислоты, фланкирующие эти цистеиновые остатки, включают наиболее высоко консервированные области молекулы (Meier et al., 1986, EMBO, 5: 1489-93; Selby et al., 1987, J. Neurosci Res., 18: 293-8). Удивительно, что эти области являются также областями, которые наиболее сходны между BDNF и NGF (Leibrock et al, 1989, Nature, 341: 149-52).
Рациональный поиск дополнительных членов семейства BDNF/NGF может быть проведен с использованием подхода, использующего существование консервированных сегментов сильной гомологии между NGF и BDNF. Например, дополнительные члены семейства генного семейства BDNF могут быть идентифицированы селекцией, из разнообразных нуклеиновых последовательностей, которые являются гомологичными BDNF и NGF, и в дальнейшем идентифицированием, из отобранных селекцией последовательностей, которые также содержат нуклеиновокислотные последовательности которые негомологичны BDNF и NGF. Выражение "негомологичный" может быть использовано по отношению к области, которая содержит по меньшей мере около шести смежных нуклеотидов, в которых по меньшей мере около двух нуклеотидов отличаются от последовательности NGF и BDNF.
Настоящее изобретение также касается рекомбинантных молекул ДНК, которые гомологичны BDNF и NT-3, или, альтернативно, NGF и NT-3, но которые также содержат области, негомологичные BDNF и NT-3, или NGF и NT-3, соответственно. Эти дополнительные члены генного семейства BDNF / NGF / NT-3 могут быть идентифицированы с использованием молекулярных проб, которые соответствуют областям гомологии. При дальнейшем анализе, обнаружено, что эти члены генного семейства BDNF / NGF / NT-3 обладают последовательностями которые, отличаются от последовательностей известных членов генного семейства BDNF / NGF / NT-3.
Например, предпочтительное специфическое выполнение изобретения обеспечивает следующий метод. Соответственно каждому из четырех консервированных сегментов ("рамки") указанных в Табл. III (см. ниже), могут быть синтезированы комплекты дегенерированных олигонуклеотидных проб размером около 10 - 20 нуклеотидов, представляющие все из возможных кодирующих последовательностей для аминокислот, обнаруженных в NGF или BDNF с тремя или семью кодонами. Пронумеровав по отношению к амино-окончанию зрелых полипептидов (так, что His 134 prepro BDNF обрабатывается как His I в зрелом протеине), четыре рамки могут быть охарактеризованы следующим образом (нумерация относительно человеческих зрелых протеинов)
Синтетические олигонуклеотиды, происходящие из пар последовательностей из рамок, показанных в Табл. III, могут быть использованы в качестве праймеров для амплифицирования PCR-последовательностей из источника (РНК или ДНК), представляющего потенциальный интерес. Этот источник может включать мРНК или кДНК или геномную ДНК от любых эукариотических видов, которые могут экспрессировать полипептид, близкосродственный BDNF или NGF. Проведением всего лишь шести реакций PCP (а именно: праймер из рамки 1 с праймером из рамки 2; рамка 1 с рамкой 3; рамка 1 с рамкой 4; рамка 2 с рамкой 3; рамка 2 с рамкой 4; рамка 3 с рамкой 4), можно обнаружить ген или генный продукт, имеющий два из четырех вышеуказанных сегментов консервированной последовательности NGF и BDNF. Если синтезировать несколько различных дегенерированных праймеров для каждой рамки, то все еще возможно провести полный поиск с довольно малым количеством PCR реакций. Также можно изменять строгость условий гибридизации используемых при примировании PCR реакций, чтобы допустить большее или меньшее подобие нуклеотидной последовательности между неизвестным геном и NGF или BDNF. Если сегмент ранее неизвестного клона BDNF / NGF генного семейства успешно амплифицируется, то этот сегмент может быть молекулярно клонирован и секвенирован, и использован в качестве зонда для выделения полной кДНК или геномного клона. Это, в свою очередь, позволит детерминирование полной последовательности неизвестного гена, анализ его экспрессии и производство генного продукта для функционального анализа.
В дополнение, настоящее изобретение обеспечивает использование гомологий последовательностей BDNF / NGF для конструирования новых рекомбинантных молекул, которые являются членами генного семейства BDNF / NGF, но которые не встречаются в природе. В качестве примера, но не для ограничения, рекомбинантная молекула может быть сконструирована согласно изобретению с включением частей как NGF, так и BDNF генов. Такая молекула могла бы проявлять свойства, связанные и с BDNF, и с NGF, и отобразить новый профиль биологических активностей, включая агонистов, так же как и антагонистов. Первичная последовательность BDNF и NGF может быть также использована для прогнозирования третичной структуры молекул с использованием компьютерного моделирования. (Hopp и Weods, 1981, Proc. Natl. Acad. Sci, США, 78: 3824-28); BDNF / NGF химерные рекомбинантные гены могут конструироваться в свете корреляций между третичной структурой и биологической функцией аналогично, могут быть сконструированы химерные гены, включающие части любого одного или нескольких членов генного семейства BDNF / NGF.
5.2. Клонирование Нейротропина-3
NT-3 ген из любого организма может быть идентифицирован с использованием областей гомологии, разделяемых BDNF / NGF, с использованием вышеуказанных методов. В двух предпочтительных, специфических выполнениях настоящего изобретения, этот ген может быть идентифицирован и клонирован следующим образом:
В одном предпочтительном выполнении, один смысловой (или 5') праймер, имеющий нуклеотидную последовательность (используя номенклатуру ИЮПАК) GGGGATGGGG GG1 TGY MG1 GG1 ATH GA (праймер 1, который включает Bam H1 и Sac II эндонуклеазные сайты расщепления, и антисмысловой (или 3') праймер, имеющий нуклеотидную последовательность.
TCGAATTCTAG AT 1CK 1AT RAA 1CK CCA
(праймер 2, который включает Eco R1 и Xba 1 сайты), могут быть использованы в pcp реакции. (Saiki и др. 1985, Sience, 230: 1350-1354) в коммерческой термоячейке (например, "Perkin - Еlmer Cetus" термоячейке) и с термостабильной ДНК-полимеразной из термус акватикус (Taq-полимераза). После примерно четырех циклов ренатурирующей температуры 45oC, остальные 36 циклов могут быть осуществлены при ренатурирующей температуре 49oC. Полученные ДНК-продукты амплификации затем могут быть разделены посредством электрофорезом на полиакрилмидном геле, и продукт, соответствующий ожидаемому размеру (около 137 пар оснований), может быть элюирован, реамплифицирован и затем переварен двумя рестрикционными эндонуклеазами, одна из которых расщепляет последовательность гена NGF, организма, в котором амплифицирован сегмент, а другая расщепляет последовательность гена BDNF организма внутри амплифицированного сегмента. Нерасщепленная ДНК (которая предположительно не кодирует ни NGF, ни BDNF, имеющая ускользающее расщепление рестрикционной эндонуклеазы) может быть затем быть выделена из расщепленной ДНК электрофорезом на полиакриламидном геле, элюирована и асимметрично амплифицирована (Inuis и др. , 1988, Proc. Natl. Acad. Sci, США, 85: 9436-9440) и секвенирована (Sanger и др. , 1979, Proc. Natl. Acad. Sci, США, 72: 3918-3921) с использованием, например, праймеров 1 и 2. Основанные на полученной таким образом последовательности, дополнительные смысловой и антисмысловой праймеры могут быть сконструированы, которые более точно отражают последовательность нового гена. Например, дополнительные смысловые праймеры, такие как
GGGATTGATGAC AAA (праймер 3), и
ACTCTCAGTGCAAAACTTCGC (праймер 4), и антисмысловой (5') праймер CGGATCCGAATTCTGCAG (T)12 V (праймер 5) могут использоваться. РНК, приготовленная из тканей, способных продуцировать нейротропную активность, такой как головной мозг (с использованием любого стандартного метода, такого, как описан Окаямой 1987, Meth. Enzymol 154: 3-28), может транскрибироваться в обратном порядке с использованием, например, праймера 5, который сконструирован для совпадения с 3' поли(A)концами и содержит сайты рестрикции эндонуклеазного расщепления для Bam H1, Eco R1 и PstI (Leibrock и др., 1989, Nature, 341: 149-152). Полученная кДНК может затем PCR-амплифицироваться с использованием праймеров 4 и 5. Затем может быть проведен саузерн-блоттинг с использованием продуктов последней реакции, и гибридизирована к олигонуклеотидной пробе с меченым 32P концом, соответствующей последовательности вниз от праймеров 3 и 4 последовательностей. Фрагменты ДНК, идентифицированные таким образом, затем могут быть клонированы в подходящий вектор, и полученный длиннейший инсерт может быть использован для скрининга геномной библиотеки, полученной от интересующего организма. Позитивные клоны, идентифицированные таким образом, могут быть затем проанализированы стандартным рестрикционным картированием и нуклеотидным секвенированием.
В другом предпочтительном выполнении изобретения, могут быть синтезированы дегенерированные олигонуклеотиды, соответствующие сегментам четырех белковых последовательностей, консервированных между NGF и BDNF. Например, эти аминокислотные последовательности (представленные на фиг. 7D) могут быть
(1) Gly - Glu - (Tyr / Phe) - Ser - Val - Cys - Asp - Ser;
(2) Lys - Gen - Tyr - Phe - (Tyr / PhE) - Glu - Thr - Lys - Cys;
(3) Glu - Cys - Arg - Jle - Asp;
(4) Trp - Arg - Phe - Jle - Arg - Jle - Asp - Thr - (Ser / Ala) - Cys - Val - Cys
В PCR-реакциях могут быть использованы серии дегенерированных смысло- и антисмысловых олигонуклеотидов (содержащие участки длиной 15 - 26 нуклеотидов, соответствующие 5 - 9 аминокислотам вышеупомянутых протеиновых последовательностей как в смысловой, так и в антисмысловой направленности, а также недегенированные "хвостовые" сайты узнавания рестрикционного энзима). Реакция амплификации между парами расположенных выше смысловых и расположенных ниже антисмысловых праймеров могут быть осуществлены при стандартных условиях или, предпочтительно, оптимальных условиях для каждой праймерной пары могут быть определены экспериментально. Например, смысловой праймер (соответствующий аминокислотной последовательности (1), см. выше).
5' GACTCGACTCGACATCC-CTN - TGY - GAY - WST - RTN - WS - 3'
и антисмысловой праймер (соответствующий аминокислотной последовательности (2), см. выше),
5' - CCAAGCTTCTAGAATTC-CA-YTT-NGT-YTC-RWA-RAA-RTA-YTC-3' могут быть использованы в реакции амплификации с использованием геномной ДНК или кДНК, происходящей от подходящего источника в качестве матрицы. Продукты реакций амплификации с использованием пар расположенных вверху смысловых и расположенных внизу антисмысловых праймеров могут быть использованы в качестве зондов гибридизации на саузерн-блоттинг геномной ДНК для идентифицирования PCR-продукта, который гибридизирует к последовательности геномной ДНК, которая содержит последовательности, гомологичные зондам, так же как и области, не гомологичные зондам (например, не NGF, не - BDNF последовательности). PCR-продукт, который идентифицирует новую последовательность геномной ДНК, может быть использован для скрининга библиотек генома или кДНК и при этом для селекции клонов, кодирующих новых членов генного семейства NGF / BDNF.
5.3. Экспрессия Нейротропина-3
Нуклеотидная последовательность, кодирующая белок NT-3, или его часть может быть вставлена в соответствующий вектор экспрессии, т.е. в вектор, который содержит необходимые элементы для транскрипции и трансляции инсертируемой протеин-кодирующей последовательности. Необходимые сигналы транскрипции и трансляции могут быть также обеспечены нативным NT-3 геном и/или его фланкирующими областями. Различные системы хозяев-векторов могут быть использованы для экспрессии протеин-кодирующей последовательности. Сюда входят (но не ограничиваются ими) системы клеток млекопитающих, инфицированных вирусом (например, вирусом коровьей оспы, аденовирусом и т.д.); клеточные системы насекомых, зараженных вирусом (например, бакуловирусом); микроорганизмы, такие как дрожжи, содержащие дрожжевые векторы, или бактерии, трансформированные ДНК бактериофагов, плазмидной ДНК или космидной ДНК. В предпочтительном выполнении изобретения, вектор экспрессии может включать промотор CMV (Stephens и Cockett, 1989, Nucl. Acids. Res., 17: 7110) и SV 40 источник репликации. Экспрессионные элементы этих векторов различаются по своей силе и специфичности. В зависимости от используемой системы вектора-хозяина, любой из числа подходящих элементов транскрипции и трансляции может быть использован.
Любой из ранее описанных методов инсерции фрагментов ДНК может быть использован для конструирования векторов экспрессии, содержащих химерный ген, состоящий из соответствующих сигналов контроля транскрипции/трансляции и кодирующих протеин последовательностей. Эти методы могут включать ин витро-рекомбинантную ДНК и "ин виво" рекомбинации (генетические рекомбинации). Экспрессия нуклеиновокислотной последовательности, кодирующей протеин NT-3 или пептидный фрагмент, может управляться второй нуклеиновокислотной последовательностью так, что NT-3 протеин или пептид экспрессируется в хозяине, трансформированном молекулой рекомбинантной ДНК. Например, экспрессия NT-3 может контролироваться любым элементом промотор/энхансер, известным по уровню техники. Промоторы, которые могут использоваться для управления экспрессией NT-3, но не ограничиваются ими, это - область промотора SV 40 (Bernoist и Chambon, 1981, Nature 290: 304-310), промотор, содержащийся в 3' длинном терминальном повторе вируса Саркомы Rous (Jamamoto и др., 1980, Cell, 22: 787-797), промотор тимидин-киназы герпеса (Wagner и др., 1981, Proc. Natl. Acad. Sci, США, 78: 144-1445), регуляторные последовательности гена металлотионеина (Brinster и др., 1982, Nature, 296: 39-42) прокариотические векторы экспрессии, такие как промотор β -лактамазы (Villa-Kamaroff и др. , 1989, Proc. Natl. Acad. Sci, США 75: 3727-3731), или tac-промотор (DeBoer и др. , 1983, Proc. Natl. Acad. Sci, США, 80: 21-25), см. также "Useful proteins from recombinant bacteria" в "Sientific American", 1980, 242: 74-94; растительные векторы экспрессии, включающие промоторную область нопалин-синтетазы (Herrera- Estrella и др., Nature, 303: 209-213) или промотор 35S РНК вируса мозаичной болезни цветной капусты (Gardner и др., 1981, Nucl. Acids. Res., 9: 2871), и промотор для фотосинтетического энзима рибулозо-бифосфат-карбоксилазы (Herrera-Estrella и др., 1984; Nature, 310: 115-120), промоторные элементы от дрожжей и других грибков, такой как промотор Ga1 4, ADC (алкоголь-дегидрогеназы) промотор, PGK (фосфоглицерин-киназы) промотор, промотор щелочной фосфатазы, и следующие животные области транскрипционного контроля, которые проявляют тканевую специфичность и были использованы в трансгенных животных: область управления геном эласты 1, который активен в панкреатических ацинарных клетках (Swift и др., 1984, Cell, 38: 639-646, Ornitz и др., 1986, Gold Spring Harbor Symp. Quant Biol., 50: 399-409; MacDonald, 1998, Hepatology, 7: 425-515), управляющая область гена инсулина, активная в бета-клетках поджелудочной железы (Hanahan, 1985, Nature, 315: 115-122), область управления геном иммуноглобулина, активная в лимфоидных клетках (Grossheld и др., 1984, Cell, 38: 647-658, Adames и др., 1985, Nature, 318: 533-538, Alexander и др., 1987, Mol. Cell. Biol., 7: 1436-1444), управляющая область вируса опухоли мышиной молочной железы, активная в семенниках, грудных, лимфоидных и плодных клетках (Leder и др., 1986, Cell, 45: 485-495), управляющая область гена альбумина, активная в печени (Pinkert и др., 1987, Genes and Devel., 1:268-276), управляющая область гена альфафетопротеина, активная в печени (KrumCauf и др., 1985, Mol. Cell Biol. , 5: 1639-1648, Hammer и др., 1987, Hammer, 235: 53-58), управляющая область альфа-1-антитрипсинового гена, активная в печени (Kelsey et al., 1987, Genes and Devel. 1: 161-171), управляющая область гена бета-глобина, активная в миелоидных клетках (Mogram et al., 1985, Nature, 315: 338-340; Kollias et al., 1986, Cell, 46: 89-94), управляющая область гена основного протеина миелина, активная в олигодендроцитных клетках головного мозга (Readhead et al., 1987, Cell, 48: 703-712), управляющая область гена миозина легкой цепи-2, активная в скелетной мускулатуре (Sani, 1985, Nature, 314: 283-286), и управляющая область гена гонадотропного освобождающего гормона, активная в гипоталамусе (Mason et al., 1986, Science 234: 1372-1378).
Векторы экспрессии, содержащие вставки гена NT-3, могут быть идентифицированы тремя общими подходами: а) гибридизация ДНК-ДНК, б) присутствие или отсутствие функций гена "маркера" и с) экспрессия вставленных последовательностей. В первом подходе, присутствие вставленного в вектор экспрессии чужеродного гена может быть обнаружено ДНК-ДНК гибридизацией с использованием последовательностей, которые являются гомологичными инсертированному NT-3 гену. Во втором подходе, система рекомбинантный вектор/хозяин может быть идентифицирована и отобрана на основе присутствия или отсутствия определенных функций гена - "маркера" (например, тимидин-киназная активность, резистентность к антибиотикам, фенотип трансформации, образование окклюзионного тела в бакуловирусе и т.д.), вызываемых инсерцией чужеродных генов и вектор. Например, если NT-3 ген вставлен внутри маркерной генной последовательности вектора, то рекомбинанты, содержащие NT-3 вставку могут быть идентифицированы посредством отсутствия функции маркерного типа. В третьем подходе, рекомбинантные векторы экспрессии могут быть идентифицированы путем исследования продукта чужеродного гена, экспрессированного рекомбинантом. Такие исследования могут быть основаны, например, на физических или функциональных свойствах NT-3 генного продукта в биоэкспериментальных системах.
Когда конкретная рекомбинантная молекула ДНК идентифицирована и выделена, для ее распространения (тиражирования) могут быть использованы несколько известных методов. Когда установлены условия роста и подходящая система-хозяина, рекомбинантные экспрессионные векторы могут быть размножены и получены в большом количестве. Как объяснялось ранее, могут быть использованы векторы экспрессии, которые включают, но не ограничиваются, следующими векторами или их производными: вирусы человека или животных, такие как вирус коровьей оспы или аденовирус, вирусы насекомых, такие как бакуловирус, дрожжевые векторы, бактериофаговые векторы (например, лямбда), и векторы плазмидной и космидной ДНК, и т.п.
В дополнение, штамм клеток-хозяев может быть выбран таким, чтобы он моделировал экспрессию вставленных последовательностей, или модифицировал и производил генный продукт желаемым специфичным образом. Экспрессия от определенных промоторов может быть усилена в присутствии определенных индукторов; так, можно управлять экспрессией созданного генетической инженерией протеина NT-3. Кроме того, различные клетки-хозяева обладают характерными и специфическими механизмами для трансляционного и пост-трансляционного процессинга и модификации (например, гликозилирования, расщепления) протеинов. Могут быть выбраны соответствующие клеточные линии или системы хозяев для обеспечения желаемой модификации и процессинга экспрессируемого чужеродного протеина. Например, экспрессия в бактериальной системе может быть использована для продуцирования негликозилированного нуклеотидного белкового продукта. Экспрессия в дрожжах продуцирует гликозилированный продукт. Экспрессия в клетках млекопитающих может быть использована для обеспечения "нативного" гликозилирования гетерологичного NT-3 протеина. Кроме того, различные системы вектор/хозяин могут влиять на прохождение таких реакций, как протеолитическое расщепление, до различной степени.
В специфическом выполнении изобретения, ДНК, кодирующая рrерrо NT-3 может быть клонирована в плазмиде pCMV, амплифицирована, а затем использована для трансфецирования COS клеток кальций-фосфатным методом (Chen и Okayama, 1987, Mol. Cell Biol. , 7: 2745-2752), NT-3 активность может быть затем собрана из клеточной культуральной среды (см. Примеры 6 и 7, ниже).
Был сделан вывод, что MGF синтезируется в двух различных формах-предшественниках, - длинной и короткой (Darling и др., 1983, Gold Spring Harbor Symp. Quant Biol., 48: 427-483). Короткая форма аналогична "рrерrо"-формам BDNF и NT-3. Согласно изобретению, может быть желательным использование экспрессионных систем, содержащих ДНК, кодирующую аналогичную длинную форму BDNF или NT-3. ДНК, кодирующая эти длинные формы-предшественники, может быть идентифицирована путем секвенирования кДНК или геномной ДНК в областях, выше областей, кодирующих зрелый BDNF или NT-3 пептид, и определение положения открытой трансляционной считывающей рамки. Сравнение последовательности NT-3 гена с последовательностью NGF и BDNF позволило предсказать длинный и короткий предшественники NT-3 протеина (Фиг. 7B). Эффективность экспрессии зрелого BDNF или NT-3 от длинной или короткой формы-предшественника может зависеть от используемой экспрессионной системы и может различаться у разных клеточных линий.
5.3.1. Идентификация и очистка генного продукта экспрессии
Когда идентифицирован рекомбинант, который экспрессирует ген NT-3, генный продукт может быть подвергнут анализу. Анализ может быть осуществлен путем исследований, основанных на физических и функциональных свойствах продукта, и включающих радиоактивное мечение продукта с последующим анализом гелевым электрофорезом.
Когда идентифицирован NT-3 протеин, он может быть выделен и очищен стандартными методами, включая хроматографию (например, ионный обмен, аффинность и гель-фильтрация колонной хроматографией), центрифугирование, дифференцированная растворимость, или любой другой стандартной технологией для очистки белков. Функциональные свойства могут быть оценены с использованием любого подходящего опыта на нейронах (но не ограничивая этим) ганглиев дорсального корня цыплячьего эмбриона, симпатических ганглиев или ганглиев, происходящих из невральных плакод.
5.4. Исследование биологической активности нейротропина-3
Согласно настоящему изобретению, может использоваться любая система, которая количественно или качественно указывает на NT-3 активность. Поскольку NT-3, в отличие от BDNF и NGF, содействует отрастанию нейритов как у происходящих от невральной плакоды нодозных ганглиев, так и у симпатических ганглиев, то любая из этих систем, в дополнение к системе культуры ганглия дорсального корня (DRG), может быть использована в качестве биоисследования на NT-3. Исследование с DRG может быть осуществлено как описано у Barde и др. (1980, Proc. Natl. Acad. Sci., США, 77: 1199-1203). Исследовательская система с нодозным ганглием может быть осуществлена как описано у Lindsay и др., 1985, Dev. Biol., 112: 319-328). Система с симпатическим ганглием может быть осуществлена как описано у Barde и др., 1982, EMBO, 1: 549-553).
5.5. Гены и протеины Нейротропина-3
С использованием описанных выше методов (см. также разделы 6 и 7), внизу были определены следующие нуклеиновокислотные последовательности, и были выведены дедукцией соответствующие им аминокислотные последовательности. Была определена последовательность геномного NT-3 мыши, которая изображена на Фиг. 7. Была определена геномная ДНК NT-3 последовательность человека, которая представлена на Фиг. 11, на которой также показаны ДНК последовательности крысы. Каждая из этих последовательностей, или их функциональных эквивалентов, может быть использована в соответствии с изобретением. Дополнительно, изобретение касается NT-3 генов и протеинов, выделенных от таких источников, как свиной, бычий, кошачий, птичий, лошадиный или кроличий, а также от приматов и любых других видов, у которых существует активность NT-3. Изобретение далее направлено на участки аминокислотных последовательностей NT-3, содержащие по меньшей мере 10 нуклеотидов, такие суб-последовательности включают способные к гибридизации участки NT-3 последовательности, которые используются, например, в опытах по нуклеиновокислотной гибридизации, саузерн- и назерн-блот-анализах; и т.д. Изобретение также обеспечивает NT-3 протеин, его фрагменты и производные, согласно аминокислотным последовательностям, представленным на Фиг. 2, 7, и 11 или их функциональные производные. Изобретение также обеспечивает фрагменты или производные протеинов NT-3, которые включают антигенный детерминант (или детерминанты), или же которые являются функционально активными. В тексте описания выражение "функционально активный" означает "обладающий положительной активностью по результатам опытов на известную функцию NT-3, например, исследований с цыплячьим эмбрионом DRG, нодозным или симпатическим ганглием.
Например, нуклеиновокислотные последовательности, изображенные на Фиг. 2, 7 и 11 могут быть изменены путем замещений, дополнений или исключений, которые обеспечивают функционально эквивалентные молекулы. Благодаря дегенерации нуклеотидных кодирующих последовательностей, другие ДНК последовательности, кодирующие в основном ту же аминокислотную последовательность, изображенную на Фиг. 2, 7 и 11, могут быть использованы на практике согласно настоящему изобретению. Они включают, но не ограничиваются, нуклеотидные последовательности, включающие все или часть генов NT-3, изображенных на Фиг. 2, 7 и 11, которые изменены заменой различных кодонов, которые кодируют функционально эквивалентные аминокислотные остатки внутри этой последовательности, продуцируя таким образом "молчащую" мутацию. Аналогично, к NT-3 протеинам, или их фрагментам или производным по изобретению относятся, но не ограничиваются, такие протеины, которые содержат в качестве первичной аминокислотной последовательности, всю или часть аминокислотной последовательности, изображенной на Фиг. 2, 7 и 11, включая измененные последовательности, у которых функционально эквивалентные аминокислотные остатки замещены остатками внутри последовательности, приводящие к молчащей мутации. Например, один или более аминокислотных остатков внутри последовательности могут быть замещены другой аминокислотой похожей полярности, которая действует как функциональный эквивалент, приводящий к молчащему изменению последовательности. Замены для аминокислоты внутри последовательности могут быть выбраны из других членов класса, к которому принадлежит эта аминокислота. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные аминокислоты (щелочные), это - аргинин, лизин и гистидин. Отрицательно заряженные (кислотные) аминокислоты включают аспартовую кислоту и глутаминовую кислоту. В объем изобретения также включены NT-3 протеины или их фрагменты или их производные, которые дифференциально модифицированы во время или после транслирования, например, при гликозилировании, протеолитическом расщеплении, лигировании к молекуле антитела или другому клеточному лиганду, и т.п.
Дополнительно, данный NT-3 может быть мутирован "ин витро" или "ин виво" для создания и/или для разрушения последовательностей транслирования, инициации и/или терминации, или же для создания вариаций в кодирующих областях и/или образования новый сайтов рестрикции эндонуклеазами, или разрушения уже имевшихся сайтов рестрикции, для облегчения дальнейшего модифицирования "ин витро". Может быть использована любая технология мутагенеза, известная по уровню техники, включая, но не ограничиваясь, сайт-направлений мутагенез "ин витро" (Hutchinson и др., 1978, J. Biol. Chem., 253: 6551), использование TAB® линкеров ("Фармациа") и т.д.
5.6. Генерирование анти-нейротропиновых-3 антител
Согласно изобретению, NT-3 протеин, а также его фрагменты или производные, могут быть использованы в качестве иммуногена для генерирования анти-NT-3 антител.
Чтобы далее улучшить правдоподобие продуцирования анти-NT-3 иммунного ответа, аминокислотная последовательность NT-3 может быть проанализирована для идентифицирования участков молекулы, которые могут быть ассоциированы с повышенной иммуногенностью. Например, аминокислотная последовательность может быть подвергнута компьютерному анализу для идентифицирования поверхностных эпитопов, в соответствии с методом Hoop и Woods, 1981, Proc. Natl. Acad. Sci., США, 78: 3824-3828, который был успешно использован для идентифицирования антигенных пептидов Гепатита B поверхностного антигена. Альтернативно, выведенные аминокислотные последовательности NT-3 от различных видов могут быть сравнены и при этом идентифицированы относительно не-гомологичные области; эти не-гомологичные области скорее всего и будут иммуногенными для разных видов.
Для получения моноклональных антител, направленных против NT-3, может быть использована любая технология, которая обеспечивает производство молекул антител стабильной клеточной линией в культуре. Например, гибридомная технология, разработанная первыми Kohler и Milstein (1975, Nature, 256: 496-497), а также триомная технология - гибридома человеческих B-клеток (Kozbor и др., 1983, Immunology today, 4: 72), EBV - гибридомная технология для продуцирования человеческих моноклональных антител (Cole и др., 1985, в книге "Monoclonal Antibodies and Cancer Therapy", Alan R. Liss. Inc. pp. 77-96) и подобные им методы, которые охватывает настоящее изобретение.
Моноклональные антитела для терапевтического применения могут быть человеческими моноклональными антителами или химерными человеко-мышиными (или других видов) моноклональными антителами. Человеческие моноклональные антитела могут быть созданы любой из многочисленных технологий, известных по уровню техники (например, Teng и др., 1983, Proc. Natl. Acad. Sci., США 80: 7308-7312; Kozbor и др. , 1983, Immunology today, 4: 72-79; Olsson и др., 1982, Meth. Enzymol. 92: 3-16).
Молекулы химерных антител могут быть получены с содержанием мышиного антиген-связывающего домена с человеческими постоянными областями (Morrison и др. , 1984, Proc. Natl. Acad. Sci., США, 81: 6851, Takeda и др., 1985, Nature, 314-452).
Различные известные процедуры могут быть использованы для продуцирования поликлональных антител к эпитопам NT-3. Для получения антител, различные животные-хозяева могут быть иммунизированы инъекцией NT-3 протеина, или его фрагментов, или его производных, включая, но не ограничиваясь, кроликов, мышей, крыс и т.д. Различные адъюванты могут быть использованы для усиления иммунологической реакции, зависящей от вида животного-хозяина, и включает, но не ограничивается, минеральными гелями Фрейнда (полными или неполными), такими как алюминия гидроксид, поверхностно-активными субстанциями, такими как лизолецитин, плуроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианины лимфы улитки, динитрофенол, и потенциально полезные человеческие адъюванты, такие как BCC (Bacille Calmetle-Guerinl и Corymebacterium parvum).
Молекулярный клон антитела к эпитопу NT-3 может быть приготовлен известными методами. Технология рекомбинантной ДНК (см. , например, Маниатиса "Лабораторный учебник по Молекулярному клонированию, 1982, Gold Spring Harbor, Нью-Йорк) может быть использована для конструирования нуклеиновокислотных последовательностей, которые кодируют молекулы моноклональных антител, или их антиген-связывающие области.
Молекулы антител могут быть очищены известными методами, например, иммуноабсорбционной или иммуноаффинной хроматографией, хроматографическими методами, такими как HPLC (высокопроизводительная жидкостная хроматография), или их сочетаниями и т.п.
Фрагменты антител, содержащие идиотип молекулы, могут быть генерированы известными методами. Например, такие фрагменты включают, но не ограничиваются: F(ab')2 фрагмент, который может быть получен перевариванием молекулы антитела пепсином; Fab' фрагменты, которые могут быть генерированы путем уменьшения количества сульфидных мостиков F(ab')2 фрагмента, и 2Fab или Fab фрагменты, которые могут быть генерированы обработкой молекулы антитела папаином и редуцирующим агентом.
5.7. Применение изобретения
Настоящее изобретение касается нуклеиновокислотной последовательности NT-3 и в основном чистого протеина, пептидных фрагментов или производных NT-3. NT-3 может быть получен в количествах, достаточных для диагностики и терапевтического применения. Аналогично, анти- NT-3 антитела и NT-3 нуклеиновокислотные пробы могут быть использованы с целью диагностического и терапевтического применения. Для большинства целей, является предпочтительным использование NT-3 генов или генных продуктов тех же видов животных для диагностических или терапевтических целей, хотя также в специфических выполнениях изобретения может быть полезным перекрестно-видовое использование NT-3.
5.7.1. Диагностические применения
Настоящее изобретение, которое относится к нуклеиновым кислотам, кодирующим NT-3 и к протеинам, пептидным фрагментам или производным NT-3, а также к антителам, направленным против NT-3 протеина, пептидов или производных, может быть использовано для диагностики заболеваний или нарушений нервной системы, которые могут быть связаны с изменениями в паттерне экспрессии NT-3.
В различных выполнениях изобретения, NT-3 гены и соответствующие им нуклеиновокислотные последовательности и суб-последовательности, включая комплементарные последовательности, могут быть использованы в экспериментах по диагностической гибридизации. NT-3 нуклеиновокислотные последовательности и суб-последовательности, включающие около 15 нуклеотидов, могут быть использованы в качестве гибридизационных проб. Гибридизационные опыты могут быть использованы для обнаружения, прогнозирования, диагностики или мониторинга состояний, нарушений или заболеваний, связанных с изменениями в NT-3 экспрессии, включая, в частности, состояния, приводящие к повреждению сенсорных нейронов. Такие заболевания и состояния включают, но не ограничиваются, травмы ЦНС, инфаркцию, инфекцию, дегенеративное нервное заболевание, злокачественные болезни или послеоперационные изменения, включающие, но не ограничивающиеся, болезнь Альцхаймера, болезнь Паркинсона, хорея Хантингтона. Например, общая РНК в тканевом образце пациента может быть исследована на присутствие NT-3 мРНК, причем изменение количества NT-3 мРНК будет указывать на невральную дегенерацию
В альтернативном выполнении изобретения, антитела, направленные против NT-3 протеина, пептидных фрагментов или производных, могут быть использованы для диагностики заболеваний и нарушений нервной системы, включая, в частности, сенсорные нарушения и дегенеративные заболевания сетчатки, а также нарушения и заболевания, перечисленные выше. Антитела по изобретению могут быть использованы, например, в гибридизационной технологии "ин ситу" (на месте), с использованием тканевых образцов пациента при необходимости такой оценки. В другом примере, антитела по изобретению могут быть использованы в процедуре ELISA для обнаружения и/или измерения количеств NT-3, присутствующего в жидких образцах; подобным же образом антитела по изобретению могут быть использованы при вестерн-блот-анализе для обнаружения и/или измерения NT-3, присутствующего в ткани или жидких образцах.
В дальнейшем выполнении изобретения, NT-3 протеин, пептидные фрагменты или производные могут быть использованы для диагностики заболеваний и нарушений нервной системы. В частном выполнении, но не с целью ограничения изобретения, меченые NT-3 протеины или пептидные фрагменты могут быть использованы для идентифицирования тканей или клеток, которые экспрессируют NT-3 рецептор, чтобы идентифицировать аберрации экспрессии NT-3 рецептора и затем потенциальные отклонения от нормы в ткани, или клеточную реакцию на NT-3.
5.7.2. Терапевтические применения
Настоящее изобретение, которое относится к нуклеиновым кислотам, кодирующим NT-3 к белкам, пептидным фрагментам или производным, так же как к антителам, направленным против NT-3 протеина, пептидов или производных, может быть использовано для лечения болезней и нарушений нервной системы, которые связаны с изменениями паттерна экспрессии NT-3. или которые могут происходить из-за воздействия на организм NT-3 или анти-NT-3 антителами.
В различных выполнениях изобретения, NT-3 протеин, пептидные фрагменты или производные могут вводится пациентам, у которых нервная система была повреждена травмами, хирургией, ишемией, инфекцией, болезнями обмена веществ, голоданием (пищевой недостаточностью), злокачественными болезнями или отравлениями. В различных специфических выполнениях изобретения, NT-3 может быть введен местно к сенсорным нейронам, которые были рассечены, включая, но не ограничиваясь ими, нейроны в ганглиях дорсального корня или в любой из следующих тканей: коленчатый, височный или нодозный ганглии; вестибулоакустический комплекс VIII-го черепного нерва; вентролатеральный полюс максилло-мандибулярной доли тройничного ганглия, мезенцефальный тройничный нуклеус и симпатические ганглии. Может быть желательным вводить относящиеся к NT-3 пептиды или NT-3 протеин путем адсорбции на мембране, например, мембране из силастика, которая может быть импланирована вблизи рассеченного нерва. Настоящее изобретение также может быть использовано, например, для ускорения восстановления пациентов, страдающих диабетической нейропатией, например, мультиплексом мононейропатии и диабетической периферийной нейропатией.
В дополнение к диабетической нейропатии, относящиеся к NT-3 пептиды или NT-3 протеин могут также быть использованы для лечения других периферийный нейропатий, включая, но не ограничиваясь, следующие: нейропатия, связанная с вирусной инфекцией, включая синдром приобретенного иммунодефицита (СПИД), инфекционный мононуклеоз с полиневритом, вирусный гепатит с полиневритом, синдром Гийенна-Барре (полиневрит): нейропатия, связанная с ботулизмом, токсические полинейропатии, включая нейропатии, связанные с отравлением свинцом или алкоголем: пищевые нейропатии, включая подострую комбинированную дегенерацию; ангиопатические нейропатии, включая нейропатии, связанные с системной красной волчанкой ("люпус эритрематозис"); нейропатии, связанные с саркоидными болезнями; карциноматозная нейропатия; компрессионная нейропатия (например, синдром запястного туннеля) и наследственные нейропатии. Наследственные нейропатии, которые могут лечиться с использованием NT-3 или относящихся к NT-3 протеинов, включают атрофию малоберцовой мускулатуры, "familial disautomia", и прогрессирующая гипертрофическая нейропатия.
В других выполнениях изобретения, NT-3 протеин или пептидные фрагменты или производные могут быть использованы для лечения врожденных состояний или нейродегенеративных нарушений, включая, но не ограничиваясь, болезнь Альцхаймера, болезнь Паркинсона, рассеянный склероз, амиотрофный латеральный склероз и хорея Хантингтона.
В специфическом выполнении изобретения, введение NT-3 протеина или его пептидных фрагментов или его производных может осуществляться совместно с хирургической имплантацией ткани при лечении болезни Альцхаймера и/или болезни Паркинсона. Как показано в Секции (примеры) 11, см. ниже, NT-3 способствует выживанию допаминэргических нейронов; поскольку допаминэргические нейроны разрушаются при болезни Паркинсона, NT-3 может быть использован в методах лечения болезни Паркинсона, предусматривающих введение пациенту эффективного количества NT-3 при необходимости такого лечения. Показано, что примерно 35% пациентов с болезнью Паркинсона страдают деменцией Альцхаймеровского типа; NT-3, полеченный по изобретению, может оказаться полезным единственным терапевтическим агентом против этого комплексного заболевания. Подобным образом, NT-3, полученный по изобретению, может быть использован для терапевтического лечения болезни Альцхаймера в сочетании с Синдромом Дауна. В дополнение, как показано в секции 12 (см. ниже) NT-3 экспрессируется на высоком уровне во время развития и дифференциации нервной системы; соответственно, NT-3 может быть использован для лечения нарушений развития нервной системы, таких как синдром Дауна, а также при лечении нарушений, связанных с де-дифференциацией клеток, такой как злокачественные образования или при нарушениях, которые могут происходить вследствие регенерации нервной системы. NT-3, полученный по изобретению, может быть использован для лечения различных деменций, а также врожденных нарушений коммитирования.
В дальнейшем выполнении изобретения, NT-3 протеин, фрагменты и производные могут использоваться в сочетании с другими цитокинами для достижения желаемого нейротропного эффекта. Например, но не для ограничения, NT-3 по изобретению может быть использован вместе со втором агентом например, с BDNF или NGF, для достижения синергического стимулирующего действия на рост нейронов и/или для поддержания выживания и/или сохранения или усиления функции, причем выражение "синергический" употреблено здесь в том смысле, что действие комбинации NT-3 протеина или пептидного фрагмента, или производного, со вторым агентом дает эффект, который сильнее эффекта, создаваемого каждой субстанцией того же количества по отдельности. Это предусматривает, что NT-3 может действовать синергически с другими пептидными факторами, происходящими из ЦНС и которые еще не полностью охарактеризованы, при росте, развитии, поддержании дифференцированных функций и выживании широкого спектра нейронных суб-популяций в центральной нервной системе. Альтернативно, действия NT-3 и второго нейротропного агента могут быть дополняющими.
Далее предусматривается, что, основываясь на полной характеристике молекулы NT-3, новые пептидные фрагменты, производные или мутанты NT-3 могут быть развиты по изобретению, и которые способны действовать как антагонисты некоторых или всех биологических функций NT-3. Такие антагонисты NT-3 могут использоваться при селективном удалении сенсорных нейронов, например, при лечении синдромов хронической боли. В еще одном дальнейшем выполнении изобретения, антитела, направленные против NT-3 протеина, или его пептидных фрагментов, или его производных, могут вводиться пациентам, страдающим различными неврологическими нарушениями и болезнями и тем, кто нуждается в таком лечении. Например, в таком лечении могут нуждаться пациенты, страдающие от перепроизводства NT-3. Анти-NT-3 антитела могут быть использованы для предотвращения аберрантной регенерации сенсорных нейронов (например, пост-операционно), или как обсуждалось выше, при лечении синдрома хронической боли.
Тканевое распределение NT-3, как описано в секциях 6 и 7 ниже, указывает, что более высокие уровни NT-3 мРНК экспрессируют в головном мозгу, почках, сердце и селезенке по сравнению с другими тканями. NT-3, продуцируемый в не-нервных тканях, может быть идентичным или неидентичным NT-3, экспрессируемому в головном мозге. Отдельные виды NT-3 могут функционировать как в нервной, так и в не-нервных тканях; нарушения в экспрессии NT-3 могут подчеркивать болезни, которые воздействуют на нервную систему, так же как и на другие системы органов. Альтернативно близкородственное семейство молекул NT-3 могут выполнять различные функции в нервной и не-нервных тканях. Молекулы NT-3 по изобретению могут поэтому использоваться для лечения болезней, которые воздействуют на нервную систему, а также на нервную регуляцию не-нервных тканей, включая, в частности, сердце, гематопоэтическую, почечную и ретикулоэндотелиальную системы.
Кроме того, как указано в Разд. 6, ниже, NT-3 экспрессия усиливается у незрелых животных по сравнению со взрослыми. Согласно изобретению, NT-3 может быть, в частности, полезен при лечении нарушений развития или, альтернативно, при стимулировании обновления нервной системы после повреждения ЦНС.
5.8. Фармацевтические композиции
Активные композиции по изобретению, которые могут включать весь или только часть (части) NT-3 генного продукта, включая протеин, пептидные фрагменты или производные его, или антитела (или фрагменты антител), направленные против NT-3 протеина, пептидных фрагментов или его производных, или могут содержать комбинации NT-3 и по меньшей мере одного другого агента, такого как NGF или BDNF; могут вводиться с любым стерильным биосовместимым фармацевтическим носителем, включая, но не ограничивая, физиологический раствор, буферный физиологический раствор, декстрозу и воду.
NT-3 протеин, пептидный фрагмент или производное могут включать аминокислотную последовательность или ее суб-последовательность, в основном такую, как описано на Фиг. 2, 7 или 11; может быть предпочтительным использование NT-3 протеина, содержащего, в частности, всю или часть аминокислотной последовательности размером примерно от 140 аминокислот до примерно 258 аминокислот, как показано на Фиг. 2, от 1 аминокислоты до примерно 119 аминокислот, как показано на фиг. 7, или же от первой аминокислоты, помеченной "зрелая" ("mature") на фиг. 11 до конца пептидной последовательности, изображенной на фиг. 11, или содержащего функционально эквивалентную последовательность, поскольку эта суб-последовательность, как предполагается, содержит функциональную часть молекулы NT-3. NT-3 может происходить от последовательностей, соответствующих генам NT-3 любых подходящих видов животных, включая, но не ограничивая, такие виды, как человек, свинья, крыса, цыпленок, корова, собака, овца, козел, кошка, кролик и т.д. Количества NT-3 протеина, пептидного фрагмента, производного или антитела, которые будут эффективны при лечении частных нарушений или состояний, зависят от природы нарушения или состояния, и могут быть определены посредством стандартных клинических методов. Когда возможно, желательно определять кривую реакции на дозировку и фармацевтические композиции по изобретению вначале "ин витро", например, в NT-3 биоэкспериментальных системах, описанных выше, а затем в модельных системах на животных, прежде чем проводить испытания на человеке. Основываясь на данных, полученных "ин витро", в специфическом выполнении изобретения, фармацевтическая композиция по изобретению, эффективно способствующая выживанию сенсорных нейронов, может обеспечить местную концентрацию протеина NT-3, равную приблизительно 0,1 - 10 μ г/мл.
Методы введения включают, но не ограничиваются внутрикожными, внутримышечными, внутрибрюшинными, внутривенными, подкожными, оральными и интраназальными. Дополнительно, может быть желательным введение фармацевтических композиций по изобретению в центральную нервную систему любым подходящим путем, включая внутрижелудочный и интратекальный; внутрижелудочное введение может быть осуществлено посредством желудочного катетера, например, прикрепленного к резервуару, такому как резервуар Ommaya.
Далее, может быть желательным введение фармацевтических композиций по изобретению местно, в области, в которой требуется лечение; это может быть достигнуто, например, но не ограничивая этим, местной инфузией во время хирургической операции, инъекцией, с помощью катетера или посредством имплантанта, причем указанный имплантант является пористым или непористым, или желатиноподобным материалом, включая мембраны, такие как сиаластиковые мембраны, или волокна.
Изобретение также обеспечивает фармацевтические композиции, содержащие NT-3 протеины, пептидные фрагменты, или производные, вводимые посредством липосом, микрочастиц или микрокапсул. В различных выполнениях изобретения может быть полезным использование таких композиций для достижения постоянного уровня освобождения NT-3 или родственных ему продуктов.
Предусмотрено, что возможно введение клеток, активно продуцирующих NT-3, родственных NT-3 субстанций, NT-3 антагонистов или анти-NT-3 антител в области, нуждающиеся в повышенных или пониженных концентрациях NT-3.
6. Пример: 1. Клонирование и характеризование мышиного гена нейротропина-3
6.1 Материалы и методы
6.1.1 Полимеразная цепная реакция
Два олигонуклеотидных праймера было синтезировано на основе двух аминокислотных последовательностей, консервированных в BDNF и всех известных NGF (Leibrock и др., 1989, Nature, 341: 149-152). Последовательность смыслового (или 5') праймера была
GGGGTCCGC GG1 TGY MGY GG1 ATH GA
(праймер 1, номенклатура ИЮПАК, 1=инозин), и включала сайты Bam HI и Sac II, а последовательность антисмыслового (3') праймера -
TCGAATTCTAG AT 1CK 1AT PAA 1 CK CCA,
и включала сайты Eco RI и Xba I (праймер 2). Реакция PCR (Saiki и др., 1985, Sience, 230: 1350-54) была осуществлена с 1 μ г мышиной геномной ДНК, с использованием "Perkin - Elmer Cetus" термоячейки и Tag-полимеразы (Gene Amp. TM). После 4 циклов ренатурирующей температуры 45oC, оставшиеся 36 циклов осуществляли при ренатурации 49oC. Полученные амплифицированные продукты ДНК, соответствовавшие ожидаемому размеру в 137 пар оснований, были элюированы из акриламидного геля, реамплифицированы и переварены Hind II и Apa1, первый из которых расщепляет мышиный NGF, а последний - мышиный BDNF. Нерасщепленную ДНК элюировали и асимметрично амплифицировали (Janis и др., 1988, Proc. Natl. Acad. Sci., USA, 85: 9436-9440) и секвенировали (Sanger и др., 1979, Proc. Natl. Acad. Sci., USA, 72: 3918-3921) с использованием праймеров 1 и 2. Основываясь на полученной таким образом последовательности, было синтезировано два дополнительных смысловых примера, соответствующие нуклеотидам 808-822 (праймер 3) и 824-844 (праймер 4) к которым были добавлены сайты SaII и Pst I. РНК экстрагировали из головного мозга взрослой мыши, печени и мышц (Okayama и др., 1987, Meth. Enzymology, 154: 3-28) и обратно транскрибировали (реверсивно) с использованием антисмыслового (5') праймера
CGGATCCGAATTCTGCAG (T)12V (праймер 5), сконструированный для совпадения с 3' поли(A) концами, и содержащий клонирующие сайты для Bam HI, Eco RI и Pst I ((Leibrock и др., 1989, Nature, 341: 149-152). Эти кДНК были сначала PCR-амплифицированы с использованием праймеров 3 и 5, и реамплифицированы с использованием праймеров 4 и 5. Саузерн-блот-анализ осуществляли с продуктами, полученными при последней реакции и гибридизировали с меченым 32P концом олигонуклеотидом, соответствующим нуклеотидам 879-893. Идентифицированные таким образом фрагменты ДНК клонировали в Bluescript® SK+ вектор ("Стратаген") и длиннейший из полученных инсертов (460 пар оснований) использовали для скрининга EMBL 3 мышиной геномной библиотеки (Клонтех). Было обнаружено два положительных клона, и ДНК одного клона переваривали различными рестрикционными энзимами. Рестрикционные фрагменты зондировали инсертом с 460 парами оснований: 770 бр Hind III и 4000 бр Pst I фрагменты были субклонированы в Bluescript® SK+. Показана полная Hind III последовательность 3' и 5' расширенная с использованием Pst I фрагмента.
6.1.2. Назерн-блоттинг
Общую РНК экстрагировали из тканей взрослой женщины (Okayama и др., 1987, Meth. Enzym, 154: 3-28), и подвергали электрофорезу на 1 - 3%-формальдегид-содержащих агарозных гелях (Hehrach и др., 1977, Biochem, 16: 4743-4751). Эту РНК переносили на нейлоновые мембраны (Hybond-N, Amersham) и гибридизировали в течение ночи при 42oC в 1 мл 200 мМ натрий фосфата (с pH 7,2), содержащего 40% формамида, 5 • Денхардта раствора и 200 μ г•мл-1 денатурированной ДНК спермы лосося. Используемый зонд был мечен 32P и представлял собой беспорядочно примированный двухнитевой зонд (Feinberg и др., 1979, Anal. Biochem, 137: 266-267) соответствующий нуклеотидам 319-1093 (Фиг. 2). Специфичная активность составила 1,3 • 108 срм • μг-1, и 107 было добавлено к гибридизированному буферу. Промывку проводили в течение 60 мин при 60oC в 0,1 • SSC, содержащем 0,5% SDS. Фильтры экспонировали в течение 5 дней при -70oC с интенсифицирующими экранами.
6.1.3. Экспрессия нейротропина-3
Олигонуклеотидные праймеры синтезировали соответственно первым 19 нуклеотидам (плюс EcoR сайт) и последним 19 нуклеотидам (плюс Bam H1 сайт) открытой рамки считывания, изображенной на фиг. 2. После PCR амплификации с использованием в качестве матрицы описанный на фиг. 2 Pst I геномный фрагмент, полученный продукт клонировали в сайт EcoRI - Bam HI вектора экспрессии pCMV (Anderson и др., 1989, J. Biol. Chem., 264: 8222-8229). Нуклеотидная последовательность NT-3 инсерта в pCMV была определена. COS-1 клетки были трансфецированы с использованием кальциево-фосфатного метода (Chen и Okayama, 1987, Mol. Cell Biol., 7: 2745-2752), и среду собирали как описывалось ранее (Leibrock и др., Nature, 341: 149-152). Используемую контрольную среду получали после обработки COS-1 клеток кальций фосфатом, или pCMV / NT-3 конструкцией, в которой был удален стоп-кодон NT-3. Обе среды были лишены биологической активности при разведении 1 : 50. Нодозные ганглии были диссоциированы, и нейроны культурировали на 24-лунковых чашках (Lindsay и др., 1985, Dev. Biol., 112: 319-328), и BDNF очищали из головного мозга свиньи (Hofer и Barde, 1988, Nature, 331:261-262).
6.2. Результаты и обсуждение
Основной проблемой при характеризировании нейротропных факторов является их крайне низкое содержание. Как NGF, так и BDNF характеризовали с использованием методов белковой очистки, основанных на биоэкспериментах для мониторинга их активности (Cohen и др., 1960, Proc. Natl. Acad. Sci., США, 46: 302-311, Barde и др. , 1982, EMBO J. 1: 549-553). Такой подход возможен с NGF, вследствие необычно высокого содержания этого протеина в подчелюстной железе взрослого самца мыши и, в конечном счете, и с BDNF из-за, в принципе неограниченного, количества свиной ткани головного мозга. Тождественности последовательностей, обнаруженные у NGF и BDNF, позволяют предположить, что может быть применена различная стратегия для характеризования других членов того, что оно было определено как генное семейство (Leibrock и др., 1989, Nature, 341: 149-152). Детальное сравнение мышиной NGF и BDNF аминокислотных последовательностей (а. п.) обнаружило два отрезка из 6 аминокислот (а.к.), подчеркнутых на Фиг. 2, которые показались весьма подходящими для подхода, использующего олигонуклеотидные праймеры в реакции PCR (Saiki и др., 1985, Science, 230: 1350-1354). Мышиная геномная матрица была использована вследствие того, что в генах NGF и BDNF нет интронов, прерывающих экзоновое кодирование биологически активных протеинов. Этот подход привел к ожидавшемуся амплифицированию последовательностей NGF и BDNF, которые впоследствии были переварены с использованием соответствующих рестрикционных ферментов. Был секвенирован оставшийся неповрежденным фрагмент ДНК, и обнаружена последовательность, не соответствующая ни BDNF, ни NGF. Два специфических смысловых (5') праймера были синтезированы для дальнейших PCR-реакций с использованием в качестве матриц комплементарную ДНК, приготовленную реверсивной транскрипцией РНК, экстрагированной из мышиного головного мозга, мышщ и печени, в 3' праймер был сконструирован для совпадения с поли(A) последовательностями (Фиг. 2). Эти три ткани дали амплифицированные продукты сходных размеров, которые были клонированы и использованы для скрининга мышиной геномной библиотеки. Один из найденных таким образом геномных клонов был секвенирован (Фиг. 2). Открытая рамка считывания предсказывает протеин из 258 а.к. (начиная с первого метионина, найденного после 3 в рамке стоп-кодонов), который назвали нейротропин-3). NT-3. Во всех отношениях общая структура предсказанного протеина напоминает структуру, установленную для NGF и BDNF: предполагаемая сигнальная последовательность из 18 а.к. (показывающая 5 и 9 а. к. идентичностей с BDNF и NGF, соответственно) продолжается про-последовательностью из 121 а. к.. Такие про-последовательности, предположительно участвующие в складывании и правильном формировании дисульфидных мостиков этих протеинов (Edwards и др., J. Biol. Chem., 263: 6810-6815), также были обнаружены в мышином NGF (103 а.к.) и мышином BDNF (112 а.к.). Единственный потенциальный сайт N-гликозилирования расположен на 9 а.к. (по сравнению с 8 а. к. у BDNF и NGF) перед тем, что предположительно является сайтом расщепления, характеризуемый кластером основных остатков, дающий начало зрелому NT-3 (Фиг. 2, стрелка). Зрелый NT-3 предположительно состоит из 119 а.к. (относительная молекулярная масса 13,625 и p1 9,3). Сравнение зрелых мышиных NGF, BDNF и NT-3 обнаруживает 54 а.к. тождеств (Фиг. 2). Все шесть цистеиновых остатков, известных тем, что они у NGF и BDNF вовлечены в образование дисульфидных мостиков (Leibrock и др., 1989, Nature, 341: 149-152), Angeletti, 1973, Biochem. 12: 100-115), находятся среди консервированных остатков (Фиг. 3., стрелка). Следует заметить, что добавление последовательности NT-3 к последовательностям NGF и BDNF обнаруживает утрату только 7 идентичных а. к. (при сравнении мышиного NGF и BDNF обнаруживается 61 а.к. идентичностей). Таким образом, консервируется почти 50% первичной структуры, что, вероятно, требуется для образования базовой трехмерной формы, общей для всех трех протеинов. В дополнение, сравнение 3 последовательностей обнаруживает 4 вариабельных домена, каждый длиной от 7 до 11 а.к. (пронумерованы V1 - V4 на Фиг. 3), которые предположительно вовлечены в нейронную специфичность, проявляемую этими протеинами.
Для исследования экспрессии NT-3 гена, РНК экстрагировали из различных мышиных тканей и анализировали с NT-3 специфичным зондом (Фиг. 4). Во всех исследованных тканях была обнаружена единственная полоса размером около 1,4 тыс. оснований. Однако уровень экспрессии этой мРНК значительно изменяется. В головном мозге (Фиг. 4B), были обнаружены отличия в отмеченных областях, причем самые высокие уровни мРНК наблюдались в мозжечке и аммоновом роге. Эти результаты демонстрируют, что распределение NT-3 мРНК в тканях взрослой мыши сильно отличается от распределения мРНК BDNF и NGF. Действительно, мРНК NGF едва обнаружима в таких тканях, как печень или скелетные мышцы (Heumann и др. , 1984, EMBO, 3: 3183-3189). Однако представляет интерес, что аммонов рог, известный своей экспрессией мРНК NGF (Korsching и др., 1985, EMBO, 4: 1389-1393), также экспрессирует мРНК BDNF и NT-3, и в гораздо больших количествах, чем в большинстве других областей головного мозга. (Фиг. 4B).
С целью выяснения, является ли NT-3 биологически активным и секретируемым протеином, последовательность, кодирующая весь протеин, клонировалась в вектор экспрессии (pCMV) используемый для трансфекции (почки обезьяны) COS клеток (Фиг. 5). С учетом того, что NT-3 мРНК находится в периферийных тканях, культивировали различные нейроны цыплячьего эмбриона, которые простираются в эти ткани и требуют наличия трофических факторов для своего выживания. Двигательные нейроны, выделенные из спинного мозга 6-дневного эмбриона (E6) (Dohrmann и др. , 1986, Dev. Biol., 118: 209-221), цилиарные нейроны (E8) и диссоциированные симпатические нейроны (ЕП) не выживали в присутствии NT-3. Однако была обнаружена реакция сенсорных нейронов, выделенных из E8 первичных сенсорных ганглиев. Как здесь показано (Фиг. 5), NT-3 поддерживает выживание примерно 30% нейронов, выделенных из нодозного ганглия. Кроме того, этот эффект является дополняющим действие BDNF, синтезированном в центральных проекционных областях и известном своим действием на суб-популяцию нодозных нейронов (Lindsay и др., 1985, Dev. Biol. 112: 319-328), и оба фактора совместно спасают большинство нейронов (90%) см. Фиг. 5. Важно отметить, что NT-3 мРНК обнаруживается в висцеральных мишенях этого ганглия, включая сердце, кишечник, печень и легкие (Фиг. 4A). Популяции реагирующих на NT-3 сенсорных нейронов были также обнаружены в E8 диссоциированном дорсальном корне и тройничных ганглиях, а также в эксплантантах E8 симпатических ганглиев. Таким образом, получается, что NT-3 представляет до сих пор неохарактеризованную биологическую активность, присутствующую в нескольких периферийных тканях, включая печень (Lindsay и Tarbit, 1979, Neuro Sci. Lett, 12: 195-200) и скелетные мышцы (Davies, 1986, Dev. Biol., 115: 56-67), и поддерживающую выживание висцеральных и проприорецептивных сенсорных нейронов, не отвечающих на NGF (для обзора, см. Davies, 1987, Development, 101: 185-208).
Вместе взятые, все эти факты свидетельствуют, что NT-3 является нейротропным фактором, родственным по своей структуре и функции к NGF и BDNF, первым двум нейротропинам. Здесь предлагается использование названия "нейротропин" (НТ) для обозначения этого класса белков, и, по аналогии с интерлейкинами, нумеровать их в порядке их обнаружения.
7. Пример 2.: Клонирование и характеризирование крысиного гена нейротропина-3
Гомология между NGF и BDNF была использована для конструирования стратегии клонирования с целью поиска дополнительных членов этого генного семейства. Здесь сообщается о клонировании гена, кодирующего третий член семейства BDNF / NGF, который назван нейротропин-3 (НТ-3). Этот новый фактор проявляет четкую биологическую активность и спациотемпоральную экспрессию по сравнению с NGF и BDNF.
7.1 Материалы и методы
7.1.1. Реакция PCR
Были синтезированы дегенерированные олигонуклеотиды, соответствующие сегментам четырех белковых последовательностей, которые высоко консервированы между NGF и BDNF; эти протеиновые последовательности (которые могут быть обнаружены в последовательностях NGF / BDNF, представленных на Фиг. 7D) были следующие:
(1) Gly-Glu-(Tyr/Phe)-Ser-Val-Cys-Asp-Ser;
(2) Lys-Glu-Tyr-The-(Tyr/Phe)-Glu-Thr-Lys-Cys;
(3) Gly-Cys-Arg-Jle-Asp;
(4) Trp-Arg-Phe-Jle-Arg-Jle-Asp-Thr-(Ser/Ala)-Cys-Val-Cys.
В PCR реакциях были использованы серии дегенерированных смысловых и антисмысловых олигонуклеотидов (содержащих дегенерированный участок длиной 15 - 26 нуклеотидов, соответствующий 5 - 9 аминокислотам указанной белковой последовательности как в смысловой, так и в антисмысловой направленности, а также недегенерированный "хвост", кодирующий сайты узнавания рестрикционных ферментов). Реакция амплификации между парами верхних смысловых и нижних антисмысловых праймеров проводили согласно условиям, рекомендованным Perkin-Elmer /Cetus за исключением того, что температура ренатурации, концентрация ионов Мg++ и длительность изменяли для определения оптимальных условий для каждой праймерной пары. Точная последовательность 1B смыслового праймера (кодирующего участок протеиновой последовательности "1" выше) была следующей:
5' -GACTCGAGTCGACATCG-GTN-TGY-GAY-WSN-RTN-WS-3'
и 2C антисмыслового праймера (соответствующего антисмысловым кодонам участка протеиновой последовательности "2" выше) была:
5' -CCAAGCTTCTAGAATTC-CA-YTT-NGT-YTC-RWA-RAA-RTA-YTG-3'
(сокращения нуклеотидов по коду ИЮПАК). Последующий анализ последовательности показал, что 1B олигонуклеотид имел два нуклеотидных несовпадения с последовательностью NT-3, тогда как у 2C олигонуклеотида было одно нуклеотидное несовпадение с последовательностью NT-3. Радиомечение при PCR было осуществлено согласно реакции генной амплификации Perkin-Elmer / Cetus, со следующими модификациями: 1 - 10 нг ДНК матрицы в агарозе с низкой температурой плавления добавляли к реакционной смеси, содержащей немеченные dATP, dGTP и DTTP при конечной концентрации 50 μ М; 50 μ Ci α32P- dGTP (3000 Ci (ммоль) добавляли на 50 μ л реакционной смеси и ее подвергали семи амплификационным циклам. Амплификационные праймеры были идентичными дегенерированными праймерам, используемым в исходной PCR реакции.
7.1.2. Саузерн-блоттинг крысиной геномной ДНК с использованием NT-3 зонда
R1B/2C продукт реакции PCR был получен путем амплификации из матрицы крысиной геномной ДНК с использованием дегенерированных 1B и 2C праймеров, как описано выше в разделе 7.1.1. Полученный PCR продукт с использованием дегенерированных 1B и 2C праймеров (обозначенный R1B/2C) обнаруживает новый ген, NT-3, а также NGF и BDNF гены в крысиной геномной ДНК. ДНК была получена из печени крыс Фишера (Маниатис и др., 1982 Молекулярное клонирование - Лабораторный учебник), переварена EcoR1 и 10 μ г были фракционированы на 1%-ном агарозном геле. Эта ДНК была перенесена на нитроцеллюлозу с использованием 10ХSSC (Маниатис и др., 1982, Молекулярное клонирование - Лабораторный учебник) гибридизована (Mahmoud и Lin, 1989, Biotechniques, 7: 331-3) к меченому 32P R1B/2C продукту реакции PCR при 60oC и промыта в 2ХSSC /0,1% SDS при 65oC. Полосы NT-3, NGF и BDNF как показано; положение полос NGF и BDNF было предварительно определено с использованием специфичных зондов. Размеры указаны в тысячах оснований слева.
7.1.3. Экспрессия нейротропина-3
Экспрессионная конструкция крысиного NT-3 была создана с использованием PCR для амплифицирования кодирующей области предполагаемого короткого предшественника NT-3 из плазмиды, содержащей 3,2 кб Sst I крысиный геномный фрагмент (Фиг. 6B), который продлевает NT-3 ген; олигонуклеотиды, используемые в PCR реакции, содержали синтетические сайты узнавания xho I на своих концах, чтобы позволить инсерцию амплифицированной кодирующей области в сайт xho I в полилинкере экспрессионного вектора pCDM8 / Seed, 1987, Nature, 329: 840-42). Конкретные нуклеотиды, использованные для амплифицирования области, кодирующей крысиный NT-3 ген, были: верхний смысловой праймер
5' -CGG TAC CCT CGA GCC ACC ATG TCC ATC TTG TTT TAT GTG-3'
(подчеркнутый ATG соответствует кодону "B" стартового сайта инициации, с последовательностью вниз от ATG, которая полностью совпадает с NT-3 последовательностью; вверх от ATG праймер содержит синтетический xho I сайт), и нижний антисмысловой праймер
5' -CGG TAC CCT CGA GAT GCC AAT TCA TGT TCT TCC C-3' (подчеркнутый триплет является комплементарным кодону терминации для гена NT-3; этот триплет фланкирован точной антисмысловой NT-3 последовательностью, а на 5' конце этого праймера имеется xho I сайт). Полученная экспрессионная плазмида для крысиного NT-3 была обозначена pC8-rN3(P1). Подобные стратегии ранее использовали для инсерции кодирующих областей крысиного NGF и BDNF в сайт xho I того же самого вектора pCDM8. NT-3, NGF и BDNF экспрессионные конструкции были трансфецированы, как описано Okayama и Berg (1982, Mol. Cell Biol, 5: 1136-42) в COS-M5 клетки засеянные в количестве 5•105 клеток на 60 мм чашку и культивировали в 2,5 мл среды Dulbecco Modified Eagle, содержащей много глюкозы (4500 мг/мл) и 10% плодной сыворотки кр. рог. скота; супернатанты собирали через 72 часа после трансфекции.
7.2. Результаты
7.2.1 Клонирование гена Нейротропина-3
Продукты амплификации ожидаемого размера (как прогнозировалось, исходя из NGF и BDNF последовательностей) были получены с использованием различных пар дегенерированных олигонуклеотидов. Эти продукты вначале подвергали рестрикционному ферментному анализу для определения относительного содержания NGF и BDNF или новых последовательностей. Во всех случаях, при окрашивании этидий бромидом были обнаружены рестрикционные фрагменты, соответствующие только последовательности NGF и BDNF. Однако использование тех же продуктов PCR реакции в качестве гибридизационных зондов саузерн-блоттинга крысиной геномной ДНК обнаружило, что один продукт (обозначенный R1B/2C см. Фиг. 6A), идентифицировал новую последовательность геномной ДНК в дополнение к NGF и BDNF (Фиг. 6A); таким образом, скрининг PCR продуктов саузерн-блоттингом позволил идентифицировать редко амплифицируемые последовательности, которые были необнаружимы другими средствами. Зонд R1B/2C также обнаружил новые последовательности в геномной ДНК эволюционно дивергентных видов (включая человека, мышь, цыпленка и Xenopus), предположительно, этот зонд идентифицирует функциональный ген.
С целью выделения этого гена, для скрининга использовали зонд R1B/2C, а также зонды, специфичные для NGF и BDNF (Миниатис и др., 1982, Лабораторный учебник "Молекулярное клонирование"), причем скринингу подвергали геномную библиотеку ДНК крысы (полученную из "лабораторий клонтех", инк., Palo Alto CA), приготовленной из Sprague-Dawley крысиной ДНК (частично переваренной SAU3A рестрикционной эндонуклеазой и клонированной в EMBL 3 / SP6/T7 бактериофаговом векторе. Было обнаружено два независимых бактериофаговых клона, которые гибридизировали к зонду R1B/2C, но не гибридизировали к двум другим зондам. Анализ рестрикционных карт крысиных геномных инсертов в эти клоны демонстрирует что они соответствуют тому же самому гену (Фиг. 6B). Бактериофаговый клон с самым длинным инсертом был обозначен ⊘ rN3(G1). Секвенирование показало, что ген, идентифицированный зондом R1B/2C, кодирует нового члена семейства NGF и BDNF (см. Фиг. 7), который назвали нейротропин-3.
7.2.2. Секвенирование зрелого нейротропина-3
Секвенирование ДНК проводили методом терминирования двойной дезонуклеотидной цепи (Sanger и др., 1977, Proc. Natl. Acad. Sci., США, 74: 5463-7), с использованием аналитического набора "SEQUENASE" Version 2.0, поставленным Биохимической Корпорацией США с использованием процедур, рекомендованных фирмой-изготовителем.
NGF имеет два четких предшественника, называемых "длинным" (начинающимся от стартового сайта "A") и "коротким" (начинающимся от стартового сайта "B"), которые различаются длиной их N-терминальных последовательностей (Darling и др., 1987, Сold Spring Harbor Symp. Quant Biol., 1: 427-34, Selfy и др., 1987, Mol. Cell Biol., 7: 3057-64, Edwards и др., 1988, Mol. Cell Biol. , 8: 2456-64). Как длинный, так и короткий предшественники могут быть протеолитически расщеплены с получением зрелой формы NGF, которая, в сущности, состоит из карбокси-терминальных 120 а.к. каждого предшественника. BDNF также может иметь подобные короткую и длинную формы предшественника.
Секвенирование гена NGF от нескольких видов обнаружило, что большая часть этой дополнительной N-терминальной последовательности находится на отдельных экзонах, за исключением четырех кодонов (Val-His-Ser-Val), которые включены у 5' конца экзона, который кодирует полный короткий предшественник (стартовый сайт "B"). Ранее здесь уже было продемонстрировано, что два из этих четырех кодонов (Val-X-X-Val), так же как и сайт-акцептор РНК сплайсинга, который им предшествует, консервированы как раз выше консервированного стартового сайта "B" в генах BDNF, выделенных у различных видов животных; это открытие привело к догадке, что существуют длинная и короткая форма предшественника BDNF. Имеется консервация Val-X-X-Val кодонов, так же как и сайта акцептора сплайсинга в гене крысиного NT-3, этот сайт акцептор сплайсинга и предполагаемая граница интрона указана на Фиг. 7A. Эти рассуждения о последовательности привели к прогнозированию существования вышерасположенных кодирующих экзонов для NT-3 гена, который бы кодировал длинную форму предшественника. Обнаружение консервированной последовательности вышепредполагаемого NT-3 "A" стартового сайта еще более укрепило уверенность в существовании длинного BDNF предшественника и предположило важную, эволюционно консервированную роль этого длинного предшественника для всех членов семейства NGF. Предсказанный N-терминал зрелого NT-3 следует за канонической последовательностью протеазного расщепления (Arg-Arg-Lys-Arg), очень похожую на те, которые видны у NGF и BDNF (Фиг. 7A, C). У некоторых видов, две C-терминальные аминокислоты NGF также протеолитически удалены. В отличие от NGF, крысиный NT-3 не имеет очевидного потенциального сайта расщепления у своего C-терминала (Фиг. 7A, C), и здесь делаем вывод, что как и с BDNF всех до сих пор исследованных видов, у C-терминала NT-3 также нет протеолитической модификации.
На основании этих рассуждений, предсказываемый размер зрелого NT-3 полипептида составляет 119 аминокислот, с рассчитанным p1 около 9,5. Таким образом, по размеру и заряду, NT-3 сильно напоминает NGF и BDNF. Семь N-терминальных аминокислот зрелого NT-3 полностью отличаются от NGF и BDNF. Начиная от аминокислоты восемь в зрелом NT-3, оптимальное совмещение требует единственного разрыва из двух аминокислот относительно BDNF и единственной инсерции одной аминокислоты относительно NGF (см. Фиг. 7D). Зрелый крысиный NT-3 проявляет 57%-ную аминокислотную гомологию с крысиным NGF, и 58%-ную аминокислотную гомологию с BDNF, 57 из 120 остатков (48%) являются общими у всех трех протеинов. (см. Фиг. 2D). Шесть цистеиновых остатков, обнаруженных у NGF и BDNF, являются абсолютно консервированными в NT-3, и области наибольшей гомологии между этими тремя белками в основном сгруппированы вокруг этих цистеиновых остатков.
7.2.3. Анализ предшественников нейротропина-3
Как раз вышепредполагаемого сайта расщепления, который освобождает зрелый NT-3, имеется общий акцепторный сайт гликозилирования - (Asn-X-Thr/Ser), см. Фиг. 7A, C), который также был обнаружен в той же самой позиции у NGF и BDNF (Ullrich и др., 1983, Nature, 303: 821-5; Leibrock и др., 1989, Nature, 341: 149-52). Играет ли этот сайт гликозилирования какую-то роль в процессинге NT-3, NGF и BDNF, предшественников, остается неизвестным.
Дальнейшее сравнение NT-3 последовательности с предшественниками NGF и BDNF обнаруживает две области аминокислотной гомологии выше последовательности зрелого NT-3 (области I и II на Фиг. 7B, C). Область I гомологии позволяет предсказать существование для крысиного NT-3 стартового сайта "B" (определенного выше для NGF), который бы производил короткого предшественника из 258 аминокислот, сходного размера с короткими предшественниками NGF (241 а.к.) и BDNF (249 а.к.), вероятный кодон метиониновой инициации, секреторная сигнальная последовательность и сайт расщепления сигнальной последовательности для короткого предшественников всех трех факторов являются консервированными (Фиг. 7C). Вследствие того, что область I гомологии простирается вверх от стартового сайта "B", можно также предсказать существование длинного предшественника для NT-3, который будет инициировать (начинаться) от стартового сайта "A" (см. Фиг. 7A, B, C). Как было видно у NGF (Ullrich и др. , 1983, Nature, 303: 821-5, Selby и др., 1987, Mol. Cell Biol., 7: 3057-64), и предположено для BDNF, такой стартовый сайт, вероятно, будет кодирован на дополнительных экзонах вверх к единственному экзону, который кодирует всего короткого предшественника.
Дополнительно к областям I и II аминокислотных гомологий, сравнение участков гидрофильности для NT-3, NGF и BDNF обнаруживает сходство структуры у предшественников, вверх от зрелых продуктов.
7.2.4. Нейротропин-3 обладает нейротропной активностью
Удивительная гомология между NT-3, NGF и BDNF позволяет с уверенностью предположить, что NT-3 может обладать нейротропной активностью. NGF и BDNF каждый могут способствовать выживанию выбранных популяций нейронов периферийной и центральной нервной системы ин виво и ин витро (рассмотрено у Whittmore и Senger, 1987, Brain Res. Rev., 12: 439-64, Lindsay, 1988, в "The Making of the Nervous System", стр. 149-65, Davies, 1988, Grends Genet, 4: 139-43). Например, использование любого из названных факторов для развития птичьего эмбриона предотвращает естественно происходящую нейронную гибель в специфических периферийных ганглиях (напр., Hoffer и Barde, 1988, Nature, 331: 261-2). Будучи добавлены к эксплантированным ганглиям, NGF и BDNF вызывают отрастание нейритов (Davies и др., 1986, J. Neurosci, 6: 1897-1904), а при добавлении к культурам диссоциированных ганглиевых нейронов, эти факторы способствуют нейронному выживанию и дифференциации (Lindsay и др., 1985, Dev. Biol. , 112: 319-328). Такие исследования "ин витро", с использованием нескольких типов периферийных ганглиев цыпленка, использовали для выяснения различий между нейротропными активностями NGF и BDNF. Тогда как оба фактора действуют на популяции сенсорных нейронов, обнаруживаемых в ганглиях дорсального корня от неврального гребня (DRG), только BDNF поддерживает сенсорные нейроны нодозного ганглия от невральной плакоды (MG) (Lindsay b lh., 1985, Dev. Biol., 112: 319-328). В отличие от BDNF, NGF может способствовать выживанию и росту нейронов симпатических ганглиев паравертебральной цепи (SG) (Barde и др., 1982, EMBO J. 1: 549-553).
Чтобы оценить потенциальную биологическую активность NT-3, ген крысиного NT-3 консервировали в вектор pCDM8 (Seed, 1987, Nature, 329: 840-842), что ранее использовали для кратковременной экспрессии BDNF и NGF в клетки млекопитающих. Эта конструкция была создана для экспрессии короткой формы-предшественника NT-3, экспрессией коротких предшествующих форм NGF и BDNF получили биологически активный материал (Edwards и др., 1988, Mol. Cell Biol. , 8: 2456-64, Leibrock и др., 1989, Nature, 341: 149-152). NT-3, NGF и BDNF конструкции трансформировали в COS клетки; собирали супернатанты от культур и сначала исследовали при различных концентрациях на их способность вызывать отрастание нейритов от DRG эксплантантов. Как ожидалось, NGF и BDNF способствовали отрастанию нейритов в этом исследовании (см. Фиг. 8). В первой демонстрации того, что NT-3 ген действительно кодирует нейротропную активность, продукт этого гена вызывает обильное отрастание нейритов от DRG эксплантантов (Фиг. 8).
Для того, чтобы установить, действует ли NT-3 непосредственно на нейроны, этот фактор исследовали в высоко обогащенных культурах диссоциированных DRG нейронов (Фиг. 9). При фактическом отсутствии Шванновских клеток и фибробластов, NT-3 способствовал выживанию и отрастанию нейритов у примерно 60% этих DRG нейронов. Учитывая, что BDNF и NGF вместе поддерживают фактически 100% DRG нейронов в культуре (Lindsay и др., 1985, Dev. Biol., 112: 319-328), следует предположить, что NT-3 способствует выживанию клеток, которые также реагирует на по меньшей мере один из других двух факторов.
7.2.5. Нейротропная активность NT-3 отличается от активности NGF и BDNF
Для дальнейшего исследования нейронной специфичности NT-3, исследовали этот фактор на NG и SG эксплантантах. Как ожидалось, контрольные опыты подтвердили, что NGF вызывает отрастание нейритов от SG, но не от NG эксплантантов E8 цыплячьего эмбриона, тогда как BDNF вызывал отрастание нейритов от NG, но не от SG эксплантантов. Любопытно, что NT-3 способствовал отрастанию нейритов как от NG, так и SG эксплантантов (Фиг. 8) предполагая наличие большей широты специфичности, чем NGF или BDNF. Однако NT-3, как NGF и BDNF не смог способствовать выживанию или отрастанию нейритов от эксплантантов или диссоциированных обогащенных нейронами культур цилиарного ганглия цыпленка. Как было показано ранее, парасимпатические нейроны, которые содержит этот ганглий, реагируют на крысиный GNTF, нейротропный фактор, не имеющий отношения к семейству NGF / BDNF /NT-3 (Manthorpe и др., 1986, Brain. Res., 367: 282-6), Stockli и др., 1989, Nature, 342: 21-28), Stockli и др., 1989, Nature, 342: 21-28). Не наблюдалось реакции ни в одном из этих экспериментов с использованием супернатантов от COS клеток, трансфецированных контрольными векторами (Фиг. 8). В таблице IV показаны результаты примерного опыта по измерению реакции эксплантированных эмбрионных E8 ганглиев дорсального корня цыпленка (DRG), нодозных ганглиев (NG), и паравертебральных симпатических ганглиев (SG) на увеличивающиеся дозы NT-3. Ганглии культурировали указанное в табл. время в виде эксплантантов в 1 мл коллагенового геля, как описано Lindsay и Rohrer, 1985, Dev. Biol., 112: 30-48). Отрастание волокон оценивали по шкале от 0 до 5, где 5 являлось максимальным отрастанием волокон, наблюдаемым на ганглиях дорсального корня в ответ на насыщающую дозу фактора нервного роста (NGF) (1 - 10 нг/мл). Крысиный NT-3 применялся в виде кондиционированной среды от COS-M5 клеток, трансфецированных плазмидой pC8-rNT(PI), как описано выше. Кондиционированную среду от "mock-трансфецированных COS-M5 клеток использовали в качестве контроля. При всех испытанных дозах, более чем в 50-кратном разбросе, NT-3 способствовал обнаружимому отрастанию волокон от всех трех типов эксплантированных ганглиев, хотя при малых дозах реакция на симпатических ганглиях была слабее. Максимальная реакция отрастания волокон на NT-3, полученная на ганглиях дорсального корня была сравнима с той реакцией, которая наблюдалась от NGF или BDNF. Максимальная реакция нодозных ганглиев на NT-3 была значительнее максимальной реакции на BDNF. Нодозные ганглии не показали реакции отрастания волокон на NGF. Максимальная реакция симпатических ганглиев на NT-3 была меньше максимальной реакции этих ганглиев на NGF, и наблюдалась при более высоких концентрациях, чем требовалось для максимальной реакции на NT-3 в культурах дорсального корня или нодозного ганглиев.
7.2.6. Крысиный нейротропин-3 активен на нейронах млекопитающих
Для того, чтобы определить, проявляет ли крысиный NT-3 активность на нейронах млекопитающих, повторяли эксперименты на эксплантантах с использованием ганглиев дорсального корня, извлеченных из 14-дневных крысиных эмбрионов (Табл. 5). Очищенный NGF использовали в качестве контроля. E14 эксплантанты ганглиев крысиного дорсального корня (по четыре ганглия на 1 мл культуры) культивировали в течение 24 часов, в основном как описано для ганглиев цыпленка (Фиг. 8, Табл. 4), без добавления нейротропного фактора (контроль), с фактором нервного роста из мышиной подчелюстной железы (NGF), или с рекомбинантным крысиным NT-3 (кондиционированная среда COS-M5 клеток, трансфецированная с плазмидой pC8-rN 3/P1, как описано выше). Каждый ганглий оценивали на отрастание волокон, как описано выше (см. Табл. 4). Результаты показывают, что как и NGF, NT-3 высоко активен в способствовании отрастания волокон от эксплантантов ганглиев дорсального корня.
Поскольку DRG, NG и SG эксплантанты каждый реагирует на по меньшей мере два из трех родственных нейротропных факторов, то максимальная реакция, проявляемая данным ганглием зависим от используемого фактора. В случае DRG, реакция на насыщающие уровни NGF, BDNF и NT-3 была относительно эквивалентной. Однако у NG максимальная реакция на NT-3 была сильнее, чем на BDNF, тогда как у SG максимальная реакция на NT-3 была существенно ниже и несколько замедлена в сравнении с NGF.
7.2.7 Исследование сайтов синтеза нейротропина-3
Было установлено, что во время развития нейронов их выживание зависит от соответствующих нейротропных молекул. Длительное выживание, даже у взрослых, может потребовать поддержания нейротропного влияния. (Thoenen и др., 1987, Ciba. Found. Symp., 126: 82-95). В других случаях выживание зрелых нейронов может более не зависеть от нейротропного фактора; тем не менее было найдено, что такие факторы сильно воздействуют на дифференцированный фенотип нейронов (Lindsay и Harmar, 1989, Nature, 337: 362-364). Определение сайтов синтеза нейротропной молекулы может поэтому помочь в выяснении ее физиологической роли.
Для исследования сайтов NT-3 синтеза и для сравнения NT-3 экспрессии с экспрессией NGF и BDNF, тройные назерн-блоттинги образцов РНК, полученных от различных тканей взрослой крысы гибридизировали к зондам, специфичным для каждого из этих генов (Фиг. 10). Как было ранее продемонстрировано, (Neumann и др. , 1984., EMBO 3: 3183-9; Shelton и Reichardt, 1984, Proc. Natl. Acad. Sci. , США, 81: 7951-7955), экспрессия NGF мРНК была наиболее высокой в головном мозгу, сердце и селезенке; по меньшей мере следы были обнаружены в других исследованных тканях. BDNF проявил более ограниченный паттерн экспрессии; самые высокие уровни были обнаружены в головном мозге (Leibrock и др. , 1989, Nature, 341: 149-152), и значительные уровни наблюдались в сердце, легких и мышцах. Как и в случае с NGF, NT-3 транскрипт (1,4 кб) обнаруживался во всех рассматриваемых взрослых тканях. Однако во всех периферийных тканях уровень экспрессии NT-3 мРНК был по меньшей мере сравнимым с наблюдавшимся уровнем во взрослом головном мозге, и в некоторых случаях (напр. почки, селезенка) был заметно выше.
Также сравнивали относительное содержание транскриптов NGF, BDNF и NT-3 в головном мозгу новорожденных и взрослых мышей. В отличие от NGF и BDNF, уровень NT-3 мРНК в мозгу новорожденного был выше чем во взрослом мозге (Фиг. 8). Более детальный анализ показал, что уровни NT-3 мРНК в центральной нервной системе значительно выше во время плодного развития и затем снижается до взрослых уровней.
7.3 Обсуждение
Структурное сравнение NGF, BDNF и самого нового члена этого семейства, NT-3, позволило выявить несколько консервированных областей, и привело к заключению, что функциональные различия между этими протеинами определяются последовательностями, которые лежат вне этих консервированных областей. Предсказанное существование длинного и короткого предшественника всех трех протеинов поставило интригующие вопросы относительно существования обеих форм-предшественников "ин виво". Длинные формы могут процессировать более эффективно, чем короткие. Тем не менее, векторы, экспрессирующие коротких предшественников, дают биологический материал в COS клетках.
Открытие того, что эти три нейротропных фактора проявляют отчетливые, специфичные по стадиям и тканям паттерны экспрессии, подкрепляет мнение, что невральное развитие зависит от отчетливой временной и пространственной экспрессии дискретных нейротропных активностей. Профиль NT-3 экспрессии в зависимости от развития предполагает, что этот фактор может играть особенно важную роль на ранней стадии развития нервной системы. Наша начальная характеристика NT-3 нейротропной активности "ин витро", в сочетании с общим преобладанием NT-3 мРНК как во взрослом мозге, так и взрослых периферийных тканях, далее предполагает, что NT-3 может оказывать широко распространенное влияние на нейронную функцию и/или выживание у взрослых. Более глобальная экспрессия NT-3 также повышает возможность того, что этот фактор действует на клетки вне нервной системы, как предполагали для NGF. (Otten и др., 1989, Proc. Natl. Acad. Sci., США, 86: 10059-10063).
Хотя до сих пор не продемонстрировано ясно, что нейроны могут одновременно реагировать более чем на один нейротропный фактор, факты позволяют предположить, что NGF и BDNF могут действовать на перекрывающихся нейронных популяциях. Например, введение NGF или BDNF может спасти значительное большинство DRG нейронов, которые бы иначе погибли во время нормального развития птицы (Hofer и Barde, 1988, Nature, 331: 261-2). Наши наблюдения действия NT-3 на периферийные ганглии цыпленка сильно подтверждает интересную возможность того, что отдельные нейроны могут реагировать на множественные, родственные факторы. Если это так, то вызывание и физиологическое существование одновременного реагирования ставит увлекательные вопросы. Например, компоненты рецепторов и/или сигнальные механизмы трансдукции для трех родственных нейротропных факторов могут быть для них общими. В принципе, одновременно реагирующие нейроны могут иметь множественные рецепторы, каждый из которых специфичен для конкретного нейротропного фактора, или единственный рецептор, который может вызывать реакцию на множественные нейротропные факторы. Ин виво, эти различные факторы могут быть одновременно представлены всем реагирующим нейронам. Более вероятно, имеются пространственно-временные различия в относительном наличии отдельных факторов (напр., Davies и др., 1987, Nature, 326: 353-358). Возможно также, что различные факторы имеются у различных мест одного и того же нейрона (например, сенсорный нейрон может получить разные факторы от его периферийных и центральных терминалов) (Kalcheim и др. , 1987, Le Douarin, EMBO, 6: 2871-2873). Если множественные факторы одновременно имеются у некоторых нейронов, то их действия могут быть как ненужными, так и комплементарными.
С объяснением индивидуальной и потенциально комплементарной роли NGF, BDNF и NT-3 будет обеспечена информация, которая имеет решающее значение для понимания нормального развития и существования нервной системы. Исследования на животных позволяют предположить, что NGF может представлять ценность при лечении дегенеративных неврологических состояний (Snider и Johnson, 1989, Ann. Neurol., 26: 489-506, Fischer и др., 1987, Nature, 329: 65-8, Thelps и др. , 1989, Neurobiol. Aging. 10: 205-7). Клонирование нового члена генного семейства NGF / BDNF и его потенциальные взаимодействия с другими членами этого семейства дает новую пищу для размышлений о возможных терапевтических применениях этих протеинов при лечении нейродегенеративных заболеваний.
8. Пример 3: Клонирование и характеризирование гена человеческого нейротропина-3
8.1. Результаты
Приготовление зонда (R1B/2C), используемого для идентифицирования крысиного NT-3 гена, осуществляли как описано выше, в разделе 7. Как здесь описано, зонд был получен путем цепной реакции полимеразы (PCR) из крысиной геномной ДНК с использованием дегенеративных нуклеотидных праймеров, соответствующих двум указанным в рамке гомологиям аминокислотной последовательности, разделяемой NGF и BDNF. Присутствие в зонде R1B/2C популяции молекул ДНК, представляющих новый ген, было обнаружено вначале саузерн-блот-гибридизацией на крысиной геномной ДНК, переваренной рестрикционной эндонуклеазой EcoRI, этот зонд обнаружил новый фрагмент ДНК, в дополнение к ожидавшимся фрагментам, известным своим соответствием NGF и BDNF генам.
Когда меченый 32P R1B/2C использовали в качестве зонда для анализа саузерн-блоттингов человеческой геномной ДНК, переваренной различными рестрикционными эндонуклеазами, как в случае крысиной ДНК, наблюдалась гибридизация к полосам, соответствующим генам NGF и BDNF, а также и к новым полосам. Например, с помощью Hind III рестрикционной эндонуклеазы наблюдалась новая (т.е. не-NGF, не-BDNF) полоса размером примерно 1,8 кб, с BAM HI наблюдалась новая полоса примерно 15 кб; и с Eco RI наблюдались новые полосы 8 и 12 кб (присутствие двух полос могло происходить от полиморфизма в Eco RI рестрикционных сайтах в человеческой геномной ДНК). Эти данные указывают, что человеческая ДНК содержит ген NT-3, который хорошо консервирован у крыс и людей.
Человеческий ген NT-3 был выделен путем скрининга геномной библиотеки, как описано для выделения крысиного NT-3 гена (см. пример, раздел 7). Короче, библиотека, состоящая из продуктов частичного переваривания San 3A геномной ДНК человеческой плаценты, клонированная в бактериофаговом векторе λ EMBL 3 / SP / T7 (из лабораторий "Клонтех", Инк.) подвергалась скринигу зондом R1B/2C, а также зондами крысиного NGF и крысиного BDNF. Ожидалось, что клон человеческого NT-3 гибридизирует с зондом R1B/2C, но не с NGF и не с BDNF. Один такой фаговый клон был идентифицирован среди 8 • 105 скринированных бляшек. Этот клон, обозначенный ⊘ hN3 / G I/, как оказалось, содержит инсерт человеческой ДНК примерно в 16 кб. Этот клон был рестрикционно картирован стандартными методами, и выбранные рестрикционные фрагменты были субклонированы в плазмиду pBluescript /Stratagene/ для анализа последовательности ДНК. На Фиг 11 показаны: последовательность человеческого NT-3 гена и выведенная из него аминокислотная последовательность протеинового продукта в сравнении с крысиными NT-3 последовательностями.
8.2 Обсуждение
Результаты анализа последовательности показывают неожиданно высокий уровень консервирования в нуклеиновокислотных и аминокислотных последовательностях между крысиным и человеческим NT-3. Внутри области, кодирующей зрелый полипептид (119 аминокислот), крысиный и человеческий гены являются гомологичными в ДНК последовательности примерно на 92%. Однако ни одно из различий в нуклеотидной последовательности между человеческим и крысиным вариантом в этой области не привело к аминокислотным замещениям, выведенные аминокислотные последовательности зрелого крысиного и человеческого NT-3 (и зрелого мышиного NT-3, см. Раздел 6, выше) являются абсолютно идентичными. Это напоминает высокую степень консервирования BDNF, которая показывает полную идентичность аминокислотных последовательностей зрелого пептида у крысы, мыши, человека и свиньи. В отличие от этого, аминокислотные последовательности зрелого человеческого NGF и NGF грызунов (мышь или крыса) отличаются примерно на 10%.
Кроме того, аминокислотные последовательности предполагаемых предшественников человеческого и крысиного NT-3 также показывают примечательно малое количество различий - (подчеркнуто на Фиг. 11). Непосредственно выше от предсказанного сайта протеазного расщепления, который бы генерировал зрелый NT-3 полипептид (Arg-Arg-Lys-Arg), человеческая последовательность лишена одного кодона (перед Pro), который присутствует в крысиной последовательности. Один блок из четырех аминокислот отличается от человеческого и крысиного рrерrо NT-3, и шесть дополнительных единственных аминокислотных замещений разбросаны между этим блоком и предсказанным сайта протеазного расщепления.
9. Биологическая активность человеческого NT-3
Вследствие того, что выведенная аминокислотная последовательность зрелого человеческого NT-3 является идентичной последовательности зрелого крысиного NT-3, можно с уверенностью предсказать, что человеческий и крысиный NT-3 протеины будут проявлять неотличимые биологические активности. Нейротропная активность человеческого NT-3 была подтверждена путем инсерции клонированного человеческого гена в плазмидный экспрессионный вектор pCDM8, трансфецируя полученную плазмиду pC8-LN3(P1) в COS-M5 клетках (как описано Chen и Okayama, 1987. Mol. Cell Biol., 7: 2745-52), и последующим исследованием нейротропной активности в кондиционированной среде от трансфецированных клеток. Человеческий ген NT-3 был амплифицирован PCR реакцией из бактериофага ⊘ hN3(G1), и инсертирован в плазмидный экспрессионный вектор pCDM8, как описано для крысиного гена NT-3 (Пример 7); полученную плазмиду обозначили pC8-hN3(P1). Определяли нуклеотидную последовательность всего NT-3 инсерта и сравнивали ее с геномной последовательностью, определенную как описано выше, для того, чтобы подтвердить, что во время PCR реакции амплификации и клонирования не было введено никаких мутаций. Методы трансфецирования и исследования были в основном идентичными методам, используемым для оценки биологической активности крысиного NT-3.
Как предсказывалось, было обнаружено, что человеческий NT-3 обладает нейротропной активностью, когда проводили исследования на эксплантантах эмбрионных 9-го дня (E9) ганглиях дорсального корня цыпленка и нодозных ганглиях (Таблица VI). Эти ганглии культивировали (см. Фиг. 8, Табл. IV) в течение 24 часов в присутствии кондиционированной среды (супернатантов) от имитационно-трансфецированных плазмидами (все они происходят от pCDM8 вектора экспрессии), кодирующими рекомбинантный человеческий BDNF, или рекомбинантный крысиный NT-3 / rNT-3; плазмида pC8-rN3(P1)), или рекомбинантный человеческий NT-3 / hNT-3; плазмида pC8-hN3(P1)). Плазмида BDNF была выбрана в качестве положительного контроля, потому что BDNF известен своей нейротропной активностью как на нодозных ганглиях, так и на ганглиях дорсального корня. Как показано на Табл. IV, и крысиный, и человеческий рекомбинантные NT-3 в умеренной дозе (сравни Табл. IV) показал примерно тот же уровень активности, что и BDNF на ганглиях дорсального корня, и значительно более высокую активность, чем BDNF, на нодозных ганглиях. Не наблюдалось различий в активности у человеческого NT-3 по сравнению с крысиным.
10. Идентификация продукта человеческого NT-3 гена путем метаболического мечения
Предсказанный размер зрелого NT-3 полипептида (крысиного или человеческого) составляет 119 аминокислот, с молекулярным весом 13,6 дальтон. С целью определения экспериментальным путем приблизительного размера зрелого человеческого NT-3 полипептида, клетки трансфецировали экспрессионной плазмидой человеческого NT-3 и метаболически метили, а затем кондиционированную среду исследовали на присутствие нового полипептида. В эксперименте, показанном на Фиг. 12, COS-M5 клетки трансфицировали плазмидной рС8 - hN3/P1/ (описано выше), клетки метили смесью [35S] метионина и [35S]цистеина, ростовую среду собрали и фракционировали электрофорезом при условиях денатурации на 15%-ном полиакриламидном геле, и протеины переносили на мембранный фильтр (в основном как описано Towbin и др., 1979 Proc. Natl. Acad. Sci., США, 76: 4350-4354), и меченые полипептиды обнаруживали авторадиографией. Имитационнотрансфецированные клетки использовали в качестве контроля (дорожка обозначена "MOCK"). Как показано на Фиг. 12, экспрессионная плазмида pC8-hN3(P1) управляла синтезом единственного полипептида размером примерно 14 кДа (отмеченного на Фиг. как NT-3), который отсутствовал в контроле. В пределах разрешения техники, это хорошо согласовалось с предсказанным размером зрелого NT-3.
11. Пример 4: Нейротропин-3 поддерживает выживание в культуре допаминэргических нейронов из вентрального мезенцефалона крысиного эмбриона.
Культуры вентрального среднего мозга E14 крысиного эмбриона были сделаны, как описано в патентной заявке США N серии 07/400 591, поданной 30 августа 1989, которая полностью включается в настоящее описание путем ссылки. Культуры засевали с плотностью 100 тыс. клеток на кв. см или 50 тыс. кл. на см2 (см. Фиг. 13 и 14), и выращивали при отсутствии контроля нейротропного фактора, или же в присутствии возрастающих количеств COS клеточного супернатанта, содержащего рекомбинантный человеческий нейротропин-3. После 8-дневного культивирования, клетки фиксировали и окрашивали с моноклональным антителом на тирозин-гидроксилазу (IH), маркер допаминэргических нейронов. Как видно на Фиг. 13 и 14, обнаружено, что возрастающие количества NT-3 увеличивают количество TH-положительных клеток, выживающих после 8 дней, с максимумом в 2,5 раза выше контрольных значений с разведением 1 : 25 NT-3 COS клеточного супернатанта. Оказалось, что очищенный фактор нервного роста не дает эффекта, а эффекты NT-3 были аналогичны действию BDNF.
12. Пример 5: NT-3, BDNF и NGF в развивающейся крысиной нервной системе: параллельные и реципрокные паттерны экспрессии
12.1. Методы
12.1.1. Материалы и диссекции
Крысы вида Spraque-Dawley, полученные от НагIап Spraque-Dawley Inc. использовали для всех диссекций. Диссекции взрослого головного мозга осуществляли по стандартным микроскопическим анатомическим отметкам. Образцы кортекса включали неокортекс и дорсальные участки обонятельной коры. Образцы промежуточного мозга были взяты с использованием медуллярных полосок (stria medullaria) и перекрестом зрительных нервов в качестве дорсальных и вентральных отметок, соответственно. Образцы среднего мозга брали на уровне colliculi superior и colliculi inferior, дорсально, и простирались к вентральной поверхности мозга до наиболее выступающего края гипофиза. Образцы заднего мозга не содержали мозжечка, но включали гипофиз и продолговатый мозг. Следует заметить, что только клювные участки стриатума использовали для образцов, чтобы исключить загрязнение тканью таламуса. Образцы гиппокампуса собирали от уровня fimbria / fornix до, примерно, каудального полюса. Диссекции головного мозга новорожденных проводили с использованием аналогичных отметок, за исключением stria medullaria. Для получения эмбриональных тканей использовали искусственно осемененных крыс, с датой осеменения, обозначенной E1, день появления потомства обозначили PO. Взрослые крысы весили от 150 до 275 граммов (6 - 8 недельного возраста).
12.1.2. Получение РНК и назерн-блоттинг
Выбранные ткани подвергали диссекции из крыс и немедленно замораживали в жидком азоте. мРНК выделяли путем гомогенизации тканей в 3М LiCl / 6М мочевины, как описано (Bothwell и др., 1990, в "Методы клонирования и анализа эукариотических генов", Джонс и Барлетт, Бостон, МА). Полученные РНК (10 μ г) фракционировали электрофорезом на четырех 1%-ных агарозо/формальдегидных гелях (Bothwell и др., выше) с последующим капиллярным переносом на нейлоновые мембраны (MagnaGraph, Micron Separations Inc.) с 10х стандартным цитратным физиологическим раствором с pH 7,0. Эти РНК затем UV - перекрестно лигировали на мембраны при экспозиции ультрафиолетового излучения (Shatalinker®, Stratagene, Inc.) и гибридизировали при 68oC с радиомечеными зондами в присутствии 0,5 М NaPO4 (pH 7), 1%-ным альбумином бычьей сыворотки (фракция V, Sigma, Inc. ) 7% SDS, 1 мМ ЭДТК (Mahmoudi и Lin, 1989, Biotechniques, 7: 31-33) и 100 μ г/мл разрушенной ультразвуком, денатурированной ДНК спермы лосося. Фильтры промывали при 68oC 2х SSC, 0,1% SDS и подвергали авторадиографии от 1 дня до двух недель с 1 - 2 интенсифицирущими экранами (Cronex®, Du Pont), и рентгеновской пленкой (XAR-5, Кодак) при -70oC. Этид-бромидное окрашивание четверных гелей продемонстрировало, что в различных образцах исследовались эквивалентные уровни общей РНК (как у Maisonpierre и др., 1990, Science, 247: 1446-1451), это было подтверждено зондированием нескольких блоттингов с использованием зонда, специфичного для 28SrРНК.
12.1.3. Приготовление зондов NT-3, BDNF и NGF и NGFR
Молекулярное клонирование кодирующих областей для крысиного NT-3, BDNF и NGF в экспрессионном векторе pCDM8 (Aruffo и Seed, 1987, Proc. Natl. Acad. Sci., США, 84: 8573-8577) было описано ранее (Maisonpierre и др., см. выше). Все 800 пар оснований (бр) xhoI инсертов этих плазмид разделили на акриламидном геле и восстанавливали электроэлюированием (Bothwell и др., 1990), а затем метили 32P случайным гекзамерным мечением (Bothwell и др., выше); гибридизация каждого из зондов к синтетическим NT-3, BDNF и NGF транскриптам (см. ниже) продемонстрировало, что зонд, специфичный для одного нейротропина, не гибридизирует к транскриптам родственных нейротропинов. Крысиный NGFR зонд представлял собой 1,6 кб Ncol кДНК фрагмент, расширяющий область кодирования крысиного NGFR протеина (Radeke и др., 1987, Nature, 325: 593-597).
12.1.4. Получение и количественное определение синтетического транскрипта
Промотор фага T7, присутствующий в экспрессионных конструкциях pCDM8 / нейротропин, описанных выше, использовался для создания синтетических транскриптов РНК, соответствующих смысловой ориентации областей, кодирующих NT-3, BDNF и NGF. Вначале количества этих синтетических транскриптов были определены спектрофотометрически. Далее транскрипты исследовали с использованием с мечением конца (Bothwell и др., выше) 30-мерного олигонуклеотидного зонда, который гибридизировали к общему 5' концу (непосредственно ниже T7 промотора) этих трех транскриптов. Денситометрическое сканирование (Компьютерный Денситометр серии 300 фирмы "Molecular Dynamics, Inc.") подвергнутых дот- и назерн-блоттингу синтетических транскриптов, гибридизированных к олигонуклеотидному зонду, (гибридизацию и промывание осуществляли при 55oC, а в остальном как описано выше), подтвердило, что эквивалентные уровни синтетических транскриптов могли бы использоваться в качестве точных стандартов (данные представлены на Фиг. 15A).
12.1.5. Денситометрическое количественное определение уровней нейротропиновых транскриптов
Уровни транскриптов в различных образцах были нормализованы до стандартизованного образца головного мозга взрослой крысы (см. выше) следующим образом. Эквивалентные аликвоты образца РНК взрослого мозга были включены в каждый назерн-блот. Для определения интенсивности сигнала от каждого исследуемого образца использовали денситометрическое сканирование с различными авторадиографическими экспозициями для каждого назерн-блота. Для каждой сканируемой экспозиции исследовали интенсивность сигнала для каждого образца. Для каждой сканируемой экспозиции интенсивность сигнала каждого образца разделяли по оценке, полученной для интенсивности сигнала в образце взрослого мозга в этой экспозиции, что нормализовало все оценки по отношению к стандартизированным образцам взрослого мозга. На Фиг. 18 показаны уровни транскриптов в различных образцах относительно уровней в образце взрослого мозга, при этом уровень во взрослом мозге приняли равным 1,0. Определением фемтограммов нейротропинового транскрипта на микрограмм общей РНК в образце взрослого мозга удалось определить действительные уровни транскриптов (в fg/ug) в образцах, нормализованных по отношению к образцу взрослого мозга.
12.2. Результаты
12.2.1. Количественное определение и сравнение уровней NT-3, BDNF и NGF мРНК в головном мозге взрослых крыс
Использовали систему назерн-блоттинга для количественного определения и сравнения экспрессии NT-3, BDNF и NGF транскриптов в различных тканевых образцах. Количество каждого нейротропинового транскрипта в различных образцах определяли относительно точных синтетических стандартов. Транскрипты синтетических РНК NT-3, BDNF и NGF, количество которых было точно установлено (см. Фиг. 15A и пояснения к ней), были включены в назерн-блоты, также содержащие 10 μ г общей РНК, выделенной из мозга взрослых крыс. Эти блоттинги гибридизировали к радиомеченым зондам, специфичным для каждого нейротропина, и затем подвергали авторадиографии (Фиг. 15B). Сканирующая денситометрия затем была использована для сравнения интенсивности сигналов гибридизации, полученных от образца взрослого мозга и синтетических стандартов. Это исследование количества обнаружило, что имелись примерно равные уровни мРНК (оцениваемые как 40 fg NT-3 транскриптов, 45 fg BDNF транскриптов и 30 fg NGF транскриптов на ug общей РНК) для всех трех нейротропинов во взрослом крысином мозге. Аликвоту этого стандартизированного образца взрослого мозга включали во все последующие назерн-блоты, таким образом обеспечивая определение количества уровней нейротропиновой экспрессии в новых образцах РНК путем сравнения (см. ниже). Чтобы облегчить визуальное сравнение трех нейротропиновых транскриптов среди различных образцов, экспозиции, изображенные на последующих фигурах, были выбраны так, что интенсивность сигналов в стандартизированном мозговом образце была сходной для всех трех нейротропинов, нормализуя тем самым сигналы в образцах других тканей к определенному стандарту.
12.2.2. Экспрессия генов NT-3, BDNF и NGF проявляет общие, а также индивидуальные признаки развития
Исследование экспрессии нейротропинового гена в крысиных эмбрионах обнаружило, что все три нейротропина проявляют резкое увеличение своих уровней экспрессии между 11-ым и 12-ым днем эмбрионального развития. (Фиг. 16A); все три нейротропиновых транскрипта широко распространены среди эмбрионов E11 и E12. Время согласованного повышения экспрессии нейротропиновых генов совпадает с периодом, в котором фактически начинается нейрогенез (как периферийно, так и центрально), и совпадает с началом развития аксонов этими формирующимися новыми нейронами (см., например, Altman и Bayer, 1982, Adv. Anat. Embryol. Cell. Biol. Vol. 74; Altman и Bayer, 1984, там же, том 85).
Несмотря на эту координацию экспрессии нейротропиновых генов во время эмбриогенеза, сравнение со стандартизированным образцом взрослого головного мозга обнаруживает, что NT-3 мРНК является все же более обильной у ранних эмбрионов (180 fg/ug общей РНК), тогда как BDNF мРНК меньше всего (5-10 fg/ug общей РНК), а NGF мРНК присутствует на промежуточных уровнях (30 fg/ug общей РНК) (Фиг. 16A). NT-3 и BDNF продолжают проявлять обоюдную взаимосвязь, когда уровни экспрессии происходят в развивающемся головном мозге (Фиг. 16B) или в густо иннервированном сердце (Фиг. 16C) - сначала высокая экспрессия NT-3 снижается, тогда как изначально низкая экспрессия BDNF повышается до тех пор, пока у взрослого в конце концов не приходят к сходным уровням; в отличие от этого, экспрессия NT-3 остается довольно постоянной. Интересно, что экспрессия NT-3 повышается во время развития печени и тимуса, органов которые негусто иннервированы и которые не дают обнаружимой экспрессии BDNF мРНК (Фиг. 16C).
Эмбриональная экспрессия NGFR транскрипта очевидно наступает прежде увеличения экспрессии нейротропинового гена, и является неожиданно высокой в раннем спинном мозге, и уменьшается во время пренатального развития головного мозга и постнатального развития сердца (Фиг. 16A, B и C).
12.2.3. Сравнение экспрессии NT-3, BDNF, NGF и NGFR в нервных системах взрослых и новорожденных
Для определения пространственного распределения экспрессии нейротропиновых генов в нервной системе крысы и для того, чтобы понять как ясные развитийные профили в мозге в целом соотносятся с развитийными изменениями внутри отдельных областей головного мозга, исследовалась экспрессия нейротропиновых генов в мозгах новорожденных и взрослых крыс. Все три фактора проявили дискретные пространственные и временные различия в своих паттернах экспрессии (Фиг. 17). Количественное определение уровней транскриптов, включая уровни в периферийных тканях, показано в графическом виде на Фиг. 4. Основное сходство, разделяемое всеми тремя факторами, это их одинаково высокий уровень экспрессии во взрослом гиппокампусе. В отличие от ситуации во взрослых периферийных тканях, где экспрессия NT-3 и NGF более похожи в своем широком распределении (Maisonpierre и др. , см. выше), NT-3 и BDNF проявляют очевидные параллели в их общих паттернах экспрессии во взрослом мозге (Фиг. 17B, 18B); интересно, что оба фактора отсутствуют в стриатуме. Однако NT-3 и BDNF также проявляют крайне интересные и ,очевидно, взаимосвязанные отличия, когда сравнивают экспрессию в новорожденном и взрослом мозге (Фиг. 17A, B и Фиг. 18A, B). NT-3 экспрессия является наивысшей у новорожденных, и значительно выше, чем у взрослых, в более незрелых областях мозга (т.е. мозжечке, гиппокампусе и неокортексе). BDNF экспрессия является в этих областях самой низкой, и самой высокой, подобно уровням у взрослых, в более каудальных областях мозга, чем в областях, которые созревают раньше (т.е. задний мозг, средний мозг и промежуточный мозг). Как во взрослом мозге, транскрипты NT-3 и BDNF необнаружимы в стриатуме новорожденных.
В сравнении с NT-3 и BDNF, уровни мРНК NGF проявляют менее резкие отличия в новорожденной против взрослой мозговой ткани (Фиг. 17, 18) уровни NGF в обонятельной луковице выше у новорожденных, тогда как уровни NGF в гиппокампусе и неокортексе выше у взрослых. Уровни мРНК NGFR были в общем выше у новорожденного по сравнению со взрослым мозгом, с исключительно высокими уровнями в мозжечке и заднем мозге новорожденного (Фиг. 17A, B).
12.2.4. Исследование экспрессии NT-3, NGF и BDNF во время развития дискретных областей центральной нервной системы
Для дальнейшего подтверждения мнения, что NT-3 экспрессируется более значительно на ранней стадии развития отдельных областей центральной нервной системы, тогда как BDNF экпрессируется в основном позднее при развитии тех же областей, анализировали экспрессию нейротропиновых генов во время развития трех областей ЦНС, созревание которых происходит в сильно отличающиеся временные периоды. Нейрогенез, за которым вскоре следует период естественно происходящей гибели клеток, начинается в случае спинного мозга очень рано (E12 - E13) и завершается за несколько дней до рождения (Altman и Bayer, см. выше). Напротив, большинство нейронов в мозжечке и гиппокампусе (аммоновом роге) (подсчитываемые по их гранулоклеточным популяциям) появляются после рождения (например, Altman, 1966, J. Comp. Neur., 128: 431-474; Schlessinger и др., 1975, J. Comp. Neur., 159: 149-176). В мозжечке более поздней стадии развития имеется обширный нейрогенез, миграция нейробластов и нейронная дифференциация во время первых трех недель жизни (например, Altman, 1966, см. выше). Сообщалось, что уровни мРНК NGF в гиппокампусе становятся легко обнаружимыми только после двух недель после рождения (Harde и др., 1986, Science, 234: 352-355); это повышение происходит намного позже перинального процесса ("всплеска"), обширной гранулоклеточной пролиферации (напр., Altman, 1966, см. выше) и инвазии волокон от холинэргических нейронов базального переднего мозга (Koh и Ioy, 1989, J. Neurosci, 9: 2999-3018), но совпадает с дальнейшей холинэргической дифференциацией этих нейронов (Large и др., выше).
Наше исследование развивающегося спинного мозга (Фиг. 5A, E) обнаруживает высокие уровни экспрессии NT-3 у E12 - E13 (150 - 280 fg/ug общей РНК), которые уменьшаются при рождении и почти необнаружимы у взрослых. мРНК BDNF которая едва обнаружима у E12 - E 13, достигает своего пика при рождении (10 - 20 fg/ug общей РНК) и затем снижается у взрослых. мРНК NGF экспрессируется на самых высоких уровнях у E12 - E13 спинного мозга (15 - 25 fg/ug общей РНК), но на уровнях в 10 раз ниже, чем уровни мРНК NT-3 на той же стадии. Интересно, что NGFR экспрессируется на более высоких уровнях в раннем спинном мозге; эта экспрессия ранее коррелировалась с периодом естественно происходящей клеточной гибели новых формирующихся двигательных нейронов в раннем спинном мозге (Ernfors и др., 1989, Neuron, 2: 1605-1613).
В мозжечке поздней стадии развития (Фиг. 19B, Г) в течение первых трех недель после рождения поддерживаются довольно высокие уровни NT-3 мРНК (500-820 fg/ug общей РНК), тогда как экспрессия BDNF начинает увеличиваться только в конце этого периода, на ранних стадиях развития мозжечка обнаружимы лишь очень низкие уровни экспрессии NGF. NGFR экспрессируется на высоких уровнях на ранней стадии развития мозжечка и затем снижается перед наблюдаемым снижением экспрессии NT-3.
В аммоновом роге (Фиг. 19C, C1) уровни мРНК как BDNF, так и NGF увеличиваются от низких уровней у E17 до промежуточных уровней при рождении, и достигают самых высоких уровней у взрослых. Хотя все три нейротропиновых транскрипта экспрессируются при сходных уровнях во взрослом аммоновом роге, экспрессия NT-3 значительно выше, чем BDNF и NGF в E17 и новорожденном аммоновом роге; уровни экспрессии NT-3 в аммоновом роге новорожденных столь же высоки, как и в перинатальном мозжечке (820 fg/ug общей РНК). В отличие от нейротропинов, экспрессия NGFR снижается во время развития аммонова рога.
Во всех трех областях ЦНС, изученных выше, экспрессия NT-3 значительно выше во время развития этих областей, а затем снижается до взрослых уровней, тогда как низкие вначале уровни мРНК BDNF повышаются до взрослых уровней подобно уровням NT-3. В отличие от взаимосвязанных профилей NT-3 и BDNF, экспрессия NGF не проявляет каких-либо последовательных паттернов; он предпочтительно экспрессируется (хотя и на низких уровнях) в раннем спинном мозге и мозжечке, но в позднем аммоновом роге.
12.3. Обсуждение
Этот анализ обнаружил как схожести, так и различия в пространственно-временном распределении трех нейротропиновых транскриптов. Транскрипты NT-3, BDNF и NGF, все проявляют одновременное увеличение их экспрессии между 11-ым и 12-ым днями эмбриогенеза крысы, и широко распространены в эмбрионах 12-го и 13-го дня. Время этого общего всплеска экспрессии примерно совпадает с развитийным всплеском нейрогенеза (напр. Altman и Bayer, 1982, см. выше); Altman и Bayer, 1984, см. выше). Эта ассоциация подкрепляет мнение о том, что все три нейротропина играют роль особой важности в развитии нервной системы, и могут отмечать период, когда все нейротропины становятся в общем необходимыми для поддержания выживания пост-митотических нейронов. Однако момент их экспрессии может также указывать и на другие роли нейротропинов в развивающейся нервной системе (см. ниже).
Хотя всплеск генной экспрессии происходит одновременно для трех нейротропинов, уровни, которых они достигают у ранних эмбрионов, сильно различаются. мРНК NT-3 наиболее обильна в эмбрионах; тогда как мРНК BDNF экспрессируется на самых низких уровнях. Этот контраст между экспрессией NT-3 и BDNF сохраняется почти в каждый исследованный момент. Во время развития, экспрессия NT-3 является наиболее сильной в областях ЦНС, в которых протекает пролиферация, миграция и дифференциация нейронов и их предшественников, и обычно снижается резко в областях ЦНС, когда они созревают. Напротив, экспрессия BDNF наиболее сильна в областях ЦНС, в которых уже произошел нейрогенез, и обычно увеличивается в областях ЦНС когда они созревают. Примечательно, что уровни, которых достигают в различных взрослых областях транскрипты NT-3 и BDNF являются, в конечном счете, совершенно сходными. Обоюдная взаимосвязь NT-3 и BDNF экспрессии во время развития, в сочетании с их сравнительно сходными профилями во взрослой ЦНС, указывает, что NT-3 и BDNF могут в некоторых случаях действовать на те же самые нейронные популяции в ЦНС. Если так, то наши данные предполагают, что NT-3 играет важную роль в развитии этих нейронов (вероятно, во время установления целевой иннервации), тогда как BDNF в основном действует позднее в жизни тех же нейронов (т.е. как фактор созревания и поддержания жизнедеятельности). Экспрессия NGF местно изменяется во время развития, но эти изменения не следуют определенному паттерну, как в случае NT-3 и BDNF. Уровни мРНК NGFR не отражает специфически экспрессию какого-либо из трех нейротропиновых генов, что согласуется с возможностью того, что NGFR может служить в качестве общего компонента индивидуальных нейротропиновых рецепторов (Radriguez-Tebar и др., 1990, Neuron, 4: 487-492). Экспрессия NGFR имеет тенденцию быть наиболее высокой на раннем развитии областей ЦНС, и наши исследования обнаруживают интересные, регулируемые развитием изменения экспрессии NGFR, которые являются предметом дальнейших исследований.
В отличие от их сходного распределения во взрослой ЦНС, NT-3 и BDNF имеют совершенно различные паттерны экспрессии во взрослых периферийных тканях; более широкое периферийное распределение транскриптов NT-3 может отражать активность на более широком спектре клеток (нервных, так и не относящихся к нервной системе) на периферии, чем BDNF. (Maisonpierre и др., см. выше).
Хотя имеется серьезное подтверждение тому, что NGF и BDNF играют важную роль в ранней стадии развития нервной системы, наш анализ обнаружил гораздо более последовательную и впечатляющую корреляцию между очень высокой экспрессией NT-3 и ранним невральным развитием. Уровни мРНК NT-3 в развивающемся мозжечке и новорожденном аммоновом роге в несколько раз выше, чем уровни любого из нейротропинов в любой другой ткани или области мозга, и более чем в двадцать раз выше уровня любого из нейротропинов во взрослом головном мозге. Открытие NT-3 как нового NGF родственного протеина, который может поддерживать по меньшей мере некоторые BDNF и NGF-зависимые нейроны (Maisonpierre и др. , выше) и временная экспрессия которого наиболее ясно совпадает с критическими периодами развития нервной системы, позволяет предположить, что NT-3 является физиологическим агентом, нормально ответственным за некоторые важные при развитии функции, прежде относимые к BDNF и NGF. Новое исследование действительных развитийных ролей всех членов этого генного семейства имеет большое значение вследствие возможности того, что антитела к этим родственным факторам могут перекрестно реагировать (Whittmore Senger, 1987, Brain Res. Rev., 12: 439-464).
Хотя мы ранее уже продемонстрировали, что NT-3 может действовать как классическая молекула нейронного выживания (Maisonpierre и др., выше), с учетом действия NT-3 как происходящий из мишени фактор, ограничения экспрессия которого приводит к нейронной селекции и отбору, все это ни в коем случае не исключает других важных для развития ролей NT-3 (так же как и для других нейротропинов). Паттерн экспрессии NT-3 в развивающейся нервной системе имеет большое сходство с таким паттерном нестина (нового промежуточного филаментного протеина, экспрессия которого является характерной для областей ЦНС в период нейрогенеза Lendahl и др., 1990) и SNAPa - антигенный маркер раннего отрастания нейритов - Jamamoto и др., 1986, J. Neurosci, 6: 3576-3594). В отличие от NGF (Cleod и др., 1989, Devel. Biol., 134: 30-37), высокие уровни экспрессии NT-3 отмечаются прежде достижения симпатическими волокнами сердца. Таким образом, NT-3 может быть в особенности связан с развитийными процессами, которые не относятся к нейронному выживанию, включая пролиферацию (дифференциацию нейронных предшественников и/или управление миграцией клеток или их аксонов; дальнейшее предположение о такой потенциальной физиологической роли NT-3 происходит из недавних открытий, что один из нейротропинов (т. е. NGF) может играть роль в пролиферации нейронных предшественников "ин витро". Наоборот, BDNF, хотя и присутствует на ранней стадии развития, может иметь более общую по значению роль задолго после начального периода нейронной гибели и селекции.
Профили экспрессии всех трех нейротропинов у взрослых имеют удивительное сходство - все три нейротропина экспрессируются при сравнительно высоких уровнях во взрослом аммоновом роге. Разрывание выростов холинэргических нейронов базального переднего мозга в аммоновом роге приводит к атрофии и уменьшению синтеза медиаторов этими нейронами (рассмотрено у Snider и Johnson, 1989, Ann. Neurol., 26: 489-506). Сходная атрофия связана с плохим осуществлением задач на "память" у старых крыс и у людей с болезнью Альцхаймера. Атрофия холинэргических нейронов базального переднего мозга может быть реверсирована в модели на крысах введением NGF. Представленные здесь данные согласуются с возможностью того, что взрослый аммонов рог нормально снабжает базальный передний мозг всеми тремя нейротропинами, предлагая свидетельство комплементарных действий NGF и BDNF на холинэргических нейронах в культуре, отражающих действительные физиологические роли этих молекул. Однако экспрессия NT-3 очень высока в самой ранней стадии развития аммонова рога, а затем снижается до взрослых уровней, которые сходны с уровнями NGF и BDNF. Эта высокая ранняя экспрессия снова предполагает, что NT-3 может играть уникальную роль в управлении или создании ранних соединений от базального переднего мозга или других гиппокамповых афферентов, или в пролиферации зубчатых гранулоклеточных предшественников; сравнительно низкие уровни NGF во время ранней стадии развития аммонова рога свидетельствуют против такой роли NGF (Large, выше).
13. Депонирование микроорганизмов
В Табл. III даны штаммы депонированных 28 февраля 1990 в Американской коллекции типов культур (American Type Culture Collection, 12301 Parklawn Drive Rock. ville. Maryland (20852):
Настоящее изобретение не ограничивается в своем объеме приведенными в описании примерами выполнения. В действительности, различные модификации изобретения в дополнение описанным здесь будут очевидны специалисту из предшествующего описания и сопровождающих фигур. Такие модификации должны подпадать под действие пунктов формулы изобретения. В описании цитированы различные источники, раскрытие которых включено полностью путем ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДНК-ФРАГМЕНТ, КОДИРУЮЩИЙ НЕЙРОТРОПНЫЙ ФАКТОР МОЗГА (BDNF), БЕЛОК BDNF И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1990 |
|
RU2131926C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ПОЛИПЕПТИДА, ГИБРИДНАЯ ДНК (ВАРИАНТЫ), СЛИТЫЙ БЕЛОК (ВАРИАНТЫ) | 1991 |
|
RU2120475C1 |
| РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТ-КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР (G - CSF) БЕЗ ДОПОЛНИТЕЛЬНОГО ОСТАТКА МЕТИОНИНА НА N-КОНЦЕ | 1991 |
|
RU2108386C1 |
| МУТАНТНЫЙ КАНАЛЬНЫЙ РОДОПСИН-2 | 2011 |
|
RU2595384C2 |
| МАЛЫЕ МОЛЕКУЛЫ РНК, ОПОСРЕДУЮЩИЕ ИНТЕРФЕРЕНЦИЮ РНК | 2007 |
|
RU2470073C2 |
| МАЛЫЕ МОЛЕКУЛЫ РНК, ОПОСРЕДУЮЩИЕ ИНТЕРФЕРЕНЦИЮ РНК | 2001 |
|
RU2322500C2 |
| ПРОМОТОР ДЛЯ СПЕЦИФИЧЕСКОЙ ЭКСПРЕССИИ ТРАНСГЕНОВ В ЭПИДЕРМИСЕ РАСТЕНИЙ | 2004 |
|
RU2382079C2 |
| ДНК (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ БЕЛКА, БЕЛОК, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2208638C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ ОБРАЗЦА | 2014 |
|
RU2662461C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА С УЛУЧШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2004 |
|
RU2342400C2 |








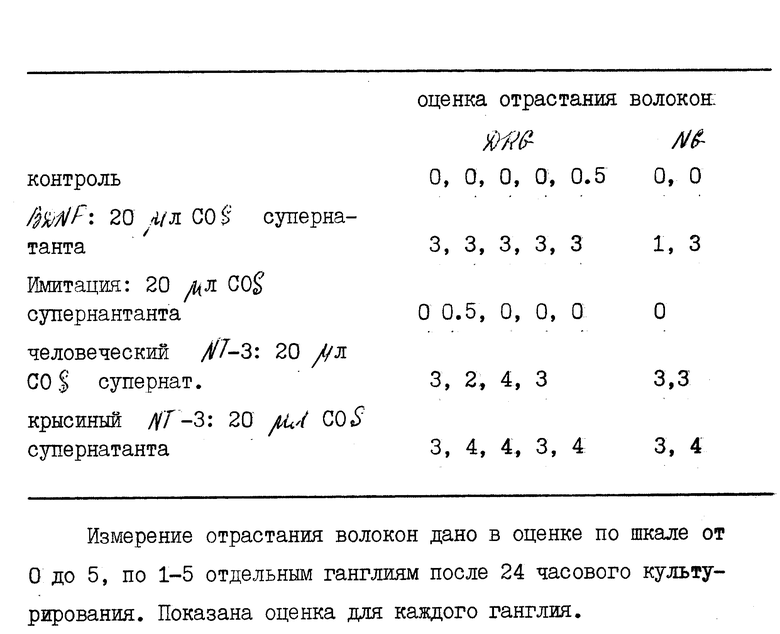



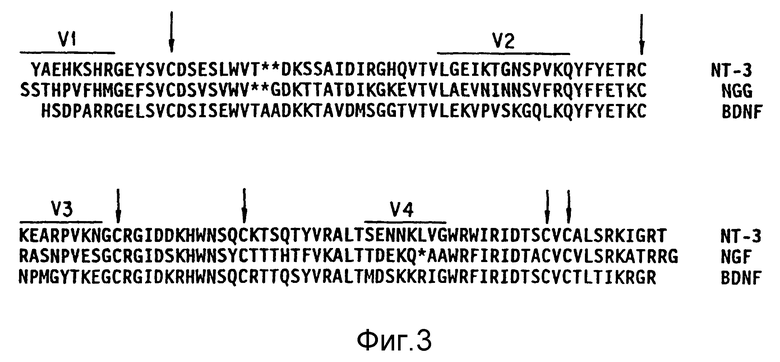
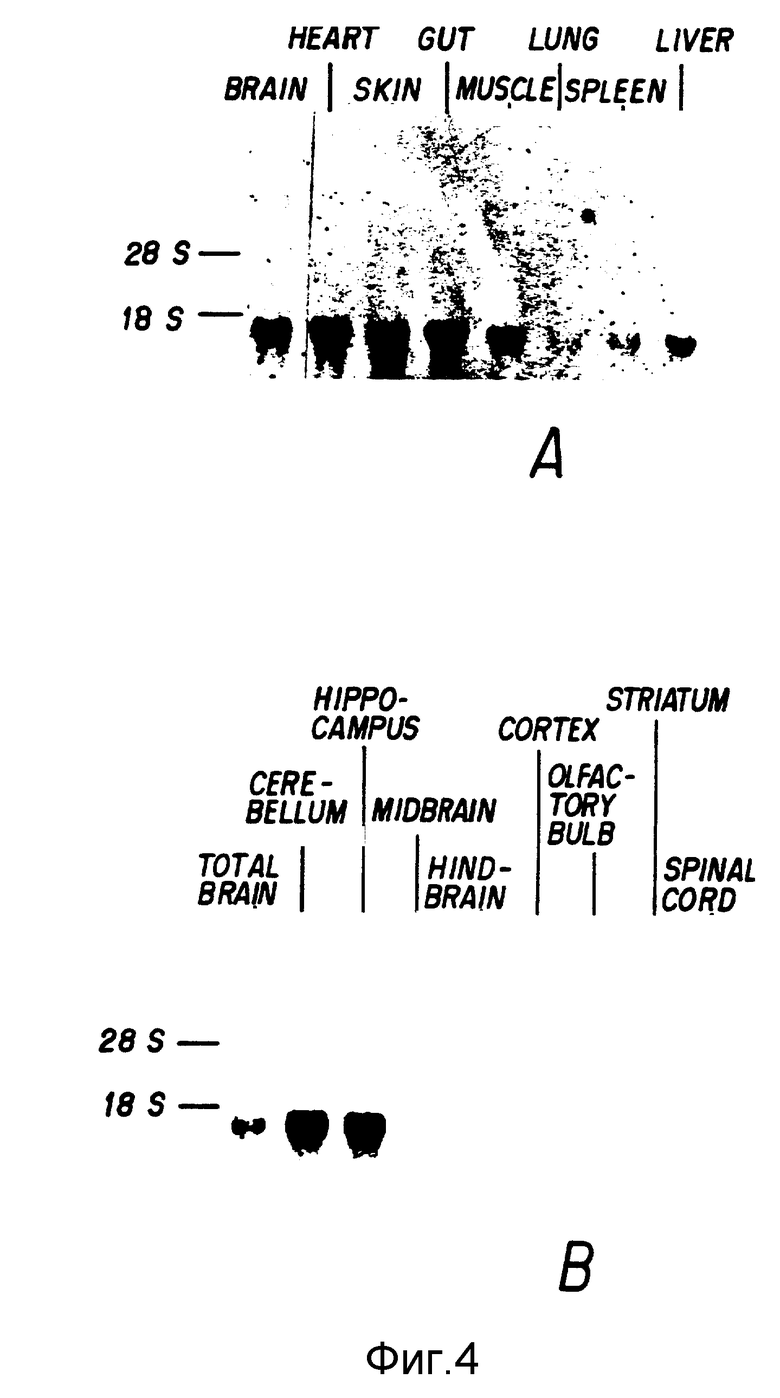
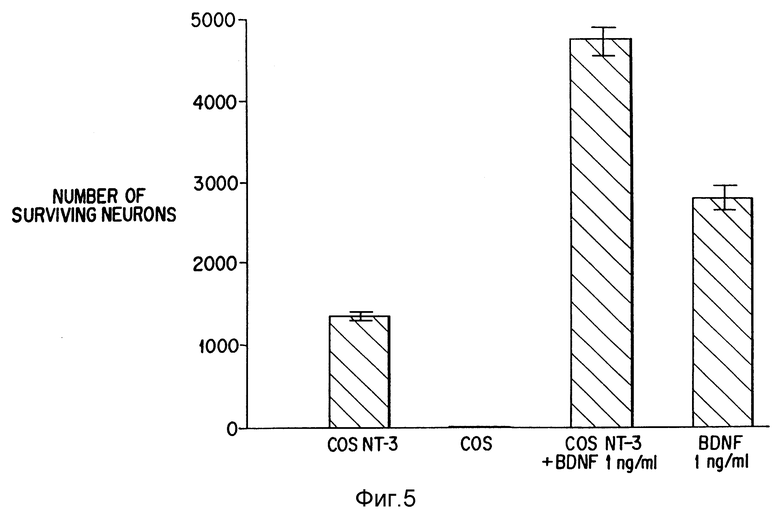
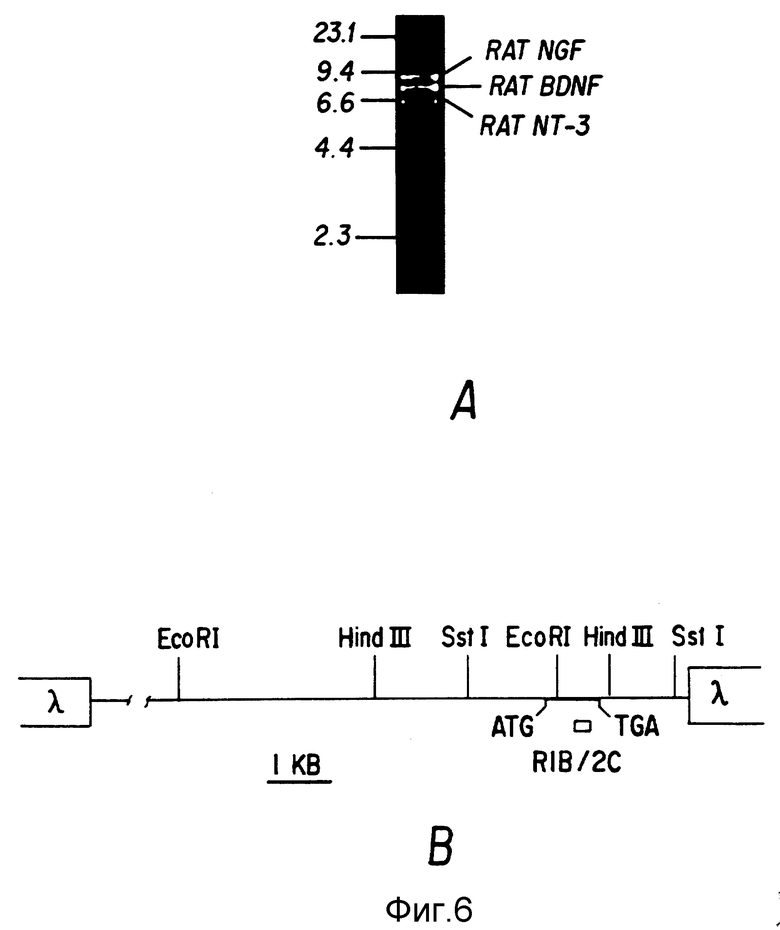


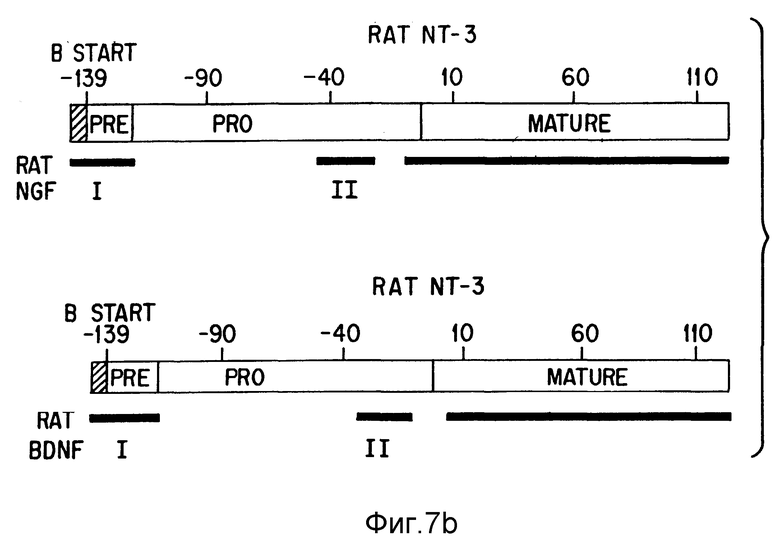
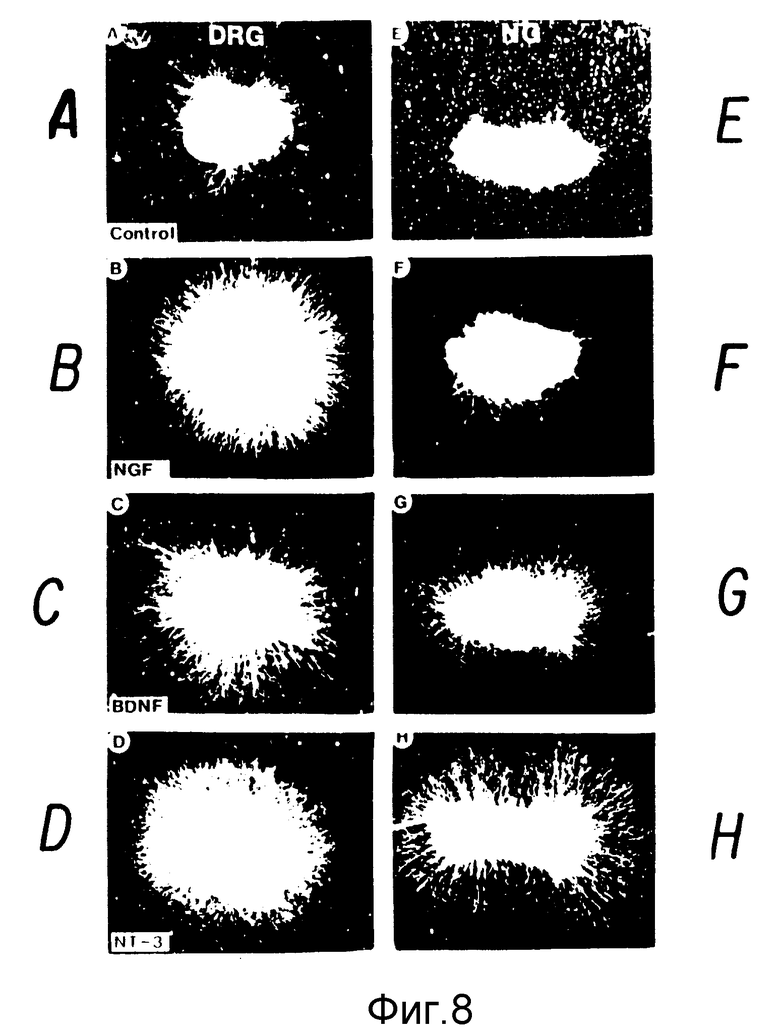

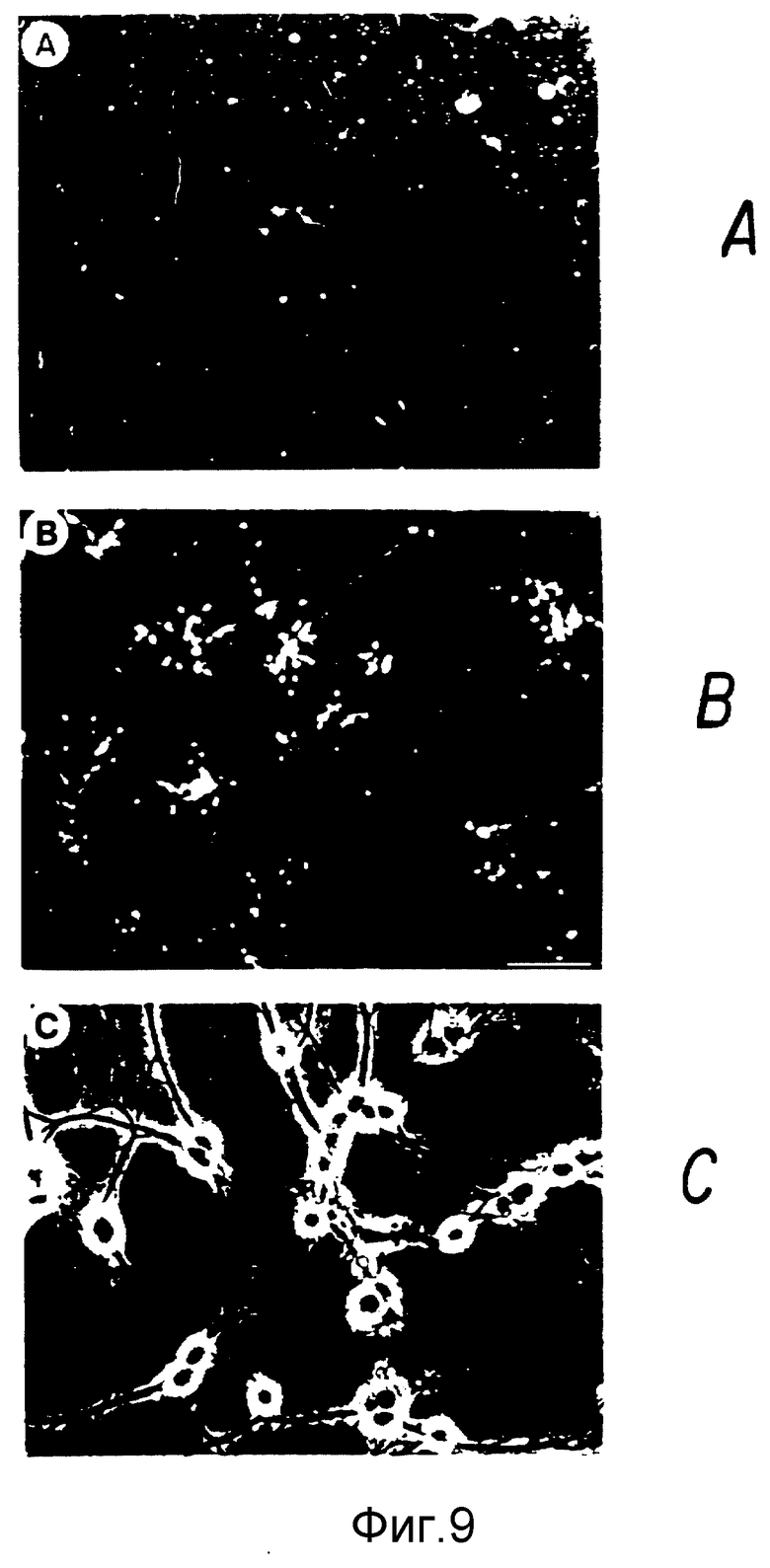
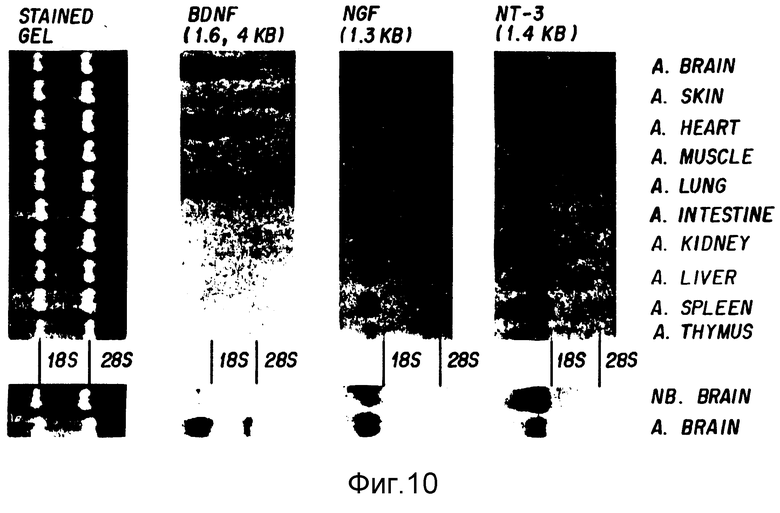










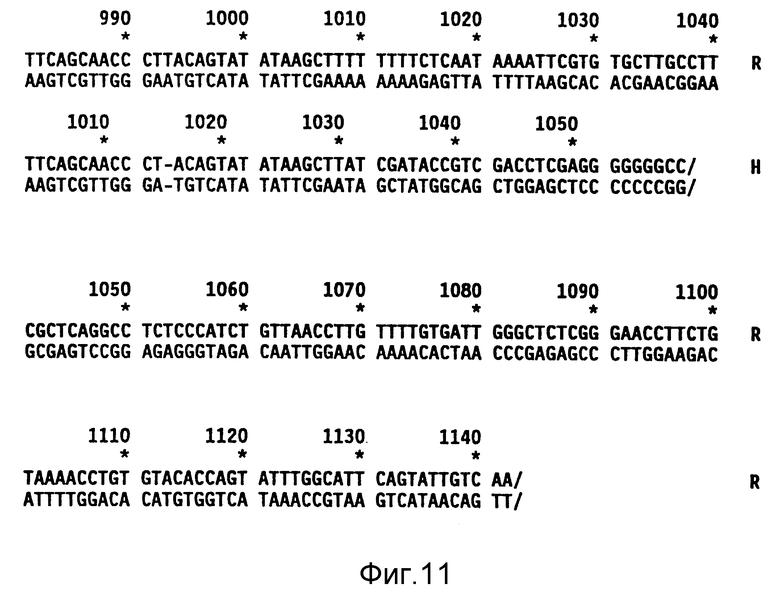
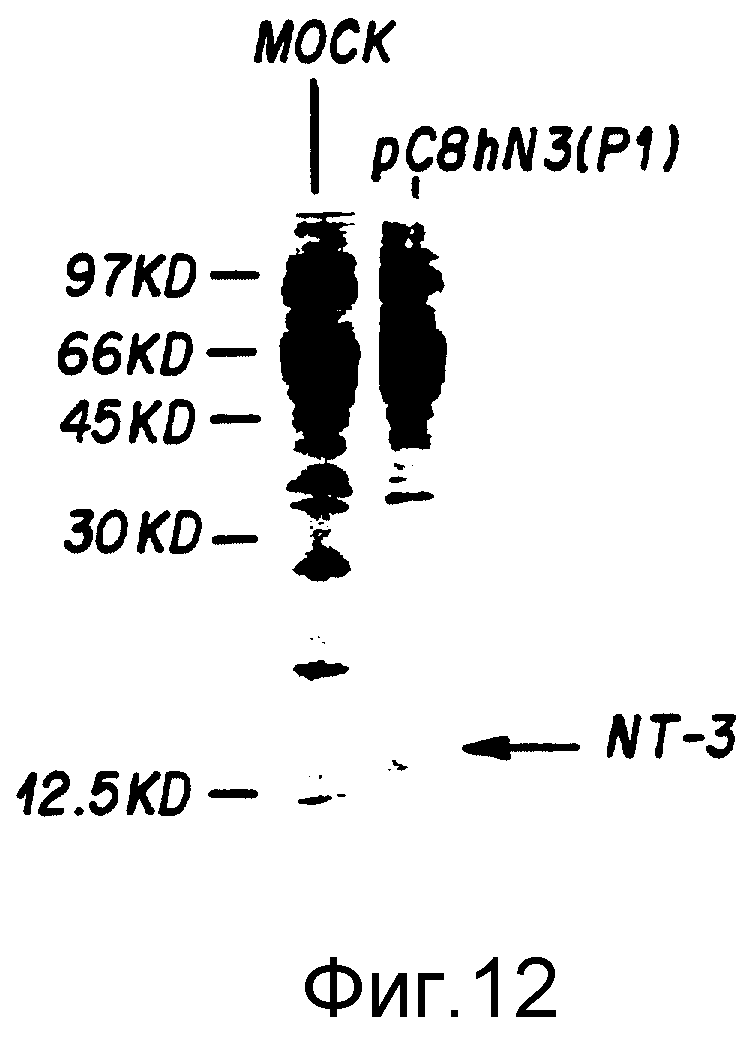
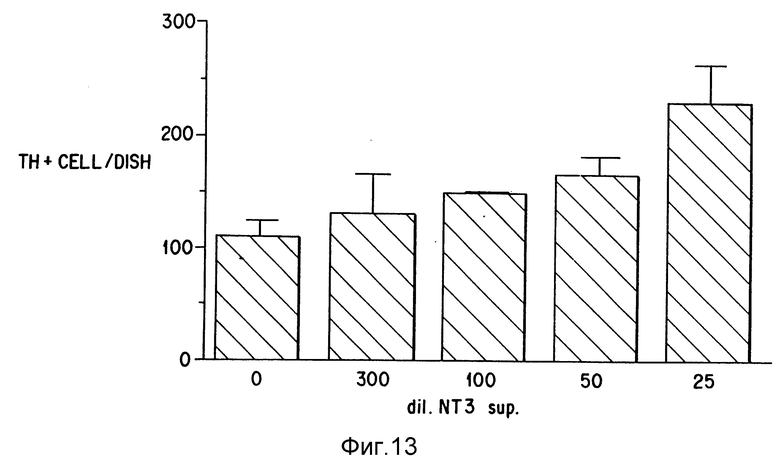
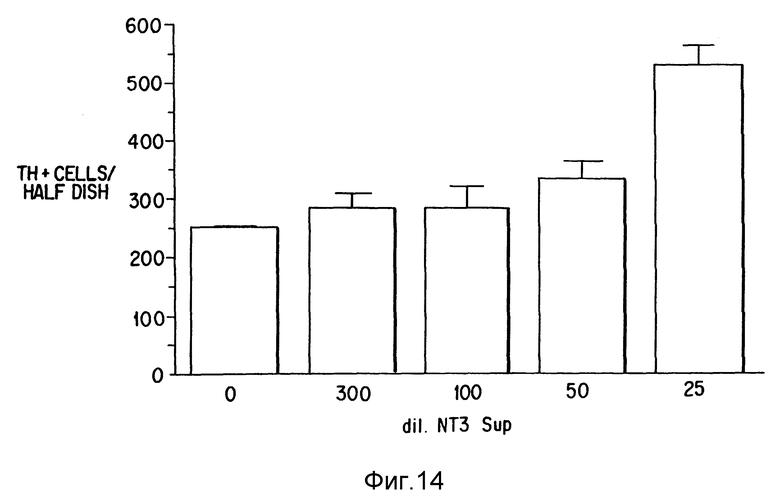
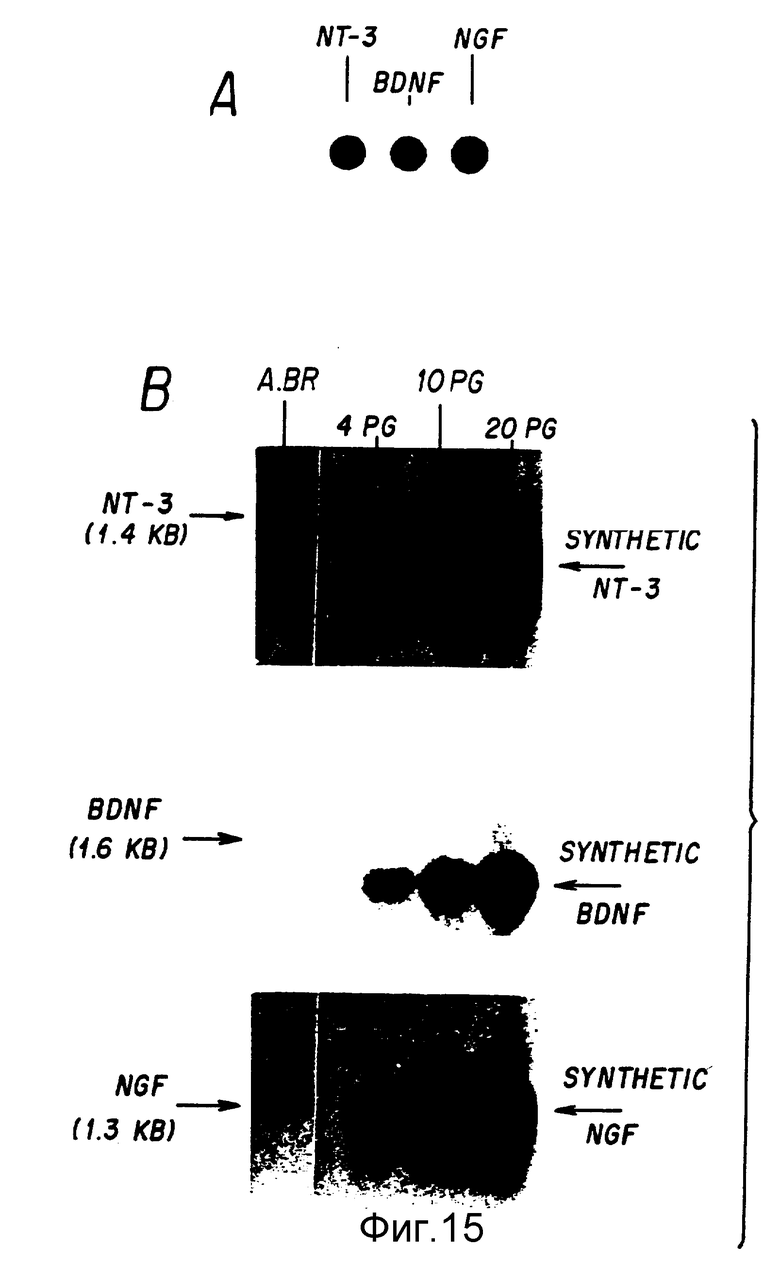
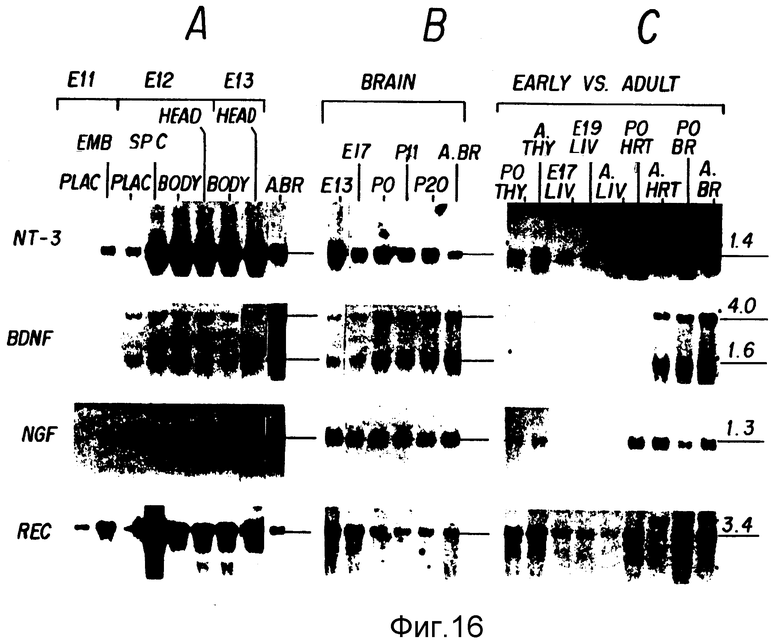
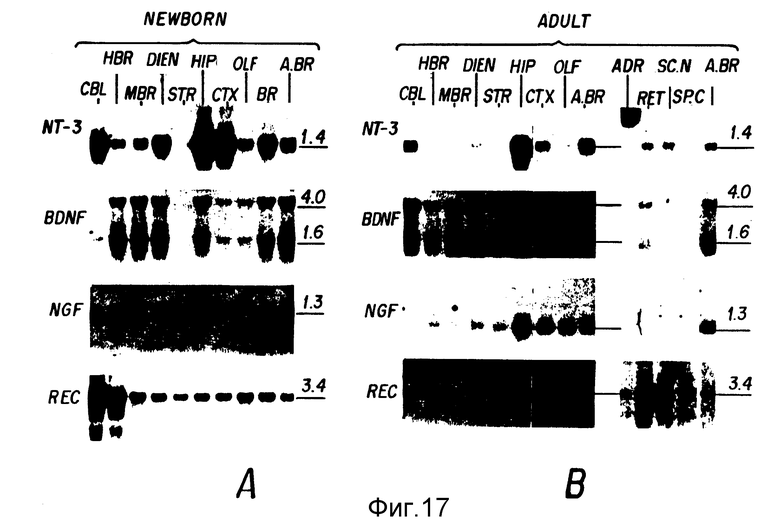
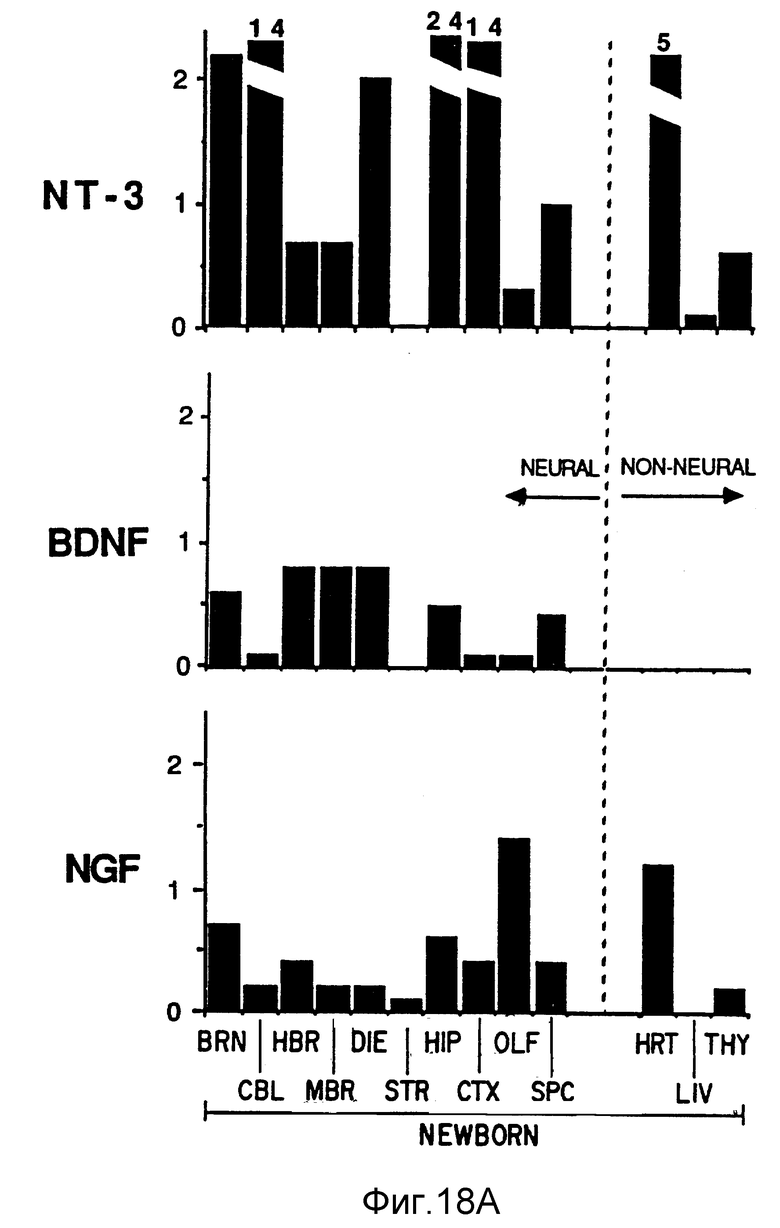
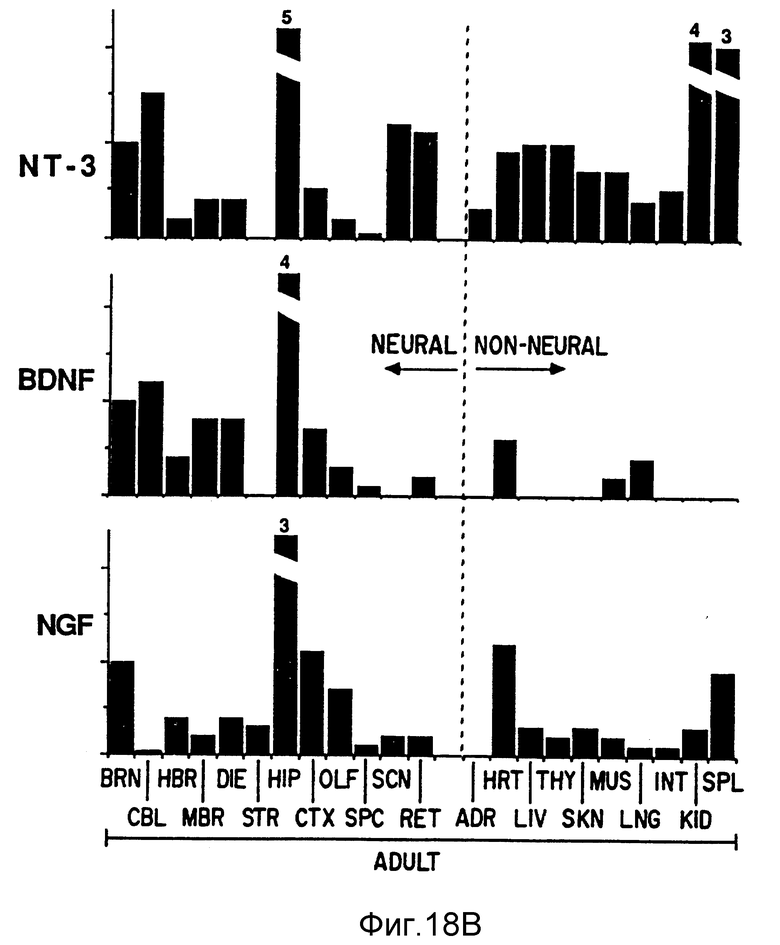
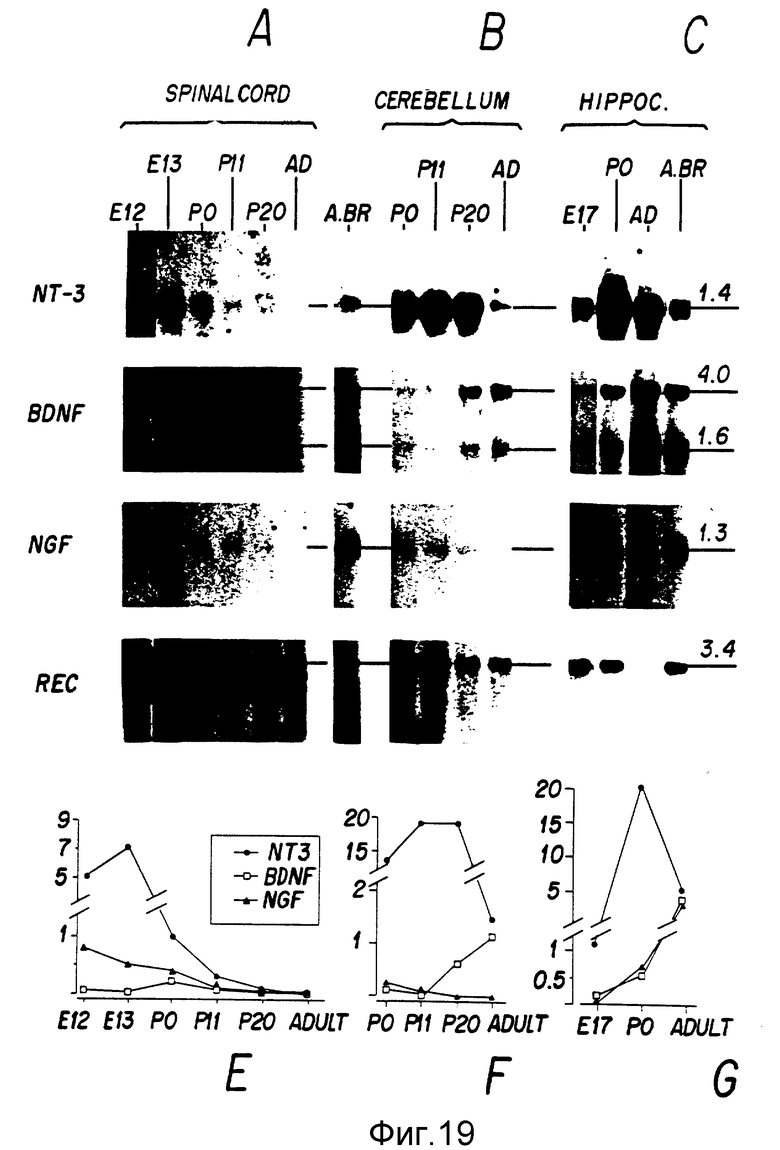
Изобретение относится к биотехнологии, генной инженерии. Получен белок нейтропин-3 (NT-3) человека культивированием клеток млекопитающих, трансформированных вектором экспрессии, содержащим выделенный фрагмент ДНК, кодирующий указанный белок. Выделенный фрагмент ДНК включает нуклеотидную последовательность, которая кодирует предшественник нейтропина-3 человека, состоящий из аминокислотной последовательности, отщепляемой протеазой и следующей за ней аминокислотной последовательности зрелого белка нейротропина-3. Белок NT-3 имеет мол. м. 14 кД, способен инициировать выживание, рост или дифференциацию нейтронов, прорастание нейритов из корешков нодозных и дорзальных ганглиев. Получена фармацевтическая композиция с нейротропной активностью, содержащая терапевтически эффективное количество белка NT-3 в качестве активного ингредиента и фармацевтически приемлемый носитель. Полученный белок NT-3 может быть использован для диагностики и лечения различных неврологических нарушений. 4 с.п. ф-лы, 19 ил., 7 табл.
(i) мол.м. примерно 14 kD, определенную посредством электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE);
(ii) способность промотировать выживание, рост или дифференциацию нейронов;
(iii) способность промотировать прорастание нейритов из корешков нодозных и дорзальных ганглиев.
| Способ получения элементарной серы | 1970 |
|
SU327769A1 |
| Gene, v | |||
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
| Molecular and Cellular Biology, v | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Устройство для преобразования движения поршня двигателя во вращательное движение вала | 1922 |
|
SU452A1 |
Авторы
Даты
1999-03-27—Публикация
1990-08-29—Подача