Перекрестная ссылка на родственные заявки
В данной заявке заявлен приоритет Предварительной заявки США на патент с регистрационным номером 60/119721, поданной 12 февраля 1999 года.
Заявление прав государства на патент
Некоторая часть описанного здесь исследования поддерживалась частично гарантами от Национального Института здоровья (NIH), действующего от имени Соединенных Штатов Америки. Правительство Соединенных Штатов Америки может иметь определенные права в данном изобретении.
Область техники
Данное изобретение относится к способам ингибирования первичных опухолей и метастазов с использованием терапии, основанной на объединенном применении антиангиогенной и направленной противоопухолевой иммунотерапии.
Предпосылки изобретения
Генерирование новых кровеносных сосудов, или ангиогенез, играет ключевую роль в росте злокачественного заболевания, и разработка агентов, которые ингибируют ангиогенез, вызывает большой интерес (см., например, Holmgren, L., O'Reilly, M.S. & Folkman, J. (1995) "Dormancy of micrometastases: balanced proliferation and apoptosis in the presence of angiogenesis suppression". Nature Medicine, 1, 149-153; Folkman, J. (1995) "Angiogenesis in cancer, vascular, rheumatoid and other disease". Nature Medicine, 1, 27-31; O'Reilly, M.S., et al., (1994) "Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastases by Lewis lung carcinoma", Cell, 79, 315-328; Kerbel, R.S. (1997) "A cancer therapy resistant to resistance", Nature, 390, 335-336; Boehm, Т., et al., (1997) "Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance". Nature, 390, 404-7; и Volpert, O.V., et al., (1998) "A human fibro-sarcoma inhibits systemic angiogenesis and the growth of experimental metastases via thrombospondin-1", Proc.Natl. Acad. Sci. (U.S.A.), 95, 6343-6348).
Известно применение антагонистов интегрина α vβ 3 для ингибирования ангиогенеза в способах ингибирования роста твердых опухолей путем уменьшения кровоснабжения твердой опухоли. См., например, патент США №5753230 (Brooks & Cheresh) и патент США №5766591 (Brooks & Cheresh), которые описывают применение α vβ 3-антагонистов, таких как синтетические полипептиды, моноклональные антитела и миметики α vβ 3, которые связываются с рецептором α vβ 3 и ингибируют ангиогенез.
Кроме того, были описаны терапии с использованием слитого белка антитело-цитокин, которые стимулировали опосредованное иммунной реакцией ингибирование установленных опухолей, таких как метастазы карциномы. Например, цитокин интерлейкин 2 (IL-2) был слит с тяжелой цепью моноклонального антитела, иммунореактивного, в двух отдельных слитых белках, с ассоциированными с опухолью антигенами, адгезивной молекулой эпителиальных клеток (Ер-САМ, KSA, KSl/4-антигеном) или дисиалоганглиозидом GD2, с использованием антител KS1/4 и ch14.18, соответственно, с образованием слитых белков chl4.18-IL-2 и KS1/4-IL-2, соответственно. См., например, патент США №5650150 (Gillies).
Идентификация специфических для сосудистой сети ингибиторов ангиогенеза, которые являются синергическими с терапиями, специфически направленными на компартмент опухоли, позволит разработать оптимально эффективное лечение рака.
Ангиогенез характеризуется инвазией, миграцией и пролиферацией эндотелиальных клеток - процессом, который зависит от клеточных взаимодействий с компонентами внеклеточного матрикса. В этом контексте было показано, что эндотелиальный адгезивный рецептор интегрина α vβ 3 играет ключевую роль, обеспечивая специфическую для сосудистой сети мишень для стратегий антиангиогенного лечения (Brooks, P.С., Clark, R.A. & Cheresh, D.A. (1994) "Requirement of vascular integrine alpha v beta 3 for angiogenesis". Science, 264, 569-571; Friedlander, M., et al., (1995) "Definition of two angiogenic pathways by distinct alpha v integrins". Science, 270, 1500-1502). Необходимость в васкулярном интегрине α vβ 3 в ангиогенезе была продемонстрирована на нескольких моделях in vivo, где генерирование новых кровеносных сосудов трансплантированными опухолями человека полностью ингибировалось системным введением либо пептидных антагонистов интегрина α vβ 3, либо анти-α vβ 3-антитела LM609 (Brooks, P.С., et al., (1994) Science, supra; Brooks, P.C., et al., (1994) "Integrin alpha v beta 3 antagonists promote tumor regression by inducing apoptosis of angiogenic blood vessels". Cell, 79, 1157-1164). Мышиная гибридома LM609 была депонирована в Американской Коллекции Типовых Культур (АТСС, Rockville, MD, USA) как Международном хранилище, согласно Будапештскому договору, и ей было присвоено название АТСС НВ 9537 15 сентября 1987 года. Такие антагонисты блокируют лигирование интегрина α vβ 3, что стимулирует апоптоз пролиферативных ангиогенных васкулярных клеток и тем самым нарушает созревание вновь образующихся кровеносных сосудов - событие, существенное для пролиферации опухолей.
Васкулярный эндотелиальный фактор роста (VEGF) был идентифицирован в качестве селективного ангиогенного фактора роста, который может стимулировать митогенез эндотелиальных клеток. Биопсии опухолей человека проявляют повышенную экспрессию мРНК VEGF злокачественными клетками и мРНК рецептора VEGF в соседних эндотелиальных клетках. Экспрессия VEGF, по-видимому, является наивысшей в участках опухолей, смежных с неваскулярными зонами некроза (см. обзор Thomas et al., (1996) "Vascular Endothelial Growth Factor, a Potent and Selective Angiogenic Agent", J.Biol.Chem., 271(2): 603-606). Эффективная противоопухолевая терапия может использовать направленные на рецептор VEGF моноклональные антитела для ингибирования ангиогенеза. (Witte L. et al., (1998) "Monoclonal antibodies targeting the VEGF receptor-2 (Flk1/KDR) as an antiangiogenic therapeutic strategy", Cancer Metastasis Rev., 17(2): 155-161.
Основное препятствие для эффективного лечения диссеминированных злокачественных поражений включает в себя минимальное остаточное заболевание, характеризующееся микрометастазами, которые не имеют хорошо развившегося кровоснабжения для доставки терапевтических веществ. В этой связи новая иммунотерапевтическая стратегия с использованием специфических в отношении опухолевого компартмента моноклональных антител оказалась эффективной для направления цитокинов в микроокружение опухоли. Это достигалось использованием рекомбинантных слитых белков антитело-цитокин, генерируемых для сохранения уникальной способности опухолеспецифического нацеливания моноклональных антител и иммуномодуляторных функций цитокинов. Применение слитого белка антитело-IL-2 для направления IL-2 в опухолевый компартмент индуцировало активацию эффекторных клеток, проникающих в микроокружение опухоли, и приводило к эффективному уничтожению зарегистрированных микрометастазов в трех различных моделях опухолей сингенных мышей (Becker, J.C., et al., (1996) "Т cell-mediated eradication of murine metastatic melanoma induced by targeted interleukin 2 therapy", J.Exp.Med., 183, 2361-2366; Xiang, R., et al., (1997) "Elimination of established murine colon carcinoma metastases by antibody-interleukin 2 fusion protein therapy", Cancer Res., 57, 4948-4955; Lode, H.N., et al., (1998) "Natural killer cell-mediated eradication of neuroblastoma metastases to bone marrow by targeted interleukin-2 therapy", Blood, 91, 1706-1715). Будучи вполне эффективным на ранних стадиях метастазирования опухоли, этот направленный на опухолевый компартмент подход мог задерживать рост метастазов только на более поздних стадиях роста опухоли, характеризующихся полностью развитым васкулярным компартментом. Здесь авторы задались вопросом, есть ли комплементарное преимущество в специфической васкулярной и направленной на компартмент опухоли стратегий лечения и являются ли они синергичными при использовании в последовательной или одновременной комбинациях.
Это было исследовано на трех моделях опухолей сингенных мышей рака ободочной кишки, меланомы и нейробластомы, причем последняя характеризовалась спонтанными метастазами в печени. Все три модели проявляют близкое сходство с этими заболеваниями у человека. Модели метаномы и нейробластомы экспрессируют дисиалоганглиозид GD2, который, как установлено, является ассоциированным с опухолью антигеном при таких нейроэктодермальных злокачественных поражениях (Irie, R.F., Matsuki, Т. & Morton, D.L. (1989) "Human monoclonal antibody to ganglioside GM2 for melanoma treatment". Lancet, 1, 786-787; Handgretinger, R., et al., (1995) "A phase I study of human/mouse chimeric antiganglioside GD2 antibody chl4.18 in patients with neuroblastoma", Eur.J.Cancer, 31A, 261-267), а модель рака ободочной кишки характеризуется экспрессией адгезивной молекулы эпителиальных клеток (Ер-САМ, KSA, KSl/4-антигена), молекулы-мишени, успешно используемой для пассивной иммунотерапии у людей (Riethmuller G., et al., (1994) "Randomised trial of monoclonal antidody for adjuvant therapy of resected Duke's С colorectal carcinoma". Lancet, 343, 1177-1183). Эти антигены специфически очерчивают компартмент опухоли на данных моделях при нацеливании на них слитых белков антитело-интерлейкин-2 с химерным человек/мышь анти-GD2-антителом (ch14.18-IL-2) (Gillies, S.D., et al., (1992) "Antibody-targeted interleukin 2 stimulates T-cell killing of autologous tumor cells", Proc. Natl. Acad. Sci.(U.S.A.), 892, 1428-1432) и гуманизированным анти-Ер-САМ (анти-KSA, анти-KS1/4-антиген) антителом KS1/4-I1-2 (Xiang, R., et al., (1997) supra; Gillies, S., et al., (1998) "Antibody-IL-12 fusion proteins are effective in SCID mouse models of prostate and colon carcinoma metastases", J.Immunol., 160, 6195-6203). Васкулярный компартмент этих моделей опухолей, как описано для нескольких моделей животных, определяется экспрессией интегрина α vβ 3 на вновь образуемых кровеносных сосудах (Brooks, P.С., et al., (1994) supra). Данные, представленные здесь, демонстрируют синергическую эффективность одновременного и последовательного лечений, специфически направленных на опухолевый и васкулярный компартменты первичных опухолей и отдаленных метастазов. Механизм этого синергизма обеспечивается уменьшением образования кровеносных сосудов и увеличением воспаления только у животных, подвергнутых этой комбинированной терапии. Эти наблюдения придают особое значение полезному эффекту комбинирования антиангиогенного подхода с опухолеспецифическим противоопухолевым иммунотерапевтическим подходом.
Сущность изобретения
Данное изобретение относится к способу обработки опухолевой клетки у пациента, нуждающегося в таком лечении, предусматривающему введение указанному пациенту ингибирующего пролиферацию опухолевых клеток количества ингибирующего ангиогенез агента и противоопухолевого иммунотерапевтического агента. Ингибирование пролиферации опухолевых клеток может включать в себя ингибирование роста опухолевых клеток в существующей опухоли или метастазах опухоли, ингибирование образования дополнительных опухолевых метастазов и даже смерть опухолевых клеток. Ингибирующий ангиогенез агент и противоопухолевый иммунотерапевтический агент могут вводиться по существу одновременно или также последовательно.
В одном варианте данное изобретение описывает способ лечения опухоли или опухолевых метастазов у пациента введением пациенту комбинации по меньшей мере одного ингибирующего ангиогенез агента и по меньшей мере одного противоопухолевого иммунотерапевтического агента. Эффективное ингибирование пролиферации опухолевых клеток у указанного пациента может быть достигнуто таким образом.
Пациент может получать вышеуказанные терапевтические композиции до, во время или после хирургического вмешательства по удалению всей опухоли или части опухоли. Введение может выполняться посредством прямой иммерсии; системной или локализованной внутривенной (i.v.), внутрибрюшинной (i.p.), подкожной (s.с.), внутримышечной (i.m.) инъекции или прямой инъекции в массу опухоли; и/или пероральным введением подходящих композиций.
Ингибирующий ангиогенез агент, пригодный для применения в способах данного изобретения, является агентом, который может ингибировать образование новых кровеносных сосудов (реваскуляризацию) или увеличение существующих капиллярных сетей в ткани вблизи опухолевой клетки. Подходящими ингибирующими ангиогенез агентами могут быть пептиды с ингибирующей ангиогенез активностью, такие как ассоциированный с опухолью антиген PSA. Другими подходящими ингибирующими ангиогенез агентами могут быть антагонисты VEGF-ассоциированного ангиогенеза, например, антагонисты рецептора VEGF на поверхности клеток. Предпочтительным ингибирующим ангиогенез агентом является антагонист связывания интегрина α vβ 3 с клетками. Антагонистом α vβ 3 для применения в способах данного изобретения является антагонист, который может ингибировать ангиогенез в ассоциированной с опухолью или с опухолевыми метастазами ткани при введении в ткани или клетки-мишени. Такие антагонисты могут быть уникальными линейными или циклическими полипептидами, линейными или цикло-RGD-содержащими полипептидами, антителами или меметиками α vβ 3 которые связываются с рецептором α vβ 3 и ингибируют ангиогенез.
Если антагонист α vβ 3 представляет собой антитело, предполагается, что это антитело может быть поликлональным, моноклональным антителом или их антигенсвязывающим фрагментом, имеющим антигенсвязывающую специфичность в отношении α vβ 3 или рецептора α vβ 3. Предпочтительным моноклональным антителом, которое связывается с интегрином α vβ 3, является моноклональное антитело, идентифицированное как LM609 (АТСС НВ 9537).
Предпочтительным ингибирующим ангиогенез агентом является полипептид, который является антагонистом рецептора α vβ 3, который может ингибировать рецептор интегрина на клетках-мишенях. Наиболее предпочтительным вариантом антагониста α vβ 3 является синтетический RGD-содержащий пептид цикло(RGDfN-MeV) (SEQ ID NO:11) и т.п. Циклические пептиды этого общего типа описаны в патенте США №5262520 (Plow et al.). He содержащие RGD пептиды описаны в патенте США №5780426 (Palladino et al.).
Противоопухолевый иммунотерапевтический агент, пригодный для применения в способах данного изобретения, представляет собой иммунотерапевтический агент, который содержит клеточный эффекторный компонент, соединенный с компонентом, направленным на ассоциированный с опухолью антиген. Подходящие клеточные эффекторные компоненты могут включать в себя цитотоксичные химикалии, цитотоксические радиоактивные изотопы и агенты передачи клеточных сигналов, такие как цитокины.
Подходящими нацеленными на опухоль компонентами являются полипептидные цепи, которые связываются с ассоциированными с опухолью антигенами, присутствующими на опухолевой клетке или в окружающем ее тканевом матриксе, такие как цепи белков-рецепторов или цепи иммуноглобулинов.
Ассоциированные с опухолью антигены, которые могут быть использованы в качестве мишеней иммунотерапевтических агентов, включают в себя ассоциированный с опухолью антиген, выбранный из группы, состоящей из AFP, СА 125, СЕА, CD19, CD20, CD44, CD45, EGF-рецептора, GD2, GD3, GM1, GM2, Her-2/Neu, Ep-CAM (KSA), IL-2-рецептора, Lewis-Y, Lewis-X (CD 15), ассоциированного с меланомой протеогликана MCSP, PSA и рецептора трансферрина.
Предпочтительный иммунотерапевтический агент имеет эффекторный компонент, который представляет собой полипептид цитокина, соединенный с направляющим компонентом, который представляет собой полипептидную цепь иммуноглобулина (Ig). Полипептидная цепь Ig содержит вариабельную область, которая связывается с ассоциированным с опухолью антигеном. Предпочтительно, чтобы указанная цепь иммуноглобулина при объединении с подходящей комплементарной цепью (т.е. тяжелая цепь комплементарна легкой цепи) определяла активный сайт антитела, специфичный в отношении ассоциированного с опухолью антигена.
Направленная на опухоль часть Ig иммунотерапевтического агента может содержать всю аминокислотную последовательность цепи иммуноглобулина или по меньшей для мере ее фрагмент, содержащий часть данного белка, специфичную в отношении связывания антигена. Таким образом, подходящая цепь полипептида Ig будет иметь по меньшей мере вариабельную область Ig, специфичную в отношении ассоциированного с опухолью антигена.
Антитело и полипептидные цепи из него, пригодные для применения в способах данного изобретения, будут иметь аминокислотную последовательность, которая может происходить от любого млекопитающего. В случае, когда такой белок антитела происходит от млекопитающего, иного, чем предполагаемый пациент, могут быть использованы белковые фрагменты данного антитела, такие как F(ab')2, Fab, Fv или сконструированный, содержащий единственную цепь Fv, белок антитела. Чтобы дополнительно уменьшить антигенность данного белка антитела, можно модифицировать аминокислотную последовательность данного антитела, чтобы сделать данный белок более сходным с нормальными компонентами антител пациента. Например, аминокислотные последовательности моноклонального мышиного антитела могут быть модифицированы различными способами для гуманизирования данного антитела, чтобы сделать его более сходным с антителами человека для введения пациентам.
Альтернативно, антитело может быть человеческого происхождения (генетически кодируемое генами Ig человека), но продуцироваться в трансгенном животном, трансформированном для экспрессии генов Ig человека вместо его собственных нативных генов Ig. Например, могут быть получены генной инженерией (сконструированы) трансгенные мыши, которые экспрессируют ДНК человеческого происхождения, кодирующую белки Ig человека. Получение моноклонального антитела из таких трансгенных мышей приведет к мышиным В-клеточным гибридомам, экспрессирующим ДНК человека, кодирующую антитела, имеющие аминокислотные последовательности человеческого происхождения. Это значительно уменьшит иммуногенность таких антител для использования в лечении человека.
Для лечения человека предпочтительными антителами для использования в способе заявленного изобретения являются гуманизированное моноклональное антитело chl4.18 против ассоциированного с опухолью антигена GD2 и моноклональное антитело KS1/4 против ассоциированного с опухолью антигена KS1/4 (также известного как Ер-СДМ и KSA).
Компонент клетки-эффектора иммунотерапевтического агента, пригодный для применения в способах, композициях и наборах данного изобретения, является цитокином, выбранным из группы, состоящей из BDNF, CNTF, EGF, Epo, FGF, Flt3L, G-CSF, GM-CSF, I-309/TCA-3, gamma-IP-10, IFN alpha, IFN beta, IFN gamma, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, LIF, LT, MCP-1 - МСР-3, M-CSF, MIF, MIP-lalpha, MIP-1beta, MIP-2, NGF, NT-3, NT-4, OSM, PBP, PBSF, PGFD, PF-4, RANTES, SCF, TGF alpha, TGF beta, TNF alpha, Тро и VEGF. Подходящий цитокин, который является хемокином, может быть выбран из группы, состоящей из С10, EMF-1, ENA-78, эотаксина, GCP-2, НСС-1, 1-309, IL-8, IP-10, лимфотактина, MCP-1, МСР-2, МСР-3, MGSA, MIG, MIP-lalpha, MIP-lbeta, MIP-2, NAP-2, PF4, RANTES, SCM-1 и SDF-1. Цитокиновая часть вышеуказанного иммунотерапевтического агента может быть полной аминокислотной последовательностью цитокинового белка или фрагментом такого слитого белка, достаточным для индукции цитокин-специфичесого биологического ответа.
В предпочтительном варианте цитокиновая часть иммунотерапевтического агента имеет биологическую активность IL-2.
В иммунотерапевтическом агенте, содержащем цитокиновый полипептид, соединенный с полипептидом Ig, подходящее сочленение между полипептидной цепью цитокина и полипептидной цепью Ig включает в себя прямую полипептидную связь, сочленение, имеющее полипептидный линкер между указанными двумя цепями, или другую химическую связь между цепями, включающую в себя использование биотинилирования и комплекса авидин-биотин. Предпочтительным сочленением является либо прямая, либо отделенная полипептидным линкером полипептидная связь. Прямая связь делает возможной экспрессию иммунотерапевтического агента в виде единого слитого белка из клетки-хозяина, трансформированной подходящим экспрессирующим вектором, кодирующим иммунотерапевтический агент в виде слитого белка.
Таким образом, предпочтительным иммунотерапевтическим агентом для применения в способах данного изобретения является бифункциональный слитый белок, имеющий цитокиновый компонент и направляющий на ассоциированный с опухолью антиген компонент, где направляющим компонентом является полипептидная цепь Ig, которая имеет специфичность в отношении ассоциированного с опухолью антигена. Примеры таких предпочтительных иммунотерапевтических агентов включают в себя направленный на GD2 слитый белок chl4.18-IL2 и направленный на ассоциированный с опухолью антиген KS1/4 (также известный как Ер-САМ и KSA) слитый белок KS1/4-IL2.
Альтернативно, другие иммунотерапевтические агенты, пригодные для применения в способах, композициях и наборах данного изобретения, могут иметь клеточный эффекторный компонент, который является цитотоксическим агентом. Подходящим цитотоксическим агентом является агент, который оказывает прямое цитотоксическое действие на опухолевую клетку, т.е. иммунотоксины, радиоактивные изотопы, цитотоксичные лекарственные средства и т.п. Подобно цитокиновым иммунотерапевтическим агентам, описанным выше, цитотоксические пептиды могут быть соединены с направляющим на ассоциированный с опухолью антиген полипептидом Ig для образования слитого белка либо непосредственно, либо через линкерный пептид или цепь. Может быть использована химическая связь химических цитотоксинов с направляющими цепями Ig. Могут быть также сконструированы несущие радиоактивный изотоп цепи антител.
Другой аспект данного изобретения относится к терапевтической композиции, содержащей ингибирующий ангиогенез агент и противоопухолевый иммунотерапевтический агент. Предпочтительно, противоопухолевый иммунотерапевтический агент направлен на опухолевые клетки или клетки опухолевых метастазов, благодаря наличию компонента, специфичного в отношении ассоциированного с опухолью антигена, сочлененного с клеточным эффекторным компонентом. В предпочтительной терапевтической композиции данного изобретения противоопухолевый иммунотерапевтический агент является бифункциональным белком, имеющим эффекторный компонент, который является полипептидом цитокина, соединенным с направленным на опухоль компонентом, который является полипептидной цепью иммуноглобулина (Ig), где указанная Ig-цепь содержит вариабельную область, которая связывается с ассоциированным с опухолью антигеном.
Еще одним аспектом данного изобретения является набор для лечения опухоли или опухолевых метастазов. Данный набор включает в себя упаковку, содержащую ингибирующий ангиогенез агент, такой как антагонист α vβ 3, способный ингибировать ангиогенез в указанной опухоли или в указанных опухолевых метастазах; бифункциональный белковый компонент, имеющий цитокиновую активность и специфичность в отношении опухолевого антигена; и инструкции для лечения опухолевых клеток в опухолях и опухолевых метастазах. Данный набор может также включать в себя специальную этикетку, указывающую на применение компонентов данного набора для лечения опухолей или опухолевых метастазов.
Краткое описание чертежей
Предпочтительные варианты данного изобретения описаны ниже со ссылкой на следующие сопутствующие чертежеи.
На фигуре 1 представлено графическое изображение действия объединенной терапии антиангиогенным антагонистом интегрина α v и специфически направленной против опухолевого компартмента иммунотерапии со слитыми белками антитело-IL-2 на первичных опухолях. На фигуре 1А изображены результаты, полученные на первичных опухолях, индуцированных подкожной инъекцией (2× 106) нейробластомы NXS2. На фигуре 1В изображены результаты, полученные на первичных опухолях, индуцированных подкожной инъекцией (2× 106) карциномы ободочной кишки СТ26-KSA. На фигуре 1С изображены результаты, полученные на первичных опухолях, индуцированных подкожной инъекцией (2× 106) клеток меланомы B78-D 14.
На фигуре 2 изображено в виде диаграмм действие объединенной антиваскулярной и противоопухолевой терапий на васкуляризацию и противоопухолевую иммунную реакцию. На фигуре 2А изображена плотность кровеносных сосудов первичных опухолей после обработки васкулярного и опухолевого компартмента либо антагонистом интегрина α v, либо слитым белком chl4.18-IL-2, либо их комбинацией (*Р<0,001, Т-критерий Стьюдента). На фигуре 2В показана степень инфильтрации лейкоцитами первичных опухолей после обработки васкулярного и опухолевого компартментов, соответственно (*Р<0,001, Т-критерий Стьюдента).
На фигуре 3 изображено в виде диаграмм действие последовательной комбинации антиангиогенного антагониста интегрина α v и специфичной в отношении опухолевого компартмента иммунотерапии со слитым белоком антитело-IL-2 на спонтанных метастазах нейробластомы в печени. Число спонтанных метастазов в печени определяли макроскопическим подсчетом очагов в печени (n=8) (**Р<0,01, критерий суммы рангов Уилкоксона).
На фигуре 4 изображено в виде диаграмм действие по существу одновременной комбинации антиангиогенного антагониста интегрина α v и специфичной в отношении опухолевого компартмента иммунотерапии со слитым белком антитело-IL-2 на спонтанных метастазах нейробластомы в печени. Показаны результаты обработки интегрином или антагонистом (17,5 мкг/ч) и опухолеспецифичным слитым белком chl4.18-IL-2 (5 мкг× 5), инициированной до (фигура 4А) или после (фигура 4В) удаления первичной опухоли. Спонтанные метастазы в печени определяли макроскопическим подсчетом очагов в печени (n=8) (**Р<0,01, критерий суммы рангов Уилкоксона).
Подробное описание изобретения
Супрессия и ликвидация первичных опухолей и отдаленных метастазов является основной задачей альтернативных стратегий лечения рака, таких как ингибирование ангиогенеза и направленная иммунотерапия.
В настоящее время было обнаружено, что существует неожиданный синергизм в эффективности при обработке опухолевых клеток в опухоли и опухолевых метастазах комбинированным применением двух терапевтических способов воздействия, называемых здесь (1) (антиангиогенной) терапией ингибирования ангиогенеза и (2) противоопухолевой иммунотерапией. В частности, описана объединенная терапия антагонистом α v и противоопухолевая терапия слитым белком антитело против опухолевого антигена/цитокин.
Было обнаружено, что имеет место синергизм между двумя уникальными монотерапиями, направленными против васкулярного и опухолевого компартментов; соответственно, специфического против опухолевой сосудистой сети антиангиогенного антагониста α v и слитых белков опухолеспецифическое антитело-интерлейкин-2.
Одновременная и последовательная комбинация этих монотерапий эффективно ликвидировала спонтанные метастазы в печени в слабоиммуногенной сингенной модели нейробластомы. В противоположность этому, контроли, подвергнутые монотерапии либо антиангиогенным антагонистом интегрина α v, либо слитыми белками антитело-IL-2, были только частично эффективными при применяемых уровнях доз.
Кроме того, одновременная обработка антагонистом интегрина α v и слитыми белками опухолеспецифическое антитело-IL-2 индуцировали драматический регресс (обратное развитие) в трех моделях опухолей сингенных мышей, т.е. меланоме, карциноме ободочной кишки и нейробластоме. Однако каждый агент, используемый отдельно в качестве монотерапии, индуцировал лишь задержку роста опухолей.
Противоопухолевая реакция сопровождалась одновременным 50%-ным уменьшением плотности опухолевых кровеносных сосудов и пятикратным увеличением воспалительных клеток в микроокружении опухолей. Впоследствии некроз опухолей был продемонстрирован только у животных, получающих комбинированную терапию, но не в том случае, когда каждый агент применяли в виде монотерапии. Эти результаты показывают, что эти синергические способы лечения обеспечивают новый и эффективный инструмент для будущей терапии метастазирующего рака.
В данном изобретении описаны способы лечения опухолей и опухолевых метастазов, терапевтические композиции и терапевтические наборы (упакованные системы), применимые на практике для описанных здесь синергических терапевтических воздействий.
1. Терапевтические композиции
Описаны разнообразные терапевтические композиции для применения на практике способов данного изобретения. Данные композиции включают в себя (антиангиогенные) ингибирующие ангиогенез реагенты, такие как антагонисты α vβ 3, и противоопухолевые агенты, такие как слитые белки антитело против опухолевого антигена/цитокин, отдельно или в различных комбинациях.
А. Ингибитор ангиогенеза
Ингибиторы ангиогенеза, которые ингибируют ангиогенез в обработанных ими тканях, могут быть использованы в композициях и способах данного изобретения. Предпочтительным ингибитором ангиогенеза является антагонист α v и, в частности, антагонист α vβ 3. Ингибирующий ангиогенез (антиангиогенный) антагонист α vβ 3 может быть пептидом, RGD-содержащим пептидом, анти-α vβ 3-антителом, анти-α vβ 3-рецептор-антителом или α vβ 3-миметиком. Примеры антагонистов α vβ 3 описаны в патенте США №5753230 (Brooks & Cheresh) и патенте США №5766591 (Brooks & Cheresh), описания которых, касающиеся получения и применения антагониста α vβ 3, специально включены здесь в качестве ссылки.
Предпочтительными антагонистами являются RGD-содержащие пептиды, такие как циклический пептид цикло(RGDfN-MeV) (SEQ ID NO:11). Дополнительные антагонисты были описаны в литературе, в том числе органические миметики и не содержащие RGD циклические пептиды, которые функционируют как антагонисты α vβ 3. См., например. Brooks et al. International Publication No. WO 97/45137, (PCT/US97/09158).
Тесты для идентификации антагониста α vβ 3, пригодного для применения в качестве антагониста, описаны в цитированных патентах США, и, следовательно, предполагается, что альтернативные антагонисты могут быть легко идентифицированы для применения на практике данного изобретения.
Подходящее моноклональное анти-α vβ 3-антитело может быть модифицировано для включения его антигенсвязывающих фрагментов, в том числе F(ab')2, Fab и сконструированных Fv или одноцепочечного антитела (SCA). Способы получения таких фрагментов известны в данной области (см., например, Hermanson, G.T., Bioconjugate Techniques/ Academic Press, 1996). Способы данного изобретения, описывающие применение антител, также включают в себя подходящую модификацию целого антитела до его антигенсвязывающих фрагментов. Одно подходящее моноклональное антитело идентифицировано как LM609 (АТСС НВ 9537).
Было показано, что другие антагонисты α vβ 3 являются эффективными в ингибировании ангиогенеза и могут быть пригодными для применения в способах данного изобретения. Например, химические антагонисты рецептора, такие как (S)-10,11-дигидро-3-[3-(пиридин-2-иламино)-1-пропилокси]-5Н-дибензо[а,d]циклогептен-10-уксусная кислота (известная как SB-265123), испытывали в различных модельных системах млекопитающих (см., например, Keenan RM et al., (1998) Bioorg.Med.Chem.Lett., 8(22): 3171-3176; Ward KW et al., (1999) Drug Metab.Dispos., 27(11): 1232-1241).
Васкулярный эндотелиальный фактор роста (VEGF) был идентифицирован в качестве селективного ангиогенного фактора роста. Таким образом, альтернативный или дополнительный ингибирующий ангиогенез агент может быть ингибитором активности VEGF, достаточным для ингибирования ангиогенного роста. Такой ингибитор мог бы быть конкурентным ингибитором или VEGF-связывающей/инактивирующей молекулой, или антагонистом рецептора VEGF. Например, возможными ингибиторами могли бы быть неангиогенный химический миметик VEGF для конкуренции за связывание с комплексом VEGF-мишень/рецептор, модифицированное неангиогенное производное VEGF, антитело, которое специфически связывает VEGF достаточно для ингибирования ангиогенной активности, или, возможно, другой специфический белок, который связывает VEGF (такой как выделенный рецепторный белок VEGF), или антитело, которое связывает рецептор VEGF и блокирует взаимодействие с VEGF.
Другие соединения были идентифицированы на основе способности соединения ингибировать ангиогенез, например, выделенный ассоциированный с опухолью антиген PSA.
В. Противоопухолевый иммунотерапевтический агент
Способы и композиции для применения в таких способах данного изобретения предполагают объединенное введение по меньшей мере одного (антиангиогенного) ингибирующего ангиогенез терапевтического агента по меньшей мере с одним противоопухолевым иммунотерапевтическим агентом. Предпочтительный противоопухолевый иммунотерапевтический агент объединяет направленный на опухоль компонент с компонентом клетки-эффектора, таким как цитокин, иммунотоксин, радиоактивный агент или т.п. Направленный на опухоль компонент предпочтительно содержит по меньшей мере антигенсвязывающую часть антитела, направленного против ассоциированного с опухолью антигена. В одном предпочтительном варианте эффекторный компонент представляет собой цитокин.
а) Ассоциированные с опухолью антигены
Ассоциированный с опухолью антиген является мишенью, при помощи которой иммунотерапевтический агент, применяемый в способах, композициях и наборе данного изобретения, в конечном счете направляется на опухолевую клетку. Ассоциированные с опухолью антигены считаются в данной области коррелирующими с определенными типами рака. В подавляющем большинстве случаев ассоциированные с опухолью антигены являются антигенами поверхности клетки, которые экспрессируются таким образом, какой обычно не обнаруживается в нормальных клетках, ассоциированных с источником раковой опухоли. Другие ассоциированные с опухолью антигены являются секретируемыми молекулами или родственными внеклеточному матриксу компонентами, которые обычно не обнаруживаются в ассоциации со зрелой нормальной тканью.
Некоторые ассоциированные с опухолью антигены являются белками, экспрессируемыми в более ранних стадиях развития ткани, и обычно не ассоциируются со зрелыми тканями (иногда называемыми онкофетальными белками). Другие ассоциированные с опухолью антигены экспрессируются нормальными зрелыми клетками, но экспрессируются в больших количествах раковыми клетками. Ассоциированные с опухолью антигены могут быть мутированными формами нормально экспрессируемых клеточных маркеров или внеклеточными компонентами. Другие ассоциированные с опухолью антигены относятся к измененным или необычным формам гликозилирования белков, липидов или внеклеточных компонентов, или новым углеводным частям молекул.
Таким образом, ассоциированные с опухолью антигены могут широко варьироваться и определяют, по меньшей мере частично, тип опухоли, подлежащей лечению с помощью данного изобретения. Множество типов опухолей и опухолевых антигенов, которые экспрессируются ими, является разнообразным и все же хорошо изученным в областях изучения рака.
Многие дополнительные маркеры опухолей находятся в процессе исследования и после идентификации и характеристики в качестве ассоциированного с опухолью антигена они также являются подходящим антигеном-мишенью для нацеливания иммунотерапевтического агента на желаемый участок опухоли или метастазов.
Сообщалось о направлении векторов генной терапии на раковые клетки с использованием моноклональных антител против антигена Lewis-Y (Kurane S. et al., Jpn.J.Cancer Res., 89(11): 1212-1219 (1998)). Подобным образом, сообщалось о направлении липосом с использованием анти-ганглиозид-GM3-антитела или антитела против антигена Lewis-X (Nam, S.M., et al., Oncol.Res., 11(1): 9-16 (1999).
Как обсуждается ниже, в данной области известны способы использования идентифицированного антигена для генерирования подходящих антител, которые будут связываться специфически с этим антигеном. Таким образом, опухолевые антигены могут быть идентифицированы, и могут быть получены моноклональные антитела, которые применимы в данном изобретении. В отношении обзора получения опухолевых антигенов см. описания в Human Cancer Markers, The Humans Press Inc., eds. Sell and Wahren, 1982. Описание стандартных биохимических и молекулярно-биологических способов, применимых для получения антигенов и/или цитокинов и т.п., можно найти, например, в Sambrook et al., (1989) Molecular Cloning, 2nd ed. (Cold Spring Harbor Press, CSH NY).
Опухолевые поверхностные антигены могут быть специфическими для класса опухолей или для индивидуального типа опухоли. Многие последовательности нуклеиновых кислот и/или аминокислотные последовательности, относящиеся к ассоциированным с опухолью антигенам и кодирующие ассоциированые с опухолью антигены, доступны из публичных компьютерных баз данных, которые можно найти в Интернете с помощью различных служб, т.е. NCBI (Национальный центр информации по биотехнологии; www3.ncbi.nlm.nih.gov), и обычно идентифицируются названием и номером доступа (несколько неограничивающих примеров типов доступной информации о последовательностях цитируются примечанием "см. номер доступа").
Предпочтительные ассоциированные с опухолью антигены-мишени включают в себя, но не ограничиваются ими, AFP (см. номер доступа NH 001125), СА125 (см. номер доступа NP 005890), СЕА (см. номер доступа ААА62835), CD19 (см. номер доступа Р15391), CD20 (см. номер доступа Р11836), CD44 (см. номер доступа Р16070), CD45 (см. номер доступа Р08575), EGF-рецептор (см. номер доступа Р00533), GD2, GD3, GM1, GM2, Her-2/Neu (см. номер доступа ААА58637), Ep-CAM (KSA) (см. номер доступа Р16422, ААА 36151), IL-2-рецептор (см. номер доступа Р14784, NP000197, Р01589), Lewis-Y, Lewis-X (CD 15), ассоциированный с меланомой протеогликан MCSP (см. номер доступа NP001888), PSA (см. номер доступа Р07288), PMSA, рецептор трансферрина (см. номер доступа NP 003218, NP 003225, AAAF04564), маркерный белок карциномы поджелудочной железы GA733-1 (см. номер доступа Р09758), рецептор фолата (см. номер доступа NP 000793), L6 (см. номер доступа Р30408) и СО-029 (см. номер доступа А36056, Р19075).
Особенно предпочтительными ассоциированными с опухолью антигенами-мишенями для нацеливающих иммунотерапевтических агентов являются GD2 и KSA (Ep-CAM; KS1/4-антиген), как описано здесь.
Ассоциированный с опухолью антигенный белок является коммерчески доступным или может быть получен с использованием стандартных способов рекомбинантных ДНК и культуры клеток, способов экспрессии белков, известных в данной области. Например, списки Sigma (St.Louis, МО) для продажи дисиало-ганглиозида GD 2 (G 0776), дисиалоганглиозида GD3 (G 5904), моносиалоганглиозида GM1 (G 7641), моносиалоганглиозида GM2 (G 4651), опухолевого антигена желудочно-кишечного тракта Са 19-9 (G 8660, G 8535), карциноэмбрионального антигена СЕА (С4835), Lewis-X-трисахарида (L 5152) и Lewis-Y (L 7401).
Антитела, специфические для многих из этих ассоциированных с опухолью антигенов, коммерчески доступны (Eq. USB, RDI, Accurate Chemical and Scientific Corp., Zymed Lab). Например, Sigma (St.Louis, МО) продает многие моноклональные антитела, такие как анти-AFP (А 8452), анти-СЕА (С2331), анти-EGF-рецептор (Е 3138), анти-IL-2-растворимый рецептор, (I 5652, I 5777, I 5902), анти-СD19 (F 3899), анти-СD20 (С8080), анти-СD44 (С7923) и анти-СD45 (С7556).
Даже если антитела не являются коммерчески доступными, с использованием известных способов получения моноклональных антител антитела, специфические для ассоциированных с опухолью антигенов, могут быть генерированы с использованием антигена в качестве иммуногена. Например, были описаны вариабельные домены тяжелой и легкой цепей мышиного антитела Lewis-Y (см. номера доступа ААВ25798 и ААВ25799). Подобным образом были описаны вариабельные домены тяжелой и легкой цепей мышиного антитела против асиало-СМ1-ганглиозида (см. номер доступа AAD09194 и AAD09195). Была выяснена кристаллическая структура тяжелой и легкой цепи моноклонального антитела против ганглиозида GD2 (см. номер доступа 2554841, 2554842). Сообщалось об антителах, которые связываются с рецептором фолата (связывающим белком), идентифицированным как маркер рака яичника (см. номер доступа NP 000793). Последовательность нуклеиновой кислоты тяжелой и легкой цепи вариабельной области моноклонального антитела против СА125 также была опубликована и использована для включения в кассетный вектор (см. номер доступа ААВ33454, 33455).
Особенно предпочтительными антителами являются описанные здесь антитела ch14.18 и KS1/4.
b) Моноклональное антитело и его антигенсвязывающие части и т.п.
Со времени появления способов генерирования моноклональных антител, впервые опубликованных Kohler and Milstein, стали хорошо известны усовершенствованные способы в данной области (См., например. Dean, C.J. in "Methods in Molecular Biology", Vol.80: Immunochemical Proticols, 2nd ed. (Pound, J.D. editor, Humana Press, Inc., Totowa NJ, 1998) chapter 4; и Ausubel, F.M. et al. Short Protocols in Molecular Biology, 2nd ed. (Current Protocols, John Wiley & Sons, NY NY, 1992) chapter 11). В настоящее время получение моноклональных антител, которые связываются с конкретным антигеном, является обычной практикой. Протоколы скрининга были также усовершенствованы для отбора, в случае необходимости, высокоаффинных связывающих антител.
Обычно хозяином для получения гибридом являются мыши или другие грызуны.
Одним из барьеров для повторной обработки человека мышиными моноклональными антителами являются НАМА (человеческие антимышиные антитела), генерируемые пациентом в ответ на данную обработку. Способы для преодоления этого барьера включают в себя гуманизацию белков мышиного антитела заменой антигенных аминокислот мышиного белка белковыми последовательностями человека, которые предположительно являются менее антигенными. Другие способы включают в себя пересадку определяющих специфичность связывания аминокислотных остатков или районов в каркасы человеческого белка.
Возможность экспрессировать белок антитела в системах фагового представления позволяет отбирать антитела, которые были подвергнуты мутагенезу либо для улучшения связывания, либо для уменьшения иммуногенности (см., например, Antibody Engineering (McCafferty, J. et al. editors, Oxford University Press, 1996). Недавно введение генов человеческого иммуноглобулина в трансгенную мышь позволило использовать мышей-хозяев для генерирования антител и, следовательно, моноклональных антител, которые происходят от последовательности нуклеиновой кислоты человека.
Антитела могут быть также уменьшены в размере путем фрагментации для получения пониженной антигенности или для создания меньших терапевтических молекул. Например, полный белок антитела может быть уменьшен либо путем расщепления подходящими ферментами, либо путем получения меньшего белка способами рекомбинантных ДНК. Подходящие фрагменты будут включать в себя по меньшей мере антигенсвязывающую часть полной молекулы и могут содержать конструкции Fab, F(ab)2, F(аb)3, Fv или Fv с одной цепью (антитело с одной цепью; SCA).
Представляется, что все компоненты терапевтических агентов на основе моноклонального антитела для применения в способах данного изобретения для лечения человека могут выигрывать от модификации для уменьшения иммуногенности и потенциального KAMA, как описано выше.
Можно также использовать специфический рецепторный белок, который может специфически связываться с конкретным ассоциированным с опухолью антигеном, в виде направляющего компонента иммунотерапевтических агентов, описанных выше. Функционально, специфический рецептор может быть так же применим, как и специфическое антитело, для направления, зависящего от специфичности и аффинности рецептора в отношении ассоциированного с опухолью антигена-мишени. Следует быть осторожным для минимизации влияния перекрестно-реактивного связывания со сходными белками, которые необязательно являются ассоциированными с опухолью белками.
с) Цитокины
В одном варианте противоопухолевые иммунотерапевтические конструкции данного изобретения включают в себя клеточную эффекторную часть, которая предпочтительно является цитокином.
Эффекторный компонент противоопухолевых терапевтических агентов данного изобретения может включать в себя любой из разнообразных цитокинов для индукции цитокин-специфического биологического ответа клеткой, несущей рецептор для данного цитокина. Цитокины хорошо охарактеризованы, и, следовательно, данное изобретение не должно рассматриваться как ограниченное таким образом. Цитокины включают в себя в качестве подкласса молекулы, называемые хемокинами. В контексте данного изобретения хемокин рассматривается как член суперсемейства цитокинов. Таким образом, термин "цитокин" в применении здесь относится, в общем, как к цитокинам, так и к хемокинам. В отношении описания типов цитокинов см. Callard. and Gearing, The Cytokine Facts Bool, Academic Press, Inc., 1994. В отношении описания типов хемокинов см. Vaddi et al. The Chemokine Facts Book, Academic Press, Inc., 1997. Многие последовательности нуклеиновых кислот и/или аминокислотные последовательности, относящиеся к цитокинам, могут быть доступны из публичных баз данных, которые доступны в Интернете посредством различных служб, т.е. NCBI (Национальный центр информации по биотехнологии; www3.ncbi.nlm.nih.gov) и обычно идентифицируются названием и номером доступа (ссылка на несколько неограничивающих примеров доступа к цитируемой здесь информации о последовательностях дана примечанием "см. номер доступа" со ссылкой на идентифицирующий номер).
Цитокины млекопитающих могут быть видоспецифическими и могут также варьироваться внутри вида вследствие мутации и/или аллельной изменчивости. Подходящий цитокин может быть выбран для применения в соответствии с видом млекопитающего, подлежащего лечению. В случае существования множественных аллелей может быть сделан выбор в соответствии с активностью цитокина или может использоваться смесь аллельных вариантов в качестве выбранного цитокина. Таким образом, применение в ветеринарии способов данного изобретения может быть приспособлено к видам подлежащего лечению животного или проведен выбор цитокина из более близкородственных видов, если один из видов-мишеней является недоступным. Для лечения человека предпочтительно использование человеческого гомолога, если он известен.
Цитокины, пригодные для применения в данном изобретении, включают в себя, но не ограничиваются ими, BDNF (см. номер доступа 4502393), CNTF (см. номер доступа 4758020), EGF (см. номер доступа р01133), Еро (см. номер доступа 4503589), FGF (см. номер доступа САВ61690), Flt3L, G-CSF (см. номер доступа САА27290), GM-CSF (см. номер доступа 4503077), I-309/TCA-3, gamma-IP-10 (см. номер доступа Р02778), IFN alpha (см. номер доступа Р01563), IFN beta (см. номер доступа Р01574), IFN gamma (см. номер доступа Р01579), IL-1 - IL-18 (см. номер доступа Р01583, Р01584, Р01585, Р08700, Р05112, Р05113, Р05231, Р13232, Р41324, Р15248, Р22301, Р20809, Р29459, Р46658, Р35225, Р40222, Р40933, Q14005, NP002181, Q14116), LIF (см. номер доступа ААС05174), LT (см. номер доступа 4504031), МСР-1 - МСР-3, M-CSF (см. номер доступа 4503075), MIF (см. номер доступа 4505185), MIP-lalpha, MIP-lbeta, MIP-2, NGF (см.номер доступа 4505391), NT-3 (см. номер доступа Р20783), NT-4 (см. номер доступа Р34130), OSM (см. номер доступа Р13725), РВР (см. номер доступа 4505621), PBSF, PGFD, PF-4, RANTES, SCF (см. номер доступа Р21583), TGF alpha (см. номер доступа Р01135), TGF beta (см. номер доступа Р01137), TNF alpha (см. номер доступа Р01375), Тро (см. номер доступа Р40225) или VEGF (см. номер доступа AAD03710).
Хемокины, пригодные для применения в данном изобретении, включают в себя, но не ограничиваются ими, С10 (см. номер доступа Р33861), EMF-1 (см. номер доступа Р08317), ENA-78 (см. номер доступа А55010), эотаксин (см. номер доступа ВАА845579), GCP-2 (см. номер доступа Р80162), НСС-1 (см. номер доступа g1004267), I-309 (см. номер доступа g4506833), IL-8 (см. номер доступа ААА59158), IP-9 (см. номер доступа САА75510), IP-10 (см. номер доступа 4504701), лимфотактин (см. номер доступа 4506853), МСР-1 (см. номер доступа 4506841), МСР-2 (см. номер доступа Р80075), МСР-3 (см. номер доступа САВ59723Л), МСР-4 (см. номер доступа Q99616), MGSA (см. номер доступа Р09341), MIG (см. номер доступа Р35625), MIP-lalpha (см. номер доступа Р10855), MIP-lbeta (см. номер доступа Р13236), MIP-2, NAP-2 (см. номер доступа Р20775), PF4 (см. номер доступа 4505733), RANTES (см. номер доступа 4506847), SCM-1 (см. номер доступа Р47992) или SDF-1 (см. номер доступа Р48061). Предпочтительные цитокины для применения в данном изобретении включают в себя IL-2 и IL-12 или их биологически активные фрагменты, которые сохраняют по меньшей мере часть эффекторной активности полной интактной молекулы.
Предпочтительным цитокином для применения в данном изобретении является IL-2.
Подходящие цитокины для применения в способах данного изобретения могут быть получены из соответствующей последовательности нуклеиновой кислоты с использованием стандартных молекулярно-биологических способов. Способы экспрессии генов известны в данной области (например, см. Goeddel, D.V. editor, Methods in Enzymology, Vol.185: Gene Expression Technology (Academic Press, Inc., NY NY, 1991)). Цитокины доступны также из коммерческих источников (т.е. Sigma, St.Louis МО).
d) Иммунотерапевтический агент в виде комплекса антитело против опухоли/цитокин
Эти противоопухолевые иммунотерапевтические агенты, пригодные для применения на практике данного изобретения, включают в себя компонент клетки-эффектора, который является предпочтительно цитокином, связанным с направленным на опухоль компонентом. Связывание опухоль-связывающего компонента с эффекторным компонентом может осуществляться различными способами.
1) Слитые с антителами белки
Были описаны иммунотерапевтические противораковые реагенты, которые направляют функцию цитокинов на клетки или ткани, которые несут опухолевые антигены, и с использованием данных цитокинов осуществляют рекрутинг иммунной реакции против клеток, несущих опухолевый антиген или ассоциированных с опухолевым антигеном. Эти иммунотерапевтические агенты называют слитыми белками антитело против опухолевого антигена/цитокин, поскольку данный слитый белок содержит слияние цитокина с полипептидной цепью рекомбинантного иммуноглобулина (Ig), которая иммунно реагирует с предварительно выбранным ассоциированным с опухолью антигеном.
В применении здесь иммунотерапевтический агент, являющийся слитым белком антитело против опухолевого антигена/цитокин, включает в себя слитые конструкции между фрагментами белка антитела, которые содержат по меньшей мере антигенсвязывающую часть, и цитокинами, которые содержат по меньшей мере эффекторную часть цитокина, достаточную для сохранения функции биологической передачи сигнала. Слитые белки данного изобретения могут быть связаны непосредственно или могут быть связаны мостиковой связью при помощи линкерного пептида или пептидов.
Слитые белки антитело против опухолевого антигена/цитокин известны в данной области и, в частности, описаны, например, в патенте США №5650150 (Gillies), описание которого, касающееся получения и применения слитых белков, специально включено сюда в виде ссылки.
Слитый белок может быть направлен на любой из множества опухолевых антигенов, которые являются поверхностными клеточными антигенами, и, следовательно, данное изобретение не должно рассматриваться как ограниченное таким образом. Например, известно получение слитого белка с использованием цитокина и тяжелой цепи Ig, как и получение рекомбинантной тяжелой цепи Ig, происходящей из моноклонального антитела. Кроме того, получение моноклональных антител является разработанной областью, и известно, как получать такие антитела против опухолевых антигенов. Получение моноклональных антител описано в "Monoclonal Antibodies and Cancer Therapy", Alan R. Liss, Inc., eds, Reisfeld and Sell, 1985.
Обычно полипептидная цепь Ig является полипептидом тяжелой или легкой цепи Ig, который содержит N-концевую вариабельную область, специфичную для клетки, несущей опухолевый антиген клеточной поверхности. Слитый белок обычно имеет указанный Ig-полипептид, связанный на карбокси-конце пептидной связью с аминоконцевой аминокислотой цитокина. Если Ig-полипептид является тяжелой цепью, тяжелая цепь Ig обычно содержит дополнительно домены СН1 и СН2 и может необязательно дополнительно содержать домен СНЗ. Однако, если желательно, такие домены константной области могут быть удалены для уменьшения иммуногенности, размера или неспецифического связывания конечной конструкции слитого белка. Для облегчения ассоциации доменов тяжелой и легкой цепи может быть желательным конструирование молекулы Fv, где тяжелая цепь Fv привязана к легкой цепи Fv. Данная связь находится между карбокси-концом одной цепи и амино-концом другой и является достаточно длинной, чтобы не вызывать значительных стерических изменений в антигенсвязывающем "кармане" после повторной укладки/ассоциации доменов.
Предпочтительный слитый белок содержит цитокин IL-2 и тяжелую цепь Ig, которая иммунореагирует с ассоциированным с опухолью антигеном GD2. В другом варианте предпочтительный слитый белок содержит цитокин IL-2 и тяжелую цепь Ig, которая иммунно реагирует с ассоциированным с опухолью антигеном Ер-СAМ (также известным как антиген KSA, KS1/4). Примеры слитых белков этих вариантов описаны ниже как ch14.18-IL-2 и KS1/4-IL-2, соответственно.
2) Конъюгаты антител
Альтернативные иммунотерапевтические конструкции могут быть использованы в способах и композициях данного изобретения. Например, использующие высокоаффинную систему биотин-авидин, независимые биотинилированные белки, содержащие цепь антитела, специфического в отношении ассоциированного с опухолью антигена, связанную с биотином (или авидином), и цитокин, связанный с подходящим конъюгатом (авидином или биотином), могут быть сконструированы с использованием подходящей связи. При использовании белок биотинилированного антитела может быть объединен с белком цитокина in vitro или in vivo до или после введения для создания бифункционального иммунотерапевтического агента, имеющего компонент, связывающий опухолевый антиген и эффекторный цитокиновый компонент, связанные комплексом биотин-авидин.
Биотинилированные антитела и белки известны в данной области и могут быть получены с использованием коммерчески доступных реагентов. Одним из признаков использования биотинилированного направленного на опухолевый антиген антитела является то, что молекула биотина имеет множественные сайты связывания авидина, которые сделают возможным большее потенциирование эффекторного компонента, такого как связанный с авидином цитокин, для каждого связанного антитела или комбинированное использование более чем одного эффекторного компонента. Другие прямые химические способы конъюгирования и реагенты также известны в данной области и применялись для конъюгирования антител с эффекторными молекулами, либо непосредственно, либо с помещенным между ними линкером (См., например, Haugland and You, in Methods in Molecular Biology Vol.80: Immunochemical Protocols, 2nd ed. (Pound, J.D. editor, Humana Press, Inc., Totowa NJ, 1998) chapter 17; и Hermanson, G.T., Bioconjugate Techniques (Academic Press, NY NY, 1996). Таким образом, иммунотерапевтические агенты данного изобретения включают в себя также биотинилированные конструкции, описанные выше, между фрагментами белка антитела, содержащими по меньшей мере антигенсвязывающую часть, и цитокинами, содержащими по меньшей мере эффекторную часть цитокина, достаточную для сохранения биологической функции передачи сигнала этого цитокина.
е) Другие иммунотерапевтические агенты
Противоопухолевые иммунотерапевтические агенты, пригодные для использования в способах, композициях и наборах, воплощающих данное изобретение, могут включать в себя эффекторную часть, которая не является цитокином. Предполагается, что клеточный эффекторный компонент может быть также токсином или иным образом повреждающим опухоль цитотоксическим агентом. Таким образом, другие применимые противоопухолевые терапевтические агенты могут включать в себя конструкции между фрагментами белка антитела, которые содержат по меньшей мере антигенсвязывающую часть, и радиоактивными изотопами, иммунотоксином, цитотоксичным пептидом или цитотоксичными лекарственными средствами.
1) Радиоактивная метка-антитело
Радиоиммуноконъюгаты, содержащие направленное на опухоль моноклональное антитело и радиоактивную изотоп-метку, использовали в качестве противораковых агентов. Антигенсвязывающая специфичность моноклонального антитела обеспечивает возможность направленной локализации в участках опухоли, тогда как радиоактивная метка обеспечивает цитотоксические свойства (см. Hermanson, G.T., Bioconjugate Techniques (Academic Press, NY NY, 1996) chapter 8). Эти радиоиммуноконъюгаты могут быть пригодны для применения в качестве противоопухолевых терапевтических агентов в способах данного изобретения.
2) Иммунотоксин-антителоКонъюгаты моноклональных антител и белковых токсинов, полученных из различных источников, также испытываются для противоопухолевого лечения (См. Hermanson, G.T., Bioconjugate Techniques (Academic Press, NY NY, 1996) Chapter 8). Такие конъюгаты могут быть пригодны для применения в способах данного изобретения.
3) Лекарственный цитотоксин-антитело
Конъюгаты моноклональных антител и лекарственных токсинов, химически синтезированных и/или очищенных из множества источников, могут быть также испытаны для противоопухолевых лечений (См. Hermanson, G.T., Bioconjugate Techniques (Academic Press, NY NY, 1996)). Такие конъюгаты могут быть пригодны для применения в способах данного изобретения.
4) Мультиспецифическое антитело
Манипулирование фрагментами антител, генерируемыми ферментативным расщеплением, или манипулирование кодирующими ДНК-последовательностями позволяет создавать биспецифические антитела (BsAbs), которые являются гибридными молекулами, объединяющими два антитела с различными специфичностями связывания. Таким образом специфическое связывание с опухолью-мишенью может быть скомбинировано со связыванием с клеточным эффекторным фармацевтическим агентом (т.е. цитокином, лекарственным средством или токсином) для локализации обработки опухолевых клеток (См., например, French, R.R., in Methods in Molecular Biology Vol. 80: Immunochemical Protocols, 2nd ed. (Pound, J.D. editor, Humana Press, Inc., Totowa NJ, 1998) chapter 12). Такие би- или в другом случае мультифункциональные антитела могут быть пригодны для применения в способах данного изобретения.
2. Терапевтические способы
Терапевтические способы данного изобретения для обработки опухолевых клеток в опухолях и опухолевых метастазах основаны на объединенном использовании ингибирующей ангиогенез (антиангиогенной) терапии и противоопухолевой иммунотерапии. Более чем один тип ингибирующего ангиогенез агента может быть использован в комбинации с более чем одним типом противоопухолевого иммунотерапевтического агента. Комбинированное использование может осуществляться одновременно, последовательно или с интервалом времени между обработками. Любой из специфических терапевтических агентов может быть введен более одного раза в ходе лечения. Способ данного изобретения обеспечивает объединенное использование ингибирующих ангиогенез терапевтических агентов и противоопухолевых иммунотерапевтических агентов, что может приводить к синергическому потенциированию ингибирующего действия на пролиферацию опухолевых клеток каждого из индивидуальных терапевтических агентов, приводя к более эффективному лечению, чем лечение, обнаруживаемое при введении только индивидуального компонента. Так, в одном аспекте способ данного изобретения включает в себя введение пациенту в комбинации количеств ингибирующего ангиогенез агента и противоопухолевого иммуно-терапевтического агента, которые могут не приводить к эффективному ингибированию ангиогенеза или активности против опухолевых клеток при их отдельном введении в тех же количествах.
Способ данного изобретения предусматривает множество способов воздействий в отношении стадий для применения данного изобретения на практике. Например, антагонист и противоопухолевый иммунотерапевтический агент (такой как слитый белок антитело против опухолевого антигена/цитокин в предпочтительном варианте) могут быть введены после смешивания, т.е. одновременно, или могут быть введены последовательно, т.е. раздельно. Кроме того, антагонист и слитый белок могут быть введены раздельно в интервале времени около 3 недель между введениями, т.е. от по существу немедленного введения после введения первого активного агента до приблизительно 3 недель после введения первого агента. Кроме того, предполагается, что порядок введения может варьироваться, т.е. что антагонист α vβ 3 может вводиться перед введением слитого белка или что введение может проводиться в обратном порядке.
В одном варианте способ данного изобретения включает в себя введение пациенту, нуждающемуся в лечении опухолей или метастазов, ингибирующего количества ингибирующего ангиогенез агента, такого как антагонист α vβ 3, и количества противоопухолевого иммунотерапевтического агента, достаточного для индукции биологического ответа. Например, достаточного для индукции цитокин-специфического биологического ответа, где, например, бифункциональный слитый белок имеет цитокин и полипептидную цепь рекомбинантного иммуноглобулина (Ig), где данная Ig-цепь содержит вариабельную область, специфичную для опухолевой клетки, несущей ассоциированный с опухолью антиген клеточной поверхности, и где Ig-цепь связана пептидной связью с данным цитокином. И когда иммунотерапевтический агент содержит цитотоксический агент, данное количество может быть таким, что оно индуцирует цитотоксическую биологическую ответную реакцию в опухолевых клетках-мишенях.
В другом варианте данное изобретение может практиковаться в сочетании с хирургическими процедурами, при которых были удалены части массы опухоли или вся масса опухоли. В этом случае данный способ может применяться после хирургической процедуры. Альтернативно, хирургическая процедура может проводиться в интервале между введением первого активного агента и второго активного агента. Примером этого способа является комбинирование данного способа с описанным ниже хирургическим удалением опухоли.
Лечение в соответствии с данным способом обычно будет предусматривать введение терапевтических композиций в одном или нескольких циклах введения. Например, если практикуется одновременное введение, терапевтическую композицию, содержащую как антагонист α vβ 3, так и противоопухолевый иммунотерапевтический агент, вводят на протяжении периода времени примерно от 2 дней до 3 недель в виде однократного цикла. После этого данный цикл обработки может быть, при необходимости, повторен в соответствии с решением практикующего врача. Подобным образом, если предполагается последовательное введение, время введения для каждого индивидуального терапевтического агента будет приспособлено таким образом, чтобы в типичном случае охватить один и тот же период времени. Интервал между циклами может варьироваться приблизительно от 0 до 2 месяцев.
Введение может выполняться с использованием периодических одноразовых доз, непрерывной инфузией и т.п. Способы введения могут включать в себя внутривенную, подкожную, внутримышечную, ортотопическую инъекцию, ортотопическую инфузию, пероральное введение и т.п.
Терапевтическая композиция, используемая в способе данного изобретения, содержит активный агент в фармацевтически приемлемом носителе, как хорошо известно, и, следовательно, данное изобретение не должно рассматриваться как ограниченное в отношении данной композиции до тех пор, пока концентрация активного агента (активных агентов) в данной композиции является достаточной для доставки (введения) указанного активного агента в описанных здесь количествах.
Обычно доза противоопухолевого иммунотерапевтического агента, такого как слитый белок из направленной на антиген части/цитокина, равна 0,01-10 мг, предпочтительно приблизительно 0,1-1 мг и более предпочтительно приблизительно 0,6 мг на кг веса тела в сутки.
Доза противоопухолевого иммунотерапевтического агента, такого как направленный на антиген цитотоксический агент, может быть обычно 0,01-10 мг, предпочтительно приблизительно 0,1-1 мг и более предпочтительно приблизительно 0,6 мг на кг веса тела в сутки, причем доза излучения может быть соответствующим образом приспособлена в зависимости от желаемой дозы облучения. Изотопы, которые оказались пригодными для лучевой терапии, включают в себя 57-кобальт; 67-медь; 99м-технеций, 123-иодид; 131-иодид и 111-индий и т.п. Радиоактивные фармацевтические агенты и дозы будут варьироваться в зависимости от радиоактивного изотопа и ткани-мишени. Иммунолучевая терапия злокачественных неоплазм (новообразований) может использовать более высокие дозы, чем общепринятая лучевая терапия, так как иммунотерапевтический агент направлен на участок (сайт) опухоли и/или на опухолевую клетку. Например, было обнаружено, что обработка В-клеточной неходжкинской лимфомы радиоиммунотерапевтическим агентом, который направлен на В-клетки, имеет максимальную переносимую дозу 0,4 мКи/кг веса тела (1 мКи=37 мБк) (Witzig, ТЕ et а1., (1999) "Phase I/II trial of IDEC-Y2B8 radioimmunotherapy for treatment of relapsed or refractory CD20(+) B-cell non-Hodgkin'e lymphome", J.Clin.Oncol., 17(12): 3793-3803. Однако направленная на конкретную опухоль или конкретные опухолевые метастазы радиоиммунотерапия может позволить более высокие переносимые дозы, чем при лечении лимфомы. Голые мышы переносили введение двух доз 18,5 мБк 111-индий-меченного антитела (Saga Т, et а1., (1999) "Radioimmunotherapy of human glioma xenografts in nude mice by indium-111 labelled internalising monoclonal antibody", Eur.J.Cancer, 35(8): 1281-1285).
Типичная доза антагониста α vβ 3 составляет 10-1000 мг, предпочтительно приблизительно 20-100 мг, более предпочтительно приблизительно 50 мг на кг веса тела в сутки.
Понятно, что рак обнаруживается во всем царстве животных, и что описанные здесь принципы относятся ко всем животным, у которых ангиогенез может ингибироваться антагонистом α vβ 3 и цитокинами в иммунной системе. Таким образом, предполагается, что данное изобретение может быть применено ко всем животным и, в частности, к человеку.
Кроме того, известно, что имеется большое разнообразие опухолей, которые требуют васкуляризации для их роста и, следовательно, являются кандидатами на способ действия комбинированной терапии данных способов. Опухоли, которые могут приводить к росту, индуцирующему ангиогенез, включают в себя опухоли, возникающие из нейроэктодермальных, эпителиальных и т.п. тканей. Примеры опухолей и опухолевых метастазов включают в себя аденому, ангиосаркому, астроцитому, эпителиальную карциному, герминому, глиобластому, глиому, гамартому, гемангиоэндотелиому, гемангиосаркому, гематому, гепатобластому, лейкемию, лимфому, медуллобластому, меланому, нейробластому, остеосаркому, ретинобластому, рабдомиосаркому, саркому, тератому и т.п. опухоли.
3. Терапевтические системы
В одном варианте в данном изобретении рассматриваются системы, содержащие упаковку и/или набор, который обеспечивает реагенты, необходимые для применения на практике способов данного изобретения. Набор для обработки опухолевых клеток в опухолях или опухолевых метастазах содержит упаковку
a) ингибирующего ангиогенез агента, такого как антагонист α vβ 3, способного ингибировать ангиогенез в опухоли или опухолевых метастазах;
b) противоопухолевого иммунотерапевтического агента, такого как бифункциональный слитый белок-реагент, имеющего цитокин и полипептидную цепь рекомбинантного иммуноглобулина (Ig), где данная Ig-цепь содержит вариабельную область, специфичную для опухолевой клетки, несущей ассоциированный с опухолью антиген клеточной поверхности, где Ig-цепь связана пептидной связью с цитокином; и
c) инструкций для использования данных реагентов в способах лечения опухолей и опухолевых метастазов.
Реагент в наборе данного изобретения обычно приготовлен в виде терапевтической композиции, описанной здесь, и, следовательно, может быть представлен в любой из множества форм, пригодных для помещения в набор. Такие формы могут включать в себя композицию в виде жидкости, порошка, таблетки, суспензии и т.п. для обеспечения антагониста и/или слитого белка данного изобретения. Данные реагенты могут быть обеспечены в отдельных контейнерах, пригодных для раздельного введения в соответствии с данным изобретением, или альтернативно могут быть обеспечены объединенными в композиции в одном контейнере в данной упаковке.
Подобным образом, такая упаковка может содержать вместо вышеописанных компонентов или в дополнение к вышеописанным компонентам любые другие противоопухолевые иммунотерапевтические агенты, такие как описанные выше.
Упаковка может содержать количество, достаточное для одной или нескольких доз, реагентов в соответствии с описанными здесь способами лечения. Обычно упаковка будет содержать количество, достаточное для одного цикла лечения, как описано здесь. Этикетка на упаковке может указывать объединенное или последовательное применение заключенных в ней реагентов для терапевтического лечения опухоли и/или опухолевых метастазов в соответствии со способами данного изобретения. Такая этикетка упаковки может быть прикреплена к каждому флакону с реагентами и/или ко всей упаковке материалов.
Набор данного изобретения содержит также "инструкцию для применения" материалов, содержащихся в упаковке. Инструкции относятся к способу объединенного применения антагониста и слитого белка для лечения опухоли или опухолевых метастазов в соответствии со способами данного изобретения. Поскольку данные способы могут широко варьироваться в зависимости от опухоли, пациента и состояния заболевания, инструкции могут быть различными для указания процедур для соответствующего введения. Данное изобретение не должно рассматриваться как ограничивающее в зависимости от характера инструкций, иных, чем специфика в отношении объединенного применения антагониста и слитого белка в соответствии со способами данного изобретения.
Подобным образом реагенты могут включать в себя противоопухолевые иммунотерапевтические цитотоксические агенты, такие как связывающее опухолевый антиген антитело, связанное с радиоактивно меченным изотопом или цитотоксичным агентом, таким как цитотоксичный пептид или цитотоксичные лекарственные средства и т.п.
4. Получение синтетических пептидов
а. Процедура синтеза
Линейные и циклические полипептиды, перечисленные в таблице ниже, синтезировали с использованием стандартных твердофазных способов синтеза, например таких, как описанные Merrifield, RB, (1969) "Solid-Phase Peptide Synthesis", Adv. Enzymol.Relat.Areas Mol.Biol., 32:221-296; Merrifield, RB, (1969) "The synthesis of biologically active peptides and proteins", JAMA, 210(7): 1247-1254; и Fields, G.B. and Noble, R.L., (1990) "Solid phase peptide synthesis utilizing 9-fluorenylmethoxycarbonyl amino acids". Int.J.Peptide Protein Res., 35(3): 161-214.
Два грамма (г) BOC-Gly-DArg-Gly-Asp-Phe-Val-OMe (SEQ ID NO:1) сначала растворяли в 60 миллилитрах (мл) метанола, к которому добавляли 1,5 мл 2н раствора гидроксида натрия с получением смеси. Затем эту смесь перемешивали в течение 3 ч при 20° С. После упаривания остаток помещали в воду, подкисляли до рН 3 разбавленной НС1 и экстрагировали этилацетатом. Экстракт сушили над Na2SO4, опять упаривали и полученный ВОС-Gly-DArg-Gly-Asp-Phe-Val-OH (SEQ ID NO:2) перемешивали при 20° С в течение 2 ч с 20 мл 2н НС1 в диоксане. Полученную смесь упаривали с получением H-Gly-DArg-Gly-Asp-Phe-Val-OH (SEQ ID NO:3), который затем растворяли в смеси 1800 мл дихлорметана и 200 мл диметилформамида (ДМФ) с последующим охлаждением до 0° С. После этого добавляли последовательно 0,5 г дициклогексилкарбодиимида (DCCI), 0,3 г 1-гидроксибензотриазола (HOBt) и 0,23 мл N-метилморфолина при перемешивании.
Полученную смесь перемешивали дополнительно в течение 24 ч при 0° С и затем при 20° С еще в течение 48 часов. Раствор концентрировали и обрабатывали смешанным ионообменным слоем для освобождения его от солей. После удаления полученной смолы фильтрованием осветленный раствор упаривали и остаток очищали хроматографией с получением цикло(Gly-DArg-Gly-Asp-Phe-Val) (SEQ ID NO:4).
Следующие пептиды, перечисленные в таблице с использованием сокращений аминокислотных остатков при помощи однобуквенного кода и идентифицированные обозначением номера пептида, получали аналогичным образом: цикло(Arg-Gly-Asp-DPhe-Val) (SEQ ID NO:5); цикло(Arg-Ala-Asp-DPhe-Val) (SEQ ID NO:6); цикло(Arg-DAla-Asp-Phe-Val) (SEQ ID NO:8); цикло(Аrg-Gly-Asp-Phe-DVal) (SEQ ID NO:7) и цикло(Arg-Gly-Asp-DPhe-NmeVal) (где метилирование осуществляется при альфа-амино-азоте амидной связи остатка валина) (SEQ ID NO:11).
Пептид, обозначенный как 66203, имеющий последовательность, идентичную пептиду 62184, отличался от последнего только содержанием соли НС1, а не ТФУ-соли, присутствующей в 62184 (SEQ ID NO:5). То же самое верно для пептидов 69601 и 62185 (SEQ ID NO:6) и для 85189 и 121974 (SEQ ID NO:11).
b. Альтернативная процедура синтеза
i. Синтез ТФУ-соли цикло(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11)
Fmoc-Arg(Mtr)-Gly-Asp(OBut)-DPhe-NMeVal-ONa (SEQ ID NO:14) синтезируют с использованием твердофазных процедур типа синтеза Меррифилда последовательным добавлением NMeVal, DPhe, Asp(OBut), Gly и Fmoc-Arg(Mtr) постадийным образом к 4-гидроксиметилфеноксиметилполистирольной смоле (смола типа Wang) (применяют обычные способы синтеза пептидов типа синтеза Меррифилда). Полистирольная смола и предшественники аминокислотных остатков являются коммерчески доступными у химических компаний Aldrich, Sigma или Fluka. После завершения последовательного добавления аминокислотных остатков смолу затем отделяют от пептидной цепи с использованием смеси 1:1 ТФУ/дихлорметан, что обеспечивает продукт Fmoc-Arg(Mtr)-Gly-Asp(OBut)-DPhe-NMeVal-OH (SEQ ID NO:15). Затем Fmoc-группу удаляют смесью 1:1 пиперидин/ДМФ, что обеспечивает неочищенный предшественник Arg(Mtr)-Gly-Asp(OBut)-DPhe-NMeVal-OH (SEQ ID NO:16), который затем очищают при помощи ВЭЖХ общепринятым способом.
Для циклизации раствор 0,6 г Arg(Mtr)-Gly-Asp(OBut)-DPhe-NMeVal-OH (синтезированного выше) (SEQ ID NO:16) в 15 мл ДМФ (диметилформамид; Aldrich) разбавляют 85 мл дихлорметана (Aldrich) и добавляют 50 мг NaHCOs. После охлаждения в смеси сухой лед/ацетон добавляют 40 мкл дифенилфосфорилазида (Aid-rich). После стояния при комнатной температуре в течение 16 ч раствор концентрируют. Концентрат подвергают гель-фильтрации (колонка Sephadex G10 в смеси изопропанол/вода 8:1) и затем очищают при помощи ВЭЖХ общепринятым способом. Обработка ТФУ (трифторуксусная кислота/Н2О (98:2)) дает цикло(Arg-Gly-Asp-DPhe-NMeVal) (также называемый здесь "цикло(RGDfN-MeV)"; SEQ ID NO:11) x ТФУ, который затем очищают при помощи ВЭЖХ общепринятым способом; RT=19,5; FAB-MS (М+Н):589.
ii. Синтез "внутренней соли"
ТФУ-соль удаляют из полученного как описано выше циклического пептида суспендированием цикло(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11) x ТФУ в воде с последующим упариванием в вакууме для удаления ТФУ. Образованный циклический пептид называют "внутренней солью", и он обозначен как цикло(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11). Используют термин "внутренняя соль", так как данный циклический пептид содержит два противоположно заряженных остатка, которые внутриэлектронно противоуравновешивают друг друга с образованием в целом незаряженной молекулы. Один из заряженных остатков имеет кислотную часть молекулы, а другой заряженный остаток содержит амино-часть. Когда кислотная часть молекулы и амино-часть находятся в тесной близости друг от друга, кислотная часть молекулы может депротонироваться амино-частью, что образует разновидность карбоксилат/аммониевой соли с общим нейтральным зарядом.
iii. HCl-обработка с образованием цикло(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11)× HCl
80 мг цикло (Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11) растворяют в 0,01М HCl пять-шесть раз и лиофилизуют после каждой операции растворения. Последующая очистка при помощи ВЭЖХ дает цикло(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11)× HCl; FAB MS (M+H):589.
iv. Обработка метансульфоновой кислотой с образованием цикло(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11)× МеSO3Н
80 мг цикло(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11) растворяют в 0,01М MeSOsH (метансульфоновая кислота) пять-шесть раз и лиофилизуют после каждой операции растворения. Последующая очистка при помощи ВЭЖХ дает цикло-(Arg-Gly-Asp-DPhe-NMeVal) (SEQ ID NO:11)× MeSO3H; RT=17,8; FAB MS (M+H):589.
Альтернативные способы циклизации включают в себя дериватизацию цепей боковых групп ациклического пептидного предшественника сульфгидрильными частями молекулы, которые при экспонировании в условиях рН, слегка более высокого, чем нормальный физиологический рН (рН 7,5), образуют внутримолекулярно дисульфидные связи с другими сульфгидрильными группами, присутствующими в молекуле, с образованием циклического пептида. Кроме того, С-концевая карбоксилатная часть ациклического пептидного предшественника может взаимодействовать со свободной сульфгидрильной группой, присутствующей в молекуле, с образованием содержащих тиоэфирную связь циклизованных пептидов.

5. Генерирование и характеристика слитого белка опухолеспецифическое антитело-цитокин
а. Белки и специфический для сосудистой сети антагонист интегрина α v
Конструирование и характеристика слитых белков антитело-цитокин ch14.18-IL-2 и huKS1/4-IL-2 были описаны ранее (Xiang, R., et al., (1997); Gillies, S., et al., (1992) supra). Антигенсвязывающие характеристики обеих конструкций были идентичны характеристикам их соответствующих антител и специфическая EL-2-активность была эквивалентна активности коммерчески доступного rhIL-2. Были синтезированы и охарактеризованы антагонистический циклический пептид интегрина α vβ 3 121974 (цикло(RGDfN-MeV)) (SEQ ID NO:11) и контрольный пептид 135981 (цикло(RADfN-MeV) (SEQ ID NO:13).
6. Клеточные линии и модели животных
Все клеточные линии и соответствующие модели животных устанавливали по существу, как описано ранее (Becker, J.C., et al., (1995); Xiang, R., et al., (1996); Lode, H.N., et al., (1996) supra). Отсутствие интегрина α vβ 3 на клетках NXS2 и CT26-KSA демонстрировали с использованием антитела против CD61 мыши (цепи интегрина β 3) (Pharmingen, La Jolla, CA). Обе клеточные линии не обнаружили сигнала (1 мкг mАВ против CD61 мыши/106 клеток) в FACS-анализе в противоположность интегрин α vβ 3-положительным клеткам мышиной меланомы B16FG3 и B78-D14, используемым в качестве положительных контролей. Кроме того, клетки NXS2 были неспособны прикрепляться к пластику, покрытому mAB против CD61 мыши (10 мкг/мл, 4° С, 24 ч), в противоположность антителу против GD2 ch14.18 (10 мкг/мл, 4° С, 24 ч), используемому в качестве положительного контроля. Однако все опухолевые клетки экспрессируют интегрин α v, согласно FACS, и прикрепляются на витронектине, что указывает на присутствие интегрина α vβ 3.
Для всех хирургических процедур мышей анестезировали инъекцией кетамина (100 мг/кг i.p.) и одновременной ингаляцией метофана (Pitman-Moore, Munlelein, IL).
Осмотические насосы (Alzet® , model 2001, Palo Alto, CA) для введения антагониста интегрина α v и контрольного пептида использовали при скорости доставки 17,5 мкг/ч. Этими насосами манипулировали в соответствии с указаниями изготовителя и имплантировали в подкожную ткань спины в стерильных условиях. Все насосы заменяли в день 7 после имплантации и удаляли в день 10 антиваскулярной обработки. Все эксперименты на животных проводили в соответствии с указаниями относительно ухода и применения лабораторных животных Национального Института Здоровья США (NIH).
7. Гистология и иммуногистохимия
Фиксированные ацетоном, замороженные срезы первичных опухолей инкубировали с 4% козьей сывороткой для блокирования неспецифического связывания. Инкубации с mAb против CD31 мыши и против CD45 мыши (Pharmingen, La Jolla, CA) (1:100) и последующее окрашивание меченным родамином козьим антикрысиным антителом (1:300) проводили в увлажненной камере при комнатной температуре. За каждой инкубацией следовали промывки ЗФР (× 3). Число сосудов и лейкоцитов в поле зрения микроскопа с большим увеличением (HPF) определяли микроскопически при увеличении 200х (Brooks, P.С., et al.,(1995) "Anti-integrin alpha v beta 3 blocks human breast cancer growth and angiogenes in human skin", J.Clin.Inves., 96, 1815-1822). Репрезентативные зоны фотографировали при 200х (сосуды) и 800х (лейкоциты), соответственно.
8. Уменьшение первичных опухолей только у мышей, обработанных антагонистом интегрина α v, комбинированным со слитыми белками антитело-IL-2
Синергическое действие ингибирующей ангиогенез терапии (антагонист интегрина α v) и иммунотерапии (слитые белки антитело-IL-2) определяли на мышах с установленными подкожными опухолями (110-130 мм3) во всех трех сингенных моделях, соответственно.
На фигуре 1 графически изображено действие комбинированной терапии антиангиогенным антагонистом интегрина α v и противоопухолевой иммунотерапевтической компартмент-специфической иммунотерапии со слитыми белками антитело-IL-2 на первичных опухолях. На фигуре 1А изображены результаты, полученные на первичных опухолях, индуцированных подкожной инъекцией (2× 106) нейробластомы NXS2. На фигуре 1В изображены результаты на первичных опухолях, индуцированных подкожной инъекцией (2× 106) карциномы ободочной кишки СТ26-KSA. На фигуре 1С изображены результаты, полученные на из первичных опухолях, индуцированных подкожной инъекцией (2× 106) клеток меланомы B78-D 14. Обработку установленных опухолей (110-130 мм3) начинали внутривенными инъекциями один раз в день слитых белков опухолеспецифическое антитело-IL-2 huKSI/4-IL-2 (10 мкг, карцинома ободочной кишки) и ch.l4.18-IL-2 (5 мкг, нейробластома, 10 мкг, меланома) (× 5) и непрерывной подкожной инфузией антагониста, специфичного для сосудистой сети интегрина α v, или контрольного пептида осмотическим насосом в течение 7 дней при 17,5 мкг/ч (верхний график). Время начала обработки указано черной стрелкой. Размер первичных опухолей мышей в каждой экспериментальной группе (n=6) определяли измерениями микрокронциркулем (ширина х длина х ширина/2). (Среднее± стандартная ошибка). Уменьшение в размере первичной опухоли мышей, получающих комбинированную обработку, в сравнении с размером установленных опухолей во время начала обработки было статистически значимым у трех различных сингенных моделей опухолей (Р<0,001, критерий суммы рангов Уилкинсона) в противоположность всем контролям (Р>0,05).
Сначала устанавливали субоптимальные количества для каждого терапевтического способа обработки и начинали их последующее применение в комбинации. Только мыши, обработанные антагонистом интегрина α v и слитыми белками с IL-2, обнаружили уменьшение опухолей во всех трех моделях в диапазоне от 59 до 90% (Р<0,001). Фактически половина животных, инокулированных клетками нейробластомы и карциномы ободочной кишки, полностью отторгали первичные опухоли, данные не показаны. В противоположность этому, каждая стратегия, использованная в виде монотерапии, в самом лучшем случае задерживала рост в сравнении с контрольной группой, соответственно. Затем анализировали действие каждого способа обработки и их комбинации на васкулярный и опухолевый компартмент.
Выполняли гистологию после комбинированной антиангиогенной и опухолеспецифической иммунотерапии установленных первичных нейробластомных опухолей, хирургически удаленных спустя 20 дней после инокуляции опухолевых клеток. Вкратце, фиксированные формалином первичные опухоли подвергали заливке в парафин и последующему окрашиванию гематоксилином/эозином. Идентифицировали некротические зоны и инфильтраты лейкоцитов.
На фигуре 2 графически изображено действие объединенной антиваскулярной и противоопухолевой терапии на васкуляризацию и противоопухолевую иммунную реакцию. Мыши (n=6) с установленными первичными нейробластомными опухолями получали комбинированную обработку специфическим для сосудистой сети интегрином ее, антагонистом, неспецифическим контрольным пептидом и опухолеспецифическим слитым белком ch14.18-IL-2, как описано для фигуры 1, включая контроли, которые получали каждую терапию раздельно. В конце обработки s.с.-опухоли удаляли хирургически. Замороженные срезы каждой опухоли анализировали иммуногистохимически с использованием антител, специфичных в отношении эндотелиальных клеток кровеносных сосудов (CD-31) и инфильтрации лейкоцитов (CD45), соответственно. Последний является хорошо установленным маркером для специфического для опухолевого компартмента иммунного ответа, индуцируемого слитым белком ch14.18-IL-2 (Becker, J.C., et al., (1996), supra; Xiang, R, et al., (1996), supra; Lode, H.N., et al., (1998), supra).
На фигуре 2А изображены результаты, характерирующие плотность кровеносных сосудов первичных опухолей после обработки васкулярного и опухолевого компартмента либо антагонистом интегрина α v, либо слитым белком chl4.18-IL-2, либо их комбинацией (*Р<0,001, Т-критерий Стьюдента). На фигуре 2В изображены результаты инфильтрации лейкоцитов первичных опухолей после обработки васкулярного и опухолевого компартментов, соответственно (*Р<0,001, Т-критерий Стьюдента).
У мышей, получающих антагонист интегрина α v, выявлено 50% уменьшение васкуляризации (фигура 2), совпадающее с задержкой роста первичных опухолей, что демонстрирует эффективную направленность на васкулярный компартмент. В этом случае на опухолевый компартмент не было прямого действия (фигура 1). В противоположность этому, у мышей, обработанных только слитым белком антитело против GD2-IL-2, обнаружили явный лейкоцитарный инфильтрат, хорошо установленную характеристику этой направленной против опухолевого компартмента терапии (Becker, J.C., et al., (1996), supra; Xiang, R., (1996), supra; Lode, H.N., et al., (1998), supra), приводящий к существенному уменьшению роста s.с.-опухоли (фигура 1).
Однако только у мышей, обработанных комбинацией антагониста интегрина α v и слитого белка анти-GD2-IL-2, обнаружили пятикратное увеличение инфильтрации лейкоцитов в опухоль, в сравнении с мышами, обработанными только слитым белком анти-GD2-IL-2, и обнаружили сходное уменьшение васкуляризации. Увеличение воспалительных клеток было показано гистологически и иммуногистохимически и было отнесено к притоку макрофагов, картине, часто наблюдаемой в некротических тканях во время удаления клеточного дебриса. Фактически такие некротические зоны присутствовали только в опухолях после комбинаторной обработки, в противоположность контролям, обработанным каждым компонентом отдельно.
9. Последовательное и одновременное васкулярное и опухолевое направленно индуцирует уничтожение спонтанных печеночных метастазов
Кроме успешного лечения первичных опухолей, более уместным вопросом является вопрос, подвергаются ли отдаленные метастазы воздействию такой стратегии комбинированной антиваскулярной и противоопухолевой специфической терапии. Это выясняли на модели нейробластомы, характеризующейся спонтанными печеночными метастазами. Для этой цели обработку первичной опухоли антиангиогенным антагонистом интегрина α v последовательно комбинировали с противоопухолевой иммунотерапией слитым белком антитело-IL-2.
На фигуре 3 графически изображено действие последовательной комбинации антиангиогенного антагониста интегрина α v и специфичного в отношении опухолевого компартмента иммунотерапии со слитым белком антитело-IL-2 на спонтанных метастазах нейробластомы в печени. Антиваскулярную обработку начинали у мышей с установленными первичными опухолями, как описано для фигуры 1, в течение 10 дней в целом. После хирургического удаления первичных опухолей мыши получали специфичную в отношении опухолевого компартмента иммунотерапию посредством инъекций один раз в день 5 мкг слитого белка ch14.18-IL-2 (× 5). Число спонтанных метастазов в печени определяли макроскопическим счетом очагов в печени (n=8) (**Р<0,01, критерий суммы рангов Уилкоксона).
Только у мышей, обработанных последовательно обоими агентами, обнаружили 1,5-2 log-уменьшение метастазов в печени, в противоположность всем контролям, где обработка каждым агентом, используемая в виде монотерапии, была неэффективной (Р<0,01) (фигура 3). В самом деле, 4/8 мышей, подвергнутых комбинированной терапии, выявили полное отсутствие печеночных метастазов, тогда как остальные животные обнаружили только 1-5 небольших метастатических повреждений. По существу, сходные результаты были получены одновременными комбинациями антагониста интегрина α v со слитым белком chl4.18-IL-2 (верхняя часть фигуры 4).
На фигуре 4 изображено действие одновременной комбинации антиангиогенного антагониста интегрина α v и специфичной в отношении опухолевого компартмента иммунотерапии со слитым белком антитело-IL-2 на спонтанных метастазах нейробластомы в печени. Спонтанные метастазы индуцировали после индукции первичных опухолей s.c. инъекцией 2× 106 клеток NXS2 нейробластомы. Обработка интегрином или антагонистом (17,5 мкг/ч) и опухолеслецифичным слитым белком ch14.18-IL-2 (5 мкг× 5), начиналась до (фигура 4А) или после (фигура 4В) удаления первичной опухоли. Спонтанные метастазы в печени определяли макроскопическим счетом очагов в печени (n=8) (**Р<0,01, критерий суммы рангов Уилкоксона).
Только у мышей, обработанных обоими агентами, выявили либо полное отсутствие (фигура 4А), либо >1,5 log уменьшение (фигура 4В) метастазов печени, в зависимости от их введения до или после удаления первичных опухолей. В противоположность этому, во всех контролях, когда каждый агент использовали в виде монотерапии, обработка была неэффективной.
10. Синергическая комбинация и эффективная терапия
Разрушение кровеносных сосудов в васкулярном компартменте злокачественных опухолей является мощной стратегией для борьбы с раком. Направлением на эндотелиальные клетки сосудистой сети опухоли ее можно успешно лечить. Пептидный антагонист, поражающий сосудистую сеть через взаимодействие с интегринами α v, экспрессируемыми на ангиогенных кровеносных сосудах (Brooks, P.С. et al., (1994), Science, supra; Friedlander, M., (1995), supra), ингибировал образование кровеносных сосудов и вызывал драматический регресс (обратное развитие) последующего роста опухоли. Это было продемонстрировано при обработке трех агрессивно растущих первичных опухолей и одной спонтанно метастазирующей опухоли. Хотя используемый антагонист α v прежде всего был направлен на α vβ 3, он связывается также с близкородственным интегрином α vβ 5. Испытанные опухоли карциномы ободочной кишки и нейробластомы явно лишены α vβ 3, но, вероятно, экспрессируют некоторое количество α vβ 5. Модель меланомы также экспрессирует α vβ 5. Однако действие этого антагониста интегрина было явно ограниченным опухолевой сосудистой сетью во всех трех моделях животных, как показано для модели нейробластомы (фигура 2). Важно, что противоопухолевое действие нацеливания на опухолевую сосудистую сеть усиливается одновременной атакой на компартмент опухоли, что является эффективным как против первичных опухолей, так и против спонтанных метастазов. Это особенно уместно, так как удаление первичной опухоли перед обработкой увеличивало рост и диссеминацию метастазов нейробластомы - открытие, хорошо документированное на других моделях опухолей, обусловленное уменьшением циркулирующих в кровотоке уровней ингибиторов ангиогенеза после иссечения первичной опухоли (Holmgren, L., et al., (1995), supra; Folkman, J., (1995), supra). Одновременное нацеливание на васкулярный и опухолевый компартменты оказалось очень эффективным, так как оно сочетает уменьшение питания опухолевых клеток с активной деструкцией опухолевых клеток, приводя к регрессу первичных опухолей и ликвидации отдаленных метастаэов. В противоположность этому подход, направленный только на васкулярный компартмент, при котором используются стратегии двух различных антиангиогенных обработок, приводил только к супрессии роста s.с.-опухоли в сингенной модели (Mauceri, H.J., et al., (1998) "Combined effects of angiostatin and ionizing radiation in antitumor therapy", Nature, 394, 287-291).
В данной стратегии специфичный в отношении опухолевого компартмента ответ опосредуется воспалительными клетками, которые активируются и направляются в микроокружение опухоли слитыми белками опухолеспецифическое антитело-IL-2. Важно, что антиангиогенная стратегия, хотя и вполне эффективная в супрессии роста первичных опухолей с хорошо развитым кровоснабжением, не имеет подобной эффективности против отдаленных метастазов при использовании в виде монотерапии (фигуры 3, 4). Однако в таких условиях минимального остаточного заболевания с небольшими опухолевыми нагрузками, характеризующимися слабой васкуляризацией, ветвь обработки противоопухолевого компартмента, используемая в комбинированной терапии, является вполне эффективной при использовании в виде монотерапии (Xiang, R., et al., (1997), supra; Lode, H.N., et al., (1998), supra). В этой ситуации роль антиангиогенной обработки заключается в подавлении индуцируемой микрометастазированием реваскуляризации и последующего увеличения метастатических очагов (Volpert, O.V., et al., (1998), supra). Это, в свою очередь, облегчает ликвидацию таких микрометастазов направленной на опухолевый компартмент терапией, которая является оптимально эффективной в условиях минимального остаточного заболевания (Becker, J.C., et al., (1996), supra).
Эффективная обработка первичных опухолей и диссеминированных метастазов остается основной проблемой в клинической онкологии. Результаты этого сообщения показывают, что комбинации специфических антиангиогенных и иммунотерапии действуют синергически на первичные опухоли, вызывая их регресс и ликвидацию микрометастазов. Поскольку оба способа обработки, т.е. антагонистами интегрина α v и слитыми белками антитело-интерлейкин-2, в настоящее время подвергаются клинической оценке в качестве монотерапий, синергизм их комбинации обеспечивает новый и эффективный инструмент для терапии рака.
Предыдущие примеры, описывающие некоторые варианты данного изобретения, являются иллюстративными и, конечно, не должны рассматриваться как специфически ограничивающие данное изобретение. Кроме того, такие вариации данного изобретения, известные в настоящее время или разработанные позднее, которые находятся в компетенции специалиста в данной области, должны рассматриваться как находящиеся в рамках данного изобретения, показанных прилагаемой формулой изобретения.









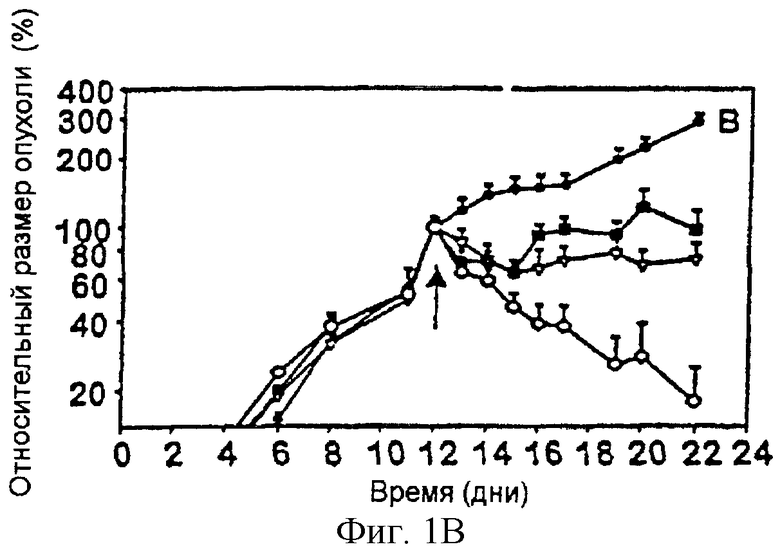
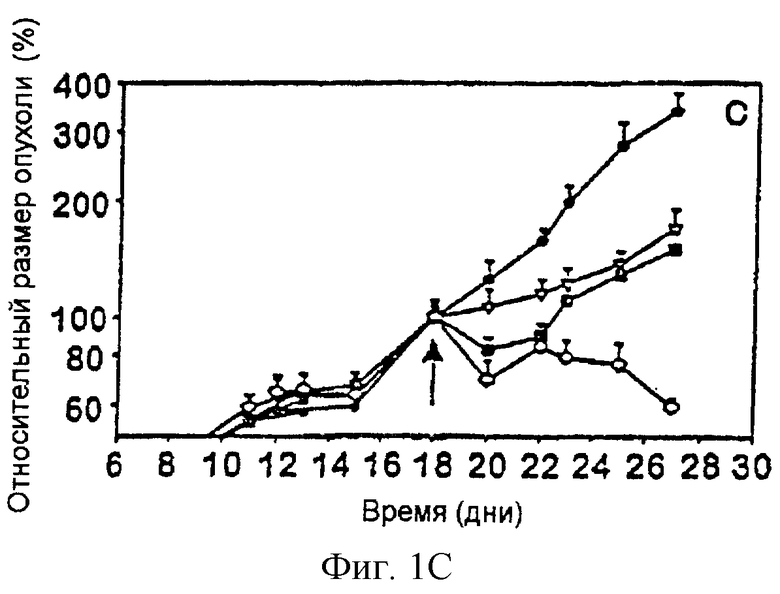
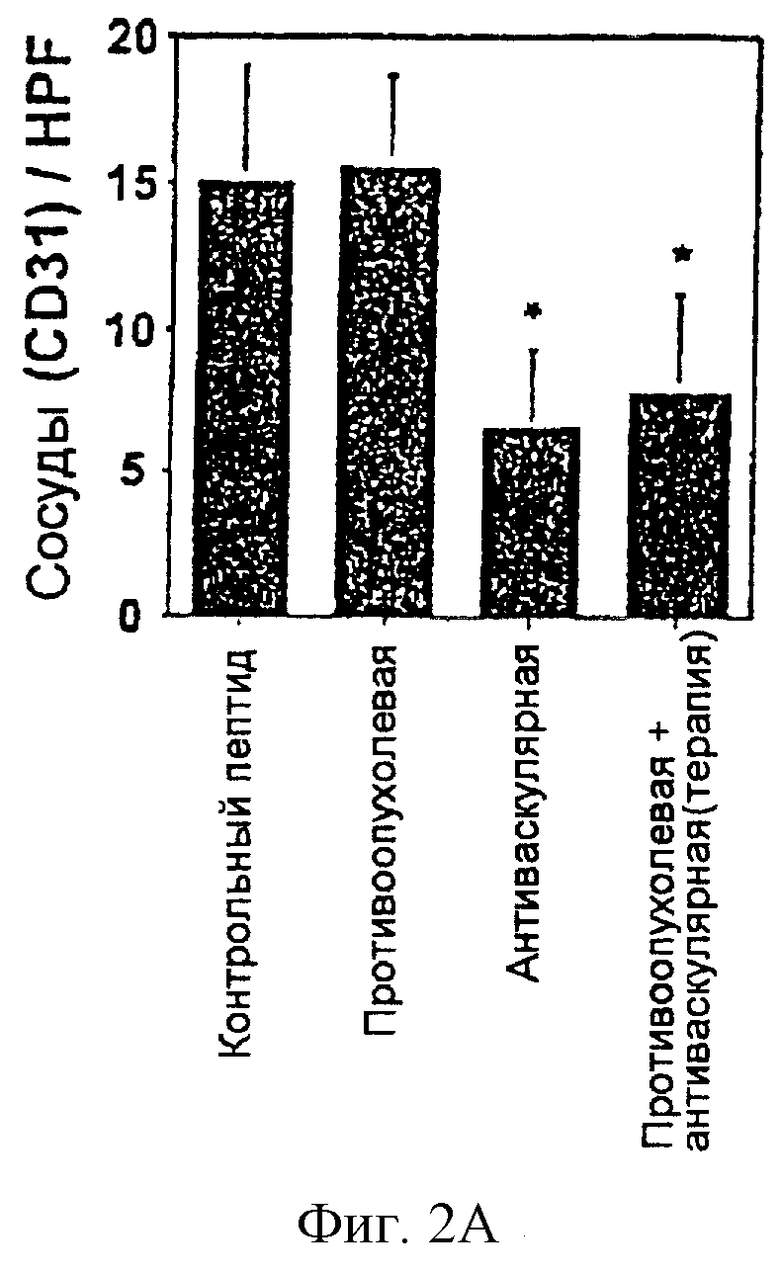
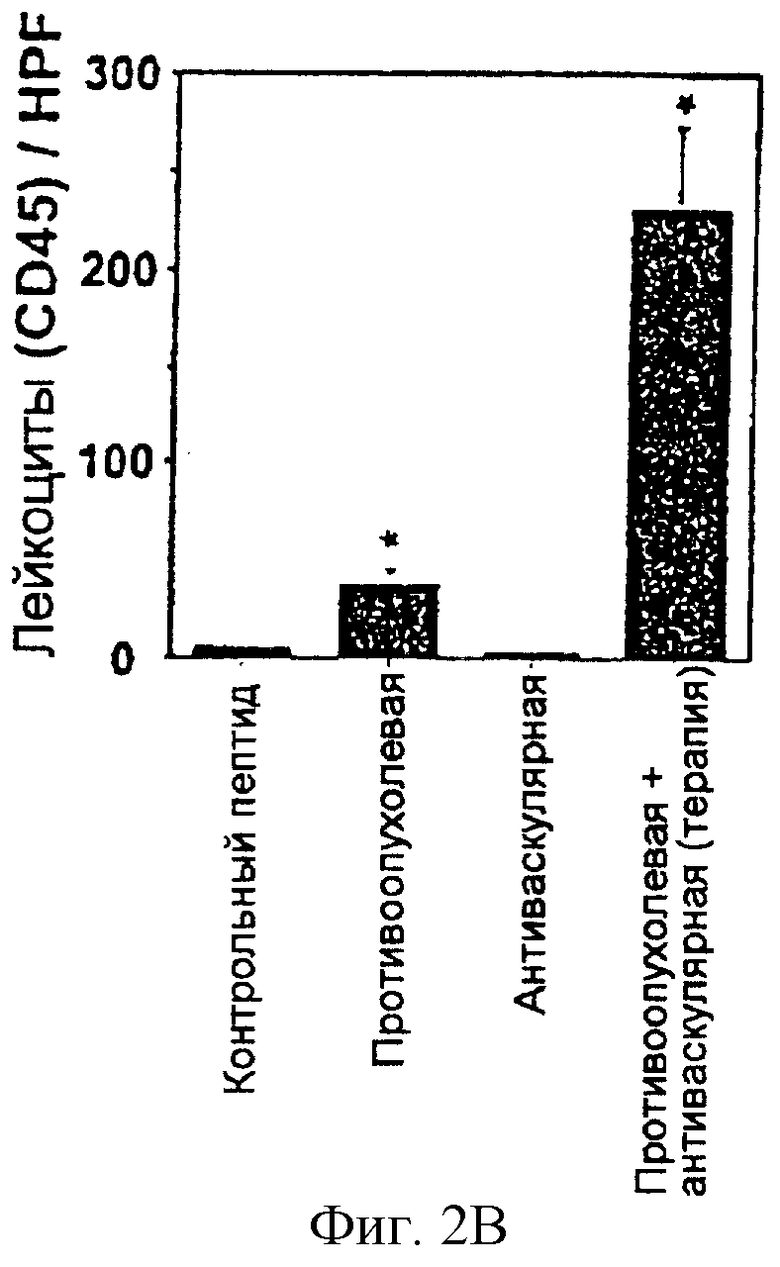
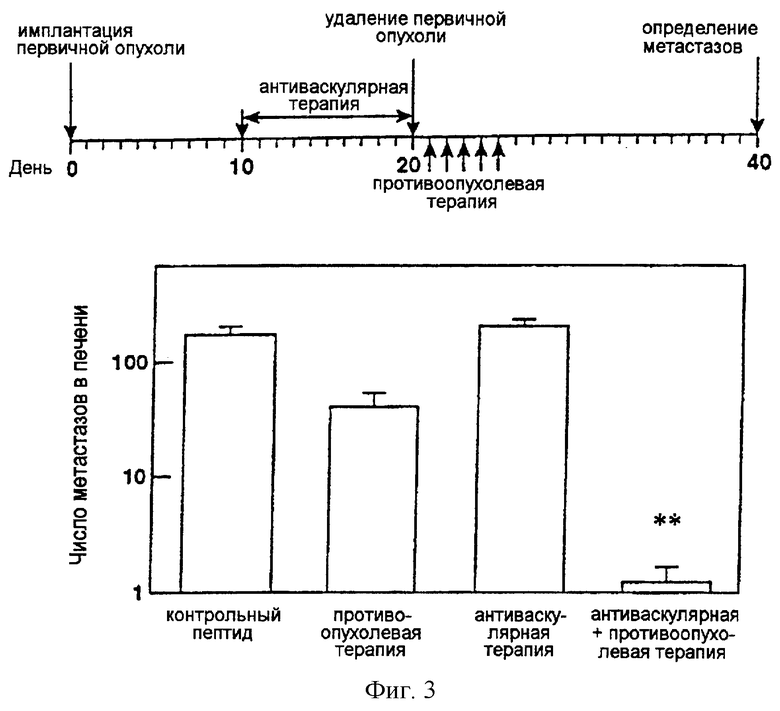
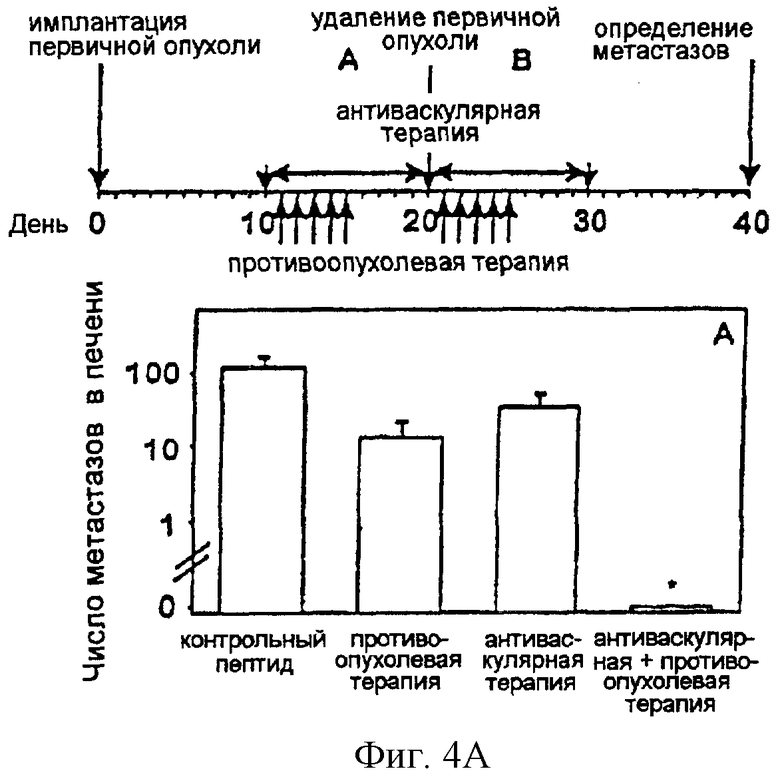
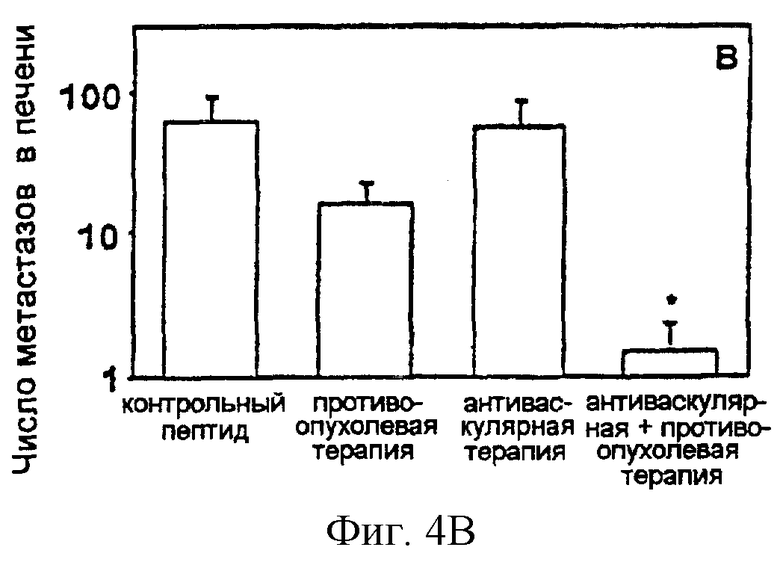
Изобретение относится к медицине и касается способов лечения опухолей и метастазов с использованием комбинации антиангиогенной терапии и иммунотерапии. Изобретение включает способ лечения нейроэктодермальной и эпителиальной опухоли у пациента, терапевтическую композицию и набор для лечения опухолевой клетки с применением агента, ингибирующего англогенез и являющегося антагнистом α vβ 3, и противоопухолевого иммунотерапевтического агента, содержащего цитокиновый компонент клетки-эффектора и компонент иммуноглобулинового Ig полипептида, направленный на ассоциированный с опухолью антиген и содержащий вариабельную область, которая связывается с ассоциированным с опухолью антигеном-мишенью. Преимущество изобретения заключается в применении для лечения опухолей антиангиогенной терапии. 3 с. и 23 з.п. ф-лы, 4 ил., 1 табл.
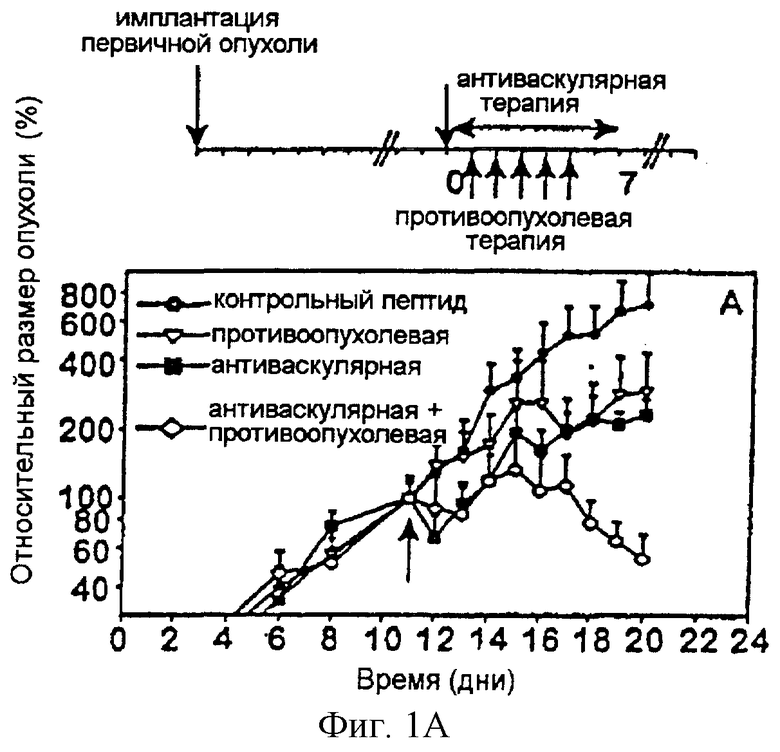
| US 5753230 А, 19.05.1998 | |||
| US 5766591 А, 16.06.1999 | |||
| US 5780426 А, 14.07.1998 | |||
| CHERESH D.A | |||
| et al | |||
| Biosynthetic and functional properties of an Arg-Gly-Asp-directed receptor involved in human melanoma cell attachment to vitronectin, fibrinogen and von Willebrand factor, J | |||
| Biol | |||
| Chem | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Автоматический переключатель для пишущих световых вывесок | 1917 |
|
SU262A1 |
Авторы
Даты
2004-09-20—Публикация
2000-02-11—Подача