Изобретение относится к криобиологии и может быть использовано в технологии криоконсервации биологических образцов, например, спермы ценных видов промысловых рыб (осетровые, лососевые).
Низкотемпературные криобанки спермы рыб являются одним из наиболее эффективных способов сохранения необходимого числа редких и исчезающих видов. Однако, поскольку глубокая заморозка - оттаивание это довольно сложные биотехнологические процессы, их эффективная работа зависит от множества технологических факторов, в том числе качества сред для криоконсервации.
Известен способ определения качества криопротекторов (ДМСО, ДЭСО) методом проникающих катионов тетрафенилфосфония. В результате глубокого замораживания бактерий Е.соli мембранный потенциал резко уменьшается (с 198 до 85 мВ). Инкубация бактерий в среде, содержащей диметилсульфоксид и диэтилсульфоксид в качестве криопротекторов, приводит к уменьшению значений потенциала на 16 и 27 мВ соответственно. Таким образом, диэтилсульфоксид является более эффективным криопротектором по сравнению с диметилсульфоксидом /1/.
ДМСО - это классический криопротектор, который широко применяется, в частности, при работе со спермой осетровых рыб /2/. Однако в высоких концентрациях это вещество становится токсичным. По этой причине, при увеличении концентрации ДМСО до 20-25% его защитное действие снижается. Для компенсации токсического действия и повышения его защитных свойств известно использование гликопротеина. В систему для заморозки, содержащую 1М и 3М растворы ДМСО, вносили раствор гликопротеина (концентрация 20 мг/мл), из трески (Gadus morhya), обитающей в Белом море. Количество эмбрионов, развившихся до стадии компактной морулы, составило 65% /3/.
Наиболее близким по технической сущности и достигаемому эффекту к способу по п.1 формулы изобретения является использование биосенсора на основе светящихся рекомбинантных клеток E.coli, несущих ген люциферазы светляков, иммобилизированных в криогеле поливинилового спирта. Данный биосенсор использован для подбора криопротекоров, используемых для иммобилизации в криогеле лабильных макромолекул /4/.
К способу по п.2, кроме вышеизложенного, наиболее близким является способ замораживания спермы баранов, сущность его в том, что в качестве криозащитных веществ в среду для заморозки добавляли синтетические жирорастворимые антиоксиданты (ИХФГАН - 1, ИХФГАН - 2, ИХФГАН - 3), синтезированные в институте химической физики РАН. Результаты осеменения спермой, замороженной с антиоксидантом, показали, что при однократном осеменении овец объягнилось на 9% больше, чем при осеменении спермой без антиоксиданта /5/.
Целью настоящего изобретения является создание экспресс-метода для оценки качества потенциальных криопротекторов и повышение их криопротекторного эффекта с использованием в качестве тест-объекта светящихся бактерий.
Эта цель достигается путем использования в качестве биосенсора рекомбинантного штамма В 5356 Е.Coli, несущего плазмиду, содержащую Lux-оперон, который помещают в среду для криоконсервации, содержащую анализируемый криопротектор, при плотности суспензии 106-107 кл/мл, экспозиции замораживания - 5 мин, экспозиции оттаивания – 30 мин, а силу протекторного эффекта определяют и по изменению люминесценции опытных проб по сравнению с контрольными. В другом варианте в качестве биосенсора используют рекомбинантный штамм В 5356 Е.Coli, несущий плазмиду, содержащую Lux-оперон, а в качестве модификатора в среду для криоконсервации, содержащую анализируемый криопротектор, добавляют аскорбиновую кислоту в концентрации 10 мкг/мл, при этом плотность суспензии составляет 106-107 кл/мл, экспозиция замораживания - 5 мин, экспозиция оттаивания - 30 мин, а силу протекторного эффекта определяют по изменению люминесценции опытных проб по сравнению с контрольными.
Достижение положительного эффекта согласно цели настоящего изобретения обеспечивается тем, что в качестве тест-объекта используется рекомбинантный штамм Е.Coli HB 101/pGB lux 37, коллекционный номер В 5356, полученного из Всероссийской коллекции промышленных микроорганизмов - ВКПМ (г. Москва). Штамм несет плазмиду pGB lux 37, содержащую lux-оперон из Ph.leognati, под контролем конститутивного промотора.
В другом варианте недостаточное защитное действие криопротектора компенсируется введением дополнительно в среду для криоконсервации модификатора, в качестве которого используют аскорбиновую кислоту в концентрации 10 мкг/мл.
Основная клеточная мишень деструктивного действия замораживания-оттаивания - это клеточная мембрана. Один из наиболее информативных бактериальных тестов на повреждение мембран - биолюминесцентный тест. Общность структуры биомембран отмечается для всех живых систем, что ставит предложенный тест в разряд наиболее показательных при определении качества криопротекторов. Он основан на регистрации интенсивности люминесценции светящихся бактерий, которая зависит от работы дыхательной цепи, большинство ферментов которой связаны с мембраной. Поэтому повреждение мембран вызывает изменение интенсивности биолюминесценции светящихся бактерий.
Добавление аскорбиновой кислоты в качестве модификатора в концентрации 10 мкг/мл полностью компенсирует токсическое действие высоких концентраций криопротекторов, например ДМСО, позволяет снизить их концентрации и при этом добиться достоверного повышения криопротекторного эффекта.
Способ осуществляется следующим образом.
Вариант I.
В контрольные пробирки типа “Эппендорф” вносят по 1 мл буфера А (17% NaCl, 25% глюкоза, 1М трис - НСl, рН 7,5), в опытные пробирки - по 1 мл исследуемого криопротектора на основе буфера А. После этого во все пробирки добавляют по 50 мкл препарата штамма В 5356 Е.Соli и инкубируют в течение 10 мин. После инкубации часть контрольных и опытных пробирок подвергают замораживанию в жидком азоте (-196°С) в течение 5 мин. Разморозку проб осуществляют на водяной бане (30°С) в течение 30 мин. Измерения проводят на люминометре ЛТ-01. Результаты измерений вносят в протокол и по предложенной формуле рассчитывают силу протекторного эффекта Pp
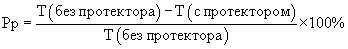
где T - процент падения свечения после замораживания в жидком азоте и последующего оттаивания.
Процент падения свечения Т - величина безразмерная и определяется по формуле
T=100%(Iо-I)/Iо,
где Iо и I соответственно интенсивность биолюминесценции контрольной и исследуемой пробы через определенный интервал времени экспозиции исследуемого раствора с тест-объектом.
Вариант II.
В контрольные пробирки типа “Эппендорф” вносили по 1 мл буфера А (17% NaCl, 25% глюкоза, 1М трис - НСl, рН 7,5). Раствор аскорбиновой кислоты (10 мг/мл) готовили на основе предложенного буфера непосредственно перед использованием. В опытные пробирки вносили по 1 мл исследуемого криопротектора на основе буфера А с аскорбиновой кислотой. После этого во все пробирки добавляли по 50 мкл препарата штамма В 5356 Е.Соli и инкубировали в течение 10 мин. После инкубации часть контрольных и опытных пробирок подвергали замораживанию в жидком азоте (-196°С) в течение 5 мин. Разморозку проб осуществляли на водяной бане (30°С) в течение 30 мин. Измерения проводили на люминометре ЛТ-01. Результаты измерений вносили в протокол и по предложенной формуле рассчитывали силу протекторного эффекта Pp
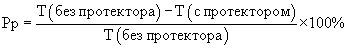
где T - процент падения свечения после замораживания в жидком азоте и последующего оттаивания.
Процент падения свечения Т - величина безразмерная и определяется по формуле
Т=100%(Iо-I)/Iо,
где Iо и I соответственно интенсивность биолюминесценции контрольной и исследуемой пробы через определенный интервал времени экспозиции исследуемого раствора с тест-объектом.
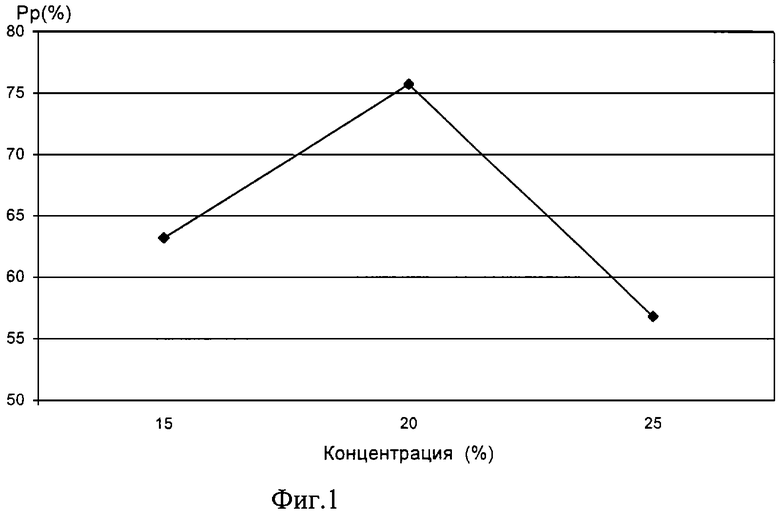
На фиг.1 - график изменения силы протекторного эффекта ДМСО различных концентраций при криоконсервации штамма В 5356 Е.Соli.
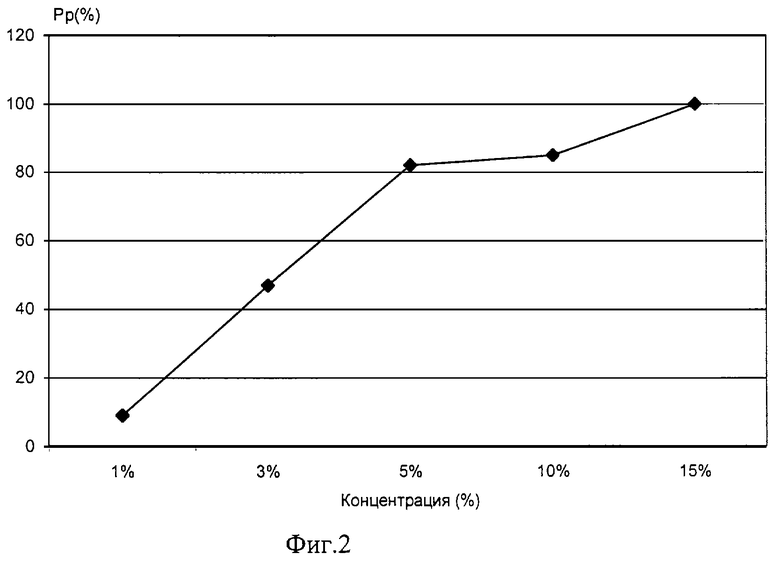
На фиг.2 - график изменения силы протекторного эффекта глицерина различных концентраций при криоконсервации штамма В 5356 Е.Соli.
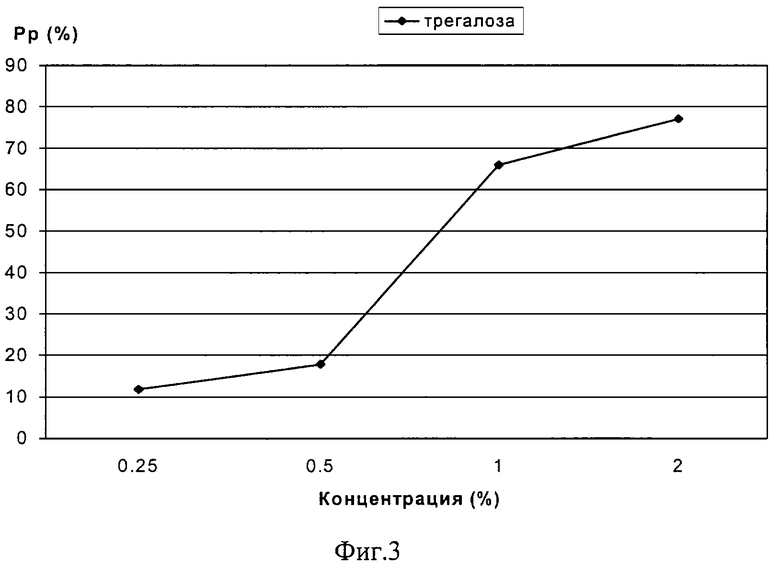
На фиг.3 - график изменения силы протекторного эффекта трегалозы различных концентраций при криоконсервации штамма В 5356 Е.Coli.
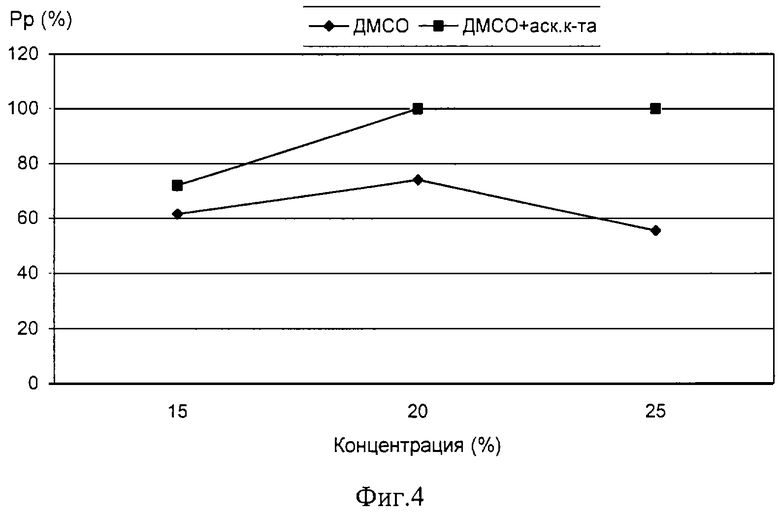
На фиг.4 - график зависимости силы протекторного эффекта ДМСО различных концентраций при внесении в среду для криоконсервации аскорбиновой кислоты.
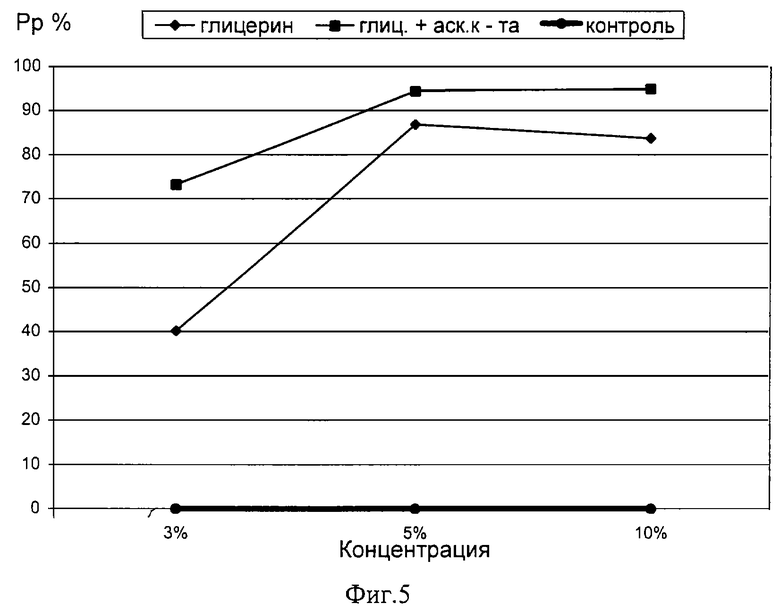
На фиг.5 - график зависимости силы протекторного эффекта глицерина различных концентраций при внесении в среду для криоконсервации аскорбиновой кислоты.
Примеры осуществления способа по варианту I.
Пример 1.
1. Подготовка к выполнению измерений.
Подготовку люминометра и его калибровку проводили в соответствии с инструкцией по эксплуатации.
2. Выполнение анализа.
2.1 Приготовление буфера А (17% NaCl, 25% глюкоза, 1М трис - HCl, PH 7,5).
2.2 Приготовление раствора ДМСО - 15% на основе буфера А.
2.3 Полученный в 2.2 раствор добавляли по 1 мл в опытные пробирки, а в контрольные добавляли 1 мл буфера А.
2.4. Приготовление препарата штамма В 5356 Е.Coli. Для этого штамм В 5356 Е.Coli подращивали в течение 18 ч при 37°С на чашке Петри с полной средой МПА с ампициллином в концентрации 50 мг/л. Затем клетки тестерного штамма смывали с чашки Петри буфером А.
2.5 50 мкл препарата штамма В 5356 Е.Coli добавляли в контрольные и в опытные пробирки.
2.6 Десятиминутная инкубация.
2.7 Пятиминутная заморозка в жидком азоте (-196°С).
2.8 Размораживание на водяной бане (30°С) в течение 30 мин.
2.9 Измерение биолюминесценции на люминометре ЛТ-01.
3 Обработка полученных данных.
3.1 Расчет процента падения свечения по формуле:
Т=(0,847-0,557)/0,847*100=34,25%.
3.2 Расчет силы протекторного эффекта по формуле:
Рр=(92,6-34,25)/92,6*100=63%.
Пример 2. Аналогично примеру 1 использовали 20% раствор ДМСО.
Сила протекторного эффекта составила 74%.
Пример 3. Аналогично примеру 1 использовали 25% раствор ДМСО.
Сила протекторного эффекта составила 55,7%.
Пример 4. Аналогично примеру 1 исследовали силу протекторного эффекта глицерина в концентрации 1%, которая составила 9%.
Пример 5. Аналогично примеру 1 использовали 3% раствор глицерина.
Сила протекторного эффекта составила 47%.
Пример 6. Аналогично примеру 1 использовали 5% раствор глицерина.
Сила протекторного эффекта составила 82,1%.
Пример 7. Аналогично примеру 1 использовали 10% раствор глицерина.
Сила протекторного эффекта составила 85%.
Пример 8. Аналогично примеру 1 использовали 15% раствор глицерина.
Сила протекторного эффекта составила 100%.
Пример 9. Аналогично примеру 1 исследовали силу протекторного эффекта трегалозы в концентрации 0.25%, которая составила 11,8%.
Пример 10. Аналогично примеру 1 использовали 0.5% раствор трегалозы.
Сила протекторного эффекта составила 17,9%.
Пример 11. Аналогично примеру 1 использовали 1% раствор трегалозы.
Сила протекторного эффекта составила 66%.
Пример 12. Аналогично примеру 1 использовали 2% раствор трегалозы.
Сила протекторного эффекта составила 77%.
Как видно из примеров 1-3 и графика на фиг.1, наибольший криопротекторный эффект ДМСО достигается при концентрации 15 и 20%, при дальнейшем повышении концентрации наблюдается резкое снижение протекторного действия и проявление токсичности, которая может быть обусловлена окисленными примесями, в том числе диметилсульфатом /6/.
На фиг.2 сведены результаты опытов в примерах 4-8 криопротекторного эффекта глицерина. Полученные данные показывают, что криопротекторное действие глицерина практически линейно увеличивается с увеличением концентрации и достигает 100% при концентрации глицерина 15%, отметим, что 10-15% концентрации глицерина являются оптимальными для криоконсервации клеток самых разных водных объектов.
На фиг.3 изображена сила протекторного эффекта трегалозы (примеры 9-12), чей протектррный эффект проявляется в значительно меньших, по сравнению с глицерином, концентрациях.
Все исследованные криопротекторы известны, данные, полученные в результате испытаний, совпадают с литературными.
Таким образом, вариант 1 способа позволяет как воспроизводить криопротекторное действие известных криопротекторов, так и оценивать силу протекторного эффекта новых, т.е. решать задачу широкого скрининга потенциальных криопротекторов среди веществ разных классов.
Примеры осуществления способа по варианту II.
Пример 13.
1. Подготовка к выполнению измерений.
Подготовку люминометра и его калибровку проводили в соответствии с инструкцией по эксплуатации.
2. Выполнение анализа.
2.1 Приготовление буфера А (17% NaCl, 25% глюкоза, 1 М трис - НСl, РН 7,5).
2.2 Приготовление раствора аскорбиновой кислоты (10 мкг/мл) на основе буфера А.
2.3 Приготовление растворов ДМСО концентрацией 15% на основе раствора аскорбиновой кислоты.
2.4 Полученный в 2.3 раствор добавляли по 1 мл в опытные пробирки, а в контрольные добавляли 1 мл буфера А.
2.5 Приготовление препарата штамма В 5356 Е.Соli. Для этого штамм В 5356 Е.Соli растили в течение 18 ч при 37°С на чашке Петри с полной средой МПА с ампициллином в концентрации 50 мг/л. Затем клетки тестерного штамма смывали с чашки Петри буфером А.
2.6 Добавление по 50 мкл препарата штамма В 5356 Е.Сoli в контрольные и в опытные пробирки.
2.7 Десятиминутная инкубация проб.
2.8 Пятиминутная заморозка в жидком азоте (-196°С).
2.9 Размораживание на водяной бане (30°С) в течение 30 мин.
2.10 Измерение биолюминесценции на люминометре ЛТ-01.
3. Обработка полученных данных.
3.1 Расчет среднеарифметического значения величины падения свечения.
3.2 Расчет процента падения свечения, Т=25,9%.
3.3 Расчет силы протекторного эффекта Рр проводили аналогично примеру 1, Рр=72%.
Пример 14. Аналогично примеру 13 готовили раствор ДМСО концентрацией 20%.
Сила протекторного эффекта составила 100%.
Пример 15. Аналогично примеру 13 готовили раствор ДМСО концентрацией 25%.
Сила протекторного эффекта составила 100%.
Пример 16. Аналогично примеру 13 готовили раствор глицерина концентрацией 3%.
Сила протекторного эффекта составила 73,22%.
Пример 17. Аналогично примеру 13 готовили раствор глицерина концентрацией 5%.
Сила протекторного эффекта составила 94,5%.
Пример 18. Аналогично примеру 13 готовили раствор глицерина концентрацией 10%.
Сила протекторного эффекта составила 95%.
Как видно из примеров 13-15 и графика на фиг.4, внесение в среду для криоконсервации аскорбиновой кислоты снижает токсическое действие ДМСО и повышает силу протекторного эффекта.
Из графика на фиг.5 и примеров 16-18 видно, что криопротекторный эффект глицерина значительно повышается при криоконсервации в присутствии аскорбиновой кислоты.
Источники информации
1. Маркарян Ш.А., Баграмян К.А., Аракелян В.Б. Мембранный потенциал до и после глубокого замораживания Escherichia coli в присутствии диметилсульфоксида и диэтилсульфоксида // Биофизика, 2002, т.47, вып.2. С.315-317.
2. Odintsova N., Kiselev К., Sanina N., Kostetsky E. Cryopreservation of primary cell cultures of marine invertebratebrates. // Cryo Letters 2001 V.75. N.1 / P.299-310.
3. Каранова М.В., Цветкова Л.И., Петропавлов Н.Н. Криопротекторный эффект низкомолекулярных и высокомолекулярных антифризных гликопротеинов при замораживании спермы среднерусского карпа Cyprinus Widdle-Russia // Биофизика, 1997, т.42, вып.3. С.725-727.
4. Н.Н. Угарова, Л.Ю. Бровко. Биолюминесценция и биолюминесцентный анализ. Методические разработки, МГУ, химфак, 1981, 133 с.
5. Ерохин А.С., Епишина И.М., Чернова И.Е. Новый антиоксидант - криопротектор спермы баранов // Зоотехния, 1994. №10. С.28-29.
6. Hoffmarm G.R. Genetic effects of dimethyl sulfate, diethyl sulfate, and related compounds. // Mutat.Res. 1980 V.75. N.1. P.63-129.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КРИОСОХРАНЕНИЯ КЛЕТОК МОРСКИХ БЕСПОЗВОНОЧНЫХ | 2006 |
|
RU2314687C1 |
| СПОСОБ КРИОСОХРАНЕНИЯ МОРСКИХ МИКРОВОДОРОСЛЕЙ | 2012 |
|
RU2496318C1 |
| СПОСОБ БИОДЕТЕКЦИИ ПОЛИАРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ (ПАУ) | 2000 |
|
RU2198929C2 |
| СПОСОБ ПОЛУЧЕНИЯ КРИОПРОТЕКТОРА ДЛЯ КРИОСРЕД | 2002 |
|
RU2243261C2 |
| Криопротектор для цельной крови при низкотемпературной заморозке | 2024 |
|
RU2837538C1 |
| СРЕДА ДЛЯ КРИОКОНСЕРВАЦИИ СЕМЕНИ БЫКА И СПОСОБ ЕЁ ПРИГОТОВЛЕНИЯ | 2014 |
|
RU2577882C1 |
| СПОСОБ ОБРАБОТКИ СПЕРМЫ, АППАРАТ И СВЯЗАННЫЕ КОМПОЗИЦИИ СРЕД | 2018 |
|
RU2775530C2 |
| СПОСОБ КРИОКОНСЕРВИРОВАНИЯ СПЕРМЫ ОСЕТРОВЫХ РЫБ | 2006 |
|
RU2317703C1 |
| СИНТЕТИЧЕСКАЯ СРЕДА ДЛЯ РАЗБАВЛЕНИЯ И ЗАМОРАЖИВАНИЯ СПЕРМЫ БАРАНОВ | 2000 |
|
RU2198622C2 |
| Защитная среда для криоконсервации спермы осетровых рыб | 2018 |
|
RU2683682C1 |
Изобретение относится к области криобиологии. Предложенный способ подбора криопротекторов предусматривает внесение исследуемых криопротекторов в среду для криоконсервации, содержащую биосенсор, замораживание 5 мин и оттаивание 30 мин. В качестве биосенсора используют рекомбинантный штамм В5356 Е.coli, хранящийся в ВКПМ, несущий плазмиду, содержащую Lux-оперон. В другом варианте, в среду для криоконсервации дополнительно добавляют модификатор - аскорбиновую кислоту, в концентрации 10 мкг/мл. Оценку протекторного эффекта определяют по изменению люминесценции опытных проб по сравнению с контрольными пробами. Предложенные способы позволяют существенно ускорить метод оценки потенциальных криопротекторов. Способы могут быть использованы в технологии криоконсервации биологических образцов. 2 н.п. ф-лы, 5 ил.
| УГАРОВА Н.Н | |||
| и др | |||
| Биолюминесценция и биолюминисцентный анализ | |||
| Методические разработки | |||
| МГУ, химфак | |||
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
| ЕРОХИН А.С | |||
| и др | |||
| Новый антиоксидант - криопротектор спермы баранов | |||
| Зоотехния | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| МАРКАРЯН Ш.А | |||
| и др | |||
| Мембранный потенциал до и после глубокого замораживания Escherichia coli в присутствии диметилсульфоксида и диэтилсульфоксида | |||
| Биофизика | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2004-09-20—Публикация
2002-11-25—Подача