Данное изобретение относится к новому пигменту для корма лососевых, к новому корму, содержащему данный пигмент, и к использованию пигмента.
В корм для выращиваемых в питомнике лосося и форели необходимо добавлять пигмент для получения желательной окраски мягких тканей рыбы. Наиболее часто используемым пигментом является астаксантин, который соответствует пигменту, который доступен в корме лососевых, живущих в дикой природе. Также могут быть использованы и другие пигменты, например, такие как кантаксантин. Такие пигменты обладают очень малой стойкостью по отношению к действию воздуха и температуры, а также света. Поэтому пигменты в большой степени деструктируют в ходе технологической переработки корма и его хранения. Все данные пигменты являются каротиноидами. Данный корм большей частью готовят из сырья, не содержащего значительных количеств астаксантина (то есть белой рыбы). Выращиваемых в питомнике лосося и форель выкармливают промышленно изготовленным кормом, в который добавляют пигмент.
Кроме этого, коммерчески доступные астаксантиновые продукты очень дорого стоят, и их биологическая сохранность очень невелика. Как уже упоминалось выше, астаксантин является довольно нестойким соединением, что, само собой разумеется, является недостатком. Низкая стойкость астаксантина объясняется его окислением. Композицию коммерческих пигментсодержащих продуктов составляют таким образом, чтобы исключить или уменьшить окисление. Одной типичной композицией для астаксантина является композиция с желатином и крахмалом. Однако используемые композиции зачастую не являются оптимальными в том, что касается биологической доступности пигмента, и для промышленной аквакультуры большую экономическую выгоду дал бы новый способ решения проблемы стойкости, обеспечивающий сочетание высокой степени стойкости с улучшенной биологической доступностью. Таким образом, в высшей степени остается желательным более стойкий пигмент, поскольку это сделало бы возможным получение композиции, более оптимальной в отношении биологической доступности, и, следовательно, сделало бы возможной значительную экономическую выгоду.
Таким образом, для промышленной аквакультуры остается желательным выявление более стойких и биологически эффективных пигментов, полезных при производстве корма для лососевых.
Различные виды лососевых различаются по своей способности использования каротиноида, входящего в их рацион. Обнаружено, что радужная форель (Oncorhynchus mykiss) использует пигмент в корме более эффективно, чем атлантический лосось (Salmo salar) и лосось-таймень (S. trutta). Радужная форель также накапливает в мягких тканях более значительные количества каротиноидов по сравнению с атлантическим лососем и лососем-тайменем, но меньшие, чем нерка (Oncorhynchus nerka) (Storebakken, T. and Но, N. К., Aquaculture, vol. 100 (1992), р. 209).
У лосося входящие в его рацион астаксантин и кантаксантин более эффективно отлагаются в мясе, а не в коже, а у радужной форели наблюдается обратная картина (Schiedt, К. et al., Pure & Appl. Chem. 57 (1985) 685-692).
Синтетически полученный астаксантин обычно представлен в неэтерифицированной форме (то есть в виде диола). Предположительно в эту форму пигмент также переходит и в кишечнике перед тем, как он будет усвоен рыбой (О.J. Torrissen et al., Reviews in Aquatic Sciences, vol. 1 (1989), pp. 209-225). В природе астаксантин часто имеет вид сложного диэфира.
В работе Simpson, К.L. and Kamata, Т., Proc. World Symp. on Finfish Nutr. and Fishfeed Technology, Hamburg 20. - 23. June, 1978. Vol II. Berlin 1979, pp. 415 424 изложено исследование пигментации радужной форели путем сравнения астаксантина, сложного эфира астаксантина и астацена. Астаксантин, сложный эфир астаксантина и астацен экстрагировали из коагулята креветок. Пигменты растворяли в жире селедки и добавляли в рацион форели. При анализе рыбы между мышечной тканью и кожей различий обнаружено не было. Рыба, рацион которой содержал сложный эфир астаксантина, отличалась более высокими уровнями полного содержания астаксантина по сравнению с другими. Это свидетельствовало о том, что сложный эфир астаксантина был более эффективен для пигментации радужной форели. Однако на том же самом симпозиуме в работе Torrissen, О. and Brжkkan, О.R. (Proc. World Symp. on Finfish Nutr. and Fishfeed Technology, Hamburg 20. - 23. June, 1978. Vol II. Berlin 1979, pp. 377-282) также продемонстрировано, что в мышечные ткани радужной форели входил и астаксантин. Данные авторы обнаружили, что астаксантин более эффективно внедрялся в мышечные ткани по сравнению со сложными диэфирами и моноэфирами, полученными очисткой из веслоногого ракообразного Calanus finmarchicus.
Согласно работе О.J. Torrissen et al., Reviews in Aquatic Sciences, vol. 1 (1989), pp. 209 225 (то есть: Foss, P. et al., Aquaculture, vol. 65 (1987), р. 293 и Storebakken, T. et al., Aquaculture, vol. 65 (1987), p. 279), по-видимому, синтетический сложный диэфир астаксантина (то есть дипальмитат астаксантина) всасывается труднее по сравнению со свободным астаксантином как в случае радужной форели, так и в случае лосося-тайменя и атлантического лосося.
У ракообразных относительно большая часть астаксантина существует в форме сложного эфира. Однако пигмент легче всасывается по сравнению с тем, что можно было бы ожидать для уровня содержания свободного астаксантина. Это в работе О.J.Torrissen et al., Reviews in Aquatic Sciences, vol. 1 (1989), pp. 209 225 предположительно объяснено наличием у ракообразных других, неидентифицированных соединений, которые могут давать вклад в увеличение эффективности всасывания.
Подытоживая, можно сказать: поскольку предполагается, что всасывание астаксантина в кишечнике рыбы проходит с участием свободного астаксантина (то есть диола), то до сих пор в основном считали, что добавление в корм сложных эфиров будет приводить к меньшим степеням биологического всасывания по сравнению с добавлением в корм свободного астаксантина. Это подтверждено экспериментами с использованием дипальмитата астаксантина.
Известно, что астаксантин, имеющий форму сложного диэфира, более стоек по сравнению со свободным астаксантином (Omara-Alwala, Т.R. et al., J. Agric. Food Chem., vol. 33 (1985), p. 260 и Arai, S. et al., Aquaculture, vol. 66 (1987), p. 255).
В литературе преимущественным исследованным сложным диэфиром является дипальмитат, и о нем сообщается, что он создает меньшую пигментацию по сравнению с диолом (Torrissen, О. and Brжkkan, О. R.; Proc. World Symp. on Finfish Nutr. and Fishfeed Technology, Hamburg 20. - 23. June, 1978. Vol II. Berlin 1979, pp. 377-282, Storebakken, Т. et al., Aquaculture, vol. 65 (1987), p. 279, Foss, P. et al., Aquaculture, vol. 65 (1987), p. 293, Torrissen, 0.J. et al., CRC Crit. Rev. Aqua. Sci., vol. 1 (1989), p. 209). Это объяснено низкой степенью гидролиза сложного диэфира.
Заявители показали, что при использовании коммерческой липазы (Candida rugosa) спустя 42 часа дипальмитат был гидролизован до получения 40% свободного астаксантина. Заявители синтезировали несколько других сложных диэфиров для того, чтобы исследовать, будут ли они гидролизоваться быстрее, чем дипальмитат. Пример 1 демонстрирует, что при одинаковых условиях эксперимента сложный диэфир элаидиновой кислоты (транс - С18:1) гидролизовался до более высокой степени (73%), в то время как сложный диэфир карбоновой кислоты с короткой цепью (С10:0) гидролизовался несколько медленнее, а сложный диэфир, полученный из концентрата жирных омега-3-кислот, содержащих приблизительно 50% ЕРА (все цис-С20:5n3) и приблизительно 35% DHA (все цис-С22:6n3) (в совокупности более, чем 90% жирных омега-3-кислот) (ЕРА + DHA), гидролизовался до свободного астаксантина со скоростью, меньшей половины скорости гидролиза дипальмитата.
Для проверки данных гидролиза, полученных для этих сложных диэфиров астаксантина при использовании коммерческой липазы, был проведен другой похожий эксперимент с использованием фермента, выделенного из кишечника атлантического лосося. К удивлению в эксперименте были получены данные, противоположные данным, полученным в эксперименте, в котором использовали коммерческую липазу; то есть сложный диэфир, полученный с использованием ЕРА + DHA, гидролизовался быстрее всего, а скорость гидролиза диэлаидата и дипальмитата была самая медленная (смотрите пример 2). Таким образом, заявители к большому удивлению обнаружили, что если астаксантин, этерифицированный концентратом жирных полиненасыщенных омега-3-кислот, гидролизовать ферментом из кишечника лосося, то по сравнению с дипальмитатом протекает на удивление быстрый гидролиз с получением свободного астаксантина. К удивлению сложный диэфир карбоновой кислоты с короткой цепью (С10:0) также гидролизовался намного быстрее, чем дипальмитат, даже несмотря на то, что скорость гидролиза была значительно медленнее по сравнению со скоростью гидролиза сложного диэфира, полученного с использованием ЕРА + DHA.
Основываясь на этих неожиданных данных, заявители настоящего изобретения открыли сложный диэфир, полученный из астаксантина и ЕРА + DHA, который с наибольшей вероятностью быстро гидролизуется с получением свободного астаксантина при введении его с кормом лососю, и который, таким образом, эффективен для пигментации лосося. В примере 3 в экспериментах по выкармливанию было продемонстрировано, что данное утверждение верно. Подобным же образом, заявители обнаружили, что сложный диэфир, полученный из астаксантина и карбоновых кислот с короткой цепью, будет пригоден в качестве пигмента с хорошей стойкостью и высоким потенциалом в отношении пигментации лососевых.
Кроме этого, заявителями к удивлению было обнаружено, что сложный диэфир, полученный с использованием ЕРА + DHA, обладает приемлемыми свойствами в отношении стойкости для его использования в промышленно изготавливаемом корме и без создания композиции с желатином или крахмалом (см. пример 3). Это было неожиданно, поскольку полиненасыщенные жирные омега-3-кислоты являются нестойкими соединениями.
В примере 3 пигментация лосося сложным диэфиром, полученным с использованием ЕРА + DHA, была сопоставлена с пигментацией при помощи коммерческого продукта, представляющего собой свободный астаксантин (Carophyll Pink, Roche). Наиболее удивительно то, что было обнаружено, что биологическая доступность согласно измерениям для всасывания астаксантина в филе лосося была на 41% выше у рыбы, в корме которой содержался сложный диэфир, полученный с использованием ЕРА + DHA, по сравнению с рыбой, в корме которой содержался коммерческий пигмент. Таким образом, введение в корм данного сложного диэфира астаксантина позволяет добиться на удивление улучшенного биологического всасывания по сравнению со свободным астаксантином.
Основной целью изобретения является создание пигмента для корма лососевых, который обладал бы большими стойкостью и биологической эффективностью по сравнению со свободным астаксантином и коммерческими пигментами для лососевых.
Еще одной целью данного изобретения является создание пигмента, который можно было бы добавлять в корм в меньших количествах по сравнению с пигментами, известными прежде, и который при этом все еще обеспечивал бы удовлетворительную пигментацию мягких тканей.
Данная и другие цели достигаются в прилагаемой формуле изобретения.
В тексте описания и формуле используется принятое обозначение ЕРА для эйкозапентаеновой кислоты (все цис-С20:5n3) и DHA для докозагексаеновой кислоты (все цис-С22:6n3), что эквивалентно терминам "все цис-5,8,11,14,17-эйкозапентаеновая кислота" и "все цис-4,7,10,13,16,19-докозагексаеновая кислота".
Настоящее изобретение в самом общем плане включает пигмент, такой как сложный диэфир астаксантина с карбоновой кислотой, где карбоновой кислотой является жирная омега-3-кислота и/или карбоновая кислота, содержащая 1 или 3-12 атомов углерода.
Жирная омега-3-кислота а может включать общее количество эйкозапентаеновой кислоты (ЕРА) (все цис-С20:5n3) и/или докозагексаеновой кислоты (DHA) (все цис-С22:6n3) от 18 до 100%. Жирная омега-3-кислота а может включать общее количество эйкозапентаеновой кислоты (ЕРА) (все цис-С20:5n3) и/или докозагексаеновой кислоты (DHA) (все цис-С22:6n3) от 40 до 100%. Жирная омега-3-кислота а может включать эйкозапентаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 8 до 98%. Жирная омега-3-кислота а может включать докозагексаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 8 до 98%. Жирная омега-3-кислота а может включать эйкозапентаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 25 до 98% и/или докозагексаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 15 до 98%. Жирная омега-3-кислота а может включать приблизительно 50% эйкозапентаеновой кислоты (ЕРА) (все цис-С20:5n3) и приблизительно 35% докозагексаеновой кислоты (DHA) (все цис-С22:6n3).
Изобретение также включает корм для лососевых, содержащий 25-70% (масс.) белков, 5-60% (масс.) липидов, 0-40% (масс.) углеводов и пигмент в комбинации с 0-15% (масс.) одного или нескольких дополнительных компонентов, таких как наполнители, связующие, консерванты, витамины и минералы, где пигментом является сложный диэфир астаксантина, полученный с использованием жирной омега-3-кислоты и/или карбоновой кислоты, содержащей 1-12 атомов углерода. Жирная омега-3-кислота а может включать общее количество эйкозапентаеновой кислоты (ЕРА) (все цис-С20:5n3) и/или докозагексаеновой кислоты (DHA) (все цис-С22:6n3) от 18 до 100%. Жирная омега-3-кислота а может включать общее количество эйкозапентаеновой кислоты (ЕРА) (все цис-С20:5n3) и/или докозагексаеновой кислоты (DHA) (все цис-С22:6n3) от 40 до 100%. Жирная омега-3-кислота а может включать эйкозапентаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 8 до 98%. Жирная омега-3-кислота а может включать докозагексаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 8 до 98%. Жирная омега-3-кислота а может включать эйкозапентаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 25 до 98% и/или докозагексаеновую кислоту (ЕРА) (все цис-С20:5n3) в количестве от 15 до 98%. Жирная омега-3-кислота а может включать приблизительно 50% эйкозапентаеновой кислоты (ЕРА) (все цис-С20:5n3) и приблизительно 35% докозагексаеновой кислоты (DHA) (все цис-С22:6n3).
Изобретение также относится к средству для пигментации лососевых, представляющее собой сложный эфир астаксантина, полученный с использованием жирной омега-3-кислоты и/или карбоновой кислоты, содержащей 1-12 атомов углерода. Изобретение также включает в себя пигмент для корма лососевых, представляющий собой сложный эфир астаксантина, полученный с использованием жирной омега-3-кислоты и/или карбоновой кислоты, содержащей 1-12 атомов углерода.
Сложные диэфиры астаксантина получали по общей схеме, предусматривающей стадии I и IIа, как указано ниже. Однако ввиду особенностей хлорпроизводных муравьиной кислоты диэфир астаксантина с муравьиной кислотой получали по схеме IIb. Исходя из этих общих схем получения, любой специалист может модифицировать их с применением традиционных методик и реактивов, тем не менее, находясь в рамках заявленных притязаний настоящего изобретения.
Стадия I:
Кислотный хлорид (или хлориды) соответствующей жирной омега-3-кислоты (или кислот) или С2-С12 карбоновой кислоты (или кислот) был получен путем осторожного добавления оксалилхлорида в количестве 1,2-1,3 молярных эквивалента к перемешиваемому раствору кислоты (кислот) в толуоле (приблизительно 1.3 М на литр) при комнатной температуре. Когда реакция была закончена, что подтверждалось ТСХ, избыток реагента и растворителя удаляли на роторном испарителе. Сырой продукт был очищен перекристаллизацией из раствора дихлорметана.
Стадия IIA:
Эфир астаксантина был получен осторожным добавлением избытка килотного хлорида (или хлоридов) в количестве приблизительно 4 молярных эквивалентов к перемешиваемому раствору астаксантина (3,3’-дигидрокси-β,β’-каротин-4,4’-дион) в пиридине, приблизительно с концентрацией 0,015 мМ/л, при комнатной температуре. По завершении реакции этерификации растворитель удаляли на роторном испарителе. Затем сырой продукт был растворен в дихлорметане и очищен промывкой в системе солевой раствор/этанол перед сушкой и удалением растворителя. (См.: Kienzle, F., Mayer, H.; Helvetica Chimica Acta 61 (1978) 2609).
Стадия IIb:
В случае диформиата астаксантина синтез был выполнен путем добавления избыточного количества (приблизительно 4 молярного эквивалента) муравьиной кислоты к раствору астаксантина (0,06 М/л) в дихлорметане, содержащему DMAP (4-(диметиламино)пиридин, 2,1 эквивалента) и EDC-HCl гидрохлорид (N-(3-диметиламинопропил)-N’-этилкарбодиимида, 2,5 эквивалента). Когда реакция была закончена, остатки прореагировавшего продукта были удалены фильтрованием через силикагель и сырой продукт был выделен выпариванием растворителя. (См.: Halldorsson, A.; Haraldsson, G.G. "Fatty acid selectivity of lipase towards astaxanthin diesters", JAOCS 2003).
Изобретение далее будет проиллюстрировано примерами.
Пример 1.
Сложные диэфиры астаксантина получали для следующих карбоновых кислот: элаидиновая кислота (транс - С18:1), пальмитиновая кислота (С16:0), декановая кислота (С10:0) и концентрат жирных омега-3-кислот, содержащий приблизительно 50% эйкозапентаеновой кислоты (ЕРА) (все цис-С20:5n3) и приблизительно 35% докозагексаеновой кислоты (DHA) (все цис-С22:6n3). Различные сложные диэфиры сначала гидролизовали при помощи коммерческой липазы, Candida rugosa (Lipase AY, 30). В данной реакции после 42 часов при комнатной температуре были получены следующие результаты:

Данные результаты демонстрируют, что сложный диэфир полиненасыщенных жирных кислот гидролизуется медленнее по сравнению с соответствующими сложными диэфирами насыщенных или мононенасыщенных жирных кислот.
На основе данного эксперимента можно сказать, что следствием этерификации с использованием омега-3-концентрата будет более медленный гидролиз с получением свободного астаксантина, и поэтому в данном случае нужно ожидать меньшее биологическое всасывание по сравнению с описанными в литературе экспериментами, когда в корм вводили дипальмитат астаксантина.
Пример 2.
Эксперимент, подобный эксперименту из примера 1, был проведен с использованием ферментов из жидкости из кишечника лосося. Жидкость из кишечника лосося собирали из оболочки, как было описано (Lie, O. et al., Соmр. Biochem. Physiol., 80B (3), (1985), pp. 447-450). После 45 часов при комнатной температуре были получены следующие результаты:
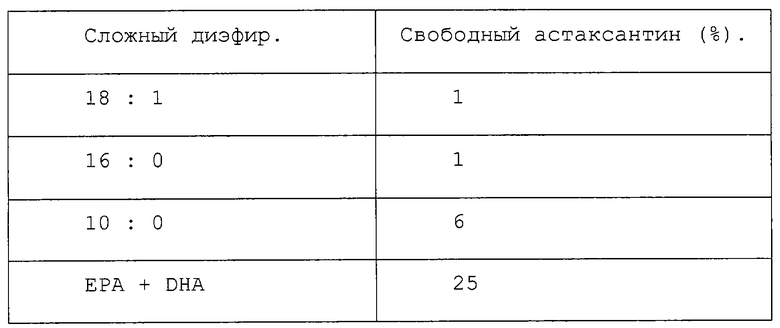
К удивлению, в данном случае для сложного диэфира, полученного с использованием ЕРА + DHA, в сравнении с другими сложными диэфирами была достигнута значительно более высокая конверсия до свободного астаксантина. Диэлаидат и дипальмитат после 45 часов были гидролизованы до уровня только в 1%, в то время как дидеканоат был гидролизован до уровня в 6%, а сложный диэфир, полученный с использованием ЕРА + DHA, был гидролизован до уровня в 25%. Данные результаты, будучи противоположными результатам из примера 1, в высшей степени неожиданны. В данном случае продемонстрировано, что более высокая степень биологического всасывания по сравнению с тем, что было достигнуто в эксперименте со сложными диэфирами астаксантина, который был описан в литературе, возможно будет получена при введении в корм сложного диэфира астаксантина, полученного либо с использованием концентрата жирных омега-3-кислот, либо с использованием карбоновой кислоты с короткой цепью.
Пример 3.
Сложный диэфир, полученный из ЕРА/DHA и астаксантина, (ACD) из примеров 1 и 2 (30 мг/кг в расчете на свободный (то есть неэтерифицированный) астаксантин) добавляли в гранулят при производстве на опытной установке корма для рыб. Во время экструдирования добавляли мочевину (2% (масс.) по отношению к рыбьему жиру) вместе с водой. Добавление пигмента и жира/масла проводили путем нанесения покрытия в вакууме на экструдированный гранулят. Сложный диэфир, полученный с использованием ЕРА + DHA, добавляли вместе с рыбьим жиром. В рыбий жир добавляли 200 мг/кг аскорбиновой кислоты. После изготовления в грануляте было установлено средневзвешенное значение, равное 18,4 мг/кг (18,1 мг/кг в виде сложного диэфира и приблизительно 0,3 мг/кг в виде гидролизованного сложного эфира). Это свидетельствует о том, что сложный диэфир, полученный с использованием ЕРА + DHA, выдерживает условия производственного процесса в степени, достаточной для того, чтобы его можно было использовать при практическом выкармливании рыбы. Было изготовлено несколько партий данных кормовых композиций. Подробные аналитические данные даны в расчете, приведенном ниже.
Тем же самым способом, что и описанный выше, в корм для рыб добавляли коммерческий астаксантин (Carophyll Pink, Roche, 30 мг/кг в расчете на свободный астаксантин). В данном коммерческом продукте неэтерифицированный астаксантин тонко диспергируют в матрице из желатина и углеводов с покрытием из крахмала. В качестве антиоксидантов добавляют этоксиквин и аскорбилпальмитат. Способ и сырье, в том числе и добавление мочевины, были идентичны тому, что было описано выше, за исключением того, что рыбий жир не содержал аскорбиновой кислоты. После изготовления в грануляте было установлено средневзвешенное значение количества свободного астаксантина, равное 25,0 мг/кг. Было изготовлено несколько партий данных кормовых композиций. Подробные аналитические данные даны в расчете, приведенном ниже.
Две кормовые композиции были даны лососю. Первоначально средняя масса рыбы была равна 70 г. В расчеты, которые приведены ниже, мы не включаем содержание пигмента в рыбе до того, как началось выкармливание. Данные величины были идентичны для обеих групп, и их численные значения настолько малы, что они не будут оказывать влияния на сделанные выводы.
Спустя 8 месяцев средняя масса 20 рыб из каждой группы была равна 1180 г для рыбы, выкармливаемой с использованием сложного диэфира астаксантина, и 1153 г для рыбы, выкармливаемой с использованием коммерческого пигмента. Среднее содержание астаксантина в филе рыбы составляло 3,34 мг/г для рыбы, выкармливаемой с использованием сложного диэфира, и 3,23 мг/г для рыбы, выкармливаемой с использованием коммерческого пигмента. Если мы предположим, что массу рыбы на 70% образуют мышцы, мы получим следующие средние значения для содержания астаксантина:
Рыба, выкармливаемая с использованием сложного диэфира астаксантина: 1,180 кг/рыба × 0,70 × 3,34 мг/кг = 2,76 мг.
Рыба, выкармливаемая с использованием коммерческого астаксантина: 1,153 кг/рыба × 0,70 × 3,23 мг/кг = 2,61 мг.
Рыба, выкармливаемая с использованием сложного диэфира астаксантина, получала следующий корм:
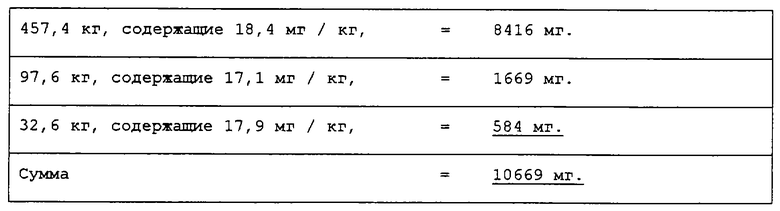
При делении на среднее количество рыбы в ходе исследования получается, что каждая рыба получила:

Это соответствует биологической доступности 100%×2,76 мг/14,00 мг = 19,7%.
Рыба, выкармливаемая с использованием коммерческого астаксантина, получила следующий корм:

При делении на среднее количество рыбы в ходе исследования получается, что каждая рыба получила:

Это соответствует биологической доступности 100×2,61/20,13=13,0%.
Таким образом, выкармливание с использованием ACD приводит к на удивление улучшенному биологическому всасыванию по сравнению со свободным астаксантином.
Примеры 4 и 5.
Выделение сырых ферментных смесей из кишечника лосося и форели.
Буферный раствор триса (0,25 М) получали в результате растворения триса (4,54 г; 37,5 ммоль) в 150 мл дистиллированной воды. рН буферного раствора доводили до 8,0, добавляя 2 М хлористоводородную кислоту. Весь гидролиз проводили при комнатной температуре, таким образом, никаких специальных усилий не требовалось.
Проводили точное отвешивание в колбу Эрленмейера объемом 100 мл сложного диэфира астаксантина (~40 мг, 33 ммоль) вместе с 2,5 г эмульгатора chremophor EL (от компании BASF). Раствор интенсивно перемешивали в течение 20 минут (до достижения гомогенности) и после этого добавляли 20 мл буфера триса, а перемешивание проводили еще в течение 10 минут. Раствор отфильтровывали на вакуум-фильтре, после этого красный фильтрат выливали в мерную колбу объемом 25 мл и разводили буфером, доводя уровень до метки. Концентрацию всех растворов спектрофотометрически (492 нм) определили равной приблизительно 1 мг/мл за исключением диацетата, который был получен с меньшей концентрацией. Все растворы хранили в холодильнике завернутыми в алюминиевую бумагу.
Выделение сырой ферментной смеси.
Из местных рыбных хозяйств были получены свежие лосось и радужная форель, корм которым давали в течение последних 12 часов. В лаборатории свежую рыбу разрезали и сырую ферментную смесь экстрагировали следующим образом: от пищеварительного тракта идет много узких трубок, окруженных жировой тканью. Каждую из них отрезали, вынимали руками и переносили в охлажденный контейнер. Вязкий раствор (~50 мл) разводили до 100 мл, используя 0,25 М буфер триса, и перемешивали в течение 30 минут на ледяной бане. Следующим этапом было центрифугирование при 11000 оборотах в минуту в течение 20 минут при 4°С (RC5C от компании Du Pont). Водный слой переносили пипеткой в стеклянные емкости в другой центрифуге и центрифугирование продолжали при 18000 оборотах в минуту в течение 30 минут при 4°С. Водный слой переносили в колбу Эрленмейера и быстро замораживали жидким азотом. Перед началом реакции проводили оттаивание смеси и ее очистку ультрацентрифугированием при 27000 оборотах в минуту в течение 45 минут при 4°С (157000 g в верхней части). Препарат липазы был получен в виде прозрачного желтого раствора.
Гидролиз.
В круглодонную колбу объемом 10 мл добавили 2 мл основного раствора и 3 мл сырой ферментной смеси из кишечника рыбы. Перед тем как колбу закрыть, ее заполняли азотом, затем ее заворачивали в алюминиевую бумагу и проводили перемешивание в течение 48 часов. По окончании всю воду удаляли при пониженном давлении (0,01 торр) и проводили повторное растворение в CH2Cl2. Раствор отфильтровывали через тампон из медицинской ваты и хранили в атмосфере азота в закрытом контейнере. Для мониторинга прохождения реакции применяли аналитическую ТСХ с использованием в качестве элюента 5%-ного ацетона в CH2Cl2 (диол (Rf=0,0-0,1), сложный моноэфир (Rf=0,3-0,5), сложный диэфир (Rf=0,8-0,9)). Для определения степени гидролиза все образцы вводили в аналитическую ВЭЖХ. [Элюент: 30%-ный ацетон в н-гексане. Колонка: колонка Nucleosil 50-5 (2×30 см). Скорость потока: 0,15 мл/мин. Детектор: 470 нм (диол, Rf=0,4-0,5, сложный моноэфир, Rf=0,7, сложный диэфир, Rf=0,9-1,0)].
Пример 4.
Эксперимент, подобный эксперименту из примера 2, провели с использованием ферментов из жидкости из кишечника лосося.
Сложные диэфиры, которые гидролизовали, получали в результате этерификации астаксантина следующими карбоновыми кислотами:
Уксусная кислота, С16:0 (пальмитиновая кислота), жирные кислоты из рыбьего жира, обогащенного жирными омега-3-кислотами (приблизительно 18% ЕРА и 12% DHA, в приведенных ниже таблицах данный реагент называется К30), концентрат жирных омега-3-кислот (приблизительно 30% ЕРА и 20% DHA, в приведенных ниже таблицах данный реагент называется К55), тот же самый концентрат ЕРА и DHA, что и использованный в примере 2 (приблизительно 50% ЕРА и 35% DHA, в приведенных ниже таблицах данный реагент называется ACD), очищенная ЕРА (более чем 95% ЕРА, в таблицах данный реагент называется ЕРА) и очищенная DHA (более чем 90% DHA, в таблицах данный реагент называется DHA).
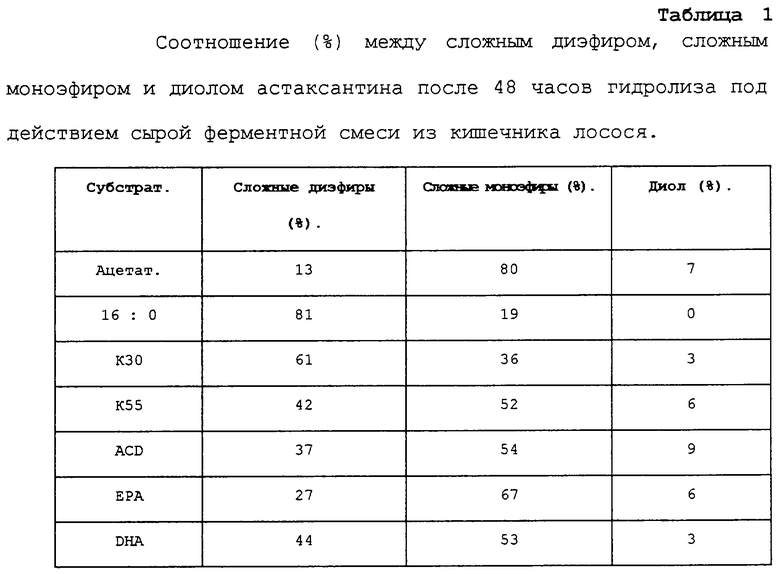
Таблица 1 демонстрирует степень гидролиза после 48 часов гидролиза под действием сырой ферментной смеси из кишечника лосося.
После 48 часов сложный диэфир, полученный из астаксантина и пальмитиновой кислоты (16:0), не давал свободного астаксантина. Однако из предшествующего уровня техники известно, что данный сложный диэфир в лососе гидролизуется и обеспечивает увеличение уровня содержания пигмента в рыбе. Таким образом, данный результат свидетельствует о том, что сырой ферментный препарат не находится в оптимальном состоянии, предположительно вследствие присутствия протеаз, под действием которых требуемые ферменты могут деструктировать.
Все другие сложные диэфиры жирных омега-3-кислот или карбоновой кислоты с короткой цепью (ацетат) характеризуются более эффективным гидролизом сложного диэфира с получением диола в сравнении со сложным диэфиром, полученным из астаксантина и пальмитиновой кислоты, и поэтому ожидается, что следствием их использования будет более эффективное всасывание пигмента в рыбе.
Самая высокая степень гидролиза наблюдалась для сложного диэфира ACD (9%). Относительное количество свободного астаксантина было в три раза выше количества свободного астаксантина из сложного диэфира из менее концентрированного рыбьего жира (К30). Результаты дополнительно свидетельствуют о том, что сложный диэфир очищенной ЕРА гидролизуется быстрее, чем сложный диэфир DHA. Однако, к удивлению, концентрат ЕРА и DHA, называемый ACD, гидролизуется быстрее, чем очищенная ЕРА. Сложный диэфир уксусной кислоты гидролизуется до получения 7% свободного астаксантина. Однако необходимо отметить, что для данного соединения только 13% остается в виде сложного диэфира тогда, когда реакция будет завершена. Это намного ниже, чем у других продуктов, которые были протестированы, и это свидетельствует о том, что, если время реакции было бы увеличено, из данного сложного диэфира было бы получено большое количество свободного астаксантина. Подобным же образом непрореагировавшим остается только 27% сложного диэфира, полученного с использованием ЕРА. Соответственно в условиях живого организма ожидается, что сложные диэфиры могут обнаруживать даже еще более высокую относительную степень гидролиза до свободного астаксантина по сравнению с тем, что демонстрируется в таблице 1.
Пример 5.
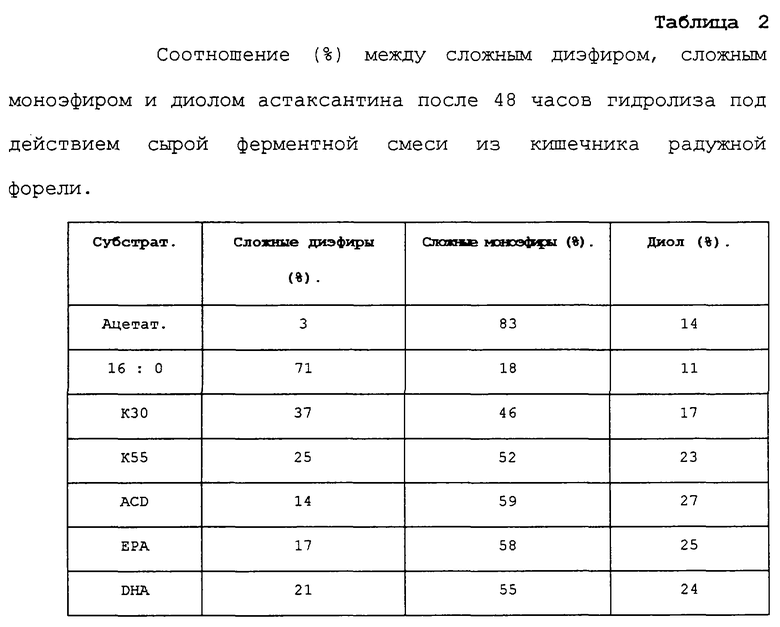
Был выполнен пример, подобный примеру 2b. Однако для данного примера использовали сырой ферментный препарат из радужной форели (Oncorhynchus mykiss). Результаты приведены в таблице 2. Таблица 2 демонстрирует, что после 48 часов непрореагировавшим остался 71% сложного диэфира пальмитиновой кислоты. Для рыбьего жира не прореагировало 37% в то время, как для ACD непрореагировавшими остались только 14%. Что касается лосося, то заявители наблюдали, что ЕРА реагирует быстрее, чем DHA (17 и 21% не прореагировало), однако для радужной форели заявители наблюдали что омега-3-концентрат, подобный сложному диэфиру ACD, приводит к более высокой степени гидролиза по сравнению со сложным диэфиром очищенной ЕРА. Остаются только очень небольшие количества сложного диэфира уксусной кислоты (3%), свидетельствуя о том, что сложный диэфир, полученный из астаксантина и карбоновой кислоты с короткой цепью, будет отличаться очень быстрым гидролизом в кишечнике рыбы.
Данные результаты подтверждаются при взгляде на относительные количества свободного астаксантина в таблице 2. Здесь ACD характеризуется самыми высокими результатами с 27% свободного астаксантина по сравнению только с 11% для сложного диэфира пальмитиновой кислоты.
Результаты в приведенных ниже таблицах 1 и 2 подтверждают заключения о том, что сложный диэфир, полученный из астаксантина и концентрата омега-3-кислот, или сложный диэфир, полученный из астаксантина и короткоцепных карбоновых кислот, будут приводить к более эффективному биологическому всасыванию у выращиваемой в питомнике рыбы по сравнению с экспериментами со сложными диэфирами астаксантина, которые были описаны в литературе.
Концентрат жирных омега-3-кислот, содержащий приблизительно 50% эйкозапентаеновой кислоты (ЕРА) и приблизительно 35% докозагексаеновой кислоты (DHA) (в совокупности более чем 90% жирных омега-3-кислот), который был использован в примере 3 для получения сложного диэфира астаксантина, представляет собой только один пример, и он не должен рассматриваться в качестве ограничения для изобретения. Специалист в соответствующей области поймет, что для получения сложного диэфира астаксантина могут быть использованы и другие концентраты жирных омега-3-кислот, например концентраты, содержащие менее чем 90% жирных омега-3-кислот, и результаты будут получены подобными результатам, показанным в примерах. Сложные диэфиры астаксантина, этерифицированные карбоновыми кислотами из масел из морепродуктов, содержащих карбоновые омега-3-кислоты, или полученные из концентратов жирных омега-3-кислот с полным уровнем содержания ЕРА и DHA в диапазоне от 18 до 100%, предпочтительно от 40 до 100%, также входят в объем данного изобретения. Более точно, сложные диэфиры астаксантина, полученные из концентратов жирных омега-3-кислот с уровнем содержания ЕРА в диапазоне от 8 до 98%, предпочтительно от 25 до 98%, и с уровнем содержания DHA в диапазоне от 8 до 98%, предпочтительно от 15 до 98%, также входят в объем данного изобретения.
Пример 2 демонстрирует, что сложный диэфир карбоновой кислоты с короткой цепью под действием ферментов из кишечника лосося также претерпевает более быстрый гидролиз с получением свободного астаксантина по сравнению со сложным диэфиром пальмитиновой кислоты. Таким образом, такой сложный диэфир в сравнении с коммерческими композициями пигмента также будет пригоден в качестве пигмента с высокой стойкостью и повышенным биологическим всасыванием. В примере 2 была использована декановая кислота. Другими карбоновыми кислотами с карбоновой цепью будут карбоновые кислоты с длиной цепи С1-С12. Для специалиста в соответствующей области очевидно, что данные кислоты могут быть как насыщенными, так и ненасыщенными.
Кроме этого, специалист в соответствующей области поймет, что изобретенному сложному диэфиру астаксантина стойкость может быть придана точно таким же способом, что и коммерческим астаксантиновым пигментам, то есть за счет использования желатиновой матрицы. Количество желатиновой матрицы по отношению к количеству пигмента может быть меньше для изобретенного пигмента по сравнению с тем, что требуется для придания стойкости коммерческим пигментам. В альтернативном варианте или дополнительно стойкость изобретенному пигменту может быть придана за счет использования антиоксидантов и/или мочевины, как это описывается в норвежской патентной заявке заявителей №19983050.
Для специалиста в соответствующей области очевидно, что сложный диэфир, полученный из жирной кислоты и астаксантина, растворим в жире в большей степени, чем свободный астаксантин. Само собой разумеется, в этом заключается преимущество настоящего изобретения, потому что пигмент будет легче вводиться в композицию корма для рыб, которая обогащена жирами.
Астаксантин может быть получен из микробиологических источников. Типичными примерами перспективных микробиологических источников астаксантина являются дрожжи Phalli rhodozyma и водоросль Haematococcus pluvialis. В Phalli rhodozyma астаксантин содержится в свободной форме, в то время как в Haematococcus pluvialis астаксантин присутствует в основном (87%) в виде сложных диэфиров (Johnson, E.A. and An, G-Н. 1991. Astaxanthin from microbial sources. Crit. Rev. Blotechnol. 11 (4): 297). Для специалиста в соответствующей области очевидно, что на основе настоящего изобретения может быть достигнута повышенная биологическая доступность сложного диэфира астаксантина из микробиологических источников в результате выбора штамма микроба и/или в результате введения в корм подходящих жирных кислот или предшественников таких жирных кислот или в результате выбора других подходящих условий ферментации таким образом, чтобы сложный диэфир астаксантина, который будет получен, содержал бы жирные омега-3-кислоты и/или карбоновые кислоты с короткой цепью.
Данное изобретение относится к новому пигменту для корма лососевых, к новому корму, содержащему данный пигмент, и к использованию данного пигмента. Пигмент содержит сложный диэфир астаксантина, полученный с использованием жирной омега-3-кислоты и/или карбоновой кислоты с короткой цепью. Данное изобретение предлагает пигмент для корма лососевых, который более стоек и биологически более эффективен по сравнению со свободным астаксантином и коммерчески доступными астаксантиновыми продуктами. 4 н. и 10 з.п. ф-лы, 2 табл.
| THE MERK INDEX | |||
| МУЗЫКАЛЬНЫЙ ПРИБОР С КАТОДНЫМИ ЛАМПАМИ | 1921 |
|
SU890A1 |
| Шланговое соединение | 0 |
|
SU88A1 |
| WO 9612415 A1, 02.05.1996 | |||
| EP 0322114 A2, 28.06.1989 | |||
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ПРОДУКТОВ ИЗ ГОЛОТУРИИ | 1995 |
|
RU2112527C1 |
| СПОСОБ ПЕРЕРАБОТКИ АСТАКСАНТИНСОДЕРЖАЩЕГО СЫРЬЯ С ИЗВЛЕЧЕНИЕМ АСТАКСАНТИНА И РОДСТВЕННЫХ ЕМУ КАРОТИНОИДОВ | 1989 |
|
RU2050388C1 |
Авторы
Даты
2004-09-27—Публикация
2000-04-17—Подача