Изобретение относится к новым производным 5’-дезоксипитидина и к содержащим их фармацевтическим композициям, способствующим избирательной доставке 5-фторурацила к тканям опухоли.
В частности, настоящее изобретение относится к новым производным 5’-дезоксицитидина общей формулы (I),
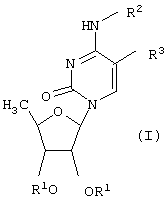
где R1 обозначает атом водорода или группу, которая легко гидролизуется в физиологических средах; R2 обозначает атом водорода или группу -CO-OR4, где R4 обозначает насыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от одного до пятнадцати атомов углерода, или группу формулы -(СН2)n-Y, где Y обозначает циклогексил или фенил, а n равно целому числу от 0 до 4; R3 обозначает атом водорода, брома, йода, цианогруппу, С1-С4алкильную группу, которая может быть замещена атомом(ами) галогена, винильную или этинильную группу, которая может быть замещена атомом(ами) галогена, С1-С4алкилом; при условии, что R2 и R3 не могут одновременно обозначать атом водорода.
Хотя 5-фторурацил (5-ФУ) или его производные пригодны для применения в качестве противоопухолевых агентов в клинической практике, предназначенных для лечения различных плотных опухолей, однако они в целом еще не обладают удовлетворительными характеристиками касательно эффективности и безопасности. Эти недостатки в основном являются результатом быстрой инактивации 5-ФУ дигидропиримидин-дегидрогеназой (ДПД) и/или неудовлетворительной доставкой 5-ФУ к тканям опухоли с точки зрения избирательной доставки к опухоли. Ранее уже предпринимались попытки усилить противоопухолевую активность 5-ФУ или его производных путем ингибирования ДПД, например, путем совместного введения 5-ФУ или его производного с ингибитором ДПД, таким как урацил [патент США 4328229], 5-этинилурапил [WO 92/04901], 5-хлор-2,4-дигидроксипиридин [патент США 5525603] и т.д. Такое совместное введение приводило к усилению противоопухолевой активности 5-ФУ или его производных, однако характеристики безопасности при этом не улучшались вследствие неудовлетворительной избирательности доставки ингибитора ДПД к тканям опухолей (в результате чего уровень 5-ФУ повышался как в опухоли, так и в плазме).
В отличие от этого в соответствии с настоящим изобретеним было установлено, что совместное введение нового производного 5’-дезоксицитидина общей формулы (I) и 5-ФУ или его производного приводит к значительному улучшению избирательной доставки 5-ФУ к тканям опухоли по сравнению с комбинацией 5-ФУ или его производного с известными ингибиторами ДПД, такими, как 5-этинилурацил, и приводит к значительному улучшению противоопухолевой активности на моделях ксенотрансплантата рака человека.
Ниже приведено более подробное определение соответствующих групп общей формулы (I).
Определение R1
R1 обозначает атом водорода или группу, которая легко гидролизуется в физиологической среде.
В приведенном выше определении понятие "группа, которая легко гидролизуется в физиологической среде" предпочтительно обозначает ацетил, пропионил, бензоил, толуоил, глицил, аланил, β-аланил, валил, лизил и т.п.
Определение R2
R2 обозначает атом водорода или группу -CO-OR4, где R4 обозначает насыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от одного до пятнадцати атомов углерода, или группу формулы -(CH2)n-Y, где Y обозначает циклогексил или фенил, а n равно целому числу от 0 до 4.
В приведенном выше определении понятие "насыщенная" углеводородная группа с прямой или разветвленной цепью, содержащая от одного до пятнадцати атомов углерода" предпочтительно обозначает метил, этил, н-пропил, 1-изопропил-2-метилпропил, 1,1,2-триметилпропил, н-бутил, изобутил, 2-этилбутил, 3,3-диметилбутил, н-пентил, изопентил, неопентил, 2-пропилпентил, н-гексил, 2-этилгексил, н-гептил, н-октил т.п.
Понятие "группа формулы -(СН2)n-Y, где Y обозначает циклогексил или фенил; n равно целому числу от 0 до 4" обозначает циклогексил, циклогексил-метил, 2-циклогексилэтил, 3-циклогексилпропил, 4-циклогексилбутил, фенил, бензил, фенетил, 3-фенилпропил, 4-фенилбутил и т.п. В наиболее предпочтительном варианте в соединениях по настоящему изобретению R4 обозначает н-пропил, н-бутил, н-пентил, изопентил, неопентил, н-гексил, 3,3-диметилбутил, 2-этилбутил, фенилэтил и циклогексилметил.
Определение R3
R3 обозначает атом водорода, брома, йода, цианогруппу, С1-С4алкильную группу, которая может быть замещена атомом(ами) галогена, винильную или этинильную группу, которая может быть замещена атомом(ами) галогена, C1-С4алкилом, при условии, что R2 и R3 не могут одновременно обозначать атом водорода.
В приведенном выше определении понятие "С1-С4алкильная группа, которая может быть замещена атомом(ами) галогена" предпочтительно обозначает метил, трифторметил, этил, пропил и т.п.
Понятие "винильная или этинильная группа [которая может быть замещена атомом(ами) галогена, С1-С4алкилом, циклоалкилом, аралкилом или ароматическим кольцом, которое может иметь один или более гетероатом(ов)]" предпочтительно обозначает винил, 1-хлорвинил, 2-бромвинил, 2-бром-1-хлорвинил, этинил, проп-1-инил, бут-1-инил, пент-1-инил, гекс-1-инил, 3,3-диметилбут-1-инил, циклопентилэтинил, циклогексилэтинил, фенилэтинил, 3-фенилпроп-1-инил, пирид-2-илэтинил, имидазол-2-илэтинил и т.п. Наиболее предпочтительной группой является этинил и йод.
Предпочтительными производными 5’-дезоксицитидина по настоящему изобретению являются
5’-дезокси-5-этинилцитидин,
5’-дезокси-5-проп-1-инилцитидин,
5-бут-1-инил-5’-дезоксицитидин,
5’-дезокси-5-пент-1-инилцитидин,
5’-дезокси-5-гекс-1-инилцитидин,
5’-дезокси-5-йодцитидин,
5-бром-5’-дезоксицитидин,
5-(1-хлорвинил)–5’-дезоксицитидин,
5’-дезокси-5-винилцитидин,
5’-дезокси-5-трифторметилцитидин,
5-(3-бензилоксибензил)-5’-дезоксицитидин,
5-циан-5’-дезоксицитидин,
5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-N4-(н-пентилоксикарбонил)-5-проп-1-илцитидин,
5-бyт-l-инил-5’-дeзoкcи-N4-(н-пeнтилoкcикapбoнил)цитидин,
5’-дезокси-5-пент-1-инил-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-гекс-1-инил-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-йод-N4-(н-пентилоксикарбонил)цитидин,
5-бром-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5-(1-хлорвинил)-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
N4-(этоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-N4-(н-пропоксикарбонил)-5-винилцитидин,
N4-(н-бутоксиоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-N4-(н-пентилоксиксикарбонил)-5-винилцитидин,
N4-(бензилоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-N4-(н-пентилоксиксикарбонил)-5-трифторметилцитидин,
5-(3-бензилоксибензил)-5’-дезокси-N4-(н-пентилоксиксикарбонил)цитидин,
5-циан-5’-дезокси-N4-(н-пентилоксиксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-(метоксикарбонил)цитидин,
5’-дезокси-N4-(этоксикарбонил)-5-этинилцитидин,
5’-дезокси-5-этинил-N4-(н-пропоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-(изопропоксикарбонил)цитидин,
N4-(н-бутоксикарбонил)-5’-дезокси-5-этинилцитидин,
5’-дезокси-5-этинил-N4-(изобутоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-[(2-пропилпентилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-(изопентилоксикарбонил)цитидин,
5’-дeзoкcи-5-этинил-N4-[(2-метилпентилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-[(3-метилпентилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-(н-гексилоксикарбонил)цитидин,
5’-дезокси-N4-[(2-этилбутил)оксикарбонил]-5-этинилцитидин,
5’-дезокси-N4-[(2-этилгексил)оксикарбонил]-5-этинилцитидин,
5’-дезокси-5-этинил-N4-[(2-фенилэтокси)карбонил]цитидин,
N4-(циклогексилоксикарбонил)-5’-дезокси-5-этинилцитидин,
N4-[(циклогексилметокси)карбонил]-5’-дезокси-5-этинилцитидин,
5’-дeзoкcи-5-этинил-N4-(нeoпeнтилoкcикapбoнил)цитидин,
5’-дезокси-N4-[(3,3-диметилбутокси)карбонил]-5-этинилцитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-этинил-N4-(н-пропоксикарбонил)цитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-винилцитидин,
2’,3’-ди-О-ацетил-N4-(этоксикарбонил)-5’-дезокси-5-винилцитидин,
2’,3’-ди-О-ацетил-5’-дезокси-N4-(н-пропоксикарбонил)-5-винилцитидин,
2’,3’-ди-О-ацетил-N4-(н-бутоксикарбонил)-5’-дезокси-5-винилцитидин,
2’,3’-ди-О-ацетил-5’-дезокси-N4-(н-пентилоксикарбонил)-5-винилцитидин,
2’,3’-ди-О-ацетил-N4-(бензилоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-5-этинил-N4-(н-децилоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-[(2,6-диметилциклогексилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-(бензилоксикарбонил)цитидин,
5’-дeзoкcи-5-этинил-N4-[(1-изопропил-2-метилпропокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-[(3-метоксибензилокси)карбонил]цитидин.
Новые производные 5’-дезоксицитидина формулы (I) могут быть получены в соответствии со следующими способами. В приведенных ниже способах А-Е Р1 обозначает гидроксизащитную группу, такую как ацетил, бензоил, триметилсилил, трет-бутилдиметилсилил и т.п.
Способ А
Соединения формулы (I), где R1, R2 и R3 имеют указанные выше значения, могут быть получены взаимодействием соединения формулы (II)
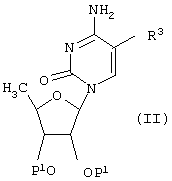
[где Р1 обозначает гидроксизащитную группу и R3 имеет указанное выше значение], с соединением общей формулы (III)
R4OCOX (III)
[где R4 имеет указанное выше значение; Х обозначает хлор или бром] в присутствии акцептора кислоты и при необходимости с последующим удалением защитной(ых) группы.
Способ Б
Соединения формулы (I), где R1 и R2 имеют указанные выше значения, а R3 обозначает этинильную или винильную группу [которая может быть замещена атомом (ами) галогена, С1-С4алкилом, циклоалкилом, аралкилом или ароматическим кольцом, которое может иметь один или более гетероатом(ов)], могут быть также получены взаимодействием соединения формулы (IV)
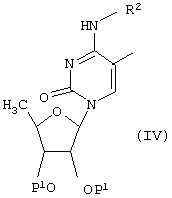
[где Р1 и R2 имеют указанные выше значения],
с ацетиленовым или винильным производным в присутствии палладия в качестве катализатора при необходимости с последующим удалением защитной(ых) группы.
Способ В
Соединения формулы (I), где R1 и R2 имеют указанные выше значения, а R3обозначает цианогруппу, могут быть получены взаимодействием соединения формулы (IV)
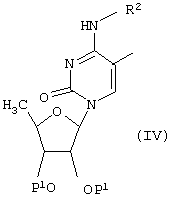
[где Р1 и R имеют указанные выше значение],
с цианидом щелочного металла и при необходимости с последующим удалением защитной(ых) группы.
Способ Г
Соединения формулы (I), где R1 и R3 имеют указанные выше значения, а R2 обозначает атом водорода, могут быть получены взаимодействием соединения формулы (V)
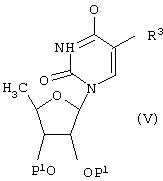
[где Р1 и R3 имеют указанные выше значения],
с фосфорилхлоридом в присутствии акцептора кислоты с последующей обработкой аммиаком и при необходимости с последующим удалением защитной (ых) группы.
Способ Д
Соединения формулы (I), где R1, R2 и R3 имеют указанные выше значения, также могут быть получены сочетанием соединения формулы (VI)
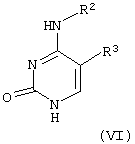
[где R2 и R3 имеют указанные выше значение], с соединением формулы (VII)
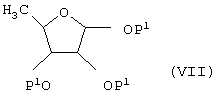
[где Р1 имеет указанное выше значение] в присутствии кислоты Льюиса в качестве катализатора и при необходимости с последующим удалением защитной(ых) группы.
Способ Е
Соединения формулы (I), где R3 обозначает винильный радикал [который может быть замещен атомом(ами) галогена, C1-С4алкилом, циклоалкилом, аралкилом или ароматическим кольцом, которое может иметь один или более гетер оатом(ов)], а R1 и R2 имеют указанные выше значения, также могут быть получены каталитическим гидрированием соединения формулы (VIII)
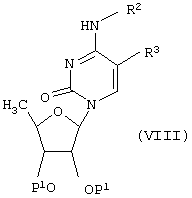
[где Р1 обозначает гидроксизащитный радикал, R3 обозначает этинильный радикал (который может быть замещен атомом(ами) галогена, С1-С4алкилом, циклоалкилом, аралкилом или ароматическим кольцом, которое может иметь один или более гетероатом(ов)) и R2 имеет указанное выше значение] с катализатором Линдлара и при необходимости с последующим удалением защитного (ых) радикала(ов).
Ниже более подробно описан способ получения новых производных 5’-дезоксицитидина формулы (I) согласно настоящему изобретению.
Способ А
Конкретные примеры соединений формулы (II) включают:
2’,3’-ди-О-ацетил-5’-дезокси-5-этинилцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилцитидин,
2’,3’-ди-O-ацетил-5’-дезокси-5-проп-1-инилцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-проп-l-инилцитидин,
2’,3’-ди-O-ацетил-5-бут-1-инил-5’-дезоксицитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-бут-1-инил-5’-дезоксицитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-пент-1-инилцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-пент-1-инилцитидин,
2’,3’-ди-O-ацетил-5’-дезокси-5-гекс-1-инилцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-гекс-1-инилцитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-йодцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йодцитидин,
2’,3’-ди-O-ацетил-5-бром-5’-дезоксицитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-бром-5’-дезоксицитидин,
2’,3’-ди-О-ацетил-5-(1-хлорвинил)-5’-дезоксицитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-(1-хлорвинил)-5’-дезоксицитидин,
2’,3’-ди-O-ацетил-5’-дезокси-5-винилцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-винилцитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-трифторметилцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-трифторметилцитидин,
2’,3’-ди-О-ацетил-5-(3-бензилоксибензил)-5’-дезоксицитидин,
5-(3-бензилоксибензил)-2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезоксицитидин,
2’,3’-ди-O-ацетил-5-циан-5’-дезоксицитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-циан-5’-дезоксицитидин и т.п.
Реакция между приведенным выше соединением общей формулы (II) и приведенным выше соединением общей формулы (III) может быть проведена в растворителе, таком как пиридин, диоксан, тетрагидрофуран, ацетонитрил, хлороформ, дихлорметан и т.п., в присутствии акцептора кислоты, такого как триэтиламин, пиридин, пиколин, 4-(N,N-диметиламино)пиридин, лутидин и т.п. Реакция можно проводить при температуре 0-30°С.
По окончании реакции защитная(ые) группа(ы) может(гут) при необходимости быть удалена(ы) способами, хорошо известными специалистам в данной области, например с помощью щелочного или кислотного гидролиза или путем обработки анионом фтора.
Способ Б
Конкретные примеры соединений формулы (IV) включают:
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(метоксикарбонил)цитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-N4-(этоксикарбонил)-5-йодцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(н-пропоксикарбонил)цитидин,
N4-(н-бутоксикарбонил)-2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йодцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(н-пентилоксикарбонил)цитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(изопентилоксикарбонил)цитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(н-гексилоксикарбонил) цитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-N4-[(2-этилбу-тил)оксикарбонил]-5-йодцитидин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-[(2-фенилэтокси)карбонил]цитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-N4-[(циклогексилметокси)карбонил]-5’-дезокси-5-йодцитидин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(неопентилоксикарбонил)цитидин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5’-дезокси-N4-[(3,3-диметилбутокси)карбонил]-5-йодцитидин,
2’,3’-ди-O-ацетил-5’-дезокси-5-йод-N4-(этоксикарбонил)цитидин,
2’,3’-ди-O-ацетил-5’-дезокси-5-йод-N4-(н-пропоксикарбонил)цитидин,
2’,3’-ди-O-ацетил-N4-(н-бутоксикарбонил)-5’-дезокси-5-йодцитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-йод-N4-(н-пентилоксикарбонил)цитидин и т.п.
Конкретными примерами ацетиленовых или винильных производных, применяемых для этой реакции сочетания, являются триметилсилилацетилен, трет-бутилдиметилсилилацетилен, 1-бутин, 1-пентин, 1-гептин, 1-гексин, 3-метил-1-бутин, 3,3-диметил-1-бутин, циклогекилацетилен, фенилацетилен, 3-фенил-1-пропин, три-н-бутил(винил)станнан и т.п.
Реакция сочетания соединения формулы (IV) с ацетиленовым производным может быть проведена в присутствии палладиевого катализатора, такого как хлорид бис(трифенилфосфин)палладия(II)-йодид меди(I), ацетат бис(трифенилфосфин)палладия(II)-йодид меди(I) и т.п. Реакция сочетания соединения формулы (IV) с винильным производным может быть проведена в присутствии палладиевого катализатора, такого как трис(дибензилиденацетон)дипалладий, тетракис(трифенилфосфин)палладий, хлорид бис(ацетонитрил)палладия(II), в присутствии три-2-фурилфосфина, трифенилфосфина и т.п.
Эти реакции могут быть проведены в растворителе, таком как хлороформ, дихлорметан, тетрагидрофуран, N-метилпирролидон, N,N-диметилформамид и т.п. Реакция может быть проведена при температуре 0-80°С, предпочтительно 10-60°С.
Способ В
Реакция между приведенным выше соединением общей формулы (IV) и цианидом щелочного металла, таким как цианид натрия, цианид калия и т.д., может быть проведена в таком растворителе, как N,N-диметилформамид, диметилсульфоксид, ацетонитрил и т.п. Реакция может быть проведена при температуре 0-100°С, предпочтительно 10-30°С.
Способ Г
Конкретные примеры соединений формулы (V) включают:
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилуридин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5’-дезокси-5-проп-1-инилуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-бут-1-инил-5’-дезоксиуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-пент-1-инилуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-гекс-1-инилуридин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5’-дезокси-5-йодуридин,
5-бром-2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезоксиуридин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5-(1-хлорвинил)-5’-дезоксиуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-винилуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-трифторметилуридин,
5-(3-бензилоксибензил)-2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезоксиуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-циан-5’-дезоксиуридин и т.п.
Указанные выше исходные продукты могут быть получены из известных 5-замещенных производных урацила с помощью способа, аналогичного способу Д, в котором 5-замещенное урацильное производное применяют вместо 5-замещенного цитозинового производного.
Реакция между приведенным выше соединением общей формулы (V) и фосфорилхлоридом может быть проведена в растворителе, таком как пиридин, диоксан, тетрагидрофуран, ацетонитрил, хлороформ, дихлорметан и т.п., в присутствии акцептора кислоты, такого как триэтиламин, пиридин, пиколин, 4-(N,N-диметиламино) пиридин, лутидин, имидазол, N-метилимидазол, триазол и т.п., при температуре 0-30°С, с последующей обработкой водным аммиаком или газообразным аммиаком в растворителе, таком как метанол, этанол, ацетонитрил, N,N-диметилформамид и т.п., при температуре 0-30°С.
Способ Д
Конкретные примеры соединений формулы (VI) включают 5-этинилцитозин, 5-проп-1-инилцитозин, 5-бут-1-инил-5’-дезоксицитозин, 5-пент-1-инилцитозин, 5-гекс-1-инилцитозин, 5-йодцитозин, 5-бромцитозин, 5-(1-хлорвинил)цитозин, 5-винилцитозин, 5-трифторметилцитозин, 5-(3-бензилоксибензил)цитозин, 5-цианцитозин, 5-этинил-N4-(н-пентилоксикарбонил)цитозин и т.п.
Конкретные примеры соединений общей формулы (VII) включают известные 5-дезокси-1,2,3-O-триацетил-D-рибофуранозид, 5-дезокси-1,2,3-O-трибензоил-D-рибофуранозид и т.п.
Соединение формулы (VI) сначала может быть превращено в триметилсилильное производное с помощью силилирующего агента, такого как гексаметилдисилазан, с последующим проведением реакции сочетания с соединением формулы (VII) в присутствии кислоты Льюиса в качестве катализатора, такой как хлорид олова(IV), хлорид титана(IV) и т.п. Эту реакцию сочетания проводят в растворителе, таком как ацетонитрил, дихлорметан, хлороформ, 1,2-дихлорэтан, нитрометан, толуол и т.п., при температуре 0-30°С, предпочтительно 0-10°С.
Способ Е
Конкретные примеры соединений формулы (VIII) включают:
5’-дезокси-5-этинилцитидин,
5’-дезокси-N4-(этоксикарбонил)-5-этинилцитидин,
5’-дезокси-5-этинил-N4-(н-пропоксикарбонил)цитидин,
N4-(н-бутоксикарбонил)-5’-дезокси-5-этинилцитидин,
5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидин,
N4-(бензилоксикарбонил)-5’-дезокси-5-этинилцитидин,
2’,3’-ди-O-ацетил-5’-дезокси-5-этинилцитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-этинил-N4-(этоксикарбонил)цитидин,
2’,3’-ди-O-aцeтил-5’-дeзoкcи-5-этинил-N4-(н-пpoпoкcикapбoнил)цитидин,
2’,3’-ди-O-aцeтил-5’-дeзoкcи-5-этинил-N4-(н-пeнтилoкcикapбoнил)цитидин и т.п.
Каталическое гидрирование этинильной группы соединения формулы (VIII) может быть проведено с использованием катализатора Линдлара в соответствии с методом, известным специалистам в данной области [ср. Synthetic Method, 1952, том 7, Р38 (Interscience Publishers, Inc., New York)].
Новые производные 5’-дезоксицитидина по настоящему изобретению могут применяться в качестве противоопухолевого агента совместно с физиологически приемлемыми фармацевтическими носителями.
Настоящее изобретение также относится к фармацевтической композиции, включающей производное 5’-дезоксицитидина общей формулы (I) и 5-фторурацил (5-ФУ) или его производное. При использовании этой композиции производное 5’-дезоксицитидина потенциирует противоопухолевое действие 5-фторурацила или его производного путем доставки существенно большего количества 5-ФУ избирательно к тканям опухоли, не приводя к значительному увеличению концентрации 5-ФУ в плазме.
Для объединения производного 5’-дезоксицитидина общей формулы (I) с 5-ФУ или с его производным для лечения рака с большей эффективностью и безопасным профилем производное 5-ФУ предпочтительно выбирают из группы, включающей:
5-фтор-1-(2-тетрагидрофурил)урацил,
1-(н-гексилоксикарбонил)-5-фторурацил,
5’-дезокси-5-фторуридин,
5’-дезокси-5-фтор-N4-(н-пропоксикарбонил)цитидин,
N4-(н-бутосикарбонил)-5’-дезокси-5-фторцитидин,
5’-дезокси-5-фтор-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-фтор-N4-(изопентилоксикарбонил)цитидин,
5’-дезокси-5-фтор-N4-(н-гексилоксикарбонил)цитидин,
5’-дезокси-N4-[(2-этилбутил)оксикарбонил]-5-фторцитидин,
5’-дезокси-5-фтор-N4-[(2-фенилэтокси)карбонил]цитидин,
N4-[(циклогексилметокси)карбонил]-5’-дезокси-5-фторцитидин,
5’-дезокси-5-фтор-N4-(неопентилоксикарбонил)цитидин,
5’-дезокси-N4-[(3,3-диметилбутокси)карбонил]-5-фторцитидин,
5’-дезокси-5-фтор-N4-(3,5-диметилбензоил)цитидин,
5’-дезокси-5-фтор-N4-(3,5-дихлорбензоил)цитидин,
2’,3’-O-ацетил-5’-дезокси-5-фтор-N4-(н-пентилоксикарбонил)цитидин и т.п.
Соединения формул (I) могут применяться либо по отдельности, либо одновременно с 5-ФУ или с его производным.
Следовательно, фармацевтическая композиция по настоящему изобретению может быть получена путем объединения соединения формулы (I) и 5-ФУ или его производного в виде одного препарата или может быть приготовлена в виде двух отдельных препаратов.
Фармацевтическая композиция, включающая соединение формулы (I), может применяться до или одновременно с введением 5-ФУ или его производного; предпочтительно за 3 часа до или одновременно с введением 5-ФУ или его производного.
В фармацевтической композиции по настоящему изобретению, включающей 5-ФУ или его производное и производное 5’-дезоксицитидина общей формулы (I), приемлемое молярное соотношение двух компонентов составляет приблизительно 0,001-10 молей, предпочтительно 0,002-0,5 молей соединения формулы (I) на моль 5-ФУ или его производного.
Настоящее изобретение также относится к набору, содержащему фармацевтическую композицию (компонент А), которая включает соединение формулы (I), и фармацевтическую композицию (компонент Б), которая содержит 5-ФУ или его производное.
Таким образом, под объем настоящего изобретения подпадают фармацевтические композиции, содержащие соединение формулы (I) и необязательно 5-ФУ или его производного и их набор, предназначенный для лечения колоректального рака, рака молочной железы, рака желудка, рака легкого, цервикального рака, рака мочевого пузыря и других злокачественных заболеваний и т.п.
Фармацевтические композиции и компоненты А и Б набора по настоящему изобретению могут применяться в любой форме, например в форме таблеток, пилюль, суппозиториев, капсул, гранул, порошков или эмульсий и т.д. Фармацевтически приемлемые носители и эксципиенты, пригодные для приготовления фармацевтической композиции по настоящему изобретению, являются общепринятыми. Фармацевтически приемлемые материалы могут представлять собой органический или неорганический инертный носитель,. пригодный для энтерального, чрескожного или парентерального введения, такой как вода, желатин, гуммиарабик, лактоза, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли и вазелин. Фармацевтическая композиция по настоящему изобретению может быть введена орально, например, в форме таблеток, капсул, пилюль, порошков, гранул, растворов, сиропов, суспензий или эликсиров. Введение также может быть осуществлено парентерально, например, в форме стерильных растворов, суспензий или эмульсий; или локально, например, в форме растворов, суспензий, мазей, порошков или аэрозолей. Фармацевтическая композиция может быть стерильной и/или может содержать дополнительные адъюванты, такие как консерванты, стабилизаторы, эмульгирующие агенты, улучшающие запах агенты, соли для изменения осмотического давления или вещества, действующие в качестве буферов.
Фармацевтическая композиция может быть приготовлена общепринятым способом.
Диапазон доз фармацевтической композиции по настоящему изобретению зависит от пути введения, возраста, веса и состояния пациента и конкретного заболевания, подлежащего лечению. В случае орального, ректального или парентерального введения взрослым людям приблизительная суточная доза составляет от примерно 1 мг до примерно 2000 мг соединения формулы (I) и от примерно 10 мг до примерно 4000 мг 5-ФУ или его производного в зависимости от типа используемого производного 5-ФУ. Оральное введение является предпочтительным путем введения фармацевтической композиции по настоящему изобретению.
Избирательная доставка к опухоли 5-ФУ в результате избирательного ингибирования ДПД опухоли соединением формулы (I) проиллюстрирована на примере приведенного ниже теста.
1. Избирательное ингибирование ДПД опухоли соединением А из примера 6
Способность соединения А из примера 6 ингибировать активность ДПД сравнивали с таковой известного ингибитора ДПД 5-этинилурацила (5-ЭУ) на лишенных волосяного покрова мышах линии BALB/c, несущих ксенотрансплантат РС-3 рака предстательной железы человека. Через 2 и 8 ч после введения соединения А (0,5 ммоля/кг) и 5-ЭУ (0,05 мкмоля/кг) в каждой группе мышей, состоящей из трех животных, брали на анализ ткани печени и опухоли. Затем измеряли активность ДПД в этих тканях, проводя измерение в соответствии с описанным в литературе методом (Naguib и др., Cancer Research 45, 5405-5412, 1985). 5-ЭУ ингибировал активность ДПД как в ткани печени, так и опухоли, в то время как соединение А выраженно ингибировало активность ДПД только в ткани опухоли (таблица 1). Эти результаты позволяют предположить, что соединение А из примера 6 избирательно ингибирует активность ДПД в ткани опухоли.
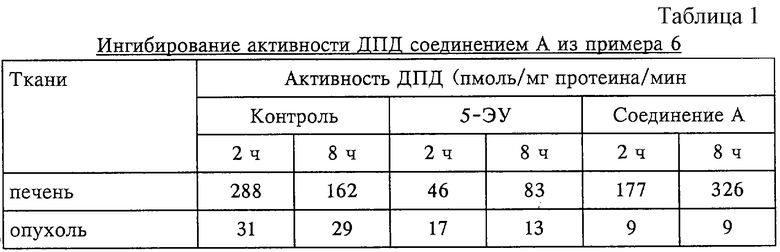
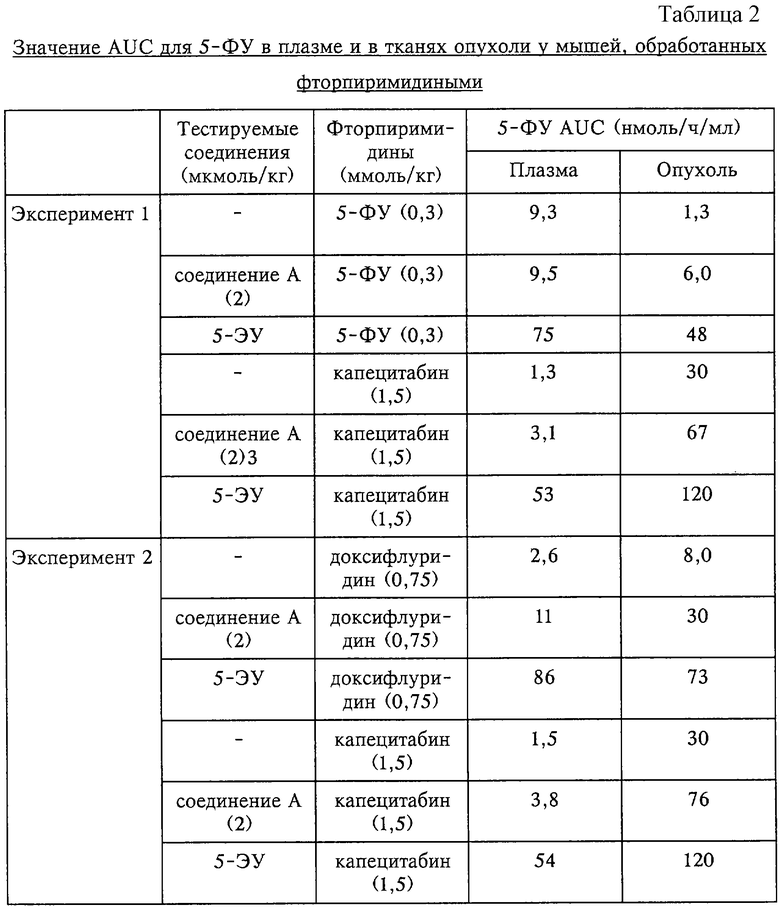
2. Избирательное увеличение уровня 5-ФУ в опухолях с помощью соединения А из примера 6 у мышей, обработанных фторпиримидинами
Эксперимент, данные которого приведены в таблице 2, демонстрирует, что соединение А из примера 6 избирательно увеличивает в опухолях AUC (площадь под кривой) для 5-ФУ у мышей, обработанных фторпиримидинами. В этом исследовании фторпиримидины, такие как 5-ФУ, доксифлуридин [5’-дезокси-5-фторуридин] и капецитабин (5’-дезокси-5-фторуридин-N4-(н-пентилоксикарбонил)цитидин], вводили лишенным волосяного покрова мышам линии BALB/c, несущим ксенотрансплантат MKN28 рака желудка человека, в сочетании либо с соединением А, либо с 5-ЭУ. Затем определяли уровни 5-ФУ в тканях опухоли и в плазме через 0,25, 0,5, 2, 4 и 7 ч после введения фторпиримидина (n=3 особи) и рассчитывали AUC для 5-ФУ. Известный ингибитор ДПД 5-ЭУ в значительной степени увеличивал AUC для 5-ФУ как в плазме, так и в тканях опухоли у мышей, обработанных и 5-ФУ, и капецитабином или доксифлуридином. Поскольку увеличение уровней 5-ФУ в плазме приводит к системной токсичности 5-ФУ, 5-ЭУ усиливает как эффективность, так и токсичность фторпиримидинов.
В отличие от этого соединение А в значительной степени увеличивает AUC для 5-ФУ только в тканях опухоли, вероятно, вследствие того, что соединение А избирательно ингибирует в опухоли активность ДПД, которая участвует в катаболизме 5-ФУ. Таким образом, соединение А из примера 6 усиливает эффективность фторпиримидинов, вызывая при этом лишь незначительное увеличение их токсичности.
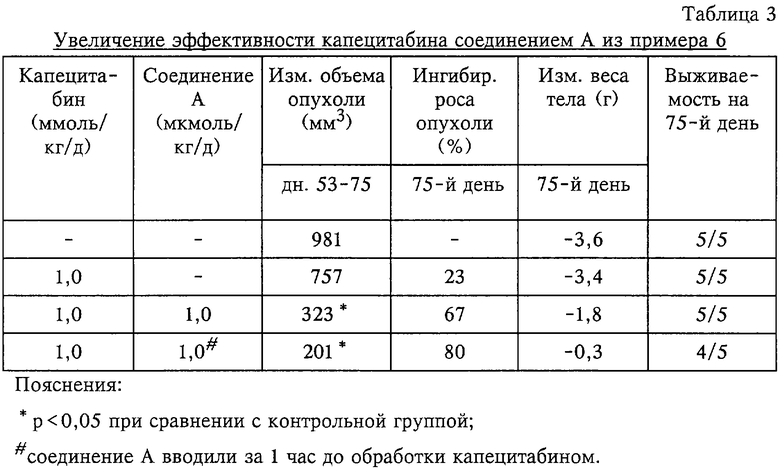
3. Увеличение противопухолевой активности капецитабина соединением А из примера 6
Соединение А из примера 6 оценивали в отношении его способности увеличивать эффективность капецитабина у лишенных волосяного покрова мышей линии BALB/c, несущих ксенотрансплантат РС3 рака предстательной железы человека. Соединение А и капецитабин вводили орально одновременно или последовательно в течение 5 последовательных дней в неделю в течение 3 недель, начиная опыт на 53-й день после инокуляции опухоли, когда опухоль начинала обнаруживаться при пальпации. На 75-й день объем опухоли вновь оценивали и рассчитывали процент ингибирования роста опухоли. Как видно из таблицы 3, капецитабин ингибировал рост опухоли в большей степени, когда в сочетании с ним соединение А вводили как одновременно, так и последовательно. Поскольку само по себе соединение А не является цитотоксичным (данные не приведены), оно усиливает эффективность капецитабина путем ингибирования активности ДПД.
Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем.
Получение исходных продуктов для примера 1.
а) Получение 2’,3’-ди-O-ацетил-5’-дезокси-5-этинилуридина
5-Этинилурацил (12 г, 88,2 ммоля) суспендировали в растворе сульфата аммония (570 мг, 4,3 ммоля) в гексаметилдисилазане (240 мл). Суспензию кипятили с обратным холодильником в течение 6 ч. После концентрирования реакционной смеси при пониженном давлении к остатку добавляли раствор 5-дезокси-1,2,3-три-O-ацетил-D-рибофуранозида (27,5 г, 105,8 ммоля) в ацетонитриле (300 мл). Затем к смеси по каплям добавляли раствор безводного тетрахлорида олова (27,6 г, 105,8 ммоля) в нитрометане (60 мл), поддерживая температуру ниже 0°С. После перемешивания смеси при 0°С в течение еще 4 ч добавляли раствор бикарбоната натрия, а затем по каплям добавляли воду. После перемешивания смеси в течение 2 ч реакционную смесь фильтровали для удаления нерастворимых продуктов, которые промывали этилацетатом. Фильтрат и смыв объединяли, сушили над MgSO4 и фильтровали. Фильтрат упаривали при пониженном давлении. После очистки остатка с помощью хроматографии на силикагеле (с использованием смеси 1:2 н-гексан:этилацетат в качестве элюента) получили 2’,3’-ди-O-ацетил-5’-дезокси-5-этинилуридин (13,7 г, выход 48%).
MALDI-MC: (m/z) 359 [М+Na]+, 375 [М+К]+.
1H-ЯМР: (270 МГц; CDCl3): δ 1,47 (3Н, d, J=6,6), 2,10 (3Н, s), 2,12 (3Н, s), 3,23 (1Н, s), 4,19-4,28 (1Н, m), 5,01-5,05 (1H, m), 5,30-5,34 (1H, m), 5,90 (1H, d, J=4,95), 7,57 (1H, s), 8,34 (1H, br.s).
б) Получение 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилуридина
К раствору 2’,3’-ди-O-ацетил-5’-дезокси-5-этинилуридина (13,7 г, 40,7 ммоля), растворенному в метаноле (100 мл), при перемешивании при 0°С добавляли по каплям раствор гидроксида натрия (3,3 г, 81,4 ммоля) в воде (10 мл). После перемешивания при 0°С в течение еще 30 мин значение рН реакционной смеси доводили до 7 с помощью 1н. водной соляной кислоты. Затем смесь упаривали при пониженном давлении.
Остаток растворяли в ДМФ (250 мл) и к раствору при перемешивании добавляли имидазол (41,6 г, 610 мМ) и трет-бутилдиметилхлорсилан (30,7 г, 203 ммоля). Смесь продолжали перемешивать в течение 23 ч. Реакционную смесь распределяли между этилацетатом и водой. Водный слой повторно экстрагировали этилацетатом. Объединенные органические слои промывали рассолом, сушили над Nа2SO4, фильтровали и упаривали при пониженном давлении. После очистки остатка с помощью хроматографии на силикагеле (с использованием смеси 3:1 н-гексан:этилацетат в качестве элюента) получили 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилуридин (14,9 г, выход 76%).
БТЯ-МС: (m/z) 481 [М+Н]+.
1H-ЯМР: (270 МГц; CDCl3): δ 0,10-0,13 (12Н, m), 0,91 (18Н, m), 1,40 (3Н, d, J=6,6), 3,21 (1H, s), 3,58 (1H, dd, J=4,29, 6,6), 4,08-4,17 (2H, m), 5,62 (1H, d, J=2,64), 7,68 (1H, s), 8,24 (1H, br.s).
Следующие соединения получали аналогично тому, как это описано выше, используя соответствующие известные 5-замещенные производные урацила.
2’,3’ -бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йодуридин
БТЯ-МС: (m/z) 583 [М+Н]+, 605[M+Na]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ -0,09 (3Н, s), -0,03 (3Н, s), 0,00 (3Н, s), 0,02 (3Н, s), 0,75 (9Н, s), 0,81 (9Н, s), 1,24 (3Н, d, J=6,6), 3,75 (1H, dd, J=4,6, 4,0), 3,86 (1H, m), 4,36 (1H, dd, J=5,3, 5,0), 5,59 (1H, d, J=5,6), 7,91 (1H, s), 11,69 (1H, br.s).
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-трисфторметилуридин
БТЯ-МС: (m/z) 525 [М+Н]+.
1H-ЯМР: (400 МГц; СDС13): δ 0,00 (6Н, s), 0,02 (3Н, s), 0,06 (3Н, s), 0,83 (9Н, s), 0,83 (9Н, s), 1,32 (3Н, d, J=5,9), 3,47 (1H, m), 4,05 (1H, m), 4,16 (1H, m), 5,54 (1H, d, J=2,2), 7,84 (1H, s), 8,43 (1H, br.s).
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-(3-бензилоксибензил)-5’-дезоксиуридин
БТЯ-МС: (m/z) 653 [М+Н]+.
1H-ЯМР: (270 МГц; СDС13): δ -0,09-0,01 (12Н, m), 0,77-0,82 (18Н, m), 0,90 (3Н, d, J=6,3), 3,27 (1H, m), 3,31 (1H, d, J=16,5), 3,61 (1H, d, J=16,5), 3,86 (1H, m), 3,95 (1H. m), 4,94 (2H, s), 5,50 (1H, d, J=2,0), 6,68-6,78 (4H, m), 7,12-7,34 (6H, m), 8,54 (1H, br.s).
Следующие соединения могут быть получены аналогично тому, как это описано выше, с использованием соответствующих известных 5-замещенных урациловых производных:
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-проп-1-инилуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-бут-1-инил-5’-дезоксиуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-пент-1-инилуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-гекс-1-инилуридин,
5-бром-2’,3’-бис-О-(трет-бутилдиметилсилил)-5’-дезоксиуридин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5-(1-хлорвинил)-5’-дезоксиуридин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-винилуридин.
Пример 1
Получение 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилцитидина
К раствору, содержащему диметиламинопиридин (19,0 г, 155,5 ммоля) в ацетонитриле (120 мл) и пиридине (12,6 мл, 155,6 ммоля), на ледяной бане по каплям в атмосфере Аr добавляли фосфорилхлорид (14,4 г, 93,8 мМ). После перемешивания смеси в течение 1 ч при комнатной температуре добавляли раствор 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилуридина (14,9 г, 31,1 ммоля) в ацетонитриле (80 мл) при 5°С и при охлаждении в ледяной бане. Смесь перемешивали при комнатной температуре в течение 2 ч. Затем к реакционной смеси одной порцией добавляли 25%-ный водный раствор аммиака (10 мл), поддерживая температуру ниже 10°С. К реакционной смеси добавляли вторую порцию 25%-ного водного раствора аммиака (65 мл), поддерживая температуру ниже 10°С. Смесь перемешивали при комнатной температуре в течение 45 мин. Затем реакционную смесь разбавляли водой (200 мл) при комнатной температуре и трижды экстрагировали этилацетатом. Объединенные органические слои последовательно промывали 1н. водным раствором соляной кислоты, насыщенным водным раствором бикарбоната натрия и рассолом. Органический слой сушили над MgSO4, фильтровали и упаривали при пониженном давлении. После очистки остатка с помощью хроматографии на силикагеле (с использованием смеси 2:1 н-гексан:этилацетат в качестве элюента) получили 2’,3’-бис-О-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилцитидин (14,8 г, выход 99%).
MALDI-MC: (m/z) 502[M+Na]+, 518 [М+К]+.
1H-ЯМР: (400 МГц; CDCl3): δ 0,05 (3Н, s), 0,06 (3Н, s), 0,12 (3Н, s), 0,24 (3Н, s), 0,89 (9Н, s), 0,92 (9Н, s), 1,41 (3Н, d, J=6,35), 3,36 (1H, s), 3,46 (1H, dd, J=3,91, 7,81), 4,19-4,26 (2H, m), 5,57 (1H, s), 5,79 (1H, br.s), 7,57 (1H, br.s), 7,80 (1H, s).
Следующие соединения получали способом, аналогичным описанному в примере 1.
Пример 2
2’,3’-биc-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йодцитидин
БТЯ-МС: (m/z) 582 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,00 (3Н, s), 0,02 (3Н, s), 0,06 (3Н, s), 0,08 (3Н, s), 0,82 (9Н, s), 0,88 (9Н, s), 1,30 (3Н, d, J=6,6), 3,78 (1H, dd, J=4,6, 4,3), 3,93 (1H, m), 4,33 (IH, dd, J=4,9, 4,6), 5,67 (1H, d, J=5,0), 6,67 (1H, br.s), 7,87 (2H, br.s).
Пример 3
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-трифторметил-цитидин
БТЯ-МС: (m/z) 524 [М+Н]+.
1H-ЯМР: (400 МГц; СDС13): δ 0,00 (6Н, s), 0,08 (3Н, s), 0,19 (3Н, s), 0,84 (9Н, s), 0,87 (9Н, s), 1,35 (3Н, d, J=6,6), 3,38 (1H, m), 4,15 (1H, m), 4,21 (1H, m), 5,51 (1H, s), 7,97 (1H, s).
Пример 4
5-(3-бензилоксибензил)-2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезоксицитидин
БТЯ-МС: (m/z) 652 [М+Н]+.
1H-ЯМР: (270 МГц; СDCl3): δ -0,01 (3Н, s), 0,00 (3Н, s), 0,09 (3Н, s), 0,22 (3Н, s), 0,86 (9Н, s), 0,90 (9Н, s), 1,10 (3Н, d, J=6,6), 3,37 (1H, m), 3,57.(2H, s), 4,08-4,18 (2H, m), 5,03 (2H, s), 5,59 (1H, s), 6,75-6,90 (3Н, m), 7,11 (1H, s), 7,26 (1H, m), 7,31-7,44 (5Н, m).
Пример 5
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-циан-5’-дезоксицитидин
БТЯ-МС: (m/z) 481 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ -0,04 (3Н, s), 0,00 (3Н, s), 0.02 (3Н, s), 0,76 (9Н, s), 0,82 (9Н, s), 1,21 (3Н, d, J=6,3), 3,81 (1H, m), 4,05 (1H, t, J=5,0), 4,71 (1H, t, J=5,0), 5,65 (1H, d, J=5,3), 6,41 (1H, s), 7,69 (1H, br.s), 7,85 (1H, br.s).
Следующие соединения могут быть получены способом, аналогичным примеру 5:
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-проп-1-инилцитидин,
2’,3’-бис-О-(трет-бутилдиметилсилил)-5-бут-1-инил-5’-дезоксицитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-пент-1-инилцитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-гекс-1-инилцитидин,
5-бром-2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезоксицитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5-(1-хлорвинил)-5’-дезоксицитидин,
2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-винилцитидин.
Пример 6
Получение 5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидина
а) 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинилцитидин (45 мг, 0,09 ммоля) растворяли в дихлорметане (1 мл) и пиридине (33 мкл, 0,42 мМ). К смеси на ледяной бане в атмосфере Аr по каплям добавляли н-пентилхлорформиат (42 мг, 0,28 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и реакционную смесь перемешивали в течение 30 мин. Реакционную смесь распределяли между дихлорметаном и водой. Водный слой экстрагировали дихлорметаном. Объединенные органические слои сушили над Na2SO4 и фильтровали. Фильтрат ’упаривали при пониженном давлении.
После очистки остатка с помощью хроматографии на силикагеле (с использованием смеси 4:1 н-гексан:этилацетат в качестве элюента) получили 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидин (40 мг, выход 72%).
БТЯ-МС: (m/z) 594 [М+Н]+.
1H-ЯМР: (270 МГц; CDCl3): δ 0,12-0,27 (12Н, m), 0,09-0,92 (21Н, m), 1,26-1,42 (7Н, m), 1,64-1,74 (2Н, m), 3,25-3,51 (2Н, m), 4,15-4,23 (4Н, m), 5,55-5,60 (1Н, m), 7,62 (0,5H, br.s), 7,73 (0,5H, br.s), 8,00 (0,5H, br.s), 12,3 (0,5H, br.s).
б) К раствору 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидина (19 мг, 0,03 ммоля) в тетрагидрофуране (500 мкл) при комнатной температуре в атмосфере Аr по каплям добавляли фторид тетрабутиламмония (93 мкл, 0,09 ммоля) [1,0 М раствор в тетрагидрофуране]. После перемешивания смеси в течение 2 ч при комнатной температуре реакционную смесь упаривали при пониженном давлении. Остаток распределяли между дихлорметаном и водой. Водный слой повторно экстрагировали дихлорметаном. Объединенные органические слои сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. После очистки остатка с помощью хроматографии на силикагеле (с использованием смеси 20:1 дихлорметан:метанол в качестве элюента) получили 5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидин (соединение А) (9 мг, выход 81%).
БТЯ-МС: (m/z) 366 [М+Н]+.
1H-ЯМР: (400 МГц; ДМСО-d6): δ 0,88 (3Н, t, J=6,84), 1,30-1,32 (7Н, m), 1,59-1,63 (2Н, m), 3,67-3,71 (1Н, m), 3,90-4,46 (5Н, m), 5,07 (1Н, m), 5,42 (1Н, m), 5,66 (1H, m), 7,89 (0,5H, br.s), 8,14 (0,5H, br.s), 9,53 (0,5H, br.s), 11,7 (0,5H, br.s).
Следующие соединения (примеры 7-35) получали способом, аналогичным примеру 6.
Пример 7
5’-дeзoкcи-5-этил-N4-(н-пeнтилoкcикapбoнил)цитидин
БТЯ-МС: (m/z) 370 [М+Н]+.
1H-ЯМР: (270 МГц; СDС13): δ 0,91 (3Н, t, J=6,93), 1,16 (3Н, t, J=7,5), 1,36 (4Н, m), 1,41 (3Н, d, J=6,6), 1,72 (2H, m), 2,47 (2Н, q, J=7,5). 3,22 (1H, br.s), 3,93 (1H, m), 4,16 (2H, t, J=6,93), 4,28 (2H, m), 4,49 (1H, br.s), 5,66 (1H, d, J=3,63), 7,37 (1H, br.s), 12,46 (1H, br.s).
Пример 8
5’-дезокси-5-йод-N4-(н-пентилоксикарбонил)цитидин
БТЯ-МС: (m/z) 468 [M+Н]+, 490 [M+Na]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 1,36 (3Н, t, J=7,0), 1,76-1,78 (7Н, m), 2,09 (2Н, m), 4,18 (1Н, m), 4,36 (1H, m), 4,54 (2H, t, J=5,9), 5,54 (1H, br.d, J=5,0), 5,84 (1H, br.d, J=5,0), 6,09 (1H, d, J=4,3), 8,47 (1H, s), 12,24 (1H, br.s).
Пример 9
5’-дезокси-N4-(н-пентилоксикарбонил)-5-трифторметилцитидин
БТЯ-МС: (m/z) 410 [М+Н]+.
1H-ЯМР: (270 МГц; СDСl3): δ 0,88-0,94 (3Н, m), 1,32-1,39 (4Н, m), 1,42 (3Н, d, J=6,6), 1,68-1,75 (2H, m), 3,09-3,30 (1H, m), 3,92 (1H, m), 4,15-4,27 (5Н, m), 5,67 (1H, d, J=3,3), 8,05-8,31 (1H, m), 12,6 (1H, br.s).
Пример 10
5-(3-бензилоксибензил)-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин
БТЯ-МС: (m/z) 538 [М+Н]+.
1H-ЯМР: (270 МГц; СDСl3): δ 0,90 (3Н, t, J=6,9), 1,04 (3Н, d, J=6,6), 1,26-1,39 (4Н, m), 1,72 (2H, m), 3,16 (1H, br.s), 3,67 (1H, d, J=16,5), 3,71 (1H, m), 3,75 (3Н, d, J=16,5), 4,10 (2H, m), 4,16 (2H, t, J=6,9), 4,40 (1H, br.s), 5,04 (2H, s), 5,62 (1H, d, J=3,3), 6,79 (1H, d, J=7,6), 6,84-6,89 (2H, m), 6,97 (1H, br.s), 7,22-7,43 (6H, m), 12,41 (1H, br.s).
Пример 11
5-циан-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин
БТЯ-МС: (m/z) 367 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,88 (3Н, t, J=6,9), 1,30 (4Н, s,), 1,31 (3Н, d, J=6,3), 1,62 (2H, m), 3,81 (1H, quin., J=6,3), 3,91 (1H, quin., J=6,3), 4,13 (2H, t, J=6,6), 4,39 (1H, m), 5,09 (1H, d, J=6,3), 5,31 (1H, d, J=5,3), 5,83 (1H, d, J=4,0), 7,57 (1H, s), 11,23 (1H, br.s).
Пример 12
5’-дезокси-5-этинил-N4-(н-пропоксикарбонил)цитидин
БТЯ-МС: (m/z) 338 [М+Н]+, 360 [M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d3): δ 0,91 (3Н, t, J=7,3), 1,31 (3Н, d, J=6,3), 1,63 (2H, sextet, J=7,3), 3,69 (1H, dt, J=5,9, 5,3), 3,91 (1H, quin., J=5,9), 4,03 (2H, t, J=6,6), 4,13 (1H, dt, J=5,0, 4,3), 4,35 (1H, br.s ), 5,05 (1H, d, J=5,9), 5,41 (1H, d, J=5,3), 5,66 (1H, d, J=4,0), 8,01 (1H, br.s).
Пример 13
5’-дезокси-5-этинил-N4-(изопропоксикарбонил)цитидин
БТЯ-МС: (m/z) 338 [М+Н]+.
1Н-ЯМР: (270 МГц; ДMCO-d6): δ 1,24 (6Н, d, J=5,9), 1,31 (3Н, d, J=6,6), 3,68 (1H, dt, J=5,9, 5,6), 3,90 (1H, quin., J=5,9), 4,12 (1H, m), 4,30 (1H, s), 4,85 (1H, m), 5,05 (1H, d, J=5,9), 5,40 (1H, d, J=5,3), 5,66 (1H, d, J=3,6), 8,02 (1H, br.s).
Пример 14
N4-(изобутоксикарбонил)-5’-дезокси-5-этинилцитидин
БТЯ-МС: (m/z) 352 [М+Н]+.
1Н-ЯМР: (270 МГц; ДMCO-d6): δ 0,91 (6Н, d, J=6,6), 1,30 (3Н, d, J=6,3), 1,91 (2H, m), 3,68 (1H, dt, J=5,9, 5,3), 3,84 (2Н, d, J=6,6), 3,89 (1H, quin., J=6,3), 4,11 (1H, m), 4,30 (1H, s), 5,03 (1H, d, J=5,9), 5,38 (1H, d, J=5,3), 5,66 (1H, d, J=4,0), 7,96 (1H, s).
Пример 15
5’-дезокси-5-этинил-N4-[(2-метилпентилокси)карбонил]цитидин
БТЯ-МС: (m/z) 380 [М+Н]+, 402[M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,85-0,93 (7Н, m), 1,31 (3Н, d, J=6,3), 1,28-1,37 (3Н, m), 1,77 (1H, m), 3,69 (1H, dt, J=5,9, 5,6), 3,88 (2H, m), 3,92 (1H, m), 4,13 (1H, dt, J=4,9, 4,6), 4,37 (1H, br.s), 5,06 (1H, d, J=5,9), 5,41 (1H, d, J=5,3), 5,66 (1H, d, J=4,0), 8,02 (1H, br.s).
Пример 16
5’-дезокси-5-этинил-N4-[(3-метилпентилокси)карбонил]цитидин
БТЯ-МС: (m/z) 380 [М+Н]+.
1H-ЯМР: (270 МГц; CDCl3): δ 0,86-0,98 (6Н, m), 1,15-1,80 (8Н, m), 3,25-3,26 (1H, m), 3,53 (1H, br.s), 3,90-3,95 (1H, m), 4,25-4,37 (4Н, m), 5,33 (1H, br.s), 5,71 (1H, d, J=4,28), 7,69 (1H, br.s), 8,13 (1H, br.s).
Пример 17
5’-дезокси-5-этинил-N4-[(2-пропилпентилокси)карбонил]цитидин
MALDI-MC: (m/z) 408,5 [М+Н]+, 430,5 [M+Na]+, 446 [М+К]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,87 (6Н, br. m), 1,29 (11Н, br. m), 1,66 (1H, br. m), 3,69 (1H, br. m), 3,94-4,5 (5H, br. m), 5,06 (1H, br. m), 5,42 (1H, br. m), 5,66 (1H, br. m), 7,90 (0,5H, br.s), 8,14 (0,5H, br.s), 9,53 (0,5H, br.s).
Пример 18
5’-дeзoкcи-5-этинил-N4-(н-oктилoкcикapбoнил)цитидин
БТЯ-МС: (m/z) 408 [M+Н]+, 430 [M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,86 (3Н, t, J=5,0), 1,26 (10Н, m), 1,31 (3Н, d, J=6,0), 1,60 (2Н, m), 3,69 (1H, dt, J=5,9, 5,6), 3,90 (1H, quin., J=6,3), 4,06 (2Н, t, J=6,3), 4,13 (1H, m), 4,35 (1H, br.s), 5,05 (1H, d, J=5,9), 5,41 (1H, d, J=5,3), 5,66 (1H, d, J=4,0), 8,02 (1H, br.s).
Пример 19
5’-дезокси-N4-[(2-этилгексил)оксикарбонил]-5-этинилцитидин
БТЯ-МС: (m/z) 408 [М+Н]+.
1H-ЯМР: (270 МГц; СDСl3): δ 0,88-0,94 (6Н, m), 1,30-1,41 (12Н, m), 3,25 (1H, d, J=3,63), 3,53 (1H, m), 3,92-3,94 (1H, m), 4,15-4,37 (4Н, m), 5,32 (1H, m), 5,70 (1H, dt, J=4,61), 7,86 (1H, br.s), 8,14 (1H, br.s).
Пример 20
5’-дезокси-5-этинил-N4-[(2-фенилэтокси)карбонил]цитидин
БТЯ-МС: (m/z) 400 [М+Н]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 1,31 (3Н, d, J=6,3), 2,94 (2Н, t, J=6,9), 3,69 (1H, dt J=5,9, 5,6), 3,90 (1H, quin., J=6,3), 4,14 (1H, m), 4,28 (2H, t, J=6,9), 4,31 (1H, br.s), 5,05 (1H, d, J=5.9), 5,41 (1H, d, J=4,9), 5,66 (1H, d, J=4,0), 7,27 (5H, m), 8,01 (1H, br.s).
Пример 21
N4-(циклогексилоксикарбонил)-5’-дезокси-5-этинилцитидин
БТЯ-МС: (m/z) 378 [M+Н]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 1,06-1,48 (9Н, m), 1,69 (2H, m), 1,86 (2H, m), 3,65-3,72 (1H, m), 3,88-3,93 (1H, m), 4,13-4,61 (3Н, m), 5,06 (1H, d, J=6,27), 5,42 (1H, d, J=4,95), 5,66 (1H, d, J=3,63), 7,9-8,1 (1H, m), 9,4 (0,5H, br.s), 11,8 (0,5H, br.s).
Пример 22
N4-[(циклогексилметокси)карбонил)]-5’-дезокси-5-этинилцитидин
БТЯ-МС: (m/z) 392 [M+Н]+, 414 [M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,86-1,25 (5Н, m), 1,31 (3Н, d, J=6,3), 1,61-1,72 (6H, m), 3,69 (1Н, dt, J=5,9, 5,6), 3,89 (2Н, d, J=6,3), 3,90 (IH, m), 4,14 (1H, m), 4,36 (1H, br.s), 5,05 (1H, d, J=5,9), 5,41 (1H, d, J=5,3), 5,66 (1H, d, J=4,0), 8,02 (1H, br.s).
Пример 23
5’-дезокси-5-этинил-N4-(неопентилоксикарбонил)цитидин
БТЯ-МС: (m/z) 366 [M+Н]+, 388 [M+Na]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 0,93 (9Н, s), 1,30 (3Н, br.d), 3,67-4,27 (5,5H, br.m), 4,47 (0,5H, br.s), 5,06 (1H, br.m), 5,39 (1H, br.m), 5,43 (1H, br.m), 7,88 (0,5H, br.s), 8,16 (0,5H, br.s), 9,56 (0,5H, br.s), 11,69 (0,5H, br.s).
Пример 24
5’-дезокси-N4-[(3,3-диметилбутокси)карбонил)-5-этинилцитидин
БТЯ-МС: (m/z) 380 [М+Н]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 1,01 (9Н, s), 1,39 (3Н, br.d), 1,63 (2Н, br.t), 3,77 (1H, br.m), 3,98-4,32 (4,5H, br.m), 4,56 (0,5H, br.s), 5,13 (1H, br.m), 5,45-5,51 (1H, br.m), 5,73-5,75 (1H, br.m), 7,96 (0,5H, br.s), 8,23 (0,5Н, br.s), 9,57 (0,5H, br.s), 11,76 (0,5H, br.s).
Пример 25
5’-дезокси-5-этинил-N4-(тридецилоксикарбонил)цитидин
MALDI-MC: (m/z) 478 [M+Н]+, 516 [M+К]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,85 (3Н, d, J=4,6), 1,24 (20Н, m), 1,30 (3Н, d, J=6,3), 1,60 (2H, m), 3,68 (1H, dt, J=5,9, 5,6), 3,90 (1H, quin., J=6,3), 4,05 (2H, t, J=6,6), 4,13 (1H, dt J=5,0, 4,3), 4,34 (1H, br.s), 5,05 (1H, d, J=5,9), 5,40 (1H, d, J=5,3), 5,65 (1H, d, J=3,6), 8,00 (1H, br.s).
Пример 26
N4-(н-бутоксикарбонил)-5’-дезокси-5-этинилцитидин
БТЯ-МС: (m/z) 352 [М+Н]+, 374[M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,89 (3Н, t, J=7,2), 1,28-1,41 (5Н, m), 1,53-1,64 (2H, m), 3,64-3,71 (1H, m), 3,85-3,92 (1H, m), 4,03-4,15 (3Н, m), 4,34 (1H, s), 5,04 (1H, d, J=5,9), 5,39 (1H, d, J=5,3), 5,64 (1H, d, J=3,6), 8,06 (1H, br.s).
Пример 27
5’-дезокси-5-этинил-N4-(н-гексилоксикарбонил)цитидин
БТЯ-МС: (m/z) 380 [М+Н]+, 402[M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,95 (3Н, t, J=6,6), 1,38-1,40 (9Н, m), 1,63-1,71 (2Н, m), 3,74-3,80 (1H, m), 3,94-4,03 (1H, m), 4,14 (2H, t, J=6,6), 4,19-4,24 (1H, m), 4,43 (1H, s), 5,13 (1H, d, J=5,9), 5,49 (1H, d, J=5,3), 5,74 (1H, d, J=4,0), 8,09 (1H, br.s).
Пример 28
5’-дезокси-5-этинил-N4-(н-децилоксикарбонил)цитидин
МС: БТЯ-МС: (m/z) 436 [M+Н]+.
1H-ЯМР: (270 МГц; ДMCO-d6): d 0,85 (3Н, t, J=6,4), 1,15-1,42 (17Н, m), 1,60 (2H, m), 3,69 (2h, m), 3,90 (1H, m), 4,05 (2H, t, J=6,6), 4,13 (1H, m), 4,34 (1H, br.s), 5,04 (1H, d, J=5,6), 5,40 (1H, d, J=4,9), 5,66 (1H, d, J=3,6), 8,01 (1H, br.s).
Пример 29
5’-дезокси-5-этинил-N4-[(2.6-диметилциклогексилокси)карбонил]цитидин
МC:БТЯ-МС: (m/z) 406 [М+Н]+.
1H-ЯМР: (270 МГц; ДMCO-d6): d 0,83 (36Н, t, J=6,3), 1,20-1,50 (9Н, m), 1,55-1,75 (2H, m), 3,68 (1H, m), 3,93 (1H, m), 4,12-4,20 (2H, m), 4,45 (0,7Н, s), 4,86 (0,3H, s), 5,04 (1H, d, J=5,6), 5,43 (1H, br.s), 5,67 (1H, br.s), 7,96 (0,3H, br.s), 8,14 (0,7H, br.s), 9,50 (0,7H, br.s), 12,00 (0,3H. br.s).
Пример 30
5’-дезокси-5-этинил-N4-(бензилоксикарбонил)цитидин
МС: БТЯ-МС: (m/z) 386 [M+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6):d 1,30 (3Н, d, J=6,3), 3,69 (1H, m), 3,89 (1H, m), 4,13 (1H, m), 4,35 (1H, br.s), 5,05 (1H, d, J=5,9), 5,14 (2H, s), 5,41 (1H, d, J=5,3), 5,66 (1H, d, J=3,6), 7,31-7,45 (5H, m), 8,01 (1H, br.s).
Пример 31
5’-дeзoкcи-5-этинил-N4-[(1-изопропил-2-метилпропокси)карбонил]цитидин
МС: БТЯ-МС: (m/z) 394 [М+Н]+.
1Н-ЯМР: (270 МГц; ДМСО-d6): d 0,93 (12Н, d, J=6,6), 1,40 (3H, d, J=6,6), 1,97 (2H, m), 3,33 (1H, d, J=3,6), 3,55 (1H, s), 3,91 (1H, m), 4,30 (1H, m), 4,36 (1H, m), 4,62 (1H, m), 5,40 (1H, s), 5,72 (1H, d, J=4,3), 7,69 (1H, s), 8,11 (1H, s).
Пример 32
5’-дезокси-5-этинил-N4-[(3-метилбензилокси)карбонил]цитидин
МС:БТЯ-МС: (m/z) 416 [М+Н]+.
1H-ЯМР: (270 МГц; ДMCO-d6): d 1,31 (3H, d, J=6,0), 3,70 (1H, m), 3,76 (3H, s), 3,90 (1H, m), 4,14 (1H, m), 4,26 (0,5Н, br.s), 4,44 (0,5H, br.s), 5,06 (2H, s), 5,16 (1H, br.s), 5,41 (1H, br.s), 5,66 (1H, m), 6,91 (1H, d, J=7,9), 7,00 (2H, m), 7,30 (1H, dd, J=7,9, 7,9), 7,89 (0,5H, br.s), 8,14 (0,5H, br.s), 9,72 (0,5H, br.s), 11,7 (0,5H, br.s).
Пример 33
5’-дезокси-5-этинил-N4-(метоксикарбонил)цитидин
МС: БТЯ-МС: (m/z) 310 [М+Н]+.
1H-ЯМР: (270 МГц; AMCO-d6): d 1,30 (3H, d, J=6,3), 3,66 (3H, s), 3,70 (1H, m), 3,90 (1H, quin., J=6,3), 4,13 (1H, m), 4,34 (1H, s), 5,05 (1H, d, J=5,9), 5,40 (1H, d, J=5,3), 5,66 (1H, d, J=4,0), 8,00 (1H, br.s).
Пример 34
5’-дезокси-5-этинил-N4-(этилоксикарбонил)цитидин
МС: БТЯ-МС: (m/z) 324 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): d 1,23 (3H, t, J=6,93), 1,31 (3H, d, J=6,27), 3,69 (1H, m), 3,90 (1H, m), 4,08-4,14 (3H, m), 4,35 (1H, br.s), 5,05 (1H, d, J=5,94), 5,40 (1H, d, J=5,27), 5,66 (1H, d, J=3,63), 8,02 (1H, br.s).
Пример 35
5’-дезокси-N4-(н-пентилоксикарбонил)цитидин
МС: БТЯ-МС: (m/z) 342 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,88 (3H, t, J=6,9), 1,31 (4Н, m), 1,32 (3H, d, J=6,3) 1,55-1,63 (2H, m), 3,63 (1H, dt, J=5,6, 5,6), 3,93 (1H, quin., J=6,3), 3,98 (1H, m), 4,01 (2H, t, J=6,9), 5,04 (1H, d, J=5,9), 5,42 (1H, d, J=4,6), 5,73 (1H, d, J=3,0), 7,07 (1H, d, J=7,6), 7,97 (1H, d, J=7,6), 10,66 (1H, br.s).
Пример 36
5’-дезокси-N4-(н-пентилоксикарбонил)-5-винилцитидин
МС: LC-MC: (m/z) 368 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,88 (3Н, t, J=7,1), 1,31 (7Н, m), 1,61 (2Н, m), 3,74 (1H, m), 3,91 (1H, m), 4,06 (2Н, t, J=6,4) 4,22 (1Н, m), 5,08 (1Н, d, J=5,3), 5,20 (1H, d, J=11,3), 5,40 (1H, d, J=4,9), 5,69 (1H, d, J=4,0), 5,88 (1H, d, J=17,9), 6,57 (1H, dd, J=11,3, 17,9), 7,78 (1H, s), 11,88 (1H, s).
Пример 37
5’-дезокси-N4-(бензилоксикарбонил)-5-винилцитидин
МС: БТЯ-МС: (m/z) 388 [M+Н]+, 410 [M+Na]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 1,30 (3Н, d, J=6,3), 3,73 (1H, m), 3,92 (1H, m), 4,23 (1H, m), 5,13 (2Н, s), 5,04-5,22 (2Н, m), 5,42 (1H, d, J=5,3) 5,69 (1H, d, J=4,3), 5,69 (1H, dd, J=15,8, 2,0), 6,55 (1H, dd, J=11,2, 15,8), 7,36-7,42 (5H, m), 7,78 (1H, s), 11,87 (1H, s).
Пример 38
N4-(этоксиксикарбонил)-5’-дезокси-5-винилцитидин
МС: БТЯ-МС: (m/z) 326 [M+Н]+, 348 [M+Na]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 1,23 (3Н, t, J=7,26), 1,32 (3Н, d, J=6,27), 3,70-3,76 (1H, m), 3,89-3,94 (1H, m), 4,11 (2Н, q, J=7,26), 4,22 (1H, m), 5,09 (1H, d, J=5,61) 5,18-5,22 (1H, m), 5,42 (1H, d, J=5,61), 5,69 (1H, d, J=3,96), 5,85-5,92 (1H, m), 6,57 (1H, dd, J=11,8, 17,82), 7,79 (1H, s), 11,88 (1H, br.s).
Пример 39
5’-дезокси-5-йод-N4-[(2-(фенилэтокси)карбонил]цитидин
МС: БТЯ-МС: (m/z) 502 [M+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 1,30 (3Н, d, J=6,3), 2,96 (2Н, t, J=7,1), 3,69 (1H, m), 3,88 (1H, m), 4,17 (1H, m), 4,29 (2Н, t, J=7,1) 5,07 (1H, d, J=5,9), 5,38 (1H, d, J=5,3), 5,62 (1H, d, J=4,6), 7,19-7,35 (5H, m), 8,01 (1H, s), 11,70 (1H, br. s).
Пример 40
5’-дезокси-5-йод-N4-(изопропоксикарбонил)цитидин
МС: MALDI-TOF: (m/z) 462,5 [M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 1,24 (6Н, d, J=6,3), 1,30 (3H, d, J=6,3), 3,69 (1H, m), 3,88 (1H, m), 4,17 (1H, m), 4,87 (1H, m), 5,07 (1H, d, J=5,6), 5,38 (1H, d, J=5,3), 5,62 (1H, d, J=4,3), 8,02 (1H, s), 11,77 (1H, br. s).
Пример 41
N4-(циклогексилоксикарбонил)5’-дезокси-5-йодцитидин
MC: LC-MC: (m/z) 479,9 [M+Н]+.
1H-ЯМР: (270 МГц; ДMCO-d6): δ 1,23-1,42 (6Н, m), 1,29 (3H, d, J=6,3), 1,70 (2H, m), 1,89 (2Н, m), 3,69 (1H, m), 3,88 (1H, m), 4,16 (1H, m), 4,60 (1H, m), 5,05 (1H, d, J=5,9), 5,37 (1H, d, J=5,3), 5,62 (1H, d, J=4,3), 8,00 (1H, s).
Следующие соединения могут быть получены способом, аналогичным примеру 6:
5’-дезокси-N-(н-пентилоксикарбонил)-5-npoп-l-инилцитидин,
5-бут-1-инил-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-пент-1-инил-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-гекс-1-инил-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-бром-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-(1-хлорвинил)-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-N4-(н-пентилоксикарбонил)-5-винилцитидин,
5’-дезокси-5-этинил-N4-(изопентилоксикарбонил)цитидин и
5’-дезокси-N4-[(2-этилбутил)оксикарбонил]-5-этинилцитидин.
Пример 42
Получение 2’,3’-ди-O-aцeтил-5’-дeзoкcи-5-йoдцитидинa
5-йодцитозин (1,0 г, 4,22 ммоля) и каталитическое количество (NH4)2SO4 суспендировали в растворе толуола (10 мл) и гексаметилдисилазана (20 мл). Суспензию выдерживали при 110°С в течение 18 ч до получения прозрачного раствора. После концентрирования реакционного раствора при пониженном давлении к остатку добавляли ацетонитрил (25 мл) и 5-дезокси-1,2,3-три-O-ацетил-D-рибофуранозид (1,32 г, 5,06 ммоля). Затем в течение 5 мин к смеси по каплям добавляли безводное четыреххлористое олово (0,58 мл, 5,06 ммоля) в нитрометане (5 мл). Во время добавления температуру смеси поддерживали ниже 0°С, охлаждая на льду. После перемешивания смеси в течение 2 ч при температуре 0-5°С к этой смеси добавляли 2 г бикарбоната натрия, а затем по каплям добавляли воду (0,7 мл). После добавления смесь интенсивно перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь фильтровали для удаления нерастворимого продукта, который промывали СН2Сl2. Фильтрат и смыв объединяли и промывали водой и насыщенным водным раствором бикарбоната натрия, затем сушили над Na2SO4 и фильтровали. Фильтрат упаривали при пониженном давлении. Сырой продукт очищали с помощью экспресс-хроматографии на SiO2 (элюент 5% MEOH/CH2Cl2), получая 5’-дезокси-2’,3’-ди-O-ацетил-5-йодцитидин в виде бесцветного твердого вещества (1,22 г, выход 66%).
БТЯ-МС: (m/z) 438 [М+Н]+, 460 [М+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 1,32 (3Н, d, J=6,3), 2,04 (3Н, s), 2,06 (3Н, s), 4,02 (1H, quin., J=6,3), 5,14 (1H, t, J=6,6), 5,48 (1H, dd, J=6,6, 4,3), 5,69 (1H, d, J=4,0), 6,78 (1H, br.s), 8,01 (1H, br.s), 8,11 (1H, s).
Пример 43
Получение 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(н-пентилоксикарбонил)цитидина
а) 5’-дезокси-2’,3’-ди-O-ацетил-5-йодцитидин (200 мг, 0,46 ммоля) растворяли в метаноле (5 мл). К этому раствору при 0°С по каплям добавляли раствор гидроксида натрия (1 моль/л). После перемешивания в течение 10 мин значение рН реакционной смеси доводили до 7 с помощью 1н. раствора соляной кислоты. Реакционную смесь упаривали при пониженном давлении.
К остатку добавляли смесь имидазола (467 мг, 6,9 ммоля) в ДМФ (5 мл). Затем к смеси добавляли трет-бутилдиметилхлорсилан (345 мг, 2,29 ммоля). Реакционную смесь перемешивали при 50°С в течение 1 ч. Смесь экстрагировали дихлорметаном, промывали водой и затем сушили над Na2SO4 и фильтровали. Фильтрат упаривали при пониженном давлении. Сырой продукт очищали с помощью экспресс-хроматографии на SiO2 (элюент от 70% ЕtOАс/н-гексан до 100% EtOA), получая 5’-дезокси-2’,3’-ди-O-(трет-бутилдиметилсилил)-5-йодцитидин в виде бесцветного твердого вещества (176,5 мг, выход 66%).
БТЯ-МС: (m/z) 582 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,00 (3Н, s), 0,02 (3Н, s), 0,06 (3Н, s), 0,08 (3Н, s), 0,82 (9Н, s), 0,88 (9Н, s), 1,30 (3Н, d, J=6,6), 3,78 (1H, dd, J=4,6, 4,3), 3,93 (1H, m), 4,33 (1H, dd, J=4,9, 4,6), 5,67 (1H, d, J=5,0), 6,67 (1H, br.s), 7,87 (2H, br.s).
б) К перемешиваемому раствору 5’-дезокси-2’,3’-бис-O-(трет-бутилдиметилсилил)-5-йодцитидина (116 мг, 0,200 ммоля) в СН2Сl2 (2 мл) добавляли при комнатной температуре в атмосфере Аr пиридин (84 мкл, 1,00 ммоль), N,N-диметиламинопиридин (6 мг, 0,05 ммоля) и н-пентилхлорформиат (95 мкл, 0,600 ммоля). После перемешивания в течение 30 мин реакционную смесь распределяли между дихлорметаном и водой, органическую фазу отделяли и водную фазу экстрагировали СН2Сl2 (15 мл х 4). Объединенную органическую фазу промывали водой и рассолом, сушили над Na2SO4 и фильтровали. Фильтрат упаривали при пониженном давлении. Сырой продукт очищали с помощью экспресс-хроматографии на SiO2 (элюент 20% ЕtOАс/н-гексан), получая 2’,3’-биc-O-(тpeт-бyтилдимeтилcилил)-5’-дeзoкcи-5-йoд-N4-(н-пентилоксикарбонил)цитидин в виде бесцветного аморфного твердого вещества (132,4 мг, выход 91%).
БТЯ-МС: (m/z) 696 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 0,00 (3Н, s), 0,03 (3Н, s), 0,05 (3Н, s), 0,07 (3Н, s), 0,77 (9Н, s), 0,81 (9Н, s), 1,20-1,27 (10Н, m), 1,46-1,55 (2H, m), 3,74 (IH, dd, J=4,6, 4,6), 3,89-4,01 (3Н, m), 4,37 (1H, dd, J=4,5, 4,6), 5,55 (1H, d, J=4,6), 7,92 (1H, s), 11,70 (1H, br.s).
Пример 44
Получение 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-[(триметилсилил)этинил]-N4-(н-пентилоксикарбонил)цитидина
К раствору, содержащему 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-йод-N4-(н-пентилоксикарбонил)цитидин (130 мг, 0,18 ммоля) в CH2Cl2 (2 мл) и Et3N (2 мл), добавляли CuI (10,7 мг, 0,1056 ммоля), Pd(PPh3)2Cl2 (2,6 мг, 0,0036 ммоля) и триметилсилилацетилен (58,6 мкл, 0,40 ммоля) и перемешивали в течение 2 ч при комнатной температуре в атмосфере Аr в темноте. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в EtOAc (25 мл х 3), промывали 2%-ным водным раствором двунатриевой соли ЭДТК (10 мл х 2), водой и рассолом, сушили над Na2SO4 и фильтровали. Фильтрат упаривали при пониженном давлении. Сырой продукт очищали с помощью экспресс-хроматографии на SiO2 (элюент 10% ЕtOАс/н-гексан), получая 2’,3’-бис-O-(трет-бутилдиметилсилил)-5’-дезокси-5-[(триметилсилил)этинил]-N4-(н-пентилоксикарбонил)цитидин в виде бесцветного аморфного твердого вещества (30,2 г, выход 26%).
БТЯ-МС: (m/z) 666[М+Н]+, 688[M+Na]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ -0,18 (3Н, s), -0,16 (3Н, s), -0,14 (3Н, s), -0,12 (3Н, s), 0,00 (9Н, s), 0,64 (9Н, s), 0,65 (3Н, s), 0,67 (9Н, s), 1,01 (4Н, m), 1,14 (3Н, d, J=6,6), 1,40 (2Н, m), 3,58 (1Н, t, J=4,9), 3,79 (1H, m), 3,87 (2H, m), 4,20 (1H, m), 5,43 (1H, d, J=3,6), 7,88 (1H, br.s).
Пример 45
Получение 5’-дезокси-2’,3’-бис-O-(трет-бутилдиметилсилил)-5-цианцитидина
К перемешиваемому раствору 5’-дезокси-2’,3’-бис-O-(трет-бутилдиметилсилилокси)-5-йодцитидина (153 мг, 0,263 ммоля) в ДМФ (5 мл) добавляли при комнатной температуре NaCN (34,3 мг, 0,70 ммоля). После перемешивания в течение 1 дня реакционную смесь концентрировали при пониженном давлении. Неочищенный продукт растворяли в EtOAc и затем промывали водой и рассолом. Экстракт сушили над Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Сырой продукт очищали с помощью экспресс-хроматографии на SiO2 (элюент EtOAc), получая 5’-дезокси-2’,3’-бис-O-(трет-бутилдиметилсилил)-5-цианцитидин в виде светло-желтого твердого вещества (71,1 мг, выход 56%)
БТЯ-МС: (m/z) 481 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ -0,04 (3Н, s), 0,00 (3Н, s), 0,02 (3Н, s), 0,76 (9Н, s), 0,82 (9Н, s), 1,21 (3Н, d, J=6,3), 3,81 (1H, m), 4,05 (1H, t, J=5,0), 4,71 (1H, t, J=5,0), 5,65 (1H, d, J=5,3), 6,41 (1H, s), 7,69 (1H, br.s), 7,85 (1H, br.s).
Пример 46
Получение 2’,3’-ди-O-ацетил-5’-дезокси-5-винилцитидина
К раствору 2’,3’-ди-O-ацетил-5’-дезокси-5-йодцитидина, Ro 09-4620, (1,6 г, 3,66 ммоля) в 10 мл ДМФ добавляли в атмосфере Аr при комнатной температуре Рd2 (dba)3 (67 мг, 0,073 ммоля) и три-2-фурилфосфин (85 мг, 0,366 ммоля) и три-н-бутил(винил)станнан (2,1 мл, 7,318 ммоля). После перемешивания в течение 19 ч к реакционной смеси добавляли три-н-бутил(винил)станнан (2,1 мл, 7,318 ммоля) и затем реакционную смесь нагревали при перемешивании до 40°С в течение 24 ч. Растворитель удаляли под вакуумом и остаток очищали колоночной хроматографией на силикагеле (элюент: смесь 95:5 этилацетат:~СН2Сl2:МеОН), получая 2’,3’-ди-O-ацетил-5’-дезокси-5-винилцитидин (1,13 г, 92%) в виде бесцветного твердого вещества
МС:БТЯ-МС: (m/z) 338 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 1,33 (3Н, d, J=6,3), 2,05 (3Н, s), 2,06 (3Н, s), 4,05 (1H, quin., J=6,3), 5,14 (1H, d, J=10,8), 5,16 (1H, t, J=6,6), 5,54 (1H, d, J=17,2), 5,53 (1H, dd, J=6,9, 5,9), 5,73 (1H, d, J=4,3), 6,55 (1H, dd, J=17,2, 10,8), 7,20 (1H, br.s), 7,57 (1H, br.s), 7,88 (lH, s).
Пример 47
Получение 5’-дезокси-5-винилцитидина
К раствору 2’,3’-ди-O-ацетил-5’-дезокси-5-винилцитидина (111 мг, 3,29 ммоля) в 5 мл метанола при комнатной температуре добавляли 1н. NaOH (0,32 мл, 0,32 ммоля). После перемешивания в течение 1 ч к реакционной смеси добавляли 1н. НС1 (примерно 0,3 мл) и затем реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью твердофазной экстракции (MEGA Bond Elute LRC, элюент: Н2О ~ смесь 1:1 Н2О:МЕОН, ступенчатый градиент), получая 5’-дезокси-5-винилцитидин (82 г, 98%) в виде бесцветного твердого вещества.
МС: LC-MC: (m/z) 253,9 [М+Н]+.
1H-ЯМР: (270 МГц; ДМСО-d6): δ 1,29 (3Н, d, J=6,3), 3,68 (1H, m), 3,86 (1H, m), 4,08 (1H, m), 4,97 (1H, d, J=5,9), 5,12 (1H, d, J=11,1), 5,28 (1H, d, J=5,3), 5,50 (1H, d, J=17,2), 5,70 (1H, d, J=3,6), 6,58 (1H, dd, J=11,1, 17,2), 7,10 (1H, br.s), 7,42 (1H, br.s), 7,64 (1H, s).
Ниже представлены примеры фармацевтических препаратов, содержащих соединение, описанное в настоящем изобретении.
 При необходимости изготавливают таблетки с пленочным покрытием, включающим гидроксипропилметилцеллюлозу, тальк и краситель.
При необходимости изготавливают таблетки с пленочным покрытием, включающим гидроксипропилметилцеллюлозу, тальк и краситель.

При необходимости изготавливают таблетки с пленочным покрытием, включающим гидроксипропилметилцеллюлозу, тальк и краситель.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-ОКСИКАРБОНИЛЗАМЕЩЕННЫЕ 5'-ДЕОКСИ-5-ФТОРЦИТИДИНЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1993 |
|
RU2493162C1 |
| N-ОКСИКАРБОНИЛЗАМЕЩЕННЫЕ 5'-ДЕОКСИ-5-ФТОРЦИТИДИНЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1993 |
|
RU2458932C2 |
| 2`-АМИНО-2`-ДЕЗОКСИНУКЛЕОЗИДЫ - ИНГИБИТОРЫ РЕПРОДУКЦИИ ВИРУСОВ КОРИ И МАРБУРГ | 2003 |
|
RU2264409C2 |
| НОВЫЕ НУКЛЕОЗИДЫ, ИМЕЮЩИЕ БИЦИКЛИЧЕСКУЮ САХАРНУЮ ГРУППИРОВКУ, И СОДЕРЖАЩИЕ ИХ ОЛИГОНУКЛЕОТИДЫ | 1999 |
|
RU2211223C2 |
| ПРОИЗВОДНОЕ 3'-ЭТИНИЛЦИТИДИНА | 2007 |
|
RU2441876C2 |
| СПОСОБ СОЕДИНЕНИЯ НУКЛЕОЗИДОВ 3'-5'-МЕЖНУКЛЕОТИДНЫМ СИЛИЛЬНЫМ ЗВЕНОМ | 1991 |
|
RU2079508C1 |
| ЦИТИДИН-5-КАРБОКСАМИД МОДИФИЦИРОВАННЫЕ НУКЛЕОТИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2014 |
|
RU2732402C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2'-ФТОР-2'-АЛКИЛЗАМЕЩЕННЫХ ИЛИ ДРУГИХ ЗАМЕЩЕННЫХ РИБОФУРАНОЗИЛПИРИМИДИНОВ И ПУРИНОВ И ИХ ПРОИЗВОДНЫХ | 2005 |
|
RU2433124C2 |
| НОВЫЕ N-МОДИФИЦИРОВАННЫЕ 5-МЕТИЛ-2'-ДЕЗОКСИЦИТИДИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКОЗНУЮ АКТИВНОСТЬ | 2021 |
|
RU2766333C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 2-ДЕЗОКСИ-2-ФТОР-D-РИБОФУРАНОЗИЛ-ПИРИМИДИНОВ И ПУРИНОВ И ИХ ПРОИЗВОДНЫХ | 2005 |
|
RU2407747C2 |
Изобретение относится к производным 5’-дезоксицитидина общей формулы
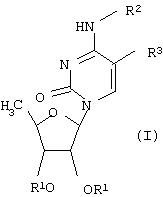
где R1 обозначает атом водорода или группу, которая легко гидролизуется в физиологических средах; R2 обозначает атом водорода или группу -CO-OR4, где R4 обозначает насыщенную углеводородную группу с прямой или разветвленной цепью, включающую от одного до пятнадцати атомов углерода, или группу формулы -(CH2)n-Y, где Y обозначает циклогексил или фенил, а n равно целому числу от 0 до 4; R3 обозначает атом водорода, брома, йода, цианогруппу, С1-С4алкильную группу, которая может быть замещена атомом (ами) галогена, винильную или этинильную группу, которая может быть замещена атомом (ами) галогена, С1-С4алкилом; при условии, что R2 и R3 не могут одновременно обозначать атом водорода. Соединения по изобретению обладают противоопухолевой активностью. Также изобретения относится к фармацевтическим композициям для лечения опухоли, содержащим в качестве активного компонента производное 5’-дезоксицитидина, отдельно или в сочетании с 5-фторурацилом или его производным. 3 н. и 4 з.п. ф-лы, 3 табл.
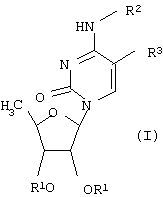
где R1 обозначает атом водорода или группу, которая легко гидролизуется в физиологических средах;
R2 обозначает атом водорода или группу -CO-OR4, где R4 обозначает насыщенную углеводородную группу с прямой или разветвленной цепью, включающую от одного до пятнадцати атомов углерода, или группу формулы -(CH2)n-Y, где Y обозначает циклогексил или фенил, а n равно целому числу от 0 до 4;
R3 обозначает атом водорода, брома, йода, цианогруппу, С1-С4алкильную группу, которая может быть замещена атомом(ами) галогена, винильную или этинильную группу, которая может быть замещена атомом(ами) галогена, С1-С4алкилом, при условии, что R2 и R3 не могут одновременно обозначать атом водорода.
5’-дезокси-5-этинилцитидин,
5’-дезокси-5-проп-1-инилцитидин,
5-бут-1-инил-5’-дезоксицитидин,
5’-дезокси-5-пент-1-инилцитидин,
5’-дезокси-5-гекс-1-инилцитидин,
5’-дезокси-5-йодцитидин,
5-бром-5’-дезоксицитидин,
5-(1-хлорвинил)-5’-дезоксицитидин,
5’-дезокси-5-винилцитидин,
5’-дезокси-5-трифторметилцитидин,
5-(3-бензилоксибензил)-5’-дезоксицитидин,
5-циан-5’-дезоксицитидин,
5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-N4-(н-пентилоксикарбонил)-5-проп-1-илцитидин,
5-бут-1-инил-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5’-дeзoкcи-5-пeнт-l-инил-N4-(н-пeнтилoкcикapбoнил)цитидин,
5’-дезокси-5-гекс-1-инил-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-йод-N4-(н-пентилоксикарбонил)цитидин,
5-бром-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5-(1-хлорвинил)-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
N4-(этоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-N4-(н-пропоксикарбонил)-5-винилцитидин,
N4-(н-бутоксиоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-N4-(н-пентилоксикарбонил)-5-винилцитидин,
N4-(бензилоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-N4-(н-пентилоксикарбонил)-5-трифторметилцитидин,
5-(3-бензилоксибензил)-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5-циан-5’-дезокси-N4-(н-пентилоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-(метоксикарбонил)цитидин,
5’-дезокси-N4-(этоксикарбонил)-5-этинилцитидин,
5’-дезокси-5-этинил-N4-(н-пропоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-(изопропоксикарбонил)цитидин,
N4-(н-бутоксикарбонил)-5’-дезокси-5-этинилцитидин,
5’-дезокси-5-этинил-N4-(изобутоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидин,
5’-дeзoкcи-5-этинил-N4-[(2-пропилпентилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-(изопентилоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-[(2-метилпентилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-[(3-метилпентилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-(н-гексилоксикарбонил)цитидин,
5’-дезокси-N4-[(2-этилбутил)оксикарбонил]-5-этинилцитидин,
5’-дезокси-N4-[(2-этилгексил)оксикарбонил]-5-этинилцитидин,
5’-дезокси-5-этинил-N4-[(2-фенилэтокси)карбонил]цитидин,
N4-(циклогексилоксикарбонил)-5’-дезокси-5-этинилцитидин,
N4-[(циклогексилметокси)карбонил]-5’-дезокси-5-этинилцитидин,
5’-дeзoкcи-5-этинил-N4-(неопентилоксикарбонил)цитидин,
5’-дезокси-N4-[(3,3-диметилбутокси)карбонил]-5-этинилцитидин,
2’,3’-ди-O-ацетил-5’-дезокси-5-этинил-N4-(н-пропоксикарбонил)цитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-этинил-N4-(н-пентилоксикарбонил)цитидин,
2’,3’-ди-О-ацетил-5’-дезокси-5-винилцитидин,
2’,3’-ди-O-ацетил-N4-(этоксикарбонил)-5’-дезокси-5-винилцитидин,
2’,3’-ди-O-aцeтил-5’-дeзoкcи-N4-(н-пpoпoкcикapбoнил)-5-винилцитидин,
2’,3’-ди-O-ацетил-N4-(н-бутоксикарбонил)-5’-дезокси-5-винилцитидин,
2’,3’-ди-O-ацетил-5’-дезокси-N4-(н-пентилоксикарбонил)-5-винилцитидин,
2’,3’-ди-О-ацетил-N4-(бензилоксикарбонил)-5’-дезокси-5-винилцитидин,
5’-дезокси-5-этинил-N4-(н-децилоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-[(2,6-диметилциклогексилокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-(бензилоксикарбонил)цитидин,
5’-дезокси-5-этинил-N4-[(1-изопропил-2-метилпропокси)карбонил]цитидин,
5’-дезокси-5-этинил-N4-[(3-метоксибензилокси)карбонил]цитидин.
| US 5472949 A, 05.12.1995.US 5453497 A, 26.09.1995.SU 1736342 A3, 23.05.1992. |
Авторы
Даты
2004-10-20—Публикация
1998-06-01—Подача