Настоящее изобретение относится к парентеральной композиции, включающей бисфосфоновую кислоту или ее фармацевтически приемлемую соль (бисфосфонат) в качестве активного компонента, фармацевтически приемлемый хелатирующий агент и фармацевтически приемлемые наполнители, способы получения данной композиции и способы ее применения в лечении и предотвращении заболеваний, включающих резорбцию костной ткани, особенно остеопороз, болезнь Педжета, гиперкальциемию при злокачественных опухолях и метаболическое нарушение костной ткани. Композиции особенно полезны для улучшения локальной толерантности активного компонента при парентеральном введении, особенно подкожным путем.
Бисфосфонаты, т.е. бисфосфоновые кислоты или их растворимые фармацевтически приемлемые соли, являются синтетическими аналогами природного пирофосфата. Благодаря их значительному сродству к твердофазному фосфату кальция бисфосфонаты прочно связываются с костным неорганическим веществом. Фармакологически активные бисфосфонаты хорошо известны специалистам и являются мощными ингибиторами костной резорбции и, следовательно, полезны в лечении и предупреждении заболеваний, включающих аномальную резорбцию костной ткани, особенно остеопороз, болезнь Педжета, гиперкальциемию при злокачественных опухолях и метаболические нарушения костной ткани.
Бисфосфонаты в качестве фармацевтических агентов описаны, например, в ЕР-А-170228, ЕР-А-197478, ЕР-А-22751, ЕР-А-252504, ЕР-А-252505, ЕР-А-258618, ЕР-А-350002, ЕР-А-273190, WO-A-90/00798 и т.д.
Фармацевтические формы продаваемых бисфосфонатов представляют собой лекарственные формы для перорального применения (таблетки или капсулы), или растворы для внутривенного введения, или инфузии. При введении в терапевтических дозах они имеют хорошую системную переносимость. Однако бисфосфонаты как класс соединений оказывают раздражающее действие на кожу и мембраны слизистой оболочки, приводя к побочным эффектам в пищеварительном тракте, например к нежелательным явлениям, относящимся к пищеводу или желудочно-кишечным нарушениям. Вследствие этого при использовании перорального пути введения следует придерживаться неудобных для пациента рекомендаций по применению. Внутривенный путь введения осложняется нежелательными проявлениями в случае неудачного применения. Если вена неточно найдена или если препарат случайно вводят вне вены, возникают местные тканевые реакции, включая некрозы. Таким образом, имеется существенная необходимость в улучшении фармацевтической лекарственной формы бисфосфонатов, чтобы уменьшить или избежать повреждения ткани после парентерального введения, особенно подкожным путем.
Патофизиологический механизм вызываемого бисфосфонатами повреждения ткани неизвестен. Поскольку местные реакции одинаковы для различных бисфосфонатов, по крайней мере те, которые вызваны азотсодержащими бисфосфонатами (аминобисфосфонатами), следует предположить для них общий механизм. Задержка начала и развития местных реакций может свидетельствовать о включении системы неспецифической иммунной защиты.
Были предприняты попытки улучшить толерантность тканей к бисфосфонатам путем создания суспензий нерастворимых или плохо растворимых солей бисфосфонатов, обеспечивающих замедленное высвобождение, описанное, например, в ЕР-А-913007740, DE-A-4244422 и DE-А-4244423. Однако доказано, что такой подход лишь незначительно улучшает локальную толерантность.
Поэтому проблема, лежащая в основе настоящего изобретения, состоит в получении композиции, которая способна свести к минимуму или исключить упомянутые выше недостатки.
По настоящему изобретению проблема решается с помощью вводимой парентерально композиции, включающей бисфосфонат, фармацевтически приемлемый хелатирующий агент и фармацевтически приемлемый наполнитель.
Заявители обнаружили, что введение бисфосфоната в композицию, включающую фармацевтически приемлемый хелатирующий агент, четко снижает продолжительность, частоту и интенсивность побочных эффектов. Присутствие дополнительного двухвалентного катионного хелатора, особенно EDTA (этилендиаминтетрауксусной кислоты) или DTPA (диэтилентриаминпентауксусной кислоты), существенно ослабляет нежелательную местную реакцию в участках введения при сравнении с соответствующими смесями без этого дополнительного двухвалентного катионного хелатора.
Если не указано иначе, следующие обозначения приняты для иллюстрации и определения значения и диапазона различных терминов, используемых для описания в контексте изобретения.
Термин “бисфосфонат” означает соединение, характеризующееся наличием двух связей С-РО
Термин “хелатирующий агент” или “хелатор” означает органическое или неорганическое соединение, которое посредством двух или нескольких своих функциональных групп образует устойчивые циклические комплексы с катионами металлов. Следует отметить, что бисфосфонаты также обладают хелатирующей активностью. Поэтому термин “хелатирующий агент” понимается как хелатор, который захватывает ионы металлов конкурентно по отношению к бисфосфонатам, используемым в качестве активного компонента в фармацевтической композиции.
Термин “фармацевтически приемлемый”, как он использован в контексте, означает, что соли или хелатирующие агенты являются приемлемыми с точки зрения токсичности.
Термин “фармацевтически приемлемая соль” относится к солям аммония, солям щелочных металлов, таким как калиевые соли или натриевые (включая моно-, ди- и тринатриевые) соли (которые являются предпочтительными), к солям щелочноземельных металлов, таким как кальциевые и магниевые соли, к солям с органическими основаниями, таким как соли дициклогексиламина, N-метил-D-глюкамина, и к солям с аминокислотами, такими как аргинин, лизин и т.д.
Термин “алкил”, один или в комбинации, означает алкильную группу с линейной цепью, разветвленной цепью или циклическую, содержащую максимум 30, предпочтительно максимум 10 и более, предпочтительно максимум 7 атомов углерода, например метил, этил, н-пропил, 2-метилпропил (изобутил), 1-метилэтил (изопропил), H-бутил, 1,1-диметилэтил (трет - бутил) и пентил. Термин “алкил” включает также обозначенные выше группы, необязательно замещенные фенилом, пиридилом, фуранилом, пирролидинилом, имидазолилом, амино-, моно- или диалкиламино, гидрокси, SH и алкокси.
Термин “разбавитель” означает ингредиент в лекарственном препарате, который лишен фармакологической активности, но является фармацевтически необходимым или желательным. Например, разбавителем может быть жидкость для растворения инъекционного препарата, например вода.
Термин “растворитель” относится к жидкости, которая удерживает другое вещество в растворе, т.е. растворяет его, например вода.
Термин “консервант” относится к веществу, добавляемому к фармацевтическому препарату, чтобы предотвратить рост бактерий.
Термин “устройство” означает приспособление для специальной цели. По настоящему изобретению цель состоит в том, чтобы сделать возможным, обеспечить или облегчить парентеральное введение препарата.
Термин “местный анестетик” относится к соединению, которое обратимо подавляет функцию нейрона в участке введения, вызывая потерю способности воспринимать боль и/или другие ощущения, как, например, гидрохлорид лидокаина.
Более подробно, настоящее изобретение относится к парентеральной композиции, включающей бисфосфонат и фармацевтически приемлемый хелатирующий агент. Парентеральные композиции могут иметь форму жидкости, например водного раствора, или стерильного порошка, и/или лиофилизата. Жидкость, например вода, может быть добавлена к стерильному порошку и/или лиофилизату, чтобы образовать раствор для введения.
В предпочтительном варианте воплощения по настоящему изобретению описанная выше композиция является жидкой, предпочтительно водным раствором.
Бисфосфонаты в качестве фармацевтических агентов описаны, например, в патенте US № 4509012, патенте US № 4666895, патенте US № 4719203, ЕР-А-252504, ЕР-А-252505, патенте US № 4777163, патенте US №5002937, патенте US №4971958, патенте US №4958839.
Способы получения бисфосфоновых кислот можно найти, например, в патенте US № 3962432, патенте US № 40-54592, патенте US № 4267108, патенте US № 4327039, патенте US № 4404761, патенте US № 4621077, патенте US № 4624947, патенте US № 47466654, патенте US № 4922077, патенте US № 4970335, патенте US № 5019651, патенте US № 4761406, патенте US № 4876248; J. Org. Chem. 32, 4111 (1967) и ЕР-А-252504. Фармацевтически приемлемые соли бисфосфоновых кислот также могут применяться по данному изобретению. Примеры солей бисфосфоновых кислот с основаниями включают соли аммония, соли щелочных металлов, такие как калиевые и натриевые (включая моно-, ди- и тринатриевые) соли (которые являются предпочтительными), соли щелочноземельных металлов, такие как кальциевые и магниевые соли, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, такими как аргинин, лизин и т.д. Предпочтительными являются нетоксичные, физиологически приемлемые соли. Соли могут быть получены известными специалистам способами, такими как описанные в публикации европейского патента № 252504 или в патенте US № 4922077.
В предпочтительном варианте воплощения по настоящему изобретению термин “бисфосфонат” соответствует по настоящему изобретению соединениям общей формулы
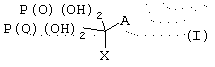
где А и Х независимо друг от друга выбирают из группы, состоящей из водорода, гидрокси, галоида, амино, SH, фенила, алкила, моно- или диалкиламино, моно- или диаминоалкила, алкокси, тиоалкила, тиофенила, и арильных или гетероарильных остатков, выбираемых из группы, состоящей из фенила, пиридила, фуранила, пирролидинила, имидазолила и бензила, где арильный или гетероарильный остаток необязательно замещен алкилом.
В приведенной выше химической формуле А может включать X, и Х может включать А, так что два остатка могут образовать часть одной и той же циклической структуры.
Предполагается также, что приведенная выше химическая формула охватывает карбоциклические, ароматические и гетероароматические структуры для заместителей А и/или X, например нафтил, хинолил, изохинолил, адамантил и хлорфенилтио.
Предпочтительными структурами являются те, в которых А выбирают из группы, состоящей из водорода, гидрокси и галоида, и Х выбирают из группы, состоящей из алкила, галоида, тиофенила, тиоалкила и диалкиламино алкила.
Более предпочтительными структурами являются те, в которых А выбирают из группы, состоящей из водорода, гидрокси и атома хлора, и Х выбирают из группы, состоящей из алкила, атома хлора, хлорфенилтио и диалкиламиноалкила.
Еще более предпочтительные структуры относятся к обозначенным выше соединениям при условии, что не включают алендронат.
Наиболее предпочтительными являются соединения, в которых А означает гидрокси и Х означает (N-метил-N-пентил)аминоэтил, т.е. ибандронат. Примеры бисфосфонатов, т.е. бисфосфоновых кислот и их фармацевтически приемлемых солей, которые могут применяться в качестве активных ингредиентов по данному изобретению, включают:
а) 4-амино-1-гидроксибутилиден-1,1-бисфосфоновую кислоту (алендронат),
б) N-метил-4-амино-1-гидроксибутилиден-1,1-бисфосфоновую кислоту,
в) 4-(N,N-диметиламино)-1-гидроксибутилиден-1,1-бисфосфоновую кислоту,
г) 3-амино-1-гидроксипропилиден-1,1-бисфосфоновую кислоту) (памидронат),
д) 3-(N-метил-N-пентил)амино-1-гидроксипропан-1,1-бисфосфоновую кислоту (ибандроновую кислоту),
е) моногидрат мононатриевой соли [3-(N-метил-N-пентил)амино-1-гидроксипропан-1,1-бисфосфоновой кислоты (ибандронат),
ж) 1-гидрокси-3-(N-метил-N-пентиламино)пропилиден-1,1 -бисфосфоновую кислоту,
з) 1-гидрокси-2-[3-пиридинил]этилиден-1,1-бисфосфоновую кислоту (ризендронат),
и) 4-(гидроксиметилен-1,1-дифосфоновая кислота)пиперидин,
к) циклогептиламинометилен-1,1-бисфосфоновую кислоту (цимадронат),
л) 1,1-дихлорметилен-1,1-дифосфоновую кислоту и динатриевую соль (клодронат),
м) 1 -гидрокси-3-(1-пирролидинил)пропилиден-1,1-бисфосфоновую кислоту (ЕВ-1053),
н) 1-гидроксиэтан-1,1-дифосфоновую кислоту (этидроновую кислоту),
о) 6-амино-1-гидроксигексилиден-1,1-бисфосфоновую кислоту (неридронат),
п) 3-(диметиламино)-1-гидроксипропилиден-1,1-бисфосфоновую кислоту (олпадронат),
р) [2-(2-пиридинил)этилиден]-1,1-бисфосфоновую кислоту (пиридронат),
с) (4-хлорфенил)тиометан-1,1-дифосфоновую кислоту (тилудронат),
т) 1-гидрокси-2-(1Н-имидазол-1-ил)этилиден-1,1-бисфосфоновую кислоту (золендронат),
у) [(циклогептиламино)метилен]бисфосфоновую кислоту (икадронат) и/или
ф) [1-гидрокси-2-имидазо-(1,2-а)пиридин-3-илэтилиден]бисфосфоновую кислоту и их фармацевтически приемлемые соли.
В предпочтительном варианте воплощения изобретения бисфосфонаты могут быть выбраны из группы, состоящей из соединений пунктов б-ф и их фармацевтически приемлемых солей.
Предпочтительными являются бисфосфонаты, выбранные из группы, состоящей из цимадроната, клодроната, тилудроната, этидроната, ибандроната, ризедроната, пиридроната, памидроната, золендроната и их фармацевтически приемлемых солей.
В более предпочтительном варианте воплощения настоящего изобретения бисфосфонат представляет собой 3-(N-метил-N-пентил)амино-1-гидроксипропан-1,1-бисфосфоновую кислоту (ибандроновую кислоту) или ее фармацевтически приемлемые соли, или даже более предпочтительно моногидрат мононатриевой соли 3-(N-метил-N-пентил)амино-1-гидроксипропан-1,1-бисфосфоновой кислоты.
Фармацевтически приемлемый хелатирующий агент, или хелатор, или его фармацевтически приемлемая соль по настоящему изобретению представляет собой соединение, которое образует посредством двух или нескольких функциональных групп устойчивые циклические комплексы с катионами металлов, например предпочтительно полиуксусная кислота или ее фармацевтически приемлемая соль, подобная EDTA и DTPA. Хелатирующие агенты являются сложными соединениями, которые в отличие от простых лигандов, например ферроцианида [Fe(CN)64-], образующих комплексные соли с помощью одной связи за счет свободной электронной пары, способны к образованию более чем одной связи. Например, этилендиамин является бидентатом (две связи), трипиридил является тридентатом (три связи), а этилендиаминтетрауксусная кислота (EDTA) является гексадентатом (шесть связей), что делает ее особенно эффективной в качестве фармацевтического хелатирующего агента. Одним из последствий хелатирования является образование циклической структуры, которая обладает высокой термодинамической и термической устойчивостью, аналогичной таковой для ароматических циклов. Более того, хелатный комплекс обычно более устойчив, чем лиганд, поскольку должно произойти разрушение двух связей, и хотя одна связь может разорваться, ее восстановление наступает до разрыва другой. Это явление известно как хелатный эффект.
Предпочтительно хелатирующий агент является двухвалентным катионным хелатором, и более предпочтительно, хелатор выбирают из группы, состоящей из этилендиаминтетрауксусной кислоты (EDTA), диэтилентриаминпентауксусной кислоты (DTPA), этиленгликоль-бис-β-аминоэтиловый эфир)тетрауксусной кислоты (EGTA), N-(гидроксиэтил)этилендиаминтриуксусной кислоты (HEDTA), нитрилотриуксусной кислоты (NTA), триэтаноламина, 8-гидроксихинолина, лимонной кислоты, винной кислоты, фосфорной кислоты, глюконовой кислоты, сахариновой кислоты, тиодипропионовой кислоты, ацетондикарбоновой кислоты, лецитина, ди(гидроксиэтил)глицина, фенилаланина, триптофана, глицерина, сорбита и их фармацевтически приемлемых солей.
Более предпочтительно, хелатирующий агент выбирают из группы, состоящей из EDTA, DTPA, лимонной кислоты, винной кислоты, фосфорной кислоты, глюконовой кислоты или их фармацевтически приемлемых солей, и еще более предпочтительно, фармацевтически приемлемым агентом является EDTA, или DTPA, или их фармацевтически приемлемая соль.
В предпочтительном варианте воплощения настоящего изобретения молярное соотношение между бисфосфонатом и фармацевтически приемлемым хелатирующим агентом составляет примерно 1:0,01 до примерно 1:500, более предпочтительно примерно 1:0,1 до примерно 1:50, и еще более предпочтительно примерно 1:10.
Например, смесь, содержащая 1 мг ибандроната/мл физиологического раствора, доведенного до рН 7,4. К раствору ибандроната прибавляют EDTA в диапазоне концентраций 0,1-10 мг/мл. Это соответствует молярным соотношениям ибандроната и EDTA приблизительно 1:0,1-1:10, Показано, что улучшающее действие EDTA является дозозависимым. При самом низком соотношении 1:0,1 еще наблюдается некоторое благоприятное воздействие, а при самом высоком соотношении 1:10 еще не удается полностью избежать нежелательных местных реакций. Таким образом, можно ожидать, что намного более высокие и более низкие молярные соотношения будут также применимы для улучшения местной толерантности вводимых парентерально бисфосфонатных смесей. Кроме того, влияние EDTA на местную реакцию, вызываемую алендронатом, а также эффективность EDTA в качестве хелатирующего агента также могли бы быть продемонстрированы.
Композиция, как описанная выше, может содержать один или несколько дополнительных фармацевтически приемлемых хелатирующих агентов, как обозначенные выше.
Наполнителями могут быть выбранные разбавители, растворители и/или консерванты, например вода, спирты, полиолы, глицерин и растительные масла. Композиции по настоящему изобретению могут содержать один или несколько этих фармацевтически приемлемых наполнителей.
В предпочтительном варианте воплощения по настоящему изобретению композиция, как описанная выше, может включать бисфосфонат или его фармацетически приемлемую соль, фармацевтически приемлемый хелатирующий агент, тонический агент (регулирующий тоничность агент, как описанный ниже), регулирующий рН агент (т.е. основание, буфер, как описанные ниже) и растворитель. Кроме того, эти композиции необязательно могут содержать местный анестетик.
В более предпочтительном варианте по настоящему изобретению значение рН раствора вышеописанных композиций находится в диапазоне 2-10, предпочтительно 4-9, более предпочтительно 6-8, и наиболее предпочтительно 7-8, например около 7,4.
В еще более предпочтительном варианте воплощения по настоящему изобретению приведенная выше композиция является парентеральной композицией, включающей:
а) 0,1-10 мг моногидрата мононатриевой соли 3-(N-метил-N-пентил)амино-1-гидроксипропан-1,1-бисфосфоновой кислоты;
б) 0,5-50 мг дигидрата динатриевой соли EDTA.
Например, приведенная выше композиция может включать:
а) 0,1-10 мг моногидрата мононатриевой соли 3-(N-метил-N-пентил)амино-1-гидроксипропан-1,1 -бисфоновой кислоты;
б)DT-50 мг дигидрата динатриевой соли EDTA;
в) примерно 9,0 мг хлорида натрия;
г) гидроксид натрия в достаточном количестве до рН примерно 7,4;
д) воду для инъекции в достаточном количестве до 0,5 или 10 мл.
Более подробно, композиция для парентерального введения может содержать примерно 1,125 мг натриевой соли ибандроната, примерно 10 мг дигидрата динатриевой соли EDTA, примерно 9,0 мг хлорида натрия, гидроксид натрия в достаточном количестве до рН 7,4 и воду для инъекции в достаточном количестве до 1,0 мл.
Предпочтительно композиция для парентерального введения может содержать примерно 1,125 мг натриевой соли ибандроната, примерно 10 мг дигидрата динатриевой соли EDTA, примерно 5,78 мг гидрохлорида лидокаина, примерно 9,0 мг хлорида натрия, гидроксид натрия в достаточном количестве до рН 7,4 и воду для инъекции в достаточном количестве до 1,0 мл.
Кроме того, изобретение раскрывает способ получения композиции, как описанная выше, включающий смешивание самое меньшее одного бисфосфоната по меньшей мере с одним фармацевтически приемлемым хелатирующим агентом и фармацевтически приемлемым наполнителем.
Изобретение включает также способ получения композиции, как описанная выше, путем смешивания самое меньшее одного бисфосфоната по меньшей мере с одним фармацевтически приемлемым хелатирующим агентом и местным анестетиком.
Композиции по настоящему изобретению применимы для лечения и предотвращения заболеваний, включая резорбцию костной ткани, особенно остеопороз, болезнь Педжета, гиперкальциемию при злокачественных опухолях и метаболическое поражение костной ткани. Кроме того, изобретение раскрывает способ лечения и предотвращения заболеваний, включая резорбцию костной ткани, особенно остеопороз, болезнь Педжета, гиперкальциемию при злокачественных опухолях и метаболическое поражение костной ткани, включающий этап введения пациенту композиции, как описанная выше.
Кроме того, изобретение включает устройство для местного и системного введения с замедленным высвобождением, включая композицию, как описанная выше.
Более подробно, композиция, как описанная выше, может содержать дополнительные наполнители, выбранные из растворителей и сорастворителей (воды для инъекции, этанола, глицерина, пропиленгликоля или полиэтиленгликоля, различных масел), солюбилизирующих, увлажняющих, суспендирующих или загущающих агентов (карбоксиметилцеллюлозы, Cremophore EL, дезоксихолата натрия, желатина, лецитина, полисорбата 20 и 80, полоксамера), антиоксидантов и восстанавливающих агентов (аскорбиновой кислоты, бисульфита натрия, метабисульфита натрия), антимикробных консервантов (бензилового спирта, пропилпарабена и метилпарабена), буферов и регулирующих рН агентов (ацетатного, цитратного, лактатного, хлористоводородной кислоты, гидроксида натрия), средств защиты организма и регуляторов тоничности (хлорида натрия, глюкозы, маннита) или местного анестетика (лидокаина, бензокаина, прокаина, тетракаина).
В предпочтительном варианте воплощения по настоящему изобретению композиция является парентеральной, включающей бисфосфонат и фармацевтически приемлемый хелатирующий агент(ы), как описанные выше.
Парентеральный путь введения композиций, как описанные выше, обычно включает подкожную, внутримышечную, внутривенную, трансдермальную, внутрикожную, интраназальную, внутриартериальную и внутрибрюшинную инъекцию или инфузию. Предпочтительно парентеральный путь включает подкожную, внутримышечную и внутривенную инъекцию или инфузию, и более предпочтительно подкожную инъекцию или инфузию.
Кроме того, изобретение относится к применению описанных выше композиций для получения лекарственных средств, используемых при лечении и предотвращении заболеваний, включающих резорбцию костной ткани, особенно остеопороз, болезнь Педжета, гиперкальциемию при злокачественных опухолях и метаболическое поражение костной ткани. Изобретение относится также к применению вышеупомянутой композиции для получения лекарственных средств, используемых для предупреждения повреждения ткани после парентерального введения бисфосфонатов, предпочтительно путем введения водного раствора.
Помимо этого, изобретение относится также к устройству для местного и системного замедленного высвобождения, включающего композицию, как описанная выше. Например, такие устройства могут состоять из имплантированных осмотических насосов или расположенных снаружи портативных инфузионных насосов, соединенных со снабжающей емкостью и/или вшитой под кожу канюлей.
Кроме того, изобретение относится также к устройствам, делающим возможным, обеспечивающим или облегчающим парентеральное введение композиции, как описанная выше. Например, может применяться устройство для достижения местного и системного замедленного высвобождения, включающее портативные инфузионные насосы, соединенные со снабжающей емкостью и/или вшитой под кожу канюлей (например, портативное инъекционное устройство; патент US № 886999), или для ослабления локальной боли, вызванной инъекцией, например безыгольными инжекторами (например, MicroPor, Medijectorтм).
Кроме того, изобретение относится также к инъекционным смесям, которые высвобождают композицию, как описанная выше, замедленным образом и могут ослабить локальную боль, вызванную инъекцией. Например, смесь замедленного высвобождения может включать образующие депо-форму соединения, такие как различные фармацевтически приемлемые масла, загустители (карбоксиметилцеллюлоза, полаксамер, желатин), биодеградируемые микрочастицы, образующие полимеры (полимеры на основе лактида/гликолида, полиангидриды, хитозан), или фармацевтически приемлемые полиэлектролиты (альбумин, протамин).
Далее изобретение будет подробно иллюстрировано следующими примерами и чертежами.
Пример 1: локальная толерантность, опыт I.
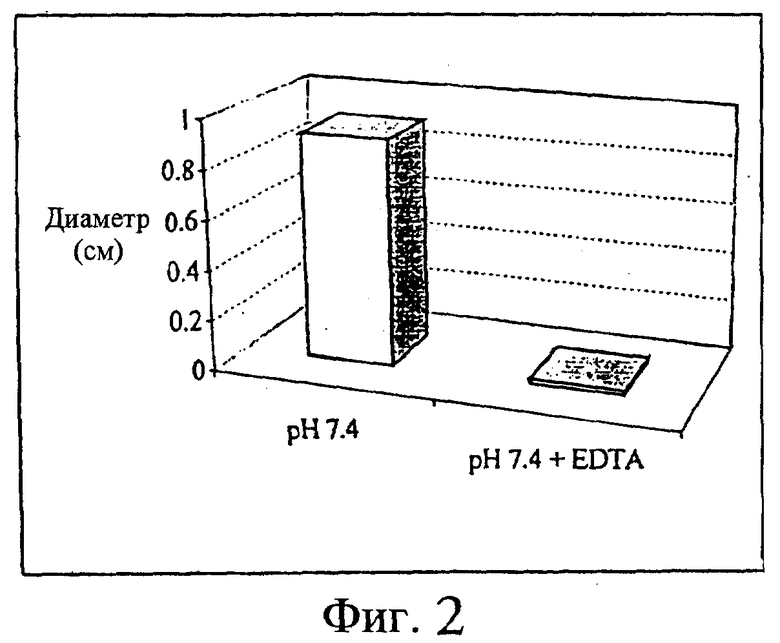
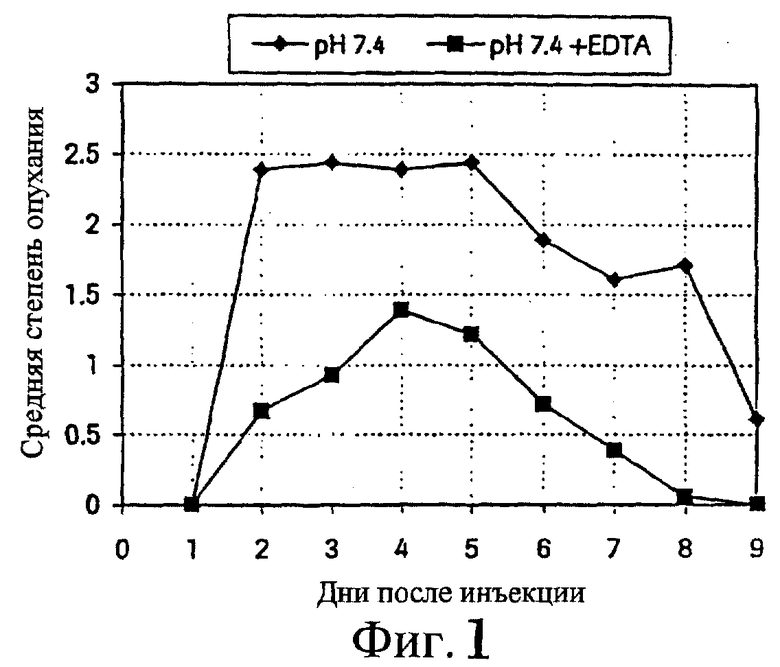
Группы из 3 крыс обрабатывали исследуемыми смесями, содержащими 1 мг ибандроната/мл физиологического раствора, забуференного при рН 7,4. Одна группа крыс получала исследуемый раствор без дополнительных добавок, другая группа получала исследуемый раствор с 1 мг/мл EDTA в качестве добавки. За день до обработки крысам выбривали спину. Три объема, по 5 мл каждый, вводили подкожно в три разных участка правой части бритой спины. Левую сторону спины обрабатывали соответствующей смесью без ибандроната (плацебо). Местные реакции оценивали по системе баллов для опухания: 0 -отсутствие реакции, 0,5 - едва заметное опухание, 1 - легкое опухание, 2 -умеренное опухание, 3 - выраженное опухание, 4 - сильное опухание. Животных наблюдали в течение 9 дней, после чего вскрывали. При вскрытии измеряли диаметр подкожных поражений, в основном состоящих из покраснения или опухания. Результаты представлены на фиг.1 и 2.
Пример 2: местная толерантность, опыт II.
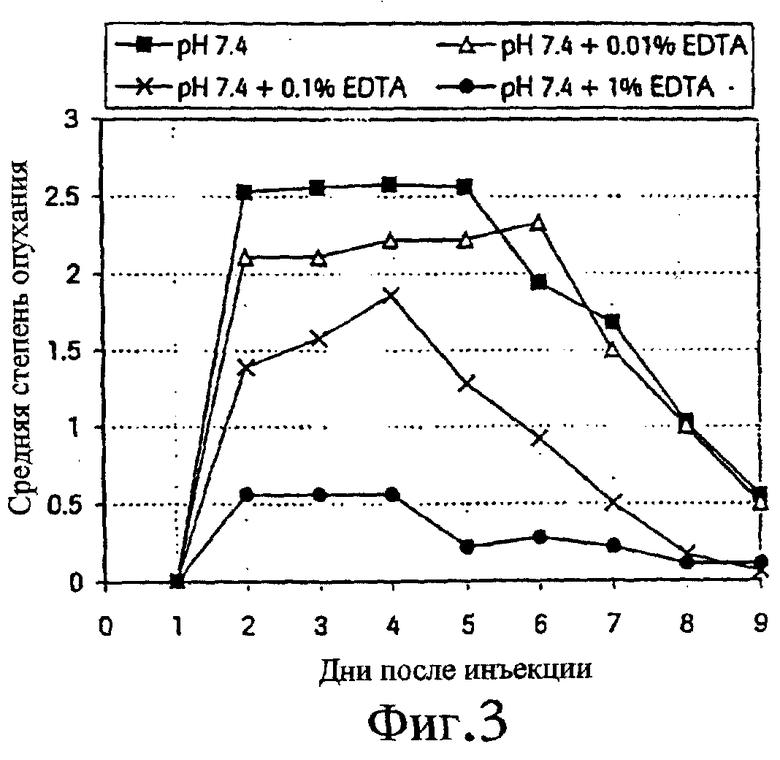
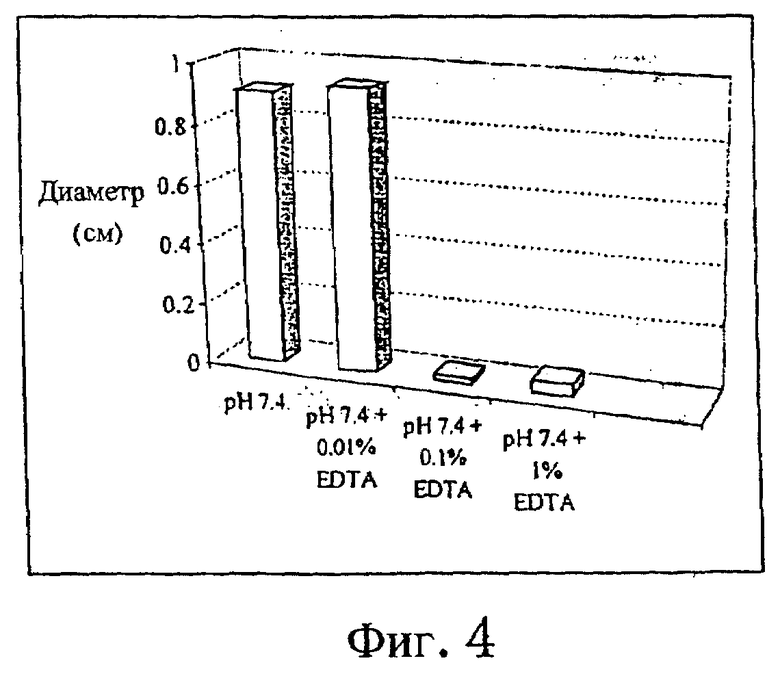
Такую же схему, как описанная в примере 1, использовали для исследования зависимости действия EDTA от концентрации. Прибавляли EDTA в концентрациях 0,1, 1,0 и 10 мг/мл. Результаты представлены на фиг.3 и 4.
Пример 3: местная толерантность, опыт III.
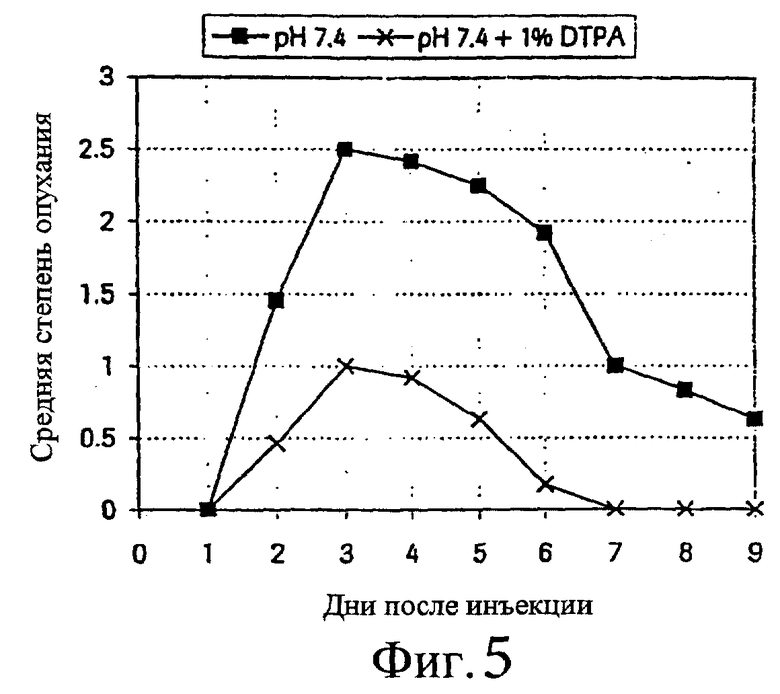
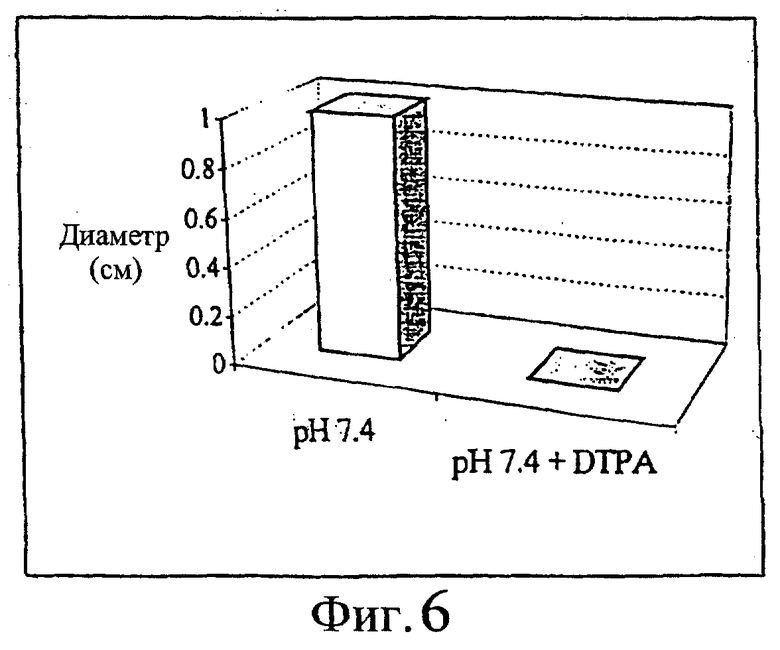
Такую же схему, как описанная в примере 1, использовали для исследования эффективности DTPA при местной реакции на подкожно введенный ибандронат. Прибавляли DTPA в концентрации 10 мг/мл. Результаты приведены на фиг.5 и 6.
Пример 4: местная толерантность, опыт IV.
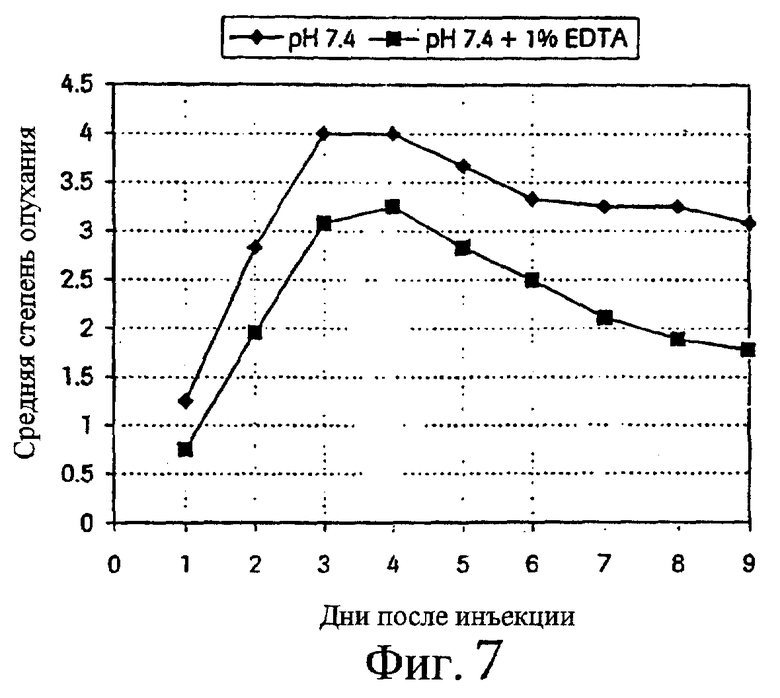
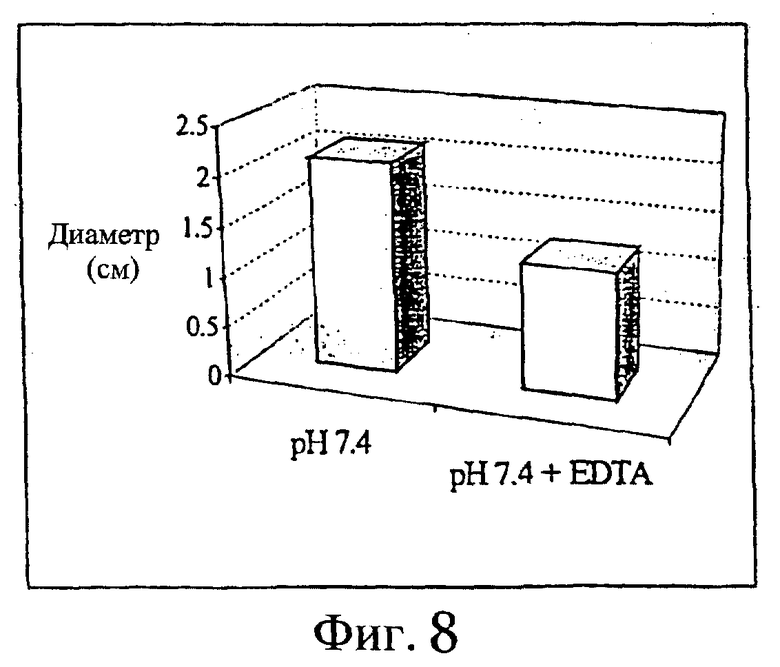
Такую же схему, как описанная в примере 1, использовали для исследования эффективности EDTA при местной реакции на подкожно введенный алендронат. Исследуемые смеси содержали 3 мг алендроната/мл физиологического раствора, забуференного при рН 7,4. Прибавляли EDTA в концентрации 10 мг/мл. Результаты представлены на фиг.7 и 8.
В результате имеется четкое доказательство, что присутствие такого хелатирующего агента, как EDTA или DTPA, в лекарственных формах для инъекции таких бисфосфонатов, как алендронат или ибандронат, уменьшает как интенсивность и продолжительность локального опухания в участке инъекции, так и тяжесть подкожных поражений, обнаруженных при вскрытии через 9 дней.
Пример 5: парентеральная композиция I, мг:
Натриевая соль ибандроната 1,125
Дигидрат динатриевой соли EDTA 10,0
Хлорид натрия 9,0
Гидроксид натрия в достаточном количестве До рН 7,4
Вода для инъекции в достаточном количестве До 1,0 мл
Пример 6: парентеральная композиция II, мг:
Натриевая соль ибандроната 1,125
DTPA 10,0
Хлорид натрия 9,0
Гидроксид натрия в достаточном количестве До рН 7,4
Вода для инъекции в достаточном количестве До 1,0 мл
Пример 7: парентеральная композиция III, мг:
Алендронат 3,0
Дигидрат динатриевой соли EDTA 10,0
Хлорид натрия 9,0
Гидроксид натрия в достаточном количестве До рН 7,4
Вода для инъекции в достаточном количестве До 1,0 мл
Пример 8: парентеральная композиция IV, мг:
Натриевая соль ибандроната 1,125
Дигидрат динатриевой соли EDTA 10,0
Гидрохлорид лидокаина 5,78
Хлорид натрия 9,0
Гидроксид натрия в достаточном количестве До рН 7,4
Вода для инъекции в достаточном количестве До 1,0 мл
Подписи к чертежам
Фиг.1 - средняя степень опухания после подкожной инъекции раствора ибандроната, рН 7,4, с 0,1% EDTA и без нее (n=9).
Фиг.2 - средний диаметр подкожных изменений через 9 дней после подкожной инъекции раствора ибандроната, рН 7,4, с 0,1% EDTA и без нее (n=9).
Фиг.3 - средняя степень опухания после подкожной инъекции раствора ибандроната, рН 7,4, с EDTA и без нее (n=9). Данные с 0,1% EDTA объединены с результатами первого опыта (n=18).
Фиг.4 - средний диаметр подкожных изменений через 9 дней после подкожной инъекции раствора ибандроната, рН 7,4, с EDTA и без нее (n=9). Данные с 0,1% EDTA объединены с результатами первого опыта (n=18).
Фиг.5 - средняя степень опухания после подкожной инъекции раствора ибандроната, рН 7,4, с 1% DTPA и без нее (n=12).
Фиг.6 - средний диаметр подкожных изменений через 9 дней после подкожной инъекции раствора ибандроната, рН 7,4, с DTPA и без нее (n=12).
Фиг.7 - средняя степень опухания после подкожной инъекции раствора алендроната, рН 7,4, с 1% EDTA и без нее (n=9).
Фиг.8 - средний диаметр подкожных изменений через 9 дней после подкожной инъекции раствора алендроната, рН 7,4, с EDTA и без нее (n=9).
Композиция может быть использована для лечения заболеваний, включающих резорбцию костной ткани, таких как остеопороз, болезнь Педжета, гиперкальциемия при злокачественных опухолях и метаболическое нарушение костной ткани. Композиция включает бисфосфонат в качестве активного компонента, фармацевтически приемлемый хелатирующий агент и фармацевтически приемлемый эксципиент. Хелатирующий агент выбран из EDTA и DTPA. Также описан способ получения композиции и устройство для местного и системного замедленного высвобождения. Устройство содержит указанную композицию и состоит из имплантированных осмотических насосов или расположенных снаружи портативных инфузионных насосов, соединенных со снабжающей емкостью и/или вшитой под кожу канюлей. Композиция особенно полезна для улучшения местной толерантности при парентеральном введении бисфосфоната, позволяет уменьшить или избежать повреждения ткани, набухания и/или боли. 3 с. и 20 з.п. ф-лы, 8 ил.
| US 4666895 А, 19.05.1987 | |||
| WO 9531203 А1, 23.11.1995 | |||
| ОЁ ПОЛУЧЕНИЯ | 0 |
|
SU203649A1 |
| ПРОИЗВОДНЫЕ МЕТИЛЕНБИСФОСФОНОВОЙ КИСЛОТЫ | 1990 |
|
RU2074860C1 |
Авторы
Даты
2004-10-27—Публикация
2001-01-16—Подача