Изобретение относится к средствам, стимулирующим остеогенез, и может найти применение в экспериментальной медицине и ветеринарии.
Проблема стимуляции остеогенеза, наряду с изысканием возможностей управления регенерацией костной ткани, является одной из актуальных (в частности, ортопедии/травматологии и ветеринарии) (У.Я.Багдонович, Д.Л.Акбердина, 1976, Р.И.Каем, В.Д.Карлов, 1981, Г.И.Лаврищева, Г.А.Оноприенко, 1996, И.В.Деревянко, 2001). Это обусловлено большим количеством больных ортопедо-травматологического профиля с повреждениями, протекающими с угнетением репаративного остеогенеза, а также заболеваниями опорно-двигательного аппарата, в патогенезе которых лежит дисбаланс нормального костеобразования (например, остеопороз).
Известно, что общебиологическая стимуляция репаративных процессов (в т.ч. и костной ткани) осуществляется парентеральным введением белковых препаратов, альбумина, протеина, анаболических препаратов, применением пиримидиновых и пуриновых производных (пентоксил, метилурацил, оротат калия) (В.И.Русаков, 1976, С.М.Буловецкий с соавт., 1981). Применительно к костной ткани, кроме общебиологической стимуляции репаративных процессов в ней, используются препараты, восполняющие дефицит кальция в организме, которые стимулируют фазу кальцификации костного матрикса, не влияя на скорость образования белковой матрицы кости - скорость образования которой и определяет скорость остеогенеза в целом (Слуцкий, 1969).
В качестве прототипа можно использовать препарат “Остеогенон” (Osteogenon), который применяется для лечения различных форм остеопороза, а также для ускорения заживления переломов костей (“РЛС - Энциклопедия лекарств”, 2001, стр.656).
Остеогенон при системном остеопорозе применяется внутрь по 2-4 таблетки (одна таблетка покрытая оболочка, 830 мг), а для ускорения заживления переломов 1-2 таблетки в сутки (“РЛС - Энциклопедия лекарств”, 2001, стр.656). По мнению создателей препарата, остеогенона, получаемого из костной ткани животных, он останавливает (уменьшает резорбцию костной ткани (тормозит остеокласты) и стимулирует костеобразования (активирует остеобласты) (“РЛС -Энциклопедия лекарств”, 2001, стр.1110). Из негативной стороны следует отметить, что препарат эффективен только при длительном (от нескольких месяцев до года) применении, возможность обострения заболевания у больных с мочекаменной болезнью, контроля уровня кальция и фосфора в моче, дороговизна препарата.
Новизной предлагаемого изобретения и его отличием является использование лиганда опиатных рецепторов - налоксона гидрохлорида - для стимуляции нормального и репаративного остеогенеза.
Налоксона гидрохлорид - порошкообразное светочувствительное вещество белого цвета с молекулярной формулой C19H21NO4·HCl с молекулярной массой 363,8, является антагонистом мю-, сигма-, каппа- опиоидных рецепторов. Растворимость в воде 50 мг/мл, в этаноле 3,4 мг/мл.

В качестве стимулятора нормального и репаративного остеогенеза предлагается применение раствора налоксона гидрохлорида в 1/15М фосфатном буфере Зеренсен рН 7,36 в качестве растворителя следующего состава:
- налоксона гидрохлорид – 150 мкг/кг;
- фосфатный буфер Зеренсен рН 7,36, 1/15 М - 0,1 мл.
Так как налоксона гидрохлорид (в эксперименте использовали препарат, выпускаемый фирмой “Sigma”) - это порошкообразное вещество, то для парентерального введения необходимо приготовить раствор, а в литературе (равно как и в документации Московского представительства “Sigma”) отсутствуют сведения о рН раствора налоксона гидрохлорида в зависимости от растворителя, мы решили использовать изотоничный крови стерильный 1/15 М фосфатный буфер Зеренсен с рН 7,36 в качестве растворителя производства фирмы “Sigma”.
В настоящее время налоксона гидрохлорид используется только для диагностики и лечения острого отравления наркотическими анальгетиками и гипотонии при септическом шоке.
Изучение влияния налоксона гидрохлорида на остеогенез проводилось на двух моделях: нормальный остеогенез изучался на модели эмбрионального остеогенеза куриных эмбрионов, а репаративный остеогенез изучался на модели закрытого перелома обеих костей правой голени мышей весом 25-30 г.
Изучение влияния налоксона гидрохлорида на нормальный остеогенез
Инкубировали оплодотворенные куриные яйца кросса “Смена-2” при температуре 38,5° С, влажности воздуха - 85% в условиях инкубатора. Яйца ежесуточно переворачивались в автономном режиме. Куриный эмбрион (яйцо) на 11 сутки инкубации взвешивали, помещали в прибор для просвечивания и определяли локализацию крупной вены у края воздушной камеры по следующим признакам:
1. плавность контуров;
2. ветвление в направлении воздушной камеры;
3. кровоток в направлении воздушной камеры.
На скорлупе поверх вены карандашом отмечали прямоугольник размером 1× 0,5 см. Фрезой, вставленной в турбинный наконечник бормашины, по контуру прямоугольника прорезывали скорлупу. Вырезанный участок скорлупы с наружной частью подскорлуповой оболочки снимали глазным пинцетом, следя за тем, чтобы прорезывание скорлупы не приводило к повреждению хорионалантоисной мембраны. Полученное яйцо ставили в подставку для яиц и выполняли инъекцию налоксона гидрохлорида в дозе 150 мкг/кг в объеме 0,1 мл в серии “А” или инъекцию 0,1 мл 1/15 М фосфатного буфера Зеренсен рН 7,36 в серии “В” по направлению тока крови, то есть в направлении воздушной камеры. Кончик иглы слегка загибали кверху для того, чтобы в вену входить под наибольшим тупым углом. В скорлупе над воздушной камерой просверливали бором небольшое отверстие для компенсации подъема давления в зародыше. После инъекции отверстие заклеивали липкой лентой и инкубировали яйцо обычным способом в инкубаторе.
Описанным выше способом инъекции налоксона гидрохлорида в дозе 150 мкг/кг, разведенного в 0,1 мл 1/15 М фосфатного буфера Зеренсен рН 7,36 и инъекции только 0,1 мл 1/15 М фосфатного буфера Зеренсен рН 7,36 выполняли на 11, 13, 15 или на 14, 16, 18 сутки инкубации для оценки степени влияния налоксона гидрохлорида на рост костной ткани на второй и третьей неделе развития эмбриона. Инъекции фосфатного буфера выполняли только для исключения влияния растворителя на результаты исследования.
Материал для гистологического исследования костной ткани забирали на 21 сутки через 2 ч после вылупления птенцов. Гистологические препараты костной ткани куриных эмбрионов приготавливали по стандартной методике (В.И.Меркулов с соавт., 1973) с последующей окраской полученных парафиновых срезов гематоксилин-эозином и по методу Ван-Гизона.
Приготовленные гистологические препараты костной ткани куриных эмбрионов были подвергнуты морфометрическому анализу по методу Автандилова в 5 сериях опытов по следующим критериям:
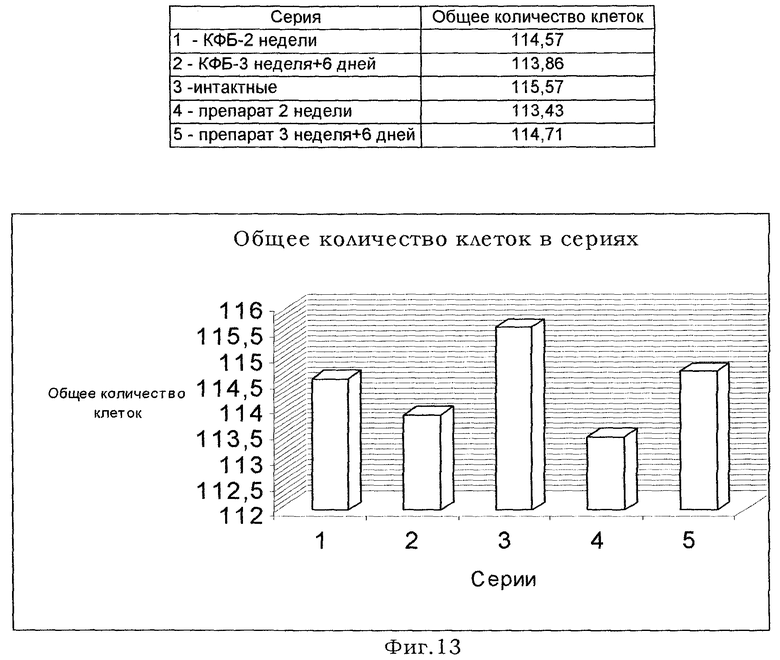
1. Определение общего количества клеток в сериях (результаты исследования представлены на фиг.9)
2. Определение среднего количества митозов на 100 клеток (фиг.8; фиг 1-5)
3. Определение среднего количества остеобластов (фиг.10) в сравниваемых сериях
4. Определение среднего количества остеоцитов (фиг.11)
5. Определение средней толщины перихондральной костной манжетки (ТПКМ) в мкм (фиг.12; фиг.6-7)
Характеристика сравниваемых серий опытов, результаты которых отражены на фиг.8-12, отражена также в таблице 1.

Исследования влияния раствора налоксона гидрохлорида в 1/15 М фосфатном буфере Зеренсен с рН 7,36 (далее по тексту - препарат) на нормальный остеогенез, проведенные на 150 куриных эмбрионах показали, что препарат, вводимый на 3 неделе эмбриогенеза, стимулирует митотическую активность в зоне роста бедренной кости (фиг.1), что проявляется увеличением количества митозов в 6,56 раза по сравнению с интактными эмбрионами (р<0,01) (фиг.2, фиг.8). Количество митозов на 100 клеток при введении препарата эмбрионам составляет в среднем 13,3, a y интактных эмбрионов 2,5. Данная тенденция сохраняется и при сравнении митотической активности в зоне роста бедренной кости у эмбрионов с введением на 3 неделе эмбриогенеза препарата и у эмбрионов, подвергшихся воздействию фосфатного буфера. Количество митозов в данном случае при введении препарата увеличилось в 5,3 раза (р<0.01) (фиг.1, 3 и 8). Количество митозов на 100 клеток при введении препарата составило 13,3 и 2,0 при введении фосфатного буфера. Следует отметить, что препарат, вводимый на 2 неделе эмбриогенеза, не изменяет число митозов (фиг.4) (не влияет на их проявление) по сравнению с интактными эмбрионами и эмбрионами, подвергшихся действию фосфатного буфера (фиг.5 и 8).
Для исключения влияния фосфатного буфера на нормальный остеогенез нами проведен морфометрический анализ гистологических препаратов куриных эмбрионов, которым вводился фосфатный буфер на 2 и 3 неделе эмбриогенеза.
При этом установлено, что фосфатный буфер, вводимый на 2 и 3 неделе развития куриного эмбриона не стимулирует митозы (фиг.8) в зоне роста бедренной кости, не влияет на плотность клеток (фиг.9) костной ткани (число клеток в поле зрения), не влияет на среднее число остеобластов (фиг.10) и среднее число остеоцитов (фиг.11), определяемых на площади 4 мм2 костной ткани по сравнению с интактными эмбрионами.
Методом морфометрического анализа нами проведено изучение влияния препарата на клеточный состав зоны роста бедренной кости куриного эмбриона. При этом установлено, что введение препарата на 2-3 неделе развития куриного эмбриона не влияет на плотность клеток костной ткани (фиг.9) (число клеток в поле зрения), ни на среднее число остеобластов (фиг.10), определяемых на площади 4 мм2 костной ткани по сравнению с интактными эмбрионами и с эмбрионами, подвергшимися воздействию фосфатного буфера.
Нами также изучен интегральный показатель эмбрионального остеогенеза - толщина перихондральной костной манжетки (ТПКМ). При этом установлено, что препарат, вводимый на 2 неделе эмбриогенеза, вызывал увеличение ТПКМ по сравнению как с интактными эмбрионами так и с эмбрионами, подвергшимися действию фосфатного буфера на 100% (р<0,01) (фиг.6; 7 и 12).
Введение препарата на 3 неделе эмбриогенеза сопровождается статистически значимым приростом ТПКМ по сравнению как с интактными эмбрионами (39,9%) так и с эмбрионами, подвергшимися действию фосфатного буфера (37,3%) (фиг.12).
Таким образом, введение препарата на 2 неделе развития куриных эмбрионов приводит к стимуляции эмбрионального остеогенеза, которая к моменту завершения созревания эмбрионов проявляется возрастанием его интегрального показателя - ТПКМ. На этом фоне отсутствие увеличения числа митозов к 21 дню является логическим продолжением завершения пролиферации, протекавшей в более ранние сроки.
Введение препарата на 3 неделе эмбриогенеза также приводит к стимуляции эмбрионального остеогенеза, что проявляется возрастанием числа митозов. На этом фоне снижение числа остеоцитов отражает не недостаточность их образования, а характеризует незавершенность формирования костной манжетки, т.е. процесса дифференцировки костных клеток. Последнее, вероятно, связано с небольшим сроком реализации эффекта препарата, для проверки чего нами была поставлена дополнительная серия экспериментов (результаты которых приведены на фиг.13 и 14) с введением препарата на 3 недели инкубации (14, 16, 18 сутки) и анализом влияния его на остеогенез через 6 суток жизни птиц. Характеристика серий опытов отражена в таблице 2. При таком режиме опыта были получены данные, идентичные введению препарата на 2 неделе инкубации с анализом на 21 сутки инкубации.
Мы не обнаружили изменений в других органах и тканях (головной мозг, печень, сердце), кроме костной, под влиянием раствора налоксона гидрохлорида в дозе 150 мкг/кг, разведенным 1/15 М фосфатным буфером Зеренсен рН 7,36 на светооптическом уровне.

Изучение влияния налоксона гидрохлорида на репаративный остеогенез проводилось на 120 мышах линии С2ВL57, У которых под эфирным наркозом между браншами пинцетов наносили закрытый перелом обеих костей правой голени. Все мыши были поделены на 3 группы: интактные - группа, в которой наносился перелом и без инъекционного вмешательства, контрольная группа - в ней наносился перелом и внутрибрюшинно троекратно (через 2, 48 и 96 часов после травмы) вводилось 0.1 мл фосфатного буфера Зеренсен 1/15 М с рН 7.36, который являлся растворителем для налоксона гидрохлорида, и опытная группа - в ней наносился перелом и внутрибрюшинно троекратно (через 2, 48 и 96 часов после травмы) вводился налоксона гидрохлорид в дозе 150 мкг/кг, растворенный в 0.1 мл фосфатного буфера Зеренсен 1/15 М с рН 7.36.
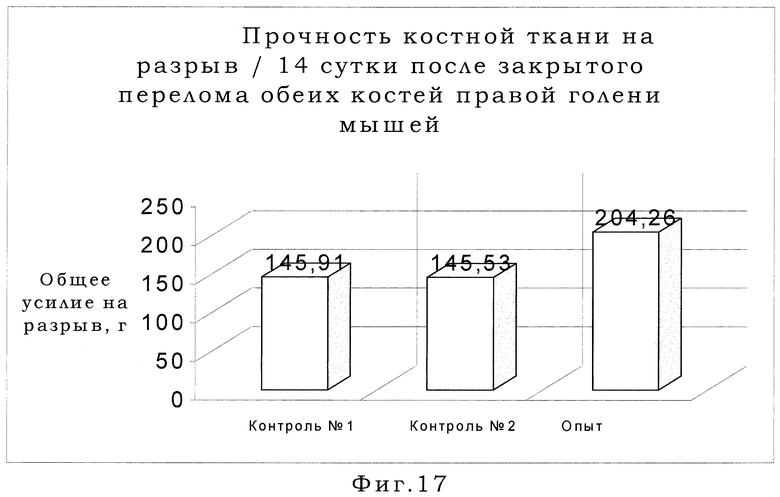
Влияние раствора налоксона гидрохлорида на течение костной репарации изучали с применением рентгенологического, гистологического методов исследования, а также теста механической прочности костной мозоли по А.В.Чукичеву. Для чего на 7, 11, 14, 21 сутки после травмы по 15 животных из каждой серии выводили из эксперимента путем трансцервикальной дислокации, 10 из которых производилось препаративное выделение обеих костей голени с последующей рентгенографией и тестом механической прочности на разрыв, а оставшимся 5 также проводилось выделение обеих костей голени с последующей фиксацией в 10% нейтральном растворе формалина для последующего изготовления гистологических препаратов по вышеуказанной методике.
Исследованиями установлено, что под влиянием налоксона гидрохлорида достоверно возрастала прочность сращения отломков костей голени по сравнению с обеими контрольными группами. Результаты сравнения теста механической прочности костной мозоли на разрыв контрольных и опытной групп представлены в таблице 3 и на фиг.15-18. Нами достоверно установлено, что уже на 7 сутки после травмы величина усилия, необходимого для разрыва срастающихся отломков у мышей-реципиентов, налоксона гидрохлорида увеличилась в 2 раза (р<0.01) по сравнению с обеими контрольными группами (таблица 3; фиг.15). Далее на 11, 14, 21 сутки после перелома наблюдалась тенденция к уменьшению разницы величины усилия на разрыв костной мозоли в опытной и контрольной группах ввиду процессов консолидации переломов. Но прочность костной мозоли в опытной группе была всегда достоверно выше (р<0.001) по сравнению с обеими контрольными группами (таблица 3; фиг.16, 17, 18).

В ходе исследования макропрепаратов установлено, что патологическая подвижность отломков у травмированных мышей-реципиентов раствора налоксона гидрохлорида значительно уменьшалась на 7 сутки после травмы по сравнению с мышами-реципиентами фосфатного буфера и интактными мышами. При этом сформированная костная мозоль появлялась у всех опытных мышей к 7 суткам после перелома, в то время как в контрольной группе только у 20% животных. При этом костная мозоль в контрольных группах всегда была менее выражена чем в опытной группе животных. В ходе проведенного нами гистологического исследования процесса сращения перелома в опытной и контрольных группах установлено, что уже на 7 сутки после травмы наблюдаются значительные различия в гистологической картине места перелома вышеуказанных групп животных. Так, в опытной группе на 7 сутки после травмы определяется гистологическая картина (фиг.19) довольно-таки активного костеобразования. В межотломковой щели наблюдаются единичные остатки кровяного сгустка, определяется незрелая волокнистая ткань, остатки грануляционной ткани. Значительная часть незрелой волокнистой ткани состоит из фибробластических клеток при наличии немногочисленных и тонких коллагеновых и ретикулиновых волокон на фоне скопления лимфоцитов, макрофагов и эритроцитов.
Отличия в гистологической картине места перлома опытной и контрольных групп животных сохраняются и на 14 сутки после травмы. Так, в опытной группе отмечается выраженная картина костеобразования (фиг.21). Диастаз между отломками заполнен зрелой, дифференцированной грубо-волокнистой соединительной тканью, в которой наблюдаются очаги гиалинового хряща. Вдали от места перелома на эндостальной поверхности определяется густая сеть зрелых костных балок.
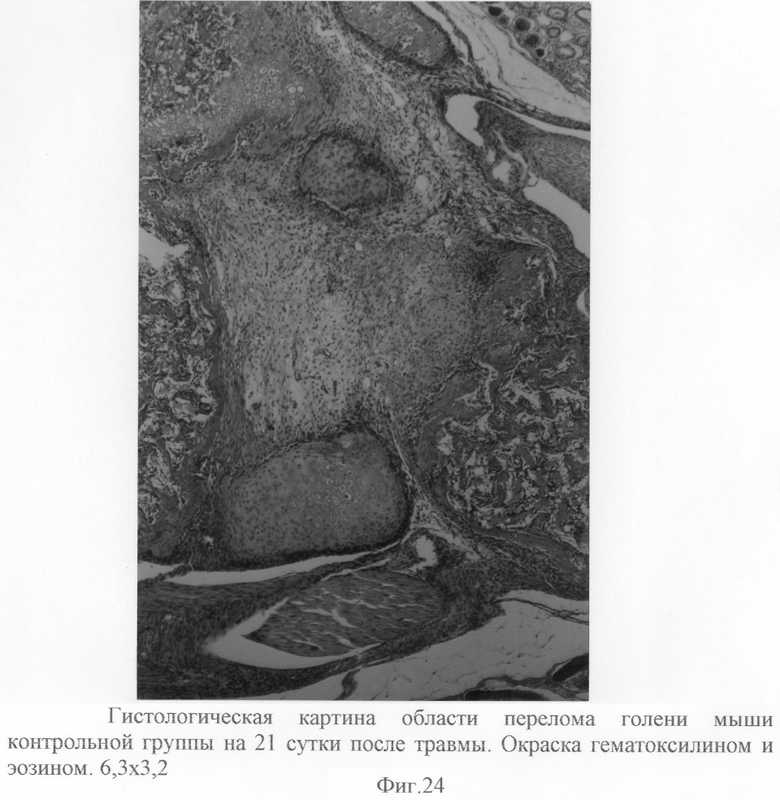
В то же самое время гистологическая картина места перелома контрольной группы животных на 14 сутки после травмы (фиг.22) представлена только начальными элементами костеобразования - в межотломковой щели наблюдается дифференцированная соединительная ткань с сетью капилляров и синусоидов. Наблюдаются также некоторое увеличение сети костных балок, эндостальное костеобразование (умеренной степени зрелости и незрелое), умеренное увеличение периостального костеобразования. Сохраняются различия в гистологической картине места перелома контрольной и опытной групп и на 21 сутки после травмы. Так, гистологическая картина костной мозоли опытной группы (фиг.23) в данные сроки после перелома характеризуется тем, что в месте диастаза (межотломковой щели) наблюдаются зрелые костные балки, характеризующие сращение перелома. Межотломковая щель, как таковая, не дифференцируется (не визуалируется). Костная мозоль контрольной группы животных на 21 сутки после перелома (фиг.24) представлена грубоволокнистой соединительной тканью с очагами гиалинового хряща, умеренной сетью костных балок.
С помощью рентгенологического метода нами произведено исследование места перелома на 7, 14, 21 сутки после травмы у животных контрольной и опытных групп. Установлено, что уже на 7 сутки в опытной группе определяются признаки слаборентгеноконтрастной мозоли (фиг.25С). В то же время исследование места перелома у животных контрольной группы признаков костной мозоли не выявило (фиг.25А, В).
Сохраняются различия в рентгенологической картине места перелома у животных контрольной и опытных групп и на 14 сутки после травмы. На рентгенограмме места перелома животных опытной группы (фиг.26С) видна хорошо выраженная костная мозоль. Края костных отломков не дифференцируются, что свидетельствует о сращении перелома. В то же время на рентгенограмме места перелома у животных контрольной группы видна только слаборентгеноконтрастная мозоль (фиг.26А, В).
На 21 сутки после перелома у животных опытной группы (фиг.27С) видна хорошо выраженная костная мозоль с явлениями реканализации костномозгового канала. В контрольной группе животных рентгенологическая картина места перелома представлена умеренно выраженной костной мозолью, менее интенсивной, чем в опытной группе, без признаков реканализации (фиг.27А, В).
Таким образом, налоксона гидрохлорид - средство, стимулирующее репаративный остеогенез.
Проведенное исследование свидетельствует о высокой биологической активности налоксона гидрохлорида по отношению к процессам костной репарации у животных с переломами длинных трубчатых костей, что открывает перспективу для его использования в лечении данной патологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2010 |
|
RU2429002C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСКОЛЬЧАТЫХ ПЕРЕЛОМОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ | 2003 |
|
RU2253393C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2015 |
|
RU2606257C1 |
| СПОСОБ И ПРЕПАРАТ ДЛЯ УСКОРЕНИЯ КОНСОЛИДАЦИИ ПЕРЕЛОМОВ КОСТЕЙ | 2013 |
|
RU2548776C2 |
| ПРИМЕНЕНИЕ ТРУТНЕВОГО РАСПЛОДА С СОЕДИНЕНИЯМИ КАЛЬЦИЯ ДЛЯ УСКОРЕНИЯ КОНСОЛИДАЦИИ ПЕРЕЛОМОВ КОСТЕЙ | 2015 |
|
RU2589263C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО СВОЙСТВОМ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ХРЯЩЕВОЙ, КОСТНОЙ, МЫШЕЧНОЙ ТКАНЕЙ И СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ХРЯЩЕВОЙ, КОСТНОЙ, МЫШЕЧНОЙ ТКАНЕЙ С ИСПОЛЬЗОВАНИЕМ ПРИГОТОВЛЕННОГО СРЕДСТВА | 2013 |
|
RU2527701C1 |
| СПОСОБ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА В ЭКСПЕРИМЕНТЕ | 2022 |
|
RU2783642C1 |
| СПОСОБ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2008 |
|
RU2373883C1 |
| ОСТЕОИНДУЦИРУЮЩИЙ МАТЕРИАЛ "ИНДОСТ" (ВАРИАНТЫ) | 2006 |
|
RU2317088C1 |
| Способ стимуляции репаративного остеогенеза на ранних стадиях посттравматического периода | 2018 |
|
RU2676659C1 |
























Изобретение относится к средствам стимуляции остеогенеза и может найти применение в экспериментальной медицине и ветеринарии. Разрабатываемый препарат налоксона гидрохлорид эффективно стимулировал нормальный (физиологический) и репаративный остеогенез. Изобретение расширяет арсенал средств заявленного назначения. 3 табл., 27 ил.
Применение налоксона гидрохлорида в качестве средства для стимуляции нормального и репаративного остеогенеза.
| Реферат из АБД Medline: Hall TJ et al | |||
| The analgetic drug buprenorphine inhibits osteoclastic bone resorbtion in vitro, but is proinflammatory in rat adjuvant arthritis | |||
| Inflamm Res | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| ПРИМЕНЕНИЕ ОПИОИДНОГО ПЕПТИДА DAGO ДЛЯ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА У ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2000 |
|
RU2195311C2 |
| US 6261582 B1, 17.07.2001 | |||
| Экономайзер | 0 |
|
SU94A1 |
| НЕМСАДЗЕ О.Д | |||
| и др | |||
| Применение стимуляторов репаративного остеогенеза в комплексном лечении хронического периодонтита и корневой кисты челюстей | |||
| Методические рекомендации | |||
| - Тбилиси, 1990, с.1-15 | |||
| Энциклопедия лекарств | |||
| - М.: РЛС, 2001, с.585, статья “налоксон”. | |||
Авторы
Даты
2004-11-20—Публикация
2003-03-31—Подача