Предполагаемое изобретение относится к области медицины, а именно к созданию способа, обладающего свойствами, стимулирующими регенерацию хрящевой, костной, мышечной тканей при лечении переломов длинных костей конечностей.
В процессе онтогенеза экспрессируются факторы роста, которые могут запускать основополагающие процессы дифференцировки и роста тканей. Однако в растущем и зрелом организме способность регенерировать структурно и функционально поврежденные ткани в значительной степени утрачивается. Снижение способности к регенерации обусловлено снижением экспрессии факторов роста, которые, в свою очередь, контролируют экспрессию белков, необходимых для синтеза тканей. Среди многочисленных эндогенных факторов, обладающих контрольно-регуляторными функциями, важное место отводится интерферонам (IFN).
Интерфероны относятся к семейству белков, оказывающих разнообразные эффекты на клетки-мишени, обладающие антивирусной, иммуномодулирующей активностью. В зависимости от клеток продуцентов различают следующие субтипы: альфа субтип, бета субтип, гамма субтип (1).
Интерферон-бета оказывает воздействие на разные клетки организма, являясь медиатором иммунного ответа, включая экспрессию молекул главного комплекса гистосовместимости, цитокиновых рецепторов для фактора некроза опухолей, интерлейкинов, колониестимулирующих факторов и других факторов роста (2).
Известно средство широкого спектра действия, используемое в том числе для стимуляции регенерации хрящевой и соединительной ткани. Препарат, содержащий интерферон человеческий рекомбинантный альфа-, и/или бета-, и/или гамма-типов и антиоксидантный комплекс из токоферола ацетата и аскорбиновой кислоты или ее солей, дополнительно содержит хондроитин-сульфат, глюкозамин. В качестве основы использованы полимеры, например, поливиниловый спирт, полиэтиленоксиды, обладающие свойствами стимуляции синтеза соединительной, хрящевой, костной тканей (патент РФ № 2349339, МПК А61К 38/21, А61Р 37/02, А61Р 19/02, опубл. 20.03.2009, Бюл. № 8), (3).
Вместе с тем, указанный препарат является многокомпонентным с широким спектром действия, выполнен в виде геля, мази, крема, пленки и используется в комплексном лечении заболеваний инфекционно-воспалительного характера, сопровождающихся деструктивными процессами или предрасположенностью к ним.
Известно средство полиэтиленгликоль (ПЭГ) - химическое вещество, которое обладает свойствами, позволяющими использовать его в качестве носителя для биоорганических молекул, например белков, и создавать депо лекарственного вещества. Поэтому введение соединений лекарственного вещества с ПЭГ способствует улучшению фармакокинетических и фармакодинамических свойств, увеличению времени полувыведения и соответственно снижению колебаний концентрации препарата в организме, увеличению его стабильности и биологической активности (патент RU 2 433 135), (4).
Известны различные способы стимуляции регенерации структурно и функционально поврежденных тканей с использованием различных препаратов и технологии их применения.
Так, известен способ стимуляции репаративного остеогенеза при переломах костей. Способ заключается в инъекционном введении в близлежащие к месту перелома или ложного сустава мягкие ткани и (или) подкожно в проекции патологического очага диспергированного биоматериала аллоплант, разведенного в физиологическом растворе в соотношении 50 мг биоматериала на 5-15 мл раствора, в количестве 1-10 инъекций за один сеанс по 0,1-15 мл в одной инъекции, количеством сеансов от 1 до 10 с промежутком 1-7 суток (патент РФ № 2364361, МПК А61В 17/56, опубл. 20.08.2009, Бюл. № 23), (5).
К недостаткам данного способа следует отнести то, что количество инъекций может быть от одной до десяти, что определяется особенностями перелома. Кроме того, лечение проводят курсами с количеством сеансов 1-10 за курс с промежутком между сеансами 1-7 суток, что значительно увеличивает продолжительность лечения.
Также известен способ стимуляции репаративного остеогенеза при замещении дефектов кости, возникших в результате травмы или после резекции кости. Способ включает инъекционную имплантацию в зону костного повреждения культивированных аутологичных костно-мозговых стромальных клеток-предшественников. При этом имплантацию клеток проводят в период завершения воспаления в зоне костного повреждения и начала естественного остеогенеза, 3-5 раз с интервалом в 2-3 дня (патент РФ № 2373883, МПК А61В 17/56, опубл. 27.11.2009 Бюл. № 33), (6).
Недостатками данного способа являются:
- операционный или пункционный путь забора части костного мозга у пациентов, что связано с дополнительной травматизацией;
- сложность технологии приготовления взвеси аутологичных костно-мозговых стромальных клеток-предшественников, что требует дополнительных затрат в связи с необходимостью использования соответствующего оборудования и дорогостоящих реактивов.
Наиболее близким к предлагаемому является способ оптимизации репаративного остеогенеза, включающий введение в костно-мозговой канал места перелома или зону ложного сустава предварительно измельченного биоматериала аллоплант для склеропластики с аутокровью в виде взвеси 5 измельченных пластин биоматериала аллоплант в 5 мл аутокрови. Взвесь вводят однократно путем инъекции иглой Гордеева с диаметром отверстия 2 мм (патент РФ №2315580, МПК A61B 17/56, опубл. 27.01.2008 Бюл. №3), (7).
Возможность оптимизации репаративной регенерации костной ткани авторы изучали в условиях экспериментального перелома длинных трубчатых костей при нестабильности отломков и наличия между ними диастаза более 0,5 мм путем сочетанного применения предварительно измельченного биоматериала аллоплант для склеропластики и аутокрови.
Недостатками известного способа являются:
- возможность нарушения асептики, связанной с необходимостью предварительного измельчения пластин биоматериала в крошку для получения взвеси;
- ограничение применения данного способа у пациентов с хроническими инфекциями (например вирусными гепатитами B, C и др.) в связи с невозможностью заготовки и использования аутокрови;
- травматичностью в связи с большими размерами иглы Гордеева и необходимостью доступа в костно-мозговой канал.
Указанное выше явилось основанием для разработки нового способа лечения на основе интерферона-бета и полиэтиленгликоля (ПЭГ 6000), обладающего дополнительными свойствами, необходимыми для стимуляции регенерации хрящевой, костной, мышечной тканей при повреждениях длинных костей конечностей.
Исходя из существующего уровня технологий стимуляции регенерации тканей при переломах, а также используемых средств, и устранения недостатков известных способов была поставлена задача: повысить эффективность лечения при переломах длинных костей, снизить его травматичность за счет подбора оптимальной концентрации используемых препаратов, упрощения технологии стимуляции регенерации тканей в зоне перелома, а также снизить частоту гнойно-воспалительных осложнений. Поставленную задачу решают следующим образом.
Способ стимуляции регенерации хрящевой, костной, мышечной тканей включает репозицию перелома длинной кости и введение приготовленного средства в костно-мозговой канал и окружающую мышечную ткань. Новым в предлагаемом способе является то, что стимулируют регенерацию тканей путем введения в костно-мозговой канал и окружающую мышечную ткань смеси растворов рекомбинантного интерферона бета (IFN-β) в концентрации 1∙105 ЕД/мл и полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 6000) с концентрацией 0,03∙10-9 моль/мл в соотношении 1:4 соответственно, после чего осуществляют ретроградный интрамедуллярный остеосинтез перелома длинной кости.
Поясняем существенные отличительные признаки предлагаемого способа, обладающего свойствами, стимулирующими регенерацию хрящевой, костной, мышечной тканей, и способа лечения с использованием приготовленного средства.
Именно использование средства путем смешивания водных растворов рекомбинантного интерферона-бета (IFN-β) в концентрации 1∙105 ЕД/мл и полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 6000) в качестве полимерного носителя с концентрацией 0,03∙10-9 моль/мл в соотношении растворов 1:4 соответственно позволяет создать депо лекарственного вещества и пролонгировать его действие, обеспечивая длительный биологический эффект при однократном применении.
Традиционные способы введения препаратов интерферона (ИФ) характеризуются быстрым всасыванием из тканей, большим объемом распределения, низкой стабильностью, коротким периодом полувыведения, что ограничивает эффективность их действия. В связи с чем для поддержания терапевтических концентраций возникает необходимость частых введений препарата в высоких дозах, что может привести к возникновению нежелательных побочных эффектов.
Использование полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 60000) в качестве полимерного носителя в концентрации 0,03∙10-9 моль/мл обеспечивает пролонгированность биологических эффектов интерферона-бета.
Выполнение стимуляции регенерации хрящевой, костной, мышечной тканей путем однократного введения смеси водных растворов рекомбинантного интерферона-бета (IFN-β) и полиэтиленгликоля в объеме 0,1 мл, содержащем 2000 ЕД интерферона-бета (2∙103 IFN-β), обеспечивает длительное воздействие на репаративный процесс в области костной травмы со стимуляцией роста костной и хрящевой тканей и стимуляцией регенерации мышечной ткани.
Осуществление ретроградного интрамедуллярного остеосинтеза перелома длинной кости после однократного введения вышеуказанного приготовленного средства позволяет улучшить микроциркуляцию в зоне перелома за счет стимуляции ангиогенеза.
Проведенные патентные исследования по подклассам A61K 38/21, A61P 19/00, A61B 17/56 и анализ научно-медицинской информации, отражающей существующий уровень способов стимуляции регенерации хрящевой, костной, мышечной, тканей, и способ лечения с использованием приготовленного средства не выявили идентичных технологий. Таким образом, предлагаемый способ и его использование для лечения переломов длинных костей, является новым.
Взаимосвязь и взаимодействие существенных приемов предлагаемого способа, обладающего свойством стимуляции регенерации хрящевой, костной, мышечной тканей, и способ лечения с использованием приготовленного средства обеспечивают достижение нового результата в решении поставленной задачи, а именно повысить эффективность лечения переломов длинных костей, снизить его травматичность за счет подбора оптимальной концентрации используемых препаратов, упростить технологию стимуляции регенерации тканей в зоне перелома.
Технический результат обеспечивается тем, что средство, обладающее активностью интерферона-бета и пролонгированным действием за счет использования полиэтиленгликоля, способствует улучшению микроциркуляции вокруг поврежденных тканей в зоне перелома за счет стимуляции ангиогенеза. Осуществление ретроградного интрамедуллярного остеосинтеза перелома длинной кости после однократного введения предлагаемого средства стимулирует структурную регенерацию хрящевой, костной, мышечной тканей.
Положительным достижением предлагаемого способа является:
- снижение частоты гнойно-воспалительных осложнений;
- ускоренное образование структурной костной мозоли в области перелома;
- усиление энхондрального окостенения;
- стимуляция ангиогенеза;
- стимуляция миогенеза.
Предлагаемый способ с использованием средства, обладающего активностью IFN-β и пролонгированным действием за счет использования полиэтиленгликоля, позволяет получить положительный эффект - длительное воздействие на репаративный процесс в области костной травмы со стимуляцией роста костной, хрящевой тканей и стимуляцией регенерации мышечной ткани при однократном применении действующего вещества.
Таким образом, предлагаемый способ стимуляции регенерации хрящевой, костной, мышечной тканей с использованием средства, приготовленного из рекомбинантного IFN-β и высокомолекулярного полимера - полиэтиленгликоля с молекулярным весом 6000 (ПЭГ 6000), имеет изобретательский уровень.
Предлагаемый способ стимуляции регенерации хрящевой, костной, мышечной тканей с использованием приготовленного средства перспективен и может широко применяться в клинической практике, в отделениях травматологии и ортопедии.
Сущность предлагаемых объектов интеллектуальной собственности поясняется иллюстрациями, где показано:
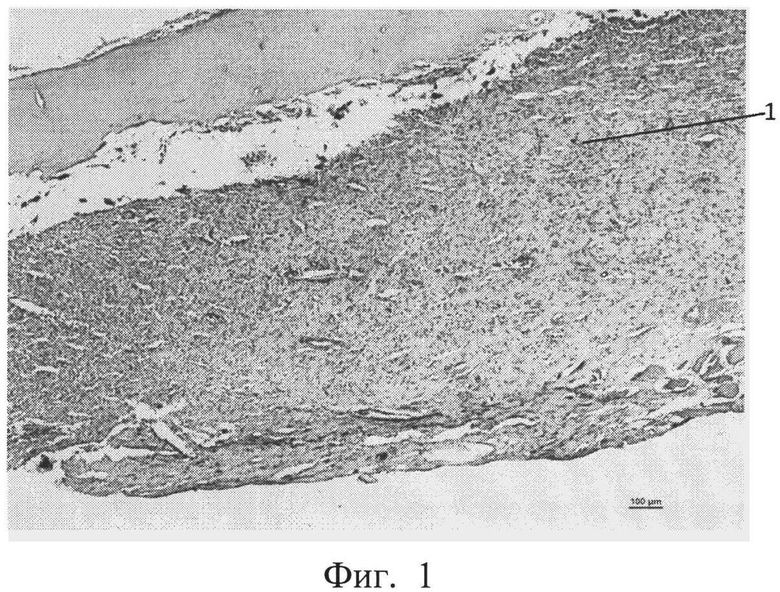
фиг.1 - морфологическая фотография зоны перелома у животного контрольной группы на 9 сутки, видна фиброзная мозоль (позиция 1),
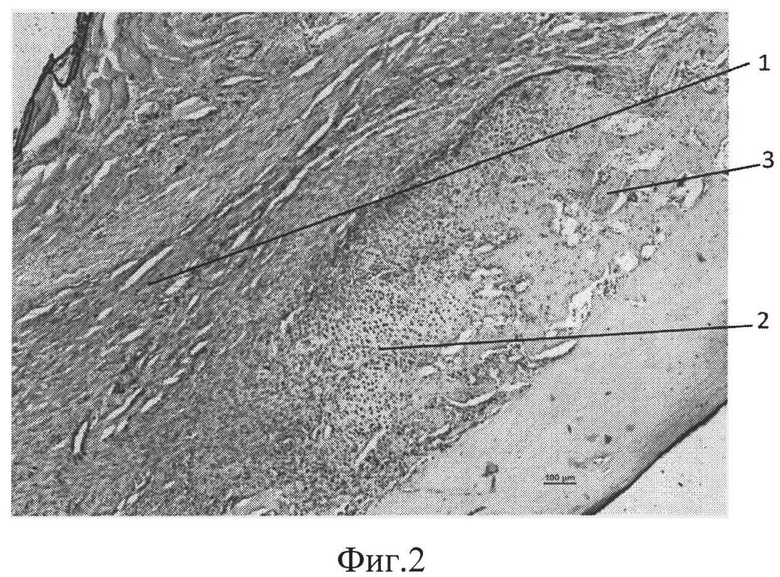
фиг.2 - морфологическая фотография зоны перелома у животного опытной группы на 9 сутки, видна мозоль, представленная фиброзной (позиция 1), хрящевой (позиция 2) и периостальной костной мозолью (позиция 3),
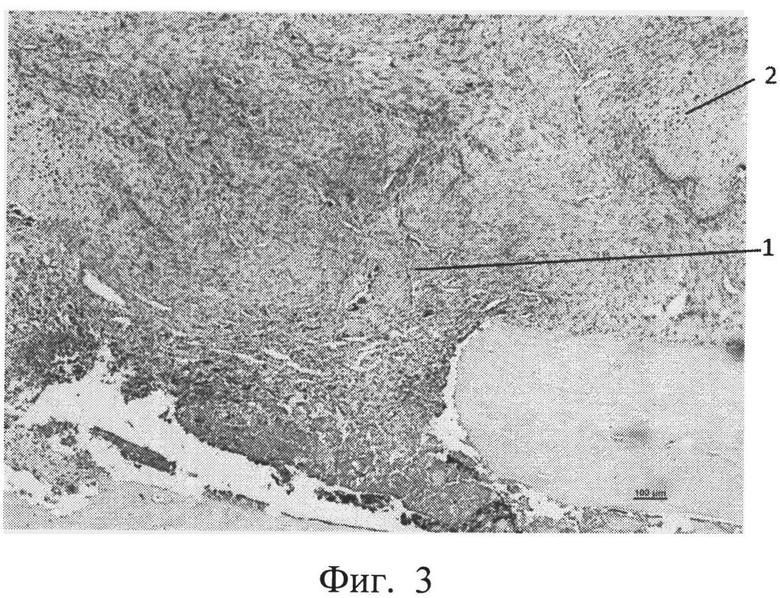
фиг.3 - морфологическая фотография зоны перелома у животного контрольной группы на 14 сутки, видна фиброзная мозоль (позиция 1) с зонами хрящевой ткани (позиция 2),
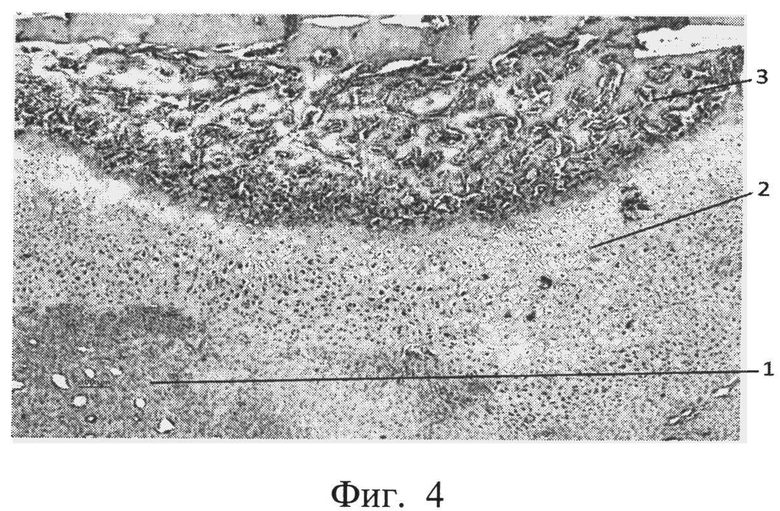
фиг.4 - морфологическая фотография зоны перелома у животного опытной группы на 14 сутки, видна небольшая зона фиброзной мозоли (позиция 1), обширная зона хрящевой ткани (позиция 2), большая зона периостальной костной мозоли (позиция 3),
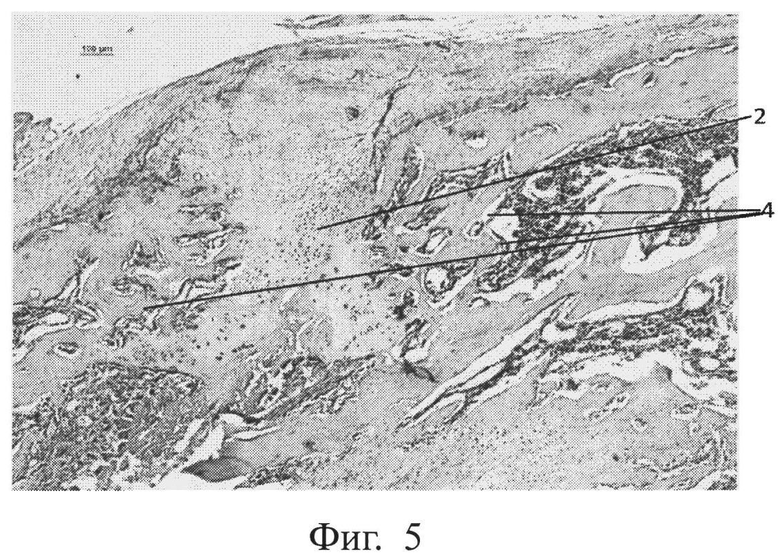
фиг.5 - морфологическая фотография зоны перелома у животного контрольной группы на 35 сутки, видны остатки хрящевой мозоли (позиция 2), формирующиеся костные балки (позиция 4),
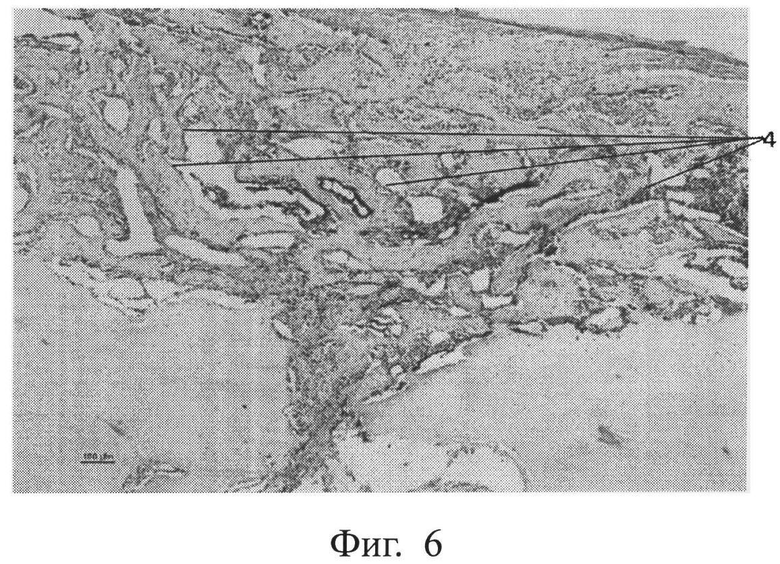
фиг.6 - морфологическая фотография зоны перелома у животного опытной группы на 35 сутки, видны сформированные костные балки (позиция 4),
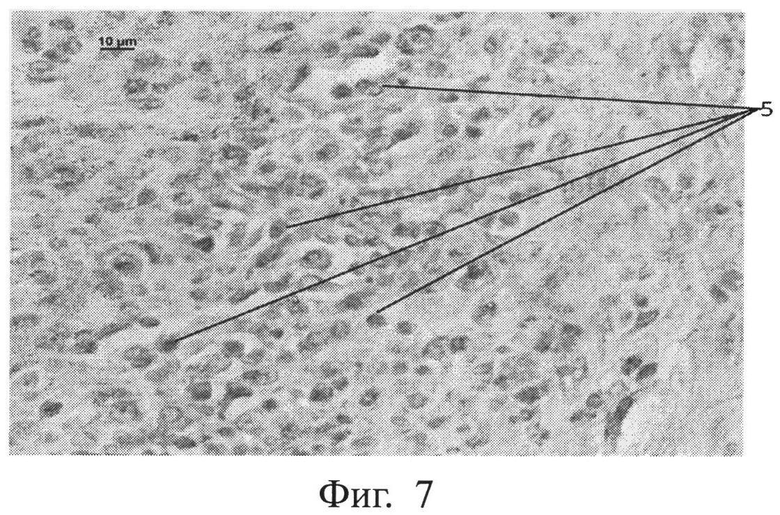
фиг.7 - морфологическая фотография зоны перелома у животного контрольной группы на 9 сутки, где выявлены CD34+ клетки в зоне регенерата (позиция 5), иммуногистохимическая окраска на CD34+, увеличение 400,
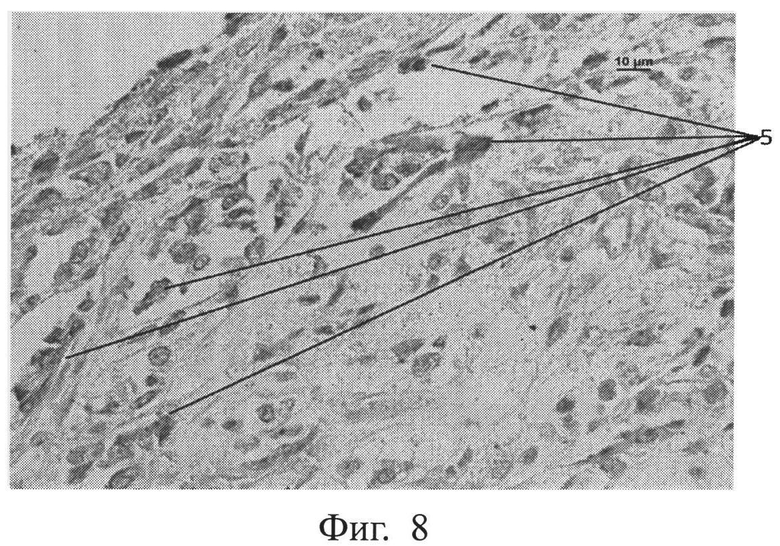
фиг.8 - морфологическая фотография зоны перелома у животного опытной группы на 3 сутки, где выявлены CD34+ клетки в зоне регенерата (позиция 5), иммуногистохимическая окраска на CD34+, увеличение 400,
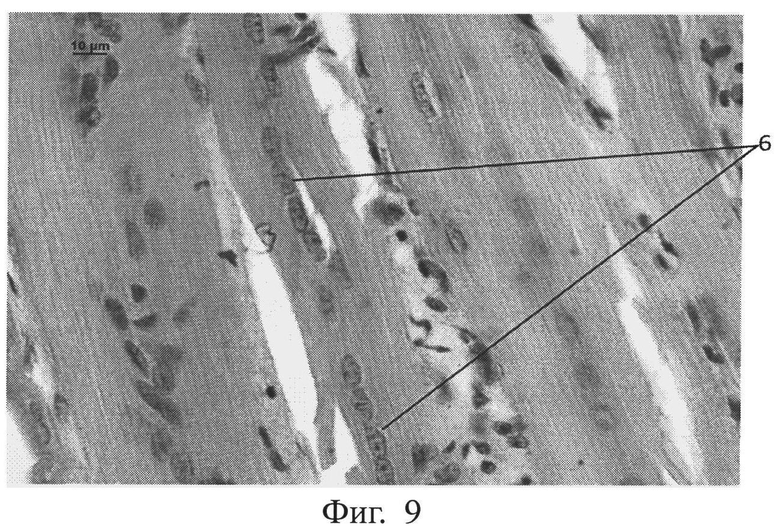
фиг.9 - морфологическая фотография зоны травмы у животного контрольной группы на 14 сутки, видны единичные делящиеся миосаттелиты (позиция 6), окраска гематоксилин-эозином, увеличение 400,
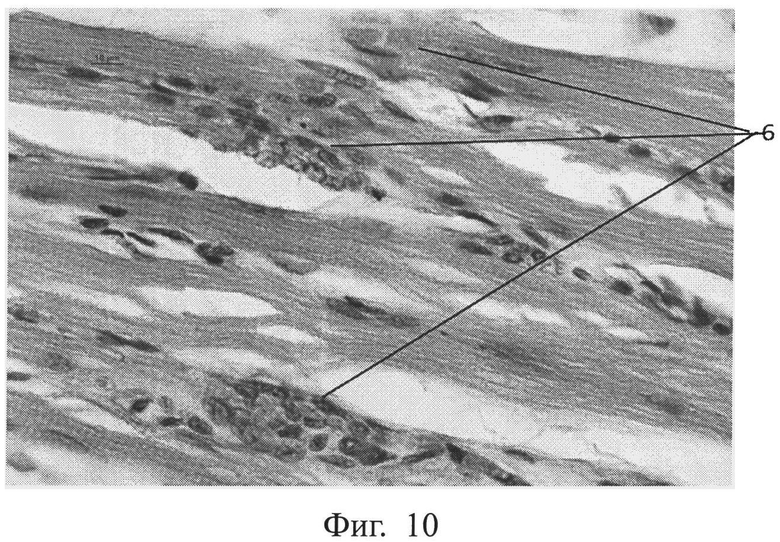
Фиг.10 - морфологическая фотография зоны травмы у животного опытной группы на 14 сутки, видны множественные делящиеся миосаттелиты (позиция 6), окраска гематоксилин-эозином, увеличение 400.
Сущность предлагаемого «Способа стимуляции регенерации хрящевой, костной, мышечной тканей» заключается в следующем:
Готовят средство, обладающее свойством, стимулирующим регенерацию хрящевой, костной, мышечной тканей, на основе водного раствора рекомбинантного интерферона-бета (IFN-β) в концентрации 1∙105 ЕД/мл и водного раствора полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 6000) в концентрации 0,03∙10-9 моль/мл. Смешивают приготовленные растворы в соотношении 1: 4 соответственно. Для этого во флакон, содержащий лиофилизированный рекомбинантный интерферон-бета (IFN-β), добавляют стерильную дистиллированную воду для получения концентрации 1∙105 ЕД/мл. Выдерживают флакон со смесью раствора в течение часа при комнатной температуре, осторожно перемешивая. Готовят навеску полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 6000) и растворяют в отдельном флаконе в дистиллированной воде. Выдерживают при комнатной температуре в течение 1 ч. Полученный раствор пропускают через стерильную пористую мембрану «Minisart». Смешивают полученный стерильный раствор ПЭГ с раствором интерферона-бета.
Приготовленное средство используют для стимуляции регенерации хрящевой, костной, мышечной тканей при лечении переломов длинных костей. Для этого, в асептических условиях интрамедулярно через инъекционную иглу медленно вводят приготовленное средство, состоящее из смеси водных растворов рекомбинантного интерферона бета (IFN-β) и полиэтиленгликоля. После этого осуществляют ретроградный интрамедуллярный остеосинтез перелома бедренной кости. Рану послойно ушивают.
Заявляемый «Способ стимуляции регенерации хрящевой, костной, мышечной тканей» был испытан на лабораторных животных (крысы-самцы линии Вистар весом 250-300 г, в возрасте 6 месяцев). Экспериментальные исследования выполнены в научном отделе экспериментальной хирургии с виварием ФГБУ «НЦРВХ» СО РАМП при свободном доступе к пище и воде на рационе питания, соответствующем нормативам ГОСТа. При выполнении исследования выполнялись все биоэтические нормы работы с экспериментальными животными согласно приказа Министерства здравоохранения СССР от 12.08.1977 г., № 755, а также «Правилами проведения работ с использованием экспериментальных животных», утвержденными Приказом МЗ СССР № 742 от 13.11.1984 г. Протокол эксперимента одобрен комитетом по биомедицинской этике ФГБУ «НЦРВХ» СО РАМН.
Перед проведением эксперимента было приготовлено средство, обладающее свойствами, стимулирующими регенерацию хрящевой, костной, мышечной тканей по предлагаемому способу. Для этого смешивали приготовленные водные растворы рекомбинантного интерферона-бета (IFN-β) и высокомолекулярного полиэтиленгликоля (ПЭГ 6000). Раствор полиэтиленгликоля (ПЭГ 6000) готовят в концентрации 0,03∙10-9 моль/мл, затем смешивают с раствором интерферона-бета (IFN-β) в концентрации 1∙105ЕД/мл в соотношении растворов 1:4 соответственно.
Для проведения эксперимента был использован рекомбинантный крысиный интерферон-бета (IFN-β). Продукт лиофилизирован из раствора забуференного солевого раствора лимонной кислоты и 125 мM трехалозы. Содержимое флакона растворяют в 1 мл стерильной дистиллированной воды и получают концентрацию 1∙105 ЕД/мл. Выдерживают флакон в течение часа при комнатной температуре, осторожно перемешивая несколько раз. На торсионных весах взвешивают навеску 7,5 мг полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 6000). Растворяют в отдельном флаконе в 4 мл дистиллированной воды. Выдерживают при комнатной температуре в течение 1 ч, несколько раз осторожно перемешивая. Полученный раствор пропускают через стерильную пористую мембрану «Minisart». Смешивают полученный стерильный раствор ПЭГ с раствором интерферона-бета, осторожными движениями несколько раз перемешивают. Общий объем полученного раствора составляет 5 мл. Аликвотируют полученный раствор в инсулиновые шприцы по 0,1 мл (1 доза, содержащая 2000 ЕД интерферона-бета).
Исследованы регенерирующие свойства заявленного средства, приготовленного предлагаемым способом для стимуляции регенерации хрящевой, костной, мышечной тканей.
Экспериментальные животные (крысы линии Вистар) были распределены следующим образом:
1-я группа - контрольная, животным с помощью остеотома моделировали поперечный перелом бедренной кости, затем производили ретроградный интрамедуллярный остеосинтез штифтом;
2-я группа - опытная, каждому животному, помимо интрамедуллярного остеосинтеза штифтом, вводили в костно-мозговой канал и окружающую мышечную ткань в зоне перелома средство, приготовленное на основе крысиного рекомбинантного IFN-β в объёме 0,1 мл, содержащем 2000 ед интерферона-бета (2∙103 IFN-β).
Операцию выполняли под внутрибрюшинным наркозом (кетамин 50 мг/кг). Операционное поле обрабатывали раствором первомура. Доступ к проксимальному метадиафизу бедренной кости осуществляли по наружной поверхности бедра, длиной 2,0 см. С помощью остеотома получали поперечный перелом бедренной кости.
В асептических условиях животным опытной группы интрамедулярно через инъекционную иглу медленно вводили приготовленное средство, состоящее из смеси водных растворов рекомбинантного интерферона бета (IFN-β) и полиэтиленгликоля, в объёме 0,1 мл, содержащем 2000 ед интерферона-бета (2∙103 IFN-β). После чего осуществляли ретроградный интрамедуллярный остеосинтез перелома бедренной кости штифтом длиной 3,5 см. Рану послойно ушивали. Снятие кожных швов выполняли на 14 сутки после операции.
Экспериментальных животных выводили из эксперимента на 3, 9, 14 и 35 сутки после перелома и введения приготовленного средства в объёме 0,1 мл, содержащего 2000 ЕД рекомбинантного крысиного интерферона-бета (2∙103 IFN-β) и ПЭГ в концентрации 0,03∙10-9 моль/мл. В каждом сроке выведения наблюдали по 5 животных.
Выведение животных из эксперимента осуществляли путем внутриперитонеального введения кетамина в дозе 100 мг/кг. Вычленяли органокомплекс - заднюю конечность крысы и производили анатомическую препаровку, выделяя зону дефекта с окружающими тканями. Материал для гистологического исследования отбирали путем забора фрагментов конечности, включающих зону экспериментального воздействия с окружающими тканями. Фиксировали раствором FineFix (Milestone, Italy), декальцинировали. Изготавливали серийные срезы толщиной 3 мкм, окрашивали гематоксилин-эозином, увеличение - 40, применяли иммуногистохимическое окрашивание на CD34+ (CD34 (ICO 115) mouse monoclonal IgG (Santa Cruz, Cat. N Sc-7324, Lot # С 0909), рабочее разведение 1:300).
Установлено, что на 3 сутки при применении окрашивания гематоксилин-эозином различий в зоне перелома в опытной и контрольной группах не выявлено: во всех обнаруживали параоссальную гематому, тканевой детрит, нейтрофильную инфильтрацию.
На 9 сутки у животных контрольной группы во всех случаях формировалась фиброзная мозоль от низкой до умеренной плотности, клеточный компонент которой преимущественно был представлен фибробластами. Приведена морфологическая фотография зоны перелома у животного контрольной группы, видна фиброзная мозоль (см. приложение к описанию фиг. 1, позиция 1).
В опытной группе на 9 сутки во всех случаях формировалась фиброзная мозоль высокой плотности, состоящая из фибробластов и из фиброцитов. У всех животных в зоне перелома отмечено формирование островков хрящевой ткани без признаков энхондрального окостенения и наблюдались периостальные очаги остеогенеза. Приведена морфологическая фотография зоны перелома у животного опытной группы, видна мозоль, представленная фиброзной (позиция 1), хрящевой тканями (позиция 2) и периостальной костной мозолью (позиция 3) (см. приложение к описанию фиг.2, позиции 1, 2, 3).
На 14 сутки у животных контрольной группы имеется формирующаяся мозоль, представленная фиброзной тканью, замещающейся хрящевой тканью. Приведена морфологическая фотография зоны перелома у животного контрольной группы, видна фиброзная мозоль (позиция 1) с зонами хрящевой ткани (позиция 2) (см. приложение к описанию, фиг.3, позиции 1, 2).
В опытной группе на 14 сутки у всех животных отмечено формирование больших зон хрящевой ткани, периостальные очаги остеогенеза. Приведена морфологическая фотография зоны перелома у животного опытной группы, видна небольшая зона фиброзной мозоли (позиция 1), обширная зона хрящевой ткани (позиция 2), большая зона периостальной костной мозоли (позиция 3) (см. приложение к описанию, фиг.4, позиции 1, 2, 3).
На 35 сутки в группе контроля регенерат включает в себя хондрогенную ткань, замещающуюся остеогенной с формирующимися костными балками. Приведена морфологическая фотография зоны перелома у животного контрольной группы, видны остатки хрящевой мозоли (позиция 2), формирующиеся костные балки (позиция 4) (см. приложение к описанию, фиг.5, позиции 2, 4).
В опытной группе на 35 сутки мозоль полностью представлена костной тканью с уже сформировавшимися костными балками. Приведена морфологическая фотография зоны перелома у животного опытной группы, видны сформированные костные балки (позиция 4) (см. приложение к описанию, фиг.6, позиция 4).
Нами выявлено, что прогениторные клетки (несущие рецепторы CD34+) появляются в зоне регенерата в опытной группе животных на 3 сутки, тогда как в контрольной группе животных они появляются лишь на 9 сутки. Показана морфологическая фотография зоны перелома у животного контрольной группы на 9 сутки, где выявлены CD34+ клетки в зоне регенерата (позиция 5) (см. приложение к описанию, фиг.7, позиция 5), иммуногистохимическая окраска на CD34+, увеличение 400. На фигуре 8 показана морфологическая фотография зоны перелома у животного опытной группы на 3 сутки, где выявлены CD34+ клетки в зоне регенерата (позиция 5) (см. приложение к описанию, фиг.8, позиция 5), иммуногистохимическая окраска на CD34+, увеличение 400.
Отмечено значительное усиление регенерации мышечной ткани у опытной группы животных по сравнению с контрольной группой, что выражалось в усилении деления миосаттелитов в зоне травмы у животных опытной группы (см. приложение к описанию, фиг.9, 10, позиция 6). На фигуре 9 приведена морфологическая фотография зоны травмы у животного контрольной группы на 14 сутки, где видны единичные делящиеся миосаттелиты (позиция 6), окраска гематоксилин-эозином, увеличение 400. На фигуре 10 приведена морфологическая фотография зоны травмы у животного опытной группы на 14 сутки, видны множественные делящиеся миосаттелиты (позиция 6), окраска гематоксилин-эозином, увеличение 400.
Также выявлено, что частота гнойно-воспалительных осложнений в опытной группе достоверно ниже, чем группе контроля (Z=2,616, p=0,0089).
Таким образом, результаты исследований показали, что заявляемый «Способ стимуляции регенерации хрящевой, костной и мышечной тканей» позволяет в сравнении с известными способами повысить эффективность лечения при переломах длинных костей, снизить его травматичность за счет приготовления средства с подбором оптимальной концентрации используемых препаратов, упрощения технологии стимуляции регенерации тканей в зоне перелома, а также снизить частоту гнойно-воспалительных осложнений.
Источники информации, принятые во внимание:
1. Кетлинский С.А. Цитокины. / С.А.Кетлинский, А.С.Симбирцев. - СПб.: Фолиант, 2008, 549 с.
2. Kalvakolanu D.V. Interferons: cellular and molecular biology of their actions / D.V. Kalvakolanu, EC. Borden // In: Bertion, JR., editor. Encyclopedia Cancer, 2002, v.2, р.511-521.
3. Средство, обладающее иммуномодулирующим, антивирусным, антибактериальным, антиоксидантным, мембраностабилизирующим, стимулирующим регенерацию хрящевой и соединительной ткани свойствами: пат. 2349339 Рос. Федерация: МПК А61К 38/21, А61Р 37/02, А61Р 19/02 / В.В. Малиновская, Н.В. Варданян, В.В. Парфенов; заявитель и патентообладатель Малиновская В.В. - №2007126556/15; заявл. 12.07.2007, опубл. 20.03.2009, Бюл. №8, 1 с.
4. Интерферон, конъюгированный с полиэтиленгликолем: патент RU 2433135 C1: МПК C07K 14/52/ С.В. Шереметьев, В.В. Зверев, С.А. Коровкин, заявитель-патентообладатель «Общество с ограниченной ответственностью «ФОРТ» - №2010140711/10; заявл. 06.10.2010, опубл. 10.11.2011, Бюл. №31.
5. Способ стимуляции репаративного остеогенеза при лечении переломов: пат. 2364361 Рос. Федерация: МПК A61B 17/56/ Р.Ш. Мирхайдаров, А.А. Григорьев, Р.К. Уразбахтин, А.Ю. Ручко, С.В. Гришанина; заявитель и патентообладатели Р.Ш. Мирхайдаров, А.А. Григорьев, Р.К. Уразбахтин, А.Ю. Ручко, С.В. Гришанина. - №2008111519/14; заявл. 25.03.2008, опубл. 20.08.2009, Бюл. №23, 1 с.
6. Способ стимуляции репаративного остеогенеза: пат. RU 2373883: МПК А61В 17/56/ С.П. Миронов, Н.П. Омельяненко, В.К. Ильина, И.Н. Карпов;заявитель и патентообладатели С.П. Миронов, Н.П. Омельяненко, В.К. Ильина, И.Н. Карпов. - № 2008113737/14;заявл. 11.04.2008, опубл. 27.11.2009.
7. Способ оптимизации репаративного остеогенеза: пат. 2315 580 Рос. Федерация: МПК А61В 17/56 / О.В. Бейдик, В.В. Анников, П.В. Глыбочко, В.Н. Николенко, А.В. Зарецков, К.К. Левченко, Ван Кай, Д.А. Марков;заявитель и патентообладатель Бейдик О.В. - № 2006102390/14; заявл. 27.01.2006, опубл. 27.01.2008, Бюл. № 3, 1 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ МЫШЕЧНОЙ ТКАНИ | 2015 |
|
RU2597838C1 |
| Способ лечения несросшегося перелома костей конечности | 2017 |
|
RU2669051C1 |
| СПОСОБ СТИМУЛЯЦИИ ФОРМИРОВАНИЯ ФИБРОЗНО-ХРЯЩЕВОГО РЕГЕНЕРАТА КОСТНОЙ МОЗОЛИ У МЛЕКОПИТАЮЩИХ | 2011 |
|
RU2461621C1 |
| Способ стимуляции регенерации костной ткани | 1985 |
|
SU1428388A1 |
| СПОСОБ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2010 |
|
RU2429002C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РОСТА КОСТНОЙ ТКАНИ | 1993 |
|
RU2077329C1 |
| СОСТАВ ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ КОСТНЫХ ТКАНЕЙ | 1998 |
|
RU2146928C1 |
| Способ регенерации костной ткани в зоне перелома | 2023 |
|
RU2839076C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2015 |
|
RU2606257C1 |
| БИОСОВМЕСТИМАЯ КОМПОЗИЦИЯ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ И СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОЙ КОМПОЗИЦИИ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ | 2008 |
|
RU2385727C1 |
Изобретение относится к области медицины и фармакологии. Описан способ стимуляции регенерации хрящевой, костной, мышечной тканей, включающий репозицию перелома длинной кости и введение приготовленного средства в костно-мозговой канал и окружающую мышечную ткань, при этом стимулируют регенерацию тканей путем введения смеси водных растворов рекомбинантного интерферона бета (IFN-β) в концентрации 1∙105 ЕД/мл и полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 6000) с концентрацией 0,03∙10-9 моль/мл в соотношении 1:4 соответственно, после чего осуществляют ретроградный интрамедуллярный остеосинтез перелома длинной кости. Средство позволяет повысить эффективность лечения при переломах длинных костей, снизить его травматичность, упростить технологию приготовления средства для стимуляции регенерации тканей в зоне перелома, а также снизить частоту гнойно-воспалительных осложнений. 10 ил.
Способ стимуляции регенерации хрящевой, костной, мышечной тканей, включающий репозицию перелома длинной кости и введение приготовленного средства в костно-мозговой канал и окружающую мышечную ткань, отличающийся тем, что стимулируют регенерацию тканей путем введения в костно-мозговой канал и окружающую мышечную ткань смеси растворов рекомбинантного интерферона бета (IFN-β) в концентрации 1∙105 ЕД/мл и полиэтиленгликоля с молекулярной массой 6000 (ПЭГ 6000) с концентрацией 0,03∙10-9 моль/мл в соотношении 1:4 соответственно, после чего осуществляют ретроградный интрамедуллярный остеосинтез перелома длинной кости.
| EA 200602257 А1, 27.04.2007 | |||
| СПОСОБ ОПТИМИЗАЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2006 |
|
RU2315580C2 |
| Прибор для наблюдения изменения ускорения силы тяжести | 1929 |
|
SU15901A1 |
Авторы
Даты
2014-09-10—Публикация
2013-05-24—Подача