Изобретение относится к медицине и биологии, в частности к физиотерапии и иммунологии, и посвящено коррекции иммунодефицитных состояний и ассоциированных с ними заболеваний путем терапевтического воздействия светом на различные зоны человека, включая области, прямо или косвенно связанные с центральными и периферическими органами иммунной системы с целью коррекции иммунодефицитных состояний и ассоциированных с ними заболеваний.
Известны методы и устройства для светотерапевтического воздействия на различные области тела человека, в том числе с целью коррекции иммунной системы [1-4]. В них используются источники оптического излучения, например в виде лазеров или светодиодов, соединенные с блоками питания. Источники излучения как правило размещаются в торцевой части выносных насадок или соединены с оптическими световодами, через которые излучение направляется на биообъект. Практикуется также использование нескольких лазеров или узкополосных источников в виде светодиодов с длинами волн излучения, лежащих в спектральном диапазоне от 0,25 мкм до 3 мкм. Источники излучения работают в широком диапазоне частот и скважности как в непрерывном, так и в импульсном режиме.
Анализ немногочисленных результатов исследования по использованию подобных оптических источников в основном на основе He-Ne и полупроводниковых лазеров для коррекции иммунной системы показывает, что в целом оптическое излучение влияет на функциональное состояние иммунной системы, стимулирует экспрессию рецепторов иммунокомпетентных клеток, повышает митотическую и пролиферативную активность, изменяет количественные показатели, характеризующие клеточный иммунитет: количество общих и активных Т-лимфоцитов, соотношение субпопуляций Т-клеток (СВ4/СП8, хелперно-супрессорный коэффициент), стимулируют макрофагальную активность [2-4].
Сведения об изменении количества В-лимфоцитов в крови в процессе лазеротерапии весьма разноречивы.
Как правило, в экспериментах излучение направляли или непосредственно на область патологии, или локализовали на область центральных и периферических органов иммунной системы, включая тимус, селезенку и лимфоузлы.
Аналогом подобных работ может служить метод и устройство, описанные в патенте США №6084242 [5]. В нем излучение от инфракрасного полупроводникового лазера направляется на биообъект с помощью световода в виде полой трубки с целью облучения локальных патологий тела при лечении онкологических заболеваний, артрита, рассеянного склероза и других заболеваний, сопровождающихся изменением иммунитета. Реакцию иммунной системы предлагается определять по содержанию Т - клеток и отношению CD4/CD8.
Недостатком подобных методов и устройств является трудность одновременного облучения светом протяженных и отдельно расположенных зон на теле человека как затронутых патологией, так и включающих элементы иммунной системы. Наибольшие проблемы возникают при сложной пространственной геометрии этих зон или при их расположении, например, с различных сторон биообъекта, что характерно, в частности, при облучении обширных патологий конечностей. В результате в аналоге для облучения обширных патологий требуется последовательное перемещение источника излучения от одной зоны к другой, что требует много времени и может не достичь желаемого эффекта в силу разновременного облучения различных зон.
Другим недостатком является отсутствие четких научных критериев оценки эффективности лечения и выбора доз облучения. Так, ни в одной работе в обзорах [1-4], включая аналог [5], не описаны надежные методы и критерии выбора доз облучения, то есть они выбирались чисто эмпирически. В итоге на сегодня по существу отсутствуют объективные данные, доказывающие терапевтическую эффективность света при лечении иммунных расстройств, несмотря на обнадеживающую клинику, имеющиеся данные немногочисленны, фрагментарны, носят неоднозначный характер и даже порой противоречивы. Более того, не представляется возможным провести их сравнительный анализ, поскольку авторами использовались разные методики оптических воздействий, различные иммунологические показатели, более того, использовались разные дозы и иммунологические показатели.
Определенное исключение указанных недостатков, т.е. повышение эффективности светотерапии при лечении протяженных патологических зон сложной геометрии достигнуто в устройстве, описанном в патенте №2145247 [6], который взят нами за прототип. Это устройство представляет матрицу множества источников излучения, размещенных на подложке с формой рабочей поверхности, подобной форме пространственно протяженной патологической зоны. В качестве источников излучения предложено использовать как лазеры, так и матрицы сверхярких светодиодов.
Однако это изобретение имеет ряд недостатков. В заявленном устройстве отсутствует описание применения для лечения различных расстройств иммунной системы. В связи с этим отсутствует, как и в аналоге, метод оценки иммунотропного эффекта оптического воздействия и алгоритм выбора оптимальных доз. Недостатком устройства является невозможность одновременного селективного облучения нескольких протяженных патологических зон или органов центральной и периферической иммунной системы. Использование одной большой матрицы может привести к нежелательному облучению здоровых непатологических зон, что увеличивает общую нагрузку на организм, может снизить положительный эффект и привести к нежелательным побочным эффектам, например, в виде общего повышения температуры, усиления микроциркуляции по всему организму, иммуносупрессии.
Используемые ныне критерии для индикации иммунотропного эффекта облучения, базируемые на определении соотношения различных субпопуляций лимфоцитов в крови (Т, Т/В, CD4/CD8) или оценки фагоцитарной активности, уровня IgG, IgM, IgA имеют широкий диапазон колебаний и в недостаточной степени коррелируют с клиническими проявлениями патологических процессов в организме.
В основу настоящего изобретения положен разработанный нами принципиально новый экспресс-способ оценки функциональной активности В-системы иммунитета, основанный на определении титров нормальных антител в сыворотке крови и секретах в реакции пассивной гемагглютинации (РПГА) с дифференциацией двух дискретных групп антител - с высоким и низким авидитетом. В норме 80-100% антител имеют высокий авидитет. При патологии и дисфункции иммунной системы происходит увеличение содержания низкоавидных антител до 75-95%, неспособных оказывать протективный эффект [7]. Способ позволяет быстро (в течение 1-2 часов) и однозначно диагностировать наличие или отсутствие иммунологической недостаточности.
О степени выраженности иммунологической недостаточности можно судить по изменению функциональной и протективной активности антител до и после трансформации низкоавидных антител в высокоавидное состояние, индуцированное различными факторами как in vivo, так и in vitro [8].
По выявленной степени иммунологической недостаточности можно назначать соответствующую иммунокоррегирующую терапию, направленную на повышение уровня высокоавидных антител [9].
Используя эти новые подходы к диагностике и лечению иммунодефицитных состояний, нам впервые удалось показать в экспериментах in vitro на сыворотках крови больных с различными иммунодефицитными расстройствами, а также на чистых препаратах IgG, выделенных из тех же сывороток, что эффект оптического излучения может непосредственно влиять на структуру и функцию антител, в частности низкоавидных антител, трансформируя их в высокоавидное состояние [10].
Таким образом, были получены первые данные, свидетельствующие о прямом влиянии оптического излучения на антитела и их протективные свойства и возникла возможность для адекватной оценки иммунотропного действия оптического излучения на организм.
Эти данные явились теоретической и практической базой для обоснования и формулировки данного изобретения.
Целью настоящего изобретения является разработка способа фотоиммуномодулирующей терапии и устройства для селективного оптического воздействия на зоны поражения с учетом индивидуального подбора доз и объективного контроля эффективности воздействия.
Поставленная цель достигается за счет того, что с помощью световых матриц осуществляется облучение селективное и/или пространственно-протяженных зон биообъекта, связанных с локальными очагами конкретного заболевания и/или прямо или косвенно с центральными и/или периферическим органами иммунной системы, включающее надкожное, и/или внутривенное, и/или экстракорпоральное облучение крови и/или ее компонентов, и/или внешнее, и/или внутритканевое эндоскопическое облучение тимуса, и/или селезенки, и/или слизистых оболочек, и/или лимфоузлов, и/или сосудов, и/или комбинированное воздействие на биообъект в сочетании облучения с другими факторами физическими, и/или химическими, и/или лекарственными препаратами.
При этом определение оптимальных энергетических и/или спектральных параметров и/или доз воздействия при предварительных тестовых исследованиях и/или эффективность иммуномодулирующего воздействия непосредственно во время и/или после лечения и/или продолжительность цикла лечения осуществляется на основании изменения соотношения высоко- и низкоавидных нормальных антител в сыворотке крови и/или секретах при тестовых исследованиях in vitro, а при лечении - до, во время или после воздействия in vivo.
Критерием достижения иммунокоррегирующего эффекта является увеличение содержания высокоавидных антител до 75-100% при одновременном снижении низкоавидных антител до 0-25%.
Критерием достижения иммунодепрессивного эффекта является снижение содержания высокоавидных антител до 5-25% при одновременном увеличении низкоавидных антител до 75-95%.
Оптимальная доза воздействия при лечении определяется на основании времени перехода всех антител из одного состояния авидности в другое, соответственно, при тестовом воздействии in vitro, а также с учетом степени выраженности иммунологической недостаточности, тяжести заболевания и площади облучаемой поверхности.
Оптимальная доза воздействия на биообъект на один сеанс рассчитывается по формуле: Ес=К×Т×Б×S,
где Ес - продолжительность сеанса, мин;
К - коэффициент поправки (зависит от используемого устройства);
Т - экспозиция воздействия, мин, необходимая для превращения низкоавидных антител в высокоавидное состояние, установленная при предварительном тестовом воздействии на сыворотку крови и/или секреты биообъекта in vitro;
Б - степень тяжести заболевания оценивается по шкале в баллах:
1 - без клинических проявлений;
2 - легкое течение болезни;
3 - средняя форма тяжести течения заболевания;
4 - тяжелая форма заболевания;
S - площадь облучаемой поверхности.
Оценка реакции организма на воздействие проводится путем определения уровня высоко- и низкоавидных антител в сыворотке крови пациента после проведения первых трех сеансов.
Оценка эффективности иммуномодулирующего воздействия и/или продолжительность лечения проводится путем определения содержания высоко- и низкоавидных антител в сыворотке крови пациента после 5-го и далее вплоть до 10-го сеансов.
При комбинированном воздействии на биообъект в качестве дополнительного физического фактора могут быть использованы оптическое излучение с различными длинами волн, в частности синего, и/или красного, и/или инфракрасного диапазона, и/или рентгеновское излучение, и/или ультразвук, и/или температура, и/или введение кислорода, и/или изменение рН среды. Иммуномодулирующий эффект достигается за счет действия различных факторов, которое может быть последовательным во времени друг за другом и/или одновременным во времени, и/или с временной задержкой друг относительно друга, а оптимальные параметры и дозы воздействия определяются на основании максимального изменения авидитета антител.
Повышение эффективности иммуномодулирующего воздействия и получение стойкой клинической ремиссии достигается за счет применения комбинированного воздействия на биообъект. В качестве дополнительных факторов воздействия химических и/или лекарственных могут быть использованы иммуномодуляторы, и/или иммуносупрессоры, и/или фотосенсибилизаторы, и/или препараты иммуноглобулинов, и/или альбуминов, и/или их смеси, а оптическое воздействие осуществляется на биообъект до введения и/или после введения в него препаратов, и/или воздействуют на сами препараты соответственно до их введения и/или после введения в биообъект, а временная задержка между облучением препарата до его введения в биообъект и/или после введения препарата и последующего облучения биообъекта. Оптимальная доза определяется на основании максимального изменения авидитета антител.
Для достижения лечебного иммуномодулирующего эффекта используют экстракорпоральное облучение плазмы крови с последующей реинфузией ее в кровяное русло после превращения всех низкоавидных антител в высокоавидное состояние.
Иммуномодулирующий эффекта реализуется с помощью устройства, включающего в себя блок с источником оптического воздействия, соединенный с блоком питания, блок жизнеобеспечения, связанный с биообъектом и обеспечивающий необходимые условия для проведения терапии, блок управления, соединенный с блоком воздействия и блоком жизнеобеспечения и дополнительный блок обратной связи, функционально связывающим блок управления и биообъект, включающий взаимосвязанные между собой блоки забора пробы крови, подготовки сывороток крови, блок тестовой детерминированной трансформации антител, блок контроля авидитета антител, информация с которого поступает в блок управления, в котором встроены две программы с алгоритмом, один из которых обеспечивает режим тестового воздействия на сыворотку крови in vitro до лечения, а второй - режим иммунокоррекции с использованием оптимальных параметров, определенных в ходе тестового воздействия.
Для проведения контрольных исследований блок контроля выполнен в виде определителя титров антител в реакции пассивной гемагглютинации, и/или в виде блока иммуноферментного анализа, и/или блока радиоиммунного анализа, а блок трансформации содержит источник физического воздействия.
При этом блок контроля авидитета включает в себя стандартную плашку с числом ячеек, в частности, 8×12, устройство автоматического измерения титров, оптический модуль в виде подведенных к отдельным ячейкам волоконных световодов и приемников излучения как для тестового облучения, так и для регистрации эффектов поглощения и/или рассеяния в осадках, образующихся на плоском и/или полусферическом дне отдельных ячеек.
В качестве источника оптического воздействия используются одиночные и/или объединенные в матрицы источники оптического излучения в виде лазеров, и/или светодиодов, и/или ламп различного типа со светофильтрами, включая лампы накаливания, газоразрядные и люминесцентные лампы и/или без них, источников рентгеновского и/или радиоволнового и миллиметрового диапазонов и/или их комбинации.
Для достижения иммуномодулирующего эффекта устройство дополнительно содержит модуль экстракорпорального воздействия на кровь, и/или источники размещены на теле пациента надкожно, блок источника снабжен оптическим волокном, соединенным с устройствами для эндоскопического или минимально-инвазивного внутритканевого облучения и/или компактные источники в виде светодиодов имплантированы для облучения зон биообъекта, прямо или косвенно связанные с элементами иммунной системы, ответственных за созревание антител в плазматических клетках и/или функционирование антител.
Усиление иммуномодулирующего воздействия достигается за счет использования комбинации источников воздействия различных типов, включая физические и/или химические источники, соединенные с блоком управления.
1. Алгоритм подбора параметров и доз облучения для достижения иммунокоррегирующего лечебного эффекта.
Методика подбора включает несколько этапов.
Этап 1. Проводится определение содержания в сыворотке крови больного низкоавидных антител и титров всех нормальных антител к грам+ и/или грам- бактериям с использованием диагностической тест-системы для экспресс-оценки состояния иммунитета [7]. Содержание низкоавидных антител до 75-90% свидетельствует о наличии иммунологической недостаточности.
Этап 2. При заданной длине волны и интенсивности облучения in vitro определяется временная экспозиция облучения, необходимая для превращения всех низкоавидных антител в высокоавидное состояние в сыворотке крови пациента.
Этап 3. Проводится расчет дозы облучения на один сеанс с учетом степени выраженности иммунологической недостаточности [9], тяжести заболевания и площади облучаемой поверхности.
Расчет ведется по формуле: Ес=К×Т×Б, где:
Ес - продолжительность сеанса, мин;
К - коэффициент поправки (зависит от используемого устройства);
Т - экспозиция воздействия, мин, необходимая для превращения низкоавидных антител в высокоавидное состояние, установленное при предварительном тестовом воздействии на сыворотку крови и/или секреты биообъекта in vitro;
Б - степень тяжести заболевания, оценивается по шкале в баллах:
1 - без клинических проявлений;
2 - легкое течение болезни;
3 - средняя форма тяжести течения заболевания;
4 - тяжелая форма заболевания.
Этап 4. Оценка реакции организма на облучение по изменению уровня высоко- и низкоавидных антител в сыворотке крови пациента после проведения первых трех сеансов.
Этап 5. Оценка эффективности облучения по изменению уровня высоко- и низкоавидных антител в сыворотке крови пациента после 5-го и далее вплоть до 10-го сеансов.
Этап 6. Прекращение облучения при достижении в сыворотке крови пациента уровня высокоавидных антител до 75-100% и снижения низкоавидных антител до 25% или полное их исчезновение.
Этап 7. В случае необходимости для повышения авидитета антител и достижения стойкой клинической ремиссии целесообразно подключение дополнительных лечебных и иммунокоррегирующих воздействий с использованием физических, химических или биологических факторов.
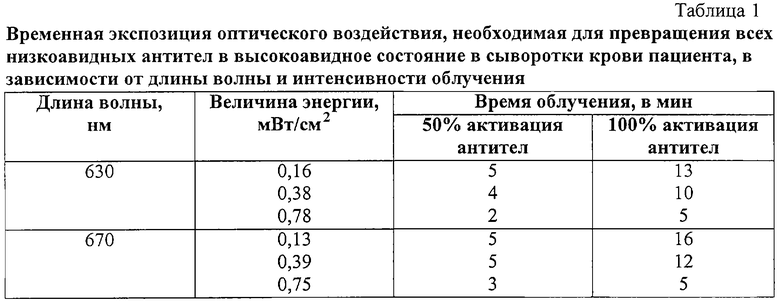
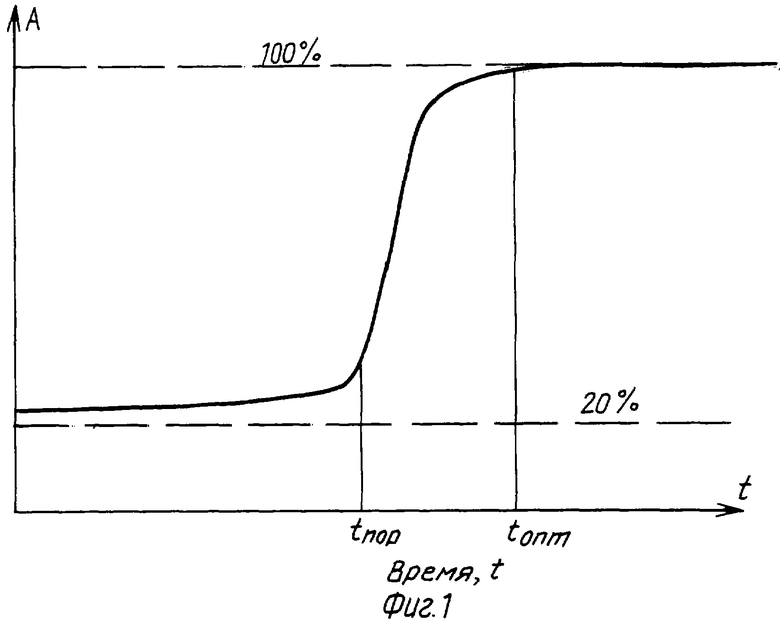
Пример дозовой зависимости изменения авидитета антител
На фиг.1 показана типичная зависимость изменения авидитета антител в функции времени облучения. Она имеет характер изменения, близкий к пороговому, определяемой двумя основными временами: пороговым временем, при котором начинается изменение авидности и оптимальным временем облучения, выше которого не имеет смысл дальнейшее облучение. Именно эта зависимость является ключевой при определении оптимальных параметров облучения как при тестовых воздействиях на образцах сыворотки крови, так и при облучении уже всего организма.
2. Пример реализации устройства фотоиммуномодулирующей терапии при лечении больных с атопическим дерматитом (АД).
2.1. Описание устройства.
Геометрическая форма устройства: удлиненный полый цилиндр с размещением светодиодов на внутренней поверхности, обращенных выходными окнами внутрь цилиндра. Форма внутренней поверхности зависит от формы биообъекта и может быть близка к цилиндрической, конической и сферической или их комбинации. Пример цилиндрической секции для облучения конечностей при лечении атопического дерматита.
Диаметр 200 мм, длина 300 мм, выполнена из пластмассы и состоит из двух половинок, которые могут раскрываться для удобства фиксации на руке пациентки. На внутренней поверхности цилиндра размещены светодиодные излучатели в количестве 240 штук со средним расстоянием между отдельными излучателями 30 мм. Длина волны излучения: 0,6 мкм. Мощность каждого излучателя, работающего в непрерывном режиме, составляет 2 мВт, средняя плотность излучения на поверхности биообъекта достигает около 1 мВт/см2. Светодиоды включены последовательно-параллельно. Питание осуществляется от сети напряжением 220 В и частотой 50 Гц. На торцах фотоматричной системы размещены два резиновых кольца диаметром 5 см, соединенных с поверхностью цилиндра с тремя пружинами, размещенными друг относительно друга под углом 120°. Рука пациента вводится последовательно в два резиновых кольца и за счет пружин она фиксируется вблизи оси цилиндра. Выбор зоны облучения осуществляется с помощью накладываемой на руку клеенки с требуемой геометрией открытых зон. Общий вес цилиндра не превышает 1,5 кг, что позволяет находится пациенту в вертикальном положении и легко выдерживать нагрузку от описанного устройства. Один сеанс облучения длится 30-60 минут. Всего процедур 5-10 в течении 5-10 дней. Режим устанавливается на основании индивидуального предварительного тестирования сыворотки крови и тяжести заболевания.
2.2. Общая характеристика клинических проявлений АД и изменений иммунограммы у больных.
Общим для всех больных АД являлись зуд различной степени выраженности, расстройство сна, раздражительность, повышенная утомляемость, плохое настроение.
Клиническая картина больных АД характеризовалась чаще симметричной, склонной к группировке эритематозно-папулезной сыпью, очагами инфильтрации и лихенифизации, точечными и линейными экскорациями, корочками, мелко- и среднепластинчатым шелушением. Кожные проявления высыпных элементов у 26 (74,2%) больных локализовались на лице, шее, туловище, сгибательных поверхностях конечностей. У 9 (25,7%) больных высыпания носили распространенный рассеянный характер.
Рецидивирующее течение АД с однотипно протекающими клиническими обострениями отмечалось у 10 (28,5%) больных, прогрессирующее - у 23 (65%), регрессивное - у 2 (5,7%).
Характерной особенностью для больных АД являлось увеличение числа эозинофилов в крови, коррелирующее с индексом SCORAD и тяжестью заболевания (r=0,711).
Результаты иммунологических исследований показали, что отличительной особенностью больных АД в стадии обострения является повышение содержания низкоавидных антител G класса до 75-88% (при норме 0-20%) и снижение высокоавидных до 12-25% (при норме 80-100%). Снижение авидитета антител отмечалось практически у всех больных, носило стойкий поликлональный характер, не зависело от антигенной специфичности (грам+, грам-) антител и степени выраженности клинических проявлений заболевания. Между уровнем низкоавидных антител и величиной индекса SCORAD была выявлена сильная корреляционная связь (r=0,94), свидетельствующая о высокой степени сопряженности между авидитетом антител G класса и клинической картиной АД.
Характерным для больных АД являлось увеличение в 4-6 раз В-лимфоцитов, т.е. до 530-688 лимф./мкл при норме - 121+23 лимф./мкл. На фоне увеличения числа лимфоцитов в 1,5-3 раза.
Наряду с нарастанием В-лимфоцитов происходило увеличение примерно в 1,5 раза числа Т-лимфоцитов, в основном за счет CD8 клеток.
У 70% больных АД отмечалось повышение уровня циркулирующих иммунных комплексов до 65-110 у.е. при одновременном снижении фагоцитарной активности нейтрофилов до 65-75% (при норме 82,7+2,3%) и способности нейтрофилов генерировать радикалы в ответ на опсонизированные антигены до 23,6+3,5 (норма 40-80).
У всех больных АД отмечалось нарушение ИНФ статуса, выражающееся в снижении уровня альфа- и гамма-ИФН и нарастании в крови циркулирующего ИФН с 1,5 до 4-6 ME.
Изменения показателей Т-системы иммунитета не коррелировали с индексом SCORAD.
Таким образом, наиболее информативным критерием, адекватно отражающим течение АД, является уровень высоко- и низкоавидных нормальных антител G класса, которого может быть использован в качестве критерия оценки терапевтических воздействий на больных АД.
2.3. Влияние низкоинтенсивного оптического излучения на клинико-иммунологические показатели больных АД.
Реакция больных АД на облучение носила двухфазный характер. У большинства больных первая фаза после трех сеансов низкоинтенсивного облучения характеризовалась увеличением числа лимфоцитов в крови и титров нормальных антител в 2-4 раза, при этом уровень низкоавидных антител оставался неизменным (75%) или увеличивался до 90-95% в некоторых случаях.
Вторая фаза реакции организма развивалась после 5 сеанса низкоинтенсивного облучения, характеризовалась тенденцией к нормализации уровня лимфоцитов и титров нормальных антител, увеличением уровня высокоавидных антител. Максимальное увеличение содержания высокоавидных антител до 95-100% происходило к 10 сеансу почти у всех больных и лишь у 8% - содержание высокоавидных антител достигло 100% в более поздние сроки (спустя две недели после окончания физиотерапевтического лечения).
10 сеансов низкоинтенсивного облучения больных АД привело к снижению величины индекса SCORAD с 32,8+2,04 до 22,08+1,68, при этом коэффициент эффективности лечения составил 33,3+2,48 и превысил результат традиционной терапии на 11% (р0,001).
В результате низкоинтенсивного облучения происходило снижение ЦИК (с 64,7+5 до 48,5+5), числа эозинофилов (520 до 280 клеток мкл), СД19 клеток (554+104 до 220+84) и нарастание СД4 клеток, индекса ИРИ (1,03 до 1,41). Отмечалась нормализация ИФН статуса.
Субъективно - у больных зуд приобретал спородический характер, в связи с чем уменьшалась раздражительность, нормализовался процесс засыпания, у 60% больных АД происходило уменьшение частоты обострении и более легкое течение при последующих обострениях.
Таким образом, низкоинтенсивное облучение ограниченного участка кожи индуцирует в организме каскад реакций, итогом развития которых явилась коррекция иммунологической недостаточности, повышение барьерной функции дермы и развитие выраженной клинической ремиссии АД. Эффект облучения оказался более выраженным в сравнении с традиционной терапией.
2.4. Влияние комбинированной терапии на клинико-иммунологические показатели больных АД.
Коэффициент эффективности лечения больных АД, получавших комбинированную терапию, т.е. традиционную с добавлением 10 сеансов низкоинтенсивного облучения, составлял 41,98+1,58% и значительно превышал эффективность традиционной терапии на 19,68% (р 0,001) и монотерапии - на 8,7% (р 0,05). При этом индекс SCORAD снижался с 50,6+2,72 до 29,4+1,74, увеличивалось содержание высокоавидных антител до 93% и снижалось низкоавидных антител с 76 до 7%. Кроме того, уменьшался уровень ЦИК с 66,1 до 46,1 число CD 19 клеток с 688+93 до 207+46, происходило повышение фагоцитарной активности и увеличение индекса ИРИ до 1,45. Снижалось число эозинофилов с 853+11 до 467+97, происходила нормализация ИНФ-статуса. Результатом комбинированной терапии явилось более легкое течение болезни и снижение частоты обострений у 76% больных.
Таким образом, становится очевидным, что терапия АД должна дополнительно включать средства, направленные на нормализацию функционирования В-системы иммунитета, в частности на повышение секреции высокоавидных антител G (G1, G2, G3) класса. Только при этом создаются благоприятные условия для снижения потока аллергенов извне, повышенного разрушения и элиминации аллергенов и атопенов из организма, снижение сенсибилизации организма и нормализация функционирования Th2 субпопуляции лимфоцитов и цитокинового дисбаланса.
Выявление ранее не известной взаимосвязи между активностью В-системы иммунитета, предопределяющей судьбу поступающих аллергенов и атопенов в организме и развитием Th2 и Ig E зависимых аллергических реакций открывает принципиально новый эффективный подход для лечения и профилактики аллергических и атонических заболеваний.
В качестве альтернативного способа воздействия на иммунную систему наряду с применяемыми нами ранее иммунокорректорами [] успешно может быть использовано низкоинтенсивное оптическое излучение кожных покровов. Таким образом путем целенаправленного воздействия на узловые патогенетически значимые звенья иммунной системы открывается путь для повышения эффективности терапии, снижения издержек на лечение больных АД, повышения качества их жизни, возникает перспектива контроля и предупреждения развития атопических реакций.

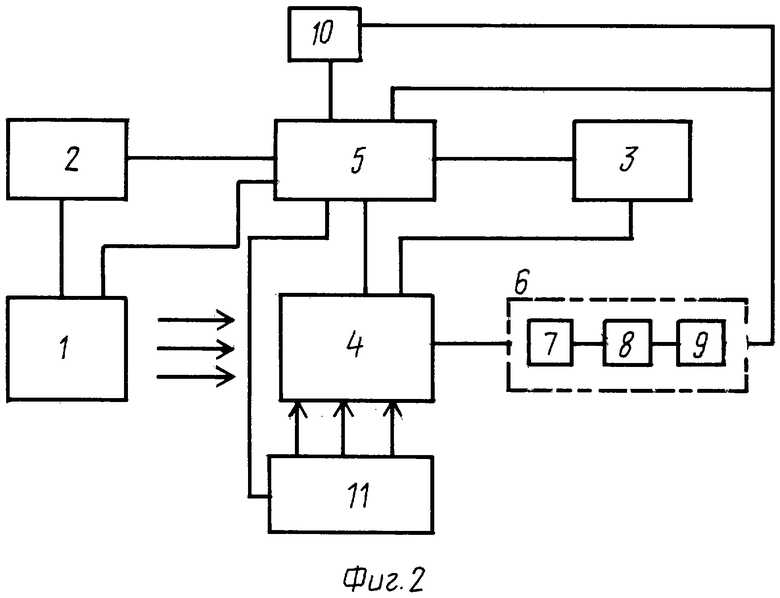
3. Блок-схема устройства для фотоиммуномодулирующей терапии.
Изображенная на фиг.2 блок-схема устройства функционирует следующим образом. Блок оптического воздействия 1 формирует оптическое излучение во временном режиме (импульсном или непрерывном), обеспечиваемом в блоке питания 2. В качестве источников излучения могут использоваться как лазеры различных типов, так и более экономичные светодиоды. Система жизнеобеспечения 3 обеспечивает необходимые внешние условия для обеспечения биообъекта 4. Излучение направляется на зоны организма как затронутые патологией, так и связанные с органами иммунной системы человека. Система управления 5 обеспечивает необходимые параметры облучения как энергетические (мощность, энергия), так и временные, определяющие общую дозу облучения. Ключевым элементом предлагаемой блок-схемы является система обратной связи 6, которая обеспечивает контроль за эффективностью воздействия. Она состоит в свою очередь из системы забора и подготовки сыворотки крови к анализу 7, собственно блока определения авидности антител, содержащихся в сыворотки крови 8, и блока корректировки 9, предназначенного в соответствии с результатами анализа для выработки информационных сигналов, поступающих в программный блок 10. В последнем в зависимости от стадии воздействия задается или режим тестирования для определения индивидуальных особенностей биообъекта 4, или режим оптимального лечения. Блок 11 предназначен для реализации режима комбинированного лечения, при котором наряду с оптическим воздействием осуществляется воздействием другими физическими и химическими факторами. В частности, перспективным является использование различных лекарственных иммуномодуляторов, причем их оптимальная доза, время введения в биообъект и время и продолжительность последующего оптического облучения определяются с помощью описанной системы обратной связи.
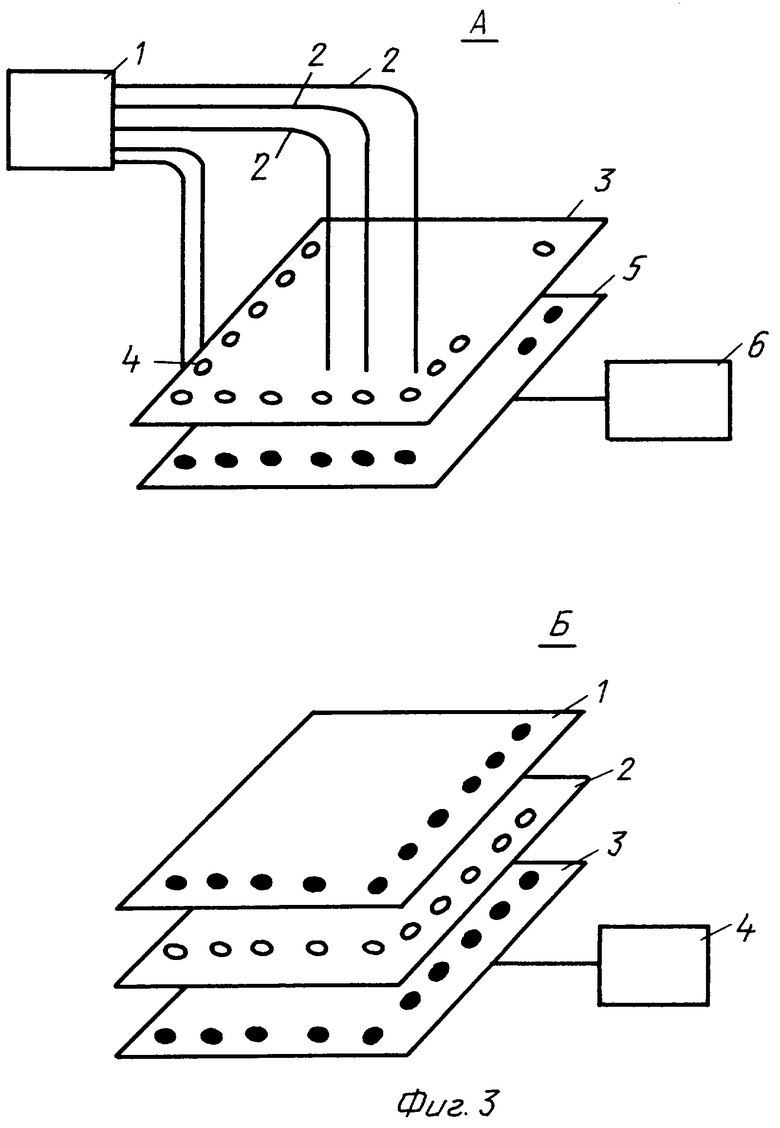
4. Оптическая часть блока контроля авидитета с использованием оптических волокон или матрицы светодиодов.
На фиг.3 представлены фрагменты различных вариантов оптической схемы блока определения авидности антител (фиг.1, поз. 8). В схеме А излучение от оптического источника 1 вводится в оптические световоды 2, которые подводятся к планшету 3 с расположенными в отдельных плашках 4 образцами сыворотки крови. Количество световодов выбирается равным количеству плашек. Излучение в данном блоке выполняет две основные функции, определяемые режимами воздействия. При относительно мощном воздействии осуществляется детерминированный переход антител из состояния с низкой авидностью в высокое. И затем происходит определение количества соответствующих антител в соответствии с формулой изобретения. Таким образом может исследоваться поведение антител при различных дозах для определения оптимального режима лечения. Второй функцией является определение изменения оптических свойств растворов в процессе стандартной реакции титрования. Для этого измеряется величина прошедшего света через каждую плашку как функция времени с помощью матрицы фотоприемников 5, расположенных под дном отдельных плашек. Сигналы от каждого фотоприемника поступают в многоканальный блок регистрации 6, где проводится их обработка и сравнение. В результате этого сравнения получается информация о величине титров и по ним уже определяется величина авидности антител.
Отличием схемы Б является использование вместо световодов отдельных светодиодов 1, которые обеспечивают облучение каждой плашки. В зависимости от мощности светодиодов можно использовать или один светодиод для каждой плашки, или же небольшую матрицу. Далее, как и в первом варианте, прошедший свет регистрируется с помощью матрицы светодиодов, сигналы с которых поступают в многоканальный блок регистрации 4.
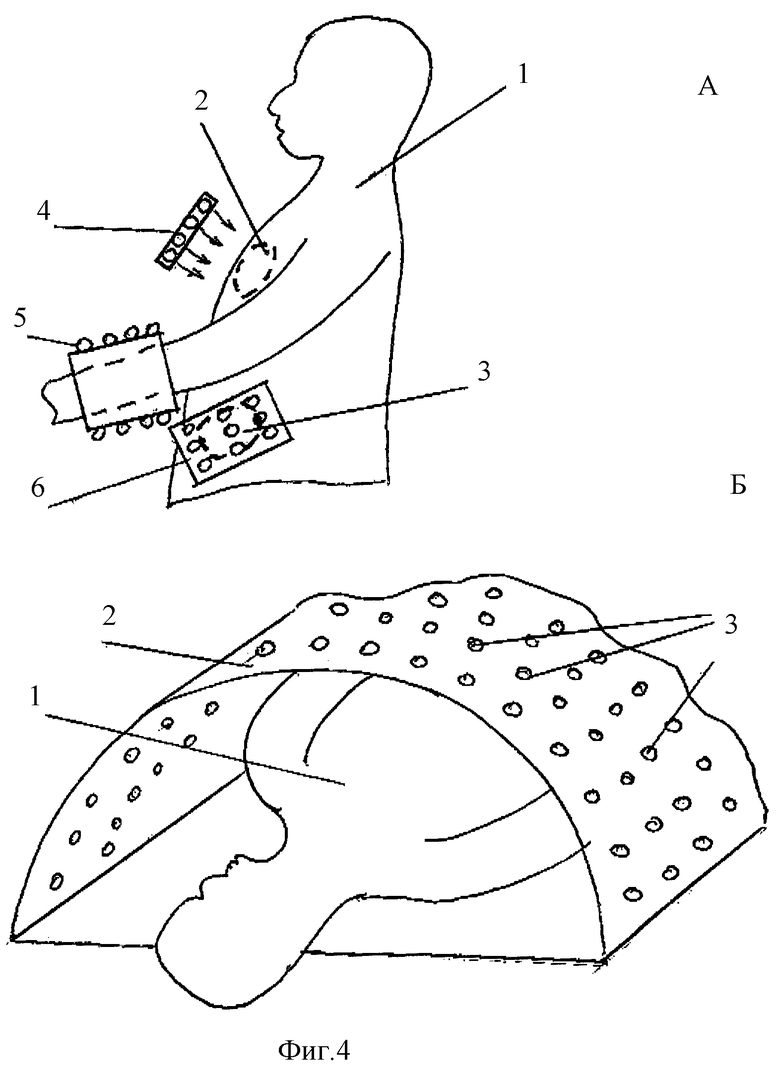
5. Примеры фотоматричных устройств для одновременного облучения различных органов, связанных с органами иммунной системы.
На фиг.4 представлены частные примеры схем облучения биообъекта. По схеме А используются одновременно несколько фотоматриц для облучения биообъекта 1 в зоне тимуса 2, одной из конечностей и в области селезенки 3. Для этого используется соответственно плоская фотоматрица 4, цилиндрическая фотоматрица 5 и гибкая фотоматрица 6. Количество фотоматриц может быть расширено для дополнительного облучения лимфоузлов, зон миндалин, скопления лимфо- и кровеносных сосудов и т.п.
Принципиальным фактором при выборе количества облучаемых зон является определение эффективности воздействия в каждом конкретном случае с помощью описанной ранее системы обратной связи и блока контроля авидности антител D. В общем случае в этом варианте поверхность биообъекта в требуемых зонах охватывается с помощью отдельных модулей, имеющих, например, прямоугольную форму. В пределах каждого сегмента источники излучения, например светодиоды, располагаются равномерно. Сегмент может быть выполнен в виде монолитного интегрального чипа с припаянными гибридными светодиодными кристаллами, покрытыми защитной прозрачной для излучения пластиной, играющей одновременно роль фиксатора, задающего среднее расстояние между поверхностью биообъекта и светодиодами. Отдельные сегменты соединены между собой гибкой связью пружинного типа и могут располагаться на различном расстоянии друг от друга с целью формирования необходимой геометрии облучения. В схеме Б показано облучение биообъекта 1 уже с помощью одной большой фотоматрицы 2 в виде полуцилиндра, на внутренней поверхности которого размещается большое количество светодиодов 3. Преимуществом такой схемы является возможность одновременного облучения как обширной патологии, например кожных проявлений атопического дерматита, так и одновременно иммунокомпетентных элементов организма, включая тимус, селезенку и обширную сеть сосудов и узлов лимфотической системы.
Для исключения возможной общей перегрузки организма при облучении, зоны, не требующие облучения, могут быть экранированы различными способами. Простейшие варианты: это использовать фигурные клеенки, марлевые экраны или дополнительные диафрагмы.
Другие способы заключаются в изменении оптической оси каждого светодиода или небольших матричных модулей в требуемом направлении с помощью компьютерной программы с целью концентрации излучения на требуемые зоны. Другой возможный метод заключается в помещении между матрицей и поверхностью объекта сплошного экрана, прозрачность которого изменяется по определенному закону тем или иным способом, например за счет различных электрооптических эффектов или механическим способом за счет относительного движения диафрагм и заслонок. И наконец, это можно осуществить за счет изменения уровня питания, в частности путем изменения тока как через каждый источник, так и одновременно через несколько источников.
6. Фотоиммуномодулирующее устройство для внутриполостного применения.
При эндоскопических применениях отдельные источники излучения располагаются не на внутренней поверхности подложки, как описано выше, а уже на внешней поверхности. В биообъекте, в частности в кишечном тракте, располагается цилиндрическая капсула с источниками излучения. Она может быть проглочена пациентом и далее после прохождения желудка естественным путем зафиксирована в определенной зоне тонкой кишки, определяемой с помощью ультразвуковой диагностики.
7. Фотоиммуномодулирующее устройство для терапии крови и лечения локальных патологий.
Описанное изобретение матрицы, касающейся поверхности руки, может быть реализовано в виде отдельных плоских сегментов прямоугольной формы с размерами 15×60 мм. Для равномерного охвата руки в области запястья необходима секция, включающая примерно 9-12 подобных сегментов, соединенных гибкой связью. Одна такая секция может быть использована для терапии крови, другая для лечения локальных патологий. В случае более обширных патологий можно использовать до 4-5 таких секций. В пределах одного сегмента возможно размещение до 10 светодиодов в два ряда по 5 светодиодов в каждом ряду.
8. Фотоиммуномодулирующее устройство - фотопластырь для облучения локальных патологий.
Форма гибкого матричного облучателя близка к плоскости с радиусом 30 мм. Длина волны красных светодиодов 0,63 мкм и инфракрасных 0,85 мкм. Мощность излучения около 10 мВт на длине волны 0,63 мкм и 0,3 Вт на длине волны 0,85 мкм. Количество светодиодов 88. Облучатель на поверхности тела фиксируется за счет медицинской клейкой ленты или пластыря. Питание автономное от батарей. Таких облучателей может быть несколько для одновременного облучения нескольких зон, расположенных в различных частях тела. Один сеанс светотерапии длится 15 минут. Всего сеансов шесть в течение одной недели.
9. Фотоиммуномодулирующее устройство в виде "скафандра" или "рыцарских доспехов".
При необходимости облучения всего тела можно воспользоваться конструкцией подложки в виде помещаемых на кушетку "скафандра" или "рыцарских доспехов", внутренняя поверхность которого содержит множество соответствующих излучателей. Более простое решение заключается в использовании отдельных секций в виде полуцилиндров определенной геометрии с расположением излучателей на их внутренней поверхности. Эти полуцилиндры помещаются на обычную кушетку, на которой располагается человек.
Подобные фотоматричные системы весьма перспективны для лечения обширных дерматологических патологий, например при лечении инфекционных заболеваний у новорожденных, матрицы светодиодов могут быть приложены к внешним прозрачным для излучения стенкам обычных инкубаторов. При необходимости облучения пациента одновременно со всех сторон, например при общей терапии крови, пациент помещается на прозрачную для излучения кушетку или сетку типа гамака, которые в свою очередь вдвигаются внутрь цилиндра, внутренняя поверхность которого с излучателями повторяет форму человека.
10. Прочие фотоиммуномодулирующие устройства.
В целом в качестве источника излучения в предлагаемом изобретении могут использоваться практически многие источники, применяемые в фототерапии, например различные типы лазеров, лампы накаливания со светофильтрами, газоразрядные и люминесцентные лампы.
В случае облучения биообъекта в форме, близкой к цилиндрической, например, конечностей, газоразрядные колбы могут быть выполнены в виде тонких цилиндров, равномерно расположенных вокруг конечностей с осями, параллельными усредненной оси конечности. Зеркальная поверхность подложки может охватывать эти источники, т.е. конструкция облучателя подобна конструкции источников накачки в лазерных системах за исключением лишь того, что в область, где размещался активный элемент, помещается конечность. В зависимости от медицинской задачи источники могут работать в различных режимах спектральных диапазонов преимущественно от 0,2 до 3 мкм с различной степенью монохроматичности от 10-3 нм до 103 м.
В данном изобретении впервые показано прямое воздействие света на иммунную систему и возможность ее модуляции с помощью оптического излучения. Показана возможность подбора оптимальных доз облучения организма на основании авидитета антител, степени выраженности иммунологической недостаточности и индивидуальных особенностей организма. Выявлена взаимосвязь между площадью облучения и количеством облучаемых зон, длиной волны, режимом воздействия (непрерывном, импульсном) при различных частотах модуляции и скважности.
Основным достоинством предлагаемого изобретения является возможность селективного и одновременного облучения любых требуемых протяженных зон организма, как непосредственно очага проявления конкретной патологии, например дерматологической, так и одновременно зон центральной и периферической иммунной системы с одновременным четким количественным контролем эффективности результата воздействия, реализованным в виде системы обратной связи на основе определения авидитета антител. Ни в одном из известных изобретений этого ранее не было достигнуто.
Показана перспективность комбинирования света с ультразвуком, магнитным полем и другими факторами физического воздействия, а также с различными лекарствами и иммуномодуляторами. Эти методы могут выгодно дополнить друг друга и обеспечить существенный синергичный иммуномодулирующий и лечебный эффект.
Предлагаемое изобретение может быть использовано также для профилактики простудных и инфекционных заболеваний, особенно в осенне-зимний период с дефицитом освещения. Есть основания предполагать, что сезонные заболевания и распространения эпидемий гриппа могут быть связаны с понижением активности иммунной системы в периоды дефицита освещенности. Поэтому его можно рекомендовать для жителей дальнего севера, людей, работа которых протекает в замкнутых пространствах, при дальних космических полетах и т.п. Наиболее экономичными, малоэнергоемкими, компактными и легкими по весу являются светодиодные матрицы.
Краткое описание фигур чертежей
Фиг.1 - пример дозовой зависимости в виде изменения авидности антител как функция времени облучения, где: А - процент содержания высокоавидных тел; tпор - пороговое время, при котором начинает изменяться авидность антител под действием излучения; tопт - оптимальное время облучения.
Фиг.2 - общая блок-схема устройства для фотоиммуномодулирующей терапии, где: 1 - блок оптического воздействия; 2 - блок питания; 3 - блок жизнеобеспечения; 4 - биообъект; 5 - блок управления; 6 - блок обратной связи; 7 - блок забора и подготовки пробы крови; 8 - блок контроля авидитета; 9 - блок корректировки воздействия; 10 - программный блок; 11 - блок с дополнительными источниками воздействия (химические препараты, ультразвук и т.п.).
Фиг.3 - оптическая часть блока контроля авидитета с использованием оптических волокон (А) или матрицы светодиодов (Б).
А: 1 - источник излучения; 2 - оптические волокна; 3 - планшет с культурами; 4 - колбочки с культурами; 5 - матрица фотоприемников; 6 - многоканальный блок регистрации.
Б: 1 - матрица светодиодов; 2 - планшет с культурами; 3 - матрица фотоприемников; 4 - многоканальный блок регистрации.
Фиг.4 - примеры фотоматричных устройств для одновременного облучения различных органов, связанных с органами иммунной системы.
А - пример использования одновременно нескольких фотоматриц: 1 - биообъект; 2 - положение тимуса; 3 - положение селезенки; 4 - плоская фотоматрица для облучения тимуса; 5 - цилиндрическая матрица для облучения конечностей; 6 - гибкая матрица для облучения области селезенки;
Б - пример использования одной большой фотоматрицы в форме полуцилиндра: 1 - биообъект; 2 - подложка в форме полуцилиндра; 3 - оптические источники (светодиоды).
Источники информации
1. Илларионов В.Е. Основы лазерной терапии. М.: Респект, 1992, с.26, 31, 71-80.
2. Takushi Tadakuma. Possible application of the laser in immunobiology. The Keio journal of medicine, 1993, 42 (4), 180-182.
3. Т.В.Кончугова, С.Б.Першин, А.А.Миненков. Иммуномодулирующие эффекты низкоинтенсивного лазерного излучения. Журнал “Вопросы курортологии”, 1997, №1, с.42-45.
4. T. Karu. Mechanism of low-power laser light action on cellular level. In: Laser in Medicine and Dentistry, Ed. By Z. Simunovic Rijelia: Uitgraf 2000, 98-124, filed Jul. 6, 1998.
5. D.S. Brown, M.R. Brown US Patent № 6084242 от 06.07.1998, опубл. 04.07.2000. Method and Device for stimulating the immune system and generating healing at the cellular level.
6. В.П.Жаров. Патент РФ №2145247 “Фотоматричное терапевтическое устройство для лечения протяженных патологий” с приоритетом от 10.04.1998, опубликовано в Бюллетене изобретений №4, февраль, 2000.
7. B.C.Гевондян, Н.М.Гевондян. Экспресс-способ оценки функциональной активности В-системы иммунитета по Гевондян. Патент РФ №2137133, приоритет от 24.07.1996 г.
8. B.C.Гевондян, Н.М.Гевондян, М.В.Гевондян. Способ и набор для экспресс-диагностики доклинических и клинически выраженных форм иммунологической недостаточности. Заявка на изобретение №2000105362, приоритет от 06.03.2000 г.
9. B.C.Гевондян, Н.М.Гевондян, М.В.Гевондян. Способ иммунокоррегирующей терапии доклинических и клинически выраженных форм иммунологической недостаточности и экспресс-отбора средств для иммунокоррекции. Заявка на изобретение №2000, приоритет от 13.03.2000 г.
10. V.P.Zharov, V.S.Gevondyan, N.M.Gevondyan, S.A.Ermilov, A.M.Volynskya. Light activation of the immune system. Part 1. Influence on G-class antibodies, Proceedings of SPIE. Vol. 3914, 324-333, August, 2000. USA.
Изобретение относится к медицине и биологии, в частности к физиотерапии и иммунологии для коррекции иммунодефицитных состояний и ассоциированных с ними заболеваний при воздействии света на различные зоны человека. Способ фотоиммуномодулирующей терапии включает когерентное и не когерентное облучение естественным излучением оптического диапазона от рентгеновского до радиоволнового биообъектов, в том числе надкожное, и/или внутривенное, и/или экстракорпоральное облучение крови и/или ее компонентов, и/или внешнее, и/или внутритканевое эндоскопическое облучение тимуса, и/или селезенки, и/или слизистых оболочек, и/или лимфоузлов, и/или сосудов, при этом с помощью световых матриц осуществляют облучение селективное и/или пространственно-протяженных зон биообъекта, связанных с локальными очагами конкретного заболевания и/или прямо и/или косвенно с центральными и/или периферическими органами иммунной системы, или комбинированное воздействие на биообъект в сочетании облучения с другими факторами физическими, и/или химическими, и/или лекарственными препаратами, а определение оптимальных энергетических и/или спектральных параметров и/или доз воздействия при предварительных тестовых исследованиях и/или эффективности иммуномодулирующего воздействия непосредственно во время и/или после лечения и/или продолжительности цикла лечения проводят на основании изменения соотношения высоко- и низкоавидных нормальных антител в сыворотке крови и/или секретах биообъекта при тестовых исследованиях in vitro, а при лечении - до, во время или после воздействия in vivo, при этом критерием достижения иммунокоррегирующего эффекта является увеличение содержания высокоавидных антител до 75-100% при одновременном снижении низкоавидных антител до 0-25%, критерием достижения иммунодепрессивного эффекта является снижение содержания высокоавдных антител до 5-25% при одновременном увеличении низкоавидных антител до 75-95%, а оптимальную дозу воздействия при лечении определяют на основании времени перехода всех антител из одного состояния авидности в другое, соответственно, при тестовом воздействии in vitro, а также с учетом степени выраженности иммунологической недостаточности, тяжести заболевания, площади облучаемой поверхности, а оптимальную дозу воздействия на биообъект на один сеанс рассчитывают по формуле: Ec=K×T×Б×S, где Ес - продолжительность сеанса, мин, К - коэффициент поправки (зависит от используемого устройства), Т - экспозиция воздействия, мин, необходимая для превращения низкоавидных антител в высокоавидное состояние, установленная при предварительном тестовом воздействии на сыворотку крови и/или секреты биообъекта in vitro, Б - степень тяжести заболевания, оценивают по шкале в баллах: 1 - без клинических проявлений, 2 - легкое течение болезни, 3 - средняя форма тяжести течения заболевания, 4 - тяжелая форма заболевания, S - площадь облучения. Устройство иммуномодулирующей терапии содержит блок оптического воздействия, соединенный с блоком питания, и блок управления, при этом дополнительно блок управления связан с блоком обратной связи, включающим блоки забора, подготовки сыворотки крови, анализа и блок корректировки, выполненный с возможностью выработки информационных сигналов, поступающих в программный блок, при этом блок управления выполнен с возможностью осуществления программируемых режимов тестового воздействия на сыворотку крови in vitro до лечения и иммунокоррекции с использованием параметров, определенных в ходе тестового воздействия. Блок анализа включает в себя плашку с ячейками, устройство автоматического измерения титров и оптический модуль в виде подведенных к отдельным ячейкам световодов и приемников излучения и выполнен с возможностью как тестового облучения, так и регистрации эффектов поглощения и/или рассеяния в осадках, образующихся на дне отдельных ячеек. Использование изобретения позволяет повысить эффективность лечения расстройств иммунной системы. 2 с. и 6 з.п. ф-лы, 4 табл., 4 ил.
| ГЕВОНДЯН В.С | |||
| и др | |||
| Изучение влияния низкоинтенсивного оптического излучения на гуморальный иммунитет | |||
| Биомедицинская радиоэлектроника | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| ИЛЛАРИОНОВ В.Е | |||
| Техника и методики процедур лазерной терапии | |||
| Справочник | |||
| - М., 1994, с.156-163 | |||
| Теория и практика лазерной терапии | |||
| Теоретические обоснования | |||
| Ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - М., 1994, с.5-2 - 5-4, 6-1, 20-1 - 20-4 | |||
| ФОТОМАТРИЧНОЕ ТЕРАПЕВТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ЛЕЧЕНИЯ ПРОТЯЖЕННЫХ ПАТОЛОГИЙ | 1998 |
|
RU2145247C1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| ЖАРОВ В.П | |||
| и др | |||
| Фотоматричные аппараты для терапии пространственно-протяженных патологий | |||
| Биомедицинская радиоэлектроника | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| УСТРОЙСТВО ДЛЯ ПОЛОСТНОГО ВОЗДЕЙСТВИЯ | 1997 |
|
RU2147893C1 |
| УСТРОЙСТВО ДЛЯ ИССЛЕДОВАНИЯ ФОТОДИНАМИЧЕСКОЙ АКТИВНОСТИ ФОТОСЕНСИБИЛИЗАТОРОВ IN VITRO | 2000 |
|
RU2160897C1 |
Авторы
Даты
2004-11-27—Публикация
2000-12-29—Подача