Изобретение относится к новым замещенным производным бензофурана, способу их получения, их солям, а также к применению для
a) лечения болезни Альцгеймера,
b) лечения болезни Паркинсона,
c) лечения болезни Хангтингтона (хореи),
d) лечения рассеянного склероза,
e) лечения бокового амиотрофического склероза,
f) лечения эпилепсии,
g) лечения последствий острых приступов,
h) лечения последствий черепно-мозговых травм,
i) лечения и профилактики последствий диффузного кислородного и пищевого дефицита в головном мозге, которые наблюдаются после гипоксии, аноксии, асфиксии, остановки сердца, отравлений, а также при осложнениях при тяжелых родах у грудничков или при наркозе,
j) в частности, также профилактического лечения апоптозной дегенерации в нейронах, которая наступает при местной радио- и химиотерапии опухолей мозга, и
k) лечения бактериального менингита,
l) лечения заболеваний с апоптозным компонентом, особенно в случае амилоидно-ассоциированной дегенерации клеток,
m) лечения сахарного диабета, в частности, если заболевание протекает с амилоидной дегенерацией островкового аппарата поджелудочной железы.
Новые производные и аналоги галантамина согласно изобретению повышают силу мускулатуры и выносливость пациентов, страдающих болезнью Альцгеймера.
Новые соединения представляют собой соединения общей формулы I
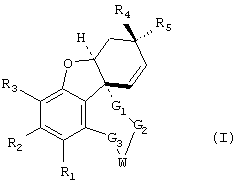
где заместители имеют следующие значения:
R1 и R2 являются одинаковыми или различными и означают:
a) водород, F, Cl, Br, J, CN, NC, ОН, SH, NO2, SО3Н, РО3Н, NH2, СF3, OSO2(СН2)nСF3, где n равен 0, 1 или 2, OSOz-арил, -винил или -этинил;
b) низшую (C1-C6), в случае необходимости разветвленную, в случае необходимости замещенную (ар)алкил-, (ар)алкоксигруппу, циклоалкил- или циклоалкоксигруппу;
c) аминогруппу, которая в случае необходимости замещена одной или двумя одинаковыми или различными низшими (C1-С6)-группами, в случае необходимости разветвленными, в случае необходимости замещенными (ар)алкил- или (ар)алкилкарбонил- или (ар)алкоксикарбонильными группами, или аминогруппу, в которой циклический заместитель представлен в виде во всяком случае замещенного пирролидин-, пиперидин-, морфолин-, тиоморфолин-, пиперазин-, гомопиперазинового остатка;
d) COOH, СОО(ар)алкил, СО-амино, со значениями аминогруппы как описано выше под п. с), или СНОН(ар)алкильную группу;
e) -(СН2)nХ (где Х=Br, Cl, F или J), -(СН2)nОН, -(СН2)nСНО, -(CH2)nCOOH, -(CH2)nCN, -(CH2)nNC-, -(СН2)nСОалкильную, - (СН2)nСОарильную группу, где n равно 1-4;
f) - (СН2)nвинильную, (СН2)nэтинильную группу или (СН2)nциклоалкильную группу, где n означает 0, 1 или 2 и циклоалкил алифатическое кольцо с величиной цикла 3-7;
g) С3-С6 алкенильную группу (в случае необходимости замещенную Н, F, Br, Cl, CN, СO2алкилом, СОалкилом, СОарилом);
h) С3-С6 алкинильную группу (в случае необходимости замещенную Н, F, Br, Cl, CN, СO2алкилом, СОалкилом, СОарилом); или
i) R1 и R2 вместе означают -СН=СН-СН=СН-, -О(СН2)nО- (n = от 1 до 3), -СН=СН-А1 или -СН2-СН2-А1-, причем А1 может означать NH, О или S;
R3 имеет те же значения, что и R1, в частности, ОН и ОСН3 и далее
R2 и R3 вместе означают –А2(CH2)nA2-, где n равно от 1 до 3 и А2 означает два одинаковых или различных остатка, выбранных из NH, О или S;
R4 и R5 либо
a) оба означают водород, либо
b) означают комбинацию водорода или (ар)алкильной, (ар)алкенильной или (ар)алкинильной группы с
i) OR6, где R6 означает водород, низшую (C1-С10) группу, в случае необходимости разветвленную или замещенную алкильную группу или циклоалкильную группу, С3-С10 замещенную силильную группу (например, триэтилсилил, триметилсилил, трет-бутилдиметилсилил или диметилфенилсилил), С2-С10 α -алкокси-алкильную группу, например, тетрагидропиранил, тетрагидрофуранил, метоксиметил, этоксиметил, (2-метоксипропил), этоксиэтил, феноксиметил или (1-феноксиэтил);
ii) O-CS-NHR6 (тиоуретан), где R6 имеет указанные выше значения;
iii) О-CO-NHR7 со следующими значениями:
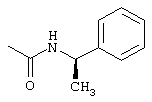
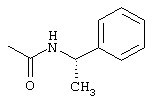
iv) О-CO-HR6, где R6 имеет указанные выше значения, в частности, сложный эфир с заместителем аминокислот (оба энантиомера), как
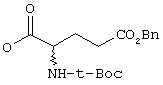
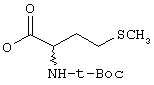
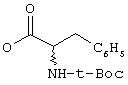
v) NR7R7, где оба заместителя R7 являются одинаковыми или различными и означают водород, низшую (C1-C4)-группу, в случае необходимости разветвленную или циклическую алкильную группу или оба заместителя R7 вместе означают -(СН2)n, где n равно от 3 до 5;
vi) NH-COR6 (амид), где R6 имеет указанные выше значения;
vii) S-R6, где R6 означает водород или низшую (C1-С10)-группу, в случае необходимости разветвленную, в случае необходимости замещенную (ар)алкильную группу и где R6 имеет указанные выше значения;
viii) SOnR8, где n равно 0, 1 или 2, где R8 означает (C1-С10)-группу, в случае необходимости разветвленную или циклическую, в случае необходимости замещенную (ар)алкильную группу.
Если R4 означает водород, R5 может быть ОН, CN, СО2алкилом, CONRaRb, где Ra означает водород, низшую (C1-C6)-группу, в случае необходимости разветвленную, циклическую, во всяком случае замещенную алкильную группу и Rb означает водород, низшую (C1-C6)-группу, в случае необходимости разветвленную или замещенную алкильную группу, или Ra+Rb вместе означают -(СН2)n-, где n равно от 2 до 6, или (CH2)nЕ(СН2)n-, где Е означает NH, N-алкил, О или S и n равно от 0 до 5, арил (фенил или нафтил), 6-π -гетероцикл (как, например, имидазолил, оксазолил, изоксазолил, триазолил, тетразолил, оксадиазолил, тиадиазолил, пиридазинил, пиримидинил, пиразинил или их замещенные варианты) или имидазолинил, тиазолинил или оксазолинил.
Для случая, когда R5 не является водородом, R4 может также быть ОН.
R4 и R5 вместе могут означать карбонил (=О), гидразон (=N-NH-R9, =N-NR9R10 или оксим (=N-OR10), где R9 означает водород, низшую (C1-С6)-группу, в случае необходимости разветвленную или циклическую, в случае необходимости замещенную (ар)алкил- или (ар)алкилкарбонил-, (ар)алкилкарбонилоксигруппу или сульфокислотную группу, такую как тозил или мезил, и R10 означает водород, низшую (C1-С6)-группу, в случае необходимости разветвленную или циклическую, в случае необходимости замещенную (ар)алкил- или (ар)алкилкарбонильную группу, сульфокислотную группу, такую как тозил- или мезильная группа.
R4 и R5 могут вместе означать заместители типа
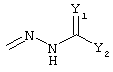
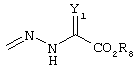
где Y1, Y2 являются одинаковыми или различными и означают О, S, NH или NR9 (свободные валентности в каждом случае означают водород) или, в случае, если Y1 означает NH, a Y2 означает N-R9, R4 и R5 могут быть связаны через -(СН2)n- (n=2, 3 или 4).
G1: -(CH2)x-, где х равен 1 или 2;
G2: -(CH2)y-, где y равен от 0 до 2;
G3: -(CH2)z-, где z равен от 0 до 3, карбонил или тиокарбонил; причем x+y+z вместе равны по меньшей мере 2 и самое большее 4 или G3 означает -СН(ОН)- или -С(ОН)=.
G1 и G2 вместе или отдельно могут также означать:
-C(R11R12)-, где R11 и R12 означают водород, ОН, низшую, в случае необходимости разветвленную или циклическую, в случае необходимости замещенную (ар)алкил-, арил-, (ар)алкилокси- или арилоксигруппу или вместе алкилспирогруппу (С3-С7-спироцикл)
или G1 и G2 вместе означают
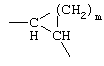
где m равно от 1 до 7.
W может иметь следующие значения:
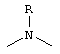
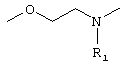
a) CR13R14, где R13 означает водород и R14 означает остаток -(CH2)nNR7R7 или -CO-NR7R7 или –COOR7, причем n может принимать значения от 0 до 2 и R7 имеет значения, как указано выше, или R7R7 через -(СН2)n- (где n равно от 3 до 5) образует кольцо, причем заместители R13 и R14 могут быть обменены,
b) N-фенил (причем фенильный остаток в случае необходимости замещен фтором, бромом, хлором, (C1-C4)алкилом, СО2алкилом, CN, CONH2 или алкоксигруппой) или N-тиен-2 или 3-ил, или N-фур-2 или 3-ил или N-1,3,5-триазинил, причем триазиновый остаток далее может быть замещен Cl, OR6 или NR7R7 и R6 и R7 имеют указанные выше значения;
c) одного из следующих заместителей
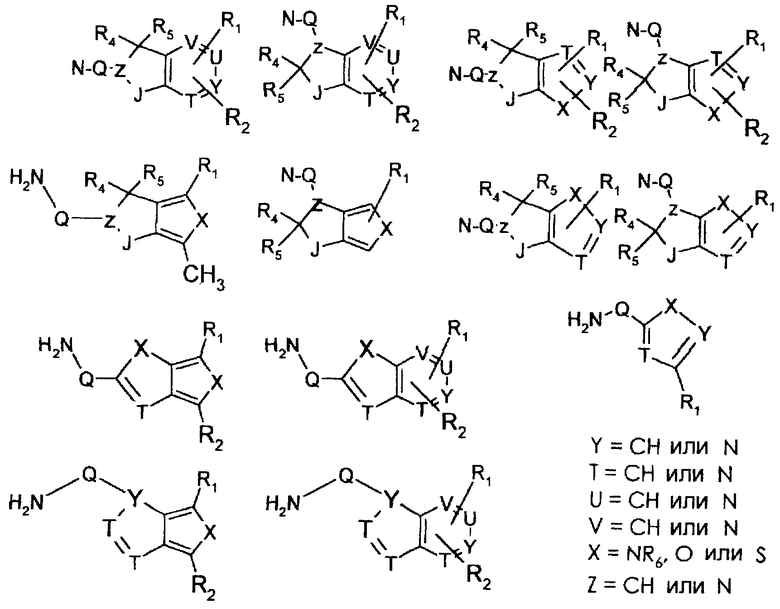
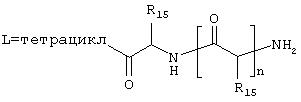
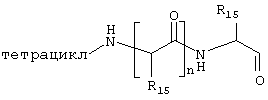
где J означает отсутствие связи или -(CH2)n- с n=0-3, карбонил, тиокарбонил, О, S, -SO- или SO2, R6 имеет указанные выше значения и далее Q определен как - (CH2)n-M*-(CH2)m, причем n=0-4 и m=0-4 и М* представляет алкинил, алкенил, дизамещенный фенил, дизамещенный тиофен, дизамещенный фуран, дизамещенный пиразин, дизамещенный пиридазин, пептидное промежуточное звено L или гетероциклическое промежуточное звено HS; причем данные значения промежуточных звеньев представлены далее в виде следующих формул
-(CH2)n- 
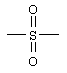

 или
или
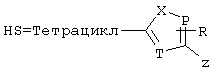
P=CH или N
T=CH или N
X=NR6, О или S
Z=CH или N
в которых R15 означает боковые цепи D-, L-, D,L-аминокислот или природных аминокислот и для случая, если n>1, R15 в отдельных остатках означает одинаковые или различные боковые цепи D-, L-, D,L-аминокислот или природных аминокислот; причем данные формулы представлены таким образом, что атом N наряду с Q каждый раз связан с G2 и G3 формулы I;
d) W может быть также через промежуточное звено Q связан с трициклическим заместителем (Тr), причем трициклический заместитель соответствует следующим формулам

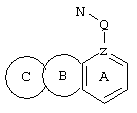
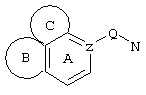
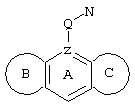
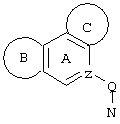
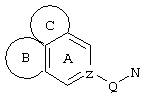
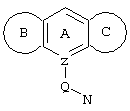
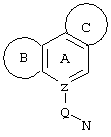
и эти формулы следует понимать таким образом, что каждый атом N наряду с Q связан с G2 и G3 формулы I и Q и Z имеют значения, приведенные под с).
Трициклические заместители (Тr) означают трициклическую кольцевую систему по меньшей мере с одним гетероциклическим кольцом в качестве циклического компонента и место присоединения к атому углерода конденсированного с ним бензольного кольца; причем Тr в случае необходимости по меньшей мере является монозамещенным; где кольцо А означает в случае необходимости замещенное бензольное кольцо и одно из колец В и С означает в случае необходимости замещенное гетероциклическое кольцо, а другое является замещенным 4-14-членным-, предпочтительно 5-7-членным циклом, который может содержать в кольце один или более гетероатомов. Бензольное кольцо в случае необходимости дополнительно замещено по меньшей мере одним заместителем, причем этими заместителями могут быть галогены, такие как фтор и хлор, галогено-С1-С3-алкильные группы, такие как трифторметил, C1-С3-алкильные группы, такие как метил, C1-С3-алкоксигруппы, такие как метоксигруппа, и гидроксигруппа, причем предпочтителен галоген, такой как фтор.
Замещенные в случае необходимости гетероциклические кольца В или С являются, например, 4 до 14-членными циклами, предпочтительно 5 до 7-членными циклами. По меньшей мере один гетероатом гетероциклического кольца (возможно от 1 до 3 гетероатомов) могут быть азотом, кислородом, серой. В частности, кольца В или С являются пиридином, пиразином, пиримидином, имидазолом, фураном, тиофеном, пирролидином, пиперидином, гексаметиленимином, тетрагидрофураном, пиперазином, морфолином и тиоморфолином, причем предпочтительны 5 до 7-членных неароматические циклы, которые могут содержать один или два одинаковых или различных гетероатома.
Кольцо В или С может также быть неароматическим гетероциклическим кольцом, содержащим 1-3 гетероатома, такие как азот, кислород или сера, и неароматическим гетероциклическим кольцом с атомом азота и еще другим гетероатомом, которым может быть азот, кислород или сера.
"5 до 8-членные кольца В или С" являются гетероциклическими или алициклическими циклами, или углеродными циклами, которые по меньшей мере монозамещены.
Указанные 5 до 8-членные углеродные циклы могут быть бензольным кольцом или насыщенным или ненасыщенным кольцом, например, бензолом, циклопентаном, циклопентеном, циклогексаном, циклогексеном, циклогексадиеном, циклогептаном, циклогептеном или циклогептадиеном.
Если кольца В или С содержат по меньшей мере один гетероатом (например, 1-3 гетероатома, таких как азот, кислород, сера и т.д.), если кольцо В или С является гетероциклическим кольцом, оно может быть ароматическим или нет. Такими ароматическими гетероциклическими кольцами являются, например, пиридин, фуран, тиофен. Предпочтительными неароматическими гетероциклическими кольцами являются приведенные выше примеры колец В и С.
Соответственно этому трициклический заместитель Тr может быть конденсированным бензольным кольцом общей формулы
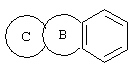
Примерами этого являются
карбазол,
1,2,3,4-4а,9а-гексагидрокарбазол,
9,10-дигидроакридин,
1,2,3,4-тетрагидроакридин,
10,11-дигидро-5Н-дибенз[b,f]азепин,
5,6,11,12-тетрагидродибенз[b,g]азепин,
6,11-дигидро-5Н-дибенз[b,е]азепин,
6,7-дигидро-5Н-дибенз[с,е]азепин,
5,6,11,12-тетрагидродибенз[b,f]азоцин,
дибензофуран,
9Н-ксантен,
10-11-дигидробенз[b,f]оксепин,
6,11-дигидробенз[b,е]оксепин,
6,7-дигидро-5Н-дибенз[b,g]оксацин,
дибензотиофен,
9Н-тиоксантен,
10,11-дигидpoдибeнзo[b,f]тиeпин,
6,11-дигидродибензо[b,е]тиепин,
6,7-дигидро-5Н-дибензо[b,g]тиоцин,
10Н-фенотиазин,
10Н-феноксазин,
5,10-дигидрофеназин,
10,11-дибензо[b,f]-[1,4]тиазепин,
2,3,5,6,11,11а-гексагидро-1Н-пирроло[2,1-b][3]бензазепин,
1-O,11-дигидро-5Н-дибензо[b,е][1,4]диазепин,
5,11-дигидродибенз[b,е][1,4]оксазепин,
5,11-дигидродибензо[b,f][1,4]диазепин,
10,11-дигидро-5Н-дибензо[b,е][1,4]диазепин,
1,2,3,3а,8,8а-гексагидропирроло[2,3b]индол.
Трициклический заместитель Тr может быть конденсированным бензольным кольцом общей формулы
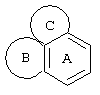
и означать, например:
1Н,3Н-нафт[1,8-cd][1,2]оксазин,
нафт[1,8-de]-l,3-оксазин,
нафт[1,8-dе]-1,2-оксазин,
1,2,2а,3,4,5-гексагидробенз[cd]индол,
2,3,3а,4,5,6-гексагидро-1Н-бензо[dе]хинолин,
4Н-пирроло[3,2,l-ij]хинолин,
1,2,5,6-тетрагидро-4Н-пирроло[3,2,l-ij]хинолин,
5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин,
1H,5Н-бензо[ij]хинолизин,
2,3,6,7-тетрагидро-1Н,5Н-бензо[ij]хинолизин,
азепино[3,2,1-hi]индол,
1,2,4,5,6,7-гексагидроазепино[3,2,1-hi]индол,
lH-пиридо[3,2,1-jk][1]бензазепин,
5,6,7,8-тетрагидро-1Н-пиридо[3,2,1-jk][1]бензазепин,
1,2,5,6,7,8-гексагидро-5Н-пиридо[3,2,1-jk][1]бензазепин,
2,3-дигидро-1H-бенз[dе]изохинолин,
1,2,3,4,4а,5,6,7-октагидронафт[1,8-bс]азепин,
2,3,5,6,7,8-гексагидро-1Н-пиридо[3,2,1-jk][1]бензазепин.
Трициклический заместитель Тr может быть конденсированным бензольным кольцом общей формулы
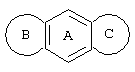
Примерами этих соединений являются:
1,2,3,5,6,7-гексагидробензо[1,2-b:4,5b']дипиррол,
1,2,3,5,6,7-гексагидроциклопент[f]индол,
1,2,3,6,7,8-гексагидроциклопентан[е]индол или
2,3,4,7,8-гексагидро-1Н-циклопента[f]хинолин.
Трициклический заместитель Тr может быть конденсированным бензольным кольцом общей формулы
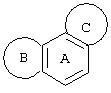
Примерами этих соединений являются:
1,2,3,6,7,8-гексагидроциклопент[е]индол или
2,3,4,7,8,9-гексагидро-1H-циклопента[f]xинолин.
Другими примерами трициклических заместителей Тr являются конденсированные бензольные кольца следующих формул, причем места прикрепления к Q могут располагаться на месте любого атома водорода:

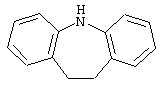
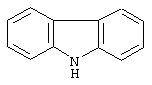
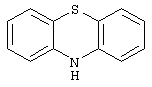
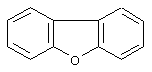
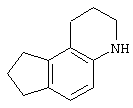
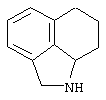
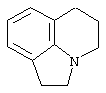
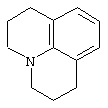
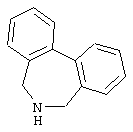
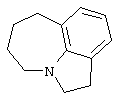
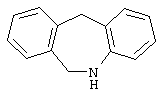
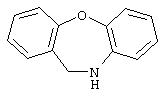
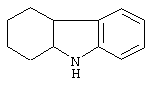
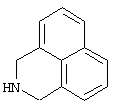
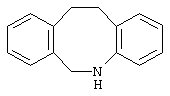
Дополнительно Тr может быть циклическим или бициклическим углеводородом, обозначенным следующими формулами:
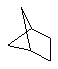
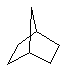
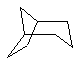
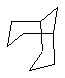
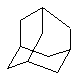
Каждый заместитель Тr может быть дополнительно замещен одним или более заместителями R1, причем значения заместителей R1 соответствуют формуле I.
e) W далее может означать -NH-, -S-, -SO- или -SO2-.
Изобретение относится далее к соединениям общей формулы II
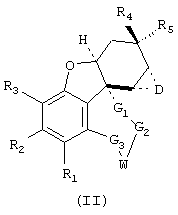
где D означает NH, N-алкил, N-ацил, кислород или серу и где заместители с R1 по R5, с G1 по G3, а также W могут иметь значения, приведенные при общей формуле I.
Далее изобретение относится к соединениям общей формулы III
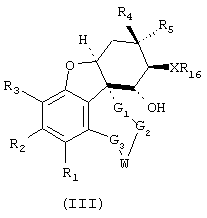
где X-R16 означает заместитель, в котором Х является кислородом или серой, a R16 водородом или низшей (C1-С10)-группой, возможно разветвленной или циклической, возможно замещенной (ар)алкильной группой, и где заместители R1 по R5, G1 по G3, а также W могут иметь значения, приведенные для общей формулы I.
Изобретение также распространяется на соединения общей формулы IV
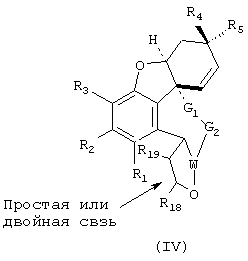
где W представляет СН или N и R18 и R19 означают водород, алкил-, арил- или аралкил и в которой С-атомы, имеющие заместители R18 и R19, могут быть соединены друг с другом простой или двойной связью и заместители R1 по R5, а также G1 по G3, могут иметь значения, приведенные для общей формулы I.
Предпочтительно, если в соединении формулы IV заместитель W означает азот и/или заместитель G1-(CH2)x-, где х равен 1 или 2, и
G2-(CH2)y-, где y равен 0 до 2; причем х+y вместе означают по меньшей мере 2 и самое большее 4.
Разделение оптических изомеров рац. норгалантамина:
Изобретение кроме того включает способ хирального разделения (6R)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ола (норгалантамина) (4)
Разделение (+) и (-) изомеров осуществляли фракционной кристаллизацией таким образом, что
- раствор или суспензию смеси оптических изомеров в 3 до 50-кратном количестве;
- растворителя, такого как вода, метанол, этанол, пропанол, изопропанол, ацетон или смеси указанных растворителей, предпочтительно метанола добавляют, помещают или смешивают;
- с эквимолярным количеством или избытком хиральной кислоты (незамещенной, одно- или многократно замещенной (+) или (-) винной кислоты, лимонной кислоты, молочной кислоты, предпочтительно (+)-O,O-ди-п-толуоилвинной кислоты, которая растворима в одном из указанных выше растворителей;
- вносят для затравки раствор кристаллов, полученных из природного производного (-)галантамина и хиральной органической кислоты, такой как (+)-O,O-ди-п-толуоилвинная кислота, и
- выдерживают при -40 до +20° С, предпочтительно при 0° С 2-24 часа или дольше;
- образовавшиеся кристаллы отфильтровывают и сушат;
- затем смешивают с избытком NH4OH и экстрагируют органическим растворителем, таким как хлороформ, метиленхлорид, этилацетат, бутилацетат, диэтиловый эфир, трет-бутилметиловый эфир, дибутиловый эфир, петролейный эфир, ксилол, бензол, толуол или подобным растворителем и отгонкой растворителя выделяют соответствующий (-) норгалантамин
В данном способе производят упаривание маточного раствора, поглощение избытка NH4OH, экстрагирование органическим растворителем (таким, как приведены выше) и упаривание фракции норгалантамина, из которых способом, аналогичным описанному выше, с хиральными органическими кислотами, такими как (-)-O,O-ди-п-толуоилвинная кислота, может быть получен (+)-норгалантамин
Полученные согласно изобретению продукты могут быть очищены подходящим способом, например, сублимацией, кристаллизацией или хроматографией.
Среди предлагаемых соединений, в особенности следует принять во внимание следующие соединения:
В последующем перечне означают "AchE": ацетилхолин эстеразу, "BchE": бутирилхолинэстеразу, "hr": человеческий вирус-рекомбинант, "mЕ": предварительное инкубирование фермента с ингибитором и "IC50": концентрацию, при которой происходит 50%-ное ингибирование.
При определении ингибирующей активности соединений использовались 0,1 М фосфатный буфер с рН 8,0, субстрат в концентрации 0,075 М, 0,01 М DTNB и ферменты в количестве 5Е/мл. Исследовали мозг крысы, используя 20 мг ткани на 1 мл фосфатного буфера (рН 8,0; 0,1 М). Методы определения биологической активности описаны George L. Ellman и др., A new and rapid colorimetric determination of acetylcholinesterase activity, Biochem. Pharmacology, 1961, т.7, с.88-85 (см. табл. 1 в конце текста описания). В рамках изобретения среди прочих особый интерес представляет соединение (6R)-3-метокси-5,6,9,10,11,12-гексагидро-4а[H1]бензофуро[3а,3,2-ef][2]бензоазепин-6-ол (норгалантамин), а именно рацемический норгалантамин, (-)-норгалантамин и (+)-норгалантамин Как рацемический норгалантамин, так и его (+) и (-)-изомеры могут быть использованы в лекарственных средствах для лечения в начальной стадии заболеваний, названных под пунктами а) по m), в качестве активных веществ или в комбинации с другими активными веществами.
Предложенные соединения могут быть синтезированы способом и приемами, описанными для получения галантамина и производных галантамина, описанными в WO 96/12692 и WO 97/40049.
Дополнительно к вышеназванным вариантам синтеза некоторые из предложенных соединений могут быть получены с применением комбинаторной (или параллельной) технологии синтеза. При данном способе синтеза интересующий основной структурный элемент (или ядро молекулы) иммобилизуют на твердой фазе (например, стеклянных шариках, полимерных шариках или другом инертном носителе), которая облегчает отделение избыточных компонентов реакции от модифицированного основного элемента. Каждый раз вводимая твердая фаза зависит от способности заполнения, вводимых реагентов и растворителя реакции. В частности, принимают во внимание полимерные шарики, как, например, смола Меррифилда, смола Ванга или смола тента-гель (TentaGel (Rapp)-Harz).
Иммобилизацию основного структурного элемента осуществляют через функциональную группу, которая в подходящих условиях реакции на последней стадии синтеза может быть снова получена. Последняя стадия состоит в отщеплении целевого продукта от твердой фазы. Выбор линкерного структурного звена, которое закрепляет основную молекулу на твердой фазе, зависит от комбинации и/или последовательности реагентов и условий реакции, которые требуются для достижения максимальных выходов и/или чистоты. Сверх того с различными линкерами продукты могут быть отщеплены от одинаковых твердых фаз в различных условиях. Указанная технология позволяет осуществлять быстрый синтез, включая автоматизированные синтезы соединений согласно изобретению.
Относительно комбинаторных и/или параллельных синтезов имеется информация в приведенных ниже литературных источниках, в которых содержится общее описание способа:
1) Abelson, J.N., Combinatorial Chemistry, Academic Press, San Diego (1996).
2) Epton, R., Innovation and Perspectives in Solid Phase Synthesis and Combinatorial Libraries, Mayflower Scientific Limited, Birmingham (1996).
3) Wilson, S.R. and Czarnik, A.W., Combinatorial Chemistry, Synthesis and Applications. John Wiley & Sons, Inc., New York (1997).
4) Gordon, E.M. and Kerwin, J.F.J., Combinatorial Chemistry and Molecular Diversity in Drug Discovery. John Wiley & Sons, Inc., New York (1998).
5) Thompson, L.A., Ellman J.A. Chem. Rev. 96, 555 (1996).
6) Special issue on combinatorial chemistry, cf., Acс. Chem. Res., 29, 111 (1996).
7) Fruchtel, J.S.; Jung, G.Angew. Chem, Int. Ed. Engl. 35, 17 (1996).
8) Cheng, S.; Comer, D.D.; Williams, J.P.; Myers, P.L.; Boger, D.L.J. Am. Chem. Soc., 118, 2567 (1996).
9) Для дополнительной информации в этой быстро развивающейся области смотри: A dynamic database of references in molecular diversity at http://www.5z.com.
10) Bayer E.; Angew Chem. Int. Ed.,30, 113-129 (1991).
11) Mayer, J.P.; Zhang, J.; Bjergarde, K.; Lentz, D.M.; Gaudino, J.J.; Tetrahedron Letters, 37, 8081 (1996).
12) заявка DE 19745628 Al.
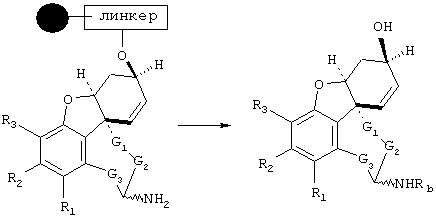
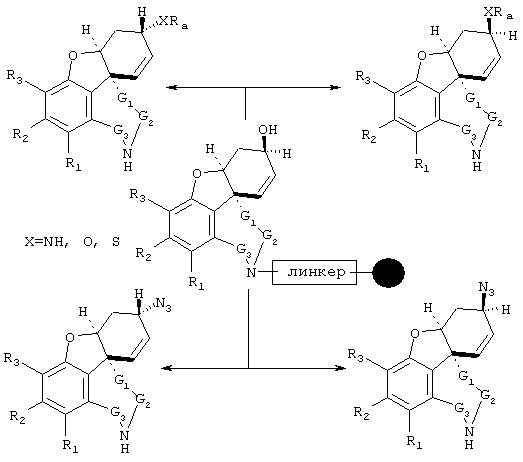
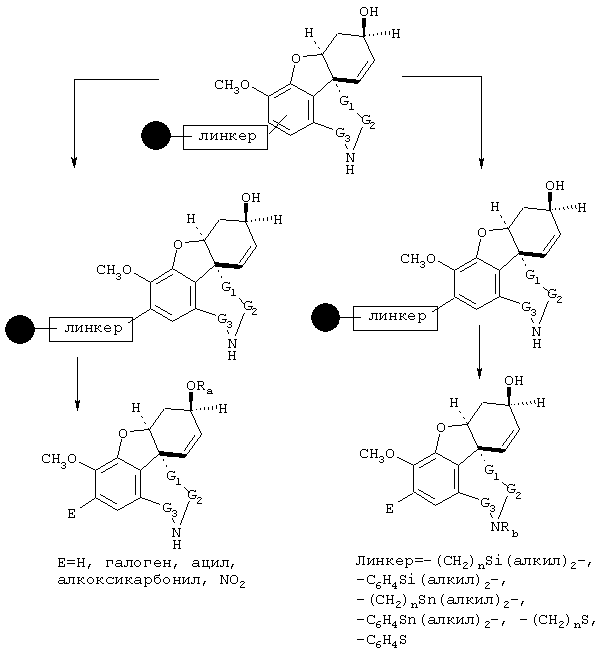
В примере норгалантаминового элемента (G1=G2=G3 = метилен; W=CH-NH) или "гомогалантамина (G1=G2=G3 = метилен, W=CH-NH2) связь между молекулой и твердой фазой может быть достигнута либо через углеродный центр (С-связывание), азотный центр (N-связывание), либо кислородный центр (О-связывание). Места присоединения зависят от типа желаемой структурной модификации. В приведенных ниже в качестве примеров схемах реакции отражены различные трансформации в различных основных структурных элементах, прикрепленных через линкер на различные твердые фазы.
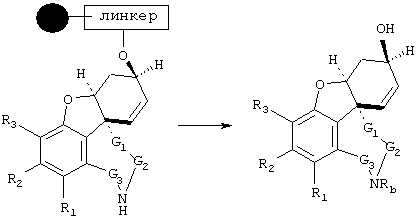
Линкер = -X(CH2)nCO (X=CH2, СО, О, S, NH), -Х(СН2)nОСО (X=СН2, СО, О, S, NH), -ХС6Н4СН2- (X=СН2, СО, О, S, NH), 2,3-дигидропиран, -X(CH2)nSi (алкил)2-,
О-линкерные трансформации элементов норгалантаминового типа и "гомогалантаминового" типа
Линкер = X(CH2)nCO (X=CH2, О, NH, SO0-2), X(CH2)nCS (X=CH2, О, NH, SO0-2), X(CH2)nJCO (X=CH2, О, NH, SO0-2, J=NH, O, S), ХС6Н4СН2 (X=CH2, О, S),
N-линкерные трансформации элемента молекулы норгалантаминового типа
С-линкерные трансформации элемента норгалантаминового типа
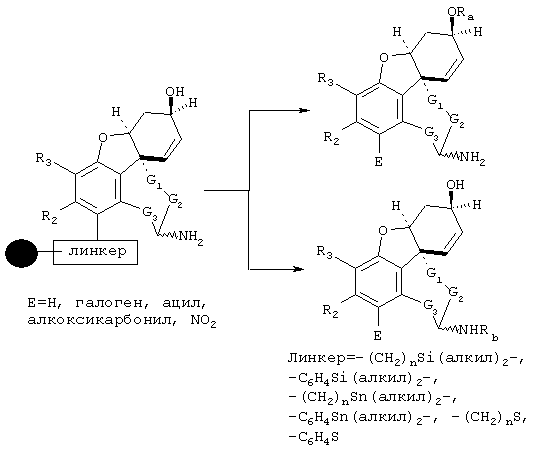
С-линкерные трансформации "гомогалантаминового элемента".
Соединения согласно изобретению, а также их фармацевтически приемлемые аддитивные соли кислот могут быть использованы в качестве активных веществ, например, для лечения заболеваний с апоптозным компонентом.
Нейродегенеративные заболевания нервной системы человека относятся к таким синдромам, для которых в настоящее время отсутствуют или имеются только недостаточно специфические способы лечения. Под неврологическими заболеваниями указанного типа с хроническим течением в первую очередь имеют в виду следующие:
- первичная дегенеративная деменция (прежде всего болезнь Альцгеймера),
- церебральные и спинальные параличи (амиотропный латеральный склероз, рассеянный склероз),
- центрально обусловленные нарушения движения (болезни Паркинсона и Хандингтона)
и
- заболевания эпилептического типа.
Нейродегенерация играет, однако, также роль в непосредственных последствиях нейрологических острых приступов, среди которых в первую очередь должны быть названы следующие:
- ишемический приступ (закупорка обеспечивающей мозг артерии),
- геморрагический приступ (внутреннее кровоизлияние),
- черепно-мозговая травма и
- повреждения мозга после сердечной недостаточности или остановки дыхания (гипоксия/аноксия).
Соединения изобретения, а также их фармацевтически приемлемые аддитивные соли кислот могут служить активными веществами в лекарственных средствах для лечения нейродегенеративных процессов, причем направленных, в частности, преимущественно не для улучшения острой симптоматики, а для замедления и модифицирования связанных с ними процессов.
В рамках сахарного диабета типа II наблюдается возрастающая роль амилоидных фрагментов при дегенерации клеток продуцирующих инсулин клеток островков Лангерганса. Неконтролируемым потоком кальция дегенерация клеток может быть усилена.1,2,3
Соединения согласно изобретению, а также их фармацевтически приемлемые аддитивные соли кислот, могут быть введены в качестве активных веществ в лекарственные средства, например, для лечения дегенеративных заболеваний клеток островкового аппарата поджелудочной железы (как, например, сахарного диабета типа II).
Соединения изобретения используют в качестве активных веществ в лекарственных средствах, которые могут быть использованы в следующих случаях:
a) для лечения болезни Альцгеймера,
b) для лечения болезни Паркинсона,
c) для лечения болезни Хангтингтона (хореи),
d) для лечения рассеянного склероза,
e) для лечения бокового амиотрофического склероза,
f) для лечения эпилепсии,
g) для лечения последствий острых приступов,
h) для лечения последствий черепно-мозговых травм,
i) для лечения и профилактики последствий диффузного кислородного и пищевого дефицита в головном мозге, которые наблюдаются после гипоксии, аноксии, асфиксии, остановки сердца, отравлений, а также при осложнениях при тяжелых родах у грудничков или при наркозе,
j) в частности, также для профилактического лечения апоптозной дегенерации в нейронах, которая наступает при местной радио- и химеотерапии опухолей мозга, и
k) для лечения бактериального менингита и
1) для лечения заболеваний с апоптозным компонентом, особенно в случае амилоидно-ассоциированной дегенерации клеток,
m) для лечения сахарного диабета, в частности, если заболевание протекает с амилоидной дегенерацией островкового аппарата поджелудочной железы.
Предложенные соединения или их фармацевтически приемлемые аддитивные соли кислот, например, гидробромид, гидрохлорид, метилсульфат, йодметилат, тартрат, фумарат, оксалат и т.д. (см. таблицу 2) могут быть введены пациентам перорально, ректально или путем подкожных, внутримышечных, внутривенных или внутрикапсульных инъекций или инфузий или интрацеребровентрикулярно, например, через имплантированные резервуары (см. табл. 2).

Типичные дозировки при приеме указанных активных веществ зависят от природы используемого соединения и при внутривенном введении составляют от 0,01 до 2,0 мг в день и на килограмм веса тела в зависимости от физического состояния и медикаментозного лечения пациента.
Следующие специфические готовые препаративные формы могут иметь применение:
таблетки и капсулы, содержащие от 0,5 до 50 мг,
раствор для парентерального введения, содержащий от 0,1 до 30 мг активного вещества/мл,
жидкие готовые препаративные формы для перорального введения в концентрации от 0,1 до 15 мг/мл,
жидкие готовые препаративные формы для интрацеребровентрикулярного введения в концентрации от 1 до 5 мг активного веществ/мл.
Предложенные соединения могут также быть трансдермальной системой, из которой высвобождается от 0,1 до 10 мг/день.
Трансдермальная дозировочная система состоит из сборного слоя, который содержит от 0,1 до 30 мг активного вещества в виде свободного основания или соли во всяком случае вместе с ускорителем пенетрации, например, диметилсульфоксидом или карбоновой кислотой, например, октановой кислотой, и расположенного близко к коже полиакрилата, например, сополимера гексилакрилата, винилацетата и акриловой кислоты, вместе с мягчителем, например, изопропилмиристатом. В качестве покрытия служит непроницаемый для активного вещества внешний слой, например, покрытый металлом, силиконизированный полиэтиленовый пластырь толщиной, например, 0,35 мм. Для получения клеящего слоя служит, например, сополимер диметиламинометакрилата и метакрилата в органическом растворителе.
Изобретение относится также к фармацевтическим композициям, которые содержат в фармацевтически приемлемом вспомогательном веществе терапевтически эффективное количество по меньшей мере одного предлагаемого согласно изобретению соединения.
Изобретение распространяется также на применение этих соединений для получения лекарственных средств и на способ получения таких соединений.
В частности, предложенные соединения, которые во многих случаях оказывают ингибирующее действие на холинэстеразы, применимы в качестве терапевтических и/или профилактических активных веществ для сенильной деменции, болезни Альцгеймера и т.д. Соединения, предлагаемые согласно изобретению, являются новыми тетрациклическими, конденсированными, гетероциклическими соединениями.
Дополнительно к терапевтическим и/или профилактическим свойствам предложенные соединения и композиции могут быть использованы при диагностике болезненных состояний названного типа.
Литература:
1) Kawahara, M.; Kuroda, Y.; Arispe, N.; Rojas, E.; ″ Alzheimer's beta-amyloid, human islet amylin, and priori protein fragment evoke intracellular free calcium elevations by a common mechanism in a hypothalamic BnRH neuronal cell line." J Вiol Chem 2000 May 12; 275 (19): 14077-83.
2) Ma, Z.; Westermark, P.; Westermark, GT: ″ Amyloid in human islets of Langerhans: immunologic evidence that islet amyloid polypeptide is modified in amyloidogenesis." Pancreas 2000 Aug; 21(2): 212-8.
3) Rhoades, E.: Agarwal, J.; Gafni, A.; ″ Aggregation of an amyloidogenic fragment of human islet amyloid polypeptide." Biochim Biophys Acta 2000 Feb 9; 1476(2): 230-8.
Далее приведены методики и примеры получения предложенных соединений.
Общие замечания
"Концентрирование" или "обогащение" означают удаление растворителей при пониженном давлении на роторном испарителе.
"MPLC" означает хроматографическую очистку на силикагеле 20-60 мкм с применением хроматографической колонки  , насоса Shimadzu LC-8A и УФ-детектора Shimadzu 6AV.
, насоса Shimadzu LC-8A и УФ-детектора Shimadzu 6AV.
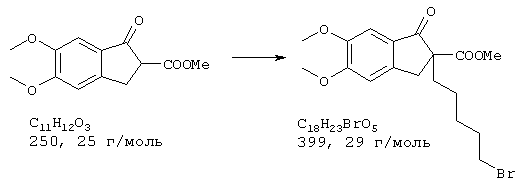
Пример 1:
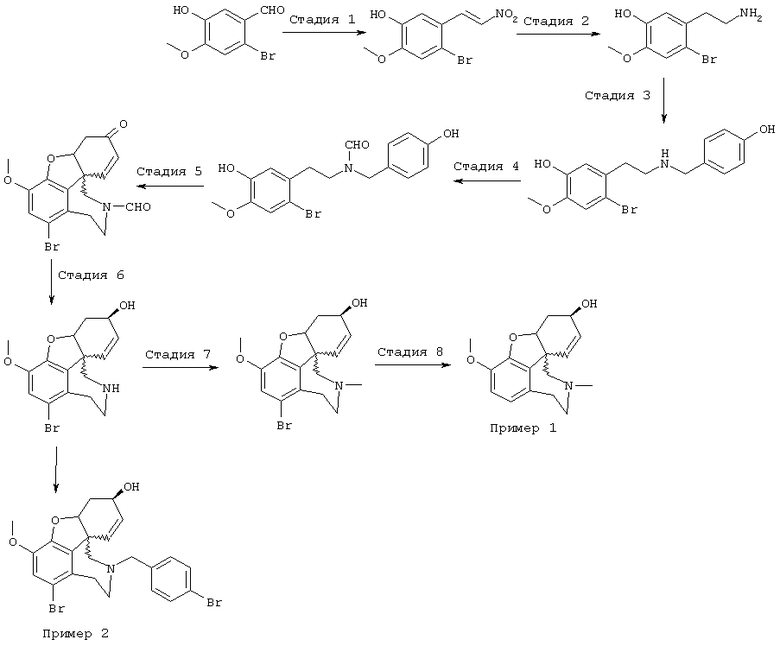
Стадия 1: 4-бром-2-метокси-5-(2-нитроэтил)фенол
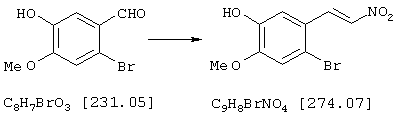
40,0 г (173 ммоля) 2-бром-5-гидрокси-4-метоксибензальдегида и 13,3 г (173 ммоля) ацетата аммония в 400 мл нитрометана нагревали с обратным холодильником 15 мин Реакционную смесь упаривали досуха, остаток извлекали из примерно 70 мл метанола и затем отсасывали. Для получения второй фракции продукта метанольный раствор упаривали примерно до 30 мл и затем выливали в 500 мл воды. Выпавшее вещество отсасывали на нутче, промывали примерно 100 мл воды и вместе с первой фракцией сушили при 50° С/50 мбар, получая всего 43,6 г (92% от теории) желтых кристаллов с т.пл. 152-154° С 4-бром-2-метокси-5-(2-нитроэтил)фенола.
ТСХ (тонкослойная хроматография): СН2Сl2:МеОН=9:1
1H-ЯМР (CDCl3; δ (ч.н.м.): 3,85 (с, 3Н, ОСН3); 7,30 (с, 1Н, Н-6); 7,38 (с, 1Н, Н-3); 8,03 (д, 3JHH=13,41 Гц, 1Н, АrСН=); 8,16 (д, 3JHH=13,41 Гц, 1Н, =СНNО2)
13С-ЯМР (CDCl3; δ (ч.н.м.): 56,3 (кв, ОСН3); 114,7 (д, С-6); 116,1 (д, С-3); 116,6 (с, С-2); 121,4 (с, С-1); 136,8 (д, АrСН=); 137,6 (д, =CHNO2); 146,5 (с, С-5); 152,2 (с, С-4).
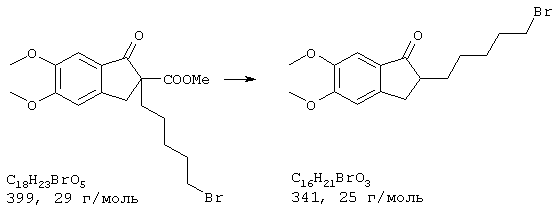
Стадия 2: 4-бром-2-метокси-5-(2-аминоэтил)фенол
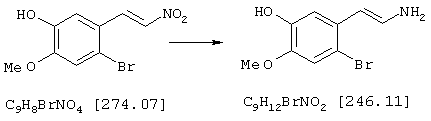
Способ А:
К 168 мл (148 ммолям) 0,88 н раствора алюмогидрида лития в диэтиловом эфире при 0° С в атмосфере азота прибавляли по каплям 7,2 г (74 ммоля) концентрированной серной кислоты. 10,0 г (36,5 ммоля) 4-бром-2-метокси-5-(2-нитроэтенил)фенола частично растворяли в одном литре абсолютного диэтилового эфира при кипячении и затем прибавляли выдержанный раствор алюмогидрида лития через капельную воронку под азотом при комнатной температуре. После окончания прибавления 700 мл диэтилового эфира перегоняли из реакционной смеси к нерастворенному 4-бром-2-метокси-5-(2-нитроэтенил)фенолу в приемник. Нагреванием остатка получали насыщенный раствор, который перемещали в реакционную смесь, как описано выше. Эту операцию повторяли до полного прибавления 4-бром-2-метокси-5-(2-нитроэтенил)фенола (от трех до четырех раз). Затем гидролизовали водой при 0° С и эфирную фазу дважды экстрагировали по 300 мл 4 н соляной кислоты. Кислый раствор смешивали с 22,2 г (148 ммолями) L-(+)-винной кислоты, подщелачивали концентрированным водным аммиаком и экстрагировали хлороформом. Объединенную органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили (Na2SO4), фильтровали и упаривали, получая 2,20 г (24% от теории) бесцветных кристаллов с т.пл. 170-172° С 4-бром-2-метокси-5-(2-аминоэтил)фенола.
Способ В:
К нагреваемому с обратным холодильником раствору 15,0 г (394,2 ммоля) алюмогидрида лития в 1 л абсолютного тетрагидрофурана в течение 2 часов под азотом прибавляли по каплям раствор 18,0 г (65,7 ммоля) 4-бром-2-метокси-5-(2-нитроэтенил)фенола в 200 мл абсолютного тетрагидрофурана. Затем реакционную смесь при охлаждении льдом гидролизовали примерно 20 мл воды и упаривали досуха. Остаток извлекали 500 мл 2 н соляной кислоты и промывали 500 мл этилового эфира уксусной кислоты. Промывную фазу снова встряхивали с 200 мл 2 н соляной кислоты, объединенные водные фазы смешивали с 70 г (467 ммолей) L-(+)-винной кислоты, подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 800 мл хлороформа. Объединенные органические фазы сушили сульфатом натрия, фильтровали и упаривали, получая 9,92 г (61% от теории) бесцветных кристаллов 4-бром-2-метокси-5-(2-аминоэтил)фенола с т.пл. 170-172° С.
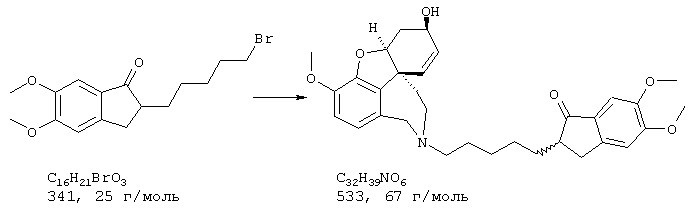
Стадия 3: 4-бpoм-5-{N-[(4-гидроксифенил)метил]-2-аминоэтил}-2-метоксифенол
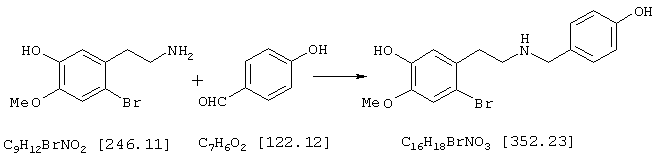
6,4 г (26,0 ммоля) 4-бром-2-метокси-5-(2-аминоэтил)-фенола и 3,2 г (26,0 ммоля) п-гидроксибензальдегида в 150 мл абсолютного этанола нагревали с обратным холодильником 2 часа. Затем при охлаждении льдом прибавляли 5,0 г (132,0 ммоля) боргидрида натрия и следующие полчаса нагревали с обратным холодильником, избыток боргидрида натрия разлагали прибавлением примерно 1 мл ледяной уксусной кислоты, а также 50 мл воды при охлаждении льдом и раствор упаривали. Остаток подкисляли 2 н соляной кислотой и промывали 50 мл хлороформа. При гидролизе могут образоваться крупные куска твердого продукта, которые перед экстракцией следует размельчить, так как они могут содержать большие количества продукта. Водную фазу снова встряхивали с 30 мл 2 н соляной кислоты, объединенные водные фазы подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 80 мл этилового эфира уксусной кислоты. Органические фазы объединяли, сушили над сульфатом натрия, фильтровали и упаривали, получая 8,9 г (97% от теории) бесцветных кристаллов с т.пл. 69-72° С 4-бром-5-{N-[(4-гидроксифенил)метил]-2-аминоэтил}-2-метоксифенола.
ТСХ: СНС13:МеОН = 9:1+2% NН3
1H-ЯМР (ДМСО; δ (ч.н.м.): 2,55-2,78 (м, 4Н, ArCH2CH2NH); 3,58 (с, 2Н, NHCH2Ph); 3,73 (с, 3Н, ОСН3); 6,60-6,76, 7,02-7,14 (2* m, 6H, 2* Ph)
13С-ЯМР (ДМСО; δ (ч.н.м.): 35,2 (t, АrСН2); 48,7 (т, H2CH2NH); 52,2 (т, NHCH2Ph); 55,9 (кв, ОСН3); 111,3 (с, С-4); 114,8 (д, С-3'); 115,9 (д, С-6); 117,3 (д, С-3); 129,1 (д, С-2'); 130,7 (с, С-5); 131,4 (с, С-1'); 146,0 (с, С-2); 146,8 (с, С-1); 156,0 (с, С-4').
Стадия 4: N-[2-(2-бром-5-гидрокси-4-метоксифенил)этил]-N-[(4-гидроксифенил)метил]формамид:
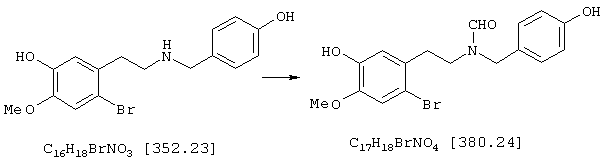
8,5 г (24,1 ммоля) 4-бром-5-{N-[(4-гидроксифенил)метил]-2-аминоэтил}-2-метоксифенола и 10 мл (123,8 ммоля) этилового эфира муравьиной кислоты нагревали 24 часа с обратным холодильником с 2,5 мл муравьиной кислоты, 10 мл N,N-диметилформамида, а также на кончике шпателя диметиламинопиридина в 150 мл абсолютного диоксана. После окончания реакции первоначально белая суспензия осветлялась и смесь смешивали с 50 мл воды. Диоксан отгоняли, полученный белый осадок отсасывали на нутче и промывали водой, получая первую фракцию продукта. Фильтрат трижды экстрагировали по 50 мл этилового эфира уксусной кислоты, объединенные органические фазы сушили над сульфатом натрия, фильтровали и упаривали. Путем последующей колоночной хроматографии (50 г силикагеля, растворитель: СНСl3:МеОН=97:3) получали вторую фракцию. Обе фракции сушили до постоянного веса при 50° С/50 мбар, получая всего 6,6 г (72% от теории) бесцветных кристаллов с т.пл. 104-106° С N-[2-(2-бром-5-гидрокси-4-метоксифенил)этил]-N-[(4-гидроксифенил)метил]формамида.
ТСХ: СНС13:МеОН 9:1
1H-ЯМР (ДМСО; δ (ч.н.м.): 2,56-2,78 (м, 2Н, ArCH2); 3,43-3,53 (м, 2Н, CH2N); 3,72 (с, 3Н, ОСН2); 4,14 (дд, 2Н, NCH2Ph); 6,67-6,80, 7,00-7,11 (2* м, 6Н, Ar, Ph); 9,30, 9,48 (2* с, 1H, CHO).
13С-ЯМР (ДМСО; δ (ч.н.м.): 32,6, 34,2 (2* т, ArCH2); 41,5, 44,3 (2* т, CH2N); 46,1, 50,4 (2* т, NCH2Ph); 56,1 (кв, ОСН3); 111,4, 111,6 (2* с, С-4); 115,1, 115,2 (2* д, С-6); 115,6, 115,7 (2* д, С-3'); 117,7, 118,0 (2* д, С-3); 126,8, 127,0 (2* с, С-5); 129,4 (д, С-2'); 130,0 (с, С-1'); 146,5, 146,6 (2* с, С-2); 147,5, 147,6 (2* с, С-1); 157,1, 157,5 (2* с, С-4'); 162,7, 163,0 (2* д, СНО).
Стадия 5: (4аα ,8аα )-4а,5,9,10,11-гексагидро-1-бром-3-метокси-6-оксо-6H-бензофуро[3а,3,2-ef][3]бензазепин-10-карбоксальдегид:
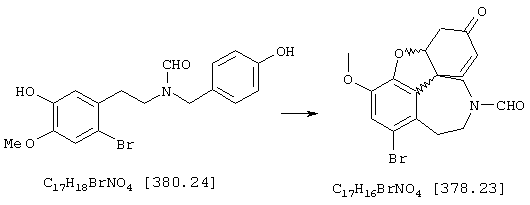
Смесь 13 г (39,5 ммоля) гексацианоферрата(III) калия, 300 мл хлороформа и 50 мл водного 10%-ного раствора карбоната калия нагревали до 60° С, смешивали с 3 г (7,9 ммоля) N-[2-(2-бром-5-гидрокси-4-метоксифенил)этил]-N-[(4-гидроксифенилил)-метил]формамида при сильном перемешивании и следующие 10 минут механически перемешивали. Затем образовавшееся коричневое вещество отфильтровывали через фильтр Hyflo, трижды промывали хлороформом по 30 мл и отжимали. Фильтрат затем промывали примерно 150 мл воды, водную фазу встряхивали со 150 мл хлороформа, объединенные органические фазы сушили над сульфатом магния, фильтровали и упаривали. Путем очистки колоночной хроматографией (15 г силикагеля, растворитель: СНС13:МеОН=97:3) получали 580 мг (19% от теории) бесцветных кристаллов с температурой плавления 218-220° С.
ТСХ: СНС13:МеОН =9:1
1H-ЯМР (СDС13; δ (ч.н.м.)): 2,58-4,27 (м, 8Н, Н-5/5'/9/9'/11/11'/12/12'); 3,80 (с, 3Н, ОСН3); 4,85 (дд, 1Н, Н-4а); 6,09 (дд, 1Н, Н-8); 6,53 (дд, 1Н, Н-7); 7,01 (с, 1Н, Н-2); 8,10, 8,30 (2* с, 1Н, СНО Konf,A/B)
13С-ЯМР (CDCl3; δ (ч.н.м.)): 33,4, 35,3 (2* т, С-9 Konf,A/B); 37,2, 37,4 (2* т, С-5 Konf,A/B); 43,7 (т, С-11); 48,7, 49,0 (2* т, С-12 Konf,A/B); 50,9, 51,4 (2* с, С-8а Konf,A/B); 56,2 (кв, ОСН3); 83,8, 84,3 (2* с, С-4а Konf,A/B); 115,3, 115,7 (2* с, C-1 Konf,A/B); 116,8, 117,0 (2* д, С-8 Konf,A/B); 127,6, 128,9 (2* с, С-12а Konf,A/B); 128,0, 128,8 (2* д, С-7 Konf,A/B); 129,8, 130,8 (2* с, С-12 Konf,A/B); 141,5, 141,7 (2* д, C-2 Konf,A/B); 143,8, 144,0 (2* с, С-3а Konf,A/B); 146,8 (с, С-3); 161,7, 162,3 (2* д, СНО); 193,0, 193,4 (2*, с, С-6).
C17H16BrNO4 (JOS 1526) 378,23 г/моль
Вычислено, %: С 53,99; Н 4,26; N 3,70.
Найдено, %: С 53,70; Н 4,47; N 3,41.
Стадия 6: [4аα ,8аα )-4а,5,9,10,11-гексагидро-1-бром-3-метокси-6Н-бензофуро[3а,3,2-еf] [3]бензазепин-6-ол:
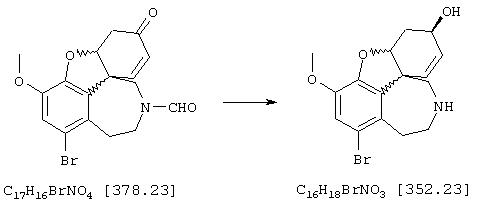
К раствору 500 мг (1,32 ммоля) (4аα ,8аα )-4а,5,9,10,11-гексагидро-1-бром-3-метокси-6-оксо-6Н-бензофуро[3а,3,2-ef][3]бензазепин-10-карбоксальдегида в 12 мл абсолютного тетрагидрофурана при -12° С под азотом прибавляли по каплям 4 мл (4,00 ммоля) 1 н раствора L-селектрида и реакционную смесь перемешивали один час при -10° С. Затем гидролизовали 3 мл метанола, раствор упаривали досуха, вносили в 50 мл 2 н соляной кислоты и сильно перемешивали еще один час. Водный раствор промывали 50 мл этилового эфира уксусной кислоты, водную фазу снова встряхивали с 20 мл 2 н соляной кислоты, объединенные водные фазы подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 50 мл этилового эфира уксусной кислоты. Объединенные органические фазы сушили над сульфатом магния, фильтровали и упаривали, получая 380 мг (82% от теории) светло-желтых кристаллов с т.пл. 132-136° С (4аα ,8аα )-4а,5,9,10,11-гексагидро-1-бром-3-метокси-6Н-бензофуро[3а,3,2-еf] [3]бензазепин-6-ола.
ТСХ: СНС13:МеОН=9:1
1Н-ЯМР (CDCl3; δ (ч.н.м.)): 1,87(ддд, 1Н, Н-5); 2,62 (ддд, 1Н, Н-5'); 2,68 (ддд, 1Н, Н-11); 2,78 (д, 1Н, Н-9, 2J9/9'=12,6 Гц); 2,85 (ддд, 1Н, Н-1'); 2,98 (д, 1Н, Н-9', 2J9/9'=12,6 Гц); 3,30 (ддд, 1Н, Н-12); 3,37 (ддд, 1Н, Н-12'); 3,80 (с, 3Н, ОСН3); 4,08 (ддд, 1Н, Н-6); 4,50 (дд, 1Н, Н-4а); 6,08 (дд, 1Н, Н-8, 3J7/8=10,2 Гц); 6,15 (д, 1Н, Н-7, 3J7/8=10,2 Гц); 6,96 (с, 1Н, Н-2);
13С-ЯМР (СDСl3; δ (ч.н.м.)): 30,2 (т, С-5); 36,7 (т, С-9); 49,7 (т, С-11); 51,6 (с, С-8д); 56,0 (кв, ОСН3); 57,3 (т, С-12); 62,0 (д, С-6); 85,5 (д, С-4а); 114,9 (с, С-1); 115,7 (д, С-8); 127,3 (д, С-2); 127,7 (д, С-7); 130,5 (с, С-12а); 134,2 (с, С-12шир.); 143,5 (с, С-3а); 145,4 (с, С-3).
Стадия 7: (4аα ,8аα )-4а,5,9,10,11-гексагидро-1-бром-3-метокси-10-метил-6Н-бензофуро[3а,3,2-ef][3]бензазепин-6-ол
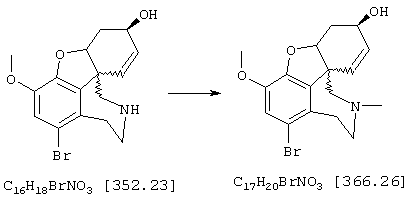
К раствору 370 мг (1,05 ммоля) (4аα , 8аα )-4а,5,9,10,11-гексагидро-1-бром-3-метокси-6Н-бензофуро[3а,3,2-ef][3]бензазепин-6-ола в 12 мл ацетонитрила при интенсивном перемешивании последовательно прибавляли 1 мл 35%-ного водного раствора формальдегида и порциями 165 мг (2,63 ммоля) цианборгидрида натрия, и реакционную смесь интенсивно перемешивали при комнатной температуре один час. Затем подкисляли 2 н раствором соляной кислоты, промывали 15 мл дихлорметана и промывную фазу снова встряхивали с 15 мл 2 н соляной кислоты. Объединенные водные фазы подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 30 мл дихлорметана. Объединенные органические фазы сушили над сульфатом магния, фильтровали и упаривали, получая 355 мг (92% от теории) желтых кристаллов с т.пл. 158-161° С (4aα , 8aα )-4a,5,9,10,11-гексагидро-1-бром-3-метокси-10-метил-6Н-бензофуро[3а,3,2-еf) [3]бензазепин-6-ола.
ТСХ: СНС13:МеОН=9:1
1H-ЯМР (CDCl3; δ (ч.н.м.)): 1,91-2,04 (м, 1Н, Н-5); 2,27-2,48 (м, 2Н, Н-5'/11); 2,41 (с, 3Н, NCН3); 2,60-2,81 (м, 2Н, Н-9/11'); 2,92-3,16 (м, 2Н, 9'/12); 3,34 (дд, 3J12/12'=6,37 Гц, 2J12/12'=16,48 Гц, 1Н, Н-12'); 4,13-4,25 (м, 1Н, Н-6); 4,58 (шир., 1Н, Н-4а); 6,02 (дд, 3J7/8=10,17 Гц, 4J6/8=5,08 Гц, 1Н, Н-8); 6,18 (д, 3J7/8=10,17 Гц, 1Н, H-7); 6,92 (с, 1Н, H-2).
Стадия 8: (4аα , 8аα )-4а,5,9,10,11-гексагидро-3-метокси-10-метил-6Н-бензофуро[3а,3,2-ef][3]бензазепин-6-ол
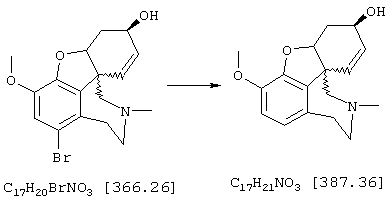
Смесь 340 мг (0,93 ммоля) (4аα ,8aα )-4a,5,9,10,11-гексагидро-1-бром-3-метокси-10-метил-6Н-бензофуро[3а,3,2-ef][3]бензазепин-6-ола и 722 мг (6,51 ммоля) хлорида кальция в 40 мл 50%-ного этанола смешивали с 1,4 г (22,32 ммоля свежего активированного цинкового порошка [цинковый порошок (Fa. Aldrich) смешивали с 2 н соляной кислотой, хорошо перемешивали, отфильтровывали и промывали дистиллированной водой до нейтральной реакции, затем тщательно промывали метанолом] и нагревали с обратным холодильником 5 ч. Затем цинк отфильтровывали, промывали метанолом и оставшийся раствор упаривали. Остаток вносили в 50 мл 1 н соляной кислоты, промывали 30 мл этилового эфира уксусной кислоты и водную фазу снова встряхивали с 20 мл соляной кислоты. Объединенные водные фазы подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 50 мл этилового эфира уксусной кислоты. Объединенные органические фазы сушили над сульфатом магния, фильтровали и упаривали, получая 230 мг (86% от теории) желтых кристаллов с т.пл. 152-155° С (4аα ,8аα )-4а,5,9,10,11-гексагидро-3-метокси-10-метил-6Н-бензофуро[3а,3,2-ef] [3]бензазепин-6-ола.
ТСХ: ЭЭ(этилацетат):EtOH=9:1 (видимая окислением в йодной камере)
1H-ЯМР (CDCl3; δ (ч.н.м.): 1,90-2,04 (м, 1Н, Н-5); 2,26-2,46 (м, 2Н, Н-11/11'); 2,42 (с, 3Н, NСН3); 2,62-2,80 (м, 3Н, Н-5'/9/9'); 3,01-3,12 (м, 1Н, Н-12); 3,12-3,29 (м, 1Н, Н-12'); 3,83 (с, 3Н, ОСН3); 4,12-4,22 (м, 1Н, Н-6); 4,57 (шир., 1Н, Н-4а); 6,01 (ддд, 3J7/8=10,16 ГЦ, 4J6/8=5,18 Гц, 5J5/8=0,95 Гц; 1Н, Н-8); 6,22 (дд, 3J7/8=10,16 Гц, 4J5/7=1,09 Гц, 1Н, Н-7); 6,61 (д, 3J1/2=8,21 Гц, 1Н, H-2); 6,66 (д, 3J1/2=8,21 Гц, 1Н, Н-1).
13С-ЯМР (CDCl3; δ (ч.н.м.): 30,0 (т, С-5); 34,5 (т, С-9); 48,9 (с, С-8а); 49,3 (кв, NCH3); 55,6 (кв, ОСН3); 59,1 (т, С-11); 62,0 (д, С-6); 66,3 (т, С-12); 85,6 (д, С-4а); 111,1 (д, С-1); 121,5 (д, С-8); 126,5 (д, С-2); 128,3 (д, С-7); 130,9 (с, С-12а); 132,7 (с, С-12 шир); 142,9 (с, С-3а); 145,3 (с, С-3 шир.).
Пример 2:
(4аα ,8аα )-4a,5,9,10,11-Гексагидро-1-бром-6-[(4-бромфенил) метил]-3-метокси-6Н-бензофуро[3а,3,2-ef][3]бензазепин-6-ол
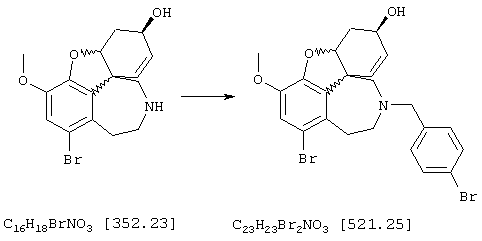
Смесь 23 мг (0,068 ммоля) (4аα , 8аα )-4а,5,9,10,11-гексагидро-1-бром-3-метокси-6Н--бензофуро[3а,3,2-ef][3]бензазепин-6-ола, 19 мг (0,136 ммоля) карбоната калия и 12 мг (0,082 ммоля) йодида натрия смешивали в 20 мл абсолютного ацетона с 21 мг (0,082 ммоля) 4-бромбензилбромида и нагревали с обратным холодильником. Через один час реакционную смесь упаривали, остаток вносили в 10 мл 2 н соляной кислоты, промывали этиловым эфиром уксусной кислоты, подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 5 мл этилового эфира уксусной кислоты. Объединенные органические фазы промывали один раз насыщенным водным раствором хлорида натрия, сушили (Nа2SO4, активированный уголь), фильтровали и упаривали. Дальнейшую очистку осуществляли флэш-хроматографией (15 г силикагеля; растворитель: СНС1з ⇒ СНС13:МеОН=95:5), получая 10 мг (29% от теории) маслянистого вещества (4аα , 8аα )-4а,5,9,10,11-гексагидро-1-бром-6[(4-бромфенил)метил]-3-метокси-6Н-бензофуро[3а,3,2-еf] [3]бензазепин-6-ола.
ТСХ: СНС13:МеОН=9:1
1H-ЯМР (CDCl3; δ (ч.н.м.): 1,78 (ддд, 1Н, Н-5); 1,98-2,31 (м, 4Н, Н-5/9/11/11'); 2,70 (ддд, 1H, H-9'); 3,57 (ддд, 1Н, H-12); 3,82 (с, 3Н, ОСН3); 3,86 (ддд, 1Н, H-12'); 4,15 (шир., 1Н, Н-6); 4,42 (д, 1Н, NCH2); 4,65 (шир., 1Н, Н-4а); 5,00 (д, 1Н, NCH2'); 5,91 (д, 1Н, Н-7); 6,06 (дд, 1Н, Н-8); 6,92 (с, 1Н, Н-2); 7,28 (д, 2Н, Ph-2/6); 7,43 (д, 2Н, Ph-3/5).
Схема к примерам 1 и 2
Пример 3:
2-[4-[(4аS,6R,8аS)-6-гидрокси-3-метокси-5,6,9,10,11,12-гексагидро-4аН-бензофуро[3а,3,2-е,f][2]бензазепин-11-ил]бутил]-1,2-бензоизотиазол-3(2Н)-он, тартрат 1,1-диоксида, дигидрат (SPH-1374)
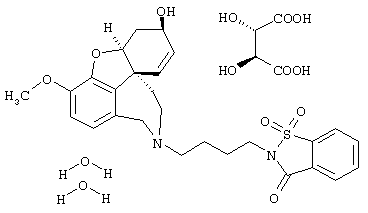
1,1-Диоксид 2-(6-бромгексил)-1,2-бензоизотиазол-3(2Н)-она (2,33 г, 7,32 ммоля, полученный согласно Hamor G.H.; Rubessa F.; Farmaco Ed. Sci. 1970, 25, 36-39, норгалантамин (2,00 г, 7,32 ммоля) и N-этилдиизопропиламин (2,84 г, 22,00 ммоля) в абсолютном хлороформе (20 мл) перемешивали 24 часа при температуре кипения.
Растворитель отгоняли и остаток очищали колоночной хроматографией (150 г силикагеля, хлороформ:метанол:аммиак: 96,5:3:0,5), получая продукт в виде бесцветной пены (2,67 г, 5,23 ммоля, 71,4%).
ТСХ: хлороформ:метанол:аммиак = 89:10:1; Rf=0,5
1H ЯМР (CDCl3): δ 8,05-7,72 (м, 4Н), 6,63-6,55 (м, 2Н), 6,10-5,90 (м, 2Н), 4,56 (шир., 1Н), 4,15-4,01 (м, 2Н), 3,84-3,70 (м, 6Н), 3,42-3,04 (м, 2Н), 2,71-2,35 (м, 4Н), 2,10-1,72 (м, 4Н), 1,65-1,40 (м, 2Н);
13С ЯМР (CDCl3): δ 158,8 (с), 145,7 (с), 143,9 (с), 137,5 (с), 134,6 (д), 134,1 (д), 133,0 (с), 129,4 (с), 127,4 (д), 127,2 (с), 126,8 (д), 124,9 (д), 121,8 (д), 120,7 (д), 111,0 (д), 88,5 (д), 61,9 (д), 57,5 (т), 55,7 (кв), 51,4 (т), 50,5 (т), 48,3 (с), 39,1 (т), 32,9 (т), 29,8 (т), 26,0 (т), 24,5 (т).
Основание (SPH-1369, 2,50 г, 4,90 ммоля) и (+)-винную кислоту (0,80 г, 5,33 ммоля, 1,09 эквивалента) нагревали в EtOH (95%, около 10 мл) до осветления раствора (около 50° С) и данный раствор по каплям за 5 мин прибавляли к перемешиваемому магнитной мешалкой абсолютному эфиру (около 200 мл); при этом выпадал осадок. После выдерживания в течение ночи при комнатной температуре полученные кристаллы отсасывали на нутче и промывали абс. эфиром (3× 50 мл), и продукт сушили в вакуумном эксикаторе при комнатной температуре/50 мбар над хлоридом кальция, получая дигидрат-тартрат в виде бесцветного порошка (3,184 г, 93,3% от теории). Образец для анализа сушили при 2 мбар и 40° С 8 часов над пентоксидом фосфора.
С27Н30N2O6S· С4Н4O4·2Н2О (JOS 1659) (697,7)
Вычислено, %: С 56,18; Н 5,78; N 4,23.
Найдено, %:
а) С 55,74; Н 5,81; N 4,15.
b) С 55,76; Н 5,79; N 4,26.
Пример 4:
1,1-Диоксид 2-[5-[(4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10,11,12-гексагидро-4аН-бензофуро[3а,3,2-ef][2]бензазепин-11-ил]пентил]-1,2-бензоизотиазол-3(2Н)-она (SPH-1372)
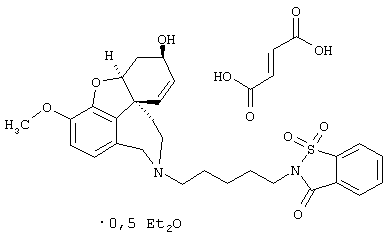
1,1-Диоксид 2-(5-бромпентил)-1,2-бензоизитиазол-3(2Н)-она (1,66 г, 5,00 ммоля), норгалантамин (1,37 г, 5,00 ммоля) и N-этилдиизопропиламин (1,94 г, 15,0 ммоля) в абсолютном хлороформе (15 мл) перемешивали 24 часа при температуре кипения.
Растворитель отгоняли и остаток очищали колоночной хроматографией (150 г силикагеля, хлороформ:метанол:аммиак: 96,5:3:0,5), получая продукт в виде бесцветной пены (2,09 г, 3,99 ммоля, 79,7%).
ТСХ: хлороформ:метанол:аммиак = 89:10:1; Rf=0,5
1H ЯМР (CDCl3): δ 8,05-7,70 (м, 4Н), 6,63-6,50 (м, 2Н), 6,09-5,85 (м, 2Н), 4,55 (шир., 1Н), 4,15-3,99 (м, 2Н), 3,82-3,60 (м, 5Н), 3,41-2,92 (м, 2Н), 2,70-2,32 (м, 3Н), 2,09-1,70 (м, 4Н), 1,58-1,23 (м, 6Н);
13С ЯМР (CDCl3): δ 158,7 (с), 145,6 (с), 143,8 (с), 137,5 (с), 134,5 (д), 134,1 (д), 133,0 (кв), 129,4 (с), 127,3 (д), 127,2 (с), 126,8 (д), 124,8 (д), 121,8 (д), 120,7 (д), 111,0 (д), 88,5 (д), 61,8 (д), 57,5 (т), 55,7 (кв), 51,4 (т), 51,0 (т), 48,2 (с), 39,1 (т), 32,8 (т), 29,8 (т), 28,1 (т), 26,6 (т), 24,3 (т), 20,3 (д).
Получение фумарата (UJ-1682)
Теплый (около 50° С) раствор основания. (1,686 г, 3,21 ммоля) в EtOH (95%, 10 мл) смешивали с насыщенным раствором фумаровой кислоты (10 мл, примерно 0,5 М в 95%-ном этаноле), нагревали примерно при 60° С до получения прозрачного раствора и полученный раствор по каплям за 5 мин прибавляли к перемешиваемому магнитной мешалкой абсолютному эфиру (около 200 мл); при этом выпадал белый осадок. После выдерживания в течение ночи при комнатной температуре полученные кристаллы отсасывали на нутче и промывали абс. эфиром (3× 50 мл), и продукт сушили в вакуумном эксикаторе при комнатной температуре/50 мбар над хлоридом кальция, получая фумарат в форме бесцветного порошка (1,394 г, 67,7% от теории). Образец для анализа сушили при 2 мбар и 40° С 8 часов над пентоксидом фосфора. Из маточного раствора получали вторую фракцию (=UJ-1682-1-2).
С28Н32N2O6S· С4Н4O4·1/2С4Н10O (JOS 1657) (677,8)
Вычислено, %: С 59,54; Н 6,21; N 4,21.
Найдено, %: С 59,49; Н 8,18; N 4,20.
Пример 5:
Фумарат 1,1-диоксида 2-[6-[(4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10,11,12-гексагидро-4аН-бензофуро[3а,3,2-ef][2]бензазепин-11-ил]гексил]-1,2-бензотиазол-3(2Н)-она (SPH-1373)
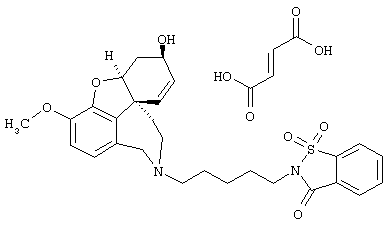
1,1-Диоксид 2-(6-бромгексил)-1,2-бензотиазол-3(2Н)-она (1,50 г, 4,33 ммоля), полученного согласно Kim, Sung-Kyu; Cho, Su-Dong; Moon, Jung-Kyen; Yoon, Yong-Jin, J. Heterocycl. Chem. (1996), 33(3), 615-618, норгалантамин (1,18 г, 4,33 ммоля) и N-этилдиизопропиламин (1,68 г, 13,0 ммоля) в абсолютном хлороформе (15 мл) перемешивали 24 часа при температуре кипения. Растворитель упаривали и остаток очищали колоночной хроматографией (150 г силикагеля, хлороформ:метанол:аммиак: 96,5:3:0,5), получая основание в виде бесцветной пены (1,91 г, 3,52 ммоля, 81,4%).
ТСХ: хлороформ:метанол:аммиак = 89:10:1; Rf=0,5
1Н ЯМР (CDCl3): δ 8,08-7,72 (м, 4Н), 6,68-6,55 (м, 2Н), 6,12-5,90 (м, 2Н), 4,57 (шир., 1Н), 4,16-4,01 (м, 2Н), 3,82-3,65 (м, 6Н), 3,52-3,03 (м, 2Н), 2,71-2,28 (м, 3Н), 2,10-1,71 (м, 4Н), 1,55-1,25 (м, 7Н);
158,8 (с), 145,7 (с), 143,9 (с), 137,6 (с), 134,6 (д), 134,2 (д), 133,1 (с), 129,5 (с), 127,4 (д), 127,3 (с), 126,9 (д), 125,0 (д), 121,9 (д), 120,8 (д), 111,1 (д), 88,6 (д), 62,0 (д), 57,6 (т), 55,8 (кв), 51,5 (т), 48,3 (т), 39,3 (т), 32,9 (т), 29,9 (т), 28,2 (т), 27,1 (т), 26,7 (т), 26,6 (т).
Получение фумарата
Полученный нагреванием основания (1,33 г, 2,47 ммоля) в растворе фумаровой кислоты (8 мл, насыщенный раствор в 95%-ном этаноле) при примерно 60° С прозрачный раствор по каплям за 5 мин прибавляли к перемешиваемому магнитной мешалкой абсолютному эфиру; при этом выпадал белый осадок. После выдерживания в течение ночи при комнатной температуре полученные кристаллы отсасывали на нутче и промывали абс. эфиром (3× 50 мл), и продукт сушили в вакуумном эксикаторе при комнатной температуре/50 мбар над хлоридом кальция, получая фумарат в форме бесцветного порошка (1,170 г, 72% от теории). Образец для анализа сушили при 2 мбар и 40° С 8 часов над пентоксидом фосфора.
C29H34N2O6S· C4H4O4 (JOS 1658)
Вычислено, %: С 60,54; Н 5,85; N 4,28.
Найдено, %: С 60,49; Н 5,97; N 4,22.
Пример 6:
Стадия 1: метиловый эфир 2-(4-бромбутил)-5,6-диметокси-1-оксоиндан-2-карбоновой кислоты
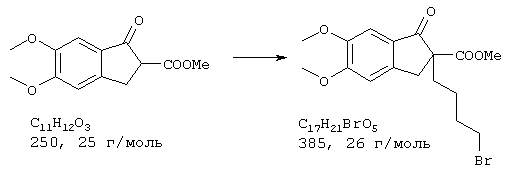
К суспензии гидрида натрия (0,84 г, 17,6 ммоля, 50%-ный в вазелиновом масле, извлечен из вазелинового масла абсолютным петролейным эфиром (3× 50 мл)) в абсолютном ДМФА прибавляли метиловый эфир 5,6-диметокси-1-оксоиндан-2-карбоновой кислоты (4,0 г, 16,0 ммоля), полученный согласно Fukushi, Hideto; Mabuchi, Hiroshi; Itoh, Katsumi; Terashita, Zen-ichi; Nishikawa, Kohei; Sugihara, Hirosada; Chem. Pharm. Bull, 1994, 42(3), 541-550, при комнатной температуре, и раствор 45 минут перемешивали при комнатной температуре. Затем смешивали с 1,4-дибромбутаном (24,2 т, 112,0 ммоля) и перемешивали 18 часов при комнатной температуре. Распределяли между водой и эфиром, водную фазу количественно экстрагировали эфиром, промывали объединенные органические фазы водой (5× ), насыщенным раствором поваренной соли (1× ) и сушили (сульфат натрия/активированный уголь). От полученного после упаривания растворителя остатка избыток дибромалкана отделяли в высоком вакууме перегонкой с шариковым дефлегматором (100° С/0,05 мбара) и полученный остаток перекристаллизовывали из кипящего трет-бутил-метилового эфира (25 мл), получая продукт в виде бесцветных кристаллов (5,02 г, 13,0 ммоля, 81,6%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 3:1; Rf=0,15
Т.пл.: 92-93° С
1H ЯМР (CDCl3): δ 7,13 (с, 1Н), 6,88 (с, 1Н), 3,94 (с, 3Н), 3,87 (с, 3Н), 3,65 (с, 3Н), 3,58 (д, J=18,3 Гц, 1Н), 3,33 (т, J=6,7 Гц, 2Н), 2,97 (д, J=17,2 Гц, 1Н), 2,20-1,99 (м, 1Н), 1,95-1,73 (м, 3Н), 1,53-1,26 (м, 2Н);
13С ЯМР (СDСl3): δ 200,7 (с), 171,6 (с), 156,1 (с), 149,7 (с), 148,5 (с), 127,7 (с), 107,1 (д), 104,8 (д), 60,6 (с), 56,2 (кв), 56,0 (кв), 52,6 (кв), 36,3 (т), 33,6 (т), 33,2 (т), 32,6 (т), 23,1 (т).
Количество, химический сдвиг и мультиплетность найденных пиков подтверждают постулированную структуру.
Стадия 2:
2-(4-Бромбутил)-5,6-диметоксииндан-1-он
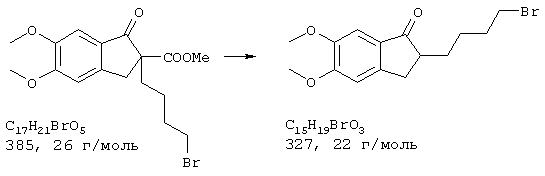
Метиловый эфир 2-(4-бромбутил)-5,6-диметокси-1-оксоиндан-2-карбоновой кислоты (3,0 г, 7,79 ммоля) перемешивали в концентрированной соляной кислоте (10 мл) и ледяной уксусной кислоте (30 мл) 12 часов при 60° С. Смешивали с насыщенным раствором карбоната натрия, нейтрализовали карбонатом натрия и количественно экстрагировали эфиром, промывали объединенные органические фазы насыщенным раствором карбоната натрия (3× ), водой (1× ), насыщенным раствором поваренной соли (1× ), сушили (сульфат натрия/активированный уголь) и перекристаллизовывали полученный после упаривания остаток из трет-бутилметилового эфира (10 мл). Указанным способом получали продукт в виде бесцветных кристаллов (1,85 г, 5,65 ммоля, 72,5%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 3:l; Rf=0,2
Т.пл.: 72-73° С
1H ЯМР (CDCl3): δ 7,15 (с, 1Н), 6,85 (с, 1Н), 3,95 (с, 3Н), 3,88 (с, 3Н), 3,40 (т, J=6,8 Гц, 1Н), 3,23 (дд, J=18,0 Гц, J=8,0 Гц, 1Н), 2,78-2,57 (м, 2Н), 2,00-1,72 (м, 3Н), 1,65-1,35 (м, 3Н);
13С ЯМР (СDС13): δ 207,1 (с), 155,5 (с), 149,4 (с), 148,8 (с), 129,3 (с), 107,3 (д), 104,3 (д), 56,1 (т), 56,0 (т), 47,4 (д), 33,5 (т), 32,6 (т), 32,5 (т), 30,6 (т), 25,8 (т).
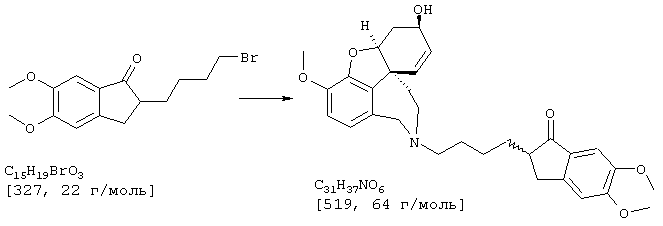
Стадия 3:
2-[4-[(4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10,11,12-гексагидро-4аН-бензофуро[3а,3,2-еf][2]бензазепин-11-ил]бутил]-5,6-диметоксииндан-1-он
2-(4-Бромбутил)-5,6-диметоксииндан-1-он (1,0 г, 3,01 ммоля), норгалантамин (919 мг, 3,36 ммоля) и карбонат калия (1,26 г, 9,09 ммоля, безводный, тонкоразмолотый) перемешивали в абсолютном ацетонитриле (10 мл) 24 часа при температуре кипения. Реакционную смесь фильтровали, растворитель отгоняли и остаток очищали колоночной хроматографией (150 г силикагеля, хлороформ:метанол:аммиак: 96,5:3:0,5), получая продукт в виде бесцветной пены (1,21 г, 2,32 ммоля, 77,6%).
ТСХ: хлороформ:метанол:аммиак: 89,5:10:0,5, Rf=0,65
1H-ЯМР (CDCl3): δ 7,14 (с, 1Н), 6,83 (с, 1Н), 6,67-6,52 (м, 2Н), 6,12-5,90 (м, 2Н), 4,57 (шир., 1Н), 4,02-4,18 (м, 2Н), 3,93 (с, 3Н), 3,87 (с, 3Н), 3,80 (с, 3Н), 3,75 (д, J=13,7 Гц, 1Н), 3,43-3,06 (м, 3Н), 2,75-2,35 (м, 5Н), 2,11-1,83 (м, 3Н), 1,59-1,29 (м, 6Н);
13С ЯМР (CDCl3): δ 207,5 (с), 155,4 (с), 149,3 (с), 148,9 (с), 145,7 (с), 144,0 (с), 133,1 (с), 129,4 (с), 127,5 (д), 126,9 (д), 121,9 (д), 111,1 (д), 107,3 (д), 104,2 (д), 88,6 (д), 62,0 (д), 57,7 (т), 56,1 (кв), 56,0 (кв), 55,8 (кв), 51,5 (т), 51,2 (т), 48,3 (т), 47,5 (д), 32,8 (т), 32,5 (т), 31,5 (т), 29,9 (т), 27,4 (т), 25,1 (т).
Пример 7:
Стадия 1: метиловый эфир 2-(5-бромпентил)-5,6-диметокси-1-оксоиндан-2-карбоновой кислоты
К суспензии гидрида натрия (0,62 г, 13,2 ммоля, 50%-ный в вазелиновом масле, извлечен из вазелинового масла абсолютным петролейным эфиром (3× 50 мл)) в абсолютном ДМФА прибавляли метиловый эфир 5,6-диметокси-1-оксоиндан-2-карбоновой кислоты (3,0 г, 12,0 ммоля) при комнатной температуре, и раствор 45 минут перемешивали при комнатной температуре. Затем смешивали с 1,5-дибромпентаном (19,3 г, 84,0 ммоля) и перемешивали 18 часов при комнатной температуре. Распределяли между водой и эфиром, водную фазу количественно экстрагировали эфиром, промывали объединенные органические фазы водой (5× ), насыщенным раствором поваренной соли (1× ) и сушили (сульфат натрия/активированный уголь). От полученного после упаривания растворителя остатка избыток дибромалкана отделяли в высоком вакууме перегонкой с шариковым дефлегматором (100° С/0,05 мбар) и полученный остаток перекристаллизовывали из кипящего трет-бутил-метилового эфира (20 мл), получая продукт в виде бесцветных кристаллов (3,75 г, 9,4 ммоля, 78,3%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 3:1; Rf=0,15
Т.пл.: 108,5-110° С
1H ЯМР (CDCl3): δ 7,15 (с, 1Н), 6,89 (с, 1H), 3,96 (с, 3Н), 3,89 (с, 3Н), 3,67 (с, 3Н), 3,60 (д, J=19,1 Гц, 1Н), 3,35 (т, J=7,0 Гц, 2Н), 2,96 (д, J=19,1 Гц, 1Н), 2,20-1,15 (м, 8Н);
13С ЯМР (CDCl3): δ 200,9 (с), 171,8 (с), 156,1 (с), 149,7 (с), 148,4 (с), 127,9 (с), 107,1 (д), 104,9 (д), 60,8 (с), 56,2 (кв), 56,1 (кв), 52,6 (кв), 36,4 (т), 34,5 (т), 33,5 (т), 32,3 (т), 28,3 (т), 26,9 (д), 23,7 (т).
Стадия 2:
2-(5-бромпентил)-5,6-диметоксииндан-1-он
Метиловый эфир 2-(5-бромпентил)-5,6-диметокси-1-оксоиндан-2-карбоновой кислоты (3,0 г, 7,51 ммоля) перемешивали в концентрированной соляной кислоте (10 мл) и ледяной уксусной кислоте (30 мл) 12 часов при 60° С. Смешивали с насыщенным раствором карбоната натрия, нейтрализовали карбонатом натрия и количественно экстрагировали эфиром, промывали объединенные органические фазы насыщенным раствором карбоната натрия (3× ), водой (1× ), насыщенным раствором поваренной соли (1× ), сушили (сульфат натрия/активированный уголь) и перекристаллизовывали полученный после упаривания остаток из трет-бутилметилового эфира (10 мл). Указанным способом получали продукт в виде бесцветных кристаллов (1,78 г, 5,22 ммоля, 69,5%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 3:1; Rf=0,2
Т.пл.: 67-68,5° С
1H ЯМР (CDCl3): δ 7,15 (с, 1Н), 6,85 (с, 1H), 3,95 (с, 3Н), 3,89 (с, 3Н), 3,50 (т, J=7,0 Гц, 2Н), 3,20 (дд, J=6,4 Гц, J=9,5 Гц, 1Н), 2,72 (д, J=3,2 Гц, 1Н), 2,60 (д, J=3,2 Гц, 1H), 2,00-1,65 (м, 3Н), 1,55-1,35 (м, 5Н);
13С NMR (CDCl3): δ 207,4 (с), 155,5 (с), 149,4 (с), 148,8 (с), 129,4 (с), 107,4 (д), 104,3 (д), 56,2 (кв), 56,0 (кв), 47,5 (д), 44,9 (т), 32,5 (т), 32,3 (т), 31,4 (т), 26,8 (т), 26,5 (т).
Стадия 3:
2-[5-[(4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10,11,12-гексагидро-4аН-бензофуро[3а,3,2-ef][2]бензазепин-11-ил]пентил]-5,6-диметоксииндан-1-он (SPH-1359)
2-(4-Бромпентил)-5,6-диметоксииндан-1-он (1,66 г, 4,86 ммоля), норгалантамин (1/46 г, 5,35 ммоля) и карбонат калия (2,01 г, 14,6 ммоля, безводный, тонкоизмельченный) перемешивали в абсолютном ацетонитриле (10 мл) 24 часа при температуре кипения.
Реакционную смесь фильтровали, растворитель отгоняли и остаток очищали колоночной хроматографией (150 г силикагеля, хлороформ:метанол:аммиак: 96,5:3:0,5), получая продукт в виде бесцветной пены (1,84 г, 2,32 ммоля, 70/9%).
ТСХ: хлороформ.метанол:аммиак: 89,5:10:0,5, Rf=0,65
1H ЯМР (CDCl3): δ 7,11 (с, 1Н), 6,82 (с, 1Н), 6,63-6,54 (м, 2Н), 6,10-5,88 (м, 2Н), 4,55 (шир., 1Н), 4,17-4,00 (м, 2Н), 3,92 (с, 3Н), 3,85 (с, 3Н), 3,78 (с, 3Н), 3,73 (д, J=13,7 Гц, 1Н), 3,40-3,01 (м, 3Н), 2,72-2,25 (м, 5Н), 2,10-1,75 (м, 3Н), 1,65-1,19 (м, 8Н);
13С ЯМР (CDCl3): δ 207,4 (с), 155,3 (с), 149,2 (с), 148,8 (с), 145,6 (с), 143,8 (с), 133,0 (с), 129,4 (с), 129,3 (с), 127,4 (д), 126,9 (д), 121,8 (д), 111,0 (д), 107,2 (д), 104,2 (д), 88,5 (д), 77,2 (д), 61,9 (д), 57,6 (т), 56,0 (кв), 55,9 (кв), 55,7 (кв), 51,4 (т), 48,2 (с), 47,5 (д), 32,9 (т), 32,4 (т), 31,5 (т), 29,8 (т), 27,2 (т), 27,1 (т).
Получение фумарата
Раствор основания (1,00, 1,874 ммоля) в насыщенном растворе фумаровой кислоты (6 мл, примерно 0,5 М в 95-%-ном этаноле) нагревали примерно при 60° С до образования прозрачного раствора и данный еще теплый раствор по каплям за 5 мин прибавляли к перемешиваемому магнитной мешалкой абсолютному эфиру (около 150 мл); при этом происходило выпадение осадка. После выдерживания в течение ночи при комнатной температуре образовавшиеся кристаллы отсасывали на нутче и промывали абсол. эфиром (3× 50 мл) и продукт сушили в вакуумном эксикаторе при комнатной температуре/50 мбар над хлоридом кальция, получая фумарат в виде бесцветного порошка (0,694, 57,0% от теории). Образец для анализа сушили при 2 мбар и 40° С 8 часов над пентоксидом фосфора. Из маточного раствора выделяли вторую фракцию.
С32Н39NO6·С4Н4O4·1/2Н2O (658,7)
Вычислено, %: С 65,64; Н 6,73; N 2,13.
Найдено, %: С 65,83; Н 6,72; N 2,10.
Формулы и таблицы для примеров 8-79 приведены в конце текста описания.
Пример 8:
Стадия 1
(6R)-1-бром-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-6-он (2а)
К перемешиваемому раствору (6R)-5,6,9,10,11,12,1-бром-3-метокси-6-оксо-4аН-гексагидро-бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксальдегида (2) (100,0 г, 0,26 моля) в толуоле (2,6 л) добавляли воду (600 мл) и концентрированную соляную кислоту (400 мл). Реакционную смесь кипятили с обратным холодильником при перемешивании 48 часов. Осадок отфильтровывали и промывали водой (3× 500 мл). Фазы гидрата отделяли и органическую фазу экстрагировали водой (3× 500 мл). Осадок нагревали с объединенными водными растворами гидрата и фильтровали горячим. В растворе при помощи 3%-ного гидроксида натрия устанавливали рН 12. Осадок отфильтровывали и сушили (50° С/50 мбар), получая 64,5 г (70%) титульного соединения (2а) с температурой плавления 228-231° С.
1H ЯМР (СDС13) δ 6,94 (дд, J1=10,3, 1,9 Гц, 1Н), 6,62 (с, 1Н), 6,00 (д, J=10,5 Гц, 1Н), 4,69 (м, 1Н), 4,04 (д, J=15,9 Гц, 1Н), 3,83 (д, J=15,9 Гц, 1Н), 3,80 (с, 3Н), 3,29 (м, 2Н), 3,07 (д, J=1,9 Гц, 1Н), 2,70 (дд, J1=17,8 Гц, J2=3,7 Гц, 1Н), 2,16 (м, 1Н), 1,80 (дт, J1=14,0 Гц, J2=2,9 Гц, 1Н);
13С-ЯМР (СDС13) δ 194,3 (с), 146,9 (с), 143,8 (с), 135,3 (д), 130,6 (с), 129,3 (с), 126,9 (д), 121,9 (д), 111,8 (с), 87,9 (д), 56,3 (т), 55,9 (кв), 51,8 (т), 49,0 (с), 37,2 (т), 33,0 (т). Анализ: (С16Н16ВrNО3·0,4 Н2O)С, Н, N.
Стадия 2:
(6R)-1-бром-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол (3)
К раствору (6R)-1-бром-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-еf] [2]бензазепин-6-она (2а) (64,5 г, 0,184 моля) в сухом ТГФ (тетрагидрофуране) (1,3 л) при -10° С прибавляли раствор L-селектрида (1 М, 276 мл, 0,276 моля). После 30-минутного перемешивания при от -10 до -5° С реакционную смесь гидролизовали МеОН (80 мл) и упаривали. Полученный остаток растворяли в 2 н соляной кислоте и перемешивали 18 час при комнатной температуре. Раствор концентрированным аммиаком доводили до рН 9 и экстрагировали EtOAc (3× 500 мл); объединенные органические слои промывали рассолом и сушили (Na2SO4), получая 55,9 г (90,6%) продукта.
1H-ЯМР (СDС13) δ 6,85 (с, 1Н), 6,05 (м, 2Н), 4,56 (шир., 1Н), 4,48 (д, J=14,7 Гц, 1Н), 4,10 (м, 1Н), 3,85 (д, J=14,7 Гц, 1Н), 3,80 (с, 3Н), 3,35-3,05 (м, 2Н), 2,62 (м, 1Н), 2,25 (м, 1Н), 1,98 (д, J=13,2 Гц, 1Н), 1,85-1,65 (м, 2Н);
13С-ЯМР (CDCl3) δ 145,8 (с), 144,0 (с), 134,1 (с), 131,6 (с), 127,9 (д), 126,8 (д), 115,5 (д), 113,0 (с), 88,4 (д), 61,7 (д), 56,0 (кв), 52,7 (т), 49,3 (с), 46,6 (т), 29,7 (т).
Стадия 3:
(6R)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол (= (+/-)-норгалантамину) (4)
К раствору (6R)-1-бром-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ола (3) (20,0 г, 56,8 ммоля) в 50%-ном EtOH (1000 мл) прибавляли активированный цинк (89,0 г, 1,36 моля) и хлорид кальция (44,0 г, 0,40 моля). Реакционную смесь кипятили с обратным холодильником 18 час и фильтровали через целит. Фильтрат упаривали, остаток разбавляли 2 н соляной кислотой (500 мл) и экстрагировали EtOAc (3× 400 мл). Значение рН водной фазы концентрированным аммиаком устанавливали выше 8,5 и экстрагировали СН2Сl2 (3× 100 мл) и CH2Cl2:MeOH=9:1 (3× 100 мл). Объединенные органические экстракты промывали рассолом (200 мл), сушили (Na2SO4) и упаривали, получая 12,3 г (79,0%) соединения 4:
1Н-ЯМР (CDCl3) δ 6,62 (шир., 2Н), 6,02 (м, 2Н), 4,61 (шир., 1Н), 4,14 (т, J=4,3 Гц, 1Н), 3,98 (д, J=5,0 Гц, 2Н), 3,83 (с, 3Н), 3,30 (м, 1Н), 2,69 (т, J=15,7, 1Н), 2,10-1,63 (м, 4Н);
13С-ЯМР (CDCl3) δ 146,2 (с), 144,1 (с), 133,1 (с), 131,7 (с), 127,8 (д), 126,8 (д), 120,8 (д), 111,1 (д), 88,4 (д), 61,9 (д), 55,9 (кв), 53,3 (т), 48,5 (с), 46,7 (т), 39,4 (т), 29,9 (т). Анализ: (C20H26N2O4) C, H, N.
Стадия 4:
Метил (6R)-l-бpoм-N11-циaнo-6-гидpoкcи-3-мeтoкcи-5,6,9,10-тетрагидро-4аН[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)карбоксимидотиоат (3bi)
К раствору (+/-)-норгалантамина (0,5 г, 1,4 ммоля) в ЕtOН:ДМФА (диметилформамиде) = 4:1 (20 мл) прибавляли 0,21 г (1,4 ммоля) диметилового эфира N-цианодитиокарбонимидо-кислоты (0,21 г, 1,4 ммоля). Реакционную смесь 4 дня кипятили с обратным холодильником и упаривали. Остаток перекристаллизовывали из EtOH, получая 0,25 г (41,7%) соединения 3bi:
1H-ЯМР (CDCl3): δ 6,90 (с, 1Н), 6,05 (дд, J1=10,3 Гц, J2=5,0 Гц, 1Н), 5,86 (д, J=10,3 Гц, 1Н), 5,62 (д, J=16,5 Гц, 1Н), 4,62 (шир., 1Н), 4,36 (д, J=16,5 Гц, 1Н), 4,14 (м, 1Н), 3,83 (с, 3Н), 3,79 (м, 1Н), 2,96 (д, J=15,3 Гц, 1Н), 2,77 (с, 3Н), 2,68 (м, 1Н), 1,92 (м, 3Н);
13С-ЯМР (CDCl3): δ 146,3 (с), 145,0 (с), 132,7 (с), 129,0 (с), 125,4 (д), 125,2 (д), 125,2 (с), 116,0 (д), 114,3 (д), 88,0 (д), 61,3 (д), 56,1 (кв), 55,0 (т), 49,6 (т), 48,6 (с), 29,4 (т), 16,1 (кв). Анализ: (С19Н20ВrN3О3S· 0,85 EtOH) C, H, N.
Пример 9:
(6R)-3-метокси-11-(2-пиримидинил)-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-еf] [2]бензазепин-6-ол (4а)
К раствору (+/-)-норгалантамина (0,5 г 1,8 ммоля) в EtOH (30 мл) прибавляли 0,21 г (1,8 ммоля) 2-хлорпиримидина и гидрокарбонат натрия (0,61 г, 7,2 ммоля). Реакционную смесь кипятили с обратным холодильником 2 дня и концентрировали. Остаток разбавляли водой (30 мл) и экстрагировали EtOAc (3× 20 мл). Объединенные органические экстракты промывали раствором поваренной соли (20 мл), сушили (Na2SO4) и упаривали, получая 0,51 г (80,8%) 4а:
1H-ЯМР (ДМСО-d) δ 7,82 (д, J=4,0 Гц, 2Н), 6,42 (д, J=12,0 Гц, 1Н), 6,23 (д, J=12,0 Гц, 1Н), 6,03 (т, J=4,0 Гц, 1Н), 5,83 (д, J=8,0 Гц, 1Н), 5,54 (дд, J1=8,0 Гц, J2=3,0 Гц, 1H), 4,98 (д, J=14,0 Гц, 1Н), 428 (д, J=16,0, 1H), 4,09 (шир., 1Н), 3,94 (д, J=14,0 Гц, 1H), 3,72 (м, 1H), 3,38 (с, 3Н), 3,21 (т, J=14,0 Гц, 1H), 2,54 (д, J=12,0 Гц, 1H), 2,15 (м, 1H), 1,55 (м, 3Н);
13С-ЯМР (ДМСО-d) δ 159,5 (с), 156,7 (2), 145,5 (с), 142,8 (с), 131,6 (с), 128,9 (с), 126,8 (д), 126,1 (д), 120,8 (д), 109,9 (д), 108,8 (д), 86,8 (д), 61,3 (д), 54,8 (кв), 50,2 (т), 47,3 (с), 47,4 (т), 34,6 (т), 29,2 (т). Анализ: (С20Н21N3О3·0,15 EtOH) C, H, N.
Пример 10:
(6R)-11-(2-хлор-4-пиримидинил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[l]бензофуро[3a,3,2-ef][2]бензазепин-6-ол (4b) получали аналогично примеру 9. Время реакции 40 час, выход 0,62 г (88,6%).
1H-ЯМР (CDCl3) δ 7,84 (д, J=4,0 Гц, 1H), 6,88 (д, J=12,0 Гц, 1H), 6,69 (д, J=12,0 Гц, 1H), 6,05 (шир., 2Н), 5,90 (д, J=4,0 Гц, 1H), 5,58 (шир., 1H), 4,34 (м, 2Н), 4,18 (шир., 1H), 3,80 (с, 3Н), 3,60 (т, J=16,0 Гц, 1H), 2,73 (д, J=16,0 Гц, 1H), 2,39 (м, 1H), 2,04 (д, J=18 Гц, 1H), 1,87 (м, 2Н);
13C-NMR (CDCl3) δ 160,5 (с), 158,4 (с), 157,0 (с), 145,0 (с), 144,1 (с), 132,2 (с), 128,2 (д), 127,8 (с), 126,6 (д), 126,1 (д), 111,0 (д), 107,1 (д), 88,1 (д), 61,6 (д), 55,8 (кв), 53,8 (т), 48,3 (с), 46,0 (т), 34,9 (т), 29,6 (т).
Пример 11:
(6R)-11-(2-диэтиламино)-4-пиримидинил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (4с).
К раствору соединения 4b (0,5 г, 1,30 ммоля) в диэтиламине (6 мл, 57,6 ммоля) прибавляли 0,1 г (1,30 ммоля) гидроксида калия. Реакционную смесь кипятили с обратным холодильником 22 час и упаривали. Остаток разбавляли насыщенным раствором карбоната калия (30 мл) и экстрагировали EtOAc (3× 20 мл). Объединенные органические фазы промывали раствором поваренной соли (20 мл), сушили (Na2SO4) и упаривали. Флэш-хроматографией получали 0,21 г (38,5%) соединения 4с. Ниже описаны только отличительные ЯМР-сигналы: 1Н-ЯМР (CDCl3) δ 2,97 (д, J=16,0 Гц, 4Н), 1,34 (м, 6Н); 13С-ЯМР (СDС13) δ 36,3 (т), 14,0 (кв).
Пример 12:
(6R)-11-(2-(3-(диметиламино)пропокси)-4-пиримидинил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]-бензазепин-6-ол (4d): получение осуществляют аналогично примеру 11. Время реакции 2 час, выход 0,16 г (41,0%). Описаны только отличительные ЯМР-сигналы: 1Н-ЯМР (CDCl3) δ 4,34 (м, 2Н), 2,28 (с, 6Н), 2,00 (м, 4Н); 13С-ЯМР (CDCl3) 65,0 (т), 56,3 (т), 45,2 (кв), 27,0 (т).
Пример 13:
(6R)-11-(4,6-дихлор-1,3,5-триазин-2-ил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол (4е): раствор 2,4,6-трихлор-1,3,5-триазина (0,66 г, 3,7 ммоля) в ацетоне (16 мл) выливали в ледяную воду (35 мл) и при 0° С маленькими порциями прибавляли (+/-)-норгалантамин (1,0 г, 3,7 ммоля). После добавления 2 н гидроксида натрия (2 мл) реакционную смесь кипятили с обратным холодильником в течение 40 ч. Водную фазу экстрагировали EtOAc (3× 30 мл). Объединенные органические фазы промывали раствором поваренной соли (30 мл), сушили (Na2SO4) и упаривали, получая 0,90 г (59,5%) соединения 4е:
1Н-ЯМР (СDС13) δ 6,82 (д, J=10,0 Гц, 1Н), 6,63 (д, J=10,0 Гц, 1Н), 6,02 (шир., 2Н), 5,30 (д, J=11,0 Гц, 1Н), 4,75 (д, J=16,0, 1Н), 4,50 (шир., 1Н), 4,22 (д, J=11,0 Гц, 1Н), 4,11 (шир., 1 Н), 3,78 (с, 3Н), 3,59 (m, 1H), 3,06 (м, 1Н), 2,61 (д, J=16,0 Гц, 1Н), 1,90 (м, 3Н);
13С-ЯМР (CDCl3) δ 207,0 (с) 171,2 (с), 163,7 (с), 146,2 (с), 143,9 (с), 132,3 (д), 129,5 (с), 127,6 (с), 126,7 (д), 121,5 (д), 110,8 (д), 88,0 (д), 61,7 (д), 55,7 (кв), 51,8 (т), 48,2 (с), 43,4 (т), 35,9 (т), 29,7 (т).
Соединения 4f-4i содержат основной галантаминовый структурный элемент, как 4е, но отличаются заместителями у атома азота. Так как сигнал протона и углерода галантаминового ядра существенно не различаются, далее приведены ЯМР-сигналы заместителей у атома азота.
Пример 14:
(6R)-11-(4,6-бис-(диэтиламино-1,3,5-триазин-2-ил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (4f): раствор соединения 4е (0,30 г, 0,71 ммоля) в 40 мл ацетона выливали в 100 мл ледяной воды и при 0° С прибавляли раствор диэтиламина (5,7 мл, 54,7 ммоля) в ацетоне (10 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 час и затем выливали в 200 мл ледяной воды. Водную фазу экстрагировали 3× 100 мл EtOAc. Объединенные органические фазы промывали раствором поваренной соли (100 мл), сушили над сульфатом натрия и упаривали. Флэш-хроматографией получали 0,17 г (47,8%) соединения 4f: 1H-ЯМР (CDCl3) δ 3,54 (м, 8Н), 1,18 (м, 12Н); 13С-ЯМР (CDCl3) δ 41,7 (т), 13,4 (кв).
Пример 15:
(6R)-11-(4,6-дифенокси-1,3,5-триазин-2-ил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (4g): к раствору (+/-)-норгалантамина (1,0 г, 3,74 ммоля) в диоксане (60 мл) прибавляли 6,5 г (18,3 ммоля) 2,4,6-трифенокси-1,3,5-триазина. Реакционную смесь кипятили с обратным холодильником в течение 20 ч. Осадок отфильтровывали и промывали диоксаном. Фильтрат упаривали, и флэш-хроматографией получали 0,91 г (45,9%) соединения 4g: 1H-ЯМР (CDCl3) δ 7,42-7,03 (м, 10Н); 13С-ЯМР (СDС13) δ 172,1 и 162,3 (с), 138,3 и 138,1 (д), 134,6 (д), 131,3 и 130,8 (д).
Пример 16:
(6R)-11-(4,6-бис-(2-аминоэтокси)-1,3,5-триазин-2-ил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (4h): по способу, описанному в примере 11, получали соединение 4а, причем время реакции составляло 3 ч. Получили 0,15 г (67,9%) соединения 4h. 1H-ЯМР (CDCl3) δ 3,64 (м, 4H), 3,42 (м, 4H); 13С-ЯМР (CDCl3) δ 61,3 (т), 42,1 (т).
Пример 17:
(6R)-11-(4,6-бис-(2-(диметиламино)этокси)-1,3,5-триазин-2-ил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-еf] [2]бензазепин-6-ол (4i). По способу, описанному в примере 11, при времени реакции 3 час получали соединение 4i с выходом 0,16 г (59,5%). 1H-ЯМР (CDCl3) δ 4,12 (кв, J=6,0 Гц, 4H), 2,29 (д, J=4,0 Гц, 12Н), 1,29 (м, 8Н); 13С-ЯМР (CDCl3) δ 65,6 (т), 56,0 (т), 45,2 (кв), 29,2 (т).
Пример 18:
2-хлор-1-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf] [2]бензазепин-11 (12Н)-ил)-1-этанон (4j): к раствору (+/-)-норгалантамина (2,0 г, 7,3 ммоля) в сухом ТГФ (100 мл) прибавляли 0,82 г хлорацетилхлорида (7,3 ммоля) и 0,81 г (8,0 ммоля) триэтиламина. Реакционную смесь кипятили с обратным холодильником в течение 3 час и упаривали. Остаток разбавляли 2 н соляной кислотой (100 мл) и экстрагировали EtOAc (3× 75 мл). Водную фазу доводили до рН>8,5 концентрированным аммиаком и экстрагировали 3× 75 мл CH2Cl2. Объединенные органические фазы промывали раствором поваренной соли, сушили над сульфатом натрия и упаривали. Флэш-хроматографией получали 0,20 г (7,7% соединения 4j): 1H-ЯМР (CDCl3) δ 6,78 (шир., 1H), 6,12 (м, 2Н), 5,30 (д, J=11,0 Гц, 1H), 4,65 (м, 2Н), 4,32-4,01 (м, 3Н), 3,78 (с, 3Н), 3,59 (м, 1H), 3,06 (м, 1H), 2,61 (д, J=16,0 Гц, 1H), 1,90 (м, 3Н); 13С-ЯМР (СDС13) δ 166,0 (с), 146,2 (с), 144,9 (с), 132,3 (д), 128,3 (с), 127,3 (с), 126,0 (д), 120,2 (д), 111,2 (д), 88,2 (д), 61,7 (д), 55,8 (кв), 52,8 (т), 48,1 (с), 45,5 (т), 41,4 (т), 35,4 (т), 29,6 (т).
Пример 19:
(6R)-6-гидрокси-N11 -изопропил-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf]бензазепин-11(12Н)-карбрксамид (4l): по способу, описанному в примере 11, при времени реакции 4 час получали 0,50 г соединения 4h с температурой плавления 106-108° С: 1H-ЯМР (CDCl3) δ 6,68 (дд, J=10,3; 8,3 Гц, 2Н), 6,00 (м, 2Н), 4,59 (шир., 1H), 4,47 (д, J=16,4 Гц, 1H), 4,31 (д, J=16,4, 1H), 4,16 (м, 1H), 3,86 (м, 1H), 3,83 (с, 3Н), 3,36 (дт, J=12,6; 2,0 Гц 1H), 2,69 (дд, J=15,7; 3,4 Гц, 1H), 2,28 (д, J=11,3 Гц, 1H), 2,02 (м, 1H), 1,88 (дд, J=12,3; 3,4 Гц, 1H), 1,77 (м, 1H), 1,07 (дд, J=21,8; 6,4 Гц, 6Н); 13С-ЯМР (СDС13) δ 156,4 (с), 146,8 (с), 144,5 (с), 132,4 (с), 129,0 (с), 127,9 (д), 126,4 (д), 120,1 (д), 111,0 (д), 88,3 (д), 61,7 (д), 55,8 (кв), 51,5 (т), 48,3 (с), 45,4 (т), 42,4 (д), 36,4 (т), 29,7 (т), 23,3 (кв), 23,1 (кв). Анализ: (C20H26N2O4) C, H, N.
Соединения 4m-4s содержат основной галантаминовый структурный элемент, как 4l, но отличаются заместителями у атома азота. Так как сигналы протона и углерода галантаминового ядра существенно не различаются, далее приведены ЯМР-сигналы только заместителей у атома азота.
Пример 20:
(6R)-N11-трет-бутил-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (4m): способ согласно примеру 11, время реакции 3 ч, выход 0,57 г (85%); температура плавления 204-205° С; 1H-ЯМР (CDCl3) δ 1,24 (с, 9Н); 13С-ЯМР (CDCl3) 156,4 (с), 50,7 (с), 29,3 (кв). Анализ: (C21H28N2O4) C, H, N
Пример 21
(6R)-N11-этил-6-гидpoкcи-3-мeтoкcи-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (4n): способ согласно примеру 11, время реакции 3 час, выход 0,61 г (98%); температура плавления 137-139° С; 1H-ЯMP (CDCl3) δ 3,14 (кв, J=4,0 Гц, 2Н), 1,04 (т, J=10 Гц, 3Н); 13С-ЯМР (CDCl3) 157,0 (с), 35,6 (т), 15,3 (кв).
Пример 22:
(6R)-N11-циклoгeкcил-6-гидpoкcи-3-мeтoкcи-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (4о): способ согласно примеру 11, время реакции 5 час, выход 0,56 г (79%); температура плавления 225-228° С; 1H-ЯМР (CDCl3) δ 1,24 (с, 9Н); 13С-ЯМР (CDCl3) δ 48,8 (д), 33,4 (т), 33,2 (т), 25,5 (т), 24,8 (т), 24,6 (т).
Пример 23:
(6R)-6-гидрокси-3-метокси-N11-фенил-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (4р): способ согласно примеру 11, время реакции 4 час, выход 0,34 г (47%); температура плавления 198-199° С; 1Н-ЯМР (CDCl3) δ 7,24 (м, 4Н), 6,99 (кв, J=4,2 Гц, 1Н); 13С-ЯМР (CDCl3) δ 154,5 (с), 138,7 (с), 128,7 (д), 122,9 (д), 119,7 (д). Анализ: (C23H24N2O4·H2O) C, H, N
Пример 24:
(6R)-N11-хлорфенил-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (4q): способ согласно примеру 11, время реакции 5 час, выход 0,16 г (21%); 1Н-ЯМР (CDCl3) δ 17,49-6,94 (м, 4Н); 13С-ЯМР δ (CDCl3) 154,1 (с), 139,1 (с), 123,4 (с), 122,9 (д), 119,7 (д).
Пример 25:
(6R)-6-гидрокси-3-метокси-N11-(S)-(-)-α -метилбензил-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (4r): способ согласно примеру 11, время реакции 6 час, выход 0,66 г (58%); 1H-ЯМР (CDCl3) δ 7,21 (д, J=6,0 Гц, 4Н), 7,17 (м, 1Н); 4,91 (м, 1Н), 1,41 (дд, J=20,0; 12 Гц, 3Н); 13С-ЯМР (CDCl3) δ 156,6 и 165,4 (с), 144,5 (с), 128,3 и 128,1 (д), 126,5 и 126,4 (д), 125,9 и 125,5 (д), 46,1 (д), 22,9 и 22,6 (кв).
Пример 26:
(6R)-6-гидрокси-3-метокси-N11-(S)-(-)-α -метилбензил-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (4s): способ согласно примеру 11, время реакции 6 час, выход 0,66 г (58%); 1H-ЯМР (CDCl3) δ 7,82 (д, J=8,0 Гц, 1Н), 7,61 (д, J=6,0 Гц, 2Н), 7,43 (м, 4Н); 13С-ЯМР (CDCl3) δ 155,4 (с), 134,0 (с), 133,6 (с), 132,5 (с), 128,6 (д), 127,9 (д), 125,9 (д), 125,7 (д), 125,6 (д), 125,6 (д), 121,1 (д).
Пример 27:
(6R)-6-гидрокси-3-метокси-N11-метил-5,6,9,10-тетрагидро-4аН- [1]бензофуро[3а,3,2-еf] [2] бензазепин-11-(12Н)-карбоксамид (4t): способ согласно примеру 11, время реакции 3 час, выход 0,57 г (99%); температура плавления 219-221° С; 1H-ЯМР (CDCl3) δ 6,81 (д, J=8,3 Гц, 1Н), 6,71 (д, J=8,1 Гц, 1H), 6,12 (д, J=10,3 Гц, 1Н), 5,81 (дд, J=10,2; 4,4 Гц, 1Н), 5,21 (д, J=15,8 Гц, 1Н), 4,44 (с, 1Н), 4,25 (д, J=5,5, 1Н), 4,07 (шир., 1H), 3,72 (с, 3Н), 3,66 (м, 1Н), 2,84 (д, J=3,4 Гц, 3Н); 2,28 (д, J=11,2 Гц, 1H), 2,04 (д, J=20,1 Гц, 1H), 1,88 (д, J=12,1 Гц, 1H), 1,65 (д, J=13,9 Гц 1H); 13С-ЯМР (CDCl3) δ 182,2 (с), 147,2 (шир.), 144,9 (с), 132,4 (с), 128,2 (д), 126,6 (с), 126,2 (д), 120,5 (д), 111,3 (д), 88,3 (д), 61,7 (д), 55,9 (кв), 53,7 (т), 50,5 (т), 48,2 (с), 35,6 (т), 32,9 (кв) 29,7 (т). Анализ: (C18H22N2O3S· 0,05СН3С6Н5) С, Н, N.
Пример 28:
(6R)-6-гидрокси-3-метокси-N11-аллил-5,6,9,10-тетрагидро-4аН- [1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-карботиоамид (4u): способ согласно примеру 11, время реакции 5 час, выход 0,47 г (70%); температура плавления 192-194° С; структура подобна 47, приведены только отличающиеся ЯМР-сигналы: 1Н-ЯМР (CDCl3) δ 6,85 (м, 1Н), 5,13 (м, 2Н), 4,14 (м, 2Н); 13С-ЯМР (CDCl3) δ 181,2 (с), 133,7 (д), 116,6 (т), 48,3 (т). Анализ: (С20Н24N2O3S) C, H, N.
Пример 29:
Диметиловый эфир ((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4aH-[1]бензофуро[3a,3,2-ef][2]бензазепин-11(12Н)-ил-фумаровой кислоты (4v): способ по пункту 11. К раствору (+/-)-норгалантамина (0,5 г, 1,74 ммоля) в 40 мл CH2Cl2 прибавляли 0,37 г (2,61 ммоля) диметилового эфира бут-2-ендионовой кислоты и перемешивали в течение 20 ч. Растворитель удаляли для получения маслянистого продукта, флэш-хроматографией которого получено 0,28 г (39,1%) 4v. Температура плавления 112-115° С. 1H-ЯМР (СDС13) δ 6,63 (дд, J1=12,6 Гц, J2=8,1 Гц, 2Н), 6,02 (дд, J1=15,9 Гц, J2=11,5 Гц, 2Н), 4,77 (шир., 1Н), 4,59 (шир., 1Н), 4,22 (д, J=15,9, 1Н), 4,13 (шир., 1Н), 3,92 (с, 3Н), 3,83 (с, 3Н), 3,72 (д, J=15,9 Гц, 1Н), 3,59 (с, 3Н), 3,46 (м, 1Н), 3,19 (дт, J1=15,1 Гц, J2=3,1 Гц, 3Н), 2,68 (дд, J1=15,8 Гц, J2=2,2 Гц, 1Н), 2,00 (м, 1Н), 1,54 (м, 1Н); 13С-ЯМР (CDCl3) δ 167,6 и 165,7 (с), 153,0 (с), 146,0 (с), 144,3 (с), 132,9 (с), 128,5 (с), 127,8 (д), 126,4 (д), 121,8 (д), 111,2 (д), 88,6 (д), 86,6 (д), 61,9 (д), 56,9 (т), 55,8 (кв), 55,0 (кв), 50,2 (кв), 48,3 (с), 33,0 (т), 29,8 (т). Анализ: (C22H25NO7) C, H, N.
Пример 30:
(6R)-11-(3-2-(4-фтор)фенил-2,5-диазабицикло[2.2.1]-гептан-5-ил-пропил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол (4w): способ согласно примеру 11, время реакции 4 час, выход 0,14 г (63,0%); 1H-ЯМР (CDCl3) δ 7,21 (м, 2Н); 6,68 (м, 3Н), 5,0 (с, 1Н), 4,47 (д, J=14,0 Гц, 1Н), 3,90 (м, 1Н), 3,63 (м, 3Н), 3,24 (м, 1Н), 2,04 (м, 3Н); 13С-ЯМР (CDCl3) 168,0 и 167,6 (с), 146,4 (д), 144,1 (с), 127,7 и 127,5 (д), 112,5 и 112,4 (д), 67,0 (т), 57,0 и 56,8 (д), 56,8 и 56,6 (т), 51,8 и 51,6 (т), 36,6 (т); 33,7 и 33,6 (т).
Пример 31:
2((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12)-илметилен)малононитрил (4х): способ по примеру 11, время реакции 6 час, выход 0,41 г (64,8%); 1Н-ЯМР (CDCl3) δ 7,12 (м, 1Н), 6,63 (дд, J1=12,6 Гц, J2=8,1 Гц, 2Н), 6,02 (дд, J1=15,9 Гц, J2=11,5 Гц, 2Н), 4,59 (шир., 1Н), 4,22 (д, J=15,9, 1Н), 4,13 (шир., 1Н), 3,83 (с, 3Н), 3,72 (д, J=15,9 Гц, 1Н), 3,46 (м, 1Н), 3,19 (дт, J1=15,1 Гц, J2=3,1 Гц, 3Н), 2,68 (дд, J1=15,8 Гц, J2=2,2 Гц, 1Н), 2,00 (м, 1Н), 1,54 (м, 1Н); 13С-ЯМР (CDCl3) δ 157,2 и 156,8 (д), 146,0 (с), 144,3 (с), 132,9 (с), 128,5 (с), 127,8 (д), 126,4 (д), 124,2 (с), 121,8 (д), 116,8 и 116,5 (с), 115,0 и 114,7 (с), 111,2 (д), 88,6 (д), 61,9 (д), 56,9 (т), 55,8 (кв), 48,3 (с), 33,0 (т), 29,8 (т).
Пример 32:
Диэтиловый эфир 2-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-илметилен)малоновой кислоты (4y): способ по примеру 11, время реакции 21 час, выход 0,46 г (63,3%), температура плавления 145-146° С, структура такая же, как у соединения 4v, описаны только отличающиеся ЯМР-сигналы: 1Н-ЯМР (CDCl3) δ 6,83 (с, 1Н), 3,43 (м, 6Н); 13С-ЯМР (СDС13) δ 181,2 (с), 133,7 (д), 116,6 (т), 48,3 (т). Анализ: (C22H25NO7·0,25С6Н14О) C, H, N.
Пример 33:
Этиловый эфир 3-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-илакриловой кислоты (4z): способ по примеру 11, время реакции 20 час, выход 0,30 г (46,2%), температура плавления 121-122° С, структура подобна соединению 4v, описаны только отличающиеся ЯМР-сигналы: 1Н-ЯМР (CDCl3) δ 7,40 (дд, J1=16,0 Гц, J2=2,0 Гц, 1H), 4,68 (д, J=16,0 Гц, 1Н), 4,10 (м, 2Н), 1,28 (м, 3Н); 13С-ЯМР (CDCl3) δ 169,3 и 167,8 (с), 161,1 (д), 97,5 (д), 59,0 (т), 14,5 и 14,3 (кв).
Способ Е: раствор (+/-)-норгалантамина (0,5 г, 1,83 ммоля), 0,51 г (3,66 ммоля) карбоната калия, (2,20 ммоля) иодида натрия и алкилгалогенид (2,20 ммоля) в ацетоне (20 мл) кипятили с обратным холодильником 12 час и упаривали. Остаток растворяли в 30 мл 2 н соляной кислоты и экстрагировали 1× 20 мл AcOEt. Водный раствор подщелачивали концентрированным аммиаком до рН>8,5 и экстрагировали AcOEt (3× 20 мл). Объединенные органические экстракты промывали раствором поваренной соли, сушили (Na2SO4), упаривали и очищали MPLC.
Соединения 4ab-4ah и 4an-4aq имеют основной галантаминовый структурный элемент, как 4аа, отличаясь только заместителем у атома азота. Поскольку сигналы протона и углерода галантаминового ядра существенно не отличаются друг от друга, ниже приведены только ЯМР-сигналы заместителей у атома азота.
Пример 34:
Этил-2-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-илацетат (4ас): получали по способу Е с применением этилхлорацетата, в течение 1 часа 0,48 г соединения 4ас (73%); 1H-ЯМР (CDCl3) δ 4,10 (м, 2Н), 3,32 (с, 2Н), 1,21 (т, J=7,3 Гц, 3Н); 13С-ЯМР (CDCl3) δ 170,7 (с), 60,4 (т), 58,0 (т), 14,1 (кв).
Пример 35:
Пропись:
ЗАМЕЩЕНИЕ В ПОЛОЖЕНИЕ 1
Прямое введение новых заместителей
3.2.1.1 [4aS-(4α а,6β ,8aR*)]-4а,5,9,10,11,12-гексагидро-1-(N,N-диметиламино)-3-метокси-11-метил-6Н-бензофуро[3а,3,2-ef][2] бензазепин-6-ол, 1-(N,N-диметиламино)галантамин (МН-7)
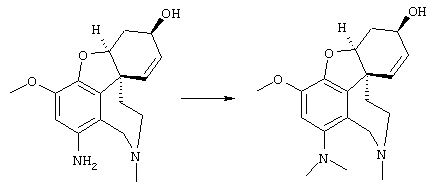
320 мг (1,06 ммоля) 1-аминогалантамин (4);
0,50 мл муравьиная кислота в 2 мл воды;
0,25 мл формальдегид (37%).
При перемешивании магнитной мешалкой все реагенты, растворенные в 10 мл воды, нагревали до 70° С. Через 4,5 час подщелачивали конц. водным аммиаком, при этом из желтого раствора выпадал белый осадок. Реакционную смесь экстрагировали до исчерпания этилацетатом, объединенные органические фазы сушили над сульфатом натрия, фильтровали и растворитель отгоняли.
Полученную смесь разделяли на колонке с силикагелем (СНС13:МеОН=1:1) и затем отгоняли растворитель в высоком вакууме с шариковым дефлегматором.
Выход: 0,17 г (0,52 ммоля = 49% от теории) светло-желтого масла
С19Н26N2O3 [330,43]
ТСХ: Rf=0,49 (СНС13:МеОН=1:1)
Т.кип. 180° С/0,01 мм
α D20 [с=0,1, СНС13]=-156,36°
Номера FID:
1H: MHEMOF.016, 13С: MHEM1F.002, DEPT: MHEM2F.002
1H-ЯМР (200 МГц, CDCl3): δ 6,57 (с, 1Н), 6,08 (дд, J=10,3, 1,0 Гц, 1Н), 5,97 (дд, J=10,3, 4,8 Гц, 1H), 4,56 (шир.с, 1H), 4,45 (д, J=15,1 Гц, 1H), 4,12 (шир.с, 1H), 3,83 (с, 3Н), 3,55 (д, J=15,1 Гц, 1H), 3,12 (тд, J=13,1, 1,7 Гц, 1H), 2,97 (дт, J=14,1, 3,5 Гц, 1Н), 2,72-2,53 (м, 1Н), 2,58 (с, 6Н), 2,44 (с, 3Н), 2,12-1,98 (м, 2Н), 1,62 (ддд, J=13,6, 3,8, 2,1 Гц, 1Н); 13С-ЯМР (50 МГц, CDCl3): δ 147,1 (с), 143,2 (с), 142,0 (с), 133,7 (с), 127,3 (д), 127,2 (д), 124,2 (с), 103,9 (д), 88,3 (д), 62,0 (д), 55,9 (кв), 54,4 (т), 54,1 (т), 48,4 (с), 45,7 (кв), 44,2 (кв), 34,8 (т), 29,8 (т).
Пример 37:
(4aS,6R,8aS)-11-(3-аминоэтил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-2-ол [4af], способ F, компонент реакции 4ad, время реакции 1 час; выход 0,31 г (59,2%); температура плавления 47-51° С; 1H-ЯМР (CDCl3) δ 2,69 (м, 2Н), 1,92 (шир., 2Н); 13С-ЯМР (СDС13) δ 51,9 (с), 38,0 (т).
Пример 40:
Этил-3-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-ил)пропаноат (4аi): способ В, время реакции 4 час; выход 0,64 г (47,5%); 1H-ЯМР (CDCl3) δ 4,15 (кв, J=6,0 Гц, 2Н), 2,81 (т, J=7,0 Гц, 2Н), 2,47 (т, J=7,0 Гц, 2Н), 1,23 (т, J=6 Гц, 3Н); 13С-ЯМР (CDCl3) δ 172,4 (с), 60,3 (т), 57,3 (т), 32,9 (т), 14,1 (кв).
Пример 41:
Трет-бутил-3-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)пропаноат (4aj): способ В, время реакции 5 час; выход 0,83 г (60,0%); 1H-ЯМР (CDCl3) δ 2,82 (т, J=7,0 Гц, 2Н), 2,40 (т, J=7,0 Гц, 2Н), 1,43 (с, 9Н); 13С-ЯМР (CDCl3) δ 172,0 (с), 80,5 (с), 57,7 (т), 34,2 (т), 28,0 (кв). Анализ: (C24H33NO5) C, H, N.
Пример 42:
3-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)-N11-изопропилпропанамид (4ak): способ В, время реакции 18 час; выход 0,55 г (78,7%); 1Н-ЯМР (CDCl3) δ 3,81 (м, 1Н), 2,79 (т, J=6 Гц, 2Н), 2,32 (т, J=6,0 Гц, 2Н), 1,10 (т, J=12,0 Гц, 6Н); 13С-ЯМР (CDCl3) δ 171,4 (с), 56,9 (т), 40,7 (д), 33,2 (т), 22,7 (кв).
Пример 43:
3-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)-Nl-трет-бутилпропанамид (4аl): способ В, время реакции 24 час; выход 0,37 г (51,2%); 1H-ЯМР (CDCl3) δ 2,76 (т, 6,0 Гц, 2Н), 2,29 (м, 2Н), 1,28 (с, 9Н); 13С-ЯМР (СDС13) δ 171,4 (с), 51,4 (т), 50,3 (с), 33,5 (т), 28,7 (кв).
Пример 44:
3-((6R)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)пропанитрил (4am): способ В, время реакции 4 час; выход 0,53 г (90,6%); 1H-ЯМР (СDСl3) δ 2,82 (т, J=7,1 Гц, 2Н), 2,47 (т, J=6,8 Гц, 2Н); 13С-ЯМР (CDCl3) δ 118,7 (с), 51,6 (т), 46,6 (т), 16,7 (т).
Пример 45:
(6R)-11-(3-гидроксипропил-3-метокси-5,6,9,10,11,12-гексагидро-4aH-[l]бензофуро[3a,3,2-ef][2]бензазепин-6-ол (4an): способ F, компонент реакции соединение 4ai, время реакции 7 час; выход 0,21 г (47,7%); 1Н-ЯМР (CDCl3) δ 3,77 (м, 2Н), 2,72 (м, 2Н), 2,02 (м, 2Н); 13С-ЯМР (CDCl3) δ 63,9 (т), 57,3 (т), 29,8 (т).
Пример 46:
(6R)-11-(3-аминопропил)-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол (4ао): способ F, компонент реакции соединение 4am, время реакции 1 час; выход 78 мг (52,8%); 1H-ЯМР (CDCl3) δ 3,22 (м, 2Н), 2,68 (м, 2Н), 1,72 (м, 2Н); 13С-ЯМР (СDС13) δ 51,3 (т), 37,8 (т), 29,3 (т).
Пример 47:
(6R)-11-(3-пиперидин-1-ил-пропил-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (4ар): способ Е, время реакции 3 ч; выход 0,36 г (53,2%); 1H-ЯМР (CDCl3) δ 2,68 (м, 8Н), 1,77 (м, 6Н), 1,50 (м, 2Н); 13С-ЯМР (CDCl3) δ 57,4 (т), 44,1 (т), 49,2 (т), 24,7 (т), 23,4 (т), 23,3 (т).
Пример 48:
Стадия 1:
(4а,S,6R8аS)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол, (-)-норгалантамин (8).
Способ 1:
К раствору 10,92 г (40,0 ммоля) рац. норгалантамина (4) в 40 мл метанола прибавляли по каплям раствор 7,72 г (20,0 ммоля) (+)-О,О,-ди-п-толуоилвинной кислоты в 15 мл метанола и затем смывали 1 мл метанола. Раствор смешивали с затравочным кристаллом (без затравочного кристалла кристаллизация продолжается несколько недель) и выдерживали на два дня при 4° С. Затем хорошо растирали стеклянной палочкой и выдерживали при 4° С еще от двух до пяти дней, причем в указанный промежуток времени снова хорошо растирали стеклянной палочкой. После этого выпавшую соль отсасывали, трижды промывали метанолом, охлажденным льдом и переносили в 100 мл воды. Водную фазу подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 60 мл этилового эфира уксусной кислоты. Объединенные органические фазы промывали один раз насыщенным водным раствором хлорида натрия, сушили (Na2SO4, активированный уголь), фильтровали и упаривали, получая 2,9 г (37,5% от теории) бесцветных кристаллов (-)-норгалантамина (8).
Способ 2:
К раствору галантамина (1) (20,0 г, 70 ммолей) в CH2Cl2 (350 мл) прибавляли мета-хлорпероксибензойную кислоту (m-СРВА) (содержание пероксида 76%, 15,6 г, 70 ммолей) и прозрачный раствор перемешивали 40 мин при комнатной температуре. На этой стадии превращение в N-оксид количественно, как установлено ВЭЖХ (высокоэффективной жидкостной хроматографией). Затем прибавляли раствор FeSO4·7H2O (9,7 г, 35 ммолей) в МеОН (100 мл). Смесь перемешивали 20 мин, смешивали с 2 н соляной кислотой (200 мл), летучую часть (СН2Сl2 и МеОН) упаривали при пониженном давлении и затем промывали эфиром (3× 100 мл). Водный раствор подщелачивали концентрированным аммиаком до рН>8,5 и экстрагировали CH2Cl2 (3× 100 мл) и СН2Сl2:МеОН=9:1 (3× 100 мл). Объединенные органические экстракты промывали раствором поваренной соли (200 мл), сушили над Na2SO4 и упаривали, получая кристаллический продукт (18,2 г, 96%), который состоял из смеси 92:8 норгалантамина и галантамина. MPLC (СНС13:МеОН:Еt3N=98:1,25:0,5), 16,1 г (84,7%) норгалантамина (8): 1H-ЯМР (CDCl3) δ 6,62 (шир., 2Н), 6,02 (м, 2Н), 4,61 (шир., 1Н), 4,14 (т, J=4,3 Гц, 1Н), 3,98 (д, J=5,0 Гц, 2Н), 3,83 (с, 3Н), 3,30 (м, 1 Н), 2,69 (д, J=15,7, 1Н), 2,10-1,63 (м, 4Н); 13С-ЯМР (CDCl3) δ 146,2 (с), 144,1 (с), 133,1 (с), 131,7 (с), 127,8 (д), 126,8 (д), 120,8 (д), 111,1 (д), 88,4 (д), 61,9 (д), 55,9 (кв), 53,3 (т), 48,5 (с), 46,7 (т), 39,4 (т), 29,9 (т).
Стадия 2:
(4a,S, 6R8aS)-3-метокси-11-фенил-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол (8а). К раствору 1,0 г соединения 8 (-)-норгалантамина в 50 мл CH2Cl2 прибавляли 0,28 г фенилборной кислоты (7,2 ммоля), 0,6 мл пиридина (7,2 ммоля), 0,67 г ацетата меди (3,6 ммоля) и молекулярное сито (1,0 г). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Осадок отфильтровывали и промывали 3× 10 мл CH2Cl2. Фильтрат экстрагировали 3× 50 мл разбавленного раствора аммиака. Объединенные водные фазы экстрагировали 3× 50 мл CH2Cl2, органические фазы промывали раствором поваренной соли, сушили над сульфатом натрия и упаривали. Посредством MPLC получали 0,33 г (26,4%) соединения 8а, температура плавления 178-180° С; 1H-ЯМР (СDС13) δ 7,18 (м, 2Н), 6,82 (м, 3Н), 6,67 (дд, J1=33,8 Гц, J2=7,6 Гц, 2Н), 6,05 (шир., 2Н), 4,66 (шир., 1Н), 4,53 (м, 1Н), 4,19 (д, J=15,3 Гц, 1Н), 3,85 (с, 3Н), 3,81 (д, J=15,3 Гц, 1Н), 3,33 (м, 1Н), 2,68 (м, 1Н), 2,07 (м, 3Н), 1,62 (м, 1Н); 13С-ЯМР (СDС13) δ 158,2 (с), 145,9 (с), 144,5 (с), 133,0 (с), 129,4 (с), 128,9 (д), 128,1 (д), 126,9 (д), 126,1 (д), 121,1 (д), 116,0 (д), 111,4 (д), 88,6 (д), 61,9 (д), 57,0 (т), 55,9 (кв), 50,6 (т), 48,2 (с), 32,8 (т), 29,9 (т). Анализ: (С22Н23NO3·0,75 H2O) C, H, N.
Пример 49:
(4a,S,6R,8аS)-3-метокси-11-тиофенил-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8b). Соединение получали, как соединение 8а, время реакции составило 3 дня, выход 0,14 г (28,0%). Описаны только отличающиеся от 8а ЯМР-сигналы: 1Н-ЯМР (СDС13) 7,23 (м, 1Н), 6,92 (т, J=3,0 Гц, 1Н), 6,83 (д, J=2,7 Гц, 1Н); 13С-ЯМР (CDCl3) δ 145,7 (с), 127,6 (д), 126,2 (д), 125,0 (д). Анализ: (C20H21NO3S) C,H,N.
Пример 50:
(4а,S,6R,8аS)-11-бензоилпиперидин-4-ил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8с). 1-Бензоилпиперидин-4-он (0,34 г, 1,7 ммоля), 0,47 г изопропилата титана (1,7 ммоля) и 3,6 г (1,3 ммоля) соединения 8 сплавляли 30 мин при 110° С. После охлаждения при комнатной температуре прибавляли раствор цианборгидрида натрия (65 мг, 0,9 ммоля) в сухом EtOH (10 мл) и перемешивали реакционную смесь при комнатной температуре 24 часа. После прибавления 2 мл воды осадок отфильтровывали, фильтрат упаривали и остаток разбавляли 20 мл EtOAc и снова фильтровали. Прозрачный раствор упаривали. Посредством MPLC получали 0,24 г (38,8%) соединения 8с. 1H-ЯМР (СDС13) δ 7,52-7,31 (м, 5Н), 6,65 (шир., 2Н), 6,08 (м, 2Н), 4,64 (шир., 1Н), 4,22-3,90 (м, 4Н), 3,82 (с, 3Н), 3,37 (м, 2Н), 3,01-2,62 (м, 5Н), 2,10-1,82 (м, 5Н), 1,67-1,42 (м, 2Н); 13С-ЯМР (CDCl3) 170,1 (с), 145,8 (с), 144,0 (с), 136,0 (с), 133,1 (с), 129,4 (д), 128,8 (д), 128,4 (д), 128,3 (д), 127,6 (д), 126,7 (д), 121,6 (д), 111,2 (д), 88,6 (д), 61,9 (д), 55,8 (кв), 55,6 (т), 48,3 (т), 30,8 (т), 29,8 (т).
Пример 51:
Фениловый эфир (4a,S,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоновой кислоты (8е): к раствору 0,50 г соединения 8 (1,74 ммоля) в 50 мл СНС13 прибавляли 2,5 г гидрокарбоната натрия (29,8 ммоля) и 1,84 мл фенилхлорформиата (14,6 ммоля). Смесь активно перемешивали и кипятили 2 часа с обратным холодильником и затем разбавляли водой (30 мл). Фазы разделяли. Водную фазу экстрагировали 2× 30 мл СН2Сl2 и объединенные органические фазы промывали 1 н соляной кислотой (30 мл), сушили над сульфатом натрия и упаривали при пониженном давлении, получая сырой продукт. Посредством MPLC (CH2Cl2:MeOH=99:1) получали 0,58 г (84,2%) соединения 8е: 1H-ЯМР (СDС13) δ 7,51-7,04 (м, 5Н), 6,82 (дд, J1=24,0 Гц, J2=6,0 Гц, 2Н), 6,04 (шир., 2Н), 4,91 (шир., 1Н), 4,69 (д, J=6,0 Гц, 2Н), 4,20 (шир., 1Н), 3,83 (с, 3Н), 3,42 (м, 1Н), 3,19 (м, 1Н), 2,43-1,90 (м, 4Н); 13С-ЯМР (CDCl3) δ 151,3 (с), 146,6 (с), 145,7 (с), 130,5 (с), 130,1 (с), 129,4 (д), 129,3 (д), 125,9 (д), 125,3 (д), 125,0 (д), 121,6 (д), 111,9 (д), 88,3 (д), 62,8 (д), 57,7 (т), 55,9 (кв), 53,4 (т), 49,3 (с), 43,3 (т), 32,7 (т).
Пример 52:
O-фениловый эфир (4a,S,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карботионовой кислоты (8f): к раствору 0,50 г соединения 8 (1,74 ммоля) в 25 мл СНС1з прибавляли 0,24 мл хлортионформиата (1,74 ммоля) и реакционную смесь перемешивали под азотом в течение 1 часа. Растворитель отделяли, получая бесцветное масло, флэш-хроматографией которого получали 0,50 г (71,2%) соединения 8а: 1Н-ЯМР (СDС13) δ 7,48-7,12 (м, 3Н), 7,02 (д, J=6,0 Гц, 2Н), 6,83 (м, 2Н), 6,04 (шир., 2Н), 5,08 (м, 1Н), 4,71 (д, J=26,0 Гц, 2Н), 4,28 (м, 1Н), 3,88 (с, 3Н), 3,41 (м, 2Н), 2,51-2,09 (м, 4Н); 13С-ЯМР (CDCl3) δ 187,5 и 187,4 (с), 153,8 и 153,7 (с), 146,7 и 146,6 (с), 145,8 и 145,7 (с), 131,3 и 130,6 (с), 130,2 и 129,5 (с), 129,2 и 129,1 (д), 126,0 и 125,9 (д), 125,0 и 124,9 (д), 122,7 и 122,6 (д), 121,6 и 120,4 (д), 115,3 (д), 112,0 (д), 84,4 и 84,2 (д), 63,1 и 62,9 (д), 55,9 (кв), 51,5 (т), 49,5 и 49,3 (с), 47,8 (т), 36,9 (т), 33,1 (т).
Пример 53:
9-Н-фтор-9-илметиловый эфир (4а,S,6R,8аS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоновой кислоты (8g): к раствору 0,5 г соединения 8 (1,8 ммоля) и 2,5 мл триэтиламина (1,8 ммоля) в 20 мл СН2Сl2 прибавляли 0,5 г хлорангидрида 9-флуоренилметилоксикарбоновой кислоты (20 ммолей) и перемешивали 30 мин при комнатной температуре. Реакционную смесь упаривали, остаток разбавляли 80 мл 2 н соляной кислоты и экстрагировали 5× 50 мл CH2Cl2. Органические фазы объединяли, промывали раствором поваренной соли, сушили над сульфатом натрия и упаривали, получая 0,88 г (99,2%) соединения 8g. Температура плавления 76-79° С; α D=-33,0; 1H-ЯМР (СDС13) δ 1,72 (дд, J=13,5; 5,0 Гц, 1Н), 1,80-2,10 (м, 2Н), 2,69 (дд, J=13,5; 5,0 Гц, 1Н), 3,20-3,45 (м, 2Н), 3,85 (с, 3Н), 3,95-4,35 (м, 3Н), 4,40-4,52 (м, 2Н), 5,78-6,05 (м, 2Н), 6,22-6,82 (м, 2Н), 7,19-7,82 (м, 8Н); 13С-ЯМР (CDCl3) δ 155,1 (с), 144,4 (с), 144,0 (с), 141,4 (с), 134,0 (с), 129,1 (с), 128,1 (с), 128,0 (д), 127,6 (д), 126,4 (д), 124,9 (д), 124,7 (д), 121,0 (д), 119,9 (д), 111,1 (д), 88,3 (д), 66,9 (т), 61,9 (д), 56,0 (кв), 51,5 (т), 48,3 (с), 47,3 (д), 45,9 (т), 36,4 (т), 29,7 (т).
Пример 54:
1-((4a,S,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)-пент-4-ен-1-он (8h): к раствору 1,0 г соединения 8 (3,7 ммоля) и 0,51 мл (3,7 ммоля) триэтиламина в 40 мл CH2Cl2:MeOH=5:2 при 0° С прибавляли 0,97 мл (5,1 ммоля) ангидрида пент-4-еновой кислоты и перемешивали 20 мин Реакционную смесь разбавляли 20 мл СН2Сl2, экстрагировали 2× 20 мл насыщенным раствором гидрокарбоната натрия. Объединенные водные фазы экстрагировали 2× 40 мл СН2С12, объединенные органические фазы промывали раствором поваренной соли, сушили над сульфатом натрия и упаривали, получая 1,24 г (95,3%) соединения 8h: 1H-ЯМР (CDCl3) δ 6,66 (шир., 2Н), 5,98 (м, 2Н), 5,78 (м, 1Н), 4,98 (м, 2Н), 4,66 (д, J=12,8 Гц, 1Н), 4,55 (с, 1Н), 4,41 (д, J=16,5 Гц, 1Н), 4,11 (шир., 1Н), 3,93 (м, 1Н), 3,81 (с, 3Н), 3,17 (т, J=17,7 Гц, 1Н), 2,76-2,15 (м, 5Н), 1,92 (м, 3Н); 13С-ЯМР (CDCl3) δ 171,7 (с), 146,8 (с), 144,6 (с), 137,3 (д), 132,4 (с), 128,1 (с), 128,0 (д), 126,3 (д), 120,3 (д), 114,9 (д), 111,0 (д), 88,2 (д), 61,7 (д), 55,8 (кв), 52,7 (т), 48,2 (с), 44,6 (т), 35,7 (т), 33,2 (т), 29,7 (т), 28,8 (т).
Пример 55:
1-((4a,S,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-карбоксамид (8i): к суспензии 0,5 г соединения 8 (1,8 ммоля) в 25 мл воды, подкисленной 2 н соляной кислотой до рН 3, прибавляли 0,23 г (3,6 ммоля) цианида натрия. Реакционную смесь перемешивали при комнатной температуре в течение 25 часов и затем подщелачивали концентрированным аммиаком до рН выше 8,5 и, наконец, экстрагировали 3× 20 мл СН2Сl2. Объединенные водные фазы экстрагировали раствором поваренной соли, сушили над сульфатом натрия и упаривали. Посредством MPLC (СНС13:МеОН(NН3)=95:5) получали 0,38 г (66%) соединения 8i: 1Н-ЯМР (CDCl3) δ 6,67 (дд, J=12,8, 8,1 Гц, 2Н), 6,00 (дд, J=15,1; 10,4 Гц, 2Н), 4,68 (шир., 1Н), 4,51 (д, J=16,8 Гц, 1Н), 4,31 (д, J=16,8 Гц, 1Н), 4,11 (м, 1Н), 3,81 (с, 3Н), 3,35 (т, J=12,8 Гц, 1Н), 2,67 (д, J=15,3 Гц, 1Н), 2,41 (шир., 1Н), 1,97 (м, 2Н), 1,72 (д, J=13,8 Гц, 1Н); 13С-ЯМР (СDС13) δ 158,1 (с), 146,8 (с), 144,5 (с), 132,3 (с), 128,6 (с), 128,0 (д), 126,2 (д), 120,3 (д), 111,1 (д), 88,1 (д), 61,6 (д), 55,8 (кв), 51,9 (т), 48,3 (с), 45,6 (т), 36,3 (т), 29,7 (т).
Пример 56:
(4a,S, 6R, 8aS)-6-гидрокси-3-метокси-N11-метил-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карботиоамид (8j): способ по примеру 142, время реакции 4 ч, выход 1,02 г (88%); температура плавления 229-230° С; 1H-ЯMP и 13С-ЯМР были идентичны с соединением 4t. Анализ: C18H22N2O3S· 0,2 СНзС6Н5) C, H, N.
Пример 57:
(4а,S,6R,8аS)-6-гидpoкcи-N11 -изoпpoпил-3-мeтoкcи-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3a,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (8k): способ А, время реакции 3 час, выход 1,86 г (71%); 1H-ЯМР и 13С-ЯМР были идентичны с соединением 4i.
Пример 58:
(4а,S,6R,8aS)-N11-тpeт-бyтил-6-гидpoкcи-3-мeтoкcи-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (8l): способ А, время реакции 3 час, выход 1,63 г (60%); температура плавления 106-108° С; 1H-HMP и 13С-ЯМР были идентичны с соединением 4m.
Пример 59:
(4а,S,6R,8аS)-6-гидрокси-3-метокси-N11-трифторметил-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (8m): способ А, время реакции 5 час, выход 0,60 г (59%);
1H-ЯМР (CDСl3) δ 8,20 (т, J=8,0 Гц, 1Н), 7,24 (м, 2Н), 7,02 (м, 1Н); 13С-ЯМР (СDС13) δ 153,6 (с), 137,6 (с), 127,6 (д), 126,1 (д), 123,0 и 117,8 (с), 122,3 (д), 119,8 (с), 111,3 (д).
Пример 60:
Метил-(4а,S,6R,8aS)-N11-циано-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамидотиоат (8n). Соединение получали, как описано для соединения 3bi. Время реакции 3 дня, выход 0,90 г (33,2%); 1H-ЯМР (CDCl3) δ 6,72 (м, 2Н), 5,98 (д, J=10,2 Гц, 2Н), 4,62 (м, 2Н), 4,14 (шир., 1Н), 3,92 (д, J=11,8 Гц, 1Н), 3,84 (с, 3Н), 3,44 (м, 2Н), 2,74 (с, 3Н), 2,68 (м, 1Н), 1,99 (м, 3Н); 13С-ЯМР (CDCl3) δ 146,2 (с), 144,9 (с), 131,7 (с), 128,7 (д), 125,8 (с), 125,5 (д), 121,8 (д), 111,2 (д), 88,1 (д), 61,6 (д), 55,8 (кв), 51,2 (т), 49,7 (т), 47,9 (с), 29,6 (т), 16,1 (кв).
Пример 61:
(4a,S,6R,8aS)-11-(циклопропилметил)-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8о): способ по примеру Е, время реакции 36 часов, выход 0,12 г (29,0%); такая же структура, как у 4аа, описаны только отличающиеся ЯМР-сигналы.
1H-NMR (CDCl3) δ 3,48 (т, J=8,0 Гц, 2Н), 0,91 (м, 1Н), 0,53 (д, J=12 Гц, 2Н), 0,11 (д, J=6 Гц, 2Н);
13С-ЯМР (CDCl3) δ 57,2 (т), 9,8 (д), 4,7 (т), 4,1 (т).
Пример 63:
3-((4a,S,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)этаннитрил (8 г): способ как в примере Е, время реакции 2 часа, выход 1,67 г (61,1%); температура плавления 169-171° С; 1H-ЯМР и 13С-ЯМР были идентичны с соединением 4ad. Анализ: (C18H20N2O3·0,67 Н2О) C, H, N.
Пример 64:
1-(2-фенил-2,5-диазабицикло[2.2.1]гептан-5-ил)-2-((4a,S,6R,8аS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]-бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-ил)-1-этанон (8s): способ как в примере Е, время реакции 3 дня, выход 0,68 г (37,8%); температура плавления 85-89° С; α D=-169,3° , структура аналогична 4аа, описаны только отличающиеся ЯМР-сигналы: 1H-ЯМР (CDCl3) δ 7,21 (м, 2Н); 6,68 (м, 3Н), 5,0 (с, 1Н), 4,47 (д, J=14,0 Гц, 1Н), 3,90 (м, 1Н), 3,63 (м, 3Н), 3,24 (м, 1Н), 2,04 (м, 3Н); 13С-ЯМР (СDС13) δ 168,0 и 167,6 (с), 146,4 (д), 144,1 (с), 127,7 (д), 127,5 (д), 112,5 (д), 112,4 (д), 67,0 (т), 57,0 и 56,8 (д), 56,8 и 56,6 (т), 51,8 и 51,6 (т), 36,6 (т); 33,7 и 33,6 (т). Анализ: (C29H33N3O4·0,33 H2O) C, H, N.
Пример 65:
(4а,S,6R,8аS)-11-(3-аминоэтил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8t): способ по примеру F, компонент реакции соединение 8r; время реакции 18 часов, выход 1,01 г (66,1%); температура плавления 72-75° С; α D=-71,58° , 1H-ЯМР и 13С-ЯМР были идентичны с соединением 4af. Анализ (C18H24N2O3·0,65 EtOH· 0,05 CH2Cl2)) C, H, N.
Пример 66:
(4a,S,6R,8аS)-11-(2-морфолин-4-ил-этил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8u): способ по примеру Е, время реакции 2 дня, выход 1,77 г (63,6%); температура плавления 101-104° С; 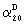 =-110,9° , 1H-ЯМР и 13С-ЯМР были идентичны с соединением 4аg. Анализ: (C22H30N2O4·0,15 СН2Сl2) C, H, N.
=-110,9° , 1H-ЯМР и 13С-ЯМР были идентичны с соединением 4аg. Анализ: (C22H30N2O4·0,15 СН2Сl2) C, H, N.
Пример 67:
(4a,S,6R,8aS)-11-(2-фенил-2,5-диазабицикло[2.2.1]гептан-5-ил-этил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8v): способ по примеру F, компонент реакции соединение 8s; время реакции 30 мин, выход 0,26 г (50,8%); температура плавления 72-75° С;  =-131,6° , 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4ah. Анализ: (С29H35N3O3·0,35 CH2Cl2·0,5 Et3N) C, H, N.
=-131,6° , 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4ah. Анализ: (С29H35N3O3·0,35 CH2Cl2·0,5 Et3N) C, H, N.
Пример 68:
3-((4a,S,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)пропановая кислота (8w): раствор 8w (0,5 г, 1,25 ммоля) прибавляли к CH2Cl2 (20 мл) в трифторуксусной кислоте (5 мл). Реакционную смесь перемешивали 2 часа при комнатной температуре и получали концентрат 0,37 г (64,5%) 8w: структура одинакова с 4аа, описаны только отличающиеся ЯМР-сигналы: 1H-ЯМР (СDС13) 8,95 (шир., 1Н), 2,82 (м, 2Н), 2,25 (м, 2Н).
Пример 69:
Трет-бутил-3-((4a,S,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-пропаноат (8х): способ В, время реакции 6 час, выход 0,74 г (53,2%); 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4aj.
Пример 70:
(4а,S,6R,8аS)-11-(3-гидроксипропил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8z): способ Е, время реакции 4 дня, выход 0,32 г (56,7%); 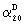 =90,0° , 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4аn.
=90,0° , 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4аn.
Пример 71:
(4a,S,6R,8aS)-11-((3-диметиламино)пропил-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8аа): способ Е, время реакции 24 часа, выход 0,45 г (51,6%); структура аналогична 4аа, описаны только отличающиеся ЯМР-сигналы.
1H-ЯМР (СDС13) δ 2,50 (м, 2Н), 2,30 (м, 2Н), 2,22 (с, 3Н), 2,18 (с, 3Н), 1,82 (м, 2Н); 13С-ЯМР (CDCl3) δ 55,6 (т), 53,4 (т), 45,0 (кв); 25,3 (т).
Пример 72:
(4а,S,6R,8aS)-3-метокси-11-(3-пиперидин-1-ил-пропил)-5, 6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8ab): способ Е, время реакции 3 дня, выход 1,77 г (54,7%); температура плавления 84-92° С; 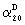 =-50,64° , 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4аn. Анализ: (C24H34N2O3·3C4H6O6) C, H, N.
=-50,64° , 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4аn. Анализ: (C24H34N2O3·3C4H6O6) C, H, N.
Пример 73:
(4a,S,6R,8aS)-11-(3-2-(4-фтор)фенил-2,5-диазабицикло-[2.2.1]гептан-5-ил-пропил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (8ас): способ Е, время реакции 4 дня, выход 1,77 г (59,3%); температура плавления 84-92° С; 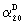 =-50,64° , 1H-ЯMP и 13С-ЯМР были идентичны с соединением 4aq. Анализ: (С30Н36FN3O3·2СН2С12·2 Еt3N) C, H, N.
=-50,64° , 1H-ЯMP и 13С-ЯМР были идентичны с соединением 4aq. Анализ: (С30Н36FN3O3·2СН2С12·2 Еt3N) C, H, N.
Пример 74:
(4a,R,6S,8aR)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол, (+)-норгалантамин (9) был приготовлен и описан как для 8: выход 5,35 г (74,2%); 1H-ЯМР и 13С-ЯМР были идентичны с соединением 8.
Пример 75:
(4a,R,6S,8aR)-6-гидрокси-N11-изопропил-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (9а): способ А, время реакции 3 часа, выход 1,03 г (79%); 1H-ЯМР и 13С-ЯМР были идентичны с соединением 41.
Пример 76:
(4a,R,6S,8aR)-N11-трет-бутил-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоксамид (9b): способ А, время реакции 3 часа, выход 0,85 г (63%); 1H-ЯМР и 13С-ЯМР были идентичны с соединением 4m.
Пример 77:
(4a,R,6S,8aR)-3-метокси-11-(2-морфолин-4-ил-этил)-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол (9с): способ Е, время реакции 2 дня; выход 0,12 г (53,2%); 1H-ЯМР и 13С-ЯМР были идентичны с соединением 4аg.
Пример 78:
(4а,R,6S,8aR)-11-((3-диметиламино)пропил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]-бензазепин-6-ол (9d): способ Е, время реакции 22 часа, выход 0,19 г (44,6%); 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 8аа.
Пример 79:
(4а,R,6S,8aR)-11-(3-пиперидин-1-ил-пропил)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]-бензазепин-6-ол (9е): способ Е, время реакции 20 часов, выход 0,33 г (75,0%); 1Н-ЯМР и 13С-ЯМР были идентичны с соединением 4ар.
Пример 80:
Стадия 1:
2-бром-4-метокси-5-(1-метилэтокси) бензальдегид
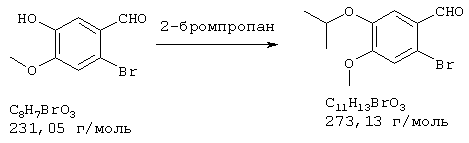
2-Бром-5-гидрокси-4-метоксибензальдегид (100,0 г, 433 ммоля), 2-бромпропан (160,0 г, 1,30 моля) и карбонат калия (300 г, 2,16 моля, безводного, свежеразмолотого) перемешивали в ацетонитриле (1200 мл) 48 часов при 60° С.
Реакционную смесь фильтровали, растворитель отгоняли на роторном испарителе и остаток распределяли между водой (800 мл) и эфиром (800 мл). Водную фазу экстрагировали эфиром (2× 300 мл), объединенные органические фазы промывали водой (2× 500 мл) и насыщенным раствором поваренной соли (1× 500 мл), сушили (сульфат натрия/активированный уголь), фильтровали и полученный после отгонки растворителя остаток перекристаллизовывали из метанола (500 мл). Указанным способом получали продукт в виде бледно-розовых кристаллов (98,1 г, 83%).
Т.пл.: 75-76° С
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 3:1, Rf=0,75
1H ЯМР (CDCl3): δ 10,13 (С, 1Н), 7,40 (с, 1Н), 7,03 (с, 1H), 4,61 (септет, J=6, 4 Гц, 1Н), 3,92 (с, 3Н), 1,38 (д, J=6,4 Гц, 6Н);
13С ЯМР (CDCl3): δ 190,8 (д), 155,6 (с), 147,1 (с), 126,4 (с), 120,0 (с), 115,8 (д), 113,7 (д), 71,5 (д), 56,4 (кв), 21,8 (кв).
Стадия 2:
2-бром-4-метокси-5-(1-метилэтокси) бензолметанол
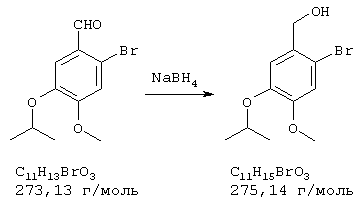
К суспензии боргидрида натрия (1,67 г, 44,1 ммоля) в безводном этаноле (60 мл) при 15° С прибавляли 2-бром-4-метокси-5-(1-метилэтокси)бензальдегид (6,0 г, 22,0 ммоля) в течение 15 минут и смесь перемешивали один час при комнатной температуре.
Остаток, оставшийся после отгонки растворителя, распределяли между насыщенным раствором гидрокарбоната натрия (60 мл) и эфиром (100 мл). Водную фазу экстрагировали эфиром (3× 40 мл), объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия (1× 100 мл), водой (1× 100 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь) и фильтровали. После отгонки растворителя на роторном испарителе получали продукт в виде бесцветных кристаллов (5,575 г, 95).
Т.пл.: 67-69° С
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 4:1, Rf=0,25
1Н ЯМР (CDCl3): δ 7,00 (с, 2Н), 4,64 (с, 2Н), 4,50 (септет, J=6,4 Гц, 1H), 3,85 (с, 3Н), 2,05 (с, 1Н), 1,34 (д, J=6,4 Гц, 6Н);
13С ЯМР (СDС13): δ 150,1 (с), 146,5 (с), 131,8 (с), 116,1 (с), 115,9 (д), 112,6 (с), 71,7 (т), 64,3 (д), 56,0 (кв), 21,8 (кв).
МТ-44 JOS 1693
C11H15BrO3
Вычислено: С, 48,02; Н, 5,50.
Найдено: С, 48,11; Н, 5,29.
Стадия 3:
1-бром-2-(хлорметил)-5-метокси-4-(3-метилэтокси)-бензол
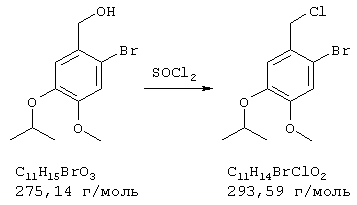
К 2-бром-4-метокси-5-(1-метилэтокси)бензолметанолу (5,63 г, 20,5 ммоля) в абсолютном CH2Cl2 (60 мл) прибавляли по каплям тионилхлорид (20 мл) в абсолютном CH2Cl2 (10 мл) в течение 10 минут и перемешивали при комнатной температуре 90 минут.
Остаток, оставшийся после удаления растворителя на роторном испарителе, распределяли между эфиром (100 мл) и насыщенным раствором гидрокарбоната натрия (100 мл), объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия (2× 100 мл), водой (1× 100 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь), фильтровали и отгоняли растворитель на роторном испарителе. Указанным способом получали продукт в виде бесцветных кристаллов (5,72 г, 95%).
Т.пл.: 68-70° С
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 3:1, Rf=0,9
1H ЯМР (CDCl3): δ 7,05 (с, 1Н), 6,97 (с, 1Н), 4,66 (с, 2Н), 4,51 (септет, J=6,4 Гц, 1Н), 3,85 (с, 3Н), 1,37 (д, J=6,4 Гц, 6Н);
13С ЯМР (CDCl3): δ 151,2 (с), 146,8 (с), 128,5 (с), 117,7 (с), 116,1 (д), 114,8 (с), 71,9 (т), 56,2 (д), 64,4 (кв), 21,9 (кв).
МТ-45 JOS 1760
С14Н20О3
Вычислено: С, 71,16; Н, 8,53.
Найдено: С, 70,90; Н, 8,28.
Стадия 4:
1-[4-(1-метилэтокси)фенил]этанон
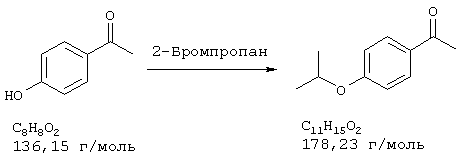
1-(4-гидроксифенил)этанон (12,7 г, 93,2 ммоля), 2-бромпропан (57,3 г, 466 ммоля) и карбонат калия (62,2 г, 466 ммолей, безводный, свежеразмолотый) в абсолютном ацетонитриле (150 мл) перемешивали 24 часа при 60° С.
Реакционную смесь фильтровали, растворитель отгоняли на роторном испарителе и остаток распределяли между водой (200 мл) и эфиром (200 мл). Водную фазу экстрагировали эфиром (2× 80 мл), объединенные органические фазы промывали водой (2× 100 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь) и фильтровали. Указанным способом после отгонки растворителя получали продукт в виде бесцветных кристаллов (16,8 г, 99%).
Т.пл.: 36-80° С
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 4:1, Rf=0,5
1H ЯМР (СDС13): δ 7,82 (д, J=9,5 Гц, 2Н), 6,88 (д, J=9,5 Гц, 2Н), 4,63 (септет, J=6,4 Гц, 1Н), 2,52 (с, 3Н), 1,33 (д, J=6,4 Гц, 6Н);
13С ЯМР (СDС13): δ 196,7 (с), 161,9 (с), 130,5 (д), 129,8 (с), 115,0 (д), 70,0 (д), 26,2 (кв), 21,8 (кв).
Стадия 5:
2-6ром-1-[4-(1-метилэтокси)фенил]этанон
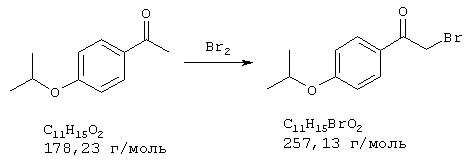
К раствору 1-[4-(1-метилэтокси)фенил]этанона (10,0 г, 56,0 ммоля) в абсолютном диоксане (100 мл) прибавляли по каплям бром (11,7 г, 73,5 ммоля) в абсолютном диоксане (70 мл)/абсолютном эфире (100 мл) за один час и перемешивали 2 часа при комнатной температуре. Реакционную смесь смешивали с сульфитом натрия (5,0 г) в воде (100 мл), фазы разделяли и масляную фазу экстрагировали эфиром (3× 100 мл), объединенные органические фазы промывали водой (2× 100 мл), насыщенным раствором гидрокарбоната натрия (2× 150 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и полученный после отгонки растворителя остаток кристаллизовали из смеси петролейного эфира (25 мл) и циклогексана (25 мл) при -20° С. Указанным способом получали продукт в виде бесцветных быстро темнеющих кристаллов (8,80 г, 59%).
Т.пл.: 36-37° С
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 4:1, Rf=0,7
1H ЯМР (CDCl3): δ 7,93 (д, J=9,5 Гц, 2Н), 6,92 (д, J=9,5 Гц, 2Н), 4,63 (септет, J=6,4 Гц, 1Н), 4,40 (с, 2Н), 1,35 (д, J=6,4 Гц, 6Н);
13С ЯМР (СDС13): δ 189,8 (с), 162,7 (с), 131,4 (д), 126,4 (с), 115,3 (д), 70,3 (д), 30,7 (т), 21,9 (кв).
Стадия 6:
1-(2-бромэтил)-4-(1-метилэтокси)бензол
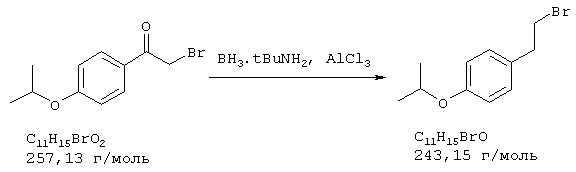
К суспензии безводного хлорида алюминия (5,70 г, 43,0 ммоля) в абсолютном CH2Cl2 (100 мл) при 5° С прибавляли трет-бутиламинборановый комплекс (7,45 г, 85,0 ммоля, гранулы или порошок). Через 15 минут прибавляли по каплям 2-бром-1-[4-(1-метилэтокси)фенил]этанон (7,30 г, 28,4 ммоля) в безводном CH2Cl2 (50 мл) за 30 минут.
Смесь перемешивали три часа при комнатной температуре, смешивали с 0,1 н соляной кислотой (100 мл) и водную фазу экстрагировали СН2Сl2 (2× 30 мл). Объединенные органические фазы промывали 0,1 н соляной кислотой (2× 50 мл), насыщенным раствором гидрокарбоната натрия (2× 50 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь) и полученный после упаривания растворителя остаток очищали перегонкой с шариковым дефлегматором (0,05 мбар/80° С), получая продукт в виде бесцветного масла (5,81 г, 83%).
ТСХ: петролейный эфир, Rf=0,35
1H ЯМР (CDCl3): δ 7,18 (д, J=9,5 Гц, 2Н), 6,87 (д, J=9,5 Гц, 2Н), 4,53 (септет, J=6,4 Гц, 1Н), 3,53 (т, J=6,9 Гц, 2Н), 3,08 (т, J=6,9 Гц, 2Н), 1,33 (д, J=6,4 Гц, 6Н);
13С-ЯМР (CDCl3): δ 156,7 (с), 130,7 (с), 129,5 (д), 115,8 (д), 69,8 (д), 38,5 (т), 33,2 (т), 21,9 (кв).
МТ-35 JOS 1760
C11H15BrO
Вычислено: С, 54,34; Н, 6,22.
Найдено: С, 54,34; Н, 6,09.
Стадия 7:
Диметиловый эфир 2-[2-[4-(1-метилэтокси)фенил]этил]-пропандикислоты
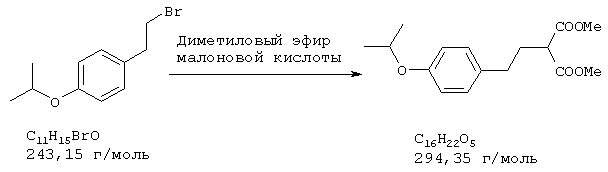
1-(2-бромэтил)-4-(1-метилэтокси)бензол (19,0 г, 78,1 ммоля), диметиловый эфир малоновой кислоты (40,0 г, 300 ммолей) и карбонат калия (42,0 г, 300 ммолей, безводный, свежеразмолотый) в абсолютном ДМФА (400 мл) перемешивали 10 часов при 70° С.
Растворитель удаляли на роторном испарителе и остаток распределяли между водой (250 мл) и эфиром (250 мл). Водную фазу экстрагировали эфиром (1× 100 мл), объединенные органические фазы промывали водой (3× 200 мл) и насыщенным раствором поваренной соли (1× 150 мл), сушили (сульфат натрия/активированный уголь) и из остатка, полученного после отгонки растворителя на роторном испарителе, отгоняли избыток диметилового эфира малоновой кислоты (160° С/15 мбар).
Сырой продукт очищали перегонкой с шариковым дефлегматором (140° С/0,001 мбар), получая продукт в виде бесцветного масла (18,9 г, 82%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 9:1, Rf=0,4
1H ЯМР (CDCl3): δ 7,08 (д, J=10 Гц, 2Н), 6,81 (д, J=10 Гц, 2Н), 4,50 (септет, J=6,5 Гц, 1Н), 3,71 (с, 6Н), 3,32 (т, J=7,5 Гц, 1Н), 2,58 (т, J=7,5 Гц, 2Н), 2,19 (кв, J=7,5 Гц, 2Н), 2,65-2,47 (м, 2Н), 2,26-2,06 (м, 2Н), 1,31 (д, J=6 Гц, 6Н);
13С ЯМР (CDCl3): δ 169,8 (с), 156,3 (с), 132,3 (с), 129,4 (д), 115,9 (д), 69,9 (д), 52,5 (кв), 50,8 (д), 32,4 (т), 30,6 (т), 22,1 (кв).
Стадия 8:
Метиловый эфир 2-[2-6ром-4-метокси-5-(1-метилэтокси)-фенил] метил-2-[2-[4-(1-метилэтокси)фенил]этил]пропандикислоты
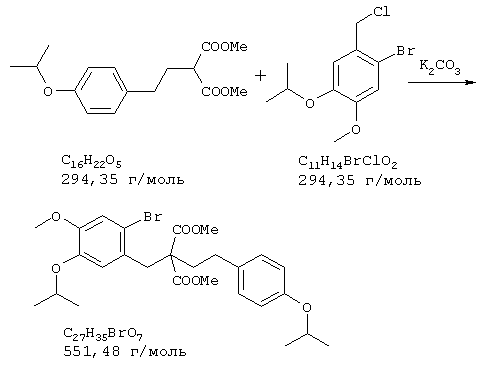
Диметиловый эфир 2-[2-[4-(1-метилэтокси)фенил]этил]-пропандикислоты (18,9 г, 64,2 ммоля), 1-бром-2-(хлорметил)-4-(1-метилэтокси)-5-метоксибензол (18,9 т, 64,2 ммоля) и карбонат калия (45,0 г, 321 ммоль, безводный, свежеразмолотый) в абсолютном ДМФА (300 мл) перемешивали 12 часов при 60° С.
Остаток, оставшийся после удаления растворителя, распределяли между водой (250 мл) и эфиром (250 мл). Водную фазу экстрагировали эфиром (1× 100 мл), объединенные органические фазы промывали водой (3× 200 мл) и насыщенным раствором поваренной соли (150 мл), сушили (сульфат натрия/активированный уголь), фильтровали и удаляли растворитель на роторном испарителе.
После высушивания в высоком вакууме получали продукт в виде бесцветного масла (33,7 г, 95%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 9:1, Rf=0,5
1H ЯМР (CDCl3): δ 7,04 (с, 1Н), 7,01 (д, J=10 Гц, 2Н), 6,79 (д, J=10 Гц, 2Н), 6,73 (с, 1Н); 4,47 (септет, J=6,5 Гц, 1Н), 4,36 (септет, J=6,5 Гц, 1Н), 3,80 (с, 3Н), 3,72 (с, 6Н), 3,48 (с, 2Н), 2,65-2,47 (м, 2Н), 2,26-2,06 (м, 2Н), 1,31 (д, J=6,5 Гц, 12Н);
13С ЯМР (CDCl3): δ 171,4 (с), 156,1 (с), 149,8 (с), 146,2 (с), 133,0 (с), 129,3 (с), 129,1 (д), 118,2 (с), 116,2 (д), 116,0 (д), 115,8 (д), 69,7 (д), 58,7 (с), 55,9 (кв), 52,3 (кв), 37,4 (т), 34,5 (т), 29,9 (т), 21,95 (кв), 21,9 (кв).
МТ-54 JOS 1698
С27Н35ВrO7
Вычислено: С, 58,81; Н, 6,40.
Найдено: С, 59,00; Н, 6,26.
Стадия 9:
Альфа-[[2-6ром-4-метокси-5-(1-метилэтокси)фенил]метил]-4-(1-метилэтокси)бензолбутановая кислота
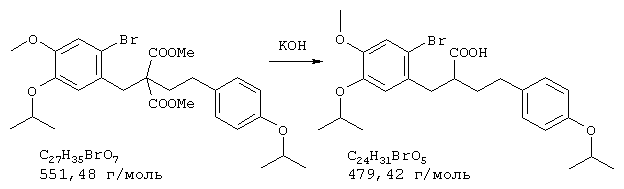
Диметиловый эфир 2-[2-бром-4-метокси-5-(1-метилэтокси)-фенил]-метил-2-[2-[4-(1-метилэтокси)фенил]этил]пропандикислоты (33,7 г, 61,1 ммоля) и гидроксид калия (17,5 г, 312 ммолей) в этаноле (150 мл)/воде (30 мл) перемешивали 12 часов при температуре кипения.
Реакционную смесь подкисляли концентрированной соляной кислотой до рН 1 и выдерживали один час при кипении с обратным холодильником.
Остаток, оставшийся после удаления растворителя, распределяли между водой (250 мл) и эфиром (250 мл). Водную фазу экстрагировали эфиром (2× 100 мл), объединенные органические фазы промывали водой до нейтральной реакции, насыщенным раствором поваренной соли (150 мл), сушили (сульфат натрия/активированный уголь) и фильтровали. Оставшийся после удаления растворителя на роторном испарителе остаток декарбоксилировали в трубке с шаровым расширением 30 минут при 140° С и затем перегоняли при 150° С/0,005 мбар. Указанным способом получали продукт в виде бесцветных кристаллов (27,5 г, 94%).
Т.пл.: 114-116° С
ТСХ: хлорофом:метанол = 9:1, Rf=0,65
1H ЯМР (ДМСО-d6): δ 7,09, (с, 1Н), 7,01 (д, J=7,3 Гц, 2Н), 6,80 (с, 1Н), 6,78 (д, J=7,3 Гц, 2Н), 4,69-4,37 (м, 2Н), 3,72 (с, 3Н), 3,00-2,33 (м, 5Н), 1,99-1,58 (м, 2Н), 1,18 (д, J=6,4 Гц, 12Н);
13С ЯМР (ДМСО6): 176,0 (с), 155,6 (с), 149,3 (с), 145,8 (с), 133,1 (с), 130,3 (с), 129,1 (д), 118,1 (д), 116,0 (д), 115,5 (с), 114,1 (д), 70,6 (д), 69,0 (д), 55,8 (кв), 44,9 (д), 33,5 (т), 31,9 (т), 21,85 (кв), 21,8 (кв).
МТ-100 JOS 1592
С24Н31ВrO5
Вычислено: С, 60,13; Н, 6,52.
Найдено: С, 60,38; Н, 6,55.
Стадия 10:
Амид альфа [[2-бром-4-метокси-5-(1-метилэтокси)фенил]метил]-4- (1-метилэтокси) бензолбутановой кислоты
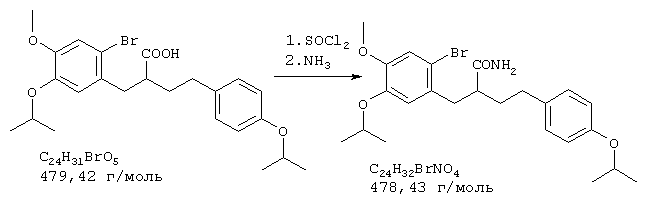
К альфа-[[2-бром-4-метокси-5-(1-метилэтокси)фенил]-метил]-4-(1-метилэтокси)бензолбутановой кислоте (10,0 г, 20,8 ммоля) в CH2Cl2 (100 мл) прибавляли по каплям тионилхлорид (50 мл) при 0° С за 15 минут и смесь перемешивали при той же температуре два часа.
Растворитель удаляли на роторном испарителе, остаток переносили в абсолютный формамид (15 мл) и при 0° С смешивали с аммиаком в формамиде (100 мл насыщенного при указанной температуре раствора). Смесь перемешивали один час при 0° С и выливали в воду (1500 мл).
Выпавшие кристаллы отфильтровывали и извлекали водой (4× 400 мл). Указанным способом получали продукт в форме бесцветных кристаллов (9,21 г, 92%).
Т.пл.: 154-156° С
ТСХ: CH2Cl2:метанол = 9:1, Rf=0,7
1H ЯМР (ДМСО-d6): δ 7,32 (с, 1Н), 7,08 (с, 1Н), 7,02 (д, J=7,3 Гц, 2Н), 6,83 (с, 1Н), 6,80 (с, 1Н), 6,78 (д, J=7,3 Гц, 2Н), 4,68-4,32 (м, 2Н), 3,77 (с, 3Н), 3,39 (с, 3Н), 3,00-2,62 (м, 2Н), 2,00-1,58 (м, 2Н), 1,18 (д, J=6,4 Гц, 12Н);
13С ЯМР (ДМСО-d6): 175,8 (с), 155,5 (с), 149,1 (с), 145,8 (с), 133,5 (с), 130,9 (с), 129,9 (д), 118,1 (д), 115,8 (д), 115,5 (с), 114,1 (д), 70,9 (д), 69,0 (д), 55,8 (кв), 45,9 (д), 34,2 (т), 32,1 (т), 21,85 (кв), 21,8 (кв).
МТ-112 JOS 1591
С24Н32ВrNO4
Вычислено: С, 60,25; Н, 6,74; N, 2,93.
Найдено: С, 59,99; Н, 6,56; N, 2,82.
Стадия 11:
Получение амида альфа-[[2-бром-5-гидрокси-4-метоксифенил] метил]-4-гидроксибензолбутановой кислоты
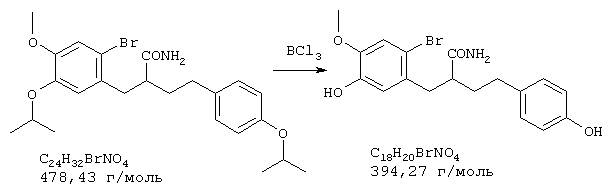
К раствору амида альфа-[[2-бром-5-гидрокси-4-метоксифенил]метил]-4-гидроксибензолбутановой кислоты (9,30 г, 19,4 ммоля) в абсолютном CH2Cl2 (150 мл) при -78° С прибавляли по каплям трихлорид бора (40 мл, 1,6 М в CH2Cl2) и перемешивали при той же температуре один час. Затем смесь нагревали до комнатной температуры и перемешивали 2 часа.
Смешивали с водой (300 мл) и отгоняли растворитель на роторном испарителе, при этом сырой продукт выкристаллизовывался, его отфильтровывали и извлекали водой (6× 200 мл) и диизопропиловым эфиром (2× 40 мл). При этом получили продукт в виде бесцветных кристаллов (6,76 г, 88%).
Т.пл.: 177-179° С.
ТСХ: CH2Cl2: метанол = 9:1, Rf=0,4
1H ЯМР (ДМСО-d6): δ 9,18 (с, 2Н), 7,18 (с, 1Н), 7,04 (с, 1Н), 6,97 (д, J=7,3 Гц, 2Н), 6,72 (с, 1Н), 6,65 (с, 1Н), 6,66 (д, J=7,3 Гц, 2Н), 3,77 (с, 3Н), 3,48 (с, 3Н), 2,92-2,38 (м, 4Н);
13С ЯМР (ДМСО-d6): δ 175,6 (с), 155,5 (с), 147,0 (с), 145,8 (с), 131,3 (с), 129,9 (с), 129,8 (д), 117,9 (с), 115,8 (д), 115,0 (д), 11,9 (д), 56,0 (кв), 48,1 (д), 37,6 (т), 37,0 (т).
МТ-114 JOS 1692
C18H20BrO4
Вычислено: С, 54,84; Н, 5,11; N, 3,55.
Найдено: С, 54,55; Н, 4,90; N, 3,28.
Стадия 12:
Амид 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-окса-6Н-бензо[а]циклогепта[hi]бензофуран-11-карбоновой кислоты
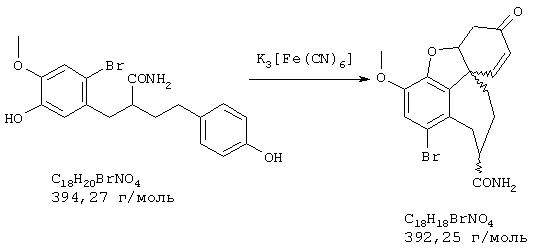
Амид α -[[2-бром-5-гидрокси-4-метоксифенил]метил]-4-гидроксибензолбутановой кислоты (3,00 г, 7,61 ммоля) суспендировали в хлороформе (300 мл) и смешивали с раствором гексацианоферрата(III) калия (13,2 г, 40,0 ммоля) в растворе карбоната калия (75 мл, 10%-ным).
Смесь активно перемешивали при комнатной температуре 40 минут и фильтровали через Hyflo. Водную фазу экстрагировали хлороформом (3× 50 мл), объединенные органические фазы промывали водой (2× 200 мл) и насыщенным раствором поваренной соли (1× 150 мл), сушили (сульфат натрия/силикагель), фильтровали и полученный после упаривания растворителя сырой продукт очищали колоночной хроматографией (50 г силикагеля, этиловый эфир уксусной кислоты). Указанным способом получали продукт в виде бесцветных кристаллов (0,36 г, 12%).
ТСХ: хлороформ: метанол = 9:1, Rf=0,4 и 0,5
1H ЯМР (CDCl3): δ 7,00 (с, 1Н); 6,86 (дд, J=12 Гц, J=1 Гц, 1Н), 6,06 (д, J=1 Гц, 1Н), 5,02 (шир. с, 2Н), 4,70 (с, 1Н), 3,82 (с, 3Н), 3,62 (д, J=16 Гц, 1Н), 3,23 (дд, J=16 Гц, J=3 Гц, 1Н), 3,08-2,89 (м, 1Н), 2,77 (дд, J=16 Гц, J=6 Гц, 1H), 2,62-1,70 (м, 5Н);
13С ЯМР (ДМСО-d6): δ 202,5 (с), 184,9 и 179,1 (с), 146,5 и 146,1 (д), 145,0 и 145,9 (с), 143,3 и 142,0 (с), 132,0 и 131,8 (с), 128,9 и 128,0 (с), 126,7 и 126,2 (д), 116,3 и 115,0 (с), 114,4 (д), 87,4 и 87,3 (д), 56,0 (кв), 49,5 и 49,3 (с), 45,3 (д), 37,3 и 37,0 (т), 35,4 (т), 34,4 (т), 30,4 (т).
Последующий выход диастереомеров
1H ЯМР (СDС13): δ 6,70-6,85 (м, 2Н), 6,07-5,91 (м, 2Н), 4,54 (с, 1Н), 4,12 (с, 1Н), 3,82 (с, 3Н), 2,99 (с, 1Н), 2,86 (т, J=15 Гц, 1Н), 2,72 (д, J=16 Гц, 1Н), 2,63 (дд, J=16 Гц, J=3 Гц, 1Н), 2,30-1,60 (м, 9Н);
13С ЯМР (CDCl3): δ 146,4 (с), 143,9 (с), 133,7 (с), 128,5 (с), 128,1 (д), 127,5 (д), 123,3 (д), 111,7 (д), 88,9 (д), 62,4 (д), 56,3 (кв), 52,8 (д), 48,3 (с), 45,1 (т), 35,8 (т), 35,6 (т), 30,4 (т).
МТ-115 JOS 1585
C18H18BrNO4
Вычислено: С, 55,12; Н, 4,63; N, 3,57.
Найдено: С, 54,91; Н, 4,66; N, 3,41.
Пример 81:
Амид 1-6ром-4α ,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-11-карбоновой кислоты
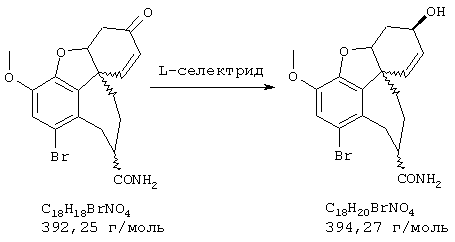
К суспензии амида 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-окса-6Н-бензо[а]циклогепта[hi]бензофуран-11-карбоновой кислоты (860 мг, 2,19 ммоля) в абсолютном ТГФ (5 мл) при 0° С прибавляли за 15 минут L-селектрид® (6,6 мл, 6,6 ммоля, 1 М в ТГФ) и смесь перемешивали 12 часов при комнатной температуре. Гидролизовали водой (3 мл) и распределяли между водой (10 мл) и этиловым эфиром уксусной кислоты (10 мл), экстрагировали водную фазу этиловым эфиром уксусной кислоты (3× 5 мл), промывали объединенные органические фазы 1 н соляной кислотой (3× 10 мл), водой (2× 10 мл), насыщенным раствором гидрокарбоната натрия (1× 10 мл) и насыщенным раствором поваренной соли (1× 10 мл), сушили (сульфат натрия/активированный уголь), фильтровали и очищали полученный после отгонки растворителя сырой продукт колоночной хроматографией (50 г силикагеля, этиловый эфир уксусной кислоты). Указанным способом получали продукт в виде бесцветных кристаллов (741 мг, 86%).
ТСХ: хлороформ:метанол = 9:1, Rf=0,35 и 0,45
1H ЯМР (CDCl3): δ 6,92 (с, 1Н), 6,10-5,89 (м, 2Н), 5,82-5,53 (м, 2Н), 4,54 (с, 1Н), 4,13 (с, 1Н), 3,81 (с, 3Н), 3,51 (д, J=15 Гц, 1Н), 3,05 (дд, J=17 Гц, J=6 Гц, 1Н), 2,96-2,84 (м, 1Н), 2,65 (д, J=16 Гц, 1Н), 2,83 (дд, J=16 Гц, J=6 Гц, 1Н), 2,44-1,40 (м, 9Н);
13С ЯМР (CDCl3): δ 177,7 и 175,2 (с), 145,3 (с), 145,7 (с), 144,2 (с) и 143,9 (с), 133,8 и 134,2 (с), 128,3 и 128,2 (д), 126,5 (д), 116,1 и 115,9 (с), 115,3 и 115,1 (д), 88,5 (д), 61,8 (д), 56,1 (кв), 49,1 и 49,0 (с), 46,0 (д), 41,9 (т), 35,9 и 35,7 (т), 29,8 и 29,6 (т), 28,8 и 26,2 (т).
МТ-120 JOS 1710
C18H20BrNO4
Вычислено: С, 54,84; Н, 5,11; N, 3,55.
Найдено: С, 54,84; Н, 5,18; N, 3,43.
Пример 82:
11-амино-1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо [а]циклогепта[hi] бензофуран-6-ол (SPH-1459)
Бис(трифторацетокси)йодбензол (PIFA, 787 мг, 1,78 ммоля) растворяли в ацетонитриле (3,5 мл, ВЭЖХ-качество) и смешивали с водой (3,5 мл, ВЭЖХ-качество). Затем прибавляли амид 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-11-карбоновой кислоты за 2 часа и смесь перемешивали 24 часа при комнатной температуре. Растворитель отгоняли на роторном испарителе, остаток переносили в хлороформ (5 мл), фильтровали и очищали колоночной хроматографией (30 г силикагеля, хлороформ:метанол:аммиак = 96:3:1). Указанным способом получали продукт в виде бесцветных кристаллов (490 мг, 75%).
ТСХ: хлороформ:метанол = 9:1, Rf=0,2 и 0,25
1H ЯМР (МеОН-d4): δ 7,07 (с, 1Н), 6,12-5,87 (м, 2Н), 5,82-5,53 (м, 2Н), 4,53 (с, 1Н), 4,14 (с, 1Н), 3,80 (с, 3Н), 3,59 (д, J=20 Гц, 1Н), 3,14-2,92 (м, 1Н), 2,47 (д, J=17 Гц, 1Н), 2,16 (с, 3Н), 2,01-2,62 (м, 2Н);
13С ЯМР (MeOH-d4): δ 148,3 и 148,2 (с), 146,5 и 146,1 (с), 135,8 (с), 129,9 и 129,3 (с), 128,5 и 127,9 (д), 125,9 и 123,9 (д), 118,4 и 118,1 (с), 116,9 и 116,0 (д), 118,4 и 118,0 (с), 116,8 и 116,0 (д), 89,0 и 88,9 (д), 62,4 и 62,3 (д), 57,2 (кв), 50,6 и 50,4 (с), 49,8 (д), 38,5 (т), 36,0 и 33,0 (т), 31,8 и 31,0 (т), 31,4 и 28,3 (т).
JOS 1707
C17H20BrNO3·1 СНС13
Вычислено: С, 44,52; Н, 4,36; N, 2,88.
Найдено: С, 44,90; Н, 4,30; N, 2,67.
Пример 83:
11-амино-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-6-ол
Получение медно-цинкового сплава
Порошок цинка (600 мг) и йодид меди(I) под аргоном в воде (4 мл) и этаноле (4 мл) подвергали взаимодействию в ультразвуковой ванне, при этом образовывалась тонкодисперсная суспензия глубокого черного цвета.
Дебромирование
К полученной суспензии прибавляли 11-амино-1-бром-4а,5,9,10,11,12-гескагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-6-ол (80 мг, 0,22 ммоля) и хлорид кальция (300 мг, 2,7 ммоля), и смесь перемешивали 12 часов при температуре кипения. Смешивали с концентрированным водным раствором аммиака (1 мл), удаляли растворитель на роторном испарителе, переносили остаток в хлороформ (15 мл), фильтровали и полученный после упаривания фильтрата на роторном испарителе остаток очищали колоночной хроматографией (30 г силикагеля, хлороформ:метанол:аммиак = 96:3:1). Указанным способом удается разделить и получить в виде бесцветной пены оба оптических изомера (10 мг, 0,04 ммоля изомера А; 26 мг, 0,09 ммоля изомера В; всего 36 мг, 59%).
Выходящий диастереомер
1H ЯМР (СDС13): δ 6,73-6,62 (м, 2Н), 6,05 (с, 2Н), 4,62 (с, 1Н), 4,14 (с, 1Н), 3,82 (с, 3Н), 3,57 (с, 1Н), 3,22 (д, J=16 Гц, 1Н), 2,83 (дд, J=16 Гц, J=6,5 Гц, 1Н), 2,24-1,60 (м, 9Н);
13С ЯМР (CDCl3): δ 146,2 (с), 144,3 (с), 133,6 (с), 128,4 (с), 128,1 (д), 127,2 (д), 124,8 (д), 111,9 (д), 89,0 (д), 62,6 (д), 56,3 (кв), 49,0 (с), 48,3 (д), 41,8 (т), 32,5 (т), 30,4 (т), 30,4 (т).
Последующий выход диастереомера
1H ЯМР (СDС13): δ 6,70-6,58 (м, 2Н), 6,07-5,91 (м, 2Н), 4,54 (с, 1Н), 4,12 (с, 1Н), 3,82 (с, 3Н), 2,99 (с, 1Н), 2,86 (т, J=15 Гц, 1Н), 2,72 (д, J=16 Гц, 1Н), 2,63 (дд, J=16 Гц, J=3 Гц, 1Н), 2,30-1,60 (м, 9Н);
13С ЯМР (CDCl3): δ 146,4 (с), 143,9 (с), 133,7 (с), 128,5 (с), 128,1 (д), 127,5 (д), 123,3 (д), 111,7 (д), 88,9 (д), 62,4 (д), 56,3 (кв), 52,8 (д), 48,3 (с), 45,1 (т), 35,8 (т), 35,6 (т), 30,4 (т).
Схема для примера 83:
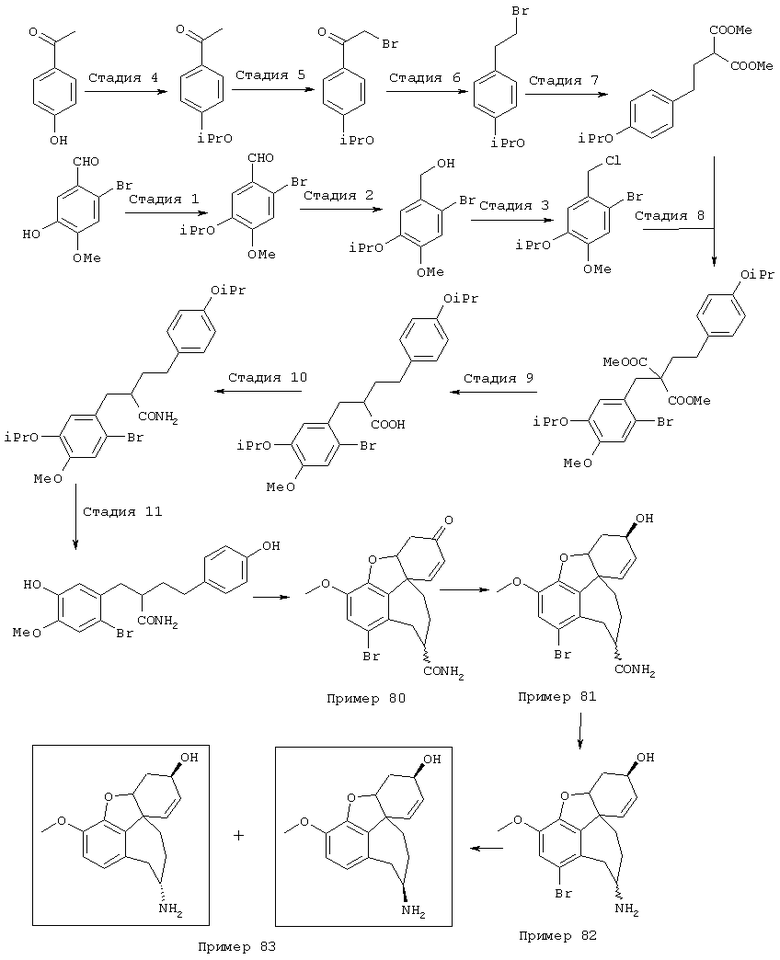
Пример 84:
Стадия 1:
Конденсация и восстановление: общая методика
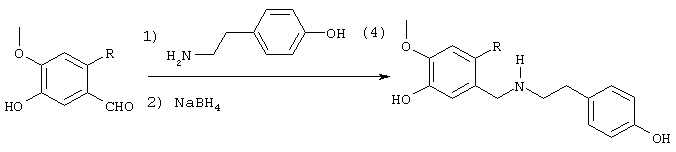
1 экв. 2-метил-4-метокси-5-гидроксибензальдегида или 2,4-диметокси-5-гидроксибензальдегида;
1 экв. тирамина;
0,8 экв. боргидрида натрия;
10 мл этанола (96%-ного)/1 г альдегида.
Исходную смесь суспендировали в этаноле и при перемешивании прибавляли тирамин, затем реакционную смесь нагревали 8,5 час с обратным холодильником. Поскольку образовавшееся основание Шиффа (МН-16' или 34') на ТСХ-пластинке снова разлагается на исходные материалы, дальнейший ход реакции рассчитывали путем восстановления малой пробы боргидридом натрия обычным способом и нанесением полученного продукта.
Через 8,5 час реакционную смесь охлаждали на ледяной бане до 0° С и медленно прибавляли по каплям боргидрид натрия, растворенный в 4 мл воды/1 г, затем перемешивали 30 мин на ледяной бане. Наконец при активном перемешивании выливали на 150 мл льда с водой/1 г альдегида, полученный осадок отфильтровывали и сушили в вакуумном сушильном шкафу. Из маточного раствора выпадала вторая фракция продукта, который собирали и сушили.
Пример 84:
Стадия 1а:
5-(N-[2-[4-гидроксифенил]этил]аминометил)-2-метокси-4-метилфенол (МН-16)
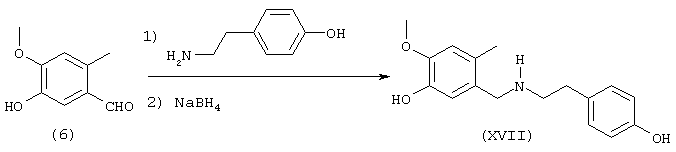
27,8 г (168 ммоля) 2-метил-4-метокси-5-гидроксибензальдегида(6);
23,0 г (168 ммоля) тирамина;
5,20 г (134 ммоля = 0,8 экв.) боргидрида натрия.
Выход: 43,4 г (161 ммоль = 96% от теории) бежевого порошка
C17H21NO3 [287,36]
TCX: Rf=0,21 (СНС13:МеОН=9:1+1% конц. NH4OH)
Т.пл.: 122-124° С
Вычислено, %: С 71,06; Н 7,37; N 4,87.
Найдено, %: С 71,07; Н 7,41; N 4,86.
1H-ЯМР (200 МГц, ДМСО-d6): δ 6,90 (м, 2Н), 6,67 (с, 1Н), 6,62 (м, 2Н), 6,55 (с, 1Н); 3,72 (с, 3Н); 3,51 (с, 2Н); 2,73 (т, J=6,5 Гц, 2Н); 2,60 (т, J=6, 5 Гц, 2Н); 2,10 (с, 3Н); 13С-ЯМР (50 МГц, ДМСО-d6): δ 155,4 (с), 145,8 (с), 143,9 (с), 130,9 (с), 130,4 (с), 129,3 (д), 126,0 (с), 116,2 (д), 115,0 (д), 114,3 (д), 55,7 (кв), 51,1 (т), 50,3 (т), 35,0 (т), 17,9 (кв).
Пример 84
Стадия lb:
5-(N-[2-[4-гидроксифенил]этил]аминометил)2,4-диметоксифенол (МН-34)
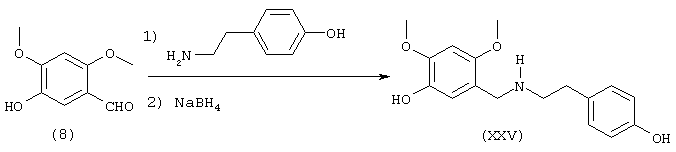
18,85 г (103,47 ммоля) 5-гидрокси-2,4-диметоксибенз-альдегида (8);
14,21 г (103,47 ммоля) тирамина;
3,13 г (82,74 ммоля = 0,8 экв.) NaBH4;
200 мл этанола 96%;
выход: 28,1 г = 92,63 ммоля = 89,5% от теории
C17H21NO4 [303,36]
TCX: Rf=0,14 (СНС13:МеОН=9:1+1% конц. NH4OH)
Т.пл.: 170-173° С
C17H21NO4 [303,36] (загрязнен алифатическим веществом С15Н32, смазкой шлифа)
Вычислено, %: С 67,31; Н 6,98; N 4,62.
Найдено, %: С 68,10; Н 7,04; N 4,66.
1H-ЯМР (200 МГц, ДМСО-d6): δ 6,95 (м, 2Н), 6,70 (с, 1Н), 6,64 (м, 2Н), 6,57 (с, 1Н), 3,75 (с, 3Н), 3,66 (с, 3Н), 3,52 (с, 2Н), 2,59 (шир.с, 4Н);
13С-ЯМР (50 МГц, ДМСО-d6): δ 155,3 (с), 149,9 (с), 146,3 (с), 139,7 (с), 130,4 (с), 129,3 (д), 120,4 (с), 116,6 (д), 115,0 (д), 98,4 (д), 56,0 (кв + кв), 50,6 (т), 47,1 (т), 35,0 (т).
Пример 84:
Стадия 2:
Формилирование: общая методика
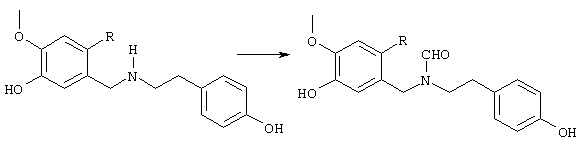
1 экв. амина
2 экв. эфира муравьиной кислоты (этилового или метилового);
10 мл 1,4-диоксана, перегнанного/1 г амина;
0,2 мл диметилформамида/1 г амина
каталитическое количество муравьиной кислоты.
Все реагенты нагревали вместе с обратным холодильником (в случае необходимости несколько раз добавляли муравьиную кислоту) и реакционную смесь после окончания реакции упаривали в вакууме досуха. Твердый остаток вносили в 10 мл метанола/1 г амина и при перемешивании порциями прибавляли 50 мл воды со льдом/1 г амина, при этом суспензию промежуточного продукта гидролизом превращали в хлопьевидный конечный продукт, который отсасывали и сушили.
Пример 84/стадия 2а
N-((5-гидрокси-4-метокси-2-фенилметил)-N-(2-[4-гидроксифенил]этил)]формамид (МН-18)
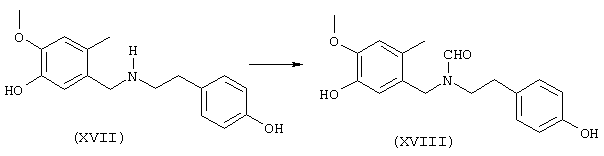
55,0 г (191 ммоль) 5-N-[2-[4-гидроксифенил]этил]-аминометил)-2-метокси-4-метилфенола (XVII);
23,5 мл (383 ммоля = 2 экв.) метилового эфира муравьиной кислоты;
11,0 мл ДМФА;
1,50 мл муравьиной кислоты;
400 мл 1,4-диоксана.
Обработку осуществляли через 7 ч.
Выход: 49,8 г (158 ммолей = 82,6% от теории) бежевого порошка
C18H21NO4 [315,37]
ТСХ: Rf=0,35 (СНС13:МеОН=9:1+1% конц. NH4OH)
Т.пл.: 170-171° С
Вычислено, %: С 68,55; Н 6,71; N 4,44.
Найдено, %: С 68,77; Н 6,86; N 4,14.
1H-ЯМР (200 МГц, ДМСО-d6): δ 9,20 (с, 1Н), 8,74 (д, J=15,3 Гц, 1H), 8,19 (с, 0,5Н), 7,88 (с, 0,5Н), 7,00-6,87 (м, 2Н), 6,74 (с, 1H), 6,72-6,56 (м, 2Н), 6,59 (с, 1H), 4,31 (с, 1H), 4,23 (с, 1H), 3,73 (с, 3Н), 3,21 (дд, J=15,3, 7,6 Гц, 2Н), 2,60 (т, J=7,6 Гц, 2Н), 2,12 (с, 3Н); 13С-ЯМР (50 МГц, ДМСО-d6): δ 162,7 и 162,3 (д), 155,7 (с), 146,7 и 146,5 (с), 144,4 и 144,2 (с), 129,7 и 129,4 (д), 128,9 и 128,4 (с), 126,5 (с), 126,4 и 126,3 (с), 116,3 и 115,9 (д), 115,1 (д), 114,6 и 114,4 (д), 55,6 (кв), 48,0 и 47,4 (т), 43,3 и 41,6 (т), 33,2 и 31,9 (т), 18,1 и 18,0 (кв), 43,3 и 41,6 (т), 33,2 и 31,9 (т), 18,1 и 18,0 (кв).
Пример 84/стадия 2b
N-(2-(4-гидроксифенил)этил)-N-((5-гидрокси-2,4-диметоксифенил) метил)формамид (МН-35)
27 г (89 ммолей) 5-(N-[2-[4-гидроксифенил]этил]амино-метил)-2,4-диметоксифенола (XXV);
14,4 мл (178 ммолей) этилового эфира муравьиной кислоты;
200 мл 1,4-диоксана;
5,5 мл диметилформамида;
2 мл муравьиной кислоты.
Переработку осуществляли через 24 ч, муравьиную кислоту добавляли в течение нескольких часов 3 порциями.
Выход: 26,13 г (78,85 ммоля = 88,6% от теории) бежевого порошка
C18H21NO5 [331,37]
ТСХ: Rf=0,53 (СНСl3:МеОН = 9:1 + 1% конц. NH4OH)
Т.пл.: 130-132° С
Вычислено, %: С 65,24; Н 6,39; N 4,23.
Найдено, %: С 64,97; Н 6,40; N 4,18.
1H-ЯМР (200 МГц, ДМСО-d6): δ 9,18 (шир.с, 1 Н), 8,48 (д, J=7,4 Гц, 1Н), 8,16 (с, 0,5Н), 7,86 (с, 0,5Н), 6,98-6,87 (м, 2Н), 6,71-6,58 (м, 4Н), 4,31 (с, 1Н), 4,19 (с, 1Н), 3,78 (с, 3Н), 3,75 (с, 3Н), 3,21 (дд, J=16,4, 7,7 Гц, 2Н), 2,69-2,55 (м, 2Н); 13С-ЯМР (50 МГц, ДМСО-d6): δ 162,7 и 162,5 (д), 155,7 и 155,6 (с), 150,6 и 150,3 (с), 146,7 и 147,3 (с), 140,1 и 139,9 (с), 129,6 и 129,3 (д), 129,0 и 128,4 (с), 116,8 и 116,4 (д), 116,2 и 115,9 (с), 115,1 (д), 98,5 и 98,4 (д), 56,3 и 56,2 (кв), 55,9 (кв), 47,9 и 45,2 (т), 43,0 и 38,3 (т), 33,4 и 31,9 (т).
Пример 84/стадия 3
Фенольное окислительное сочетание: 1-метилгалантамин (XV)
[(± )-(4аα , 8aR*)]-4a,5,9,10,11,12-гексагидро-3-метокси-1-метил-6-оксо-6Н-бензофуро[3а,3,2-ef][2]бензазепин-11-карбоксальдегид, 1-метил-N-формилнарведин (MB-19)
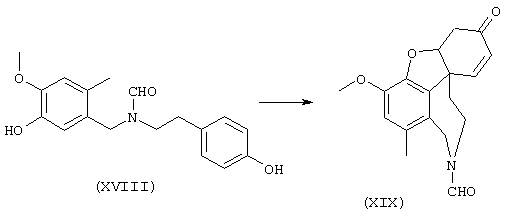
11,4 г (69,8 ммоля) N-((-5-гидрокси-4-метокси-2-фенилметил)-N-(2-[4-гидроксифенил]этил)]формамида (XVIII);
47,0 г (338 ммолей) карбоната калия;
47,0 г (142 ммоля) гексацианоферрата(III) калия;
1,60 л толуола;
470 мл воды;
40,0 г Hyflo.
Карбонат калия, гексацианоферрат(III) калия, воду и толуол нагревали в четырехлитровой четырехгорлой колбе до 80° С и при сильном механическом перемешивании высыпали исходную смесь. Температуру поддерживали при 80° С 1 час, затем прибавляли Hyflo и перемешивали 10 минут. Реакционную смесь упаривали и твердый остаток промывали 1 × водой и 3 × горячим толуолом. Толуольную фазу отделяли от водной фазы и последнюю экстрагировали толуолом. Органические фазы объединяли, растворитель отгоняли и продукт сушили в вакуумном сушильном шкафу.
Выход: 6,17 г (19,7 ммоля = 55,0% от теории) светло-желтого порошка
C18H19NO4 [313,39]
ТСХ: Rf=0,48 и 0,42 (2 ротамера) (СНС13:МеОН=9:1+1% конц. NH4OH)
Т.пл.: разложение > 215° С
Вычислено, %: С 69,00; Н 6,11; N 4,47.
Найдено, %: С 68,78; Н 6,33; N 4,40.
1H-ЯМР (смесь 2 ротамеров, 200 МГц, ДМСО-d6): δ 8,18 (с, 0,2Н), 8,10 (с, 0,8Н), 7,25 (дд, J=10,4, 1,9 Гц, 0,8Н), 7,15 (дд, J=10,4, 1,9 Гц, 0,2Н), 6,73 (с, 0,2Н), 6,69 (с, 0,8Н), 5,95 (д, J=10,3 Гц, 0,8Н), 5,93 (д, J=10,3 Гц, 0,2Н), 5,14 (д, J=15,4 Гц, 0,8Н), 4,83 (д, J=15,4 Гц, 0,2Н), 4,67 (шир.с, 1Н), 4,51 (д, J=15,4 Гц, 0,2Н), 4,07 (д, J=15,4 Гц, 0,8Н), 3,97 (шир.с, 1Н), 3,78-3,60 (м, 4Н) 3,07 (дд, J=17,4, 3,4 Гц, 1Н), 2,78 (дд, J=17,4, 1,9 Гц, 1Н), 2,33 (с, 3Н), 2,30 (с, 0,8Н), 2,22 (с, 0,2Н), 1,86 (дт, J=13,5, 3,7 Гц, 1Н); 13Н-ЯМР (смесь 2 ротамеров, 50 МГц, ДМСО-d6): δ 194,9 (с), 162,8 и 162,1 (д), 145,2 и 144,8 (д), 145,5 и 145,3 (с), 142,9 и 142,8 (с), 130,6 и 130,3 (с), 128,2 (с), 127,5 и 127,0 (с), 126,4 и 126,2 (д), 114,5 и 114,2 (д), 87,0 и 86,8 (д), 55,6 (кв), 49,2 и 49,0 (с), 47,4 и 45,6 (т), 41,8 и 40,1 (т), 37,7 (т), 37,5 (т), 37,4 (т), 34,1 (т), 19,2 и 18,9 (кв).
Пример 85
[(± )-(4аα ,6β ,8aR*)]-4а,5,9,10,11,12-гексагидро-3-метокси-1-метил-6Н-бензофуро[3а,3,2-еf][2]бензазепин-6-ол, 1-метил-N-деметилгалантамин (МН-20)
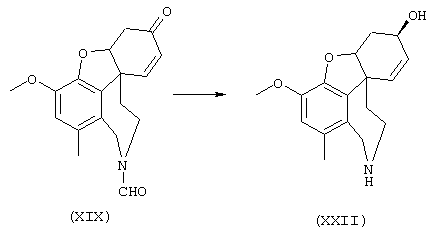
500 мг (1,60 ммоля) 1-метил-N-формилнарведина (XIX);
6,00 мл (6,06 ммоля = 3,78 экв.) L-селектрида 1 М в ТГФ;
12,0 мл абс. ТГФ.
Суспензию тонко измельченных исходных веществ в абс. ТГФ охлаждали до 0° С и затем прибавляли по каплям L-селектрид, причем наблюдали повышение температуры до 5° С. Перемешивали при 0° С 1 час, при этом образовывался прозрачный раствор. Через 70 мин добавляли 5 капель воды и 1 мл конц. водного аммиака, 10 мин перемешивали и затем реакционную смесь наполовину упаривали в вакууме. Наконец, прибавляли еще один раз 10 мл аммиака и раствор экстрагировали метиленхлоридом. Объединенные органические фазы промывали один раз разбавленным раствором аммиака, сушили над сульфатом натрия, фильтровали и растворитель упаривали. Полученное светло-красное масло очищали через колонку с силикагелем.
Выход: 440 мг (1,53 ммоля = 96,0% от теории) бесцветного масла
C17H21NO3 [287,36]
ТСХ: Rf=0,39 (СНС13:МеОН=9:1+1% NH4OH)
C17H21NO3×0,8 H2O [301,76]
Вычислено, %: С 67,66; Н 7,55; N 4,64.
Найдено, %: С 67,60; Н 7,40; N 4,65.
1H-ЯМР (200 МГц, СDС13): δ 6,51 (с, 1Н), 6,06 (д, J=10,2 Гц, 1Н), 5,97 (дд, J=10,2, 4,5 Гц, 1Н), 4,57 (шир.с, 1Н), 4,27 (д, J=16,0 Гц, 1Н), 4,11 (т, J=4,4 Гц, 1Н), 3,80 (с, 3Н), 3,77 (д, J=16,0 Гц, 1Н), 3,40-3,10 (м, 2Н), 2,65 (дд, J=15,6, 3,2 Гц, 1Н), 2,23 (с, 3Н), 1,99 (ддд, J=15,6, 4,9, 2,3 Гц, 1Н), 1,89-1,63 (м, 2Н); 13С-ЯМР (50 МГц, CDCl3): δ 144,4 (с), 142,9 (с), 133,4 (с), 130,5 (с), 127,8 (с), 127,5 (д), 127,1 (д), 113,5 (д), 88,1 (д), 61,4 (д), 55,8 (кв), 49,0 (с), 48,9 (т), 46,9 (т), 39,7 (т), 29,8 (т), 19,4 (кв).
Пример 86
[(± )-4aα ,8aR*)]-4a,5,9,10,11,12-гексагидро-3-метокси-1,4'-диметил-спиро[-6Н-бензофуро[3a,3,2-ef][2]бензазепин]-6,2'-[1,3]-диоксолан]-11-карбоксальдегид, 1-метил-N-формил-нарвединкеталь (МН-21)
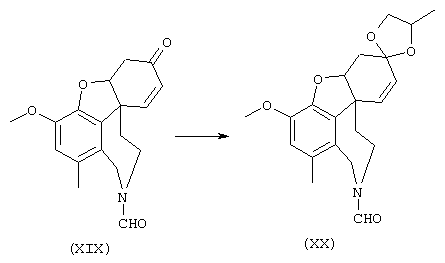
6,17 г (19,7 ммоля) 1-метил-N-формилнарведина (XIX);
40,0 мл толуола;
375 мг (1,97 ммоля) п-толуолсульфокислоты;
11,1 мл (149 ммолей) полиэтиленгликоля.
В колбу с водоотделителем загружали исходное вещество в толуоле и прибавляли 1/3 п-толуолсульфокислоты с 2/3 пропиленгликоля. Реакционную смесь нагревали с обратным холодильником и через 2 час порциями прибавляли остальную п-толуолсульфокислоту в пропиленгликоле в течение 5 час, затем кипятили с обратным холодильником 6 ч. После окончания реакции (необходим контроль ВЭЖХ, так как ТСХ мало показательна) толуольную фазу отделяли и пропиленгликольную фазу экстрагировали до исчерпывания толуолом. Объединенные толуольные фазы экстрагировали 2 × уксусной кислотой (8%-ная в воде), 2 × насыщенным раствором бикарбоната натрия и 2 × водой, затем растворитель удаляли.
Выход: 5,34 г (14,38 ммоля = 73% от теории) бежевой пены
C21H25NO5 [371,44]
ТСХ: Rf=0,71 (СНС13:МеОН=9:1)
C21H25NO5×0,85 H2O [386,74]
Вычислено, %: С 65,22; Н 6,96; N 3,62.
Найдено, %: С 65,39; Н 7,19; N 3,52.
1H-ЯМР (смесь диастереомеров и ротамеров, 200 МГц, CDCl3): δ 8,14-8,01 (м, 1Н), 7,30-7,09 (м, 2Н), 6,51 (с, 1Н), 6,22-5,97 (м, 1Н), 5,85-5,61 (м, 1Н), 5,38 и 4,77 (д, J=15,7 Гц, 1Н), 4,49 (шир.с, 1Н), 4,37-4,01 (м, 2Н), 3,93-3,74 (м, 5Н), 3,71-3,10 (м, 1Н), 2,79-2,58 (м, 1H), 2,41 (с, 2Н), 2,32 (д, J=10,2 Гц, 3Н), 2,25-1,74 (м, 3Н); 13Н-ЯМР (смесь диастереомеров и ротамеров, 50 МГц, СDС13): δ 162,5 (д), 161,7 (д), 143,7 (с), 143,6 (с), 143,3 (д), 142,7 (д), 129,9 (с), 129,6 (с), 127,8 (д), 127,6 (д), 126,0 (с), 125,7 (с), 114,6 (д), 114,4 (д), 87,5 (д), 87,4 (д), 68,2 (д), 68,0 (т), 56,1 (кв), 56,0 (кв), 49,2 (с), 49,0 (с), 48,7 (т), 46,7 (т), 43,2 (т), 41,2 (т), 38,7 (т), 37,2 (т), 37,1 (т), 34,8 (т), 19,7 (кв), 19,4 (кв), 18,9 (кв).
[(± )-(4aα ,8aR*)]-4а,5,9,10,11,12-гексагидро-3-метокси-1,11-диметил-6Н-бензофуро[3а,3,2-еf][2]бензазепин-6-он, 1-метилнарведин (МН-22)
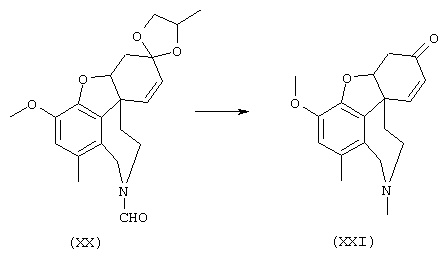
5,34 г (14,4 ммоля) 1-метил-N-формилнарвединкеталя (XX);
25,2 мл (25,2 ммоля = 1,75 экв.) алюмогидрида лития 1М в ТГФ;
20 мл абс. ТГФ.
1-Метил-N-формилнарведин (V) растворяли в абс. ТГФ и при перемешивании порциями прибавляли алюмогидрид лития. Через 15 мин реакционную смесь смешивали с 10 мл толуола, затем гидролизовали 1,5 мл воды и после добавления 1,5 мл раствора едкого натра (15% в воде) перемешивали 15 мин После прибавления 1,5 г Hyflo нагревали 1 час с обратным холодильником, отфильтровывали, фильтровальный осадок кипятили 3 × с по 10 мл толуола: ТГФ=1:1 и отсасывали. Органические фазы упаривали досуха, смешивали с 25 мл 4 н НСl и перемешивали 25 мин при 60° С, затем исчерпывающе экстрагировали этилацетатом. Объединенные органические фазы экстрагировали этилацетатом. Объединенные органические фазы снова промывали разбавленной НСl. Объединенные кислые водные фазы освобождали от избыточного этилацетата перегонкой, затем подщелачивали конц. водным аммиаком и до исчерпывания экстрагировали хлороформом. Объединенные хлороформные фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель удаляли. Очистку осуществляли перекристаллизацией из диизопропилового эфира:этилацетата = 9:1.
Выход: 4,01 г (13,36 ммоля = 93% от теории) желтых, очень тонких иглообразных кристаллов
C18H21NO3 [229,37]
ТСХ: Rf=0,43 (СНС13:МеОН=96:5)
Т.пл.: 121-122° С
Вычислено, %: С 72,22; Н 7,07; N 4,68.
Найдено, %: С 71,95; Н 7,08; N 4,57.
1H-ЯМР (200 МГц, CDCl3): δ 7,01 (дд, J=10,4, 1,6 Гц, 1H), 6,56 (с, 1H), 5,99 (д, J=10,4 Гц, 1Н), 4,68-4,62 (м, 1H), 3,97 (д, J=15,7 Гц, 1H), 3,80 (с, 3Н), 3,79 (д, J=15,7 Гц, 1H), 3,22-2,95 (м, 3Н), 2,71 (дд, J=17,8, 3,7 Гц, 1H), 2,44 (с, 3Н), 2,23 (с, 3Н), 2,20-2,01 (м, 1H), 1,87 (дт, J=13,8, 3,4 Гц, 1H); 13С-ЯМР (50 МГц, CDCl3): δ 194,4 (с), 145,2 (с), 142,9 (с), 131,0 (с), 128,9 (с), 126,8 (д+д+с), 114,3 (д), 87,7 (д), 55,9 (кв), 55,8 (т), 54,1 (т), 48,9 (с), 43,5 (кв), 37,1 (т), 33,4 (т), 19,4 (кв).
[(± )-(4аα ,6β ,8aR*)]-4a,5,9,10,11,12-гексагидро-3-метокси-1,11-диметил-6Н-бензофуро[3а,3,2-еf][2]бензоазепин-6-ол, 1-метилгалантамин (МН-30)
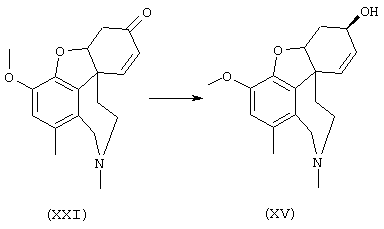
170 мг (0,57 ммоля) 1-метилнарведина (XXI);
0,70 мл (0,68 ммоля) = 1,2 экв.) L-селектрида® 1М в ТГФ;
5 мл абсолютного ТГФ.
Исходную смесь под азотом помещали в ТГФ и охлаждали до -25° С, затем медленно прибавляли по каплям L-селектрид. Перемешивали 30 мин при -15° С, причем первоначальная суспензия становилась прозрачным раствором. Затем реакционную смесь через 1 час доводили до комнатной температуры, гидролизовали 5 каплями воды, перемешивали 30 мин, прибавляли 0,5 мл конц. водным NH4ОH, перемешивали еще 10 мин, снова добавляли 2 мл конц. NH4ОH и, наконец, экстрагировали метиленхлоридом. Объединенные органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель упаривали, получая 350 мг сырого продукта. Указанный сырой продукт очищали через силикагель (СНС13:МеОН=9:1), получая желтое масло, которое затвердело при добавлении эфира.
Выход: 120 мг (0,398 ммоля = 70% от теории) бесцветного порошка
С18Н23NO3 [301,39]
ТСХ: Rf=0,43 (СНСl3:МеОН=95:5), не отделять от исходной смеси
1H-ЯМР (200 МГц, СDС13): δ 6,54 (с, 1Н), 6,10 (дд, J=10,2, 1,2 Гц, 1Н), 5,98 (дд, J=10,2, 4,7 Гц, 1Н), 4,56 (шир.с, 1Н), 4,12 (шир.с, 1Н), 3,99 (д, J=15,6 Гц, 1Н), 3,82 (с, 3Н), 3,81 (д, J=15,6 Гц, 1Н), 3,20 (ддд, J=14,2, 12,1, 2,1 Гц, 1Н), 2,96 (дт, J=14,2, 3,4 Гц, 1Н), 2,65 (ддд, J=15,7, 3,2, 1,5 Гц, 1Н), 2,41 (с, 3Н), 2,24 (с, 3Н), 1,99 (ддд, J=15,5, 5,0, 2,5 Гц, 2Н), 1,60 (ддд, J=13,7, 4,0, 2,4, Гц, 1Н); 13С-ЯМР (50 МГц, СDСl3): δ 144,0 (с), 143,0 (с), 133,4 (с), 128,9 (с), 127,4 (д+д), 127,0 (с), 126,6 (с), 113,6 (д), 88,3 (д), 61,9 (д), 55,7 (кв), 55,4 (т), 53,8 (т), 48,2 (с), 42,7 (кв), 33,8 (т), 29,8 (т), 19,4 (кв).
Получение гидробромида:
Реакционный раствор гидролизовали этанолом (примерно половиной реакционного объема), перемешивали 30 мин, затем доводили конц. НВr до рН≤ 1 и перемешивали в течение ночи. Полученный осадок отсасывали, промывали этанолом и сушили.
Т.пл. 246-250° С (гидробромид)
C18H24NO3Br× 0,5 H2O [391,30]
Вычислено, %: С 55,25; Н 6,44; N 3,58.
Найдено, %: С 55,21; Н 6,39; N 3,56.
Пример 89
[(± )-(4аα ,6α ,8аR*)]-4а,5,9,10,11,12-гексагидро-3-метокси-1,11-диметил-6Н-бензофуро[3а,3,2-ef] [2] бензазепин-6-ол, 1-метилэпигалантамин (MH-31)
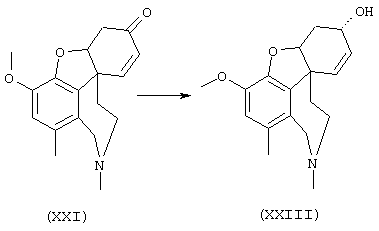
2,00 г (6,68 ммоля) 1-метилнарведина (XXI);
150 мл метанола;
2,50 г (6,68 ммоля) гептагидрата трихлорида церия;
0,50 г (13,4 ммоля) = 2 экв. NaBH4.
Исходное вещество растворяли при нагревании в метаноле и затем охлаждали до 0° С, прибавляли СеСl3×7Н2O и перемешивали примерно 30-60 мин при 0° С. Далее прибавляли порциями NaBH4, перемешивали следующие 2 час при 0-5° С; при этом образовался осадок. Реакционную смесь гидролизовали 5 мл 2 н НСl, отгоняли метанол в вакууме, остаток смешивали со 150 мл 2 н НСl, подщелачивали конц. NH4OH (фиолетовый осадок), экстрагировали этилацетатом, объединенные органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель отгоняли. В качестве сырого продукта получили смесь изомеров 1-метилэпигалантамина и 1-метилгалантамина в соотношении около 5:1, которую можно разделить путем хроматографии (силикагель, СНС13:МеОН=9:1+0,5% NH4OH).
Выход: 1,34 г (4,45 ммоля = 66,6% от теории) бесцветного масла
C18H23NO3 [301,39]
ТСХ: Rf=0,20 (СНС13:МеОН=9:1)
1H-ЯМР (200 МГц, CDCl3): δ 6,51 (с, 1Н), 6,10 (д, J=10,2 Гц, 1Н), 5,79 (д, J=10,2 Гц, 1Н), 4,69-4,56 (м, 1Н), 4,55 (шир.с, 1Н), 3,96 (д, J=15,3 Гц, 1Н), 3,82 (с, 3Н), 3,79 (д, J=15,3 Гц, 1Н), 3,21 (тд, J=13,1, 1,7 Гц, 1Н), 2,97 (дт, J=14,1, 3,3 Гц, 1Н), 2,75 (дддд, J=14,1, 5,3, 4,0, 1,2 Гц, 1Н), 2,38 (с, 3Н), 2,23 (с, 3Н), 2,10 (дд, J=13,1, 3,2 Гц, 1Н), 2,03 (шир.с, 1Н), 1,69 (ддд, J=13,6, 10,7, 2,6 Гц, 2Н); 13С-ЯМР (50 МГц, CDCl3): δ 145,0 (с), 142,9 (с), 133,5 (с), 131,7 (д), 128,5 (с), 126,7 (д), 126,6 (с), 113,5 (д), 88,3 (д), 63,1 (д), 55,8 (кв), 55,2 (т), 54,1 (т), 48,3 (с), 42,6 (кв), 34,6 (т), 32,4 (т), 19,5 (кв).
Получение гидробромида:
Полученный 1-метилэпигалантамин помещали в этанол и подкисляли конц. НВг до рН 1. Гидробромид выкристаллизовывали на холоду и полученный осадок отсасывали, промывали холодным этанолом и сушили.
Т.пл.: 254-255° С (гидробромид)
C18H24NO3Br× 0,5 Н2О [391,30]
Вычислено, %: С 56,25; Н 6,44; N 3,58.
Найдено, %: С 56,28; Н 6,21; N 3,57.
Пример 90
[(± )-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-3-метокси-1-метил-6Н-бензофуро[3a,3,2-ef][2]бензазепин-6-ол, 1-метил-N-деметилэпигалантамин
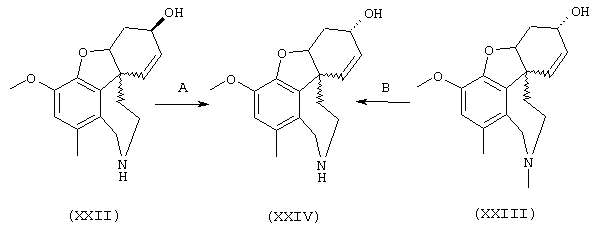
Способ А (эпимеризация l-метил-N-деметилгалантамина (XXII))
Стадия 1 (ацетилирование): [(± )-(4аα ,6α ,8aR*)]-6-О-ацетилокси-4а,5,9,10,11,12-гeкcaгидpo-3-мeтoкcи-l-метил-6H-бензофуро[3а,3,2-еf] [2]бензазепин (МН-67)
100 мг (0,35 ммоля) 1-метил-N-деметилгалантамина (XXII);
0,50 мл (1,74 ммоля = 5экв.) N,N-диметилформамид-бис (2,2-диметилпропил)ацеталя;
0,10 мл (1,74 ммоля = 5 экв.) ледяной уксусной кислоты;
12 мл толуола.
Исходное вещество нагревали в 10 мл толуола под азотом до 80° С и через 1 час прибавляли по каплям смесь N,N-диметилформамид-бис (2,2-диметилпропил) ацеталя и ледяной уксусной кислоты в 2 мл толуола. После выдерживания 22 ч при 80° С охлажденную толуольную фазу экстрагировали 1 × водой и затем 1 н соляной кислотой, кислотные водные фазы подщелачивали концентрированным раствором аммиака, экстрагировали этилацетатом, органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель отгоняли. Остаток очищали колоночной хроматографией
(СНС13:МеОН=95:5).
Выход: 45 мг (0,14 ммоля = 39% от теории) бесцветного масла
C19H23NO4 [329,40]
ТСХ: Rf=0,20 (СНС13:МеОН=95:5)
1H-ЯМР (200 МГц, CDCl3): δ 6,50 (с, 1H), 6,14 (д, J=10,2 Гц, 1H), 5,72 (д, J=10,2 Гц, 1H), 5,67-5,58 (м, 1H), 4,57 (шир.с, 1Н), 4,24 (д, J=16,0 Гц, 1Н), 3,83 (с, 3Н), 3,75 (д, J=16,0 Гц, 1H), 3,40-3,09 (м, 2Н), 2,90-2,70 (м, 1H), 2,23 (с, 3Н), 2,07 (с, 3Н), 2,01-1,73 (м, 3Н); 13С-ЯМР (50 МГц, СDС13): δ 170,2 (с), 145,3 (с), 142,8 (с), 133,0 (с), 130,5 (с), 128,4 (д), 127,2 (д), 127,0 (с), 113,5 (д), 87,3 (д), 66,4 (д), 55,8 (кв), 48,8 (с+т), 47,1 (т), 40,4 (т), 28,2 (т), 21,1 (кв), 19,4 (кв).
Стадия 2: Гидролиз сложного эфира (МН-78)
17 мг (0,05 ммоля) 6-O-ацетил-1-метил-N-деметил-эпигалантамина (ХХIIа);
0,5 мл метанола;
0,1 мл 2 н КОН;
17 мг (0,12 ммоля) = 2,4 экв. карбоната калия.
Реагенты перемешивали вместе при комнатной температуре.
После окончания реакции смешивали с 1 мл воды. Метанол отгоняли, подкисляли 4 мл 2 н соляной кислоты, водную фазу промывали этилацетатом, затем подщелачивали концентрированным водным раствором аммиака и экстрагировали этилацетатом. Органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель отгоняли.
C17H21NO3 [287,36]
ТСХ: Rf=0,07 (СНС13:МеОН=9:1)
Способ В (деметилирование 1-метилэпигалантамина) (МH-94)
0,80 г (2,65 ммоля) 1-метилэпигалантамина (XXIII);
1,50 г (6,63 ммоля = 2,5 экв.) бис (2-метил-2-пропилового эфира азодикарбоновой кислоты;
80 мл тетрагидрофурана.
Реагенты перемешивали вместе при комнатной температуре 24 час, затем растворитель отгоняли. Остаток переносили в трифторуксусную кислоту в метиленхлориде, перемешивали 30 мин, на ледяной бане подщелачивали концентрированным водным раствором аммиака и экстрагировали метиленхлоридом. Органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель отгоняли. Сырой продукт очищали колоночной хроматографией (СНС13:МеОН=9:1).
Выход: 400 мг (1,39 ммоля = 53% от теории) бесцветного масла
C17H21NO3 [287,36]
ТСХ: Rf=0,10 (СНС13:МеОН=9:1)
1H-ЯMP (200 МГц, СDСl3): δ 6,50 (с, 1Н), 6,08 (д, J=10,3 Гц, 1Н), 5,80 (д, J=10,3 Гц, 1Н), 4,70-4,62 (м, 1Н), 4,57 (шир.с, 1Н), 4,26 (д, J=15,7 Гц, 1Н), 3,83 (с, 3Н), 3,75 (д, J=15,7 Гц, 1Н), 3,35-3,20 (м, 1Н), 2,85-2,70 (м, 1Н), 2,50-2,29 (м, 2Н), 2,23 (с, 3Н), 2,00-1,64 (м, 2Н); 13С ЯМР (50 МГц, СDС13): δ 145,4 (с), 142,9 (с), 133,5 (с), 131,6 (д), 130,7 (с), 127,2 (д), 126,8 (с), 113,3 (д), 88,2 (д), 63,1 (д), 55,9 (кв), 48,9 (т), 48,8 (с), 47,2 (т), 32,2 (т), 28,2 (т), 19,5 (кв).
Общая методика получения четвертичных производных 1-метил- и 1-метилэпигалантаминов (примеры 91-100)
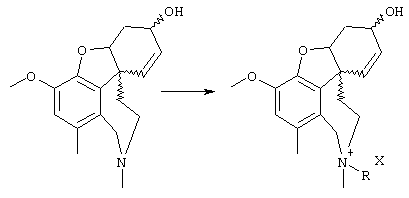
Исходное вещество растворяли в очень малом количестве ДМФА (при R=СН2С1 в качестве растворителя и реагента служит метиленхлорид (р.А. 99,5%)), добавляли алкилгалогенид и реакционную смесь нагревали (обычно не выше температуры кипения алгилгалогенида, но максимум 70° С). Определяли окончание реакции ТСХ, затем реакционную смесь медленно при перемешивании прибавляли по каплям к эфиру (в некоторых случаях легко замасливается), осадок отсасывали и промывали эфиром. Для очистки и удаления остатков ДМФА осадок растворяли в этаноле и вторично высаживали этилацетатом, затем сушили в вакуумном сушильном шкафу при 50° С.
ТСХ: СНС13:МеОН=9:1, Rf обычно сжатый после старта.
Пример 90
Хлорид [(± )-4aα ,6β ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-(2-метил-2-пропенил)-6Н-бензофуро[3а,3,2-еf][2]бензазепиния (МН-33)
280 мг (0,94 ммоля) 1-метилгалантамина (XV);
0,30 мл (3,08 ммоля = 3 экв.) 1-хлор-2-метилпроп-2-ена;
5,00 мл диметилформамида.
Реакцию проводили при 70° С и через 2 час перерабатывали, причем реакционную смесь прибавляли по каплям к 25 мл диэтилового эфира.
Выход: 270 мг (0,69 ммоля = 73% от теории) бесцветного порошка
С22Н30СlNO3 [391,94]
ТСХ: Rf=0,10 (СНС13:МеОН=9:1)
Т.пл.: 239-241° С
C22H30ClNO3×1,4 Н2O [417,14]
Вычислено, %: С 63,34; Н 7,92; N 3,36.
Найдено, %: С 63,22; Н 7,85; N 3,59.
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,6 (с), 134,2 (с), 133,5 (с), 131,1 (с), 130,9 (д), 127,5 (т), 124,9 (д), 115,9 (с), 114,4 (д), 86,3 (д), 73,0 (т), 60,8 (т), 59,4 (д), 55,5 (кв), 46,3 (с), 43,0 (кв), 31,1 (т), 23,8 (кв), 18,9(кв).
Пример 92
Бромид [(± )-(4аα ,6β ,8аR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-(2-пропинил)-6Н-бензофуро[3а,3,2-еf][2]бензазепиния (МН-38)
349 мг (1,16 ммоля) 1-метилгалантамина (XV);
0,13 мл (1,16 ммоля) 3-бром-1-пропина(пропаргил-бромида);
4,00 мл диметилформамида.
Реакцию проводили при 60° С и перерабатывали через 19 час, причем реакционную смесь прибавляли по каплям к 80 мл диэтилового эфира.
Выход: 300 мг (0,71 ммоля = 62% от теории) бежевого порошка
С21Н26ВrNO3 [420,35]
ТСХ: Rf=0,09 (СНС13:МеОН=9:1)
Т.пл.: 216-218° С
С21Н26ВrNO3×0,35 Н2O× 0,25 С3Н7NO [444,93]
Вычислено, %: С 58,72; Н 6,44; N 3,90.
Найдено, %: С 58,70; Н 6,37; N 3,94.
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,8 (с), 144,7 (с), 133,4 (с), 131,0 (с), 125,2 (д), 115,3 (с), 114,5 (д), 86,2 (д), 83,7 (д), 72,6 (т), 60,6 (т), 59,7 (д), 55,6 (кв), 46,2 (с), 43,0 (кв), 31,0 (т), 18,8 (кв).
Пример 93
Бромид [(± )-(4аα ,6β ,8аR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-фенилметил-6Н-бензофуро[3а,3,2-еf][2]бензазепиния (МН-39)
242 мг (0,80 ммоля) 1-метилгалантамина (XV);
0,25 мл (1,01 ммоля) = 1,4 экв. бензилбромида;
4,00 мл диметилформамида.
Реакцию проводили при 60° С и обрабатывали через 10 мин
Выход: 262 мг (0,55 ммоля = 69% от теории) бежевого порошка
С25Н30ВrNO3 [472,42]
ТСХ: Rf=0,08 (СНС13:МеОН=9:1)
Т.пл. 246-248° С
Вычислено, %: С 63,56; Н 6,40; N 2,96.
Найдено, %: С 63,35; Н 6,34; N 2,93.
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,7 (с), 133,4 (д), 130,7 (с), 130,4 (д), 129,0 (д), 128,1 (с), 114,5 (д), 86,3 (д), 59,7 (т), 59,5 (д), 55,6 (кв), 46,2 (с), 18,6 (кв).
Пример 94
Йодид [(± )-(4aα ,6β ,8aR*)]-4a,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11,11-триметил-6Н-бензофуро [3а,3,2-ef][2]бензазепиния (МН-83)
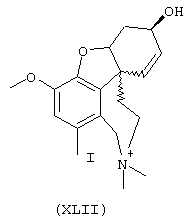
140 мг (0,46 ммоля) 1-метилгалантамина (XV);
198 мг (1,39 ммоля) = 3 экв. метилйодида;
4,00 мл диметилформамида.
Реакцию проводили при 40° С и обрабатывали через 1,5 час, причем реакционную смесь прибавляли по каплям к 30 мл диэтилового эфира.
Выход: 146 мг (0,54 ммоля = 71% от теории) светло-коричневого порошка
C19H26INO3 [443,32]
ТСХ: Rf=0,05 (СНС13:МеОН=9:1)
Т.пл.: 278-280° С
С19Н26INO3×0,3 H2O [448,72]
Вычислено, %: С 50,86; Н 5,97; N 3,12.
Найдено, %: С 50,57; Н 5,85; N 3,43.
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,6 (с), 144,1 (с), 132,8 (с), 131,6 (с), 114,2 (д), 86,3 (д), 62,6 (т), 59,5 (д), 55,4 (кв), 45,9 (с), 31,0 (т), 18,4 (кв).
Пример 95
Хлорид [(± )-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-(2-метил-2-пропенил)-6Н-бензофуро[3а,3,2-еf][2]бензазепиния (МН-66)
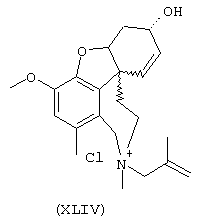
150 мг (0,50 ммоля) 1-метилэпигалантамина (XXIII);
45,0 мг (1,50 ммоля) = 3 экв. 1-хлор-2-метилпроп-2-ена;
4,00 мл диметилформамида.
Реакцию проводили при 70° С и обрабатывали через 100 мин, причем реакционную смесь прибавляли по каплям к 50 мл диэтилового эфира.
Выход: 160 мг (0,41 ммоля = 82% от теории) бесцветного порошка
С22Н30СlNO3 [391,94]
ТСХ: Rf=0,09 (СНС13:МеОН=9:1)
Т.пл.: 162-164° С
C22H30C1NO3×0,7 Н2O× 0,15 С3Н7NO [415,51]
Вычислено, %: С 64,90; Н 7,87; N 3,88.
Найдено, %: С 64,77; Н 7,68; N 3,95.
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,7 (с), 134,2 (с), 134,1 (с), 131,1 (д), 127,5 (т), 114,4 (д), 87,3 (д), 73,0 (т), 60,7 (д), 59,4 (т), 55,6 (кв), 46,3 (с), 23,8 (кв), 18,9 (кв).
Пример 96
Бромид [(± )-4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-(2-пропинил)-6Н-бензофуро[3а,3,2-еf][2]бензазепиния (МН-71)
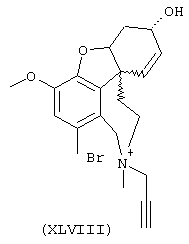
150 мг (0,50 ммоля) 1-метилэпигалантамина (XXIII);
180 мг (1,50 ммоля = 3 экв.) 3-бром-1-пропина (пропаргил-бромида);
4,00 мл диметилформамида.
Реакцию проводили при 70° С и обрабатывали через 2,5 час, причем реакционную смесь прибавляли по каплям к 30 мл диэтилового эфира.
Выход: 167 мг (0,40 ммоля = 82% от теории) светло-коричневого порошка
С21Н26ВrNO3 [420,35]
ТСХ: Rf=0,09 (СНС13:МеОН=9:1)
Т.пл.: 158-162° С
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,8 (с), 133,9 (с), 131,2 (с), 114,5 (д), 87,2 (д), 83,7 (д), 72,6 (д), 55,6 (кв), 46,3 (с), 31,9 (т), 18,8 (кв).
Пример 97
Бромид [(± )-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-(2-пропенил)-6Н-бензофуро[3а,3,2-еf][2]бензазепиния (МН-72)
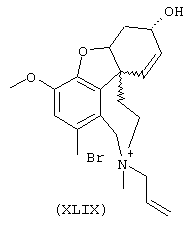
150 мг (0,50 ммоля) 1-метилэпигалантамина (XXIII);
0,13 мл (1,50 ммоля = 3 экв.) 3-бром-1-пропена(аллилбромида);
4,00 мл диметилформамида.
Реакцию проводили при 60° С и обрабатывали через 2 ч.
Выход: 150 мг (0,36 ммоля = 64% от теории) светло-коричневого порошка
С21Н28ВrNO3 [422,36]
ТСХ: Rf=0,11 (СНСl3:МеОН=9:1)
Т.пл.: 140-145° С
C21H28BrNO3×1 Н2O× 0,25 C3H7NO [458,64]
Вычислено, %: С 56,96; Н 6,98; N 3,82.
Найдено, %: С 56,69; Н 6,65; N 4,05.
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,7 (с), 134,5 (д), 134,0 (с), 131,1 (с), 128,3 (с), 126,1 (д), 115,3 (д), 114,4 (д), 87,2 (д), 60,7 (д), 59,8 (т), 55,6 (кв), 46,3 (с), 31,5 (т), 18,8 (кв).
Пример 98
Бромид [(± )-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-(4-(трифторметил)фенил-метил)-6Н-бензофуро [3а,3,2-ef] [2]бензазепиния (МН-75)
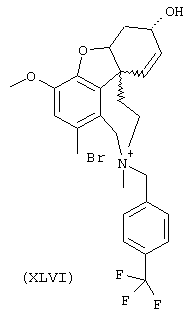
150 мг (0,50 ммоля) 1-метилэпигалантамина (XXIII);
357 мг (1,50 ммоля = 1,4 экв.) 4-трифторметилбензил-бромида;
4,00 мл диметилформамида.
Реакцию проводили при 70° С и обрабатывали через 1 ч.
Выход: 142 мг (0,26 ммоля = 53% от теории) светло-желтого порошка
С26Н29ВrF3NО3 [540,42]
ТСХ: Rf=0,10 (СНС13:МеОН=9:1)
Т.пл.: 178-182° С
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,8 (с), 134,4 (д+д), 134,2 (д), 132,6 (с), 131,2 (с), 130,9 (с), 130,3 (с), 126,6 (д), 125,8 (с), 121,2 (д), 114,5 (д), 87,3 (д), 60,8 (д), 55,6 (кв), 46,3 (с), 34,3 (т), 18,7 (кв).
Пример 99
Бромид [(± )-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-11-(фенилметил)-6Н-бензофуро[3а,3,2-еf][2]бензазепиния (МН-76)
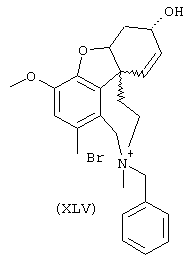
153 мг (0,51 ммоля) 1-метилэпигалантамина (XXIII);
92 мг (1,51 ммоля = 3 экв.) бензилбромида;
4,00 мл диметилформамида.
Реакцию проводили при 70° С и обрабатывали через 3 часа.
Выход: 150 мг (0,32 ммоля = 63% от теории) светло-коричневого порошка
С25Н30ВNO3 [472,42]
ТСХ: Rf=0,11 (СНС13:МеОН=9:1)
Т.пл.: 169-175° С
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,6 (с), 134,1 (с), 133,4 (д), 131,0 (с), 130,4 (д), 128,9 (д), 128,1 (с), 114,4 (д), 87,2 (д), 61,8 (д), 59,4 (т), 55,6 (кв), 46,3 (с), 31,5 (т), 18, 6 (кв).
Пример 100
Йодид [(± )-(4аα ,6α ,8аR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11,11-триметил-6Н-бензофуро[3а,3,2-ef][2]бензазепиния (МН-81)
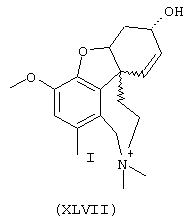
210 мг (0,70 ммоля) 1-метилэпигалантамина (XXIII);
290 мг (2,10 ммоля = 3 экв.) метилйодида;
4,00 мл диметилформамида.
Реакцию проводили при 70° С и обрабатывали через 2 час, причем реакционную смесь прибавляли по каплям к 30 мл диэтилового эфира.
Выход: 240 мг (0,54 ммоля = 77% от теории) светло-коричневого порошка
С19Н26INO3 [443,32]
TCX: Rf=0,05 (СНС13:МеОН=9:1)
Т.пл.: разложение > 280° С
Вычислено, %: С 51,48; Н 5,91; N 13,16.
Найдено, %: С 51,25; Н 5,75; N 3,32.
13С-ЯМР (50 МГц, ДМСО-d6): δ 144,7 (с), 133,6 (с), 131,1 (с), 114,4 (д), 87,1 (д), 62,2 (т), 60,7 (кв), 55,5 (кв), 48,4 (д), 46,2 (с), 31,5 (т), 18,9 (кв).
Общий способ получения галантамин-N-оксидов (пример 101)
1 экв. производного галантамина
1-1,5 экв. 3-хлорнадбензойной кислоты
100 мл хлороформа/1 г производного галантамина
0,7 мл Н2O2 (35%)/1 г производного галантамина
3-Хлорнадбензойную кислоту растворяли в 1/3 хлороформа, смешивали с пероксидом водорода и перемешивали 2 минуты. Затем этот раствор прибавляли к раствору производного галантамина в 2/3 хлороформа. Перемешивали 15 минут, упаривали и очищали колоночной хроматографией (градиент: СНС13:МеОН =9:1 МеОН)
Пример 101
[4aS-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-3-метокси-11-метил-6Н-бензофуро[3а,3,2-еf][2]бензазапин-6-ол, 11-оксид, эпигалантамин-N-оксид (Pi-23)
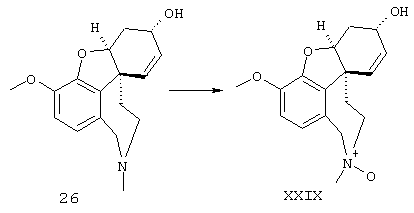
49,7 мг (0,17 ммоля) эпигалантамина (26);
29,9 мг (0,17 ммоля) = 3 экв. 3-хлорнадбензойной кислоты;
0,03 мл пероксида водорода (35%);
5 мл хлороформа.
Выход: 37 мг (71% от теории)
C17H21NO4 [303,36]
ТСХ: Rf=0,05 (СНС13:МеОН=9:1)
1H-ЯМР (200 МГц, CDCl3): δ 6,67 (с, 2Н), 5,96 (шир.с, 2Н), 4,78 (д, J=15,0 Гц, 1Н), 4,67-4,50 (м, 2Н), 4,26 (д, J=15,0 Гц, 1Н), 3,83 (с, 3Н), 3,67-3,41 (м, 2Н), 3,41 (с, 2Н), 2,96 (с, 3Н), 2,77 (дт, J=13,1, 3,7 Гц, 1Н), 2,05 (шир.с, 1Н), 1,74 (т, J=11,3 Гц, 1Н).
13С-спектры вследствие быстрого образования сольватов и кристаллизации в хлороформе не были получены, доказательство структуры однако получили рентгенокристаллографией.
Общий способ получения N-замещенных производных 1-метилгалантамина (примеры 102-106)
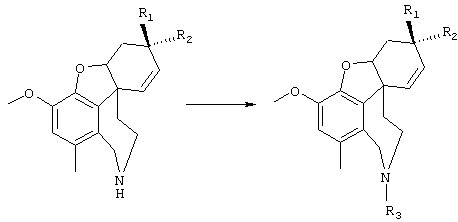
200 мг (0,70 ммоля) 1-метил-N-деметилгалантамина (или -эпигалантамина);
192 мг (1,39 ммоля = 2 экв.) карбоната калия;
117 мг (0,78 ммоля = 1,1 экв.) йодида натрия;
(0,84 ммоля = 1,2 экв.) замещенного алкилгалогенида;
10 мл ацетона, высушенного над 4 молекулярным ситом.
молекулярным ситом.
Йодид натрия, карбонат калия и исходное вещество хорошо растирали в ступке, смесь вместе с несколькими стеклянными шариками помещали в колбу и суспендировали в абс. ацетоне. Дозировали замещенный алкилгалогенид и реакционную смесь нагревали с обратным холодильником. После окончания реакции реакционную смесь упаривали в вакууме досуха и остаток вносили в 2 н НС1, водную фазу промывали этилацетатом, затем подщелачивали конц. водным аммиаком и снова экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель отгоняли. Сырой продукт очищали через колонку с силикагелем (растворитель: СНС13:МеОН=9:1+1% NH4OH).
Пример 102
[(± )-(4аα ,6β ,8aR*)]-4a,5,9,10,11,12-гексагидро-3-метокси-1-метил-11-(2-пропенил)-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол, 1-метил-N-аллилгалантамин (МН-25)
200 мг (0,70 ммоля) 1-метил-N-деметилгалантамина (XXII);
0,07 мл (0,84 ммоля = 1,2 экв.) 1-бром-2-пропена (аллилбромида).
Через 10 ч продукт реакции перерабатывали.
Выход: 50 мг (0,15 ммоля = 22%) от теории желтого масла
C20H25NO3 [327,43]
ТСХ: Rf=0,17 (СНС13:МеОН=9:1+1% NH4OH)
С20Н25NO3×0,8 H2O [341,83]
Вычислено, %: С 70,27; Н 7,84; N 4,10.
Найдено, %: С 70,18; Н 7,60; N 4,05.
1H-ЯМР (200 МГц, СDС13): δ 6,52 (с, 1Н), 6,12 (д, J=10,3 Гц, 1Н), 6,03-5,78 (м, 2Н), 5,18 (шир.с, 1Н), 5,11 (д, J=4,5 Гц, 1Н), 4,57 (шир.с, 1Н), 4,12 (шир.с, 1Н), 4,09 (д, J=15,0 Гц, 1H), 3,81 (с, 3Н), 3,78 (д, J=15,0 Гц, 1Н), 3,32-3,02 (м, 4Н), 2,72-2,58 (м, 1Н), 2,21 (с, 3Н), 2,07-1,89 (м, 2Н), 1,57 (ддд, J=13,7, 3,4, 2,7 Гц, 1Н);
13С-ЯМР (50 МГц, CDCl3): δ 144,0 (с), 143,0 (с), 136,0 (д), 133,6 (с), 129,1 (с), 127,4 (д), 127,2 (д), 126,9 (с), 117,5 (т), 113,7 (д), 88,4 (д), 62,0 (д), 57,2 (т), 55,8 (кв), 52,9 (т), 52,0 (т), 48,4 (с), 33,9 (т), 29,8 (т), 19,4 (кв).
Пример 103
[(± )-(4аα ,6β ,8aR*)]-4a,5,9,10,11,12-гексагидро-3-метокси-1-метил-11-(фенилметил)-6Н-бензофуро[3а,3,2-еf][2]-бензазепин-6-ол, 1-метил-N-бензилгалантамин (МН-26)
200 мг (0,70 ммоля) 1-метил-N-деметилгалант\амина (XXII);
0,1 мл (0,84 ммоля = 1,2 экв.) бромметилбензола (бензил- бромида).
Через 24 ч реакция заканчивалась.
Выход: 140 мг (0,37 ммоля = 53% от теории) желтого масла
C24H27NO3 [377,48]
TCX: Rf=0,36 (СНС13:МеОН=9:1+1% NH4OH)
1H-ЯМР (200 МГц, CDCl3): δ 7,30 (м, 5Н), 6,50 (с, 1Н), 6,16 (д, J=10,2 Гц, 1Н), 5,99 (дд, J=10,2, 4,9 Гц, 1Н), 4,61 (шир.с, 1H), 4,13 (шир.с, 1Н), 4,00 (д, J=15,7 Гц, 1Н), 3,82 (с, 3Н), 3,81 (д, J=15,7 Гц, 1H), 3,69 (с, 2Н), 3,34 (тд, J=14,1, 12,4, 1,8 Гц, 1H), 3,13 (тд, J=14,1, 3,5 Гц, 1H), 2,74-2,37 (м, 2Н), 2,19-1,93 (м, 2Н), 1,90 (с, 3Н), 1,57 (дт, J=13,7, 3,0 Гц, 1Н); 13С-ЯМР (50 МГц, CDCl3): δ 143,9 (с), 143,0 (с), 138,9 (с), 133,6 (с), 129,2 (с), 128,7 (д), 128,2 (д), 127,4 (д), 127,3 (д), 127,2 (с), 126,9 (д), 113,7 (д), 88,4 (д), 62,0 (д), 57,4 (т), 55,8 (кв), 52,4 (т), 52,2 (т), 48,5 (с), 33,7 (т), 29,8 (т), 19,1 (кв).
Пример 104
[(± )-(4аα , 6β , 8aR*)]-4а, 5,9,10,11,12-гексагидро-3-метокси-1-метил-11-(2-(4-морфолинил)этил)-6Н-бензофуро[3а,3,2-ef] [2]бензазепин-6-ол, 1-метил-N-морфолиноэтил-галантамин (МН-28)
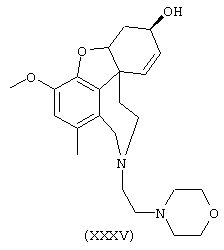
200 мг (0,70 ммоля) 1-метил-N-деметилгалант- амина (XXII);
155 мг (0,84 ммоля = 1,2 экв.) гидрохлорида 4-(2-хлорэтил) морфолина.
Через 24 ч реакция заканчивалась.
Выход: 210 мг (0,52 ммоля = 75% от теории) желтого масла
C23H32N2O4 [400,52]
ТСХ: Rf=0,51 (СНС13:МеОН=9:1+1% NH4OH)
C23H32N2O4×0,9 Н2O [416,72]
Вычислено, %: С 66,29; Н 8,17; N 6,72.
Найдено, %: С 66,28; Н 8,09; N 6,85.
1H-ЯМР (200 МГц, CDCl3): δ 6,52 (с, 1H), 6,10 (д, J=10,3 Гц, 1Н), 5,97 (дд, J=10,3, 4,8 Гц, 1Н), 4,55 (шир.с, 1Н), 4,13 (шир.с, 1H), 4,12 (д, J=15,9 Гц, 1Н), 3,88 (д, J=15,9 Гц, 1H), 3,81 (с, 3Н), 3,75-3,65 (м, 4Н), 3,30 (ддд, J=14,3, 12,4, 2,0 Гц, 1H), 3,10 (дт, J=14,3, 3,3 Гц, 1H), 2,76-2,58 (м, 4Н), 2,55-2,41 (м, 5Н), 2,25 (с, 3Н), 2,08-1,90 (м, 2Н), 1,55 (дд, J=13,7, 2,8 Гц, 1Н); 13С-ЯМР (50 МГц, СDС13): δ 144,1 (с), 143,0 (с), 133,5 (с), 128,9 (с), 127,4 (д), 127,1 (д), 126,9 (с), 113,7 (д), 88,4 (д), 66,7 (т+т), 66,6 (т), 61,9 (д), 57,1 (т), 55,8 (кв), 54,0 (т+т), 53,4 (т), 52,0 (т), 48,4 (с), 33,4 (т), 29,8 (т), 19,4 (кв).
Пример 105
[(± )-(4аα ,6β ,8aR*)]-4a,5,9,10,11,12-гексагидро-3-метокси-1-метил-11-(3-(1-пиперидинил)пропил)-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол, 1-метил-N-пиперидинопропил-галантамин (МН-29)
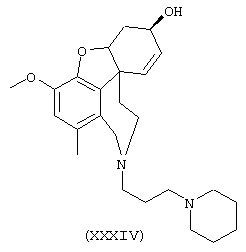
200 мг (0,70 ммоля) 1-метил-11-деметилгалант-амина (XXII);
166 мг (0,84 ммоля = 1,2 экв.) гидрохлорида 1-(3-хлор-пропил)пиперидина;
Через 24 ч реакция заканчивалась.
Выход: 180 мг (0,44 ммоля = 63% от теории) желтого масла
С25Н36N2O3 [412,58]
ТСХ: Rf=0,27 (СНС13:МеОН=9:1+1% NH4OH)
C25H36N2O3×0,50 Н2O [421,58]
Вычислено, %: С 71,23; Н 8,85; N 6,64.
Найдено, %: С 71,33; Н 8,97; N 6,60.
1H-ЯМР (200 МГц, СDС13): δ 6,52 (с, 1Н), 6,10 (д, J=10,4 Гц, 1Н), 5,96 (дд, J=10,4, 4,7 Гц, 1Н), 4,55 (шир.с, 1Н), 4,12 (шир.с, 1Н), 4,08 (д, J=15,7 Гц, 1Н), 3,83 (д, J=15,7 Гц, 1Н), 3,81 (с, 3Н), 3,24 (ддд, J=14,2, 12,2, 2,0 Гц, 1Н), 3,07 (дт, J=14,2, 3,5 Гц, 1Н), 2,71-2,13 (м, 10Н), 2,24 (с, 3Н), 2,07-1,88 (м, 2Н), 1,77-1,35 (м, 9Н); 13С-ЯМР (50 МГц, CDCl3): δ 144,0 (с), 142,9 (с), 133,5 (с), 128,9 (с), 127,3 (д+д), 127,2 (с), 113,7 (д), 88,4 (д), 62,0 (д), 57,2 (т), 55,8 (кв), 54,5 (т+т+т), 53,3 (т), 51,4 (т), 48,5 (с), 33,4 (т), 29,8 (т), 25,7 (т+т), 25,0 (т), 24,2 (т), 19,5 (кв).
Пример 106
[(± )-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-3-метокси-1-метил-11-(3-(1-пиперидинил)пропил)-6Н-бензофуро[3а,3,2-ef][2] бензазепин-6-ол, 1-метил-N-пиперидинопропил-эпигалантамин (МН-117)
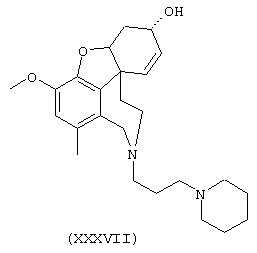
100 мг (0,35 ммоля) 1-метилэпигалантамина (XXIV);
83 мг (0,42 ммоля = 1,2 экв.) гидрохлорида (1-(3-хлор-пропил) пиперидина.
Через 28 ч реакция заканчивалась.
Выход: 60 мг (0,15 ммоля = 42% от теории) светло-желтого масла
C25H36N2O3 [412,58]
TCX: Rf=0,12 (СНС13:МеОН=9:1)
1H-ЯМР (200 МГц, CDCl3): δ 6,50 (с, 1H), 6,10 (д, J=10,2 Гц, 1Н), 5,78 (дд, J=10,2, 1H), 4,70-4,57 (м, 1H), 4,54 (шир.с, 1Н), 4,05 (д, J=15,2 Гц, 1Н), 3,82 (д, J=15,2 Гц, 1H), 3,82 (с, 3Н), 3,25 (ддд, J=13,5, 12,8, 1,6 Гц, 1H), 3,09 (дт, J=13,5, 2,5 Гц, 1H), 2,75 (дт, J=13,7, 4,1 Гц, 1H), 2,56-2,27 (м, 8Н), 2,23 (с, 3Н), 2,08 (тд, J=13,1, 4,0 Гц, 2Н), 1,81-1,38 (м, 9Н); 13С-ЯМР (50 МГц, СDС13): δ 144,9 (с), 142,7 (с), 133,4 (с), 131,3 (с), 128,3 (д+д), 127,0 (с), 113,3 (д), 88,1 (д), 63,0 (д), 57,2 (т), 55,7 (кв), 54,4 (т+т+т), 53,1 (т), 51,6 (т), 48,4 (с), 33,1 (т), 29,5 (т), 25,6 (т+т), 24,8 (т), 24,1 (т), 19,5 (кв).
Общий способ получения производных бромида галантаминия (примеры 107-109)
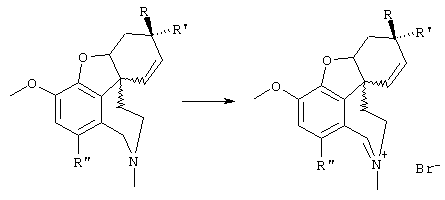
R, R’=H, OH
1 экв. производного галантамина
1 экв. N-бромсукцинимида
50 мл метиленхлорида или хлороформа, перегнанного над P2O5/l г производного галантамина
Исходную смесь растворяли в растворителе и прибавляли при перемешивании N-бромсукцинимид. Сразу образовался осадок, который отсасывали через соответствующее время, промывали и отсасывали досуха.
Как правило, полученные продукты являются очень чистыми, однако важно заранее большое количество растворителя, так как обычно сукцинимид внедряется в вещество и продут затем трудно дополнительно очистить.
Пример 107
Бромид [4aS-(4aα ,6β ,8aR*)]-4а,5,9,10-тетрагидро-6-гидрокси-3-метокси-11-метил-6Н-бензофуро[3а,3,2-ef][2]бензазепиния, бромид галантаминия (МН-119)
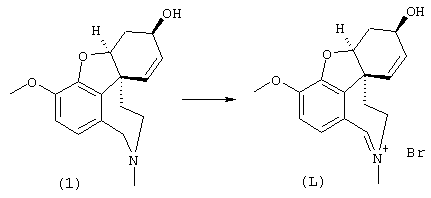
200 мг (0,7 ммоля) галантамина (I);
124 мг (0,7 ммоля = 1,2 экв.) N-бромсукцинимида;
10 мл метиленхлорида или хлороформа, перегнанного над Р2О5.
Образующийся осадок отсасывали через 10 мин
Выход: 230 мг (0,63 ммоля = 90% от теории) светло-желтого порошка
С17Н20ВrNО3 [366,25]
ТСХ: Rf=0,58 (СНС13:МеОН=9:1+1% NH4OH)
Т.пл.: 216-219° С
C17H20BrNO3×0,1 HBr [374,34]
Вычислено, %: С 54,55; Н 5,41; N 3,74.
Найдено, %: С 54,52; Н 5,36; N 3,66.
1H-ЯМР (200 МГц, CDCl3): δ 9,10 (с, 1H), 7,54 (д, J=8,5 Гц, 1H), 7,27 (д, J=8,5 Гц, 1Н), 5,92 (дд, J=10,3, 4,5 Гц, 1H), 5,73 (д, J=10,3 Гц, 1Н), 4,74 (с, 1H), 4,59 (с, 1H), 4,11 (с, 2Н), 3,94 (с, 3Н), 3,79 (с, 3Н), 2,38 (д, J=15,3 Гц, 1H), 2,15 (м, 3Н); 13С-ЯМР (50 МГц, CDCl3): δ 167,3 (д), 151,3 (с), 146,2 (с), 136,9 (с), 133,0 (д), 129,8 (д), 126,4 (д), 115,0 (с), 112,9 (д), 87,0 (д), 58,9 (д), 56,4 (кв), 54,0 (т), 51,5 (кв), 45,9 (с), 31,1 (т), 29,7 (т).
Пример 108
Бромид [(± )-(4aα ,6β ,8aR*)-4а,5,9,10-тетрагидро-6-тидрокси-3-метокси-1,11-диметил-6Н-бензофуро[3а,3,2-ef][2]-бензазепиния, бромид 1-метилгалантаминия (Pi-8)
200 мг (0,66 ммоля) 1-метилгалантамина (XV);
118 мг (0,66 ммоля) N-бромсукцинимида;
5 мл хлороформа.
Через 5 минут образовывался оранжево-желтый осадок, который отсасывали через 15 минут. Осадок (162 мг) дважды промывали диэтиловым эфиром. Фильтрат упаривали, вносили в небольшое количество этанола и высаживали диэтиловым эфиром (54 мг).
Выход: 216 мг (0,57 ммоля = 86% от теории) оранжево-желтого порошка
C18H22BrNO3 [380,28]
ТСХ: Rf=0,02 (СНС13:МеОН =9:1)
Т.пл.: 223-226° С
C18H22BrNO3×0,35 НВr [408,60]
Вычислено, %: С 52,91; Н 5,51; N 3,43.
Найдено, %: С 52,99; Н 5,52; N 3,48.
1H-ЯМР (200 МГц, ДМСО-d6): δ 9,06 (с, 1Н), 7,04 (с, 1Н), 5,81 (дд, J=10,1, 4,5 Гц, 1Н), 5,54 (д, J=10,2 Гц, 1Н), 4,74 (с, 1Н), 4,17-3,95 (м, 4Н), 3,91 (с, 3Н), 3,86 (с, 3Н), 2,53 (с, 3Н), 2,40-1,96 (м, 4Н); 13C-ЯMP (50 МГц, ДМСО-d6): δ 166,4 (д), 150,5 (с), 144,7 (с), 140,4 (с), 136,7 (с), 128,4 (д), 127,9 (д), 114,9 (д), 113,9 (с), 86,5 (д), 58,7 (д), 56,3 (кв), 54,4 (т), 50,5 (кв), 47,0 (с), 35,1 (т), 29,4 (т), 18,9 (кв).
Пример 109
Бромид [4aS-(4aα ,6a,8aR*)]-4а,5,9,10-тетрагидро-6-гидрокси-3-метокси-11-метил-6Н-бензофуро[3а,3,2-ef][2]бензазепиния, бромид эпигалантаминия (Pi-13)
0,78 г (2,71 ммоля) эпигалантамина (26);
0,48 г (2,71 ммоля) N-бромсукцинимида;
6 мл абсолютного хлороформа.
Через 3 минуты образовывался желтый осадок, который отсасывали и дважды промывали диэтиловым эфиром. Вторую фракцию можно было получить упариванием фильтрата и прибавлением по каплям к 60 мл диэтилового эфира. Вторую фракцию для очистки растворяли в небольшом количестве этанола и прибавляли по каплям к диэтиловому эфиру.
Выход: 0,91 г (2,48 ммоля = 92% от теории)
С17Н20ВrNО3 [366,25]
TCX: Rf=0,05 (СНС13:МеОН=9:1+1% NH4OH)
Т.пл.: 205-210° С
C17H20BrNO3×0,3 HBr [390,52]
Вычислено, %: С 52,28; Н 5,24; N 3,59.
Найдено, %: С 52,12; Н 5,18; N 3,88.
1H-ЯМР (200 МГц, ДМСО-d6): δ 9,10 (с, 1H), 7,51 (д, J=11,5 Гц, 1H), 7,20 (д, J=11,5 Гц, 1H), 5,82 (д, J=12,7 Гц, 1H), 5,68 (д, J=12,7 Гц, 1H), 4,80 (шир.с, 1H), 4,40-4,21 (м, 1H), 4,21-4,04 (м, 2Н), 3,94 (с, 3Н), 3,77 (с, 3Н), 2,60 (с, 1H), 2,30-2,10 (м, 2Н), 1,81-1,60 (м, 1H); 13С-ЯМР (50 МГц, ДМСО-d6): δ 167,3 (д), 151,2 (с), 146,5 (с), 137,3 (с), 134,4 (д), 133,0 (д), 126,0 (д), 115,0 (с), 113,0 (д), 88,0 (д), 60,7 (д), 56,4 (кв), 54,2 (т), 51,4 (кв), 46,2 (с), 31,5 (т), 30,8 (т).
Общий способ получения производных галантамин-12-карбонитрила (примеры 110-113)
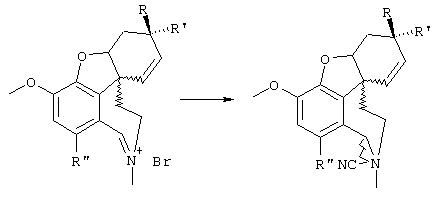
R, R’=H, OH
1 экв. производного галантамина
3 экв. цианида калия
30 мл воды/1 г производного галантамина
10 мл диэтилового эфира/1 г производного галантамина
Исходную смесь растворяли в делительной воронке в воде и раствор покрывали эфиром, затем добавляли твердый цианид калия (свежерастертый), при этом сразу в водной фазе образовывался белый осадок. Через 2-3 минуты продукт путем встряхивания экстрагировали в эфирную фазу. Водную фазу до исчерпания экстрагировали эфиром, а в случае труднорастворимых производных хлороформом, органические фазы объединяли, промывали насыщенным водным раствором поваренной соли, сушили над Na2SO4, фильтровали и растворитель отгоняли. При необходимости полученный продукт очищали через колонку с силикагелем (растворитель: СНС13:МеОН = 9:1), если не указано иначе.
Пример 110
[4aS-(4aα ,6β ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-11-метил-6Н-бензофуро[3а,3,2-еf][2]бензазепин-12-карбонитрил, галантамин-12-карбонитрил (МН-123)
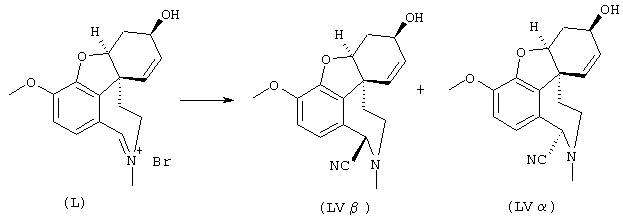
3,50 г (9,56 ммоля) бромида галантаминия (L);
1,90 г (28,7 ммоля = 3 экв.) цианида калия;
100 мл воды;
40,0 мл диэтилового эфира.
Реакцию проводили по общему способу.
Выход сырого продукта > 2 г
Маслянистую неочищенную смесь, состоящую из соотношения изомеров примерно 9:1, растворяли в возможно малом количестве этанола и при перемешивании выкристаллизовывали основной изомер. Осадок отсасывали, промывали этанолом и фильтрат объединяли с промывным раствором и упаривали. Процедуру повторяли до выделения основного количества чистого основного изомера.
Выход: 990 мг (3,28 ммоля = 34% от теории) белого порошка
C18H20N2O3 [312,37]
Оставалась смесь обоих изомеров (соотношение 9:1) и галантамина, который образовывался во время выделения основного изомера, которую можно было очистить через колонку. Из колонки вымывали снова смесь изомеров в соотношении 9:1, так они взаимопревращались в колонке.
ТСХ: Rf=0,77 основной изомер
0,63 побочный изомер (СНС13:МеОН=9:1)
Т.пл.: 151-155° С
С18Н20N2O3×0,1 H2O [314,17]
Вычислено, %: С 68,82; Н 6,48; N 8,92.
Найдено, %: С 68,85; Н 6,32; N 8,69.
1H-ЯМР (200 МГц, CDCl3): δ 6,70 (с, 2Н), 6,35 (д, J=10,2 Гц, 1Н), 6,07 (дд, J=10,2, 5,3 Гц, 1Н), 4,71 (с, 1Н), 4,61 (м, 1Н), 4,15 (дт, J=11,1, 5,0 Гц, 1Н), 3,85 (с, 3Н), 3,50 (дд, J=15,0, 13,6 Гц, 1Н), 2,91 (дт, J=15,0, 3,2 Гц, 1Н), 2,74-2,61 (м, 1Н), 2,61 (с, 3Н), 2,38 (д, J=11,4 Гц, 1H), 1,98-2,08 (м, 2Н), 1,78 (ддд, J=13,7, 5,0, 1,2 Гц, 1H); 13С-ЯМР (50 МГц, СDС13): δ 146,7 (с), 145,6 (с), 132,9 (с), 128,2 (д), 126,9 (д), 124,2 (с), 122,5 (с), 111,6 (д), 88,9 (д), 61,6 (д+д), 55,9 (кв), 49,9 (т), 48,1 (с), 46,1 (кв), 36,4 (т), 29,7 (т).
Пример 111
[(± )-(4аα ,6β ,8аR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-6Н-бензофуро[3а,3,2-ef][2]-бензазепин-12-карбонитрил, 1-метилгалантамин-12-карбонитрил (Pi-12)
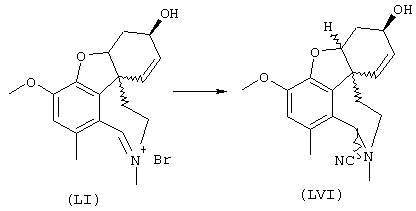
300 мг (0,79 ммоля) бромида 1-метилгалант-аминия (LI);
154 мг (2,36 ммоля = 3 экв.) цианида калия;
20,0 мл воды.
Смогли выделить 205 мг сырого продукта.
Разделение диастереомеров пытались осуществить колоночной хроматографией с этилацетатом в качестве растворителя. Но при этом не смогли достичь разделения смеси диастереомеров.
Выход: 151 мг (0,46 ммоля = 59% от теории)
С19Н22N2O3 [326,39]
ТСХ: Rf=0,30/0,65 (смесь диастереомеров; этилацетат)
Т.пл.: 72-73° С
C19H22N2O3×0,5 Н2О [335,39]
Вычислено, %: С 68,04; Н 6,91; N 8,35.
Найдено, %: С 67,91; Н 6,62; N 8,20.
1H-ЯМР (смесь 2 изомеров, 200 МГц, CDCl3): δ 6,59 (с, 1Н), 6,31 (д, J=8,9 Гц, 0,4Н), 6,27 (д, J=8,9 Гц, 0,6Н), 6,01 (дд, J=9,2, 5,0 Гц, 1Н), 4,96 (с, 0,6Н), 4,83 (с, 0,4Н), 4,57 (шир.с, 0,6Н), 4,50 (шир.с, 0,4Н), 4,12 (дт, J=15,5, 4,9 Гц, 1Н), 3,83 (с, 3Н), 3,47 (ддд, J=13,9, 9,8, 3,4 Гц, 1Н), 2,88 (дт, J=14,6, 3,8 Гц, 1Н), 2,70 (шир.с, 1Н), 2,62 (с, 1,8Н), 2,60 (с, 1,2Н), 2,31 (с, 3Н), 2,10-1,92 (м, 2Н), 1,87-1,68 (м, 1Н); 13С-ЯМР (смесь 2 изомеров, 100 МГц, СDС13): δ 145,5 (с), 145,4 (с), 145,3 (с), 144,8 (с), 135,7 (с), 133,6 (с), 129,7 (д), 129,3 (д), 129,6 (с), 128,7 (с), 128,4 (д), 127,7 (д), 122,9 (с), 122,8 (с), 116,7 (с), 115,3 (с), 114,5 (д), 114,4 (д), 89,4 (д), 88,9 (д), 62,3 (д), 62,2 (д), 57,9 (д), 56,6 (д), 56,5 (кв), 56,3 (кв), 51,0 (т), 50,3 (т), 49,0 (с), 47,9 (с), 47,2 (кв), 47,2 (с), 36,8 (т), 33,7 (т), 30,2 (т), 20,3 (кв), 19,3 (кв).
Пример 112
[4aS-(4aα ,6а,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-11-метил-6Н-бензофуро[3а,3,2-ef][2]бензазепин-12-карбонитрил, эпигалантамин-12-карбонитрил (Pi-14)
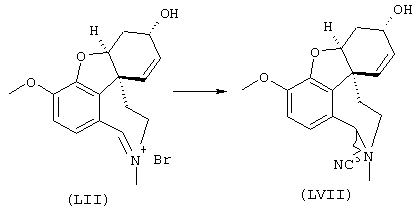
500 мг (1,37 ммоля) бромида эпигалантаминия (LII);
270 мг (4,10 ммоля) = 3 экв. цианида калия;
15,0 мл воды.
Выход: 0,33 г (1,06 ммоля = 77% от теории)
C18H20N2O3 [312,37]
ТСХ: Rf=0,75 (СНС13:МеОН=9:1)
Т.пл.: 90-96° С
1Н-ЯМР (смесь 2 изомеров, 200 МГц, CDCl3): δ 6,92 (д, J=8,3 Гц, 0,3Н), 6,72 (д, J=8,0 Гц, 0,3Н), 6,68 (д, J=8,0 Гц, 0,7Н), 6,62 (д, J=8,3 Гц, 0,7Н), 6,31 (дт, J=10,5, 1,6 Гц, 0,7Н), 6,03 (д, J=10,5 Гц, 0,3Н), 5,85 (д, J=10,3 Гц, 1H), 5,22 (с, 0,3Н), 4,64 (с, 0,7Н), 4,58 (шир.с, 1H), 3,86 (с, 0,9Н), 3,85 (с, 2,1Н), 3,12 (дт, J=14,8, 3,2 Гц, 0,3Н), 2,98-2,70 (м, 1,7Н), 2,58 (с, 2,1Н), 2,38 (с, 0,9Н), 2,27-2,04 (м, 1,2Н), 1,85 (дд, J=13,5, 4,2 Гц, 1,4Н), 1,71 (ддд, J=13,5, 10,7, 2,5 Гц, 1,4Н); 13С-ЯМР (смесь из 2 изомеров, 50 МГц, CDCl3): δ 147,5 и 147,2 (с), 145,2 и 145,0 (с), 132,6 (с), 132,5 и 131,9 (д), 126,6 (д), 124,0 и 123,3 (с), 121,8 и 120,1 (д), 116,5 (с), 111,3 и 111,2 (д), 88,7 и 88,4 (д), 62,8 (д), 61,4 и 58,4 (д), 55,8 (кв), 50,0 (т), 47,9 (с), 45,9 (кв), 36,9 (т), 32,0 и 31,7 (т).
Пример 113
[(± )-(4aα ,6α ,8aR*)]-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-1,11-диметил-6Н-бензофуро[3а,3,2-ef][2]-бензазепин-12-карбонитрил, 1-метилэпигалантамин-12-карбонитрил (Pi-19)
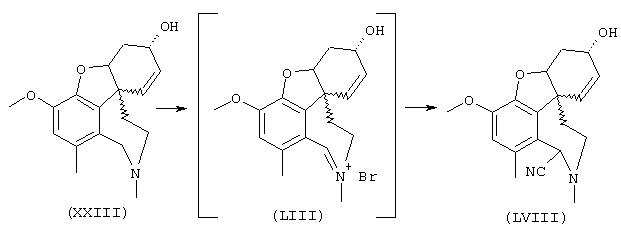
Бромид 1-метилэпигалантаминия для получения производных галантамина получали по общему способу, причем однако осадок не образовывался. Реакционный раствор упаривали досуха, оставшийся остаток помещали в эфир, отсасывали и промывали.
Оставшийся сырой продукт после ЯМР-анализа сразу вводили в следующую реакцию.
500 мг (1,32 ммоля) бромида 1-метилэпигалантаминия (LIII);
260 мг (3,96 ммоля = 3 экв.) цианида калия;
50 мл воды.
Очистку производили путем колоночной хроматографии (СНС13:МеОН=9:1).
Выход: 220 мг (0,67 ммоля = 51% от теории) белой пены
C19H22N2O3 [326,39]
ТСХ: Rf=0,70/0,60 (смесь диастереомеров; СНС13:МеОН=9:1)
1H-ЯМР (смесь 2 изомеров, 200 МГц, СDСl3): δ 6,57 (с, 1Н), 6,26 (д, J=10,4 Гц, 1Н), 5,82 (д, J=10,4 Гц, 1Н), 4,94 и 4,82 (с, 1Н), 4,74-4,55 (м, 1Н), 4,50 и 4,45 (м, 1Н), 3,87 и 3,84 (с, 3Н), 3,55-3,32 (м, 1Н), 3,05-2,68 (м, 2Н), 2,58 и 2,57 (с, 3Н), 2,33 и 2,30 (с, 3Н), 2,23-2,07 (м, 1Н), 1,93-1,63 (м, 2Н); 13С-ЯМР (смесь 2 изомеров, 50 МГц, СDС13): δ 146,0 (с), 145,8 (с), 144,5 (с), 144,1 (с), 135,0 (с), 133,0 (с), 132,2 (д), 131,7 (д), 129,5 (д), 128,5 (с), 127,6 (с), 127,1 (д), 122,4 (с), 122,2 (с), 116,4 (с), 114,8 (с), 113,9 (д), 113,8 (д), 88,5 (д), 88,4 (д), 63,0 (д), 62,6 (д), 57,2 (д), 56,4 (д), 56,0 (кв), 55,8 (кв), 50,7 (т), 50,0 (т), 48,4 (с), 47,3 (с), 46,7 (кв), 36,9 (т), 34,1 (т), 31,7 (т), 19,8 (кв), 18,8 (кв).
Общая рабочая методика получения производных 12-метил-галантамина (примеры 114-117)
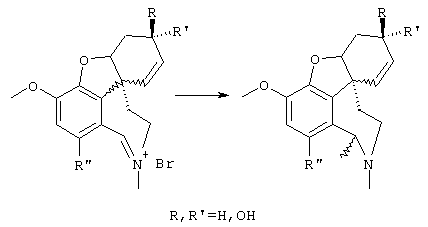
1 экв. производного галантамина
2-4 экв. метилмагниййодида (3 М в диэтиловом эфире)
20 мл абс. диэтилового эфира/1 г производного галантамина
Весь реактив Гриньяра помещали в атмосферу N2 и затем прибавляли твердое производное галантамина без растворителя. Через определенное время добавляли диэтиловый эфир и перемешивали определенное время, при этом твердая масса растворялась. Затем гидролизовали водой, реакционный раствор подщелачивали конц. аммиаком и экстрагировали этилацетатом. Органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель отгоняли.
Пример 114
[4aS-(4aα ,6β ,8aR*)]-4а,5,9,10,11,12-гексагидро-3-метокси-11,12-диметил-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол, 12-метилгалантамин (Pi-4)
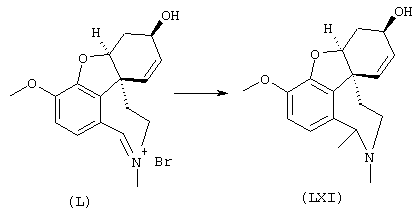
2,00 г (5,46 ммоля) бромида галантаминия (L);
6,70 мл (20,2 ммоля = 3,7 экв.) метилмагниййодида (3 М в диэтиловом эфире);
40 мл абс. диэтилового эфира.
Через 40 мин прибавляли растворитель и перемешивали 5 ч перед гидролизом.
Выход: 760 мг (2,52 ммоля = 46% от теории) светло-желтой пены
С18Н23NO3 [301,38]
ТСХ: Rf=0,65 (СНС13:МеОН=9:1+1% NH4OH)
Т.пл.: 46-48° С
1H-ЯМР (смесь 2 изомеров, 200 МГц, СDСl3): δ 6,66 (д, J=8,3 Гц, 0,8Н), 6,65 (с, 0,2Н), 6,64 (с, 0,2Н), 6,57 (д, J=8,3 Гц, 0,8Н), 6,13 (д, J=10,1 Гц, 0,2Н), 6,07 (д, J=10,1 Гц, 0,8Н), 5,94 (дд, J=10,1, 4,4 Гц, 1Н), 4,54 (шир.с, 1Н), 4,26 (кв, J=7,0 Гц, 0,2Н), 4,08 (т, J=4,4 Гц, 1Н), 3,88 (кв, J=7,4 Гц, 0,8Н), 3,80 (с, 0,6Н), 3,78 (с, 2,4Н), 3,62 (ддд, J=14,6, 13,2, 1,0 Гц, 0,8Н), 3,45 (д, 14,2 Гц, 0,2Н), 3,12 (дт, J=14,8, 3,3 Гц, 0,2Н), 2,85 (тд, J=15,5, 3,5 Гц, 0,8Н), 2,76 (шир.с, 1Н), 2,63 (д, J=15,6 Гц, 1Н), 2,43 (с, 3Н), 2,16 (д, J=2,7 Гц, 0,2Н), 1,98 (дт, J=15,5, 2,3 Гц, 0,8Н), 1,95 (дд, J=15,5, 2,3 Гц, 0,2Н), 1,51 (д, J=7,3 Гц, 2,4Н), 1,47 (д, J=7,3 Гц, 0,6Н); 13С-ЯМР (смесь 2 изомеров, 50 МГц, CDCl3): δ 146,1 и 145,6 (с), 143,8 и 143,4 (с), 134,9 и 132,6 (с), 132,4 и 131,3 (с), 129,3 (д), 127,6 и 127,3 (д), 126,9 (д), 122,0 и 119,9 (д), 111,5 и 110,8 (д), 88,6 и 88,5 (д), 64,0 (д), 61,9 и 61,6 (д), 58,3 и 55,7 (кв), 48,8 (с), 44,1 (т), 41,3 (кв), 31,5 и 31,0 (т), 29,9 и 29,7 (т), 21,8 и 17,5 (кв).
Пример 115
[4aS-(4a?,6?,8aR*,12R*)]-4а,5,9,10,11,12-гексагидро-3-метокси-11,12-диметил-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол (=12-метилгалантамин); (основной изомер)
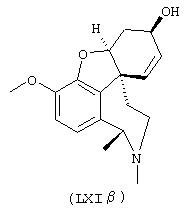
Смесь изомеров очищали колоночной хроматографией на силикагеле (СНС13:МеОН=9:1+1% NH4OH), причем смогли получить чистый изомер.
1H-ЯМР (200 МГц, CDCl3): δ 6,66 (д, J=8,3 Гц, 1Н), 6,57 (д, J=8,3 Гц, 1Н), 6,07 (д, J=10,1 Гц, 1Н), 5,94 (дд, J=10,1, 4,4 Гц, 1Н), 4,54 (шир.с, 1Н), 4,08 (т, J=4,4 Гц, 1H), 3,88 (кв, J=7,4 Гц, 1Н), 3,78 (с, 3Н), 3,62 (дд, J=14,6, 13,2 Гц, 1Н), 2,85 (тд, J=15,5, 3,5 Гц, 1Н), 2,63 (д, J=15,6 Гц, 1Н), 2,43 (с, 3Н), 2,11 (дт, J=13,3, 2,4 Гц, 1Н), 1,95 (ддд, J=16,5, 5,0, 1,8 Гц, 1Н), 1,51 (д, J=7,3 Гц, 3Н), 1,47 (дд, J=13,3 Гц, 1Н); 13С-ЯМР (50 МГц, СDС13): δ 146,2 (с), 143,5 (с), 135,1 (с), 131,4 (с), 129,4 (д), 127,4 (д), 122,2 (д), 111,6 (д), 88,8 (д), 64,0 (д), 61,8 (д), 55,8 (кв), 48,9 (с), 44,2 (т), 41,5 (кв), 31,7 (т), 29,8 (т), 21,9 (кв).
Пример 116
[(± )4аα ,6β ,8aR*)]-4a,5,9,10,11,12-гексагидро-3-метокси-6Н-1,11,12-триметилбензофуро[3а,3,2-ef][2]бензазепин-6-ол, 1,12-диметилгалантамин (Pi-21)
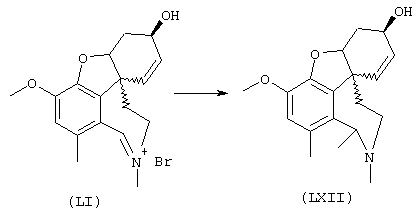
500 г (1,31 ммоля) бромида 1-метилгалант-аминия (LI);
1,00 мл (3,00 ммоля = 2,3 экв.) метилмагниййодида (3 М в диэтиловом эфире);
15 мл абсолютного диэтилового эфира.
Во время прибавления исходной смеси добавляли 5 мл диэтилового эфира, чтобы сделать реакционную смесь перемешиваемой. После окончания прибавления исходной смеси (30 мин) добавляли 10 мл диэтилового эфира. Через 2,5 часа реакционную смесь гидролизовали.
Выход: 73 мг (0,23 ммоля = 18% от теории)
C19H25NO3 [315,41]
ТСХ: Rf=0,50 (СНС12:МеОН=9:1+1% NH40H)
Т.пл.: 45-50° С
1H-ЯМР (смесь 2 изомеров, 200 МГц, CDCl3): δ 6,57 (с, 1H), 6,06 (д, J=10,2 Гц, 1H), 5,95 (дд, J=10,2, 4,5 Гц, 1Н), 4,59-4,44 (м, 1H), 4,17-4,03 (м, 2Н), 3,81 (с, 3Н), 3,75-3,55 (м, 1H), 2,97-2,77 (м, 1H), 2,73-2,55 (м, 1H), 2,51 (с, 0,5Н), 2,46 (с, 2,5Н), 2,25 (с, 3Н), 2,15-1,87 (м, 2Н), 1,51 (д, J=7,3 Гц, 3Н), 1,30-1,18 (м, 1H); 13С-ЯМР (смесь 2 изомеров, 50 МГц, CDCl3): δ 144,7 (с), 142,9 (с), 132,5 и 131,7 (с), 130,4 и 129,0 (с), 129,3 (д), 127,8 и 126,8 (с), 127,5 (д), 114,3 и 114,0 (д), 88,7 и 88,4 (д), 62,2 и 61,8 (д), 59,3 и 58,8 (д), 56,0 и 55,8 (кв), 49,4 и 48,4 (с), 44,3 (т), 41,5 (кв), 31,7 (т), 29,9 (т), 19,7 и 19,2 (кв), 18,8 (кв).
Пример 117
[4aS-(4aα ,6а,8aR*)]-4а,5,9,10,11,12-гексагидро-3-мефокси-11,12-диметил-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол, 12-метилэпигалантамин (Pi-22)
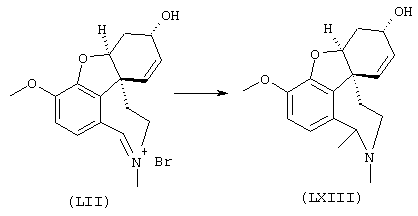
300 мг (0,82 ммоля) бромида эпигалантаминия (LII);
1,00 мл (3,00 ммоля = 3,70 экв.) метилмагниййодида (3 М в диэтиловом эфире).
Реактив Гриньяра прибавляли за 30 мин, затем добавляли 5 мл эфира. Через 20 мин прибавляли 15 мл эфира и через 3 ч гидролизовали.
Очистку производили колоночной хроматографией (СНС13:МеОН=9:1).
Выход: 60 мг (0,20 ммоля = 24% от теории)
С18Н23NO3 [301,39]
ТСХ: Rf=0,78 (СНС13:МеОН=9:1+1% NH4OH)
1H-ЯМР (200 МГц, СDС13): δ 6,65 (д, J=8,3 Гц, 1Н), 6,53 (д, J=8,3Н, 1Н), 6,04 (д, J=10,4 Гц, 1Н), 5,76 (д, J=10,4 Гц, 1Н), 4,70-4,57 (м, 1Н), 4,54 (шир.с, 1Н), 3,93-3,82 (м, 1H), 3,81 (с, 3Н), 3,61 (т, J=13,6 Гц, 1Н), 2,94-2,67 (м, 3Н), 2,41 (с, 3Н), 2,20 (тд, J=13,2, 2,4 Гц, 1H), 1,69 (ддд, J=13,6, 10,6, 2,0 Гц, 1H), 1,52 (д, J=7,3 Гц, 3Н), 1,59-1,44 (м, 1H); 13С-ЯМР (50 МГц, СDС13): δ 147,0 (с), 143,2 (с), 134,5 (с), 131,3 (д), 131,1 (с), 128,9 (д), 121,5 (д), 111,2 (д), 88,6 (д), 64,1 (д), 62,7 (д), 55,6 (кв), 48,6 (с), 44,4 (т), 41,2 (кв), 32,0 (т+т), 21,8 (кв).
Пример 118
[4aS-(4аα ,6β ,8aR*)]-4a,5,9,10-тетрагидро-6-гидрокси-3-метокси-11-метил-6Н-бензофуро [3а,3,2-ef][2]бензазепин-12(11Н)-он (МН-128)
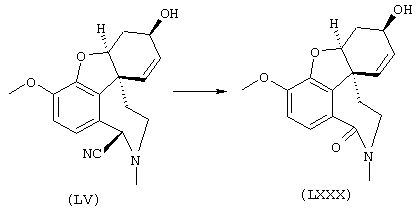
200 мг (0,64 ммоля) галантамин-12-карбонитрила (LV);
0,64 мл (0,64 ммоля) триметилсиланолята натрия (1 М в CH2Cl2);
5 мл абсолютного тетрагидрофурана.
Исходную смесь перемешивали в атмосфере N2 при комнатной температуре 72 час, причем образовывался осадок, который отсасывали, промывали тетрагидрофураном и сушили.
Выход: 177 мг (0,59 ммоля = 92% от теории) светло-желтого порошка
C17H19NO4 [301,35]
ТСХ: Rf=0,65 (СНС13:МеОН=9:1)
Т.пл.: 251-155° С
1H-ЯМР (200 МГц, СDС13): δ 7,49 (д, J=8,5 Гц, 1Н), 6,89 (д, J=8,5 Гц, 1Н), 5,87 (дд, J=9,8, 5,3 Гц, 1Н), 5,53 (д, J=9,8 Гц, 1H), 4,74 (шир.с, 1Н), 4,13 (дт, J=10,1, 4,8 Гц, 1H), 3,91 (с, 3Н), 3,80 (дт, J=14,1, 2,1 Гц, 1H), 3,25-3,16 (м, 1Н), 3,19 (с, 3Н), 2,71 (дт, J=15,7, 1,7 Гц, 1H), 2,31 (дт, J=14,1, 3,9 Гц, 1H), 2,06 (ддд, J=15,7, 5,0, 2,3 Гц, 1H), 1,83 (дт, J=14,6, 2,5 Гц, 1H); 13С-ЯМР (50 МГц, CDCl3): δ 168,3 (с), 146,9 (с), 145,1 (с), 131,7 (с), 131,6 (д), 125,2 (д), 124,4 (д), 123,4 (с), 111,9 (д), 89,2 (д), 61,0 (д), 55,8 (кв), 49,5 (т), 48,0 (с), 38,3 (т), 34,9 (кв), 29,3 (т).
Пример 119
11-Оксид [4аS-(4аα ,6β ,8аR*)]-4а,5,9,10-тетрагидро-3-метокси-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ола (МН-142)
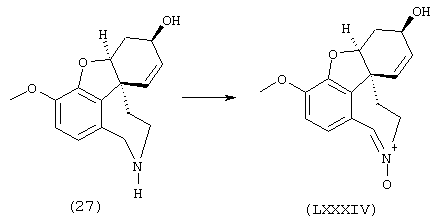
4,25 г (15,55 ммоля) деметилгалантамина (27);
85 мг (0,77 ммоля) = 5% диоксида селена;
70 мл 10%-ного водного раствора H2O2 (35%) в ацетоне (раствор для оксидирования).
Деметилгалантамин растворяли в растворе для оксидирования без доступа влаги и воздуха и охлаждали до 0° С. Затем прибавляли SeO2 и перемешивали сначала 20 мин при 0° С и затем 4 ч при комнатной температуре, при этом выпадал осадок, который отсасывали, промывали ацетоном и сушили. Фильтрат смешивали с водой, ацетон отгоняли в вакууме и оставшуюся водную фазу экстрагировали метиленхлоридом. Объединенные органические фазы промывали насыщенным раствором поваренной соли, сушили над сульфатом натрия, фильтровали и растворитель отгоняли. Маслянистый остаток переносили в ацетон, при этом выпадал осадок, который мог быть получен как вторая фракция. Повторными упариваниями фильтрата и внесением в ацетон могли быть получены дополнительные фракции.
Выход: 3,53 г (12,29 ммоля = 79% от теории) белого порошка
C16H17NO4 [287,31]
ТСХ: Rf=0,42 (СНС13:МеОН=9:1+1% конц. NH4OH)
Т.пл.: 232-233° С (СНС13); при 215° С появляется жидкость
C16H17NO4×0,2 Н2O [290,91]
Вычислено, %: С 66,06; Н 6,03; N 4,81.
Найдено, %: С 66,11; Н 6,05; N 4,73.
1Н-ЯМР (200 МГц, ДМСО-d6): δ 7,82 (с, 1Н), 6,90 (с, 2Н), 5,81 (дд, J=10,1, 4,4 Гц, 1Н), 5,54 (д, J=10,1 Гц, 1Н), 4,64 (шир.с, 1Н), 4,36 (д, J=5,5 Гц, 1Н), 4,14-4,02 (м, 2Н), 3,79 (с, 3Н), 2,39-1,99 (м, 4Н); 13С-ЯМР (50 МГц, ДМСО-d6): δ 146,1 (с), 144,6 (с), 134,6 (д), 131,8 (с), 128,3 (д), 127,6 (д), 122,4 (д), 118,3 (с), 112,6 (д), 86,7 (д), 61,8 (д), 59,1 (т), 55,7 (кв), 45,3 (с), 34,2 (т), 29,7 (т).
Пример 119
Метиловый эфир [4aS-(4aα ,6β ,8aR*)]-4a,5,9,10,13,14a-гексагидро-6-гидрокси-3-метокси-6Н,14Н-бензофуро[3а,3,2-ef]-изоксазоло[3,2-а][2]бензазепин-13(или 14)-карбоновой кислоты (МН-143)
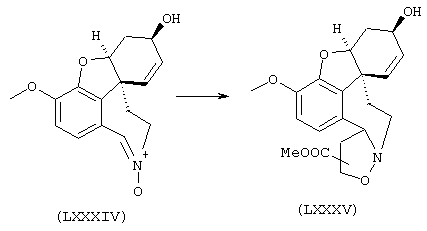
175 мг (0,61 ммоля) галантаминнитрона (LXXXIV);
0,05 мл (0,61 ммоля) метилового эфира акриловой кислоты;
6 мл абсолютного толуола.
Реагенты нагревали в атмосфере аргона с обратным холодильником 48 час, затем растворитель отгоняли. Остаток очищали колоночной хроматографией (СНС13:МеОН=9:1+1% конц. NH4OH).
Выход: 225 мг (0,60 ммоля = 99% от теории) светло-коричневого стеклоподобно застывающего масла
С20Н23NO6 [373,40]
ТСХ: Rf=0,74 (СНС13:МеОН=9:1+1% конц. NH4OH)
C20H23NO6×0,5 Н2О [382,40]
Вычислено, %: С 62,82; Н 6,33; N 3,66.
Найдено, %: С 62,88; Н 6,17; N 3,65.
Смесь стерео- и региоизомеров. Точная обработка спектров находится в главе 2.2.
Пример 120
Метиловый эфир [4aS-(4aα ,6β ,8aR*,14aS*)]-4a,5,9,10-тетрагидро-6-гидрокси-3-метокси-6Н,14аН-бензофуро[3а,3,2-ef]-изоксазоло[3,2-а][2]бензазепин-14-карбоновой кислоты (МН-145)
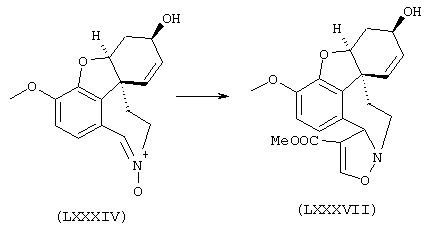
200 мг (0,70 ммоля) галантаминнитрона (LXXXIV);
0,06 мл (0,70 ммоля) метилового эфира ацетиленкарбоновой кислоты (метилового эфира пропиоловой кислоты);
5 мл абсолютного толуола.
Реагенты нагревали 10 мин в атмосфере, аргона с обратным холодильником, при этом раствор уже при нагревании окрашивался в оранжевый цвет; растворитель затем отгоняли. Остаток очищали колоночной хроматографией (СНС13:МеОН=9:1). Маслянистый остаток кристаллизовали из этанола, причем смогли получить желтые иглообразные кристаллы.
Выход: 261 мг (0,70 ммоля = 100% от теории) светло-желтых иглообразных кристаллов.
C20H21NO6 [371,39]
ТСХ: Rf=0,73 (СНС13:МеОН=9:1)
Т.пл.: 151-154° С
Вычислено, %: С 64,68; Н 5,70; N 3,77.
Найдено, %: С 64,59; Н 5,89; N 3,67.
1H-ЯМР (200 МГц, CDCl3): δ 7,54 (с, 1H), 6,96 (д, J=8,4 Гц, 1Н), 6,74 (д, J=8,4 Гц, 1H), 5,96-5,77 (м, 2Н), 5,67 (с, 1H), 4,55 (шир.с, 1Н), 4,10 (шир.с, 1Н), 3,85 (с, 3Н), 3,68 (с, 3Н), 3,59 (ддд, J=14,3, 6,8, 3,8 Гц, 1H), 3,30 (ддд, J=12,9, 9,3, 3,4 Гц, 1H), 2,64 (дд, J=15,7, 3,7 Гц, 1H), 2,15 (тд, J=7,7, 3,4 Гц, 1Н), 2,01 (ддд, J=15,6, 5,3, 1,9 Гц, 1Н), 1,54 (ддд, J=15,6, 6,7, 3,5 Гц, 2Н); 13С-ЯМР (50 МГц, CDCl3): δ 163,9 (с), 154,6 (д), 146,8 (с), 145,1 (с), 133,3 (с), 130,3 (д), 126,9 (д), 125,3 (с), 123,3 (д), 111,3 (д), 109,9 (с), 89,1 (д), 68,7 (д), 61,4 (д), 55,8 (кв), 52,4 (т), 51,4 (кв), 47,2 (с), 29,2 (т), 28,0 (т).
Пример 121
[4aS-(4aα ,6β ,8aR*)]-4a,5,9,10,13,14а-гексагидро-6-гидрокси-3-метокси-6Н,14Н-бензофуро [3а,3,2-ef] изоксазоло [3,2-а] [2]бензазепин-13(или 14)-карбонитрил (МН-146)
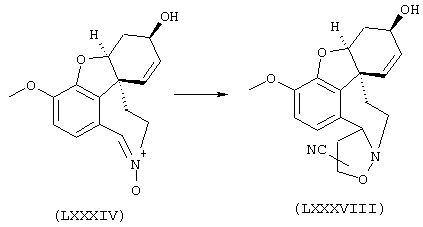
200 мг (0,70 ммоля) галантаминнитрона (LXXXIV);
0,05 мл (0,70 ммоля) акрилонитрила;
5 мл абсолютного толуола.
Реагенты нагревали 2 часа в атмосфере аргона с обратным холодильником, затем растворитель отгоняли. Остаток очищали колоночной хроматографией (СНС13:МеОН=9:1).
Выход: 230 мг (0,68 ммоля = 97% от теории) светло-желтого масла
C19H20N2O4 [340,38]
ТСХ: Rf=0,74 (СНС13:МеОН=9:1)
C19H20N2O4×0,2 H2O [343,98]
Вычислено, %: С 66,34; Н 5,98; N 8,14.
Найдено, %: С 66,22; Н 6,03; N 7,86.
Смесь 4 стерео- и региоизомеров. Точная обработка спектров находится в главе 2.2.
Пример 122
13-ацетат [4aS-(4aα ,6β ,8aR*,14aS*)]-4а,5,9,10,13,14а-гексагидро-6-гидрокси-3-метокси-6Н,14аН-бензофуро[3а,3,2-ef]-изоксазоло[3,2-а][2]бензазепин-6,13-диола (МН-153)
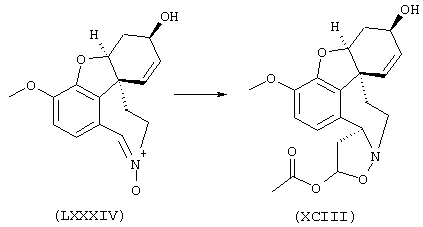
200 мг (0,70 ммоля) галантаминнитрона (LXXXIV);
0,24 мл (2,10 ммоля = 4экв.) винилового эфира уксусной кислоты;
5 мл абсолютного толуола.
Реагенты нагревали 4 дня в атмосфере N2 с обратным холодильником, причем каждый день добавляли 1 экв. винилового эфира уксусной кислоты. Затем растворитель отгоняли и остаток очищали колоночной хроматографией (СНС13:МеОН=9:1). Очищенное масло выкристаллизовывали из метанола.
Выход: 256 мг (0,69 ммоля = 98% от теории) бежевых кристаллов
C20H23NO6 [373,41]
ТСХ: Rf=0,70 (СНС13:МеОН=9:1)
Т.пл.: 132-134° С
C20H23NO6×0,6 H2O [384,21]
Вычислено, %: С 62,52; Н 6,35; N 3,65.
Найден, %: С 62,59; Н 6,12; N 3,61.
1H-ЯМР (смесь 2 изомеров, 200 МГц, CDCl3): δ 6,76 и 6,73 (д, J=8,3 Гц, 1Н), 6,68 и 6,60 (д, J=7,7 Гц, 1Н), 6,36 (д, J=4,1 Гц, 1Н), 6,30 (д, J=10,6 Гц, 1Н), 6,08-5,91 (м, 1H), 4,60 и 4,50 (шир.с, 1H), 4,32 (дд, J=11,3, 5,6 Гц, 1H), 4,13 (шир.с, 1H), 3,84 (с, 3Н), 3,80 (дд, J=19,1, 9,8 Гц, 1H), 3,22 (ддд, J=10,0, 6,8, 2,8 Гц, 1Н), 2,92 (дд, J=12,3, 5,8 Гц, 1H), 2,78-2,57 (м, 2Н), 2,09 (с, 3Н), 2,07-1,79 (м, 2Н); 13С-ЯМР (смесь 2 изомеров, 50 МГц, CDCl3): δ 169,6 (с), 145,8 (с), 143,8 (с), 134,1 (с), 129,8 (д), 128,0 и 127,7 (д), 127,0 (с), 118,7 и 118,5 (д), 111,4 и 110,9 (д), 95,3 и 94,5 (д), 88,7 и 88,2 (д), 61,4 (д+д), 55,7 и 55,5 (кв), 54,5 (т), 47,3 (с), 41,7 (т), 29,7 (т), 29,3 (т), 21,0 и 20,9 (кв).
Пример 123
[4аS-(4аα ,6β ,8аR*,14аS*)]-4а,5,9,10-тетрагидро-6-гидрокси-3-метокси-6Н,14аН-бензофуро[3а,3,2-ef]изоксазоло[3,2-а][2]бензазепин-14-карбонитрил (МН-159)
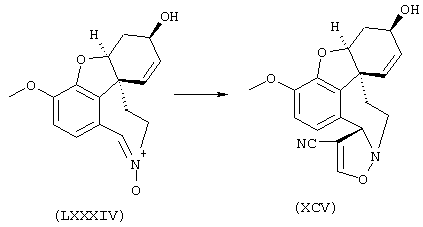
500 мг (1,74 ммоля) галантаминнитрона (LXXXIV);
90 мг (1,74 ммоля) ацетиленкарбонитрила;
10 мл абсолютного толуола.
Реагенты перемешивали 7 дней в атмосфере аргона при комнатной температуре, при этом раствор окрашивался в желтый цвет, затем растворитель отгоняли. Остаток выкристаллизовывали из метанола, отсасывали и промывали метанолом. Фильтрат упаривали и из остатка колоночной хроматографией (СНС13:МеОН=9:1) получали 2-ю фракцию продукта.
Выход: 570 мг (1,68 ммоля = 97% от теории) бесцветных кристаллов.
C19H18N2O4 [338,37]
ТСХ: Rf=0,60 (СНС13:МеОН=9:1)
Т.пл.: 137-139° С
Вычислено, %: С 67,45; Н 5,36; N 8,28.
Найдено, %: С 64,17; Н 5,41; N 8,19.
1H-ЯМР (200 МГц, CDCl3): δ 7,09 (д, J=8,6 Гц, 1Н), 6,76 (д, J=8,6 Гц, 1H), 5,98 (с, 2Н), 5,54 (с, 1Н), 4,52 (шир.с, 1H), 4,11 (шир.с, 1H), 3,83 (с, 3Н), 3,75-3,59 (м, 1H), 3,42-3,25 (м, 1H), 2,64 (дд, J=15,9, 3,2 Гц, 1Н), 2,44 (д, J=11,5 Гц, 1H), 2,11-1,94 (м, 2Н), 1,71-1,52 (м, 1H); 13С-ЯМР (50 МГц, CDCl3): δ 156,5 (д), 147,1 (с), 145,5 (с), 132,7 (с), 129,6 (д), 127,9 (д), 123,8 (с), 120,8 (д), 114,0 (с), 111,7 (д), 88,9 (д), 88,6 (с), 68,4 (д), 61,3 (д), 55,9 (кв), 52,5 (т), 47,2 (с), 29,3 (т), 28,3 (т).
Пример 125:
Стадия 1:
1-Бром-5-метокси-2(2-метоксиэтен-1-ил)-4-(1-метилэтокси)бензол
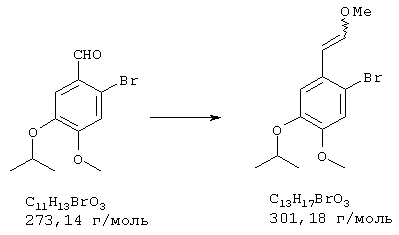
К суспензии хлорида (метоксиметил)трифенилфосфония (50,0 г, 152 ммоля) в абсолютном ТГФ (330 мл) при охлаждении льдом прибавляли трет-бутилат калия (20,5 г, 183 ммоля). Через 15 мин порциями прибавляли 2-бром-4-метокси-5-(1-метилэтокси)бензальдегид (33,1 г, 121 ммоль).
Через 15 мин остаток, полученный после удаления растворителя на роторном испарителе, распределяли между водой (300 мл) и эфиром (300 мл). Органическую фазу сушили (сульфат натрия), фильтровали и полученный после упаривания остаток (37,3 г) очищали посредством MPLC (петролейный эфир:этиловый эфир уксусной кислоты = 2:1, поток 70 мл/мин). Указанным способом получили продукт в виде бесцветных кристаллов (32,5 г, 85%).
Температура плавления: 43-45° С.
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 2:1 Rf=0,75
1H-ЯМР (CDCl3) δ 7,00 (с, 1Н); 6,90 (с, 1Н), 6,83 (д, J=12,7 Гц, 1Н транс), 6,13 (д, J=7,6 Гц, 1Н цис), 5,98 (д, J=12,7 Гц, 1Н транс), 5,50 (д, J=7,6 Гц, 1Н цис), 4,49 (септет, J=6,4 Гц, 1Н), 3,81 (с, 3Н), 3,74 (с, 3Н транс), 3,70 (с, 3Н цис), 1,35 (д, J=6,4 Гц, 6Н); 13С-ЯМР (CDCl3) δ 149,2 и 149,6 (с), 147,6 и 148,9 (с), 146,0 и 146,7 (д), 127,5 и 128,4 (с), 115,7 и 117,2 (д), 113,6 и 116,2 (д), 113,3 и 113,7 (с), 103,8 и 104,2 (д), 71,5 и 71,9 (д), 56,1 и 56,4 (кв), 56,0 и 60,6 (кв), 21,9 и 22,0 (кв).
Стадия 2:
2-Бром-4-метокси-5 -(1-метилэтокси)бензолацетальдегид
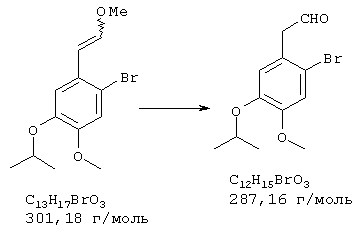
1-Бром-5-метокси-2-(2-метоксиэтен-1-ил)-4-(1-метилэтокси) бензол (20,0 г, 66,4 ммоля) перемешивали в тетрагидрофуране (250 мл)/2 н НС1 (10 мл) три часа при температуре кипения.
После удаления растворителя на роторном испарителе остаток распределяли между водой (200 мл) и эфиром (200 мл), водную фазу экстрагировали эфиром (3× 100 мл), объединенные органические фазы промывали водой (4× 150 мл), насыщенным раствором гидрокарбоната натрия (2× 200 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь) и фильтровали. После упаривания получали продукт в виде желтого масла (18,7 г, 98%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 4:1 Rf=0,77
1H-ЯМР (CDCl3) δ 9,71 (т, J=1,71 Гц, 1Н), 7,06 (с, 1Н), 6,80 (с, 1H), 4,49 (септет, J=6,4 Гц, 1Н), 3,90 (с, 3Н), 3,73 (д, J=1,71 Гц, 2Н), 1,35 (д, J=6,4 Гц, 6Н); 13С-ЯМР (CDCl3) δ 191,8 (д), 146,6 (с), 145,1 (с), 125,4 (с), 118,1 (с), 115,8 (д), 113,7 (д), 71,5 (д), 56,4 (кв), 49,8 (т), 21,8 (кв).
Стадия 3:
2-бром-4-метокси-5-(1-метилэтокси) бензолэтанол
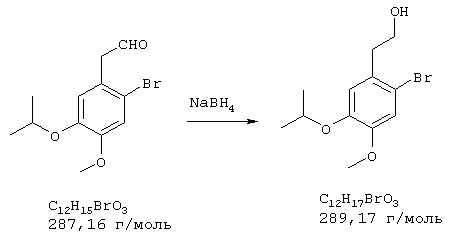
2-Бром-5-(1-метилэтокси)-4-метоксибензолацетальдегид (2,60 г, 9,05 ммоля) прибавляли при 15° С за 30 мин к суспензии боргидрида натрия (0,341 г, 9,05 ммоля) в абсолютном этаноле (40 мл) и перемешивали при указанной температуре два часа.
Этанол удаляли на роторном испарителе, и остаток распределяли между насыщенным раствором гидрокарбоната натрия (200 мл) и эфиром (200 мл). Водную фазу экстрагировали эфиром (3× 50 мл). Объединенные органические фазы промывали водой (3× 200 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь) и фильтровали. После упаривания получали продукт в виде бесцветных кристаллов (2,60 г, 99%).
ТСХ: ПЭ (петролейный эфир):ЭЭ (диэтиловый эфир) = 9:1, 0,25
1H-ЯМР (CDCl3) δ 6,98 (с, 1Н), 6,80 (с, 1Н), 4,47 (септет, J=6,3 Гц, 1Н), 3,82 (т, J=7,0 Гц, 2Н), 3,80 (с, 3Н), 2,90 (т, J=7,0 Гц, 2Н), 1,32 (д, J=7,3 Гц, 6Н); 13С-ЯМР (СDС13) δ 149,7 (с), 146,4 (с), 129,6 (с), 118,5 (д), 116,3 (д), 114,8 (с), 71,8 (д), 62,2 (т), 56,1 (кв), 38,8 (т), 21,9 (кв).
МТ-163 JOS 1682
Cl2H17BrO3
Вычислено, %: С 49,84; Н 5,93.
Найдено, %: С 49,69; Н 5,79.
Стадия 4:
1-Бром-2-(2-йодэтил)-5-метокси-4-(1-метилэтокси) бензол
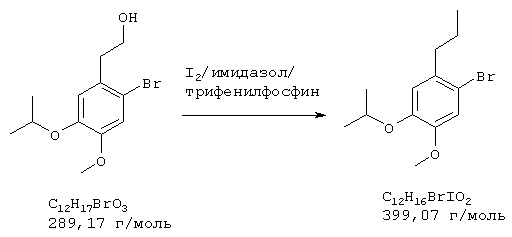
Трифенилфосфин (24,7 г, 94,0 ммоля), имидазол (12,8 г, 188,0 ммоля) и йод (23,06 г, 90,9 ммоля) перемешивали в абсолютном CH2Cl2 (150 мл) один час при 15° С.
2-Бром-5-(1-метилэтокси)-4-метоксибензолэтанол (18,0 г, 62,2 ммоля) в абсолютном СН2Сl2 (100 мл) прибавляли по каплям при указанной температуре в течение 10 мин и смесь перемешивали два часа при комнатной температуре.
Смесь фильтровали и фильтрат промывали водой (1× 200 мл). Водную фазу экстрагировали CH2Cl2 (2× 50 мл) и объединенные органические фазы промывали раствором тиосульфата натрия (1× 200 мл), водой (1× 200 мл), раствором сульфата меди (1× 200 мл), водой (1× 200 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и растворитель удаляли на роторном растворителе.
После очистки колоночной хроматографией (1000 г силикагеля/петролейный эфир:этиловой эфир уксусной кислоты = 96:4) получали продукт в виде бесцветных иглообразных кристаллов (19,0 г, 77%).
1H-ЯМР (CDCl3) δ 7,00 (с, 1Н), 6,77 (с, 1Н), 4,49 (септет, J=6,3 Гц, 1Н), 3,81 (с, 3Н), 3,39-3,24 (м, 2Н), 3,24-3,09 (м, 2Н), 1,36 (д, J=7,3 Гц, 6Н); 13С-ЯМР (СDС13): δ 150,0 (с), 146,5 (с), 131,7 (с), 118,0 (д), 116,3 (д), 114,3 (с), 71,8 (д), 56,1 (кв), 40,0 (т), 22,0 (кв), 4,2 (т).
MT-164 JOS 1704
C12H16BrIO2
Вычислено, %: С 36,12; Н 4,04.
Найдено, %: С 36,38; Н 3,91.
Стадия 5:
Диметиловый эфир 2-[-2-[2-бром-4-метокси-5-(1-метилэтокси)фенил]этил]пропандикислоты
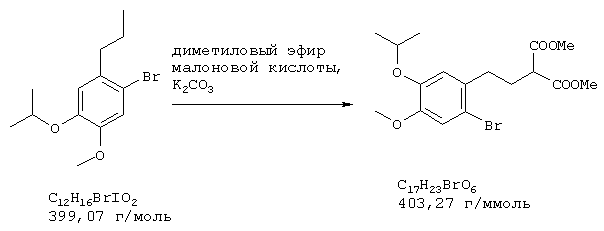
1-Бром-2-(2-йодэтил)-4-(1-метилэтокси)-5-метоксибензол (18,0 г, 45,1 ммоля), карбонат калия (32,0 г, 321 ммоль, безводный свежеразмолотый) и диметиловый эфир малоновой кислоты (50,0 г, 378 ммоля) перемешивали в абсолютном ДМФА (200 мл) 12 часов при 80° С.
Смесь фильтровали, растворитель удаляли на роторном испарителе и остаток распределяли между водой (300 мл) и эфиром (300 мл). Водную фазу экстрагировали эфиром (3× 50 мл), объединенные органические фазы промывали водой (4× 150 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали, полученный после отгонки растворителя остаток перегонкой освобождали от избыточного малонового эфира (160° С/15 мбар) и очищали перегонкой с шариковым дефлегматором (170° С/0,06 мбара), получая продукт в виде бесцветного масла (18,9 г, 72%).
1H-ЯМР (CDCl3) δ 6,99 (с, 1Н), 6,73 (с, 1H), 4,49 (септет, J=6,3 Гц, 1H), 3,81 (с, 3Н), 3,76 (с, 6Н), 3,39 (т, J=7,9 Гц, 1H), 2,68 (т, J=7,9 Гц, 2Н), 2,18 (кв, J=7,9 Гц, 2Н), 1,34 (д, J=6,3 Гц, 6Н); 13С-ЯМР (CDCl3) δ 169,6 (с), 149,7 (с), 146,6 (с), 131,7 (с), 117,8 (д), 116,3 (д), 114,6 (с), 71,8 (д), 56,2 (кв), 52,5 (кв), 50,9 (д), 33,1 (т), 29,0 (т), 22,0 (кв).
MT-165 JOS 1771
С17Н23ВrО6
Вычислено, %: С 50,63; Н 5,75.
Найдено, %: С 50,87; Н 5,62.
Стадия 6:
Диметиловый эфир 2-[2-[2-бром-4-метокси-5-(1-метилэтокси) фенил]этил]-2-[4-(1-метилэтокси)фенилметил]-пропандикислоты
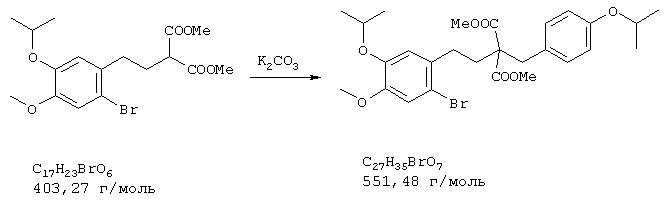
l-Бpoм-2-(2-йодэтил)-4-(1-метилэтокси)-5-метоксибензол (18,0 г, 45,1 ммоля), карбонат калия (32,0 г, 321 ммоль, безводный свежеразмолотый) и (50,0 г, 378,4 ммоля) диметиловый эфир малоновой кислоты перемешивали в (200 мл) безводном ДМФА 12 часов при 80° С.
Смесь фильтровали, растворитель отгоняли и остаток распределяли между 300 мл воды и 300 мл эфира. Водную фазу трижды экстрагировали по 50 мл, объединенные органические фазы промывали четыре раза по 150 мл воды и один раз 200 мл насыщенного раствора поваренной соли, фильтровали и растворитель отгоняли. Избыточный диметиловый эфир малоновой кислоты отделяли перегонкой (160° С/15 мбар) и остаток очищали перегонкой с шариковым дефлегматором (170° С/0,06 мбар), получая продукт в виде бесцветного масла (18,9 г, 72%).
МТ-166 JOS 1694
С27Н35ВrO7
Вычислено, %: С 58,81; Н 6,40.
Найдено, %: С 59,03; Н 6,24.
Стадия 7:
4-[2-бром-4-метокси-5-(1-метилэтокси)]-α -[4-(1-метилэтокси) фенилметил]бензолбутановая кислота
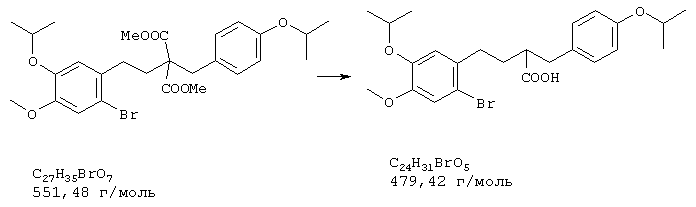
Диметиловый эфир 2-[2-[2-бром-5-(1-метилэтокси)-4-метоксифенил]этил]-2-[4-(1-метилэтокси)фенилметил]пропандикарбоновой кислоты (18,1 г, 32,8 ммоля) и гидроксид калия (17,5 г, 312 ммолей) перемешивали в смеси этанола (100 мл) и воды (20 мл) 12 часов при температуре кипения.
Реакционную смесь подкисляли концентрированной соляной кислотой до рН 1 и кипятили один час с обратным холодильником.
Оставшийся после удаления растворителя остаток распределяли между водой (250 мл) и эфиром (250 мл). Водную фазу экстрагировали эфиром (2× 100 мл), объединенные органические фазы промывали водой до нейтральной реакции, насыщенным раствором поваренной соли (150 мл) и сушили (сульфат натрия/активированный уголь). Оставшийся после удаления растворителя остаток декарбоксилировали в трубке с шаровым расширением 30 мин при 160° С в высоком вакууме и затем перегоняли при 210° С/0,008 мбар. Указанным способом получали продукт в виде бесцветных кристаллов (13,3 г, 84%).
1Н-ЯМР (CDCl3) δ 7,04 (д, J=9,5 Гц, 2Н), 6,99 (с, 1Н), 6,80 (д, J=9,5 Гц, 2Н), 6,77 (с, 1Н), 4,60-4,39 (м, 2Н), 3,79 (с, 3Н), 3,09-2,58 (м, 5Н), 2,09-1,72 (м, 2Н), 1,43-1,29 (м, 1Н);
13С-ЯМР (СDС13): 181,0 (с), 156,2 (с), 149,3 (с), 146,3 (с), 132,3 (с), 130,7 (с), 129,6 (д), 117,6 (д), 116,1 (д), 115,7 (д), 114,3 (с), 71,6 (д), 69,6 (д), 55,9 (кв), 46,7 (д), 37,0 (т), 33,1 (т), 317 (т), 21,8 (кв).
Стадия 8:
Амид 4-[2-бром-4-метокси-5-(1-метилэтокси)]-α -[4-(1-метилэтокси)фенилметил]бензолбутановой кислоты
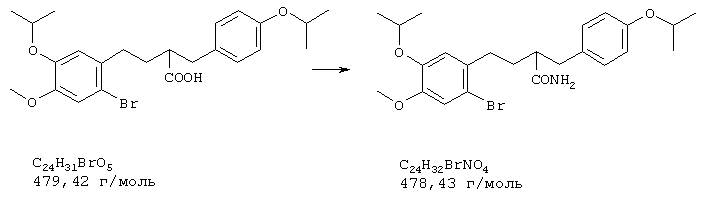
К 4-[2-бром-4-метокси-5-(1-метилэтокси)]-α -[4-(1-метил-этокси)фенил]бензолбутановой кислоте (24,0 г, 50,1 ммоля) в абсолютном СН2Сl2 (200 мл) прибавляли по каплям дихлорангидрид щавелевой кислоты (15 мл) при 0° С в течение 15 мин и смесь перемешивали два часа при той же температуре.
Растворитель удаляли на роторном испарителе, остаток помещали в абсолютный ТГФ (100 мл) и при 0° С в течение двух часов пропускали аммиак. Смесь перемешивали один час при 0° С и выливали в воду (1000 мл).
Выпавшие кристаллы отфильтровывали и извлекали водой (4× 500 мл). Указанным способом получали продукт в виде бесцветных кристаллов (19,9 г, 83%).
1H-ЯМР (CDCl3) δ 7,04 (д, J=9,5 Гц, 2Н), 6,96 (с, 1Н), 6,72 (д, J=9,5 Гц, 2Н), 6,70 (с, 1Н), 6,00 (шир., 1Н), 5,55 (шир., 1Н), 4,60-4,30 (м, 2Н), 3,77 (с, 3Н), 2,96-2,52 (м, 4Н), 2,51-2,28 (м, 1Н), 2,03-1,60 (м, 2Н), 1,36-1,20 (м, 12Н);
13С-ЯМР (CDCl3): 1774, (с), 156,2 (с), 149,2 (с), 146,4 (с), 132,7 (с), 131,1 (д), 129,7 (д), 117,5 (с), 116,1 (д), 115,7 (д), 114,4 (д), 71,6 (д), 69,6 (д), 56,0 (кв), 48,6 (д), 38,0 (т), 33,3 (т), 32,5 (т), 21,9 (кв).
МТ-168 JOS 1770
С24Н32ВrNO4
Вычислено, %: С 60,25; Н 6,74; N 2,93.
Найдено, %: С 60,15; Н 6,55; N 2,77.
Стадия 9:
Амид 4-(2-бром-5-гидрокси-4-метокси)-α -(4-гидроксифенил-метил)бензолбутановой кислоты
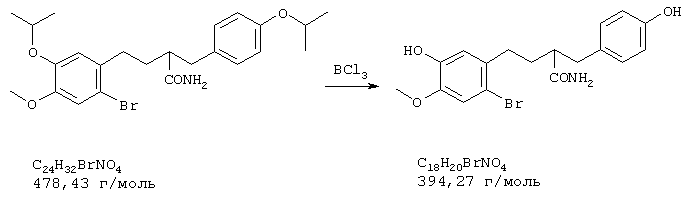
К амиду 4-[2-бром-4-метокси-5-(1-метилэтокси)]-α -[4-(1-метилэтокси)фенилметил]бензолбутановой кислоты (10,0 г, 20,9 ммоля) в абсолютном CH2Cl2 (150 мл) прибавляли по каплям при -78° С трихлорид бора (45 мл, 1,6 М в CH2Cl2) и перемешивали при той же температуре один час. Затем смесь нагревали до комнатной температуры и перемешивали два часа.
Смешивали с водой (400 мл) и отгоняли растворитель на роторном испарителе, при этом выпадал кристаллический сырой продукт, который отфильтровывали и извлекали водой (6× 200 мл) и диизопропиловым эфиром (2× 40 мл). При этом получали продукт в виде бесцветных кристаллов (7,11 г, 86%).
МТ-171 JOS 1714
C18H20BrNO4·0,25 Н2О
Вычислено, %: С 54,22; Н 5,18; N 3,51.
Найдено, %: С 54,05; Н 4,95; N 3,54.
Стадия 10:
Амид 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-окса-6Н-бензо[а]циклогепта[hi]бензофуран-10-карбоновой кислоты (SPH-1478)
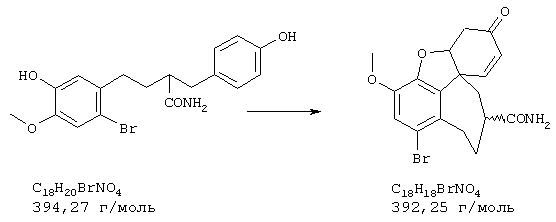
Амид α -[[2-бром-5-гидрокси-4-метоксифенил]метил]-4-гидроксибензолбутановой кислоты (3,00 г, 7,61 ммоля) суспендировали в хлороформе (300 мл) и смешивали с раствором гексацианоферрата(III) калия (13,2 г, 40,0 ммоля) в растворе карбоната калия (75 мл, 10%-ный).
Смесь активно перемешивали при комнатной температуре 40 мин и фильтровали через Hyflo. Водную фазу экстрагировали хлороформом (2× 50 мл), объединенные органические фазы промывали водой (2× 200 мл) и насыщенным раствором поваренной соли (1× 150 мл), сушили (сульфат натрия/силикагель) и полученный после упаривания растворителя сырой продукт очищали колоночной хроматографией (50 г силикагеля, этиловый эфир уксусной кислоты). Указанным способом получали продукт в виде бесцветных кристаллов (179 мг, 6%).
ТСХ: этиловый эфир уксусной кислоты, Rf=0,6
1H-ЯМР (CDCl3): δ 6,95 (с, 1Н), 6,71 (дд, J=12,1 Гц, J=2,0 Гц, 1Н), 6,02 (д, J=12,1 Гц, 1Н), 5,70 (шир., 2Н), 4,82 (с, 1Н), 3,81 (с, 3Н), 3,58 (дд, J=16,5 Гц, J=6,0 Гц, 1Н), 3,13 (дд, J=6,0 Гц, J=16,5 Гц, 1Н), 2,82-2,57 (м, 3Н), 2,48-2,15 (м, 2Н), 2,12-1,62 (м, 2Н);
13С-ЯМР (ДМСО-d6): δ 196,7 (с), 178,2 (с), 147,3 (д), 145,6 (с), 143,9 (с), 132,5 (с), 131,4 (с), 127,5 (д), 117,0 (с), 114,8 (д), 88,3 (д), 53,5 (кв), 49,7 (с), 43,7 (д), 40,9 (т), 39,7 (т), 38,0 (т), 32,1 (т);
13С-ЯМР (CDCl3): δ 193,8 (с), 176,7 (с), 146,7 (д), 143,5 (с), 143,2 (с), 131,0 (с), 129,9 (с), 127,7 (д), 116,5 (с), 115,1 (д), 87,6 (д), 56,1 (кв), 49,1 (с), 44,2 (д), 39,4 (т), 37,0 (т), 32,0 (т), 31,7 (т).
Пример 126:
Амид 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо [а] циклогепта [hi] бензофуран-10-карбоновой кислоты (SPH-1479)
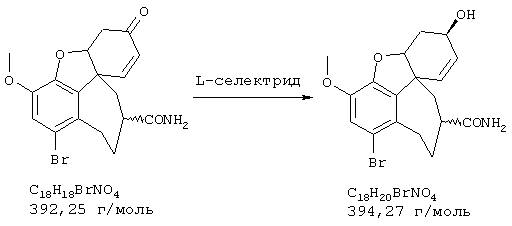
К суспензии амида 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-окса-6Н-бензо[а]циклогепта[hi]бензофуран-10-карбоновой кислоты (160 мг, 0,41 ммоля) в абсолютном ТГФ (5 мл) прибавляли при 0° С L-селектрид® (2,0 мл, 2,0 ммоля, 1 М в ТГФ) в течение 15 мин и смесь перемешивали 12 часов при комнатной температуре. Гидролизовали водой (2 мл) и распределяли между водой (10 мл) и этиловым эфиром уксусной кислоты (10 мл), водную фазу экстрагировали этиловым эфиром уксусной кислоты (3× 5 мл), промывали объединенные органические фазы 1 н соляной кислотой (3× 10 мл), водой (2× 10 мл), насыщенным раствором гидрокарбоната натрия (1× 10 мл) и насыщенным раствором поваренной соли (1× 10 мл), сушили (сульфат натрия/активированный уголь), фильтровали и очищали полученный после отгонки растворителя продукт колоночной хроматографией (10 г силикагеля, этиловый эфир уксусной кислоты). Указанным способом получали продукт в форме бесцветных кристаллов (137 мг, 85%).
МТ-194 JOS 1712
C18H20BrNO4
Вычислено, %: С 54,84; Н 5,11; N 3,55.
Найдено, %: С 54,55; Н 5,22; N 3,34.
ТСХ: этиловый эфир уксусной кислоты, Rf=0,5
1Н-ЯМР (МеОН-d4): δ 6,99 (с, 1Н), 6,03 (д, J=16,5 Гц, 1Н), 5,94 (дд, J=16,5 Гц, J=5,9 Гц, 1Н), 4,52 (с, 1Н), 4,16 (с, 1Н), 3,76 (с, 3Н), 3,49 (дд, J=19,8 Гц, J=5,9 Гц, 1Н), 2,90 (т, J=17,5 Гц, 1Н), 2,77 (т, J=17,5 Гц, 1Н), 2,46 (д, J=17,6 Гц, 1Н), 2,29-2,10 (м, 2Н), 1,98-1,53 (м, 3Н);
13С-ЯМР (MeOH-d4): δ 181,6 (с), 148,1 (с), 145,4 (с), 135,4 (с), 132,3 (с), 129,5 (д), 128,7 (д), 117,8 (д), 115,4 (с), 89,0 (д), 70,3 (д), 62,6 (д), 57,2 (кв), 45,7 (с), 42,5 (т), 33,5 (т), 33,1 (т), 31,9 (т).
Схема к примерам 125 и 126
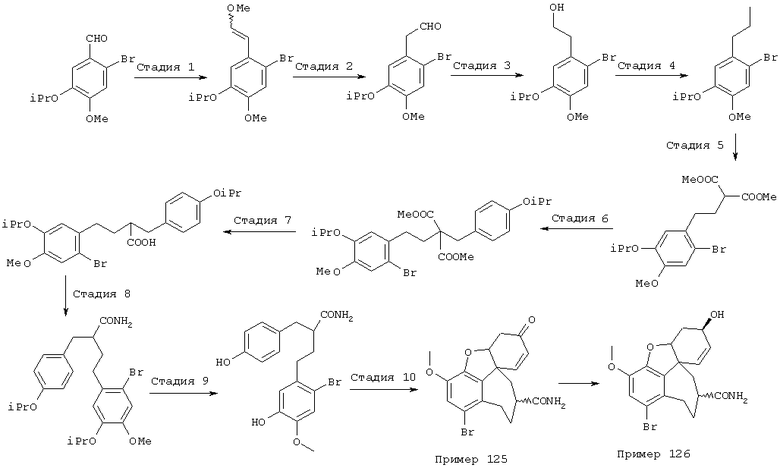
Пример 127
Стадия 1
5-(6-ацетилокси-1-оксогексил)-5,6-дигидро-4Н-пирроло [3,2,1-ij] хинолин-2(1Н)-он
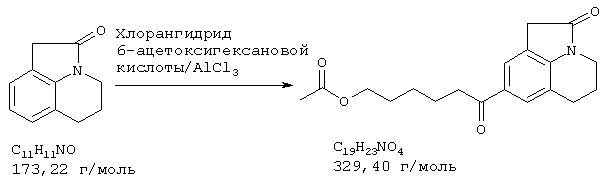
К суспензии безводного хлорида алюминия (61,5 г, 461,6 ммоля) в абсолютном CH2Cl2 (500 мл) прибавляли по каплям хлорангидрид 6-ацетилоксигексановой кислоты (16,7 г, 86,6 ммоля) в абсолютном CH2Cl2 (50 мл) при 0° С в течение 10 минут и перемешивали 15 минут при той же температуре. Прибавляли по каплям 5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-2(1Н)-он (10,0 г, 57,7 ммоля) в абсолютном CH2Cl2 (100 мл) в течение 15 минут при 0° С, затем нагревали до температуры кипения и 30 минут перемешивали. Охлаждали до 0° С, гидролизовали льдом и распределяли между водой (300 мл) и CH2Cl2 (100 мл). Водную фазу экстрагировали CH2Cl2 (2× 100 мл), объединенные органические фазы промывали 2 н соляной кислотой (2× 250 мл), водой (2× 250 мл), полуконцентрированным водным раствором Nа2СО3 (2× 250 мл), концентрированным водным раствором Nа2СО3 (2× 250 мл) и концентрированным раствором поваренной соли (1× 250 мл), сушили (сульфат натрия/активированный уголь) и растворитель удаляли на роторном испарителе. После перекристаллизации из метанола (150 мл) получали продукт в виде светло-желтых кристаллов (14,3 г, 75,5%).
МТ-304 JOS 1675
C19H23NO4
Вычислено, %: С 69,28; Н 7,04; N 4,25.
Найдено, %: С 69,27; Н 6,99; N 4,25.
1H-ЯМР (CDCl3): δ 7,72 (с, 2Н), 4,06 (т, J=6,5 Гц, 2Н), 3,72 (т, J=5,7 Гц, 2Н), 3,54 (с, 2Н), 2,90 (т, J=7,0 Гц, 2Н), 2,80 (т, J=6,0 Гц, 2Н), 2,09-1,93 (м, 5Н), 1,85-1,56 (м, 4Н), 1,50-1,30 (м, 2Н);
13С-ЯМР (СDС13): δ 198,9 (с), 174,2 (с), 171,1 (с), 145,5 (с), 131,3 (с), 127,8 (д), 122,9 (с), 122,4 (д), 119,5 (с), 64,3 (т), 38,9 (т), 38,0 (т), 36,1 (т), 28,5 (т), 25,7 (т), 24,4 (т), 24,1 (т), 21,0 (кв), 20,9 (т).
Стадия 2: 5-(6-гидрокси-1-оксогексил)-5,6-дигидро-4Н-пирроло[3,2,l-ij]хинолин-2(1Н)-он
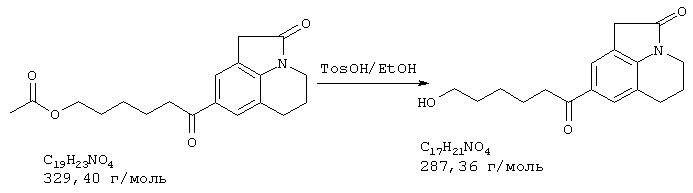
5-(6-Ацетилокси-1-оксогексил)-5,6-дигидро-4Н-пирроло-[3,2,1-ij]хинолин-2(1Н)-он (10,0 г, 30,6 ммоля) суспендировали в безводном этаноле (150 мл), смешивали с каталитическим количеством моногидрата 4-метилбензолсульфокислоты и перемешивали пять часов при температуре кипения. Объем растворителя упаривали на одну треть и получали продукт в виде светло-желтых иглообразных кристаллов (8,22 г, 93,5%) путем кристаллизации при -20° С.
МТ-305 JOS 1672
C17H2lNO3
Вычислено, %: С 71,06; Н 7,37; N 4,87.
Найден, %: С 71,30; Н 7,37; N 4,87.
1H-ЯМР (СDС13): δ 7,67 (с, 2Н), 3,80-3,52 (м, 4Н), 3,48 (с, 2Н), 2,97-2,66 (м, 4Н), 2,08-1,86 (м, 2Н), 1,82-1,26 (м, 6Н);
13С-ЯМР (СDС13): δ 199,3 (с), 174,2 (с), 145,4 (с), 131,2 (с), 127,8 (д), 122,8 (с), 122,3 (д), 119,4 (с), 62,3 (т), 38,7 (т), 38,0 (т), 36,0 (т), 32,3 (т), 25,4 (т), 24,3 (т), 24,1 (т), 20,8 (т).
Стадия 3 5-(6-йод-1-оксогексил-5,6-дигидро-4Н-пирроло-[3,2,1-ij]хинолин-2(1Н)-он
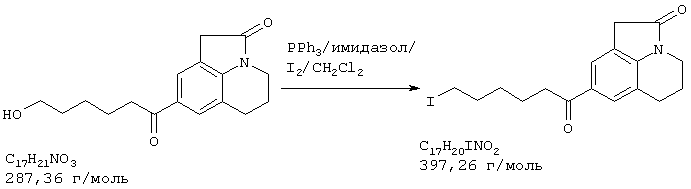
Трифенилфосфин (2,02 г, 7,74 ммоля), йод (3,08 г, 12,12 ммоля) и имидазол (0,618 г, 9,08 ммоля) перемешивали в абсолютном CH2Cl2 (30 мл) 30 минут при 15° С.
Прибавляли по каплям 5-(6-гидрокси-1-оксогексил)-5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-2(1Н)-он (2,0 г, 6,96 ммоля) в безводном CH2Cl2 (10 мл) в течение 5 минут при той же температуре, затем перемешивали 40 минут при комнатной температуре.
Смешивали с полунасыщенным раствором сульфита натрия (50 мл), разделяли фазы, экстрагировали водную фазу CH2Cl2, промывали объединенные органические фазы 2 н соляной кислотой (3× 100 мл), водой (2× 100 мл), насыщенным раствором гидрокарбоната натрия (2× 100 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь), фильтровали и после удаления растворителя на роторном испарителе перекристаллизовывали полученный сырой продукт из метанола (10 мл).
Вариант А:
Остаток очищали колоночной хроматографией (100 г силикагеля, хлороформ), получая продукт в форме светло-желтых кристаллов (2,44 г, 88,3%).
Вариант В:
Остаток еще раз перекристаллизовывали из метанола (10 мл), получая продукт в форме светло-желтых кристаллов (2,28 г, 82,4%).
МТ-308
JOS 1670 C17H20INO2
Вычислено, %: С 51,40; Н 5,07; N 5,53.
Найдено, %: С 51,56; Н 4,97; N 3,46.
1H-ЯМР (CDCl3): δ 7,70 (с, 2Н), 3,72 (т, J=5,7 Гц, 2Н), 3,52 (с, 2Н), 3,18 (т, J=6,9 Гц, 2Н), 2,91 (т, J=7,2 Гц, 2Н), 2,80 (т, J=6,1 Гц, 2Н), 2,12-1,61 (м, 6Н), 1,57-1,36 (м, 2Н);
13С-ЯМР (СDС13): δ 198,7 (с), 174,1 (с), 145,5 (с), 131,2 (с), 127,8 (д), 122,9 (с), 122,3 (д), 119,4 (с), 38,8 (т), 37,9 (т), 36,0 (т), 33,2 (т), 30,1 (т), 24,0 (т), 23,3 (т), 20,9 (т), 6,6 (т).
Стадия 4 5-(6-метилсульфонилокси-1-оксогексил)-5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-2(1Н)-он
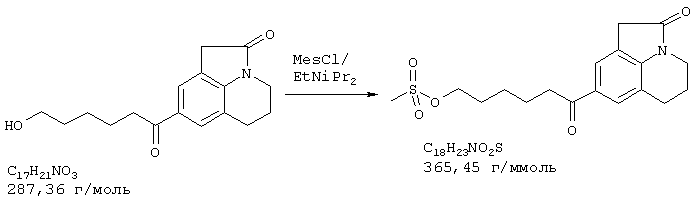
К 5-(6-гидрокси-1-оксогексил-5,6-дигидро-4Н-пирроло-[3,2,1-1-ij]хинолин-2(1Н)-ону (1,0 г, 3,48 ммоля) и N-этил-диизопропиламину (560 мг, 4,35 ммоля) в безводном СН2Сl2 (10 мл) прибавляли по каплям в течение 5 минут хлорангидрид метансульфокислоты (458 мг, 4,00 ммоля) при 15° С, затем перемешивали два часа при комнатной температуре.
Смешивали с водой (20 мл), разделяли фазы, экстрагровали водную фазу СН2С12 (1× 10 мл), промывали объединенные органические фазы 2 н соляной кислотой (3× 10 мл), водой (2× 10 мл), насыщенным раствором гидрокарбоната натрия (2× 10 мл) и насыщенным раствором поваренной соли (1× 10 мл), сушили (сульфат натрия/активированный уголь), фильтровали и полученный после удаления на роторном испарителе сырой продукт извлекали диизопропиловым эфиром (10 мл), получая продукт в форме светло-желтых кристаллов (1,17 г, 92,2%).
1H-ЯМР (CDCl3): δ 7,70 (с, 2Н), 4,22 (т, J=6,5 Гц, 2Н), 3,71 (т, J=5,8 Гц, 2Н), 3,52 (с, 2Н), 2,99 (с, 3Н), 2,92 (т, J=7,0 Гц, 2Н), 2,80 (т, J=6,0 Гц, 2Н), 2,17-1,92 (м, 5Н), 1,90-1,64 (м, 4Н), 1,60-1,37 (м, 2Н);
13С-ЯМР (СDС13): δ 198,7 (с), 174,2 (с), 145,6 (с), 131,2 (с), 127,8 (д), 123,0 (с), 122,4 (д), 119,5 (с), 69,8 (т), 38,8 (т), 37,8 (т), 37,3 (кв), 36,1 (т), 28,9 (т), 25,1 (т), 24,3 (т), 23,7 (т), 20,9 (т).
Стадия 5
5-[6-[(4aS,6R,8aS)-4a,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-6Н-бензофуро[3а,3,2-ef][2]бензазепин-11-ил]-1-оксогексил]-5,6-дигидро-4Н-пирроло [3,2,1-ij]хинолин-2(1Н)-он (SPH-1500)
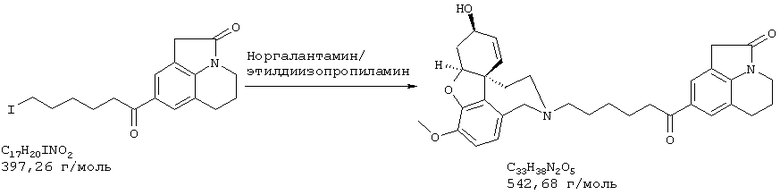
Норгалантамин (1,13 г, 1,64 ммоля), 5-(6-йод-1-оксогексил)-5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-2(1Н)-он (1,50 г, 3,75 ммоля) и N-этилдиизопропиламин (1,46 г, 11,3 ммоля) перемешивали в абсолютном хлороформе (20 мл) 54 часа при температуре кипения.
Остаток, полученный после удаления растворителя на роторном испарителе, очищали колоночной хроматографией (200 г силикагеля, хлороформ:метанол:аммиак = 96:3:1), получая продукт в виде светло-желтой пены (1,31 г, 64,3%).
1H-ЯМР (СDС13): δ 7,63 (с, 2Н), 6,68-6,46 (м, 2Н), 6,00 (д, J=10,3 Гц, 1Н), 5,90 (дд, J=10,3 Гц, J=4,6 Гц, 1H), 4,51 (с, 1Н), 4,19-3,96 (м, 2Н), 3,75 (с, 1Н), 3,73 (с, 3Н), 3,70-3,58 (м, 2Н), 3,44 (с, 2Н), 3,35-2,98 (м, 2Н), 2,96-6,67 (м, 4Н), 2,66-2,29 (м, 4Н), 2,15-1,84 (м, 4Н), 1,82-1,11 (м, 6Н);
13С-ЯМР (CDCl3): δ 199,1 (с), 174,1 (с), 145,6 (с), 145,3 (с), 143,8 (с), 133,0 (с), 131,2 (с), 129,3 (с), 127,7 (д), 127,4 (д), 126,8 (д), 122,8 (с), 122,3 (д), 121,7 (д), 119,4 (с), 111,0 (д), 88,5 (д), 61,8 (д), 57,6 (т), 55,7 (кв), 51,4 (т), 51,2 (т), 48,2 (с), 38,7 (т), 38,0 (т), 36,0 (т), 32,8 (т), 29,8 (т), 27,1 (т), 26,9 (т), 24,3 (т), 24,2 (т), 20,8 (т).
Стадия 6
Фумарат 5-[6-[(4аS,6R,8аS)-4а,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-6Н-бензофуро[3а,3,2-еf][2]бензазепин-11-ил]-1-оксогексил]-5,6-дигидро-4Н-пирроло[3,2,1-ij] хинолин-2(1Н)-она (SPH-1499)
Осаждение фумарата производили аналогично примеру 4.
МТ-311 JOS 1762
С37Н42Н2O9·Н2O
Вычислено, %: С 65,67; Н 6,55; N 4,14.
Найдено, %: С 65,93; Н 6,54; N 4,03.
Пример 128а
Стадия 1
Диметиловый эфир 2-[[4-(метилэтокси)фенил]метил]-пропановой дикислоты
1-(Хлорметил)-4-(1-метилэтокси)бензол (20,5 г, 111 ммолей), диметиловый эфир малоновой кислоты (102,5 г, 776 ммолей) и карбонат калия (46,5 г, 332 ммоля, безводный, свежеразмолотый) перемешивали в абсолютном ДМФА (250 мл) 24 часа при 70° С.
Смесь фильтровали и остаток, полученный после упаривания растворителя на роторном испарителе, распределяли между эфиром (250 мл) и водой (250 мл). Органическую фазу промывали водой (3× 200 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и растворитель отгоняли.
Избыточный диметиловый эфир малоновой кислоты удаляли перегонкой в вакууме (85° С/15 мбар) и оставшийся в остатке сырой продукт очищали перегонкой с шариковым дефлегматором (130° С/0,001 мбар). Указанным способом получали продукт в виде бесцветного масла (23,6 г, 78%).
МТ-67 JOS 1774
C15H20O5
Вычислено, %: С 64,27; Н 7,19.
Найдено, %: С 64,28; Н 7,07.
Стадия 2:
4-(1-Метилэтокси)бензолпропановая кислота
Диметиловый эфир 2-[[4-(1-метилэтокси)фенил]метил]-пропановой дикислоты (23,6 г, 84,2 ммоля) перемешивали в 2 н растворе гидроксида калия (15 мл)/этанола (25 мл) 18 часов при температуре кипения.
Этанол отгоняли на роторном испарителе, остаток подкисляли концентрированной соляной кислотой до рН 1 и экстрагировали эфиром (3× 150 мл). Объединенные органические фазы промывали водой (6× 200 мл) и насыщенным раствором поваренной соли (200 мл), сушили (сульфат натрия/активированный уголь) и фильтровали. Остаток, полученный после упаривания на роторном испарителе, декарбоксилировали в трубке с расширением (140° С/0,08 мбар) и наконец перегоняли (155° С/0,08 мбар). Указанным способом получали продукт в форме бесцветных кристаллов (14,4 г, 82%).
1H-ЯМР (CDCl3): 67,12 (д, J=9,5 Гц, 2Н), 6,82 (д, J=9,5 Гц, 2Н), 4,50 (септет, J=6,3 Гц, 1Н), 2,89 (т, J=7,9 Гц, 2Н), 2,63 (т, J=7,9 Гц, 2Н), 1,32 (д, J=6,3 Гц, 6Н);
13С-ЯМР (CDCl3): δ 178,8 (с), 156,4 (с), 132,1 (с), 129,2 (д), 116,0 (д), 69,9 (д), 35,8 (т), 29,7 (т), 22,1 (кв).
Стадия 3
2-Бром-4-метокси-5-(1-метилэтокси)бензолацетонитрил
1-Бром-2-(хлорметил)-5-метокси-4-(1-метилэтокси)-бензол (7,00 г, 23,8 ммоля) и цианид калия (1,70 г, 26,1 ммоля, свежеразмолотый) перемешивали в абсолютном ДМСО (диметилсульфоксиде) (70 мл) 12 часов при комнатной температуре.
Смесь выливали в воду (700 мл), водную фазу экстрагировали эфиром (3× 150 мл), объединенные органические фазы промывали водой (5× 150 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и остаток, полученный после упаривания, извлекали диизопропиловым эфиром (15 мл). Указанным способом получали продукт в виде бесцветных кристаллов (6,46 г, 95%).
МТ-72 JOS 1695
C12H14BrNO2
Вычислено, %: С 50,72; Н 4,97; N 4,93.
Найдено, %: С 50,73; Н 4,84; N 4,89.
1H-ЯМР (CDCl3): δ 7,02 (с, 1Н), 6,97 (с, 1H), 4,50 (септет, J=6,3 Гц, 1H), 3,81 (с, 3Н), 3,72 (с, 2Н), 1,36 (д, J=6,3 Гц, 6Н);
13С-ЯМР (CDCl3): δ 150,8 (с), 147,1 (с), 121,5 (с), 117,3 (с), 116,7 (д), 116,3 (д), 113,9 (с), 72,1 (д), 56,2 (кв), 24,2 (т), 21,9 (кв).
Стадия 4
(1-Метил) этиловый эфир 4-(1-метилэтокси)бензолпропановой кислоты
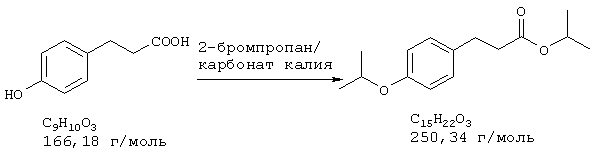
4-Гидроксибензолпропионовую кислоту (50,0 г, 300 ммолей), карбонат калия (210 г, 1,5 моля, безводный, свежеразмолотый) и 2-бромпропан (221 г, 1,8 моля) перемешивали в абсолютном ДМФА (500 мл) 24 часа при 60° С.
Раствор фильтровали и остаток, полученный после упаривания на роторном испарителе, распределяли между эфиром (500 мл) и 2 н раствором едкого натра (500 мл). Органическую фазу промывали 2 н раствором едкого натра (2× 200 мл), водой (3× 500 мл) и насыщенным раствором поваренной соли (200 мл), сушили (сульфат натрия/активированный уголь) и фильтровали. Остаток, полученный после отгонки растворителя на роторном испарителе, очищали перегонкой с шариковым дефлегматором (139-142° С/0,025 мбар), получая продукт в виде бесцветного масла (70,8 г, 94%).
МТ-159 JOS 1768
С15Н22O3
Вычислено, %: С 71,97; Н 8,86.
Найдено, %: С 71,84 Н 8,75.
1H-ЯМР (CDCl3): δ 7,10 (д, J=9,5 Гц, 2Н), 6,81 (д, J=9,5 Гц, 2Н), 4,99 (септет, J=6,3 Гц, 1Н), 4,48 (септет, J=6,3 Гц, 1Н), 2,87 (т, J=7,9 Гц, 2Н), 2,54 (т, J=7,9 Гц, 2Н), 1,20 (д, J=6,3 Гц, 6Н), 1,31 (д, J=6,3 Гц, 6Н);
13С-ЯМР (CDCl3): δ 172,4 (с), 156,2 (с), 132,4 (с), 129,1 (д), 115,8 (д), 69,7 (д), 67,4 (д), 36,4 (т), 30,1 (т), 22,0 (кв), 21,7 (кв).
Стадия 5
4-(1-Метилэтокси) бензолпропанол
1. Из 4-(1-метилэтокси)бензолпропановой кислоты
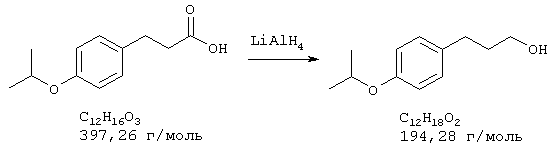
4-(1-Метилэтокси)бензолпропановую кислоту (7,57 г, 36,3 ммоля) в абсолютном ТГФ (80 мл) прибавляли по каплям при 0° С к суспензии алюмогидрида лития (4,17 г, 110 ммолей) в абсолютном ТГФ (80 мл) в течение 30 минут и перемешивали 12 часов при комнатной температуре. Гидролизовали водой (30 мл) и смешивали с концентрированной соляной кислотой до тех пор, пока раствор не становился прозрачным, распределяли между водой (30 мл) и эфиром (60 мл), экстрагировали водную фазу эфиром (2× 20 мл), промывали объединенные органические фазы 2 н соляной кислотой (3× 100 мл), водой (1× 100 мл), насыщенным раствором гидрокарбоната натрия (2× 100 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь) и фильтровали.
После отгонки растворителя на роторном испарителе получали продукт в форме бесцветных кристаллов (6,84 г, 97%).
2. Из (1-метил)этилового эфира 4-(1-метилэтокси)-бензолпропановой кислоты
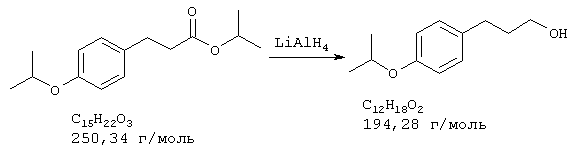
(1-Метил)этиловый эфир 4-(1-метилэтокси)бензолпропановой кислоты (10,0 г, 39,9 ммоля) в абсолютном ТГФ (100 мл) прибавляли по каплям при 0° С к суспензии алюмогидрида лития (3,04 г, 80 ммолей) в абсолютном ТГФ (100 мл) в течение 30 минут и перемешивали 12 часов при комнатной температуре.
Гидролизовали водой (30 мл) и смешивали с концентрированной соляной кислотой до того, как раствор становился прозрачным, распределяли между водой (30 мл) и эфиром (60 мл), экстрагировали водную фазу эфиром (2× 20 мл), промывали объединенные органические фазы 2 н соляной кислотой (3× 100 мл), водой (1× 100 мл), насыщенным раствором гидрокарбоната натрия (2× 100 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь) и фильтровали.
После отгонки растворителя на роторном испарителе получали продукт в форме бесцветных кристаллов (7,04 г, 99%).
МТ-89 JOS 1700
C12H18O2
Вычислено, %: С 74,19; Н 9,34.
Найдено, %: С 73,93; Н 9,07.
1H-ЯМР (CDCl3): δ 7,10 (д, J=9,5 Гц, 2Н), 6,82 (д, J=9,5 Гц, 2Н), 4,50 (септет, J=6,3 Гц, 1Н), 3,68 (т, J=7,9 Гц, 2Н), 2,66 (т, J=7,9 Гц, 2Н), 2,0 (шир., 1Н), 1,93-1,78 (м, 2Н), 1,32 (д, J=6,3 Гц, 6Н);
13С-ЯМР (CDCl3): δ 155,9 (с), 133,7 (с), 129,2 (д), 115,9 (д), 69,9 (д), 62,0 (т), 34,3 (т), 31,1 (т), 22,0 (кв).
Стадия 6
1-(3-йодпропил)-4-(1-метилэтокси) бензол
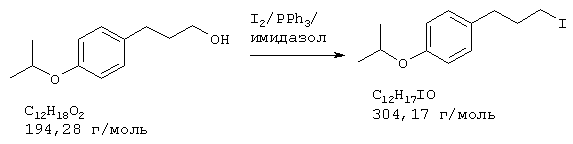
Трифенилфосфин (13,1 г, 49,9 ммоля), йод (19,9 г, 78,4 ммоля) и имидазол (4,0 г, 58,8 ммоля) перемешивали в абсолютном CH2Cl2 (250 мл) 20 минут при комнатной температуре. Прибавляли по каплям при 15° С 4-(1-метил-этокси)бензолпропанол (8,74 г, 45,0 ммоля) в CH2Cl2 (100 мл) и перемешивали 12 часов при комнатной температуре.
Распределяли между водой (300 мл) и CH2Cl2 (150 мл), экстрагировали водную фазу CH2Cl2 (2× 50 мл), промывали объединенные органические фазы водой (1× 200 мл), полунасыщенным раствором сульфата меди(II) (2× 200 мл), водой (1× 200 мл), 10%-ным раствором сульфита натрия (1× 200 мл), насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и остаток, полученный после упаривания растворителя на роторном испарителе, переносили в диизопропиловый эфир (200 мл). Фильтровали и остаток, полученный из фильтрата после упаривания растворителя на роторном испарителе, очищали колоночной хроматографией (900 г силикагеля; петролейный эфир:этиловый эфир уксусной кислоты = 95:5). Указанным способом получали продукт в виде бесцветного масла (10,9 г, 79%).
МТ-151 JOS 1755
Cl2H17IO
Вычислено, %: С 47,39; Н 5,63.
Найдено, %: С 47,37; Н 5,41.
1H-ЯМР (CDCl3): δ 7,11 (д, J=9,5 Гц, 2Н), 6,82 (д, J=9,5 Гц, 2Н), 4,53 (септет, J=6,3 Гц, 1Н), 3,18 (т, J=7,9 Гц, 2Н), 2,67 (т, J=7,9 Гц, 2Н), 2,10 (квинтет, J=7,9 Гц, 2Н), 1,35 (д, J=6,3 Гц, 6Н);
13С-ЯМР (CDCl3): δ 156,2 (с), 132,2 (с), 129,4 (д), 115,9 (д), 69,8 (д), 35,2 (т), 35,0 (т), 22,1 (кв), 6,5 (т).
Стадия 7
α -[2-Бром-4-метокси-5-(1-метилэтокси)фенил]-4-(1-метил-этокси)бензолпентаннитрил
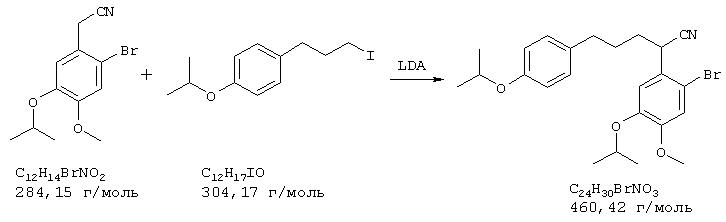
К раствору диизопропиламина (3,55 г, 35,08 ммоля) в абсолютном ТГФ (50 мл) прибавляли н-бутиллитий (12,7 мл, 27,5 ммоля, 2,2 М в гексане) в течение 15 минут при температуре -78° С, затем смесь нагревали до -30° С и перемешивали 30 минут при этой температуре.
Раствор охлаждали до -78° С, смешивали с 2-бром-4-метокси-5-(1-метилэтокси)бензолацетонитрилом (7,94 г, 27,9 ммоля) в абсолютном ТГФ (100 мл), 20 минут перемешивали при той же температуре, нагревали до комнатной температуры и перемешивали еще один час. Смесь охлаждали до -78° С, затем прибавляли по каплям 1-(3-йодпропил)-4-(1-метилэтокси)бензол (8,50 г, 27,9 ммоля) в абсолютном ТГФ (50 мл) в течение 15 минут и смесь перемешивали 45 минут.
Смешивали с насыщенным раствором хлорида аммония (50 мл) и нагревали до комнатной температуры. Полученный после упаривания остаток распределяли между 2 н соляной кислотой (200 мл) и эфиром (200 мл). Водную фазу экстрагировали эфиром (3× 50 мл), объединенные органические фазы промывали водой (3× 200 мл), насыщенным раствором бикарбоната натрия (1× 200 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и остаток, оставшийся после удаления растворителя на роторном испарителе, очищали колоночной хроматографией (1000 г силикагеля, петролейный эфир:этиловый эфир уксусной кислоты = 98:2). Так получали продукт в виде бесцветного масла (11,46 г, 71%).
МТ-158 JOS 1699
С24Н30ВrNО3
Вычислено, %: С 62,62; Н 6,57; N 3,04.
Найдено, %: С 62,32; Н 6,31; N 2,97.
Стадия В
Амид α -[2-бром-4-метокси-5-(1-метилэтокси)фенил]-4-(1-метилэтокси)бензолпентановой кислоты
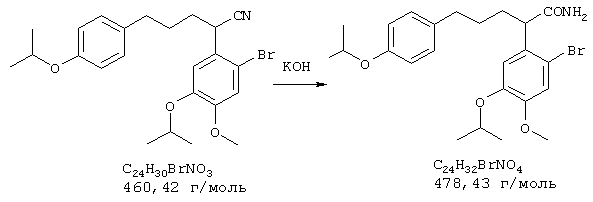
α -[2-Бром-4-метокси-5-(1-метилэтокси)фенил]-4-(1-метилэтокси) бензолпентаннитрил (30,0 г, 65,2 ммоля) в этаноле (600 мл) смешивали с гидроксидом калия (60,0 г, 1,07 моля) в воде (100 мл) и перемешивали 6 часов при температуре кипения.
Полученный после упаривания остаток распределяли между 2 н соляной кислотой (200 мл) и эфиром (300 мл). Водную фазу экстрагировали эфиром (3× 75 мл). Объединенные органические фазы промывали водой (3× 200 мл), насыщенным раствором гидрокарбоната натрия (1× 200 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и оставшийся после удаления растворителя остаток очищали колоночной хроматографией (1000 г силикагеля, петролейный эфир:эфир = 1:2). Фракцию верхнего потока помещали в абсолютный CH2Cl2 (100 мл), при 0° С смешивали с хлорангидридом щавелевой кислоты (3 мл) и одной каплей ДМФА и перемешивали два часа. Остаток, полученный после отгонки растворителя на роторном испарителе, суспендировали в абсолютном ТГФ (100 мл), после чего под поверхность 2 часа пропускали аммиак. Смесь фильтровали и остаток, полученный после упаривания, распределяли между водой (100 мл) и эфиром (100 мл). Водную фазу экстрагировали эфиром (3× 50 мл), объединенные органические фазы промывали водой (3× 200 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия/активированный уголь), фильтровали и полученный после упаривания остаток объединяли с фракцией нижнего потока колоночной хроматографии, выкристаллизовывали диизопропиловым эфиром и извлекали диизопропиловым эфиром (100 мл). Указанным способом получали продукт в форме бесцветных кристаллов (26,0 г, 83,5%).
1H-ЯМР (CDCl3): δ 7,01 (д, J=8,9 Гц, 2Н), 6,98 (с, 1Н), 6,92 (с, 1H), 6,75 (д, J=8,9 Гц, 2Н), 5,98 (шир., 1Н), 5,52 (шир., 1H), 4,47 (септет, J=6,3 Гц, 2Н), 3,91 (т, J=7,0 Гц, 1H), 3,82 (с, 3Н), 2,74-2,40 (м, 2Н), 2,22-2,00 (м, 1Н), 1,91-1,36 (м, 3Н), 1,35-1,22 (м, 6Н);
13С-ЯМР (CDCl3): δ 175,2 (с), 155,8 (с), 149,9 (с), 147,0 (с), 133,9 (с), 130,8 (с), 129,1 (д), 115,7 (д), 114,8 (д), 114,7 (д), 71,4 (д), 69,7 (д), 56,0 (кв), 49,7 (д), 34,6 (т), 31,9 (т), 29,1 (т), 22,0 (кв), 21,8 (кв), 21,7 (кв).
Стадия 9
Амид α -[2-бром-5-гидрокси-4-метоксифенил]-4-гидрокси-бензолпентановой кислоты
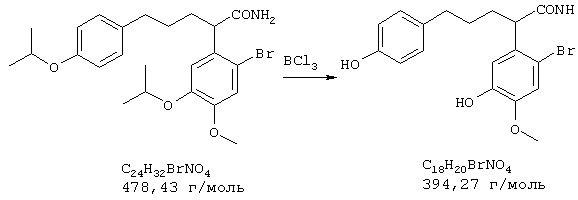
Амид α -[2-бром-4-метокси-5-(1-метилэтокси)фенил]-4-(1-метилэтокси)бензолпентановой кислоты (24,0 г, 50,2 ммоля) в абсолютном CH2Cl2 (300 мл) смешивали при -78° С с трихлоридом бора (150 мл, 150 ммолей, 1 М в CH2Cl2) и перемешивали четыре часа при комнатной температуре. Прибавляли по каплям воду (200 мл) и органическую фазу удаляли на роторном испарителе. Выпавшие кристаллы извлекали водой (6× 200 мл), получая продукт в форме бесцветных кристаллов (19,8 г, колич.).
МТ-161 JOS 1713
C18H20BrNO4
Вычислено, %: С 54,84; Н 5,11; N 3,55.
Найдено, %: С 54,46; Н 5,40; N 3,25.
Стадия 10
Амид 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-окса-6Н-бензо[а]циклогепта [hi] бензофуран-12-карбоновой кислоты (SPH-1484)
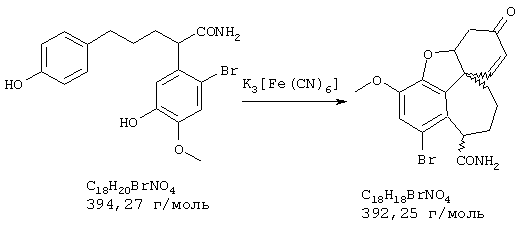
Амид α -[2-бром-5-гидрокси-4-метоксифенил)-5-гидрокси-бензолпентановой кислоты (3,00 г, 7,61 ммоля) суспендировали в хлороформе (300 мл) и смешивали с раствором гексацианоферрата(III) калия (13,2 г, 40,0 ммоля) в растворе карбоната калия (75 мл, десятипроцентный).
Смесь активно перемешивали при комнатной температуре 40 минут и фильтровали через Hyflo. Водную фазу экстрагировали хлороформом (2× 50 мл), объединенные органические фазы промывали 2 н соляной кислотой (2× 100 мл), водой (2× 200 мл) и насыщенным раствором поваренной соли (1× 150 мл), сушили (сульфат натрия/активированный уголь) и полученный после упаривания растворителя сырой продукт очищали колоночной хроматографией (50 г силикагеля, этиловый эфир уксусной кислоты). Указанным способом получали продукт в виде смеси двух диастереомерных энантиомерных пар, причем нижний поток изомеризовался в верхний поток.
Колоночной хроматографией (хлороформ:метанол = 96:4) получали энантиомерную пару с более высоким значением Rf в виде бесцветных кристаллов (0,24 г, 8% от теории).
MT-162/OF JOS 1679
C18H18BrNO4
Вычислено, %: С 55,12; Н 4,63; N 3,57.
Найдено, %: С 55,15; Н 4,71; N 3,38.
1H-ЯМР (ДМСО-d6): δ 7,57 (с, 1H), 7,48 (Д, J=14,5 Гц, 1H), 7,14 (с, 2Н), 5,89 (д, J=14,5 Гц, 1Н), 4,66 (с, 1Н), 4,32 (с, 1Н), 4,01 (кв, J=7,7 Гц, 1Н), 3,78 (с, 3Н), 3,02 (д, J=19,6 Гц, 1Н), 2,79 (д, J=19,6 Гц, 1Н), 2,52 (д, J=16,5 Гц, 1Н), 2,16 (д, J=16,5 Гц, 1Н), 1,96-1,67 (м, 2Н), 1,14 (т, J=7,7 Гц, 1H);
13С-ЯМР (ДМСО-d6): δ 195,6 (с), 174,6 (с), 149,5 (д), 147,9 (с), 144,4 (с), 133,6 (с), 130,6 (с), 126,5 (д), 117,5 (с), 117,1 (д), 88,4 (д), 56,8 (кв), 52,1 (с), 51,6 (д), 37,9 (т), 36,6 (т), 33,3 (т), 21,5 (т).
Пример 128b
Амид (6R)-1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-12-карбоновой кислоты (SPH-1483)
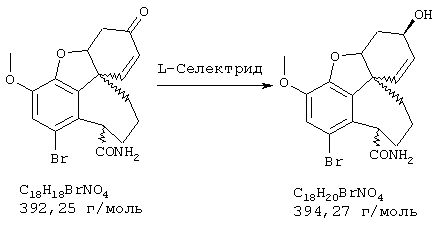
К суспензии амида 1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-окса-6Н-бензо[а]циклогепта[hi]бензофуран-12-карбоновой кислоты (600 мг, 1,52 ммоля) в абсолютном ТГФ (5 мл) прибавляли при 0° С L-селектрид® (4,6 мл, 4,6 ммоля, 1 М в ТГФ) в течение 15 минут и смесь перемешивали 12 часов при комнатной температуре. Гидролизовали водой (3 мл) и распределяли между водой (10 мл) и этиловым эфиром уксусной кислоты (10 мл), экстрагировали водную фазу этиловым эфиром уксусной кислоты (3× 5 мл), промывали объединенные органические фазы 1 н соляной кислотой (3× 10 мл), водой (2× 10 мл), насыщенным раствором бикарбоната натрия (1× 10 мл) и насыщенным раствором поваренной соли (1× 10 мл), сушили (сульфат натрия/активированный уголь), фильтровали и сырой продукт, полученный после отгонки растворителя, очищали колоночной хроматографией (50 г силикагеля, этиловый эфир уксусной кислоты). Указанным способом получали продукт в виде бесцветных кристаллов (798 мг, 83%).
MT-169/OF JOS 1677
С18H20BrNO4
Вычислено, %: С 54,84; Н 5,11; N 3,55.
Найдено, %: С 54,67; Н 5,10; N 3,46.
1H-ЯМР (CDCl3/AMCO-d6): δ 6,97 (с, 1H), 6,79 (шир., 1H), 6,49 (шир., 1H), 6,12 (д, J=11,4 Гц, 1H), 5,83 (дд, J=11,4 Гц, J=5,1 Гц, 1H), 4,42 (с, 1H), 4,31-4,21 (м, 1H), 3,78 (с, 3Н), 3,42-3,18 (м, 2Н), 2,68-2,29 (м, 2Н), 2,14-1,38 (м, 5Н);
13С-ЯМР (СDС13/ДМСО-d6): δ 173,4 (с), 146,3 (с), 143,6 (с), 134,2 (с), 128,8 (д), 128,6 (д), 126,8 (с), 116,1 (с), 115,6 (д), 87,1 (д), 60,1 (кв), 55,6 (д), 50,1 (с), 49,5 (д), 37,5 (т), 31,0 (т), 29,8 (т), 20,3 (т).
Пример 128с
(6R)-10-Амино-1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо [а]циклогепта [hi] бензофуран-6-ол (SPH-1482)
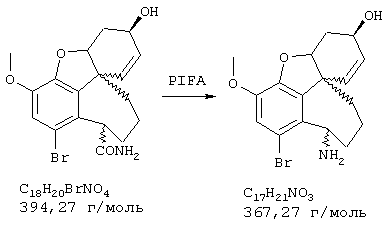
Бис(трифторацетокси)йодбензол (300 мг, 0,76 ммоля) растворяли в ацетонитриле (1,5 мл, качество ВЭЖХ) и смешивали с водой (1,5 мл, качество ВЭЖХ). Затем прибавляли амид (6R)-1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-12-карбоновой кислоты (338 мг, 0,76 ммоля) в течение 2 часов и смесь перемешивали 24 часа при комнатной температуре. Растворитель отгоняли на роторном испарителе, остаток переносили в хлороформ (5 мл), фильтровали и очищали колоночной хроматографией (30 г силикагеля, хлороформ:метанол:аммиак = 96:3:1). Указанным способом получали продукт в виде бесцветных кристаллов (161 мг, 58%).
МТ-179 JOS 1705
С17Н20ВrNO3·0,66 Н2О
Вычислено, %: С 54,02; Н 5,68; N 3,71.
Найдено, %: С 53,96; Н 5,52; N 3,60.
1H-ЯМР (MeOH-d4): δ 7,08 (с, 1Н), 6,41 (д, J=14,5 Гц, 1Н), 5,8883 (дд, J=14,5 Гц, J=5,1 Гц, 1Н), 4,72 (с, 1Н), 4,58 (с, 1Н), 4,13 (т, J=3,6 Гц, 1Н), 3,82 (с, 3Н), 2,49 (д, J=17,2 Гц, 1Н), 2,45-2,07 (м, 4Н), 1,92-1,58 (м, 4Н);
13С-ЯМР (МеОН-d4): δ 147,2 (с), 144,7 (с), 134,5 (с), 133,3 (с), 130,9 (д), 126,4 (д), 116,6 (д), 115,5 (с), 87,8 (д), 61,2 (д), 57,3 (кв), 54,0 (д), 48,6 (с), 38,3 (т), 35,2 (т), 30,1 (т), 17,9 (т).
Пример 128d
(6R)-10-Амино-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-6-ол
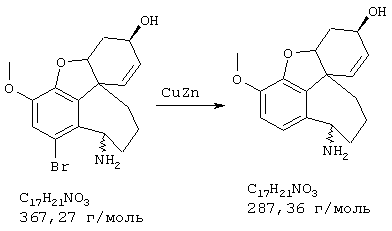
(6R)-10-Амино-1-бром-4а,5,9,10,11,12-гексагидро-3-метокси-6-гидрокси-6Н-бензо[а]циклогепта[hi]бензофуран-6-ол (70 мг, 0,19 ммоля) и хлорид кальция (300 мг, 2,7 ммоля) прибавляли к черной суспензии цинка (получение: порошок цинка (500 мг) и йодид меди(I) (500 мг) под аргоном в воде (4 мл) и этаноле (4 мл) обрабатывали 45 минут ультразвуком) и смесь перемешивали 5 часов при температуре кипения. Смешивали с концентрированным водным раствором аммиака (1 мл), удаляли растворитель на роторном испарителе, вносили остаток в хлороформ (15 мл), фильтровали и остаток, полученный после упаривания фильтрата на роторном испарителе, очищали колоночной хроматографией (30 г силикагеля, хлороформ:метанол:аммиак = 96:3:1). Указанным способом получали продукт в виде бесцветных кристаллов (42 мл, 78%).
1H-ЯМР (СDС13): δ 6,81-6,61 (м, 3Н), 6,97 (дд, J=14 Гц, J=4 Гц, 1Н), 4,44 (с, 1H), 4,30 (с, 1Н), 4,24 (т, J=3 Гц, 1Н), 3,85 (с, 3Н), 2,63 (дд, J=17 Гц, J=6 Гц, 1Н), 2,40 (кв, J=15 Гц, 1H), 2,19-2,08 (м, 1Н), 2,02 (дд, J=18 Гц, J=4 Гц, 1H), 1,97-1,52 (м, 9Н);
13С-ЯМР (СDС13): δ 145,4 (с), 143,2 (с), 134,1 (с), 132,6 (с), 129,9 (д), 125,4 (д), 121,9 (д), 109,9 (д), 87,7 (д), 61,1 (д), 54,8 (кв), 48,5 (с), 37,0 (т), 34,4 (т), 29,0 (т), 25,8 (т), 16,9(т).
ПРИМЕР 129
8-[6-[(4aS,6R,8aS)-4a,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-6Н-бензофуро[3а,3,2-ef][2]бензазепин-11-ил]-1-оксогексил]-1,2,5,6-тетрагидро-4Н-пирроло [3,2,1-ij]хинолин-4-он (SPH-1516)
1. Синтез в растворе:
Норгалантамин (1,13 г, 4,13 ммоля), 8-(6-йод-1-оксогексил)-1,2,5,6-тетрагидро-4Н-пирроло[3,2,l-ij]хинолин-4-он (1,50 г, 3,75 ммоля) и N-этилдиизопропиламин (1,46 г, 11,3 ммоля) перемешивали в абсолютном хлороформе (20 мл) 54 часа при температуре кипения.
Полученный после удаления растворителя на роторном испарителе остаток очищали колоночной хроматографией (200 г силикагеля, хлороформ:метанол:аммиак = 96:3:1), получая продукт в виде светло-желтой пены (1,87 г, 92%).
ТСХ: СНС13:МеОН:NН3 = 89:10:1, Rf=0,5
1H-ЯМР (СDСl3): δ 7,62 (с, 1Н), 7,67 (с, 1Н), 6,68-6,43 (м, 2Н), 6,00 (д, J=9,7 Гц, 1Н), 5,93-5,81 (м, 1Н), 4,51 (с, 1Н), 4,22-3,91 (м, 4Н), 3,92-3,64 (м, 4Н), 3,48-2,28 (м, 13Н), 2,20-1,12 (м, 10Н);
13С-ЯМР (CDCl3): δ 198,7 (с), 167,5 (с), 145,5 (с), 145,1 (с), 143,7 (с), 132,8 (с), 132,6 (с), 129,1 (с), 128,9 (с), 127,2 (д), 126,7 (д), 126,3 (д), 123,6 (д), 121,6 (д), 119,3 (с), 110,8 (д), 88,3 (д), 61,6 (д), 57,4 (т), 55,6 (кв), 51,2 (т), 51,0 (т), 48,1 (с), 45,4 (т), 38,0 (т), 32,6 (т), 31,1 (т), 29,7 (т), 27,0 (т), 26,8 (т), 24,2 (т), 23,9 (т).
Получение фумарата (SPH-1519) аналогично примеру 4
МТ-407 JOS 1761
C37H42N2O9·H2O
Вычислено, %: С 65,67; Н 6,55; N 4,14.
Найдено, %: С 65,69; Н 6,49; N 4,02.
2. Твердофазный синтез
0,300 г (0,102 ммоля) норгалантамин-6-илокси-1,5-диоксопентилоксиметиловой смолы Меррифилда оставили набухать в закрытой с обеих сторон 5 мл-полиэтиленовой фритте 30 минут в 3 мл диметилформамида/ацетона (1/1) и после фильтрования суспендировали в растворе 0,125 г (0,315 ммоля) 8-(6-йодо-1-оксогексил)-1,2,5,6-тетрагидро-4Н-пирроло[3,2,1-ij]хинолин-4-она и 54 мкл (0,041 г, 0,315 ммоля) этилдиизопропиламина в 3 мл диметилформамида/ацетона (1/1).
Суспензию встряхивали при комнатной температуре 19 часов. Негативная хлораниловая проба указывала на полное превращение вторичного амина. Смолу трижды промывали диметилформамидом (2 мин, 3 мл) и шесть раз тетрагидрофураном/метанолом (4/1, 2 мин, 3 мл). После этого смолу суспендировали в растворе 0,113 г (0,63 ммоля) 30%-ного метанольного раствора метанолята натрия и 3,0 мл тетрагидрофурана/метанола (4/1). Через 15 часов раствор отфильтровывали и смолу шесть раз экстрагировали по 3 мл дихлорметана.
Объединенные фильтраты нейтрализовали метанольной соляной кислотой, разбавляли 10 мл дихлорметана, дважды промывали 15 мл насыщенного раствора хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали на роторном испарителе при пониженном давлении. Сырой продукт отделяли MPLC (200 г селикагеля, об. = 285 нм, хлороформ/метанол/конц. аммиак = 96/3/1). После упаривания получали желтое масло, которое при выдерживании закристаллизовывалось: 0,043 г (0,041 г, 0,075 ммоля, 74%), желтоватые кристаллы (MW=542,7), ВЭЖХ, ТСХ идентичны со сравнительными пробами:
ТСХ: Rf=0,55 (хлороформ/метанол = 8/2 + 2% конц. аммиака)
ВЭЖХ: tRet=13,7 мин, 95,7% (Merck 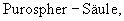 4,0 мм × 125 мм, RP-18e, 5,0 мкм, 1 мл/мин, 285 нм, ацетонитрил/20 мМ Cl3CCO2H в H2O (5/95 об./об. за 5 мин, 5/95 → 60/40 об./об. в 18 мин (конвекция), 60/40 об./об. за 5 мин)
4,0 мм × 125 мм, RP-18e, 5,0 мкм, 1 мл/мин, 285 нм, ацетонитрил/20 мМ Cl3CCO2H в H2O (5/95 об./об. за 5 мин, 5/95 → 60/40 об./об. в 18 мин (конвекция), 60/40 об./об. за 5 мин)
Пример 130а
(4aS,6R,8aS)-4a,5,9,10,11,12-гексагидро-3-метокси-11-метил-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол, галантамин (НМ 424)
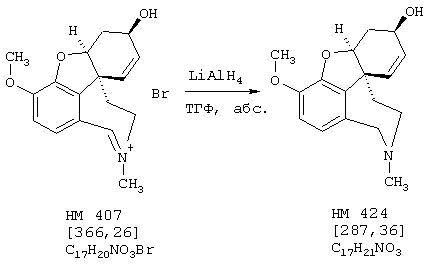
К суспензии бромида галантаминия НМ 407 (1,0 г, 2,13 ммоля) в абсолютном тетрагидрофуране (50 мл) прибавляли алюмогидрид лития (104 мг, 2,73 ммоля) и перемешивали 3 часа при комнатной темпаратуре. Затем избыточный алюмогидрид лития разлагали этилацетатом и осаждали водой (49 мг, 2,73 ммоля) с образованием отфитровывающегося осадка. Образовавшийся Аl2O3 отфильтровывали, фильтрат сушили над сульфатом натрия и растворитель удаляли на роторном испарителе. Получали 750 мг (96% от теории) галантамина в виде белой пены.
ТСХ: СНС13:МеОН/NН3 (9:1)
1H-ЯМР (CDCl3): δ 6,66-6,58 (м, 2Н), 6,08-5,94 (м, 2Н), 4,58 (шир., 1Н), 4,15 (шир., 1Н), 4,06 (д, J=15,2 Гц, 1H), 3,78 (с, 3Н), 3,66 (д, J=15,2 Гц, 1Н), 3,25 (ддд, J=14,4, 2,2, 1,9 Гц, 1H), 3,05 (ддд, J=14,9, 3,1, 3,1 Гц, 1H), 2,68 (ддд, J=15,7, 1,8, 1,8, 1Н), 2,40 (с, 3Н), 2,15-1,90 (м, 2Н), 1,55 (ддд, J=13,7, 4,1, 2,0 Гц, 1H);
13С-ЯМР (CDCl3): δ 145,8 (с), 144,1 (с), 133,1 (с), 129,2 (с), 127,6 (д), 126,8 (д), 122,1 (д), 111,1 (д), 88,7 (д), 62,0 (д), 60,4 (т), 55,8 (кв), 53,7 (т), 48,2 (с), 41,9 (кв), 33,4 (т), 29,9 (т).
Пример 130b:
(4aS,6R,8aS)-4a,5,9,10,11-Пентагидро-12-дейтеро-3-метокси-11-метил-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол, (12-дейтерогалантамин, SPH-1520)
К суспензии бромида галантаминия НМ 407 (250 мг, 0,683 ммоля) в абсолютном тетрагидрофуране (15 мл) прибавляли алюмодейтерид лития (28 мг, 0,68 ммоля) и перемешивали 3 часа при комнатной температуре. Затем избыток алюмодейтерида лития разлагали этилацетатом и осаждали оксидом дейтерия (12 мг, 0,68 ммоля) Al2O3. Образовавшийся Аl2О3 отфильтровывали, фильтрат сушили над сульфатом натрия и растворитель удаляли на роторном испарителе. Получали 100 мг (51% от теории) НМ 427 в виде белой пены.
ТСХ: СНС13:МеОН/NН3 (9:1)
1H-ЯМР (CDCl3): δ 6,66-6,58 (м, 2Н), 6,08-5,94 (м, 2Н), 4,58 (шир., 1Н), 4,14 (шир., 1Н), 4,06 (д, J=15,2 Гц, 0,5Н), 3,78 (с, 3Н), 3,66 (д, J=15,2 Гц, 0,5Н), 3,25 (ддд, J=14,4, 2,2, 1,9 Гц, 1Н), 3,05 (ддд, J=14,9, 3,1, 3,1 Гц, 1Н), 2,68 (ддд, J=15,7, 1,8, 1,8, 1Н), 2,40 (с, 3Н), 2,15-1,90 (м, 2Н), 1,55 (ддд, J=13,7, 4,1, 2,0 Гц, 1Н);
13С-ЯМР (CDCl3): δ 145,8 (с), 144,1 (с), 133,1 (с), 129,2 (с), 127,6 (д), 126,8 (д), 122,1 и 122,0 (д), 111,1 (д), 88,7 (д), 62,0 (д), 60,4 (т), 55,8 (кв), 53,8 и 53,7 (т), 48,2 (с), 42,1 и 41,9 (кв), 33,8 и 33,7 (т), 29,9 (т).
ЖХ/МС (сочетание жидкостной хроматографии и масс-спектрометрии): 30*2,1 мм Zorbax SB С 18 3 мкм, 40% МеОН за 2 мин до 100% @ 10 мин, за 10 мин; остаток Н2О при 0,5 мл/мин, УФ 210, 250, 280 и 310 нм, отдельный пик (комн. темп. около 6,0 мин). PI-MS m/z 289 ([М+Н]+), 271 ( [М+Н-Н2О]+). NI-MS m/z 287 ([М+Н]-), 269 ( [M-H-H2O]-).
Пример 131:
Норсангуинин (SPH-1486)
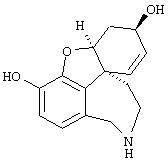
Раствор норгалантамина (1,0 г, 3,66 ммоля) в 40 мл абсолютного ТГФ смешивали при комнатной температуре с 17 мл L-селектрида® (1 М в ТГФ) и перемешивали 24 часа при температуре кипения.
Охлаждали до комнатной температуры, смешивали с этиловым эфиром уксусной кислоты (20 мл), затем с водой (100 мл) и разделяли фазы. Органическую фазу экстрагировали водой (4× 20 мл), объединенные водные фазы экстрагировали этиловым эфиром уксусной кислоты (2× 20 мл) и оставшиеся после упаривания остаток очищали колоночной хроматографией (100 г силикагеля, хлороформ:аммиак = 90:9:1) и выкристаллизовывали из ацетона. Указанным способом получали продукт в виде бесцветных кристаллов (0,78 г, 82,3%).
1Н-ЯМР (ДМСО-d6): δ 6,52-6,37 (м, 2Н), 6,03 (д, J=10,3 Гц, 1Н), 5,78 (дд, J=10,3 Гц, J=4,6 Гц, 1Н), 4,43 (с, 1Н), 4,09 (с, 1Н), 3,90 (д, J=16 Гц, 1Н), 3,71 (д, J=16 Гц, 1Н), 3,25-2,92 (м, 2Н), 2,24-2,90 (м, 2Н), 2,39 (д, J=14 Гц, 2Н);
13С-ЯМР (ДМСО-d6): δ 145,6 (с), 140,4 (с), 133,0 (с), 132,3 (с), 127,7 (д), 127,6 (д), 119,6 (д), 114,8 (д), 86,5 (д), 60,1 (д), 53,1 (т), 48,3 (с), 46,6 (т), 40,2 (т), 30,8 (т).
Пример 132:
(4а,S,6R,8aS)-4a,5,9,10,11,12-гексагидро-3-метил-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол (SPH-1487)
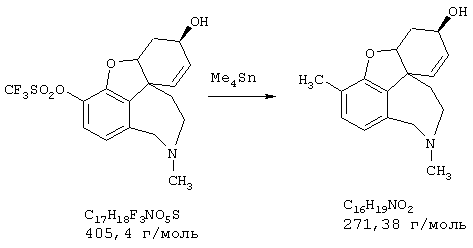
(4aS,6R,8aS)-4a,5,9,10,11,12-гексагидро-3-трифторметил-сульфонилокси-6Н-бензофуро[3а,3,2-еf][2]бензазепин-6-ол (200 мг, 0,49 ммоля), тетраметилстаннан (106 мг, 0,59 ммоля), безводный хлорид лития (62 мг, 1,47 ммоля) и тетракистрифенилфосфинпалладий (28 мг, 0,025 ммоля, 0,05 эквивалента) перемешивали в абсолютном ДМФА (3 мл) 24 часа при 100° С. Распределяли между водой (20 мл) и этиловым эфиром уксусной кислоты (30 мл), экстрагировали водную фазу этиловым эфиром уксусной кислоты (5× 30 мл), промывали объединенные органические фазы водой (3× 10 мл) и насыщенным раствором поваренной соли (15 мл) и полученный после упаривания остаток очищали колоночной хроматографией (20 г силикагеля, хлороформ:метанол:аммиак = 96:3:1). Указанным способом получали продукт в виде бесцветных кристаллов (102 мг, 77%).
МТ-298 JOS 1711
C17H21NO2·0,25 Н2О
Вычислено, %: С 74,02; Н 7,86; N 5,08.
Найдено, %: С 73,77; Н 7,67; N 5,04.
1H-ЯМР (CDCl3): δ 6,90 (д, J=7,0 Гц, 1Н), 6,46 (д, J=7,0 Гц, 1H), 6,08 (д, J=11,5 Гц, 1Н), 6,00 (дд, J=8,5 Гц, J=5,2 Гц, 1H), 4,54 (с, 1Н), 4,13 (с, 1Н), 4,11 (д, J=16,5 Гц, 1H), 3,70 (д, J=16,5 Гц, 1H), 3,30 (т, J=12,7 Гц, 1H), 3,08 (д, J=12,7 Гц), 2,66 (дд, J=15,2 Гц, J=5,0 Гц, 1H), 2,42 (с, 3Н), 2,18 (с, 3Н), 2,17-2,00 (м, 2Н), 1,57 (дд, J=13,3 Гц, J=5,0 Гц, 1H);
13С-ЯМР (CDCl3): δ 156,4 (с), 135,3 (с), 131,6 (с), 130,1 (д), 127,7 (д), 127,6 (д), 122,0 (д), 119,8 (с), 88,1 (д), 62,7 (д), 61,3 (т), 54,2 (т), 48,5 (с), 42,4 (д), 33,9 (т), 30,4 (т), 15,3 (кв).
Пример 136:
SPH-1146 ТК 66/1
Бромид (-)-циклопропилметилгалантаминия
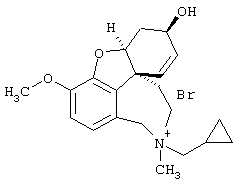
Получение аналогично примерам 90-99, т.пл. 230-237° С.
 =-110 (С=1,5 в воде)
=-110 (С=1,5 в воде)
Пример 137:
SPH-1149 НМ 104
Бромид (-)-(3-метилбут-2-ен-1-ил)-галантаминия
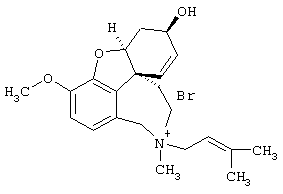
Получение аналогично примерам 90-99, т.пл. 198-201° С.
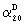 =-118,2 (1,5 в воде)
=-118,2 (1,5 в воде)
Пример 138:
SPH-1162 CI 2-1 3au
Этиловый эфир 3-((6R)-1-бром-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4aH-[l]бензофуро[3a,3,2-ef][2]бензазепин-11(12Н)-ил) пропановой кислоты
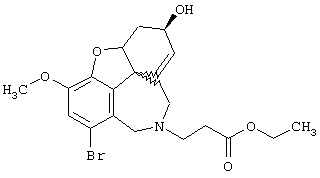
Получение аналогично примеру 143
Время реакции: 8 час, выход: 80% бесцветной пены
Основная структура одинакова с примером 143, здесь даны только отличающиеся сигналы:
1H-ЯМР (CDCl3) δ 4,13 (кв, J=6,0 Гц, 2Н), 2,85 (т, J=7,0 Гц, 2Н), 2,58 (т, J=7,0 Гц, 2Н), 1,27 (т, J=6 Гц, 3Н);
13С-ЯМР (CDCl3) δ 172,4 (с), 60,3 (т), 57,3 (т), 32,9 (т), 14,1 (кв).
Пример 139:
SPH-1184 LCz 225/1
Полугидрат бромида (-)(4-бромфенил)метилгалантаминия
Получение аналогично примерам 90-99,
Вычислено, %: С 52,77 Н 5,17; N 2,56.
Найдено, %: С 52,45; Н 5,15; N 2,52.
Пример 140:
SPH-1191 LCz 205
Бромид (-)-(3-хлорпропил)галантаминия· 1,25 Н2О
Получение аналогично примерам 90-99.
Вычислено, %: С 51,40; Н 6,36; N 3,00.
Найдено, %: С 51,08; Н 6,07; N 2,92.
Пример 141:
SPH-1208 CB 2
Амид (6R)-1-бром-6-гидрокси-N11-изопропил-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н) карбоновой кислоты
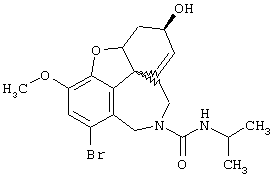
Получение аналогично примеру 142, выход: 96%;
1H-ЯМР (СDС13) δ 6,87 (с, 1Н), 6,04 (дд, J=16,0; 10,0 Гц, 2Н), 4,88 (д, J=18,0 Гц, 1Н), 4,61 (м, 1Н), 4,28 (д, J=18,0, 1Н), 4,13 (шир., 1H), 3,90 (м, 1H), 3,85 (с, 3Н), 3,26 (т, J=12,0 Гц, 1H), 2,67 (дд, J=16,0; 3,0 Гц, 1Н), 2,29 (д, J=10,0 Гц, 1Н), 1,99 (м, 2Н), 1,72 (д, J=17 Гц, 1Н); 1,12 (дд, J=20,0; 5,0 Гц, 6Н); 13С-ЯМР (СDС13) δ 156,0 (с), 146,5 (с), 144,9 (с), 133,8 (с), 128,6 (д), 128,2 (с), 127,5 (с), 125,8 (д), 115,1 (д), 112,3 (д), 88,5 (д), 61,6 (д), 56,1 (кв), 50,3 (т), 49,1 (с), 45,2 (т), 42,7 (д), 36,6 (т), 29,6 (т) 23,4 (кв), 23,0 (кв).
Анализ (C20H25BrN2O4·0,3 H2O)
Вычислено: С 54,26; Н 5,83; N 6,33.
Найдено: С 54,28; Н 5,79; N 6,14.
Пример 142:
SPH-1209 CB 5
Амид (6R)-l-бpoм-6-гидpoкcи-3-мeтoкcи-N11-мeтил 5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-тиокарбоновой кислоты
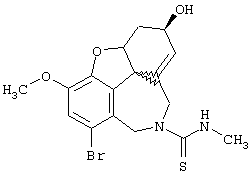
К перемешиваемому раствору бромноргалантамина (0,2 г, 0,57 ммоля) в толуоле (10 мл) прибавляли по каплям метилизотиоцианат (42,0 мг, 0,57 ммоля) и нагревали 3 часа с обратным холодильником. После упаривания остаток вносили в 2 н НС1 (20 мл) и промывали AcOEt (1× 10 мл). Водный раствор подщелачивали концентрированным аммиаком до рН>8,5 и экстрагировали AcOEt (3× 10 мл). Объединенные органические фазы промывали насыщенным раствором поваренной соли, сушили (Na2SO4) и упаривали, получая продукт в виде бесцветных кристаллов с температурой плавления 183-185° С (0,22 г, 99%);
1Н-ЯМР (СDС13) δ 7,35 (шир., 1Н), 6,89 (м, 1Н), 6,10 (м, 2Н), 5,50 (д, J=12,0 Гц, 1Н), 5,11 (д, J=12,0 Гц, 1Н), 4,69 (шир., 1Н), 4,52 (д, J=12,0 Гц, 1Н), 4,17 (шир., 1Н), 3,85 (с, 3Н), 3,60 (т, J=18,0 Гц, 1Н), 3,10 (д, J=3,4 Гц, 3Н), 2,72 (дд, J=18,8, 2,0 Гц, 1Н), 2,13 (м, 2Н), 1,79 (д, J=12,0 Гц, 1Н); 13С-ЯМР (CDCl3) δ 181,5 (с), 146,8 (с), 145,4 (с), 133,9 (с), 128,9 (д), 128,2 (с), 125,5 (д), 115,3 (д), 112,5 (д), 88,6 (д), 61,5 (д), 56,2 (кв), 51,7 (т), 51,2 (т), 48,9 (с), 35,8 (т), 33,0 (кв), 29,6 (т).
Анализ (C18H21BrN2O3S· 0,5 H2O)
Вычислено: С 50,83; Н 4,98; N 6,59.
Найдено: С 50,73; Н 5,02; N 6,63.
Пример 143:
SPH-1210 CB 4
3-((6R)-1-бром-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)пропаннитрил
К раствору норгалантамина (200 мг, 0,57 ммоля) в 50%-ном EtOH (20 мл) прибавляли акрилонитрил (0,05 мл, 0,85 ммоля) и хлорид кальция (200 мг, 1,80 ммоля) и реакцию нагревали 3 часа с обратным холодильником. Реакцию концентрировали, остаток вносили в 2 н НС1 (50 мл) и промывали EtOAc (3× 25 мл, органические фазы отбрасывали). Водный раствор подщелачивали конц. NН3 до рН>8,5 и экстрагировали метиленхлоридом (3× 25 мл). Объединенные органические фазы промывали насыщенным раствором хлорида натрия (200 мл), сушили (Na2SO4) и упаривали, получая продукт в виде бесцветной пены 220 мг (95,7%).
1H-ЯМР (CDCl3) δ 6,90 (с, 1Н), 6,04 (дд, J1=16,0 Гц, J2=10,0 Гц, 2Н), 4,60 (шир., 1Н), 4,38 (д, J=16,0, 1H), 4,12 (шир., 1H), 4,08 (д, J=16,0 Гц, 1H), 3,83 (с, 3Н), 3,47 (т, J=10,0 Гц, 1H), 3,18 (д, J=18,0 Гц, 1H), 2,80 (т, J=10,0 Гц, 2Н), 2,63 (м, 2Н), 2,61 (м, 1H), 2,03 (м, 2Н), 1,60 (д, J=10,0 Гц, 1H); 13С-ЯМР (СDС13) δ 145,6 (с), 144,5 (с), 134,1 (с), 128,4 (д), 127,1 (с), 126,1 (д), 118,6 (с), 115,8 (д), 114,3 (д), 88,7 (д), 61,7 (д), 56,1 (кв), 54,9 (т), 52,0 (т), 48,9 (с), 47,2 (т), 33,3 (т), 29,7 (т), 16,8 (т).
Анализ (C19H21BrN2O3)
Вычислено: С 56,31; Н 5,22; N 6,91.
Найдено С 56,53; Н 5,44; N 6,64.
Пример 144
SPH-1227
[4aS-(4aα ,6α ,8aR*)]-4a,5,9,10,11,12-Гексагидро-3-метокси-11-метил-6Н-бензофуро [3а,3,2-ef][2]бензазепин-6-амин
Стадия 1
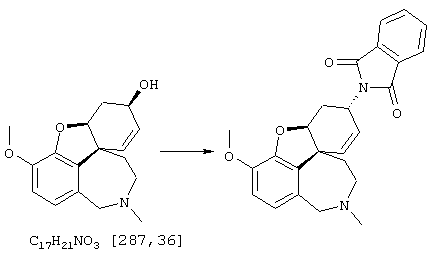
Раствор 300 мг (1,05 ммоля) галантамина, 208 мг (1,20 ммоля) диэтилового эфира азадикарбоновой кислоты, 314 мг (1,20 ммоля) трифенилфосфина и 1,20 ммоля фталимида в 30 мл тетрагидрофурана перемешивали 24 ч при комн. температуре. Затем тетрагидрофуран удаляли, остаток вносили в 30 мл 2 н соляной кислоты, трижды промывали по 30 мл этилового эфира уксусной кислоты и подщелачивали концентрированным водным аммиаком. Затем раствор трижды экстрагировали по 30 мл этилового эфира уксусной кислоты, объединенные органические фазы промывали один раз насыщенным водным раствором хлорида натрия, сушили (Na2SO4), фильтровали и упаривали. Сырой продукт очищали ЖХ (жидкостной хроматографией) (15 г силикагеля, растворитель: СНС13:МеОН = 97:3).
83% бесцветных кристаллов, т.пл.: 60-63° С
ТСХ: СНС13:МеОН =9:1
Стадия 2
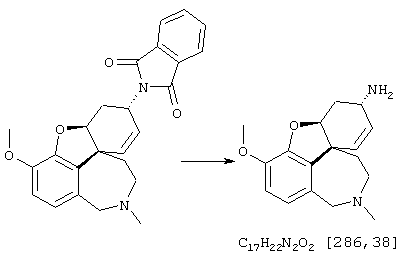
К охлажденному до -5° С раствору 0,72 ммоля исходного вещества в 5 мл абсолютного метанола прибавляли по каплям 146 мг (1,44 ммоля) триэтиламина, а также 162 мг (1,58 ммоля) 3-(диметиламино)пропиламина. Затем реакционную смесь перемешивали 24 часа при комнатной температуре и после этого удаляли метанол, триэтиламин и 3-(диметиламино)пропиламин на роторном испарителе. Полученный сырой продукт очищали ЖХ (15 г силикагеля, растворитель: СНС13:МеОН=9:1 с 0,5% концентрированного водного аммиака), получая бесцветные кристаллы с т.пл. 119-121° С со значением вращения  [с=0,1, СНС13]=-264° С.
[с=0,1, СНС13]=-264° С.
ТСХ: СНС13:МеОН=9:1
1H-ЯМР (CDCl3): δ 1,56-1,89, м, 2Н; 2,78, м, 1Н; 3,02, м, 1H; 3,24, м, 1Н; 3,48, м, 1H; 2,32, с, 1Н; 3,83, с, 1H; 3,63, д, 1H; 4,07, д, 1H; 4,62, шир, 1H; 4,98, шир, 1H; 5,74, д, 1H; 6,11, д, 1H; 6,54, д, 1H; 6,64, д, 1H.
Пример 145:
SPH-1273 CB 99
(4aS,6R,8aS)-11-Метил-3-фенокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро [3а,3,2-ef][2]бензазепин-6-ол
К раствору 1,0 г (3,6 ммоля) О-деметилгалантамина в 50 мл дихлорметана прибавляли 0,44 г (3,6 ммоля) бензолборной кислоты, 2,5 мл (9 ммолей) триэтиламина, 0,67 г (3,6 ммоля) ацетата меди(II) и 1 г молекулярного сита (размельченного до 4 ангстрем). Реакционную смесь затем перемешивали 44 ч при комнатной температуре. Твердое вещество отфильтровывали. Фильтрат экстрагировали 2 раза по 30 мл насыщенного водного раствора гидрокарбоната натрия. Водные фазы снова экстрагировали 3 раза по 30 мл метиленхлорида. Объединенные органические фазы сушили над сульфатом натрия и растворитель отгоняли. Сырой продукт (0,55 г, 43,7% от теории) очищали колоночной хроматографией (СНС13:МеОН=95:5).
Выход: 0,3 г (23,8% от теории)
ТСХ: СНС13:СН3ОН=9:1
СВ 99:
1H-ЯМР (CDCl3): δ 7,29 (м, 2Н), 7,04 (т, J=7,2 Гц, 1Н), 6,89 (д, J=8,7 Гц, 2Н), 6,73 (дд, J1=31,6 Гц, J2=8,7 Гц, 2Н), 6,03 (м, 2Н), 4,59 (с, 1Н), 4,51 (шир., 1Н), 4,17 (д, J=15,3 Гц, 1Н), 3,77 (д, J=15,3 Гц, 1Н), 3,33 (т, J=13,0 Гц, 1Н), 3,10 (д, J=14,5 Гц, 1Н), 2,53 (м, 1Н), 2,43 (с, 3Н), 2,15 (м, 1Н), 1,89 (м, 1Н), 1,62 (д, J=13,8 1Н); 13С-ЯМР (CDCl3): δ 157,3 (с), 148,1 (с), 139,6 (с), 134,2 (с), 129,6 (2* д), 128,1 (д), 126,2 (д), 122,8 (д), 122,7 (д) 120,2 (д), 116,8 (д), 88,7 (д), 61,7 (д), 59,9 (т), 53,2 (т), 48,1 (с), 41,2 (кв), 32,8 (т), 29,7 (т).
Анализ: (C22H23NO3·0,2 СНС13)
Вычислено: С 71,43; Н 6,26; N 3,75.
Найдено С 71,43; Н 6,61; N 3,84.
Пример 146:
SPH-1288 HM 112, DD 13
Амид (6R)-3,6-дигидрокси-N11-изопропил-5,6,9,10-терагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоновой кислоты
К раствору 1,6 ммоля исходного вещества в 17 мл абсолютного дихлорметана медленно прибавляли по каплям под аргоном при -5° С раствор 0,42 мл (4,3 ммоля) трихлорида бора в 4 мл абсолютного дихлорметана. После перемешивания 3 часа при -5° С до 0° С реакционную смесь выливали на 20 мл воды и насыщали гидрокарбонатом натрия. Водную фазу экстрагировали 4 раза по 15 мл н-бутанола и растворитель отгоняли. Остаток очищали колоночной хроматогафией (растворитель: СНС13:СН3ОН=97:3) и сушили при 50° С/50 мбар.
1H-ЯМР (CDCl3): δ 6,57 (дд, J1=18,7 Гц, J2=8,0 Гц, 2Н), 5,94 (дд, J1=21,4 Гц, J2=10,4 Гц, 2Н), 4,90 (дд, J1=10,6 Гц, J2=6,0 Гц, 1Н), 4,36 (м, 3Н), 3,85 (м, 1Н), 3,33 (т, J=12,1 Гц, 1Н), 2,93 (м, 1Н), 2,25 (м, 1Н), 1,87 (м, 2Н), 1,24 (м, 1Н), 1,06 (дд, J1=21,3 Гц, J2=6,5 Гц, 6Н); 13С-ЯМР (CDCl3): δ 156,7 (с), 146,5 (с), 141,0 (с), 131,5 (с), 130,1 (с), 128,1 (д), 127,1 (д), 120,1 (д), 115,5 (д), 88,2 (д), 51,6 (т), 48,0 (с), 45,9 (т), 42,8 (д), 42,0 (д) 36,8 (т), 34,2 (т), 23,5 (кв), 23,1 (кв).
Анализ (С19Н24N2O4·0,8 СНС13) (JOS 1622).
Вычислено: С 54,0; Н 5,68; N 6,37.
Найдено: С 54,08; Н 5,61; N 6,33.
Пример 147
SPH-1302 HM 203
1,1-Диметилэтиловый эфир (4аа,6β ,8aR*)-4а,5,9,10-тетрагидро-6-гидрокси-3-метокси-6Н-бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-карбоновой кислоты (8d)
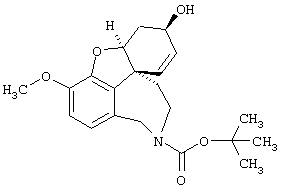
К раствору 12,0 г смеси норгалантамина и галантамина в соотношении 94:6 (соответствующей 41,3 ммоля норгалантамина) и 7,10 г (70,2 ммоля) триэтиламина в 400 мл абсолютного тетрагидрофурана прибавляли по каплям в течение 30 минут раствор 9,00 г (41,30 ммоля) ди-трет-бутилового эфира пироугольной кислоты в 150 мл абсолютного тетрагидрофурана при охлаждении льдом. Через 10 минут охлаждение льдом удаляли и перемешивали 16 часов при комнатной температуре. Затем органический растворитель упаривали, остаток переносили в этиловый эфир уксусной кислоты, промывали трижды по 150 мл 1 н водной соляной кислоты, трижды по 200 мл насыщ. раствора гидрокарбоната натрия и дважды по 200 мл насыщ. раствора хлорида натрия. Растворитель сушили над сульфатом натрия, упаривали и остаток очищали MPLC; растворитель:хлороформ:метанол = 99:1 90:10. Получали 11,2 г белой пены НМ 203 (73% от теории).
ТСХ: СНС13:МеОН/NH3 9:1
1H-ЯМР (CDCl3, 200 МГц): 1,35-1,45 (м, 9Н), 1,75 (м, 1Н), 1,97 (м, 1Н), 2,05 (м, 1Н), 2,40 (м, 1Н), 2,69 (шир., 1Н), 3,30 (шир., 1Н), 3,85 (ОСН3, с, 3Н), 4,08-4,17 (м, 3Н), 4,60 (шир., 1Н), 5,97-6,06 (м, 2Н), 6,70-6,78 (м, 2Н).
Анализ (C21H27NO5·0,4 MeOH)
Вычислено: С 66,54; Н 7,46; N 3,63.
Найдено: С 66,59; Н 7,59; N 3,47.
Пример 149:
SPH-1339 НМ 264-1
(4aS,6R,8aS)-11-пропил-3-метокси-5,6,9,10,11,12-гексагидро-4аН- [1]бензофуро[3а,3,2-еf][2]бензазепин-6-ол
Способ 1:
Раствор 250 мг (0,92 ммоля) (-)-норгалантамина и 160 мг (2,76 ммоля) пропаналя в 20 мл абсолютного ацетонитрила порциями смешивали со 145 мг (2,3 ммоля) цианборгидрида натрия и перемешивали 12 часов при комнатной температуре. Затем еще раз порциями добавляли еще 145 мг (2,3 ммоля) цианборгидрида натрия и реакционную смесь перемешивали следующие 6 часов. После упаривания растворителя осуществляли обработку по способу А1. Дальнейшую очистку производили путем MPLC (растворитель: хлороформ:метанол/NН3 = 95:5). Получали 200 мг (70% от теории) НМ 264.
ТСХ: СНС13:МеОН/NН3 9:1
Способ 2:
Раствор 200 мг (0,73 ммоля) (-)-норгалантамина и 120 мг (1,46 ммоля) ацетата натрия в 12 мл воды, 4 мл абсолютного этанола и 0,62 мл ледяной уксусной кислоты охлаждали до 0° С, смешивали с 211 мг (3,65 ммоля) пропаналя и перемешивали 5 минут. Затем порциями по 10 мг прибавляли 138 мг (3,65 ммоля) боргидрида натрия. Через 20 минут добавляли следующие 211 мг (3,65 ммоля) пропаналя и 138 мг (3,65 ммоля) боргидрида натрия и перемешивали 30 минут. Затем реакционную смесь обрабатывали, как описано в способе Al. Получали 210 мг (91% от теории) НМ 264.
ТСХ: СНС13:МеОН/NН3 9:1
1H-ЯМР (СDС13, 200,13 МГц): δ 0,88 (т, J=7,2, 3Н), 1,96-2,11 (м, 2Н), 2,45 (секстет, J=7,8, J=4,6, J=5,0 Гц, 2Н), 2,68 (ддд, J=15,7, J=1,8, J=1,8, 1Н), 3,18 (ддд, J=14,9, J=3,1, J=3,1 Гц, 1Н), 3,35 (ддд, J=14,4, J=2,2, J=1,9, 1H), 3,80 (д, J=15,3 Гц, 1Н), 3,85 (с, 3Н), 4,10 (д, J=15,3, 1H), 4,12 (шир., 1Н), 4,60 (шир., 1Н), 5,96-6,13 (м, 2Н), 6,61 (д, J=8,2, 1Н), 6,68 (д, J=8,2, 1Н); 13С-ЯМР (CDCl3 50,32 МГц): δ 11,8 (кв), 20,5 (т), 29,9 (т), 32,9 (т), 48,4 (с), 51,4 (т), 53,5 (т), 55,8 (кв), 57,7 (т), 62,0 (д), 88,6 (д), 111,1 (д), 121,9 (д), 127,0 (д), 127,4 (д), 129,6 (с), 133,1 (с), 143,9 (с), 145,7 (с).
Пример 150:
SPH-1340 HM 265-1
N-Деметил-N-пропаргил-галантамин
Раствор 0,50 г (1,83 ммоля) (-)-деметилгалантамина, 0,51 г (3,66 ммоля) карбоната калия и 0,55 г (3,66 ммоля) йодида натрия в 25 мл диметилформамида смешивали с 2,20 ммоля реагентов и нагревали шесть часов при 70-80° С. Затем растворитель упаривали. Остаток вносили в 50-100 мл 2 н водной соляной кислоты и дважды промывали по 40-70 мл этилового эфира уксусной кислоты. Затем подщелачивали конц. водным аммиаком и трижды экстрагировали по 40-70 мл дихлорметана. Объединенные органические фазы дважды промывали по 40-70 мл насыщ. раствора хлорида натрия, сушили над сульфатом натрия и растворитель упаривали.
Дальнейшую очистку осуществляли путем MPLC (растворитель: хлороформ:метанол/NН3 = 95:5).
Выход: 0,26 г (46% от теории) бесцветного масла
ТСХ: CHCl3:MeOH/NH3 9:1
1H-ЯМР (CDCl3, 200,13 МГц): δ 1,53 (ддд, J=13,8, J=3,7, J=2,1, 1H), 1,89-2,09 (м, 4Н), 2,27 (т, J=2,3, 2Н), 2,65 (ддд, J=15,8, J=1,6, J=1,6, 1H), 3,15-3,43 (м, 2Н), 3,79 (д, J=15,0 Гц, 1Н), 3,85 (с, 3Н), 4,11 (д, J=15,0 Гц, 1Н), 4,13 (шир., 1Н), 4,58 (шир., 1Н), 5,91-6,09 (м, 2Н), 6,63 (шир., 2Н); 13С-ЯМР (CDCl3, 50,32 МГц): δ 29,9 (т), 34,5 (т), 44,2 (т), 48,0 (с), 51,5 (т), 55,8 (кв), 58,2 (т), 61,9 (д), 72,8 (с), 79,4 (д), 88,6 (д), 111,3 (д), 122,0 (д), 126,8 (д), 127,6 (д), 128,7 (с), 132,9 (с), 144,1 (с), 145,8 (с).
Пример 151:
SPH-1357 MF 8
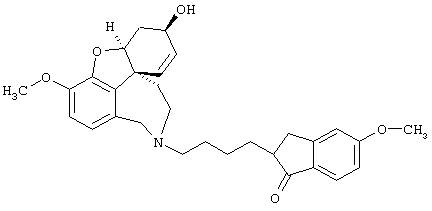
Получение аналогично примеру 6/стадия 3, но с использованием 2-(4-бромбутил)-5-метоксииндан-1-она, бесцветная пена.
1H-ЯМР (ч.н.м., СDС13): δ 7,65 (д, J=8,1 Гц, 1Н), 6,87 (д, J=7,7 Гц, 2Н), 6,62 (дд, J1=12,9 Гц, J2=8,4 Гц, 2Н), 6,04 (м, 2Н), 4,60 (шир., 1Н), 4,14 (м, 2Н), 3,85 (с, 3Н), 3,83 (с, 3Н), 3,81 (м, 1Н), 3,61 (д, J=6,24 Гц, 1Н), 3,25 (м, 2Н), 2,88 (д, J=15,1, 5Н), 2,52 (шир., 1Н), 2,07 (м, 3Н), 1,93 (м, 1Н), 1,64-1,48 (м, 4Н); 13С-ЯМР (ч.н.м., CDCl3): 207,0 (с), 165,3 (с), 162,5 (с), 156,6 (с), 145,8 (с), 144,1 (с), 133,1 (с), 129,5 (с), 127,6 (д), 126,9 (д), 122,0 (д), 115,2 (д), 111,2 (д), 109,6 (д), 88,7 (д), 62,0 (т), 57,6 (т), 55,9 (кв), 55,8 (кв), 51,5 (т), 48,4 (д), 47,6 (д), 32,8 (т), 31,5 (т), 29,9 (т), 29,6 (т), 27,4 (т), 25,1 (т).
Пример 155:
SPH-1377 BK-34-2
2-[4-[(4aS,6R,8aS)-4a,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-6Н-бензофуро[3а,3,2-ef][2]бензазепин-11-ил]бутил]-5-метоксииндан-1-он, фумарат
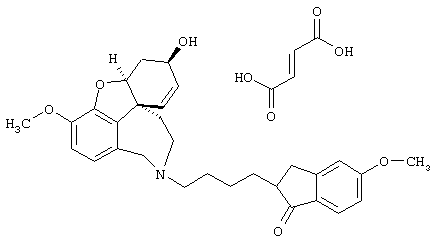
Получение из примера 151 аналогично примеру 7/получение фумарата.
Т.пл.: 107-110° С.
C30H35NO5 5/4C4H4O4·1H2O
Вычислено: С 64,07; Н 6,44; N 2,11.
Найдено: С 64,26; Н 6,41; N 2,23.
1H-ЯМР (ч.н.м., CDCl3): δ 7,56 (д, J=10 Гц, 1H), 7,10 (с, 1H), 6,98 (д, J=10 Гц, 1Н), 6,80 (м, 2Н), 6,63 (с, 2Н), 6,13 (д, J=12,0 Гц, 1H), 5,89 (м, 1H), 4,61 (с, 1H), 4,50 (д, J=8,0 Гц, 1H), 4,07 (шир., 2Н), 3,88 (с, 3Н), 3,72 (с, 3Н), 3,52 (т, J=12 Гц, 1H), 3,31 (м, 2Н), 2,69 (м, 5Н), 2,30 (д, J=12 Гц, 1H), 2,07 (м, 2Н), 1,74 (м, 4Н), 1,38 (м, 3Н); 13С-ЯМР (ч.н.м., СDС13): 206,3 (с), 166,9 (с), 165,3 (с), 157,2 (с), 146,3 (с), 144,6 (с), 133,1 (д), 129,7 (с), 129,4 (с), 126,4 (д), 125,1 (д), 122,5 (д), 115,8 (д), 112,7 (д), 110,3 (д), 86,8 (д), 65,3 (т), 60,0 (т), 56,1 (кв), 55,8 (кв), 51,1 (т), 47,5 (д), 46,9 (д), 32,5 (т), 32,5 (т), 31,9 (т), 31,2 (т), 30,8 (т), 24,9 (т), 24,2 (т).
Пример 157:
SPH-1515
Аллиловый эфир (4аS,6R,8аS)-3,6-дигидрокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро [3а,3,2-ef][2]бензазепин-11(12Н)-ил)карбоновой кислоты (ML-7)
К суспензии 0,788 г (2,13 ммоля) норсангуинина (ВЭЖХ-чистота 70%) и 10 мл абсолютного дихлорметана в атмосфере инертного газа через перегородку вводили шприцем 2,11 мл (1,538 г, 19,3 ммоля) триэтиламина и 0,81 мл (0,693 г, 6,384 ммоля) триметилсилилхлорида и суспензию перемешивали три часа при комнатной температуре. В это время выпадал хлопьевидный осадок. Затем прибавляли 0,34 мл (0,385 г, 3,192 ммоля) аллилового эфира хлормуравьиной кислоты при охлаждении на ледяной бане (экзотермическая реакция). Реакционную смесь в течение двух часов при перемешивании нагревали до комнатной температуры, оставляя ледяную баню оттаивать. Реакцию останавливали прибавлением 13 мл 2 н соляной кислоты и фазы разделяли. Органические фазы промывали четырежды по 10 мл 2 н соляной кислоты и один раз раствором поваренной соли, объединенные органические фазы снова экстрагировали один раз 20 мл дихлорметана. Объединенные органические фазы сушили сульфатом натрия и фильтровали. После отгонки растворителя на роторном испарителе сырой продукт (ВЭЖХ-чистота 87,5%) очищали MPLC (50 г силикагеля, об. = 285 нм, хлороформ/метанол = 95/5). После упаривания и сушки в высоком вакууме получали продукт в виде желтоватого высоковязкого масла, которое при сгущении выкристаллизовывались из дихлорметана. Выход: 0,443 г (1,29 ммоля, 61%), бесцветное кристаллическое твердое вещество (Mw=343,4), ТСХ: Rf=0,55 (хлороформ/метанол = 9/1), т. пл.: 197-198° С (дихлорметан).
1H-ЯМР (200,13 МГц, CDCl3, TMS) δ 7,66 (шир.с, 0,3Н), 6,52-6,76 (м, 2Н), 5,95 (шир.с, 2Н), 5,72-5,90 (м, 1Н), 5,06-5,36 (м, 2Н), 4,90 (д, J=12,7 Гц, 0,5Н) и 4,79 (д, J=12,7 Гц, 0,5Н), 4,51 (шир.с, 3Н), 4,00-4,41 (м, 3Н), 3,22-3,53 (м, 1Н), 3,13 (шир.с, 0,3Н), 2,58 (шир.д, J=13,4 Гц, 1Н), 1,63-2,10 (м, 3Н); 13С-ЯМР (50,32 МГц, СDС13, TMS), δ 155,4 и 155,2 (с), 145,4 (с), 140,6 (с), 132,7 и 132,6 (д), 131,9 и 131,7 (с), 128,3 (с), 127,1 (д), 127,0 (д), 121,6 и 121,1 (д), 117,4 и 116,8 (т), 115,8 и 115,7 (д), 87,7 (д), 66,1 и 65,9 (т), 61,8 (д), 51,9 и 51,5 (т), 48,4 (с), 45,9 и 45,4 (т), 37,0 и 36,0 (т), 29,5 (т).
Схему к примерам 158 и 159 см. в конце текста описания.
Пример 158
SPH-1522
(4aS,6R,8aS)-N11-(N-трет-бутоксикарбонил-6-аминогексил)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро-[3a,3,2-ef]-[2]бензазепин-11(12Н)карбоксамид (СК-52-6)
0,600 г (0,426 ммоля) N-трет-бутоксикарбонил-норгалантамин-6-илокси-1,5-диоксопентилоксиметил-смолы Меррифилда оставляли набухать в избытке дихлорметана в закрытом с двух сторон 10 мл полиэтиленовой фритте 30 минут и аналогично способу удаления защиты для иммобилизации N-трет-бутоксикарбонилноргалантамина (пример 147) демаскировали и промывали (каждый раз по 6 мл растворителя). После этого смолу аналогично предыдущей стадии подвергали взаимодействию с 730 мкл (0,551 г, 4,260 ммоля) этилдиизопропиламина и 0,379 г (1,278 ммоля) трифосгена в 6 мл абсолютного дихлорметана. После промывания и высушивания смолы в вакууме в течение ночи получали 0,653 г N-хлоркарбонилноргалантамин-6-илокси-1,5-диоксопентилоксиметил-смолы Меррифилда.
После набухания смолы (0,103 г, 0,065 ммоля) и фильтрования суспендировали ее в растворе 0,164 г (0,650 ммоля) гидрохлорида N-трет-бутоксикарбонил-1,6-диаминогексана, 222 мкл (0,168 г, 1,300 ммоля) этилдиизопропиламина, 0,053 мкл (0,051 г, 0,650 ммоля) пиридина и 2,0 мл диметилформамида (чтобы растворить, гидрохлорид предварительно нагревали). Затем суспензию встряхивали при комнатной температуре 5,5 часа. Смолу трижды промывали диметилформамидом (2 мин, 1 мл) и шесть раз дихлорметаном (2 мин, 1 мл). После высушивания в вакууме смолу встряхивали в 2 мл тетрагидрофурана 30 минут и после фильтрования смешивали с раствором 0,059 г (0,018 г, 0,325 ммоля) 30%-ного метанольного раствора метилата натрия и 1,5 мл тетрагидрофурана/метанола (4/1). После встряхивания в течение 9,5 часа при комнатной температуре раствор отфильтровывали и смолу трижды экстрагировали по 1,5 мл дихлорметана/метанола (1/1) и трижды по 1,5 мл дихлорметана. Объединенные фильтраты нейтрализовали метанольной соляной кислотой, разбавляли 10 мл дихлорметана, промывали один раз 15 мл 2 н соляной кислоты и дважды по 15 мл насыщенного раствора хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали на роторном испарителе при пониженном давлении. Сырой продукт (0,051 г) отделяли колоночной хроматографией (5 г силикагеля, хлороформ/метанол = 50/1). После упаривания получали бесцветное масло.
Выход: 0,030 г (0,058 ммоля, 89%), бесцветное масло (МW=515,7)
ТСХ: Rf=0,47 (хлороформ/метанол = 9/1)
1Н-ЯМР: (200,13 МГц, CDCl3, TMS) δ 6,73 (д, J=8,1 Гц, 1Н), 6,66 (д, J=8,3 Гц, 1Н), 5,90-6,07 (м, 2Н), 4,23-4,70 (м, 5Н), 4,13 (шир.с, 1Н), 3,82 (с, 3Н), 3,35 (т, J=13,5 Гц, 1,0Н), 2,96-3,20 (м, 4Н), 2,67 (шир.д, J=15,7 Гц, 1Н), 1,65-2,10 (м, 3Н), 1,42 (с, 9Н), 1,06-1,40 (м, 8Н).
13С-ЯМР: (50,32 МГц, СDС13, TMS)
δ 157,2, 156,0, 147,0, 144,7, 132,5, 129,2, 128,1, 126,5, 120,2, 111,2, 88,4, 61,9, 55,9, 51,7, 48,5, 45,7, 42,1, 40,5, 39,3, 36,6, 30,0, 29,7, 28,4, 26,1, 23,5.
ВЭЖХ: tRet=17,8 мин, 98,7% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5,0 мкм, 1 мл/мин, 285 нм, ацетонитрил/20 мМ Cl3CCO2H в Н2O (20/80 за 5 мин, 20/80 → 60/40 в 12 мин, 60/40 за 5 мин, об./об.)
Пример 159
N-трет-Бутилоксикарбонилглицин-[4-[(4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро [3a,3,2-ef][2]-бензазепин-11(12н)-ил]-3-аза-4-оксобутил]амид (СК-58-2)
0,199 г (0,102 ммоля) норгалантамин-6-илокси-1,5-диоксо-пентилоксиметил-смолы Меррифилда оставляли набухать в 2 мл дихлорметана 30 минут в закрытой с двух сторон 5 мл полиэтиленовой фритте и после фильтрования суспендировали ее в растворе 120 мкл (0,091 г, 0,700 ммоля) этилдиизопропиламина в 1,5 мл дихлорметана. Затем суспензию смешивали с охлажденным до 0° С раствором 0,062 г (0,210 ммоля) трифосгена и 0,5 мл дихлорметана и встряхивали при комнатной температуре два часа. Смолу трижды промывали дихлорметаном (2 мин, 2 мл) и трижды диметилформамидом (2 мин, 2 мл). Затем прибавляли раствор 47 мкл (0,042 г, 0,700 ммоля) этилендиамина и 2,0 мл диметилформамида и суспензию встряхивали при комнатной температуре. Через три часа раствор отфильтровывали и смолу шесть раз промывали по 2 мл диметилформамида (2 мин) (проба Кайзера не показательна. Шарики проявляют красно-коричневое окрашивание). Смолу смешивали с раствором 0,037 г (0,210 ммоля) N-Boc-глицина, 0,028 г (0,210 ммоля) 1-гидроксибензотриазола и 1 мл диметилформамида и встряхивали суспензию пять минут. Затем добавляли 0,043 г (0,210 ммоля) дициклогексилкарбодиимида, растворенного в 1 мл дихлорметана. Суспензию встряхивали три часа при комнатной температуре, фильтровали смолу и промывали ее трижды диметилформамидом (2 мл, 2 мин) и шесть раз дихлорметаном (2 мл, 2 мин). После высушивания в вакууме получали 0,239 г смолы, которую встряхивали 30 минут в тетрагидрофуране и после фильтрования смешивали с раствором 0,076 г (0,023 г, 0,63 ммоля) 30%-ного метанольного раствора метилата натрия и 2,0 мл тетрагидрофурана/метанола (4/1). После встряхивания в течение 8,25 часа раствор отфильтровывали и смолу трижды экстрагировали по 2 мл дихлорметана/метанола (1/1) и трижды по 2 мл дихлорметана. Объединенные фильтраты нейтрализовали метанольной соляной кислотой, разбавляли 10 мл дихлорметана, промывали дважды по 15 мл насыщенного раствора хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали на роторном испарителе при пониженном давлении. Сырой продукт (0,064 г) отделяли колоночной хроматографией (5 г силикагеля, хлороформ/метанол = 25/1 → 15/1). После упаривания получали бесцветное масло.
Выход: 0,030 г (0,025 г, 0,048 ммоля, 47%), бесцветное масло (МW=516,6)
ТСХ: Rf=0,38 (хлороформ/метанол = 9/1)
1Н-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,90 (шир.с, 1Н), 6,83 (д, J=8,1 Гц, 1Н), 6,60-6,71 (м, 1Н), 5,88-6,08 (м, 2Н), 5,39 (шир.с, 1Н), 5,19 (шир.с, 1Н), 4,50-4,70 (м, 2Н), 4,04-4,34 (м, 3Н), 3,82 (с, 3Н), 3,70 (д, J=6,1 Гц, 1H), 3,65 (д, J=5,6 Гц, 1H), 3,11-3,49 (м, 5Н), 2,68 (д, J=15,9 Гц, 1H), 2,41 (д, J=10,9 Гц, 1Н), 1,65-2,09 (м, 3Н), 1,44 (с, 9Н).
ВЭЖХ: tRet=15,2 мин, 82,3% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5,0 мкм, 1 мл/мин, 285 нм, MeOH /H2O (5/95 за 5 мин, 5/95 → 100/0 в 15 мин (конвекция), 100/0 за 10 мин, об./об.).
ЖХ/Масс-спектрометрия: tRet=30,6 мин (колонка Phenomenex Luna, 3,0 мм × 50 мм, RP-18, 3,0 мкм, 0,8 мл/мин, метанол/Н2O (10/90 за 2 мин, 10/90 → 100/0 в 15 мин, 100/0 за 5 мин, об./об.).
APCI-PI-MS
517(17), 499(5), 461(55), 443(39), 417(100), 399(18), 274(43), 256(16)
Пример 160
SPH-1524
Аллиловый эфир (4aS,6R,8aS)-6-(бензоилокси)-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро [3а,3,2-ef][2]бензазепин-11(12)-ил) карбоновой кислоты (СК-65-1)
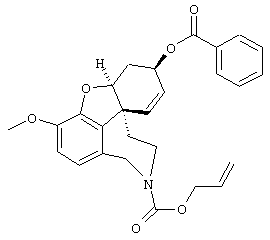
0,075 г (0,210 ммоля) N-аллилоксикарбонилноргалантамина, 0,475 г (2,098 ммоля) ангидрида бензойной кислоты и 0,013 г (0,105 ммоля) диметиламинопиридина вносили в 2 мл дихлорметана и затем смешивали с 0,185 мл (0,136 г, 1,049 ммоля) этилдиизопропиламина. Через 13 часов при комнатной температуре раствор смешивали с 5 мл насыщенного раствора гидрокарбоната натрия, трижды экстрагировали по 5 мл этилового эфира уксусной кислоты. Объединенные органические экстракты промывали дважды по 10 мл 2 н соляной кислоты и дважды 10 мл насыщенного раствора хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали на роторном испарителе при пониженном давлении. Остаток извлекали дважды 10 мл петролейного эфира и раствор декантировали. Остаток (0,100 г) очищали колоночной хроматографией (10 г силикагеля, растворитель = петролейный эфир/этиловый эфир уксусной кислоты = 2/1).
Выход: 0,066 г (0,080 ммоля, 68%), бесцветная пена (MW=461,5)
ТСХ: Rf=0,52 (этиловый эфир уксусной кислоты/петролейный эфир = 2/1)
Т.пл.: 45-49° С (этиловый эфир уксусной кислоты/петролейный эфир = 2/1)
ИК: КВr
ν (см-1) 2946 (м), 1708 (с), 1509 (м), 1483 (м), 1276 (с), 1108 (м), 1056 (м), 714 (м)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 8,06 (д, J=7,1 Гц, 1Н), 7,29-7,61 (м, 3Н), 6,59-6,84 (м, 2Н), 6,28 (д, J=10,3 Гц, 5Н), 6,07 (дд, J=5,0 Гц, J=10,2 Гц, 1Н), 5,76-5,99 (м, 1Н), 5,59 (т, J=4,4 Гц, 1Н), 5,09-5,35 (м, 2Н), 4,87 (дд, J=15,7 Гц, J=22,0 Гц, 1Н), 4,05-4,70 (м, 5Н), 3,89 (с, 3Н), 3,29-3,60 (м, 1Н), 2,81 (шир.д, J=16,1 Гц, 1Н), 1,74-2,25 (м, 3Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 166,2 (с), 155,3 и 155,1 (с), 147,4 и 147,3 (с), 144,3 (с), 132,99 и 132,85 (д), 131,7 (д), 131,4 и 131,0 (с), 130,4 (с), 129,9 (д), 128,4 (д), 127,1 (д), 120,7 и 120,2 (д), 117,4 и 116,8 (т), 111,4 и 111,3 (д), 86 (д), 66,1 и 66,0 (т), 63,4 (д), 56,0 (кв), 63,8 (д), 51,9 и 51,4 (т), 48,3 (с), 45,8 и 45,4 (т), 37,9 и 37,0 (т), 27,8 (т).
Схему к примерам 161 и 162 см. в конце текста описания.
Пример 161
SPH-1525
Иммобилизация аллилового эфира (4aS,6R,8aS)-3,6-дигидрокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)карбоновой кислоты на п-гидроксиметил-феноксиполистирольную смолу (смоле Ванта)
Способ А (СК-63-2)
0,257 г (0,244 ммоля) смолы Ванга (п-алкоксибензилалкогольная смола, D-1250, Bachem Feinchemikalien AG) перемешивали в атмосфере аргона в 3 мл абсолютного дихлорметана 15 минут. Затем прибавляли по каплям в течение пяти минут при 0° С 86 мкл (0,141 г, 1,19 ммоля) тионилхлорида. Суспензию перемешивали при 0° С в течение одного часа. Затем смолу переводили в закрывающуюся с обеих сторон полиэтиленовую фритту, промывали пять раз дихлорметаном (2 мин, 2,5 мл), дважды метанолом (2 мин, 2,5 мл), один раз дихлорметаном (2 мин, 2,5 мл) и один раз диэтиловым эфиром (2 мин, 2,5 мл). Смолу затем сушили в вакууме над пентоксидом фосфора.
Стадия 1
0,2334 г полученной таким образом хлор-смолы Ванга, 0,232 г (0,713 ммоля) карбоната цезия, 0,088 г (0,238 ммоля) йодида тетра-н-бутиламмония и 0,245 г (0,713 ммоля) N-Alloc-норсангуинина при перемешивании суспендировали в 3 мл абсолютного диметилформамида. Затем суспензию перемешивали 24 часа при 60° С. Через пять часов прибавляли 1 мл диметилформамида, чтобы суспендироваить выпавший осадок. Затем смолу закрывающейся с обеих сторон полиэтиленовой фритты обрабатывали раствором диметилформамид/вода (2/1), и промывали дважды раствором диметилформамид/вода (2/1, 2 мин, 2.5 мл), дважды раствором диметилформамид/вода (1/2, 2 мин, 2,5 мл), дважды раствором метанол/вода (1/1, 2 мин, 2,5 мл), дважды метанолом (2 мин, 2,5 мл) и шесть раз дихлорметаном (2 мин, 2,5 мл).
Способ В (СК-63-1)
0,121 мл (0,192 г, 1,247 ммоля) четыреххлористого углерода при 0° С помещали в 2,0 мл абсолютного дихлорметана. При перемешивании (мешалка KPG) прибавляли по каплям 0,311 г (1,188 ммоля) трифенилфосфина, растворенного в 1,0 мл абсолютного дихлорметана в течение 15 минут при 0° С. Перемешивали следующие десять минут при 0° С и еще затем следующие десять часов при комнатной температуре до тех пор, пока не перестали методом тонкослойной хроматографии обнаруживать присутствие трифенилфосфина. Затем добавляли 0,2506 г (0,238 ммоля) смолы Ванга и 1,5 мл дихлорметана и суспензию перемешивали 35 часов при комнатной температуре (300 с-1). Обработку хлорированной смолы Ванга осуществляли аналогично способу А. После высушивания получали 0,2403 г хлор-смолы Ванга, которую перерабатывали аналогично указанной выше стадии 1 такими же количествами карбоната цезия, йодида тетра-н-бутиламмония и N-Alloc-норсангуинина.
Пример 162
SPH-1526
Установление загрузки, аллиловый эфир (4aS,6R,8aS)-6-(бензоилокси)-3-гидрокси-5,6,9,10-тeтрагидро-4aH-[1]бензофуро [3а,3,2-ef][2]бензазепин-11(12)-ил)карбоновой кислоты
1.1.1 Стадия 1 (СК-63-2)
Для установления загрузки и для доказательства того, что N-Alloc-норсангуинин связан со смолой через фенольную группу, смолы, которая получена по способу А и стадии 1, последовательно смешивали с раствором, состоящим из 0,537 г (2,375 ммоля) ангидрида бензойной кислоты и 2 мл дихлорметана, и с раствором, состоящим из 0,015 г (0,119 ммоля) диметиламинопиридина, 0,203 мл (0,154 г, 1,188 ммоля) этилдиизопропиламина и 0,5 мл дихлорметана. Затем суспензию встряхивали при комнатной температуре. Через 18 часов смолу отфильтровывали, промывали шесть раз по 2,5 мл дихлорметана (2 мин) и один раз 2,5 мл диэтилового эфира (2 мин) и сушили в вакууме над пентоксидом фосфора. Получали 0,3085 г замещенной смолы, которую суспендировали в абсолютном дихлорметане 15 минут и затем тщательно отфильтровывали.
Стадия 2
Для отщепления смолу смешивали с 2,5 мл раствора трифторуксусной кислоты/дихлорметана (15/85), встряхивали 30 минут при комнатной температуре, фильтровали и еще раз встяхивали с 2,5 мл раствора трифторуксусной кислоты/дихлорметана (15/85), фильтровали и затем экстрагировали четыре раза по 2,5 мл дихлорметана. Объединенные фильтраты или экстракты смешивали с 10 мл дистиллированной воды и с помощью гидрокарбоната натрия устанавливали рН 6. Фазы разделяли и водную фазу трижды экстрагировали 10 мл дихлорметана. Объединенные органические фазы промывали дважды по 10 мл насыщенного раствора хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Очистку сырого продукта (0,078 г) осуществляли колоночной хроматографией (10 г силикагеля, этиловый эфир уксусной кислоты/петролейный эфир = 2/1). После высушивания в высоком вакууме получали 0,078 г бесцветной пены, которая согласно ВЭЖХ-анализу имела чистоту 95%. Бесцветную пену можно очистить перекристаллизацией из диэтилового эфира при -22° С (морозильное отделение в холодильнике).
Выход: 0,059 г (0,056, 0,0125 ммоля, таким образом достигнута загрузка 0,41 ммоля/г, 61% теоретической максимальной загрузки (0,67 ммоля/г = 0,95 ммоля/г/(1 г + 1 г · 0,95 моля/г · (447,5 г/моль - 18 г/моль)/1000)) бесцветной пены (МW=447,5)
ТСХ: Rf=0,29 (этиловый эфир уксусной кислоты/петролейный эфир = 1/1)
Т.пл.: 158-159° С (диэтиловый эфир)
1H-ЯМР: (200,13 МГц, d6-ДМСО)
δ 7,99 (д, J=6,5 Гц, 2Н), 7,38-7,71 (м, 3Н), 6,39-6,63 (м, 3Н), 5,73-6,17 (м, 2Н), 5,47 (т, J=4,3 Гц, 1Н), 5,04-5,33 (м, 2Н), 4,00-4,72 (м, 6Н), 2,60-2,89 (м, 1Н), 2,55 (шир.д, J=18,6 Гц, 1Н), 2,25 (шир.д, J=15,7 Гц, 1Н), 1,70-1,93 (м, 2Н).
13С-ЯМР: (50,32 МГц, d6-ДМСО)
δ 165,4 (с), 154,6 и 154,4 (с), 146,3 (с), 141,3 (с), 133,5 (д), 133,3 (д), 133,2 (д), 131,8 (д), 131,5 (с), 130,2 (с), 129,5 (д), 128,6 (д), 128,0 (с), 122,2 (д), 120,4 и 120,0 (д), 117,0 и 116,1 (т), 115,0 (д), 84,7 (д), 65,2 и 65,0 (т), 63,8 (д), 51,0 и 50,5 (т), 48,0 (с), 45,1 и 44,7 (т), 37,3 и 36,4 (т), 27,4 (т).
ВЭЖХ: tRet=21/41 мин, 95,1% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5 мкм, 285 нм, 1 мл/мин, ацетонитрил/20 мМ С13ССО2Н в Н2О (15/85 за 5 мин, 15/85 → 60/40 в 12 мин, 60/40 за 5 мин, об./об.).
(СК-63-1)
Смолу, которую получали по способу В и стадии 1, обрабатывали ангидридом бензойной кислоты аналогично стадии 1 и после высушивания в вакууме получали 0,3004 г замещенной смолы. Отщепление продукта и обработку водой производили аналогично стадии 2. После упаривания и высушивания в вакууме получали 0,070 г сырого продукта, который очищали колоночной хроматографией (10 г силикагеля, этиловый эфир уксусной кислоты/петролейный эфир = 2/1). После упаривания и сушки в высоком вакууме получали 0,051 г бесцветной пены, которая согласно ВЭЖХ-анализу имела чистоту 93%.
Выход: 0,051 г (0,047 г, 0,0106 ммоля, таким образом достигали загрузки 0,35 ммоля/г, 52% теоретической максимальной загрузки (0,67 ммоля/г = 0,95 ммоля/г/(1 г + 1 г · 0,95 моля/г · (447,5 г/моль - 18 г/моль)/1000)) бесцветной пены (Mw=447,5).
ВЭЖХ: tRet=21,41 мин, 92,7% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5 мкм, 285 нм, 1 мл/мин, ацетонитрил/20 мМ Cl3CCO2H в H2O (15/85 за 5 мин, 15/85 → 60/40 в 12 мин, 60/40 за 5 мин, об./об.).
Пример 163: Синтез на твердой фазе/мануальный
Схему к примеру 163 см. в конце описания.
Пример 163/стадии 1-7
Иммобилизация (4aR,6S,8aR)-3-метокси-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро [3а,3,2-ef][2]бензазепин-6-ола на гидроксиметил-полистирольной смоле (смола Меррифилда)
Способ А (СК-41-1) стадии 1-2 и 5-7
5,000 г (5,2 ммоля) гидроксиметильной смолы Меррифилда (гидроксиметильная смола, D-1160, Bachem Feinchemikalien AG) в трехгорлом реакторе с расположенной на дне фриттой и мешалкой KPG перемешивали один час в 60 мл дихлорметана (300 с-1). После фильтрования суспензию смешивали с раствором 2,373 г (20,8 ммоля) ангидрида глутаровой кислоты, 4,45 мл (3,362 г, 26,0 ммоля) этилдиизопропиламина в 30 мл абсолютного дихлорметана. Суспензию перемешивали при комнатной температуре десять часов, фильтровали, промывали один раз 50 мл дихлорметана, один раз 50 мл метанола и трижды по 50 мл дихлорметана. Затем смолу сушили в вакууме.
4,385 г полученной таким способом 4-карбокси-1-оксобут-1-илоксиметильной смолы Меррифилда суспендировали при перемешивании за 30 мин, в 50 мл абсолютного дихлорметана и фильтровали. Затем прибавляли 4,569 г (12,23 ммоля) N-трет-бутоксикарбонил-норгалантамина и 0,249 г (2,04 ммоля) диметиламинопиридина, оба растворенные в 15 мл дихлорметана, и 2,10 мл (1,582 г, 12,23 ммоля) этилдиизопропиламина, растворенного в 5 мл дихлорметана. При перемешивании прибавляли по каплям раствор из 1,89 мл (1,544 г, 12,23 ммоля) диизопропилкарбодиимида и 5 мл дихлорметана за пять минут при комнатной температуре. Через 24 часа смолу отфильтровывали, промывали 40 мл метанола и фильтровали. Затем смолу промывали шесть раз по 40 мл дихлорметана (5 мин) и сушили в вакууме.
Смолу смешивали с 42 мл абсолютного дихлорметана и 3 мл анизола и 30 минут перемешивали (150 с-1). После этого при перемешивании (300 с-1) прибавляли 15 мл трифторуксусной кислоты в течение 15 минут. Затем суспензию перемешивали 60 минут (150 с-1), фильтровали и промывали дихлорметаном (2× 40 мл, 5 мин), дихлорметаном/диметилформамидом/триэтиламином (5/4/1) (3× 40 мл, 5 мин) и, наконец, дихлорметаном (5× 40 мл, 5 мин). После высушивания в вакууме получали 4,353 г смолы. Для установления загрузки 0,2384 г смолы в 3 мл диметилформамида суспендировали в закрывающейся с обеих сторон полиэтиленовой фритте. После фильтрования смолу встряхивали в растворе из 177 мкл (0,191 г, 1,875 ммоля) ангидрида уксусной кислоты, 180 мкл (0,136 г, 1,050 ммоля) этилдиизопропиламина и 2 мл диметилформамида девять часов при комнатной температуре. После промывания диметилформамид (3× 2,5 мл, 2 мин) и тетрагидрофураном/метанолом (4/1) (5× 2,5 мл, 2 мин) смола не давала реакции с хлораниловой пробой. Полимер суспендировали в 0,3 М растворе метилата натрия в тетрагидрофуране/метаноле (4/1). Смолу встряхивали 8 часов при комнатной температуре, фильтровали и экстрагировали метанолом/дихлорметаном (1/1, 3× 2,5 мл) и дихлорметаном (3× 2,5 мл). Объединенные фильтраты нейтрализовали метанольной соляной кислотой. Раствор разбавляли примерно 10 мл дихлорметана, промывали по 25 мл насыщ. раствора гидрокарбоната натрия, 1 н соляной кислоты и насыщенного раствора хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Очистку осуществляли колоночной хроматографией (10 г силикагеля, диэтиловый эфир/этанол = 100/15). После упаривания и высушивания в высоком вакууме получали 0,028 г желтоватой пены, которая согласно ВЭЖХ-анализу содержала 10% других примесей.
Выход: 0,025 г (0,080 ммоля, таким образом достигалась загрузка 0,34 ммоля/г, 45% теоретической максимальной загрузки (0,75 ммоля/г = 1,04 ммоля/г/(1 г + 1 г · 1,04 моля/г · (387,4 г/моль - 18 г/моль)/1000)) желтоватой пены (MW=315,4)
ТСХ: Rf=0,29 (диэтиловый эфир/этанол = 100/15)
ИК: КВr
ν (см-1) 3551 (v), 3305 (шир.м), 2926 (м), 2864 (v), 1650 (м), 1615 (c), 1443 (м), 1257 (м), 1070 (м).
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,54-6,89 (м, 2Н), 5,75-6,09 (м, 2Н), 5,14-5,33 (м, 0,3Н), 4,32-4,74 (м, 3,3Н), 4,12 (шир.с, 1Н), 3,86-4,00 (м, 0,3Н), 3,81 и 3,79 (с, 3Н), 3,56-3,76 (м, 0,8Н), 3,23 (шир.т, J=12,6 Гц, 0,8Н), 2,67 (шир.д, J=15,9 Гц, 1Н), 2,38 (шир.с. 0,7Н), 2,06 (м, 3Н), 1,62-2,00 (м, 3Н).
ВЭЖХ: tRet =13,9 мин, 89,8% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5 мкм, 285 нм, 1 мл/мин, ацетонитрил/20 мМ Cl3CCO2H в Н2О (05/95 за 5 мин, 05/95 → 60/40 в 10 мин, 60/40 за 10 мин, об./об., рН 10)
Способ В (СК-43-2), стадии 1 и 3-7
3,500 г (3,64 ммоля) гидроксиметильной смолы Меррифилда (гидроксиметильная смола, D-1160, Bachem Feinchemikalien AG) аналогично способу, описанному под способом А, обрабатывали 1,661 г (14,6 ммоля) ангидрида глутаровой кислоты, 3,15 мл (2,378 г, 18,39 ммоля) этилдиизопропиламина и 0,044 г (0,364 ммоля) диметиламинопиридина в 20 мл абсолютного дихлорметана. После промывания смолу последовательно раствором из 3,15 мл (2,378 г, 18,39 ммоля) этилдиизопропиламина и 10 мл абсолютного дихлорметана и раствором из 1,34 мл (1,317 г, 10,92 ммоля) пивалоилхлорида и перемешивали девять часов при комнатной температуре. После промывания дихлорметаном (4× 30 мл, 5 мин), тетрагидрофураном (30 мл, 5 мин) и дихлорметаном (2× 30 мл, 5 мин) смолу последовательно с 4,061 г (10,87 ммоля) N-трет-бутокси-карбонилноргалантамина и 0,222 г (1,82 ммоля) диметиламинопиридина, оба растворенные в 15 мл дихлорметана, и 3,15 мл (2,378 г, 18,39 ммоля) этилдиизопропиламина, растворенным в 15 мл дихлорметана. Через 24 часа при комнатной температуре раствор отфильтровывали и смолу смешивали с 40 мл сухого раствора из метанола и дихлорметана и перемешивали при комнатной температуре десять минут. После фильтрования и шестикратного промывания дихлорметаном и высушивания в вакууме аналогично способу А смолу промывали 40 мл трифторуксусной кислоты/дихлорметана/анизола (25/70/5) и сушили. Получали 4,145 г желтой смолы. Из них 0,2214 г смолы для определения загрузки аналогично способу обрабатывали и очищали. Получали 0,024 г желтоватой пены, которая согласно ВЭЖХ-анализу имела чистоту 90%.
Выход: 0,022 г (0,069 ммоля, это соответствует загрузке 0,31 ммоля/г, 41% от теоретической максимальной загрузки)
ВЭЖХ: tRet=14,4 мин, 89,0% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5 мкм, 285 нм, 1 мл/мин, ацетонитрил/20 мМ С13ССО2Н в Н2О (05/95 за 5 мин, 05/95 → 60/40 в 10 мин, 60/40 за 10 мин, об./об., рН 10)
Пример 163/стадии 8-13
SPH-1528
1.2 N-п-МЕТОКСИБЕНЗОИЛ-ФЕНИЛАЛАНИЛ-ФЕНИЛАЛАНИН ((4AS,6R,8AS)-6-ГИДРОКСИ-3-МЕТОКСИ-5,6,9,10-ТЕТРАГИДРО-4АH-[1]БЕНЗОФУРО[3A,3,2-EF][2]БЕНЗАЗЕПИН-11(12Н)-ИЛ)АМИД (СК-47-1)
0,245 г (0,076 ммоля) N-трет-бутоксикарбонилноргалантамин-6-илокси-1,5-диоксопентилоксиметильной смолы Меррифилда в закрытой с обеих сторон 5-мл полиэтиленовой фритте оставляли набухать дважды по 15 минут в 3 мл диметилформамида и после фильтрования суспендировали в растворе 0,065 г (0,169 ммоля Fmoc-фенилаланина и 0,062 г (0,169 ммоля) тетрафторбората 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония в 1 мл диметилформамида и встряхивали 5 минут при комнатной температуре. Затем прибавляли 58 мкл (0,044 г, 0,338 ммоля) этилдиизопропиламина в 0,5 мл диметилформамида. Суспензию встряхивали при комнатной температуре 3 часа. Смолу промывали шесть раз диметилформамидом (1 мин, 2,5 мл) и суспендировали в 20%-ном растворе пиперидина в диметилформамиде по две и десять минут при комнатной температуре. После шестикратного промывания диметилформамидом (1 мин, 2,5 мл) смолу аналогично первой стадии сочетания пептида обрабатывали 0,065 г (0,169 ммоля) Fmoc-фенилаланина и 0,062 г (0,169 ммоля) тетрафторбората 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония в 1 мл диметилформамида и 58 мкл (0,044 г, 0,338 ммоля) этилдиизопропиламина в 0,5 мл диметилформамида, промывали диметилформамидом, встряхивали в 20%-ном растворе пиперидина в диметилформамиде и снова шесть раз промывали диметилформамидом (1 мин, 2,5 мл). Затем последовательно прибавляли растворы 0,065 г (0,169 ммоля) Fmoc-Phe-OH в 1 мл диметилформамида, 0,062 г (0,169 ммоля) тетрафторбората 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония в 1 мл диметилформамида и 58 мкл (0,044 г, 0,338 ммоля) этилдиизо-пропиламина в 0,5 мл диметилформамида и встряхивали суспензию 30 минут при комнатной температуре. Проба Кайзера показала полное превращение. Затем аналогично вышеописанной процедуре промывали, суспендировали в растворе пиперидина в диметилформамиде и снова промывали диметилформамидом. После нового последовательного прибавления 0,026 г (0,169 ммоля) п-метоксибензойной кислоты в 1 мл диметилформамида, 0,062 г (0,169 ммоля) тетрафторбората 2-(1-Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония в 1 мл диметилформамида и 58 мкл (0,044 г, 0,338 ммоля) этилдиизопропиламина в 0,5 мл диметилформамида смолу встряхивали в течение ночи, так как проба Кайзера через 30 минут из-за зелено-синего окрашивания не была четкой. Смолу фильтровали, промывали трижды диметилформамидом, пять раз дихлорметаном и метанолом и затем сушили в вакууме. Смолу (0,251 г) за 30 мин суспендировали в ТГФ, фильтровали и суспендировали в растворе 0,250 г (1,39 ммоля) 30%-ного метанольного раствора метилата натрия и 2,5 мл тетрагидрофурана/метанола (4/1). Через восемь часов раствор отфильтровывали и смолу шесть раз экстрагировали по 3 мл дихлорметана/метанола. Объединенные фильтраты нейтрализовали 106 мкл (0,158 г, 1,39 ммоля) трифторуксусной кислоты, концентрировали и разделяли препаративной тонкослойной хроматографией (силикагель, хлороформ/метанол = 100/5). Содержащую продукт силикагельную фракцию экстрагировали хлороформом/метанолом (9/1), и объединенные экстракты еще раз фильтровали через фильтр (диаметр пор 0,2 мкм), упаривали и сушили в вакууме.
Выход: 0,041 г (0,029 г, 0,041 ммоля, 53%) розового воска (МW=701,8). Продукт содержал побочный продукт (0,006 г, 0,008 ммоля, 10%), который согласно ЖХ/Масс-спектроскопии являлся диастереомером основного продукта.
ТСХ: Rf=0,43 (хлороформ/метанол = 20/1)
ВЭЖХ: tRet=2,7 мин, 70,4% (колонка Phenomenex Luna, 3,0 мм × 50 мм, RP-18, 3,0 мкм, 0,5 мл/мин, 285 нм, метанол/20 мМ С13ССO2Н в Н2О (30/70 об./об.)
ЖХ/Масс-спектрометрия: TRet=30,6 мин, 73% (колонка Phenomenex Luna, 3,0 мм × 50 мм, RP-18, 3,0 мкм, 0,5 мл/мин, метанол/Н2О (5/95 об./об. за 2 мин, 5/95 → 40/60 об./об. в 15 мин, 40/60 об./об. за 5 мин)
APCI-PI-MS
702(56), 421(100), 274(6), 256(13)
APCI-NI-MS
700
tRet=35,6 мин, 8% (диастереомерный побочный продукт)
APCI-PI-MS
702(56), 421(100), 274(6), 256(13)
APCI-NI-MS
700
1.3
1.4 ПРИМЕРЫ 163-167; СИНТЕЗ НА РОБОТЕ
1.5
1.6 N-П-КАРБОКСИЛ-ДИПЕПТОИЛ-((4AS,6R,8AS)-6-ГИДРОКСИ-3-МЕТОКСИ-5,6,9,10-ТЕТРАГИДРО-4АН-[1]БЕНЗОФУРО[3А,3,2-EF][2]-БЕНЗАЗEПИН-11(12Н)-ИЛ)AМИД (СК-59-1)
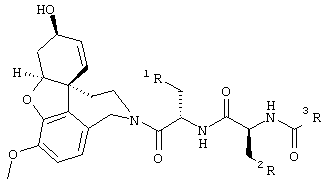
По 0,300 г (0,102 ммоля) норгалантамин-6-илокси-1,5-диоксопентилоксиметильной смолы Меррифилда помещали в полиэтиленовые реакторы с фриттами синтезирующего робота (Syro II MultiSynTech) и смешивали с 3 мл абсолютного диметилформамида. После пятиминутного выдерживания перемешивали суспензию 25 минут при 23° С с интервалами. Все последующие операции производили при той же температуре. Затем смолу промывали один раз 3 мл диметилформамида и последовательно смешивали с раствором, состоящим из 0,119 г (0,306 ммоля) Fmoc-фенилаланина или 0,117 г (0,306 ммоля) N-Fmoc-О-трет-бутилсерина и 1,5 мл диметилформамида и раствором из 0,112 г (0,306 ммоля) тетрафторбората 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония и 1 мл диметилформамида. После этого суспензии твердого вещества перемешивали пять минут. Затем прибавляли 105 мкл (0,079 г, 0,612 ммоля) этилдиизопропиламина в 0,5 мл диметилформамида. Суспензии перемешивали 3 часа, за две минуты отсасывали и каждую смешивали с раствором, состоящим из 421 мкл (0,260 г, 2,550 ммоля) ангидрида уксусной кислоты, 437 мкл (0,330 г, 2,550 ммоля) этилдиизопропиламина и 3 мл диметилформамида. После перемешивания 15 минут и двухминутного отфильтровывания смолу шесть раз промывали диметилформамидом (3 мл, 2 мин), суспендировали или перемешивали в 20%-ном растворе пиперидина в диметилформамиде каждый раз по 15 минут. После шестикратного промывания диметилформамидом (2 мин, 3 мл) смолу обрабатывали аналогично первой стадии пептидного сочетания Fmoc-фенилаланином или N-Fmoc-О-трет-бутилсерином, непрорагировавшие аминные функции маскировали ангидридом уксусной кислоты и 20%-ным раствором пиперидина в диметилформамиде, отщепляли F-moc-защитные группы. Далее аналогично вышеописанной процедуре промывали, смешивали с растворами, состоящими из 0,047 г (0,306 ммоля) п-метоксибензойной кислоты или 0,038 г (0,306 ммоля) изоникотиновой кислоты в 2,5 мл диметилформамида и перемешивали пять минут. Затем к каждому раствору прибавляли по 48 мкл (0,039 г, 0,306 ммоля) диизопропилкарбодиимида, 241 мкл и 0,5 мл 1,2-дихлорэтана. Перемешивали три часа. Смолу фильтровали (2 мин), промывали трижды диметилформамидом (2 мин, 3 мл), шесть раз дихлорметаном (2 мин, 3 мл), за десять минут при 40° С отсасывали досуха и затем сушили в вакууме над пентоксидом фосфора. Проба Кайзера для всех смол (от 0,250 до 0,377 г) была отрицательной.
Смолу, которая содержала О-трет-бутилзащищенные остатки серина, последовательно смешивали с 1 мл дихлорметана, 0,125 мл фенола, 0,125 мл анизола и 3,75 мл трифторуксусной кислоты и перемешивали три часа при комнатной температуре. Затем растворы отфильтровывали и смолы промывали трижды дихлорметаном (2 мин, 3 мл), трижды дихлорметаном/этилдиизопропиламином (95/5, 2 мин, 3 мл), трижды дихлорметаном (2 мин, 3 мл) и трижды тетрагидрофураном (2 мин, 3 мл) и сушили при пониженном давлении.
Смолы переносили в закрывающиеся с обеих сторон 5-мл-полиэтиленовые фритты, суспендировали 30 мин в ТГФ, фильтровали и суспендировали в растворе 0,092 г (0,028 г, 0,510 ммоля) 30%-ного раствора метилата натрия в метаноле и 3 мл тетрагидрофурана/метанола (4/1). Через шесть часов раствор отфильтровывали и смолу пять раз экстрагировали по 3 мл тетрагидрофурана/метанола (4/1). Объединенные фильтраты нейтрализовали Dowex 50W (на кончике шпателя) и NaHCO3 (на кончике шпателя). Суспензии фильтровали через небольшое количество целита, целитовые фильтры дважды промывали по 5 мл дихлорметана. Фильтраты концентрировали и очищали препаративной тонкослойной хроматографией (растворитель: хлороформ/метанол = (10/1) для CK-49-1-IPP-3, СК-59-МРР-1, CK-59-IPP-2, СК-59-АсРР-3, хлороформ/метанол = (4/1) для CK-59-IPP-4 и хлороформ/метанол = (6/1) для СК-59-МРР-5). Содержащие продукт фракции силикагеля экстрагировали хлороформом/метанолом (9/1) и фильтровали. Объединенные экстракты еще раз фильтровали через фильтр (диаметр пор 0,2 мкм), упаривали и сушили в вакууме.
ВЭЖХ: колонка Phenomenex Synergi Polar-RP, 4,6 мм × 150 мм, 4,0 мкм, 1,0 мл/мин, метанол/20 мМ С13ССO2Н в Н2О (20/80 за 5 мин, 20/80 → 80/20 в 20 мин, 80/20 за 10 мин, об./об.).
ЖХ/масс-спектрометрия: колонка Phenomenex Luna, 3,0 мм x 50 мм, RP-18, 3,0 мкм, 0,08 мл/мин, метанол/Н2О (10/90 за 2 мин, 10/90 → 100/0 в 15 мин, 100/0 за 5 мин, об./об.).
Результаты и выходы см. в конце текста описания.
Пример 167b
SPH-1543
В качестве побочного продукта получали N-ацетилфенилаланин-((4aS,6R,8аS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3a,3,2-ef][2]бензазепин-11(12Н)-ил)амид:
Результаты см. в табл.А.
Пример 170
SPH-1371
(4aa,6b,8aR*)-4a,5,9,10,11,12-гексагидро-3-метокси-11-[3-(1-пиперидинил)пропил]-6Н-бензофуро[3а,3,2-ef][2]бензазепин-6-ол, дигидробромид, дигидрат
Получение из свободного основания обработкой HBr/EtOH
 =-92,5° (с 0,24, H2O)
=-92,5° (с 0,24, H2O)
Общая методика - "производные виофена" (примеры 171-172)
1. 1 Экв. норгалантамина и 1 экв. соответствующего тиенилгалогенида нагревали вместе с 3 экв. тонкоизмельченного безводного К2СО3 в сухом ацетонитриле (10%-ный раствор по весу) 24 часа при температуре кипения. Полноту превращения проверяли ТСХ.
После охлаждения раствор фильтровали и остаток К2СО3 много раз под контролем ТСХ промывали сухим ацетонитрилом. Полученный после упаривания сырой продукт очищали флэш-хломатографией.
Пример 171
SPH-1490
6,7-Дигидро-5(4-((4aS,6R,8aS)-6-гидрокси-3-метокси-4а,5,9,10-тетрагидро-6Н-бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-ил)бутил)бензо[b]тиофен-4(5Н)-он
С28Н33NO4S (479,64)
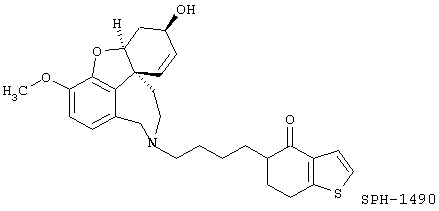
Норгалантамин: 500 мг (1,83 ммоля);
5-(4-Бромбутил)-6,7-дигидро-бензо[b]тиофен-4(5Н)-он: 479 мг (1,67 ммоля);
К2СО3: 693 мг (5,01 ммоля);
около 4 мл ацетонитрила
Сырой продукт: 450 мг
Флэш-хроматография: этилацетат:триэтиламин = 100:2
Выход: 440 мг (50%) светло-желтого порошка
1H (400 МГц, СDС13):
δ 7,34 (д, J=5,26, 1Н), 7,04 (д, J=5,26, 1H), 6,66 (д, J=8,18, 1H), 6,62 (д, J=8,18, 1H), 6,09 (м, 2Н), 4,61 (м, 1H), 4,25-4,07 (м, 2Н), 3,92-3,84 (м, 1H), 3,84-3,79 (м, 1H), 3,80 (с, 3Н), 3,46-3,56 (м, 1H), 3,30-3,18 (м, 1H), 3,13-3,03 (м, 1Н), 3,02-2,91 (м, 1H), 2,73-2,65 (м, 1H), 2,64-2,47 (м, 2Н), 2,45-2,36 (м, 1H), 2,32-2,23 (м, 1Н), 2,11-1,83 (м, 4Н), 1,63-1,09 (м, 6Н).
13С (100 МГц, CDCl3):
δ 195,2 (с), 154,8 (2* с), 145,8 (с), 144,4 (с), 136,8 (с), 132,9 (с), 127,9 (д), 126,4 (д), 125,1 (д), 123,2 (д), 122,4 (д), 111,3 (д), 88,6 (д), 61,9 (д), 58,1 (т), 55,9 (кв), 51,4 (т), 51,3 (т), 48,2 (с), 46,2 (д), 29,9 (т), 29,5 (т), 28,9 (т), 28,8 (т), 28,5 (т), 24,8 (т), 24,2 (т).
Пример 172
SPH-1491
6,7-Дигидро-5-(5-((4aS,6R,8aS)-6-гидрокси-3-метокси-4а,5,9,10-тетрагидро-6Н-бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-ил)пентил) бензо[b]тиофен-4(5Н)-он
C29H35NO4S (493,67)
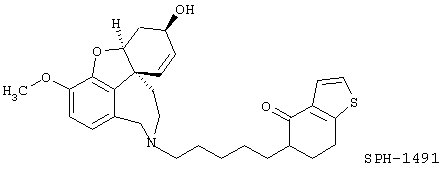
Норгалантамин: 200 мг (0,73 ммоля);
5-(5-Бромпентил)-6,7-дигидро-бензо[b]тиофен-4(5Н)-он: 201 мг (0,67 ммоля);
К2СО3: 277 мг (2,00 ммоля);
около 4 мл ацетонитрила.
Сырой продукт: 430 мг
Флэш-хроматография: этилацетат:триэтиламин = 100:2
Выход: 240 мг (66,3%) светло-желтого порошка
1H-ЯМР: (400МГц, СDС13):
δ 7,35 (д, J=5,2 Гц, 1H), 7,03 (д, J=5,2 Гц, 1Н), 6,64 (д, J=8,1 Гц, 1Н), 6,61 (д, J=8,1 Гц, 1H), 6,05 (д, J=10,2 Гц, 1Н), 5,99 (дд, J=10,2, 4,6 Гц, 1H), 4,60 (м, 1H), 3,83 (д, J=15,2, 1Н), 4,14-4,10 (м, 1Н), 3,83 (д, J=15,2 Гц, 1H), 3,81 (с, 3Н), 3,41-3,31 (м, 1H), 3,22-3,14 (м, 1H), 3,07 (дт, J=17,2, 5,2 Гц, 1H), 2,96 (ддд, J=17,2, 9,1, 4,7 Гц, 1H), 2,70-2,62 (м, 1H), 2,56-2,34 (м, 4Н), 2,26 (м, 1H), 2,10-1,8 (м, 4Н), 1,61-1,21 (м, 8Н).
13С-ЯМР: (100 МГц, CDCl3):
δ 195,7 (с), 155,1 (2*с), 146,2 (с), 144,5 (с), 137,3 (с), 133,5 (с), 128,0 (д), 127,3 (д), 125,5 (д), 123,6 (д), 122,5 (д), 111,5 (д), 89,1 (д), 62,5 (д), 58,1 (т), 56,3 (кв), 51,3 (т), 48,8 (с), 46,7 (д), 33,2 (т), 30,3 (т), 30,0 (т), 29,9 (т), 29,4 (т), 27,8 (т), 27,6 (т), 27,5 (т), 24,6 (т).
Общая методика - "азациклоалкил-производные" (примеры 173-176)
1 Экв. норгалантамина и 3 экв. соответствующего амино-алкилгалогенида нагревали вместе с 3 экв. тонкоизмельченного сухого К2СО3 в сухом ацетонитриле (примерно 10%-ный раствор по весу) 24 часа при температуре кипения. Полное превращение контролировали посредством ТСХ.
Оставшийся после отгонки растворителя остаток растворяли в 2 н НС1. После 2-кратного экстрагирования диэтиловым эфиром подщелачивали 10%-ным раствором NaOH и исчерпывающе экстрагировали хлороформом. После высушивания над Na2SO4 упаривали и очищали флэш-хроматографией (СНС13:МеОН:NН3=10:1:0,5).
Приведенные выходы реакций в расчете на 500 мг (1,83 ммоля) норгалантамина в качестве исходного продукта определяли флэш-хроматографией.
Пример 173
SPH-1492
(4aS,6R,8aS)-3-метокси-11-(6-пиперидин-1-ил-гексил)-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол
C27H40N2O3 (440,63)
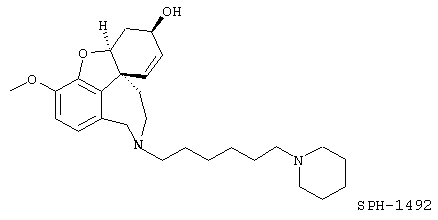
Выход: 161 мг (20%) желтоватого масла
1H (400 МГц, СDС13):
δ 6,66 (д, J=8,0 Гц, 1Н), 6,62 (д, J=8,0 Гц, 1Н), 6,10 (д, J=10,0 Гц, 1Н), 6,01 (дд, J=10,0, 5,4 Гц, 1Н), 4,62 (м, 1Н), 4,14 (м, 1Н), 4,13 (д, J=15,6, 1Н), 3,84 (с, 3Н), 3,81 (д, J=15,6, 1Н), 3,4-3,3 (м, 1Н), 3,2-3,15 (м, 1Н), 2,69 (ддт, J=15,7, 3,4, 1,6 Гц, 1H) 2,55-2,25 (м, 8Н), 2,10-2,0 (м, 1Н), 2,01 (ддд, J=12,9, 5,0, 2,6 Гц, 1H), 1,65-1,2 (м, 16Н).
13С (100 МГц, CDCl3):
δ 146,2 (с), 144,4 (с), 133,6 (с), 129,9 (с), 127,9 (д), 127,4 (д), 122,4 (д), 111,5 (д), 89,1 (д), 62,5 (д), 59,9 (т), 58,1 (т), 56,3 (кв), 54,9 (4* т), 51,9 (т), 48,8 (с), 33,3 (т), 30,3 (т), 28,0 (т), 27,9 (т), 27,8 (т), 27,1 (т), 26,2 (т), 24,8 (т).
Пример 174
SPH-1493
(4aS,6R,8aS)-3-метокси-11-(6-(4-метилпиперазин)-1-ил-гексил)-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-ол
С27Н41N3О3 (455,65)
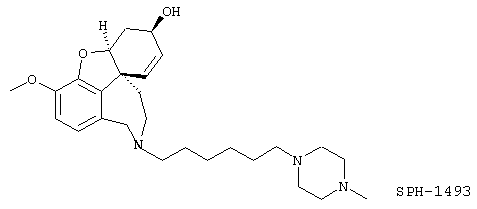
Выход: 208 мг (25%) желтоватого масла
1H (400 МГц, CDCl3):
δ 6,66 (д, J=8,18, 1H), 6,61 (д, J=8,18, 1H), 6,09 (д, J=10,23, 1H), 6,0 (дд, J=9,94, 4,97, 11-1), 4,61 (м, 1H), 4,20-4,08 (м, 2Н), 3,84 (с, 3Н), 3,80 (д, J=15,8, 1H), 3,40-3,30 (м 1H), 3,23-3,10 (м, 1H), 2,73-2,63 (м, 1Н), 2,63-2,30 (м, 12Н), 2,29 (с, 3Н), 2,10-1,94 (м, 2Н), 1,57-1,17 (м, 10Н).
13С (100 МГц, CDCl3):
δ 146,2 (с), 144,4 (с), 133,6 (с), 129,9 (с), 127,9 (д), 127,4 (д), 122,4 (д), 111,5 (д), 89,1 (д) 62,5 (д), 59,1 (т), 58,2 (т), 56,3 (кв), 55,5 (2* т), 53,6 (3* т), 51,9 (т), 48,8 (с), 46,5 (кв), 33,3 (т), 30,4 (т), 27,98 (т), 27,83 (т), 27,74 (т), 27,23 (т).
Пример 175
SPH-1494
(4aS,6R,8aS)-3-метокси-11-(6-(4-гидроксипиперидин)-1-ил-гексил)-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3а,3,2-ef][2] бензазепин-6-ол
C27H40N2O4 (456,63)
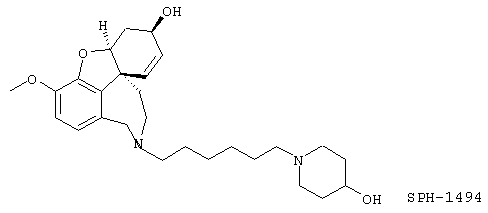
Выход: 200 мг (24%) желтоватого масла
1H (400 МГц, CDCl3):
δ 6,64 (д, J=8,1 Гц, 1Н), 6,59 (д, J=8,1 Гц, 1Н), 6,07 (д, J=10,2 Гц, 1H), 5,97 (дд, J=10,2, 4,9 Гц, 1H), 4,58 (м, 1Н), 4,11 (м, 1Н), 4,07 (м, 1Н), 3,81 (с+м, 4Н), 3,71-3,61 (м, 1H), 3,35 (м, 1H), 3,15 (м, 1H), 2,81-2,71 (м, 2Н), 2,67 (д, J=15,4, 1H), 2,52-2,36 (м, 4Н), 2,34-2,26 (м, 2Н), 2,20-2,08 (м, 2Н), 2,06-1,94 (м, 2Н), 1,93-1,84 (м, 2Н), 1,63-1,53 (м, 2Н), 1,52-1,38 (м, 5Н), 1,32-1,20 (м, 4Н).
13С (100 МГц, СDС13):
δ 146,2 (с), 144,5 (с), 133,6 (с), 129,9 (с), 127,9 (д), 127,4 (д), 122,4 (д), 111,5 (д), 89,1 (д), 62,5 (2* д) 58,9 (2* т), 58,2 (т), 56,3 (кв), 51,9 (2* т), 51,3 (т), 48,8 (с), 34,6 (т), 33,4 (т), 30,4 (т), 28,0 (т), 27,8 (2* т), 27,7 (т), 27,3 (т).
Пример 176
SPH-1521
1-(6-((4aS,6R,8аS)-6-гидрокси-3-метокси-4а,5,9,10-тетрагидро-6Н-бензофуро[3а,3,2-еf] [2]бензазепин-11 (12Н)-ил)-гексил)пиперидин-4-он
C27H38N2O4 (454,61)
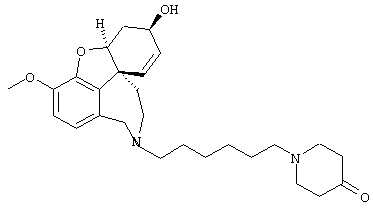
Выход: 125 мг (15%) желтоватого масла
1H (400 МГц, CDCl3):
δ 6,65 (д, J=8,18 Гц, 1Н), 6,60 (д, J=8,18 Гц, 1H), 6,07 (д, J=10,8 Гц, 1Н), 5,99 (дд, J=10,8, 4,5 Гц, 1Н), 4,60 (м, 1H), 4,18-4,08 (м, 2Н), 3,82 (с, 3Н), 3,79-3,76 (м, 1H), 3,40-3,30 (м, 1H), 3,22-3,10 (м, 1H), 2,74-2,68 (м, 4Н), 2,67-2,62 (м, 1Н), 2,53-2,34 (м, 8Н), 2,09-1,93 (м, 2Н), 1,57-1,42 (м, 6Н), 1,37-1,21 (м, 4Н).
13С (100 МГц, CDCl3):
δ 209,7 (с), 146,2 (с), 144,5 (с), 133,5 (с), 129,7 (с), 128,1 (д), 127,4 (д), 122,4 (д), 111,5 (д), 89,0 (д), 62,4 (д), 58,1 (2* т), 57,9 (2* т), 56,4 (кв), 56,3 (т), 53,4 (т), 52,2 (т), 51,9 (т), 48,8 (с), 41,5 (т), 33,4 (т), 30,4 (т), 27,9 (т), 27,8 (т), 27,7 (т).
Пример 180
SPH-1363
Ди-трет-бутиловый эфир (4аS,6R,8аS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef]-[2]бензазепин-11(12Н)-ил)метилазодикарбоновой кислоты (СК-24-2)
Раствор 0,300 г (0,1,04 ммоля) галантамина в 3 мл дихлорметана при комнатной температуре смешивали с 0,264 г (1,150 ммоля) ди-трет-бутилазодикарбоксилата и перемешивали четыре дня при комнатной температуре. После упаривания на роторном испарителе остаток (0,258 г) очищали флэш-хроматографией на силикагеле (25 г, растворитель дихлорметан/петролейный эфир = 2/3+4% триэтиламина). После высушивания в высоком вакууме получали 0,292 г белой пены.
Выход: 0,292 г (0,56 ммоля, 54%), бесцветная пена (МW=517,6)
ТСХ: Rf=0,71 (дихлорметан/метанол = 9/1+2% конц. раствора NН3)
Т.пл.: 59-62° С (петролейный эфир/дихлорметан = 1/1+4% триэтиламина)
ИК: КВr
ν (см-1) 3557 (v), 3340 (шир.м), 2932 (с), 2915 (с), 1726 (с), 1711 (с)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,49-6,66 (м, 2Н), 6,39 (с, 0,6Н), 5,84-6,06 (м, 2Н), 4,52 (с, 1Н), 4,35 (шир.с, 1H), 3,99-4,17 (м, 2Н), 3,71-3,88 (м, 1Н), 3,76 (с, 3Н), 3,07-3,40 (м, 2Н), 2,61 (шир.д, J=15,7 Гц, 1Н), 2,40 (шир.д, J=11,8 Гц, 0,3Н), 1,79-2,05 (м, 2Н), 1,56-1,72 (м, 1Н), 1,46 (с, 9Н), 1,45 (с, 9Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS) δ 156,7 (с), 155,9 (с), 145,9 (с), 144,0 (с), 132,8 (д), 129,8 (с), 127,6 (д), 126,7 (д), 121,5 (д), 111,1 (д), 88,5 (д), 68,9 (т), 62,4 (т), 61,8 (т), 61,8 (д), 56,6 (т), 55,8 (кв), 49,7 (т), 48,1 (с), 35,2 (т), 29,8 (т), 14,32 (кв), 14,26 (кв).
ЖХ/масс-спектрометрия: RRet=9,56 мин (колонка Zorbax SB, 2,1 мм × 30 мм, RP-18, 3 мкм, 0,5 мл/мин, метанол/Н2О (40/60 → 100/0 (об./об.) в 2 мин)
APCI-PI-MS
518(100), 500(25), 462(9), 285(13), 274(11), 256(26)
APCI-NI-MS
516
Пример 181
SPH-1362
Диэтиловый эфир (4аS,6R,8аS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1] бензофуро [3а,3,2-ef][2]бензазепин-11(12Н)-ил)метил-азодикарбоновой кислоты (СК-21-3)
К раствору 0,150 г (0/52 ммоля) галантамина в 2 мл дихлорметана прибавляли 89 мкл (0,100 г, 0,57 ммоля) диэтилазодикарбоксилата и раствор перемешивали 72 часа при комнатной температуре. После упаривания на роторном испарителе остаток (0,258 г) очищали флэш-хроматографией на силикагеле (25 г, растворитель дихлорметан/петролейный эфир = 1/1+4% триэтиламина). После высушивания в высоком вакууме получали 0,168 г белой пены.
Выход: 0,168 г (0,36 ммоля, 70%), белая пена (МW=461,6)
ТСХ: Rf=0,66 (дихлорметан/метанол = 9/1+2% конц. раствора NH3)
Т.пл.: 40-42° С (петролейный эфир/дихлорметан = 1/1+4% триэтиламина)
ИК: КВr
ν (см-1) 3553 (v), 3305 (м), 2981 (с), 2935 (с), 1742 (с), 1722 (с)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,77 (шир.с, 1Н), 6,64 (д, J=8,3 Гц, 1Н), 6,58 (д, J=8,1 Гц, 1Н), 5,84-6,06 (м, 2Н), 4,53 (с, 1Н), 3,98-4,23 (м, 6Н), 3,69-3,87 (м, 1Н), 3,76 (с, 3Н), 3,01-3,42 (м, 2Н), 2,66 (шир.д, J=15,7 Гц, 1Н), 2,33 (шир.с, 0,2Н), 1,65-1,77 (м, 2Н), 1,35-1,47 (м, 1Н), 1,09-1,35 (м, 6Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 155,1 (с), 145,9 (с), 143,9 (с), 132,8 (д), 130,2 (с), 127,5 (д), 126,9 (д), 121,4 (д), 111,1 (д), 81,2 (с), 80,9 (с), 69,5 (т), 61,9 (д), 56,8 (т), 55,8 (кв), 49,8 (т), 48,1 (с), 35,6 (т), 29,8 (т), 28,1 (кв), 28,0 (кв).
ЖХ/масс-спектрометрия: tRet=8,08 мин (колонка Zorbax SB, 2,1 мм × 30 мм, RP-18, 3 мкм, 0,5 мл/мин, метанол/Н2О (40/60 → 100/0 (об./об.) в 2 мин)
APCI-PI-MS
462(100), 444(32), 286(34), 274(12), 256(29)
APCI-NI-MS
460
Способ синтеза норгалантамина
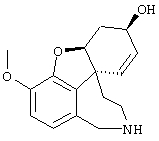
Способ А
20 г (70 ммолей) галантамина обрабатывали 14,206 г (0,07 моля) м-хлорнадбензойной кислоты (85%) в 350 мл дихлорметана с последующим прибавлением 9,730 г (35 ммолей) Fe(II)SO4·7H2O в 100 мл метанола. Реакцию прерывали через 20 минут 200 мл 2 н соляной кислотой. После отгонки легкокипящего растворителя, кислотно-щелочного разделения и отфильтровывания осадка Fe(OH)x через Hyflo-Нутча фильтрат сушили над Nа2SO4, фильтровали и упаривали. Получали около 18 г сырого продукта в виде желтой пены.
Переработка, вариант 1 (СК-1-1)
Сырой продукт (18,46 г) при слабом нагревании помещали в примерно 200 мл уксусной кислоты/метанола/триэтиламина (90/10/2). При охлаждении снова выпадал Fe(OH)x, который отфильтровывали. Очистку осуществляли MPLC-хроматографией (силикагель, h=25 см, d=3,6 см, об. = 300 нм) с изменяющейся смесью растворителей (этиловый эфир уксусной кислоты/метанол/триэтиламин = 95/5/2 → 90/10/2 → 80/20/2). Содержание норгалантамина составляло согласно определению ВЭЖХ (кофеин в качестве внутреннего стандарта) только 68%.
Выход: 10,34 г (38 ммолей, 54%) желтоватого аморфного твердого вещества (MW=273,3)
Переработка, вариант 2 (СК-1-11)
Сырой продукт (16,48 г) растворяли в 100 мл метанола, смешивали с раствором 12,86 г (102 ммоля) дигидрата щавелевой кислоты в 100 мл метанола и осторожно нагревали, чтобы гомогенизировать раствор. После этого раствор оставляли при комнатной температуре и затем охлаждали примерно до 5° С, отфильтровывали выкристаллизовавшийся продукт и промывали осадок метанолом. Объединенные упаренные метанольные растворы снова подвергали перекристаллизации.
Выход: 16,108 г (43 ммоля, 62%) бесцветного кристаллического твердого вещества
Вычислено для С16Н19NO3·С2H2O4·0,5Н2O
С 58,06, Н 5,95, N 3,76.
Найдено С 57,91, Н 5,88, N 3,69.
Способ В (СК-1-10)
2,000 г (6,96 ммоля) галантамина и 0,981 г (10,44 ммоля) продукта сочетания пероксида водорода и мочевины перемешивали в 25 мл дихлорметана и 5 мл метанола при комнатной температуре два дня, затем смешивали с 0,030 г платины/активированного угля и перемешивали один час при комнатной температуре. При добавлении катализатора наблюдали сильное выделение газа. Затем добавляли 0,967 г (3,48 ммоля) Fe(II)SO4·7H2O в 5 мл МеОН и коричневую суспензию сильно перемешивали. Реакцию прерывали через 20 минут 50 мл насыщенного раствора NаНСО3. Реакционный раствор фильтровали посредством Hyflo. Фазы разделяли и водную фазу до исчерпания экстрагировали дихлорметаном. Объединенные органические экстракты промывали насыщенным раствором NaHCO3 {50 мл) и насыщенным раствором NaCl (50 мл), сушили над Na2SO4, фильтровали и упаривали. Сырой продукт (1,925 г) растворяли в 10 мл метанола, смешивали с раствором 1,332 г (10,6 ммоля) дигидрата щавелевой кислоты в 10 мл метанола и осторожно нагревали, чтобы гомогенизировать раствор. После этого раствор выдерживали при комнатной температуре, затем охлаждали примерно до 5° С, отфильтровывали выкристаллизовавшийся продукт и осадок промывали метанолом. Объединенные упаренные метанольные растворы снова подвергали перекристаллизации.
Выход: 1,010 г (2,7 ммоля, 39%), бесцветное кристаллическое твердое вещество (MW=371,4), согласно ВЭЖХ 97%.
Способ С:
Деметилирование норгалантамина диэтилазодикарбоксилатом (СК-1-7)
К раствору 0,300 г (1,04 ммоля) галантамина в 3 мл дихлорметана прибавляли 178 мкл (0,199 г, 1,144 ммоля) диэтилазодикарбоксилата и раствор перемешивали три дня при комнатной температуре. После упаривания на роторном испарителе при 40° С остаток растворяли в 5 мл этанола и 5 мл 4 н соляной кислоты и перемешивали при 80° С полчаса. Реакцию охлаждали до комнатной температуры и разбавляли раствор 5 мл воды. Этанольную часть отгоняли на роторном испарителе и водную фазу трижды экстрагировали по 10 мл диэтилового эфира. В водной фазе прибавлением карбоната натрия и гидроксида натрия устанавливали рН 10-11 и четырежды экстрагировали по 20 мл дихлорметана. Объединенные фазы промывали 40 мл насыщенного раствора поваренной соли, сушили над Na2SО4. После фильтрования и упаривания остаток (0,268 г) очищали MPLC на силикагеле (60 г, растворитель этиловый эфир уксусной кислоты/этанол/триэтиламин = 19/1/0,4). После высушивания в высоком вакууме получали 0,136 г желтоватой пены.
Выход: 0,136 г (0,495 ммоля, 48%), бело-желтая пена (Mw=273,3), ВЭЖХ идентична со сравнительным образцом.
ВЭХЖ: tRet=3,79 мин, 96,3% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5 мкм, 250 нм, 1 мл/мин, ацетонитрил/20 мМ трихлоруксусная кислота в H2O (15/80 об./об.).
Способ D:
Деметилирование норгалантамина ди-трет-бутилазодикарбоксилатом (СК-1-6)
0,300 г (1,04 ммоля) галантамина и 0,264 г (1,144 ммоля) ди-трет-бутилазодикарбоксилата в 3 мл дихлорметана реагировали аналогично вышеописанной процедуре три дня при комнатной температуре, упаривали и перемешивали в 5 мл этанола и 5 мл 4 н соляной кислоты 30 минут при 80° С. Реакцию охлаждали до комнатной температуры и раствор разбавляли 5 мл воды. После обработки водой остаток (0,259 г) очищали MPLC на силикагеле (60 г, растворитель этиловый эфир уксусной кислоты/этанол/триэтиламин = 19/1/0,4). После высушивания в высоком вакууме получали 0,132 г бело-желтой пены.
Выход: 0,132 г (0,48 ммоля, 46%) бело-желтой пены (MW=273,3), ВЭЖХ идентична со сравнительным образцом.
ВЭХЖ: tRet=3,74 мин, 100% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5 мкм, 250 нм, 1 мл/мин, ацетонитрил/20 мМ трихлоруксусная кислота в Н2О (15/80 об./об.).
Способ Е:
Омыление (4aS,6R,8aS)-3-метокси-12-трифторацетил-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро [3а,3,2-ef] бензазепин-6 -ола
Способ А (СК-40-2)
3,3 мл 0,25 М раствора гидроксида калия (0,045 г, 0,81 ммоля) в диоксане/метаноле/воде (10/2/5) смешивали с 0,100 г (0,27 ммоля) N-трифторацетилноргалантамина и перемешивали один час при комнатной температуре. Затем раствор разбавляли 0,4 мл 2 н соляной кислоты и отгоняли летучие компоненты на роторном испарителе. Остаток поглощали насыщенным раствором карбоната натрия и пять раз экстрагировали дихлорметаном. Объединенные экстракты промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали на роторном испарителе при пониженном давлении. Получали 0,070 г бело-желтоватой пены 95%-ной чистоты (ВЭЖХ, кофеин в качестве внутреннего стандарта).
Выход: 0,070 г (0,067, 0,25 ммоля, 91%), бело-желтоватая пена (Mw=273,3)
Способ В (СК-40-3)
Раствор 0,100 (0,27 ммоля) N-трифторацетилноргалантамина и 0,243 г (1,35 ммоля) 30%-ного метанольного раствора метилата натрия в 3 мл тетрагидрофурана/метанола (1/1) перемешивали три часа при комнатной температуре. Раствор нейтрализовали 0,7 мл 2 н соляной кислоты и раствор упаривали досуха, остаток поглощали 25 мл дихлорметана и промывали насыщенным раствором карбоната натрия и насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали на роторном испарителе при пониженном давлении. После высушивания в вакууме получали желтоватую пену (0,067 г) 76%-ной чистоты (ВЭЖХ, кофеин в качестве внутреннего стандарта).
Выход: 0,067 г (0,051 г, 0,19 ммоля, 69%), бело-желтоватой пены (МW=273,3)
Способ G:
Разделение (+) и (-)-изомеров рац. норгалантамина (4)
Получение (-)-норгалантамина (8)
К раствору 10,92 г (40,0 ммоля) рац. норгалантамина (4) в 40 мл метанола прибавляли по каплям раствор 7,72 г (20,0 ммоля) (+)-O,O-ди-п-толуоилвинной кислоты в 15 мл метанола и затем промывали 1 мл метанола. Раствор смешивали с затравочным кристаллом и выдерживали два дня при 4° С. Затем хорошо растирали стеклянной палочкой и выдерживали еще от двух до пяти дней при 4° C, причем снова растирая стеклянной палочкой. После этого выпавшую соль отсасывали, трижды промывали охлажденным льдом метанолом и вносили в 100 мл воды. Водную фазу подщелачивали концентрированным водным аммиаком и трижды экстрагировали по 60 мл этилового эфира уксусной кислоты. Объединенные органические фазы один раз промывали насыщенным водным раствором хлорида натрия, сушили (Na2SO4, активированный уголь), фильтровали и упаривали, получая 2,90 г (37,5% от теории) бесцветных кристаллов со значением вращения 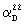 [СНСl3]=-62,4 (-)-норгалантамина (8). Метанольный маточный раствор упаривали, остаток помещали в 100 мл воды и обрабатывали чистую соль, как описано выше, получая 4,1 г (53,1% от теории) сырого продукта, который далее применяли для получения (+)-норгалантамина.
[СНСl3]=-62,4 (-)-норгалантамина (8). Метанольный маточный раствор упаривали, остаток помещали в 100 мл воды и обрабатывали чистую соль, как описано выше, получая 4,1 г (53,1% от теории) сырого продукта, который далее применяли для получения (+)-норгалантамина.
Получение (+)-норгалантамина
К раствору 4,1 г (15,0 ммоля) выделенного норгалантамина (обогащенного (+)-изомером) в 21 мл метанола прибавляли по каплям 2,9 г (7,5 ммоля) (-)-O,O-ди-п-толуоилвинной кислоты в 5,6 мл метанола, причем дополнительно смывали 0,5 мл метанола. Раствор смешивали с затравочным кристаллом и обрабатывали, как при выделении (-)-норгалантамина, получая 3,0 г (39% от теории) бесцветных кристаллов со значением вращения 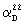 [CHCl3]=+57,5° (+)-норгалантамина.
[CHCl3]=+57,5° (+)-норгалантамина.
В качестве альтернативы (+)-норгалантамин получали также взаимодействием рац. норгалантамина (4) с (-)-O,O-ди-п-толуоилвинной кислотой аналогично вышеописанному способу со значением 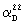 [СНС13]=+60,5° .
[СНС13]=+60,5° .
Пример 182
SPH-1534
Триизопропилсилиловый эфир (4аS,6R,8аS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-11(12Н)-ил)карбоновой кислоты (СК-9-2)
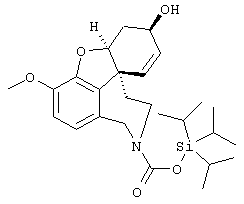
0,200 г (0,732 ммоля) норгалантамина (68% (ВЭЖХ, СК-1-1)) и 0,47 мл (0,341 г, 3,37 ммоля) триэтиламина помещали в одногорлую колбу, снабженную затвором и СО2-баллоном, которая путем эвакуации и промывки наполнена диоксидом углерода, при -80° С в 6 мл дихлорметана. Затем раствор охлаждали до тех пор, пока твердый диоксид углерода выпадал в реакционный раствор. Через полчаса примерно при -80 - -90° С шприцем вводили триизопропилсилилхлорид (0,155 мл, 0,141 г, 0,732 ммоля). Затем реакционный раствор медленно в течение ночи нагревали до комнатной температуры. При этом выпадал бесцветный осадок. Реакционный раствор смешивали с 10 мл 1 н соляной кислоты, фазы разделяли и водную фазу дважды экстрагировали 10 мл дихлорметана. Объединенные органические фазы промывали 10 мл 1 н соляной кислоты и 10 мл насыщенного раствора поваренной соли, сушили над Na2SO4, фильтровали и упаривали. Желтое вязкое масло (0,315 г) очищали колоночной хроматографией на силикагеле с растворителем петролейный эфир/этиловый эфир уксусной кислоты. После упаривания получали 0,208 г продукта в виде бесцветной пены.
Выход: 0,208 г (0,44 ммоля, 60%) бесцветной пены (МW=437,7)
ТСХ: Rf=0,35 (петролейный эфир/этиловый эфир уксусной кислоты = 1/1)
Т.пл.: 53-54° С (петролейный эфир/этиловый эфир уксусной кислоты = 1/1) ИК: КВr
ν (см-1) 3556 (м), 3454 (м), 2946 (с), 1679 (с)
1H-ЯМР: (200,13 МГц, СDС13, TMS)
δ 6,60-6,85 (м, 2Н), 5,93-6,09 (м, 2Н), 4,90 (д, J=15,3 Гц, 0,4Н), 4,80 (д, J=15,7 Гц, 0,6Н), 4,57 (с, 1Н), 4,06-4,40 (м, 3Н), 3,83 (с, 3Н), 3,27-3,57 (м, 0,4Н), 2,70 (шир.д, J=16,3 Гц, 1Н), 2,41 (шир.д, J=11,0 Гц, 0,6Н), 1,60-2,11 (м, 3Н), 1,29 (шир.h, J=5,1 Гц, 3Н), 1,05 (д, J=6,8 Гц, 8Н), 0,98 (д, J=6,9 Гц, 10Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 154,4 и 153,9 (с), 146,5 и 146,2 (с), 144,3 и 144,1 (с), 132,2 и 131,8 (д), 129,4 и 129,2 (с), 127,9 (д), 126,5 (д), 121,6 и 120,9 (д), 111,1 и 110,9 (д), 88,2 (д), 61,8 (д), 55,8 и 55,7 (кв), 52,5 и 51,7 (т), 48,3 (с), 46,4 и 45,8 (т), 37,3 и 36,1 (т), 29,7 (т), 17,77, 17,75, 17,68 и 17,65 (кв), 11,9 (д).
Пример 183
SPH-1535
Трет-бутилдифенилсилиловый эфир (4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]-бензазепин-11(12Н)-ил)карбоновой кислоты
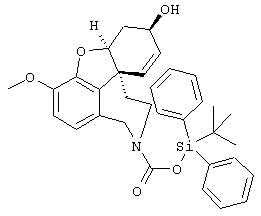
Аналогично способу получения N-триизопропилсилилокси-карбонилноргалантамина (TBDP-CI) норгалантамин (68% (ВЭЖХ, СК-1-1)) обрабатывали 1 или 1,1 экв. трет-бутилдифенилсилилхлорида и 5 экв. триэтиламина. Реакцию затем прерывали водой или разбавленной соляной кислотой, фазы разделяли и водную фазу экстрагировали дихлорметаном. После высушивания Na2SO4, фильтрования и упаривания аморфную пену очищали колоночной хроматографией (силикагель, этиловый эфир уксусной кислоты/петролейный эфир = 1/1). Получали бесцветную пену (см. табл. 3).
TCX: Rf=0,40 (петролейный эфир/этиловый эфир уксусной кислоты = 1/1)
Т.пл.: 71-80° С (петролейный эфир/этиловый эфир уксусной кислоты = 1/1)
ИК: КВr
ν (см-1) 3553 (м), 3454 (шир.м), 2932 (с), 1686 (с), 1625 (м)
1Н-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 7,20-7,68 (м, 10Н), 6,56-6,77 (м, 2Н), 4,83-5,03 (м, 1Н), 5,03 (с, 1Н), 4,02-4,40 (м, 3Н), 3,83 (с, 3Н), 3,63 (шир.т, J=13,1 Гц, 0,3Н), 3,41 (шир.т, J=12,9 Гц, 0,7Н), 2,70 (шир.д, J=15,6 Гц, 1Н), 2,41 (шир.д, J=19,7 Гц, 1Н), 1,78-2,10 (м, 2Н), 1,54-1,76 (м, 1Н), 1,05 (с, 9Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 153,7 и 153,2 (с), 146,6 и 146,1 (с), 144,4 и 144,2 (с), 135,0 и 134,7 (д), 132,4 и 132,3 (с), 132,4 (с), 132,3 и 131,8 (с), 129,7 и 129,6 (д), 129,2 и 129,0 (с), 126,5 (с), 121,8 и 121,2 (д), 111,1 и 110,9 (д), 88,3 и 88,1 (д), 61,8 (д), 55,9 (кв), 52,7 и 51,8 (т), 48,3 (с), 46,5 и 46,1 (т), 37,4 и 35,8 (т), 29,7 (т), 27,0 и 26,9 (кв), 19,1 и 18,9(д).
Пример 184
SPH-1536
(4aS,6R,8aS)-3-Метокси-12-трифторацетил-5,6,9,10,11,12-гексагидро-4аН-[1]бензофуро[3a,3,2-ef] [2] бензазепин-6-ол
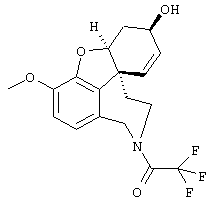
Способ А (СК-32-1)
К раствору 1,00 г (3,66 ммоля) норгалантамина (68% (ВЭЖХ, СК-1-1)), 1,5 мл (1,095 г, 10,8 ммоля) триэтиламина в 5 мл абсолютного дихлорметана при 0° С прибавляли по каплям раствор, состоящий из 5 мл дихлорметана и 4,6 мл (3,333 г, 32,9 ммоля) ангидрида трифторуксусной кислоты в течение 15 минут. После этого раствор перемешивали 1,75 часа при 0° С и затем прерывали реакцию прибавлением 5,5 мл 2 н соляной кислоты. Фазы разделяли и водную фазу трижды экстрагировали по 20 мл дихлорметана. Объединенные органические фазы промывали 30 мл насыщенного раствора поваренной соли, сушили над Na2SO4, фильтровали и упаривали. Сырой продукт (0,866 г) очищали MPLC (силикагель, h=25 см, d=3,6 см, об. = 300 нм, растворитель петролейный эфир/этиловый эфир уксусной кислоты = 2/1). После упаривания и высушивания в вакууме получали продукт в виде бело-желтоватой пены (0,866 г).
Выход: 0,866 г (1,95 ммоля, 53%) бело-желтоватой пены, Mw=369,3.
Способ В (СК-32-2)
2,52 г норгалантамина (примерно 90%-ного, 2,268 г, 8,30 ммоля) и 3,45 мл (2,520 г, 24,9 ммоля) триэтиламина растворяли в 20 мл абсолютного дихлорметана. Затем прибавляли по каплям раствор 1,211 мл (1,830 г, 8,71 ммоля) ангидрида трифторуксусной кислоты в 10 мл дихлорметана в течение 30 минут при 0° С. Нагревали до комнатной температуры, порциями прибавляли еще ангидрид трифторуксусной кислоты (1,2 мл, 1,830 г, 8,71 ммоля) и перемешивали реакционную смесь в течение ночи. Раствор разбавляли 120 мл этилового эфира уксусной кислоты и промывали 50 мл 1 н соляной кислоты, 50 мл насыщенного раствора NaHCO3 и дважды по 50 мл насыщенного раствора поваренной соли, сушили над Na2SO4 и фильтровали. После упаривания остаток растворяли в 150 мл дихлорметана и прибавляли 141,1 г 5%-ного раствора NН3. Двухфазный раствор сильно перемешивали при комнатной температуре. Через 30 минут фазы разделяли и водную фазу экстрагировали дихлорметаном (дважды по 50 мл). Объединенные органические фазы промывали 1 н соляной кислотой (дважды по 50 мл) и насыщенным раствором поваренной соли (дважды по 50 мл), сушили над Na2SO4, фильтровали и упаривали. Остаток (2,77 г) очищали MPLC (450 г силикагеля, об. = 300 нм, растворитель петролейный эфир/этиловый эфир уксусной кислоты = 1/1). После упаривания и сушки в вакууме получали продукт в виде бело-желтоватой пены (2,6171 г).
Выход: 2,6171 г (7,09 ммоля, 85%), бело-желтоватая пена (Mw=369,3).
ТСХ: Rf=0,23 (петролейный эфир/этиловый эфир уксусной кислоты = 1/1).
Т.пл.: 65-68° С (петролейный эфир/этиловый эфир уксусной кислоты = 1/1).
ИК: КВr
ν (см-1) 3546,3 (v), 3417 (шир.v), 2924 (м), 1690 (с)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,62-6,92 (м, 2Н), 5,88-6,16 (м, 2Н), 5,25 (д, J=15,2 Гц, 0,5Н), 4,85 (д, J=16,6 Гц, 0,5Н), 4,42-4,77 (м, 2Н), 4,02-4,34 (м, 2Н), 3,84 (с, 3Н), 3,60-3,83 (м, 0,5Н), 3,27-3,50 (м, 0,5Н), 2,72 (д, J=16,0 Гц, 1,0Н), 2,29 (шир.с, 0,7Н), 1,80-2,13 (м, 3Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 156,1 (м), 146,4 и 146 (с), 144,8 и 144,7 (с), 132,0 (с), 128,8 и 128,5 (д), 126,6 и 126,1 (с), 125,7 и 125,3 (д), 120,9 и 119,1 (д), 121,9 (кв, J=288 Гц), 111,3 (д), 88,1 и 88,0 (д), 61,6 (д), 55,8 (кв), 52,6 и 51,8 (т), 47,9 (с), 46,5 и 46,3 (т), 38,4 и 35,4 (т), 29,64 и 29,58 (т).
Пример 185
SPH-1537
Аллиловый эфир (4aS,6R,8aS)-6-гидрокси-3-метокси-3,6,9,10-тетрагидро-4аН-[1]бензофуро[3a,3,2-ef][2]бензазепин-11 (12Н)-ил)карбоновой кислоты
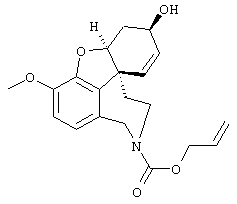
Вариант А (СК-17-1)
3,000 г (11,0 ммоля) норгалантамина при 0° С вносили в раствор 10 мл абсолютного дихлорметана и 4,6 мл (3,333 г, 32,9 ммоля) триэтиламина. При 0° С прибавляли по каплям раствор, состоящий из 1,454 г (12,1 ммоля) аллилового эфира хлормуравьиной кислоты и 5 мл абсолютного дихлорметана, в течение 20 минут. Реакционный раствор перемешивали в течение ночи и при этом нагревали до комнатной температуры. Реакционный раствор смешивали с 50 мл 1 н соляной кислоты и 50 мл дихлорметана. Фазы разделяли и водную фазу трижды экстрагировали по 50 мл дихлорметана. Объединенные органические фазы промывали 100 мл насыщенного раствора поваренной соли, сушили над Na2SO4, фильтровали и упаривали. Сырой продукт (3,2 г) отделяли MPLC (силикагель, h=25 см, d=3,6 см, об. = 300 нм, растворитель петролейный эфир/этиловый эфир уксусной кислоты = 2/1). После упаривания и сушки в вакууме получали продукт в виде бело-желтоватой пены (2,594 г) и 0,232 г побочного продукта, который был идентифицирован как N,O-диаллилоксикарбонилноргалантамин
Выход: 2,594 г (7,26 ммоля, 66%)
ТСХ: Rf=0,30 (петролейный эфир/этиловый эфир уксусной кислоты = 1/1)
Т.пл.: 44-46° С (петролейный эфир/этиловый эфир уксусной кислоты = 1/1)
ИК: КВr
ν (см-1) 3550 (м), 3458 (м), 1700 (с)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,62-6,86 (м, 2Н), 5,95-6,09 (м, 2Н), 5,76-5,94 (м, 1Н), 5,10-5,33 (м, 2Н), 4,93 и 4,83 (д и д, J=15,1 Гц и J=15,7 Гц, 1Н), 4,45-4,68 (м, 3Н), 4,05-4,44 (м, 3Н), 3,83 (с, 3Н), 3,27-3,55 (м, 1Н), 2,70 (шир.дд, J=15,1 Гц и J=15,7 Гц, 1Н), 2,26 (шир.с, 0,5Н), 1,93-2,11 (м, 1Н), 1,69-1,92 (м, 1Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 155,1 и 155,0 (с), 146,4 (с), 144,3 (с), 132,7 (д), 132,3 и 132,0 (с), 129,1 (с), 128,0 (д), 126,2 (д), 121,4 и 120,8 (д), 117,3 и 116,7 (т), 111,1 и 110,9 (д), 88,1 и 88,0 (д), 65,9 и 65,8 (т), 61,7 (д), 55,7 (кв), 51,8 и 51,3 (т), 48,2 (с), 45,8 и 45,3 (т), 37,2 и 36,3 (т), 29,7 (т).
Пример 186
SPH-1538
Аллиловый эфир (4aS,6R,8aS)-6-(2-аллилоксикарбонилокси)-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2] бензазепин-11(12Н)-ил)карбоновой кислоты
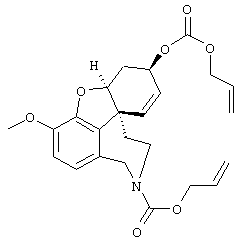
Бесцветный воск (МW=441,5)
ТСХ: Rf=0,51 (петролейный эфир/этиловый эфир уксусной кислоты = 1/1)
ИК: КВr
ν (см-1) 2947 (м), 1739 (с), 1700 (с)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,56-6,81 (м, 2Н), 6,22 (д, J=10,3 Гц, 1Н), 5,73-6,04 (м, 3Н), 5,08-5,40 (м, 5Н), 4,90 (д, J=15,5 Гц, 0,5Н), 4,80 (д, J=15,9 Гц, 0,5Н), 4,44-4,64 (м, 5Н), 4,04-4,43 (м, 2Н), 3,82 (с, 3Н), 3,24-3,54 (м, 1Н), 2,78 (шир.д, J=16,4 Гц, 1Н), 1,65-2,21 (м, 3Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 155,0 и 154,8 (с), 154,4 (с), 147,2 (с), 144,1 (с), 132,7 (д), 131,5 (д), 130,9 (с), 130,6 (д), 128,9 и 128,8 (с), 122,3 (д), 120,6 и 120,1 (д), 118,3 (т), 117,2 и 116,6 (т), 111,5 и 111,3 (д), 85,3 (д), 68,1 (т), 66,5 (д), 65,8 и 65,7 (т), 55,8 (кв), 51,6 и 51,2 (т), 47,8 (с), 45,6 и 45,2 (т), 37,6 и 36,7 (т), 27,5 (т).
Вариант В (СК-17-2)
1,000 г (3,66 ммоля) норгалантамина (68% (ВЭЖХ, СК-1-1)), растворенного в 3 мл абсолютного дихлорметана, и 0,441 г (3,66 ммоля) аллилового эфира хлормуравьиной кислоты, растворенной в 2 мл абсолютного дихлорметана, аналогично способу А обрабатывали 1,48 мл (1,448 г, 18,3 ммоля) пиридина. После водной обработки аналогично способу А и колоночной хроматографии (50 г силикагеля, растворитель петролейный эфир/этиловый эфир уксусной кислоты = 2/1 → 1/1) получали 0,784 г бесцветной пены и 0,214 г того же побочного продукта.
Выход: 0,784 г (2,19 ммоля, 60%)
Пример 187
Схему к примеру 187 см. в конце текста описания.
Стадии 1-4
Иммобилизация аллилового эфира (4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2]-бензазепин-11(12Н)-ил)карбоновой кислоты на гидроксиметилполистирольной смоле (смоле Меррифилда)
В закрытой с обеих сторон 5-мл полиэтиленовой фритте суслендировали 0,200 г (0,208 ммоля) гидроксиметилполистирольной смолы (1,04 ммоля, смола Меррифилда3) в 3 мл дихлорметана и встряхивали 30 минут примерно 40 раз в минуту. После фильтрования прибавляли 0,095 г (0,832 ммоля) ангидрида глутаровой кислоты, 178 мкл (0,134 г, 1,04 ммоля) этилдиизопропиламина в 2 мл дихлорметана и суспензию встряхивали 16 часов при комнатной температуре примерно 40 раз в минуту. Реакционный раствор отфильтровывали и смолу промывали один раз дихлорметаном, один раз метанолом и пять раз дихлор-метаном по 2,5 мл. После этого смолу суспендировали в 77 мкл (0,075 г, 0,624 ммоля) пивалоилхлорида и 178 мкл (0,134 г, 1,04 ммоля) этилдиизопропиламина в 1,75 мл дихлорметана и встряхивали шесть часов при комнатной температуре. После фильтрования и промывания дихлорметаном (1× 2,5 мл), тетра-гидрофураном (1× 2,5 мл) и дихлорметаном (5× 2,5 мл) смолу втряхивали в растворе из 0,230 г (0,624 ммоля) N-аллилоксикарбонилноргалантамина, 0,013 г (0,104 ммоля) 4-диметиламинопиридина и 178 мкл (0,134 г, 1,04 ммоля) этилдиизопропиламина в 2 мл дихлорметана при комнатной температуре. Через 22 часа реакцию прерывали фильтрованием реакционного раствора, смолу промывали дихлорметаном (1× 2,5 мл), диметилформамидом (2× 2,5 мл) и дихлорметаном (5× 2,5 мл), отсасывали досуха и сушили в вакууме при от 30 до 50 мбар в течение ночи.
Для установления загрузки аликвоту смолы (0,262 г) оставляли набухать в 2,5 мл метанола/тетрагидрофурана (1/3) 30 минут, фильтровали и суспендировали в растворе 0,168 г (0,933 ммоля) 30%-ного метанольного раствора метилата натрия в 0,5 мл метанола и 1,5 мл тетрагидрофурана. Смесь встряхивали 15,5 часа при комнатной температуре, отфильтровывали и смолу экстрагировали трижды метанолом/дихлорметаном (1/1, 2,5 мл) и трижды дихлорметаном (2,5 мл). Объединенные фильтраты нейтрализовали 95 мкл (0,067 г, 1,248 ммоля) трифторуксусной кислоты и упаривали на роторном испарителе. Остаток очищали колоночной хроматографией (5 г силикагеля, растворитель петролейный эфир/этиловый эфир уксусной кислоты = 1/1). После упаривания и высушивания в высоком вакууме получали 0,048 г бесцветного стекловидного твердого вещества.
Выход: 0,048 г (0,13 ммоля, 65% в расчете на степень замещения гидроксиметильной смолы). 1Н-ЯМР-спектр идентичен с исходным материалом.
Пример 187/стадии 5-8
SPH-1539
1-(4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н)-ил)-6-(4-гидрокси-1-пиперидил)гексан-1-он (СК-36-1)
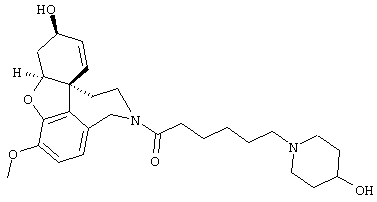
0,273 г смолы, полученной из 0,200 г (0,208 ммоля) гидроксиметилполистирольной смолы (1,04 ммоля/г) по описанному выше способу А, 0,120 г (0,104 ммоля Рd(Рh3Р)4, 0,292 г (2,08 ммоля) димедона встряхивали в 2,5 мл тетрагидрофурана в закрытой с обеих сторон 5-мл полиэтиленовой фритте шесть часов при комнатной температуре около 40 раз в минуту. Смолу фильтровали и промывали дихлорметаном (1× 2,5 мл), дихлорметаном/метанолом /этилдиизопропиламином (5/4/1) (3× 2,5 мл) и в заключение дихлорметаном (5× 2,5 мл). После этого смолу смешивали с раствором из 96 мкл (0,133 г, 0,624 ммоля) 6-бромкапроилхлорида и 178 мкл (0,134 г, 1,04 ммоля) этилдиизопропиламина в 2 мл дихлорметана и встряхивали пять часов при комнатной температуре. После промывания диметилформамидом (6× 2,5 мл) смолу встряхивали в растворе из 0,210 г (2,08 ммоля) 4-гидроксипиперидина и 2 мл диметилформамида двенадцать часов при комнатной температуре. Смолу промывали трижды по 2,5 мл дихлорметана и трижды по 2,5 мл тетрагидрофурана и после этого суспендировали в растворе 0,168 г (0,933 ммоля) 30%-ного метанольного раствора метилата натрия в 0,5 мл метанола и 1,5 мл тетрагидрофурана. Через двенадцать часов при комнатной температуре смолу фильтровали и экстрагировали метанолом/дихлорметаном (1/1, 3× 2,5 мл) и дихлорметаном (3× 2,5 мл). Объединенные фильтраты нейтрализовали 95 мкл (0,067 г, 1,248 ммоля) трифторуксусной кислоты и на роторном испарителе упаривали примерно до объема 2 мл. Сырой продукт очищали препаративной тонкослойной хроматографией (готовая пластинка PSC (PSC-Fertigplatte von Merck, Art.-nr.: 113895, 20× 20 см, 1 мм, силикагель 60 F254), растворитель дихлорметан/метанол = 9/1+3% триэтиламина). От упаренной фракции продукта отделяли фильтрованием через колонку с оксидом алюминия (рН 9-10, растворитель дихлорметан/метанол = 20/1) трифторацетат триэтиламмония. После упаривания и сушки в высоком вакууме получали 0,012 г продукта в виде желтоватой пены.
Выход: 0,012 г (0,025 ммоля, 12% в расчете на степень замещения гидроксиметильной смолы), бело-коричневатый воск (Mw=470,6).
ТСХ: Rf=0,32 (дихлорметан/метанол = 8/2+2% триэтиламина)
ВЭЖХ: tRet=5,38 мин, 98,6% (колонка Waters Xterra, 3,9 мм × 100 мм, RP-18, 3,5 мкм, 250 нМ, 1 мл/мин, ацетонитрил/20 мМ Na2B4O7 в Н2О (20/80 об./об., рН 10).
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,81-6,88 и 6,61-6,71 (м, 2Н), 5,90-6,10 (м, 2Н), 4,52-4,75 (м, 2Н), 4,51 (д, J=16,5 Гц, 1Н), 4,15 (шир.с, 1H), 3,84 (с, 3Н), 3,82 (с, 1Н), 3,40-3,60 и 3,10-3,30 (м, 1H), 2,81-3,03 (м, 2Н), 2,70 (шир.д, J=16,3 Гц, 1Н), 2,33-2,62 (м, 4Н), 1,15-2,30 (м, 21Н).
ЖХ/масс-спектрометрия: tRet=8,7 мин, 98% (колонка Zorbax SB С 13, 2,1 мм × 30 мм, RP-18, 3 мкм, 0,5 мл/мин, метанол/Н2О (40/60 → 100/0 (об./об.) в 2 мин)
APCI-NI-MS
470
Пример 188
Схема к примеру 188 дана в конце текста описания.
Пример 188/стадии 1-7
SPH-1540
(4aS,6R,8aS)-6-Гидрокси-3-метокси-N11-(нафтил)-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-11(12Н) карбоксамид
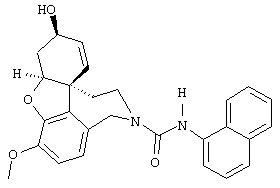
Вариант А (СК-41-3), стадии 1, 4 и 6-7
0,228 г (0,212 ммоля) 4-карбокси-1-оксобут-1-илоксиметильной смолы Меррифилда оставляли набухать в закрытой с обеих сторон 5-мл полиэтиленовой фритте 30 минут в 3 мл дихлорметана и после фильтрования смешивали с раствором 0,234 г (0,628 ммоля N-трет-бутоксикарбонилноргалантамина, 0,013 г (0,105 ммоля). 4-диметиламинопиридина и 108 мкл (0,082 г, 0,628 ммоля) этилдиизопропиламина в 1 мл дихлорметана. После этого прибавляли 97 мкл (0,079 г, 0,628 ммоля) диизопропилкарбодиимида, растворенного в 1 мл дихлорметана, и встряхивали суспензию 24 часа примерно 40 раз в минуту при комнатной температуре. После фильтрования смолу суспендировали десять минут в 2,5 мл дихлорметана/метанола (1/1) при встряхивании, фильтровали и промывали дихлорметаном (5× 2,5 мл). После этого смолу суспендировали один раз десять минут и один раз 50 минут в 2,5 мл раствора из трифторуксусной кислоты, дихлорметана и анизола (25/70/5). После фильтрования промывали дихлорметаном (2× 2,5 мл), дихлорметаном/метанолом/триэтиламином (5/4/1, 3× 2,5 мл) и в заключение дихлорметаном (5× 2,5 мл). Смолу встряхивали одиннадцать часов в растворе из 0,208 мкл (0,245 г, 1,45 ммоля) 1-нафтилизоцианата, 113 мкл (0,085 г, 0,657 ммоля) этилдиизопропиламина и 2 мл дихлорметана при комнатной температуре. После трехкратного промывания дихлорметаном (2,5 мл) и тетрагидрофураном (2,5 мл) полимер суспендировали в растворе 0,188 г (1,045 ммоля) 30%-ного метанольного раствора метилата натрия в 0,4 мл метанола и 1,6 мл тетрагидрофурана. Затем смолу встряхивали 24 часа при комнатной температуре, фильтровали, экстрагировали метанолом/дихлорметаном (1/1, 3× 2,5 мл) и дихлорметаном (3× 2,5 мл). Объединенные фильтраты нейтрализовали концентрированной соляной кислотой. Суспензию фильтровали через колонку с силикагелем (10 г, дихлорметан/метанол = 9/1), и фильтрат упаривали на роторном испарителе. Сырой продукт очищали препаративной тонкослойной хроматографией (силикагель, растворитель дихлорметан/метанол = 47/3). После упаривания и сушки в высоком вакууме получали 0,091 г желтоватой пены. Для удаления соли триэтиламмония остаток переносили в дихлорметан и экстрагировали дважды 1 н соляной кислотой и один раз насыщенным раствором поваренной соли, сушили над МgSO4, фильтровали и упаривали.
Выход: 0,042 г (0,095 ммоля, 45% в расчете на степень замещения 4-карбокси-1-оксобут-1-илоксиметильной смолы Меррифилда), коричнево-желтоватый воск (МW=442,5)
ТСХ: Rf=0,21 (дихлорметан/метанол = 48/2)
ВЭЖХ: tRet=5,15 мин, 100% (колонка Merck Purospher 4,0 мм × 125 мм, RP-18e, 5 мкм, 250 нм, 1 мл/мин, ацетонитрил/20 мМ Cl3CCO2H в Н2О (40/60 об./об.)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 7,71 (д, J=6,9 Гц, 1Н), 7,20-7,66 (м, 6Н), 6,85 (д, J=8,4 Гц, 1Н), 6,63 (д, J=8,2 Гц, 1Н), 5,96 (шир.с, 2Н), 4,91 (д, J=16,7 Гц, 1Н), 4,25-4,62 (м, 3Н), 4,09 (шир.с, 1Н), 3,78 (с, 3Н), 3,25-3,50 (м, 2Н), 2,55-2,67 (м, 1Н), 1,87-2,04 (м, 2Н), 1,60-1,75 (м, 1Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 155,7, 146,9, 144,6, 134,4, 133,8, 132,5, 129,0, 128,7, 128,1, 128,0, 126,3, 125,6, 125,5, 124,8, 122,1, 120,7, 111,0, 88,2, 62,9, 55,9, 51,8, 48,3, 46,1, 36,4, 29,7.
Вариант В, стадии 2-5 и 7
0,250 г (0,233 ммоля) 4-карбокси-1-оксобут-1-илоксиметильной смолы Меррифилда помещали во фритта-реактор робота для синтеза (Syro II MultiSynTech). Затем смолу оставляли набухать в реакторе 30 минут в дихлорметане, отсасывали, трижды промывали дихлорметаном и последовательно смешивали с 0,150 мл (1,163 ммоля) этилдиизопропиламина в 1 мл дихлорметана и 0,084 г (0,698 ммоля) пивалоилхлорида в 1,5 мл дихлорметана. После шестичасового перемешивания при 23° С раствор отсасывали и полимер промывали по 3 мл дихлорметана (6× 2 минуты). После прибавления 0,260 г (0,698 ммоля) N-трет-бутоксикарбонилноргалантамина, 0,014 г (0,116 ммоля) 4-диметиламинопиридина и 0,150 г (1,163 ммоля) этилдиизопропиламина в 2,5 мл дихлорметана суспензию перемешивали при 23° С 15 часов. После отсасывания смолу перемешивали в 2,5 мл дихлорметана/метанола (1/1) десять минут, отсасывали, промывали трижды дихлорметаном/метанолом (1/1) (3 мл, 2 минуты) и пять раз дихлорметаном (3 мл, 2 минуты). После этого полимер суспендировали один раз десять минут и один раз 50 минут по 2,5 мл раствора из трифторуксусной кислоты, дихлорметана и анизола (25/70/5). После отсасывания промывали дихлорметаном (3× 3 мл), дихлорметаном/метанолом/триэтиламином (5/4/1, 3× 3 мл) и в заключение дихлорметаном (5× ) каждый раз по две минуты. Затем смешивали смолу с 0,197 г (1,163 ммоля) 1-нафтилизоцианата, 0,150 г (1,163 ммоля) этилдиизопропиламина и 2,5 мл диметилформамида и перемешивали шесть часов при 50° С. Реакцию прерывали, отсасывая раствор, смолу при 23° С промывали шесть раз по две минуты 3 мл дихлорметана и при 40° С 10 минут смолу отсасывали досуха. Для отщепления смолу переносили в закрытую с обеих сторон 5-мл полиэтиленовую фритту и оставляли набухать в 2,5 мл тетрагидрофурана 30 минут. После фильтрования полимер суспендировали в растворе из 0,209 г (1,163 ммоля) 30%-ного метанольного раствора метилата натрия в 0,75 мл метанола и 1,25 мл тетрагидрофурана, и встряхивали 15 часов примерно 40 раз в минуту при комнатной температуре. Смолу фильтровали и экстрагировали трижды метанолом/дихлорметаном (1/1, 2, 5 мл) и трижды дихлорметаном (2,5 мл). Объединенные экстракты нейтрализовали концентрированной соляной кислоты, фильтровали и упаривали. В заключение продукт очищали колоночной хроматографией через 10 г силикагеля (растворитель дихлорметан/метанол = 99/1). После упаривания и высушивания в вакууме получали 0,029 г розового воска 75%-ной чистоты (ВЭЖХ), идентичного продукту, полученному по способу А.
Выход: 0,029 г (0,021 г, 0,047 ммоля, 20% в расчете на степень замещения 4-карбокси-1-оксобут-1-илоксиметильной смолы Меррифилда)
ВЭЖХ: tRet=14,32 мин, 75% (колонка Merck Purospher 4,0 мм × 125 мм, RP-18e, 5 мкм, 250 нм, 1 мл/мин, ацетонитрил/20 мМ Cl3CCO2H в Н2О (30/70 об./об.).
Схема к примерам 189-190 дана в конце текста описания.
Пример 189
SPH-1541
Стадии 1-2
(4aS,6R,8aS)-3-Метокси-11-трет-буроксикарбония-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-еf][2]бензазепин-6(12Н)илокси)-5-оксопентановая кислота (СК-48-1)
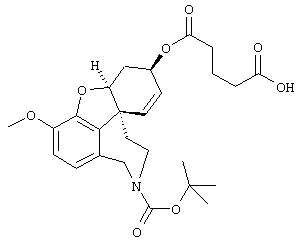
5,000 г (18,295 ммоля) норгалантамина (98% (ВЭЖХ)) и 3,804 мл (2,777 г, 27,442 ммоля) триэтиламина помещали в 75 мл абсолютного дихлорметана при 0° С. При перемешивании в течение 15 минут при 0° С прибавляли по каплям раствор из 4,393 г (20,124 ммоля) ди-трет-бутилкарбоната. После 40 минут при 0° С реакционный раствор перемешивали в течение трех дней при комнатной температуре. Через два дня прибавляли еще 1,598 г (7,318 ммоля) ди-трет-бутилкарбоната и 1,27 мл (0,926 г, 9,147 ммоля) триэтиламина. Реакционный раствор смешивали со 150 мл дихлорметана и органическую фазу промывали трижды по 100 мл 1 н соляной кислоты, трижды по 100 мл насыщенного раствора NаНСО3 и дважды по 100 мл насыщенного раствора поваренной соли, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток (7,065 г, 18,9 ммоля, 103% выход сырого продукта) растворяли в 75 мл абсолютного дихлор-метана и к этому раствору прибавляли 4,175 г (36,590 ммоля) ангидрида глутаровой кислоты, 0,224 г (1,829 ммоля) 4-диметиламинопиридина и 3,804 мл (2,777 г, 27,442 ммоля) триэтиламина. Раствор перемешивали при комнатной температуре три дня. Реакцию прерывали прибавлением 200 мл диэтилового эфира и 500 мл водного раствора аммиака (рН 10-11). Мутную водную фазу отделяли (плохое разделение фаз, прибавление небольшого количества метанола, в случае необходимости, перед отгонкой раствора дихлорметана) и трижды экстрагировали 200 мл диэтилового эфира и в заключение концентрированной соляной кислотой до рН 2. При этом мутный раствор становился прозрачным. Водную фазу четыре раза экстрагировали по 400 мл дихлорметана. Объединенные органические экстракты промывали трижды по 300 мл дистиллированной воды и дважды 300 мл насыщенного раствора поваренной соли, сушили над Na2SO4, фильтровали, смешивали с 50 мл диизопропилового эфира и концентрировали при пониженном давлении до тех пор, пока продукт не закристаллизовался. Раствор выдерживали некоторое время и затем отфильтровывали выкристаллизовавшееся бесцветное твердое вещество, которое сушили в вакууме.
Выход: 7,546 г (15,48 ммоля, 84,6% с обеих стадий), бесцветное кристаллическое твердое вещество (Mw=487,6)
ТСХ: Rf=0,45 (петролейный эфир/этиловый эфир уксусной кислоты = 1/2)
Rf=0,28 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты = 1/2)
Т.пл.: 159-163° С (дихлорметан/диизопропиловый эфир = 1/1)
ИК: KBr
ν (см-1) 3245 (шир.с), 2978 (с), 1715 (с), 1683 (с)
1H-ЯМР: (200,13 МГц, CDCl3, TMS)
δ 6,53-6,79 (м, 2Н), 6,13-6,29 (м, 1Н), 5,82-5,97 (м, 1Н), 5,33 (т, J=4,9 Гц, 1,0Н), 4,87 (д, J=15,6 Гц, 0,3Н), 4,67 (д, J=15,7 Гц, 0,7Н), 4,53 (с, 1Н), 3,99-4,38 (м, 2Н), 3,83 (с, 3Н), 3,19-3,50 (м, 1Н), 2,68 (д, J=16,0 Гц, 1,0Н), 2,40 (т, J=7,3 Гц, 2,0Н), 2,39 (т, J=7,0 Гц, 2,0Н), 2,01-2,17 (м, 1Н), 1,93 (квуи, J=7,1 Гц, 2,0Н), 1,66-1,84 (м, 1Н), 1,41 (с, 3Н), 1,37 (с, 6Н).
13С-ЯМР: (50,32 МГц, CDCl3, TMS)
δ 178,2 (с), 172,6 (с), 154,9 (с), 147,1 (с), 144,0 (с), 131,3 (с), 130,5 (д), 129,6 (с), 123,0 (д), 120,2 (д), 111,0 (д), 85,8 (д), 79,9 (с), 63,2 (д), 55,8 (кв), 51,8 и 51,2 (т), 48,0 (с), 45,2 (т), 37,9 и 37,0 (т), 33,4 (т), 32,9 (т), 28,2 (кв), 27,5 (т), 19,7 (т).
Пример 190
SPH-1542
(смотри схему, стадия 3)
Иммобилизация трет-бутилового эфира (4aS,6R,8aS)-6-гидрокси-3-метокси-5,6,9,10-тетрагидро-4аН-[1]бензофуро[3а,3,2-ef][2] бензазепин-11(12)-ил)карбоновой кислоты на гидроксиметилполистирольную смолу (смолу Меррифилда) (СК-43-5)
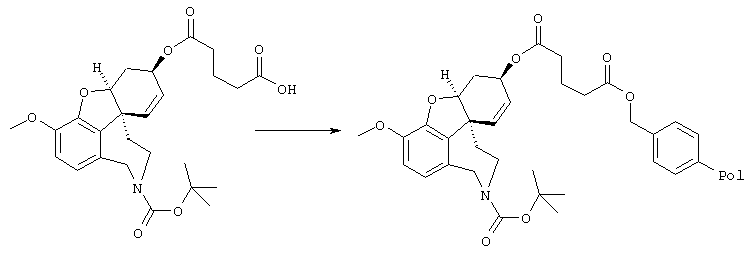
5,000 г (5,2 ммоля) гидроксиметилполистирольной смолы (1,04 ммоля/г, смола Меррифилда (Hydroxymethyl-Resin, D-1160, Bachem Feinchemikalien AG) перемешивали в трехгорлом реакторе с расположенной на дне фриттой и мешалкой KPG в 50 мл диметилформамида (300 с-1). После фильтрования к смоле прибавляли раствор из N-трет-бутоксикарбонилноргалантамин-6-илокси-5-оксопентановой кислоты (7,607 г, 15,6 ммоля), 4-диметиламинопиридина (0,635 г, 5,2 ммоля) в 30 мл абсолютного диметилформамида. При комнатной температуре затем порциями прибавляли раствор из диизопропилкарбодиимида (2,42 мл, 1,969 г, 15,6 ммоля) и 10 мл диметилформамида. После 20-часового перемешивания при комнатной температуре фильтровали, смолу промывали шесть раз дихлорметаном (40 мл, 5 мин) и один раз диэтиловым эфиром (40 мл, 5 мин) и сушили в вакууме. Для установления загрузки аликвоту смолы (0,2465 г) оставляли набухнать в закрывающейся с обеих сторон полиэтиленовой фритте в 2,5 мл метанола/тетрагидрофурана (1/4) 30 минут, фильтровали и суспендировали в растворе 0,280 г (1,56 ммоля) 30%-ного метанольного раствора метилата натрия в 0,5 мл метанола и 2 мл тетрагидрофурана. Смесь встряхивали девять часов при комнатной температуре, фильтровали и смолу экстрагировали трижды метанолом/дихлорметаном (1/1, 2,5 мл) и трижды дихлорметаном (2,5 мл). Объединенные фильтраты нейтрализовали 119 мкл (0,178 г, 1,56 ммоля) трифторуксусной кислоты и упаривали на роторном испарителе. Остаток помещали в 30 мл этилового эфира уксусной кислоты, промывали дважды насыщенным раствором NаНСО3 (10 мл), дистиллированной водой (10 мл) и насыщенным раствором поваренной соли (10 мл), сушили над Nа2SO4, фильтровали и снова упаривали. Остаток (0,080 г) очищали колоночной хроматографией (10 г силикагеля, растворитель петролейный эфир/этиловый эфир уксусной кислоты = 1/1 → 1/2). После упаривания и высушивания в высоком вакууме получали 0,0661 г бесцветного стекловидного твердого вещества.
Выход: 0,0661 г (0,177 ммоля, таким образом достигали загрузки 0,718 ммоля/г, 103% теоретической максимальной загрузки (= 1,04 ммоля/г/1 г + 1 г · 1,04 моля/г · (487,6 моля/г - 18 моль/г)/1000)), 1Н-ЯМР-спектр идентичен исходному материалу.
ВЭЖХ: tRet=9,18 мин, 93,8% (270 нм), 97,7% (285 нм) (колонка Phenomenex Luna, 3,0 мм × 50 мм, RP-18, 3,0 мкм, 0,5 мл/мин, метанол/20 мМ трихлоруксусной кислоты в Н2О (50/50 об./об.).
Стадия 4
Вторичное использование избытков (4аS,6R,8аS)-3-метокси-11-трет-бутоксикарбонил-5,6,9,10-терагидро-4аН-[1]бензофуро[3а,3,2-ef][2]бензазепин-6-(12Н)-илокси)-5-оксопентановой кислоты из иммобилизации смолы (СК-51-1)
Фильтрат и первый из пяти дихлорметановых фильтратов объединяли и промывали трижды 100 мл 1 н соляной кислоты, трижды 100 мл дистиллированной воды и дважды насыщенным раствором хлорида натрия, сушили Na2SO4, фильтровали и упаривали. Аморфный остаток (6,806 г) суспендировали в 50 мл этанола и 30 мл дистиллированной воды и затем прибавляли 1,97 г (46,9 ммоля) моногидрата гидроксида лития. Суспензию перемешивали три дня при комнатной температуре. Реакционный раствор трижды экстрагировали по 100 мл дихлорметана и объединенные экстракты экстрагировали трижды по 100 мл 1 н соляной кислоты и дважды по 100 мл насыщенного раствора поваренной соли. Из органической фазы после сушки над Na2SO4, фильтрования и упаривания при пониженном давлении получали 5,06 г бесцветной пены, которая согласно ВЭЖХ содержала около 60% N-трет-бутоксикарбонилноргалантамина. Остаток аналогично описанной выше процедуре обрабатывали 0,164 г (1,339 ммоля) диметиламинопиридина, 3,056 г (26,78 ммоля) ангидрида глутаровой кислоты и 2,8 мл (2,033 г, 20,09 ммоля) триэтиламина в 50 мл дихлорметана. Реакцию прерывали прибавлением 200 мл диэтилового эфира и 250 мл водного раствора аммиака (рН 10-11). Мутную водную фазу отделяли и дважды экстрагировали 200 мл диэтилового эфира и, наконец, концентрированной соляной кислотой устанавливали рН 2. Водную фазу трижды экстрагировали по 200 мл дихлорметана. Объединенные органические экстракты промывали трижды по 200 мл дистиллированной воды и дважды по 200 мл насыщенного раствора поваренной соли, сушили над Na2SO4, фильтровали, упаривали примерно до 50 мл, смешивали с 50 мл диизопропилового эфира и концентрировали при уменьшенном давлении до тех пор, пока продукт не закристаллизовался. Раствор выдерживали на некоторое время и затем отфильтровывали выкристаллизовавшееся бесцветное твердое вещество, которое сушили в высоком вакууме.
Выход: 4,909 г (10,07 ммоля, 96,6% в расчете на взятый избыток при иммобилизации).
ВЭЖХ: tRet=13,9 мин, 99,8% (колонка Merck Purospher, 4,0 мм × 125 мм, RP-18e, 5 мкм, 285 нм, 1 мл/мин, ацетонитрил/20 мМ Cl3CCO2H в H2O (40/60 об./об., рН 10).
Пример 192
Стадия 1
Амид N-(адамантан-1-ил)-6-бромгексановой кислоты
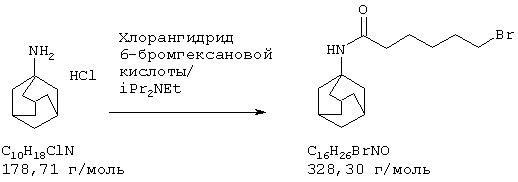
Гидрохлорид адамантан-1-амина (2,50 г, 13,3 ммоля) и N-этилдиизопропиламин (3,79 г, 29,3 ммоля) в абсолютном CH2Cl2 (50 мл) перемешивали 15 минут при комнатной температуре. Затем прибавляли по каплям при 0° С хлорангидрид 6-бромгексановой кислоты (3,13 г, 14,7 ммоля) в CH2Cl2 (10 мл) и перемешивали один час при комнатной температуре.
Экстрагировали 2 н НС1 (2× 50 мл), водой (1× 50 мл), насыщенным раствором гидрокарбоната натрия (2× 50 мл) и насыщенным раствором поваренной соли (1× 100 мл), сушили (сульфат натрия/активированный уголь), фильтровали и полученный после удаления на роторном испарителе растворителя остаток перекристаллизовывали из петролейного эфира (25 мл)/диизопропилового эфира (25 мл), получая продукт в виде бесцветных кристаллов с температурой плавления 73-75° С (3,51 г, 80%).
ТСХ: СНС13:МеОН=9:1, Rf=0,9
1H-ЯМР (CDCl3): δ 5,43 (шир., 1Н), 3,33 (т, J=6,0 Гц, 2Н), 2,21-1,15 (м, 23Н);
13С-ЯМР (CDCl3): δ 171,6 (с), 51,4 (с), 41,3 (т), 37,0 (т), 36,1 (т), 33,5 (т), 32,2 (т), 29,1 (д), 27,4 (т), 24,6 (т).
Стадия 2
SPH-1517
Амид N-(адамантан-1-ил)-6-[(4aS,6R,8aS)-4a,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-6Н-бензофуро[3a,3,2-ef][2] бензазепин-11-ил)бромгексановой кислоты, фумарат
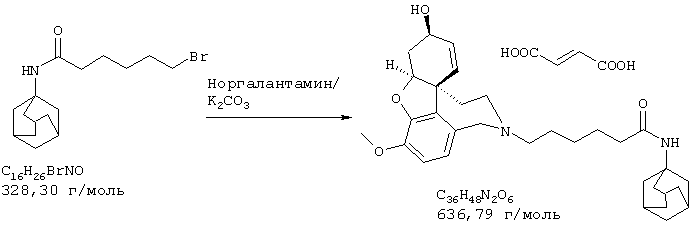
Норгалантамин (1,00 г, 3,66 ммоля), амид N-(адамантан-1-ил)-6-бромгексановой кислоты (1,20 г, 3,66 ммоля) и карбонат калия (безводный, свежеразмолотый, 1,52 г, 11,3 ммоля) в абсолютном ацетонитриле (10 мл) перемешивали 8 часов при температуре кипения. Остаток, полученный после удаления растворителя на роторном испарителе, очищали колоночной хроматографией (200 г силикагеля, хлороформ:метанол:аммиак = 96:3:1), получая продукт в виде светло-желтой пены (1,73 г, 91%). Превращение в фумарат осуществляли аналогично получению МТ-311 и МТ-407 и получали продукт в форме светло-желтых кристаллов с температурой плавления 109-114° С.
ТСХ: СНС13:МеОН:NН3=89:10:1, Rf=0,6
Элементный анализ (JOS 1763):
C37H42N2O9·H2O
Вычислено: С 66,03; Н 7,70; N 4,28.
Найдено: С 66,27; Н 7,61; N 4,22.
1Н-ЯМР: (ДМСО-d6): δ 7,20 (шир., 1Н), 6,90-6,63 (м, 2Н), 6,51 (с, 2Н), 6,11 (д, J=10,2 Гц, 1Н), 5,82 (дд, J=11,4 Гц, J=4,7 Гц, 1H), 4,56 (с, 1Н), 4,41 (д, J=14,8 Гц, 1H), 4,22-3,86 (м, 2Н), 3,76 (с, 3Н), 3,62-3,12 (м, 3Н), 2,81-2,47 (м, 3Н), 2,44-1,04 (м, 26Н);
13С-ЯМР (ДМСО-d6): δ 171,6 (с), 167,4 (с), 146,3 (с), 144,1 (с), 134,7 (д), 132,9 (с), 129,0 (д), 126,3 (д), 124,6 (с), 122,0 (д), 111,7 (д), 86,7 (д), 59,8 (д), 55,5 (кв), 50,7 (т), 50,5 (т), 47,3 (с), 41,1 (т), 36,1 (т), 36,0 (с), 32,0 (т), 31,0 (т), 28,9 (д), 26,0 (т), 25,2 (т), 24,9 (т).
Пример 193
Стадия 1
2 (5-Бромпентил)-1H-бенз [dе]изохинолин-1,3(2Н)-дион
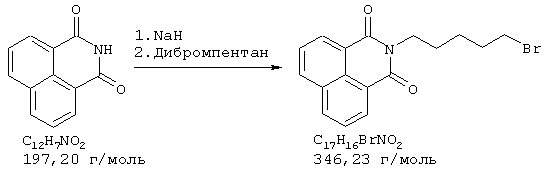
К суспензии гидрида натрия (2,33 г, 55,8 ммоля 55%-ной дисперсии, освобожденной промыванием абсолютным петролейным эфиром от вазелинового масла) в абсолютном ДМФА (50 мл) медленно прибавляли по каплям 1Н-бенз[dе]изохинолин-1,3(2Н)-дион (10,0 г, 50,7 ммоля) в ДМФА (50 мл) при комнатной температуре. Перемешивали 30 минут, нагревали до 60° С, прибавляли сразу 1,5-дибромметан (46,64 г, 202,8 ммоля) и перемешивали 12 часов при указанной температуре. Фильтровали и остаток, полученный после удаления растворителя на роторном испарителе, распределяли между водой (200 мл) и эфиром (200 мл). Водную фазу экстрагировали эфиром (3× 50 мл), объединенные органические фазы промывали водой (3× 200 мл), 2 н NaOH (2× 100 мл) и насыщенным раствором поваренной соли (1× 200 мл), сушили (сульфат натрия) и освобождали от растворителя на роторном испарителе. Избыток дихлорметана отделяли перегонкой (100° С/20 мбар), остаток перекристаллизовывали из метанола (200 мл), получая продукт в форме бесцветных кристаллов (15,45 г, 88%) с температурой плавления 114-116° С.
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 4:1, Rf=0,35
1H-ЯМР (CDCl3): δ 8,48 (дд, J=7,0 Гц, J=1,3 Гц, 2Н), 8,13 (дд, J=7,0 Гц, J=1,3 Гц, 2Н), 8,48 (т, J=7,0 Гц, 2Н), 4,21 (т, J=7,6 Гц, 2Н), 3,89 (т, J=6,6 Гц, 2Н), 1,89 (квинтет, J=6,6 Гц, 2Н), 1,79-1,43 (м, 4Н);
13С-ЯМР (CDCl3): δ 163,8 (с), 133,7 (д), 131,3 (с), 130,9 (д), 127,8 (с), 126,7 (д), 122,4 (д), 39,8 (т), 33,5 (т), 32,2 (т), 27,0 (т), 25,5 (т).
Стадия 2
SPH-1496
2-[5-[(4aS,6R,8aS)-4a,5,9,10,11,12-Гексагидро-6-гидрокси-3-метокси-6Н-бензофуро[3а,3,2-ef][2]бензазепин-11-ил]пентил]-1Н-бенз[de]изохинолин-1,3(2Н)-дион, фумарат
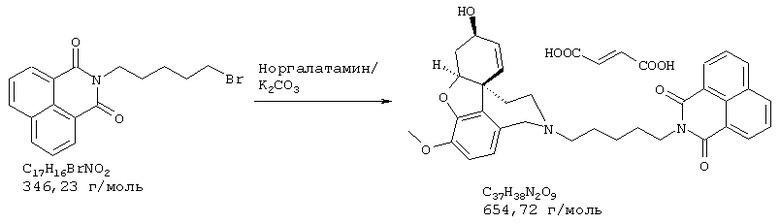
Норгалантамин (1,00 г, 3,66 ммоля), 2-(5-бромпентил)-1Н-бенз [dе]изохинолин-1,3(2Н)-дион (1,15 г, 3,33 ммоля) и карбонат калия (безводный, свежеразмолотый, 1,15 г, 10,0 ммоля) в абсолютном ацетонитриле (10 мл) перемешивали 12 часов при температуре кипения. Остаток, полученный после удаления растворителя на роторном испарителе, очищали колоночной хроматографией (100 г силикагеля, хлороформ:метанол:аммиак = 96:3:1), получая продукт в виде светло-желтой пены (1,58 г, 88%). Превращение в фумарат осуществляли аналогично получению МТ-311 и МТ-407 и получали продукт в форме светло-желтых кристаллов с температурой плавления 129-134° С.
ТСХ: СНС13:МеОН:NН3=89:10:1, Rf=0,5
Микроэлементный анализ (JOS 1790):
С37Н38N2O9·1,5Н2O
Вычислено: С 65,19; Н 6,06; N 4,11.
Найдено: С 65,02; Н 5,82; N 3,98.
1H-ЯМР: (ДМСО-d6): δ 8,34 (д, J=7,0 Гц, 4Н), 7,76 (д, J=7,0 Гц, 2Н), 6,81-6,49 (м, 4Н), 6,07 (д, J=11,4 Гц, 1Н), 5,81 (дд, J=11,4 Гц, J=4,7 Гц, 1Н), 4,49 (с, 1Н), 4,29 (д, J=14,0 Гц, 1Н), 4,16-3,74 (м, 4Н), 3,70 (с, 3Н), 3,43-3,01 (м, 2Н), 2,50 (шир., 2Н), 2,27 (д, J=14,8 Гц, 1H), 2,12-1,88 (м, 2Н), 1,78-1,12 (м, 8Н);
13С-ЯМР (ДМСО-d6): δ 167,3 (с), 163,3 (с), 146,2 (с), 143,8 (с), 134,7 (д), 134,2 (д), 132,8 (с), 131,2 (с), 130,6 (д), 128,7 (д), 127,2 (д), 127,1 (с), 126,5 (д), 126,1 (с), 121,9 (с), 121,6 (д), 111,5 (д), 86,7 (д), 59,8 (д), 56,0 (т), 55,5 (кв), 50,7 (т), 50,2 (т), 47,4 (с), 39,5 (т), 32,2 (т), 30,9 (т), 27,3 (т), 25,3 (т), 24,1 (т).
Пример 194
Стадия 1
6-Бром-1-(3,4-диметоксифенил)-1-гексанон
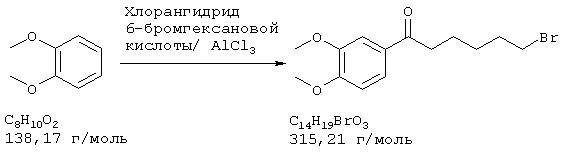
К смеси 1,2-диметоксибензола (3,10 г, 22,7 ммоля) и хлорида алюминия (3,0 г, 22,7 ммоля) в абсолютном сероуглероде (50 мл) при температуре от 0 до 5° С прибавляли по каплям хлорангидрид 6-бромгексановой кислоты (4,9 г, 22,7 ммоля) в течение 10 минут. Нагревали в течение 30 минут до 40° С и перемешивали один час при данной температуре. Гидролизовали 2 н соляной кислотой (20 мл), распределяли между бензолом (30 мл) и 2 н соляной кислотой (30 мл) и экстрагировали водную фазу бензолом (2× 15 мл), объединенные органические фазы промывали 2 н соляной кислотой (3× 50 мл), водой (1× 50 мл), насыщенным раствором гидрокарбоната натрия (3× 50 мл), насыщенным раствором поваренной соли (1× 50 мл), сушили (сульфат натрия/активированный уголь), фильтровали и оставшийся после упаривания на роторном испарителе остаток перекристаллизовывали из пентана (35 мл), получая продукт в форме бесцветных кристаллов с температурой плавления 44-45° С (3,2 г, 44,7%).
ТСХ: петролейный эфир:этиловый эфир уксусной кислоты = 4:1; Rf=0,85.
1H-ЯМР (CDCl3): δ 7,54 (дд, J=1,9 Гц, J=8,9 Гц, 1Н), 7,51 (д, J=1,9 Гц, 1Н), 6,89 (д, J=8,9 Гц, 1Н), 3,97 (с, 6Н), 3,40 (т, J=6,4 Гц, 2Н), 2,92 (т, J=7,0 Гц, 2Н), 1,90 (квинтет, J=6,4 Гц, 2Н), 1,73 (квинтет, J=7,0 Гц, 2Н), 1,63-1,48 (м, 2Н);
13С-ЯМР (CDCl3): δ 198,6 (с), 153,2 (с), 149,0 (с), 130,2 (с), 122,6 (д), 110,1 (д), 110,0 (д), 56,0 (кв), 55,9 (кв), 37,7 (т), 33,6 (т), 32,6 (т), 27,9 (т), 23,6 (т).
Стадия 2
SPH-1497
1-(3,4-Диметоксифенил)-6-[(4aS,6R,8aS)-4a,5,9,10,11,12-гексагидро-6-гидрокси-3-метокси-6Н-бензофуро[3а,3,2-ef][2] бензазепин-11-ил]гексан-1-он, фумарат
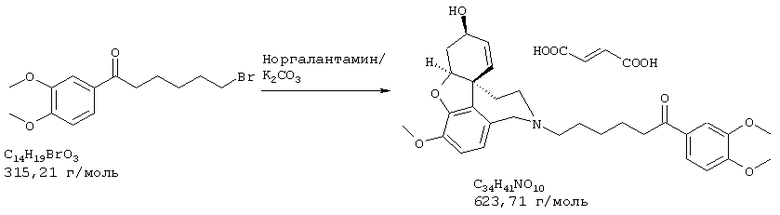
Норгалантамин (1,00 г, 3,66 ммоля), 6-бром-1-(3,4-диметоксифенил)-1-гексанон (1,15 г, 3,66 ммоля) и карбонат калия (безводный, свежеразмолотый, 1,15 г, 10,0 ммоля) в абсолютном ацетонитриле (15 мл) перемешивали 12 часов при температуре кипения. Остаток, полученный после удаления растворителя на роторном испарителе, очищали колоночной хроматографией (100 г силикагеля, хлороформ:метанол:аммиак = 96:3:1), получая продукт в виде светло-желтой пены (1,70 г, 91%). Превращение в фумарат осуществляли по стандартной методике.
Превращение в фумарат производили аналогично получению МТ-311 и МТ-407 и получали продукт в форме светло-желтых кристаллов с температурой плавления 88-94° С.
ТСХ: СНС13:МеОН:NН3=89:10:1, Rf=0,5
Микроэлементный анализ (JOS 1782):
C35H43NO10·0,5 H2O
Вычислено: С 65,00; Н 6,86; N 2,17.
Найдено: С 64,81; Н 6,64; N 2,09.
1H-ЯМР (ДМСО-d6): δ 7,61 (д, J=8,9 Гц, 1Н), 7,43 (с, 1H), 7,01 (д, J=8,9 Гц, 1Н), 6,81-6,66 (м, 2Н), 6,58 (с, 2Н), 6,11 (д, J=11 Гц, 1H), 5,82 (дд, J=11 Гц, J=5 Гц, 1Н), 4,61-4,33 (м, 2Н), 4,20-3,92 (м, 2Н), 3,84 (с, 3Н), 3,80 (с, 3Н), 3,72 (с, 3Н), 3,62-3,12 (м, 2Н), 3,10-2,81 (м, 2Н), 2,78-2,43 (м, 3Н), 2,39-1,86 (м, 5Н), 1,78-1,40 (м, 5Н), 1,38-1,14 (м, 2Н);
13С-ЯМР (ДМСО-d6): δ 198,5 (с), 167,2 (с), 153,0 (с), 148,6 (с), 146,3 (с), 144,2 (с), 134,6 (д), 132,9 (с), 129,7 (с), 129,0 (с), 126,2 (д), 124,0 (д), 122,7 (д), 122,1 (д), 111,7 (д), 110,9 (д), 110,2 (д), 86,6 (д), 65,0 (д), 59,8 (кв), 55,8 (кв), 55,5 (кв), 50,8 (т), 50,4 (т), 47,3 (с), 37,2 (т), 31,9 (т), 31,0 (т), 26,1 (т), 24,7 (т), 23,8 (т), 15,2 (т).
Экспериментальные данные по определению максимальной толерантной дозы (МТД) в мг/кг, полученные в эксперименте на мышах при пероральном (р.о.) и внутрибрюшинном (i.p.) введении, приведены в таблице 4 (см. в конце текста описания).
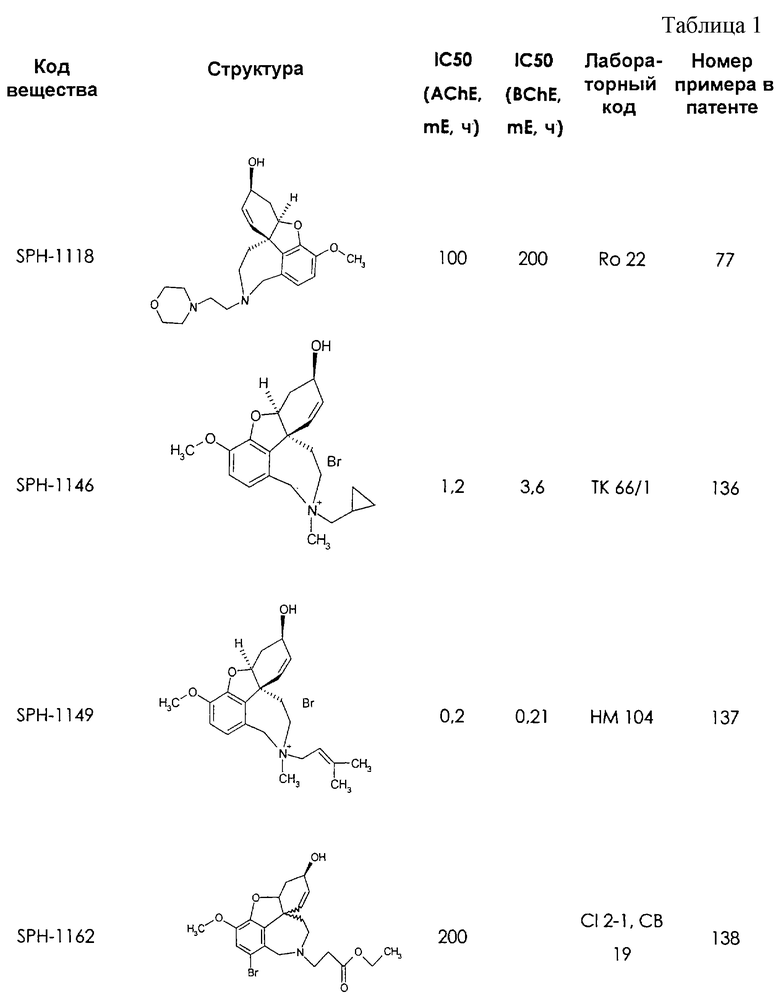
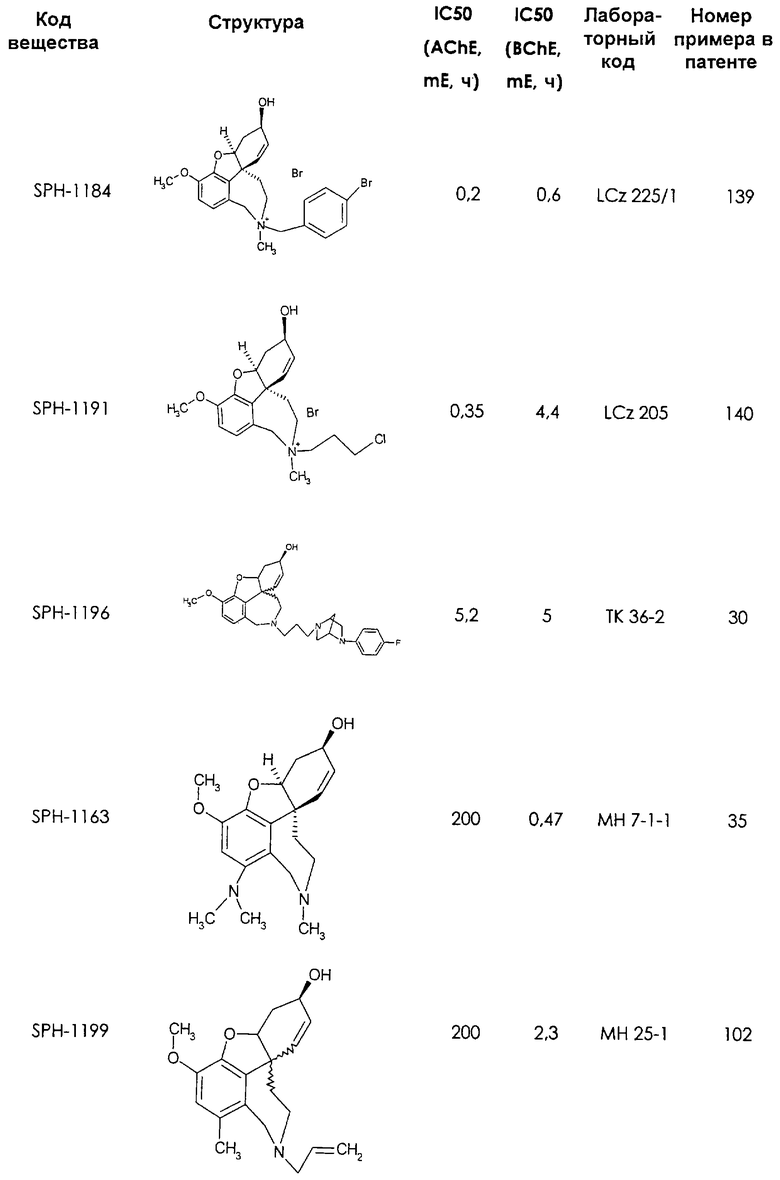
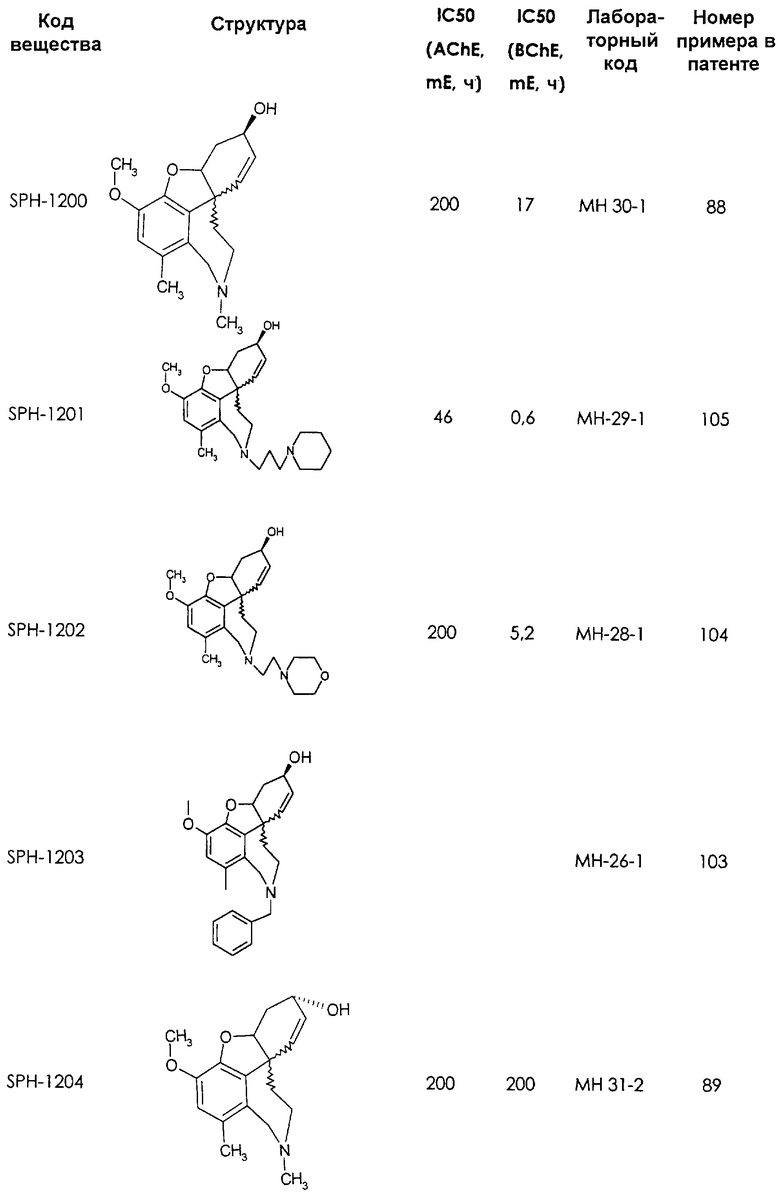
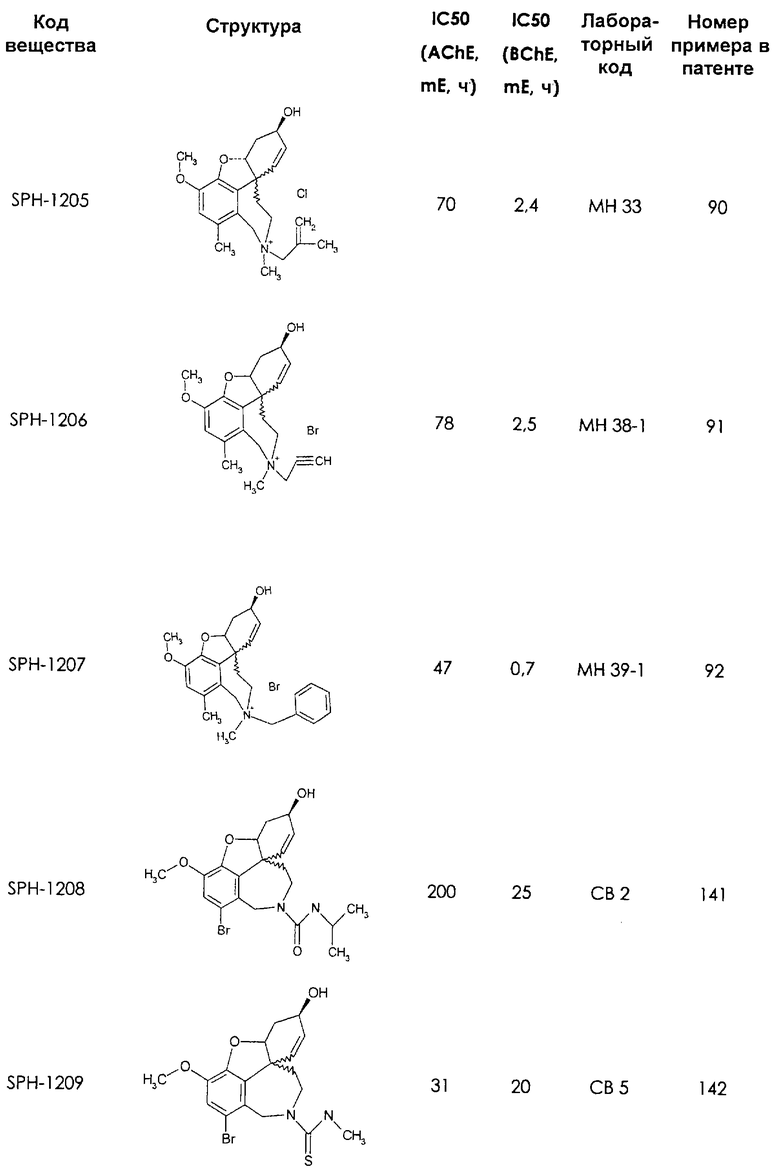
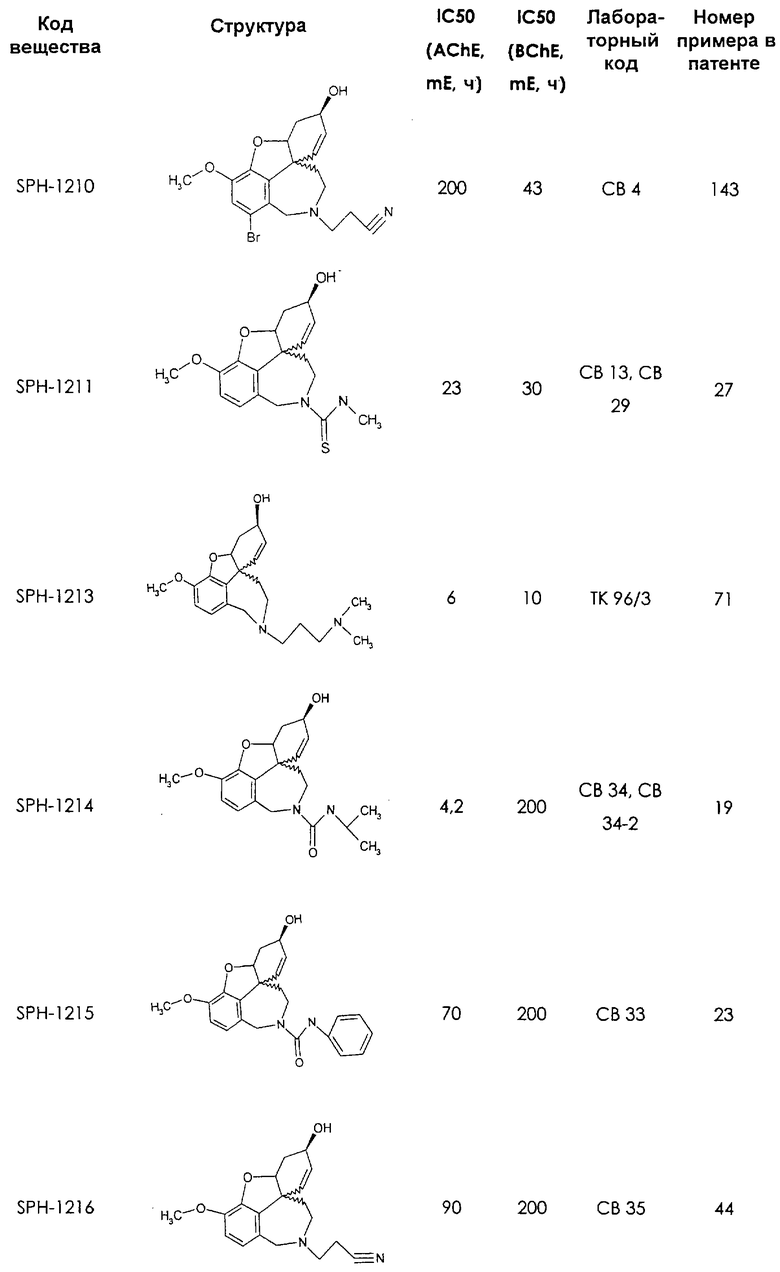
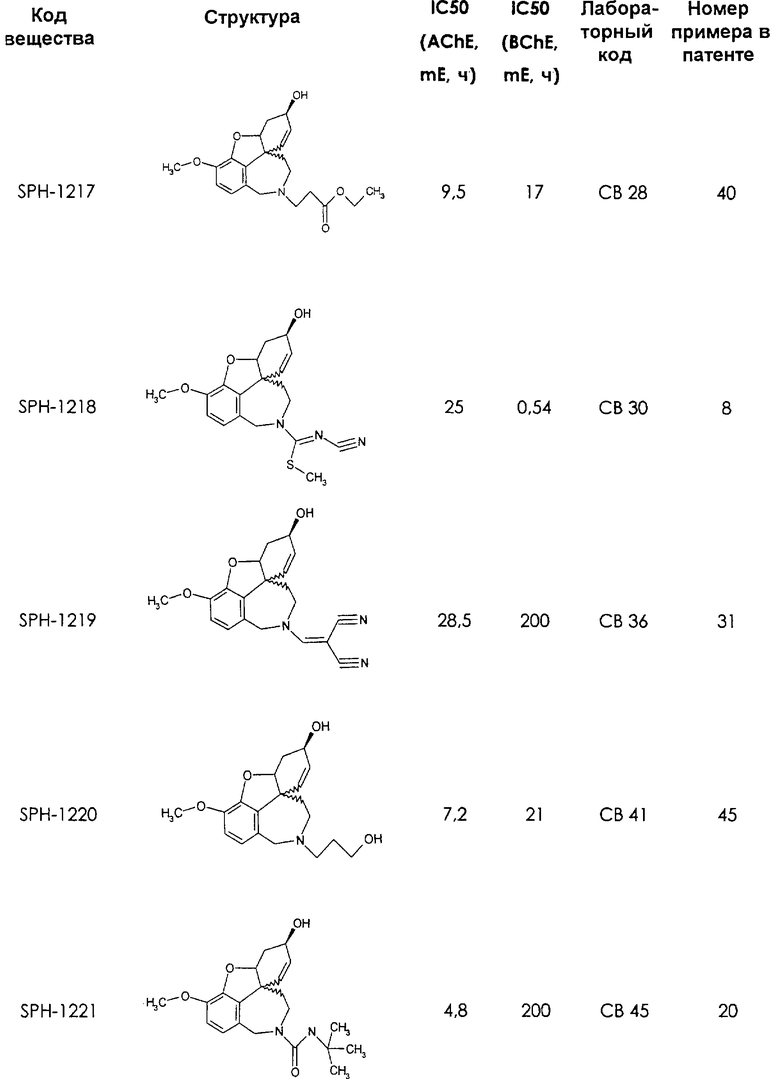
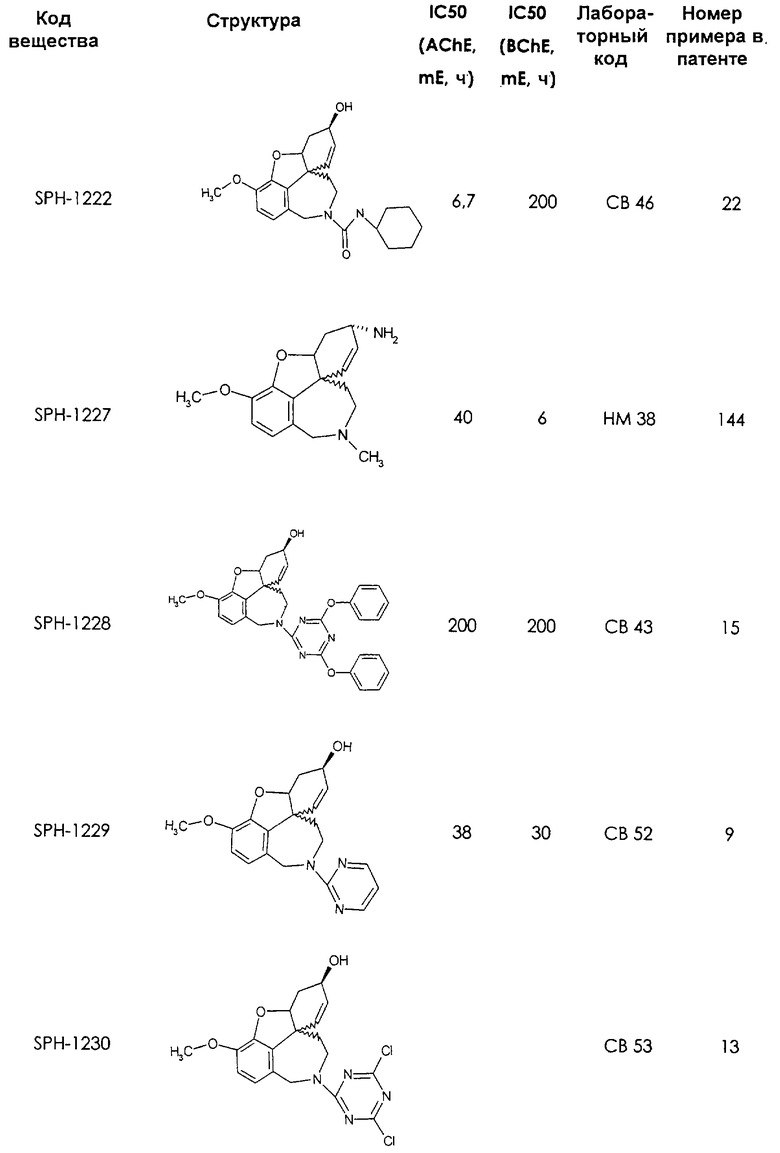
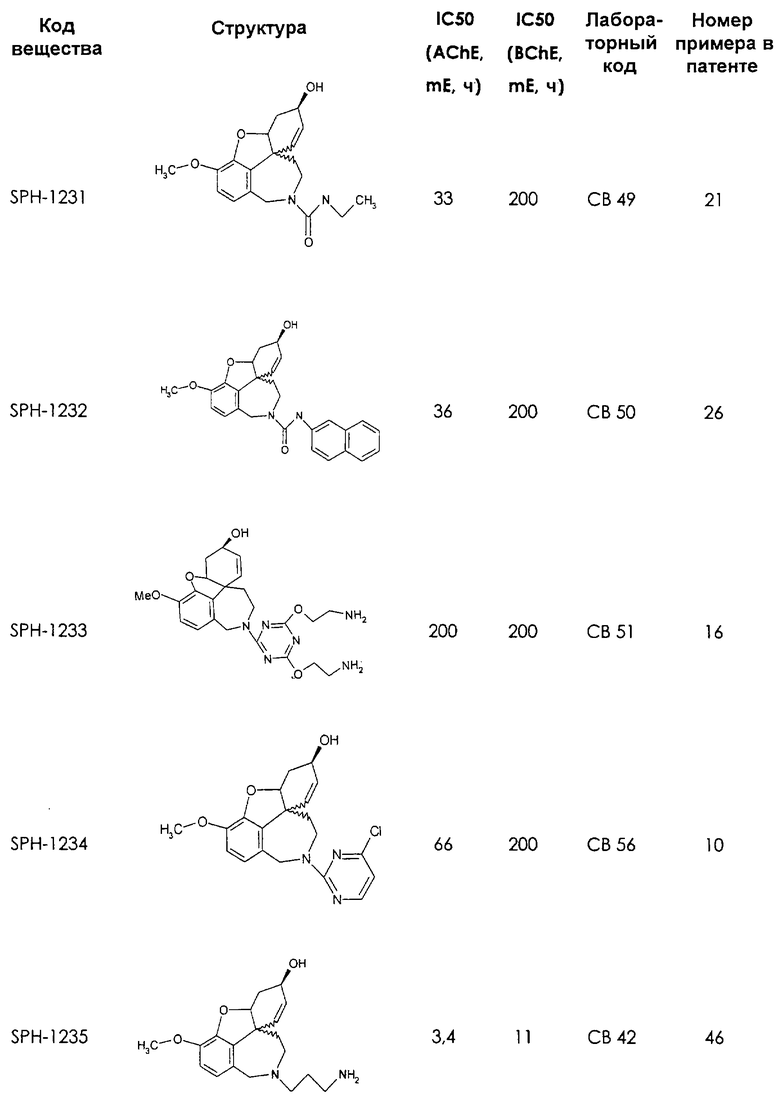
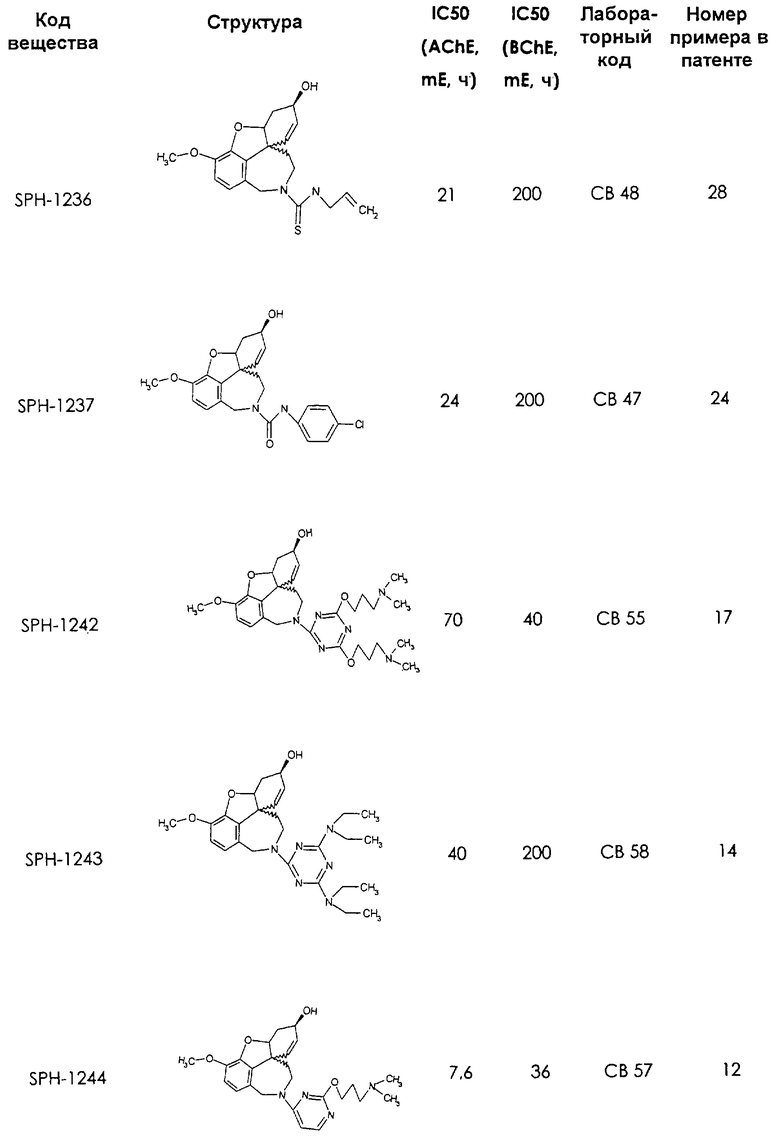
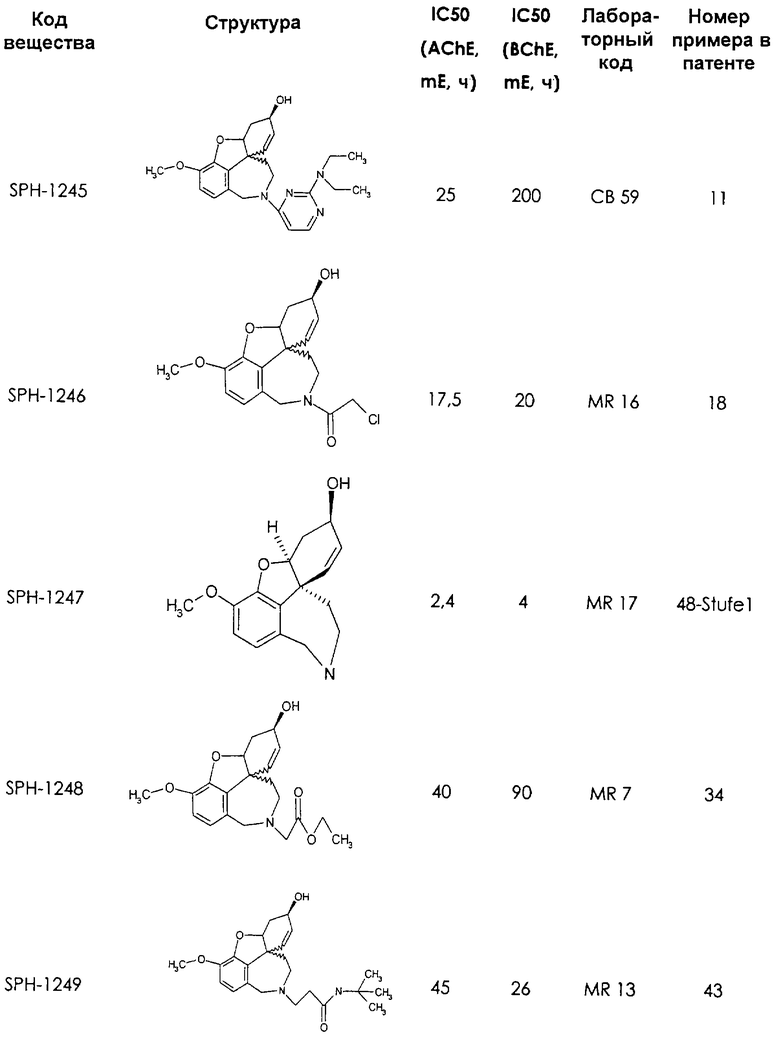
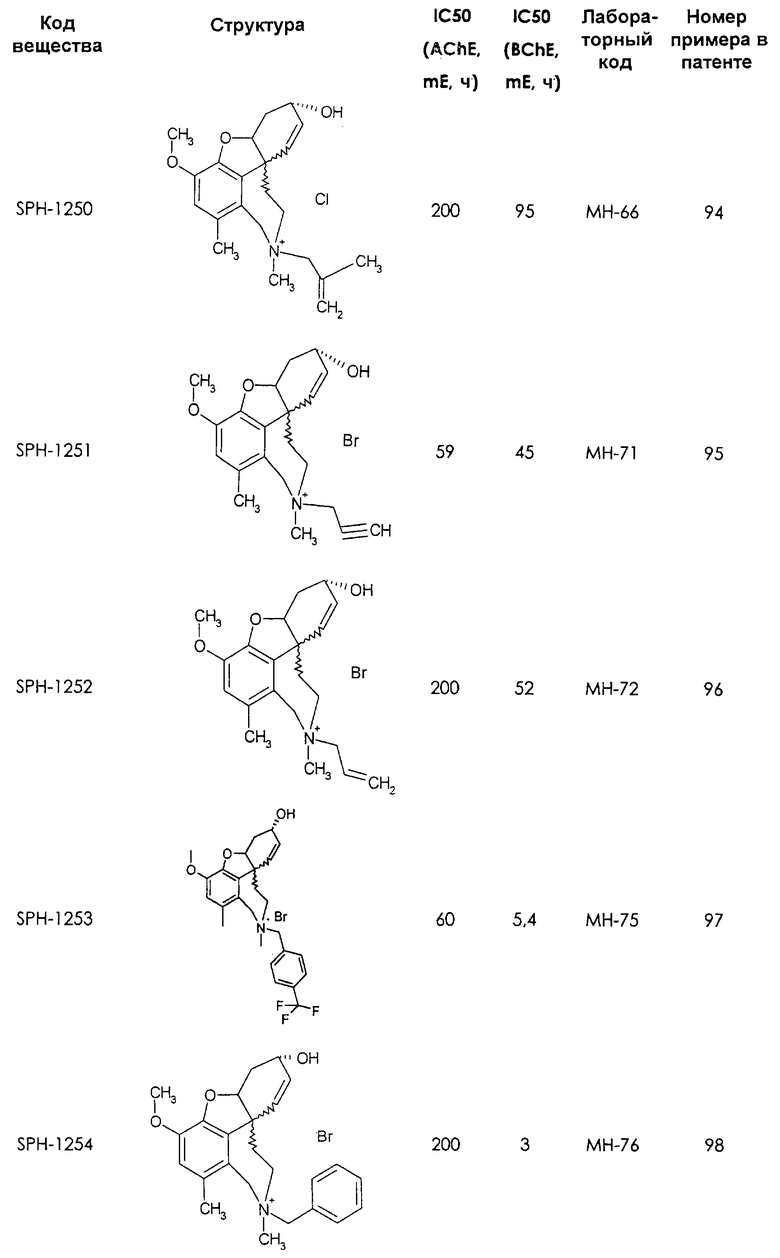
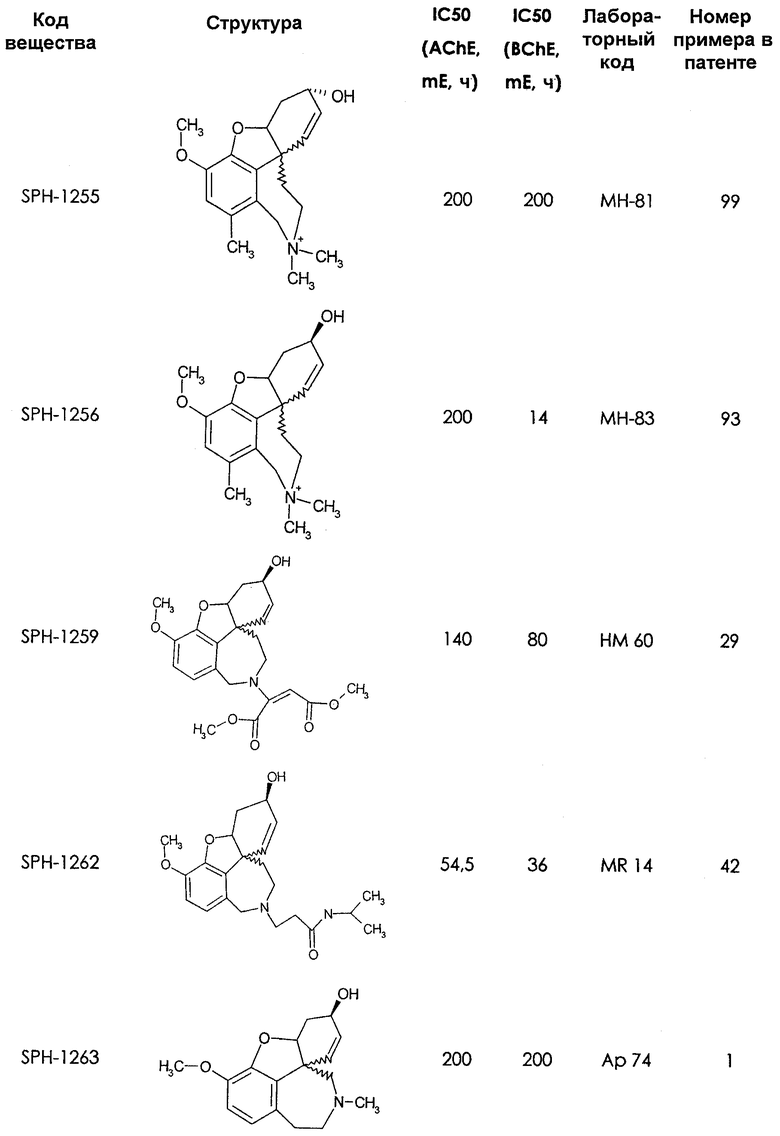
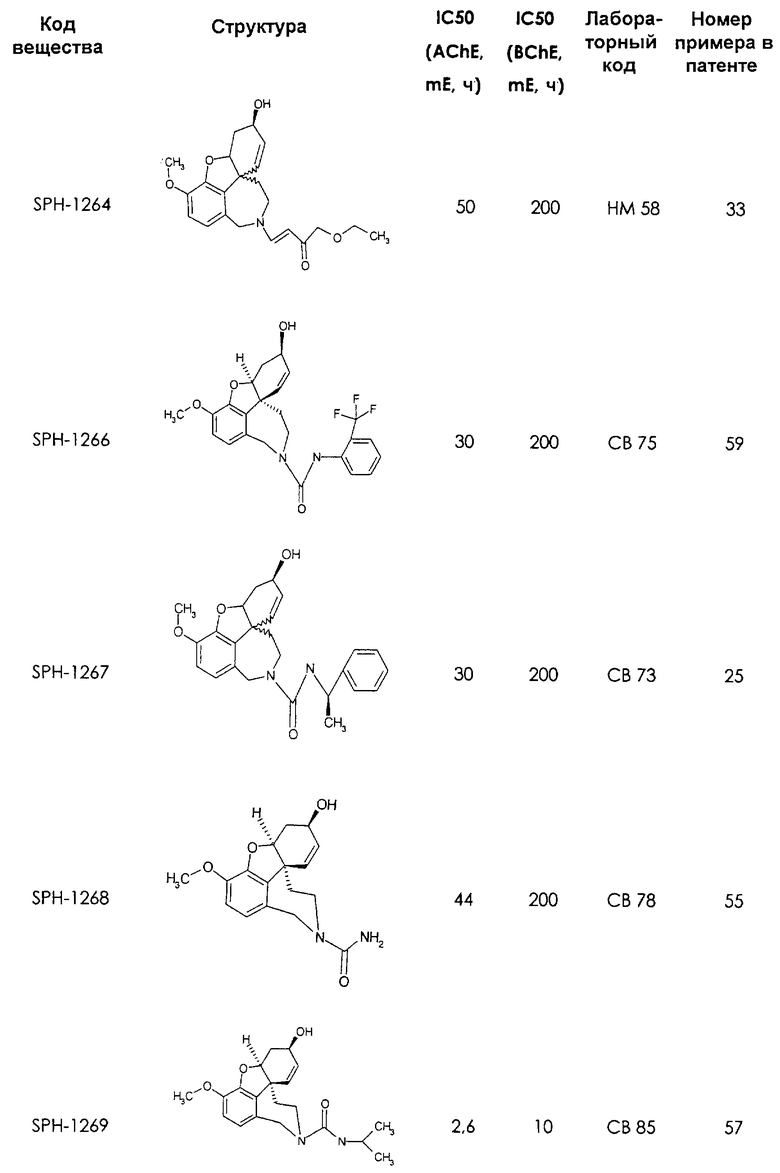
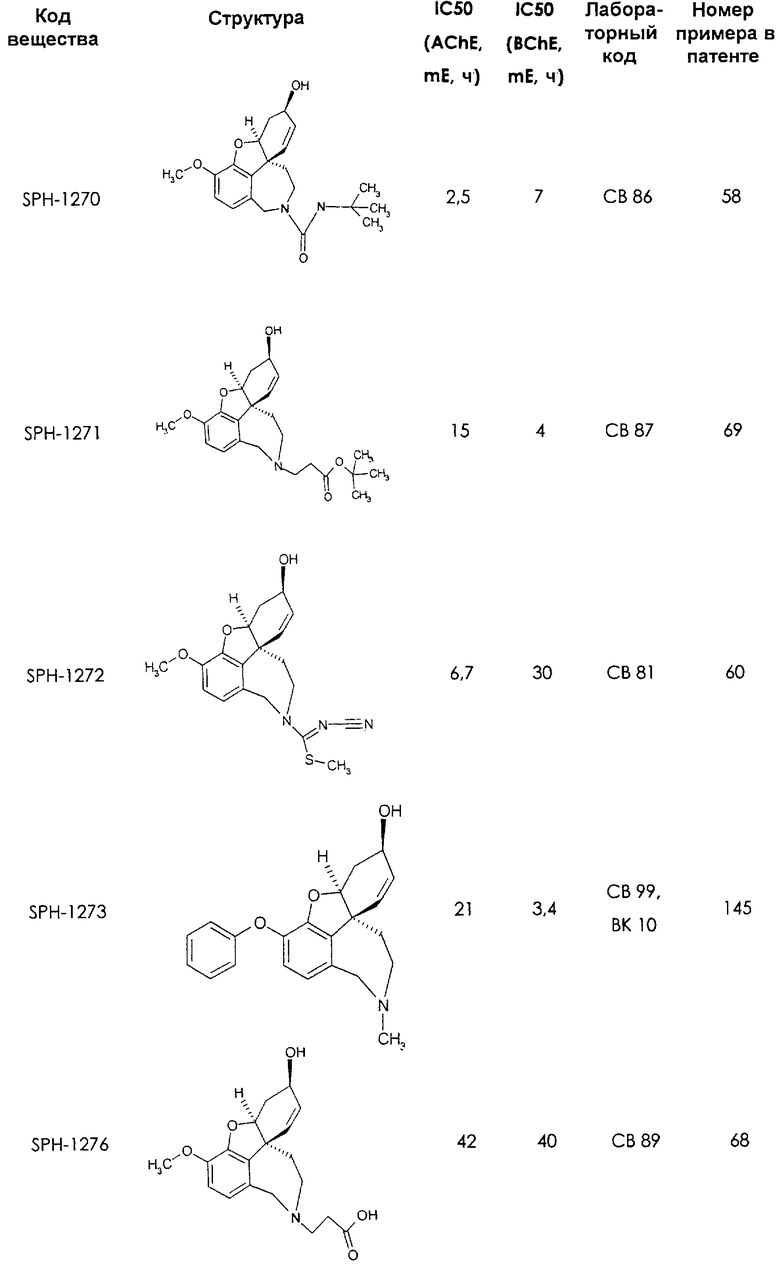
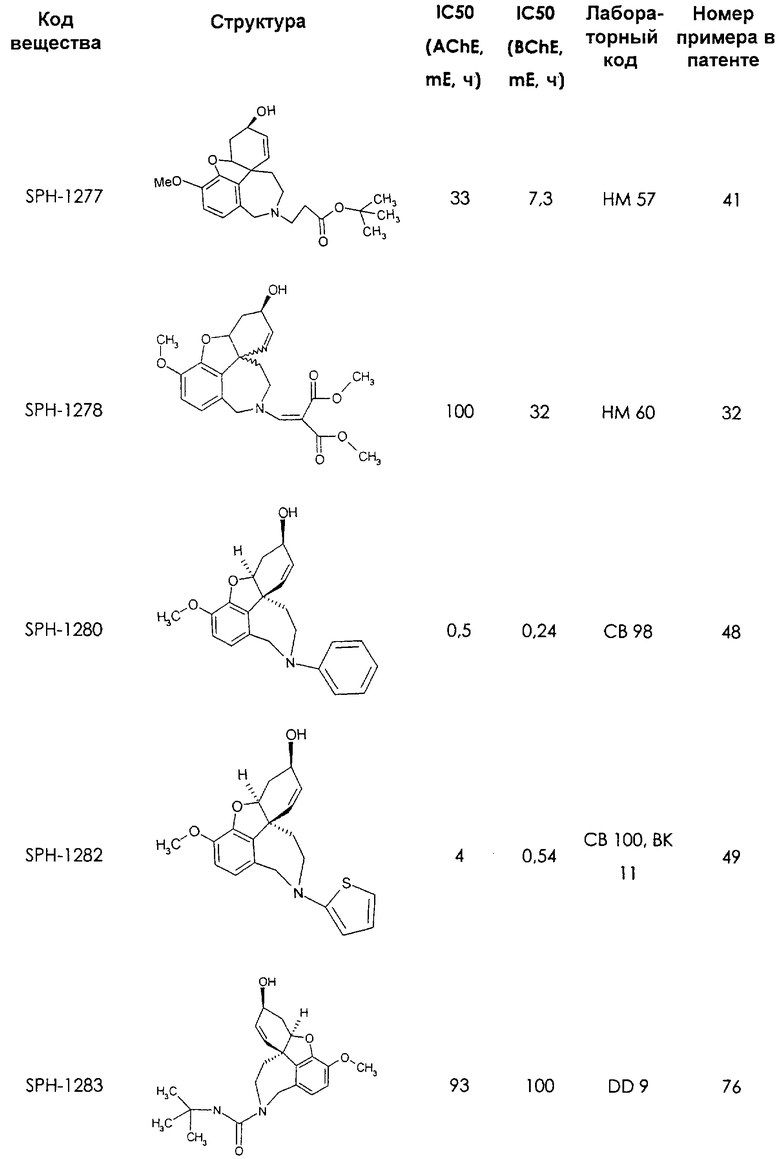
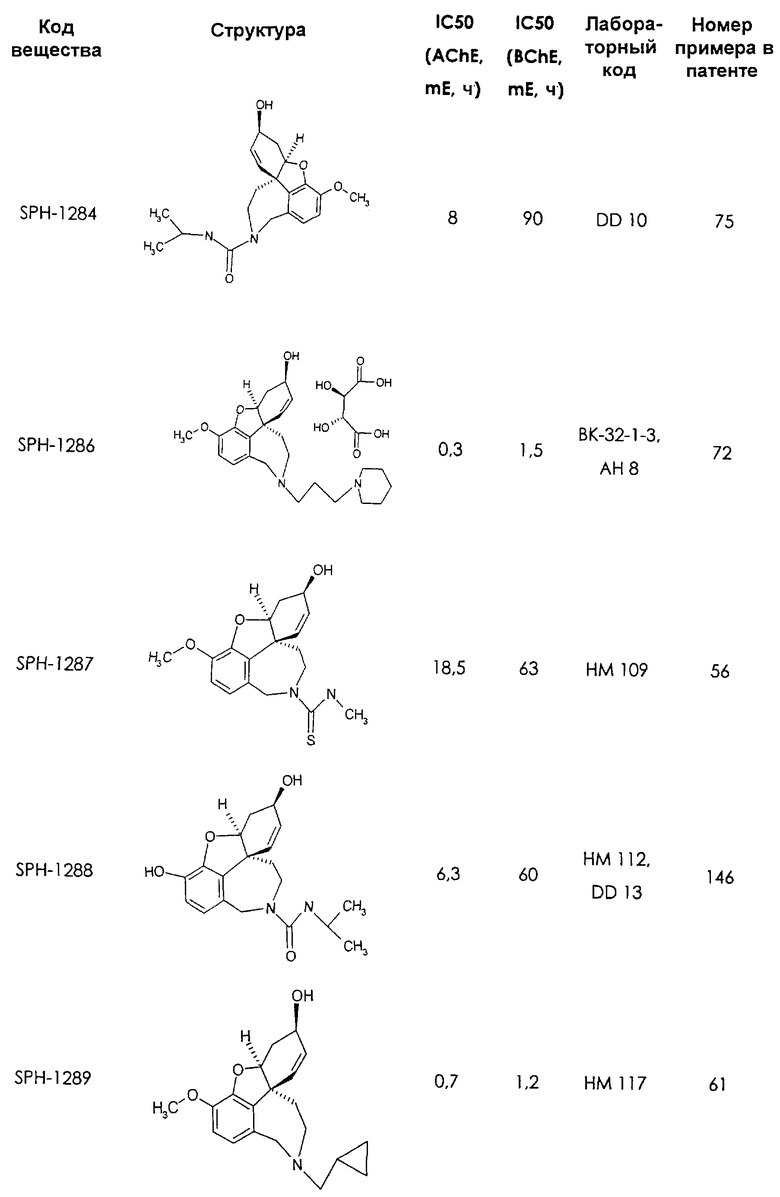
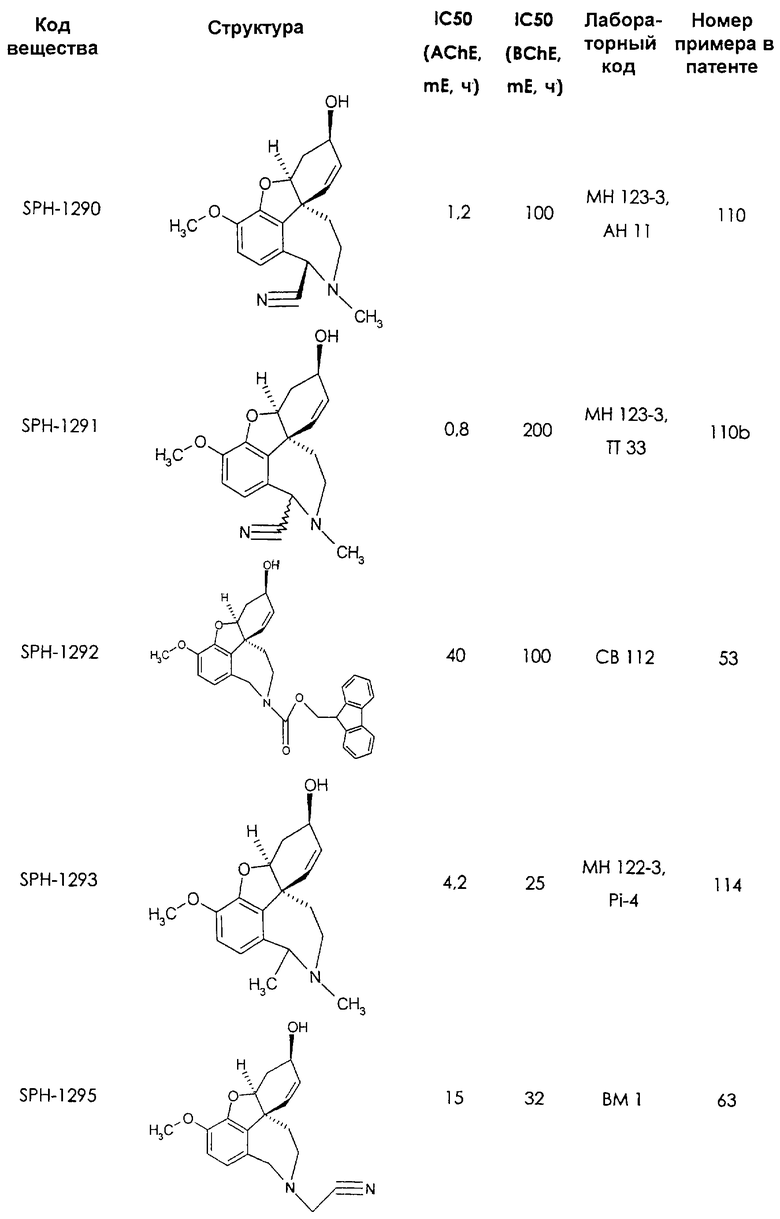
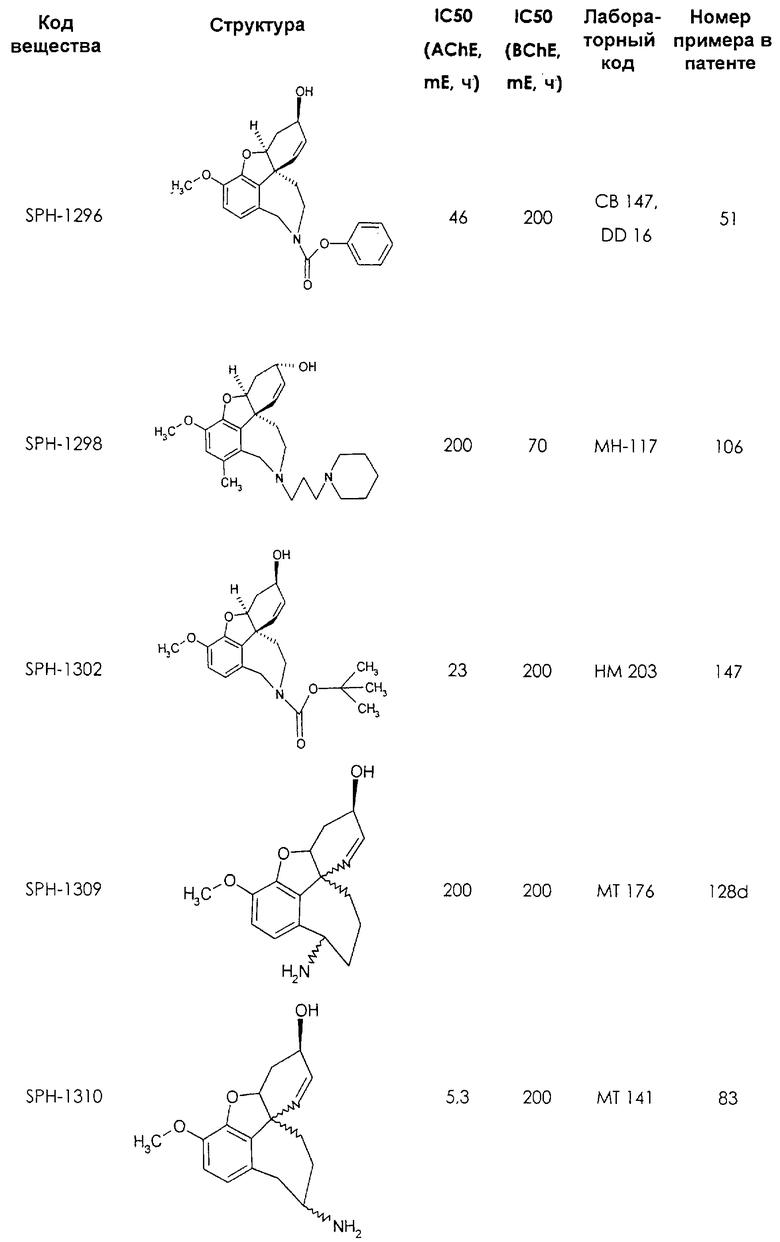
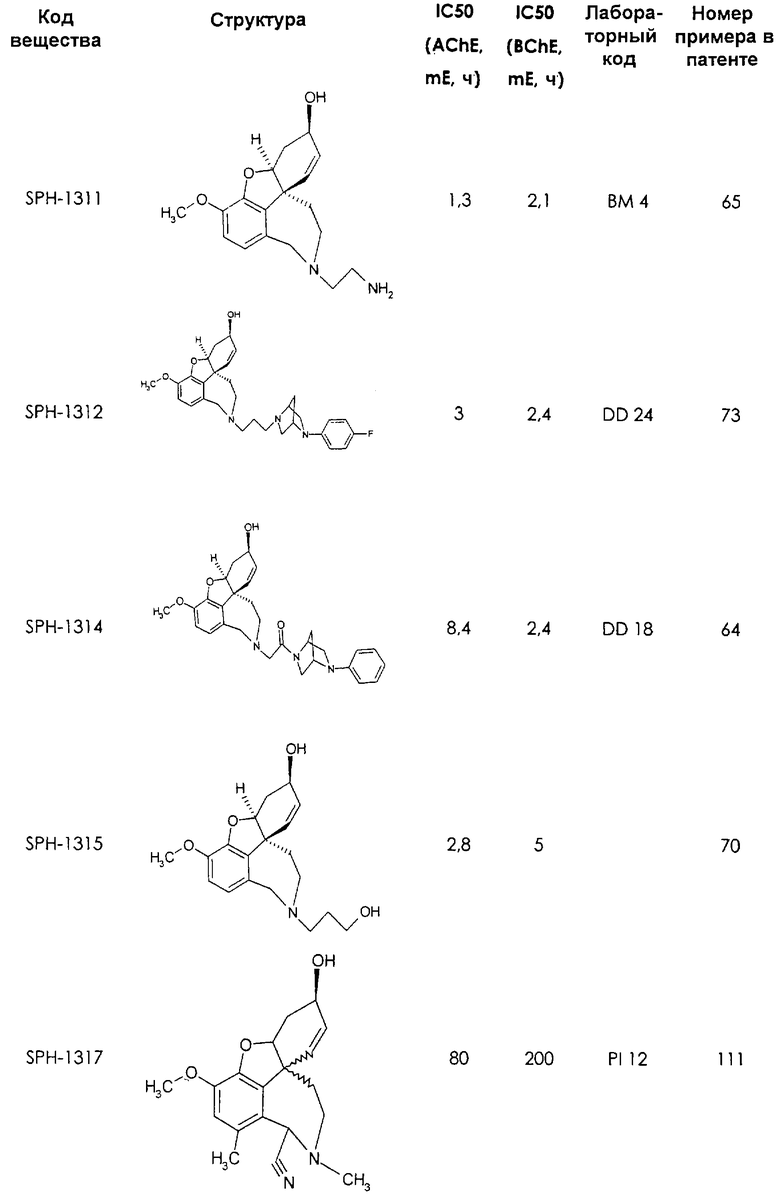
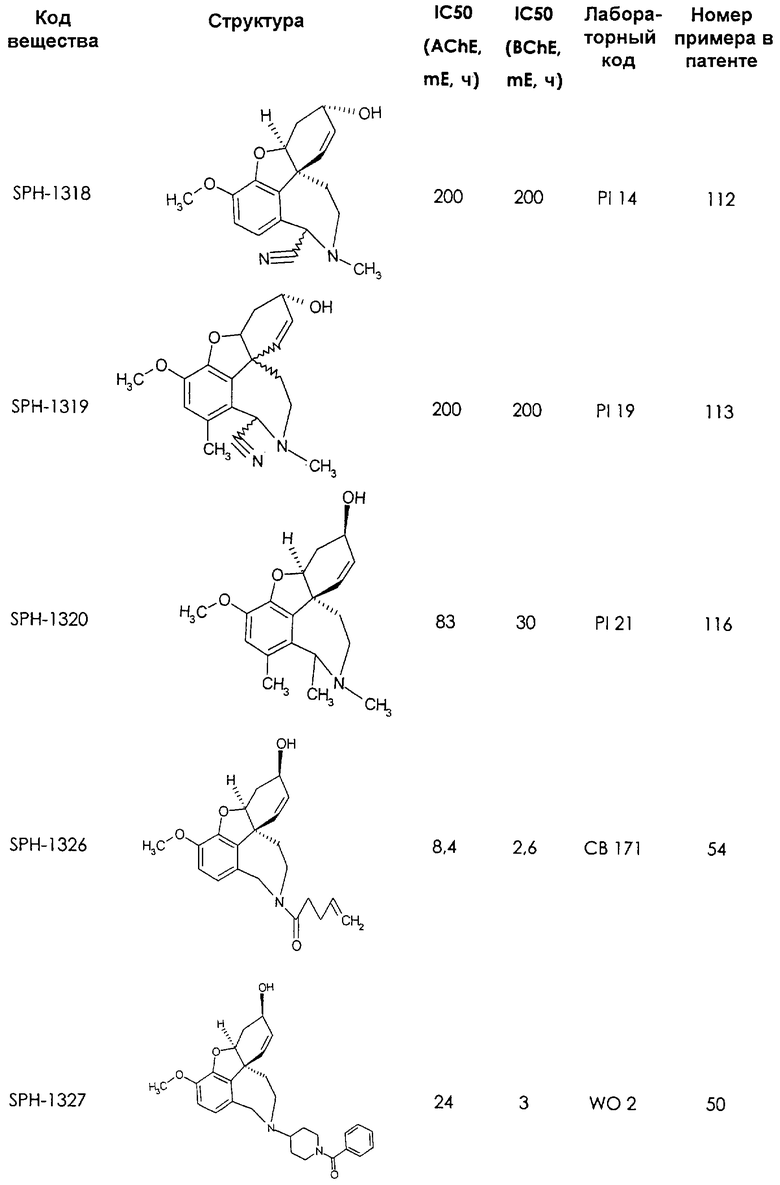
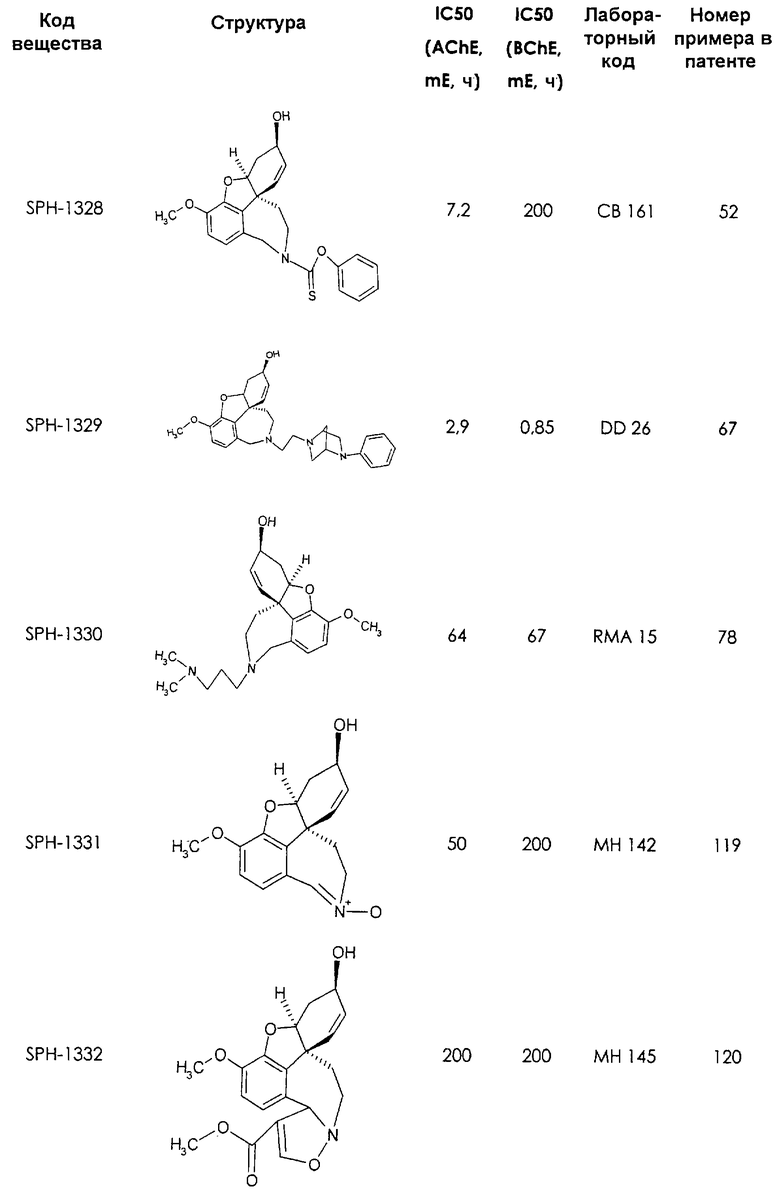
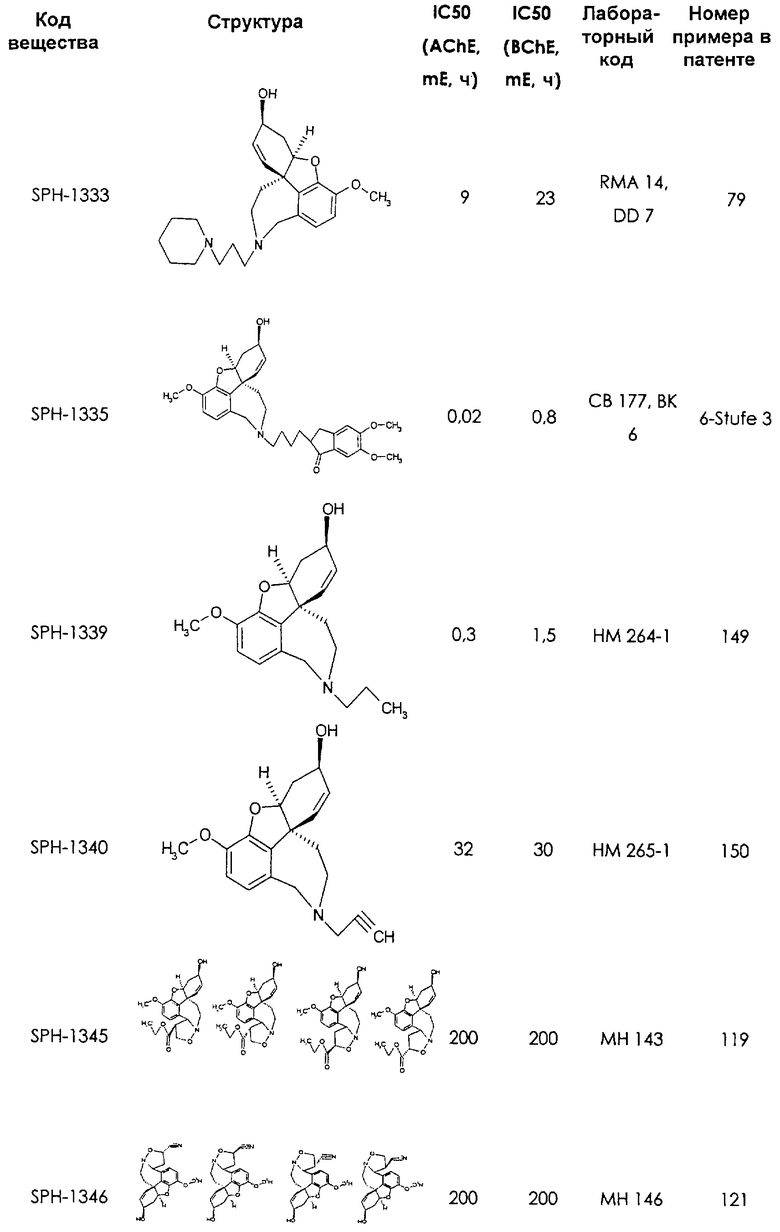
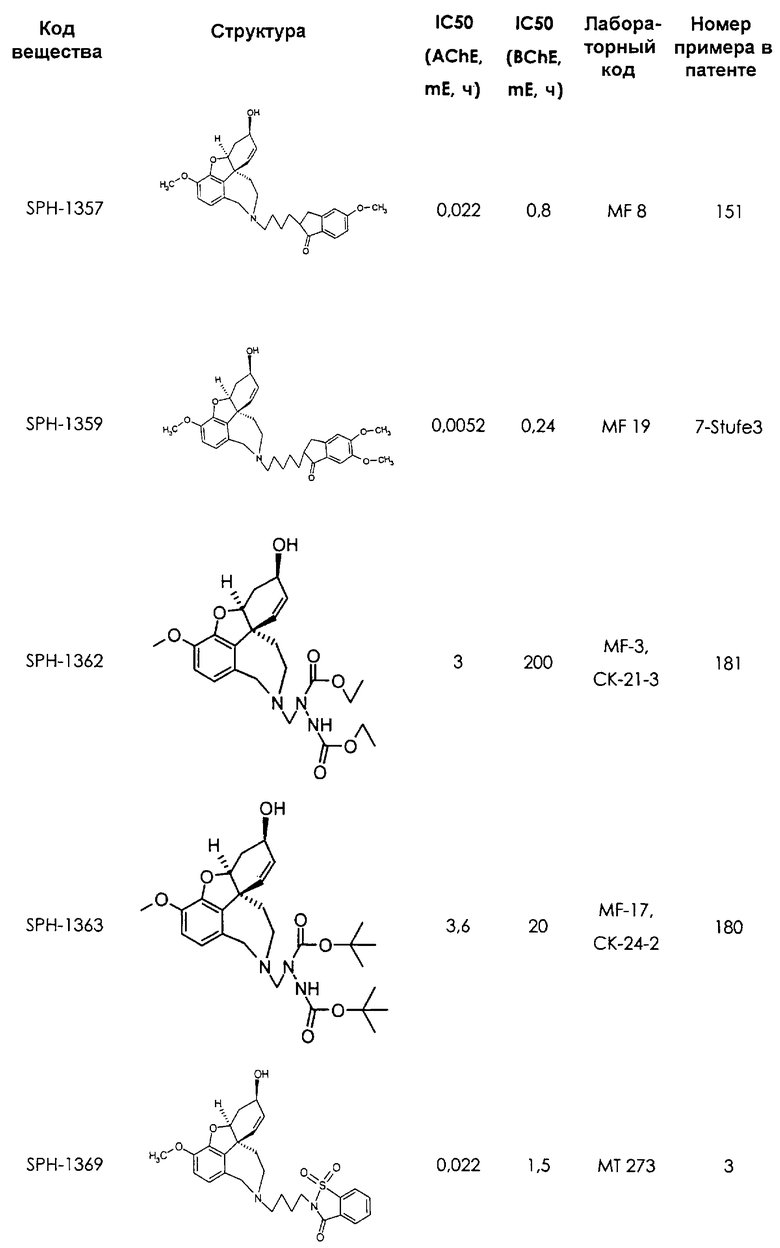
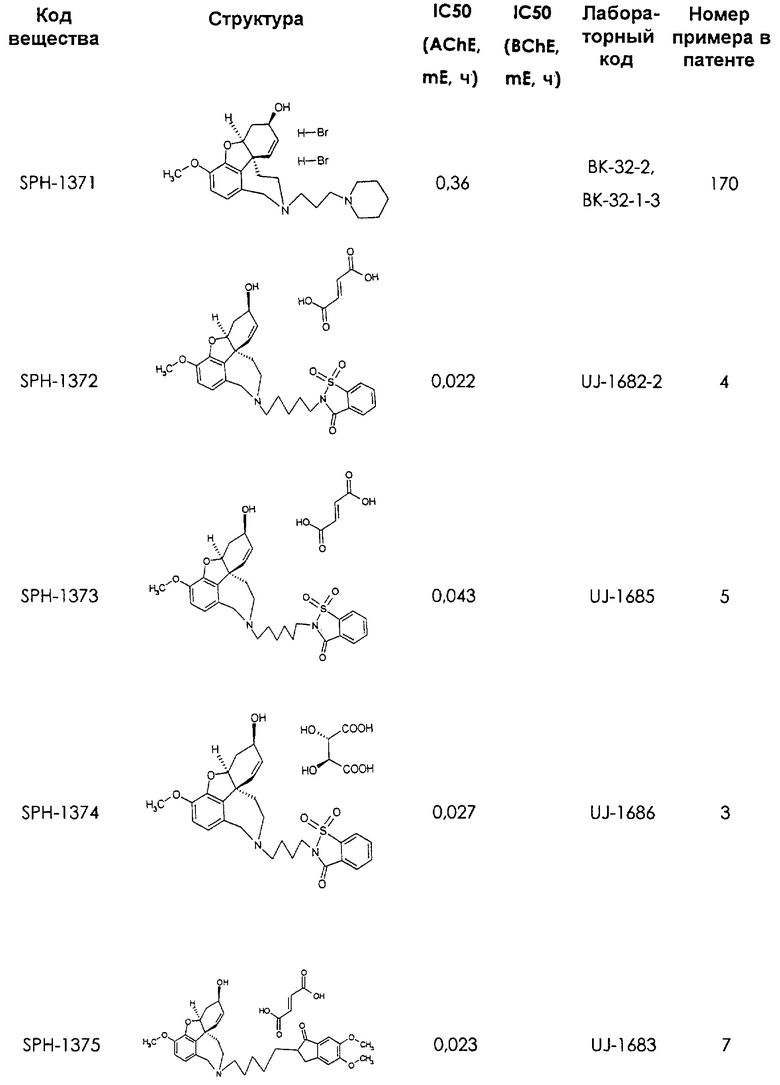
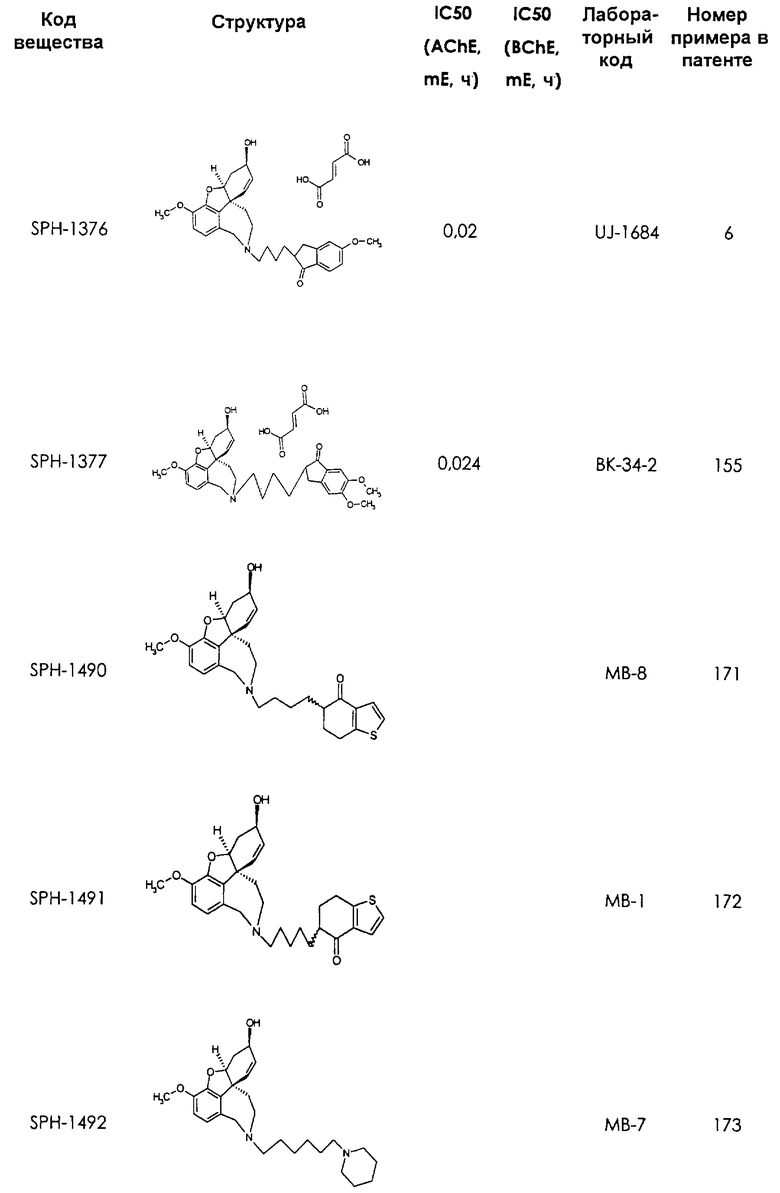
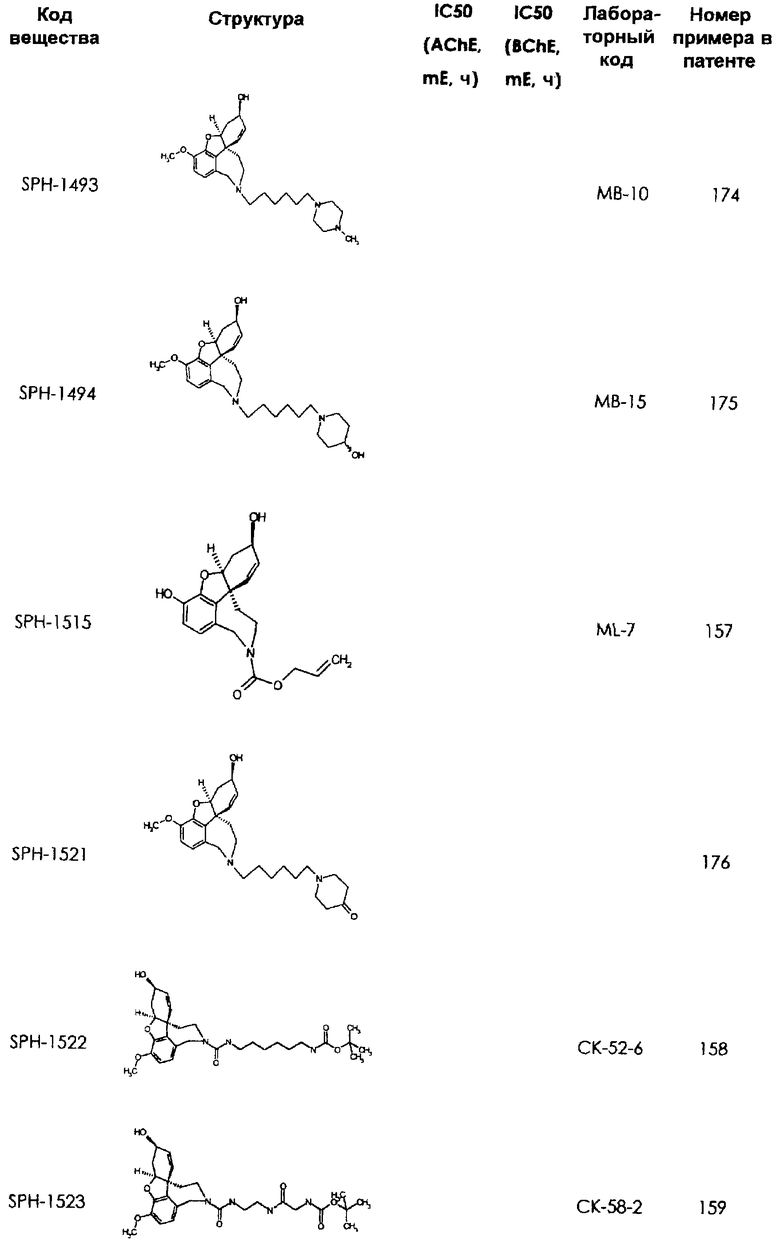
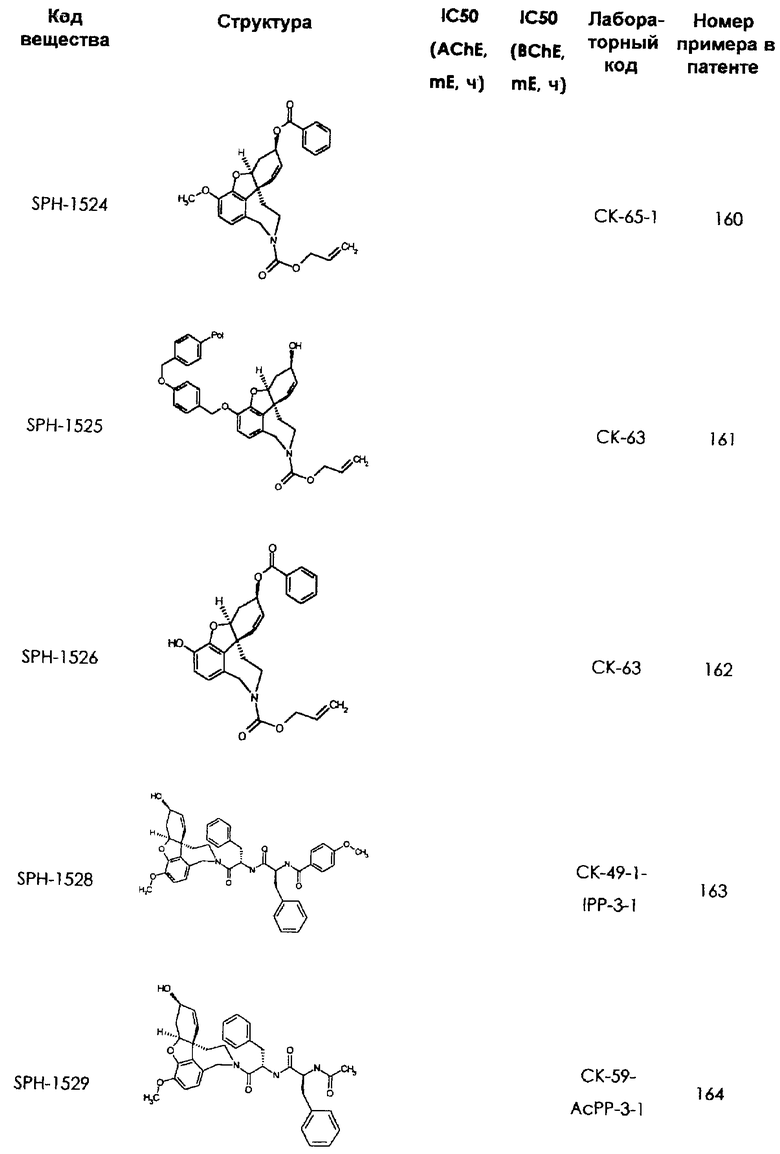
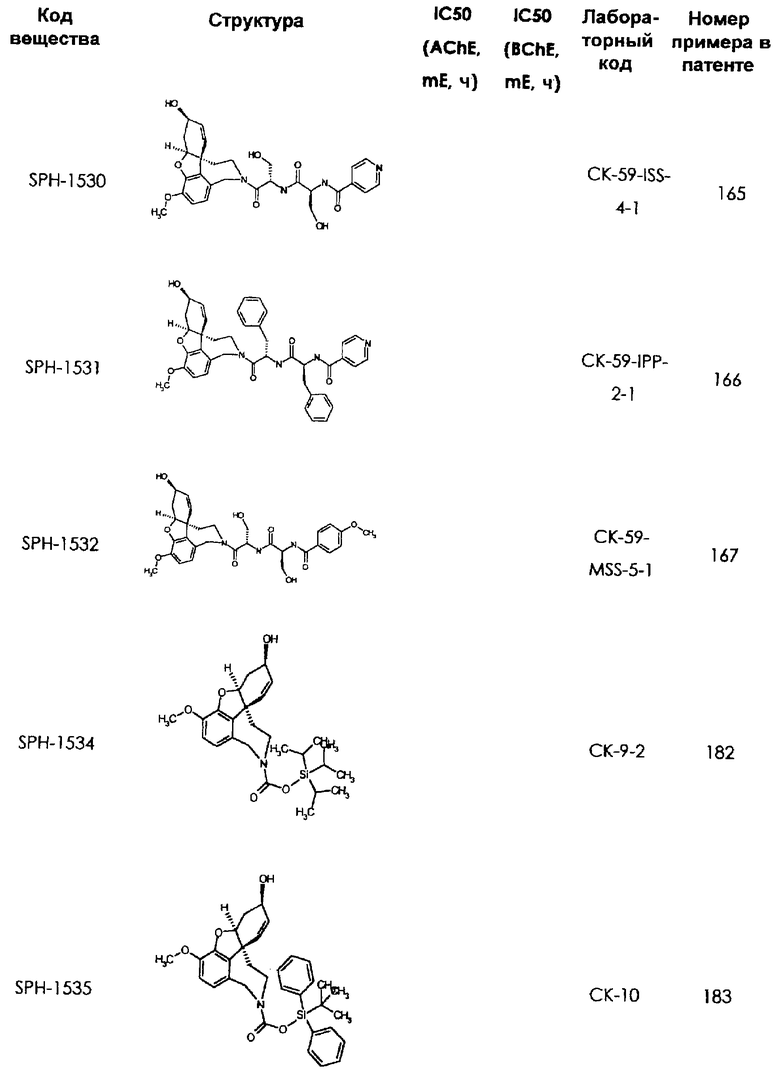
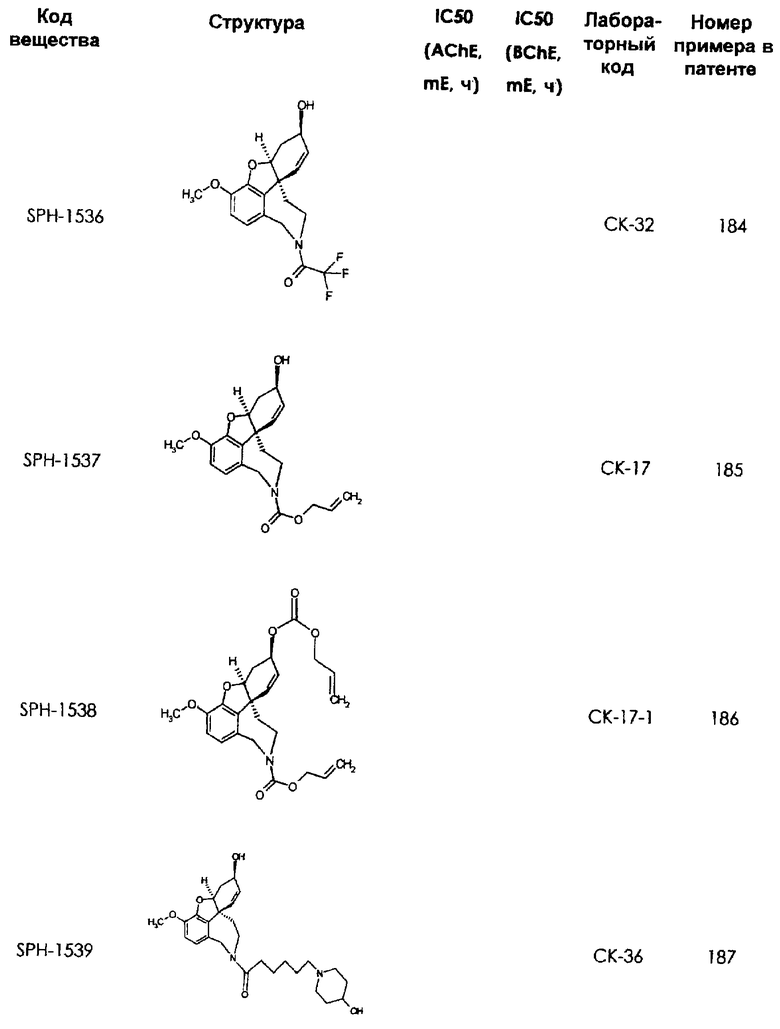
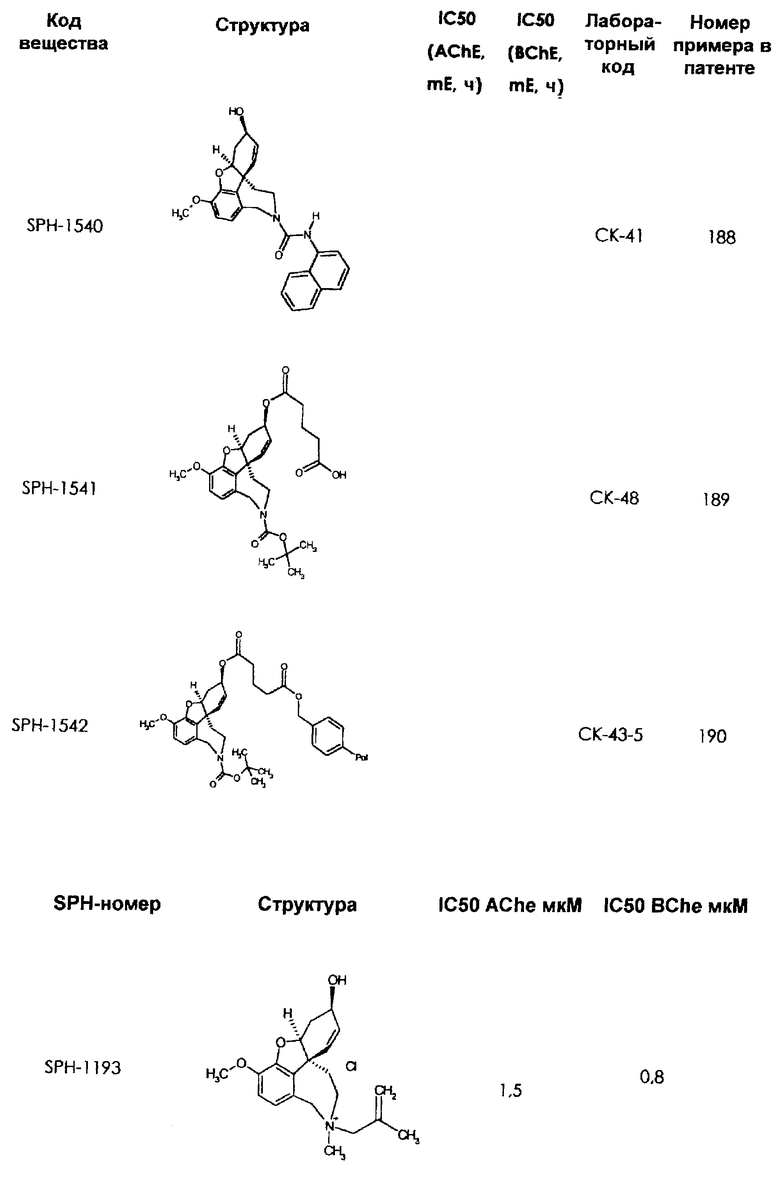
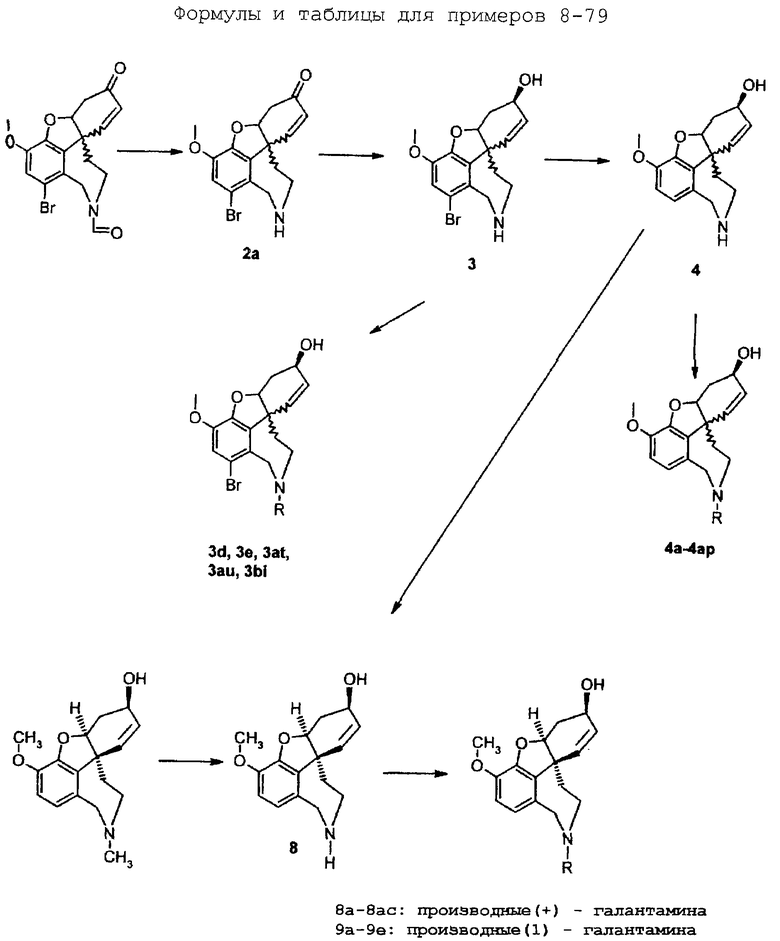




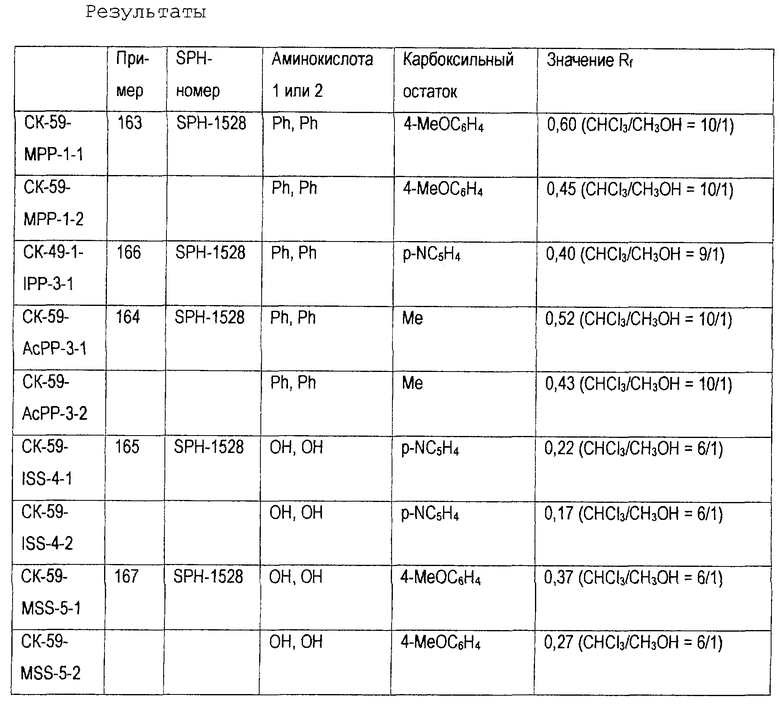
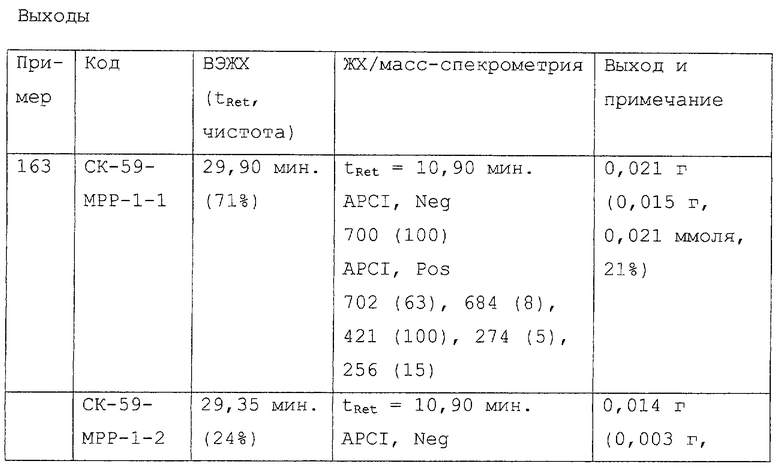
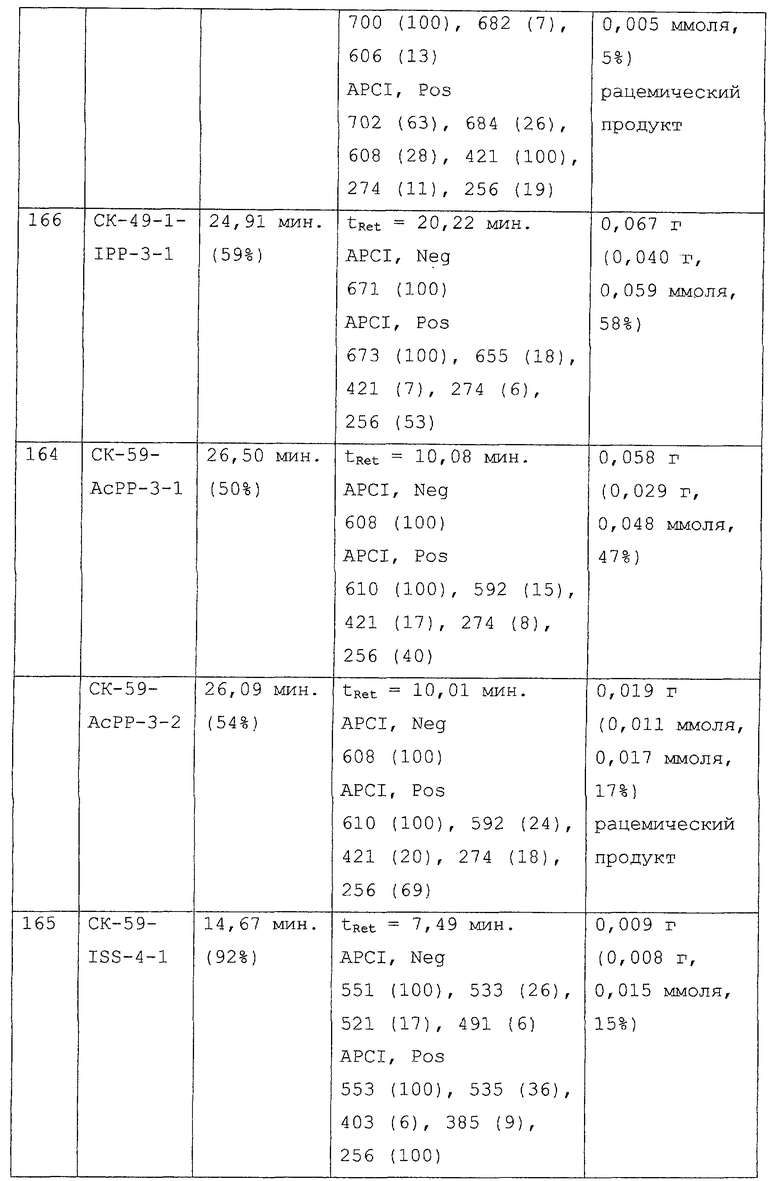
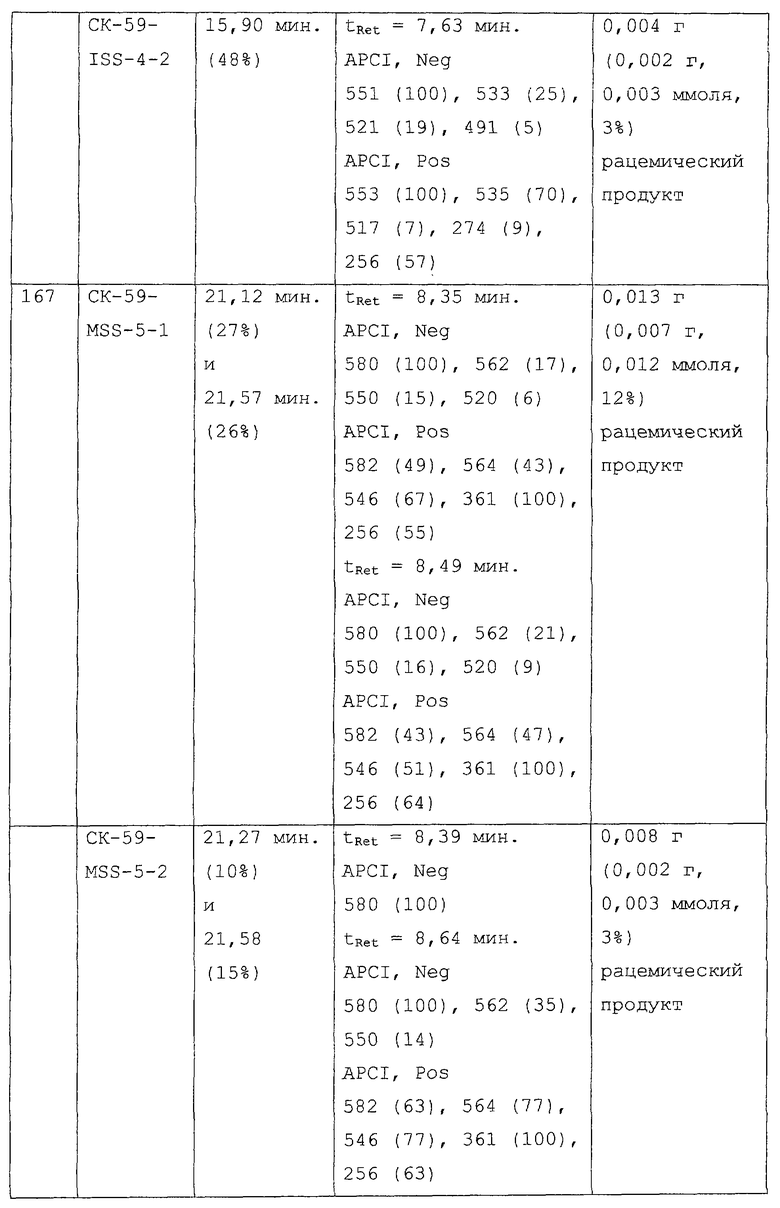
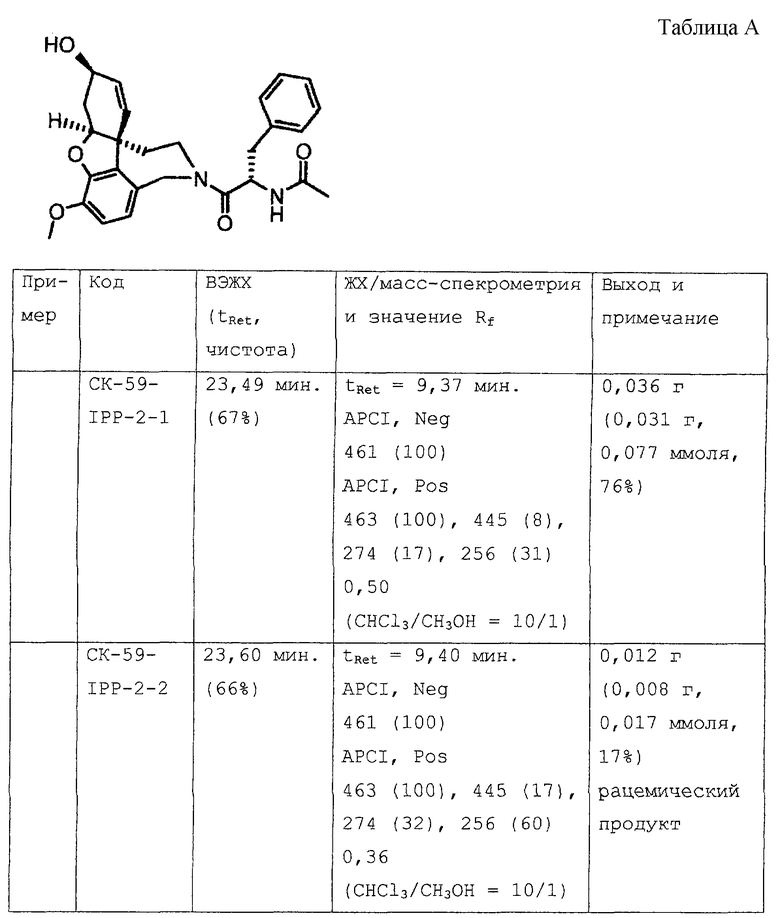

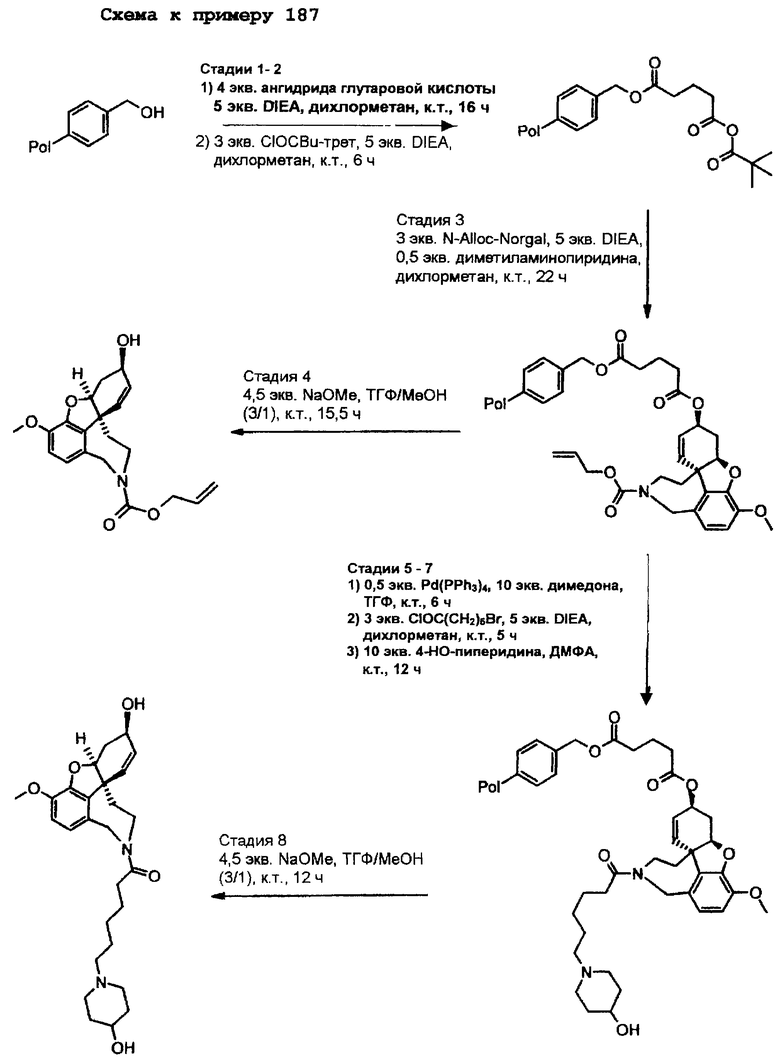
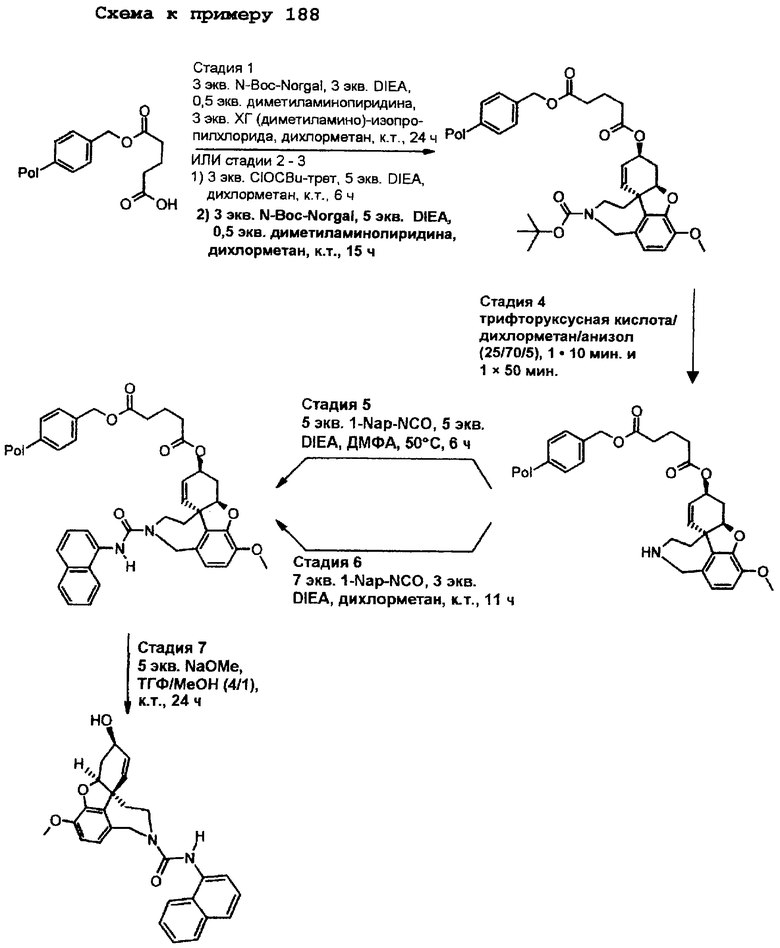
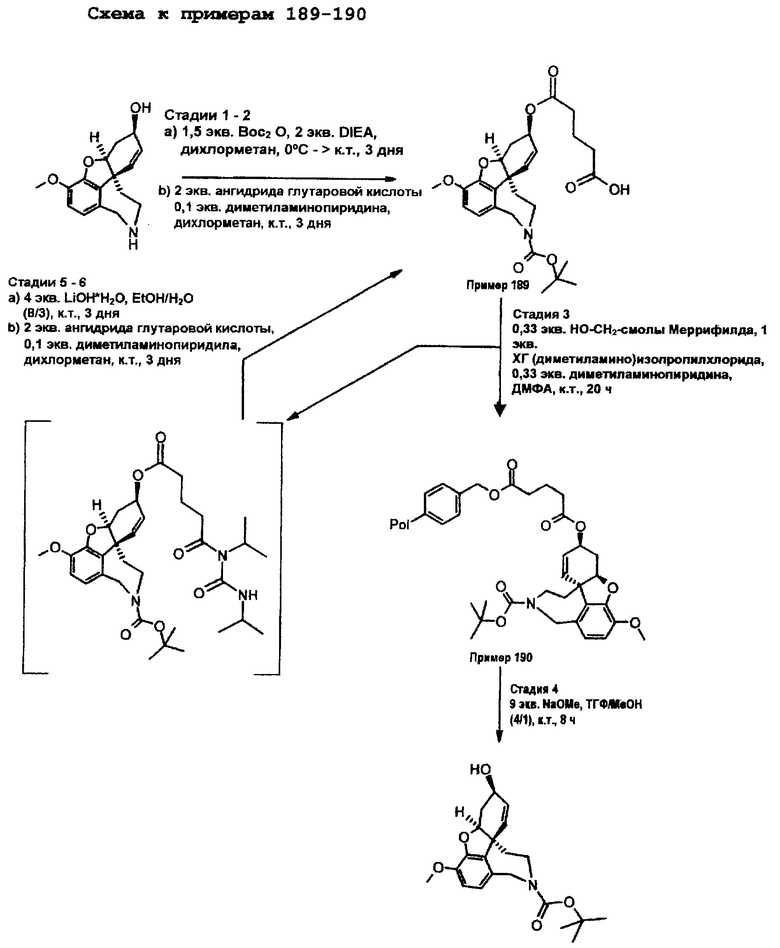
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,4,5-ТРИ(МЕТОКСИФЕНИЛ) ЦИС-ИМИДАЗОЛИН И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730497C1 |
| ПРОИЗВОДНЫЕ ТРИЦИКЛИЧЕСКОГО ТРИАЗОЛОБЕНЗАЗЕПИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1998 |
|
RU2198885C2 |
| Производные 2,3-дигидро-1Н-индола, обладающие свойствами лигандов мелатониновых рецепторов, способ получения и применение | 2017 |
|
RU2692239C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЁННЫХ 1,2,4-ТРИАЗОЛ-3-КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ ИЗ УНИВЕРСАЛЬНОГО ПРЕДШЕСТВЕННИКА | 2015 |
|
RU2605414C1 |
| Способ получения (6R,7S,7aS)-6-((R)-1-(3,5-бис(трифторметил)фенил)этокси)-7-(4-фторфенил)гексагидро-3Н-пирролизин-3-она | 2022 |
|
RU2789599C1 |
| БИЦИКЛИЧЕСКИЕ АГОНИСТЫ ВАЗОПРЕССИНА | 2000 |
|
RU2254332C2 |
| МОДУЛЯТОРЫ 5HT РЕЦЕПТОРА | 2003 |
|
RU2317982C2 |
| Спироконденсированные производные 2,3-дигидроиндола, их применение в офтальмологии | 2017 |
|
RU2712039C2 |
| АМИНОБЕНЗОФЕНОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КОЖИ | 1998 |
|
RU2200153C2 |
| ИНДОЛИН-СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2402530C2 |
Изобретение относится к новым производным галантамина общей формулы I:
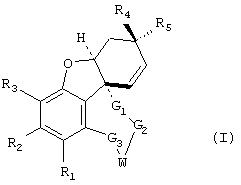
где R1-R5, G1-G3 и W имеют значения, указанные в формуле изобретения, а также изобретение относится к способу получения этих соединений, лекарственному средству на их основе и способу его получения. Соединения формулы I и лекарственное средство на их основе обладают ингибирующим действием в отношении холинэстеразы и предназначены для лечения различных заболеваний. Технический результат - получение новых соединений, обладающих ценным биологически активным действием. 7 н. и 23 з.п. ф-лы, 5 табл.
где заместители имеют следующие значения:
A) R1 и R2 являются одинаковыми или различными и означают
Аа) водород, F, Cl, Br, J, CN, NC, ОН, SH, NO2, SО3Н, РО3Н, NH2, СF3, OSO2(СН2)nСF3, где n = 0, 1 или 2, -ОSО2-арил, -винил или -этинил;
Аb) низшую (C1-С6) в случае необходимости разветвленную алкильную, аралкильную, алкокси-, аралкокси-, пиклоалкильную или циклоалкоксигрулпу;
Ас) аминогруппу, в случае необходимости замещенную одной или двумя одинаковыми или различными низшими (C1-C6)-группами, в случае необходимости разветвленными алкильными, аралкильными или алкилкарбонильными, аралкилкарбонильными или алкоксикарбонильными, аралкоксикарбонильными группами, или замещенную группой, выбранной из пирролидинового, пиперидинового, морфолинового, тиоморфолинового, пиперазинового или гомопиперазинового остатков;
Ad) -COOH, -СОО-алкил-, -СОО-аралкил-, СО-аминогруппу, которая в случае необходимости замещена, как указано в Ас ), или СОН-алкильную или СОН-аралкильную группу;
Ае) -(СН2)nХ (где Х = Br, Cl, F или J), -(СН2)nОН-, -(CH2)nCHO-, -(СН2)nСООН-, -(CH2)nCN-, -(CH2)nNC-, -(СН2)nСО-алкил- или -(СH2)nСО-арильную группу, где n = 1-4;
Af) -(СН2)nвинил-, -(СН2)nэтинил-, -(СН2)nциклоалкильную группу, где n = 0, 1 или 2 и циклоалкил является алифатическим кольцом с 3 до 7 С-атомов;
Аg) замещенную С3-С6-алкенильную группу (в случае необходимости замещенную Н, F, Br, Cl, CN, СO2-алкилом, СО-алкилом, СО-арилом);
Ah) замещенную С3-С6-алкинильную группу (в случае необходимости замещенную Н, F, Br, Cl, CN, СO2-алкилом, СО-алкилом, СО-арилом); или
Ai) R1 и R2 вместе означают -СН=СН-СН=СН-, -O(CH2)nO- (n = от 1 до 3), -CH=CHA1- (A1 означает NH, О или S) или -CH2-CH2-A1- (A1 означает NH, О или S);
B) R3 имеет те же значения, что и R1, в особенности ОН и ОСН3, или
C) R2 и R3 вместе означают –A2(CH2)nA2-, где n = от 1 до 3, и заместители А2 являются одинаковыми или различными и означают NH, О или S;
D) R4 и R5 означают либо
Da) оба водород либо
Db) один из R4 и R5 означает водород, алкильную, аралкильную, алкенильную, аралкенильную, алкинильную или аралкинильную группу, а другой из R4 и R5 означает
Dbi) OR6, где R6 означает водород, низшую (C1-С10), в случае необходимости разветвленную алкильную группу или циклоалкильную группу, С3-С10 замещенную силильную группу (например, триэтилсилил, триметилсилил, трет-бутилдиметилсилил или диметилфенилсилил), С2-С10-альфа-алкоксиалкильную группу, например тетрагидропиранил, тетрагидрофуранил, метоксиметил, этоксиметил, 2-метоксипропил, этоксиэтил, феноксиметил или 1-феноксиэтил;
Dbii) O-CS-NHR6 (тиоуретан), где R6 имеет указанные в Dbi) значения,
Dbiii) O-CO-NHR'7 со следующими значениями:
Dbiv) О~СО-НR6, где R6 имеет указанные в Dbi) значения, в частности, сложный эфир с заместителями аминокислот (оба энантиомера), как
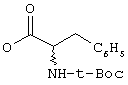
Dbv) NR7R7, где оба заместителя R7 являются одинаковыми или различными и означают водород, низшую (С1-C4)-группу, в случае необходимости разветвленную алкильную группу или циклоалкильную группу, или заместители R7 вместе означают -(СH2)n-, где n = от 3 до 5;
Dbvi) NH-COR6 (амид), где R6 имеет указанные в Dbi) значения;
Dbvii) S-R6, где R6 имеет указанные в Dbi) значения;
Dbviii) SOnR8, где n = 0, 1 или 2 и R8 означает (С1-C10)-группу, в случае необходимости разветвленную или циклическую, в случае необходимости замещенную алкильную или аралкильную группу;
Dbix) R4 означает водород и R5 означает ОН, CN, СО2-алкильную группу, CONRaRb, где Ra означает водород, низшую (C1-С6) в случае необходимости разветвленную или циклическую замещенную алкильную группу и Rb означает водород, низшую (C1-С6) в случае необходимости разветвленную или замещенную алкильную группу, или Ra и Rb вместе означают -(СН2)n-, где n = от 2 до 6, или -(СН2)nЕ(СН2)n-, где Е означает NH, N-алкил, О или S и n = от 0 до 5, арил (фенил или нафтил) или 6-π-гетероцикл,
Dbx) R4 и R5 вместе означают карбонил (=О), гидразон (=N-NH-R9, =N-NR9R10) или оксим (=N-OR10), где R9 означает водород, низшую (C1-С6) в случае необходимости разветвленную или циклическую, в случае необходимости замещенную алкильную, аралкильную, алкилкарбонильную, аралкилкарбонильную, алкилкарбонилокси- или аралкилкарбонилоксигруппу или группу сульфокислоты, как тозил или мезил, и R10 означает водород, низшую (C1-C6) в случае необходимости разветвленную или циклическую, в случае необходимости замещенную алкильную, аралкильную, алкилкарбонильную или аралкилкарбонильную группу или группу сульфокислоты, как тозил или мезил,
Dbxi) R4 и R5 вместе означают заместители типа
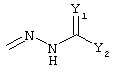
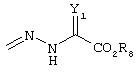
где Y1 и Y2 одинаковые или различные и означают О, S, NH или N-R9 (свободные валентности в каждом случае представляют водород), где R9 имеет значения, указанные в Dbx);
Е) G1 означает -(СН2)х-, где х = 1 или 2;
F) G2 означает -(СН2)у-, где у = от 0 до 2;
E/Fa: G1 и G2 вместе или отдельно означают -C(R11R12)-, где R11 и R12 означают водород, ОН, низшую в случае необходимости разветвленную или циклическую, в случае необходимости замещенную алкильную, аралкильную, арильную, алкилокси, аралкилокси-, арилоксигруппу или вместе означают алкилспирогруппу (С3-С7-спирокольцо),
E/Fb: G1 и G2 вместе означают
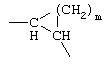
где m = от 1 до 7,
E/Fc: G1 и G2 вместе или раздельно означают –CR11R12-, где R11 и R12 означают водород, ОН, низшую в случае необходимости разветвленную или циклическую, в случае необходимости замещенную алкильную, аралкильную, арильную, алкокси, аралкокси- или арилоксигруппу,
E/Fd: G1 и G2 вместе означают алкилспирогруппу (С3-С7-спирокольцо),
G) G3 означает (CH2)z-, где z = от 0 до 3, при условии, что сумма x+y+z вместе равна по меньшей мере 2 и самое большее 4, или где G3 означает карбонил или тиокарбонил, -СН(ОН)- или -С(ОН)=;
Н) W означает
На) CR13R14, где R13 означает водород и R14 означает -(CH2)nNR7R7, -CO-NR7R7 или -COOR7, причем n = от 0 до 2 и R7 имеет указанные выше значения, или R7 и R7 образуют через (СН2)n-, где n = от 3 до 5, кольцо, причем заместители R13 и R14 могут заменяться,
Нb) N-фенил (в случае необходимости замещенный фтором, бромом, хлором, (C1-C4) алкилом, СО2-алкилом, CN, CONH2 или алкоксигруппой) или N-тиен-2- или 3-ил, или N-фур-2- или 3-ил, или N-1,3,5-триазинил, причем триазиновый остаток дополнительно может быть замещен Cl, OR6 или NR7R7 и R6 или R7 имеют указанные выше значения;
Нc) один из следующих приведенных заместителей
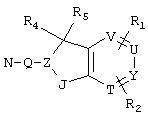
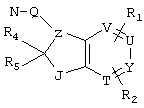
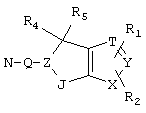
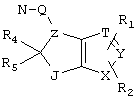
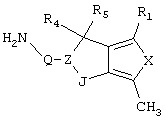
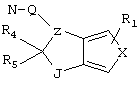
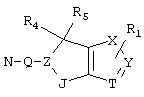
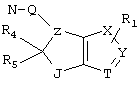
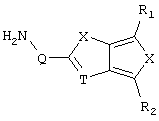
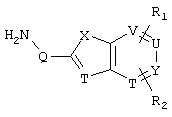
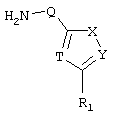
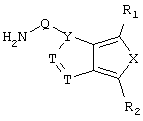
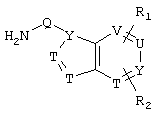
Y = СН или N;
Т = СH или N;
U = СН или N;
V = СН или N;
Х = NR6, О или S;
Z = СН или N,
где J означает отсутствие связи или -(СН2)n-, причем n=0-3, карбонил, тиокарбонил, О, S, -SO или SO2, R6 имеет указанные выше значения и где
Q означает - (CH2)n-M*-(CH2)m-, причем n = от 0 до 4 и m = от 0 до 4; М* представляет алкинил, алкенил, дизамещенный фенил, дизамещенный тиофен, дизамещенный фуран, дизамещенный пиразин, дизамещенный пиридазин, промежуточное звено одной из далее приведенных формул, пептидное промежуточное звено L или гетероциклическое промежуточное звено HS следующих формул:
-(CH2)n-
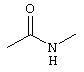

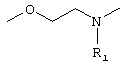
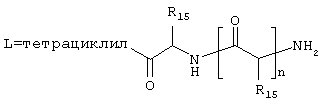 или
или 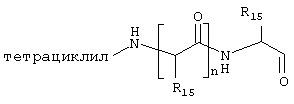
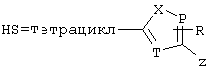
P = CH или N;
T = CH или N;
X = NR6, или N;
Z = CH или N,
где R15 означает боковую цепь D-, L-, D,L-аминокислоты или неприродной аминокислоты и в случае n>1 R15 в отдельных остатках означает одинаковые или различные боковые цепи D-, L-, D,L-аминокислот или неприродных аминокислот, при условии, что атом N рядом с Q связан с группой G2 и G3 формулы I;
Hdi) в случае необходимости по меньшей мере монозамещенный трициклический заместитель (Тr) по меньшей мере с одним гетероциклическим кольцом в качестве составной части цикла и одним местом присоединения к атому углерода конденсированного бензольного кольца, который через промежуточное звено Q и соседний с Q атом азота связан с G2 и G3 соединения формулы I, причем Q имеет указанные выше в Нc) значения;
Hdii) циклический углеводород следующих формул
или Не) -NH-, -О-, -S-, -SO- или –SO2-,
Hf) причем в случае, если W означает -NH-, z в группе G3 означает 0, 2 или 3 при условии, что z в группе G3 означает 1, если заместитель R1 означает низшую алкильную группу, как метил или этил.
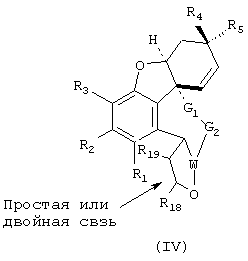
где R18 и R19 означают водород, алкил, арил или аралкил, в которых С-атомы, соединенные с заместителями R18 и R19, связаны друг с другом простой или двойной связью и где заместители с R1 по R5 и с G1 по G3 имеют значения, приведенные в п.1 для общей формулы I, причем W означает -СН- или -NH-.
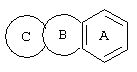
или
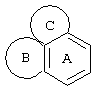
или
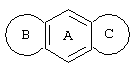
или
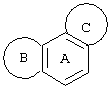
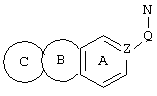
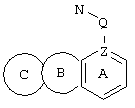
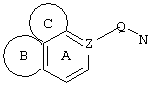
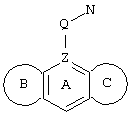
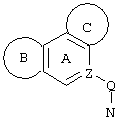
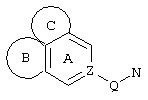
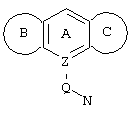
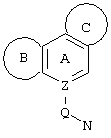
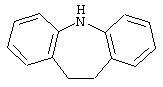
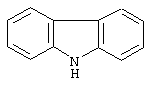
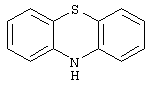
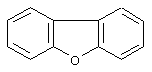
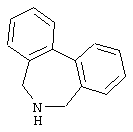
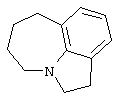
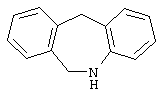
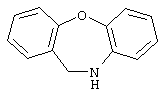
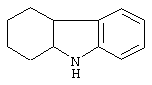
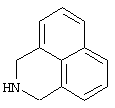
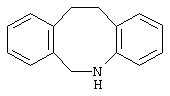
| WO 9740049 А1, 30.01.1997 | |||
| WO 9612692 А1, 02.05.1996 | |||
| RU 98102930 А, 10.11.1999. |
Авторы
Даты
2004-11-27—Публикация
2001-03-22—Подача