Область изобретения
Настоящее изобретение относится к так называемому сухому способу работы с образцами и реагентами, и в частности, к области приготовления образцов, количественному и качественному экстрагированию, очистке и амплификации нуклеиновых кислот (ДНК или РНК, включая различные виды нуклеиновых кислот) из органических образцов, таких как кровь, сыворотка, моча, клеточные суспензии, образцы амплифицированные in vitro и образцы биопсий.
Уровень техники
Существует большое количество разнообразных протоколов для выделения и очистки нуклеиновых кислот. Большинство способов имеют своей целью выделение высокочистых образцов, которые подходят для использования при амплификации с помощью ПЦР (полимеразной цепной реации).
Один из используемых в настоящее время протоколов, в котором применяется Split Second™ DNA Preparation Kit (Boehringer Mannheim GmbH), включает следующие стадии. Сначала в пробирки для микроцентрифуги разливают первый буферный раствор. Образец, например цельную кровь человека, добавляют в пробирки. Пробирки помещают на качалку на 10 мин и затем центрифугируют 5 мин при 2500 об/мин на микроцентрифуге. Затем отбирают и выбрасывают супернатант, а осадок ресуспендируют в буферном растворе. Ресуспендированный осадок затем центрифугируют 3 мин при 2500 об/мин. После второго центрифугирования отбирают и выбрасывают супернатант. Осадок ресуспендируют во втором буфере и смесь тщательно взбалтывают (на установке Вортекс). После инкубирования в течение 5 мин на водной бане при 65°С, образец можно непосредственно использовать для ПЦР.
Другим протоколом является очистка ДНК с использованием хаотропического (разобщающего) агента и частиц диоксида кремния, как описано у Dr. J. Kleiber (preparation of DNA templates, Boehringer Mannheim GmbH, FRG). Суспензию кремнезема добавляют в лизирующий буфер в пробирке для микроцентрифуги, и взбалтывают. Затем к лизирующему буферу, содержащему частицы диоксида кремния, добавляют кровь, обработанную EDTA (этилендиаминтетрауксусной килотой), и смесь взбалтывают. После 10 мин инкубации, во время которой пробирку следует регулярно переворачивать, чтобы не дать осесть частичкам диоксида кремния, смесь центрифугируют. После удаления супернатанта, осадок диоксида кремния с нуклеиновыми кислотами подвергают серии промывок: первый буфер для промывки (гуанидинтиоцианат, Tris/HCl), затем этанол (70%) и, наконец, ацетон. Каждая стадия промывки требует перемешивания смеси взбалтыванием, ее центрифугирования и удаления супернатанта. После последней отмывки осадок оксида кремния с нуклеиновой кислотой высушивают нагреванием до 56°С в течение 10 минут. Наконец, смесь центрифугируют 2 мин при 10,000×g. После этого супернатант содержит очищенную нуклеиновую кислоту и может быть использован для ПЦР.
Не трудно заметить, что множественные стадии используемых в настоящее время протоколов являются трудоемкими и требуют постоянной концентрации внимания. Экстрагируемые объемы требуется пипетировать в большом количестве пробирок для микроцентрифуги, и эти пробирки подвергают различным воздействиям, таким как центрифугирование, перемешивание взбалтыванием и инкубация.
Работа с образцами, которые берут из тела человека, вне зависимости являются ли они образцами биопсии, крови или сыворотки, или образцами других жидкостей тела, таких как моча или слюна, клеточными суспензиями или in vitro амплифицированными образцами, включает в себя множество практических сложностей и особых соображений. Лабораторный персонал не только должен быть защищен от болезнетворных агентов, которые возможно содержатся в образцах, сами образцы должны быть защищены от загрязнения, как исходящего из других образцов, так и от персонала, работающего с ними.
Большое количество этапов, обычно используемых при очистке нуклеиновых кислот, повышает риск перенесения нуклеиновых кислот из образца в образец. При принятии решения на основе результатов необычайно чувствительной полимеразной цепной реакции (ПЦР) или других систем амплификации, мельчайшая контаминация может привести к ложным положительным результатам.
Работа с человеческой кровью предполагает специфические проблемы. Поскольку нельзя использовать гепаринизированную кровь (гепарин ингибирует ПЦР), образцы имеют тенденцию к свертыванию в контейнерах, где они находятся, в кончиках пипеток и пробирках для микроцентрифуги. Далее, кровь имеет тенденцию приставать к поверхностям и высыхать с формированием крошечных хлопьев, которые с легкостью переносятся по воздуху. И, наконец, не следует пренебрегать психологическим дискомфортом или стрессом, испытываемым при работе с потенциально заразными образцами человеческой крови.
Настоящее изобретение имеет своей целью улучшение, например, упрощение очистки нуклеиновых кислот из органических образцов в общем, и, в частности, приготовления образцов нуклеиновых кислот из цельной (необработанной) крови человека.
В частности, нуклеиновые кислоты представлены в форме дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК). ДНК в свою очередь подразделяется на плазмидную ДНК и геномную ДНК. РНК обычно подразделяют на информационную РНК (мРНК), транспортную РНК (тРНК) и рибосомальную РНК (рРНК). Эти группы часто называют "видами нуклеиновых кислот". Было бы желательным создать легкий и надежный способ качественной экстракции нуклеиновых кислот, т.е. различения различных видов нуклеиновых кислот.
Во многих химических или фармацевтических областях применения, реагент или фармацевтический реагент хранится и доставляется пользователю в лиофилизированной форме и должен быть восстановлен при смешивании его с подходящим количеством соответствующего растворителя. Растворителем часто является вода или водный раствор, такой как физиологический солевой раствор. К этой технике прибегают в основном с тем, чтобы увеличить стабильность и вместе с ней срок хранения реагента или фармацевтического реагента. В некоторых случаях, реакции между компонентами, содержащимися в реагентах, становятся невозможными или заметно замедляются в лиофилизированном состоянии и инициируются, когда материал восстанавливают.
При восстановлении лиофилизированного вещества должно быть гарантировано тщательное перемешивание. Градиенты концентрации, недостаточное перемешивание и возможно оставшиеся твердые частицы могут привести к ошибкам и риску при дальнейшем использовании восстановленной смеси. Также необходимо принимать в расчет опасность контаминации лиофилизированного вещества, в особенности, когда восстановление производят открытым способом.
Примеры приложений, в которых контаминирующий материал может полностью изменить результат включают аналитические и биохимические приложения, в которых генетическая информация из образца подвергается амплификации. Важные реакции этого типа включают полимеразную цепную реакцию (ПЦР), лигазную цепную реакцию (ЛЦР), ЛЦР с промежутком (gapped-LCR-reaction), амплификацию нуклеиновых кислот, основанную на их последовательности (NASBA), самоподдерживающуюся репликацию (SSR), амплификацию, медиированную транскрипцией (ТМА), амплификацию с вытеснением нити (SDA), амплификацию мишени, амплификацию сигнала, Hybrid CaptureR реакцию, или любое сочетание реакций, описанных выше. Задачей настоящего изобретения является сведение к минимуму или полное устранение возможности контаминации при приготовлении образца для вышеуказанных и других приложений, при которых контаминация вызывает риск ошибки.
Другой задачей настоящего изобретения является создание способа и устройства для восстановления лиофилизированных веществ, например, реагентов для биохимического анализа или фармацевтических агентов, которые могли бы обеспечить более высокую степень безопасности, надежности и легкости в использовании, чем доступные в настоящее время системы.
Наиболее близкие известные аналоги
В патенте US 5330916 описан способ экстракции компонентов клетки и сосуд, который подходит для использования в этом способе. Так называемый двусторонний сосуд для экстракции имеет два отделения, отделенных друг от друга фильтром, и подвижный притертый поршень, который размещен в одной из камер. При движении поршня образец подвергается воздействию механических сил, клетки в образце разрываются и их содержимое попадает в жидкую фазу. Указанная жидкая фаза проходит через фильтр во второе отделение, при этом органические составляющие и остатки клеток остаются в первом отделении.
В патенте US 5786182 описан двухкамерный сосуд одноразового использования для реакций амплификации, в котором первая камера содержит смесь реагентов для амплификации, а вторая камера содержит фермент для амплификации. Эти две камеры соединены каналом для прохода жидкости, который можно открыть или через который можно переместить образец в результате механического воздействия, приложения вакуума и т.п. Сущность изобретения заключается в том, что разделяют реагенты, обладающие разной устойчивостью к нагреванию, т.е. чувствительный к нагреванию ферментативный реагент и устойчивый при нагревании реагент для амплификации, и предусматиривают возможность соединения их вместе в выбранный момент времени.
Сосуд согласно патенту US 5786182 предназначен для реакций амплификации и не предусматривает возможности попеременного наполнения камер, составляющих данный двухкамерный сосуд, так же как он не подходит для экстракции нуклеиновых кислот, т.е. в нем отсутствуют средства для тщательного перемешивания образца и реагента.
Способ и сосуд согласно US 5330916 представляет собой наиболее близкий существующий аналог в том, что касается экстрагирования нуклеиновых кислот. Однако он не позволяет вносить изменения в процедуры экстракции, замены буферов, последовательной экстракции и т.д. с достаточной степенью легкости и надежности.
Краткое содержание изобретения
Настоящее изобретение решает вышеуказанные задачи посредством устройства и способов согласно прилагаемой формуле изобретения.
Согласно настоящему изобретению предложено устройство для экстрагирования нуклеиновых кислот, в котором указанная система содержит первый сосуд (3) для размещения образца и по меньшей мере один второй сосуд (4), содержащий по меньшей мере один реагент (2), при этом указанные сосуды соединены посредством узкого канала (7, 8) с возможностью отсоединения, и средства (5, 6) для вынужденного перемещения образца из первого сосуда во второй и обратно.
Настоящее изобретение также относится к способу экстрагирования нуклеиновых кислот из образца, согласно которому указанный образец помещают в первый сосуд, который соединен с возможностью отсоединения со вторым сосудом, при этом указанный второй сосуд содержит заранее приготовленный реагент, после чего образец прокачивают во второй сосуд и обратно, повторяя это до момента достаточного перемешивания, после чего сосуд, содержащий смесь, соединяют с третьим сосудом, содержащим заранее приготовленный реагент, и перемешивание повторяют.
Дальнейшие примеры реализации изобретения и их преимущества станут очевидны или могут быть легко выведены из описания и примеров, включая прилагаемые чертежи.
Краткое описание чертежей
Настоящее изобретение будет раскрыто более подробно в описании и примерах, приведенных ниже, со ссылками на соответствующие чертежи, на которых:
на фиг.1 показано поперечное сечение двух сосудов, А и В, согласно одному из примеров реализации изобретения;
на фиг.2 изображено два сосуда согласно фиг.1, соединенных друг с другом согласно изобретению;
на фиг.3 показан сосуд с колпачком для отделения матрицы, несущей нуклеиновые кислоты; и
на фиг.4 показана конструкция с фиг.3, помещенная в центрифужную пробирку (А) и пробирку для микроцентрифуги (В), соответственно, например, для их опорожнения с помощью центрифуги.
Описание изобретения
Способ очистки, экстрагирования и ферментативной обработки нуклеиновых кислот согласно настоящему изобретению делает возможной работу с образцом “всухую” и необходимыми буферами, поскольку стадия пипетирования становится ненужной.
Образец, например, объем крови, сыворотки, мочи, слюны, клеточная суспензия, например, из образца биопсии, или образец амплифицированный in vitro, помещают в первое пространство. Это первое пространство может быть пространством, содержащимся в пробирке, VacutainerR, шприце или предпочтительно первое пространство, которое содержится в устройстве согласно изобретению, описанному ниже. Образец затем приводят в контакт с лизирующим буфером, который также предпочтительно содержит матрицу, способную связывать нуклеиновые кислоты. Подходящим лизирующим буфером является солевой раствор, кроме того, содержащий детергент, обычно используемые агенты, такие как Tris (Boehringer Mannheim GmbH) и EDTA (Merck). Подходящей матрицей являются частицы стекла или оксида кремния, диатомовые земли, стеклянные волокна, нейлоновые волокна, суспензия целлюлозы, шарики парамагнетика, латексные шарики и т.п. Матрица может иметь также покрытие, например, она может быть покрыта стрептавидином или любым другим материалом для отделения нитей нуклеиновых кислот или нитей только одной нуклеиновой кислоты.
Этот первый буфер, предпочтительно содержащий также твердую матрицу, содержится во втором пространстве, имеющем узкий канал. При попадании во второе пространство образец образует смесь с лизирующим буфером и матрицей. Эту смесь затем продавливают через вышеупомянутый канал, и она попадает в пространство, которое может быть первым пространством, в случае если образец первоначально был помещен в устройство согласно настоящему изобретению. При прохождении через узкий канал или отверстие между двумя пространствами или сосудами, смесь эффективным образом перемешивается. Затем смесь продавливают обратно во второе пространство и процедуру повторяют некоторое количество раз, гарантирующее тщательное перемешивание и лизис клеток в образце. После достаточного количества перемещений через канал смесь становится практически гомогенной. Во время этого перемешивания нуклеиновые кислоты связываются с матрицей, содержащейся в лизирующем буфере. Когда перемешивание прекращают, смесь находится или в первом, или во втором пространстве.
Матрицу со связанными с ней нуклеиновыми кислотами затем отделяют от основной массы раствора. В случае использования матрицы, состоящей из частиц, такое отделение можно провести, если закрыть пространство, которое содержит матрицу, мембраной или разделительным колпачком, как описано ниже, и центрифугировать устройство. Матрица останется на мембране или в разделительном колпачке.
При использовании матрицы из парамагнитных частиц разделения достигают приложением магнитного поля вокруг сосуда или к подвижному элементу или поршню, используемому для вынужденного перемещения содержимого сосудов из одного в другой.
Смесь, содержую лизирующий буфер и матрицу, затем смешивают с буфером для промывания, содержащимся в третьем пространстве или в сосуде, присоединенном ко второму сосуду или пространству. Пропуская смесь туда и обратно между этими двумя пространствами через узкий канал, в очередной раз обеспечивают тщательное перемешивание и промывку. Когда перемешивание заканчивают, смесь находится или во втором или в третьем пространстве, а все остальное выбрасывают. Наконец, очищенные нуклеиновые кислоты могут быть удалены с матрицы с использованием буфера для элюирования или, в случае парамагнитной матрицы, при выключении парамагнитного поля.
Путем использования различных матриц можно проводить экстракцию различных видов нуклеиновых кислот. Это осуществляют подбором материала матрицы, структуры матрицы, ее упаковки и прочих
структурно-физических свойств. Этот процесс зависит также от выбора подходящих химических свойств и/или химической или биологической предобработки, например, такой как обработка для улучшения аффинных свойств, покрытие матрицы антителами, аффинными группами, стрептавидином, биотином. Специфические последовательности нуклеиновых кислот могут быть экстрагированы с использованием комплиментарной нуклеиновой кислоты, гибридизованной на матрице. Таким образом, например, можно провести экстракцию специфичных вирусных нуклеиновых кислот, как часть подготовки образца к диагностическому тесту.
Буфер или буферы для экстрагирования могут быть подобраны или адаптированы для экстракции определенных видов нуклеиновых кислот. Согласно одному примеру реализации изобретения, образец пропускают туда и обратно между двумя сосудами, один из которых содержит матрицу, специальным образом адаптированную или способствующую адсорбции одного вида нуклеиновых кислот, в то время как другой сосуд содержит матрицу специальным образом адаптированную или способствующую адсорбции другого вида нуклеиновых кислот и буферный раствор, подходящий для обеих матриц. Таким образом, экстрагируемые нуклеиновые кислоты физически разделяются, что улучшает кинетику реакции и приводит к более высокому результату, как качественно, так и количественно.
Согласно альтернативному способу реализации данного способа, матрицу можно добавлять после проведения лизиса.
Устройство согласно настоящему изобретению содержит по меньшей мере два сосуда, которые имеют подвижные участки стенок или элементы для вытеснения содержимого каждого из сосудов, и соединительные элементы, которые подходят к соответствующей части, по меньшей мере, одного другого сосуда и предпочтительно прочих сосудов.
Согласно предпочтительному способу реализации, один из сосудов содержит твердую матрицу, жестко зафиксированную в нем или имеющую физические препятствия к покиданию сосуда. Матрицей может служить вставка из гранулированного или волокнистого материала, например, частиц стекла или диоксида кремния, стекловолокна, нейлонового волокна, целлюлозы или диатомовой земли, которая по выбору может быть подвергнута спеканию или сжатию другим способом, с тем, чтобы придать ей форму вставки и таким образом, исключить возможность уноса ее из сосуда в направлении потока жидкости при опорожнении сосуда. Матрица может быть специфичным образом выбрана, адаптирована или модифицирована с учетом физических/структурных и/или химических/ биологических свойств, как описано выше. Альтернативным образом, при использовании парамагнитных частиц, перемещение частиц матрицы можно регулировать приложением к сосуду магнитного поля.
Матрица также может представлять собой покрытие на внутренней поверхности стенок одного из сосудов, альтернативно, стенки одного из сосудов могут быть выполнены из стекла, акрила, полистирола или другого материала, способного обратимо связывать, например, нуклеиновые кислоты при определенных условиях. В последнем случае является предпочтительным создание шероховатостей или увеличение активной поверхности стенок иным способом.
Согласно одному из примеров реализации данного изобретения возможности комбинирования сосудов определяются резьбой, формой или размером их наконечников и отверстий. Первый сосуд может, например, быть снабжен как внешней, так и внутренней резьбой. После того как перемешивание в первом сосуде окончено, второй сосуд выбрасывают, и первый сосуд соединяют с третьим сосудом посредством его внешней резьбы.
Кроме того, используя цветовые коды, тактильные метки и т.п., можно определять порядок использования сосудов. Накладывая непосредственные физические ограничения (различная резьба, различные размеры сединяемых частей, и т.д.) на возможности соединения сосудов, можно минимизировать возможность ошибки.
Устройство согласно настоящему изобретению предпочтительно выполнено из подходящего термопласта. Примеры таких материалов включают, но не ограничены, полипропиленом (ПП), полистиролом (ПС), полиэтиленом (ПЭ), полиэтиленом высокого давления (ПЭВД), поликарбонатом (ПК), полиацетатом (ПА), полиметилметакрилатом (ПММА) и поливинилиденфторидом (ПВФ). Выбор материала определяется не только химическими и температурными требованиями по отношению к реагентам и буферам, которые будут повергаться обработке, или к реакциям, которые предстоит проводить в устройстве, но также соображениями экономии, такими как материальные затраты, технология производства и т.п.. Одним из подходящих способов производства является прессование под давлением. Вакуумное пресс-литье является еще одним возможным способом производства. Устройство согласно изобретению, конечно, производится в условиях, которые исключают присутствие в нем загрязнений, которые могут влиять на протекание реакции или реакций, для использования в которых оно предназначается.
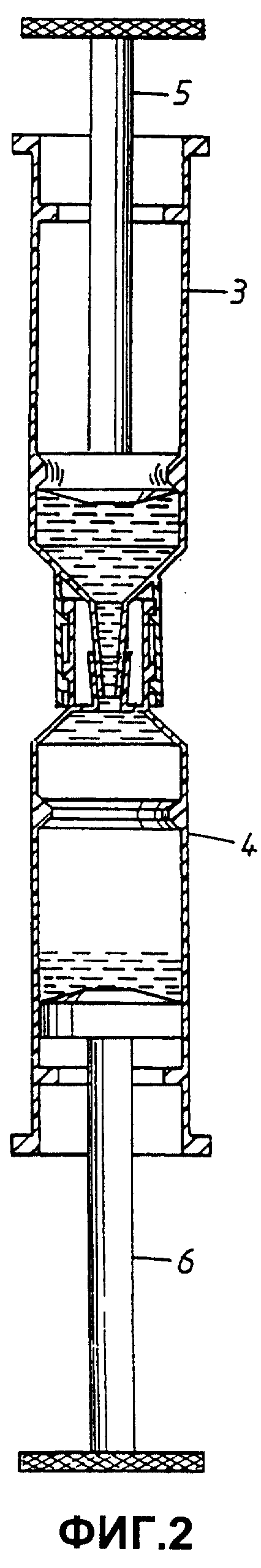
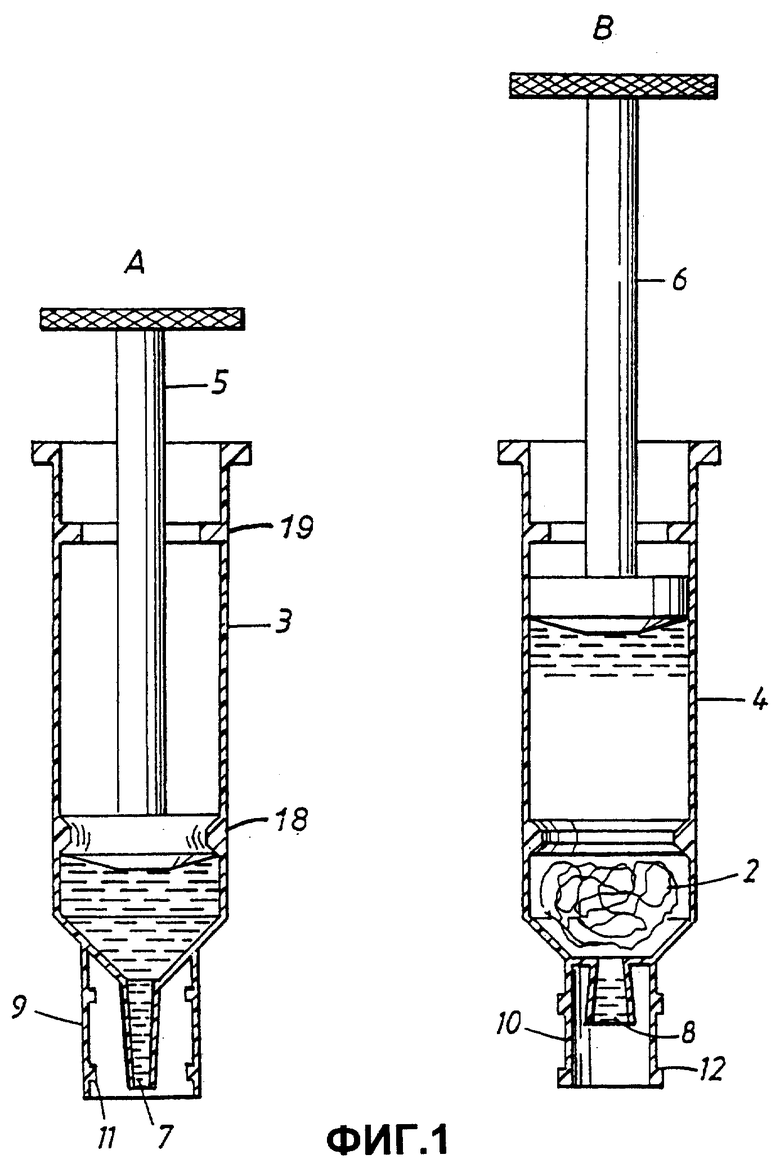
Устройство изображено на Фиг.1 в виде двух сосудов 3 и 4. В иллюстративных целях сосуды изображены в виде изделий, напоминающих обычные шприцы, имеющих основную часть, подвижный поршень 5 и 6, и выходное отверстие или наконечник 7 и 8. Вокруг выходных отверстий размещен кольцевой выступ 9 или 10. Поскольку кольцевой выступ на сосуде 3 имеет внутреннюю резьбу 11, а кольцевой выступ на сосуде 4 имеет соответствующую внешнюю резьбу, они могут быть прочно соединены друг с другом, обеспечивая плотное соединение отверстий 7 и 8. Кольцевые выступы и резьбу также можно использовать для присоединения колпачка на сосуды для защиты целостности их содержимого, обеспечения стерильности их внутренних поверхностей и т.п.
В целях иллюстрации, объем жидкости, которая содержится в сосуде 3 и обозначена прерывистыми линиями, может рассматриваться как образец, например, образец цельной крови. Жидкость в сосуде 4 в этом случае представляет собой лизирующий буфер, также предпочтительно содержащий матрицу.
С тем, чтобы можно было управлять перемещением поршней, сосуды выполнены с первым кольцевым сужением 18 на ближнем конце сосуда и вторым кольцевым сужением 19 на удаленном конце сосуда. Первый выступ 18 окажет заметное сопротивление и таким образом укажет пользователю, что поршень находится вблизи от своего нижнего положения. Тем не менее, поршень можно продавить через первый выступ 18, например при опустошении сосуда. Второй выступ 19 предохранит поршень от вытаскивания из сосуда, например по ошибке или в результате слишком высокого давления, создаваемого в сосуде.
На Фиг.2 два сосуда 3 и 4 показаны соединенными посредством нарезных кольцевых выступов, описанных выше. Соединение открывает путь для потока жидкости между пространствами двух сосудов, проходящего через сужение или "шейку", образованную выходными отверстиями сосудов. Поскольку соединение плотное, оба сосуда ограничивают один общий объем. При опускании поршня 5 образец, содержащийся в сосуде 3, продавливается через узкий канал в сосуд 4, который содержит лизирующий буфер и матрицу 2. Поскольку соединение является плотным, поршень 6 отходит назад вследствие давления, оказываемого поршнем 5. Когда большая часть образца опорожнена в сосуд 4, нажимают поршень 6, перегоняя образец плюс буфер в сосуд 3. Таким образом, содержимое перекачивают туда и обратно с образованием смеси. При использовании негепаринизированной крови, что является необходимым для целей ПЦР, показано, что такое перемешивание предотвращает свертывание крови. По окончании перемешивания смесь оставляют в одном из сосудов, или 3 или 4.
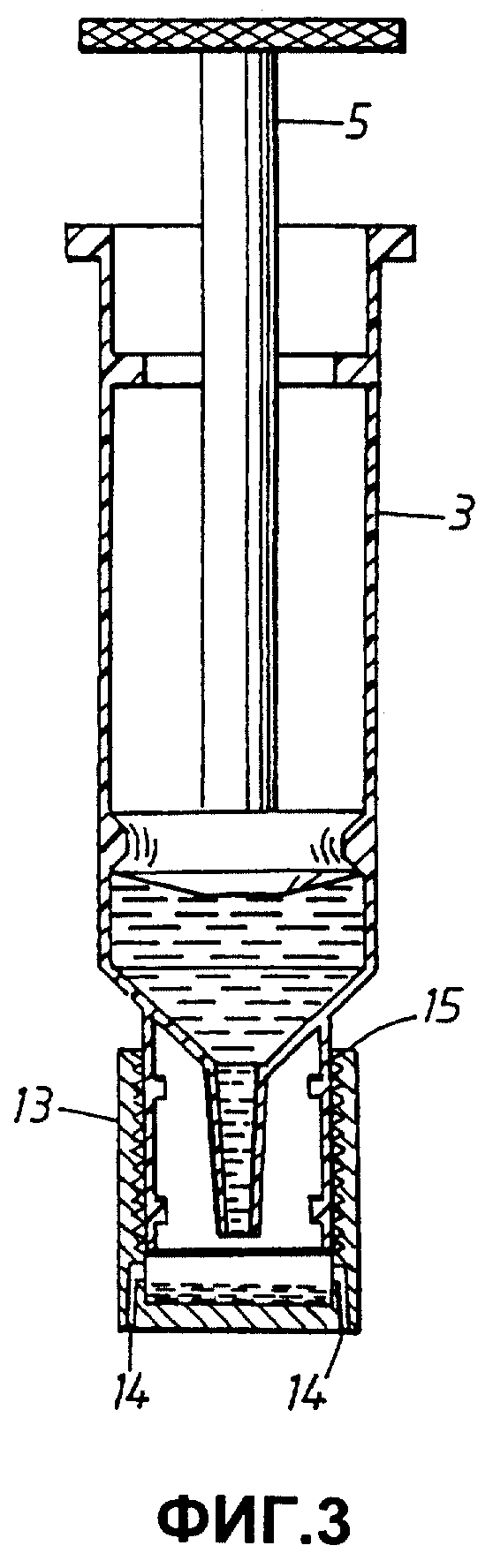
Согласно одному из примеров реализации сосуд 4 содержит матрицу, выполненную таким образом, чтобы предотвратить ее унос из сосуда, например, вставку из стекловолокна или спеченных частиц диоксида кремния и т.д., при этом предпочтительным является опорожнение содержимого 4 после тщательного перемешивания в сосуд 3, или другой эквивалентный сосуд, так, чтобы в сосуде осталась только матрица со связанными с ней нуклеиновыми кислотами. Сосуд 3 затем выбрасывают вместе со всем содержимым.
Затем к сосуду 4 присоединяют третий сосуд (не показан), который содержит буфер для промывки, и процедуру перекачивания повторяют. Когда промывка завершена, сосуд 4 освобождают от всего, кроме матрицы со связанными с ней нуклеиновыми кислотами, а третий сосуд, содержащий использованный промывочный буфер, выбрасывают.
Нуклеиновые кислоты затем можно элюировать с матрицы, например, наполнив сосуд 4 буфером для элюирования, который предпочтительно содержится в четвертом сосуде, согласно данному изобретению. Альтернативно, сосуд, содержащий буфер для элюирования, присоединяют к сосуду 4 и элюирование проводят путем перекачивания содержимого туда и обратно между этими двумя сосудами.
Если предполагают использовать экстрагируемую нуклеиновую кислоту как матрицу для процесса амплификации, например ПЦР, к сосуду 4 можно присоединить четвертый сосуд, который содержит лиофилизированные реагенты для амплификации. Содержимое сосуда 4, включающее элюированную ДНК, затем продавливают в четвертый сосуд и перекачивают туда и обратно, с тем, чтобы достичь эффективного растворения и гомогенизации реагентов. В этом способе реализации приготовляют полную реакционную смесь, включающую матрицу для амплификации, и переносят ее непосредственно в сосуд для проведения ПЦР реакции. Это дает множество преимуществ, таких как более простое обращение и уменьшенный риск внесения загрязнений и т.п.
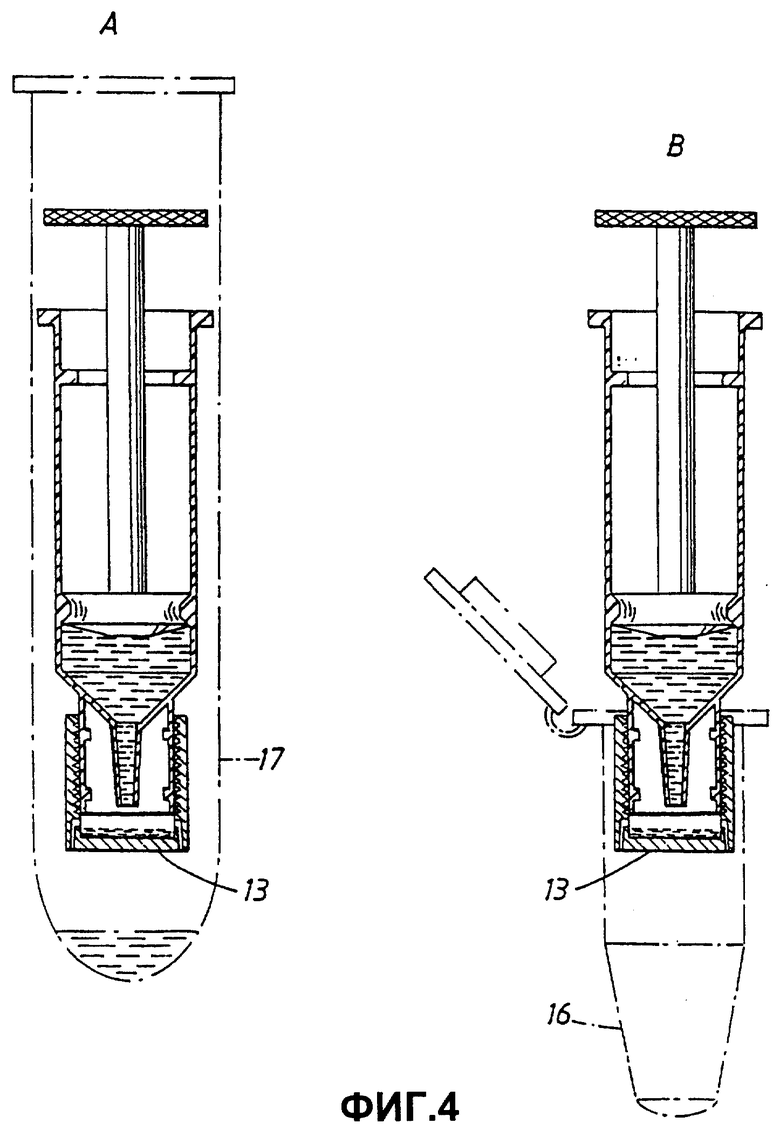
Сосуды также можно опорожнять посредством центрифугирования. Фиг.3 показывает способ реализации, в котором сосуд 3 содержит смесь из буфера и матрицы. На этой стадии нуклеиновые кислоты связаны с матрицей, при этом добавляют буфер для элюирования. Разделительный колпачок 13, имеющий выходные поры 14, соединяют с выходным отверстием 7 сосуда 3. Колпачок 13 может быть закреплен на резьбе кольцевого выступа 9 (не показано). При центрифугировании буфер для элюирования покидает сосуд через поры 14, матрица же остается в разделительном колпачке. Элюированные нуклеиновые кислоты затем можно использовать для амплификации, например ПЦР.
Фиг.4 иллюстрирует два способа применения, один, когда сосуд с надетым разделительным колпачком 13 помещен в центрифужную пробирку 17, и другой, когда сосуд используют для опорожнения его содержимого в пробирку для микроцентрифуги 16. Во время центрифугирования матрица остается в сосуде или задерживается разделительным колпачком, тогда как буфер для элюирования и нуклеиновые кислоты проходят через выходные поры 14 и перемещаются в пробирку 16 или 17. Пробирки 16 и 17 можно далее использовать в стадиях, например, необходимых для ПЦР протокола.
Первый сосуд, который является контейнером для образца, также может быть первичным приемником образца. Подразумевается, что первый сосуд приспосабливают для отбора образца. Согласно одному из способов реализации первый сосуд приспосабливают для удерживания гиподермальной иглы. Таким путем образец крови можно отбирать непосредственно в первый сосуд. При другом способе реализации первый сосуд приспосабливают для отбора полоски геля или колонии с чашки с агаром. Тогда сосуд оснащают насадкой для выкалывания полоски или насадкой для снятия колонии с чашки с агаром. Перекачивание содержимого сосудов в особенности подходит для экстрагирования нуклеиновых кислот из геля или клона, выращиваемого на чашке с агаром.
Согласно другому способу реализации устройство и способ по изобретению может быть приспособлено для параллельного формата работы. В лабораториях, где работают с большим количеством образцов, способ реализации, который включает использование множества сосудов, например 96, 384 или более сосудов типа, подходящего для микроцентрифуги или планшетов для микротитрования, может быть осуществлен в виде так называемого стандартного формата работы с микротитрами или других параллельных форматов. Такой набор, например 8×12 сосудов, предпочтительно можно сформовать как одно целое путем прессования под давлением. Соответствующие поршни также собирают в один блок с образованием рядов и колонок в том же формате, и также объединяют в единое целое путем прессования под давлением. Описанное выше перекачивание можно осуществлять вручную. Предпочтительным образом используют механическое устройство. Им может быть механическое или пневматическое устройство, включающее набор поршней. В этом способе реализации выходные отверстия 7 и 8 и кольцевые выступы 9, 10, имеющие резьбу, должны быть модифицированы способом, позволяющим плотное и надежное соединение без закручивания. Вращающее движение трудно осуществить, когда сосуды собраны в виде решетки, как в данной реализации. Другими словами, сосуды должны быть плотно соединены путем выранивания сосудов и прижатия их друг к другу. Это может быть осуществлено с использованием плотно входящих друг в друга соединений (фитингов), фланцев, защелкивающихся механизмов и т.п. Изменив форму кольцевых выступов 9 и 10, можно получить механизм типа "толкаем-закрываем" и "тянем-открываем".
Пример
В настоящем примере использовали набор взаимно соединяемых шприцов. Тестировали различные матрицы: частицы оксида кремния, стеклянные и нейлоновые волокна. Использовали лизирующий буфер, состоящий из солевого раствора и детергента. Буфер для промывки состоял из соевого раствора и этанола.
Образец негепаринизированной цельной крови человека набирали в первый шприц или непосредственно от пациента с использованием гиподермальной иглы, надетой на шприц, или из промежуточного контейнера, VacutainerR, содержавшего образец от пациента.
Приготавливали второй шприц, содержавший частицы диоксида кремния, суспендированные в лизирующем буфере. Затем шприц, содержащий образец крови, соединяли со вторым шприцом, и образец крови выпускали в лизирующий буфер. Смешанное содержание обоих шприцов затем перекачивали туда и обратно между двумя шприцами. Каждое перемещение через узкий перехват между соединенными шприцами способствовало перемешиванию образца с лизирующим буфером и обеспечивало тщательное перемешивание частиц оксида кремния в растворе. Такое перекачивание продолжали в течение нескольких минут и оканчивали, когда образец и лизирующий буфер были полностью в одном из шприцов. Другой шприц отсоединяли и выбрасывали.
При использовании солевого раствора с детергентом для лизиса клеток в образце негепаринизированной крови было обнаружено, что способ обработки согласно изобретению эффективно предотвращает сворачивание крови.
К шприцу, который содержал образец, оксид кремния и лизирующий буфер, присоединяли третий шприц, содержащий буфер для промывки. Затем буфер для промывки прокачивали туда и обратно между вторым и третьим шприцами. После окончания перемешивания объединенный раствор оставляли во втором шприце.
При использовании гранулированной матрицы, свободно перемещавшейся в содержимом сосуда, матрицу отделяли от раствора с помощью присоединения разделяющего колпачка к кончику шприца, помещения последнего в центрифужную пробирку и центрифугирования (как показано схематически на прилагающейся Фиг.4). Матрица оставалась в разделительном колпачке, тогда как раствор удаляли. Можно так проводить дальнейшую промывку или элюировать нуклеиновую кислоту из осадка, находящегося в разделительном колпачке.
Если матрицей служит вкладка из стеклянных волокон - или, как во втором примере, осуществленном изобретателем, нейлоновая нить некоторой длины - нет необходимости в использовании какого-либо разделительного колпачка. Вместо этого, матрицу промывали и элюировали in situ, путем присоединения различных шприцов, содержащих необходимые буферы к шприцу, содержавшему матрицу. Наконец, с матрицы элюировали нуклеиновые кислоты. Результат очистки подтверждали, подвергая элюированный образец гель-электрофорезу. Отчетливая отдельная полоса показывала, что очистка нуклеиновых кислот прошла успешно.
Хотя данное изобретение описано в отношении предпочтительных примеров реализации, которые представляют собой наилучший из известных в настоящее время изобретателю способов, следует понимать, что в пределах объема изобретения, который определен в прилагающейся формуле изобретения, возможны различные изменения и модификации, которые очевидны специалисту в данной области.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ экстракции нуклеиновых кислот из ногтевых пластин | 2020 |
|
RU2751244C1 |
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК COCCIDIOIDES IMMITIS ДЛЯ ПРОВЕДЕНИЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2005 |
|
RU2295569C1 |
| СИСТЕМА И СПОСОБ СБОРА ОБРАЗЦА НУКЛЕИНОВОЙ КИСЛОТЫ | 2014 |
|
RU2654666C2 |
| СИСТЕМА И СПОСОБ СБОРА ОБРАЗЦА НУКЛЕИНОВОЙ КИСЛОТЫ | 2015 |
|
RU2729113C2 |
| СПОСОБ СПЕЦИФИЧЕСКОГО ВЫДЕЛЕНИЯ ПОЛНОГО ДНК-СОДЕРЖИМОГО БАКТЕРИАЛЬНЫХ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИИ | 2010 |
|
RU2567809C2 |
| Способ выделения целевых фрагментов ДНК из многокомпонентной смеси | 2024 |
|
RU2832884C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК ИЗ МИКРООРГАНИЗМОВ И КЛЕТОК ЖИВОТНЫХ, ПРИГОДНОЙ ДЛЯ ПОСТАНОВКИ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 1997 |
|
RU2129610C1 |
| Способ выделения РНК и ДНК из сухих биологических образцов, хранившихся на бумажном носителе, и набор для его осуществления | 2016 |
|
RU2628695C1 |
| АВТОМАТИЗИРОВАННАЯ ПРОЦЕДУРА ТЕСТИРОВАНИЯ ВИРУСНОЙ НАГРУЗКИ ВИЧ-1 ДЛЯ ВЫСУШЕННЫХ МАЗКОВ | 2015 |
|
RU2718059C2 |
Изобретение относится к области молекулярной биологии. Сущность изобретения - способ и устройство, в них нуклеиновые кислоты выделяют непосредственно из образца без стадии пипетирования с помощью заранее приготовленных, соединяемых друг с другом сосудов. Указанные сосуды используют по отдельности или соединенными вместе согласно стандартному формату микротитрования. Образец смешивают с лизирующим буфером и нуклеиновые кислоты связываются с матрицей в замкнутой системе, включающей, по меньшей мере, два взаимосоединяемых объема. Посредством вынужденного перемещения смеси образца и буфера несколько раз туда и обратно из одного объема в другой через узкий проход обеспечивают их тщательное перемешивание. Технический результат - быстрое и безопасное выделение нуклеиновых кислот. 11 с. и 33 з.п. ф-лы, 4 ил.
| US 5330916, 19.17.1994 | |||
| US 5786182, А, 28.07.1998 | |||
| Е.М.Хватова и др | |||
| Нуклеотиды мозга | |||
| - М., 1987, с.7-39. |
Авторы
Даты
2005-01-20—Публикация
2000-12-06—Подача