Настоящее изобретение относится к катализаторам для использования при получении метилхлорида и к способу получения метилхлорида из метанола и НСl с использованием таких катализаторов. Изобретение касается также способа продления срока жизни таких катализаторов.
В промышленном производстве метилхлорида с использованием газофазного каталитического процесса метанол и хлористый водород обычно подают в примерно эквимолярном соотношении в реактор с неподвижным или псевдоожиженным слоем при температуре 250-300° С. Реакция является сильно экзотермичной, и часто наблюдаются большие повышения температуры, причем легко достигаются температуры выше 400° С. Такие высокие температуры или "горячие пятна" могут привести к спеканию катализатора и образованию кокса с последующей потерей активности катализатора за относительно короткие периоды времени. Рабочее давление промышленных реакторов не является критическим для работы процесса: используют реакторы высокого и низкого давления.
В качестве катализатора для получения метилхлорида из метанола и НСl обычно используют оксид алюминия. Обычно предпочтительным катализатором является γ -оксид алюминия, поскольку достигаются приемлемые уровни активности для образования метилхлорида без возникновения избытка горячих пятен в слое катализатора. Например, патент US 5183797 описывает применение γ -алюмооксидных катализаторов для получения метилхлорида с подавленным образованием реакционного горячего пятна для ограничения коксования катализатора путем регулирования площади поверхности катализатора.
Основным побочным продуктом реакции метанола с хлористым водородом является диметиловый эфир.
Заявителями было найдено, что, если в качестве катализатора реакции метанола с хлористым водородом использовать η -оксид алюминия, легированный солью щелочного металла, достигается значительное снижение селективности по диметиловому эфиру. Селективность по диметиловому эфиру имеет тенденцию быть примерно в 100 раз ниже, чем селективность, полученная с имеющимся в продаже γ -алюмоксидным катализатором.
Согласно первому аспекту настоящего изобретения предложен катализатор для гидрохлорирования метанола, который включает η -оксид алюминия, легированный солью щелочного металла.
Согласно второму аспекту настоящего изобретения предложен катализатор для гидрохлорирования метанола, приготовление которого включает стадию легирования η -оксида алюминия солью щелочного металла. После этого легированный продукт может быть прокален.
Согласно третьему аспекту настоящего изобретения предложен способ получения метилхлорида, который включает реакцию метанола с НСl в паровой фазе в присутствии катализатора, определенного в первом или втором аспектах настоящего изобретения.
Предпочтительно щелочным металлом в соли щелочного металла, которой согласно настоящему изобретению легируют η -оксид алюминия, является цезий или калий, более предпочтительно, цезий, поскольку снижение селективности по диметиловому эфиру является более заметным. Было найдено, что существует малая разница в селективности по метилхлориду или диметиловому эфиру между различными солями одного и того же щелочного металла, например нитратом, хлоридом и гидроксидом.
Легирование η -оксида алюминия солью щелочного металла может быть осуществлено известными методами пропитки. Обычно к η -оксиду алюминия по каплям добавляют водный раствор соли щелочного металла. Затем η -оксид алюминия нагревают под вакуумом для удаления воды. Легированный катализатор может быть после этого прокален.
Согласно следующему аспекту настоящего изобретения предложен способ приготовления катализатора по первому или второму аспектам настоящего изобретения, включающий стадию пропитки η -оксида алюминия водным раствором соли щелочного металла.
Концентрация водного раствора соли щелочного металла, используемого в способе по следующему аспекту настоящего изобретения, должна быть выбрана так, чтобы дать требуемую концентрацию соли щелочного металла в катализаторе.
Концентрация соли щелочного металла в катализаторе обычно составляет 0,05-5,0 ммоль × г-1, предпочтительно 0,1-3,0 ммоль × г-1 и более предпочтительно 0,1-2,0 ммоль × г-1, например, 0,2-2,0 ммоль × г-1.
Физическую форму катализатора, т.е. форму и размер, выбирают с учетом, среди прочего, конкретного реактора, используемого в реакции гидрохлорирования, и условий реакции в нем.
Мольное соотношение НСl : метанол, используемое при получении метилхлорида, составляет по меньшей мере 1:10 и не более чем 10:1, предпочтительно 1:1,5-1,5:1, более предпочтительно является близким к стехиометрическому.
При таком получении процесс можно проводить при 200-450° С, предпочтительно около 250° С.
При таком получении процесс можно проводить в реакторах парофазного гидрохлорирования высокого или низкого давления, обычно между 100 и 1000 кПа (абс.).
Процесс получения может проводиться периодически или быть непрерывным процессом. Непрерывный процесс является предпочтительным.
Дополнительные аспекты изобретения относятся к легированию η -оксида алюминия для того, чтобы задержать начало коксования такого катализатора при его использовании в реакции гидрохлорирования.
Предпочтительно в таких дополнительных аспектах изобретения щелочной металл в соли щелочного металла, которой проводится легирование η -оксида алюминия, представляет собой цезий или калий, предпочтительно цезий. Было найдено, что есть лишь небольшое различие в скорости коксообразования между различными солями одного и того же металла, например, нитратом, хлоридом и гидроксидом.
Настоящее изобретение дополнительно поясняется ссылкой на нижеследующие примеры.
Рабочие характеристики катализаторов при гидрохлорировании метанола оценивали, используя обычную микрореакторную систему, работающую при атмосферном давлении с потоком газа, регулируемым регуляторами массового потока Brooks.
В примерах удельные поверхности и объемы пор катализаторов определяли по абсорбции азота, а активность катализаторов определяли в лабораторном микрореакторе. Изотермы абсорбции азота определяли, используя Micromeritics ASAP2400 Gas Absorption Analyser после дегазации образцов катализатора в течение ночи.
Общая методика
Приблизительно 0,04 мл/мин жидкого метанола подавали насосом ВЭЖХ в испаритель из нержавеющей стали, заполненный стеклянными бусинами диаметром 2-3 мм, поддерживаемый при температуре 130° С. Полученный таким образом поток испаренного метанола был эквивалентен 36,3 мл/мин потока паров метанола при комнатной температуре и давлении. Для того, чтобы облегчить прохождение метанола через испаритель, в испаритель одновременно вводили 25 мл/мин газообразного азота.
Испаренную смесь метанол/азот смешивали с 40 мл/мин газообразного хлористого водорода и подавали в U-образную реакторную трубку из пирекса, содержащую катализатор и погруженную в печь с циркуляцией воздуха. Температуру печи контролировали двумя термопарами, помещенными на стенке реактора в окрестности заполненного катализатором слоя.
В примерах 1-14 экструдаты катализатора размалывали и просеивали до фракции размером 300-500 микрон и 0,07 г размолотого катализатора смешивали с 0,9 г пирекса фракции такого же размера. Эту смесь помещали в реакторной трубке микрореакторной системы внутрь печи при температуре 250° С. Рабочие характеристики катализатора оценивали путем повышения температуры печи на 10° С/час до максимальной температуры 310° С. Пробы реакторных продуктов анализировали газовой хроматографией каждые 15 минут.
Выходящие из микрореактора газы смешивали с 5 л/мин газообразного азота, чтобы предотвратить конденсацию любых продуктов реакции или непрореагировавшего метанола, и часть этого потока анализировали газовой хроматографией, используя газовый хроматограф НР5890, оборудованный клапаном для отбора проб газа и капиллярной колонкой CPWax 52 50 м × 0,530 мм диаметром (от Chrompak). Полученный от газового хроматографа сигнал интегрировали, используя компьютерную программу РЕ Nelson Turbochrom, и относительное содержание метилхлорида, диметилового эфира и непрореагировавшего метанола получали в виде нормализованного процентного (об./об.) состава, используя относительные факторы отклика для данных компонентов, которые были предварительно определены из анализа волюметрически приготовленных стандартных газовых смесей.
Результаты температурных профилей анализировали, используя линеаризированную форму уравнения Аррениуса (график ln (% об./об.) как функция 1/Т), чтобы получить расчетные значения активности по образованию метилхлорида и диметилового эфира при 290° С.
Примеры 1-3
Данные примеры являются сравнительными испытаниями, в которых используют экструдаты γ -оксида алюминия с удельными поверхностями 296 м2 ×г-1, 196 м2 ×г-1 и 225 м2 ×г-1 соответственно размолотые и просеянные до фракции размером 300-500 микрон. Оценка их рабочих характеристик дала результаты, показанные в таблице 1.
Из таблицы 1 можно видеть, что (а) эти катализаторы показывают приемлемый уровень активности по отношению к образованию метилхлорида при значительном уровне образования побочного продукта диметилового эфира и (b) активность этих катализаторов не связана непосредственно с измеренной удельной поверхностью.
Примеры 4-6
Данные примеры являются сравнительными испытаниями, в которых экструдаты η -оксида алюминия с удельными поверхностями по БЭТ 332 м2 ×г-1, 417 м2 ×г-1 и 398 м2 ×г-1 соответственно были размолоты и просеяны до фракции размером 300-500 микрон, и оценивались их рабочие характеристики. Полученные результаты приведены в таблице 2.
Из таблицы 2 можно видеть, что уровни активности по отношению к образованию метилхлорида, достигнутые на η -алюмоксидных катализаторах, значительно выше уровней, достигнутых на γ -алюмооксидных катализаторах (примеры 1-3), в то время как полученные концентрации диметилового эфира подобны наблюдавшимся для γ -алюмооксидных катализаторов. Должно быть ясно, что при таких высоких уровнях активности по отношению к образованию метилхлорида использование таких η -алюмоксидных катализаторов в промышленном процессе становится проблематичным из-за возникновения больших горячих пятен в слое катализатора.
Примеры 7 и 8
Эти примеры показывают использование легированных η -оксидов алюминия согласно настоящему изобретению. Образцы η -алюмоксидных экструдатов, использованные в примере 4, пропитывали хлоридом калия и хлоридом цезия следующим образом: η -алюмоксидный экструдат (приблизительно 10 г) вводили в двугорлую колбу, колбу откачивали для удаления воздуха из пор оксида алюминия. Раствор соли щелочного металла (приблизительно 30 мл) добавляли в колбу через капельную воронку. Затем частицы катализатора отфильтровывали и сушили в роторном испарителе при 70° С под вакуумом в течение одного часа. После сушки катализаторы размалывали и просеивали до фракции с размером частиц 300-500 микрон для испытаний. Номинальный ввод щелочного металла в каждый образец катализатора рассчитывали исходя из замеренного объема пор η -алюмоксидного экструдата и концентрации раствора соли, использованного для каждого приготовления. Полученные результаты приведены в таблице 3.
Из таблицы 3 можно видеть, что (а) добавление соли щелочного металла умерило активность по образованию метилхлорида до приемлемых уровней, в то время как селективность по диметиловому эфиру была впечатляюще снижена, и (b) влияние соли цезия на селективность по диметиловому эфиру существенно выше чем то, которое было достигнуто с солью калия.
Примеры 9 и 10
Данные примеры иллюстрируют катализаторы по настоящему изобретению, включающие η -оксид алюминия, легированный хлоридом цезия. Образцы η -алюмоксидных катализаторов, использованные в примерах 5 и 6, были пропитаны хлоридом цезия по методике, описанной в примерах 7 и 8. Полученные результаты приведены в таблице 4.
Из таблицы 4 можно видеть, что добавление соли цезия умеряет активность по отношению к образованию метилхлорида и впечатляюще снижает селективность по отношению к образованию диметилового эфира.
Примеры 11-14
Данные примеры показывают другие катализаторы по настоящему изобретению. В этих примерах образцы η -алюмоксидного экструдата, использованного в примере 4, пропитывали различными концентрациями хлорида цезия, используя способ, описанный в примерах 7 и 8. Полученные результаты приведены в таблице 5.
Из таблицы 5 можно видеть, что влияние добавления хлорида цезия на наблюдаемые изменения активности по метилхлориду и диметиловому эфиру явно нелинейно. Существенное снижение активности по образованию метилхлорида получено при вводе 0,1 ммоль × г-1 хлорида цезия, но для получения наиболее полного снижения селективности по отношению к образованию диметилового эфира необходимы более высокие концентрации хлорида цезия.
Примеры 15-20
Эти примеры демонстрируют коксование катализаторов со временем, причем пример 15 является сравнительным примером. В примерах 15-20 приготовление катализаторов осуществляли, пропитывая хлоридом цезия η -алюмоксидные экструдаты с удельной поверхностью по БЭТ 320 м2 ×г-1 следующим образом: η -алюмоксидный экструдат (приблизительно 10 г) вводили в двугорлую колбу, колбу откачивали для удаления воздуха из пор оксида алюминия. Раствор хлорида цезия (приблизительно 30 мл) добавляли в колбу через капельную воронку. Затем частицы катализатора отфильтровывали и сушили в роторном испарителе при 70° С под вакуумом в течение одного часа. После сушки катализаторы размалывали и просеивали до фракции с размером частиц 300-500 микрон для испытаний. Номинальный ввод щелочного металла в каждый образец катализатора рассчитывали исходя из замеренного объема пор η -алюмоксидного экструдата и концентрации раствора соли, использованного для каждого приготовления.
Коксование катализаторов во времени определяли, используя реакторную систему Rupprecht and Patashnick РМА1500 Pulse Mass Analyser ТЕОМ (ТЕОМ обозначает осциллирующие микровесы с клиновидным элементом). Образец (приблизительно 100 г) катализатора, показанного в таблице 6, загружали в ТЕОМ реактор и образец сушили in situ в токе гелия в течение 5 часов при 400° С. После сушки температуру образца понижали до 390° С и оставляли образец при этой температуре на ночь.
Таблица 6
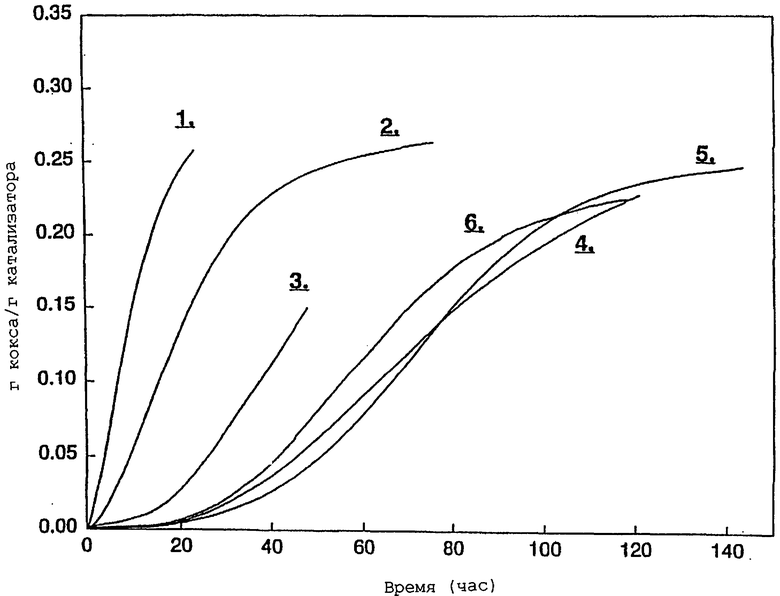
Коксование катализатора при 390° С осуществляли, заменяя поток газа Не на метилхлорид (15 мл/мин при нормальных температуре и давлении), подаваемый через регулятор массового потока Brooks, и осуществляя мониторинг увеличения массы катализатора за период нескольких суток при атмосферном давлении. Результаты показаны на чертеже, который показывает прирост массы на грамм катализатора как функцию времени пробега. На чертеже кривые обозначены номерами 1-6, соответствующими соответственно примерам 15-20.
Из чертежа можно видеть, что для всех катализаторов скорость отложения кокса как функция времени меняется нелинейным образом. Однако при увеличении ввода цезия начало коксования задерживалось настолько, что время достижения заданного уровня коксоотложения впечатляюще возрастало. Полученные результаты показывают, что максимальное влияние на отложение кокса достигается при вводе цезия большем или равном 0,2 ммоль/г.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И ПРОЦЕСС ГИДРОХЛОРИРОВАНИЯ МЕТАНОЛА | 2007 |
|
RU2352393C1 |
| КАТАЛИЗАТОР СИНТЕЗА АЛКИЛМЕРКАПТАНА И СПОСОБ ПРИГОТОВЛЕНИЯ ТАКОГО КАТАЛИЗАТОРА | 2004 |
|
RU2342992C2 |
| КАТАЛИЗАТОРЫ, КОТОРЫЕ СОДЕРЖАТ ГАЛОГЕНИДСОДЕРЖАЩИЕ ВОЛЬФРАМАТЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ, ДЛЯ СИНТЕЗА АЛКИЛМЕРКАПТАНОВ И СПОСОБ ИХ ПРИГОТОВЛЕНИЯ | 2005 |
|
RU2384364C2 |
| СОДЕРЖАЩИЕ ВОЛЬФРАМАТ КАТАЛИЗАТОРЫ СИНТЕЗА АЛКИЛМЕРКАПТАНА И СПОСОБ ИХ ПРИГОТОВЛЕНИЯ | 2005 |
|
RU2387476C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ НЕНАСЫЩЕННЫХ КИСЛОТ ИЛИ ИХ СЛОЖНЫХ ЭФИРОВ И КАТАЛИЗАТОРЫ ДЛЯ ИХ ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2203731C2 |
| КАТАЛИЗАТОР ДЛЯ СИНТЕЗА АЛКИЛМЕРКАПТАНОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2635922C2 |
| ФОСФОРСОДЕРЖАЩИЙ КАТАЛИЗАТОР ДЛЯ ПРЕВРАЩЕНИЯ ОКСИГЕНАТОВ В ОЛЕФИНЫ | 2014 |
|
RU2635567C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛМЕРКАПТАНОВ В МНОГОЗОННОМ РЕАКТОРЕ С НЕПОДВИЖНЫМ СЛОЕМ | 2007 |
|
RU2443686C2 |
| СПОСОБ ЭПОКСИДИРОВАНИЯ ОЛЕФИНОВ И КАТАЛИЗАТОР ДЛЯ ПРИМЕНЕНИЯ В СПОСОБЕ | 2004 |
|
RU2328491C2 |
| КАТАЛИЗАТОР, СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРА И СПОСОБ ПОЛУЧЕНИЯ НЕНАСЫЩЕННОЙ КАРБОНОВОЙ КИСЛОТЫ И/ИЛИ ЭФИРА НЕНАСЫЩЕННОЙ КАРБОНОВОЙ КИСЛОТЫ | 2020 |
|
RU2801149C2 |
Использование: химия хлорорганических соединений. Сущность: заявлен катализатор гидрохлорирования, который включает η-оксид алюминия, легированный хлоридом цезия. Также заявлен способ гидрохлорирования метанола в паровой фазе с использованием вышеописанного катализатора. Технический результат: понижение селективности по диметиловому эфиру и замедление отложения кокса на работающем катализаторе. 3 с. и 13 з.п. ф-лы, 6 табл., 1 ил.
| JP 54084505 A, 05.07.1979 | |||
| СПОСОБ РЕГУЛИРОВАНИЯ ПРОДУВКИ ВАПНЫ КИСЛОРОДНОГО КОНВЕРТЕРА | 0 |
|
SU234433A1 |
| US 3726935 A, 10.04.1973 | |||
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРУГЛЕВОДОРОДОВ МЕТАНОВОГО РЯДА | 1996 |
|
RU2127245C1 |
Авторы
Даты
2005-03-10—Публикация
2000-06-01—Подача