Изобретение относится к химии гетероциклических соединений, а именно к замещенным 1-(пиридинил-3)-2-феноксиэтанолам-1 общей формулы I,
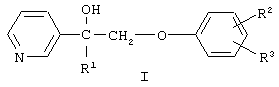
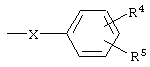
где R1 означает алкил с числом атомов углерода от одного до восьми, циклоалкил с числом атомов от трех до восьми или группу 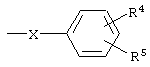 , где Х означает группу, СН=СН или простую связь, R4 и R5 независимо друг от друга означают атом водорода, галогена или трифторметильную группу R2 и R3 независимо друг от друга означают атом водорода или галогена, и их соли с органическими кислотами, которые обладают фунгицидной активностью и могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов.
, где Х означает группу, СН=СН или простую связь, R4 и R5 независимо друг от друга означают атом водорода, галогена или трифторметильную группу R2 и R3 независимо друг от друга означают атом водорода или галогена, и их соли с органическими кислотами, которые обладают фунгицидной активностью и могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов.
Известен 3,3-диметил-1-(1H-1,2,4-триазолил-1)-1-(4-хлорфенокси)-бутанон-2, или триадимефон, который используется в качестве системного фунгицида для борьбы с болезнями пшеницы (мучнистая роса, ржавчина), яблони (мучнистая роса, парша), огурцов и дыни (мучнистая роса), виноградной лозы (оидиум, серая гниль), томатов защищенного грунта (мучнистая роса), черной смородины (американская мучнистая роса) и других культур [Справочник по пестицидам / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан, Т.Н.Пылова. - М.: Химия, 1985. - 352 с.].
Известны пиридинметанолы общей формулы II,
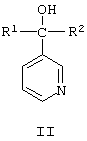
где R1 означает фенил, 4-хлорфенил или циклогексил, R2 означает С4-C8 циклоалкенил или С3-C8 циклоалкил, а также их соли, которые обладают фунгицидной активностью и могут использоваться для подавления грибов, поражающих сельскохозяйственные культуры и декоративные растения [Пат. США №3794656, кл. C 07 D 31/24 (НПК 260-290 R), 1974].
Известны различные препаративные формы (композиции) фунгицидных препаратов, например порошки, гранулы, растворы в воде и органических растворителях, смачивающиеся порошки, концентраты эмульсий и другие [Пестициды и регуляторы роста растений/ Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. - М.: Химия, 1995, с.9-26]. Препаративные формы помимо основного действующего вещества содержат различные наполнители и добавки, характер которых определяется конкретными условиями применения такой формы. Так растворы пестицидов в воде или органических растворителях, применяющиеся для опрыскивания растений, внесения в почву различными методами, пропитки материалов, содержат действующее вещество и растворитель, но могут также содержать регуляторы кислотности, поверхностно-активные вещества, красители, умягчители воды, синергические добавки. Например, препарат ДНОК применяют в виде водного раствора для опрыскивания садов и виноградников в концентрации 0,1-0,2% [Пестициды и регуляторы роста растений / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. - М.: Химия, 1995, с.242].
Техническая задача, решаемая данным изобретением, состоит в расширении ассортимента фунгицидов для более эффективной борьбы с вредоносными грибами.
Для решения этой задачи синтезируют замещенные 1-(пиридинил-3)-2-феноксиэтанолы-1 общей общей формулы I, обладающие фунгицидной активностью.
Согласно изобретению замещенные 1-(пиридинил-3)-2-феноксиэтанолы-1 формулы I получают взаимодействием замещенных 2-(пиридинил-3)оксиранов формулы III с замещенным фенолом формулы IV, где R1, R2 и R3 имеют те же значения, что и в формуле I, в присутствии основания при 100-150°С:
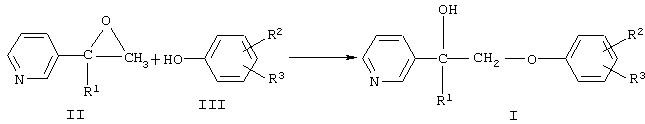
Аналогичные процессы присоединения фенолов к оксиранам известны [S.Miller, B.Bann, R.Thrower. The reaction between phenol and ethylene oxide // Journ. Chem. Soc., 1950, p. 3623].
Замещенные 2-(пиридинил-3)оксираны формулы III получают взаимодействием кетонов общей формулы V с солями триметилсульфония в диметилсульфоксиде или диметилсульфиде в присутствии сильного основания, например трет-бутилата калия, трет-амилата натрия или гидрида натрия или в межфазных условиях при температуре от -10 до +5°С:
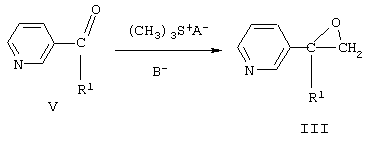
где R1 означает то же, что и в формуле I, А означает анион кислоты, В означает основание.
Для других субстратов такая реакция известна [E.J.Corey, M.Chaykovsky. Dimethyloxosulfonium methylide ((СН3)2SOСН2) and dimethylsulfonium methylide ((CH3)2SCH2). Formation and application to organic syntheses // Journal of the American Chemical Society. 1965. Vol. 87. № 6. P. 1353-1364].
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. 2-(Пиридинил-3)-2-циклогексилоксиран. К смеси 9.45 г (0.05 моль) пиридинилцклогексилкетона, 14.28 г (0.07 моль) иодида триметилсульфония и 31 мл ДМСО при охлаждении до 0°С добавлют по каплям в течение 30 мин расвор 4.63 г (0.063 моль) трет-бутоксида калия в 31 мл ДМСО. Смесь перемешивают 15 мин, охлаждают в смеси льда и соли и в течение 30 мин приливают по каплям 150 мл воды. Продукт извлекают СНСl3 (3×30 мл). Экстракт промывают водой (3×30 мл) и 20 мл рассола. Раствор сушат над MgSO4 и растворитель отгоняют в вакууме. Получают 8.05 г (85,2%) оксирана в виде масла. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 0,75-1,75 (м, 11 Н, СН циклогексильн.), 2,70, 3,10 (АВ-система, 2 Н, CH2, J=4,0), 7,38 (д д, 1 Н, 5-СН пирид., J1=8,0, J2=4,0), 7,66 (д т, 1 Н, 4-СН пирид., J1=8,0, J2=1,1), 8,45 (дд, 1 Н, 6-СН пирид., J1=4,0, J2=2,1), 8,47 (д, 1 Н, 2-СН пирид., J=2,1).
Пример 2. 1-(Пиридинил-3)-1-фенил-2-(4-хлорфенокси)этанол-1 (1). К раствору 0,346 г (1,76 ммоль) 2-(пиридинил-3)-2-фенилоксирана и 0,44 г (3,4 ммоль) 4-хлорфенола в 3 мл диметилфрмамида добавляют 0,12 г NaOH, 0,05 мл воды и нагревают 4 ч при температуре 120°С. Затем реакционную смесь выливают в 30 мл воды при перемешивании, экстрагируют хлороформом (3×15 мл), экстракт промывают трижды 10%-ным раствором NaOH, рассолом, сушат MgSO4 и упаривают в вакууме. Получают 0,41 г (71,6%) 1-(пиридинил-3)-1-фенил-2-(4-хлорфенокси)этанола-1 в виде масла. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 4,52, 4,66 (АВ-система, 2Н, СН2, J=9,6), 6,3 (с, 1Н, ОН), 7,0, 7,5 (А2В2-система, 4Н, СН хлорфен., J=8,8), 7,33 (м, 6Н, 5 СН фенила, 1 СН пирид.), 7,86 (д, 1Н, СН пирид., J=8,4), 8,42 (д, 1Н, СН пирид., J=4,2),8,68 (с, 1Н, СН пирид.).
Пример 3. 1-(Пиридинил-3)-1-циклогексил-2-(4-хлорфенокси)этанол-1 (2). Масло. Спектр ЯМР 1H (DMSO-d6, δ, м.д., J, Гц): 0,8-1,9 (м, 11Н, СН циклогекс.), 4,2 (АВ-система, 2Н, СН2О, J=8,4), 5,3 (с, 1Н, ОН), 6,93, 7,28 (А2В2-система, 4Н, СН хлорфен., J=9,5), 7,33 (дд, 1Н, СН пирид., J1=7,6, J2=3,8), 7,83 (д, 1Н, СН пирид., J=7,6), 8,40 (д, 1Н, СН пирид., J=3,8), 7,68 (с, 1Н.СН пирид.).
Пример 4. 1-(Пиридинил-3)-1-[2-(3-трифторметилфенил)этенил]-2-(4-хлорфенокси)этанол-1 (3). Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 4,34, 4,45 (АВ-система, 2Н, СН2, J=10,0), 6,15 (с, 1Н, ОН), 6,78, 6,89 (АВ-система, 2Н, СН=СН, J=17,0), 7,16 (дд, 1Н, СН пирид., J1=8,4, J2=4,2), 7,40, 7,54 (А2В2-система, 4Н, СН хлорфен., J=8,0), 7,59-7,82 (м, 4Н, СН аром.), 7,92 (д, 1Н, СН пирид., J=4,2), 8,48 (д, 1Н, СН пирид., J=4,2), 8,77 (с, 1Н, СН пирид.).
Пример 5. 1-(Пиридинил-3)-1-[2-(4-хлорфенил)этенил]-2-(4-хлорфенокси)этанол-1 (4). Масло. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 4,23, 4,32 (АВ-система, 2Н, СН2, J=9,6), 6,12 (с, 1Н, ОН), 6,74, 6,82 (АВ-система, 2Н, СН=СН, J=14,4), 6,95, 7,20(А2В2-система, 4Н, СН хлорфен., J=8,0), 7,06 (м, 1Н, СН пирид.), 7,38, 7,50 (А2В2-система, 4Н, СН хлорфен., J=8,0), 7,95 (д, 1Н, СН пирид., J=4,2), 8,45 (д, 1Н, СН пирид., J=4,2), 8,80 (с, 1Н, СН пирид.).
Пример 6. 1-(Пиридинил-3)-1-(2,2-диметилпропил)-2-(4-хлорфенокси)этанол-1 (5). Т. пл. 145-146°С. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 0,75 (с, 9Н, СН2), 1,95, 2,00, (АВ-система, 2Н, СН2 алиф., J=14,8), 4,02 (АВ-ситема, 2Н, СН2O, J=8,1), 5,3 (уш.с, 1Н, ОН), 6,9, 7,28 (А2В2-система, 4Н, СН хлорфен., J=9,2), 7,32 (дд, 1Н, СН пирид., J1=8,4, J2=4,2), 7,92 (д, 1Н, СН пирид., J=8,4), 8,41 (д, 1Н, СН пирид., J - 4,2), 8,78 (с, 1Н, СН пирид.).
Пример 7. Испытания на биологическую активность соединений проводили в экспериментах in vitro. Для этого готовили композиции, представляющие собой ацетоновые растворы испытуемых веществ с концентрацией 0,377%. В расплавленный сахарозно-картофельный агар добавляли полученную композицию по 1 мл на 100 мл агара. При этом получали агаровую среду, содержащую 30 мг/л испытуемого соединения. В среду для контроля добавляли чистый ацетон в том же количестве. Приготовленные таким способом среды разливали в чашки Петри, охлаждали и на поверхность затвердевшего агара высевали кусочки мицелия грибов, после чего чашки инкубировали в течение 3 суток при 25±0,5°С. Подавление роста мицелия вычисляли в процентах к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице.
Описываются замещенные 1-(пиридинил-3)-2-феноксиэтанолы-1 общей формулы I,

где R1 означает алкил, циклоалкил, замещенный или незамещенный фенил, R2 и R3 означают водород или галоген, которые получают взаимодействием оксиранов формулы II с фонолами формулы III в присутствии основания при 100-150°С, и фунгицидная композиция на их основе.
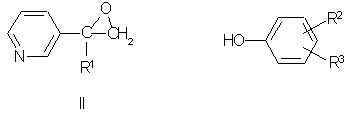
Технический результат заключается в получении соединений, эффективных против вредоносных грибов. 3 н.п. ф-лы, 1 табл.
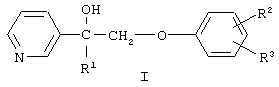
где R1 означает алкил с числом атомов углерода от одного до восьми, циклоалкил с числом атомов от трех до восьми или группу
где Х означает группу СН=СН или простую связь; R4 и R5 независимо друг от друга означают атом водорода, галогена или трифторметильную группу; R2 и R3 независимо друг от друга означают атом водорода или галогена, и их соли с органическими кислотами.


где R1 означает алкил с числом атомов углерода от одного до восьми, циклоалкил с числом атомов от трех до восьми или группу
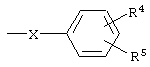
где X означает группу СН=СН или простую связь; R4 и R5 независимо друг от друга означают атом водорода, галогена или трифторметильную группу; R2 и R3 независимо друг от друга означают атом водорода или галогена в присутствии основания при 100-150°С.
| US 3794656, 26.02.1974 | |||
| US 5174997, 29.12.1992 | |||
| US 5196433, 23.03.1993 | |||
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗОЛА, ОПТИЧЕСКИ ИНЕРТНЫЕ ИЛИ ИМЕЮЩИЕ R- ИЛИ S-КОНФИГУРАЦИЮ C-2 И C-3 АСИММЕТРИЧНЫХ ЦЕНТРОВ, ИЛИ ИХ СОЛИ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1990 |
|
RU2039050C1 |
Авторы
Даты
2005-03-20—Публикация
2003-06-26—Подача