Заявки, относящиеся к этой же тематике: Заявка Cho, обозначенная MSB-7241 (U.S. Ser. No. 09/209,920) "Гибридные клетки-хозяева человека для экспрессии генов млекопитающих" и заявка Cho и Chan, обозначенная MSB-7254 (U.S. Ser. No. 09/209,915) "Векторы с последовательностью концевого повтора вируса Эпштейна-Барр" содержат взаимосвязанный материал. Обе заявки зарегистрированы 10 декабря 1998.
Предшествующий уровень техники
Область: Данное изобретение относится к улучшенному способу получения фактора VIII и его производных. Способ в общем относится к конструированию векторов, трансфекции и выбору клеточных линий с улучшенной продукцией в безбелковых условиях. В частности это изобретение относится к процессу получения белка с прокоагулирующей активностью фактора VIII в промышленных масштабах.
Предшествующий уровень техники: Фактор VIII человека - это следовый гликопротеин плазмы, участвующий в качестве кофактора в активации факторов Х и IХа. Наследуемая недостаточность фактора VIII приводит к Х-связанному заболеванию гемофилии А, которое успешно лечится очищенным фактором VIII. Заместительная терапия гемофилии А развивалась от использования фактора VIII, получаемого из плазмы, до применения рекомбинантного фактора VIII, полученного клонированием и экспрессией кДНК фактора VIII в клетках млекопитающих (Wood et al., 1984, Nature 312: 330).
Фактор VIII имеет доменную организацию А1-А2-В-А3-С1-С2 и синтезируется в виде одноцепочечного полипептида из 2351 аминокислот, из которого вырезается сигнальный пептид из 19 аминокислот при транслокации в просвет эндоплазматического ретикулума. Из-за того, что фактор VIII плохо гликозилируется, было сложно достичь высокого уровня экспрессии (>0.2 пг/клетка/день) фактора VIII (Lind et al., 1995, Eur J Biochem. 232: 19-27; Kaufman et al., 1989, Mol Cell Biol. 9: 1233-1242). Экспрессия фактора VIII в клетках млекопитающих обычно на 2-3 порядка ниже, чем экспрессия других генов при использовании аналогичных векторов и методик. Продуктивность клеточных линий для получения фактора VIII находится в пределах 0.5-1 мкЕд/кл/д (0.1-0.2 пг/кл/д).
Было показано, что В-домен фактора VIII является несущественным для прокоагулирующей активности. Различные группы сообщали об улучшении экспрессии фактора VIII в клетках млекопитающих при использовании усеченных вариантов фактора VIII (Lind et al., 1995, Eur J Biochem 232: 19-27; Tajima et al., 1990, Proc 6th Int Symp H.T. p.51-63; US Patent 5,661,008 Almstedt, 1997). Однако, уровень экспрессии вариантов фактора VIII оставался ниже 1 пг/кл/д для стабильного клона клеток.
Краткое изложение изобретения
Мы открыли (i) способ получения клеточных линий с очень высокой продуктивностью белков, обладающих прокоагулирующей активностью фактора VIII, и (ii) свободный от белков плазмы процесс получения белков, обладающих прокоагулирующей активностью фактора VIII.
Процесс получения белков, обладающих прокоагулирующей активностью фактора VIII, в промышленном масштабе. С использованием вновь созданных клеток хозяев были получены клоны клеток со специфической производительностью в пределах 2 - 4 пг/кл/д (10-20 мкЕд/кл/д). В бессывороточных условиях один клон поддерживал суточную продуктивность 2-4 пг/кл/д. Клоны с таким высоким уровнем продуктивности способны производить 3-4 миллиона единиц в день в 15-литровом перфузионном ферментере. По определению одна единица активности фактора VIII - это активность, содержащаяся в одном миллилитре плазмы. Один пг фактора VIII в общем эквивалентен 5 мкЕд активности FVIII.
В данной работе белок, обладающий прокоагулирующей активностью фактора VIII, - это белок, вызывающий активацию фактора Х в модельных системах in vivo и in vitro. В качестве неограничивающих примеров это определение включает полноразмерный рекомбинантный фактор VIII человека и фактор VIII с делетированным В-доменом, последовательность которого приведена на фиг.1.
Высокий уровень экспрессии белка, обладающего прокоагулирующей активностью фактора VIII, означает по крайней мере около 2 мкЕд/кл/д или более, предпочтительно 4 мкЕд/кл/д, наиболее предпочтительно 5 мкЕд/кл/д активности фактора VIII при наращивании в среде, свободной от белков плазмы; или по крайней мере 4 мкЕд/кл/д, предпочтительно 8 мкЕд/кл/д, наиболее предпочтительно 10 мкЕд/кл/д активности фактора VIII при наращивании в среде с добавлением полученного из плазмы белка. Если экспрессируемый белок - BDD-FVIII, то описанным здесь методом можно получить клеточные линии со специфической продуктивностью до 15 мкЕд/кл/д, предпочтительно до 20 мкЕд/кл/д.
При описании происхождения клеточных линий понятие "полученные из" неограниченно включает нормальное митотическое деление клеток и процессы типа трансфекции, слияния клеток или другие генноинженерные методы, используемые для изменения клеток или получения клеток с новыми свойствами.
Краткое описание чертежей
Фиг.1 - аминокислотная последовательность BDD-FVIII (SEQ ID NO:1).
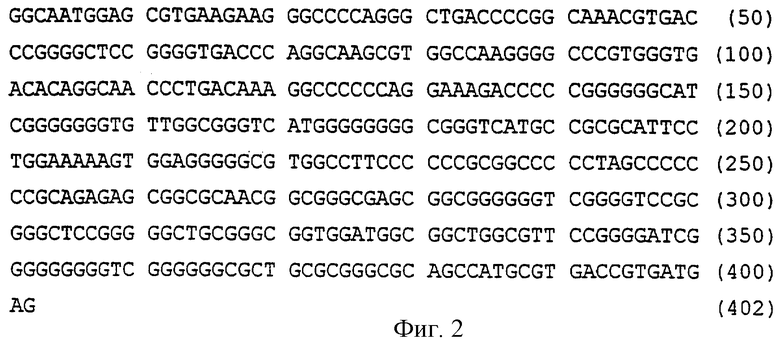
Фиг.2 - последовательность концевого повтора (TR) из вируса Эпштейна-Барр (SEQ ID NO:2).
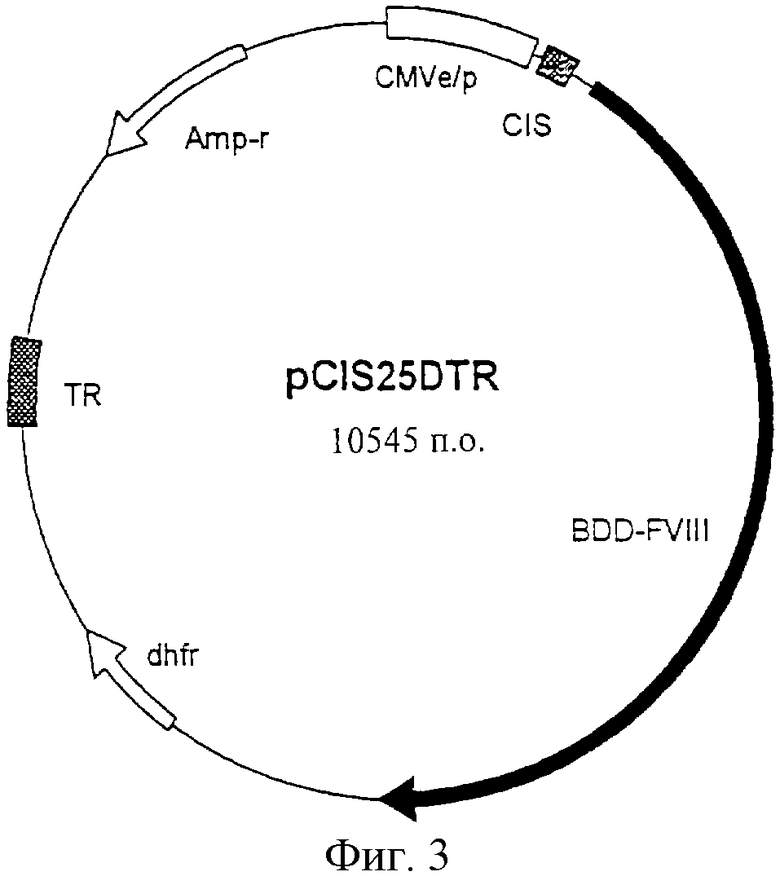
Фиг.3 - карта плазмиды pCIS25DTR.
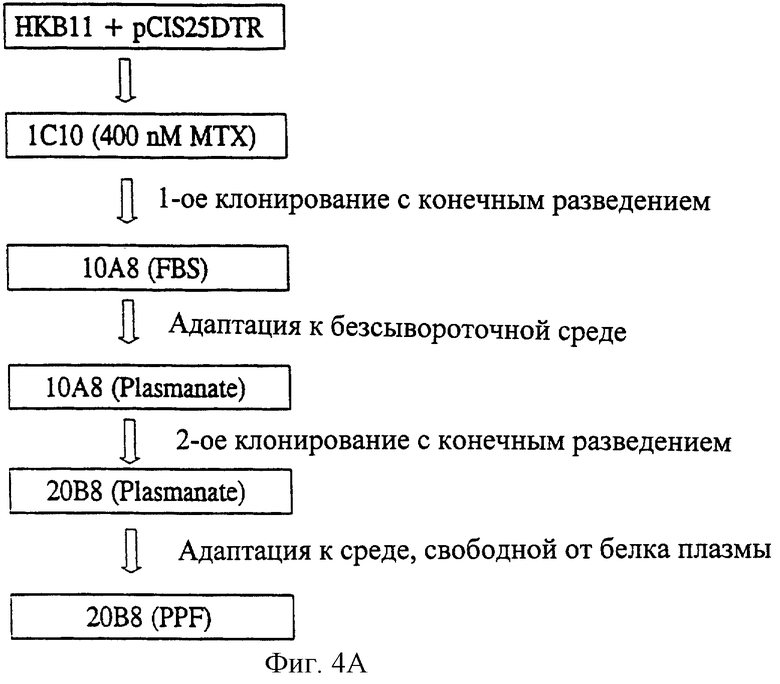
Фиг.4(а) - получение клона 2OВ8.
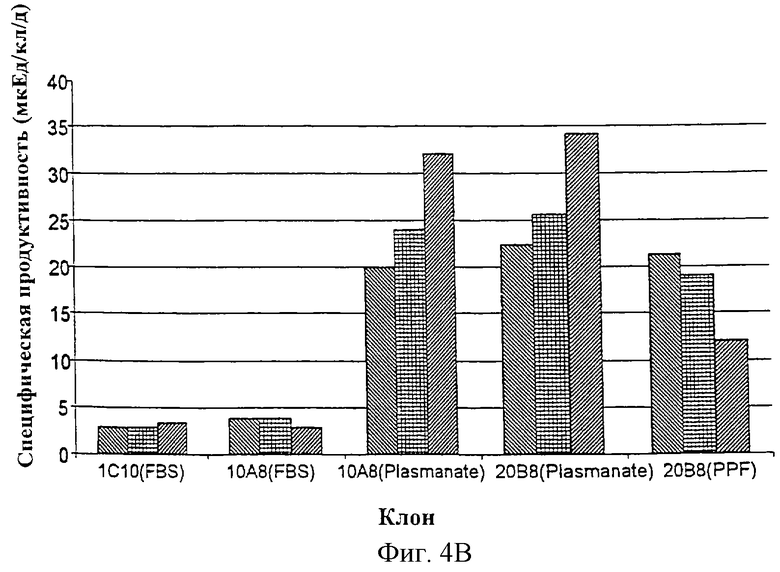
Фиг.4(b) - сравнение продуктивности нескольких клонов в различных средах.
Представлены три пула данных двухмесячного исследования стабильности каждого клона.
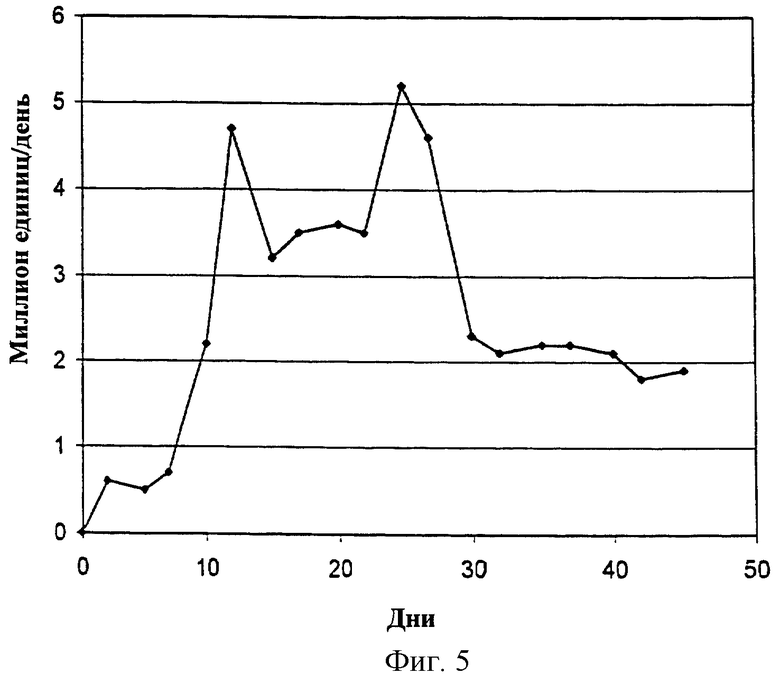
Фиг.5 - объемная продуктивность клона 2OВ8.
Лучшие варианты осуществления изобретения
Исследование FVIII
Активность производных фактора VIII, полученных экспрессией рекомбинантного гена в метотрексат (МТХ)-устойчивых популяциях клеток, определяли хромогенным анализом. Активность измеряли при помощи набора Coatest® factor VIII:С/4 (Chromogenix, Molndal, Sweden) согласно инструкции производителя. В качестве стандартов измерения в этом исследовании использовали анти-гемофилийный фактор (фактор VIII) стандарта США, известный как MEGA I (Office of Biologics Research and review, Bethesda, MD). См. Barrowcliffe, 1993, Thromb Haem 70: 876.
Конструирование векторов экспрессии для FVIII с делетированным В-доменом
Последовательность FVIII с делетированным В-доменом (BDD) представлена на Фиг.1. 90-кДа и 80 кДа-цепи были соединены линкером, состоящим из 14 аминокислот. См. Chan, S.-Y., "Получение рекомбинантного фактора VIII в присутствии липосомоподобных веществ сложного состава" ("Production of Recombinant Factor VIII in the presence of Liposome-like Substances of Mixed Composition"), заявка на Патент США N 08/634,001, зарегистрированная 16 апреля 1996. Вектор экспрессии для BDD-FVIII был получен с использованием стандартных методов для рекомбинантных ДНК. Структура вектора экспрессии (pCIS25DTR) представлена на Фиг.3. Вектор содержит область транскрипции для BDD-FVIII и селективный маркер, дигидрофолят редуктазу (dhfr). Кроме того, для повышения эффективности интеграции в вектор была включена последовательность концевого повтора из вируса Эпштейна-Барр (Фиг.2), который обладает повышенным уровнем лекарственной селекции. Вектор по существу является конструкцией вектора (помещенного в АТСС под номером 98879), который был создан для включения транскрипционного участка, соответствующего последовательности, показанной на Фиг.1. Дополнительную информацию о последовательности концевого повтора можно найти в родственной патентной заявке Cho и Chan, обозначенной MSB-7254, включенной в данное описание путем ссылки, "Последовательность концевого повтора вируса Эпштейна-Барр повышает уровень лекарственной селекции", зарегистрированной в тот же день, что и данная заявка.
Специалисты в данной области техники могут конструировать и использовать аналогичные векторы для получения клеток, экспрессирующих белки, обладающие прокоагулирующей активностью фактора VIII. Например, кодирующие последовательности известных вариантов фактора VIII, сохраняющих прокоагулирующую активность, могут быть заменены на кодирующую последовательность BDD-FVIII. Также, вместо dhfr можно использовать другие селективные маркеры, такие как глутамин синтетаза (gs) или ген устойчивости к нескольким лекарствам (mdr). Выбор агента селекции должен проводиться согласно фактам, известным в данной области техники, т.е. для dhfr предпочтительным агентом селекции является метотрексат, для gs - метионин сульфоксиимин, а для mdr - колхицин.
Примеры
Получение клеточных линий, экспрессирующих BDD-FVIII: Трансфекция. селекция по лекарству и амплификация гена.
Клетки НКВ11 (депозитарный номер в АТСС - CRL 12568 - гибрид клеток 293S и человеческих клеток лимфомы Беркитта, см. заявку на Патент США Cho et al., поданную в тот же день, что и данная заявка, и обозначенную MSB-7241, включенную в данное описание путем ссылки) были трансфицированы 30 микрограммами ДНК pCIS25DTR методом электропорации при 300 вольт и 300 микрофарад (ВТХ Electro cell Manipulator 600) при использовании 2-мм кюветы (ВТХ #620). В сравнительном эксперименте, проведенном параллельно с клетками НКВ11, клетки CHO (яичника китайских хомяков) и 293S (почки эмбриона человека) трансфицировали при использовании катионного липидного реагента DMRIE-C (Life Technologies, Gaithersburg, MD) согласно протоколу, предлагаемому Life Technologies. Амплификацию трансфицированных клеток проводили при возрастающих концентрациях метотрексата (МТХ) (100 нМ, 200 нМ, 400 нМ и 800 нМ) при 1×106 клеток на 96-луночный планшет в МТХ-селективной среде без гипоксантина и тимидина (среда DME/F12 без тимидина и гипоксантина с добавлением 5% диализованной эмбриональной бычьей сыворотки (FBS), поставляемой Hyclone, Logan, UT). Были учтены выросшие МТХ-устойчивые клетки и примерно через 2-3 недели после трансфекции была проверена секреция BDD-FVIII при использовании набора Coatest® factor VIII. Культивирование клеток проводили при 37°С в увлажняемом инкубаторе при 5% СО2.
Клонирование с конечным разведением
Клоны единичных клеток (SCC) были получены при клонировании с конечным разведением (LDC) высоко продуцирующих популяций в 96-луночных планшетах в бессывороточных условиях. Клетки сеяли в количестве 1-10 клеток на лунку в среду DME/F12 с добавлением 10 мкг/мл рекомбинантного инсулина Humulin® (Lilly, Indianapolis, IN), 10X незаменимых аминокислолт (Life Technology, Gaithersburg, MD) и белковой фракции плазмы человека Plasmanate® (Bayer, Clayton, NC). Белковая фракция плазмы человека (НРР) Plasmanate® содержит человеческий альбумин (88%) и различные глобулины (12%). Клоны проверяли на продуцирование BDD-FVIII при использовании наборов Coatest® factor VIII. Клоны с наибольшей продуктивностью отбирали по оценке стабильности в шейкерных флаконах. Для клеток НКВ первый этап клонирования проводили при использовании селективной среды с добавлением 5% диализованной FBS. Второй этап клонирования проводили в среде без сыворотки, но с добавлением белковой фракции плазмы человека Plasmanate® при использовании первичных клонов единичных клеток, адаптированных в бессывороточной среде с добавлением белковой фракции плазмы человека Plasmanate®.
Получение клона НКВ 2OВ8
Как показано на Фиг.4(а), первичная популяция 1С1О была получена из клеток НКВ, трансфицированных pCIS25DTR, после амплификации с 400 нМ МТХ в селективной среде с 5% FBS. Один из первичных клонов единичных клеток (SCC), 1ОА8, полученный из 1С1O клонированном с конечным разведением при использовании селективной среды с добавлением 5% FBS, был адаптирован в бессывороточной среде с добавлением белковой фракции плазмы человека Plasmanate®. Неожиданно оказалось, что клон 1ОА8 обладает сильно повышенным уровнем продукции rFVIII на этом этапе (Фиг.4b). Таким образом, было проведено второе клонирование с конечным разведением в среде с добавлением белковой фракции плазмы человека Plasmanate®. Продуктивность клонов SCC (например, 2OВ8), полученных при втором клонировании с конечным разведением, была аналогична продуктивности клона 1ОА8, адаптированного при добавлении белковой фракции плазмы человека Plasmanate®. Клон 2ОВ8 обладал более высокими уровнями BDD-FVIII, чем исходный клон 1ОА8, полученный при первом клонировании с конечным разведением в среде, содержащей сыворотку. В заключение клон 2ОВ8 был адаптирован к росту в среде без белков плазмы (PPF). Образцы клона 2ОВ8 были помещены в Американскую Коллекцию Типов Культур (АТСС) (Manassas,VA) (номер в АТСС: CRL-12582).
Как показано в Таблице 1, клоны НКВ обладают сверхпродуктивностью по BDD-FVIII. В клетках НКВ наблюдалось 10-20-кратное увеличение продуктивности по сравнению с клонами, полученными после трансфекции клеток СНО и 293S. Клетки НКВ, не образующие больших клеточных агрегатов при росте в суспензионной культуре, являются предпочтительными для экспрессии белков, обладающих прокоагулирующей активностью фактора VIII.
Адаптация клонов при отсутствии белков плазмы
Клоны НКВ, адаптированные к росту в виде бессывороточных суспензионных культур, далее адаптировали к росту без добавок белков плазмы. Этот процесс проводили в стерильных поликарбонатных шейкерных флаконах (Cornig, Cornig, NY) при плотности клеток примерно 0.5×106 кл/мл при использовании среды, свободной от белков плазмы. Средой, свободной от белков плазмы (PPF), являлась среда DME/F12 с добавлением плуроника F68 (0.1%), CuSO4 (50 нМ) и FeSO4/EDTA (50 мкМ). Полную замену среды проводили каждые 48 часов, и шейкерные флаконы снова засевали при плотности 0.5×106 кл/мл.
Ферментация клона 2OВ8
Продуктивность клона 2OВ8 оценивали в 15-литровом перфузионном ферментере. Ферментер засевали клетками клона 2OВ8 при плотности около 3×106 кл/мл. Ферментер орошался со скоростью 4 объема в день бессывороточной средой, как описано в предыдущем абзаце. Во время периода оценки (45 дней) поддерживалась конечная плотность клеток 2×107. Как показано на Фиг.5, в течение первых 4 недель ферментации клетки клона 2OВ8 орошались бессывороточной средой с добавлением белковой фракции плазмы человека Plasmanate® и были способны поддерживать высокую продуктивность. С 28 дня до конца ферментации клетки орошались той же бессывороточной средой, но без белковой фракции плазмы человека Plasmanate®. Как показано на Фиг.5, клетки продолжали продуцировать FVIII на высоком уровне в среде без белков плазмы. "Среда, свободная от белков плазмы" означает, что никаких белков, выделяемых из плазмы, к среде не добавлялось.
Обсуждение
Получение клеток НКВ обеспечивает безбелковую систему для получения не только BDD-FVIII, но и других терапевтических белков. Белки, полученные в клетках НКВ, гликозилированы по человеческой модели, что может увеличить время полужизни некоторых гликопротеинов in vivo. Эти клетки также могут быть использованы для получения аденовирусных и адено-ассоциированных линий, разрабатываемых для целей генотерапии.
Вышеприведенные примеры предназначены для иллюстрации изобретения, и специалисты в данной области техники могут использовать их варианты. Соответственно предполагается, что объем заявки ограничивается только нижеприведенной формулой изобретения.

Изобретение относится к биотехнологии и может быть использовано для получения белка, обладающего активностью фактора VIII, в промышленных масштабах. Проводят трансфекцию клеток НКВ вектором pCIS25DTR, содержащим селективный маркер и последовательность, кодирующую белок, обладающий прокоагулирующей активностью фактора VIII. Отбирают клетки при помощи агента селекции и выделяют клоны, экспрессирующие на высоком уровне белок, обладающий прокоагулирующей активностью фактора VIII. Изобретение позволяет получить белок, обладающий активностью фактора VIII, с высоким выходом, а также линию клеток НКВ с улучшенной продукцией в безбелковых условиях. 4 н. и 4 з.п. ф-лы, 6 ил., 1 табл.
| US 5612213 А, 18.03.1997 | |||
| US 5804420 А, 08.09.1998 | |||
| PU H | |||
| et al., Rapid establishment of high-producing cell lines using dicistronic vectors with glutamine synthetase as the selection marker,MOL | |||
| BIOTECHNOL., 1998, v.10, n.1, p.17-25 | |||
| KANE S.E., Selection of transfected cells and coamplification of transfected genes, METHODS MOL | |||
| BIOL., 1997, v.62, p.359-367 | |||
| BEBBINGTON C.R | |||
| et al., High-level expression of a recombinant antibody from myeloma cells using a glutamine synthetase gene as an amplifiable selectable marker, Biotechnology, 1992, v.10, n.2, p.169-175 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИКЕТОАМИНОВ | 0 |
|
SU254076A1 |
| ТРАНСГЕН ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА В МОЛОКЕ ТРАНСГЕННЫХ КОРОВ, СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОЙ КОРОВЫ (ВАРИАНТЫ), МОЛОКО ОТ ТРАНСГЕННОЙ КОРОВЫ, ПИЩЕВОЙ СОСТАВ | 1990 |
|
RU2095414C1 |
Авторы
Даты
2005-03-27—Публикация
1999-12-08—Подача