Изобретение относится к способу получения гибридных клеток человека НКВ11, линии гибридных клеток человека IG2.
Предшествующий уровень техники
Область применения: Это изобретение в общем относится к генноинженерным клеточным линиям млекопитающих для получения биологически активного белка. Конкретно, изобретение касается клонов гибридных клеток человека, полученных путем слияния клеток почки эмбриона человека (293S) и клеток лимфомы Беркитта. Эти гибридные клетки человека могут быть использованы для получения гетерологичных белков.
Предшествующий уровень: К настоящему моменту большинство терапевтических рекомбинантных белков получают в клетках млекопитающих, кроме клеток человека.
Некоторые примеры
Для получения терапевтического рекомбинантного белка использовали клетки яичника китайского хомяка (СНО) (dhfr-) (Urlaub et al., 1980, Proc Natl Acad Sci USA 77: 4216-42220) с амплифицируемым маркером селекции дигидрофолят редуктазой (Kaufman et al., 1982, Mol. Biol. 159: 601-621; Gasser et al., 1982, Proc Natl Acad Sci USA 79: 6522-6526).
Известно, что в клетках млекопитающих получают различные терапевтические белки, например рекомбинантный фактор VIII (rFVIII) (Kaufman et al., 1988, J Biol Chem 263: 6352-6362), активатор тканевого плазминогена (tPA) (Патент США 4766075, Goeddel et al., 1988), эритропоиетин (ЕРО) (Патент США 4703008, Lin, 1987) и моноклональные антитела (mAbs) (Патент США 4816397, Boss et al., 1989).
Клетки (ВНК) почки новорожденных хомяков (ВНК21) использовали для получения rFVIII после селекции по G418 и амплификации с метотрексатом (МТХ) G418-устойчивых клеток (Патент США 4965199 to Capon et al., 1990).
Клетки миеломы мыши (NSO) использовали для получения модифицированного антитела человека к TNF (фактор некроза опухоли) (ЕНАТ) (Патент США 4816397 Boss et al., 1989). Однако эта клеточная линия продуцирует белки со специфическими мышиными углеводными участками, которые нежелательны для применения у человека.
Линия человеческих клеток Namalwa (происходящая от лимфомы Беркитта) использовалась для получения альфа интерферона в Исследовательской Лаборатории Wellcome и для получения проурокиназы (Satoh et al., 1996, Cytotechnology 18: 167-185, 1996), активатора тканевого плазминогена (t-PA) (Khan et al., 1995, Biochem Soc Trans 23: S99), фактора стимуляции колоний гранулоцитов-макрофагов (Okamoto et al., 1991, Arch Biochem Biophys 286: 562-568), интерферонов и лимфотоксина (Hosoi et al., 1991, Cytotechnology 5: 17-34) и фактора стимуляции колоний гранулоцитов (Hosoi et al., 1991, Cytotechnology 7: 25-32) в Исследовательских Лабораториях Токио. Однако эти клетки очень трудно трансфицировать ДНК.
Walls и др. (1989б Gene 81: 139-149) сообщали об использовании коамплификационного dhfr/MTX подхода для экспрессии функционального белка С в клетках почки эмбриона человека (клетки 293S). Известно, что клетки 293 (Stillman et al., 1985, Mol. Cell. Biol. 5: 2051-2060) образуют в суспензии большие агрегаты, особенно при высокой концентрации кальция (> 100 мкМ), которая обуславливает большую агрегацию и меньшую жизнеспособность клеток (Peshwa et al., 1993, Biotech and Bioeng 41: 179-187). Все процитированные ссылки включены в описание изобретения путем ссылки.
Краткое изложение изобретения
Были получены клоны гибридизованных клеток человека, которые легко трансфицируются электропорацией или катионными липосомами и хорошо адаптируются к росту в суспензионной культуре. В условиях клеток человека возможна экспрессия гетерологичных белков при использовании амплификации с низким уровнем (50-100 нМ) МТХ. Кроме того, клетки легко адаптируются к росту в среде без сыворотки.
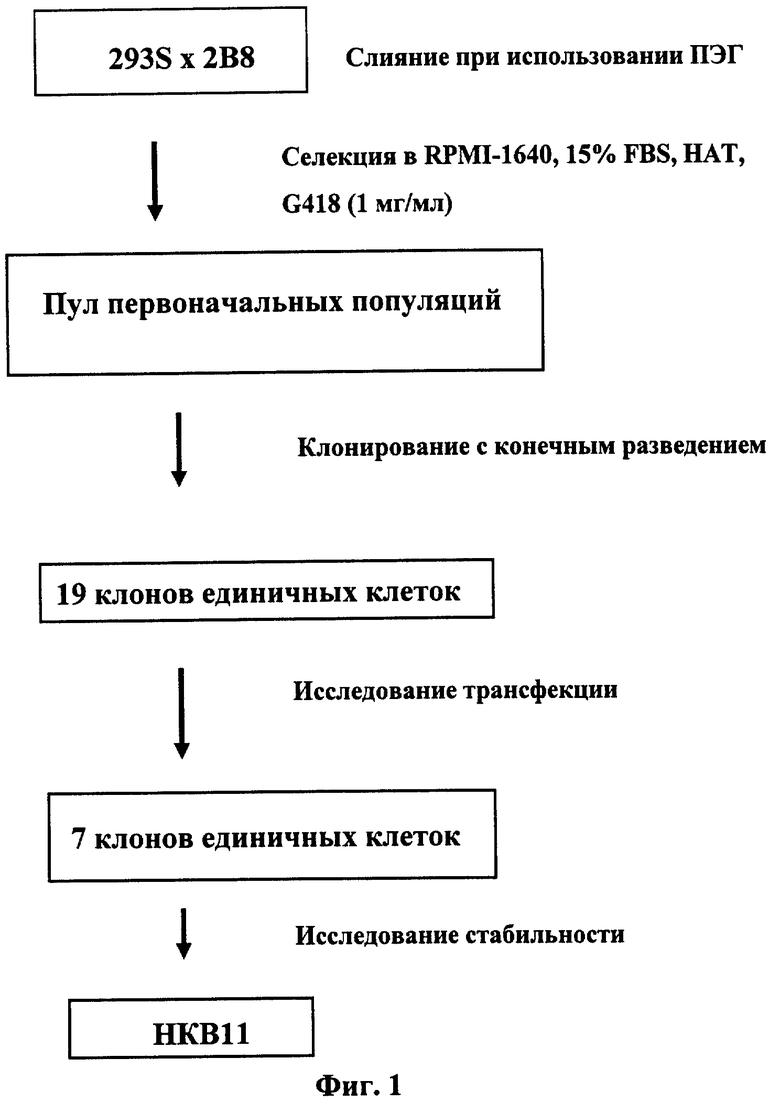
Эти клетки являются продуктом слияния клеток почки эмбриона человека (293S) и клеток лимфомы Беркитта. Краткое описание см. на Фиг.1. Эти гибридные клоны, обозначенные НКВ, несут дефектный EBV-геном (вируса Эпштейна-Барр), полученный из НН514-16, клеточной линии, происходящей от клеток лимфомы Беркитта P3HR1 (Hinuma et al., 1967, J Virol 1: 1045-1051). P3HR1 несут EBV, не ведущий к бессмертию клеток. НН514-16 - это клон P3HR1 (Hinuma et al., 1967, J Virol 1: 1045-1051), несущий нетрансформирующий EBV. HH14-16 утерял het-ДНК, ДНК, прерывающую латентность, в процессе клонирования (Rabson et al., 1983, Proc Natl Acad Sci USA 87: 3660-3664). Таким образом, EBV в клонах НКВ является нетрансформирующим и остается в латентной форме.
НКВ являются человеческими гибридными клетками-хозяевами, подходящими для рекомбинантного продуцирования терапевтических белков. Эти клетки-хозяева получены гибридизацией различных родительских клеточных линий, каждая из которых несет различные необходимые свойства. Клетки-хозяева, обладающие необходимыми характеристиками, получены из клеток, полученных в результате гибридизации.
Клетки-хозяева можно генно-инженерно модифицировать для высокого уровня экспрессии широкого ряда белков. Белки, которые могут быть получены в модифицированных клетках-хозяевах, неограниченно включают растворимый ICAM-1, рекомбинантный интерлейкин 4 (IL-4), tPA, EPO, rFVIII и BDD-FVIII (варианты фактора VIII с делегированным В-доменом) и производные этих белков. Фактор VIII имеет доменную организацию А1-А2-В-А3-С1-С2 и синтезируется в виде одноцепочечного полипептида из 2351 аминокислот, из которого вырезается 19-аминокислотный сигнальный белок при транслокации в просвет эндоплазматического ретикулума. Благодаря тому, что фактор VIII плохо гликозилируется, было сложно достичь высокого уровня экспрессии (>0,2 пг/кл/д) фактора VIII (Lind et al., 1995, Eur J Biochem. 232: 19-27; Kaufman et al., 1989, Mol Cell Biol. 9: 1233-1242). Экспрессия фактора VIII в клетках млекопитающих обычно на 2-3 порядка ниже, чем экспрессия других генов при использовании аналогичных векторов и методов. Продуктивность клеточных линий, продуцирующих фактор VIII, находилась в пределах 0,5-1 ед/кл/д (0,1-0,2 пг/кл/д).
Было показано, что В-домен фактора VIII является несущественным для прокоагулирующей активности. Различные группы сообщали об улучшении экспрессии фактора VIII в клетках млекопитающих при использовании усеченных вариантов фактора VIII (Lind et al., 1995, Eur J Biochem 232: 19-27; Tajima et al., 1990, Proc 6th hit Symp H.T. p.51-63; патент США 5661008 Almstedt, 1997). Тем не менее, уровень экспрессии вариантов фактора VIII оставался ниже 1 пг/кл/д в стабильном клеточном клоне. Было также обнаружено, что, хотя эндогенный иммуноглобулин (Ig) не экспрессировался, экспрессия рекомбинантного Ig в модифицированных клетках-хозяевах была высокой. Белки, продуцирующиеся в клетка НКВ11, имеют специфический для человека профиль гликозилирования. Таким образом, клоны являются оптимальными клетками-хозяевами для получения генно-инженерного Ig и других белков.
В данном описании клетка, происходящая из лимфомы Беркитта - это клетка лимфомы Беркитта, полученная из клетки лимфомы Беркитта, полученной из другой клетки, происходящей от лимфомы Беркитта, или клетка, полученная в результате митотического деления любой из вышеописанных клеток. "Полученная из" в данном контексте неограниченно означает нормальное митотическое деление и процессы, такие как трансфекции, слияния клеток или другие методы генной инженерии и клеточной биологии, используемые для изменения клеток или получения клеток с новыми свойствами. Аналогично, клетка, происходящая из почки эмбриона человека - это клетка почки эмбриона человека, полученная из клетки почки эмбриона человека, полученной из другой клетки, происходящей из почки эмбриона человека, или клетка, полученная в результате митотического деления любой из вышеописанных клеток. Также клетка, происходящая из 293S - это клетка 293S, полученная из клетки 293S, полученной из другой клетки, происходящей из 293S, или клетка, полученная в результате митотического деления любой из описанных клеток. Также клетка, происходящая из 2В8 - это клетка 2В8, полученная из клетки 2В8, полученной из другой клетки, происходящей из 2В8, или клетка, полученная в результате митотического деления любой из вышеописанных клеток. Гетерологичный белок - это белок, для получения которого клетка была модифицирована.
Краткое описание чертежей
На Фиг.1 представлена схема получения клеток НКВ.
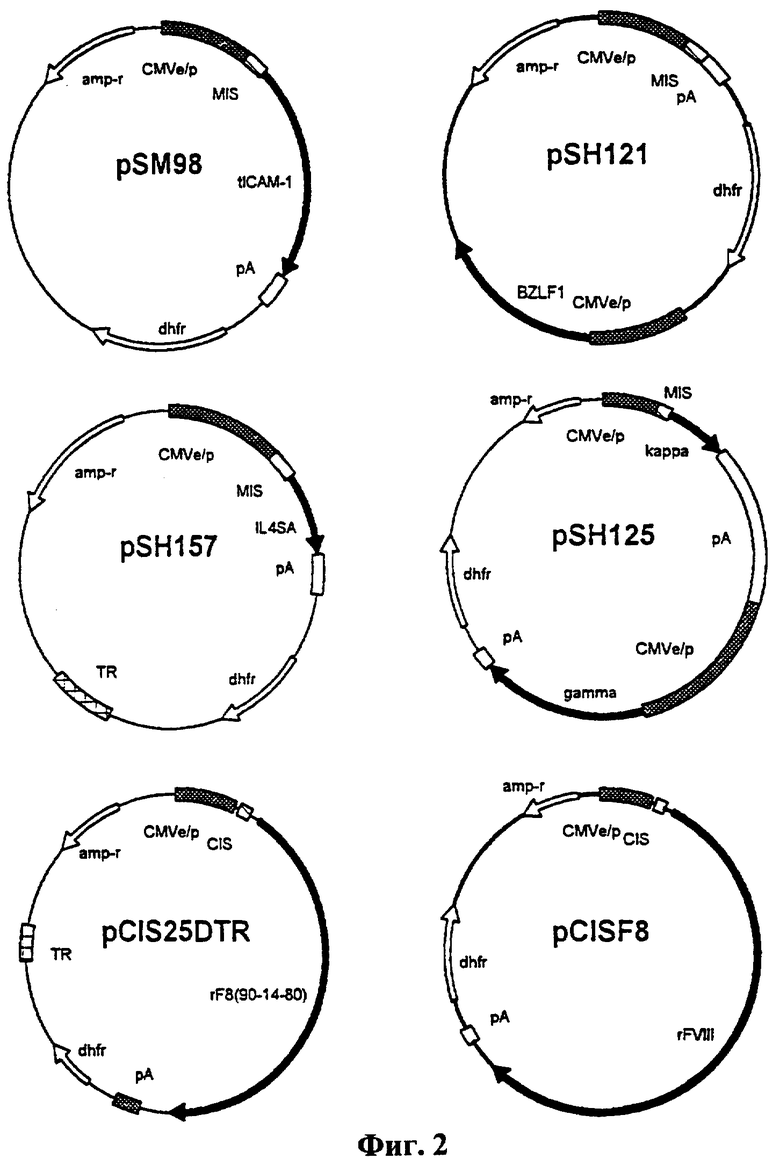
На Фиг.2 представлены физические карты векторов экспрессии, упоминаемых в тексте. Все плазмиды сконструированы на основе pBR322 и содержат участок экспрессии dhfr. Все гены, кодирующие рассматриваемые белки, находятся под регуляцией промотора/энхансера CMV (цитомегаловируса) (CMV е/р); 5’-интрон (MIS или CIS) находится на 5’-конце генов, кроме BZLF1. Сигнал полиаденилирования указан как рА. Обе плазмиды, pSH157 и pCIS25DTR, содержат последовательность концевого повтора вируса Эпштейна-Барр (EBV-TR) (402 п.о.).
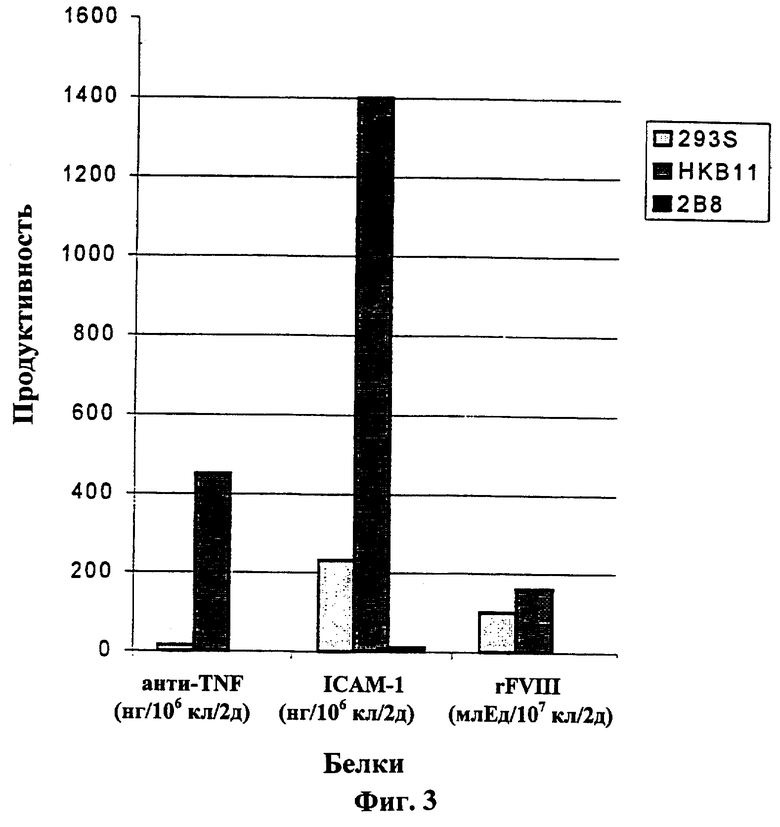
На Фиг.3 представлено сравнение линий клеток-хозяев для экспрессии генов в исследовании транзиторной трансфекции. Трансфекции проводили в одинаковых условиях: одинаковое количество клеток 293S, 2B8 и НКВ11 трансфицировали одинаковым количеством плазмидной ДНК при использовании одного и того же агента трансфекции. Культуральные жидкости собирали через 2 дня после трансфекции. Уровень продукции белков определяли методом ELISA (IgG и ICAM-1; измеряли в нг белка/106 клеток/2 дня) и набором для исследования Coatest® (rFVIII; измеряли в млед/107 клеток/2 дня).
Определенные варианты осуществления
Материалы и способы
Клетки НН514-16 были любезно предоставлены доктором George Miller (Yale University). Клетки 293S были получены от доктора Brad Zerler (Molecular Therapeutic Institute,West Heaven, CT). Клетки 293S - это клетки 293 (ATCC CRL-1573), адаптированные к росту в суспензионной культуре (Stillman et aL, 1985, Mol Cell Biol 5: 2051-2060).
Плазмиды
Все векторы экспрессии, использованные в данной работе, были основаны на pBR322 с сегментом экспрессии гена dhfr. Физические карты векторов экспрессии представлены на Фиг.2. Плазмиды, pSH157 и pCIS25DTR, также включают последовательность концевого повтора вируса Эпштейна-Барр (EBV-TR). Последовательность EBV-TR представлена в заявке на патент' Cho и Chan, обозначенной MSB-7254, "Последовательность концевого повтора вируса Эпштейна-Барр повышает уровень лекарственной селекции". Вектор pSH131, который был помещен в Американскую Коллекцию Типов Культур, ATCC 98879, может использоваться для получения векторов экспрессии для определенных белков, как это описано у Cho и Chan (MSB-7254, выше).
ELISA (твердофазный иммуноферментный анализ)
Для измерения секреции tICAM-1 на микротитровальных планшетах с круглым дном адсорбировали моноклональные антитела к ICAM-1, C92.5 (McClelland et al., 1991, Proc Natl Acad Sci USA 88: 7993-7997). Планшеты блокировали обработкой раствором фосфатных буферных солей (PBS), содержащим 1% бычьего сывороточного альбумина (BSA), затем инкубировали с образцами, содержащими tICAM-1. Затем планшеты промывали промывочным буфером (PBS с добавлением 0.005% Tween 20) и инкубировали с биотинилированным С78.5, вторым моноклональным антителом к другому эпитопу на tICAM-1 (McClelland et al., 1991, указано выше). После промывания планшеты инкубировали с HRP-стрептавидином. Затем планшеты промывали промывочным буфером, вводили в реакцию с тетраметил бензидином (ТМВ), и останавливали реакцию добавлением 1н НСl.
Концентрацию tICAM-1 определяли измерением оптической плотности при 450/570 нм и сравнением со стандартной кривой очищенного tICAM-1.
Для измерения секреции иммуноглобулина (Ig) для покрытия планшетов использовали антитела анти-Ig, а в качестве антител детекции использовали биотинилированные анти-Ig. В качестве стандарта использовали известную концентрацию молекул Ig. В остальном процесс проводили таким же образом.
Для измерения секреции интерлейкина-4 (IL-4) для покрытия планшетов использовали антитела анти-IL-4, а в качестве антител детекции использовали биотинилированные анти-1L-4. В качестве стандарта использовали очищенную молекулу IL-4.
Исследование по измерению секреции rFVIII
Для подсчета молекул rFVIII использовали реактивы из набора Coatest® VIII:C/4 (Chromogenix, Molndal, Sweden). В качестве стандарта измерения в EIA/RIA А/2 планшетах (Corning, Corning, NY), предварительно нагретых до 37°С на Select Heat Blocks (VWR Scientific, San Francisco, CA), использовали антигемофилийный фактор стандарта США (фактор VIII), известный как MEGA I (Office of Biologies Research and Review, Bethesda). К каждому образцу добавляли фактор IХа, фактор X, фосфолипид и СаСl2 и инкубировали в течение 10 минут для активации фактора X. Затем добавляли хромогенный субстрат (S2222) и инкубировали 10 минут для высвобождения хромогенной группы, pNA. Эту реакцию останавливали добавлением 50%-ной уксусной кислоты. Колориметрическое поглощение измеряли при 405/450 нм на спектрофотометре для микропланшетов SPECTRAmax® 250 (Molecular Devices, Sunnyvale, CA) и обрабатывали данные при помощи программы SOFTmax® PRO, поставляемой Molecular Devices.
Получение клеточной линии лимфомы Беркитта, чувствительной к HAT и устойчивой к G418
Для получения клеток, чувствительных к HAT, были получены клеточные линии, дефицитные по гипоксантин-гуанин фосфорибозил трансферазе (HGPRT) (Szybalska et al., Proc. Natl. Acad. Sci. USA 48: 2026-2034, 1962; Littlefield, Proc. Natl. Acad. Sci.
USA 50: 568-576, 1963) по стандартным методикам, описанным Siadak et al. (US Patent 4834975, 1989).
Клетки НН514-16 (полученные от доктора G. Miller, Yale University), свободные от het-ДНК вируса EBV (Rabson et al., 1983, Proc Natl Acad Sci USA 87: 3660-3664) обрабатывали 300 мкг/мл этилового эфира метансульфоновой кислоты (MSE) (Sigma, St. Louis, МО) в суспензионной среде RPMI-1640 (Life Science, Gaithersburg, MD) с добавлением 15% эмбриональной бычьей сыворотки (FBS) (Hyclone, Logan, UT) в течение 24 часов. После промывки клеток средой, клетки помещали в среду, содержащую 6-тиогуанин (6TG) (Sigma) (5 мкг/мл) для отбора HGPRT-отрицательных клеток. В течение 6-тимесячного периода селекции концентрацию 6GT увеличивали с 5 мкг/мл до 30 мкг/мл. Затем клетки тестировали на чувствительность к среде, содержащей HAT. Клоны единичных клеток (SCC) получали клонированием с конечным разведением (одна клетка на лунку в 96-тилуночных планшетах) НАТ-чувствительной популяции А5. Для получения G418-устойчивых клеток один из клонов, A5/1D7, трансфицировали pSV2neo, которая имеет ген пео под промотором SV40 в векторе pBR. Для слияния использовали один из G418-устойчивых (1,5 мг/мл) клонов, обозначенный 2В8 (помещенный в Американскую Коллекцию Типов Клеток под номером CRL-12569).
ПРИМЕР 1. Слияние клеток и получение клонов единичных клеток. Слияние клеток первоначально проводили методом слияния с полиэтиленгликолем (ПЭГ), описанным Kennett (1979, Meth Enzymol 58: 5-359). По 5 миллионов клеток 293S и 2В8 в логарифмической стадии роста промывали PBS, свободным от Са++ и Mg++ (Life Technologies, Rockville, MD) и сеяли на одну лунку в 6-тилуночные планшеты, предварительно обработанные агглютинином арахиса (Sigma) (5 мкг/мл). 6-тилуночные планшеты с клетками центрифугировали при 400 г в течение 6 минут в центрифуге Beckman J-6M/E (Beckman, Palo Alto, CA). После удаления из лунок PBS клетки обрабатывали 2 мл 40% (масс/объем) ПЭГ (Sigma) в течение 1 минуты. В качестве контроля одну из лунок ПЭГ не обрабатывали. Клетки трижды промывали 5 мл PBS, содержащего 5% DMSO с последующей трехкратной промывкой PBS. Клетки инкубировали со свежей средой с добавлением 15% FBS в течение 25 минут.
Клетки высевали на 96-тилуночные планшеты (1,2×106 клеток на лунку) при использовании свежей среды, содержащей G418 (1 мг/мл) и HAT (Life Technology), с добавлением 15% FBS. Клетки подкармливали дважды в неделю, используя селективную среду. В данном примере, для начальной селекции клетки 293S обладали необходимым свойством отсутствия чувствительности к НАТ-содержащей среде, и аналогично клетки 2В8 обладали необходимым свойством устойчивости к G418.
В то время как слившиеся клетки растут в селективных условиях, смешанные клетки в таких условиях не растут. Через три недели селекции первоначальные популяции переносили в большие масштабы. Для получения клонов единичных клеток двадцать первоначальных стабильно растущих популяций смешивали и подвергали клонированию с конечным разведением (одна клетка на лунку) при использовании селективной среды. После тщательного отслеживания отдельных клонов под микроскопом было отобрано девятнадцать клонов единичных клеток из 15 96-тилуночных планшетов. Клоны единичных клеток, полученные после слияния, были обозначены как клетки НКВ (гибридные клетки человеческих клеток почки и В-клеток). По исследованию трансфекции было отобрано семь клонов. Эти семь клонов далее тестировали на стабильность продукции различных белков. Один из семи клонов, НКВ11, был отобран в качестве предпочтительных клеток-хозяев млекопитающих для получения гетерологичных белков. Схему см. на Фиг.1.
ПРИМЕР 2. Характеристика клонов НКВ
Хотя гибридные клетки отбирали в селективных условиях, их гибридный статус подтверждали подсчетом хромосом в клетках. Действительно, для всех клонов НКВ число хромосом было 90-110. Эти числа аналогичны сумме хромосом клеток 293S и 2В8 (64 и 47 соответственно, согласно данным АТСС). Клетки 293S (Stillman et al., 1985, Mol Cell Biol 5: 2051-2060) - это суспензионно адаптированные клетки 293 (АТСС CRL-1573).
Для определения клонов, секретирующих эндогенный Ig, все гибридные клоны тестировали на экспрессию эндогенного Ig (мю и каппа) прямым исследованием иммунофлуоресценции при использовании фиксированных метанолом клеток. В повторных экспериментах по прошествии длительного периода было обнаружено, что эти клетки негативны по экспрессии мю- и каппа-цепей согласно результатам исследования иммунофлуоресценции (Таблица 1) и ELISA (данные не приведены).

В Таблице 1 приведены результаты исследования иммунофлуоресценции трех типов клеток. Клетки ресуспендировали в PBS и наносили мазком на стекло. После высушивания мазки фиксировали в холодном (-20°С) метаноле в течение 5 минут. Клетки окрашивали FITC против каппа- и мю- цепей человека (в разведении 1:20) (Zymed Laboratories, Inc., So. San Francisco, CA) во влажной камере при 37°С в течение 45 минут. После промывки стекол PBS в течение 10 минут их накрывали покровным стеклом при использовании PBS/глицерина (1:1). Клетки изучали под флуоресцентным микроскопом (Carl Zeiss, Inc., Thomwood, NY).
Наличие специфичного для человека фермента присоединения сиаловой кислоты, альфа(2-6) сиалилтрансферазы, было подтверждено анализом FACS клеток НКВ при использовании конъюгированного с FITC лектина Sambukus nigra (SNA) (Sigma, St. Louis, МО). Для белка, секретируемого из клеток НКВ (клон 1G2), было обнаружено альфа(2-3) и альфа(2-6) присоединение сиаловой кислоты при анализе профиля гликозилирования методом олигосахаридного фингерпринтинга (данные не приведены). Это наблюдение указывает на то, что клетки НКВ, полученные при слиянии клеток 293S и 2В8, поддерживают специфичные для человека ферменты гликозилирования.
Для проверки этих гибридных клеток на способность к экспрессии чужеродных генов клетки были трансфицированы векторами экспресии для ICAM-1 и IgG (анти-TNF антитело). Для проверки секреции IgG клетки НКВ (5×106 клеток) трансфицировали электропорацией 10 мкг плазмидной ДНК, обеспечивающей функциональную экспрессию тяжелой (гамма) и легкой (каппа) цепей. Для проверки уровня секреции растворимого ICAM-1 клетки НКВ (5×106 клеток) трансфицировали электропорацией 10 мкг плазмидной ДНК, обеспечивающей функциональную экспрессию растворимого ICAM-1. Уровни экспрессии определяли методом ELISA для IgG или ICAM-1. Все 19 клонов единичных клеток секретировали на относительно высоком уровне ICAM-1 (100-500 нг/мл/2д) и IgG (30-200 нг/мл/2д) в исследовании транзиторной трансфекции (Таблица 2). Эти данные указывают на то, что гибридные клетки поддерживают экспрессию трансфицированных генов Ig, при том, что экспрессия эндогенного гена Ig была занижена.
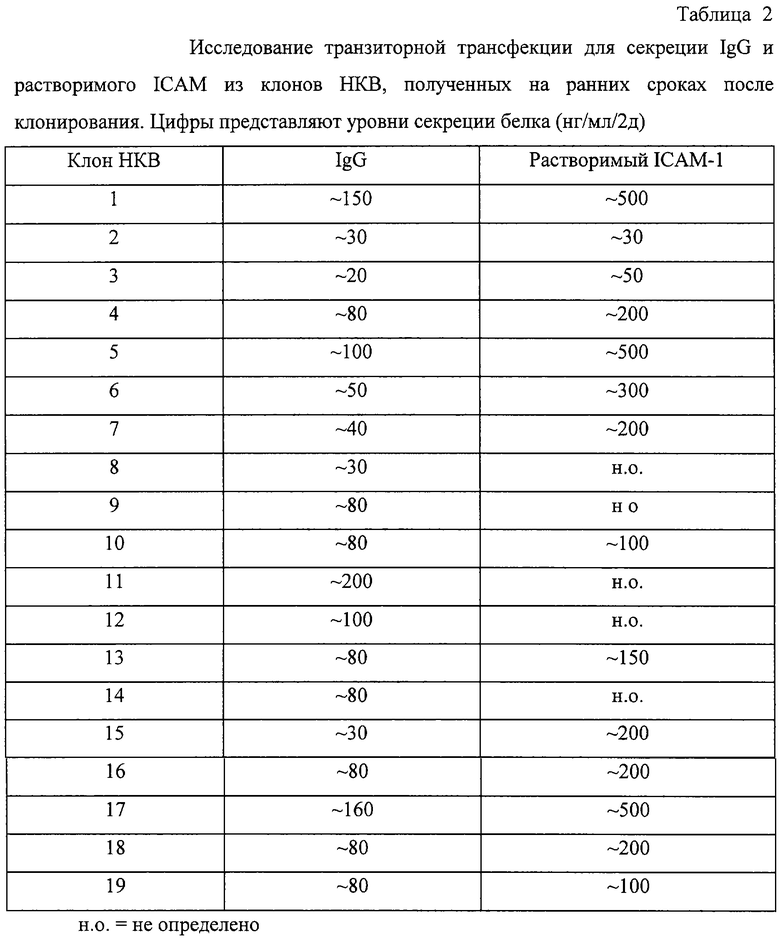
Вирус Эпштейна-Барр (EBV) присутствует в клетках 2В8 в виде эписом. Все клоны единичных клеток были положительны по экспрессии EBNA-1 (ядерного антигена) (данные не приведены), что указывает на то, что они положительны по EBV. Однако было неизвестно, присутствует ли в гибридных клетках полный геном EBV. Таким образом, статус генома EBV в гибридных клетках исследовали трансфекцией клеток фрагментом BZLF1 генома EBV, трансактивирующим геном, прерывающим латентность. Клетки НКВ (5×106 клеток) трансфицировали 10 мкг плазмидной ДНК (pSH121), позволяющей функциональную экспрессию BZLF1. Детекцию капсидного антигена EBV (EBV-VCA) проводили методом непрямой иммунофлуоресценции при использовании сыворотки человека, содержащей анти- EBV-VCA титр и конъюгированный с FITC анти-IgG человека. Технические детали исследования иммунофлуоресценции описаны выше. Как показано в Таблице 3, ложно трансфицированные клетки были негативны по экспрессии капсидного антигена EBV (EBV-VCA), что указывает на то, что они негативны по репликации EBV. Однако небольшой процент трансфицированных клеток был положителен по экспрессии антигена. Эти данные указывают на то, что гибридные клетки несут геном EBV в его латентной форме.

Гибридные клетки адаптировали к безсывороточным условиям последовательным двукратным снижением FBS в шейкерных флаконах. Через две недели клетки росли в среде без FBS. Клетки росли в виде небольших агрегатов в шейкерных флаконах. В отличие от клеток 293S гибридные клетки легко адаптировались к безсывороточным суспензионным культурам. В средах без сыворотки, без альбумина с добавлением трансферрина и инсулина гибридные клетки можно поддерживать дольше, чем в течение года в суспензионной культуре при использовании шейкерных флаконов.
Для сравнения уровней секреции продуктов трансфицированных генов один из клонов, НКВ 11, и исходные клетки, 293S и 2В8, трансфицировали pSM98 (растворимый ICAM-1), pSH125 (анти-TNF IgG) и pCISFS (rFVIII). Как показано на Фиг.3, уровни секреции ICAM-1 и IgG в клетках НКВ 11 были значительно выше (примерно в 10 раз), чем в клетках 293S. Уровни секреции двух белков в клетках 2В8 были неопределимы. Уровни секреции rFVIII в клетках НКВ11 были аналогичны уровням секреции в клетках 293S. Эти данные указывают на то, что эффективность трансфекции клеток НКВ11 значительно выше, чем эффективность трансфекции исходных клеток.
ПРИМЕР 3. Получение стабильных клонов НКВ, секретирующих гетерологичные белки
Гибридные клоны исследовали на стабильность экспрессии белков в системе амплификации (dhfr/MTX). Сначала клетки трансфицировали соответствующим вектором экспрессии, а затем трансфицированные клетки (обычно 106 клеток на 96-тилуночный планшет) высевали и отбирали/амплифицировали в селективной среде без гипоксантина и тимидина, но с добавлением FBS и МТХ (50 нМ). После первого скрининга планшетов отбирали клетки из высокосекретирующих лунок и переносили в 6-тилуночные планшеты. Клетки в 6-тилуночных планшетах далее амплифицировали с возрастающими концентрациями МТХ (100, 200 и 400 нМ) в среде. Первоначальные популяции 6-тилуночных планшетов проверяли далее для получения лучшей популяции. В конечном итоге эти популяции использовали для получения клонов единичных клеток. Как показано в Таблице 4, клетки НКВ11 были оптимальны для получения больших количеств гетерологичных человеческих белков. Для получения производных ICAM-1, IgG и IL-4 клетки НКВ11 были так же пригодны, как и клетки СНО (данные не приведены). Однако клоны НКВ растут быстрее, чем клоны СНО, и могут быть легко адаптированы к росту в суспензионной культуре в безсывороточных условиях. В случае получения BDD-FVIII клоны НКВ11 обладали примерно в десять раз большей продуктивностью, чем клоны СНО. Вышеприведенные результаты указывают на то, что клетки НКВ11 являются оптимальными клетками-хозяевами для экспрессии человеческих терапевтических белков.
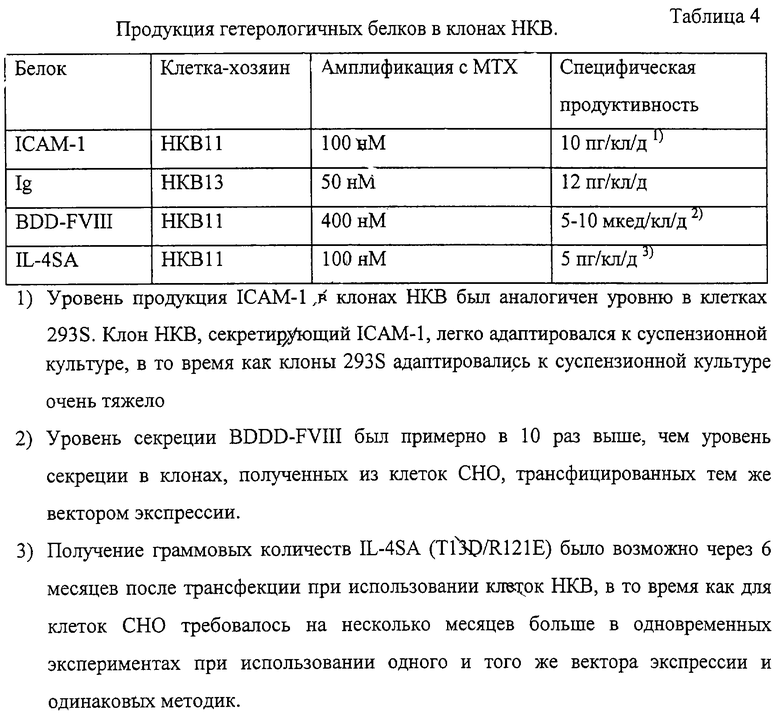
Клеточные линии, полученные вышеописанными способами, включали (i) клоны, секретирующие растворимый ICAM-1 (10 пг/кл/день), полученные из клеток НКВ11, трансфицированных pSM98, после амплификации с 100 нМ МТХ, (ii) клоны единичных клеток, секретирующие моноклональное антитело (анти-TNF) (12 пг/кл/день), полученные из клеток НКВ 13, трансфицированных pSS125, после амплификации с 50 нМ МТХ и клонирования с конечным разведением без МТХ, (iii) клоны единичных клеток, секретирующие усеченный rFVIII (BDD-FVIII) (5-10 мкед/кл/день в безсывороточных условиях), полученные из клеток НКВ11, трансфицированных pCIS25DTR, после амплификации (400 нМ МТХ) и клонирования с конечным разведением без МТХ, и (iv) клоны, секретирующие производное IL-4 (селективный агонист IL-4, IL-4SA; мутированный по двум аминокислотным положениям, T13D и R121E) (5 пг/кл/день), полученные из клеток НКВ11, трансфицированных pSH157, после амплификации с МТХ. Клон НКВ, секретирующий IL-4SA, 1G2, использовали для относительно быстрого получения небольших количеств белка (граммовые количества). Физические карты упомянутых векторов экспрессии представлены на Фиг.2.
Обсуждение
Для линии гибридных клеток человека, описанных здесь, показано наличие необходимых свойств, которыми обладают родительские клеточные линии. Клеточные линии НКВ, полученные слиянием клеток почки эмбриона человека (или клеток, происходящих от клеток почки эмбриона человека) с клетками лимфомы Беркитта (или клетками, происходящими от клеток лимфомы Беркитта), могут быть использованы для получения клеточных линий для экспрессии гетерологичных белков.
Первоначальной задачей получения линий гибридов клеток 293S и 2В8 было решение проблемы агрегирования клеток 293S, имеющих тенденцию скапливаться при росте в суспензионной культуре (нежелательное свойство). Клетки НКВ были получены процессом гибридизации при выращивании в виде монослоя в Т-флаконах. Однако эти клетки растут как суспензионные (не образуют больших агрегатов) при культивировании в виде суспензии. Клетками НКВ очень удобно оперировать при трансфекции, а эффективность трансфекции значительно выше, чем эффективность трансфекции клеток 293S.
Хотя трансформация или гибридизация, необходимые в большинстве случаев для получения стабильной клеточной линии, могут привести к изменению профилей гликозилирования (Yamashita, 1989, J Biol Chem 264: 2415-2423), было показано, что НКВ11, являющаяся соматической гибридной клеточной линией, обладает типичными для человека ферментами гликозилирования, например, альфа(2-3) и альфа(2-6) сиалил трансферазами. Более того, белки, получаемые из трансфицированных клеток НКВ, имеют нормальный для человека способ гликозилирования связей альфа(2-3) и альфа(2-6) сиаловой кислоты.
В итоге, клетки НКВ являются гибридными клетками человека, обладающими необходимыми характеристиками каждой из родительских линий; а именно, хорошим ростом в суспензионной культуре без агрегирования (как это наблюдается у клеток 2В8) и легкостью трансфекции и необходимыми характеристиками секреции (как это наблюдается у клеток 293S). Предпочтительная линия гибридных клеток человека, НКВ11, негативна по экспрессии гена иммуноглобулина, как и клетки 293S. Эта особенность является преимуществом в тех случаях, когда необходимо рекомбинантное получение моноклональных антител из клеток человека. Обнаружение того факта, что при слиянии клеток человека получаются клетки с преимущественными характеристиками, служит основой для дальнейшего изучения слияния при использовании 293S и других клеточных линий, происходящих из В-клеток, например Namalwa и 6F11, для получения новых комбинаций свойств гибридных клеток.
Вышеприведенные примеры служат для иллюстрации изобретения, и специалисты в данной области техники могут использовать их варианты. Соответственно предполагается, что объем изобретения ограничивается только нижеследующей формулой изобретения.
Изобретение относится к области биотехнологии и касается гибридных клеток человека. Гибридные клетки человека/человека получают слиянием клеток почки эмбриона человека (293S) и модифицированных клеток лимфомы Беркитта (2В8). Клетки слияния могут быть использованы как клетки-хозяева для рекомбинантной экспрессии генов млекопитающих. Способом по изобретению получена линия гибридных клеток человека НКВ11, АТСС:CRL-12568, используемая в качестве клетки-хозяина для экспрессии гетерологичного белка, обладающего человеческим профилем гликозилирования. Получена также линия гибридных клеток человека IG2, АТСС:РТА-87, экспрессирующая белок IL-4SA (Т13D/R121Е). Преимущества использования этих гибридных клонов клеток почки человека и В-клеток, называемых НКВ, включают те факты, что клетки негативны по экспрессии иммуноглобулина, хорошо растут в среде, свободной от белков плазмы (с добавлением или без рекомбинантного инсулина), в виде суспензионных культур в шейкерном флаконе или в ферментере, очень восприимчивы к трансфекции ДНК и секретируют большие количества гетерологичных рекомбинантных белков, таких как рекомбинантные моноклональные антитела, растворимый ICAM-1, rIL-4 и rFVIII. 3 с. и 12 з. п. ф-лы, 4 табл., 3 ил.
| US 4377513 А, 22.03.1983 | |||
| US 4621050 А, 22.03.1983. |
Авторы
Даты
2004-05-10—Публикация
1999-12-08—Подача