Область техники
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения рекомбинантного фактора свертываемости крови VIII человека (FVIII). Изобретение представляет собой рекомбинантную плазмидную ДНК рАР227, кодирующую полипептид с последовательностью рекомбинантного фактора свертываемости крови VIII человека с делецией В-домена, и продуцент на основе линии клеток Cricetulus griseus CHO 2H5, содержащей указанную плазмидную ДНК, синтезирующий рекомбинантный фактор свертываемости крови VIII человека с делецией В-домена.
Предшествующий уровень техники
Дефицит фактора VIII приводит к развитию гемофилии А, наиболее часто встречающейся форме этого заболевания, составляющей около 85% от всех случаев гемофилии. Частота гемофилии А, по данным ВОЗ, колеблется от 5 до 10 случаев на 100 тысяч новорожденных мальчиков. В России, согласно информации Национального фонда гемофилии, этим заболеванием страдают около 10000 человек. Самым характерным симптомом гемофилии является кровотечение, наступающее даже после небольшой травмы. Часто встречаются гематомы, отмечаются кровоизлияния в суставы, возможны кровоизлияния в костную ткань, приводящие к некрозу и декальцинации костей.
Для нормального гемостаза уровень фактора VIII должен быть не менее 25%, симптоматика обычно появляется при его снижении до 5% и ниже. Тяжесть болезни напрямую связана с уровнем фактора.
Суть лечения гемофилии А сводится к заместительной терапии фактором VIII, поэтому создание оптимальных и эффективных способов получения этого белка является одной из важнейших задач биотехнологии.
В настоящее время фактор VIII производится генно-инженерным способом с использованием клеток млекопитающих, благодаря чему устраняется необходимость использования фактора крови, полученного из плазмы доноров, а риск соответствующих вирусных инфекций сводится к минимуму.
Фактор VIII - высокомолекулярный гликопротеид, присутствующий в крови в виде неактивного кофактора. Он способствует активации фактора Х протеазами, образующимися по внутреннему механизму свертывания. Фактор VIII синтезируется гепатоцитами и циркулирует в плазме в комплексе с фактором фон Виллебранда.
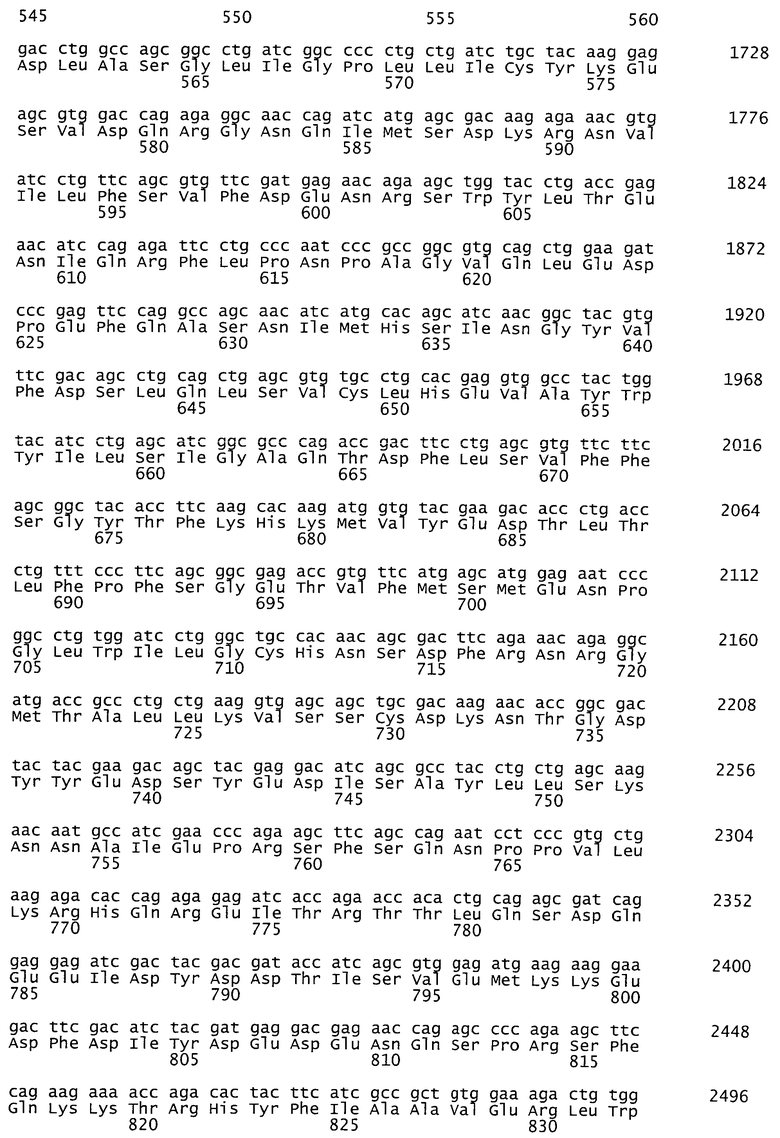
Фактор VIII - это достаточно крупный по размерам белок, включающий шесть доменов: А1(1-336)-А2(372-710)-В(741-1648)-А3(1896-2019)-С1(2020-2172)-С2(2173-2332) и состоящий из 2332 аминокислот (после отщепления сигнального пептида), со сложным профилем гликозилирования. Промышленное производство и стабилизация такого крупного белка достаточно трудны и дороги. Неудивительно поэтому, что значительная часть исследований последних лет была направлена на выявление модифицированных форм фактора VIII, которые при уменьшении размера белка сохраняли бы уровень прокоагулянтной активности, присущий природному фактору сворачиваемости крови VIII.
В результате этих работ было обнаружено, что форма фактора VIII, с делениями в области В-домена, проявляет коагуляционную активность такую же, как и исходный белок (например, см. Biochemistry, 1986 Dec 30; 25(26):8343-7; Biochem J. 1991 Jul 1, 277 (Pt1):23-31; Eur J Biochem. 1995 Aug 15, 232(1): 19-27; Semin Hematol. 2001 Apr, 38(2 Suppl 4):4-12).
Кроме того, удаление В-домена снижает число антигенных детерминант за счет исчезновения части сайтов N-гликозилирования, что в свою очередь уменьшает риск появления специфических антител у пациента, получающего терапию фактором VIII.
Модифицированный фактор VIII с делецией В-домена (rhFVIII-BDD) представляет собой белок с массой около 170 кДа, состоящий из двух фрагментов, размером 90 кДа и 80 кДа соответственно. При сохранении того же уровня биологической активности он является более стабильным, чем полноразмерный фактор VIII. В частности, лекарственный препарат РеФакто, изготовленный на основе укороченного белка, не требует присутствия альбумина для стабилизации. Кроме того, сокращение размеров белка позволяет повысить уровень экспрессии примерно в 10 раз по сравнению с полноразмерным белком (патент US 5661008).
Тем не менее, отмечается (например, см. патент US 6358703), что даже для фактора VIII с делегированным В-доменом, экспрессия в клетках млекопитающих обычно на 2-3 порядка ниже, чем экспрессия других белков при использовании аналогичных рекомбинантных векторов и методик. В силу этих причин задача создания клеточных линий, позволяющих достигать высокого уровня экспрессии фактора сворачиваемости крови VIII, остается актуальной.
Для достижения высокого уровня экспрессии используются разные способы: от различных вариантов оптимизации последовательности белка FVIII и конструкций векторов экспрессии до подбора наиболее эффективных клеточных линий. При этом наиболее предпочтительными считаются клеточные линии млекопитающих, позволяющие достичь корректных с точки зрения сохранения функций рекомбинантного белка набора его пострансляционных модификаций, а также элементов его вторичной и третичной структуры. Размер делетированной последовательности в области В-домена варьировался в разных работах в интервале от примерно 500 до 1000 аминокислот. Кроме того, для оптимизации последовательности использовались точечные мутации аминокислот и различной длины линкеры (от 3 до 25 аминокислотных остатков) между цепями 90 и 80 кДа.
Например, Toole с сотрудниками, сообщает об экспресии FVIII, не содержащего участки последовательности от 982 до 1562 и от 760 до 1639 аминокислот, соответственно (Proc. Nati. Acad. Sci. USA, Vol.83, pp.5939-5942, August 1986, Biochemistry). Такой FVIII оказался в 10-20 раз активнее полноразмерного FVIII дикого типа.
В уже упоминавшейся работе (Biochemistry, 1986 Dec 30; 25(26):8343-47) были созданы вектора, содержащие несколько типов последовательностей FVIII: первый тип включал участок В-домена, начиная с Arg 747, Arg752, или Arg776 присоединенный к Glu 1649; второй тип не содержал области между Ser743 и Gin1638 и включал линкер из 14 аминокислот; в третьем типе конструкций В-домен был удален полностью или замещен на линкер из 1-4 Arg остатков. Заметного уровня экспрессии (0.5-1 МЕ/мл) удалось достичь только в случае, когда домен был заменен на 3 или 4 остатка Arg.
Конструкции с делениями в области В-домена описаны также в ЕР 295597. Был удален участок домена между 816 и 1598, а также между 741 и 1689 аминокислотами. Авторы отмечали, что время полужизни таких мутантных форм сопоставимо с полноразмерным белком, а активность по отношении к тромбину даже превышает таковую. Уровень экспрессии клонов в клетках СНО и ВНК составил порядка 8-15 ME/ млн. кл/ мл.
Патент US 5112950 предлагает конструкции, содержащие делеции в области 868-1562 и 771-1666. Последний вариант (с делецией в области 771-1666) в тесте с тромбопластином был в 5 раз активнее, а уровень его продукции был в 10 раз выше по сравнению с исходным FVIII.
Патент US 4868112 раскрывает конструкции векторов, содержащих ген FVIII без определенного удаленного участка в области В-домена (размером от 581 до 915 аминокислот) и ген дигидрофолатредуктазы (DHFR), а также DHFR-дефицитные линии клеток СНО, трансфицированные указанными векторами. Уровень экспрессии белка в такой системе составлял порядка 2МЕ/мл/сутки.
Патент US 5661008 описывает несколько вариантов фактора VIII с делегированным В-доменом (участки 741-1648 и 745-1562), причем оставшиеся части белка в нескольких вариантах были соединены аргининовыми линкерами различной длины: от 2 до 4 аминокислот.Авторы полагают, что линкер длиннее 10 аминокислотных остатков нежелателен. Экспрессия полученных векторных конструкций проводилась в СНО-клетках, уровень экспрессии составил 0,8-1,5 МЕ/мл (для разных вариантов).
В патенте RU 2429294 описана система экспрессии фактора VIII с делецией В-домена в клетках СНО, не содержащая белков животного происхождения, и предназначенная для биофармацевтического производства. Продуктивность этой системы составляет 0,5 Ед/млн. кл/сутки. Однако стабильность подтверждена только на трех пассажах, что является недостаточным для промышленного производства белка.
В патенте ЕА4317 рассматривается получение вариантов фактора VIII с делецией В-домена, замененного Arg-богатым линкерным пептидом, длиной 10-25 аминокислотных остатков, а также мутантов на основе такого укороченного белка. Экспрессия проводится в иммортализованных клетках человека 293 Т (клетки эмбриональной почки человека), при этом вместе с целевым белком происходит экспрессия по меньшей мере одного вирусного белка активатора транксрипции. Поскольку лекарственное средство на основе Фактора VIII предполагает системное введение в кровоток пациента, а примесь вирусного транскрипцинного активатора в препарате недопустимо с точки зрения существенного риска появления туморогенных свойств, то технология производства соответствующего лекарственного средства сильно усложняется путем введения дополнительных этапов в процедуру выделения и валидации вирусной чистоты конечного продукта. Это приводит к лишним затратам при промышленном производстве.
Патент RU 2249041 описывает способ получения клеточных линий НКВ11, трансфицированных вектором pCIS25DTR, содержащим область транскрипции FVIII-BDD, DHFR в качестве селективного маркера, и последовательность концевого повтора из вируса Эпштейна-Барр для повышения интеграции. Авторы утверждают, что подобным способом можно получить клеточные линии с продуктивностью до 20 мкЕд/кл/день. Однако нет информации о стабильности таких клонов и пригодности для промышленного использования. Кроме того, недостатком данного технического решения является использование раковых клеток (лимфомы Беркитта), что может быть небезопасно из-за возникновения дополнительных рисков при работе с такими клетками, более сложной процедуры выделения и очистки белка, необходимой для того, чтобы избежать трансформирующей активности или примесей туморогенного материала в итоговом продукте (патент US 7470523, Int J Cancer 1999 Nov 12; 83(4):555-63).
Основным недостатком большинства клеточных систем получения белка, известных из уровня техники, является невысокий уровень экспрессии, необходимый для промышленного производства фактора VIII. Кроме того, наличие мутаций, а также искусственных неприродных последовательностей (линкеров) в белке может приводить к риску возникновения иммунного ответа против препарата на основе данного белка, что крайне нежелательно.
Стремясь максимально снизить указанные риски, мы выбрали для экспрессии последовательность фактора VIII, в которой линкерная вставка отсутствует полностью, а участок делетированного В-домена представляет собой аминокислоты с 743 по 1638 (см. фиг.1). Именно такая последовательность rhFVIII-BDD была использована в единственном существующем сейчас препарате с делегированным В-доменом, РеФакто, который признан эффективным и безопасным.
Указанная последовательность описана в Европейском патенте ЕР 0506757 и статье «Novel forms of B-domain-deleted recombinant factor VIII molecules. Construction and biochemical characterization» (Eur J Biochem. 1995 Aug 15, 232(1): 19-27). Соответствующая система экспрессии является наиболее близким аналогом настоящего изобретения. Белок rFVIII-SQ представляет собой FVIII с делецией части В-домена и пептидной связью между Ser743 и Arg1638. Плазмида pKGE327, содержащая ген DHFR, экспрессировалась в клетках CHO-DG44 в присутствии 10% фетальной сыворотки. После амплификации метотрексатом удалось достичь уровня экспрессии 0,5-1,5 МЕ/мл. Недостатком данной системы экспрессии, как и прочих, описанных выше, является низкая производительность. Кроме того, здесь, также как и в остальных приведенных источниках не указываются данные о стабильности полученной системы, которые представляются крайне важными для оценки возможности применения такой системы в промышленном производстве.
Раскрытие изобретения
Настоящее изобретение решает задачу конструирования плазмидной ДНК, содержащей последовательность рекомбинантного фактора VIII-BDD, и создания линии клеток (штамма-продуцента), позволяющей получать рекомбинантный фактор VIII-BDD с хорошим выходом (на постоянном уровне около 20 МЕ/мл/сутки) и сохраняющим свою производительность на протяжении большого числа пассажей (не менее 60), что является важным и необходимым для промышленного производства белка.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК рАР227, состоящей из 13973 п.о. и линии клеток Cricetulus griseus CHO 2H5, позволяющей получать фактор VIII свертываемости крови со стабильно высоким выходом, достаточным для промышленного производства лекарственного средства на его основе.
Введение различных генетических элементов генома эукариот в состав рекомбинантных конструкций, используемых для последующей трансфекции клеток млекопитающих, может оказывать положительное влияние на стабильность трансгена в геноме клетки-реципиента, существенно улучшая ростовые характеристики культуры (S.C. Makrides Gene Transfer and Expression in Mammalian Cells, (2003) Elsevier Science, chapters 10-12). Подобные элементы, в частности MAR, используются для создания промышленных штаммов-продуцентов, для которых критическим параметром, определяющим возможность его использования в производстве, является стабильность уровня продукции и скорости роста культуры.
Элементы прикрепления к ядерному матриксу MAR (Matrix Attachment Regions) представляют собой фрагменты ДНК эукариот длиной 300-3000 п.о. и играют ключевую роль в организации ядерной и хромосомной архитектуры. В интерфазе они фиксируют хроматин с белками, формирующими ядерный матрикс, разделяя геном эукариот на независимые хроматиновые петли (Mirkovitch, J., Mirault, M.E., and Laemmli, U.K. (1984) Cell 39, 223-232.). Благодаря колокализации MAR-элементов с участками активной транскрипции и регуляторных элементов в геноме, первые положительно влияют на уровень транскрипции трансгена, привлекая активаторы транскрипции и контролируя доступность ДНК в составе хроматина. Помимо указанных свойств MAR-элементы, например MAR гена лизоцима птиц, могут предотвращать постепенное снижение активности трансгенного промотера, что существенно повышает стабильность уровня экспрессии трансгена (Alien, G.C., Spiker, S., and Thompson, W.F. (2000) Plant Mol. Biol. 43, 361-376).
В процессе конструирования плазмиды мы обнаружили, что использование MAR в плазмиде, включающей ген rhFVIII-BDD, позволяет поддерживать уровень экспрессии данного белка с наибольшей стабильностью.
Преимущества предлагаемого изобретения заключаются также в использовании химико-ферментативного метода синтеза гена rhFVIII-BDD, что позволяет подобрать оптимальный кодонный состав гена, избежать наличия в последовательности структур ДНК, препятствующих процессу трансляции, критических сайтов сплайсинга, полиаденилирования. Оптимизация первичной структуры гена и использование энхансера транскрипции цитомегаловируса CMV, а также фрагмента ДНК, обеспечивающего прикрепление к ядерному матриксу MAR, позволяют существенно увеличить уровень секреции фактора VIII в питательную среду, и, соответственно, финальный выход целевого продукта.
Рекомбинантная плазмидная ДНК рАР227 содержит следующие последовательности: MAR - района прикрепления к ядерному матриксу гена лизоцима птиц, энхансера транскрипции вируса CMV, кДНК гена rhFVIII-BDD, внутреннего сайта инициации трансляции IRES, гена DHFR, сигнала полиаденилирования вируса SV40, кассеты, содержащей все необходимые элементы для экспрессии гена аминогликозид-3'-фосфотрансферазы (АРН), обеспечивающего устойчивость штамма клеток-продуцента к генетицину, и кассеты для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину. Плазмида рАР227 (фиг.3), кодирующая полипептид фактора VIII, характеризуется следующими признаками:
- состоит из 13973 п.о.,
- имеет молекулярную массу 9,1 МДа,
- кодирует полипептид фактора VIII свертываемости крови человека, с делецией В-домена,
- обеспечивает устойчивость бактериальных клеток, трансформированных данной плазмидой, к ампицилину и клеток млекопитающих, трансфецированных указанной плазмидой, к генетицину,
- содержит уникальные участки узнавания следующих эндонуклеаз рестрикции: AhdI (10094 п.о.), AsiSI (660 п.о.), BglII (2674 n.o.), BmtI (1085 n.o.), BssHII (8520 п.о.), BstBI (8804 п.о.), Eco47III (13117 п.о.), EcoRI (12777 п.о.), EcoRV (13711 п.о.), MluI (5474 п.о.), NheI (1085 п.о.), NotI (6660 п.о.), PpuMI (5458 п.о.), RsrII (8638 п.о.), SbfI (5105 п.о.), SpeI (152 п.о.), Tth111I (8238 п.о.), XcmI (2096 п.о.).
Для производства белка была выбрана линия клеток Cricetulus griseus СНО DHFR-. Исходная линия приобретена в Американской коллекции клеточных культур (АТСС), CRL 9096. Выбор линии клеток обусловлен наличием оптимального профиля гликозилирования для синтеза человеческих белков, а также стабильностью и безопасностью данной линии клеток, что является важнейшим параметром для производства терапевтических белков. На основе этой линии клеток была получена линия клеток Cricetulus griseus CHO 2Н5 - продуцент рекомбинантного фактора VIII свертываемости крови человека, являющаяся производным яичников взрослого китайского хомяка Cricetulus griseus CHO и характеризующаяся следующими признаками:
Морфологические признаки: Клетки имеют типичные морфологические признаки эпителиальной культуры, и, исходно, представляет собой адгерантную культуру. Эта линия является гиподиплоидной (2n=2), модальное число хромосом 20.
Культуральные признаки: Клетки культивируются в монослое на простых питательных средах, например, на среде ДМЕМ в присутствии 2-10% фетальной сыворотки.
Физиолого-биохимические признаки: Клетки растут при температуре 37°С, pH 6.7-7.3.
Устойчивость к антибиотикам: Клетки обладают устойчивостью к генетицину в концентрации 700 мкг/мл.
Штамм клеточной линии Cricetulus griseus CHO 2H5, был депонирован во Всероссийскую Коллекцию промышленных микроорганизмов в ГНИИ Генетика-ВКПМ под номером Н-126, дата депонирования 20.06.2012 г.
Заявленное изобретение поясняется на следующих фигурах:
На фиг.1 представлена аминокислотная последовательность гена фактора VIII с делецией В-домена, 1457 аминокислотных остатков, SEQ ID NO:1.
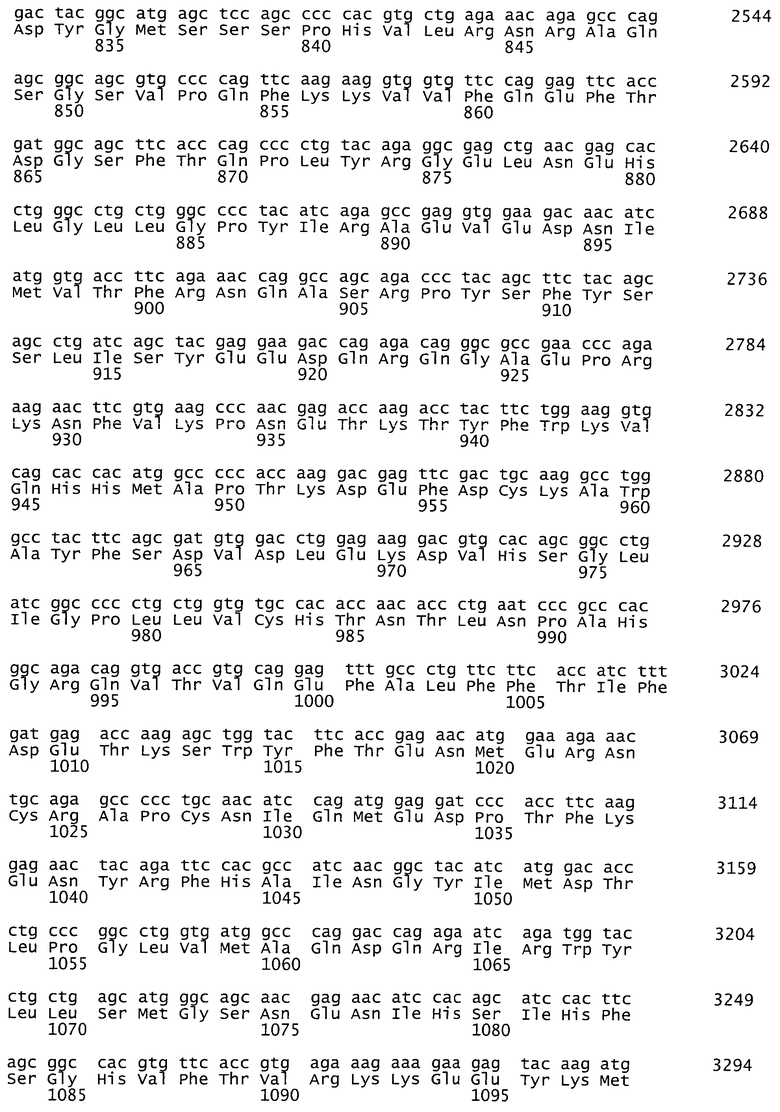
На фиг.2. представлена оптимизированная последовательность гена фактора VIII человека с делецией В-домена, 4371 п.о., SEQ ID NO:2.
На фиг.3 представлена карта рекомбинантной плазмидной ДНК рАР227, использованная для создания штамма-продуцента рекомбинантного фактора VIII свертываемости крови человека с делецией В-домена.
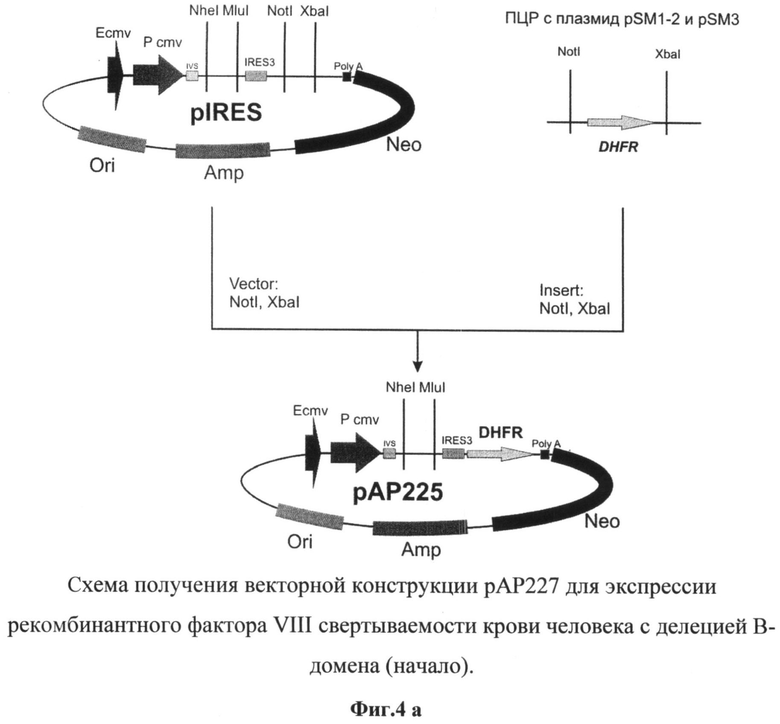
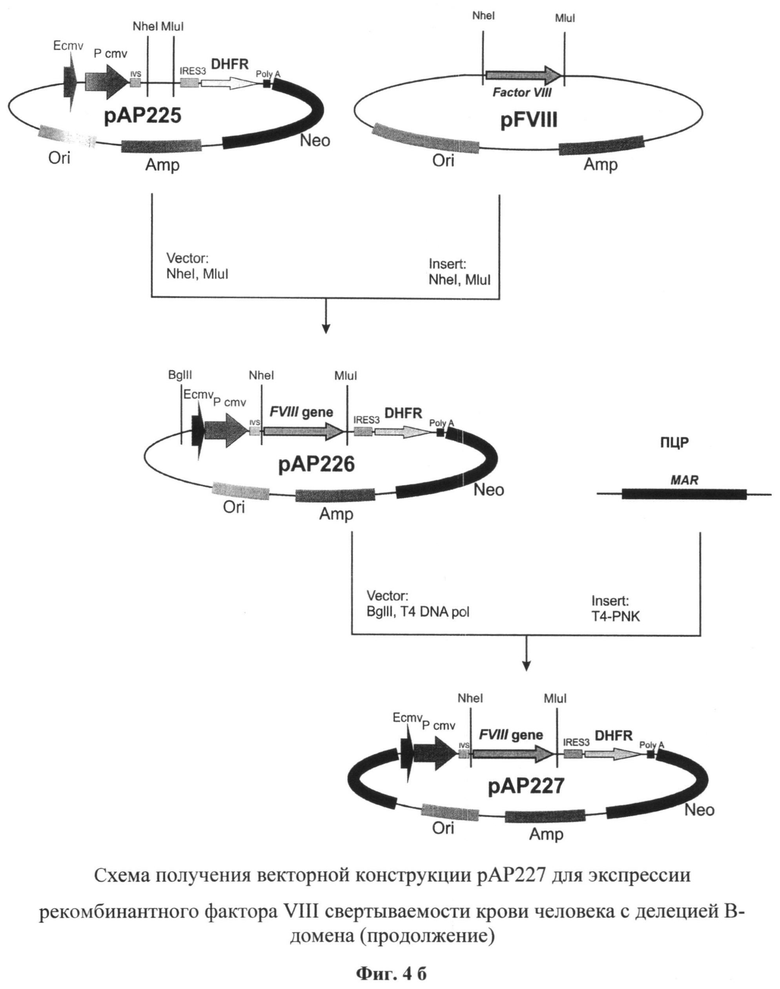
На фиг.4 (а и б) представлена схема получения векторной конструкции рАР227 для экспрессии рекомбинантного фактора VIII свертываемости крови человека с делецией В-домена.
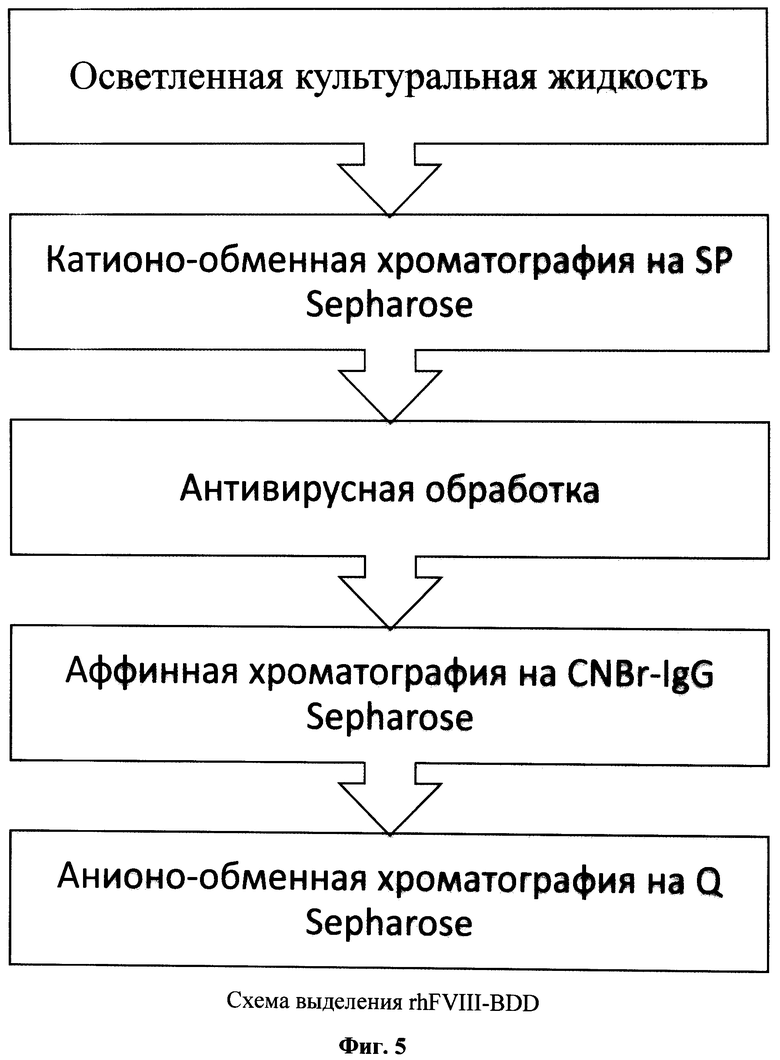
На фиг.5 представлена схема выделения полученного белка.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК рАР227.
Нуклеотидную последовательность, соответствующую кДНК гена коагуляционного фактора VIII человека с делецией В-домена (rhFVIII-BDD) получают химико-ферментативным синтезом. Для этого оптимизированную последовательность гена разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, проводят с помощью твердофазного фосфамидитного метода с использованием синтезатора, например, ASM-102U (БИОССЕТ, Новосибирск). Полученные олигонуклеотиды подвергают 5'-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (NEB, США). Фосфорилированные олигонуклеотиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреита, прогревают до 65°С, медленно охлаждают до 37°С в течение часа и добавляют Т4-ДНК-лигазу. Реакцию лигирования ДНК проводят 12 ч при 37°С; 0,1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПЦР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеров:
F8_fwd
5'-TAGGCTAGCCGCCACCATGATGCAGATCGAGCTGAGCAC -3' и
F8_rev 5'-CGACGCGTTATCAGTACAGGTCCTGGGCCTCGCA-3'.
Синтезированный таким образом фрагмент ДНК содержит последовательность кДНК гена rhFVIII-BDD, фланкированную сайтами узнавания рестриктаз NheI и MluI - SEQ ID NO:2 (фиг.2). Продукт амплификации гидролизуют рестриктазами NheI и MluI, очищают электрофорезом в 1% агарозном геле, полосу ДНК величиной около 4380 п.о. выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
Для получения векторной ДНК рАР227 использовали серию последовательных этапов клонирования (фиг.4). В качестве исходной плазмиды был выбран вектор pIRES (Clontech, США). Используя сайты рестрикции XbaI и NotI, в указанный вектор клонировали ген дигидрофолатредуктазы мыши, полученный методом ПЦР с использованием геномной ДНК, выделенной из клеток миеломы мыши SP2/0, и специфических праймеров
DHFR_fwd
5'-CCTCTAGATGGTTGTGGCCATATTATCATCGTGTTTTTCAAAG-3' и
DHFR_rev 5'-GGAAGCGGCCGCTTAGTCTTTCTTCTCGTAGACTTCA-3'.
с последующим проведением сайт-направленного мутагенеза для оптимизации консенсусной последовательности в окружении инициаторного кодона IRES-элемента с помощью набора QuikChange® II XL (Stratagene, США) и следующих олигонуклеотидов:
D3_fwd
5'-CCTTTGAAAAACACGATGATAATATGGCCACAACCATGGTTCGACCATTGAACTGCATC-3' и
D3_rev
5'-GATGCAGTTCAATGGTCGAACCATGGTTGTGGCCATATTATCATCGTGTTTTTCAAAGG-3'.
В полученную плазмиду рАР225 по сайгам рестрикции NheI и MluI клонировали синтезированную ранее последовательность кДНК гена rhFVIII-BDD.
Первичная структура промежуточной векторной конструкции рАР226 в районе инициаторного кодона IRES-элемента была подтверждена методом секвенирования по Сэнгеру.
Плазмиду рАР226 далее последовательно обрабатывали эндонуклеазой рестрикции BgII и Т4-ДНК полимеразой и образовавшийся вектор использовали в реакции лигирования с ПЦР-продуктом, полученным с использованием MAR-специфических праймеров
MAR_fwd
5'-GGGGATCCGTAATACAATTGTACCAGGTTTTGGTTTATTAC-3' и
MAR_rev
5'-GAAAACAATATATTTCCAAATGAAAAAAAAATCTGATAAAAAG-3'
Отбор полученных после трансформации лигазной смеси бактериальных клеток XL-10 Gold проводили таким образом, чтобы выявить плазмидную ДНК рАР227, содержащую последовательность MAR в геномной ориентации по отношению к промотеру.
Далее селекцию рекомбинантных плазмид проводили таким образом, чтобы идентифицировать векторную ДНК рАР227, содержащую последовательность гена фактора VIII в прямой по отношению к промотеру ориентации. В дальнейшем первичная последовательность полученной плазмидной ДНК была подтверждена методом сиквенирования по Сэнгеру. По данным секвенирования отобрали плазмиду, нуклеотидная и соответствующая ей аминокислотная последовательности NheI - MluI фрагмента которой полностью идентичны последовательности кДНК гена rhFVIII-BDD, которую использовали в дальнейшей работе.
Пример 2. Получение линии клеток Cricetulus griseus CHO 2H5, стабильно продуцирующих рекомбинантный коагуляционный фактор VIII человека.
Для получения клеточной линии, стабильно продуцирующей рекомбинантный фактор VIII свертываемости крови человека (rhFVIII), клетки линии Cricetulus griseus CHO DHFR- (ATCC, CRL-9096), трансфицируют плазмидной ДНК рАР227, линеаризованной по сайту рестрикции AhdI, например методом липофекции при помощи реагента jetPEl™ (Polyplus Transfection Inc., США).
Клетки Cricetulus griseus CHO DHFR- высевают на чашку Петри (например, диаметром 10 см) с плотностью 2×104 клеток/см2 в 12 мл среды DMEM, содержащей 10% бычьей фетальной сыворотки и/или в лунки шестилуночного планшета (например Costar) с плотностью 250×103 клеток/лунка в 3 мл вышеописанной среды, и инкубируют 24 часа при 37°С в СО2 инкубаторе.
Далее проводят трансфекцию, используя 15 мкг линеаризованной по сайту рестрикции AhdI плазмиды рАР277 и 30 мкл реагента jetPEl™ согласно рекомендациям производителя. Через 48 часов после трансфекции начинают селекцию на антибиотике генетицин в концентрации 700 мкг/мл. Смену селективной среды, содержащей антибиотик, проводят регулярно каждые 3-4 дня. Начиная с 7-го дня, лунки и/или чашки Петри анализируют на наличие клонов активно делящихся клеток, устойчивых к генетицину. По окончании процедуры селекции (окончание селекции определялось по полной гибели не трансфицированной популяции клеток, также находящихся под давлением антибиотика) чашки Петри и/или шестилуночные планшеты, содержащие стабильно трансфицированную культуру, были заполнены полужидкой средой Clone Matrix CHO (Genetix) и дальнейшее клонообразование происходило в полужидкой среде в присутствии антител, специфичных к фактору 8, меченных флуоресцентным красителем Alexa 488. Далее субклонирование было выполнено с помощью роботизированной системы ClonePix (Genetix). Всего было получено 150 клонов.
Продуктивность клонов оценивают анализом с использованием хромогенного субстрата и/или иммуноблотинга с использованием моноклональных или поликлональных антител к коагуляционному фактору VIII человека. Для этого в лунках и/или чашках Петри, в которых клетки достигли 80-90% конфлюентности, заменяют среду на свежую, и инкубируют 24-72 часа при 37°С в СО2-инкубаторе. Супернатант используют в тесте для определения специфической активности, используя, например, набор COATEST SP4 FVIII (Chromogenix (Италия) и/или Technoclone, Австрия). Также для детекции FVIII были использованы коммерческие антитела против тяжелой цепи фактора VIII, производимые компанией Abeam. Панель из 40 лидерных клонов была отобрана для процедуры амплификации метотрексатом.
Для биотехнологических целей в системе амплификации рекомбинантных генов в качестве селектируемого маркера часто используют ген дигидрофолатредуктазы (DHFR), интегрированный в экспрессирующий вектор. DHFR катализирует превращение фолиевой кислоты в тетрагидрофолат, необходимый для синтеза эукариотическими клетками глицина, тимидинмонофосфата и пуриновых оснований. В этой связи клетки СНО, в которых ген DHFR инактивирован под действием мутации (СНО DHFR-), не растут на средах без нуклеозидов и приобретают эту способность после трансфекции геном DHFR.
Растущие трансфектанты далее отбираются по признаку амплификации гена DHFR на фоне увеличивающихся концентраций метотрексата - ингибитора DHFR, в питательной среде, так как увеличение числа копий гена будет придавать клеткам устойчивость к ингибитору в больших концентрациях. После проведения множественных раундов селекции получают популяцию клеток, содержащих до нескольких сотен копий гена DHFR.
Для данной лидерной панели было проведено 7 последовательных раундов амплификации метотрексатом. Для этой цели клетки каждого клона культивировали на среде IMDM, не содержащей глицин, гипоксантин и тимидин, в присутствии 10% диализованной фетальной сыворотки с добавлением увеличивающихся количеств метотрексата: 20 нМ, 50 нМ, 100 нМ, 200 нМ, 400 нМ, 800 нМ, 1600 нМ. Продолжительность каждого раунда составляла примерно 10-14 дней. Достигнуто увеличение продуктивности 2,5-14 раз в зависимости от клона. В результате были отобраны 6 лидерных клонов-продуцентов rhFVIII, которые были подвергнуты амплификации более высокими концентрациями метотрексата (3, 6 и 15 мкМ), достигнуто дополнительное увеличение продуктивности от 6 до 10 раз. Данная лидерная панель далее была использована в тесте на стабильность продуцирующей способности и ростовых характеристик. Для этой цели клоны культивировали на протяжении 50-100 генераций, периодически оценивая как уровень экспрессии rhFVIII так и ростовые характеристики клонов.
Таким образом, был получен один из наиболее производительных и стабильных клонов Cricetulus griseus CHO 2H5, который был далее использован для создания мастер-банка и последующего производства рекомбинантного фактора VIII свертываемости крови человека. Уровень экспрессии белка для данного клона составляет 9-17 МЕ/мл/24 ч на среде ДМЕМ в присутствии 10% фетальной сыворотки, удельная продукция составляет 60-80 мкМЕ/кл/24 часа.
Линия клеток Cricetulus griseus CHO 2H5 - продуцент рекомбинантного фактора VIII свертываемости крови человека, была успешно адаптирована к суспензионным бессывороточным условиям культивирования.
Далее проводилось культивирование в различных условиях для достижения оптимального выхода белка, подробно описанное в примерах 3 и 4.
Пример 3.
Культивирование клеток-продуцентов рекомбинантного фактора VIII свертываемости крови человека в роллерных бутылях.
Клетки засевают в роллерные бутыли с плотностью 5·104 кл/см2, в 500 мл питательной среды на бутыль емкостью 5 л и поверхностью для роста культуры клеток=2000 см2. Для роста клеток используют среду DME/F12 с 10% фетальной сыворотки.
Культивирование осуществляют при 37°С, содержании СО2 в воздушной фазе=5% V/V, скорости вращения роллерных бутылей=10-20 об/час, как правило 12-14 об/час.
После формирования плотного монослоя культур клеток, как правило через 72 часа после засева клеток, производят замену среды роста на среду продукции следующего состава: DME/F12 с 2% фетальной сыворотки, по 400-700 мл питательной среды на 1 роллерную бутыль, как правило по 500 мл на 1 роллерную бутыль.
Ежесуточно осуществляют полную замену объема питательной среды продукции.
Уровень экспрессии целевого белка в данных условиях культивирования составляет 9-12 МЕ/мл (или 0,9-1,2 мг/л) продуктосодержащей питательной среды/24 часа.
При использовании среды, состоящей из DME/F12 с 4% фетальной сыворотки, с 50 ME инсулина (рекомбинантный инсулин человека) на 1 л питательной среды и 1% V/V диметилсульфоксида, уровень экспрессии целевого белка составляет 12-18 МЕ/мл (или 1,2-1,8 мг/л) продуктосодержащей питательной среды/24 часа.
Пример 4. Культивирование клеток-продуцентов рекомбинантного фактора VIII свертываемости крови человека в культуральных сосудах индустриального типа.
Для культивирования клеток-продуцентов и получения продуктосодержащей питательной среды используют культуральные сосуды Cell Factory с суммарной поверхностью для роста клеток=2,4 м2 и рабочим объемом питательной среды=8 л. Посевная плотность составляет 2,5·104 кл/см2. Среда роста имеет состав: DME/F12 с 10% фетальной сыворотки; среда продукции: DME/F12 с 4% фетальной сыворотки, с 50 ME инсулинаЛл среды продукции, с 1% V/V диметилсульфоксида.
Клетки культивируют при 37°С, содержание СО2 в газовой фазе=5%. После формирования плотного монослоя культур клеток, как правило через 72 часа после засева клеток, среду роста заменяют на среду продукции. Среду продукции заменяют каждые 24 часа на свежую, такого же состава и объема.
При данных условиях культивирования уровень экспрессии целевого белка составляет 20-28 МЕ/мл (2,0-2,8 мг/л) за 24 часа.
Выделение полученного белка проводили с использованием методов, описанных далее в примерах 5-8. При этом была использована уникальная комбинация методов выделения, позволяющая использовать данный метод для промышленного производства лекарственного препарата на основе rhFVIII-BDD.
Пример 5. Выделение rhFVIII-BDD с использованием катионо-обменной хроматографии на SP Sepharose
Фактор свертывания крови VIII (FVIII) является металл-зависимым белком, имеющим несколько центров связывания различных ионов металлов. Ключевым ионом является кальций (Са2+), наличие которого необходимо для проявления биологической активности FVIII. Помимо центров связывания кальция, FVIII обладает центром высокого сродства к ионам меди (Cu2+), связывание которых стабилизирует структуру белка и улучшает его функциональные свойства. Однако, при концентрациях больше 1 мМ ионы меди ингибируют FVIII. Таким образом, в процессе выделения все растворы FVIII содержали ионы кальция (Са2+) и близкие к эквимолярным белку количества ионов меди (Cu2+).
SP-сефароза является сильным катионо-обменным сорбентом, связывающим биомолекулы, имеющие положительный заряд в условиях нанесения. Использование SP сефарозы в процессе выделения FVIII приводит к количественному захвату FVIII из культуральной жидкости, что приводит к очистке от отрицательно заряженных примесей, таких как белки и ДНК штамма-продуцента, не связывающихся с сорбентом, а также позволяет сконцентрировать FVIII перед проведением следующей хроматографической стадии.
Перед нанесением осветленной культуральной жидкости на SP-сефарозу сорбент уравновешивали стартовым буфером (20 мМ имидазол, 5 мМ CaCl2, 3 мМ EDTA, 0,02% полисорбат 80, pH 7.5). После нанесения сорбент промывали стартовым буфером от несвязавшихся примесей. Фракцию FVIII элюировали солевым буфером (20 мМ имидазол, 5 мМ CaCl2, 3 мМ EDTA, 600 мМ NaCl, 0.05% полисорбат 80, 0.0001 мМ CuSO4, pH 7.5). Полученный раствор подвергали антивирусной обработке.
Пример 6. Антивирусная обработка rhFVIII-BDD
Антивирусную обработку FVIII проводили путем добавления к элюату с SP сефарозы полисорбата 80 до 1% и три-(н-бутил)-фосфата до 0,03%; смесь оставляли при перемешивании в течение одного часа при комнатной температуре. При этом разрывается оболочка вирусов, содержащая липиды, и инфекционность вирусов полностью утрачивается.
Пример 7. Выделение rhFVIII-BDD с использованием аффинной хроматографии на CNBr IgG Sepharose.
CNBr-IgG сефароза является аффинным сорбентом собственного производства, полученным путем иммобилизации моноклональных антител к FVIII на CNBr-активированной сефарозе; моноклональные антитела получали в результате культивирования линии мышиной гибридомы. Использование аффинного сорбента в процессе выделения приводит к специфическому количественному связыванию FVIII, что приводит к его максимально эффективной очистке от остаточных примесей.
Колонку с CNBr-IgG сефарозой предварительно уравновешивали стартовым буфером (20 мМ имидазол, 5 мМ CaCl2, 400 мМ NaCl, 0,02% полисорбат 80, 0.0001 мМ CuSO4, pH 6.8), после чего наносили раствор FVIII, прошедший антивирусную обработку, и промывали сорбент стартовым буфером. Фракцию FVIII элюировали буфером, содержащим 50% этиленгликоля. Полученную фракцию FVIII разводили в 2 раза буфером разбавления (100 мМ ацетат аммония, 30 мМ NaCl, 5 мМ CaCl2, 0.02% полисорбат 80, pH 6.4) и сразу же наносили на следующую стадию очистки.
Пример 8. Выделение rhFVIII-BDD с использованием анионо-обменной хроматографии на Q-Sepharose
Q-Сефароза является сильным анионо-обменным сорбентом, связывающим биомолекулы, имеющие отрицательный заряд в условиях нанесения и позволяющий разделять вещества по силе связывания. Использование Q-сефарозы в процессе выделения rhFVIII-BDD позволяет очистить мономер rhFVIII-BDD от родственных примесей (в основном продуктов деградации), имеющих меньшее сродство к сорбенту, а также позволяет сконцентрировать FVIII в буфер готовой формы.
Колонку с Q-сефарозой предварительно уравновешивали стартовым буфером (100 мМ аммония ацетат, 10 мМ NaCl, 0.02% Tween 80, pH 6.4). После нанесения разбавленного элюата с аффинной стадии сорбент промывали стартовым буфером, а затем промывочным буфером (100 мМ аммония ацетат, 100 мМ NaCl, 20 мМ CaCl2, 0,02% полоксамер 407, pH 6,4). После этого сорбент уравновешивали промежуточным буфером (19.3 мМ гистидин, 100 мМ NaCl, 17.5 мМ сахароза, 0.02% полоксамер 407, pH 7.0), затем фракцию FVIII элюировали буфером с высокой концентрацией кальция (19.3 мМ гистидин, 250 мМ NaCl, 50 мМ CaCl2, 17.5 мМ сахароза, 0.02% Pluronic F127, pH 7.0). Получали субстанцию FVIII в буфере, пригодном для хранения или лиофилизации.
Пример 9. Определение биологической активности полученного белка.
Активность FVIII измеряли методом хромогенного анализа. Метод основан на том, что скорость увеличения оптической плотности реакционной смеси, имеющей в своем составе набор факторов свертывания, последовательно активирующих друг друга, зависит от активности FVIII, являющимся первым фактором в каскаде. В реакционную смесь вносили исследуемый образец фактора VIII и смесь реагентов, имеющую в своем составе активированный фактор IX и фактор X. Смесь инкубировали при 37°С и непрерывном перемешивании, после чего добавляли хромогенный субстрат активированного фактора X. Скорость изменения оптической плотности конечной реакционной смеси детектировали с помощью спектрофотометра; активность FVIII определяли относительно международного стандарта.
Субстанция FVIII, полученная по методике, описанной в предыдущих примерах, показывала высокую удельную активность около 10000 МЕ/мг.
Полученный очищенный белок может быть использован для получения лекарственного средства.













Изобретение относится к области биотехнологии и может быть использовано для получения рекомбинантного фактора свертываемости крови VIII человека с делецией В-домена (hFVIII-BDD). Рекомбинантной плазмидной ДНК ДНК рАР227, кодирующей полипептид с последовательностью hFVIII-BDD, включающей также MAR - область прикрепления к ядерному матриксу гена лизоцима птиц, усилитель транскрипции вируса CMV, внутренний сайт инициации трансляции IRES вируса энцефаломиокардита, ген DHFR мыши, сигнал полиаденилирования вируса SV40, ген аминогликозид-3'-фосфотрансферазы, обеспечивающей устойчивость к генетицину (Neo), кассету для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину, трансформируют клетки линии Cricetulus griseus CHO DHFR (-) с получением линии клеток Cricetulus griseus CHO 2H5, продуцирующей рекомбинантный hFVIII-BDD со стабильно высоким выходом на уровне около 20 МЕ/мл/24 ч. Культивирование клеток-продуцентов проводят в среде DME/F12, содержащей 2-4% фетальной бычьей сыворотки, 1% диметилсульфоксида и 50 МЕ/л инсулина. 3 н. и 1 з.п. ф-лы, 5 ил., 9 пр.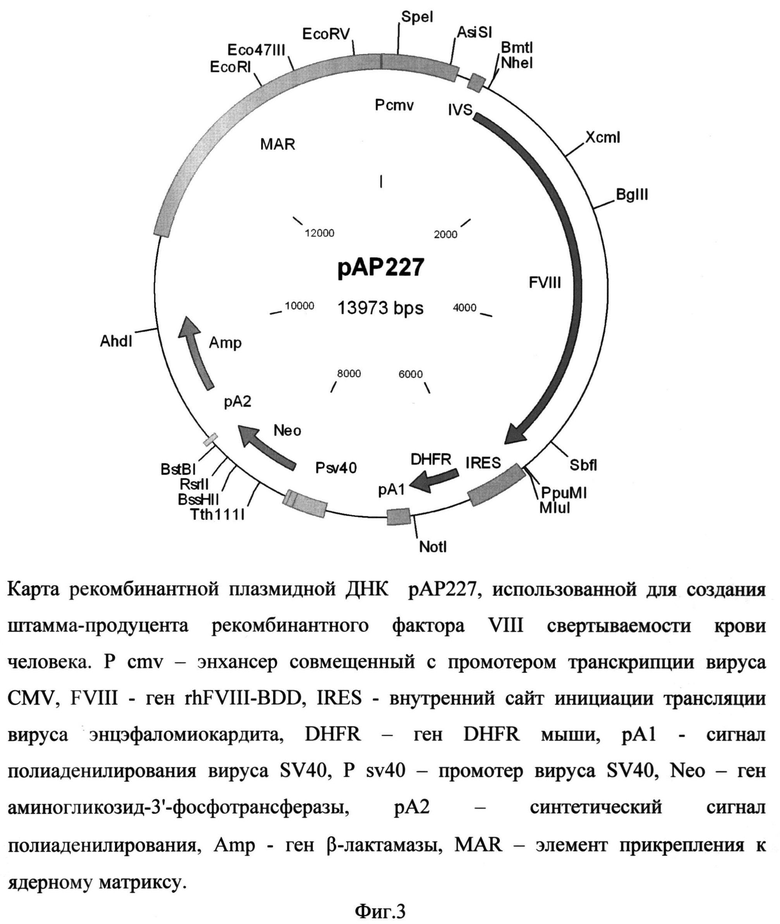
1. Рекомбинантная плазмидная ДНК рАР227, кодирующая полипептид с последовательностью фактора VIII свертываемости крови человека, имеющая размер 13973 п.о., с физической картой, представленной на фиг.3, и состоящая из следующих элементов:
- оптимизированной последовательности, кодирующей полипептид фактора VIII свертываемости крови человека с делецией В-домена, представленной в виде SEQ ID N0:2,
- MAR - области прикрепления к ядерному матриксу гена лизоцима птиц,
- усилителя транскрипции вируса CMV,
- внутреннего сайта инициации трансляции IRES вируса энцефаломиокардита,
- гена DHFR мыши,
- сигнала полиаденилирования вируса SV40,
- аминогликозид-3'-фосфотрансферазы, обеспечивающего устойчивость штамма клеток-продуцента к генетицину (Neo),
- кассеты для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину,
- уникальных участков узнавания следующих эндонуклеаз рестрикции: AhdI (10094 п.о.), AsiSI (660 п.о.), BglII (2674 п.о.), BmtI (1085 п.о.), BssHII (8520 п.о.), BstBI (8804 п.о.), Eco47III (13117 п.о.), EcoRI (12777 п.о.), EcoRV (13711 п.o.), MluI (5474 п.o.), NheI (1085 п.o.), NotI (6660 п.о.), PpuMI (5458 п.o.), RsrII (8638 п.o.), SbfI (5105 п.o.), SpeI (152 п.o.), Tth111I (8238 п.o.), XcmI (2096 п.о.).
2. Линия клеток Cricetulus griseus CHO 2H5 - продуцент рекомбинантного фактора VIII свертываемости крови человека, полученная путем трансформации линии клеток Cricetulus griseus CHO DHFR - рекомбинантной плазмидной ДНК рАР227 по п.1.
3. Способ получения полипептида, обладающего активностью фактора VIII, включающий культивирование линии клеток по п.2, и выделение полипептида из культуральной жидкости, характеризующийся тем, что культивирование, обеспечивающее экспрессию указанного полипептида, проводят в среде DME/F12, содержащей 2-4% фетальной сыворотки, 1% диметилсульфоксида и 50 МЕ/л инсулина.
4. Способ по п.3, отличающийся тем, что выделение полипептида осуществляют при помощи следующей последовательности операций:
осветление культуральной жидкости, катион-обменная хроматография на SP-Сефарозе, антивирусная обработка, аффинная хроматография на CNBr-IgG Сефарозе, анион-обменная хроматография на Q-Сефарозе.
| Способ определения напряжений ползучести | 1973 |
|
SU506757A1 |
| WO 9946299 А1, 16.09.1999 | |||
| US 2007258962 А1, 08.11.2007 | |||
| RU 2009139151 А, 27.04.2011 | |||
| LIND P | |||
| et | |||
| al., Novel forms of B-domain-deleted recombinant factor VIII molecules Construction and biochemical characterization, Eur | |||
| J | |||
| Biochem.,1995, v.232, p.19-27. | |||
Авторы
Даты
2013-12-10—Публикация
2012-07-19—Подача