Состояние проблемы
Изобретение относится к способу перорального введения и препарату биологически активного соединения, заключенного в индифферентную среду из одного или нескольких биосовместимых полимерных материалов, образующих микрокапсулы с активным веществом, которые благодаря своим размерам и физико-химическим свойствам обеспечивают доставку этого вещества и его включение в агрегированные лимфатические фолликулы (пейеровы бляшки) пищеварительных органов животных без потери активности при прохождении через желудочно-кишечный тракт. Аналогичные агрегаты имеются в дыхательных органах, мочеполовой системе, толстой кишке и других органах, имеющих слизистую оболочку. В ходе дальнейшего изложения эти образования обозначаются как ассоциированная со слизистой лимфатическая ткань.
Микрокапсулы широко применяются для предохранения биологически активных соединений от разложения. Обычно такие соединения заключают в один или несколько слоев защитного материала, как правило, полимерной природы. Активное соединение может быть окружено слоем полимерного материала в форме оболочки (микрокапсулы) или равномерно распределено в нем (микросферы). В дальнейшем термином "микрокапсулы" будут обозначаться обе формы препарата. Количество активного вещества в микрокапсулах можно варьировать в зависимости от назначения препарата, от очень небольших величин до 95% и более общего состава микрокапсулы. Размеры последней также могут изменяться от менее 1 мкм до 3 мл и более.
Пейеровы бляшки представляют собой агрегированные лимфатические узелки, локализованные в стенках толстых и тонких кишок и слепого отростка, и являются важным компонентом защитной системы организма против инфекционных организмов и другого чужеродного материала. Антигены - это вещества, индуцирующие образование антител и/или клеточные иммунные реакции вследствие наличия в их составе посторонних белков или тканей.
Реакции, индуцируемые взаимодействием антигенов с иммунной системой, могут быть положительными или отрицательными в смысле способности организма продуцировать антитела или отвечать опосредуемыми через клетки иммунными реакциями на повторное воздействие тем же антигеном. В понятие опосредуемого через клетки иммунитета включают способность вызывать гибель инородных клеток или тканей, "опосредуемую через клетки цитотоксичность" и аллергические реакции отложенного типа. Антитела относятся к классу белков, называемых иммуноглобулинами (Ig), которые образуются под воздействием антигенов и образуют с ними специфические комплексы. Такие комплексы обеспечивают выведение антигена из организма, их образование сопровождается гибелью "живых" антигенов (например, патогенных возбудителей, инородных или раковых клеток) и нейтрализацией активности токсинов или ферментов. Основным классом иммуноглобулинов в секрете, омывающем слизистые, являются иммуноглобулины A (sIgA). Секретирующие их антитела предотвращают прилипание патогенных организмов к слизистой или их проникновение в нее. Это же относится и к другим антигенам.
Многочисленные антигены проникают в организм через слизистые оболочки, однако наиболее распространенные способы иммунизации, например, внутримышечные или подкожные инъекции вакцин или антигенов, редко вызывают появление sIgA в продуктах секреции слизистой. Их продукция наиболее интенсивно индуцируется посредством прямой иммунизации ассоциированной со слизистой лимфатической ткани, основная часть которой присутствует в организме в форме пейеровых бляшек желудочно-кишечного тракта.
Пейеровы бляшки имеют в своем составе клетки-предшественники, так называемые В клетки, которые локализуются в lamina propria желудочно-кишечного тракта и верхних отделов дыхательной системы и дифференцируются в зрелые клетки, синтезирующие IgA. Исследования Heremans и Bazin по формированию способности синтезировать IgA у мышей после перорального введения антигена показали, что существует определенная последовательность формирования антиген-специфичных клеток, продуцирующих IgA: сначала они появляются в брыжеечных лимфатических узлах, затем в селезенке и, наконец, в lamina propria желудочно-кишечного тракта (Bazin Н., Levi G. & Doria G. Predominant contribution of IgA antibody-forming cells to an immune response detected in extraintestinal lymphoid tissues of germ free mice exposed to antigen via the oral route / Ведущая роль клеток продуцирующих IgA-антитела в иммунных реакциях, выявляемых во внекишечных лимфоидных тканях безмикробных мышей после орального введения антигена /, I. Immunol. 105: 1049; 1970 и Crabbe P.A., Nash D.R., Bazin Н., Eyssen H. & Heremans J.F. Antibodies of the IgA type in intestinal plasma cells of germ-free mice after oral or parenteral immunization with ferritin / IgA - антитела в клетках кишечной плазмы безмикробных мышей после пероральной или парентеральной иммунизации ферритином /, J. Exp. Med.130: 723; 1969). Последующие исследования показали, что пероральное введение антигенов приводит к образованию sIgA антител в пищеварительных органах, а также их появлению в продуктах секреции таких удаленных от пищеварительного тракта органах, как бронхи, грудные железы (в молоке и молозиве), слюнные железы, и в слезах (Mestecky J., McGhee J.R., Arnold R.R., Michalek S.M., Prince S.J. & Babb J.L. Selective induction of an immune response in human external secretions by ingestion of bacterial antigen / Избирательная индукция иммунной реакции во внешних секретах человека после перорального введения бактериального антигена /, J. Clin Invest. 61: 731; 1978, Montgomery Р.С., Rosner B.R. & Cohen J. The secretory antibody response. Anti-DNP antibodies induced by dinitrophenylated Type III pneumococcus / Секреторная реакция антител. Антитела к ДНП, индуцированные динитрофенилированными пневмококками III типа /, Immunol. Commun. 3: 143; 1974; & Hanson L.A., Ahistedt S., Carlsson В., Kaijser В., Larsson P., Mattsby Baltzer A., Sohl Akerlund A., Svanborg Eden C. & Dvennerhoint A.M. Secretory IgA antibodies to enterobacterial virulence antigens: their induction & possible relevance / Секреция IgA антител к вирулентным антигенам энтеробактерий: Их индукция и возможная роль / Adv. Exp. Med. Biol. 1007; 165; 1978). Данные указанных авторов свидетельствуют о том, что пейеровы бляшки служат обильными источниками клеток-предшественников, трансформирующихся в IgA-продуцирующие клетки, которые после сенсибилизации антигеном поступают в циркуляцию и обусловливают экспрессию антител не только в месте исходного действия антигена, но и на удаленных от него участках слизистой. Такая система транспорта В клеток в различные участки слизистой после их сенсибилизации обеспечивает реакцию ее иммунной системы на проникающие в желудочно-кишечный тракт из окружающей среды антигены и потенциальные возбудители.
Особое значение с точки зрения предлагаемого изобретения имеет способность антигенов индуцировать образование защитных антител после перорального введения. Известно, что поступление антигенов в организм животных с кормом приводит к образованию специфических иммуноглобулинов А, которые могут быть обнаружены в смывах из бронхов или носовой полости. При исследованиях на добровольцах также показано, что введение антигриппозной вакцины (перорально) индуцирует секрецию соответствующих антител в носовую полость.
Многочисленные исследования продемонстрировали возможность оральной иммунизации для индуцирования активности иммунной системы слизистой. Одновременно было показано, однако, что для этого необходимы очень высокие дозы антигена. Поэтому, за редкими исключениями, такой способ не может иметь практической ценности. Очевидно, что любой препарат для перорального введения или способ последнего должны обеспечивать предохранение активного ингредиента от разрушения в желудочно-кишечном тракте в процессе транспорта к пейеровым бляшкам. Несоблюдение этого условия приведет к тому, что если этот ингредиент и достигнет бляшек, то его количество или активность будут недостаточны для проявления желаемого эффекта.
В связи с этим очевидна потребность в способе пероральной иммунизации, который бы обеспечивал эффективную стимуляцию иммунной системы слизистой и позволял решить проблему защиты антигена от разрушения при прохождении по желудочно-кишечному тракту к пейеровым бляшкам. Еще более актуальной задачей является разработка способа, обеспечивающего избирательный транспорт антигена в пейеровы бляшки и его освобождение в этих образованиях. Нерешенной остается и проблема иммунизации с использованием слизистой других органов, что позволило бы избежать разрушения антигена и обеспечило его поступление именно в ассоциированную со слизистой лимфатическую ткань. Кроме того, предстоит решить вопросы защиты антигена от разрушения после его поступления в слизистую, обеспечения и/или оптимизации дальнейшего транспорта антигена из ассоциированной со слизистой лимфатической ткани и освобождения биологически активного материала из фармакологического препарата после введения последнего в организм.
Краткое содержание изобретения
Изобретение относится к способу введения и препарату для направленного переноса и последующего освобождения биологически активного соединения в организме животных после контакта со слизистыми оболочками, особенно к способу перорального и внутрилегочного введения. Биологически активное соединение заключают в микрокапсулу из биологически совместимого полимера или сополимера, который может проходить через желудочно-кишечный тракт и сохраняться на поверхности слизистой, не подвергаясь разрушению или подвергаясь ему в незначительной степени, что обеспечивает поступление биологически активного соединения в пейеровы бляшки или другие ассоциированные со слизистой лимфатические ткани и проникновение в них в исходных эффективных количествах. Термином биологически сопоставимый полимерный материал обозначается полимер, не обладающий токсичностью, канцерогенным или воспалительным действием в организме. Желательно, чтобы индифферентный полимерный материал микрокапсул подвергался биодеградации, т.е. разрушался в ходе физиологических процессов до продуктов, не накапливающихся в тканях и выводящихся из организма. Микрокапсулы должны иметь такие размеры и физико-химические свойства, которые обеспечивали бы их эффективное избирательное поступление в пейеровы бляшки. В изобретении решены проблемы направленного переноса биологически активного соединения в пейеровы бляшки и другие ассоциированные со слизистой ткани и включения в них.
Цель изобретения состоит в разработке способа перорального введения антигена животным, при котором он достигает пейеровых бляшек и включается в них, стимулируя таким образом иммунную систему слизистой, без потери иммуногенной активности в процессе транспорта по желудочно-кишечному тракту.
Другая задача изобретения заключается в разработке способа перорального введения животным антигена, при котором он достигает пейеровых бляшек и включается в них без потери активности в процессе транспорта по желудочно-кишечному тракту, стимулируя таким образом системный иммунитет.
Еще одна цель изобретения - разработка способа введения антигена животным, при котором он достигает ассоциированных со слизистой лимфатических тканей, стимулируя таким образом иммунную систему слизистой, без потери активности вследствие разрушения на поверхности последней.
Следующая цель изобретения - разработка способа введения антигена животным, при котором он достигает ассоциированных со слизистой лимфатических тканей и включается в них, стимулируя таким образом системный иммунитет, без потери активности вследствие деградации на поверхности слизистой.
Цель изобретения состоит также в разработке способа перорального введения биологически активного соединения животным, обеспечивающего его транспорт и включение в пейеровы бляшки, для создания локальной или системной концентрации препарата.
Цель изобретения состоит также в разработке метода введения животным биологически активного соединения, обеспечивающего его поступление и включение в ассоциированную со слизистой лимфатическую ткань для создания локальной или системной концентрации препарата.
Цель изобретения - разработка фармакологической формы, содержащей биологически активный ингредиент и заключающий его полимерный или сополимерный индифферентный материал, предпочтительно поддающийся биодеградации, которая пригодна для переноса в слизистые оболочки описанными выше способами.
Еще одна цель изобретения состоит в создании улучшенной системы вакцинации, позволяющей избежать использования стимуляторов иммуногенеза.
Следующая цель изобретения - создание усовершенствованной системы вакцинации для индукции иммунитета в процессе пульсирующего освобождения антигена после однократного введения его в составе микрокапсулы.
Цель изобретения состоит также в создании усовершенствованной системы для вакцинации, которая позволяет избежать использования стимуляторов иммуногенеза и позволяет индуцировать иммунную реакцию посредством пульсирующего освобождения антигена исключительно из микрокапсулы после однократного введения препарата.
Цель изобретения состоит также в разработке композиции, обеспечивающей достижение вышеуказанных целей.
Подробное описание изобретения
Ниже приведены примеры реализации изобретения. Они иллюстрируют способы направленного и программированного переноса антигенов (тринитрофенил гемоцианина морского блюдечка и токсоидной вакцины стафилококкового энтеротоксина В) и лекарственного препарата (этретината) в ассоциированную со слизистой лимфатическую ткань мышей в составе микрокапсул из полимера DL-лактид-гликолида (50:50).
Следует отметить, что для этой цели можно использовать и другие полимерные материалы, например полигликолид, поли(DL-лактид-когликолид), кополиоксалаты, поликапролактон, поли(лактид-кокапролактон), поли(эстерамиды), полиортоэфиры и поли-8-оксимаслянную кислоту, а также полиангидриды и другие полимерные соединения.
Кроме того, можно использовать другие, помимо указанных выше, биологически активные ингредиенты. К их числу относятся антигены противовирусных вакцин, вакцин против бактериальных протозойных и грибковых заболеваний (грипп, парагрипп, другие респираторные заболевания, (Hemophilus influenza, Bordetella pertussis, Neisseria gonorrhoeae, Streptococcus pneumoniae & Plasmodium falciparum), а также вакцин против других болезней, вызываемых патогенными микроорганизмами; заболеваний, обусловленных патогенными микрогельминтами; и противоаллергических вакцин. Дополнительно в качестве биологически активных ингредиентов используют иммуномодуляторы, питательные вещества, лекарственные средства, пептиды, лимфокины, цитокины и другие соединения.
I. Микрокапсулирование
А. Изготовление микрокапсул с красителями
Для того чтобы проследить проникновение микрокапсул в пейеровы бляшки, изготавливают светящиеся капсулы из неподдающегося биодеградации полимера полистирола, содержащие растворимый в воде флюоресцирующий краситель кумарин. Процедура изготовления состоит в следующем:
Сначала готовят раствор полимера, разводя 4,95 г полистирола (Type 685D, Dow Chemical Company, Midland, MI) в 29,5 г метилен хлорида (Reagent Grade, Eastman Kodak Rochester, NY). Затем в полимерный раствор добавляют примерно 0,05 г кумарина (Polysciences Inc., Warrington, PA) и помещают смесь на магнитную мешалку.
В отдельной емкости готовят 10%-ный водный раствор поливинилового спирта (ПВС), используемого в качестве рабочей среды. Для этого 40 г ПВС (Vinol 2050, Air Products & Chemical, Allentown) разводят в 360 г деионизированной воды.
Готовый раствор насыщают 6 г метиленхлорида. Затем его переливают в мешалку из синтетической смолы (Асе Glass, Inc., Vineland, NY) с турбинной крыльчаткой (2,5 дюйма) и моторчиком Фишера и перемешивают при скорости вращения 380 оборотов/мин. Вместимость мешалки 1 л.
Полученную таким образом смесь кумарина с полистиролом переносят в емкость с раствором ПВС, используя для этого воронку диаметром 7 мм с длинной ножкой. При этом образуется устойчивая водно-масляная эмульсия, которую дополнительно перемешивают в течение 30 мин при атмосферном давлении до получения микрокапель масла желаемого размера. Затем емкость закрывают и постепенно понижают давление до 520 мм рт.ст., используя водяной насос, подсоединенный к манометру, и выпускной клапан. Содержимое емкости перемешивают при пониженном давлении в течение 24 часов до полного испарения метиленхлорида. После этого центрифугированием собирают отвердевшие микрокапсулы и подсушивают их в течение 72 часов в вакуумной камере при комнатной температуре.
Б. Изготовление микрокапсул с антигеном
Растворимый в воде антиген ТНФ - ГМЦ заключают в капсулу из поли(DL-лактид-когликолида) - биологически совместимого, поддающегося биодеградации полиэфира. При этом используют следующую процедуру.
Сначала готовят раствор полимера, растворяя 0,5 г поли(DL-лактид-когликолида) в соотношении 50:50 в 4,0 г метиленхлорида. Затем 300 мкл антигена ТНФ-ГМЦ (46 мг антигена/мл после диализа) равномерно распределяют в растворе поли(DL-лактид-коглинолида), используя смеситель Vortex-Genie 2 (Scientific Industries Inc., Bohemia, NY).
В отдельной емкости готовят 8%-ный водный раствор ПВС, разводя 4,8 г ПВС в 55,2 г деинизированной воды. После растворения ПВС раствор переливают в смеситель из синтетической смолы с турбинной крыльчаткой из тефлона диаметром 1,5 дюйма на вращающемся валу (Kontes Glass Inc., Vineland, NY). Затем через воронку длиной 7 мм с длинной ножкой доливают полимерный раствор, одновременно перемешивая раствор ПВС при скорости вращения вала около 650 оборотов/мин. Полученную таким образом водно-масляную эмульсию перемешивают в течение еще 10 мин, содержимое емкости переносят в 3,5 л деионизированной воды в сосуде на 4 л и перемешивают примерно при 800 оборотах/мин с помощью крыльчатки из нержавеющей стали (2 дюйма). Образовавшиеся при этом микрокапсулы в течение 30 мин промывают деионизированной водой, собирают посредством центрофугирования, дважды промывают деионизированной водой для удаления остатков ПВС и снова собирают в условиях лиофильной сушки. Полученные таким образом микрокапсулы представляют собой сферические частицы диаметром от 1 до 10 мкм. Аналогичным способом получают другие микрокапсулы, например, для включения стафилококкового энтеротоксина В.
Содержание антигена ТНФ-ГМЦ в микрокапсулах, точнее их сердцевине, определяют взвешиванием 10 мг содержащих его капсул в центрифужной пробирке на 12 мл. Для этого в пробирку наливают 3,0 мл метиленхлорида и перемешивают до растворения поли(DL-лактид-когликолида). Затем в пробирку добавляют 3,0 мл деионизированной воды и энергично перемешивают в течение еще 1 мин. Полученную смесь центрифугируют для разделения водной и органической фаз. Водный слой переносят в мерную колбу объемом 10 мл. Повторяют экстракцию, объединив водные фазы в мерной колбе и долив в нее деионизированную воду до конечного объема. Методом белковой пробы проводят количественное определение антигена ТНФ-ГМЦ в мерной колбе и рассчитывают его содержание в микрокапсулах. Последние должны содержать антиген в количестве 0,2% общего веса. Аналогичным образом определяют содержание стафилококкового энтеротоксина В в заключающих его микрокапсулах.
II. Проникновение микрокапсул с красителем в пейеровы бляшки после перорального введения
Пейеровы бляшки образуют основную массу ткани, в которой происходит индуцированное образование IgA антител. Эти изолированные островки лимфоретикулярной ткани расположены по всей длине тонкого кишечника и слепого отростка. Направленное поступление в них интактного антигена, сопровождающееся его локальным накоплением, согласно современным представлениям служит наиболее эффективным способом индукции диффузной иммунной реакции слизистой. Подверженные биодеградации капсулы являются оптимальными носителями для такой направленной вакцинации.
Пример 1. Микрокапсулы из полистирола
Включение микрокапсул в лимфоретикулярную ткань пищеварительной системы и его ограничение размерами микрокапсул изучали в экспериментах по пероральному введению мышам полистироловых капсул, содержащих флюоресцирующий краситель кумарин. Мышам линии BALB/C натощак и без анестезии вводили 0,5 мл суспензии, содержащей 100 мг/мл флюоресцирующих микрокапсул разного размера (от менее 5 до 8-50 мкм в диаметре). Суспензию готовили на водопроводной воде и вводили в желудок с помощью зонда. В разные сроки после введения (0,5; 1 и 2 часа) мышей забивали и извлекали тонкий кишечник. Отрезки кишки длиной 1 см с изолированными пейеровыми бляшками отмывали от содержимого, выворачивали внутренней стороной наружу и быстро замораживали. Замороженные отрезки исследовали под флюоресцентным микроскопом, определяя число, локализацию и размеры микрокапсул, включающихся в пейеровы бляшки из просвета кишечника.
Отдельные микрокапсулы после промывки оставались между ворсинками, однако их включение в иные ткани, кроме пейеровых бляшек отсутствовало. Через 30 мин после перорального введения микрокапсулы обнаруживали в пейеровых бляшках проксимального, но не дистального отделов тонкого кишечника. С течением времени они переносились благодаря перистальтическим сокращениям в другие отделы пищеварительной системы и спустя 2 часа их обнаруживали на всем протяжении желудочно-кишечного тракта, включая пейеровы бляшки подвздошной кишки. Подвергавшиеся эндоцитозу микрокапсулы характеризовались преимущественно периферической локализацией, на удаленных от апикальной части участках бляшек, в связи с чем складывается впечатление, что физический захват микрокапсул между телом бляшки и прилегающими ворсинками при перистальтике способствует их включению. Сопоставление эффективности включения микрокапсул размером менее 5 мкм по сравнению с более крупными капсулами (8-50 мкм) свидетельствует о том, что пейеровы бляшки быстро и избирательно включают микрокапсулы размером 1-10 мкм, тогда как включение микрокапсул диаметром более 10 мкм отсутствует. Это позволяет считать микрокапсулы, изготовленные из подвергающегося биодеградации материала, эффективным средством направленного переноса антигенов в лимфоретикулярную ткань с целью индукции иммунной реакции на поверхности слизистой.
Пример 2. Микрокапсулы из поли(DL-лактид-когликолида) в соотношении 85:15
1. Включение биологически совместимых и подверженных биодеградации микрокапсул в пейеровы бляшки
Разным группам мышей через желудочный зонд вводили суспендированные в воде микрокапсулы из подверженного биодеградации материала, содержащие флюоресцирующий краситель кумарин-6. Материалом микрокапсул служил поли(DL-лактид-когликолид) в соотношении 85:15, обладающий способностью противостоять биодеградации на протяжении 6 недель. Спустя 1-35 дней после введения отбирали три репрезентативные пейеровы бляшки, пробы ткани крупных брыжеечных лимфатических узлов и селезенки и после соответствующей обработки готовили замороженные срезы.
При исследовании под флюоресцентным микроскопом с использованием необходимых фильтров и источников возбуждения по локализации темно-зеленого флюоресцирующего красителя определяли распределение микрокапсул диаметром значительно меньше 1 мкм. С целью выявления общего количества микрокапсул в отдельных органах или тканях микроскопированию подвергали все имеющиеся срезы. С помощью окулярного калибровочного микрометра определяли размер каждой микрокапсулы и регистрировали ее локализацию в органе или ткани.
Включение микрокапсул, независимо от размера, отмечали уже через 24 часа после введения; они сохранялись в пейеровых бляшках во все сроки 35-дневного периода наблюдений (таблица 1). Не отмечено ни одного случая проникновения микрокапсул в кишечную ткань за пределами пейеровых бляшек. Общее число микрокапсул в этих образованиях увеличивалось в течение первых 4 дней после введения и уменьшалось на протяжении последующих 31 дня до 15% максимальной величины.
Это наблюдение согласуется с данными о том, что свободные микрокапсулы присутствуют на поверхности кишечных ворсинок в 1, 2 и 4-й день после введения. Интересно, что примерно через 10 часов после перорального введения микрокапсул в форме суспензии содержавший кумарин материал обнаруживался в экскрементах. Эти наблюдения проводились с использованием источника ультрафиолетового излучения, и уже через сутки основная часть флюоресцирующего материала выводилась из кишечника. Таким образом, непрерывное включение микрокапсул в пейеровы бляшки в течение 2-4 дней после введения может объясняться захватом небольшого их количества слизистой кишечной стенки в промежутках между ворсинками. Кроме того, интенсивность включения захваченных микрокапсул, по-видимому, на несколько порядков выше, чем микрокапсул, присутствующих в просвете кишечника над поверхностью слизистой. Это наблюдение имеет важное значение с медицинской точки зрения, поскольку масса лимфатической ткани пейеровых бляшек у человека по сравнению с мышами неизмеримо больше, а продолжительность прохождения микрокапсул через тонкий кишечник человека дольше, что может значительно повышать эффективность их включения в пейеровы бляшки.
Во все сроки наблюдений, как показано в таблице 1, в пейеровых бляшках присутствовали микрокапсулы любого размера. Через 1, 2 и 4 дня после их введения относительная доля микрокапсул диаметром менее 2 мкм (45-47%), от 2 до 5 мкм (31-35%) и более 5 мкм (18-23%) оставалась довольно постоянной. Спустя 7 дней и особенно в более поздние сроки характер распределения микрокапсул разного размера изменялся, и число наиболее крупных из них (более 5 мкм в диаметре) начинало преобладать над числом более мелких (менее 2 мкм и от 2 до 5 мкм). Этот сдвиг совпадал по времени со снижением общего числа микрокапсул в пейеровых бляшках, начинавшимся с 7 дня. Эти наблюдения свидетельствуют об избирательной миграции микрокапсул малого и среднего размера из пейеровых бляшек и задержке в них преимущественно крупных микрокапсул.
Эти данные подтверждаются наблюдениями за локализацией микрокапсул в морфологических структурах пейеровых бляшек. Они, как правило, обнаруживались в эпителии непосредственно в местах проникновения в бляшки (в пределах 200 мкм от них) или в глубине лимфоидной ткани, на расстоянии 200 мкм и более от ближайшего слоя эпителия (таблица 1). Микрокапсулы, характеризовавшиеся последним типом локализации, были обычно представлены мелко- и среднеразмерными формами. В первый день после введения 92% микрокапсул локализовались в эпителии вблизи куполообразной поверхности бляшек. Относительное число микрокапсул, проникавших на более значительную глубину, возрастало до 24% их общего количества на 4-й день, после чего постепенно уменьшалось до 2% на 14-й и последующие дни. Таким образом, мелкие и среднего размера микрокапсулы мигрируют через пейеровы бляшки и выводятся из них, тогда как крупные, диаметром более 5 мкм, на протяжении длительного времени остаются в пределах купола.
2. Миграция микрокапсул в брыжеечные лимфатические узлы и селезенку
Небольшое количество микрокапсул обнаруживали в лимфатических узлах брыжейки в день введения, после чего их количество прогрессивно возрастало вплоть до 7 дня (таблица 2). Затем оно уменьшалось, однако часть микрокапсул сохранялась в этих узлах на протяжении, по крайней мере, 35 дней. Анализ распределения микрокапсул по размерам выявил относительно более высокое содержание мелких микрокапсул (менее 2 мкм в диаметре) по сравнению с микрокапсулами среднего размера (2-5 мкм) в лимфатических узлах в ранние сроки после введения и отсутствие в них крупных микрокапсул диаметром более 5 мкм, что свидетельствует о более интенсивной миграции в них мелкоразмерных частиц. Кроме того, в первое время после введения большинства микрокапсул локализовалось непосредственно под оболочкой узла или в его подкапсульном синусе. Позднее микрокапсулы перемещались в более глубокие структуры узла и к 14 дню 90% всех микрокапсул локализовалось в пределах коркового слоя медуллярного вещества. Первоначальная локализация микрокапсул в субкапсульном синусе или вблизи его свидетельствует о том, что они проникают в узлы через лимфатические сосуды, дренирующие пейеровы бляшки. Прогрессивное увеличение количества мелких микрокапсул в глубине лимфатических узлов к 4 дню после их перорального введения и постепенное снижение их общего количества на протяжении последующих 14 дней и в более поздние сроки свидетельствует о том, что микрокапсулы мигрируют через узловую ткань и выводятся из нее через эфферентные лимфатические протоки.
Аналогичные исследования в селезенке выявили отсутствие в ней микрокапсул до 4 дня после введения. Максимальное количество их регистрировалось не ранее 14 дня. Как и в случае брыжеечных лимфатических узлов, в селезенке отсутствовали микрокапсулы размером более 5 мкм. Во все сроки наблюдений микрокапсулы локализовались в глубине коркового слоя ткани. Следует отметить, что максимальное число микрокапсул в селезенке обнаруживали во время, когда их содержание в брыжеечных лимфатических узлах уменьшалось, а сохранявшиеся в них микрокапсулы локализовались в самых глубинных частях узлов. Это наблюдение согласуется с известной последовательностью перемещения лимфы из пейеровых бляшек в брыжеечные лимфатические узлы, а оттуда - в кровяное русло, через грудной проток. Таким образом, прежде чем поступить в селезенку микрокапсулы проходят через пейеровы бляшки и лимфатические узлы брыжейки, а затем переносятся кровью.
В дополнительных экспериментах с помощью гистохимических и иммуногистохимических методов исследовали срезы пейеровых бляшек, брыжеечных лимфатических узлов и селезенки, содержавшие абсорбированные микрокапсулы из полилактида-когликолида в соотношений 85:15. Помимо прочего, в этих исследованиях установлено, что абсорбированные пейеровыми бляшками микрокапсулы локализуются внутри макрофагоподобных клеток, в которых с помощью окраски реактивом Шиффа с периодной кислотой (ПКШ) выявляли углеводы, преимущественно гликоген, и антигены класса II главного комплекса гистосовместимости (ГКГ). Кроме того, присутствующие в брыжеечных лимфатических узлах и селезенке микрокапсулы обычно переносятся туда в указанных ПКШ и ГКГ положительных клетках. Таким образом, микрокапсулы, содержащие антиген, включают в антиген-трансформирующие придаточные клетки (АТПК) пейеровых бляшек и разносятся ими в другие лимфатические ткани.
Приведенные данные показывают, что характер иммунной реакции, индуцируемой посредством перорального введения заключенной в микрокапсулы вакцины, можно регулировать подбором микрокапсул определенного размера. Микрокапсулы размером менее 5 мкм выводятся из пейеровых бляшек в составе АТПК и высвобождают антиген в лимфатическую ткань, служащую местом индукции системной иммунной реакции. В противоположность этому, микрокапсулы диаметром 5-10 мкм задерживаются в пейеровых бляшках и в АТПК на протяжении длительного времени и высвобождают антиген непосредственно в бляшках, индуцируя продукцию sIgA антител.
Пример 3. Сопоставление включения в пейеровы бляшки микрокапсул из 10 различных материалов
С целью выявления индифферентных материалов, наиболее пригодных для создания систем контролируемой доставки биологически активных соединений к тканям - мишеням, проводили эксперименты с микрокапсулами из разных материалов, одновременно оценивая физико-химические свойства последних, обеспечивающие направленную абсорбцию микрокапсул ассоциированной со слизистой лимфатической тканью. Что касается последней задачи, то предыдущие исследования показали более интенсивный фагозитоз гидрофобных частиц клетками ретикулоэндотелиальной системы по сравнению с гидрофильными. В связи с этим была изучена абсорбция пейеровыми бляшками микрокапсул размером от 1 до 10 мкм, изготовленных из 10 различных полимерных материалов, отличающихся разной степенью гидрофобности. В их число входили: полистирол, поли(L-лактид), поли(DL-лактид), 50:50 поли(DL-лактид-когликолид), 85:15 поли(DL-лактид-когликолид), поли(оксимасляная кислота), поли(метил-метакрилат), этилцеллюлоза, ацетилцеллюлоза - фталат водорода и триацетилцеллюлоза. Установлена абсорбция микрокапсул из 7 использованных материалов и их преимущественная локализация в теле пейеровых бляшек спустя 48 часов после введения в форме суспензии, содержащей 20 мг микрокапсул, перорально (таблица 3). Случаи проникновения микрокапсул в кишечную стенку за пределами пейеровых бляшек не зарегистрированы. За единственным исключением (этилцеллюлоза), эффективность абсорбции коррелировала с относительной гидрофобностью индифферентного материала капсул. При введении наиболее гидрофобных материалов: полистирола, полиметил метакрилата и полиоксимасляной кислоты, в трех репрезентативных пейеровых бляшках мышей насчитывалось до 1500 микрокапсул. При использовании капсул из менее гидрофобных материалов: поли(L-лактида), поли(DL-лактида), 85:15 поли(DL-лактид-когликолида) или 50:50 поли(DL-лактид-когликолида), их количество в аналогичных пробах составляло 200-1000 штук. Целлюлозные микрокапсулы не абсорбировались.
Установлено, что зависимость избирательной абсорбции микрокапсул от физико-химических свойств составляющего их материала опосредуется через поверхностные процессы на границе раздела между пейеровыми бляшками и полостью кишечника. Поэтому изменение поверхностных характеристик микрокапсул посредством химической модификации полимера или свойств оболочки модно использовать в качестве средства регуляции эффективности захвата микрокапсул и доставки биологически активных соединений в ассоциированные со слизистой лимфатические ткани или АТПК. В качестве неограничивающих примеров материалов для таких оболочек можно привести химические реактивы, полимеры, антитела, биоадгезивные соединения, белки, пептиды, углеводы, пектины и подобные им материалы как природного, так и искусственного происхождения.
III. Продукция антител, индуцируемая вакцинами в составе микрокапсул
Материалы и методы:
Мыши: мыши линии BALB/C в возрасте от 8 до 12 недель (во всех экспериментах).
Тринитрофенил гемоцианин: Гемоцианин, получаемый из морского блюдечка (Megathura crenulate), производства компании Calbiochem (Сан Диего, США), коньюгировали с нитрофенильным гаптеном (ТНФ-ГМЦ) с использованием 2,4,6-тринитробензол-сульфоновой кислоты, как описано Rittenburg и Amkraut (Immunogenecity of trinitrophenyl-hemocyanin: Production of primary and secondary anti-hapten precipitins / Иммуногенные свойства тринитрофенил-гемоцианина: Получение первичных и вторичных антигаптеновых преципитинов / J. Inununol., 97, 421, 1966). Степень замещения по данным спектрофотометрического определения равнялось ТНФ861 - ГМЦ (при коэффициенте молярной экстинкции 15400 и длине волны 350 нм с 30%-ной поправкой на поглощение ГМЦ в этих условиях).
Вакцина со стафилококковым энтеротоксином В:
Формалиновую вакцину стафилококкового энтеротоксина В (СЭВ) готовили по методу Warren J.R., Spero L., & Metzger J.F. (Anfcigenicity of formalin-inactivated staphylococcal enterotoxin В / Антигенные свойства инактивированного формалином стафилококкового энтеротоксина В / J. Immunol., 111, 885, 1973). Вкратце, 1 г энтеротоксина разводили в 0,1 м натрий - фосфатном буфере рН 7,5 до конечной концентрации 2 мг/мл. В полученный раствор добавляли формалин до получения молярного соотношения формалин:энтеротоксин 4300:1. Раствор помещали в инкубатор при 37°C и медленном встряхивании, поддерживая величину рН на уровне 7,5+0,1 ежедневно. Спустя 30 дней токсин концентрировали, отмывали боратным буфером (ББ) в фильтрационной камере (Амикон) под давлением и стерилизовали методом фильтрации. Превращение энтеротоксина в энтеротоксоид подтверждали по отсутствию снижения веса кроликов с массой тела 3,0-3,5 кг после внутримышечного введения им 1 мг токсоидного материала.
Иммунизация: Антиген в микрокапсулах и без них суспендировали при определенной концентрации в растворе, состоявшем из 8 частей стерилизованной ультрафильтрацией водопроводной воды и 2 частей 7,5%-ного раствора бикарбоната натрия. 0,5 мл суспензии с помощью желудочного зонда вводили мышам - реципиентам натощак, как описано Babb J.L., Kiyono Н., Michalek S.M., & Me Ghee J.R. (LPS regulation of the immune responce: Suppression of immune response to orally-administered T-dependent antigen/Регуляция ЛФР иммунной реакции: Подавление иммунной реакции на пероральное введение Т-зависимого антигена /, J. Immunol 127, 1052, 1981).
Получение биологических жидкостей:
1. Плазма крови: Кровь отбирали калиброванными капиллярными пипетками после прокола ретро-орбитального сплетения. После образования сгустка сыворотку центрифугировали для отделения от эритроцитов и тромбоцитов, подвергали тепловой инактивации и хранили до проведения анализа при -70°C.
2. Кишечная жидкость: Мышам 4-кратно вводили по 0,5 мл промывной жидкости (25 mM NaCl, 40 тМ Nа2SO4, 10 тМ КСl & 20 тМ NаНСО3, а также 48,5 мМ полиэтиленгликоля при осмотическом давлении 530 мОсм) с 15-минутными интервалами (см. Elson С.О., Ealding W. & Lefkowitz J. A lavage technique allowing repeated measurement of IgA antibody on mouse intestinal secretions /Метод промывки, обеспечивающий повторные определения IgA антител в кишечной жидкости мышей/, J. Immunol. Meth. 67: 101; 1984). Через 15 мин после последней промывки мышей анестезировали и спустя еще 15 мин внутрибрюшинно вводили им 0,1 мг пилокарпина. На протяжении последующих 10-20 мин стимулировали дефекацию. Выделения собирали в чашку Петри, содержавшую 3 мл раствора 0,1 кг/мл соевого ингибитора трипсина (Sigma, St. Louis, МО) в 50 мМ ЭДТА, энергично перемешивали и центрифугировали для удаления суспендированного материала. Надосадочную жидкость переносили в центрифужную пробирку из поликарбоната с округлым дном и добавляли в нее 30 мкл 20 мМ раствора фтористого фенилметилсульфонила (ФФМС, Sigma). Полученную смесь осветляли центрифугированием при 27000 × g в течение 20 мин, при 4°C. После этого добавляли по 20 мкл ФФМС и 1% азида натрия и разбавляли полученный раствор FCS до конечной концентрации 10% для получения альтернативного субстрата для остающихся протеаз.
3. Слюна: Одновременно с опорожнением кишечника происходило интенсивное слюноотделение. Пастеровской пипеткой отбирали 0,25 мл слюны и добавляли к ней по 20 мкл ингибитора трипсина, ФФМС, азида натрия и FCS, после чего осветляли.
4. Смывы из бронхов и альвеол: Промывную жидкость из бронхов и альвеол получали после орошения легких 1,0 мл фосфатного буферного раствора. Для введения последнего в трахею вставляли зонд, который фиксировали шовным материалом. Затем пятикратно промывали трахею и остальные дыхательные пути буферным раствором, в полученные смывы добавляли по 20 мкл ингибитора трипсина, ФФМС, азида натрия и FCS и полученную смесь осветляли с помощью центрифугирования.
5. Реактивы для иммунохимических исследований:
Специфические для мышиных IgM, IgG и IgA козьи антитела (поликлональные), адсорбированные на твердой фазе и очищенные методом аффинной хроматографии, получали из коммерческого источника (Southern Biotechnology Associates, Birmingham). Их специфичность при использовании для радиоиммунологических определений оценивали по связыванию с соответствующими очищенными моноклональными антителами и белками миеломы.
6. Радиоиммунологические определения на твердой фазе:
Очищенные антитела метили свободным от носителя йодом-125 (Amersham) с помощью Т-хлораминового метода (Hunter W.W. Radioimmunoassay / Радиоиммунологический метод /, в: Handbook of Experimental Immunology, M. Weir (editor), Blackwell Scientific Publishing, Oxford p.14.1, 1978). Индикаторные полоски (Immulon Removawell, Dynatech) докрывали конъюгатом ТНФ с бычьим сывороточным альбумином (БСА) или стафилококковым энтеротоксином В в концентрации 1 мкг/мл ББ при 4°C. Контрольные полоски оставляли непокрытыми. Все полоски в течение 2 часов выдерживали в 1%-ном растворе БСА и ББ при комнатной температуре. ББ использовали в качестве растворителя для приготовления всех проб и меченных йодом-125 реактивов. Пробы биологических жидкостей соответствующим образом разбавляли, помещали в промытые ячейки (в трех повторностях) и инкубировали в течение 6 часов при комнатной температуре. После промывания в каждую ячейку добавляли по 1000000 имп/мин меченного I125 специфического иммуноглобулина и инкубировали в течение ночи при 4°C. Несвязанные меченные I125 антитела вымывали, а оставшийся в ячейках радиоактивный материал подсчитывали на 5500-гамма-спектрометре (Beckman Instruments, San Ramon, CA). При определении ТНФ-специфичных антител калибровку производили посредством серийных двукратных разведений стандартной сыворотки (Miles Scientific, Naperviile, IL), содержавшей известное количество иммуноглобулинов, в ячейках, покрытых мечеными специфическими антителами (1 мкг/ячейка). Для построения калибровочной кривой и интерполяции неизвестных параметров использовали данные компьютеризованного статистического анализа по типу “Logit-Log” или “Four Parameter Logistic” (Basic Technology Center, Vanderbilt Medical Center, Nashville, TN). В случае специфических антител к стафилококковому энтеротоксину В, результаты выражали через степень разведения сывороток, при которой уровень сигнала был более чем в 3 раза выше, чем при соответствующем разведении контрольных сывороток от сопоставимой группы животных (по конечным результатам тестирования).
А. Инъекции микрокапсул с вакциной
1. Повышение иммуногенной активности микрокапсулами
Пример 1. Иммуногенная активность вакцины при ее внутрибрюшинном введении в микрокапсулах
Проведенные в нашей лаборатории исследования доказали, что введение антител или вакцины в составе микрокапсул значительно усиливает иммунную реакцию в разнообразных экспериментальных системах. В качестве примера можно привести результаты непосредственного сравнения титров и изотипического распределения антител к стафилококковому энтеротоксину В - возбудителю стафилококкового пищевого отравления, после иммунизации энтеротоксоидом в форме раствора или в составе микрокапсул. Мышам, разделенным на несколько групп, вводили различные дозы токсоидной вакцины, заключенной в микрокапсулы из полилактид-когликолида (в соотношении 50:50), или в форме раствора. В обоих случаях введение производили посредством внутрибрюшинных инъекций. Через 10 и 20 дней после иммунизации получали пробы плазмы крови и по результатам титрования специфическим для изотипа иммунорадиометрическим методом определяли титры антитоксиновых антител (таблица 4). Оптимальная доза растворенного токсоида (25 мкг) вызывали значительно более слабую иммунную реакцию, которая проявлялась только в продукции IgM антител. В противоположность этому, введение 25 мкг токсоида в составе микрокапсул индуцировало образование не только IgM, но и IgG антител, которые обнаруживались при разведениях плазмы до 1/2560 на 20 день после иммунизации. Кроме того, применение микрокапсул позволяло увеличивать вводимые дозы токсоида, не снижая интенсивности иммунной реакции, как это наблюдалось при увеличении дозы растворенного материала до 50 мкг. По данным измерения освобождения активного ингредиента из микрокапсул, их применение давало возможность в 4-5 раз повысить вводимую дозу без потери чувствительности ткани в зоне действия токсина, что значительно повышало степень иммунизации. Иммунопотенциирующая активность микрокапсул выражена еще сильнее после вторичной и третичной иммунизации (таблица 6).
Титры антитоксиновых IgG антител на 20 день после иммунизации были в 512 раз выше при введении 50 мкг токсоида в составе микрокапсул, чем при введении оптимальной иммунизирующей дозы растворенного материала. Более того, для получения таких же титров антител, как после однократной иммунизации 100 мкг энтеротоксоида в составе микрокапсул, требовалось трехкратное введение оптимальной дозы токсоида в форма раствора. Сходное потенциирующее действие было обнаружено и при иммунизации такими широко распространенными в лабораторной практике белковыми антигенами, как гемоцианин морского блюдечка или противогриппозная вакцина.
Пример 2. Иммуногенная активность вакцины при ее подкожном введении в микрокапсулах
Предлагаемая система иммунизации эффективна также при внутримышечном и подкожном введении вакцины. Проведено сравнительное исследование внутрибрюшинного и подкожного способов введения микрокапсул мышам с целью оценки интенсивности иммунной реакции и ее динамики. Результаты представлены в таблице 7.
Подкожные инъекции 100 мкг энтеротоксоида в составе микросфер в 4 точках на спине мышей вызывали образование IgG антитоксиновых антител в таких же титрах, как после внутрибрюшинного введения, хотя и в несколько более поздние сроки. Тем не менее, эти результаты свидетельствуют о возможности введения микрокапсул с вакцинами не только внутрибрюшинно, но и другими способами. Результаты вторичной иммунизации внутрибрюшинными и подкожными инъекциями также существенно не отличались в отношении максимальных титров антител, хотя реакция на подкожное введение развивалась несколько позднее, чем на внутрибрюшинное (таблица 8).
2. Механизм иммунопотенциирующего действия микрокапсул
Пример 1. Повышение иммуногенной активности микрокалсулами не связано с собственной потенциирующей активностью полимерного материала
Существуют три возможных механизма, посредством которых микрокапсулы из лактид-когликолида размером 1-10 мкм потенциируют иммунную реакцию на содержащийся в них антиген. Первый из них состоит в увеличении продолжительности освобождения антигена по сравнению с наблюдающейся при непосредственном введении последнего в организм. Во-вторых, экспериментально показано, что микросферы указанного размера быстро подвергаются фагоцитозу клетками, переваривающими антиген. Поэтому направленный перенос относительно больших количеств интактного антигена непосредственно на клетки, обусловливающие иммунную реакцию на зависимые от Т-клеток антигены, может служит второй причиной потенциирующего действия микрокапсул. Третья причина может состоять в собственной иммуногенной активности микрокапсул и их способности активировать клетки иммунной системы посредством такого же механизма, которым аналогичная активация осуществляется такими адьювантами, как бактериальные липополисахариды или мурамил-дипептид. Последний механизм характеризуется тем, что его проявление возможно при одновременном введении антигена адьюванта.
С целью проверки наличия у микрокапсул собственной иммуногенной активности, опосредуемой через способность их индуцировать неспецифическую активацию иммунной системы, было проведено сопоставление действия энтеротоксоида, содержащегося в капсулах в дозе 100 мкг, и равного количества энтеротоксоида, смешанного с не содержащими антиген микрокапсулами (плацебо). Разные формы антигенов вводили внутрибрюшинно мышам линии BALB/c, разделенным на группы по 10 особей, специфические IgM и IgG антитела к энтеротоксину определяли по результатам конечного титрования при радиоиммунологическом определении (таблица 9).
Иммунная реакция на введение оптимальной дозы энтеротоксоида в форме раствора (25 мкг) была значительно слабее. Максимальные титры антител IgM и IgG соответственно на 10 и 20 дни после введения антигена составляли 1:800. При введении равной дозы антигена в микрокапсулах наблюдали значительное увеличение титров антител обоего типа, которые продолжали нарастать, по крайней мере, до 30 дня.
Одновременное введение раствора энтеротоксоида и микрокапсул плацебо, сопоставимых по весу, размеру, составу и дозе с капсулами, содержавшими антиген, не сопровождалось образованием антител в титрах, превышавших титры антител, регистрировавшиеся после введения только растворенного антигена. Аналогичные результаты получены при введении антигена за 1 день до или через 1, 2 или 5 дней после плацебо. Таким образом, эти данные свидетельствуют о том, что иммунопотенциирующий эффект в случаях введения антигена в микрокапсулах из полилактид-гликолида размером 1-10 мкм не является следствием наличия у последних способности активировать иммунную систему. Полученные данные скорее предполагают депонирующий эффект, направленный перенос антигена на АТПК или сочетание обоих механизмов.
Пример 2. Замедление скорости освобождения антигена из микрокапсул размером 1-10 мкм усиливает образование антител и задерживает проявление максимальной иммунной реакции.
Проводили сравнение иммунной реакции после внутрибрюшинного введения 4 типов микрокапсул, отличавшихся скоростью освобождения антигена. Последняя зависела от двух факторов: скорости диффузии через поры материала стенок и интенсивности гидролиза (биоэрозии) микрокапсул. Партии 605-026-1 и 514-140-1 характеризовались разной начальной скоростью освобождения антигена через поры и наличием второй фазы освобождения, обусловленной деградацией капсульной стенки в процессе гидролиза. Напротив, в партиях 697-143-2 и 298-060-00 микрокапсулы были изготовлены из плотного однородного материала, препятствовавшего освобождению антигена через поры, в связи с чем оно было в основном функцией гидролиза стенок микрокапсул. В двух последних партиях микрокапсулы отличались соотношением лактида и гликолида. Устойчивость к гидролизу при величине этого отношения 85:15 служила причиной пониженной скорости освобождения энтеротоксоида.
Максимальную иммунную реакцию после введения микрокапсул из партии 605-026-1 (60% антигена освобождалось за 48 часов) регистрировали через 20 дней после введения, когда титры IgG антител достигали 1:6400 (таблица 10). В те же сроки максимальная реакция развивалась при использовании микрокапсул из партии 514-140-1, обеспечивавших освобождение 30% антигена в течение 48 часов. Однако в этом случае высокая концентрация IgG антител сохранялась и на 30-й день.
Иммунизация антигеном в микрокапсулах из партии 697-143-2, обеспечивавших освобождение 10% активного ингредиента в течение 48 часов, сопровождалась максимальным увеличением титров IgG антител до 1:102400 на 30 и 45 дни после вакцинации, что значительно выше, чем увеличение при использовании вариантов микрокапсул, обеспечивавших более раннее освобождение антигена. Дальнейшее снижение скорости освобождения в микрокапсулах из полилактид-гликолида с соотношением компонентов 85:15 (партия 928-060-00, освобождение антигена не ранее чем через 48 часов после вакцинации) задерживало пик продукции антител до 45-60 дня, однако дальнейшего усиления иммунной реакции при этом не происходило.
Полученные результаты показывают, что замедление или задержка освобождения антигена усиливают иммунную реакцию. В то же время некоторые особенности этой реакции при использовании различных типов микрокапсул свидетельствуют о том, что депонирующий эффект не является единственным механизмом иммунопотенциирующего действия. Чем выше начальная скорость освобождения антигена, тем ниже максимальные титры антител. Это согласуется с моделью, согласно которой антиген, освобождающийся через поры в течение первых 48 часов, по эффективности действия на иммунную систему не превосходит антиген, введенный в форме раствора. Значительно отложенное начало освобождения используется макрофагами для фагоцитоза микрокапсул, эффективного преобразования антигена и развития реакции на него, а степень последней определяется количеством антигена, поступающим на чувствительные клетки. Однако задержка освобождения позднее определенного срока, когда все количество антигена должно поступить в соответствующие клетки, не сопровождается дальнейшей активацией иммунной реакции, а вызывает лишь задержку наступления пика антител.
2. Пульсирующее освобождение вакцины из микрокапсул для программируемой иммунизации после однократного введения
При иммунизации любой вакциной для получения хороших результатов требуется ее введение в двух, трех или более повторностях. Обычно первая инъекция производится с целью получения первичной реакции, вторая - для индукции вторичной реакции, а третья - для получения третичной реакции. Необходимость множественных инъекций обусловлена тем, что для стимуляции мощного ответа со стороны иммунной системы необходимы повторные взаимодействия антигена с соответствующими клетками. Поэтому после первой вакцинации пациент еще несколько раз должен обращаться к врачу для получения второй, третьей и последующих инъекций вакцины и обеспечения надежной иммунной защиты организма. На практике же, пациенты зачастую не посещают врача для повторных вакцинаций.
Предназначенные для инъекций вакцины обычно включают антиген и адьювант. Антиген, например, может быть ассоциирован с квасцами. Комбинация антигена с адьювантом при первой вакцинации имеет важнее значение с той точки зрения, что последний усиливает иммунную реакцию. При второй и третьей вакцинации антиген сам стимулирует иммунную систему, поэтому при повторной иммунизации введения адьюванта не столь необходимо, как при первой.
Корпорация Альза предложила методику вакцинации, обеспечивающую непрерывное освобождение антигена и иммунопотенциирующего средства (адьюванта) для стимуляции иммунной реакции (патент США №4455142). Настоящее изобретение отличается от запатентованного, по крайней мере, двумя важными аспектами. Во-первых, оно не требует использования иммунопотенциирующего средства для стимуляции иммунной реакции и, во-вторых, не предусматривает непрерывного освобождения антигена из системы его доставки к тканям-мишеням.
Изобретение относится к лекарственной форме вакцины (антигена) в виде микрокапсул или микросфер, представляющих собой структуру из поддающегося биодеградации полимерного материала (например, полилактид-когликолида) с заключенным в нем активным веществом. В более частном случае, получают разные микрокапсулы и смешивают их таким образом, чтобы посредством однократной инъекции вакцины обеспечить улучшенную первичную реакцию, а затем пульсирующее освобождение антигена для получения вторичной, третичной и последующих реакций.
Смесь микрокапсул состоит из частиц крупного и мелкого размеров. Мелкие микрокапсулы, диаметром менее 10 мкм, предпочтительно менее 5 мкм, а в оптимальном случае от 1 до 5 мкм, стимулируют первичную реакцию иммунной системы (без применения адьюванта), благодаря тому, что они легко узнаются и включаются макрофагами. После поглощения этими клетками микрокапсулы высвобождают антиген, который подвергается трансформации в ходе внутриклеточных процессов и поступает на поверхность макрофагов, обеспечивая проявление первичной реакции. Микрокапсулы большего размера (более 5 мкм, предпочтительно более 10 мкм в диаметре), но не настолько крупные, чтобы не поддаваться введению посредством инъекций (желательно не более 250 мкм в диаметре, изготавливают из различных полимерных материалов таким образом, чтобы они высвобождали антиген в форме отдельных порций в процессе биодеградации с разной скоростью.
Согласно данному изобретению состав микрокапсул, содержащих антиген для индукции первичной реакции иммунной системы, существенно не отличается от состава микрокапсул для стимуляции вторичной, третичной и последующих реакций. Во всех случаях для их изготовления используют один и тот же класс поддающихся биодеградации полимеров. Максимальная реакция на антиген в составе таких микрокапсул достигается благодаря подбору их размеров и пульсирующему характеру высвобождения антигена.
Предпочтительно использовать полимерные материалы, скорость биодеградации которых можно контролировать простым изменением соотношения мономерных компонентов, например полилактид-когликолида, с тем, чтобы микрокапсулы, используемые для индукции вторичной реакции, быстрее подвергались биологическому разложению, чем микрокапсулы, используемые для индукции последующих реакций. Таким образом обеспечивается пульсирующее освобождение антигена.
Таким образом, изменяя размеры микрокапсул практически одинакового состава, можно оптимизировать действие антигена на иммунную систему. Не менее важным аспектом изобретения является использование мелких микрокапсул (менее 10 мкм в диаметре, предпочтительно менее 5 мкм и особенно от 1 до 5 мкм). Применение системы доставки антигена, потенциирующей иммунной систему, в форме микрокапсул малого размера приобретает особенно важное значение при необходимости вызвать иммунную реакцию на относительно слабые иммуногенные агенты, такие как убитые вакцины, вакцины, содержащие низкомолекулярные белки или их субединицы, и т.п. соединения.
Пример 1. Сочетанное введение свободной вакцины и вакцины в составе микрокапсул
Исследовали вакцину против вируса японского энцефалита (Biken). Вирус был получен из Research Foundation for Microbial Disease (Университет Осаки, Суита, Осака, Япония). Согласно рекомендации изготовителям иммунизация должна производиться трехкратно: сначала двумя дозами с интервалом 1-2 недели, а затем (спустя месяц) третьей дозой. Мы провели сравнение результатов иммунизации мышей согласно рекомендуемому протоколу и путем однократного введения этим животным вакцины к вирусу японского энцефалита, одна часть которой состояла из стандартного материала, а две другие представляли собой антиген в составе микрокапсул размером более 10 мкм. Результаты иммунизации обоими методами сравнивали посредством определения титров сывороточных антител против японского энцефалита, выявляемых иммуноферментативным анализом. Методика последнего позволяла индентифицировать присутствовавшие в сыворотках специфические антитела к отдельным компонентам вакцины против японского энцефалита, но не обеспечивала определение в тех же пробах вирус - нейтрализующих антител. Титры последних определяли, используя методику ингибирования цитопатического эффекта вируса (ЦЭВ) и методику ингибирования бляшкообразования. Ниже приведены результаты этих анализов.
Эксперимент проводили на 4 группах мышей: (1) контрольные животные, не получавшие вакцину, (2) мыши, которым в день 0 вводили обычную (без капсул) вакцину к Японскому энцефалиту в дозе 3,0 мг, (3) мыши, которым в день 0 вводили противоэнцефалитную вакцину, а затем повторяли инъекции на 14 и 42 дни (стандартный протокол) и (4) мыши, которым в день 0 вводили 3,0 мг обычной вакцины и такое же количество препарата в форме микрокапсул. Контрольные животные использовались для определения базальных уровней противовирусных нейтрализующих антител, с которыми сравнивали титры антител экспериментальных мышей. В свою очередь группа последних, получавшая 3,0 мг обычной вакцины в день 0, служила для сопоставления с группой животных, получавших комбинированные инъекции обычной или микрокапсульной вакцины. Полученные результаты показывают, что введение вакцины в составе микрокапсул значительно усиливает реакцию иммунной системы на свободную вакцину, однократно вводившуюся в дозе 3,0 мг. Животные, получавшие трехкратные инъекции свободной вакцины, служили контролем для сравнения с мышами, получавшими микрокапсулы, с целью выяснения сопоставимости иммуногенной активности комбинированной вакцинации свободной и микрокапсулированной вакциной при однократном введении и активности противовирусной вакцины при ее трехкратном введении согласно стандартному протоколу.
У 10 животных каждой экспериментальной группы на 21, 49 и 77 дни брали пробы крови и тестировали сыворотки по ингибированию цитопатического эффекта стандартной дозы (100 TCID50) вируса японского энцефалита. В таблице 11 представлены результаты оценки ингибирующей активности, выраженные в показателях максимального разведения сывороток, при котором они на 50% ингибировали ЦЭВ. Как видно из таблицы, у контрольных животных не отмечено существенной вирус - нейтрализующей активности сывороток, независимо от сроков определения (группа 1). У 1 из 10 животных, получавших однократную инъекцию 3,0 мг противовирусной вакцины в день 0 (группа 2), нейтрализующие антитела также отсутствовали. Максимальный титр антител у 9 остальных животных достигал 1:254 на 49 день после вакцинации. Средняя геометрическая титров противовирусных антител в этой экспериментальной группе была наиболее высокой на 49 день. У 8 из 10 животных, получавших противовирусную вакцину в соответствии со стандартным протоколом (группа 3), отмечали снижение иммунной реакции между 49 и 77 днями. Средняя геометрическая титров антител у животных этой группы уменьшалась более чем на 50% между 40 и 77 днями. Антитела к вирусу японского энцефалита были обнаружены у всех 10 мышей группы 4, получавших вакцину в составе микрокапсул. Средняя геометрическая титров антител в этой группе возрастала с 21 по 77 дня после вакцинации. Средний титр антител у этих животных на 49 день был значительно ниже, чем у мышей, получавших трехкратные инъекции вакцины (группа 3) (р=0,006). Однако, в отличие от животных последней группы, титры антител у мышей группы 4 продолжали нарастать с 49 по 77 дни наблюдений. На 77 день средние титры антител у животных обеих групп существенно не отличались (р=0,75). Это показывает, что при введении вакцины в форме микрокапсул титры антивирусных антител достигали сопоставимого с контролем уровня к 77 дню после вакцинации. В противоположность животным, получавшим трехкратные инъекции вакцины (группа 3), у животных группы 4, получавших микрокапсулы, титры сывороточных противовирусных антител непрерывно увеличивались на протяжении всего периода наблюдений. Другое различие между мышами этих двух групп состояло в том, что в последнем случае (группа 4) увеличение средних титров антител между 49 и 77 днями достигало двукратной величины. Средние титры антивирусных антител на 21 день у животных, получавших вакцину в составе микрокапсул, и у мышей, получавших однократную инъекцию свободной вакцины в день 0, были примерно одинаковыми (р=0,12). Однако между 49 и 77 днями различия титров антител у животных этих групп были весьма значительны (р=0,03 и Р=0,03 соответственно). Эти результаты показывают, что титры антител к вирусу японского энцефалита, отмечаемые после иммунизации по стандартному протоколу, могут быть достигнуты однократным введением вакцины в составе микрокапсул. Хотя применявшиеся в настоящем исследовании индифферентный материал вакцины не обеспечивал столь быстрого повышения титров вирус-нейтрализующих антител, которое отмечалось при использовании стандартной вакцины, их конечная величина была сопоставима с величиной титров, достигавшейся после стандартной трехкратной вакцинации.
Для подтверждения результатов этих исследований проводили анализ объединенных сывороточных проб от каждой из 4 групп животных. Анализ проводился в другой лаборатории, куда были переданы соответствующие образцы. Оценивалась способность сывороток ингибировать образование бляшек в стандартном провоцирующем тесте с вирусом японского энцефалита. Результаты тестирования представлены в таблице 12 и подтверждают приведенные выше данные. Хотя титры антивирусных антител у животных, получавших вакцину в микрокапсулах, достигали максимальной величины не так быстро, как после иммунизации обычной вакциной, их конечные уровни у животных обеих групп были вполне сопоставимы. К тому же, после введения микрокапсул титры антител оставались повышенными на протяжении более длительного периода, чем после введения стандартной вакцины. Эти наблюдения служат лишним подтверждением того, что однократное введение вакцины в составе микрокапсул дает практически такие же результаты, как трехкратное введение стандартной вакцины в соответствии с обычным протоколом.
Пример 2. Сочетанное введение вакцины в микрокапсулах размером более 10 и менее 10 микрометров
Одно из преимуществ использования полимерных микрокапсул для введения вакцины состоит в возможности контролировать время и/или скорость освобождения антигена. Режим высвобождения можно подобрать таким образом, чтобы вызвать максимальную продукцию антител в ответ на однократную иммунизацию. Один из режимов, улучшающих иммунную реакцию на вакцинацию, - пульсирующее высвобождение антигена, обеспечивающее такое же его действие, как при обычной иммунизацией живой вакциной.
Возможность использования такого режима изучалась при подкожном введении 100 мкг энтеротоксоида мышам нескольких групп в составе микрокапсул размером 1-10 мкм (соотношение компонентов в полилактид-когликолиде 50:50, содержащие энтеротоксоида 1,51 весовых процента), микрокапсул размером 20-125 мкм (соотношение компонентов в полилактид-когликолиде 50:50, содержание энтеротоксоида 0,64 весовых процента) или смеси микрокапсул размером 1-10 и 20-125 мкм при одинаковом содержании энтеротоксоида в каждой их разновидности. Забор крови у подопытных мышей производили с интервалами в 10 дней и посредством конечного титрования IgG антител плазмы при специфическом для изотипов радиоиммунометрическом анализе с использованием абсорбированного на твердой фазе энтеротоксина оценивали индуцированную иммунную реакцию. IgG антитела появлялись в крови на 10 день после введения энтеротоксоида в составе микрокапсул диаметром 1-10 мкм. Их титры повышались до максимальной величины 1:102400 к 30 или 40 дням и уменьшались до 1:25600 на 60 день. В противоположность этому, реакция на микрокапсулы размером 20-125 мкм развивалась не ранее 30 дня после введения. К 50-60 дням титры антител увеличивались до 1:51200. При сочетанном введении равных частей энтеротоксоида в составе микрокапсул диаметром 1-10 или 20-125 мкм иммунная реакция мышей в течение первых 30 дней была в целом такой же, как при введении одних мелких микрокапсул. Однако начиная с 40 дня реакция мышей, получавших энтеротоксоид одновременно в составе капсул размером 1-10 и 20-125 мкм, прогрессивно усиливалась, и титры вирус-нейтрализующих антител к 60 дню после инъекции возрастали до 1:819200, что значительно выше суммарного ответа на раздельное введение тех и других микрокапсул.
Иммунная реакция, наблюдавшаяся при сочетанном введении содержащих энтеротоксоид капсул размером 1-10 и 20-125 мкм, свидетельствует о двухфазном характере освобождения антигена (пульсирующем освобождении). Первая фаза является результатом быстрого поглощения и ускоренного разложения мелких микрокапсул в процессе тканевого гистоцитоза, сопровождающихся усиленной первичной реакцией благодаря локализации больших количеств антигена на придаточных клетках и, по-видимому, их активации. Вторая фаза высвобождения антигена обусловлена биодеградацией микрокапсул размером 20-125 мкм, величина которых препятствует их перевариванию фагоцитами. В этой фазе антиген высвобождается в предварительно стимулированный организм и индуцирует анамнестическую иммунную реакцию. Таким образом, возможно создание системы для однократной вакцинации на основе микрокапсул из полилактид-когликолида с соотношением компонентов 50:50, которая потенциирует иммунную реакцию благодаря присутствию микрокапсул размером 1-10 мкм и обеспечивает активную вторичную иммунизацию антигеном в микрокапсулах по 20-125 мкм, контролируемую в отношении сроков и продолжительности. Кроме того, изменяя соотношение полимерных компонентов, можно получать препараты, которые обеспечивают еще более позднее высвобождение антигена и, следовательно, третичную и четвертичную иммунизацию в отсутствие дополнительных инъекций.
Подводя итоги, можно заключить, что существует большое число возможных подходов к вакцинации с использованием инъекцируемых микрокапсул согласно настоящему изобретению. Они включают, в частности, множественные инъекции мелких микрокапсул, предпочтительно 1-5 мкм в диаметре, которые поглощаются макрофагами и позволяют избежать использования иммунопотенциирующих средств. Другой подход состоит в использовании смешанных инъекций свободного антигена для индукции первичной иммунной реакции и антигена в составе микрокапсул диаметром 10 мкм или более для обеспечения пульсирующего высвобождения антигена с целью усиления вторичной и третичной реакций и достижения иммунизации однократным введением вакцины. Возможно также применение мелких микрокапсул для индукции первичной иммунной реакции на содержащийся в них антиген в сочетании с более крупными микрокапсулами для усиления вторичной и последующих реакций, что устраняет необходимость применения иммунопотенциирующих средств и множественных инъекций.
Б. Пероральное введение микрокапсул с вакцинами
Пример 1. Микрокапсулы для перорального введения, содержащие ТНФ-ГМЦ антиген, индуцируют одновременную иммунную реакцию в форме продукции сывороточных антител и антител слизистой
Микрокапсулы для гаптенового белкового антигена в форме коньюгированного с тринитрофенилом гемоцианина морского блюдечка (ТНФ-ГМЦ антигена) изготавливали из полилактид-когликолида в соотношении 50:50. Микрокапсулы сортировали по размерам, для последующей работы отбирали микрокапсулы размером 1-5 мкм, содержавшие 0,2 весовых процента антигена. Пригодность этих микрокапсул в качеств системы доставки антигена к тканям-мишеням после перорального введения оценивали посредством их скармливания экспериментальным животным в форме суспензии (10 мг/мл) в количестве 0,5 мл (10 мкг антигена). Суспензию готовили на водном (стерилизованном) бикарбонатном буферном растворе и вводили ее с помощью желудочного зонда на протяжении 4 последовательных дней. Для сравнения дополнительную группу мышей иммунизировали свободным антигеном ТНФ-ГМЦ в форме раствора, содержавшего 20 мкг/мл антигена, в дозе 0,5 мл. Контрольным мышам перорально вводили один растворитель.
На 14 и 28 дни после последнего введения антигена у 5 мышей каждой группы натощак производили забор крови, слюны и желудочное кишечного секрета. Полученные пробы анализировали с помощью изотип-специфичной радиоиммунологической методики для определения специфических для антигена ТНФ-ГМЦ и общих антител классов IgM, IgG и IgA (таблица 13). В слюне и кишечном секрете присутствовали почти исключительно IgA антитела, в соответствии с результатами предыдущих исследований. Это же служило подтверждением отсутствия загрязнения указанных биологических жидкостей материалом крови при заборе проб. Ни в одной из экспериментальных групп не зарегистрировано существенных изменений общего уровня иммуноглобулинов в исследованных биологических жидкостях. В сыворотках контрольных мышей были обнаружены специфичные к антигену антитела природного происхождения, относящиеся к изотипам IgM и IgG. Кроме того, в сыворотках и кишечной жидкости были идентифицированы IgA антитела. Во всех случаях титры антител были невысоки. В то же время введение равной дозы ТНФ-ГМЦ антигена в составе микрокапсул (30 мкг) на протяжении трех последовательных дней вызывало появление большого количества антител в кишечном секрете и антител всех изотипов в сыворотке на 14 день после иммунизации (см. последнюю колонку таблицы 13). Титры этих антител нарастали до 28 дня. В противоположность этому, пероральное введение того же количества антигена в форме раствора не индуцировало специфические антитела, независимо от их класса или подвергавшейся анализу биологической жидкости.
Полученные результаты заслуживают внимания с нескольких точек зрения. Во-первых, введение микрокапсул индуцирует образование большого количества специфических антител к антигену как в сыворотках крови, так и в кишечной жидкости (IgA) в то время, как при обычным способе системной иммунизации такая реакция отсутствует или выражена очень слабо. В связи с этим можно ожидать, что предлагаемая методика иммунизации позволит значительно усилить процессы иммуногенеза в слизистой, которая служит воротами инфекции или местом развития патологического процесса при заражении разнообразными бактериальными и вирусными возбудителями. Во-вторых, микрокапсулированные препараты антигена оказались мощными иммуногенными средствами при пероральном введении, тогда как свободные антигены не обладают таким свойством. Таким образом, использование антигена в составе микрокапсул значительно повышает его эффективность благодаря направленному введению непосредственно в ткани-мишени и усиленному включению в пейеровы бляшки. В-третьих, фаза индукции иммунного ответа характеризуется большей продолжительностью. При системной иммунизации белковыми антигенами в отсутствие адьюванта максимальные титры антител достигаются через 7-14 дней после инъекции, тогда как в составе микрокапсул те же антигены вызывают аналогичную реакцию спустя 28 дней после перорального введения, когда титры антител выше, чем на 14 день. Это свидетельствует о том, что биологическое разрушение материала капсул и освобождение антигена происходят на протяжении довольно длительного периода, индуцируя реакцию большей, чем при введении свободного антигена, продолжительности.
Пример 2. Пероральное введение микрокапсул, содержащих токсоид СЭВ, индуцируют одновременную продукцию сывороточных антител и антител слизистой к токсину СЭВ
Приведенные выше результаты показывают, что (а) при введении микрокапсулированного антигена отмечается высокая адьювантная активность препарата и (б) микрокапсулы диаметром до 5 мкм проникают в брыжеечные лимфатические узлы и селезенку после включения в пейеровые бляшки. Эти данные свидетельствуют о целесообразности системной иммунизации посредством перорального введения содержащих антиген микрокапсул из поддающегося биодеградации материала с подбором их по размерам в зависимости от назначения препарата. Такая возможность была показана в экспериментах, в которых отдельные группы мышей иммунизировали введением 100 мкг стафилококкового энтеротоксоида В в форме раствора или в составе микрокапсул из полилактид-гликолида (соотношение компонентов 50:50) в качестве индифферентного материала. В этих экспериментах растворы и микрокапсулы с токсоидом вводили мышам с помощью желудочного зонда трехкратно, с интервалами по 30 дней после чего, спустя 10 и 20 дней после каждой иммунизации, производили забор крови для получения плазмы. В таблице 14 представлены результаты конечного титрования антител IgM и IgG к токсину через 20 дней после первичной, вторичной и третичной пероральной иммунизации животных.
У мышей, получавших вакцину в составе микрокапсул, наблюдали устойчивое повышение титров специфических антител после каждой последующей иммунизации, тогда как аналогичное действие растворенного антигена отсутствовало. В описываемых экспериментах использовали те же самые партии микрокапсул и те же методы оценки, что и в экспериментах, результаты которых отражены в ранее представленных таблицах 4, 5 и 6. Таким образом, эти данные являются непосредственным подтверждением повышенной эффективности иммунизации микрокапсулами, содержащими стафилококковый энтеротоксоид В, для перорального введения по сравнению с оптимальными дозами растворенного энтеротоксоида для парентеральных инъекций.
У мышей тех же групп изучали реакцию IgA антител при использовании обоих способов иммунизации. При этом исходили из предположения, что применение микрокапсул той же серии размером от менее 1 до 10 мкм, содержащих энтеротоксоид, будет сопровождаться освобождением антигена некоторыми из них после включения в пейеровы бляшки. Через 10 и 20 дней после третичной пероральной иммунизации получали пробы слюны и кишечного секрета и анализировали их на присутствие специфических антител IgA (таблица 15). В противоположность растворенному токсоиду, не обладавшему способностью индуцировать иммунную реакцию после перорального введения, скармливание мышам равных количеств токсоидной вакцины в составе микрокапсул приводило к значительному увеличению количества sIgA антител в слюне и желудочно-кишечной жидкости. Следует отметить, что при сборе последней ее разводили до конечного объема 5 мл. Хотя степень разведения не поддается точной оценке, можно с уверенностью предположить, что концентрация sIgA антител в слизистой кишечника, по крайней мере, в 10 раз выше, чем в исследовавшихся пробах, что, однако, не учитывалось при проведении измерений, проводившихся в описываемых экспериментах.
Приведенные данные показывают, что микрокапсулы с энтеротоксоидом являются эффективным средством индукции образования антитоксиновых sIgA антител в слизистой кишечника и других органов после перорального введения. Более того, используя смеси микрокапсул разного диаметра (от менее 1 до 10 мкм), можно вызвать образование большого количества этих антител в слизистой и одновременное их появление в крови. Это свидетельствует о возможности приготовления разнообразных вакцинных препаратов с повышенной эффективностью и удобных для практического применения на основе микрокапсульной технологии.
В. Микрокапсулы с вакцинной для введения в трахею
Пример 1. Введение микрокапсул с СЭВ токсоидом в трахею вызывает одновременную продукцию сывороточных антител и антител слизистой к токсину СЭВ
Агрегированные лимфатические фолликулы, подобные пейеровым бляшкам желудочно-кишечного тракта, имеются также в ассоциированной со слизистой лимфатической ткани иной анатомической локализации, например в дыхательной системе. Функция этих образований не отличается от функции пейеровых бляшек: они могут абсорбировать разные материалы из просвета дыхательных путей и служат местами индуцированной иммунной реакции, которая характеризуется повышенной продукцией антител. Исследовали возможность иммунизации с использованием функции ассоциированной со слизистой лимфатической ткани бронхов. Различным группам мышей вводили по 50 мкл фосфатного буферного раствора, содержащего 50 мкг СЭВ токсоида, либо в форме микрокапсул, либо в форме растворенного материала. Введение производили непосредственно в трахею. Через 10, 20, 30 и 40 дней после введения производили забор проб крови, слюны, смывов из кишечника и бронхо-альвеолярной жидкости.
Результаты анализа плазмы крови на присутствие антител после введения растворенного СЭВ токсоида свидетельствуют об отсутствии его индуцирующего действия на продукцию антител всех изотипов (таблица 16). В противоположность этому, введение в трахею равного количества вакцины СЭВ в составе микрокапсул индуцировало образование антител всех классов. Действие вакцины было максимальным спустя 30 дней после введения и сохранялось на протяжении последующего 10-дневного периода в отношении антител IgM, IgG и IgA, титры которых достигали соответственно 1:400, 1:51300 и 1:400.
Аналогичным образом введение микрокапсул сопровождалось образованием специфических антитоксиновых антител в слизистой дыхательных путей, тогда как свободная вакцина не вызывала активации иммунной системы (таблица 17). Изучение кинетики IgG антитоксиновых антител показало, что их появление в бронхоальвеолярной жидкости запаздывает по сравнению с плазмой крови, причем через 20 дней после введения вакцины в ней присутствовали только IgG антитела, титры которых были невысокими по сравнению с окончательными величинами в более поздние сроки. На 30 день отмечали максимальные титры IgG и IgA антител (соответственно 1:1280 и 1:320). Они сохранялись, по крайней мере, до 40 дня. IgM антитела в смывах из бронхов и альвеол во все сроки после иммунизации микрокапсулированной вакциной не обнаружены, что подтверждает отсутствие продуцирующих их клеток в легких и неспособность крупных молекул антител проникать из крови через стенки альвеолярных капилляров, служащих фильтрами для материала с молекулярной массой более 200000.
Полученные результаты показывают, что введение микрокапсул позволяет вызывать иммунную реакцию на антиген СЭВ токсоида непосредственно в дыхательных путях, тогда как аналогичное действие вакцины в форме раствора отсутствует. Антитела к этому антигену при этом способе иммунизации обнаруживались как в секрете, омывающем слизистую дыхательных путей, так и в крови. Следует отметить, что предлагаемый способ обеспечивает индукцию IgA антител, которые, как предполагают, образуются и секретируются локально, в верхних отделах дыхательной системы, т.е. зоне, которая не защищена IgG антителами, которые поступают в нижние части дыхательной системы из крови. Таким образом иммунизация антигенами в составе микрокапсул, вводимых непосредственно в трахею при вдыхании аэрозольных препаратов, может стать эффективным средством индукции антител, защищающих от инфекции верхние отделы дыхательной системы.
Г. Микрокапсулы с вакцинами для иммунизации с использованием разных путей введения
При испытании на людях и животных было установлено, что системная иммунизация в сочетании с введением антигена в слизистые оболочки в большей степени индуцирует иммунную реакцию последних, чем любая другая комбинация способов введения вакцины (Pierce N.F. and Gowans J.L. Cellular kinetics of the intestinal immune response to cholera toxoid in rats / Клеточная кинетика иммунной реакции кишечника на холерный токсоид у крыс/, J. Exp. Med., 142, 1550, 1975). Мышам, разделенным на 3 группы, внутрибрюшинно вводили 100 мкг микрокапсул, содержащих СЭВ энтеротоксоид, а спустя 30 дней - 100 мкг того же препарата, используя внутрибрюшинный, пероральный или внутритрахейный способы введения. Цель исследования состояла в получении непосредственного подтверждения преимуществ использования микрокапсул с антигеном для индукции антител.
Через 20 дней после иммунизации микрокапсулированным препаратом получали пробы плазмы крови, смывов из желудочно-кишечного тракта к бронхо-альвеолярной полости и посредством титрования при радиоиммунологическом анализе определяли характер распределения в этих жидкостях различных изотипов антител к токсину СЭВ (таблица 18). Повторная иммунизация мышей тем же способом, что и первичная иммунизация (внутрибрюшинно), вызывала появление в плазме крови и секретах желудочно-кишечной и дыхательной систем антител IgG в высоких титрах, тогда как IgA антитела во всех изученных пробах отсутствовали. В противоположность этому, вторичная иммунизация посредством введения содержащих токсоид СЭВ микрокапсул перорально или непосредственно в трахею сопровождалась появлением в плазме крови как специфических антитоксиновых IgG антител, титры которых накануне повторной иммунизации достигали 1:51200, так и антител sIgA, которые в смывах из желудочно-кишечного тракта и бронхоальвеолярной полости также присутствовали в больших количествах. Пероральное введение микрокапсул мышам, предварительно иммунизированным внутрибрюшинными инъекциями, индуцировало секрецию антител изотипа sIgA в желудочно-кишечную жидкость в количествах, сопоставимых с количеством их после трехкратного перорального введения (сравните таблицы 15 и 18). При введении микрокапсул в трахею мышей, предварительно иммунизированных посредством их внутрибрюшинного введения, наибольший эффект отмечали в отношении индукции диффузной иммунной реакции слизистой с одновременным появлением больших количеств антител IgG и sIgA в смывах из желудочно-кишечного тракта и бронхо-альвеолярной полости.
Эти наблюдения представляют особенно большой интерес в отношении иммунизации против разнообразных инфицирующих агентов, патофизиологическое действие которых осуществляется посредством острой инфекции дыхательных путей. Присутствующие в органах дыхания антитела происходят из двух различных источников. Антитела класса IgA преобладают в слизистой оболочке и слизи, омывающей носоглотку и бронхиальное дерево (Soutar С.A. Distribution of plasma cells and other cells containing immunoglobulin in the respiratory tract of normal man and class of immunoglobulin contained therein / Распределение клеток плазмы и других типов клеток, содержащих иммуноглобулины, в дыхательной системе здоровых людей, и типы присутствующих в них иммуноглобулинов/, Thorax 31: 58; 1976 and Kaltreider H.B. and Chan M.K.L. The classspecified immunoglobulin composition of fluids obtained from various levels of canine respiratory tract. / Специфический состав иммуноглобулинов разных классов в жидкостях, полученных из разных отделов дыхательной системы собак /, J. Immunol, 116, 423, 1976). Эти антитела образуются в локальных клетках плазмы, имеющихся в lamina propria верхних отделов дыхательной системы. В отличие от носоглотки и бронхиального дерева бронхиолы и альвеолы содержат преимущественно IgG антитела, которые пассивно поступают в них из крови в процессе транссудации (Reynolds H.Y. and Newdfll, H.H. Analysis of proteins and respiratory cells obtained from human lungs by bronchial lavage / Анализ белков и клеток дыхательной системы человека, полученных из легких и смывов из бронхов/, J. Lab. Clin. Med., 84, 559, 1974). Таким образом, для эффективной защиты легких необходимы как циркулирующие IgG антитела, так и антитела изотипа sIgA в слизистой оболочке.
Приведенные данные показывают, что смешанный способ иммунизации с использованием микрокапсул обеспечивает наибольшую эффективность индукции одновременно циркулирующих антител и антител слизистой. Проведенные эксперименты включали первичную иммунизацию и последующую активацию иммунной системы, что требовало введения на каждой из этих стадий новых порций микрокапсул с заключенным в них антигеном. Тем не менее гибкость предлагаемого способа позволяет обеспечить контролируемое пульсирующее высвобождение антигена после однократного введения микрокапсул с целью максимальной стимуляции одновременной системной и секреторной иммунной реакции. В качестве примера можно упомянуть введение антигена одновременно пероральным путем и посредством инъекции во время однократного посещения пациентом лечебного учреждения. Варьируя соотношение лактида и гликолида в полимерном материале микрокапсул, вводимых обоими способами, можно добиваться такого положения, при котором системное введение антигена вызывает спустя несколько дней активацию иммунной системы, а перорально введенный антиген будет освобождаться из пейеровых бляшек в более поздние сроки, потенциируя иммунную реакции слизистой.
IV. Абсорбция лекарственных средств
Приведенные ниже примеры показывают, что микрокапсулы размером до 5 мкм, предпочтительно от 1 до 5 мкм, могут улучшать абсорбцию лекарственных средств, в том числе вакцинных антигенов, в организме. Из полилактид-гликолида (в соотношении 50:50) изготавливали микрокапсулы, содержавшие этретинат (этиловый эфир Е-9) 4-метокси-2-3,6-триметил)фенил-3,7-диметил-2,4,8-нонатетраеновой кислоты. Использовали микрокапсулы диаметром 0,5-4,0 мкм, содержавшие 37,2 весовых процента препарата. Микрокапсулы, а также свободный этретинат посредством желудочного зонда вводили мышам в 1%-ном растворе твина-80 в воде. Введение производили однократно, в дозе 50 мг этретината /кг веса тела. В определенные периоды производили забор проб крови и проводили количественный анализ этретината / или продуктов его превращения в сыворотках с помощью высокоэффективной жидкостной хроматографии (таблица 19). Полученные результаты показывают, что введение этретината мышам в составе микрокапсул сопровождается значительно более выраженным увеличением его концентрации в крови по сравнению с мышами, получавшими некапсулированный препарат. Как и в случае микрокапсул с вакцинами размером менее 5 мкм, микрокапсулы, содержащие этретинат, обеспечивают его поступление в кровь из пейеровых бляшек (лимфатической ткани желудочно-кишечного тракта). Аналогичный подход можно использовать для усиления абсорбции других лекарственных средств, что может найти особенно широкое применение в системах направленной доставки таких биологически активных соединений, как пептиды, белки, нуклеиновые кислоты и другие материалы.

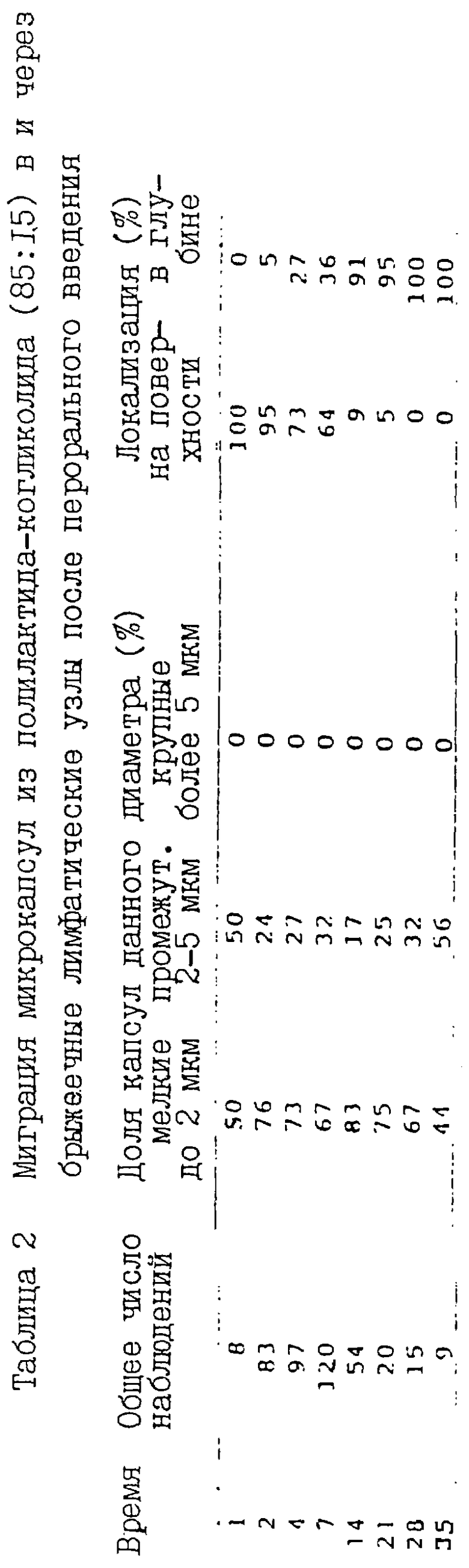







Таблица 12.
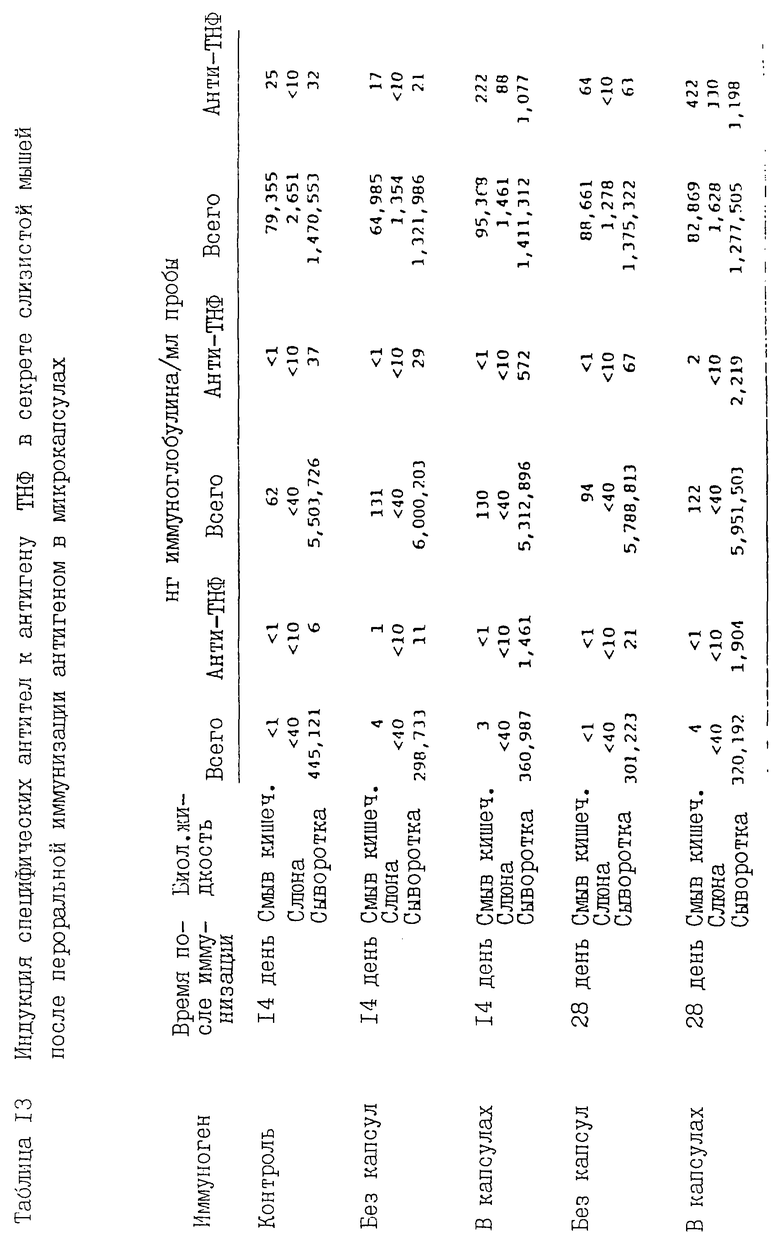






Изобретение относится к ветеринарии. Предложенные способы и композиция обеспечивают перенос биологически активного соединения, преимущественно антигена, в организме животных. Эффективное количество биологически активного соединения заключают в микрокапсулы из биосовместимого материала, размеры которых не превышают 10 мкм, и вводят эффективное количество этих микрокапсул, преимущественно перорально, иммунизируемым животным. В качестве материала для микрокапсул обычно используют биологически активный полимер или сополимер, обладающий способностью проходить через желудочно-кишечный тракт или локализоваться на поверхности слизистых оболочек, не подвергаясь биодеградации. Это обеспечивает перенос биологически активного соединения на пейеровы бляшки или другие ассоциированные со слизистой оболочкой лимфатические ткани, что обеспечивает индуцирование системного иммунитета и активизацию иммунной системы слизистых оболочек. 3 н. и 19 з.п. ф-лы, 19 табл.
а) инкапсулирование эффективного количества указанного биологически активного соединения в биологически совместимом наполнителе с образованием микрокапсул размером 1-10 мкм, и
б) введение эффективного количества микрокапсул животному таким образом, чтобы необходимое для терапевтического действия число микрокапсул достигло и включилось в указанную ассоциированную со слизистой оболочкой лимфоретикулярную ткань.
| US 4166800 А, 04.09.1979 | |||
| US 4681752 А, 21.07.1987 | |||
| US 4526938 A, 02.07.1985 | |||
| US 4389330 А, 21.06.1983 | |||
| US 4585651 А, 29.04.1986. |
Авторы
Даты
2005-04-20—Публикация
1989-03-16—Подача