ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
1. Область изобретения
Данное изобретение имеет отношение к анализам связывания антител и наборам для радиоактивного мечения, препаратам лиофилизированных клеток, реактивам и протоколам тестирования клинической эффективности используемых в терапии антител при лечении/визуализации опухолей и опухолевых клеток. В частности, наборы данного изобретения используют для изготовления и оценки радиоактивно меченных конъюгатов антител, которые будут использованы для лечения и визуализации В-клеточных лимфомных опухолей посредством направленной доставки к мишени - поверхностному антигену В-клеток ВР35 ("CD20").
2. Технологическая предпосылка
Все публикации и заявки на патенты включены здесь при ссылке на них в таком же объеме, как в случае, если бы для каждой отдельной публикации или заявки на патент было конкретно и отдельно указано, что она включена в виде ссылки.
Иммунная система позвоночных (например, приматов, которые включают в себя людей, человекообразных обезьян, обезьян и т.д.) состоит из ряда органов и типов клеток, которые образовались в ходе эволюции для того, чтобы: точно и специфично узнавать чужеродные микроорганизмы (“антиген”), которые вторглись в организм хозяина-позвоночного; специфично связываться с такими чужеродными микроорганизмами; и удалять/уничтожать такие чужеродные микроорганизмы. Лимфоциты так же, как и другие типы клеток, имеют решающее значение для иммунной системы. Лимфоциты образуются в тимусе, селезенке и костном мозге (взрослый организм) и составляют примерно 30% от общего количества белых кровяных телец, присутствующих в системе циркуляции человека (взрослый организм).
Существуют две основных субпопуляции лимфоцитов: Т-клетки и В-клетки. Т-клетки ответственны за опосредуемый клетками иммунитет в то время, как В-клетки ответственны за продукцию антител (гуморальный иммунитет). Однако Т-клетки и В-клетки можно считать взаимозависимыми - при обычном иммунном ответе Т-клетки активируются в том случае, когда рецептор Т-клетки связывается с фрагментами антигена, который связан с гликопротеидами главного комплекса гистосовместимости ("МНС") на поверхности антигенпредставляющей клетки; такая активация вызывает высвобождение биологических медиаторов (“интерлейкинов”), которые по существу стимулируют В-клетки к дифференцировке и продукции антитела (“иммуноглобулинов”) против антигена.
Каждая В-клетка в организме хозяина экспрессирует особое антитело на своей поверхности - поэтому одна В-клетка будет экспрессировать антитело, специфичное для одного антигена, в то время как другая В-клетка будет экспрессировать антитело, специфичное для другого антигена. Следовательно, В-клетки довольно разнообразны, и это разнообразие имеет решающее значение для иммунной системы. У человека каждая В-клетка может продуцировать огромное количество молекул антитела (а именно, примерно от 107 до 108). Такая продукция антител в наиболее типичных случаях прекращается (или в значительной степени снижается), когда чужеродный антиген нейтрализован. Однако иногда пролиферация особой В-клетки будет продолжаться, не снижаясь; результатом такой пролиферации может быть рак, называемый “В-клеточной лимфомой”.
Как Т-клетки, так и В-клетки содержат белки клеточной поверхности, которые могут быть использованы как “маркеры” дифференцировки и для идентификации. Одним из таких маркеров В-клеток человека является антиген дифференцировки Вр35, ограниченный В-лимфоцитами человека, называемый "CD20". CD20 экспрессируется во время раннего периода развития предшественников В-клеток и сохраняется до дифференцировки плазматических клеток. В частности, молекула CD20 может регулировать этап процесса активации, который необходим для инициации клеточного цикла и дифференцировки, и обычно на очень высоких уровнях экспрессируется на неопластических (“опухолевых”) В-клетках. CD20, по определению, присутствует как на “нормальных” В-клетках, так и на “малигнизированных” В-клетках, т.е. таких В-клетках, не снижающаяся пролиферация которых может приводить к В-клеточной лимфоме. Таким образом, поверхностный антиген CD20 потенциально может служить кандидатом для “обеспечения направленной доставки” к В-клеточным лимфомам.
По существу такую направленную доставку к мишени в общем виде можно представить следующим образом: антитела, специфичные в отношении поверхностного антигена CD20 В-клеток, например, инъецируют пациенту. Указанные анти-СD20-антитела специфично связываются с антигеном клеточной поверхности CD20 (очевидно) как нормальных, так и малигнизированных В-клеток; анти-СD20-антитело, связанное с поверхностным антигеном CD20, может приводить к гибели и ослаблению опухолевых В-клеток. Кроме того, с aнти-CD20-антителом могут быть конъюгированы химические агенты или радиоактивные метки, обладающие потенциальной способностью разрушать опухоль, так что агент специфично “доставляется”, например, к опухолевым В-клеткам. Независимо от подхода основной целью является уничтожение опухоли: конкретный подход может определяться конкретным анти-СD20-антителом, которое используется, и, таким образом, отвечающие требованиям подходы к направленной доставке к мишени - CD20-антигену - могут значительно варьироваться.
Например, сообщалось о попытках такой направленной доставки к мишени - поверхностному антигену CD20. По имеющимся сообщениям, мышиное (мышь) моноклональное антитело 1F5 (анти-СD20-антитело) вводили посредством непрерывной внутривенной инфузии пациентам с В-клеточной лимфомой. Как сообщают, требовались экстремально высокие уровни (>2 грамм) 1F5, чтобы уменьшить количество циркулирующих опухолевых клеток, и результаты были описаны как “временные”. Press et al., "Monoclonal Antibody 1F5 (Anti-CD20) Serotherapy of Human B-Cell Lymphomas," Blood 69/2: 584-591 (1987).
Возможной проблемой при таком подходе является то, что моноклональные антитела не человека, а другого организма (например, мышиные моноклональные антитела) обычно не обладают эффекторными функциями у человека, т.е. они, в том числе, не способны опосредовать комплемент-зависимый лизис или лизировать клетки-мишени человека благодаря зависимой от антител цитотоксичности или опосредованного Fc-рецепторами фагоцитоза. Кроме того, моноклональные антитела не человека, а другого организма, могут распознаваться хозяином-человеком как чужеродный белок; поэтому многократные инъекции таких чужеродных антител могут приводить к индукции иммунных ответов, приводящих к вредным реакциям гиперчувствительности. Для моноклональных антител на основе мышиных антител это часто называют ответом, направленным против мышиных антител, у человека (Human Anti-Mouse Antibody response), или "НАМА"-ответом. Кроме того, указанные “чужеродные” антитела могут быть атакованы иммунной системой хозяина так, что они в действительности нейтрализуются до того, как они достигают местонахождения мишени.
Лимфоцитам и клеткам лимфомы присуща чувствительность к радиотерапии. Поэтому В-клеточные неоплазии являются привлекательными мишенями для радиоиммунотерапии (РИТ) по нескольким причинам: местное испускание ионизирующего излучения радиоактивно меченными антителами может убивать клетки, имеющие или не имеющие антигена-мишени (например, CD20), находящиеся в близком соседстве с антителом, связанным с антигеном; проникающая радиация, например источники бета-излучения, могут избавить от проблемы ограниченного доступа антитела в объемные или сильно васкуляризованные опухоли; и общее количество необходимых антител может быть снижено. Радионуклид испускает радиоактивные частицы, которые могут повреждать клеточную ДНК до того момента, когда механизмы клеточной репарации не способны дать клеткам возможность продолжать жить; поэтому если клетками-мишенями являются опухоли, радиоактивная метка целительным образом убивает опухолевые клетки. Радиоактивно меченные антитела по определению включают применение радиоактивного вещества, которое может требовать необходимости в предосторожности как для пациентов (а именно, возможная трансплантация костного мозга), так и для медицинского персонала (а именно, необходимость проявлять высокую степень осторожности при работе с радиоактивностью).
Поэтому подходом к повышению способности мышиных моноклональных антител осуществлять лечение В-клеточных нарушений являлось конъюгирование радиоактивной метки с антителом так, что метка или токсин локализуются в месте опухоли. Токсины (т.е. химиотерапевтические средства, такие как доксорубицин или митомицин С) также конъюгировали с антителами. Смотри, например, опубликованную заявку РСТ WO 92/07466 (опубликована 14 мая 1992 г.).
“Химерные” антитела, т.е. антитела, которые содержат части от двух или более различных видов (например, мышь и человек), были разработаны в качестве альтернативы “конъюгированным антителам”. Были созданы химерные антитела мыши/человека, и показано, что они проявляют параметры связывания родительского мышиного антитела и эффекторные функции, связанные с константным районом антитела человека". Смотри, например, Cabilly et al., патент США 4816567; Shoemaker et al., патент США 4978745; Beavers et al., патент США 4975369; и Boss et al., патент США 4816397, все они включены в данное описание в виде ссылок. Как правило, указанные химерные антитела конструируют посредством получения геномной библиотеки генов из ДНК, экстрагированной из ранее существовавших мышиных гибридом. Nishimura et al. (1987) Cancer Research 47: 999. Затем проводят скрининг библиотеки по генам вариабельных районов как тяжелых, так и легких цепей, демонстрирующих правильную картину перестройки фрагментов антител. Затем клонированные гены вариабельных районов лигируют в экспрессирующий вектор, содержащий клонированные кассеты гена соответствующего константного района тяжелой или легкой цепи человека. Затем химерные гены экспрессируют в предпочтительной клеточной линии, обычно линии миеломы мыши.
Например, Liu, A.Y. et al., "Production of Mouse-Human Chimeric Monoclonal Antibody to CD20 with Potent Fc-Dependent Biologic Activity", J. Immun. 139/10: 3521-3526 (1987) описывают химерное антитело мыши/человека, направленное против СD20-антигена. Смотри также заявку РСТ №WO 88/04936. Однако в ссылке не представлено информации относительно способности, эффективности или практического применения использования химерных антител Liu для лечения В-клеточных нарушений.
Отмечают, что функциональные анализы in vitro (например, комплемент-зависимый лизис ("CDC"); антителозависимая клеточная цитотоксичность ("ADCC") и т.д.), в сущности, не могут предсказать способность какого-либо антитела уничтожать или уменьшать количество клеток-мишеней, экспрессирующих специфичный антиген, in vivo. Смотри, например, Robinson R.D., et al., "Chimeric mouse-human anti-carcinoma antibodies that mediate different anti-tumor cell biological activities," Hum. Antibod. Hybridomas, 2: 84-93 (1991) (химерные антитела мыши-человека, не обладающие обнаруживаемой активностью ADCC). Поэтому потенциальная терапевтическая эффективность антител точно может быть определена только путем экспериментирования in vivo.
С этой целью в заявках, которые рассматриваются совместно, 08/475813, 08/475815 и 08/478967, включенных здесь в виде ссылки в полном объеме, приведена информация о радиоактивно меченных анти-СD20-конъюгатах для диагностической “визуализации” В-клеточных лимфомных опухолей перед введением используемого для терапии антитела. Конъюгат “In2В8” содержит мышиное моноклональное антитело 2В8, специфичное в отношении антигена CD20 человека, которое связано с индием [111] (111In) бифункциональным хелатирующим агентом, а именно MX-DTPA (диэтилентриаминопентауксусной кислотой), который содержит смесь 1-изотиоцианатбензил-3-метил-DTPA и 1-метил-3-изотиоцианатбензил-DТРА в соотношении 1:1. Индий-[111] выбран в качестве диагностического радионуклида потому, что он испускает гамма-излучение, и прежде использовался в качестве средства для визуализации.
Патенты, имеющие отношение к хелатирующим агентам и конъюгатам хелатирущих агентов, известны в данной области. Например, патент США №4831175 Gansow направлен на хелаты полизамещенной диэтилентриаминопентауксусной кислоты и белковые конъюгаты, которые их содержат, и способы их получения. Патенты США №№5099069, 5246692, 5286850 и 5124471 Gansow также имеют отношение к полизамещенным DTPA-хелатам. Указанные патенты включены здесь в полном объеме.
В заявках 08/475813, 08/475815 и 08/478967 был выбран специфичный бифункциональный хелатирующий агент, используемый для обеспечения хелатирования, так как он обладает высоким сродством к трехвалентным металлам и предусматривает повышенные содержание в опухоли по отношению к неопухолевой ткани, меньшее поглощение костной тканью и большее удерживание радионуклида в местах мишеней in vivo, т.е. в местах В-клеточных лимфомных опухолей. Однако в данной области известны другие бифункциональные хелатирующие агенты, и они также могут быть полезны в терапии опухолей.
Также в заявках 08/475813, 08/475815 и 08/478967 показаны радиоактивно меченные терапевтические антитела для целенаправленной доставки к В-клеточным лимфомам и опухолевым клеткам и их разрушения. В частности, конъюгат Y2B8 содержит такое же мышиное моноклональное антитело против CD20 человека, 2В8, связанное с иттрием-[90] (90Y) с помощью такого же бифункционального хелатирующего агента. Указанный радионуклид был выбран для терапии по нескольким причинам. Период полураспада 90Y, равный 64 часам, достаточен для того, чтобы обеспечить возможность накопления опухолью, в отличие, например, от 131I, он представляет собой источник чистого бета-излучения высокой энергии, не сопровождающегося при его распаде гамма-излучением, с радиусом действия от 100 до 1000 диаметров клетки. Минимальное количество проникающей радиации позволяет вводить 90Y-меченые антитела в амбулаторных условиях. Кроме того, для гибели клеток не требуется интернализации меченых антител, и локальное испускание ионизирующего излучения должно быть летальным для близлежащих опухолевых клеток, у которых отсутствует антиген-мишень.
Так как радионуклид 90Y связывали с антителом 2В8, используя ту же самую бифункциональную хелатирующую молекулу MX-DTPA, конъюгат Y2B8 обладает теми же преимуществами, которые обсуждались выше, например, повышенным удерживанием радионуклида в сайте-мишени (опухоль). Однако в отличие от 111In его нельзя использовать в целях визуализации из-за отсутствия ассоциированного с ним гамма-излучения. Таким образом, радионуклид для диагностической “визуализации”, такой как 111In, можно использовать для определения локализации и относительного размера опухоли перед и/или после введения терапевтических химерных или 90Y-меченых антител с целью уменьшения опухоли. Кроме того, меченное индием антитело делает возможным производить дозиметрическое определение.
В зависимости от предполагаемого применения антитела, а именно как диагностического или терапевтического реагента, в данной области известны другие радиоактивные метки, и они были использованы для подобных целей. Например, радионуклиды, которые использовались для клинической диагностики, включают в себя 131I, 125I, 123I, 90Тc, 67Ga, а также 111In. Для потенциального применения в целенаправленной терапии антитела также метили разнообразными радионуклидами (Peirersz et al. (1987) The use of monoclonal antibody conjugates for the diagnosis and treatment of cancer. Immunol. Cell Biol. 65: 111-125). Указанные радионуклиды включают в себя 188Re и 186Re, а также 90Y, и в меньшей степени - 199Аu и 67Сu. I-[131] также был использован в терапевтических целях. В патенте США №5460785 представлен список таких радиоизотопов, и патент включен в данное описание в виде ссылки.
Как сообщалось в совместно рассматриваемых заявках 08/475813, 08/475815 и 08/478967, введение радиоактивно меченного конъюгата Y2B8, а также немеченого химерного анти-CD20-антитела, в результате приводило к значительному уменьшению опухоли у мышей, несущих В-клеточную лимфобластную опухоль. Кроме того, клинические испытания на человеке, о которых сообщалось в этих заявках, показали значительное уменьшение количества В-клеток у пациентов с лимфомой, которым инфузировали химерное анти-СD20-антитело. Действительно, недавно химерное 2В8 было объявлено первым в США утвержденным FDA противоопухолевым моноклональным антителом под названием Rituxan®. Таким образом, было показано, что по меньшей мере одно химерное анти-СD20-антитело проявляет терапевтическую эффективность при лечении В-клеточной лимфомы.
Кроме того, в заявке на патент США с регистрационным №08/475813, включенной здесь в виде ссылки, сообщается о последовательном введении Rituxan®, химерного анти-СD20-антитела, либо с меченым индием, либо с меченым иттрием моноклональным антителом или с обоими. Хотя радиоактивно меченные антитела, используемые в указанных случаях комбинированной терапии, являются мышиными антителами, начальная обработка химерным анти-СD20 в достаточной степени истощает популяцию В-клеток, так что НАМА-ответ снижается, тем самым, способствуя осуществлению программ комбинированной терапии и диагностики.
Таким образом, в таком контексте комбинированной иммунотерапии мышиные антитела могут найти особое применение в качестве диагностических реагентов. Более того, в заявке на патент США 08/475813 было показано, что терапевтически эффективная доза меченного иттрием анти-СD20-антитела после введения Rituxan® достаточна для того, чтобы (а) очистить от любых оставшихся В-клеток периферической крови, от которых не очистило химерное анти-СD20-антитело; (b) начать истощение В-клеток в лимфатических узлах; или (с) начать истощение В-клеток в других тканях.
Таким образом, конъюгация радиоактивных меток с антителами, используемыми для терапии рака, предоставляет полезное для клиники средство, которое можно использовать для оценки потенциальной терапевтической эффективности таких антител, создания диагностических реагентов для того, чтобы контролировать ход лечения, и разрабатывать дополнительные терапевтические реагенты, которые можно использовать для повышения первоначальной потенциальной способности химерного антитела убивать опухоли. При наличии испытанной эффективности анти-СD20-антитела в лечении неходжкинских лимфом и известной чувствительности лимфоцитов к радиоактивности, было бы очень полезно, чтобы такие терапевтические антитела стали бы доступными для приобретения в форме наборов, посредством которых их можно было бы модифицировать радиоактивной меткой и вводить непосредственно пациенту в условиях клиники.
Хотя существует много способов и реагентов для осуществления радиоактивного мечения антител, что отсутствует в данной области, так это подходящий наполнитель для размещения указанных реагентов в условиях клиники, посредством которого их можно было легко приготовить и ввести пациенту прежде, чем произойдет значительный распад радиоактивной метки или значительное разрушение антитела из-за радиоактивной метки. Отсутствие таких подходящих средств для того, чтобы перевести указанную полезную технологию на коммерческую основу, может быть следствием низкой эффективности включения, демонстрируемой некоторыми известными протоколами мечения, и последующей необходимостью очищать реагент на колонке после процедуры радиоактивного мечения. Задержка в разработке таких наборов отчасти также может быть следствием того, что ранее были недоступны для коммерческого приобретения чистые радиоизотопы, которые можно использовать для создания эффективно меченных продуктов без последующей очистки. Альтернативно, возможно причиной повсеместного отсутствия таких наборов является фактическое отсутствие антител, для которых удалось достичь либо утверждения, либо эффективности, которые были достигнуты для Rituxan® при лечении лимфомы у больных людей.
Например, как обсуждалось в патенте США 4636380, включенном здесь в виде ссылки, как правило, среди научной общественности полагают, что для того, чтобы радиоактивный фармацевтический препарат нашел клиническое применение, он должен подвергаться длительной и трудоемкой процедуре выделения и очистки. Действительно, инъекции несвязанной радиоактивной метки пациенту были бы нежелательны. Необходимость дополнительных этапов очистки делает способ радиоактивного мечения антител невозможным в условиях клиники, особенно для врачей, у которых нет ни оборудования, ни времени для очистки своих собственных терапевтических средств.
Кроме того, радиоактивно меченные белки могут быть исходно нестабильными, особенно белки, меченные радиолитическими изотопами, такими как 90Y, которые имеют тенденцию вызывать повреждения антитела тем больше, чем дольше они связаны с ним в близком соседстве. В свою очередь, такой радиолиз приводит к ненадежной эффективности терапевтического средства вследствие отсутствия радиоактивной метки и/или сниженного связывания с антигеном-мишенью и может приводить к нежелательным иммунным ответам, направленным на денатурированный белок. Помимо этого, не имея возможностей для мечения и очистки антител на месте, клиницисты не имели выбора кроме назначения уже меченных терапевтических антител, или метили их вне клиники в другом относительно доступном месте и после мечения транспортировали в клинику для введения пациенту. Все такие манипуляции добавляют драгоценное время к периоду между мечением и введением, внося тем самым вклад в нестабильность терапевтического средства, в то же время, в сущности, сокращая применение наборов для радиоактивного мечения в условиях клиники.
Другие исследователи безуспешно пытались разработать наборы для радиоактивного мечения антител, которых было бы специалисту достаточно, чтобы отказаться от отдельного этапа очистки антитела. Например, Cytogen недавно выпустили коммерческий набор для радиоактивного мечения мышиного моноклонального антитела, направленного на ассоциированный с опухолью гликопротеид TAG-72. Однако антитело, выпущенное Cytogen, очень плохо поддается приготовлению композиции набора из-за тенденции образовывать частицы при хранении, которые потом надо удалять посредством дополнительного этапа фильтрации. Кроме того, антитело, выпущенное Cytogen, вызывало побочные реакции у пациентов вследствие НАМА-ответов.
Другими авторами было заявлено о том, что они имеют разработанные протоколы радиоактивного мечения, которое поддавалось бы компоновке набора, в котором отдельный этап очистки не требовался бы (Richardson et al. (1987) Optimization and batch production of DTPA-labeled antibody kits for routine use in 111In immunoscintography. Nuc. Med. Commun. 8: 347-356; Chinol and Hnatowich (1987) Generator-produced yttrium-[90] for radioimmunotherapy. J. Nucl. Med. 28(9): 1465-1470). Однако при таких протоколах было невозможно достичь уровня включения, которого достигли авторы данного изобретения, используя заявленные здесь протоколы, результатом которых была эффективность включения по меньшей мере 95%. Такой уровень включения предоставляет дополнительное преимущество повышенной безопасности тем, что фактически несвязанная метка не будет инъецирована пациенту в результате низкого радиоактивного включения.
Протоколы, включенные в наборы данного изобретения, позволяют проводить быстрое мечение, которому подвергают примерно полчаса или только пять минут, в зависимости от метки. Кроме того, протоколы наборов данного изобретения имеют эффективность мечения более 95%, позволяя таким образом отказаться от необходимости дальнейшей очистки. При отказе от необходимости в дальнейшей очистке сберегается время полураспада радиоактивной метки и сохраняется целостность антитела для терапевтической цели, для которой его метят.
В данной заявке раскрыта информация об удобных наборах и способах, посредством которых диагностические и терапевтические антитела можно радиоактивно метить и вводить пациенту воспроизводимым, надежным и удобным способом. Наборы согласно данному изобретению превращают способ радиоактивного мечения антител в нетрудный, не мучительный стандартизованный способ, который чрезвычайно облегчает протоколы лечения пациентов. Данные наборы дают преимущества перед предшествующим уровнем техники в том, что определены оптимальные параметры мечения и введения терапевтического или диагностического средства, что снижает стоимость продукции. Так как описанные здесь наборы предоставляют оптимальные параметры в соответствии с конкретной меткой, применение набора, предназначенного для конкретной метки, также будет минимизировать изъятие компонентов для использования в других целях, т.е. то, что происходит в случае использования неподходящего набора для конкретной метки. Устранение растаскивания набора по частям, в свою очередь, также обеспечивает оптимальную эффективность мечения. Кроме того, протоколы и стерильные, апирогенные компоненты, включенные в каждый набор, способствуют осуществлению более удобной для пользователя процедуры, так как тестирование стерильности, пирогенности и очистка реагентов после мечения устраняются.
3. Краткое изложение сути изобретения
Данное изобретение включает в себя набор для радиоактивного мечения диагностического или терапевтического антитела перед введением пациенту, содержащий по меньшей мере (i) флакон, содержащий антитело, конъюгированное с хелатирующим агентом, (ii) флакон, содержащий буфер композиции для стабилизации и введения радиоактивно меченного антитела, и (iii) инструкции по радиоактивному мечению антитела, где указанные компоненты флаконов поставляются в таком количестве и в такой концентрации, что при их объединении с радиоактивной меткой достаточной чистоты и активности согласно инструкциям набора не требуется дополнительная очистка радиоактивно меченного антитела перед введением указанному пациенту. Кроме того, в случае мечения согласно инструкциям набора и радиоизотопом достаточной чистоты и активности включение такого изотопа может достигать уровней выше 95%, и даже вплоть до 98% или выше.
Наиболее предпочтительно антителом, включенным в набор, является анти-СD20-антитело. Антитело поставляется в форме, в которой оно связано с бифункциональным хелатирующим агентом. Предпочтительно антитело конъюгируют с MX-DTPA, но также можно использовать другие хелатирующие агенты, такие как DTPA, конъюгированный фенил- или бензил-DTPA, циклогексил-DTPA, производные EDTA и DOTA. Хелатирующим агентом согласно данному изобретению может быть любой хелатирующий агент, который по меньшей мере бифункционален, т.е. который обладает по меньшей мере двумя сайтами связывания (по меньшей мере один сайт для хелатирования иона металла и по меньшей мере один сайт для связывания с белковым лигандом).
В зависимости от используемого антитела конъюгированное антитело обычно поставляется в концентрации от 0,5 до 30 мг/мл, более предпочтительно 2 мг/мл. Объем конъюгированного антитела будет зависеть от концентрации и количества, необходимого для оптимального мечения в зависимости от радиоактивной метки. Однако конъюгированное антитело поставляют в таком объеме и концентрации, чтобы весь объем был добавлен в реакционный флакон с использованием стерильного шприца и асептическим способом. Это сделает возможным повышенную воспроизводимость и легкость применения. Все реагенты заявленных здесь наборов стерильны и апирогенны, и специально разработаны для простоты и скорости перехода непосредственно от тестирования антитела к введению. С некоторыми метками необходимость в тестировании эффективности мечения может не требоваться.
Компонентом набора, обладающим особыми преимуществами, является буфер композиции для стабилизации от воздействия радиолиза и для введения радиоактивно меченного конъюгированного антитела пациенту. Буфер для приготовления композиции представляет собой фармацевтически приемлемый носитель, который служит и разбавителем для меченого антитела, и буфером для введения. Несмотря на то что любой фармацевтически приемлемый разбавитель может быть использован для введения терапевтического или диагностического антитела пациенту, буфер для приготовления композиции данного изобретения особенно подходит для введения радиоактивно меченных антител.
Например, буфер композиции согласно данному изобретению содержит радиопротектор, такой как сывороточный альбумин человека (ЧСА) или аскорбат, которые минимизируют радиолиз из-за иттрия и, в меньшей степени, индия. В данной области известны другие радиопротекторы, и их также можно использовать в буфере композиции согласно данному изобретению, а именно акцепторы свободных радикалов (фенол, сульфиты, глютатион, цистеин, гентизиновая кислота, никотиновая кислота, аскорбилпальмитат, НОР(:О)H2, глицерин, формальдегид-сульфоксилат натрия, Na2S2O5, Nа2S2О3 и SO2 и т.д.).
Следует отметить, что хотя радиопротекторы обычно применяют в буферах для приготовления композиции, чтобы защитить антитело от радиолиза, можно оказать дополнительную защиту включением радиопротектора также и в реакционный буфер. Прежде этого обычно не делали, а именно не добавляли ЧСА, из-за наличия металлов, которые помешали бы процессу мечения. Однако можно “очистить” ЧСА, используя хелатирующую смолу, такую, чтобы ее также можно было включить в буфер реакции. Также может потребоваться обработка аскорбата или других радиопротекторов, чтобы удалить загрязняющие металлы.
Буфер для приготовления композиции согласно данному изобретению также содержит избыток неконъюгированного хелатирующего агента. Целью включения неконъюгированного хелатирующего агента является то, чтобы указанный хелатирующий агент служил акцептором любой несвязанной с белком радиоактивной метки у пациента, и осуществлял выделение радиоактивной метки, тем самым снижая поглощение изотопов, “ищущих кость”, т.е. 90Y, костной тканью пациента. Например, в случае, когда антитело набора конъюгировано с хелатирующим агентом DTPA, избыток DTPA или любого другого хелатирующего агента может быть включен в буфер для приготовления композиции. Буфер композиции также предпочтительно поставляется в таком объеме, что содержимое полностью переносят в реакционный флакон. Как обсуждалось выше, в результате это приводит к повышению простоты применения и воспроизводимости, поскольку не приходится измерять и переносить точные объемы.
Предпочтительный буфер композиции содержит забуференный фосфатами или физиологический раствор соли, сывороточный альбумин человека и DTPA. Сывороточный альбумин человека предпочтительно присутствует в концентрации примерно от 1 до 25% (маc./об.) и более предпочтительно в концентрации примерно равной 7,5% (маc./об.). Концентрация DTPA предпочтительно составляет примерно 1 мМ. Аскорбат может быть использован в качестве альтернативы сывороточному альбумину человека, и обычно используется в концентрации примерно от 1 до 100 мг/мл. Хотя можно использовать широкие пределы концентраций, не подвергая риску безопасность пациента.
Антитело набора для радиоактивного мечения без труда метят предпочтительным радиоизотопом посредством бифункционального хелатирующего агента согласно способам данного изобретения. В этом отношении для дополнительного упрощения набор согласно данному изобретению также может включать в себя флакон, содержащий буфер для доведения рН раствора радиоизотопа, и стерильный стеклянный реакционный флакон для выполнения мечения и затем для ресуспендирования конечного радиоактивно меченного антитела в буфере для приготовления композиции. Обычно достаточно реакционного флакона объемом 10 мл, но также можно использовать флаконы, способные вмещать от 5 до 20 мл. Буфер предпочтительно представляет собой раствор ацетата натрия с низким содержанием металлов в концентрации от 10 до 1000 мМ, наиболее предпочтительно 50 мМ.
Специальный набор согласно данному изобретению содержит антитело, конъюгированное с MX-DTPA, 2B8-MX-DTPA. 2В8 представляет собой анти-СD20-антитело, которое, как показано, оказывает влияние на истощение популяции В-клеток при введении пациентам с лимфомой. Однако специалистам в данной области должно быть ясно, что набор для радиоактивного мечения согласно данному изобретению можно оптимизировать для радиоактивного мечения других анти-СD20-антител или любого другого антитела, которое было конъюгировано с DTPA или другими поливалентными хелатирующими агентами. Предпочтительный набор согласно данному изобретению может включать в себя по меньшей мере (i) флакон, содержащий антитело 2В8, конъюгированное с MX-DTPA, либо в растворе, либо лиофилизированное (требующее восстановления исходного состояния); и (ii) флакон, содержащий буфер композиции для введения радиоактивно меченного антитела пациенту. Предпочтительный набор будет также содержать (iii) буфер для доведения рН изотопа и (iv) реакционный флакон. Альтернативно, и более предпочтительно буфер поставляется в реакционном флаконе, тем самым, устраняя этапы измерения и перенесения буфера и повышая простоту, устойчивость и стерильность компонентов набора. Однако также предвидятся другие варианты, а именно в которых буфер добавляют сначала к флакону с изотопом, и затем забуференный изотоп переносят в реакционный флакон. В этом случае реакционный флакон может поставляться с требуемым объемом антитела. В альтернативном случае флакон с изотопом/буфером можно сделать большим, достаточным для того, чтобы вместить добавку конъюгата антитела, т.е. непосредственно во флакон поставщика. Это устранит необходимость в реакционном флаконе.
Как описано выше, осуществляют другую предпочтительную форму набора, в которой сам реакционный флакон содержит требуемый объем конъюгированного антитела (т.е. 1 или 1,5 мл для 111In и 90Y соответственно). Антитело может поставляться в буфере, который обеспечивает значение рН, подходящее для радиоактивного мечения, в соответствии с конкретным необходимым изотопом (т.е. рН 3-6 для 111In, рН 3-5 для 90Y). Можно использовать различные буферы в зависимости от изотопа (т.е. ацетат натрия для 90Y, цитрат натрия для 111In). рН и состав буфера могут также варьироваться в зависимости от природы связываемого лиганда, который нужно метить (а именно, при мечении пептидов можно позволить использовать рН<3). По существу далее изотоп должен быть перенесен непосредственно в реакционный флакон так же, как буфер композиции. Ограничение до двух этапов переноса при применении набора дополнительно увеличило бы воспроизводимость и простоту, и дополнительно уменьшило бы возможность загрязнения стерильности во время манипуляции с компонентами набора.
Наборы для радиоактивного мечения согласно данному изобретению могут дополнительно содержать флакон радиоизотопа, или радиоизотоп можно заказать отдельно у подходящего поставщика. Предпочтительными радиоизотопами согласно данному изобретению являются хлорид 111In и хлорид 90Y в НСl, хотя заявленные способы не ограничены данными изотопами. В данной области известны другие радионуклиды, которые использовались для применений с целью визуализации, а именно как описано в патентах США №4634586, 5460785 и 5766571, которые включены здесь в виде ссылки. Индий-111 обладает особыми преимуществами при визуализации В-клеточных опухолей, а источники бета-излучения, такие как 90Y особенно пригодны в качестве радиотерапевтических средств. Хотя для конъюгации с антителами, в зависимости от используемого хелатирующего агента, можно использовать и другие радиоизотопы, пригодные для этих и других целей, а именно источники альфа-излучения.
При условии доказанной эффективности комбинированных терапевтических схем, раскрытых в заявке на патент США, имеющей номер регистрации 08/475813, следующий вариант набора будет также включать в себя отдельный флакон химерного антитела, т.е. Rituxan®, чтобы вводить перед или после радиоактивно меченного анти-СD20-антитела. В том случае, когда химерное антитело вводят до радиоактивно меченного антитела, НАМА-ответ, который может, как правило, иметь место в ответ на введение мышиного анти-СD20-антитела, может быть значительно снижен, тем самым, увеличивая терапевтическую эффективность радиоактивно меченных мышиных антител. Кроме того, в том случае, когда для того, чтобы очистить циркулирующие В-клетки применяют химерное анти-СD20, последующие диагностические изображения, достигнутые с помощью антител, меченных 111In, могут быть гораздо более чистыми.
Также должно быть очевидным, что как диагностическое радиоактивно меченное антитело, так и терапевтическое радиоактивно меченное антитело можно использовать вместе по схеме комбинированной терапии. В этом отношении диагностическое антитело можно использовать либо до, либо после терапевтического антитела, чтобы визуализировать размер опухоли до или после лечения. В таком случае набор согласно данному изобретению может включать в себя отдельные, возможно, с цветным кодом, флаконы с буфером, специально приготовленным в соответствии с требованиями оптимального рН для антител, радиоактивно меченных конкретными радиоизотопами, которые надо использовать. Такая система будет давать уверенность в том, что для каждой метки использовали соответствующий буфер, и будет обеспечивать клиницистам такую же простоту радиоактивного мечения двух антител, как в случае, если были бы приобретены два набора. Такой набор в действительности объединяет компоненты из двух наборов для радиоактивного мечения в один.
Компоненты набора для радиоактивного мечения согласно данному изобретению поставляют при соответствующей концентрации и значении рН, так что стерильность легко сохраняется до введения антитела, и невелика потребность в дополнительных буферах или средах. Однако специалистам в данной области должно быть ясно, что некоторые реагенты можно готовить, стерилизовать и тестировать на стерильность на месте. Таким образом, предвидятся вариации набора согласно изобретению в зависимости от бюджета и предпочтений потребителя.
Набор для радиоактивного мечения согласно данному изобретению можно использовать в способе радиоактивного мечения антитела, конъюгированного с хелатирующим агентом, для введения пациенту. Согласно данному изобретению такой способ, в общем, включает в себя: (i) смешивание антитела, конъюгированного с хелатирующим агентом, с раствором, содержащим радиоизотоп; (ii) инкубирование смеси соответствующее количество времени при соответствующей температуре; и (iii) разведение меченного антитела до соответствующей концентрации в буфере композиции так, чтобы радиоактивно меченное антитело можно было ввести непосредственно пациенту без дополнительной очистки.
Наиболее предпочтительным антителом является анти-СD20-антитело, и, в частности, анти-СD20 антителом может быть 2В8. Антитело можно конъюгировать с любым подходящим хелатирующим агентом, а именно MX-DTPA, CHX-DTPA, фенил- или бензил-DTPA, DOTA, производными EDTA и т.д. Предпочтителен MX-DTPA. Способы, предназначенные для конъюгации антител, известны в данной области (Kozak et al. (1989); Mirzadeh et al. (1990), Brachbiel et al. (1986)).
Авторы данного изобретения обнаружили, что способ радиоактивного мечения конъюгированного с хелатирующим агентом антитела работает лучше там, где раствор, содержащий радиоактивную метку, перед его смешиванием с антителом, конъюгированным с хелатирующим агентом, доводят до значения рН примерно от 3,0 до 6,0, и более предпочтительно примерно до 4,2. Для доведения рН особенно предпочтительным является ацетат натрия с низким содержанием металлов, хотя можно использовать другие буферы. Предпочтительно ацетат натрия имеет концентрацию примерно между 10 и 1000 мМ и более предпочтительно 50 мМ.
В том случае, когда радиоизотоп представляет собой хлорид 111In, объем хлорида 111In, который следует использовать во время мечения для приготовления однократно вводимой дозы, обычно составляет примерно 5,5 мКюри, деленных на концентрацию радиоактивности. Для введения пациенту обычная диагностическая доза 111In составляет примерно от 2 до 10 мКюри. Количество ацетата натрия, используемого для доведения значения рН, варьируется в зависимости от концентрации ацетата натрия и раствора носителя изотопа, и поэтому может быть довольно широким. Когда концентрация ацетата натрия равна 50 мМ, количество, необходимое для доведения рН, обычно составляет примерно 1,2 используемого объемного количества хлорида 111In, хотя можно использовать и большие объемы. Следует принимать во внимание, что отношение ацетата натрия к НСl является важным, и количество используемого ацетата натрия будет изменяться в зависимости от количества и концентрации НСl в буфере. Затем примерно 1 мл антитела, конъюгированного с хелатирующим агентом, в концентрации примерно 2 мг/мл смешивают с ацетатным раствором радиоактивной метки, и смесь инкубируют примерно в течение 30 минут, или в течение времени, достаточного для того, чтобы достичь оптимального мечения антитела. Такое время может быть в пределах примерно от 30 секунд до 60 минут. Затем добавляют буфер композиции в количестве, необходимом для того, чтобы достичь общего конечного объема, примерно равного 10 мл.
Оптимальное время, необходимое для мечения антитела, может варьировать в зависимости от антитела, конкретной используемой радиоактивной метки и конкретного используемого конъюгата. Основным фактором оптимизации времени, отводимого для радиоактивного мечения, является отношение хелатирующего агента к антителу того реагента, который должен быть мечен. Например, отношение хелатирующего агента к антителу должно быть достаточно высоким, чтобы достичь терапевтически приемлемого уровня включения, т.е. от 90 до 95%, в зависимости от радиоизотопа, но также не должно быть слишком высоким, таким чтобы подвергать риску структурную целостность или иммунореактивность антитела. Это требует способа определенного балансирования, которое в некоторых случаях может приводить к более низкому уровню конъюгированного хелатирующего агента и более продолжительному времени мечения.
Например, для 2В8 и MX-DTPA обнаружено, что мечение можно выполнять за пять минут для 90Y и примерно в течение тридцати минут для 111In, чтобы достичь желаемого уровня включения радиоактивности, только при молярном отношении хелатирующего агента к антителу, равном примерно от  до 1. Поэтому не было необходимости увеличивать отношение хелатирующего агента к антителу, поскольку достигали желаемого уровня включения радиоактивности. Кроме того, не выгодно было увеличивать количество конъюгированного хелатирующего агента, поскольку это могло повлиять на иммунореактивность антитела. Указанные параметры можно определить эмпирически для других антител для разработки таких наборов, как наборы, описанные в данном изобретении.
до 1. Поэтому не было необходимости увеличивать отношение хелатирующего агента к антителу, поскольку достигали желаемого уровня включения радиоактивности. Кроме того, не выгодно было увеличивать количество конъюгированного хелатирующего агента, поскольку это могло повлиять на иммунореактивность антитела. Указанные параметры можно определить эмпирически для других антител для разработки таких наборов, как наборы, описанные в данном изобретении.
В том случае, когда радиоизотоп представляет собой хлорид 90Y, объем хлорида 90Y, используемого во время мечения для получения однократно вводимой дозы, обычно заключенной в пределах примерно от 10 до 50 мКюри, и предпочтительно составляет примерно 45 мКюри, деленных на концентрацию радиоактивности. Количество ацетата натрия, используемого для доведения значения рН, варьируется в зависимости от концентрации ацетата натрия и раствора носителя изотопа и поэтому может быть довольно широким. Когда концентрация ацетата натрия равна 50 мМ и 90Y поставляют в 50 мМ НСl, количество, необходимое для доведения рН, обычно составляет примерно 1,2 используемого объемного количества хлорида 90Y. Затем 1,5 мл антитела, конъюгированного с хелатирующим агентом, в концентрации примерно 2 мг/мл смешивают с ацетатным раствором радиоактивной метки и инкубируют примерно 5 минут, или в течение времени, достаточного для того, чтобы достичь оптимального мечения антитела. Такое время может быть в пределах примерно от 30 секунд до 60 минут. Буфер композиции добавляют в количестве, необходимом для того, чтобы достичь общего конечного объема, примерно равного 10 мл.
Предпочтительно способ радиоактивного мечения согласно изобретению выполняют, используя описанный здесь набор для радиоактивного мечения. Однако специалистам в данной области должно быть ясно, что предпочтительные компоненты и условия являются только допустимым руководством для практического применения способа согласно изобретению, и могут быть до некоторой степени изменены при соответствующей оптимизации. Условия, которые отклоняются от предпочтительных условий, но еще выполняют цели способа, рассматриваются в рамках изобретения.
Набор для радиоактивного мечения согласно данному изобретению может также поставляться с реагентами, пригодными для удобной проверки аффинности связывания антитела после радиоактивного мечения. В таком случае набор согласно изобретению можно также использовать для определения процента связывания радиоактивно меченного антитела с его клеткой-мишенью перед введением антитела пациенту. Авторы данного изобретения также обнаружили, что заявленный конкретный набор для анализа связывания может подходить для тестирования аффинности любого антитела, для которого вообще нет очищенного антигена. Соответственно компоненты для анализа связывания также могут продаваться в виде отдельного набора.
Вообще набор для анализа связывания и радиоактивного мечения включает в себя (i) по меньшей мере один флакон лиофилизированных клеток, которые экспрессируют антиген, который узнается антителом, входящим в набор; (ii) флакон, содержащий антитело, конъюгированное с хелатирующим агентом; (iii) флакон, содержащий буфер композиции, и (iv) инструкции по радиоактивному мечению антитела так, чтобы радиоактивно меченное антитело можно было вводить непосредственно пациенту без необходимости в последующей очистке. Как описано выше в отношении набора для радиоактивного мечения, данный набор также может включать в себя флакон, содержащий буфер для доведения значения рН радиоизотопа и стерильный стеклянный реакционный флакон. Предпочтительно буфер представляет собой раствор ацетата натрия в концентрации примерно от 10 до 1000 мМ с низким содержанием металлов, и стеклянный реакционный флакон вмещает объем по меньшей мере 5 мл. Антителом предпочтительно является анти-СD20-антитело, и хелатирующим агентом предпочтительно является MX-DTPA. Как описано ранее, можно использовать другие хелатирующие агенты. Предпочтительным конъюгированным антителом является 2В8-МХ-DTPA, хотя можно метить любые конъюгированные с хелатирующим агентом антитела и оценивать их аффинность. Буфером для приготовления композиции является забуференный фосфатами раствор соли, содержащий радиопротектор и неконъюгированный хелатирующий агент, как описано выше, и может быть включен или не включен радиоизотоп, и предпочтительно он представляет собой хлорид 111In или хлорид 90Y. Можно использовать другие радиоизотопы, в зависимости от хелатирующего агента.
Различие между набором для анализа связывания/радиоактивного мечения и набором для радиоактивного мечения, описанными выше, состоит в добавлении антиген-позитивных клеток, служащих субстратной мишенью, для тестирования аффинности антител. В том случае, когда антигеном является CD20, предпочтительными СD20-позитивными клетками являются SB-клетки (ATCC#CCL 120), но можно использовать любые CD20-позитивные клетки. Набор для анализа связывания и радиоактивного мечения может дополнительно включать антиген-негативные клетки, используемые в качестве негативного контроля. Предпочтительными CD20-негативными клетками являются клетки HSB (ATCC#CCL 120.1), но можно использовать любые СD20-негативные клетки.
Конечно, комбинированный набор для радиоактивного мечения и анализа связывания может, кроме того, включать в себя флакон с химерным анти-СD20-антителом в дополнение к антителу, которое необходимо метить, в целях назначения схемы комбинированной терапии, или для очистки периферических В-клеток перед диагностической визуализаций. Таким специальным антителом предпочтительно является Rituxan®, но также может быть любое антитело, для которого показано, что оно обеспечивает гибель опухолевых клеток. Фактически два различных типа антител могут быть объединены в один набор, т.е. антитела, направленные на два различных антигена В-клеток, при условии, что схема комбинированной терапии служит для того, чтобы иметь целью один и тот же тип клетки, а именно В-клеточную лимфому.
Так же, как компоненты набора могут быть использованы для мечения других антител, могут быть приготовлены другие клетки для тестирования аффинности антител в зависимости от антигена-мишени. Однако для анти-СD20-антител, для коммерческих условий особенно подходит набор для анализа связывания и радиоактивного мечения согласно данному изобретению, в котором клетки-мишени предоставлены в лиофилизированной форме. Это позволяет просто и систематически проводить проверку эффективности антител, и обойти трудности и издержки, которые влечет за собой поддержание условий для культур клеток. Лиофилизированные клетки обычно поставляют в аликвотах от 0,5 до 500×106 клеток на флакон, согласно способам изобретения.
Возможно, что в конкретных условиях будет предпочтительно назначать антитело, которое уже было радиоактивно помечено, и в случае такой возможности могут быть желательны реагенты для анализа связывания, чтобы убедиться в том, что антитела сохраняют сродство к мишени. В этом случае данное изобретение также предоставляет набор для анализа связывания для определения процента связывания радиоактивно меченных антител с его клеткой-мишенью. Такой набор включает в себя по меньшей мере один флакон фиксированных и/или лиофилизированных антиген-позитивных клеток, и может необязательно содержать антиген-негативные клетки, как описано выше для набора для анализа связывания и радиоактивного мечения. Кроме того, должно быть очевидным, что варианты такого набора могут включать в себя немеченое контрольное антитело для проверки специфичности связывания антитела потребителя посредством конкурентного анализа.
Кроме того, когда антиген представлен CD20, CD20-позитивными клетками предпочтительно являются клетки SB (ATCC#CCL 120) и СD20-негативными клетками предпочтительно являются клетки HSB (АТСС#ССL 120.1), которые поставляются в лиофилизированной форме в аликвотах от 0,5 до 50×106 клеток. В этом случае антителом предпочтительно является конъюгат 2В8 с MX-DTPA, меченный 111In или 90Y.
Имея в виду дополнительные варианты набора, заявленные в данной работе, следует сделать акцент на том, что преимущества набора для радиоактивного мечения и способа согласно данному изобретению состоят в том, что не требуется дополнительный этап очистки, и радиоактивно меченное антитело может быть непосредственно введено пациенту, тем самым, сберегая драгоценное время и увеличивая стабильность антител. Поэтому подчеркивается, что хотя тестирование или проверка специфичности связывания и аффинности радиоактивно меченного антитела перед введением может быть желательной для клинициста, от такого теста можно отказаться в случаях с отдельными радиоизотопами, если стабильность антитела и ингибирование радиолиза являются предметом особого беспокойства, т.е. как в случае с иттрием. Предоставляя варианты набора, посредством которых можно тестировать аффинность и специфичность связывания, авторы данного изобретения никак не высказывают мнение, что такие тесты абсолютно необходимы в способах или наборах согласно изобретению. Выбор тестировать ли такую пригодность антител является исключительно выбором клинициста.
Авторы данного изобретения также обнаружили, что способ, используемый для приготовления фиксированных и лиофилизированных клеток для наборов для анализа связывания согласно данному изобретению, очень подходит для приготовления клеток для коммерческих наборов. Клетки можно фиксировать перед лиофилизацией, чтобы улучшить структуру/повысить стабильность. В частности, на клетках, приготовленных согласно данному изобретению, показана высокая воспроизводимость при использовании для анализа связывания антител.
В частности, данное изобретение включает в себя способ приготовления лиофилизированных клеток, включающий в себя (i) сбор клеток при плотности клеток от 0,5 до 2×106 клеток в мл посредством центрифугирования; (ii) промывку клеток по меньшей мере один раз в сбалансированном растворе соли, т.е. HBSS; (iii) ресуспендирование осажденных клеток в буфере для лиофилизации, содержащем сбалансированный раствор соли, который содержит белок-носитель и по меньшей мере один тип сахара; (iv) распределение аликвот ресуспендированных клеток в микроцентрифужные пробирки или стеклянные флаконы; и (v) лиофилизацию клеток 12-96 час или более предпочтительно 24-72 час примерно при 30-60 миллитор. Способ, в частности, пригоден для получения лиофилизированных клеток, где указанными клетками являются клетки SB (ATCC#CCL 120) или клетки HSB (ATCC#CCL 120.1), но вероятно также подходит для других типов клеток.
Предпочтительно буфер, как правило, содержит бычий сывороточный альбумин в качестве белка-носителя в концентрации 1% (мас./об.) и маннит в концентрации 10%. Однако, по-видимому, можно использовать другие белки-носители, а именно ЧСА, и другие сахара. Клетки собирают центрифугированием при скорости примерно 1300 об/мин, и добавляют солевой раствор HBSS (сбалансированный солевой раствор Хенкса). Клетки обычно ресуспендируют в концентрации 50×106 клеток в мл. Однако специалистам в данной области должно быть ясно, что указанные выше условия можно немного модифицировать, не подвергая существенному риску жизнеспособность клеток. Кроме того, указанные выше условия могут быть пополнены дополнительными процедурами, предназначенными для того, чтобы оптимизировать процесс для больших количеств клеток, например, тангенциальной проточной диафильграцией, чтобы сменить раствор, в котором находятся клетки, на буфер для лиофилизации.
Наборы для анализа связывания согласно данному изобретению можно использовать при анализе для оценки аффинности связывания радиоактивного антитела. Такой анализ также является предметом данного изобретения. Анализ связывания для определения процента связывания радиоактивного антитела с его клеткой-мишенью, как правило, включает в себя следующие этапы: (i) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела по меньшей мере с одной аликвотой антиген-позитивных клеток; (ii) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела, идентичной аликвоте на этапе (i) по меньшей мере с одной аликвотой буфера для разведения такого же объема, как аликвота антиген-позитивных клеток на этапе (i), в качестве контроля; (iii) осаждение клеток центрифугированием; (iv) измерение радиоактивности в надосадке осажденных клеток и контроле; и (v) сравнение количества радиоактивности в надосадке клеток с количеством радиоактивности в контроле.
Так же, как и наборы для радиоактивного мечения согласно данному изобретению необязательно содержат хлорид 111In или хлорид 90Y, анализ связывания согласно данному изобретению обычно выполняют с помощью антител, меченных 111In или 90Y. В том случае, когда радиоактивной меткой является 111In, радиоактивность в анализируемых пробирках измеряют, используя гамма-счетчик. В том случае, когда радиоактивной меткой является 90Y, радиоактивность в анализируемых пробирках измеряют, используя сцинтилляционный счетчик, хотя можно использовать гамма-счетчик.
При анализе связывания согласно данному изобретению предпочтительным антителом является анти-СD20-антитело, и анти-СD20-антителом предпочтительно является 2В8, при этом 2В8-антитело метят, используя набор для радиоактивного мечения согласно данному изобретению. Однако можно тестировать любое радиоактивно меченное антитело, при условии, что имеются клетки, экспрессирующие конкретный антиген. В том случае, когда антигеном является CD20, предпочтительными клетками для выполнения анализа являются клетки SB (ATCC#CCL 120), однако анализ также можно оптимизировать и выполнять с любым радиоактивно меченным антителом и соответствующей клеткой-мишенью.
Буфер для разведения, используемый для анализа, должен поддерживать связывание антитела, т.е. физиологический буфер, возможно содержащий белок-носитель, например БСА, чтобы минимизировать неспецифичное связывание с клетками. Хотя в качестве контроля служит пробирка с буфером для разведения, в анализ может быть включен дополнительный контроль с использованием антиген-негативных клеток. В этом случае анализ связывания дополнительно включает в себя следующие этапы: (i) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела по меньшей мере с одной аликвотой антиген-негативных клеток; (ii) осаждение антиген-негативных клеток центрифугированием; (iv) измерение радиоактивности в надосадке осажденных антиген-негативных клеток; и (v) сравнение количества радиоактивности в надосадке антиген-негативных клеток с количеством радиоактивности в надосадке антиген-позитивных клеток и в контроле. Сравнение радиоактивности, полученной в этой пробирке, с контролем в виде буфера для разведения будет служить мерой количества неспецифичного связывания с антиген-позитивными клетками. Когда антигеном является CD20, CD20-позитивными клетками являются клетки SB, СD20-негативными клетками предпочтительно являются клетки HSB (ATCC#CCL 120.1).
Как описано выше, лиофилизированные клетки согласно данному изобретению представляют собой простой, эффективный и воспроизводимый стандарт для тестирования эффективности связывания радиоактивно меченного антитела. Поэтому анализ связывания согласно данному изобретению предпочтительно выполняют, используя лиофилизированные клетки, включенные в наборы для анализа связывания согласно данному изобретению. Кроме того, анализы радиоактивного мечения согласно данному изобретению можно комбинировать с анализом связывания согласно данному изобретению, при этом антитело сначала метят способом мечения антитела, конъюгированного с хелатирующим агентом, как описано в данном изобретении. Наиболее предпочтительно анализ связывания согласно данному изобретению выполняют, используя один набор для анализа связывания и радиоактивного мечения, который здесь описан.
Могут быть некоторые случаи, когда аффинность антитела необходимо тестировать или проверить, но радиоактивная метка еще не присоединена. Например, при некоторых обстоятельствах, а именно при поиске неполадок, может оказаться полезным тестирование аффинности связывания антитела перед радиоактивным мечением. Для такого случая данное изобретение также осуществляет анализ конкурентного связывания для оценки аффинности тестируемого антитела к клетке-мишени, включающий в себя (i) получение меченного рутением контрольного антитела, используя известное антитело, специфичное для того же самого антигена; (ii) инкубирование возрастающих количеств тестируемого антитела и возрастающих количеств немеченого контрольного антитела с клетками-мишенями в фиксированной концентрации, и очень малым количеством меченного рутением антитела, при этом каждая отдельная концентрация тестируемого антитела и каждая отдельная концентрация контрольного антитела находятся в отдельных пробирках, соответственно; (iii) определение количества связывания в каждой реакционной пробирке на основе относительной электрохемилюминесценции (ECL), используя аппаратуру ORIGEN; и (iv) расчет среднего значения аффинности тестируемого антитела. Среднее значение аффинности может быть рассчитано на основе значений ЕС 50 и известной концентрации антитела, добавленного в очень малом количестве, используя способ Мюллера (J. Immunological Methods (1980) 34: 345) или другой подходящий способ. Следует отметить, что данный анализ также можно использовать для того, чтобы тестировать аффинность радиоактивно меченных антител, или любого антитела, для которого нельзя очистить антиген и требуются клетки в качестве источника антигена. Фиксированные лиофилизированные клетки согласно данному изобретению можно использовать в качестве клеток-мишеней.
В том случае, когда анализ конкурентного связывания согласно данному изобретению выполняют для того, чтобы тестировать аффинность анти-СD20-антител, контрольным антителом может быть 2В8, или любое другое неконъюгированное анти-СD20-антитело. Контрольным антителом может быть антитело, конъюгированное с хелатирующим агентом. Тестируемым антителом также может быть контрольное антитело, конъюгированное с хелатирующим агентом. Альтернативно, тестируемым антителом может быть другое анти-СD20-антитело, аффинность связывания которого с CD20 по сравнению с 2В8 представляет интерес. Однако анализ можно адаптировать для применения к антителам, обладающим другой специфичностью, при условии, что имеются подходящие клетки-мишени.
При анализе конкурентного связывания согласно данному изобретению предпочтительными клетками-мишенями являются CD20-позитивные клетки, более предпочтительно клетки SB (ATCC#CCL 120), и более предпочтительно ресуспендированные лиофилизированные клетки SB, полученные согласно способу данного изобретения. Также можно использовать клетки, лиофилизированные с использованием других способов, или фиксированные клетки. Меченное рутением антитело обычно готовят способом, включающим в себя инкубирование контрольного антитела с хелатирующим агентом сложным эфиром N-гидроксисукцинимида и рутений(II)трис-бипиридина (TAG-NHS), хотя также предполагаются и другие известные способы мечения антител. Для мечения контрольное антитело и TAG-NHS предпочтительно инкубируют при молярном соотношении, примерно равном 1:15.
Указанные и другие аспекты данного изобретения станут несомненно понятными при обращении к следующим фигурам, примерам и описанию изобретения.
4. Краткое описание чертежей
Фигура 1. Иммунореактивность нативного 2В8 сравнивали с доступными из коммерческих источников анти-СD20-антителами В1 (Coulter) и Leu 16 (Becton Dickinson) при прямой конкуренции в радиоиммунном анализе, используя 125I-меченые В1. Антиген-позитивные клетки SB (100000) добавляли в каждую лунку планшета с фильтрами V&P; 10 нг радиоактивно меченого В1 смешивали с немеченым конкурентом в различных концентрациях, и смесь добавляли к клеткам. Антитела инкубировали с клетками в течение одного часа при температуре окружающей среды; определения выполняли в трех повторах. Затем лунки промывали, сушили и определяли связанную с фильтрами радиоактивность. Указанные данные корректировали относительно фоновой радиоактивности, и они представляют собой среднее из трех определений.
Фигура 2. Возрастающие количества неконъюгированного 2В8 анализировали на связывание с В-клетками человека (SB), используя FACS-анализ (анализ на клеточном сортере с возбуждением флуоресценции). Сравнивали с доступным из коммерческих источников анти-СD20-моноклональным антителом (В1) и с двумя антителами нерелевантных изотипов. ФИТЦ-меченый F(ab)’2 козы против IgG мыши использовали в качестве второго реагента. Результаты показывают, что 2В8 специфичен для СD20-антигена и что он проявляет связывание в большей степени, чем В1.
Фигура 3. В-клетки человека (SB) инкубировали с возрастающими количествами 125I-меченого 2В8. Образцы в трех повторах инкубировали в течение одного часа и связанную с клетками радиоактивность определяли после фильтрации для сбора клеток. Анализ Скатчарда позволил рассчитать константу кажущейся аффинности, равную 4,3×10-9 М.
Фигура 4. Иммунореактивность нативных 2В8, 2B8-MX-DTPA и В1. Антитело В1 радиоактивно метили, как описано в разделе “Способы”. Десять нанограмм радиоактивно меченного В1 смешивали с возрастающими концентрациями конкурента, и смесь добавляли в лунки планшетов с фильтрами V&P, содержащими 100000 антиген-позитивных клеток SB в каждой; все определения выполняли в трех повторах. После одного часа инкубации при температуре окружающей среды лунки обильно промывали. Затем фильтры сушили и связанную радиоактивность определяли на гамма-счетчике; все значения корректировали относительно фона. Показанные значения представляют собой среднее из определений в трех повторах.
Фигура 5. Антитело 2В8 было приготовлено в составе композиции в конечной концентрации 10 мг/мл в нормальном солевом растворе или нормальном солевом растворе, содержащем 10 мМ глицин-HCl, рН 6,8. Затем наборы образцов в двух повторах помещали во флаконы с закручивающейся крышкой, флаконы продували азотом и затем закрывали. Затем образцы инкубировали при 4°С или 30°С в течение 12 недель; иммунореактивность образцов оценивали еженедельно. Не наблюдали потери иммунореактивности любыми образцами 2В8 в течение 12-недельного исследования. Изображены иммунореактивности в 1 неделю (фиг.5А), 6 неделю (фиг.5В) и 12 неделю (фиг.5С).
Фигура 6. Анализ связывания для определения иммунореактивности 111In-меченого 2B8-MX-DTPA, инкубированного в PBS, рН 7,4, содержащем 50 мг/мл сывороточного альбумина человека (48 час инкубации). Фигура 6А: Постоянное количество радиоактивно меченного антитела (5 нг/мл) инкубировали с возрастающими объемами клеток SB (20×106 клеток/мл). Количество радиоактивности (имп/мин), связанной с клетками, откладывали против объема добавленной суспензии клеток. Фигура 6В: Откладывали суммарно внесенную радиоактивность, деленную на связанную радиоактивность (АТ/В). Линейная экстраполяция позволила рассчитать пересечение с осью у (0,997). Обратная величина у-пересечения × 100 давала значение иммунореактивности, равной 100%, при очень большом избытке антигена.
Фигура 7. Авторадиограмма, полученная для анализа методом SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 4°С в PBS, рН 7,4, содержащем 75 мг/мл сывороточного альбумина человека и 1 мМ DTPA. В указанное время образцы подвергали электрофорезу в 4-20% трис-глициновых гелях, используя невосстанавливающие условия, денатурирующие условия (SDS). Образцы наносили по 5 мкл (дорожки 1, 2), 10 мкл (дорожки 5, 6). Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и фотографировали.
Фигура 8. Денситометрическое сканирование авторадиограммы, соответствующей нулевой временной точке, полученной для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 4°С в PBS, рН 7,4, содержащем 75 мг/мл сывороточного альбумина человека и 1 мМ DTPA. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей, среды и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 96,2%.
Фигура 9. Денситометрическое сканирование авторадиограммы для 48 час, полученной для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 4°С в PBS, рН 7,4, содержащем 75 мг/мл сывороточного альбумина человека и 1 мМ DTPA. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 95,5%.
Фигура 10. Авторадиограмма, полученная для анализа в SDS-ПААГ 111In-мeчeнoгo 2B8-MX-DTPA, инкубированного при 4°С в PBS, рН 7,4, содержащем 50 мг/мл сывороточного альбумина человека. В указанное время образцы подвергали электрофорезу в 4-20% трис-глициновых гелях, используя не восстанавливающие условия. Образцы наносили по 5 мкл (дорожки 1, 2), 10 мкл (дорожки 3, 4) и 20 мкл (дорожки 5, 6). Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и фотографировали. (Примечание: авторадиограмму для 48 час получали, используя усиливающие экраны, приводящие в результате к более интенсивному сигналу по сравнению с авторадиограммой в нулевое время).
Фигура 11. Денситометрическое сканирование авторадиограммы, соответствующей нулевой временной точке, полученной для анализа в SDS-ПААГ 111In-меченого 2B8-MX-DTPA, инкубированного при 4°С в PBS, рН 7,4, содержащем 50 мг/мл сывороточного альбумина человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле при невосстанавливающих условиях. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№3) составляла 95,9%.
Фигура 12. Деиситометрическое сканирование авторадиограммы для 48 час, полученной для анализа в SDS-ПААГ 111In-меченого 2B8-MX-DTPA, инкубированного при 4°С в PBS, рН 7,4, содержащем 50 мг/мл сывороточного альбумина человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле при невосстанавливающих условиях. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и одну из дорожек сканировали, используя денситометр. Относительная площадь радиоактивно меченного конъюгата составляла 97,0% (объединенные площади пиков №2, 3 и 4).
Фигура 13. Авторадиограмма, полученная для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. В указанное время образцы подвергали электрофорезу в 4-20% трис-глициновых гелях, используя невосстанавливающие условия. Образцы наносили по 5 мкл (дорожки 1, 2), 10 мкл (дорожки 3, 4) и 20 мкл (дорожки 5, 6). Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и фотографировали.
Фигура 14. Денситометрическое сканирование авторадиограммы, соответствующей нулевой временной точке, полученной для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 97,9%.
Фигура 15. Денситометрическое сканирование авторадиограммы для 98 час, полученный для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 94,7%.
Фигура 16. Авторадиограмма, полученная для анализа в SDS-ПААГ 111In-меченого 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. В указанное время образцы подвергали электрофорезу в 4-20% трис-глициновых гелях, используя невосстанавливающие условия. Образцы наносили по 5 мкл (дорожки 1, 2), 10 мкл (дорожки 3, 4) и 20 мкл (дорожки 5, 6). Гели экспонировали с рентгеновской пленкой примерно в течение 16-20 час при температуре окружающей среды и фотографировали.
Фигура 17. Денситометрическое сканирование авторадиограммы, соответствующей нулевой временной точке, полученной для анализа в SDS-ПААГ 111In-меченого 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 16-20 час при температуре окружающей среды и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№3) составляла 95,3%.
Фигура 18. Денситометрическое сканирование авторадиограммы для 96 час, полученной для анализа в SDS-ПААГ 111In-меченого 2B8-MX-DTPA, инкубированного при 37° с в сыворотке человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 16-20 час при температуре окружающей среды и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№3) составляла 94,0%.
Фигура 19. Макакам-крабоедам делали внутривенные инъекции каждые 48 часов, всего семь инъекций; показаны введенные количества. Уровни циркулирующих – Т- и В-клеток определяли FACS-анализом, используя aнти-CD2 (Т-клетки), анти-Mo-IgG (2В8), анти-СD20 (Leu 16) и антитело против IgG человека (В-клетки). Не наблюдали влияния на уровни циркулирующих Т-клеток. (Животные группы V получали однократную дозу).
Фигура 20. Восстановление уровней циркулирующих В-клеток у животных, получавших 2В8, прослеженное посредством FACS-анализа с использованием флуоресцентно меченных антител, коротко описанных в описании фиг.19. За животными групп III и IV не следили, так как они были забиты на 13 день.
Фигура 21. Макакам-крабоедам внутривенно инъецировали 89Y-2B8-MX-DTPA, который был приготовлен с использованием клинически чистого 2B8-MX-DTPA. Животным вводили дозу каждые 48 часов в количествах, показанных выше, всего семь доз. В 0, 2, 7, 10 и 14 день у макак брали кровь и проводили химическую гематологическую оценку сыворотки и уровни циркулирующих В-клеток (на 10 день не анализировали содержание В-клеток в сыворотке). Кроме пониженного общего количества лимфоцитов у всех животных, за исключением одной особи в группе II, в ходе исследования значительных отклонений не отмечалось.
Фигура 22. Клиренс мышиного анти-СD20-антитела 2В8 у макак-крабоедов определяли посредством ELISA после однократной инъекции 10 мг/кг в нулевой день. Как показано на панели А, антитело проявляло значение β t1/2, равное примерно 4,5 дням. Клиренс 2В8-антитела и его конъюгата с MX-DTPA из циркуляции мышей BALB/c показан на панели В. Мышам внутривенно инъецировали 25 мкг нативного или конъюгированного 2В8 и отбирали образцы крови в разное время вплоть до 264 - часов после инъекции; затем анализировали сыворотку иммуноферментным анализом, используя клетки SB в качестве захватывающего агента. Как нативные, так и конъюгированные антитела показали значение клиренса, равное 8,75 дня.
Фигура 23. Каждой из двадцати мышей BALB/c инъецировали 1,1 мкКюри радиоактивно меченного конъюгата (100 мкл), приготовленного в PBS, рН 7,4, содержащем 50 мг/мл ЧСА. Группы по пять мышей в каждой забивали в 1, 24, 48 и 72 час, и затем готовили кровь и различные ткани и анализировали связанную радиоактивность.
Фигура 24. Каждой из двадцати мышей BALB/c внутривенно инъецировали примерно 1,0 мкКюри (в 100 мкл) радиоактивно меченного конъюгата, приготовленного в 1 × PBS, рН 7,4, содержащем 75 мг/мл сывороточного альбумина человека и 1 мМ MDPA. Группы по пять мышей в каждой забивали в 1, 24, 48 и 72 час, и затем готовили кровь и различные ткани и анализировали связанную радиоактивность.
Фигура 25. Бестимусным мышам, несущим В-клеточные опухоли Ramos, внутривенно инъецировали 24 мкКюри lllIn-2B8-MX-DTPA, и группы по три мыши в каждой забивали в 0, 24, 48 и 72 час. После подготовки ткани и определения связанной радиоактивности определяли значения процента инъецированной дозы на грамм ткани и откладывали, как показано.
Фигура 26. Анализ связывания для определения иммунореактивности 90Y-меченного способом "mix-and-shoot" 2B8-MX-DTPA, инкубированного в PBS, pH 7,4, содержащем 50-75 мг/мл сывороточного альбумина человека (48 час инкубации). Панель А: Постоянное количество 90Y-меченого антитела (примерно 1 нг/мл) инкубировали с возрастающими количествами клеток SB. Количество связанной с клетками радиоактивности (имп/мин) откладывали против концентрации клеток. Панель В: Откладывали общую внесенную 90Y-радиоактивность, деленную на связанную радиоактивность (АТ/В). Линейная экстраполяция позволила рассчитать пересечение с у (1,139). Обратная величина у-пересечения × 100 дала значение иммунореактивности, равное 87,9% при бесконечно большом избытке антигена. Не наблюдали связывания с CD20-негативными клетками (HSB).
Фигура 27. Авторадиограммы, полученные для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 4°С в PBS, pH 7,4, содержащем 75 мг/мл сывороточного альбумина человека и 1 мM DTPA. В указанное время образцы подвергали электрофорезу в 4-20% трис-глициновых гелях, используя невосстанавливающие условия, денатурирующие условия (SDS). Образцы наносили по 5 мкл (дорожки 1, 2), 10 мкл (дорожки 5, 6). Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и фотографировали.
Фигура 28. Денситометрическое сканирование авторадиограммы, соответствующей нулевой временной точке, полученной для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 4°C в PBS, рН 7,4, содержащем 75 мг/мл сывороточного альбумина человека 1 мМ DTPA. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды, и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 96,1%.
Фигура 29. Денситометрическое сканирование авторадиограммы для 48 час, полученной для анализа в SDS-ПААГ 90Y-меченого 2B8-MX-DTPA, инкубированного при 4°С в PBS, рН 7,4, содержащем 75 мг/мл сывороточного альбумина человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гель экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды, и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 94,1%.
Фигура 30. Авторадиограммы, полученные для анализа в SDS-ПААГ 90Y-меченного методом "mix-and-shoot" 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. В указанное время образцы подвергали электрофорезу в 4-20% трис-глициновых гелях, используя невосстанавливающие условия. Образцы наносили по 5 мкл (дорожки 1, 2), 10 мкл (дорожки 3, 4) и 20 мкл (дорожки 5, 6). Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды и фотографировали.
Фигура 31. Денситометрическое сканирование авторадиограммы, соответствующей нулевой временной точке, полученной для анализа в SDS-ПААГ 90Y-меченного методом "mix-and-shoot" 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды, и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 89,1%.
Фигура 32. Денситометрическое сканирование авторадиограммы для 72 час, полученной для анализа в SDS-ПААГ 90Y-меченного методом "mix-and-shoot" 2B8-MX-DTPA, инкубированного при 37°С в сыворотке человека. Образцы подвергали электрофорезу в 4-20% трис-глициновом геле, используя невосстанавливающие условия. Образцы наносили по 5 мкл, 10 мкл и 20 мкл в лунки по два повтора. Гели экспонировали с рентгеновской пленкой примерно в течение 15 мин при температуре окружающей среды, и одну из дорожек сканировали, используя денситометр. Относительная площадь пика радиоактивно меченного конъюгата (№2) составляла 88,8%.
Фигура 33. Каждой из двадцати мышей BALB/c внутривенно инъецировали 5 мкКюри 90Y-меченого 2B8-MX-DTPA, приготовленного в 1 × PBS, рН 7,4, содержащем 75 мг/мл сывороточного альбумина человека и 1 мМ DPA. Группы по пять мышей в каждой забивали в 1, 24, 48 и 72 час, и готовили их кровь и различные ткани, и анализировали связанную радиоактивность.
Фигура 34. Возрастающие количества меченого полученного из СНО антитела 2В8 инкубировали с фиксированной концентрацией свежесобранных СD20-позитивных В-клеток (SB) или СD20-негативных Т-клеток (HSB). Связывание антитела с клетками количественно оценивали FACS-анализом, используя ФИТЦ-меченый F(ab)’2 козы против IgG мыши, как здесь описано. Сравнение проводили с антителом нерелевантного изотипа (S004). Только полученное из СНО антитело 2В8 показывало заметное связывание с CD20-позитивными клетками SB.
Фигура 35. Иммунореактивность полученного из СНО 2В8 сравнивали с родительским антителом 2В8-49, полученным в линии клеток гибридом, посредством прямой конкуренции при анализе ORIGEN. Возрастающие количества антитела инкубировали с фиксированной концентрацией CD20-позитивных В-клеток (SB) и следовым количеством меченного рутением СНО-2В8. После инкубации в течение трех часов при температуре окружающей среды определяли связывание, выраженное в виде относительной электрохемилюминесценции (ECL), используя оборудование ORIGEN, как описано в “Материалах и способах”. Значения представляют собой средние из определений в двух повторах. Рассчитали средние константы аффинности для СНО-2В8 и 2В8-49, равные 1,3×10-10 М и 2,5×10-10 М соответственно. Для сравнения включали антитело нерелевантного изотипа (S004).
Фигура 36. Связывание конъюгатов 2B8-MX-DTPA, приготовленных на основе полученного из СНО 2В8, сравнивали с неконъюгированным антителом посредством прямой конкуренции при анализе ORIGEN. Конъюгаты готовили посредством инкубации 2В8 с MX-DTPA в течение 8, 17 и 24 час перед удалением не прореагировавшего хелатирующего агента. Для оценки связывания антитела инкубировали с фиксированной концентрацией CD20-позитивных В-клеток (SB) и следовым количеством меченного рутением СНО-2В8. После инкубации в течение трех часов при температуре окружающей среды определяли связывание, выраженное в виде относительной электрохемилюминесценции (ECL), используя оборудование ORIGEN, как описано в “Материалах и способах”. Значения представляют собой средние из определений в двух повторах. Препараты конъюгатов показывали сходное связывание при сравнении с неконъюгированным антителом 2В8.
Фигура 37. А) Клетки SB промывали и ресуспендиррвали до 90×106 клеток/мл в буфере для разведения (1 x PBS, рН 7,4, содержащий 1% (маc./об.) бычьего сывороточного альбумина). Клетки в возрастающих концентрациях инкубировали в течение 3 час с 7,5 нг/мл In2В8, полученного с использованием 2В8-МХ-DTPA партии 0165А. В) График с обратными величинами по обеим осям концентрации клеток против связанной радиоактивности/общую радиоактивность (В/АТ). Иммунореактивность рассчитывали в виде 1/пересечение с осью у х 100. Значения иммунореактивности и коэффициента корреляции (R) составили 80,6% и 0,981 соответственно.
Фигура 38. А) Клетки SB промывали и ресуспендировали до 90×106 клеток/мл в буфере для разведения (1х PBS, рН 7,4, содержащий 1% (маc./об.) бычьего сывороточного альбумина). Клетки в возрастающих концентрациях инкубировали в течение 3 час с 2 нг/мл Y2B8, полученного с использованием 2В8-МХ-DTPA партии 0165А. В) График с обратными величинами по обеим осям концентрации клеток против связанной радиоактивности/общую радиоактивность (В/АТ). Иммунореактивность рассчитывали в виде 1/пересечение с осью у × 100. Значения иммунореактивности и коэффициента корреляции (R) составили 72,2% и 0,999 соответственно.
5. Детальное описание изобретения
Определения
Если не оговорено особо, все используемые здесь технические и научные термины имеют те же самые значения, как и значения, которые обычно имеет в виду специалист в данной области, к которому данное изобретение имеет отношение. Хотя любые способы и материалы, сходные или эквивалентные описанным здесь способам и материалам, можно использовать в практике или тестировании согласно данному изобретению, описаны предпочтительные способы и материалы. В целях данного изобретения ниже даются определения следующих терминов:
c низким содержанием металлов - относится к реагентам, обработанным для того, чтобы уменьшить загрязнение металлами до уровня, который не влияет на включение радиоактивности;
антиген-позитивная - означает, что экспрессирует антиген, который узнается конкретным антителом согласно изобретению, и таким образом, это антитело способно связываться;
% включения радиоактивности - относится к количеству радиоактивной метки из реакционной смеси при радиоактивном мечении, которая конъюгирована с антителом, относительно общего количества радиоактивной метки, исходно добавленной к реакционной смеси;
% связывания - относится к количеству антитела из образца, которое специфично или неспецифично связывается с антигеном-мишенью;
% иммунореактивности или специфичности связывания относится к количеству образца антитела, которое специфично связывается с антигеном-мишенью;
диагностическое антитело - относится к антителу, конъюгированному с радиоактивной меткой, такой как 111I, которое может осуществлять диагностическую визуализацию опухолей и антиген-позитивных клеток.
терапевтическое антитело - относится к антителу, конъюгированному с радиоактивной меткой, испускающей альфа- или бета-излучение (такой как 90Y), которая может осуществлять уничтожение клеток в том случае, когда она связана с антигеном-мишенью.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Доклиническая разработка мышиного моноклонального анти-СD20-антитела 2В8, конъюгированного 2В8, 111In-и 90Y-меченого 2В8
I. Материалы и способы разработки мышиного моноклонального анти-СD20-антитела 2В8, конъюгата 2B8-MX-DTPA, 111In-меченого 2B8-MX-DTPA и очищенного посредством ВЭЖХ 90Y-MX-DTPA
А. Материалы
1. Клетки
Линии клеток человека SB и HSB получали из Американской коллекции типов культур (American Type Culture Collection) и культивировали в RPMI-1640, содержащей 10% фетальной сыворотки теленка. Линия СD20-позитивных клеток SB представляет собой линию В-лимфобластных клеток, полученных из светлого слоя кровяного сгустка периферической крови пациента с острым лимфобластным лейкозом (1). Линия антиген-негативных клеток HSB представляет собой линию Т-лимфобластных клеток, полученных из опухолей, индуцированных у новорожденных сирийских хомячков (2). Линию клеток миеломы мышей SP2/0 сходным образом поддерживали в RPMI-1640, содержащей 10% фетальной сыворотки теленка.
2. Антитела
Анти-СD20-антитела В1 и Leu 16 приобретали из Coulter Immunology и Becton/Dickinson соответственно. 125I-меченые антитела козы против IgG мыши и антитела козы против IgG человека получали из ICN. F(ab)’2 козы против IgG мыши получали из Cappel.
3. Реагенты
Полный и неполный адъюванты Фрейнда приобретали из Sigma Chemical Company. Полиэтиленгликоль, концентрат HAT и концентрат НТ - все это получали от Boehringer Mannheim. Флуоресцеинизотиоцианат (ФИТЦ) приобретали от Sigma Chemical Company. Хлорид индия-[111] и хлорид 90Y получали из Amersham или NEN Dupont. Хлорид иттрия-[89] приобретали из Aldrich Chemical Company. Все другие реагенты получали из стандартных источников.
Реактивы, используемые для протоколов конъюгации и радиоактивного мечения, обрабатывали для того, чтобы удалить загрязняющие ионы тяжелых металлов, которые могут конкурировать с радиоизотопами во время этапа радиоактивного мечения. Реактивы обычно обрабатывали пропусканием растворов через колонку с ионообменной смолой Chelex 100 или обрабатывая партии добавлением Chelex к приготавливаемому раствору. Для всех препаратов и разведений использовали воду с низким содержанием металлов, либо очищенную на Milli-Q, либо воду для промывания (WFIr). Растворы, не содержащие металлов, стерильно фильтровали и собирали в стерильные пластиковые сосуды.
В. Способы
1. Получение и скрининг 2В8 в надосадках гибридом посредством РИА
Десять мышей BALB/c иммунизировали 20 миллионами клеток SB, суспендированными в PBS, содержащем полный адъювант Фрейнда. Клетки инъецировали животным как п/к, так и в/б в нескольких местах. После 2-недельного периода покоя мышам второй раз инъецировали клетки SB, эмульгированные в неполном адъюванте Фрейнда. Последующие реиммунизации проводили по недельному графику клетками SB, суспендированными в PBS. Мышей иммунизировали в течение периода от 6 недель до 4 месяцев.
Двух животных в каждой временной точке забивали смещением шейных позвонков, и извлекали их селезенки для слияния с миеломой мышей SP2/0. Животных выбирали на основании способности сыворотки после иммунизации эффективно ингибировать связывание радиоактивно меченного анти-СВ20-антитела Coulter B1 с клетками человека SB. За три дня до каждого слияния отобранные животные получали одну последнюю внутривенную (в хвостовую вену) инъекцию 20 миллионов клеток SB в PBS. После забивания извлекали селезенки в стерильных условиях, и спленоциты сливали с клетками SP2/0 в соотношении 5:1 (спленоциты: SР2/0). Слившиеся клетки промывали, в среде для культуры ткани и распределяли в 96-луночных планшетах, содержащих селективную среду HAT. Проводили скрининг гибридом радиоиммунным анализом ингибирования с использованием антитела Coulter B1 спустя 10-14 дней.
Скрининг гибридов, секретирующих анти-СD20-антитело, выполняли, используя принятые способы радиоммуноанализа. Коротко, анти-СD20-антитело Coulter B1 очищали аффинной хроматографией с белком А. Пятьдесят микрограмм очищенного антитела связывали с 12SI кратковременным окислением в присутствии йодных шариков-(Pierce Chemical Co.), следуя процедуре производителя. Радиоактивно меченное антитело обессоливали на амберлитовой смоле и хранили в буфере для разведения (PBS, рН 7,4, содержащий 0,2% желатина, 0,02% азида натрия и 1,0% БСА). Десять нанограмм радиоактивно меченного антитела помещали в каждую лунку предварительно блокированного планшета для анализа на фильтрах (блокирующий буфер: буфер для разведения, содержащий 10% FBS) вместе с 50 мкл надосадка гибридом из тестируемых лунок и 100000 клеток SB, суспендированных в 50 мкл буфера для разведения. Суспензию инкубировали в течение одного часа при температуре окружающей среды. Планшеты тщательно промывали промывочным буфером (PBS, рН 7,4, содержащий 0,2% желатина и 0,02% азида натрия) на вакуумном коллекторе V&P Scientific и лежащие на дне фильтры, содержащие задержанные клетки SB, переносили в гамма-счетчик. Лунки, содержащие только среду НАТ и меченое антитело В1, использовали в качестве контролей фона, и идентичные лунки, содержащие клетки SB, использовали в качестве позитивного контроля. Контроли ингибирования содержали радиоактивно меченное антитело В1 и различные количества немеченого антитела В1 в пределах от 2 мкг до 2 нг.
2. Исследования проточной цитометрией
а. Линии клеток
Предварительные исследования проточной цитометрией проводили с надосадками культур гибридом 2В8. Сто микролитров надосадка гибридом инкубировали с клетками SB в течение одного часа при температуре окружающей среды; затем добавляли второе антитело (F(ab)’2 козы против IgG мыши; Cappel), используемое в разведении 1/400, и инкубацию продолжали в течение 1 часа в темноте. Клетки промывали 5 раз. Контроли включали в себя только клетки (без первого или второго антитела), для которых определяли автофлуоресценцию, клетки только со вторым антителом, чтобы определить неспецифичное связывание и доступный из коммерческих источников В1, конъюгированный с флуоресцеинизотиоцианатом (В1-ФИТЦ) для контроля СD20-популяции.
Для некоторых экспериментов флуоресцеин соединяли с очищенным антителом 2В8 посредством реакции аминогрупп с флуоресцеинизотиоцианатом (ФИТЦ). Коротко, антитело 2В8 (1,2 мг/мл) инкубировали в 0,1 М натрий-карбонатном буфере, рН 9,5, с 150-200 мкг ФИТЦ на мг белка. Раствор инкубировали при комнатной температуре в течение 2 часов, и полученный в результате конъюгат 2В8-ФИТЦ очищали на колонке с сефадексом G-25. Другие реагенты, используемые в этих исследованиях, такие как В1 и Leu 16, приобретали в виде конъюгатов с флуоресцеином непосредственно из Coulter или Becton Dickinson.
Клетки, которые предстояло анализировать, собирали и промывали три раза PBS, содержащим 0,2% БСА и 0,1% азида натрия. Жизнеспособность определяли посредством исключения трипановым синим при требуемой жизнеспособности >90%. Концентрации клеток доводили до 3 миллионов на мл при 50 мкл, добавляемых в лунку в 96-луночных планшетах с U-образным дном. В соответствующие лунки добавляли первое антитело (50 мкл), и смесь инкубировали от 30 мин до 1 час при температуре окружающей среды; затем клетки промывали 5 раз 200 мкл/лунку PBS, содержащего 0,2% БСА и 0,02% азида натрия. Клетки центрифугировали в планшетах при 1300 об/мин в течение 1 мин в центрифуге Sorvall, и надосадки удаляли осторожным “стряхиванием” планшетов. Добавляли при необходимости второе антитело и инкубировали еще от 30 мин до 1 час при температуре окружающей среды в темноте; затем лунки промывали, как описано выше. Наконец к каждому образцу добавляли 200 мкл фиксирующего буфера (0,15 М хлорид натрия, содержащий 1% параформальдегида, рН 7,4), и обработанные клетки переносили в пробирки 12×75 мм для анализа.
b. Цельная кровь макак-крабоедов
После удаления плазмы клетки дважды промывали центрифугированием и ресуспендировали в HBSS. Добавляли фетальную сыворотку теленка (2 мл), и клетки ресуспендировали. Затем сто микролитров ресуспендированных клеток распределяли по 6 коническим центрифужным пробиркам, объемом 15 мл. Флуоресцентно меченные моноклональные антитела добавляли следующим образом:
Пробирка №1: Мышиное анти-СD2-ФИТЦ (АМАС), 2,5 мкг/мл, 5 мкг;
Пробирка №2: ФИТЦ-антитело козы против IgM человека (Fisher), 2,5 мкг/мл, 5 мкг;
Пробирка №3: RPE-антитело козы против IgG мыши (Fisher), 2,5 мкг/мл, 5 мкг;
Пробирка №4: ФИТЦ-антитело козы против IgM человека + RPE-антитело козы против IgG мыши (абсорбированные), 2,5 мкг/мл, 5 мкг;
Пробирка №5: ФИТЦ-антитело против CD20 человека (анти-Leu 16, Becton Dickinson), 5 мкг;
Пробирка №6: Только клетки (автофлуоресценция).
Меченые антитела и клетки центрифугировали в течение 2 мин при 1500 об/мин, чтобы смешать клетки и антитела, и затем все 6 образцов помещали в лед и инкубировали в течение 30 мин. Затем пробирки извлекали изо льда и добавляли лизирующий буфер (предварительно нагретый до 37°С) до объема 12 мл. Затем образцы инкубировали в течение 15 минут при комнатной температуре, центрифугировали в течение 5 мин при 4°С при 1500 об/мин, и надосадки удаляли. Затем клетки дважды промывали в буфере для мечения (PBS, содержащий 1% БСА и 0,05% азида натрия).
Затем клетки фиксировали добавлением 0,5 мл фиксирующего буфера (0,15 М хлорид натрия, рН 7,4, содержащий 1% параформальдегид) на пробирку и анализировали на устройстве FACScan Becton Dickinson, используя автокомпенсацию и предварительную калибровку калибровочными шариками. Зеленую флуоресценцию флуоресцеина измеряли в режиме FL1, и красную флуоресценцию фикоэритрина измеряли в режиме FL2. Данные выражали в логарифмической форме. Вначале идентифицировали популяции жизнеспособных лимфоцитов на точечном графическом растровом изображении при сравнении прямого светорассеяния и светорассеяния под прямым углом. Затем выделяли общую популяцию лимфоцитов, не пропуская все другие события. Последующие измерения флуоресценции отражали только такие специфичные события, которые происходили в пределах пропущенной области.
Для фармакологических/токсикологических исследований высоких доз определяли уровни лимфоцитов перед исследованием для каждой макаки-крабоеда, и использовали в качестве базовых значений. Рассчитывали процент Т- и В-клеток и отношения Т:В, и использовали как контроли истощения популяций. Популяцию В-клеток перед исследованием подсчитывали с помощью Leu 16 и антитела против IgM человека.
После инъекции 2В8 обезьянам, когда СD20-антиген насыщали 2В8, процент В-клеток в общей популяции приблизительно оценивали, используя ФИТЦ-антитело козы против IgM человека, RPE-антитело против IgG мыши и популяцию с двойным окрашиванием, содержащую два указанных маркера. Популяцию с двойным окрашиванием использовали для количественной оценки до тех пор, все 2В8 не были выведены из периферической крови. Процент Т-клеток в общей популяции лимфоцитов оценивали, используя анти-СD2-ФИТЦ. Данные усредняли из трех определений, для каждого образца проводили измерения 10000 событий. Потом оценивали клетки из каждого указанного образца крови, подсчитывая в каждом случае Т- и В-клеточные субпопуляции в общей популяции лимфоцитов. Также оценивали соотношения Т:В. Истощение популяции В-клеток оценивали в виде процента снижения уровня В-клеток относительно исходных уровней В-клеток для каждой отдельной обезьяны.
3. Радиойодирование и иммунопреципитация CD20
Сто миллионов клеток SB делили на две равные части после поверхностного иодирования 125I и йодными шариками lodobeads (Pierce Chemical Co.). Клетки многократно промывали центрифугированием до тех пор, пока уровни радиоактивности в надосадках не возвращались к фону. Сто микрограмм антитела 2В8 или B1 (Coulter Immunology) добавляли к любому из двух образцов меченых В-клеток. Антитела и клетки SB инкубировали в течение ночи, и затем три раза промывали центрифугированием до тех пор, пока не удаляли все несвязанные антитела. Затем осадки клеток, содержащие связанные 2В8 или В1 лизировали и экстрагировали добавлением 1% детергента NP 40 в 0,1 М трис-НСl, рН 8,0, после чего инкубировали при комнатной температуре в течение 1 час. Экстракт центрифугировали в микроцентрифуге при высокой скорости в течение 30 мин, и надосадки переносили в новые пробирки. В каждую пробирку добавляли белок-А-сефарозу (300 мкл), и смолу осаждали центрифугированием. Затем белок-А-сефарозу 20 раз промывали, чтобы удалить неспецифично связанный иодированный белок. Когда отношение радиоактивности на шариках к надосадку достигало значения 100, осадок экстрагировали буфером для образца для SDS-ПААГ и нагревали до кипения. После охлаждения примерно 15000 имп/мин каждого экстракта добавляли в лунки 10% полиакриламидного геля. В отдельную лунку добавляли предварительно окрашенный стандарт низкой молекулярной массы (BioRad Inc.) для хорошего разделения и использовали для определения молекулярной массы. Белки разделяли электрофорезом, и гель сушили и экспонировали с листом рентгеновской пленки в течение 24 часов при -70°С; затем пленку проявляли и анализировали.
4. Анализ Скатчарда связывания 2В8
Оценивали кажущуюся аффинность очищенного 2В8 с помощью анализа Скатчарда. Радиоактивно меченное 2В8 готовили посредством реакции с 125I в присутствии йодных шариков Iodobeads. После удаления несвязанного йода радиоактивно меченное антитело инкубировали в различных концентрациях, в двух повторах, в пределах от 5000 нг на лунку до 35 нг/лунку с 10000 клеток SB. Количество антитела, связавшегося с клетками, подсчитывали на основе удельной активности 125I-меченого 2В8. Отношение количества связанного/количеству свободного антитела откладывали против молярной концентрации связанного антитела, и константу кажущейся аффинности определяли из отношения значений точек пересечения осей Х и Y.
5. Получение 2В8-MX-DTPA
а. Источник MX-DTPA
Для некоторых доклинических исследований меченная углеродом-14 1-изотиоцианатбензил-3-метилдиэтилентриамино-пентауксусная кислота (MX-DTPA) была предоставлена в виде сухого твердого вещества доктором Otto Gansow из Национального Института здоровья, и хранилась в эксикаторе при 4°С, защищенной от света. Маточный раствор хелатирующего агента готовили в воде Milli-Q, и определяли концентрацию по оценке радиоактивности и используя удельную активность соединения. Маточные растворы обычно готовили 2-5 мМ, и хранили при -70°С в полипропиленовых пробирках. Для других исследований MX-DTPA получали из Coulter Immunology в виде динатриевой соли в воде и хранили при -70°С.
b. Поддержание условий отсутствия металлов
Кроме использования не содержащих металлы реактивов, все манипуляции с реагентами выполняли так, чтобы минимизировать возможность загрязнения металлами. По возможности использовали пластиковые сосуды из полипропилена, такие как колбы, лабораторные стаканы и градуированные цилиндры. Указанные сосуды промывали Alconox и основательно промывали водой Milli-Q перед использованием. Кроме того, для точного манипулирования маленькими объемами использовали не содержащие металлов наконечники пипеток (BioRad). Для манипулирования большими объемами реактивов использовали стерильные пластиковые серологические пипетки (имеющиеся размером от 1 до 25 мл). Реакции для удобства выполняли в полипропиленовых микроцентрифужных пробирках с закручивающейся крышкой (Sardstedt Industries; емкостью 1,5 мл) или полипропиленовых конических пробирках (Costar; 15 мл и 50 мкл). При работе с диализными трубками, надевали одноразовые хирургические перчатки, предварительно промытые водой Milli-Q.
с. Подготовка антитела
Мышиное анти-СD20 антитело 2В8 сначала очищали из асцитов белок-А-хроматографией и QAE-хроматографией. Для более поздних экспериментов 2В8 очищали из надосадков биореакторов с полыми волокнами, используя тот же процесс очистки. Антитело, полученное на полых волокнах, в настоящее время для коммерческих целей заменено антителом, полученным из СНО, описанным в примере 2.
Антитело готовили для конъюгации, перенося его в 50 мМ бицин-NaOH, рН 8,6, не содержащий металлов, содержащий 150 мМ NaCl, используя диализ, или многократный обмен буфера. В некоторых исследованиях обмен буфера осуществляли с использованием многократной ультрафильтрации с помощью центрифужных фильтров Centricon 30 (Amicon) (с MWCO 30000 Д). В общем 50-200 мкл белка (10 мг/мл) добавляли на фильтрующий элемент и добавляли 2 мл бицинового буфера. Фильтр центрифугировали при 4°С в роторе Sorval SS-34 при 6000 об/мин в течение 45 мин. Объем удерживаемого материала составлял примерно 50-100 мкл. Данный процесс повторяли дважды с тем же самым фильтром. Удерживаемый материал переносили в полипропиленовую пробирку с закручивающейся крышкой объемом 1,5 мл, делали анализ белка, разбавляли до 10,0 мг/мл и хранили при 4°С до момента использования для конъюгации. Для некоторых исследований белок переносили в 50 мМ цитрат натрия, рН 5,5, содержащий 150 мМ NaCl и 0,05% азида натрия, используя такой же протокол, как описано выше.
d. Протокол конъюгации
Конъюгацию 2В8 с MX-DTPA проводили в полипропиленовых пробирках при температуре окружающей среды. Замороженные маточные растворы MX-DTPA размораживали непосредственно перед использованием. Обычно 50-200 мкл антитела при концентрации 10 мг/мл добавляли в реакцию с хелатирующим агентом при молярном соотношении хелатирующего агента к белку, равном 4:1. Реакции инициировали добавлением маточного раствора хелатирующего агента и осторожным перемешиванием; конъюгации давали возможность продолжаться в течение ночи, обычно от 14 до 20 час, при температуре окружающей среды. Не прореагировавший хелатирующий агент удаляли из конъюгата диализом или многократной ультрафильтрацией, как описано выше, в не содержащем металлов нормальном солевом растворе (0,9% маc./об.), содержащем 0,05% азида натрия. Концентрацию белка доводили до 10 мг/мл и хранили при 4°С в полипропиленовой пробирке вплоть до радиоактивного мечения.
е. Определение включения хелатирующего агента
Включение хелатирующего агента определяли, считая в сцинтилляционном счетчике и сравнивая значение, полученное для очищенного конъюгата с удельной активностью меченого углеродом-[14] хелатирующего агента. Для более поздних исследований, в которых использовали нерадиоактивный хелатирующий агент, полученный из Coulter Immunology, включение хелатирующего агента оценивали при инкубации конъюгата с избытком раствора радиоактивного носителя 90Y известной концентрации и удельной активности.
Коротко, маточный раствор хлорида иттрия известной концентрации готовили в 0,05 н. НСl, не содержащем металлов, к которому добавляли 90Y (хлоридная соль) без носителя. Аликвоту этого раствора анализировали в жидкостном сцинтилляционном счетчике, чтобы определить точную удельную активность данного реагента. В полипропиленовую пробирку добавляли объем реагента хлорида иттрия, равный 3-кратному количеству молей хелатирующего агента, который предположительно должен связаться с антителом, обычно 2 моль/моль антитела, и рН доводили до 4,0-4,5 с помощью 2 М ацетата натрия. Затем добавляли конъюгированное антитело, и смесь инкубировали 15-30 мин при температуре окружающей среды. Реакцию гасили добавлением 20 мМ ЭДТА в конечной концентрации 1 мМ, и рН раствора доводили примерно до рН 6 2 М ацетатом натрия.
После 5 мин инкубации весь объем очищали высокоэффективной эксклюзионной хроматографией по размеру, как описано ниже. Элюированные фракции, содержащие белок, объединяли, определяли концентрацию белка, и проводили анализ аликвот на радиоактивность. Включение хелатирующего агента рассчитывали, используя удельную активность препарата хлорида 90Y и концентрацию белка.
f. Иммунореактивность 2B8-MX-DTPA
Иммунореактивность конъюгированного 2В8 оценивали, используя ELISA на целых клетках. Клетки SB в середине лог-фазы собирали из культуры центрифугированием и два раза промывали 1x HBSS. Клетки разбавляли до 1-2×106 клеток/мл в HBSS, и делили на аликвоты в 96-луночные полистироловые планшеты для микротитрования по 50000-100000 клеток/лунку. Планшеты сушили в вакууме в течение 2 час при 40-45°С, чтобы фиксировать клетки на пластике. Планшеты хранили сухими при -20°С вплоть до использования. Для анализа планшеты нагревали до температуры окружающей среды непосредственно перед использованием, затем блокировали 1 × pbs, рН 7,2-7,4, содержащим 1% БСА (2 час). Образцы для анализа разбавляли в 1 × РВS/1% БСА, вносили в планшеты и серийно разводили (1:2) в том же самом буфере. После инкубирования планшетов в течение 1 час при температуре окружающей среды планшеты три раза промывали 1 × PBS. В лунки добавляли второе антитело (специфичный HRP-конъюгат антитела козы против IgG1 мыши) (50 мкл) (разведение 1:1500 в 1 × PBS/1% БСА) и инкубировали 1 час при температуре окружающей среды. Планшеты промывали четыре раза 1x PBS, после чего добавляли раствор субстрата ABTS (50 мМ цитрат натрия, рН 4,5, содержащий 0,01% ATBS и 0,001% Н2О2). Планшеты измеряли при 405 нм после 15-30 мин инкубации. В анализы включали антиген-негативные клетки HSB, чтобы проследить неспецифичное связывание. Иммунореактивность конъюгата рассчитывали, откладывая значения оптической плотности против соответствующего коэффициента разведения и сравнивая эти значения со значениями, полученными с использованием нативного антитела (представляющего 100% иммунореактивности), тестированного на том же планшете. Сравнивали несколько значений на линейной части кривой титрования и определяли среднее значение.
g. Стабильность нативного 2В8 и 2B8-MX-DTPA in vitro
Для этой 12-недельной оценки стабильности антитела и конъюгата аликвоты антитела 2В8 и 2B8-MX-DTPA готовили либо в нормальном солевом растворе, либо в нормальном солевом растворе, содержащем 10 мМ глицин-HCl, рН 6,8. Наборы образцов в двух повторах инкубировали как при 4°, так и при 30°С, и образцы оценивали еженедельно, используя следующие способы: SDS-ПААГ (как восстанавливающий, так и не восстанавливающий), иммунореактивность иммуноферментным анализом на целых клетках, используя для захвата либо клетки SB (антиген-позитивные), либо клетки HSB (антиген-негативные), и изоэлектрофокусирующим гель-электрофорезом (пределы рН 3-10). Кроме того, эффективность радиоактивного мечения конъюгата оценивали на 4,8 и 12 неделе посредством радиоактивного мечения конъюгата 90Y и анализа продукта в SDS-ПААГ и авторадиографического анализа. Наконец, в отдельном исследовании аликвоты 2B8-MX-DTPA инкубированные при 4° и 30°С в течение 10 недель, радиоактивно метили 111In и оценивали при исследовании биологического распределения у мышей BALB/c, как описано ниже.
h. Иммуногистологические исследования
Иммуногистологические исследования как с нативным, так и с конъюгированным (2B8-MX-DTPA) антителами выполняли на оборудовании IMPATH Laboratories, используя срезы тканей человека, фиксированные ацетоном. Антитело очищали из надосадков биореактора с полыми волокнами хроматографией на белок-А-и Q-сефарозе. Конъюгат клинической степени очистки готовили, используя MX-DTPA из Coulter Immunology, согласно протоколу, описанному выше.
i. Иммунореактивность радиоактивно меченного 2B8-MX-DTPA in vitro
Для некоторых экспериментов использовали протокол ELISA на целых клетках, используемый для немеченого 2B8-MX-DTPA. В более поздних экспериментах иммунореактивность конъюгатов, меченных 111In и 90Y (каждый приготовлен в IDEC Pharmaceuticals или, в альтернативном случае, в MPI Pharmacy Services, Inc.), определяли, используя модифицированную версию анализа связывания целыми клетками, описанного Lindmo (3). Коротко, возрастающие концентрации антиген-позитивных клеток SB или антиген-негативных клеток HSB в середине лог-фазы [20-30 × 106 клеток/мл в буфере для разведения (PBS, рН 7,4, содержащий 1% БСА, 0,1% желатина и 0,02% азида натрия)] добавляли в наборы пробирок в двух повторах. Радиоактивно меченный конъюгат разбавляли до конечной концентрации антитела 1-5 нг/мл буфером для разведения, и в каждую пробирку добавляли 0,35 мл. После 75-90-минутного периода инкубации при температуре окружающей среды клетки осаждали центрифугированием и собирали надосадки. Радиоактивность, оставшуюся во фракции надосадков, определяли с помощью гамма- или сцинтилляционного счетчика. Данные откладывали в виде частного от деления общей добавленной радиоактивности на радиоактивность, ассоциированную с клетками, против обратной величины количества клеток в пробирке. Пересечение с осью у, таким образом, представляет иммунореактивную фракцию.
j. Стабильность радиоактивно меченного 2B8-MX-DTPA в сыворотке человека in vitro
Стабильность меченного 111In и 90Y 2B8-MX-DTPA in vitro оценивали при инкубации в сыворотке человека при 37°С в течение 96 часов. Конъюгированное антитело готовили и радиоактивно метили 111In (протокол "mix-and-shoot") или 90Y, как описано выше. Удельные активности конъюгатов, меченных 111In и 90Y, составляли 2,5 и 14,6 мкКюри/мг соответственно; радиоактивно меченные конъюгаты суспендировали в буфере, содержащем 75 мг/мл сывороточного альбумина человека (ЧСА) и 1 мМ DTPA (конъюгат, меченный иттрием), или в буфере, содержащем 50 мг/мл ЧСА (конъюгат, меченный индием). Радиоактивно меченные конъюгаты разбавляли 1:10 нормальной сывороткой человека (не инактивирована теплом), и аликвоты стерильно помещали в стерильные закрытые пробирки; затем пробирки инкубировали при 37°С в течение периодов времени вплоть до 96 часов. В выбранных временных точках образцы конъюгата извлекали и анализировали посредством электрофореза в не восстанавливающем SDS-ПААГ на 4-20% градиентных гелях с последующей авторадиографией, и мгновенной тонкослойной хроматографией.
k. Стабильность 111In-2B8-MX-DTPA, приготовленного в составе композиции для клинического применения, in vitro
Конъюгат 2B8-MX-DTPA радиоактивно метили 111In и использовали без очистки ВЭЖХ (протокол "mix-and-shoot"). Радиоактивно меченное антитело разводили в PBS и добавляли сывороточный альбумин человека (ЧСА) до конечной концентрации 50 мг/мл. Удельная активность приготовленного в составе композиции радиоактивно меченного конъюгата составляла 2,2 мкКюри/мг. Затем приготовленный в составе композиции конъюгат инкубировали при 4°С в течение 48 часов, и аликвоты анализировали во временных точках, равных 0, 24 час и 48 часам, используя электрофорез в SDS-ПААГ в невосстанавливающих условиях в 4-20% градиентных гелях с последующей авторадиографией, и мгновенной тонкослойной хроматографией. Иммунореактивность в каждой временной точке оценивали, используя анализ на суспензии целых клеток, описанный выше в разделе 1.
l. Стабильность 90Y-2B8-MX-DTPA, приготовленного в составе композиции для клинического применения, in vitro
Конъюгат 2B8-MX-DTPA радиоактивно метили 90Y и очищали эксклюзионной хроматографией по размеру при ВЭЖХ, используя 1 × PBS в качестве элюирующего буфера. Фракции радиоактивно меченного конъюгата объединяли и добавляли сывороточный альбумин человека и DTPA до конечной концентрации 75 мг/мл и 1 мМ соответственно. Удельная активность приготовленного в составе композиции радиоактивно меченного конъюгата составляла 14,6 мКюри/мг. Затем приготовленный в составе композиции конъюгат инкубировали при 4°С в течение 48 часов, и аликвоты анализировали во временных точках, равных 0, 24 час и 48 часам, используя электрофорез в SDS-ПААГ в невосстанавливающих условиях в 4-20% градиентных гелях с последующей авторадиографией, и мгновенной тонкослойной хроматографией. Иммунореактивность в каждой временной точке оценивали, используя анализ на суспензии целых клеток; описанный выше в разделе 1.
2. Исследования на животных
а. Фармакологические/токсикологические исследования высоких доз на приматах, с использованием 2В8
Антитело 2В8 оценивали в фармакологическом исследовании высоких доз, согласно предписаниям GLP в White Sands Research Center (номер исследования 920111). Использовали взрослых обезьян Масаса fascicularis (крабоеды); каждая группа для исследования состояла из одного самца и одной самки. Антитело инъецировали внутривенно каждые 48 часов, всего семь инъекций. Исследование состояло из пяти групп: группа I (солевой раствор); группа II (0,6 мг/кг); группа III (2,5 мг/кг); группа IV (10 мг/кг); и группа V (10 мг/кг только в 0 день).
Перед началом исследования получали кровь от всех 10 животных и использовали для того, чтобы определить фоновые уровни реактива и исходные популяции В-клеток. Все последующие образцы крови отбирали перед каждой инъекцией антитела. Группы III и IV забивали на 13 день для полной аутопсии и гистопатологии.
У животных групп I, II и V кровь брали в 0, 1, 3, 7, 13, 21, 37 и 52 день; примерно 5 мл цельной крови отбирали в гепаринизированные пробирки. Цельную кровь хранили при 4°С и анализировали в течение 24 часов. Кровь каждого животного центрифугировали при 2000 об/мин в течение 5 мин, и плазму из надосадка извлекали для анализа уровней 2В8 в сыворотке способом РИА (смотри процедуру РИА для способов специфичного анализа). Осевший материал, содержащий лейкоциты периферической крови (PBL) и эритроциты (RBC), ресуспендировали в FCS для FACS-анализа.
b. Фармакокинетические исследования 2В8 и 2B8-MX-DTPA
Средний период полувыведения бета 2В8 в сыворотке макак-крабоедов определяли, используя животных группы V (выше). Антитела козы против IgGI мыши (Fisher Scientific) разводили до 2,0 мкг на мл в 10 мМ боратном буфере, рН 9,6, и 50 мкл добавляли в каждую лунку 96-луночного планшета. Антителу давали возможность связаться с планшетом во время инкубации в течение ночи при 4°С или в течение 2 час при температуре окружающей среды. Каждый планшет блокировали в течение 30 мин при температуре окружающей среды 150 мкл на лунку PBS, содержащего 1% БСА. Планшеты промывали дистиллированной водой, и образцы сыворотки или плазмы вносили в трех повторах в отдельные лунки при начальном разведении 1:100, с последующими серийными разведениями 1:2. Очищенное 2В8 добавляли к сыворотке предварительно отобранной крови и разводили для использования в качестве стандартной кривой, начиная с 0,5 мг/мл; образцы разводили 1:100 и затем серийно разводили, как и другие образцы. Планшеты инкубировали в течение 1 час при температуре окружающей среды и 4 раза промывали дистиллированной водой. Затем добавляли второй реагент (HRPO-антитело козы против IgGl мыши) в разведении 1:4000, и инкубировали при температуре окружающей среды еще час. Планшеты снова промывали в дистиллированной воде и добавляли 0,1 мл субстрата пероксидазы, содержащего перекись водорода. Давали возможность развиться окраске в ходе реакции в течение 20 мин; затем определяли оптическую плотность при 405 нм, используя считывающее устройство для ELISA на микопланшетах. Результаты откладывали в мкг антитела на мл сыворотки.
Кроме того, определяли значения β t1/2 для 2В8 и 2В8-МХ-DTPA у мышей BALB/c. Неконъюгированный 2В8, хранившийся при -70°С в 1 × PBS, рН 7,4/10% глицерине размораживали, разводили до 0,5 мг/мл и стерильно фильтровали. Конъюгированное антитело готовили, следуя стандартным протоколам, но с меченным углеродом-[14] хелатирующим агентом; включение хелатирующего агента составляло 1,5 моль/моль антитела. Очищенный конъюгат разводили до 0,5 мг/мл в нормальном солевом растворе (0,9%), стерильно фильтровали и хранили при 4°С с нативным антителом вплоть до использования.
Мышам шести-восьминедельного возраста инъецировали 100 мкл очищенного антитела 2В8 в концентрации 250 мкг/мл. Затем у мышей брали кровь посредством ретроорбитальной пункции в различных временных точках в пределах от 0 до 264 часов, и анализировали их сыворотку на наличие нативного и конъюгированного антитела 2В8 иммуноферментным анализом на целых клетках, используя линию антиген-позитивных В-клеток SB для фиксации. Полученные в результате данные откладывали в виде концентрации 2В8 или 2B8-MX-DTPA против времени; на основании этих результатов строили график линейной регрессии и наклон использовали для того, чтобы определить значения β t1/2.
с. Фармакологические/токсикологические исследования [89]-Y-2B8-MX-DTPA у макак-крабоедов
2B8-MX-DTPA, несущие иттрий-[89], готовили, используя протокол, описанный для включения 90Y, за исключением того, что не использовали очистку ВЭЖХ. Не радиоактивный, не несущий металлов конъюгат готовили в составе композиции в 1 x PBS, содержащем 75 мг/мл ЧСА и 1 мМ DTPA, и оценивали в исследовании GLP номер 920611 в White Sands Research Center. В каждую из четырех групп включали одного самца и одну самку. Животным инъецировали внутривенно каждые 48 часов, всего семь инъекций, следующие количества лекарственного средства: группа I (солевой раствор); группа II (0,003 мг/кг); группа III (0,03 мг/кг) и группа IV (0,3 мг/кг). Животных оценивали в ходе исследования по определению массы тела и температуре, потреблению пищи и воды, элиминации, химическому составу сыворотки, гематологическим показателям, анализу мочи и физическому обследованию. У животных в группах I и IV кровь брали перед инфуэией в 0, 2, 7, 10 и 14 день и анализировали уровни циркулирующих В-клеток FACS-анализом.
а. Биологическое распределение радиоактивно меченного 2B8-MX-DTPA
В предварительном исследовании 2B8-MX-DTPA, меченный 111In, оценивали по биологическому распределению в тканях у мышей BALB/c шести-восьминедельного возраста. Радиоактивно меченный конъюгат готовили, используя 2B8-MX-DTPA клинической степени очистки, следуя протоколу "mix and shoot", описанному выше. Удельная активность конъюгата составляла 2,3 мКюри/мг, и конъюгат готовили в составе композиции в PBS, рН 7,4, содержащем 50 мг/мл ЧСА. Мышам внутривенно инъецировали 100 мкл 2B8-MX-DTPA, меченного 111In (примерно 21 мкКюри), и группы из трех мышей забивали смещением шейных позвонков в 0, 24, 48 и 72 часа. После забоя извлекали хвост, сердце, легкие, печень, почки, селезенку, мышцу и бедренную кость, промывали, взвешивали; также брали образец крови для анализа. Радиоактивность, связанную с каждым образцом, определяли с помощью гамма-счетчика, и затем определяли процент инъецированной дозы на грамм ткани. Не делали попыток учесть вклад в активность, обусловленный кровью, связанной с отдельным органом.
По отдельному протоколу аликвоты 2B8-MX-DTPA, инкубированные при 4° и 30°С в течение 10 недель, радиоактивно метили 111In до удельной активности 2,1 мКюри/мг для обоих препаратов. Затем указанные конъюгаты использовали в исследованиях биораспределения, как описано выше.
Для дозиметрических определений 2B8-MX-DTPA радиоактивно метили 111In до удельной активности 2,3 мКюри/мг, и примерно 1,1 мкКюри инъецировали каждой из 20 мышей BALB/c. Затем группы по пять мышей в каждой забивали в 1, 24, 48 и 72 час, и их органы извлекали и готовили для анализа. Кроме того, извлекали части кожи, мышцы и кости и готовили для анализа; мочу и фекалии также собирали и анализировали во временных точках 24-72 часа.
Используя сходный подход, 2B8-MX-DTPA также радиоактивно метили 90Y, и оценивали его биологическое распределение у мышей BALB/c в течение 72-часового периода времени. После очистки высокоэффективной жидкостной (ВЭЖХ) эксклюзионной хроматографией по размеру, четырем группам по пять мышей в каждой внутривенно инъецировали примерно 1 мкКюри конъюгата, приготовленного в виде композиции для клинического применения (удельная активность: 12,2 мКюри/мг); затем группы забивали в 1, 24, 48 и 72 час, и их органы и ткани анализировали, как описано выше. Радиоактивность, связанную с каждым образцом ткани, определяли, измеряя энергию тормозного излучения в гамма-сцинтилляционном счетчике. Затем значения активности выражали в виде процента инъецированной дозы на грамм ткани, или процента инъецированной дозы на орган. Хотя органы и другие ткани многократно промывали, чтобы удалить кровь снаружи, органы не перфузировали. Таким образом, в значениях активности органа не учитывали вклад в активность, представленный кровью, связанной внутри.
е. Локализация 2B8-MX-DTPA, меченного 111In, в опухоли
Локализацию радиоактивно меченного 2B8-MX-DTPA определяли у бестимусных мышей, несущих В-клеточные опухоли Ramos. Бестимусным мышам шести-восминедельного возраста подкожно инъецировали (в левый бок сзади) 0,1 мл RPMI-1640, содержащей 1,2×107 клеток опухоли Ramos, которая ранее была адаптирована для роста у бестимусных мышей. Опухоли появлялись в течение двух недель и весили в пределах от 0,07 до 1,1 грамм. Мышам внутривенно инъецировали 100 мкл 2B8-MX-DTPA, меченного 111In (16,7 мкКюри), и группы из трех мышей забивали смещением шейных позвонков в 0, 24, 48 и 72 часа. После забоя извлекали хвост, сердце, легкие, печень, почки, селезенку, мышцу, бедренную кость и опухоль, промывали, взвешивали; также брали образец крови для анализа. Радиоактивность, связанную с каждым образцом, определяли с помощью гамма-счетчика, и определяли процент инъецированной дозы на грамм ткани.
3. Дозиметрические расчеты
Используя данные по биологическому распределению, полученные с использованием мышей BALB/c, которым инъецировали 2B8-MX-DTPA, меченный либо 111In, либо 90Y (таблицы 1-4 и 5-8), оценки поглощенной дозы радиации от дозы 1,0 мКюри, введенной пациенту, имеющему вес 70 кг, рассчитывали, используя подход, формализованный Комитетом общества ядерной медицины по внутренним медицинским дозам радиации (Medical Internal Radiation Dose (MIRD) Committee of the Society of Nuclear Medicine). Время биологического полураспада радиоактивно меченного конъюгата определяли на основе значений инъецированной дозы на орган, определяемых по данным биологического распределения для каждого радиоактивного иммуноконъюгата. Для некоторых тканей, например крови, предполагали, что биологический распад радиоконъюгата следует двухкамерной модели, с экспоненциальным распадом в этих камерах. Для других тканей, например печени, уровни активности в которых остаются приблизительно постоянными в течение 72-часового исследования биологического распределения, предполагали, что время биологического полураспада было очень длительным, и установили значение 1000 часов.
Распределение активности через 1 час после в/в инъекции 111In-2D8-MX-DTPA нормальным мышам BALB/c
Среднее значение±стандартное отклонение
Средняя масса = 20,97±2,46 грамм
Распределение активности через 24 часа после в/в инъекции 111In-2B8-MX-DTPA нормальным мышам BALB/c
Среднее значение±стандартное отклонение
Средняя масса = 21,03±0,94 грамм
Распределение активности через 48 часов после в/в инъекции 111In-2B8-MX-DTPA нормальным мышам BALB/c.
Среднее значение±стандартное отклонение
Средняя масса = 20,65±1,93 грамм
Распределение активности через 72 часа после в/в инъекции 111In-2B8-MX-DTPA нормальным мышам BALB/c
Среднее значение±стандартное отклонение
Средняя масса = 21,46±0,84 грамм
Распределение активности через 1 час после в/в инъекции 90Y-2BS-MX-DTPA нормальным мышам BALB/c
Среднее значение±стандартное отклонение
Средняя масса = 18,17±0,81 грамм
Распределение активности через 24 часа после в/в инъекции 90Y-2B8-MX-DTPA нормальным мышам BALB/c
Среднее значение±стандартное отклонение
Средняя масса = 21,671±1,11 грамм
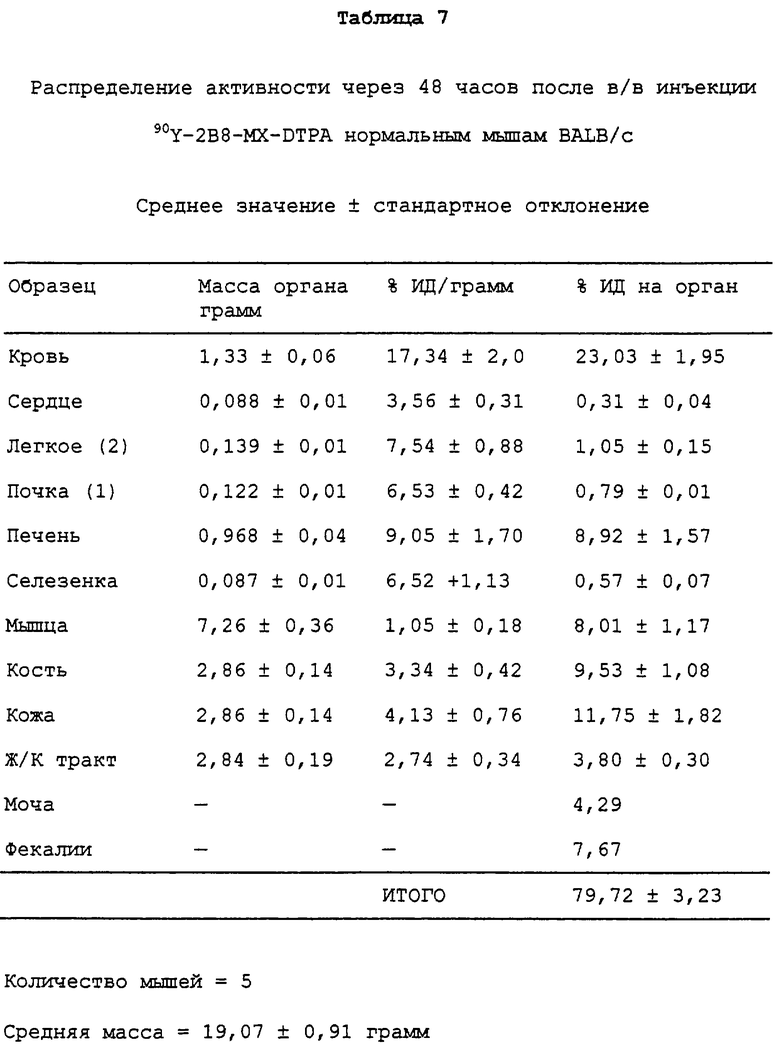
Распределение активности через 72 часа после в/в инъекции 90Y-2B8-MX-DTPA нормальным мышам BALB/c
Среднее значение±стандартное отклонение
Средняя масса = 19,21±0,27 грамм
Сходным образом другие значения времени биологического полураспада определяли или рассчитывали, используя стандартные уравнения для расчета t1/2 для экспоненциального распада. После того как были определены указанные значения, определяли переменные Тue, Te1, Te2, A1, A2 и А, приведенные в списке в таблицах 9 и 10, для каждого радиоактивно меченного конъюгата, используя уравнения, представленные сверху в данных таблицах (выходные переменные). Эти значения, а также значения, указанные в последующих таблицах, рассчитывал, используя программу, написанную в электронной таблице Symphony (Lotus Development Corp.) господином Phillip Hagan, MS, Nuclear Medicine Service, VA Medical Center, La Jolla, CA 92161.

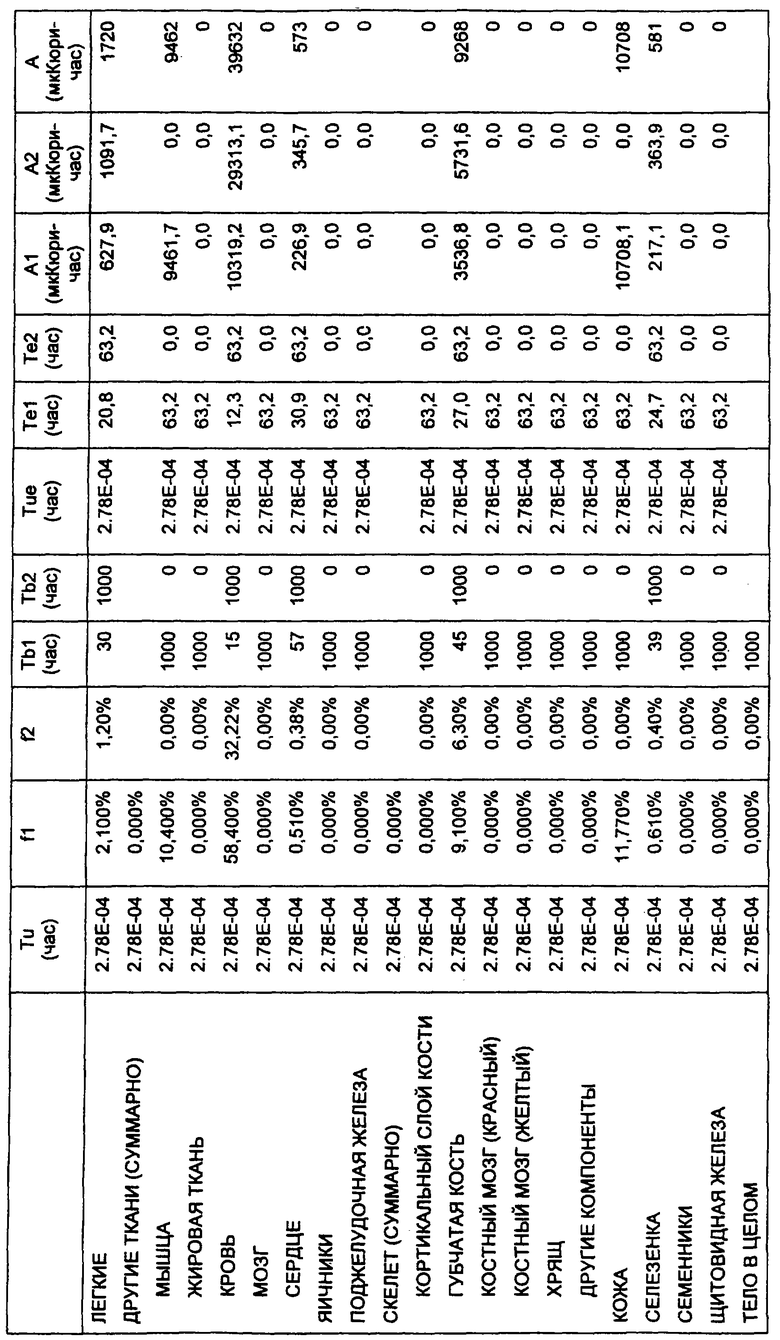
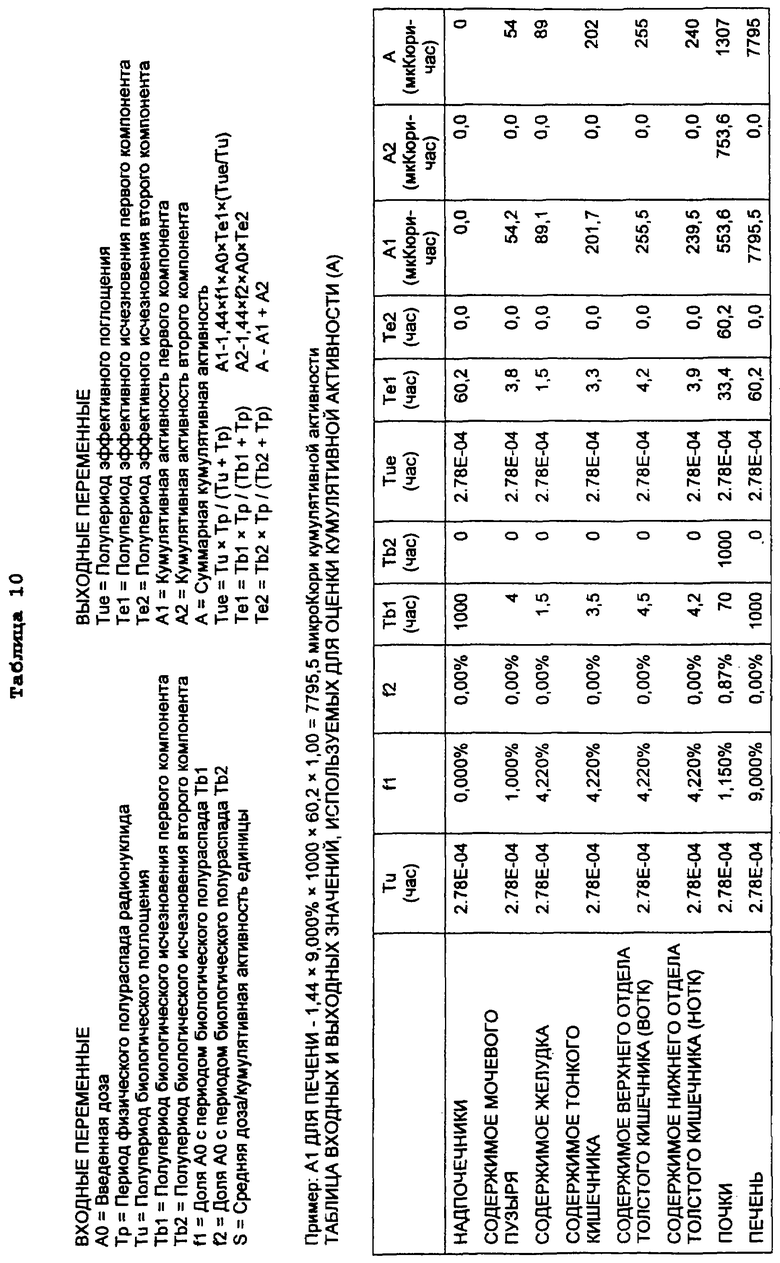
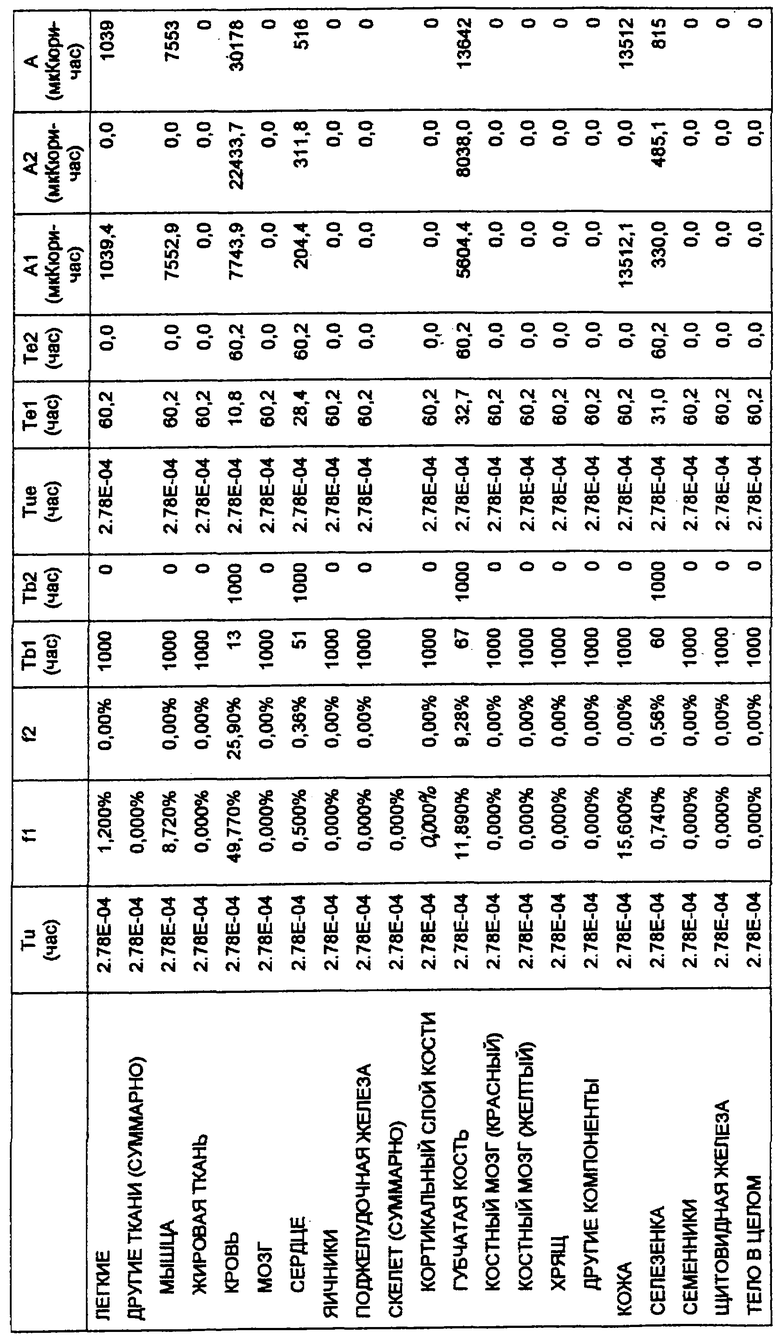
Используя значения общей кумулятивной активности (А) из таблиц 9 и 10, и значений S, взятых из брошюры MIRD номер 11 (таблицы 11 и 12, и 13 и 14), оценки дозы поглощенной радиации определяли для каждого радиоактивно меченного конъюгата для тканей, перечисленных в списке (таблицы 15, 16, 17 и 18). При определении оценок суммарной дозы радиоактивности для конъюгата, меченного индием, представленных в таблице 19, собственную дозу данного органа суммировали с поглощенной дозой, создаваемой активностью близлежащих органов или тканей. Однако в расчетах определяемых значений дозы радиации за счет конъюгата, меченного иттрием (таблица 20), некоторые значения для перечисленных в списке тканей отсутствуют (например, для надпочечников). Это является следствием более короткой длины пробега высвобождаемой частицы 13 относительно длины пробега испускаемой g-частицы, и поэтому предоставления незначительного вклада в активность прилегающими тканями, и следствием отсутствия первичных данных о биологическом распределении для данных тканей.

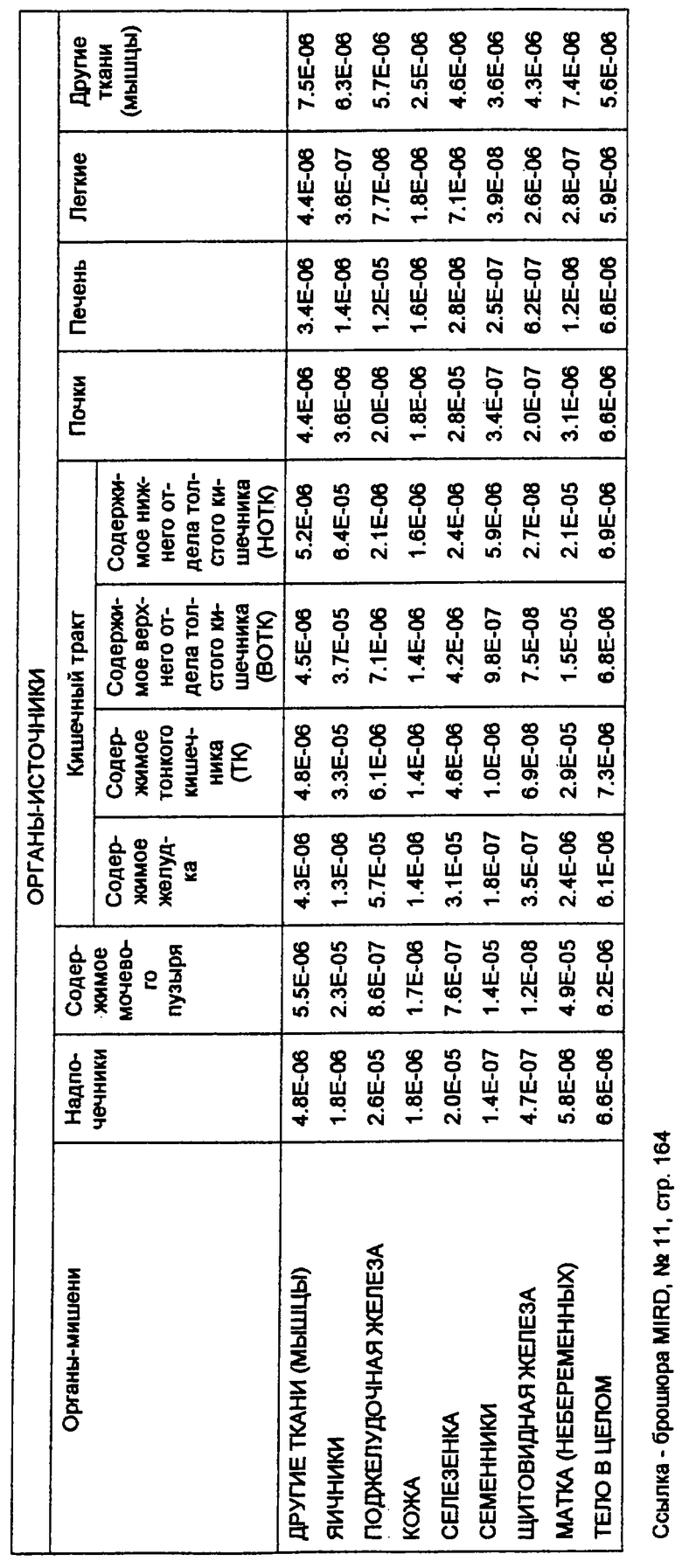
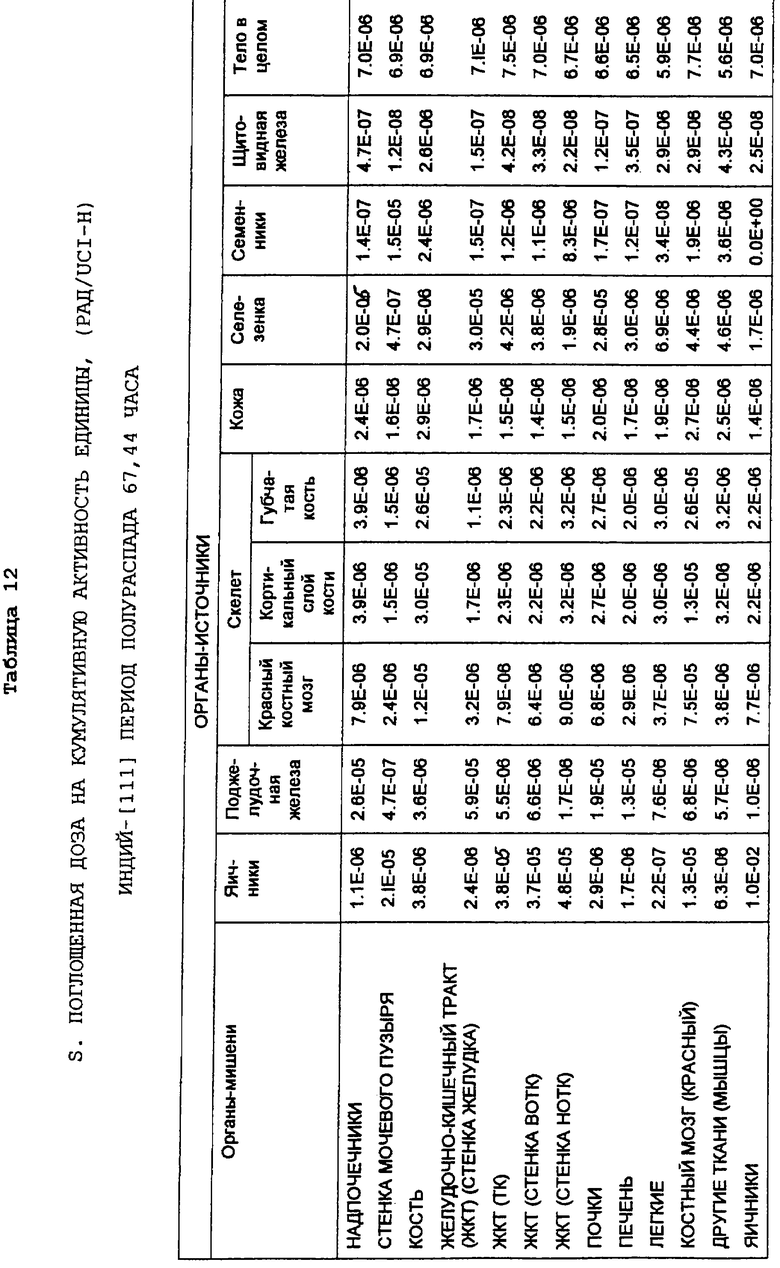

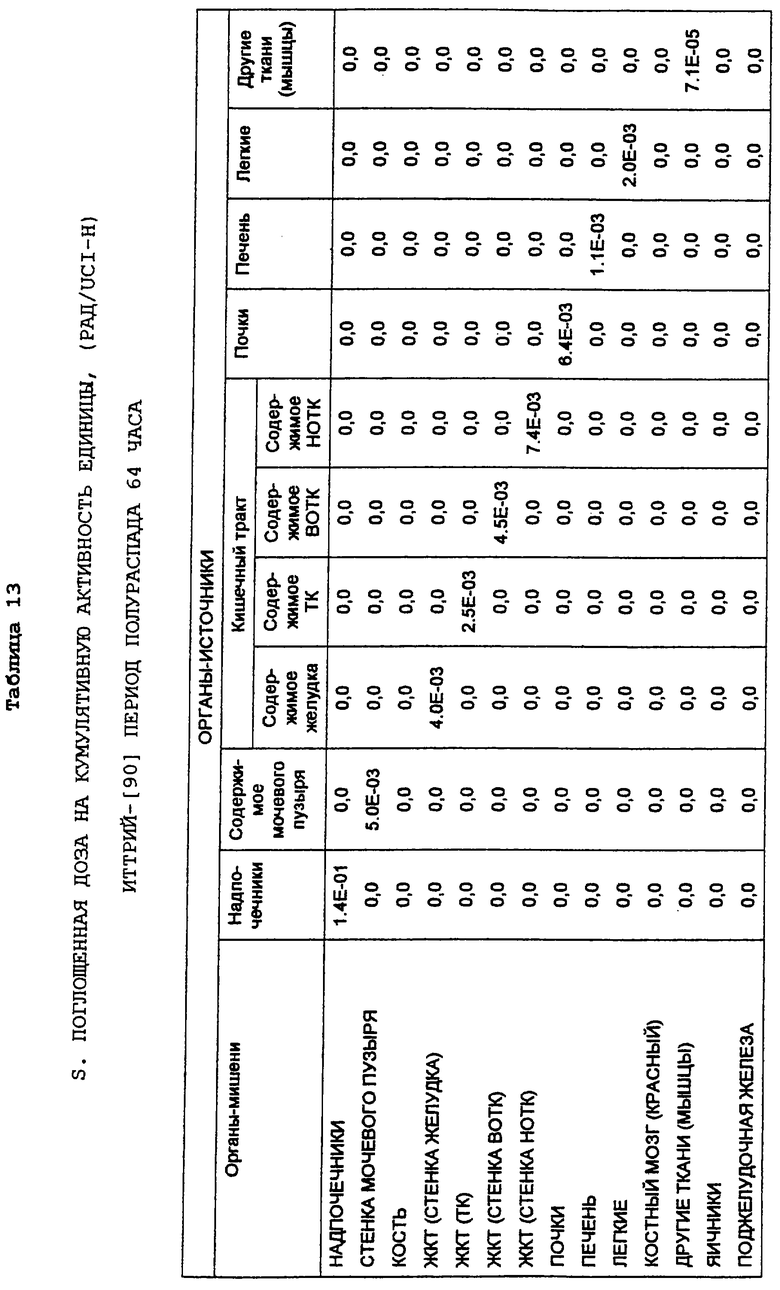



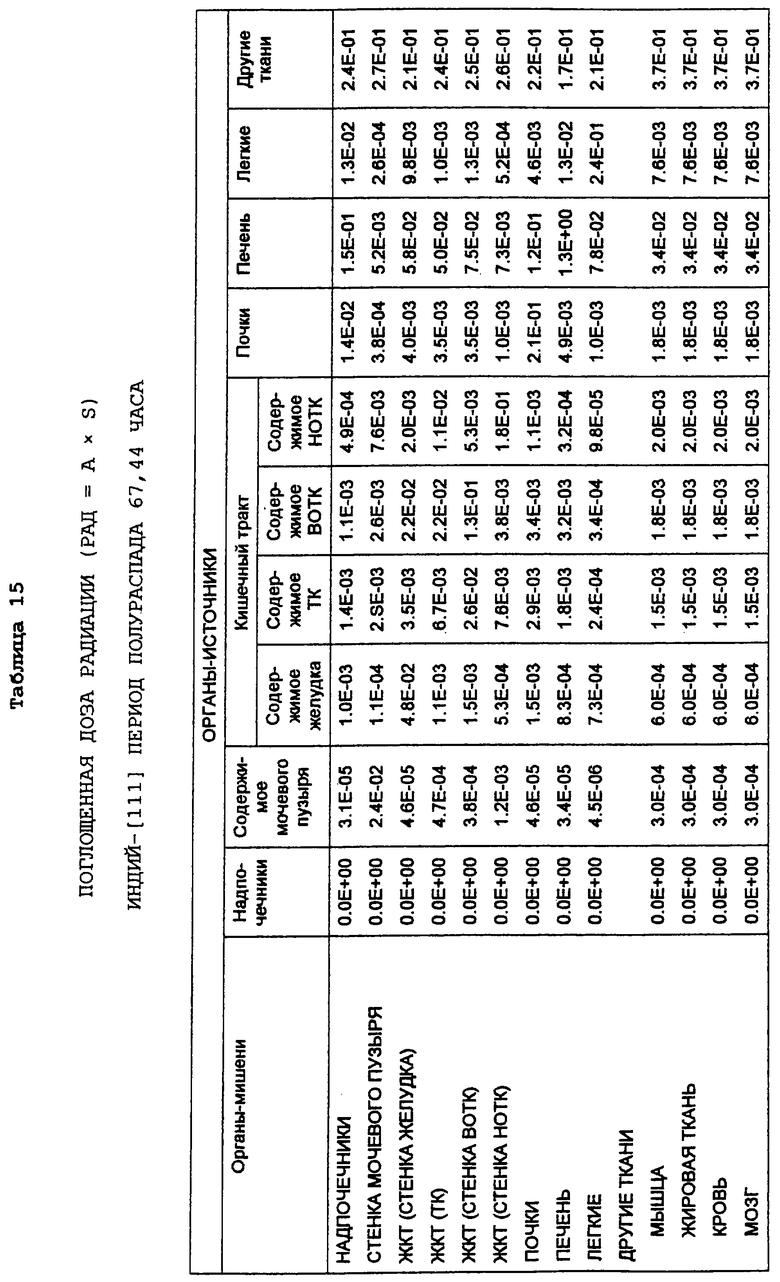

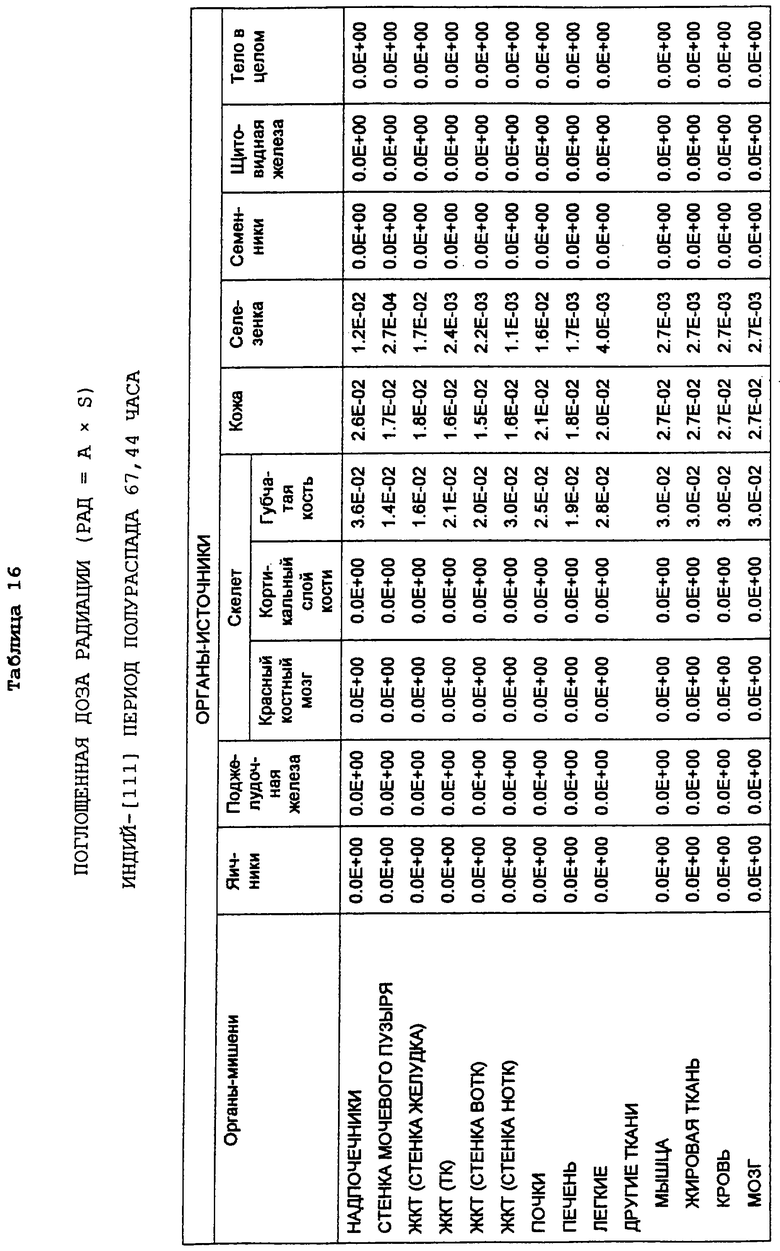
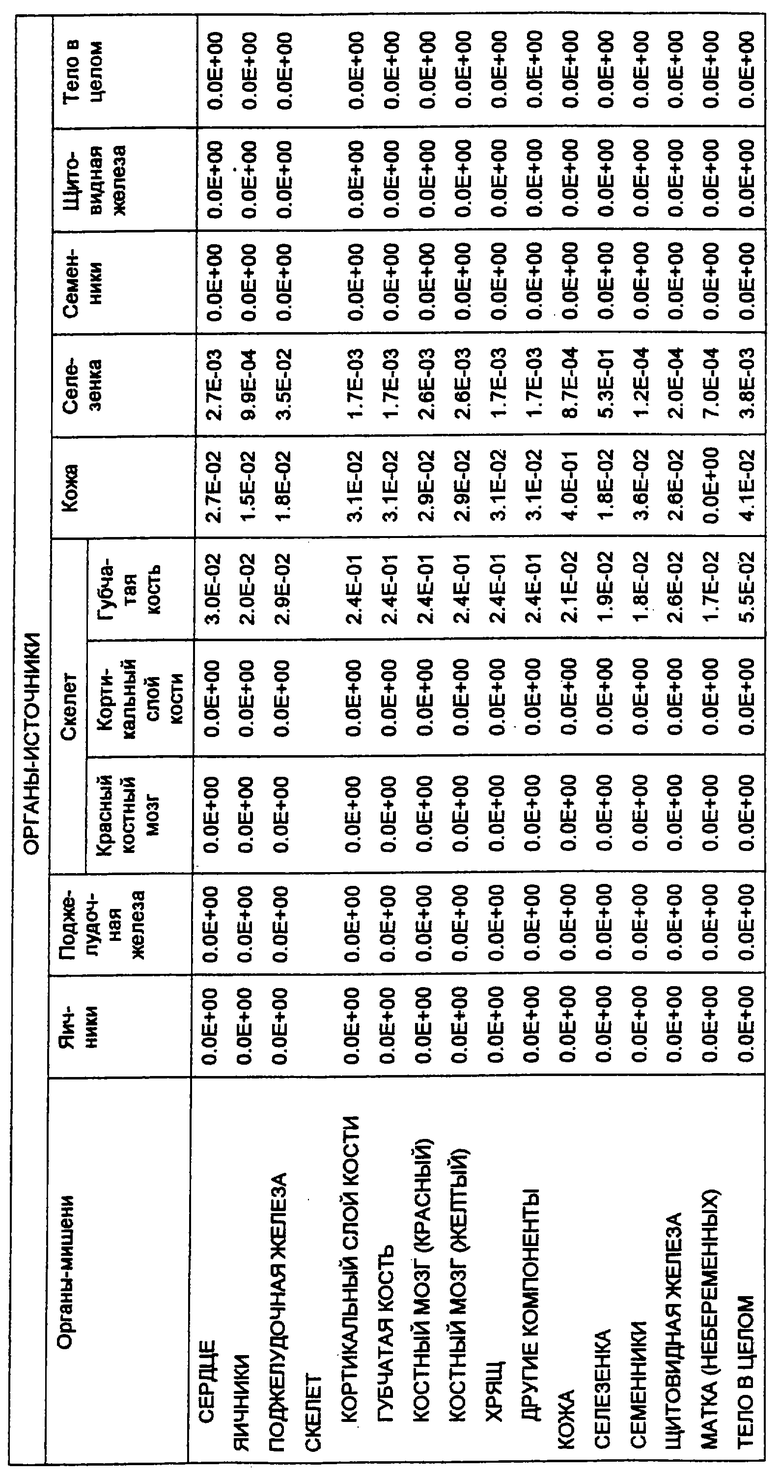

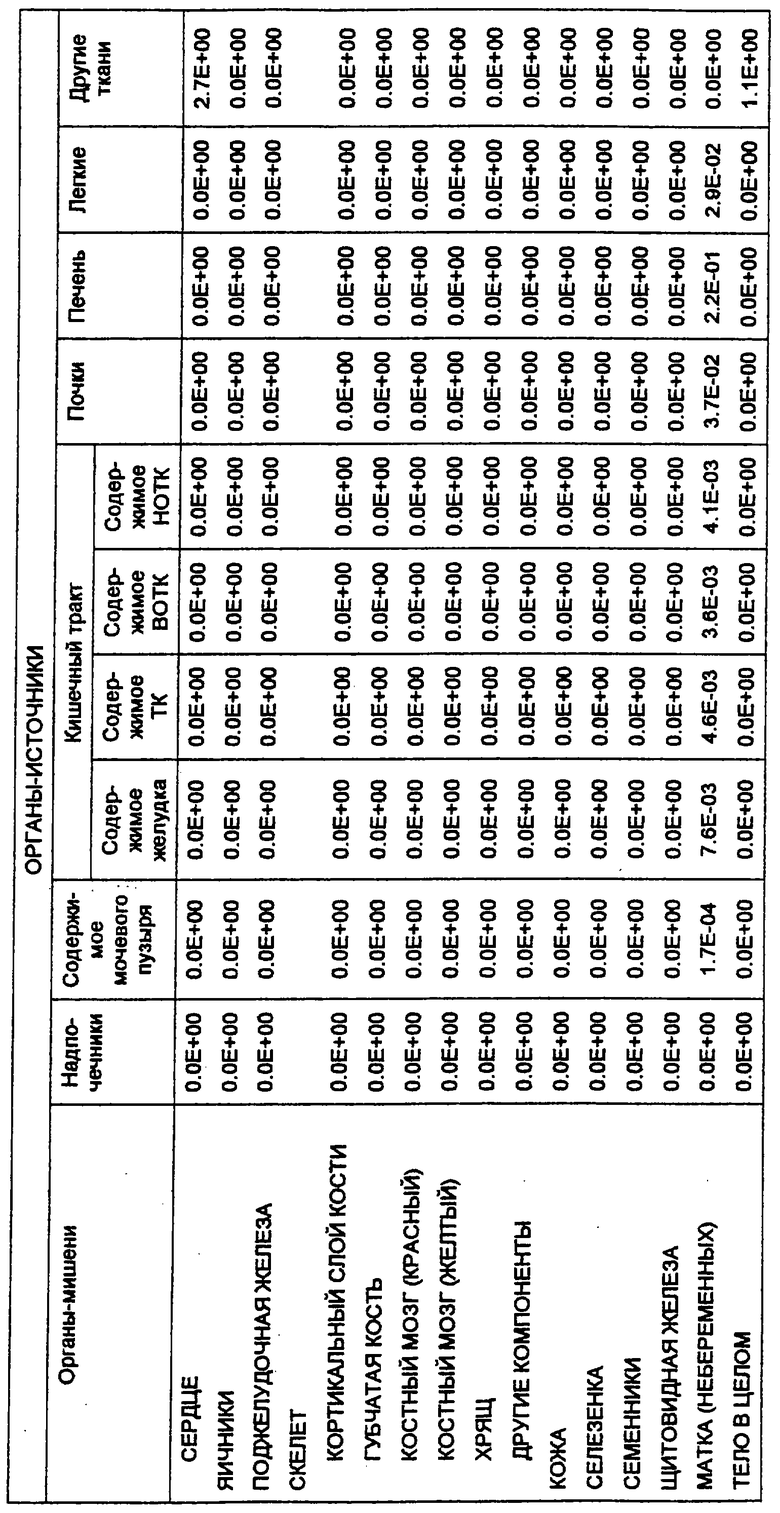
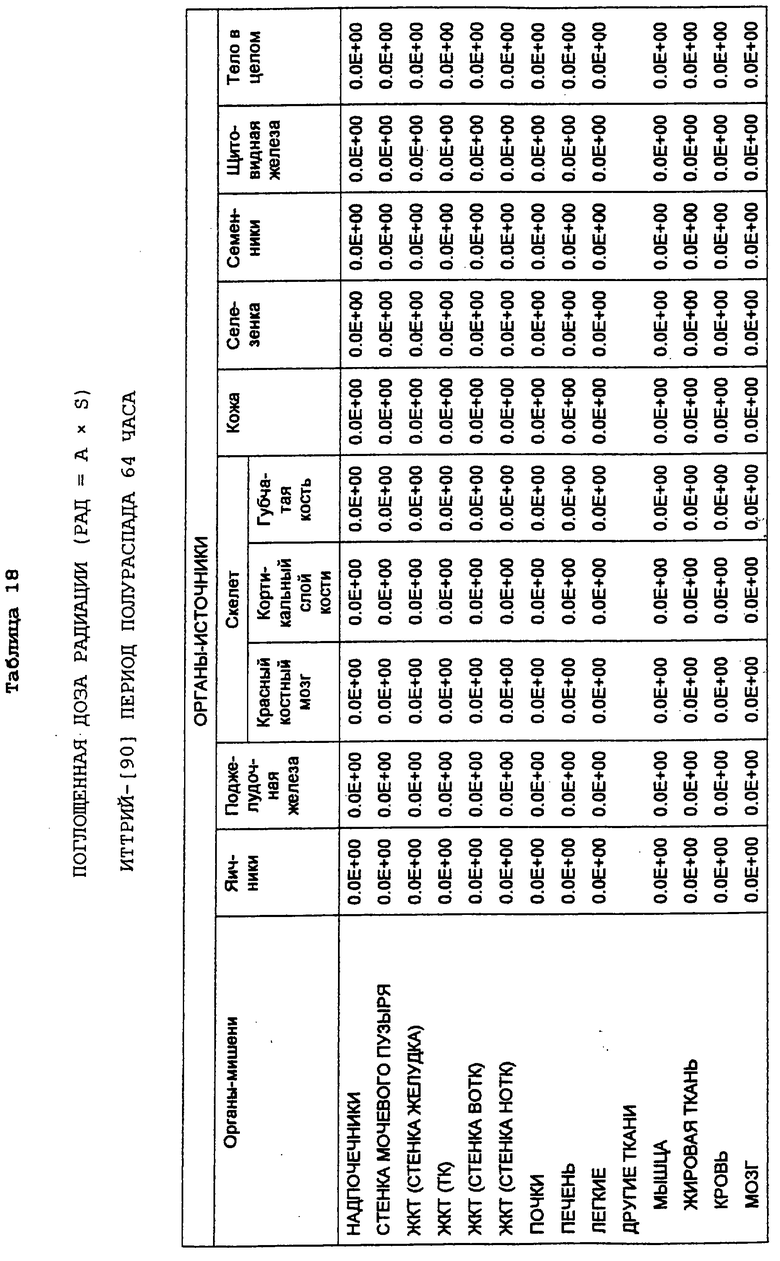
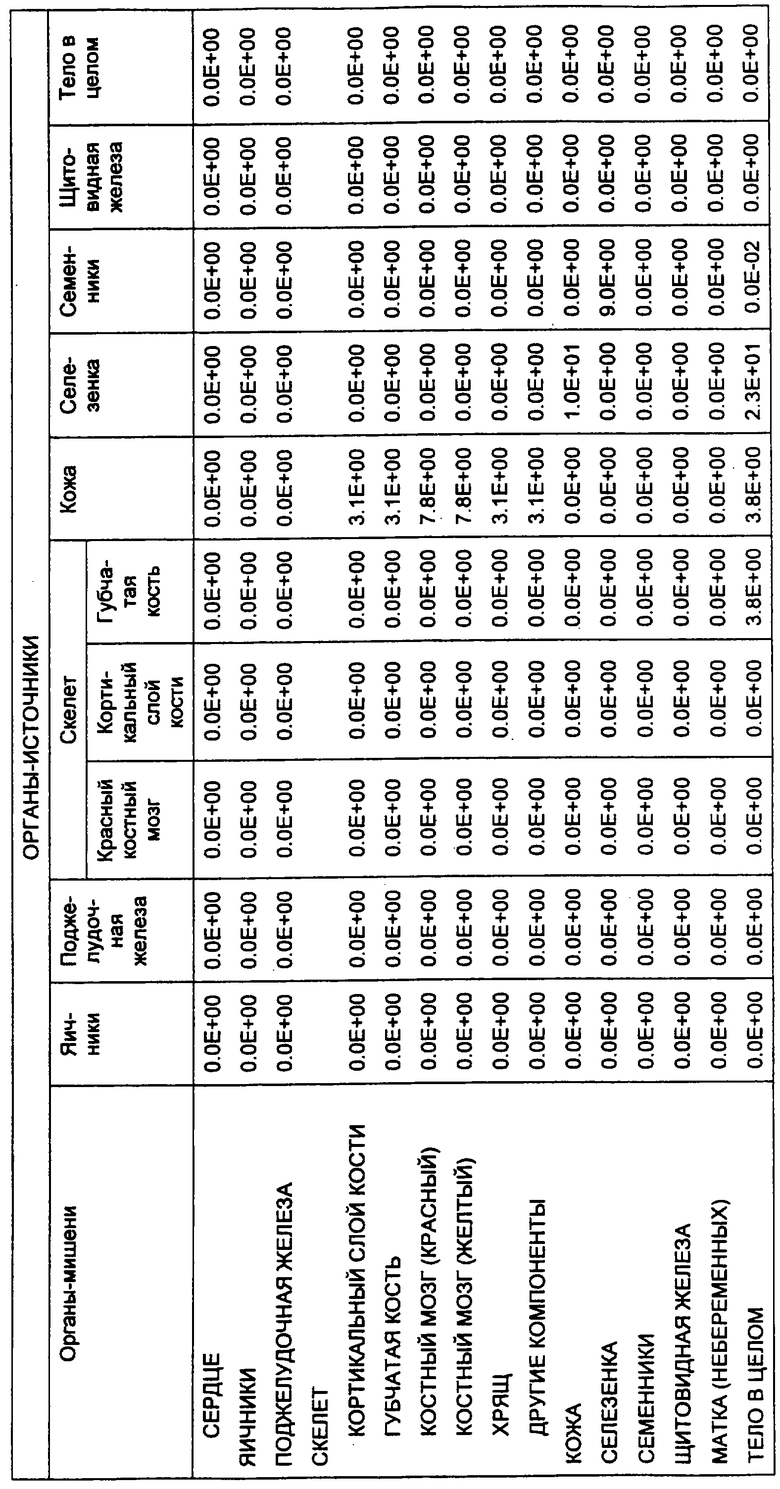
Оценки радиационной дозиметрии в результате введения 2В8-МХ, меченного индием-[111], равномерно распределенного у стандартного человека (70 кг), основанные на данных о распределении у животных через 72 часа после инъекции
Ссылка: A Schema for Absorbed-dose Calculation for Biologically Distributed Radionuclides, MIRD J. of Nucl. Med./Suppl. #1, 2/68.
Расчеты выполнены с использованием матрицы электронной таблицы в Symphony (Lotus Development Corporation) и осуществлены Phillip L. Hagan, MS, Nuclear Medicine Service, VA Hospital San Diego, CA 92161.

Ссылка: A Schema for Absorbed-dose Calculation for Biologically Distributed Radionuclides, MIRD J. of Nucl. Med./Suppl. #1, 2/68.
Расчеты выполнены с использованием матрицы электронной таблицы в Symphony (Lotus Development Corporation) и осуществлены Phillip L. Hagan, MS, Nuclear Medicine Service, VA Hospital San Diego, CA 92161.
II. Результаты
А. Исследования in vitro, проведенные с 2В8 и 2В8-МХ-DTPA
1. Получение и характеристика антитела 2В8 против CD20
В результате всего девяти слияний получено три гибридомы, продуцирующие антитела, которые эффективно конкурировали с радиоактивно меченным антителом Coulter B1. В каждом случае гибридому размножали в 24-луночном планшете. Первые два антитела, выделенные из слияний 3 и 4, имели один и тот же изотип, и оба были идентифицированы, как IgM. Третье антитело, продуцируемое слиянием 5 и обозначенное 2В8, определили как антитело изотипа каппа IgG1 и отобрали для продолжения исследований. Клон 2В8.Нll размножали и помещали на длительное хранение в жидкий азот. Клон 2В8.Нll субклонировали, чтобы получить клон 2B8.Hll.G3, и снова субклонировали для получения клона 2B8.Hll.G3.G9. Этот клон размножали для дальнейшего исследования, и антитело очищали аффинной белок-А-хроматографией.
Конкурентный анализ с использованием немеченых 2В8, B1 и Leu 16 и радиоактивно меченного Coulter B1, показал, что 2В8 способен более эффективно ингибировать связывание B1 с CD20, чем равные концентрации либо B1, либо Leu 16 (фиг.1). Сходные результаты получили (данные не показаны) при конкурентном исследовании с использованием 2В8, конъюгированного с ФИТЦ, нативного B1 и нерелевантных антител UPC-10 и S-003 (изотипов IgG 2а и 1 соответственно).
Прямое связывание с клеточным антигеном CD20 антител 2В8 и В1 сравнивали FACS-анализом, используя СD20-позитивные клетки SB и СD20-негативные клетки HSB. Результаты, показанные на фигуре 2, свидетельствуют о том, что для сравнимых количеств антитела с клетками SB больше связывалось 2В8, чем В1. Не наблюдалось существенного связывания нерелевантных антител с клетками SB. С клетками HSB при любых используемых реагентах наблюдали только фоновую флуоресценцию. Полученные результаты подтверждают специфичность взаимодействия 2В8 с антигеном CD20, и подтверждают, что 2В8 может иметь более высокое сродство к поверхностному антигену, чем В1.
Чтобы определить кажущуюся аффинность 2В8, очищенное антитело радиоактивно метили 125I, и возрастающие концентрации меченого антитела инкубировали с антиген-позитивными клетками SB; связанную с клетками радиоактивность определяли после 1-часового периода инкубации (фиг.3). Результаты свидетельствуют о том, что антитело 2В8 связывается с антигеном CD20 с константой кажущейся аффинности, равной 4,3×10-9 М.
Исследования нормальных лимфоцитов периферической крови человека проточной цитометрией показали, что 2В8 было специфично для В-клеток и не реагировало с другими типами лимфоцитов (например, Т-клетками, моноцитами, макрофагами). ФИТЦ-меченое 2В8 сравнивали с В1-ФИТЦ и Leu 16-ФИТЦ, используя одну и ту же популяцию лимфоцитов человека. Результаты, показанные в таблице 21, свидетельствуют о том, что 2В8 реагировало примерно с 14 процентами лимфоцитов периферической крови, в отличие от примерно 12 процентов для Leu 16 и 11 процентов для В1. Популяция лимфоцитов на основании другого маркера В-лимфоцитов (CD-19) составляла от 11 до 14 процентов. Наконец, когда лимфоциты периферической крови человека инкубировали с 2В8 и либо В1, либо Leu 16, и затем встречно красили маркером CD19 (Becton/Dickinson), популяция В-лимфоцитов с двойным окрашиванием составляла 9 процентов с 2В8 и 10 процентов либо с В1, либо с Leu 16. Данные результаты подтверждают сходство указанных реагентов.

Иммунопреципитация радиоактивно меченного клеточного антигена CD20, либо 2B8, либо В1 в результате приводила к осаждению пары неразличимых видов белков с молекулярными массами примерно 33 и 35 кД (данные не показаны).
2. Получение и характеристика 2B8-MX-DTPA
Конъюгат 2B8-MX-DTPA получали за счет реакции антитела с молярным избытком 4:1 изотиоцианатбензил-3-метилдиэтилен-триаминопентауксусной кислоты (4). Обычно вводили 1-2 моль хелата MX-DTPA на моль антитела 2B8. Как видно из результатов, представленных на фиг.4, конъюгат 2B8-MX-DTPA не проявляет явного ослабления иммунореактивности по сравнению с нативным 2B8, так как и нативное, и конъюгированное антитела 2B8 проявляют фактически идентичные профили ингибирования В1; значения IC50 для 2В8 и 2B8-MX-DTPA составляли примерно 3 и 4 мкг/мл соответственно. Указанные результаты получали, используя антитело В1, меченное 125I при радиоиммуноанализе на целых клетках, выполненном с использованием клеток SB. Сходные результаты получали, используя 2В8 или 2B8-MX-DTPA в качестве ингибиторов связывания 2В8, меченного 125I, с клетками SB; как 2В8, так и его конъюгат с MX-DTPA ингибировали связывание 125I-2B8 с клетками SB при концентрациях примерно 3-4 мкг/мл (данные не показаны).
Чтобы оценить стабильность in vitro нативного 2В8 и конъюгата 2B8-MX-DTPA, образцы в нормальном солевом растворе, или солевом растворе, содержащем 10 мМ глицина-НСl, рН 6,8, инкубировали при 4° и 30°С в течение 12 недель, и еженедельно анализировали аликвоты, используя следующие анализы: иммунореактивность иммуноферментным анализом на целых клетках, электрофорезом в SDS-ПААГ при восстанавливающих и невосстанавливающих условиях, и гель-электрофорезом с изоэлектрофокусированием. Хотя анализы иммунореактивности не выявили ослабления узнавания антигена образцами антител, инкубированными и при той и при другой температуре (фигура 5), интервал изоэлектрического фокусирования для антитела (рН 7,30-8,40 на 0 неделе), который был стабилен при 4°С, показал снижение на 0,2 единицы рН при 30°С через шесть недель (таблица 22). Однако данный результат может иметь двойное объяснение, так как находится в пределах ошибки эксперимента для анализа:
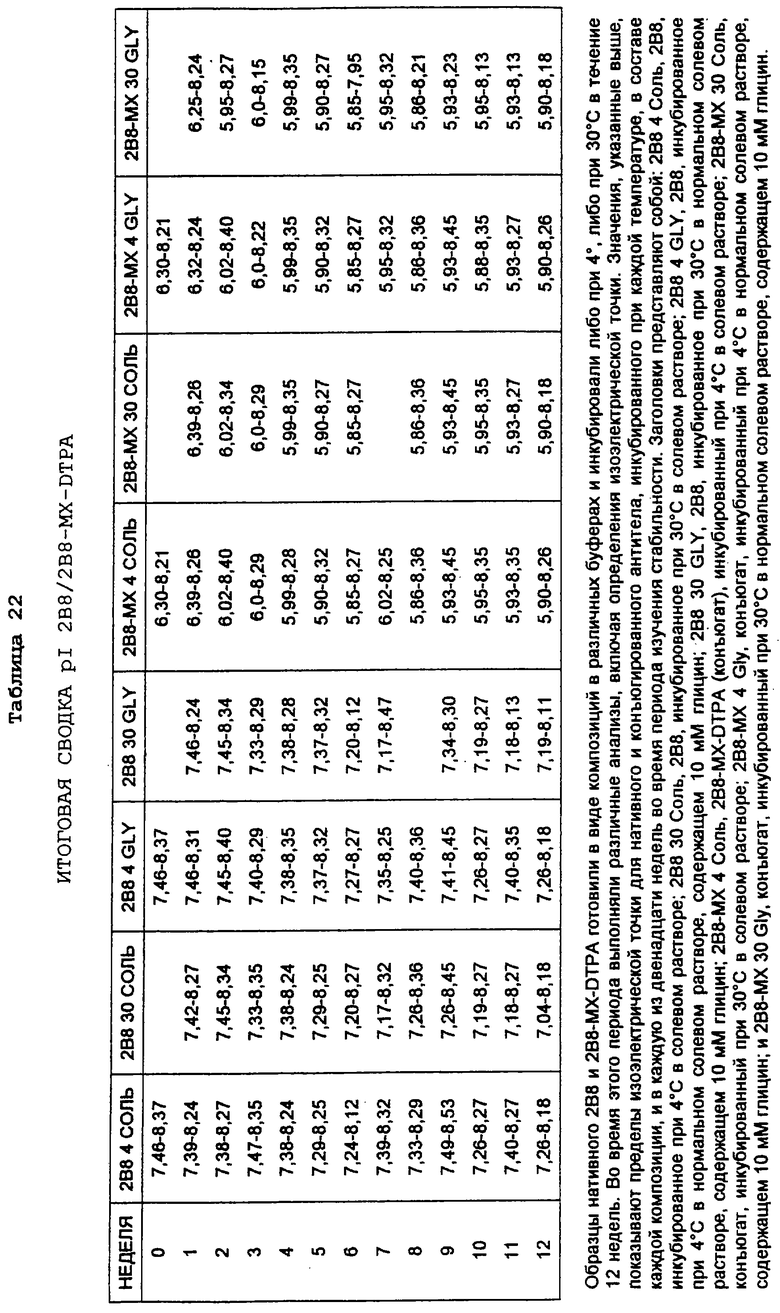
Наконец, используя электрофорез в невосстанавливающем SDS-ПААГ, после 1 недели в образце антитела, хранившегося при 30°С, выявлены агрегаты высокой молекулярной массы (таблица 23). Денситометрические анализы гелей показали, что агрегаты составляют от 8 до 17% образцов (таблица 23). Однако когда эти образцы анализировали электрофорезом в восстанавливающем SDS-ПААГ, не обнаружено признаков особых видов молекул с высокой молекулярной массой, свидетельствуя об образовании ковалентных агрегатов антител при 30°С. Кроме того, не наблюдали потери иммунореактивности.

В ходе указанного изучения стабильности образцы 2В8-MX-DTPA, инкубированные как при 4°С, так и при 30°С, также тестировали на включение радиоактивного металла, используя 90Y. Образцы, которые анализировали на 4, 8 и 12 неделе включали >90% 90Y, независимо от температуры инкубации.
Наконец, в отдельном исследовании аликвоты 2B8-MX-DTPA, инкубированные при 4° и 30°С в течение 10 недель, радиоактивно метили 111In и оценивали его биологическое распределение в тканях мышей BALB/c. При обеих температурах инкубации конъюгат давал сходное биологическое распределение (данные не показаны). Кроме того, полученные результаты были сходны с результатами биологического распределения, полученными на мышах BALB/c с использованием меченого 111I конъюгата, хранившегося при 4°С (смотри ниже).
Было установлено, что протоколы радиоактивного мечения и для 111In и для 90Y воспроизводимы. Обычно получали включения радиоактивной метки >95% для 111In и >90% для 90Y. Удельные активности конъюгатов, меченных 111In и 90Y, постоянно были в пределах 2-3 и 10-15 мКюри/мг антитела соответственно. В начале разработки протоколов радиоактивного мечения 111In и 90Y не образовавшие комплексы радиоизотопы удаляли из радиоактивно меченного 2B8-MX-DTPA, используя ВЭЖХ-гель-проникающую хроматографию. В более поздних экспериментах исключили ВЭЖХ-очистку меченного индием конъюгата, благодаря получению высокого уровня включения радиоактивной метки (>95%) при использовании данного изотопа.
Иммунореактивность препаратов 2B8-MX-DTPA, меченных 111In и 90Y, анализировали способом Lindmo (3). Обнаружено, что 2B8-MX-DTPA, меченный 111In, обладает 100% иммунореактивностью (фиг.6), и определено, что конъюгат, меченный 90Y, иммунореактивен на 60% (данные не показаны).
3. Характеристика 2B8-MX-DTPA, меченного 111In и 90Y
Предварительные эксперименты с конъюгатом, меченным 90Y, показали, что значительная деградация антитела и потеря иммунореактивности происходят при удельных активностях >10 мКюри/мг антитела. Поэтому разработали композицию для того, чтобы минимизировать влияние радиолиза. Хотя были оценены и найдены эффективными несколько низкомолекулярных акцепторов свободных радикалов, высокие концентрации сывороточного альбумина человека (ЧСА) были наиболее эффективны в сохранении целостности антител и иммунореактивности (фигуры 7-9).
Антитело, меченное 90Y, готовили в составе композиции в 1 × pbs, pH 7,4, содержащем 75 мг/мл ЧСА; также добавляли диэтилентриаминопентауксусную кислоту (DTPA) до конечной концентрации 1 мМ, чтобы гарантировать, что любой 90Y, который может освободиться от антитела, будет хелатирован. Деградацию 2B8-MX-DTPA, радиоактивно меченного до удельной активности 14,6 мКюри/мг, оценивали в 0 и 48 часов, используя электрофорез в SDS-ПААГ и авторадиографию. На фигурах 8 и 9 показано, что радиоактивно меченное антитело не проявляет значительной деградации в течение 48-часового периода в случае инкубации при 4°С. Анализ с использованием мгновенной тонкослойной хроматографии показал, что потеря 90Y составляла менее 2% в течение 48 часовой инкубации (таблица 24). Иммунореактивность также была относительно постоянной на уровне 60% (таблица 24).
Стабильность 90Y-2B8-MX-DTPA, приготовленного в композиции для клинического применения
Радиоактивно меченный конъюгат (удельная активность 14,6 мКюри/мг) готовили в составе композиции в PBS, pH 7,4, содержащем 75 мг/мл сывороточного альбумина человека и 1 мМ DTPA, и аликвоты инкубировали при 4°С. Стабильность конъюгата анализировали в указанных временных точках электрофорезом в SDS-ПААГ и авторадиографией, мгновенной тонкослойной хроматографией и анализом связывания на целых клетках. Результаты свидетельствуют, что примерно 96% радиоактивного металла остается связанным с конъюгатом через 48 часов при 4°С, и что иммунореактивность антитела остается постоянной примерно на уровне 60%.
Исследования композиции также проводили с конъюгатом, меченным 111In; удельная активность составляла 2,2 мКюри/мг. Радиоактивно меченное антитело оценивали в 1 × PBS, рН 7,4, содержащем 50 мг/мл ЧСА. На фигуре 10 показана фотография авторадиограмм во время инкубации образцов 0 и 48 час; денситометрический анализ авторадиограмм свидетельствует о том, что в течение всего периода исследования не было деградации радиоактивно меченного антитела (фигуры 11, 12). Анализ образцов мгновенной тонкослойной хроматографией не выявил потери 111In (таблица 25); более того, иммунореактивность сохранялась примерно на уровне 100% (таблица 25).
Стабильность 111In-2B8-MX-DTPA, приготовленного в композиции для клинического применения
Радиоактивно меченный конъюгат (удельная активность 2,2 мКюри/мг) готовили в составе композиции в PBS, рН 7,4, содержащем 50 мг/мл сывороточного альбумина человека, и аликвоты инкубировали при 4°С. Стабильность конъюгата анализировали электрофорезом в SDS-ПААГ и авторадиографией, мгновенной тонкослойной хроматографией и анализом связывания на целых клетках. Результаты свидетельствуют, что примерно 96% радиоактивной метки остается связанным с конъюгатом через 48 часов при 4°С, и что иммунореактивность антитела остается постоянной примерно на уровне 100%.
В том случае, когда препарат 2B8-MX-DTPA, приготовленный в составе композиции для клинического применения, радиоактивно меченный 90Y до удельной активности 14,6 мКюри/мг, инкубировали в течение 96 часов при 37°С в сыворотке человека и анализировали электрофорезом в SDS-ПААГ в невосстанавливающих условиях и авторадиографией, в течение периода инкубации терялось менее 4% радиоизотопа. Результаты денситометрического сканирования авторадиограмм во время ноль и 96 час не выявили существенной деградации радиоактивно меченного конъюгата (фигуры 13-15). Эти результаты были подтверждены анализами посредством аналитической тонкослойной хроматографии образцов во время ноль и 96 часов (таблица 26). Взятые вместе указанные результаты свидетельствуют о том, что конъюгат, меченный иттрием, стабилен при условиях, используемых в данном исследовании. Сходные результаты были получены с конъюгатом 2B8-MX-DTPA, меченным 111In (фигуры 16-18).
Анализ аналитической тонкослойной хроматографией конъюгата 90Y-2B8-MX-DTPA, инкубированного в сыворотке человека в течение 96 часов при 37°С
Образцы сыворотки человека, содержащие 90Y-2B8-MX-DTPA (удельная активность 14,6 мКюри/мг), анализировали в указанных временных точках посредством нанесения пятен образцов в разведении 1:20 объемом 1 мкл на пластины для моментальной тонкослойной хроматографии; образцы анализировали в трех повторах. Хроматографические пластины обрабатывали восходящей хроматографией в 10% ацетате аммония в смеси метанол:вода (1:1; об./об.), сушили и разрезали поперек на половины. Затем определяли радиоактивность, связанную с верхней и нижней половинами каждой пластины, и рассчитывали процент радиоактивности, связанной с конъюгатом. (Свободный радиоактивный металл мигрирует с фронтом растворителя в то время, как радиоактивность, связанная с белком, остается на старте.) Показаны средние значения каждого определения радиоактивности, связанной с конъюгатом.
В. Исследования на животных
1. Фармакологические/токсикологические исследования высоких доз 2В8 и 2B8-MX-DTPA
В GLP-исследовании, выполненном в White Sands Research Center (исследование номер 920111), макакам-крабоедам вводили внутривенные инъекции различных доз 2В8. Образцы крови брали перед каждой новой инъекцией, и кровь подвергали проточной цитометрии для оценки популяции лимфоцитов (таблица 27).



Животным в группах с I по IV делали инъекции каждые 48 часов, всего семь инъекций; животным группы V инъекцию делали один раз в 0 день. Животных групп III и IV забивали на 14 день.
Не отмечалось существенного фармакотоксического действия, связанного с введением анти-СD20-антитела 2В8 ни по одному из клинических параметров, оцениваемых во время или после исследования. Аналогично не отмечалось отклонений во время анализа на гистопатологию различных образцов, полученных от животных групп III и IV.
Длительность исследования составляла 14 дней, и животных во время исследования оценивали по следующим категориям: клинические наблюдения, масса тела, температура тела, потребление пищи и воды, выделение фекалий, химические характеристики сыворотки, гематология, анализ мочи и физические обследования. Кроме того, у животных каждой группы брали кровь на 0, 1, 7 и 13 день, и проводили анализ крови по уровням антител (2В8) в сыворотке и уровням Т- и В-клеток. На 13 день животных групп III и IV забивали, и выбранные ткани после приготовления образцов исследовали в световом микроскопе. Оценивали следующие ткани: сердце, селезенку, печень, почки, легкие, кору головного мозга, спинной мозг, лимфатический узел, желудок, подвздошную кишку, толстую кишку, скелетную мышцу, семенники/яичники, поджелудочную железу и костный мозг.
Когда анализировали уровни циркулирующих Т- и В-клеток в крови обработанных животных, у животных в группах со II по V выявлена >50% потеря циркулирующих В-клеток на 1 день (фиг.19); введение антитела не оказывало влияния на уровни Т-клеток (данные не показаны). У всех групп, получавших 2В8, продемонстрировано насыщение В-клеток и избыток антитела в плазме (не показано). У животных в группе V, которые получали однократную дозу 2В8 10,0 мг/кг, также выявлено снижение уровней циркулирующих В-клеток, эквивалентное снижению, наблюдаемому у животных в других группах.
Животных в группах I, II и V обследовали вплоть до 52 дня (фиг.20). Уровни В-клеток возвращались к >70% от нормального уровня на 38 день, за исключением одного животного в группе II (PR0804) и одного животного в группе V (PR0716). Уровни циркулирующих В-клеток у этих животных через 52 дня оставались примерно равными 40% от нормальных уровней.
В дополнение к данному исследованию оценивали фармакотоксическое действие 89Y-2B8-MX-DTPA у макак-крабоедов в GLP-исследовании, выполненном в White Sands Research Center (исследование №920611). Конъюгат клинической степени очистки нагружали нерадиоактивным 89Y. Конъюгат, несущий иттрий, готовили в составе композиции в PBS, рН 6,8, содержащем 75 мг/мл сывороточного альбумина человека и 1 мМ DTPA (композиция для клинического применения), и вводили внутривенно, как описано в разделе “Способы”.
Как показывают результаты на фигуре 21, 89Y-меченый 2В8-MX-DTPA оказывал незначительное, если это имело место, влияние на циркулирующие В-клетки у этих животных, независимо от введенной дозы. Кроме того, не обнаружено других отклонений, кроме общего истощения популяции лимфоцитов (20-43%), ни в каких оцениваемых клинических параметрах, включая химические анализы сыворотки, анализы мочи, массы тела и температуры.
2. Фармакокинетические исследования 2В8 и 2В8-МХ-DTPA
Как описано выше, животные в группе V при GLP-исследовании получали однократную дозу 2В8, составляющую 10,0 мг/кг. Анализ линейной регрессии данных свидетельствует о том, что нативное антитело было выведено из циркуляции у этих обезьян со значением β t1/2, примерно равным 4,5 дням. В сходном исследовании с использованием мышей BALB/c, анализом линейной регрессии (не показано) были определены значения β t1/2 для нативного и конъюгированного 2В8, равные 8,75 дня (фиг.22). Указанные результаты свидетельствуют о том, что конъюгация 2В8 не оказывает влияния на его клиренс у мышей BALB/c.
3. Исследования биологического распределения и локализации в опухоли радиоактивно меченного 2B8-MX-DTPA
Основываясь на предварительном эксперименте по биологическому распределению, описанном выше (раздел 2d), конъюгат 2В8 радиоактивно метили 111In до удельной активности 2,3 мКюри/мг, и приблизительно 1,1 мкКюри инъецировали каждой из двадцати мышей BALB/c, чтобы определить биологическое распределение радиоактивного материала. Затем группы из пяти мышей в каждой забивали в 1, 24, 48 и 72 час, и их органы и часть кожи, мышц и костей извлекали и готовили для анализа. Кроме того, собирали мочу и фекалии и анализировали во временных точках в период от 24 до 72 час. Уровень радиоактивности в крови падал с 40,3% инъецированной дозы на грамм в 1 час до 18,9% на 72 часу (таблицы 1-4; фиг.23). Значения для сердца, почки, мышцы и селезенки оставались в пределах 0,7-9,8% в течение всего эксперимента. Уровни радиоактивности, выявленные в легких, снижались с 14,2% в 1 час до 7,6% в 72 час; сходным образом соответствующие значения инъецированной дозы на грамм в печени составляли 10,3% и 9,9%. Указанные данные использовали при определении оценок поглощенной дозы радиации 111In-2B8-MX-DTPA (таблица 19).
Биологическое распределение 90Y-меченого конъюгата, обладающего удельной активностью 12,2 мКюри/мг антитела, оценивали у мышей BALB/c. Получили включения радиоактивной метки >90%, и радиоактивно меченное антитело очищали ВЭЖХ. Депонирование радиоактивности в ткани оценивали в основных органах и в коже, мышце, кости и в моче и фекалиях в течение 72 часов, и выражали в виде процента инъецированной дозы/г ткани. Результаты, показанные в таблицах 5-8 и на фигуре 24, свидетельствуют, что в то время как уровни радиоактивности, связанной с кровью, падали примерно от 39,2% инъецированной дозы на грамм в 1 час до приблизительно 15,4% в 72 часа; уровни радиоактивности, связанной с хвостом, сердцем, почкой, мышцей и селезенкой, оставались довольно постоянными около 10,2% или меньше в течение всего хода эксперимента. Важно, что радиоактивность, связанная с костью, была в пределах от 4,4% инъецированной дозы на грамм кости в 1 час до 3,2% в 72 часа. Взятые вместе, эти результаты свидетельствуют о том, что с конъюгатом было ассоциировано небольшое количество свободного иттрия, и что небольшое количество свободного радиоактивного металла высвобождалось в ходе исследования. Эти данные использовали при определении оценок поглощенной дозы радиации для 90Y-2B8-MX-DTPA (таблица 20).
Для исследований локализации в опухоли готовили 2В8-МХ-DTPA и радиоактивно метили 111In до удельной активности 2,7 мКюри/мг. Затем сто микролитров меченого конъюгата (примерно 24 мкКюри) инъецировали каждой из 12 бестимусных мышей, несущих В-клеточную опухоль Ramos. Масса опухолей была в пределах от 0,1 до 1,0 грамм. Во временных точках 0, 24, 48 и 72 часа после инъекции брали 50 мкл крови посредством ретроорбитальной пункции, мышей забивали смещением шейных позвонков и извлекали хвост, сердце, легкие, печень; почки, селезенку, мышцы, бедренную кость и опухоль. После подготовки и взвешивания тканей определяли радиоактивность, связанную с каждым образцом ткани, используя гамма-счетчик, и значения выражали в виде процента инъецированной дозы на грамм.
Результаты (фиг.25) свидетельствуют о том, что концентрации 111In-2B8-MX-DTPA в опухоли постоянно возрастали в течение эксперимента. Тринадцать процентов инъецированной дозы накапливалось в опухоли через 72 часа. Уровни в крови, напротив, падали в течение эксперимента примерно от 30% в нулевое время до 13% в 72 часа. Все другие ткани (за исключением мышцы) содержали от 1,3 до 6,0% инъецированной дозы на грамм ткани к концу эксперимента; мышечная ткань содержала примерно 13% инъецированной дозы на грамм.
С. Дозиметрия
Суммарные данные по дозиметрии, полученные в исследованиях биологического распределения у нормальных мышей BALB/c и представленные в таблицах 19 и 20 для конъюгатов, меченные индием и иттрием соответственно, согласуются с данными, представленными в литературе в случае сравнения на миллиКюри инъецированной дозы (5), и свидетельствуют о том, что конъюгаты 2В8, меченные и иттрием и индием, можно без риска оценить в отношении клинической эффективности у пациентов с лимфомой.
D. Токсикология
1. 2В8: Тест общей безопасности однократной дозы
Мышам и морским свинкам вводили однократную внутрибрюшинную дозу 2В8 (0,5 мл или 5,0 мл соответственно) и наблюдали в течение семи дней. Никаких явных признаков токсичности не обнаружили.
2. 2В8 и 2B8-MX-DTPA: Иммуногистологические исследования на тканях человека
Тканевую реактивность мышиного моноклонального антитела 2В8 оценивали, используя панель из 32 различных тканей человека, фиксированных ацетоном. Антитело 2В8 реагирует с анти-СD20-антигеном, который имел очень ограниченный характер распределения в тканях, наблюдаемый только в подгруппе клеток лимфоидной ткани, включая клетки источника кроветворения.
В лимфатическом узле иммунореактивность наблюдали в популяции зрелых кортикальных В-лимфоцитов, а также пролиферирующих клетках зародышевых центров. Позитивную реактивность также наблюдали в периферической крови, В-клеточных районах миндалин, белой пульпе селезенки, и с 40-70% модулярных лимфоцитов, обнаруженных в тимусе. Позитивную реактивность также наблюдали в фолликулах lamina propria (пейеровы бляшки) толстого кишечника. Наконец агрегаты или рассеянные лимфоидные клетки в строме различных органов, включая мочевой пузырь, молочную железу, шейку матки, пищевод, легкое, околоушную железу, простату, тонкий кишечник и желудок, также были позитивны к антителу 2В8.
Установлено, что все простые эпителиальные клетки, а также многослойный эпителий и плоский эпителий различных органов не реактивны. Аналогично, реактивность не наблюдали с нейроэктодермальными клетками, включая такие клетки головного мозга, спинного мозга и периферических нервов. Мезенхимальные элементы, такие как клетки скелетной и гладкой мускулатуры, фибробласты, эндотелиальные клетки и полиморфно-ядерные клетки, появляющиеся при воспалении, также были выявлены как негативные.
Тканевую реактивность конъюгата 2B8-MX-DTPA оценивали, используя панель из шестнадцати тканей человека, которые были фиксированы в ацетоне. Как показано ранее для нативного антитела, конъюгат 2B8-MX-DTPA распознавал СD20-антиген, который проявлял очень ограниченный характер распределения в тканях, наблюдаемый только в подгруппе клеток источника лимфоидных клеток. В лимфатическом узле иммунореактивность наблюдали в популяции В-клеток. Сильную реактивность наблюдали в белой пульпе селезенки и модулярных лимфоцитах тимуса. Иммунореактивность также наблюдалась в рассеянных лимфоцитах в мочевом пузыре, сердце, толстом кишечнике, печени, легком и матке, и объяснялась присутствием клеток воспаления, имеющихся в этих тканях. Как описано для нативного антитела (выше), не наблюдали реактивности с нейроэктодермальными клетками или мезенхимальными элементами.
III. Обсуждение
Мышиное моноклональное анти-СD20-антитело 2В8, продуцируемое клоном с таким же названием, проявляет аффинность к СD20-антигену В-клеток, которая может быть выше, чем аффинность, наблюдаемая для антитела В1, что определено по конкуренции с антителами с известной специфичностью к СD20-антигену, и посредством анализа Скатчарда. Кроме того, данные по иммунопреципитации свидетельствуют о том, что антиген, преципитируемый 2В8, по-видимому, является тем же самым антигеном, что и антиген, преципитируемый В1, так как оба антитела преципитировали дублет с относительными молекулярными массами 33 и 35 кД. Цитофлюорографический анализ специфичности антитела 2В8 для лимфоцитов периферической крови показывает, что антитело специфично реагирует с В-клетками, и не проявляет реактивности с Т-клетками, или другими типами лимфоцитов. Наконец, предварительные данные о стабильности свидетельствуют о том, что антитело стабильно при 30°С в течение 12 недель без потери иммунореактивности.
Когда антитело 2В8 конъюгировали с метилбензилдиэтилен-триаминопентауксусной кислотой (MX-DTPA), фактически не наблюдали снижения иммунореактивности относительно нативного антитела. Более того, радиоактивное мечение конъюгата либо 111In, либо 90Y давало меченые конъюгаты с иммунореактивностью в 100% и 60% соответственно. Исследования стабильности конъюгатов, меченных 111In или 90Y, инкубированных в сыворотке человека в течение 96 часов при 37°С, показали ничтожно малую потерю радиоактивного металла в течение исследования, свидетельствуя о том, что конъюгаты будут стабильными при клиническом применении.
Исследования локализации в опухолях у бестимусных мышей с использованием препарата 2В8-MX-DTPA, меченного индием, показали, что в течение эксперимента с опухолевыми клетками связывались возрастающие количества конъюгата без необычного накопления в других тканях. Кроме того, на основании биологического распределения получали дозиметрические оценки. Более того, дозиметрические оценки, полученные на основе исследований биологического распределения, находятся в соответствии с данными, опубликованными в литературе. Наконец, исследования перекрестной реактивности с тканями человека нативного и конъюгированного антител показали, что оба антитела узнают антиген с сильно ограниченным распределением в тканях, реагируя только с подгруппой клеток в лимфоидных тканях, включая клетки источника кроветворения. Взятые вместе эти результаты свидетельствуют о том, что конъюгация не изменяет тканевую специфичность антитела и что радиоактивно меченные конъюгаты стабильны in vivo и узнают СD20-антиген, присутствующий на поверхности опухолей, полученных экспериментально у бестимусных мышей.
В том случае, когда 2В8 использовали в фармакологическом/токсикологическом исследовании высоких доз, антитело не оказывало существенного фармакологического действия ни на какой из оцениваемых параметров ни во время, ни после исследования. Аналогично не отмечено отклонений в ходе анализа различных гистопатологических препаратов, оцениваемых световой микроскопией. Неожиданно все используемые дозы антитела приводили к заметному истощению популяции циркулирующих В-клеток. Однако уровни циркулирующих В-клеток возвращались примерно до нормальных уровней после того, как введение антитела прекращалось. В группе обезьян, которым вводили однократную дозу (группа V) нативное антитело выводилось из циркуляции с кажущимся значением β t1/2, приблизительно равным 4,5 дням. Как прогнозировалось, когда такие фармакокинетические исследования выполняли на мышах BALB/c, антитело 2В8 выводилось со значением β t1/2, равным 8,75 дням. Таким образом, взятые вместе, эти данные свидетельствуют о том, что нативное антитело также может оказывать некоторое клиническое действие как дополнение к радиоактивно меченным конъюгатам.
В целом результаты авторов изобретения показывают, что высокоаффинное антитело 2В8 и его MX-DTPA-конъюгат проявляют в тканях человека реактивность ограниченного характера. Кроме того, у приматов нативное антитело нетоксично и вызывает временный клиренс В-клеток; однако после того как антитело выводится из циркуляции, уровни В-клеток возвращаются к исходным довольно быстро. Кроме того, конъюгаты 2B8-MX-DTPA, меченные индием и иттрием, выглядели стабильными in vitro, не теряя радиоактивного металла в ходе пролонгированной инкубации в сыворотке человека. Наконец оценки дозы радиации, полученные на основе биологического распределения 2B8-MX-DTPA, меченного 90Y или 111In, у мышей BALB/c при пересчете на миллиКюри инъецированной дозы соответствуют оценкам дозы, полученным на основании клинических исследований на человеке с использованием конъюгированных антител против общего идиотипа, меченных указанными изотопами.
IV. Краткое изложение доклинической разработки протокола радиоактивного мечения "mix-and-shoot" для получения 90Y-MX-DTPA
А. Введение
Мышиное моноклональное анти-СD20-антитело(2В8), меченное 90Y, оценивали в фазе I клинических испытаний при лечении рецидивирующей В-клеточной лимфомы. В исходном протоколе, применяемом для получения антитела, меченного иттрием, использовали этап высокоэффективной жидкостной хроматографии (ВЭЖХ) для удаления не связанного с белком радиоизотопа перед приготовлением композиции и введением пациентам. К сожалению, на этот процесс тратиться чрезвычайно много времени, в результате приводя к более длительному экспонированию антитела с радиоизотопом в незащищенном состоянии. Это приводит к усиленному радиолизу антитела с сопутствующим снижением иммунореактивности. Кроме того, аспект трудоемкости процесса делает трудным приготовление более одной дозы в день в радиофармации. Упрощение способа способствовало бы его осуществлению на месте в клинике в качестве альтернативы использованию NIPI Pharmacy Services как аптеки радиоактивных средств.
В соответствии с этим разработали модифицированную процедуру радиоактивного мечения, названную способом "mix-and-shoot", который исключает необходимость в очистке ВЭЖХ, поддерживая высокое включение радиоактивной метки и лучшее сохранение иммунореактивности. Исследования стабильности in vitro, а также исследования биологического распределения у мышей показали, что радиоактивно меченное антитело, полученное способом "mix-and-shoot", сравнимо с материалом, получаемым с использованием современного процесса с ВЭЖХ. Результаты указанных доклинических исследований свидетельствуют о том, что новый протокол "mix-and-shoot" можно использовать для приготовления 2B8-MX-DTPA, меченного 90Y, пригодного для применения в клинических испытаниях.
В. Материалы и способы
Материалы
1. Клетки
Линии лимфобластных клеток человека SB (CD20-позитивные) и HSB (СD20-негативные) получали из Американской коллекции типов культур (American Type Culture Collection) и поддерживали в RPMI-1640, содержащей 10% фетальной сыворотки теленка с добавлением глутамина.
2. Антитела
Антитело 2В8 очищали в производственном отделе из надосадка биореактора с полыми волокнами, используя протоколы, описанные ранее в IND (BB-IND 4850/4851).
3. Дополнительные реактивы
Хлорид иттрия-[90] получали из Amersham. Все другие реактивы получали из источников, описанных в прилагаемых сообщениях, приведенных ниже. Реактивы, используемые для протоколов радиоактивного мечения, обрабатывали для того, чтобы удалить загрязнение ионами тяжелых металлов, которые могут конкурировать с радиоизотопами во время этапа радиоактивного мечения (смотри раздел “Способы”). Реактивы готовили в условиях, определенных GLP, в производственном отделе IDEC следуя утвержденным документам по серийному производству.
Способы
1. Получение 2В8-МХ-DТРА
MX-DTPA клинической степени очистки получали из Coulter Immunology в виде динатриевой соли в воде и хранили при -70°С. Конъюгат (2B8-MX-DTPA) готовили в производственном отделе. Для данных исследований использовали две различных партии конъюгата; обе были предоставлены в нормальном солевом растворе в концентрации 10 мг/мл. Конъюгаты фильтровали в стерильных полипропиленовых шприцах объемом 2 мл и хранили при 2-8°С.
2. Поддержание условий отсутствия металлов
Все манипуляции с реагентами выполняли так, чтобы минимизировать возможность загрязнения металлами. Использовали полипропиленовые и полистироловые пластиковые сосуды, такие как колбы, лабораторные стаканы и градуированные цилиндры. Указанные сосуды промывали Alconox и перед использованием основательно промывали водой Milli-Q или водой для промывания (WFIr). Для точного манипулирования маленькими объемами использовали не содержащие металлов наконечники пипеток (BioRad). Для манипулирования большими объемами реактивов использовали стерильные пластиковые серологические пипетки. Реакции удобно было выполнять в микроцентрифужных пробирках с закручивающейся крышкой, сделанных из полипропилена, объемом 1,8 мл.
3. Определение включения радиоактивной метки
Включение радиоактивной метки определяли, используя мгновенную тонкослойную хроматографию (МТСХ) в трех повторах согласно SOP SP-13-008. В общем, протокол представлял собой следующее: радиоактивно меченный конъюгат разбавляли 1:20 в 1 × PBS, содержащем 1 мМ DTPA или 5 мМ EDTA, затем 1 мкл наносили в виде пятна на расстоянии 1,5 см от края пластины из бумаги ITLC SG (Gelman Sciences), размером 1×5 см. Бумагу проявляли, используя 10% ацетат аммония в смеси метанол:вода (1:1; об./об.). Пластины сушили, разрезали поперек на половины, и определяли радиоактивность, связанную с каждой частью, считая в сцинтилляционном счетчике. Радиоактивность, связанную с верхней половиной пластины (радиоактивность, связанная с белком), выражали в виде процента общей радиоактивности, определенной суммированием значений верхней и нижней половин.
4. Протокол "mix-and-shoot" для меченного иттрием-[90] 2B8-MX-DTPA
Антитела радиоактивно метили хлоридом 90Y без носителя, предоставленным Amersham, в 0,04 М НСl. Аликвоту радиоизотопа (10-20 мКюри/мг антитела) переносили в полипропиленовую пробирку и добавляли 0,02 × объем 2 М ацетата натрия, свободного от металлов, чтобы довести раствор до рН 3,6. Сразу же добавляли 2B8-NaDTPA (0,3 мг; 10,0 мг/мл в нормальном солевом растворе), и раствор осторожно перемешивали. Раствор проверяли рН-бумагой, чтобы проверить рН в пределах 3,8-4,1 и инкубировали в течение 5 мин. Реакцию гасили перенесением реакционной смеси в отдельную полипропиленовую пробирку, содержащую 1 × PBS с 75 мг/мл сывороточного альбумина человека (ЧСА) и 1 мМ диэтилен-триаминопентауксусной кислотой (DTPA) и осторожно перемешивали. Радиоактивно меченное антитело хранили при 2-8°С.
Удельные активности определяли измерением радиоактивности соответствующей аликвоты радиоактивно меченного конъюгата. В полученное значение вносили поправку на эффективность счетчика, относили к концентрации белка конъюгата, определенной по оптической плотности при 280 нм, и выражали в мКюри/мг белка.
5. Иммунореактивность иттрий-[90]-2B8-MX-DTPA in vitro
Иммунореактивность конъюгата, меченного 90Y, определяли, используя SOP № SP13-009, на основе модифицированной версии анализа связывания целыми клетками, описанной Lindmo. Возрастающие концентрации CD20-позитивных клеток SB клеток или СD20-негативных HSB-клеток в лог-фазе добавляли в наборы полипропиленовых пробирок объемом 1,5 мл в двух повторах; конечный объем клеток 0,40 мл. Радиоактивно меченный конъюгат разводили до конечной концентрации антитела 1-2,5 нг/мл и в каждую пробирку добавляли 0,35 мл. После 90 мин инкубации клетки осаждали центрифугированием и собирали надосадки. Радиоактивность, оставшуюся во фракции надосадка, определяли в сцинтилляционном счетчике. Данные откладывали в виде частного от деления добавленной суммарной радиоактивности на радиоактивность, связанную с клетками, против обратной величины количества клеток в пробирке. Пересечение с осью у представляет иммунореактивную фракцию.
6. Стабильность иттрий-[90]-2B8-MX-DTPA, приготовленного в виде композиции для клинического применения, in vitro
Конъюгат 2B8-MX-DTPA радиоактивно метили 90Y и готовили в виде композиции, как описано в протоколе "mix-and-shoot", представленном выше. Готовили две партии радиоактивно меченного конъюгата; одну партию использовали для оценки стабильности радиоактивного включения, а другую партию использовали для оценки сохранения иммунореактивности. Конъюгаты, приготовленные в виде композиции, инкубировали при 4°С в течение 48 часов, и анализировали аликвоты во временных точках 0, 24 час и 48 часов, используя SDS-ПААГ-электрофорез в невосстанавливающих условиях и авторадиографию. Иммунореактивность в каждой временной точке оценивали, используя анализ, описанный выше.
7. Стабильность иттрий-[90]-2B8-NTX-DTPA в сыворотке человека in vitro
Стабильность 2B8-MX-DTPA, меченного 90Y, оценивали при инкубации в сыворотке человека при 37°С вплоть до 72 часов. Конъюгированное антитело радиоактивно метили иттрием-[90] и готовили в виде композиции, как описано выше. Радиоактивно меченный конъюгат разводили 1:10 нормальной сывороткой человека (не инактивирована теплом), и аликвоты инкубировали в пластиковых пробирках при 37°С. В выбранных временных точках брали образцы и анализировали SDS-ПААГ-электрофорезом в невосстанавливающих условиях и авторадиографией.
8. Биологическое распределение иттрий-[90]-2В8-MX-DTPA
2B8-MX-DTPA, меченный иттрием-[90], оценивали по биологическому распределению в тканях мышей BALB/c от восьми- до десятинедельного возраста. Радиоактивно меченный конъюгат получали и готовили в виде композиции, как описано выше. Мышам внутривенно инъецировали 5 мкКюри 2B8-MX-DTPA, меченного 90Y, и группы по пять мышей забивали в 1, 24, 48 и 72 час. После забоя извлекали хвост, сердце, легкие, печень, почки, селезенку, мышцу и бедренную кость, промывали, взвешивали; также брали образец крови и кожи для анализа. Радиоактивность, связанную с каждым образцом, определяли, измеряя тормозное излучение, используя гамма-счетчик, и определяя процент инъецированной дозы на грамм ткани и процент инъецированной дозы на орган.
9. Дозиметрия
Данные по биологическому распределению, полученные с использованием мышей, которым инъецировали 2B8-MX-DTPA, использовали для расчета оценок доз радиации, поглощенных при введении дозы в 1,0 мКюри пациенту массой 70 кг. Оценки делали согласно способам, принятым Комитетом общества ядерной медицины по внутренним медицинским дозам радиации (Medical Internal Radiation Dose (MIRD). Эти расчеты были выполнены Phillip Hagan, Nuclear Medicine Service, VA Medical Center, La Jolla, CA 92161.
10. Приемочные испытания протокола приготовления клинических доз иттрий-[90]-2B8-MX-DTPA
(Руководство R&D (научно-исследовательское и опытно-конструкторское), озаглавленное "Validation of "Mix-and-Shoot" Radiolabeling Protocol for the Preparation of Clinical Doses of 90Y-2B8-MX-DTP; автор Р. Chinn; датировано 22 апреля 1994).
С. Результаты
1. Получение 2B8-MX-DTPA, меченного иттрием-[90], с использованием протокола "mix-and-shoot"
Предварительные эксперименты по оценке кинетики-реакции радиоактивного мечения с использованием 2B8-MX-DTPA и 90Y показали, что при рН 3,6-4,0 95% радиоизотопа включается за время реакции от 5 до 10 мин. Воспроизводимость данного радиоактивного включения (95,7%±1,7%) затем подтвердили в проверочном исследовании протокола крупномасштабного производства (Руководство R&D (научно-исследовательское и опытно-конструкторское), озаглавленное "Validation of "Mix-and-Shoot" Radiolabeling Protocol for the Preparation of Clinical Doses of 90Y-2B8-MX-DTP; автор Р. Chinn; датировано 22 апреля 1994). Получение 2B8-MX-DTPA, меченного 90Y, с использованием данного протокола "mix-and-shoot" давало продукт, сравнимый с продуктом, который получали способом с ВЭЖХ (смотри BB-IND 4850/4851). Было установлено, что протокол радиоактивного мечения обычно воспроизводим в пределах удельных активностей от 10 до 15 мКюри/мг антитела.
Иммунореактивность 2B8-MX-DTPA, меченного 90Y, приготовленного с использованием данного протокола, обычно была больше 70% по сравнению с 55-60%, наблюдаемыми при прохождении приемочных испытаний протокола с использованием ВЭЖХ (фигура 26). Данные различия, возможно, являются следствием уменьшенного воздействия радиолиза из-за меньшего времени инкубации при использовании протокола "mix-and-shoot". Получаемые результаты были типичными, и как обсуждается ниже, репрезентативными при прохождении приемочных испытаний протокола для крупномасштабного получения клинических доз радиоактивно меченного конъюгата.
2. Стабильность 2B8-MX-DTPA, меченного 90Y, in vitro
Предварительные эксперименты с незащищенным конъюгатом антитела, меченным 90Y, полученным с использованием способа с ВЭЖХ, показали, что радиолиз вызывает существенную деградацию антитела и потерю иммунореактивности. Поэтому был разработан буфер для композиции, чтобы минимизировать действие радиолиза. Было показано, что сывороточный альбумин человека (ЧСА) эффективен для минимизации деградации антитела из-за радиолиза. Чтобы подтвердить эффективность композиции для минимизации радиолиза проводили оценку с радиоактивно меченным конъюгатом, полученным способом "mix-and-shoot". 90Y-меченое антитело, радиоактивно меченное до удельной активности 14,5 мКюри/мг антитела, готовили в составе композиции в 1 × PBS, рН 7,4, содержащем 75 мг/мл ЧСА и 1 мМ DTPA. Деградацию конъюгата 2B8-MX-DTPA оценивали в 1, 24 и 48 часов, используя SDS-ПААГ-электрофорез и авторадиографию. На фигурах 2, 3 и 4 показано, что радиоактивно меченный конъюгат не показал существенной деградации в течение периода 48 часов в случае инкубирования при 4°С. Анализ мгновенной тонкослойной хроматографией не выявил потери 90Y в течение 48 часов инкубации; полученные результаты подтверждены анализом в SDS-ПААГ/авторадиографией (таблица 28). Иммунореактивность также была относительно постоянной на уровне >88% (таблица 29).
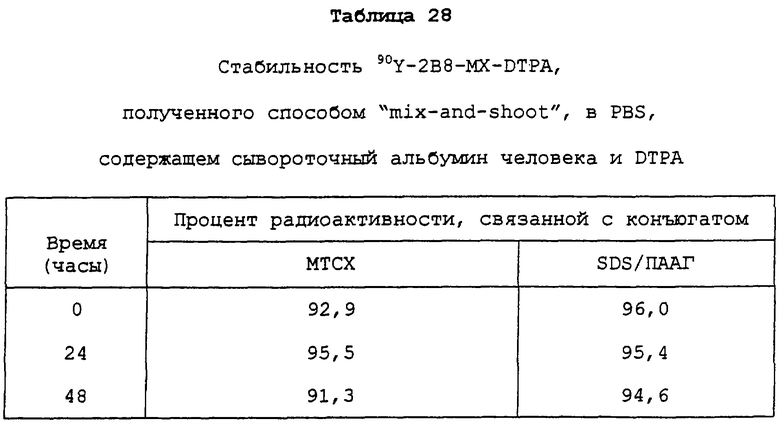
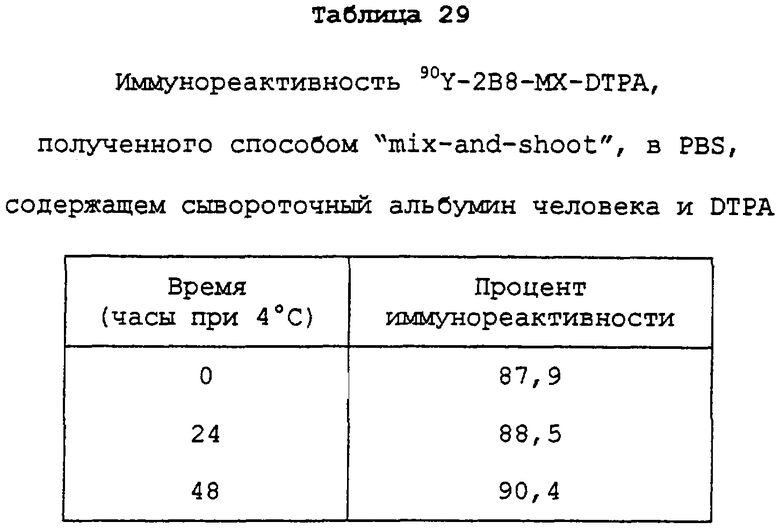
2B8-MX-DTPA, меченное 90Y, приготовленное в композиции для клинического применения, с удельной активностью 15,7 мКюри/мг инкубировали в течение 72 часов при 37°С в сыворотке человека. Образцы, анализированные SDS-ПААГ-электрофорезом и авторадиографией (фигура 30), не проявляли потери радиоизотопа в течение периода инкубации (таблица 30). Результаты денситометрического сканирования авторадиограмм во временных точках ноль и 72 час не выявили существенной деградации радиоактивно меченного конъюгата (фигуры 31 и 32). Полученные результаты были подтверждены анализом тонкослойной хроматографией (таблица 30). Следует отметить, что включение радиоактивной метки для антитела, используемого в данном исследовании, было ниже, чем полученное при исследованиях для приемочных испытаний протокола мечения. Указанное более низкое включение радиоактивности было следствием меньшего количества партии хлорида 90Y, используемого для данного конкретного получения радиоактивного антитела. Более низкое включение радиоактивности не меняет заключения о том, что меченный иттрием конъюгат, приготовленный способом "mix-and-shoot" стабилен при данных условиях инкубации.
Стабильность конъюгата 90Y-2B8-MX-DTPA, инкубированного в сыворотке человека
Образцы сыворотки человека, содержащие 90Y-2B8-MX-DTPA (удельная активность 15,7 мКюри/мг), анализировали в отношении не связанного с белком 90Y в указанных временных точках, используя пластины для мгновенной тонкослойной хроматографии и SDS-ПААГ/авторадиографию.
3. Исследования биологического распределения иттрий-[90]-2B8-MX-DTPA
Биологическое распределение конъюгата, меченного 90Y, с удельной активностью 11,5 мКюри/мг антитела и включением радиоактивности >95% оценивали на мышах BALB/c. Депонирование радиоактивности в тканях оценивали в основных органах, коже, мышце, костях, моче и фекалиях в течение 72 часов и выражали в виде процента инъецированной дозы на г ткани и в виде процента инъецированной дозы на орган. Результаты показаны в таблицах 31-34, и фигура 33 показывает, что уровни радиоактивности, связанной с кровью, снижались примерно с 43% инъецированной дозы на грамм (% ИД/г) в 1 час до примерно 16% спустя 72 часа; в 24 часа и позже уровни радиоактивности, связанной с сердцем, почкой и селезенкой, оставались довольно постоянными 4-8%. Для легкого и печени радиоактивность снижалась с 10-12% в 1 час до 8%-10% в 72 часа. Радиоактивность кожи была относительно постоянной примерно на уровне 3% с 24 часов до 72 часов. Радиоактивность в желудочно-кишечном тракте была постоянной на уровне 0,5-1% от 24 часов до 72 часов. Радиоактивность мышцы оставалась примерно на уровне 0,6% в течение всего исследования. Поглощение радиоактивности бедренной костью (кость) оставалась менее 4% во всех временных точках, свидетельствуя о том, что количество свободного иттрия в препарате конъюгата было ничтожно малым и что в ходе исследования высвобождалось небольшое количество радиоактивного металла.
Распределение активности через 1,0 час после в/в инъекции 90Y-2B8-MX-DTPA нормальным мышам BALB/c
Среднее значение ± стандартное отклонение
Средняя масса = 19,58 грамм ± 0,71 грамм

Распределение активности через 48 часов после в/в инъекции 90Y-2B8-MX-DTPA нормальным мышам BALB/c
Среднее значение±стандартное отклонение
Средняя масса = 21,48±2,05 грамм
Распределение активности через 72 часа после в/в инъекции 90Y-2B8-MX-DTPA нормальным мышам BALB/c
Среднее значение ± стандартное отклонение
Средняя масса = 20,76±0,97 грамм
4. Дозиметрия
Поглощенные дозы радиации для “стандартного” человека массой 70 кг, рассчитанные для конъюгата, меченного 90Y, с использованием данных по биологическому распределению у мышей (значения % ИД/орган в таблицах 31-34), представлены в таблице 35. Эти результаты сравнимы с результатами, полученными ранее с использованием 2B8-MX-DTPA, меченного 90Y, приготовленного с использованием способа радиоактивного мечения с ВЭЖХ.
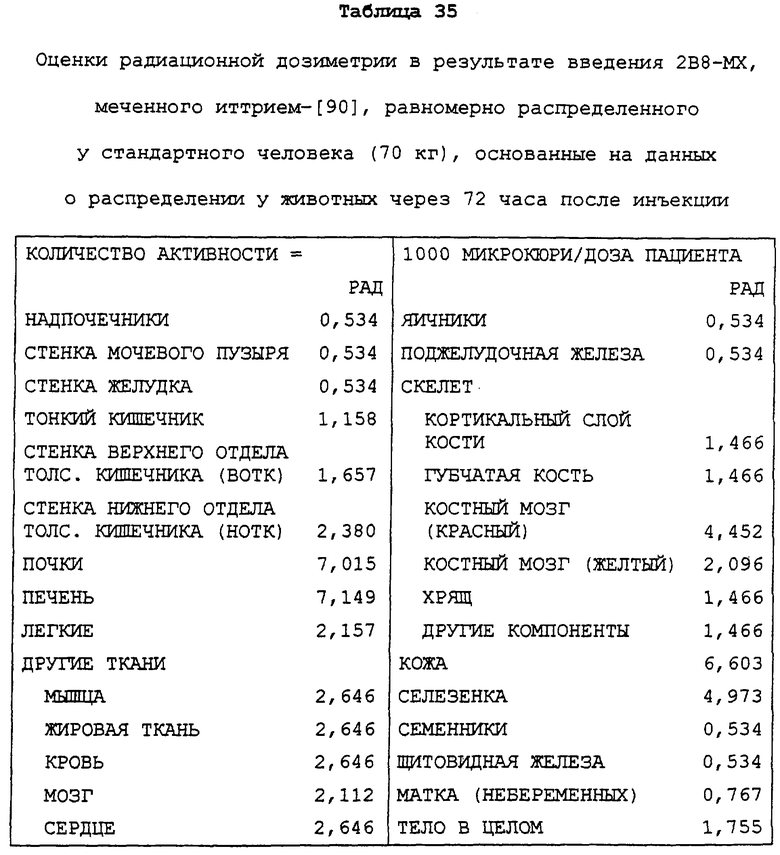
Ссылка: A Schema for Absorbed-dose Calculation for Biologically Distributed Radionuclides, MIRD J. of Nucl. Med./Suppl. #1, 2/68.
Расчеты выполнены с использованием матрицы электронной таблицы в Symphony (Lotus Development Corporation) и осуществлены Phillip L. Hagan, MS, Nuclear Medicine Service, VA Hospital San Diego, CA 92161.
5. Приемочные испытания протокола приготовления клинических доз иттрий-[90]-2B8-MX-DTPA
Всего десять партий для приемочных испытаний были приготовлены в MPI Pharmacy Service, Inc. Результаты тестирования, проведенного на каждой партии, суммированы в таблице 36. Было рассчитано среднее значение для каждого результата тестирования, и там, где это целесообразно, указаны стандартные отклонения. Чтобы оценить вариабельность способа вследствие различной продолжительности мечения, партии с №1 по №8 готовили, используя 10 мин продолжительность мечения; партии №9 и №10 готовили, используя время реакции, равное 5 мин. На основании результатов тестирования десяти партий для приемочных испытаний были установлены характеристики выпускаемой продукции. Характеристики выпускаемой продукции суммированы в таблице 37.
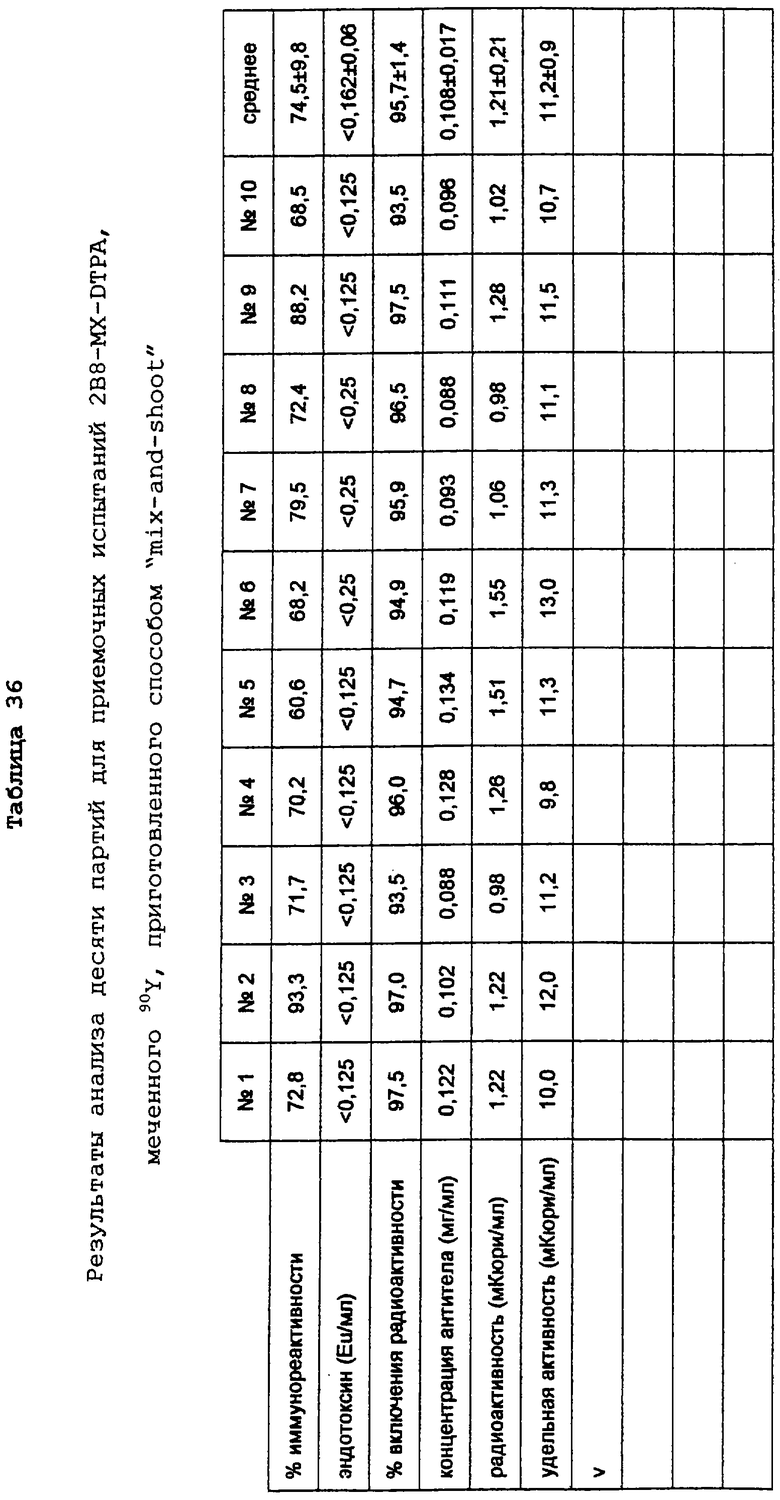
Выходные характеристики 2B8-MX-DTPA, меченного 90Y, приготовленного с использованием протокола "mix-and-shoot"
D. Обсуждение
В исходном протоколе радиоактивного мечения для получения 2B8-MX-DTPA, меченного 90Y, использовали чрезвычайно трудоемкий и требующий много времени этап очистки ВЭЖХ для удаления из препарата не связанного с белком 90Y. Для того чтобы упростить этот способ и сделать его более поддающимся применению на месте в клинике, попытки были направлены на исключение этапа ВЭЖХ в пользу способа, который был назван протоколом "mix-and-shoot". Цель состояла в том, чтобы определить условия радиоактивного мечения, результатом которых было бы очень высокое включение радиоактивного изотопа в конъюгат, тем самым исключая необходимость этапа очистки. Было обнаружено, что >95% включения радиоактивности можно получить при рН 3,6 при инкубации от пяти до десяти минут. Дополнительным преимуществом данного протокола было более высокое сохранение иммунореактивности (>70%), по-видимому, вследствие более короткого времени экспозиции антитела с радиоизотопом, обладающим высокой энергией, перед добавлением сывороточного альбумина человека, который обеспечивает защиту от радиолиза. Сохранение иммунореактивности превосходит таковое, наблюдаемое ранее при использовании способа с ВЭЖХ.
Исследования стабильности конъюгата, меченного 90Y, приготовленного с использованием протокола "mix-and-shoot", инкубируемого в буфере композиции (1 × PBS, содержащий 75 мг/мл сывороточного альбумина человека и 1 мМ DTPA) до 48 часов при 4°С, не выявили потери радиоизотопа и показали полное сохранение иммунореактивности. Исследования стабильности, проведенные с сывороткой человека в течение 72 часов при 37°С, также выявили минимальную потерю радиоизотопа. Полученные результаты стабильности сравнимы с результатами, наблюдаемыми ранее для конъюгата, радиоактивно меченного с использованием ВЭЖХ-протокола.
Биологическое распределение у мышей BALB/c, оцениваемое с использованием конъюгата, меченного 90Y способом "mix-and-shoot", не выявило необычного депонирования в тканях. Полученные результаты свидетельствуют о том, что радиоактивно меченное антитело существенно не было изменено так, чтобы драматически повлиять на характеристики антитела in vivo. Также указанные результаты сравнимы с результатами, полученными ранее с радиоактивно меченным конъюгатом, приготовленным с использованием ВЭЖХ-способа радиоактивного мечения (смотри BB-IND 4850/4851).
Дозиметрические оценки для “стандартного” человека массой 70 кг, рассчитанные на основании данных по биологическому распределению у мышей, находятся в соответствии с оценками, полученными для конъюгата, радиоактивно меченного с использованием ВЭЖХ-протокола (смотри BB-IND 4850/4851). Кроме того, результаты дозиметрии сравнимы с результатами, полученными для пациентов, "зарегистрированных в идущем в настоящее время клиническом испытании (исследование IDEC №1315), при сравнении на миллиКюри инъецированной дозы. Для шести пациентов в исследовании значения средней (рад ± стандартное отклонение) для целого тела, сердца, печени и селезенки составляли 1,40±0,57; 10,50±4,68; 9,89±8,91 и 9,75±6,00 соответственно.
Перед выполнением протокола мечения "mix-and-shoot" для получения 90Y-2B8-MX-DTPA клинической степени очистки было необходимо оценить воспроизводимость протокола. Поэтому десять партий для приемочных испытаний готовили с использованием различных партий хлорида 90Y. Для десяти приготовленных партий значения иммунореактивности, полученной с использованием способа "mix-and-shoot", находились в пределах от 60,6% до 93,3% со средним значением 74,5% и медианой 72,1%. Такое сохранение иммунореактивности значительно лучше, чем примерно 60%, получаемые ранее с использованием применяемого в настоящее время ВЭЖХ-способа (пределы от 54,9% до 65,1%, среднее 60,2%). Среднее включение радиоактивности для десяти партий составляло 95,7% (пределы от 93,5% до 97,5%). Это значение сравнимо со значением, наблюдаемым ранее при использовании ВЭЖХ-способа (пределы от 91,7% до 93,7% и среднее 93,1%). Также результаты теста на эндотоксин, концентрация антитела, концентрация радиоактивности, удельная активность, общая радиоактивность во флаконе, концентрация суммарного белка, рН и стерильность были сравнимы для десяти партий. Вместе полученные результаты подтверждают воспроизводимость способа "mix-and-shoot". Кроме того, авторы изобретения оценили вариабельность способа вследствие различной продолжительности мечения, выполняя реакции в течение 5 и 10 минут. Так как не было отмечено существенных отличий для двух продолжительностей реакции, было решено, что более короткое время инкубации будет использовано в окончательном протоколе.
Е. Резюме
Авторы данного изобретения разработали процедуру мечения, названную способом "mix-and-shoot" для получения клинических доз 2B8-MX-DTPA, меченного 90Y, которая исключает необходимость в используемом в настоящее время этапе высокоэффективной жидкостной хроматографии (ВЭЖХ) для удаления не связанного с белком радиоизотопа. Упрощенный протокол исключает этот трудоемкий этап очистки, в то же время, сохраняя высокий уровень включения радиоизотопа (>95%) и более высокое сохранение иммунореактивности (>70%). На основании сохранения радиоизотопа и иммунореактивности было обнаружено, что радиоактивно меченный конъюгат, приготовленный в виде композиции для клинического применения, стабилен in vitro при инкубации при 4°С в течение 48 часов. Кроме того, радиоактивно меченный конъюгат был стабилен при инкубации в сыворотке человека при 37°С в течение 72 часов. Исследования биологического распределения у мышей BALB/c не выявили необычного депонирования в тканях, включая кости. Оценки поглощенных доз радиации для “стандартного” человека массой 70 кг были сравнимы с оценками, полученными в проходящем в настоящее время клиническом испытании с использованием 2B8-MX-DTPA, меченного 90Y. Результаты этих исследований показали, что меченный 90Y 2B8-MX-DTPA, полученный с использованием протокола "mix-and-shoot", сравним с таковым, полученным с использованием традиционного ВЭЖХ-способа. Приемочные испытания протокола крупномасштабного получения радиоактивно меченного конъюгата клинической степени очистки показали, что способ воспроизводим и что продукт сравним с продуктом, полученным используемым в настоящее время способом с ВЭЖХ. Результаты этих доклинических исследований свидетельствуют о том, что указанный новый протокол "mix-and-shoot" можно использовать для получения 2B8-MX-DTPA, меченного 90Y, пригодного для применения в клинических испытаниях.
Детальное описание предпочтительных вариантов
Пример 1. Включение радиоактивности - наборы и анализы
I. Краткое изложение сути изобретения
Одной из целей данного изобретения была разработка протоколов набора для радиоактивного мечения для получения 2B8-MX-DTPA, меченного 111In и 90Y (In2B8 и Y2B8 соответственно), и установление выходных характеристик продуктов для клинического применения. Протоколы набора для радиоактивного мечения воспроизводимы в отношении включения радиоактивности и связывания с антиген-позитивными клетками SB и свидетельствуют о пригодности набора для радиоактивного мечения для применения в клинических испытаниях. Рекомендуется, чтобы выходные характеристики In2B8 и Y2B8 для включения радиоактивности и связывания были установлены на уровне ≥95% и ≥70% соответственно.
II. Введение
Мышиное моноклональное анти-СD20-антитело, меченное 90Y (Y2B8), в настоящее время проходит оценку в клинических испытаниях для лечения рецидивирующей В-клеточной лимфомы. Отсутствие у изотопа иттрия гамма-компонента делает его непригодным для систем визуализации. Поэтому для оценки локализации в опухоли и дозиметрии у пациентов до и после лечения меченным иттрием лекарственным средством будет использован 2B8-MX-DTPA, меченный 111In. Используемые в настоящее время протоколы для получения Y2B8 и In2В8, названные способами "mix-and-shoot", дают радиоактивно меченные антитела, которые подходят для клинических исследований. Однако упрощение процесса мечения может обеспечить срочное приготовление доз в условиях клиники.
Новый набор для радиоактивного мечения предпочтительно содержит четыре компонента: 1) 2B8-MX-DTPA в нормальном солевом растворе с низким содержанием металлов в концентраций 2 мг/мл, 2) 50 мМ ацетат натрия, используемый для доведения рН раствора радиоизотопа до подходящего для мечения значения, 3) буфер композиции (1 × PBS, рН 7,4, содержащий 7,5% сывороточного альбумина человека и 1 мМ DTPA), 4) пустой стеклянный флакон объемом 10 мл (флакон для реакции). Все компоненты тестируют на стерильность и апирогенность.
В приведенном описании суммированы приемочные испытания данного радиоактивного набора, который является простым и легким в применении и который дает радиоактивно меченные антитела с включением радиоактивности ≥95% и приемлемое сохранение связывания с антиген-позитивными клетками. Характеристики тестирования готовой продукции рекомендованы для продуктов, используемых в клинике.
III. Материалы и способы включения радиоактивности
А. Реактивы в наборе для радиоактивного мечения
1. 2B8-MX-DTPA, IDEC; Партия №082395RМ2
2. 50 мМ ацетат натрия, с низким содержанием металлов, партия №082395RМ3
3. Буфер композиции (1 × PBS, рН 7,4, содержащий 7,5% (маc./об.) сывороточного альбумина человека и 1 мМ DTPA), IDEC, партия №082395RM1
4. Реакционный флакон, 10 мл, IDEC
В. Материалы и оборудование
1. Набор для включения радиоактивности Biodex Tec-Control, кат. №151-770
2. Перчатки: без порошка
3. Стерильные полипропиленовые шприцы
4. Стерильные иглы для шприцов
5. Небольшие пробирки с крышками; 1,5 мл
С. Способы
1. Приготовление Y2B8 и In2В8 с использованием набора для радиоактивного мечения
Готовили реактивы набора и фильтровали в стеклянные флаконы с прокладкой. Боросиликатные флаконы типа I (2 или 10 мл) промывали стерильной водой для инъекций (WFI) и автоклавировали перед заполнением. Бутилкаучуковые прокладки промывали стерильной WFI и автоклавировали перед использованием. Реактивами заполняли вручную и обжимали в комнате класса 100, и тестировали на пирогенность и стерильность способами USP.
а. Приготовление In2В8
Дополнительные реактивы:
1. Индий-[111]: хлоридная соль, без носителя, в НСl.
Меры предосторожности:
1. Все этапы предпочтительно выполняют, используя стерильные способы.
2. Компонентам набора для радиоактивного мечения необходимо дать возможность достичь комнатной температуры перед использованием.
3. Конечный продукт должен быть введен пациенту в пределах 8 часов после завершения этапа 9, приведенного ниже.
Протокол радиоактивного мечения In2В8
Процедура
1. Объем 111InСl3 для добавления в реакционный флакон рассчитывали следующим образом:
а. Концентрация радиоактивности во время радиоактивного мечения в мКюри/мл:
С0 = концентрация радиоактивности во время точного определения (смотри сертификат анализа производителя).
Δt = изменения времени (положительное число означает время после точного определения, отрицательное число означает время до точного определения).
Концентрация радиоактивности во время мечения 
b. Объем 111InCl3 для добавления к реакционному флакону:

2. Объем 50 мМ ацетата натрия, который надо добавить к реакционному флакону, рассчитывали следующим образом:
Добавляемый объем 111InCl3 (этап 1b) × (1,2) = объем 50 мМ ацетата натрия, который надо добавить.
3. Прокладки реакционного флакона и флакона с 50 мМ ацетатом натрия протирали спиртом. Используя шприц 1cc, рассчитанный объем 50 мМ ацетата натрия (этап 2) переносили в реакционный флакон.
4. Прокладку источника 111InСl3 протирали спиртом. Во флаконе делали отверстие иглой, снабженной стерильным 0,2 мкм-фильтром. Используя стерильный шприц 1сс, переносили требуемый объем (этап 1b) 111InCl3 в реакционный флакон. Содержимое флакона перемешивали, переворачивая флакон несколько раз.
5. Прокладку флакона с 2B8-MX-DTPA протирали спиртом. Используя шприц 1сс, медленно переносили 1,0 мл 2B8-MX-DTPA в реакционный флакон. Содержимое флакона перемешивали, переворачивая флакон несколько раз.
6. Реакции давали возможность продолжаться в течение 30 минут ±5 минут при температуре окружающей среды.
7. Общий объем реакционной смеси рассчитывали, складывая вместе объем добавленного 111InCl3 (этап 4), объем добавленного 50 мМ ацетата натрия (этап 3) и объем добавленного 2B8-MX-DTPA (этап 5).
8. Объем буфера композиции для добавления к реакционному флакону, чтобы получить конечный объем 10 мл, рассчитывали вычитанием из 10 общего количества, рассчитанного на этапе 7.
9. Флакон с буфером композиции протирали спиртом, и во флаконе делали отверстие. Из-за вязкости буфера композиции в реакционном флаконе делали отверстие, используя иглу, снабженную 0,2 мкм-фильтром для шприцов. Используя стерильный фильтр 10сс, снабженный иглой подходящего калибра, объем буфера композиции, рассчитанный на этапе 8, переносили в реакционный флакон. Иглу из отверстия реакционного флакона извлекали, и содержимое флакона перемешивали, переворачивая флакон несколько раз (конечный продукт). Этот флакон инкубировали по меньшей мере 5 минут перед проведением “анализа включения радиоактивности”. Окраска раствора была янтарной, и флакон был заполнен, подтверждая, что буфер композиции был добавлен.
10. Суммарную радиоактивность флакона с конечным продутом измеряли, используя соответствующий набор аппаратуры для измерения 111In.
11. Конечный продукт сразу же переносили для сохранения в условия 2°-8°С для “анализа связывания” и “анализа включения радиоактивности”.
b. Приготовление Y2B8
Дополнительные реактивы:
1. Иттрий-[90]: хлоридная соль, без носителя, в НСl.
Меры предосторожности:
1. Все этапы необходимо выполнять, используя стерильные способы.
2. Компонентам набора для радиоактивного мечения необходимо дать возможность достичь комнатной температуры перед использованием.
3. Продукт следует ввести пациенту в пределах 8 часов после завершения этапа 8, приведенного ниже.
Протокол радиоактивного мечения Y2B8
1. Объем 90YCl3 для добавления в реакционный флакон рассчитывали следующим образом:
а. Концентрация радиоактивности во время радиоактивного мечения:
С0 = концентрация радиоактивности во время точного определения (смотри сертификат анализа производителя).
Δt = изменения во времени (положительное число означает время после точного определения, отрицательное число означает время до точного определения).
Концентрация радиоактивности во время мечения 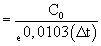
b. Объем 90YCl3 для добавления к реакционному флакону:

2. Объем 50 мМ ацетата натрия для добавления к реакционному флакону рассчитывали следующим образом:
а. Для 90YCl3 в 0,040 М НСl (Amersham):
Объем 90YСl3 (этап 1b) × (0,8)=объем ацетата натрия для добавления.
b. Для 90YCl3 в 0,050 М НСl (Nordion):
Объем 90YCl3 (этап 1b) × (1,0)=объем ацетата натрия для добавления.
3. Прокладку реакционного флакона и флакона с ацетатом натрия протирали спиртом. Используя шприц 1сс, рассчитанный объем (этап 1а или 1b) 50 мМ ацетата натрия (этап 2) переносили в реакционный флакон. Содержимое флакона перемешивали, переворачивая флакон несколько раз.
4. Прокладку источника 90YCl3 протирали спиртом. Во флаконе делали отверстие иглой, оснащенной стерильным 0,2 мкм-фильтром. Используя стерильный шприц 1сс, переносили требуемый объем (этап 1b) 90YСl3 в реакционный флакон. Содержимое флакона перемешивали, переворачивая флакон несколько раз.
5. Прокладку флакона с 2B8-MX-DTPA протирали спиртом. Используя шприц 3сс, переносили 1,5 мл 2B8-MX-DTPA в реакционный флакон. Содержимое флакона перемешивали, переворачивая флакон несколько раз.
6. Общий объем реакционной смеси рассчитывали, складывая объем добавленного хлорида Y-90 (этап 4) плюс количество добавленного 50 мМ ацетата натрия (этап 3), плюс количество добавленного 2B8-MX-DTPA (этап 5).
7. Объем буфера композиции для добавления к реакционному флакону, чтобы получить конечный объем 10 мл, рассчитывали вычитанием из 10 общего реакционного объема, рассчитанного на этапе 6.
8. Флакон с буфером композиции протирали спиртом, и во флаконе делали отверстие. Из-за вязкости буфера композиции в реакционном флаконе делали отверстие, используя иглу, снабженную 0,2 мкм-фильтром для шприцов. Используя стерильный фильтр 10сс, снабженный иглой подходящего калибра, объем буфера композиции, рассчитанный на этапе 7, переносили в реакционный флакон. Иглу из отверстия реакционного флакона извлекали, и содержимое флакона перемешивали, переворачивая флакон несколько раз (конечный продукт). Этот флакон инкубировали по меньшей мере 5 минут перед проведением “анализа включения радиоактивности”. Окраска раствора была янтарной, и флакон был заполнен, подтверждая, что буфер композиции был добавлен.
9. Радиоактивность флакона с конечным продутом измеряли, используя соответствующий набор аппаратуры для измерения 90Y.
10. Конечный продукт сразу же переносили для сохранения в условия 2°-8°С вплоть до момента, когда он потребуется для введения пациенту.
11. Тестирование иммунореактивности:
Используя шприц объемом 1 мл, 0,1 мл стерильно отбирали из реакционного флакона и переносили в отдельную пробирку с закручивающейся крышкой объемом 1,5 мл. Пробирку сразу же переносили хранения в условия 2°-8°С для “анализа связывания” и “анализа включения радиоактивности”.
Приемочные испытания протоколов наборов радиоактивного мечения выполняли в IDEC Pharmaceuticals (San Diego, CA), MD Anderson Health Center (Houston, TX), Mayo Clinic (Rochester, MN) и City of Hope (Duarte, CA). Все компоненты набора, включая 2B8-MX-DTPA клинической степени очистки, были приготовлены IDEC Pharmaceuticals в условиях GMP (условия производства качественных продуктов согласно кодексу федеральных норм) и определена их стерильность и апирогенность.
Радиоактивно меченные антитела готовили в составе композиции с 1 × PBS, содержащим 7,5% (маc./об.) сывороточного альбумина человека (ЧСА; клиническая степень очистки; Baxter-Hyland) и 1 мМ DTPA. Результаты тестирования готовой продукции, проведенного на каждой партии для приемочных испытаний, описаны ниже.
Шесть партий для приемочных испытаний каждого из антител In2В8 и Y2B8 готовили пять операторов. Эти партии были обозначены следующим образом и сделаны в следующих условиях:
In2B8:
№1 IDEC Pharmaceuticals
№2 IDEC Pharmaceuticals
№3 IDEC Pharmaceuticals
№4 MD Anderson Health Center
№5 Mayo Clinic
№6 City of Hope
Y2B8:
№1 IDEC Pharmaceuticals
№2 IDEC Pharmaceuticals
№3 IDEC Pharmaceuticals
№4 MD Anderson Health Center
№5 Mayo Clinic
№6 City of Hope
2. Приготовление лиофилизированных клеток SB и HSB
Линии клеток человека SB (CD20-позитивные) и HSB (CD20-негативные) получали из Американской коллекции типов культур и культивировали в Т-флаконах, используя RPMI-1640, содержащую 10% фетальной сыворотки теленка с добавлением 2% глютамина. Культуры содержали при 37°С и 5% СO2. Клетки обычно делили 1:2 через день и собирали при концентрации 0,5-2,5×106 клеток/мл и жизнеспособности >80%. Концентрации клеток определяли, используя гемацитометр, и жизнеспособность определяли посредством исключения трипановым синим.
Клетки собирали при температуре окружающей среды при плотности клеток 0,5-2×106 клеток/мл центрифугированием (1300 об/мин на центрифуге Sorvall) и дважды промывали 1 × HBSS. Осажденные клетки ресуспендировали до 50×106 клеток/мл в 1 × HBSS, содержащем 1% (маc./об.) бычьего сывороточного альбумина (БСА) и 10% (маc./об.) маннита (буфер для лиофилизации), разносили по 0,5 мл в полипропиленовые микроцентрифужные пробирки с кольцевой прокладкой объемом 1,5 мл и хранили при -70°С, и лиофилизировали в течение ночи при 30-60 миллитор. Пробирки с лиофилизированными клетками хранили в сухом виде при 2°-8°С и восстанавливали в стерильной воде для анализов; пробирки клеток, лиофилизированных в микроцентрифужных пробирках, хранили с осушителем.
3. Аналитические анализы
Аналитические способы, используемые для тестирования партий In2В8 и Y2B8 для приемочных испытаний, описаны ниже. Для каждой партии для приемочных испытаний выполняли следующие анализы:
1. Анализ связывания с использованием лиофилизированных клеток SB.
2. Анализ включения радиоактивности для Y2B8/In2B8 с использованием набора Biodex.
а. Анализы связывания
Каждый оператор оценивал процент связывания, используя лиофилизированные СD20-позитивные клетки SB согласно следующим протоколам для In2B8 и Y2B8 соответственно. Эти анализы обеспечивают быстрый и эффективный способ подтверждения того, что радиоактивно меченное антитело еще узнает CD20 как антиген. В одном месте в клинике также оценивали СD20-негативные клетки HSB. Лиофилизированные клетки готовили и хранили согласно указанному выше способу - “Приготовление лиофилизированных клеток SB и HSB”.
i. Анализ связывания In2B8
Дополнительные реактивы:
1. Индий-[111]-2B8-MX-DTPA.
2. Лиофилизированные клетки SB; три пробирки, содержащие 25×106 клеток/пробирку.
3. Лиофилизированные клетки HSB; три пробирки, содержащие 25×106 клеток/пробирку.
4. Стерильная вода для промывания или стерильная вода для инъекции.
5. Буфер разведения (1 × PBS, рН 7,2-7,4, содержащий 1% сывороточного альбумина быка (БСА) и 0,02% азида натрия), профильтрованный через 0,2 мкм-фильтр и хранившийся при комнатной температуре.
6. Стеклянные или пластиковые тест-пробирки для подсчета радиоактивности.
Процедура:
Схема анализа (нерадиоактивная часть)
1. Брали три пробирки лиофилизированных клеток SB и HSB.
2. SWFI (стерильная вода для инъекций) объемом 0,50 мл добавляли в каждую пробирку, и пробирки встряхивали с перемешиванием до получения гомогенной суспензии.
3. Четыре пустых микроцентрифужных пробирки объемом 1,5 мл. К трем пробиркам добавляли 0,50 мл буфера для разведения, представляющего собой контроль без клеток.
4. К другой микроцентрифужной пробирке объемом 1,5 мл, добавляли 0,99 мл буфера для разведения; эту пробирку помечали 1:100.
5. Брали стерильную полипропиленовую пробирку с крышкой объемом 50 мл и к пробирке добавляли 10 мл буфера для разведения.
Схема анализа (радиоактивная часть)
1. Брали радиоактивно меченное антитело, хранившееся при 2°-8°С.
2. С помощью Р20 отбирали объем 0,01 мл и добавляли к микроцентрифужной пробирке объемом 1,5 мл, содержащей 0,99 мл буфера для разведения (разведение 1:100). Наконечник промывали и пробирку осторожно встряхивали, чтобы перемешать содержимое.
3. С помощью Р200 отбирали объем 0,20 мл из пробирки с разведением 1:100 и добавляли в коническую пробирку, содержащую 10 мл буфера для разведения. Содержимое пробирки тщательно перемешивали.
Протокол анализа.
1. Разведенный 111In2B8-MX-DTPA объемом 0,50 мл добавляли во все пробирки.
2. Крышки на всех пробирках плотно закрывали для сохранности, и содержимое пробирок непрерывно перемешивали в течение 60 минут.
3. После 60-минутной инкубации при температуре окружающей среды все пробирки центрифугировали в течение 5 минут минимум при 2000 g.
4. По 0,75 мл каждого надосадка переносили в пробирки, подходящие для счетного оборудования.
5. Радиоактивность пробирок подсчитывали, используя гамма-счетчик, настроенный относительно фона.
ii. Анализ связывания Y2B8
1. Дополнительные реактивы:
1. 90Y-2B8-MX-DTPA.
2. Лиофилизированные клетки SB.
3. Стерильная вода для промывания или стерильная вода для инъекции.
4. Буфер разведения (1 × PBS, рН 7,2-7,4, содержащий 1% сывороточного альбумина быка (БСА) и 0,02% азида натрия).
Процедура:
Подготовка образца радиоактивно меченного антитела.
1. Брали радиоактивно меченное антитело, хранившееся при 2°-8°С.
2. С помощью Р20 отбирали объем 10 мкл и добавляли к микроцентрифужной пробирке объемом 1,5 мл, содержащей 990 мкл буфера для разведения (разведение 1:100). Наконечник промывали и пробирку осторожно встряхивали.
3. Брали стерильную полипропиленовую пробирку с крышкой, объемом 50 мл, и в пробирку добавляли 10 мл буфера для разведения, используя пипетку для серологического анализа объемом 10 мл.
4. С помощью Р200 отбирали объем 35 мкл из пробирки с разведением 1:100 и добавляли в коническую пробирку, содержащую 10 мл буфера для разведения. Тщательно перемешивали.
Приготовление лиофилизированных клеток.
1. Брали три пробирки лиофилизированных клеток SB и HSB.
2. SWFI объемом 0,50 мл добавляли в каждую пробирку, и пробирки встряхивали с перемешиванием до получения суспензии отдельных клеток.
3. Брали три пустых микроцентрифужных пробирки объемом 1,5 мл; к трем пробиркам добавляли 0,5 мл буфера для разведения, представляющего собой контроль без клеток.
Протокол анализа
1. Разведенный 90Y2B8-MX-DTPA объемом 0,5 мл добавляли в каждую пробирку.
2. После того как убеждались в том, что крышки плотно прижаты для сохранности, пробирки помещали стоя на миксер на 45 минут.
3. После 45-минутной инкубации при температуре окружающей среды клетки осаждали микроцентрифугированием в течение 5 минут.
4. По 0,8 мл каждого надосадка переносили во флаконы для сцинтилляционного счета.
5. В каждый флакон добавляли сцинтилляционный коктейль.
6. Количество радиоактивности в каждом флаконе определяли, используя сцинтилляционный счетчик, настроенный относительно фона.
b. Анализ включения радиоактивности
Процент включения радиоактивности определяли мгновенной тонкослойной хроматографией (МТСХ), используя радиохроматографический набор Biodex Tec-Control, в соответствии со следующим протоколом:
Дополнительные материалы и оборудование:
1. 2B8-MX-DTPA, радиоактивно меченный 111In или 90Y.
2. Пробирки для подсчета радиоактивных ТСХ-пластин.
3. Ножницы.
4. Стерильный шприц 1сс.
5. Стерильные иглы, 26G.
6. Гамма-счетчик или сцинтилляционный счетчик.
7. Пипеттор.
Процедура:
1. Сначала следует изучить полное руководство по эксплуатации Biodex.
2. Каждый радиоактивно меченный образец тестировали в трех повторах согласно инструкциям к набору; обрабатывали одну пластину на флакон.
3. Чтобы нанести пятно радиоактивно меченного образца на хроматографическую пластину использовали пипеттор, чтобы нанести 1 мкл на стартовую линию. В альтернативном случае можно нанести пятно одной небольшой каплей, выходящей из иглы 26G, надетой на стерильный шприц 1сс.
4. Считали активность в каждой секции, используя подходящий счетчик, т.е. гамма-счетчик для 111In и сцинтилляционный счетчик для 90Y, настроенные относительно фона.
5. Следовали инструкциям Biodex для расчета процента радиоактивно меченного антитела.
IV. Результаты.
Результаты тестирования каждой партии для приемочных испытаний In2В8 или Y2B8 суммированы в таблицах 38 и 39.
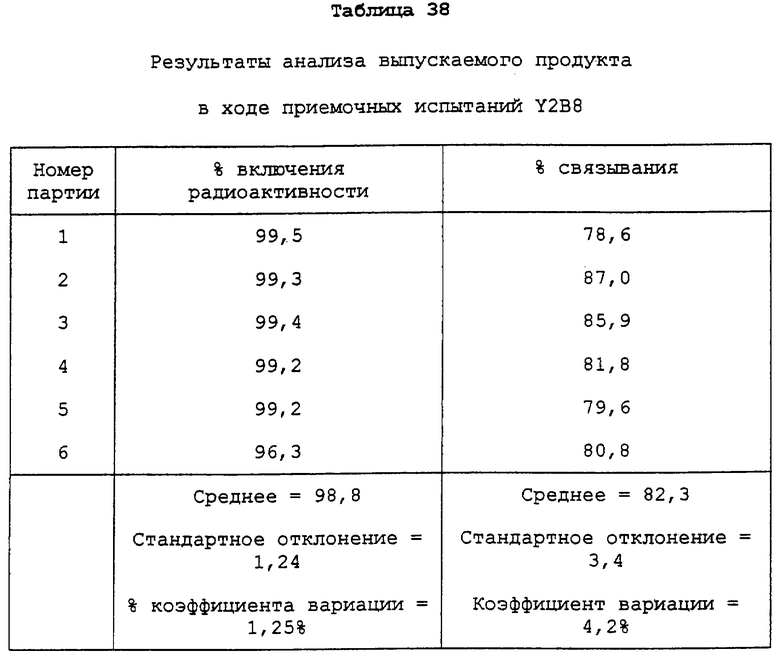
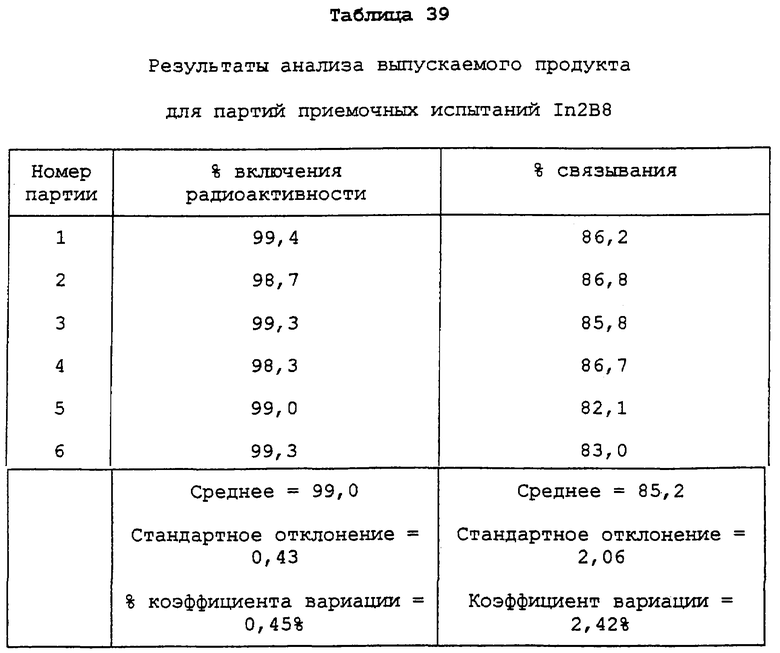
V. Обсуждение и выводы
Чтобы упростить современные способы радиоактивного мечения In2В8 и Y2B8, разработали набор, состоящий из четырех компонентов. Концентрации ацетата натрия и 2B8-MX-DTPA снизили до 50 мМ и 2 мг/мл соответственно, чтобы обеспечить перенесение точных объемом с помощью шприцов. Все компоненты набора предпочтительно заполняли в стеклянные флаконы c прокладками и тестировали стерильность и пирогенность в IDEC перед выпуском, таким образом, устраняя необходимость выполнения указанных тестов на местах в клинике. На месте все манипуляции с реагентами выполняли, используя стерильные шприцы и иглы. Поэтому строгое соблюдение стерильной технологии, которое обычно можно сделать в условиях радиофармации, гарантирует, что радиоактивно меченные и приготовленные в виде композиций антитела пригодны для введения пациентам.
Воспроизводимость и возможность эксплуатации в неблагоприятных условиях протоколов радиоактивного мечения для In2В8 и Y2B8 оценивали, выполняя несколько циклов приемочных испытаний с использованием различных партий каждого радиоизотопа. Для шести партий In2В8, приготовленных для приемочных испытаний, связывание находилось в пределах от 82,1% до 86,8% со средним значением 85,1%; значения включения радиоактивности составляли примерно 99% (пределы от 98,3% до 99,4%). Для шести партий Y2B8, приготовленных для приемочных испытаний, полученный процент связывания находился в пределах от 78,6% до 87,0% со средним значением 82,3%; значения включения радиоактивности для Y2B8 в среднем равнялись 98,8% (пределы от 96,3% до 99,5%). Вместе указанные результаты подтверждают воспроизводимость и возможность использования в неблагоприятных условиях способов на основе наборов для радиоактивного мечения для получения как In2В8, так и Y2B8. На основании результатов приемочных испытаний рекомендуется, чтобы выходные характеристики включения радиоактивности и связывания были установлены на уровне ≥95% и ≥70% соответственно для In2В8 и Y2B8.
Кроме того, вследствие более простого применения и меньшей вероятности ошибок во время приготовления рекомендуется, чтобы для тестирования готовой продукции In2В8 и Y2B8 на местах в клинике применяли процент связывания при использовании лиофилизированных СD20-позитивных клеток и включение радиоактивности.
Подводя итог, указанные результаты вместе свидетельствуют о том, что In2В8 и Y2B8, полученные с использованием набора для радиоактивного мечения, пригодны для применения в условиях клиники. Кроме того, для обоих радиоактивно меченных антител устанавливают выходные характеристики, отражающие результаты нескольких циклов приемочных испытаний, проведенных пятью различными операторами.
Пример 2. Включение радиоактивности и связывание - наборы и анализы
I. Краткое изложение сути изобретения
Мышиное анти-СD20 моноклональное антитело, обозначенное 2В8, клонировали в клетках СНО, чтобы получить линию клеток с высокой экспрессией. Специфичность антитела, полученного из клеток СНО, в отношении СD20-позитивных клеток человека показана FACS-анализом и конкурентным связыванием. Незначительное связывание наблюдали с Т-клетками человека. Используя анализ конкурентного связывания, определили аффинность антитела к CD20-позитивным клеткам, равную 1,3×10-10 М. Антитело подвергали реакции с хелатирующим агентом MX-DTPA, чтобы образовать конъюгат, 2B8-MX-DTPA, при незначительной потере иммунореактивности (значение аффинности составляло 4,4×10-10 М). Оптимальная конъюгация с хелатирующим агентом, как было определено посредством измерения радиоактивного включения 111In, достигали через восемь часов реакции. Протоколы радиоактивного мечения 2B8-MX-DTPA оптимизировали для 90Y или 111In, в отношении рН и времени инкубации, чтобы гарантировать максимальное включение радиоактивности (≥95%) и сохранение иммунореактивности (≥70%). Были рекомендованы характеристики выпускаемой продукции для клинических испытаний для In2В8 и Y2B8, приготовленных с использованием 2B8-MX-DTPA, полученного из клеток СНО, для включения радиоактивности (≥95%) и связывания с лиофилизированными и восстановленными CD20-позитивными клетками человека (≥70%). Взятые вместе эти результаты свидетельствуют о пригодности полученного на основе СНО 2B8-MX-DTPA для применения в клинических испытаниях.
II. Введение
Ранее используемое антитело 2В8 получали в биореакторах с полыми волокнами. Чтобы уменьшить расходы на производство данного антитела, его клонировали и экспрессировали в клетках СНО, чтобы получить линию клеток с высокой экспрессией продукта. В данном примере описаны результаты характеристики in vitro антитела 2В8, полученного из СНО, конъюгированного антитела (2B8-MX-DTPA) и продуктов мечения антитела 90Y и 111In, полученных с использованием протоколов наборов для радиоактивного мечения в клинике.
III. Материалы и способы
А. Реагенты
Линии клеток человека SB (CD20-позитивные) и HSB (CD20-негативные) получали из Американской коллекции типов культур и культивировали в Т-флаконах, используя RPMI-1640, содержащую 10% фетальной сыворотки теленка с добавлением 2% глютамина. Культуры содержали при 37°С и 5% CO2. Клетки обычно делили 1:2 через день и собирали при концентрации 0,5-2,5×106 клеток/мл и жизнеспособности > 80%.
Концентрации клеток определяли, используя гемацитометр, и жизнеспособность определяли посредством исключения трипановым синим. Конкретная информация о партиях клеток записана в тетради №1553 и в переплете, озаглавленном "Cell Activity Logbook 1995 & 1996" автора Ron Morena.
2B8, получаемое из СНО, производили в условиях GMP на производственном оборудовании IDEC. Антитело готовили в составе композиции в нормальном солевом растворе с низким содержанием металлов при концентрации 11,5 мг/мл. Электрофорезом в SDS-ПААГ было определено, что антитела являются гомогенными. 2B8-MX-DTPA производили в условиях GMP согласно PSBR-043 из 2B8, полученного из СНО, и готовили в составе композиции в солевом растворе с низким содержанием металлов в концентрации 2 мг/мл (партии №0165А и №0165В).
Хлорид 111In фармацевтической степени очистки приобретали из Amersham (Великобритания) или Cyclotron Products Inc. (Coral Gables, FL). Хлорид иттрия-[90] получали из Amersham (Великобритания), Nordion International (Kanatta, Canada), или Pacific Northwest National Laboratory (Richland, WA). MX-DTPA, приготовленный в условиях GMP, получали из Hauser Chemical (Boulder, CO). Кальций-тринатриевую соль диэтилентриаминопентауксусной кислоты (DTPA) клинической степени очистки получали из Heyl (Berlin, Germany). TAG-NHS получали из IGEN Inc. (Rockville, MD). Шарики с мышиными анти-СD19 приобретали в Dynal Inc. (Lake Success, NY). Антимышиный ФИТЦ-меченый F(ab’)2 козы приобретали из Jackson Immuno-Research.
Партии реактивов, требующих удаления загрязняющих тяжелых металлов, обрабатывали Chelex 100 (BioRad Industries) или хелатирующей сефарозой (Pharmacia) пропусканием растворов через колонку. Маточные растворы с низким содержанием металлов разбавляли стерильной водой для промывания (SWFIr). Растворы хранили в стерильных пластиковых сосудах.
Дополнительные реактивы описаны ниже для конкретных способов.
В. Материалы и оборудование
1. Анализатор Origen; IGEN Inc. Модель №1100-1000; IDEC №1492.
2. Сцинтилляционный счетчик со счетом сверху; Packard, модель №А9912; IDEC №1329.
3. Гамма-счетчик; Isodata, модель №20-10; IDEC №0628.
4. Радиохроматографический набор Tec-Control, Biodex, модель №151-770.
5. Лиофилизатор; Virtis, модель Freezemobile 12; IDEC №0458.
Дополнительные материалы и оборудование описаны для конкретных способов.
С. Способы
1. Приготовление лиофилизированных клеток SB и HSB
Клетки культивировали, как описано выше, и собирали при температуре окружающей среды при плотности клеток 0,5-2×106 клеток/мл центрифугированием (1300 об/мин в центрифуге Sorvall) и дважды промывали 1 × HBSS. Осажденные клетки ресуспендировали до 50×106 клеток/мл в 1 × HBSS, содержащем 1% (маc./об.) бычьего сывороточного альбумина (БСА) и 10% (маc./об.) маннита (буфер для лиофилизации), разносили по 0,5 мл в полипропиленовые микроцентрифужные пробирки с кольцевой прокладкой объемом 1,5 мл и хранили при -70°С, и лиофилизировали в течение ночи при 30-60 миллитор. Пробирки с лиофилизированными клетками хранили в сухом виде при 2°-8°С и восстанавливали в стерильной воде для анализов; пробирки клеток, лиофилизированных в микроцентрифужных пробирках, хранили с осушителем.
2. FACS-анализ связывания
Прямое связывание антител с В-клетками человека определяли проточной цитометрией. Возрастающие концентрации антитела инкубировали в 1 × PBS, рН 7,2, содержащем 1% (маc./об.) БСА (буфер связывания) с 5×106 CD20-позитивных (SB) или СD20-негативных (HSB) клеток в течение 30 мин на льду. Клетки промывали центрифугированием, ресуспендировали в буфере для связывания, и инкубировали с антимышиными F(ab’)2 козы, меченными ФИТЦ, в течение 30 мин на льду. После инкубации со вторым реагентом клетки промывали центрифугированием и ресуспендировали в 1 × РВS, содержащем 1,1% (об./об.) формальдегида, чтобы фиксировать клетки. Среднюю интенсивность флуоресценции определяли, используя проточную цитометрию.
3. Анализ конкурентного связывания
Иммунореактивность 2В8 и 2B8-MX-DTPA определяли при конкурентном связывании с CD20-позитивными клетками SB, используя электрохемилюминесцентный способ ORIGEN (Leland and Powell). Клетки SB в лог-фазе собирали из культуры и дважды промывали 1 × HBSS. Клетки разбавляли в 1 × PBS, рН 7,2, содержащем 1% (маc./об.) бычьего сывороточного альбумина. В некоторых экспериментах использовали лиофилизированные клетки после восстановления стерильной водой.
Меченное рутением индикаторное антитело готовили, инкубируя 2В8, полученное из СНО (партия №165) в 1 × PBS, рН 7,2, с хелатирующим агентом сложным эфиром N-гидроксисукцинимида и рутений(II)трис-бипиридина (TAG-NHS) при молярном соотношении TAG-NHS к антителу, равном 15:1. После 1 часа инкубации при температуре окружающей среды, защищенной от света, реакцию гасили глицином в течение 10 мин. Не прореагировавший TAG удаляли эксклюзионной хроматографией по размеру, используя колонку Pharmacia PD-10, уравновешенную 1 × PBS. Концентрацию белка определяли, используя анализ белка по Бредфорду. Включение TAG определяли измерением оптической плотности при 455 нм. Рассчитали молярное отношение TAG к белку, равное 3,0.
Анализы проводили в полипропиленовых пробирках размером 12×75 мм. Варьирующие количества конкурирующего антитела (0,002-17 мкг/мл) инкубировали в 1 × рвS, рН 7,2, содержащем 1% (маc./об.) БСА с 0,08 мкг/мл TAG-меченого СНО-2В8, 0,08 мг/мл шариков с анти-СПЭ и 167000 клеток/мл. После инкубации при температуре окружающей среды и перемешивании с орбитальным вращением в течение 3 часов определяли относительную электрохемилюминесценцию (ECL), используя оборудование ORIGEN. Определяли средние значения ECL для образцов в двух повторах и откладывали против концентрации конкурирующего антитела, используя компьютерную программу Kaleidagraph. Для некоторых экспериментов откладывали процент ингибирования. Были установлены кривые конкуренции и определены значения ЕС50 (концентрация антитела, дающая связывание, составляющее 50% от максимального), используя следующую программу с 4 параметрами:
Y=((m1-m4)/(1+(m0/m3)^m2))+m4 ; m1= ; m2= ; m3= ; m4=
m0 = независимая переменная
m1 = характеристика нулевого сигнала в относительных единицах ECL
m2 = параметр кривизны
m3 = ЕС50 в мкг/мл
m4 = характеристика максимального сигнала в относительных единицах ECL.
Средние значения аффинности рассчитывали на основе значений ЕС50 и известной концентрации индикаторного антитела, используя способ Мюллера.
4. Получение 2B8-MX-DTPA
Хелатирующий агент, 1-изотиоцианатбензил-3-метилдиэтилентриаминопентауксусную кислоту (MX-DTPA) доставляли в виде сухого порошка (свободная кислота) и хранили в сухом виде при -20° или -70°С. Примерно 3 мг антитела СНО-2В8 в нормальном солевом растворе с низким содержанием металлов доводили до рН 8,6 добавлением одной десятой объема 50 мМ бората натрия, рН 8,6. Антитело в концентрации 10-11 мг/мп инкубировали при молярном соотношении MX-DTPA к белку, равном 4:1, добавляя MX-DTPA, растворенный в 50 мМ борате натрия, рН 8,6. После инкубации при температуре окружающей среды (от 2 до 24 часов) не прореагировавший хелатирующий агент удаляли из конъюгата повторяющейся диафильтрацией в нормальном солевом растворе с низким содержанием металлов, используя центрифужные фильтрационные устройства Centricon 30.
5. Получение In2B8 и Y2B8
In2B8 получали с использованием протокола набора для радиоактивного мечения, как описано в данной работе. Антитело метили до удельной активности 3 мКюри/мг, и готовили в концентрации 0,2 мг/мл. Коротко, от 0,5 до 2 мКюри хлорида 111In переносили в микроцентрифужную пробирку, не содержащую металлов, и рН доводили примерно до рН 4,2, используя 1,2х-объем 50 мМ ацетата натрия с низким содержанием металлов. К раствору ацетата индия добавляли 2B8-MX-DTPA в концентрации 2 мг/мл, и после инкубации при температуре окружающей среды в течение 30 мин готовили композицию меченого антитела в концентрации 0,2 мг/мл, в 1 × PBS, рН 7,2, содержащем 7,5% (маc./об.) сывороточного альбумина человека и 1 мМ DTPA (конечная концентрация ЧСА от 4% до 6%). Все образцы тестировали по включению радиоактивности в трех повторах; значения составляли >95%.
Y2B8 также готовили, используя версию протокола набора для радиоактивного мечения в небольшом масштабе, описанную в примере 1. Антитело метили до удельной активности 15 мКюри/мг, и готовили в концентрации 0,3 мг/мл. Коротко, от 0,5 до 2 мКюри хлорида 90Y переносили в микроцентрифужную пробирку, не содержащую металлов, и рН доводили примерно до рН 4,2, используя 1,2х-объем 50 мМ ацетата натрия с низким содержанием металлов. К раствору ацетата 90Y добавляли 2В8-МХ-DTPA в концентрации 2 мг/мл, и после инкубации при температуре окружающей среды в течение 5 мин готовили композицию меченого антитела в концентрации 0,3 мг/мл, в 1 x PBS, рН 7,2, содержащем 7,5% (маc./об.) сывороточного альбумина человека и 1 мМ DTPA (конечная концентрация ЧСА от 4% до 6%). Все образцы тестировали по включению радиоактивности в трех повторах; значения составляли >95%.
Концентрации радиоактивности конечных радиоактивно меченных продуктов рассчитывали на основании количества радиоактивности, добавленной в реакционную смесь, и на основании обращения к сертификату анализа радиоизотопа. Концентрацию антитела в реакционной смеси после гашения рассчитывали на основании известного добавленного количества антитела.
Для кинетических исследований радиоактивного мечения, оценивающих влияние рН на включение радиоактивности и связывание, рН реакционной смеси доводили добавлением различных количеств 50 мМ ацетата натрия с низким содержанием металлов (от 0,8 до 2,2х объемов раствора радиоизотопа).
6. Определение радиоактивного включения для In2В8 и Y2B8
Количество радиоактивности, связанной с конъюгатами (включение радиоактивности) в конечных продуктах или инкубируемых образцах определяли, используя доступный для приобретения набор, производимый Biodex (радиохроматографический набор Tec-Control; смотри пример 1). В общем, 1 мкл тестируемых образцов наносили в двух или трех повторах, используя микропипеттор, и обрабатывали согласно вкладышу с инструкцией Biodex. Радиоактивность на половинах пластин считали в стеклянных пробирках, используя гамма-счетчик Isodata или сцинтилляционный счетчик Packard Top Count, как описано далее. Включение радиоактивной метки рассчитывали путем деления количества радиоактивности в верхней половине пластины на общую радиоактивность, найденную в обеих - верхней и нижней половинах. Значение выражали в процентах и определяли среднее значение.
7. Определение иммунореактивности In2В8 и Y2B8
Иммунореактивность оценивали, используя метод Lindmo et аl. и как описано выше в примере 1.
8. Анализ прямого связывания In2В8 и Y2B8
Чтобы определить связывание с CD-позитивными клетками SB для In2B8 и Y2B8 соответственно, использовали одни и те же протоколы, которые описаны в данной работе. In2B8 и Y2B8 получали и готовили в составе композиции, как описано выше. Для анализа образцы In2B8 и Y2B8 разбавляли буфером для разведения при анализе (1 × PBS, рН 7,2, содержащий 1% (маc./об.) бычьего сывороточного альбумина (БСА)) до 40 нг/мл и 11 нг/мл соответственно.
Антиген-позитивные (SB) и антиген-негативные (HSB) клетки поддерживали в RPMI 1640 с добавлением 10% фетальной сыворотки теленка при 37°С и 5% СО2. Клетки (жизнеспособность > 90%, как определено исключением с трипановым синим) собирали при температуре окружающей среды при плотности клеток 0,5-2×106 клеток/мл центрифугированием (1300 об/мин в центрифуге Sorvall), и дважды промывали 50 мл 1 × HBSS. Осажденные клетки ресуспендировали при концентрации 50×106 клеток/мл в предварительно охлажденном 1 × HBSS, содержащем 1% (маc./об.) бычьего сывороточного альбумина (БСА) и 10% (маc./об.) маннита (буфер для лиофилизации). Суспензии клеток разносили в полипропиленовые микроцентрифужные пробирки с кольцевой прокладкой объемом 1,5 мл при концентрации 50×106 клеток/мл (0,5 мл на пробирку) и лиофилизировали в течение ночи при 30-60 миллитор. Лиофилизированные клетки хранили в сухом виде при 2°-8°С и восстанавливали в стерильной воде для анализов.
Лиофилиэированные клетки SB и HSB в полипропиленовых пробирках объемом 1,5 мл восстанавливали до 50×106 клеток/мл, используя стерильную воду. К клеткам добавляли, соответственно, разведенные In2В8 и Y2B8 в трех повторах и инкубировали от 45 до 60 мин с перемешиванием со дна на крышку при температуре окружающей среды. После инкубации клетки осаждали центрифугированием и связанную с клетками радиоактивность определяли, считая образцы в гамма-счетчике Isodata или сцинтилляционном счетчике Packard Top Count, как описано ниже. Радиоактивность, связанную (В) с клетками, подсчитывали вычитанием несвязанной радиоактивности (надосадка) из суммарной добавленной радиоактивности. Суммарную радиоактивность определяли по радиоактивности, посчитанной в пробирках без клеток. Процент связывания рассчитывали, выражая связанный счет в процентах от суммарного счета.
9. Измерение радиоактивности
Образцы с включенной радиоактивностью считали в течение 1 мин, используя гамма-счетчик Isodata. Счетчик устанавливали в интервалах энергии 100-500 КэВ, и фон устанавливали на ноль непосредственно перед применением образца, используя 111 In. Гамма-счетчик Isodata также использовали для счета пластин МТСХ, с нанесенными на нем пятнами 90Y. Интервалы энергии для определения излучения торможения составляли 100-1000 кэВ.
Для анализов связывания 90Y-образцы переносили в 24-луночные планшеты и коктейль MicroScint 40 и считали в Packard TopCount в течение 1 мин, используя установочные параметры минимальной и максимальной энергии. Образцы с индием-[111] считали в течение 1 мин, используя гамма-счетчик Isodata. Счетчик устанавливали в интервалах энергии 100-500 кэВ, и фон устанавливали на ноль непосредственно перед использованием.
10. Выходные характеристики клинических доз In2В8 и Y2B8
Выходные характеристики включения радиоактивности и связывания с СD20-позитивными клетками устанавливали, приготовив шесть доз каждого антитела In2В8 и Y2B8 с использованием двух партий 2D8-MX-DTPA клинической степени очистки (партии №0219 и 0220), полученных согласно данному изобретению и упакованных в условиях GMP. Анализы готовой продукции выполняли, как описано выше.
IV. Результаты
А. Характеристика 2В8, полученного из СНО
С использованием анализа проточной цитометрией показано, что СНО-2В8 прямо связывается с СD20-позитивными клетками SB и не связывается с СD20-негативными клетками HSB (фигура 34). Не отмечено значимого связывания с клетками SB и HSB для антитела (S004) изотипа (γ1к), не соответствующего данной области.
Связывание СНО-2В8 с СD20-позитивными клетками оценивали в конкурентном анализе, используя систему регистрации хемилюминесценции ORIGEN. Лиофилизированные и реконструированные антиген-позитивные клетки SB инкубировали с возрастающими количествами bf-антитела в присутствии индикатора - меченного рутением СНО-2В8. Результаты показали, что СНО-2В8 ингибирует связывание с СD20-позитивными клетками в такой же степени, как антитело, полученное из биореакторов с полыми волокнами (2В8-49) (фигура 35). Значения ЕС50 определяли графически, и использовали способ Мюллера (Muller 1980), чтобы рассчитать средние значения аффинности. Была определена аффинность СНО-2В8, равная 1,3×10-10 М; антитело 2В8, полученное из биореакторов с полыми волокнами, давало значение аффинности 2,5×10-10 М. Неспецифичное связывание было незначительным, о чем свидетельствует отсутствие конкуренции с антителом нерелевантного изотипа S004.
В. Характеристика 2B8-MX-DTPA, полученного из СНО
Конъюгат 2В8 (2B8-MX-DTPA) готовили, используя протокол, сходный с протоколом для охарактеризованного ранее 2В8-49. Реакции проводили, используя примерно 3 мг антитела и молярное отношение хелатирующего агента к антителу 4:1. Оценивали время инкубации 2, 4, 8, 17 и 24 час, чтобы определить время реакции, которое дает приемлемое сохранение связывания с CD20-позитивными клетками и высокое включение радиоактивного 111In. Кривые конкурентного связывания, сравнивающие СНО-2В8 с конъюгатом CHO-2B8-MX-DTPA, реагировавшими в течение 8-24 часов, были сходными, свидетельствуя о том, что процесс конъюгации существенно не изменяет связывания антитела с CD20-антигеном (фигура 36). Используя значения ЕС50, определенные графически (фигура 36) константы аффинности неконъюгированного и конъюгированного антител были найдены в пределах от 2,3×10-10 M до 5,9×10-10 М (таблица 40). Включение радиоактивности составляло > 95% для времени конъюгации от 8 до 24 часов (таблица 30).
Влияние времени реакции конъюгации на включение радиоактивности и иммунореактивность CHO-2B8-MX-DTPA
С. Характеристика In2В8 и Y2B8, приготовленных из 2В8-MX-DTPA, полученного из СНО
CHO-2B8-MX-DTPA, меченное индием-[111] (In2B8), готовили, используя протокол набора для радиоактивного мечения в небольшом масштабе, описанный ранее для антитела, полученного из биореактора с полыми волокнами (пример 1). Коротко, конъюгированное антитело (2B8-MX-DTPA, полученное из СНО; партия №0165А) инкубировали с ацетатом 111In при указанных рН в течение 30 минут при температуре окружающей среды. Реакционные смеси готовили в PBS, рН 1,2, содержащем 7,5% (маc./об) сывороточного альбумина человека и 1 мМ DTPA. Приготовленные образцы In2В8 анализировали в отношении включения радиоактивности, используя мгновенную тонкослойную хрома то график. Связывание In2В8 с CD20-позитивными клетками определяли, используя лиофилизированные и реконструированные клетки SB. Для сравнения конъюгат, приготовленный из антитела, продуцируемого гибридомой (2В8-49), инкубировали с ацетатом 111In в течение 30 минут при рН 4,2 (условия ранее установленные для данного антитела).
Проводили кинетические исследования, чтобы определить условия мечения, обеспечивающие максимальное сохранение связывания с CD20-позитивными клетками и высокое включение радиоактивности (таблицы 41 и 42). Конъюгированное антитело (полученное из СНО 2B8-MX-DTPA) инкубировали при температуре окружающей среды с ацетатом 111In при рН 4,2 в течение указанного времени (таблица 42).
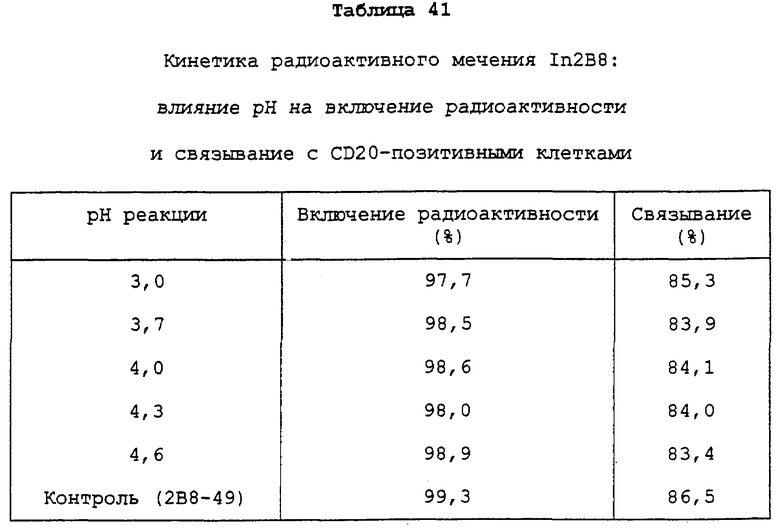

Результаты свидетельствуют о том, что в пределах рН от 3,0 до 4,6 и за время инкубации 30 мин было достигнуто включение радиоактивности >97%, при сохранении связывания примерно на уровне 84%. Значения включения радиоактивности и связывания не изменялись при времени инкубации от 15 до 45 мин для реакций при рН от 2,9 до 4,6 (таблица 42). Результаты сравнимы с результатами, полученными с использованием антитела 2В8-49 (таблицы 41 и 42).
Антитело, меченное иттрием-[90], готовили, инкубируя антитело (полученное из СНО 2B8-MX-DTPA) с ацетатом 90Y при указанных рН в течение 5 минут при температуре окружающей среды. Реакционные смеси готовили в PBS, рН 7,2, содержащем 7,5% (маc./об.) сывороточного альбумина человека и 1 мM DTPA. Приготовленные образцы Y2B8 анализировали в отношении включения радиоактивности, используя мгновенную тонкослойную хроматографию. Связывание Y2B8 с CD20-позитивными клетками определяли, используя лиофилизированные и реконструированные клетки SB. Для сравнения конъюгат, приготовленный из антитела, продуцируемого гибридомой (2В8-49), инкубировали с ацетатом 90Y в течение 5 минут при рН 4,2 (условия ранее установленные для данного антитела).
Проводили сходные кинетические исследования, чтобы определить получение антитела, меченного 90Y (Y2B8). Для реакций радиоактивного мечения в пределах рН от 3,9 до 4,7 при времени инкубации 5 мин, включение радиоактивности составляло >96% при >80% сохранении связывания с CD20-позитивными клетками (таблица 43). Сходные результаты были получены при времени инкубации 3, 5 и 10 мин в пределах рН от 2,9 до 4,6 (таблица 44). Затем конъюгированное антитело (полученное из СНО 2B8-MX-DTPA) инкубировали при температуре окружающей среды с ацетатом 90Y при рН 4,2 в течение указанного времени (таблица 44). Результаты были сравнимы с результатами, полученными с использованием антитела 2В8-49 (таблицы 43 и 44).

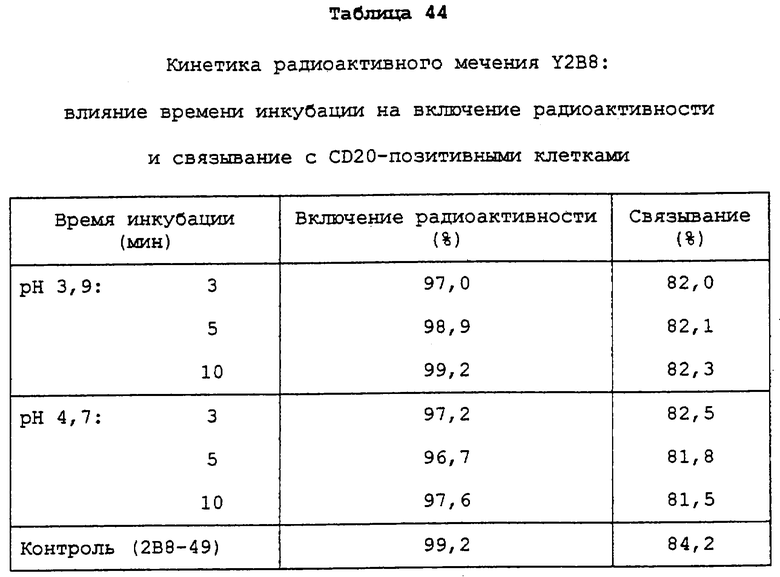
Иммунореактивности In2B8 и Y2B8, приготовленных из СНО-2В8, определяли, используя способ Lindmo et al. Возрастающие концентрации свежесобранных CD20-позитивных клеток SB инкубировали с постоянным количеством In2B8 или Y2B8 в условиях избытка антигена. Графический анализ обратных величин данных связывания позволил определить иммунореактивности In2B8 и Y2B8, равные 80,6% и 72,2% соответственно (фигуры 37 и 38).
D. Выходные характеристики полученных из СНО In2B8 и Y2B8
Две партии наборов для радиоактивного мечения In2B8/Y2B8 клинической степени очистки использовали для того, чтобы получить шесть партий каждого из антител In2В8 и Y2B8. In2В8 и Y2B8 готовили, используя версии протоколов радиоактивного мечения в небольшом масштабе, в настоящее время применяемые в клинических испытаниях. Каждую партию 2B8-MX-DTPA тестировали в отношении включения радиоактивности и связывания с CD20-позитивными (SB) и СD20-негативными (HSB) клетками человека. Полученные результаты суммированы в таблицах 45 и 46. Для шести партий полученного In2В8 включение радиоактивности находилось в пределах от 98,9% до 99,3% со средним значением 99,1%. Связывание с СD20-позитивными клетками было в пределах от 81,9% до 85,1% co средним значением 83,6%; связывание с СВ20-негативными клетками составляло <4%. Для шести партий приготовленного Y2B8 включение радиоактивности находилось в пределах от 97,4% до 98,7% со средним значением 98,2%. Связывание с СD20-позитивными клетками было в пределах от 81,4% до 82,7% со средним значением 81,9%; связывание с СD20-негативными клетками составляло <8%.
Результаты анализа выпускаемой продукции для полученного из СНО In2В8, приготовленного с использованием протокола набора для радиоактивного мечения
Результаты анализа выпускаемой продукции для полученного из СНО Y2B8, приготовленного с использованием протокола набора для радиоактивного мечения
V. Обсуждение и выводы
Мышиное моноклональное анти-СБ20-антитело (2В8), клонированное и экспрессированное в клетках СНО (полученное из СНО 2В8) сохраняет специфичность по отношению к CD20-позитивным клеткам человека, как показано FACS и анализом конкурентного связывания. Связывание с Т-клетками человека было минимальным. Используя анализ конкурентного связывания, определили аффинность антитела к CD20-позитивным клеткам человека, равное 1,3×10-10 М. Используя тот же анализ, для антитела 2В8, полученного из биореакторов с полыми волокнами, установлено значение аффинности 2,5×10-10 М.
Осуществляли реакцию антитела СНО-2В8 с MX-DTPA, чтобы образовать конъюгат, 2B8-MX-DTPA, при этом поддерживая сохранение подходящей иммунореактивности. Определили оптимальное включение хелатирующего агента, измеряя включение радиоактивности с 111In, и оно достигалось через восемь часов инкубации при температуре окружающей среды. Протоколы радиоактивного мечения конъюгата 2B8-MX-DTPA оптимизировали для 90Y или 111In относительно рН и времени инкубации, чтобы гарантировать максимальное включение радиоактивности и сохранение иммунореактивности.
Результаты нескольких повторов получения In2В8 и Y2B8 показывают воспроизводимость протокола радиоактивного мечения, используемого для получения клинических доз. На основании указанных результатов радиоактивного мечения рекомендуется, чтобы выходные характеристики для радиоактивного включения и связывания с использованием лиофилизированных CD20-позитивных клеток были установлены на уровне ≥95% и ≥70% соответственно. Взятые вместе, эти результаты демонстрируют сравнимость полученного из СНО 2В8 и 2В8-49, полученного на основе полых волокон, и свидетельствуют о пригодности полученного из СНО 2B8-MX-DTPA для применения в клинических испытаниях.
Наконец, в данном изобретении заявлен способ мечения, названный способом "mix-and-shoot", для получения клинических доз радиоактивно меченных антител, который исключает необходимость в используемом в настоящее время этапе высокоэффективной жидкостной хроматографии (ВЭЖХ) для удаления не связанного с белком радиоизотопа. Упрощенный протокол устраняет этот трудоемкий этап очистки, сохраняя при этом высокий уровень включения радиоизотопа (>95%) и более высокое сохранение иммунореактивности (>70%). На основании сохранения радиоизотопа и иммунореактивности было установлено, что радиоактивно меченный конъюгат, приготовленный в составе композиции для применения в клинике, стабилен in vitro в случае инкубирования при 4°С в течение 48 часов. Кроме того, радиоактивно меченный конъюгат стабилен при инкубации в сыворотке человека при 37°С в течение 72 часов. Исследования биологического распределения у мышей BALB/c не выявили необычного депонирования в тканях и значительного накопления в костях. Оценки поглощенных доз радиации для “стандартного” человека весом 70 кг были сравнимы с оценками, полученными при проходящих в настоящее время клинических испытаниях 2B8-MX-DTPA, меченного 90Y. Результаты этих исследований показали, что 2B8-MX-DTPA, меченный 90Y, приготовленный с использованием протокола "mix-and-shoot", сравним с меченым конъюгатом, приготовленным с использованием традиционного способа с ВЭЖХ. Приемочные испытания протокола получения радиоактивно меченного конъюгата клинической степени чистоты в небольшом масштабе показали, что способы были воспроизводимы и что продукт сравним с продуктом, получаемым с использованием современного способа с ВЭЖХ. Результаты представленных доклинических исследований свидетельствуют о том, что новый протокол "mix-and-shoot" можно применять для получения 2B8-MX-DTPA, меченного 90Y, пригодного для применения в клинических испытаниях.
Ссылки
Каждая из следующих упоминаемых в списке работ включена здесь в виде ссылки:
1. Adams, R.A., Flowers, A., and Davis, B.J. Direct Implantation and Transplantation of Human Acute Lymphoblastic Leukemia in Hamsters, SB-2. Cancer Research 28: 1121-1125, 1968.
2. Adams, R.A. Formal Discussion: The Role of Transplantation in the Experimental Investigation of Human Leukemia and Lymphoma. Cancer Res. 27(1): 2479-2482, 1967.
3. Lindmo, Т., Boven, E., Cuttitta, F., Fedoroko, J., and Bunn, P.A.; J. Inomunol. Methods, 72: 77-1984.
4. Kozak, R.W., Raubitschek, A., Mirzadeh, S., Brechbiel, M.W., Junghaus, R., Gansow, O.A., and Waldmann, T.A. Cancer Res. (1989) 49:2639-2644.
5. Parker, В.A., Halpern, S.E., Miller, R.A., Hupf, H., Shawler, D.L., Collins, H.A., Amox, D., White, C.A. and Royston, I. N. Eng. J. Med., submitted.
6. Leland, J.K. and Powell, M.J. J. (1990) Electrochem. Soc. 137, 3127.
7. Muller, R. J. Immunological Methods (1980) 34, 345.
8. Mirzadeh, S., Brechbiel, M.W., Atcher, R.W. and Gansow, O.A. (1990) Bioconjugate Chemistry 1(1), 59.
9. Brechbiel, M.W., Gansow, O.A., Atcher, R.W., Sclom, J., Esteban, J., Simpson, D.E. and Colcher, D. (1986) 25, 2772.


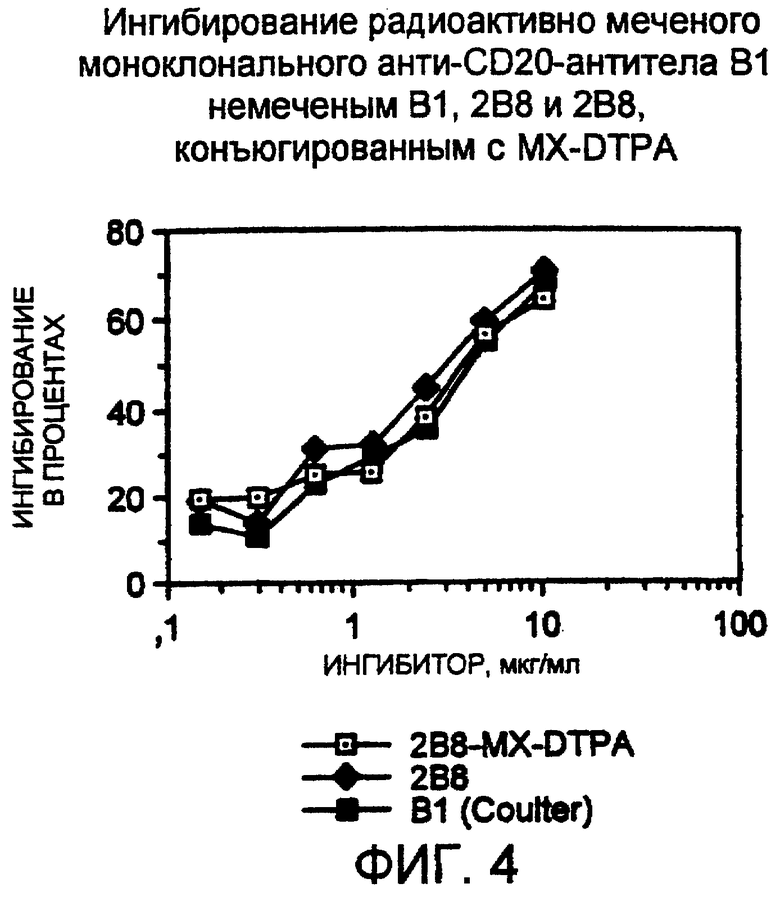

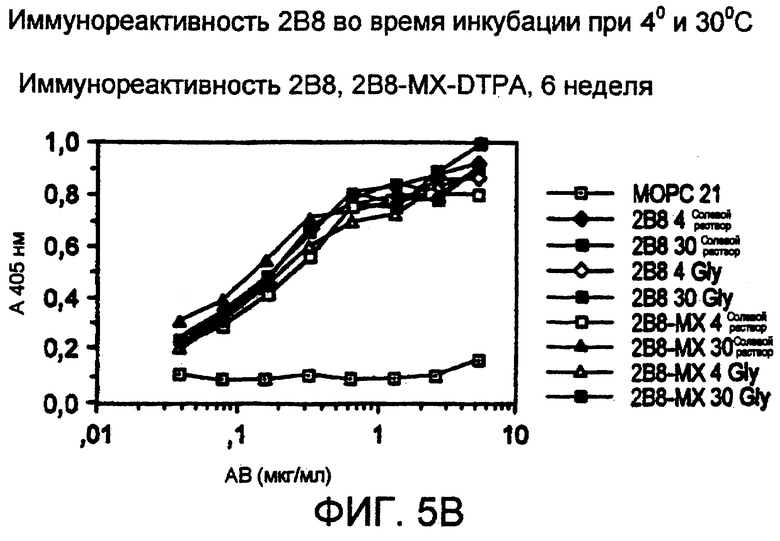
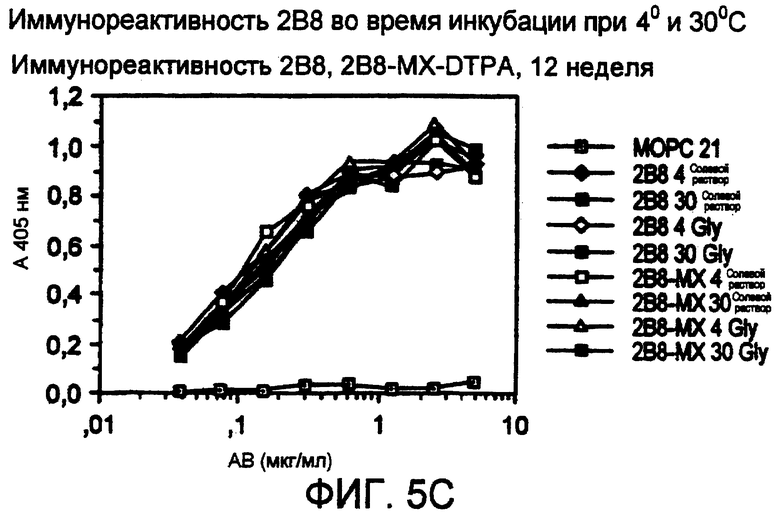
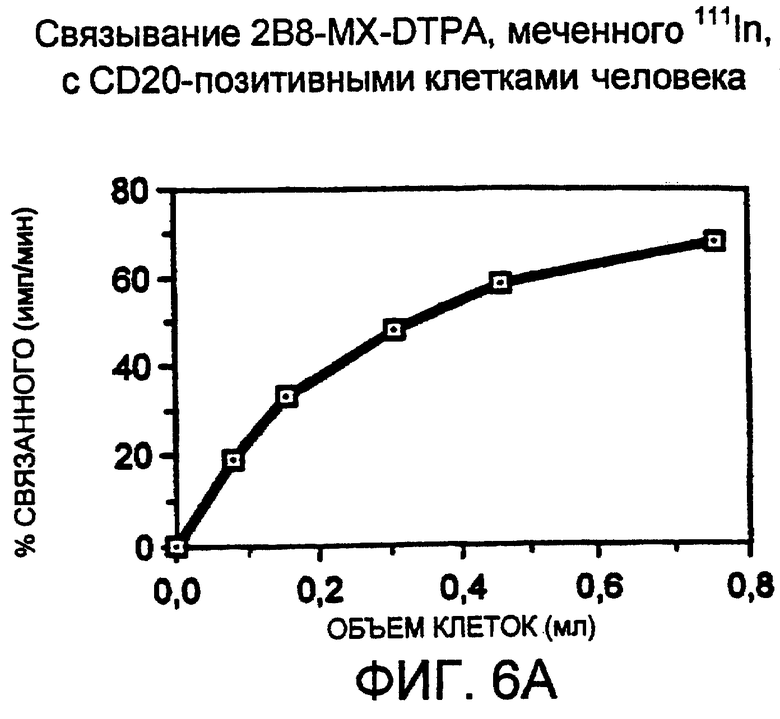






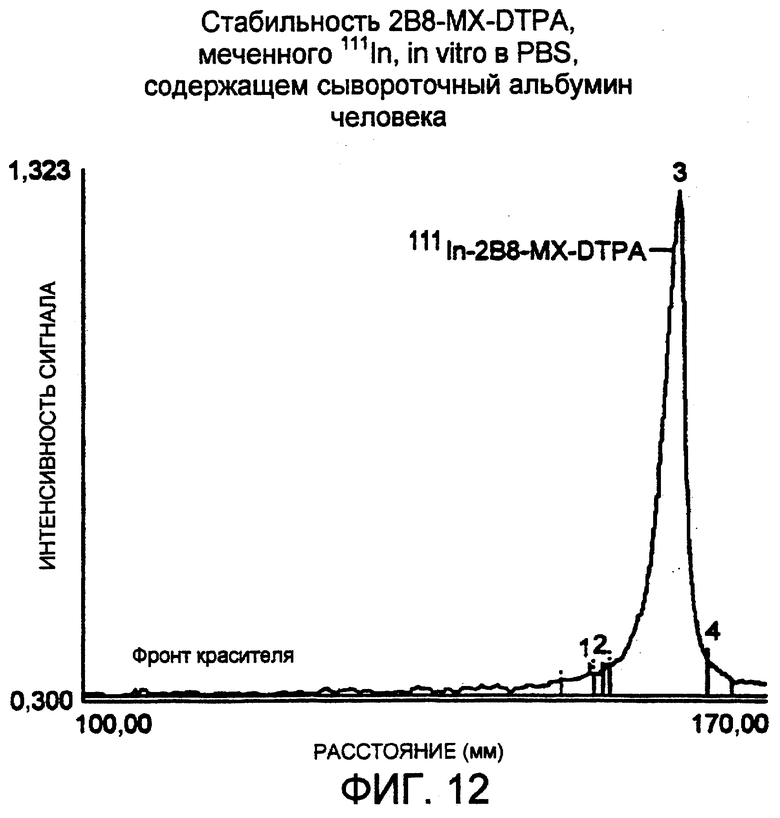





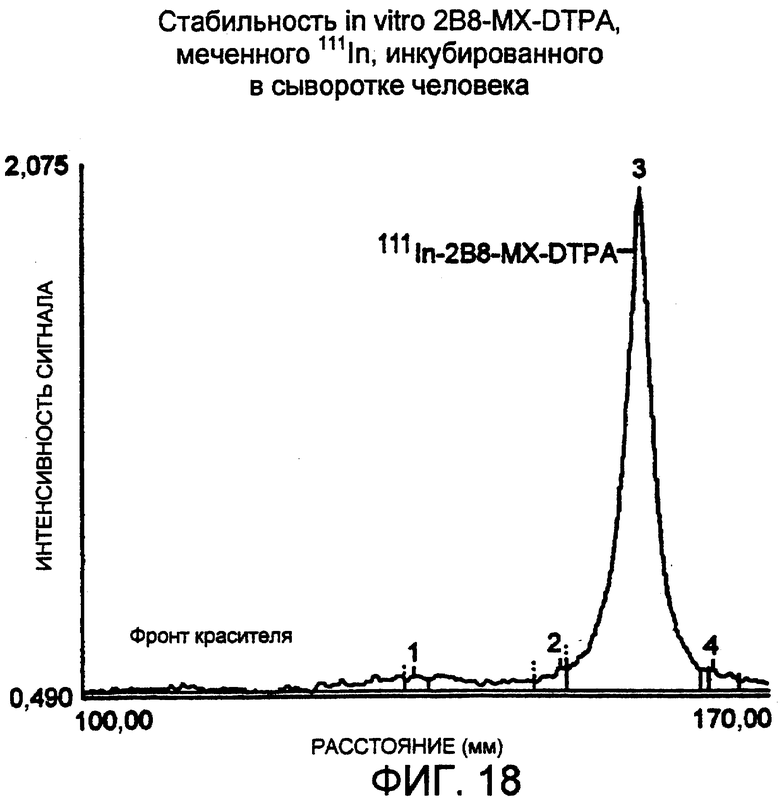

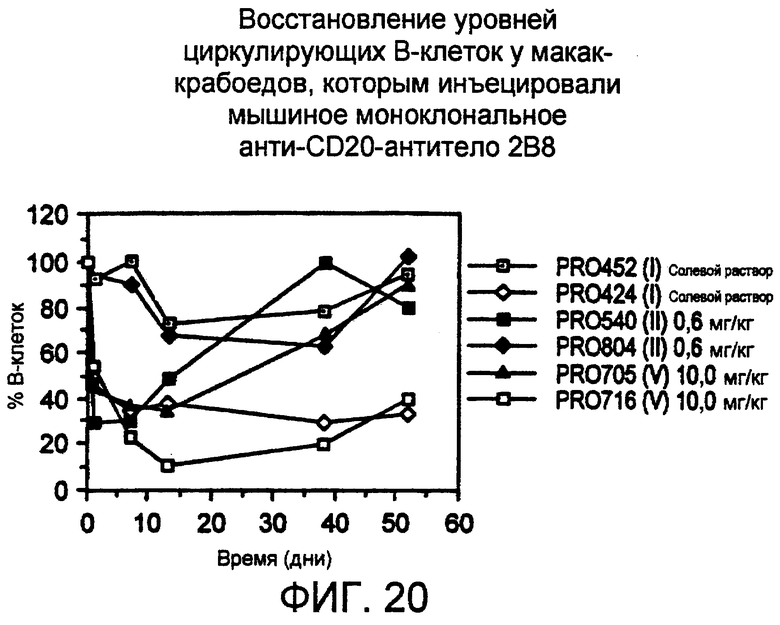


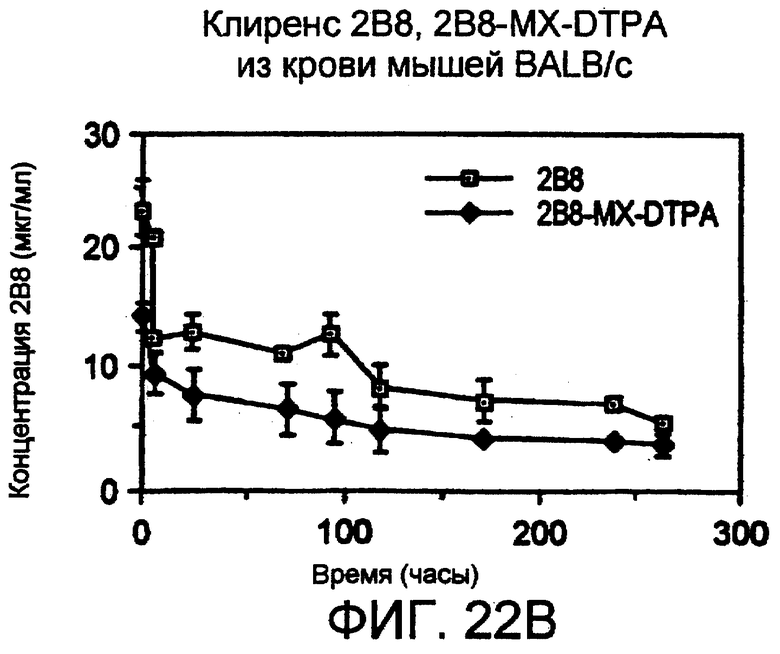






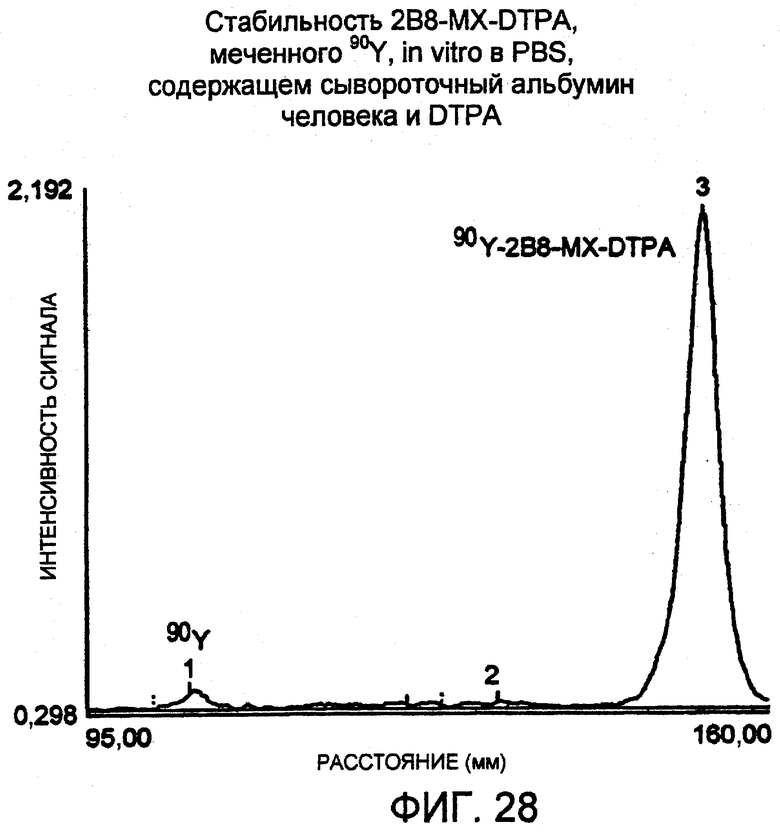

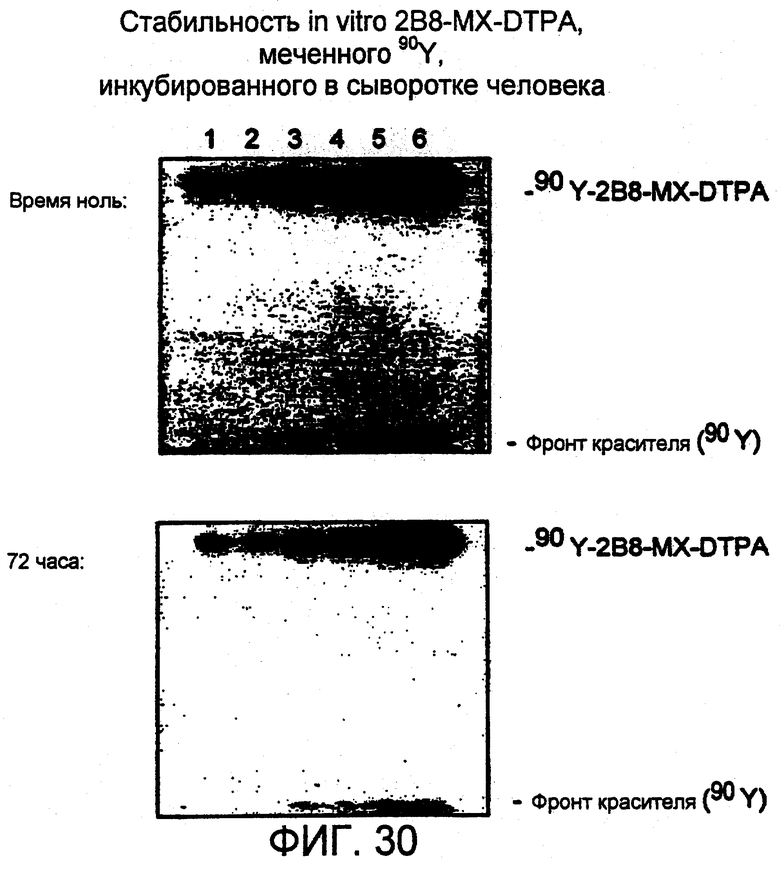

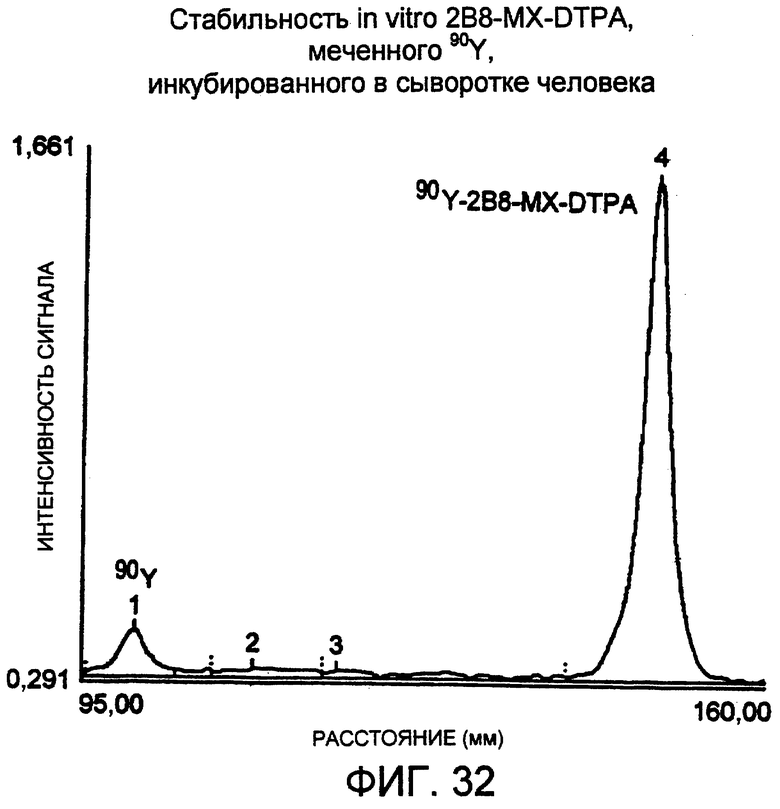

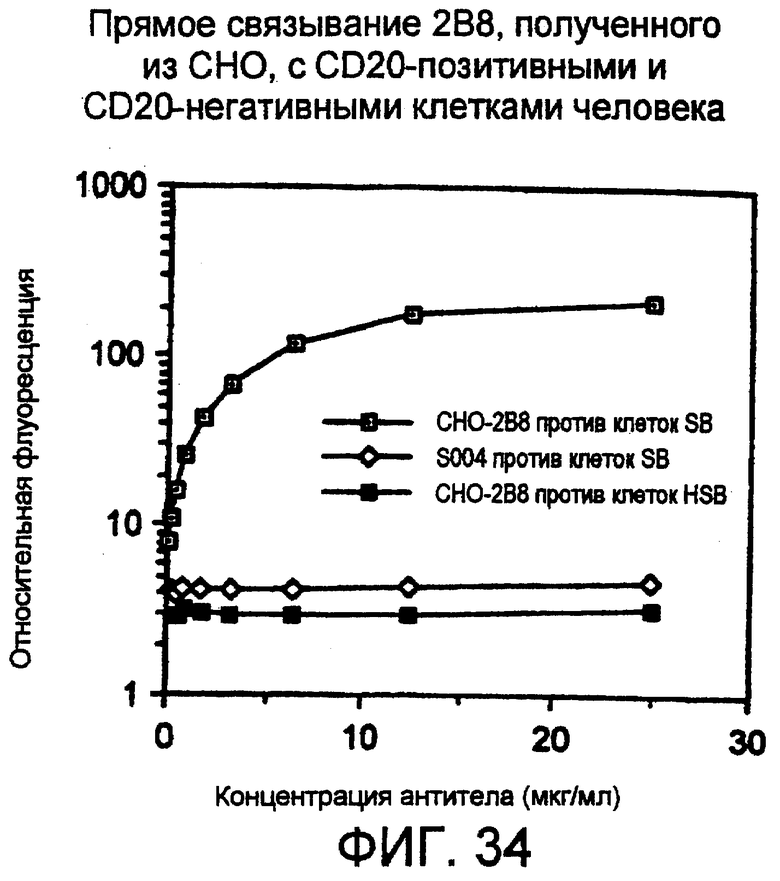
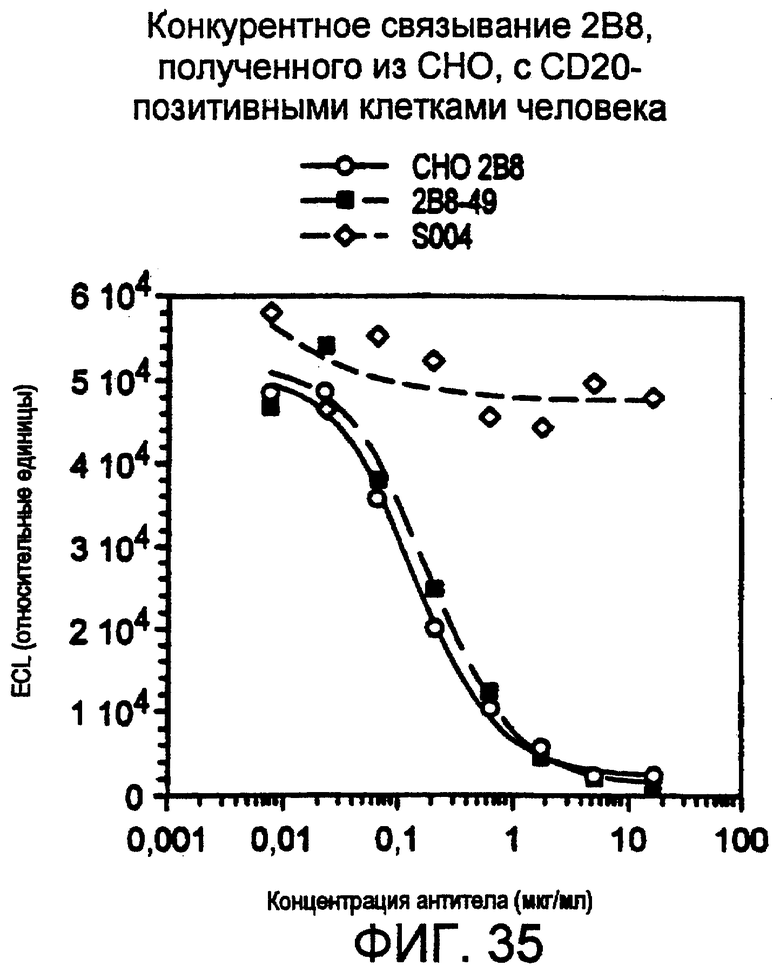
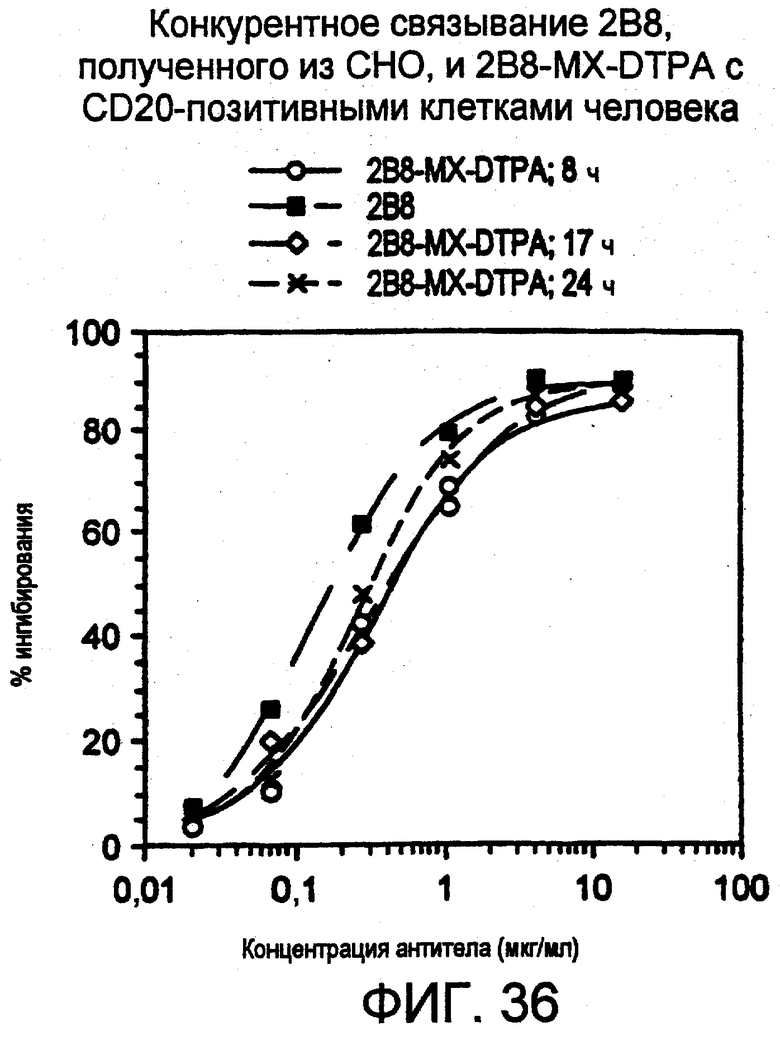



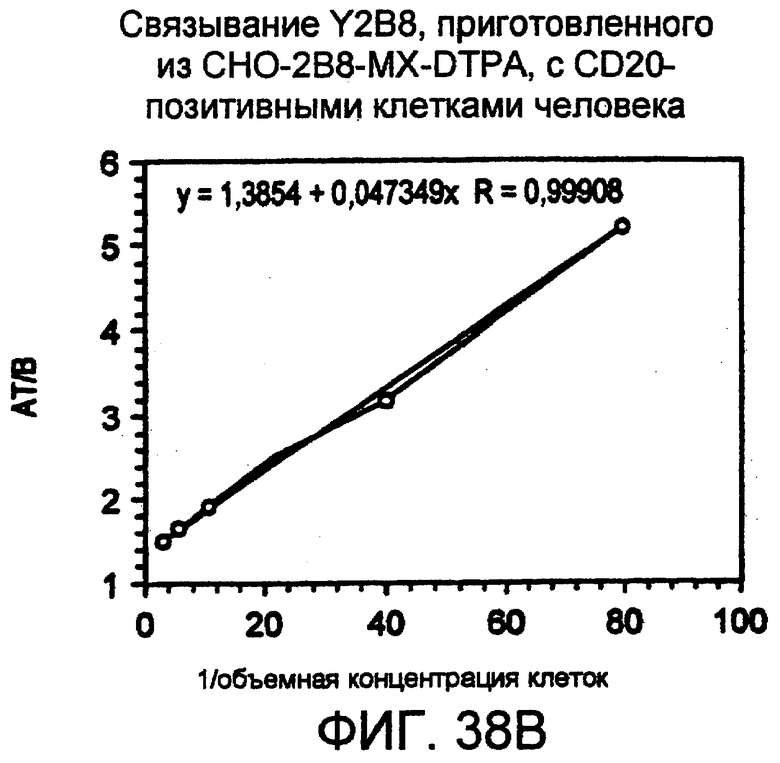
Изобретение относится к области радиационной биохимии. Сущность изобретения состоит в наборах для анализа связывания антител и радиоактивного мечения, предназначенных для тестирования антител при опухолях. В частности, разработаны наборы для приготовления и оценки радиомеченых анти-CD20-конъюгатов, которые используют для лечения и диагностики В-клеточных лимфомных опухолей. Все реагенты стерильны и дают при использовании высоковоспроизводимые результаты. Технический результат - расширение арсенала диагностических средств для выявления опухолей. 9 н. и 95 з.п. ф-лы, 46 табл., 45 ил.

(i) флакон, содержащий антитело, конъюгированное с хелатирующим агентом,
(ii) флакон, содержащий буферную композицию для стабилизации и введения радиоактивно меченного антитела,
(iii) инструкции по радиоактивному мечению антитела, где указанные компоненты флаконов поставляются в таком количестве и в такой концентрации, что в том случае, когда их объединяют с радиоактивной меткой согласно инструкциям набора, продуцируется радиоактивно меченное антитело, в котором эффективность включения метки составляет более 95%, которое обладает достаточной специфической активностью и иммунореактивность которого выше 70%, такое, что не требуется дальнейшей очистки меченого антитела перед введением указанному пациенту.
(i) физиологический раствор соли;
(ii) радиопротектор; (iii) неконъюгированный с белком хелатирующий агент.
(i) смешивание антитела, конъюгированного с хелатирующим агентом, с раствором, содержащим радиоактивную метку;
(ii) инкубирование смеси в течение соответствующего количества времени при соответствующей температуре;
(iii) разведение меченого антитела до соответствующей концентрации буферной композицией так, что в указанном радиоактивно меченном антителе эффективность включения метки составляет более 95%, оно обладает достаточной специфической активностью и его иммунореактивность составляет выше 70%, так что его можно вводить пациенту непосредственно без дополнительной очистки.
(i) по меньшей мере один флакон фиксированных или лиофилизированных антиген-позитивных клеток;
(ii) флакон, содержащий антитело, конъюгированное с хелатирующим агентом;
(iii) флакон, содержащий буферную композицию;
(iv) инструкции по радиоактивному мечению антитела, где указанные компоненты флаконов поставляются в таком количестве и в такой концентрации, чтo когда их объединяют с радиоактивной меткой согласно инструкциям набора, продуцируется радиоактивно меченное антитело, в котором эффективность включения метки составляет более 95%, которое обладает достаточной специфической активностью и иммунореактивность которого выше 70%, такое, что не требуется дальнейшей очистки меченого антитела перед введением указанному пациенту.
(i) смешивание и инкубирование по меньшей мере одной аликвоты радиоактивно меченного антитела по меньшей мере с одной аликвотой антиген-позитивных клеток;
(ii) смешивание и инкубирование по меньшей мере одной аликвоты радиоактивно меченного антитела, идентичной аликвоте на этапе (i), по меньшей мере с одной аликвотой буфера разведения такого же объема, что и аликвота антиген-позитивных клеток на этапе (i), в качестве контроля;
(iii) осаждение клеток центрифугированием;
(iv) измерение радиоактивности в надосадке осажденных клеток и в контроле;
(v) сравнение количества радиоактивности в надосадке клеток с количеством радиоактивности в контроле.
(i) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела по меньшей мере с одной аликвотой антиген-негативных клеток;
(ii) осаждение антиген-негативных клеток центрифугированием;
(iv) измерение радиоактивности в надосадке осажденных антиген-негативных клеток;
(v) сравнение количества радиоактивности в надосадке антиген-негативных клеток с количеством радиоактивности в надосадке антиген-позитивных клеток и в контроле.
(i) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела по меньшей мере с одной аликвотой антиген-позитивных клеток;
(ii) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела, идентичной аликвоте на этапе (i), по меньшей мере с одной аликвотой буфера разведения такого же объема, что и аликвота антиген-позитивных клеток на этапе (i), в качестве контроля;
(iii) осаждение клеток центрифугированием;
(iv) измерение радиоактивности в надосадке осажденных клеток и в контроле;
(v) сравнение количества радиоактивности в надосадке клеток с количеством радиоактивности в контроле, где указанный анализ выполняют с использованием набора, содержащего следующие компоненты:
(i) по меньшей мере один флакон фиксированных или лиофилизированных антиген-позитивных клеток;
(ii) флакон, содержащий антитело, конъюгированное с хелатирующим агентом;
(iii) флакон, содержащий буферную композицию;
(iv) инструкции по радиоактивному мечению антитела,
где указанные компоненты флаконов поставляются в таком количестве и в такой концентрации, что, когда их объединяют с радиоактивной меткой согласно инструкциям набора, продуцируется радиоактивно меченное антитело, обладающее достаточной радиоактивностью, специфической активностью и иммунореактивностью, такое, что не требуется дальнейшей очистки меченого антитела перед введением указанному больному человеку.
(i) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела по меньшей мере с одной аликвотой антиген-позитивных клеток;
(ii) смешивание по меньшей мере одной аликвоты радиоактивно меченного антитела, идентичной аликвоте на этапе (i), по меньшей мере с одной аликвотой буфера для разведения такого же объема, что и аликвота антиген-позитивных клеток на этапе (i), в качестве контроля;
(iii) осаждение клеток центрифугированием;
(iv) измерение радиоактивности в надосадке осажденных клеток и в контроле;
(v) сравнение количества радиоактивности в надосадке клеток с количеством радиоактивности в контроле;
где указанный анализ выполняют с использованием набора, содержащего по меньшей мере один флакон фиксированных или лиофилизированных антиген-позитивных клеток и флакон, содержащий антитело, конъюгированное с хелатирующим агентом, которое специфически связывается с антигеном указанных антиген-позитивных клеток.
(i) приготовление тестируемых антител, меченных рутением;
(ii) инкубирование возрастающих количеств немеченых тестируемых антител в отдельных флаконах с фиксированной концентрацией фиксированных, свежих или лиофилизированных антиген-позитивных клеток и с фиксированной концентрацией меченных рутением антител;
(iii) определение относительного количества связывания меченных рутением антител с клетками в каждой отдельной пробирке на основании относительной электрохемилюминесценции;
(v) расчет аффинности тестируемого антитела в отношении клеток на основании относительного количества связывания меченных рутением антител с клетками, которое было определено в каждой реакционной пробирке.
| Экономайзер | 0 |
|
SU94A1 |
| Способ радиоиммунологического определения антител к поверхностному антигену вируса гепатита В. | 1990 |
|
SU1839710A3 |
| RU 94026278 A, 24.11.1997. | |||
Авторы
Даты
2005-04-27—Публикация
2000-02-29—Подача